Производные 5-[4-(азетидин-3-илокси)фенил]-2-фенил-5н-тиазоло[5,4-c]пиридин-4-она и их использование в качестве рецепторов mch
Номер патента: 15559
Опубликовано: 31.08.2011
Авторы: Секереш Хелен Джейн, Гармен Дэвид Джозеф, Гардинир Кевин Мэттью, Брунавс Майкл, Хембр Эрик Джеймс
Формула / Реферат
1. Соединение формулы
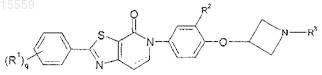
где ------ отсутствует или возможно представляет собой связь;
q представляет собой 1 или 2;
R1 независимо выбран из водорода, -C1-C2-алкила, галогена, гидрокси, -C1-C2-галогеналкила, -C1-C3-алкокси, циано, -O-C3-C4-циклоалкила и -OC1-C2-галогеналкила;
R2 выбран из группы, состоящей из водорода, -C1-C3-алкила, гидрокси, -C1-C3-алкокси, циано, -C1-C2-галогеналкила, -OC1-C2-галогеналкила и галогена;
R3 выбран из группы, состоящей из водорода, -C1-C4-алкила, -C2-C4-галогеналкил, -C2-C4-алкил-OH, -C3-C6-циклоалкила, -CH2C3-C6-циклоалкила, -C2-C4-алкил-O-C1-C4-алкила, -C(O)C1-C4-алкила, -C(O)C1-C4-галогеналкила, -CH2-тиазола, фенила, бензила, тетрагидротиопиранила и тетрагидропиранила, причем указанная циклоалкильная, тетрагидротиопиранильная, тетрагидропиранильная и тиазолильная группа может содержать в качестве заместителей одну или две группы, независимо выбранные из группы, состоящей из галогена, гидрокси, C1-C2-алкила и -C1-C2-галогеналкила;
или фармацевтически приемлемая соль, энантиомер, диастереомер такого соединения или их смесь.
2. Соединение по п.1, отличающееся тем, что
R1 представляет собой хлор, метокси, циклопропокси, фтор или трифторметил;
q представляет собой 1 или 2;
R2 представляет собой H, -CN или -OCH3и
R3 представляет собой водород, -CH3, -CH2CH2OH, -CH2CH2F, -CH2CHF2, изопропил, циклопропил, -CH2циклопропил или циклобутил, причем указанная циклопропильная или циклобутильная группа может содержать в качестве заместителей одну или две группы, независимо выбранные из группы, состоящей из фтора и метила,
или фармацевтически приемлемая соль, энантиомер, диастереомер такого соединения, или их смесь.
3. Соединение, выбранное из группы, состоящей из
5-[4-(азетидин-3-илокси)-3-метоксифенил]-2-(4-хлорфенил)-5H-тиазоло[5,4-c]пиридин-4-она,
2-(4-хлорфенил)-5-[4-(1-циклобутилазетидин-3-илокси)-3-метоксифенил]-5H-тиазоло[5,4-c]пиридин-4-она,
2-(4-хлорфенил)-5-[4-(1-циклопропилазетидин-3-илокси)-3-метоксифенил]-5H-тиазоло[5,4-c]пиридин-4-она,
5-[4-(1-ацетилазетидин-3-илокси)-3-метоксифенил]-2-(4-хлорфенил)-5H-тиазоло[5,4-c]пиридин-4-она,
2-(4-хлорфенил)-5-[3-метокси-4-(1-метилазетидин-3-илокси)фенил]-5H-тиазоло[5,4-c]пиридин-4-она,
5-[4-(азетидин-3-илокси)-3-метоксифенил]-2-(4-хлорфенил)-6,7-дигидро-5H-тиазоло[5,4-c]пиридин-4-она,
2-(4-хлорфенил)-5-[3-метокси-4-(1-метилазетидин-3-илокси)фенил]-6,7-дигидро-5H-тиазоло[5,4-c]пиридин-4-она,
2-(4-хлорфенил)-5-[4-(1-изопропилазетидин-3-илокси)-3-метоксифенил]-6,7-дигидро-5H-тиазоло[5,4-c]пиридин-4-она;
2-(4-хлорфенил)-5-[4-(1-циклобутилазетидин-3-илокси)-3-метоксифенил]-6,7-дигидро-5H-тиазоло[5,4-c]пиридин-4-она;
2-(4-хлорфенил)-5-{3-метокси-4-[1-(2-метоксиэтил)азетидин-3-илокси]фенил}-6,7-дигидро-5H-тиазоло[5,4-c]пиридин-4-она;
2-(4-хлорфенил)-5-{4-[1-(2-гидроксиэтил)азетидин-3-илокси]-3-метоксифенил}-6,7-дигидро-5H-тиазоло[5,4-c]пиридин-4-она;
2-(4-хлорфенил)-5-[4-(1-циклопропилазетидин-3-илокси)-3-метоксифенил]-6,7-дигидро-5H-тиазоло[5,4-c]пиридин-4-она и
2-(4-хлорфенил)-5-{3-метокси-4-[1-(3,3,3-трифторпропионил)азетидин-3-илокси]фенил}-6,7-дигидро-5H-тиазоло[5,4-c]пиридин-4-она.
4. Фармацевтическая композиция, включающая соединение по любому из пп.1-3 и фармацевтически приемлемый носитель и/или разбавитель.
5. Применение соединения по любому из пп.1-3 или фармацевтически приемлемой соли такого соединения для получения лекарственного средства для лечения, предотвращения или снижения выраженности заболеваний, связанных с ожирением, включая расстройства пищевого поведения, диабет, осложнения диабета, диабетическую ретинопатию, депрессию и тревожность.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента Настоящее изобретение относится к соединениям - антагонистам меланин-концентрирующего гормона, имеющим формулу (I)(US), Брунавс Майкл, Секереш Хелен Джейн (GB) Медведев В.Н. (RU) где R1, q, R2 и R3 имеют определенные значения, или фармацевтически приемлемым солям,энантиомерам, диастереомерам такого соединения, или их смеси, полезным в лечении,предотвращении или снижении выраженности симптомов, связанных с ожирением, и связанных с ожирением заболеваний.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 015559 Область техники Настоящее изобретение относится к области медицины, и, в частности, относится к лечению ожирения и заболеваний, связанных с ожирением. Более конкретно, настоящее изобретение относится к селективным антагонистам меланин-концентрирующего гормона (MCH), полезным для лечения, предотвращения или снижения выраженности ожирения и связанных с ним заболеваний. Уровень техники У трансгенных мышей с повышенной экспрессии MCH наблюдают умеренное ожирение, как мышиMCH-/-, так и мыши и MCHR1-/-, отличаются пониженным увеличением веса по сравнению с контрольной линией дикого типа. Индуцируемое MCH увеличение массы тела и гиперфагия отсутствуют у мыщей, у которых отсутствует MCHR1. Непептидные низкомолекулярные антагонисты MCHR1 снижают потребление пищи, стимулируемое MCH. Изложенные выше факты подтверждают гипотезу лечения ожирения и связанных с ним заболеваний соединениями, которые являются эффективными антагонистами MCHR1. В международной заявке PCT WO 2003/033476 А 1 описаны соединения, которые, как сообщают,можно применять в качестве антагонистов рецептора MCH. В международной заявке PCT WO 2003/033480A1 описаны соединения, как сообщают, пригодные в качестве антагонистов рецептора MCH. В международной заявке PCT WO 2006/066174A1 описаны соединения, которые можно применять для лечения, предотвращения или снижения выраженности симптомов, связанных с ожирением и связанными с ним заболеваниями. Эффективность современных методов лечения ожирения всех пациентов и на протяжении длительных промежутков времени не подтверждена. Примеры таких методов лечения включают различные безрецептурные препараты для подавления аппетита, различные режимы питания и/или физическую нагрузку. Таким образом, существует потребность в новых и/или улучшенных терапевтически эффективных агентах, пригодных для лечения, предотвращения и/или снижения выраженности эффектов ожирения. Можно ожидать, что антагонисты MCHR1 будут пригодны для лечения или предотвращения ожирения и связанных с ним заболеваний. Существует потребность в эффективных антагонистах MCHR1. Также существует потребность в соединениях, которые связывают MCHR1 избирательно по сравнению сMCHR2. Также существует потребность в антагонистах MCHR1, обладающих улучшенным профилем безопасности по сравнению с соединениями известного уровня техники. Настоящее изобретение обеспечивает такие эффективные, селективные антагонисты MCHR1, обладающие улучшенным профилем безопасности, для лечения ожирения и связанных с ним заболеваний. Краткое описание изобретения Настоящее изобретение относится к соединению формулы I гдеотсутствует или возможно представляет собой связь;R1 независимо выбран из водорода, -C1-C2-алкила, галогена, гидрокси, -C1-C2-галогеналкила, -C1-C3 алкокси, циано, -O-C3-C4-циклоалкила и -OC1-C2-галогеналкила;R3 выбран из группы, состоящей из водорода, -C1-C4-алкила, -C2-C4-галогеналкила, -C2-C4-алкилOH, -C3-C6-циклоалкила, -CH2C3-C6-циклоалкила, -C2-C4-алкил-O-C2-C4-алкила, -C(O)C1-C4-алкила,-C(O)C1-C4-галогеналкила, -CH2-тиазола, фенила, бензила, тетрагидротиопиранила и тетрагидропиранила, причем указанная циклоалкильная, тетрагидротиопиранильная, тетрагидропиранильная и тиазолильная группа может содержать в качестве заместителей одну или две группы, независимо выбранные из группы, состоящей из галогена, гидрокси, C1-C2 алкила и -C1-C2 галогеналкила; или к фармацевтически приемлемой соли, энантиомеру, диастереомеру такого соединения или их смеси. Настоящее изобретение также относится к соединению формулы II гдеотсутствует или возможно представляет собой связь;R1 независимо выбран из водорода, -C1-C2-алкила, галогена, гидрокси, -C1-C2-галогеналкила, -C1-C3 алкокси, циано, -O-C3-C4-циклоалкила и -OC1-C2-галогеналкила;R4 выбран из группы, состоящей из -C1-C4-алкила, -C2-C4-алкил-OH, и -C3-C6-циклоалкила, причем указанная циклоалкильная группа может содержать в качестве заместителей одну или две группы, независимо выбранные из группы, состоящей из галогена и -C1-C2-алкила; или к фармацевтически приемлемой соли, энантиомеру, диастереомеру такого соединения или их смеси. Настоящее изобретение также относится к фармацевтическим композициям, включающим соединение формулы I или II. Настоящее изобретение также относится к способу лечения или предотвращения ожирения у нуждающегося в этом пациента, причем такое лечение или предотвращение включает введение указанному пациенту терапевтически эффективного количества соединения формулы I или II совместно с фармацевтически приемлемым носителем, разбавителем или наполнителем. Настоящее изобретение также относится к способу избирательного противодействия (антагонизма) связыванию с рецепторами MCHR1 для лечения заболеваний, которые вызываются или которые обостряются меланин-концентрирующим гормоном. Настоящее изобретение предусматривает применение соединения формулы I или II в качестве препарата для подавления аппетита и/или в качестве агента для снижения веса. Настоящее изобретение относится к применению соединения формулы I или II для производства лекарственного средства для лечения ожирения и связанных с ним заболеваний. Настоящее изобретение относится к соединению формулы I или II для применения в терапии. Подробное описание изобретения Для настоящего изобретения, раскрытого и/или заявленного в данном описании, ниже определены некоторые термины. Термин "C1-C2-алкил" относится к метильной или этильной группам или соответствующим радикалам. В данном изобретении термин "C1-C4-алкил" относится к прямой или разветвленной алифатической цепи, состоящей из от 1 до 4 атомов углерода, включая, но не ограничиваясь перечисленными: метил,этил, пропил, изопропил и н-бутил. Если не указано иначе, термин "алкил" означает C1-C4-алкил. В данном изобретении термин "C3-C6-циклоалкил" относится к циклическому углеводородному радикалу или группе, содержащей от 3 до 6 атомов углерода и не содержащей двойных связей. C3-C6 циклоалкильные группы включают циклопропил, циклобутил, циклопентил и циклогексил. Термин "C1-C2-галогеналкил" относится к C1-C2-алкильной группе, замещенной одним, двумя или тремя атомами галогена. Примеры C1-C2-галогеналкила включают, но не ограничены перечисленными,трифторметил и хлорзтил. Термин "C1-C4-галогеналкил" относится к C1-C4-алкильной группе, содержащей в качестве заместителей один, два или три атома галогена. Примеры C1-C4-галогеналкила включают, но не ограничены перечисленными, трифторметил, хлорэтил и 2-хлорпропил. Термин "C2-C4-галогеналкил" относится к C2-C4-алкильной группе, содержащей в качестве заместителей один, два или три атома галогена. Примеры C2-C4-галогеналкила включают, но не ограничены перечисленными, трифторэтил, хлорэтил и 2-хлорпропил. Термин "C1-C3-алкоксигруппа" относится к молекуле C1-C3-алкила, соединенной оксисвязью с атомом кислорода, т.е. к -OC1-C3-алкилу. Примеры C1-C3-алкоксигрупп включают метокси, этокси, пропокси, изопропокси. В данном изобретении термин "C2-C4-алкил-OH" относится к заместителю, содержащему указанное количество атомов углерода и группу OH на конце. Например, C2-алкил-OH представляет собой-CH2CH2OH. Термин "галоген" относится к фтору, хлору, брому и йоду. Термин "-OC1-C2-галогеналкил" относится к C1-C2-алкокси (т.е. -OC1-C2-алкильной) группе, содержащей галогены в качестве заместителей при одном или двух атомах углерода. В данном изобретении термины "лечение" и "лечить" включают сдерживание, снижение выражен-2 015559 ности, облегчение, замедление, остановку или обращение прогрессирования или тяжести патологического состояния или его осложнений. В данном изобретении термин "предотвращение" относится к снижению вероятности того, что у реципиента соединения формулы I или II проявится или разовьется какое-либо из патологических состояний или их осложнений, описанных в данном изобретении. В данном изобретении термин "терапевтически эффективное количество" означает количество соединения формулы I или II, достаточное для лечения или предотвращения патологического состояния или его неблагоприятных эффектов, описанных в данном изобретении; или количество соединения формулы I или II, достаточное для оказания антагонистического действия в отношении рецептора MCHR1 для решения задач настоящего изобретения. Термины "заболевания, связанные с ожирением" и "связанные заболевания" в данном изобретении относятся к симптомам, заболеваниям или патологическим состояниям, которые вызваны, которые усугубляет, стимулирует или которые связаны с состоянием тучности. Такие заболевания, патологические состояния и/или симптомы включают, но не ограничены перечисленными, расстройства пищевого поведения (булимию, нервную анорексию и т.д.), диабет, осложнения диабета, диабетическую ретинопатию,нарушение половой/репродуктивной функции, депрессию, тревожность, гипертензию, мозговое кровоизлияние, застойную сердечную недостаточность, расстройства сна, атеросклероз, ревматоидный артрит,инсульт, гиперлипидемию, гипертригликемию, гипергликемию и гиперлипопротеинемию. В предварительной приоритетной заявке на патент США S/N 60/870011 описано соединение формулы гдевозможно представляет собой связь для образования двойной связи;q представляет собой 0, 1, 2 или 3; при этом в других положениях фенильного кольца находятся атомы водорода;R1 независимо выбран из водорода, C1-C4-алкила, галогена, гидрокси, C1-C4-галогеналкила, C1-C4 алкокси, -O-C3-C6-циклоалкила и -OC1-C4-галогеналкила;R3 выбран из группы, состоящей из водорода, C1-C4-алкила, C1-C4-галогеналкила, C2-C4-алкил-OH,C3-C6-циклоалкила и C2-C4-алкил-O-C1-C4-алкила, -C(O)C1-C4-алкила, причем указанная циклоалкильная группа может содержать в качестве заместителей одну или две группы, независимо выбранные из группы, состоящей из галогена и C1-C4-галогеналкила; или фармацевтически приемлемая соль такого соединения. Некоторые соединения формулы I или II могут также существовать в виде фармацевтических солей присоединения кислоты. Соли присоединения кислоты обычно получают путем проведения реакции эквивалентного количества кислоты (по количеству молей доступных основных свободных пар электронов на атомах азота, или небольшого избытка) с основным соединением согласно настоящему изобретению. Указанный продукт в форме соли присоединения часто выделяют в виде продукта кристаллизации. Кристаллизация может быть спонтанной или ее можно ускорить с помощью охлаждения и/или внесения затравки. Фармацевтически приемлемые соли и обычная методика их получения известны специалисту в данной области. См., например, P. Stahl, et al., Handbook of Pharmaceutical Salts: Properties, Selections andUse (VCHA/Wiley-VCH, 200); S. M. Berge, et al., "Pharmaceutical Salts" Journal of Pharmaceutical Sciences,том 66, номер 1, январь 1977. Предпочтительные соединения согласно настоящему изобретению Некоторые соединения согласно настоящему изобретению особенно и предпочтительно представляют особый интерес. Ниже приведен список нескольких групп предпочтительных соединений. Предпочтительные группы R1. Предпочтительные группы R1 независимо выбраны из группы, состоящей из водорода, галогена,гидрокси, -C1-C2-галогеналкила, -C1-C3-алкокси, -O-C3-C4-циклоалкила и -OC1-C2-галогеналкила. Более предпочтительно R1 представляет собой хлор, фтор, метокси, циклопропокси, трифторметил, трифторметокси или циано. Наиболее предпочтительная R1 группа представляет собой хлор. Предпочтительные R2. Предпочтительная группа R2 выбрана из группы, состоящей из водорода, -OC1-C2-алкила, циано,-OC1-C2-галогеналкила и галогена. Более предпочтительная R2 группа выбрана из группы, состоящей из водорода, метокси (-OMe), циано, фтора и хлора. Наиболее предпочтительно R2 представляет собой метокси. Предпочтительные группы R3. Предпочтительные группы R3 независимо выбраны из группы, состоящей из водорода, -C1-C4 алкила, -CH2 циклопропила, -CH2C3-C4-циклоалкила и -С(О)C1-C2-алкила, причем указанные алкильная и-3 015559 циклоалкильная группы возможно содержат в качестве заместителей одну или две группы, независимо выбранные из группы, состоящей из галогена, гидрокси, -С 3-С 4-циклоалкила, -C1-C2-алкила и -C1-C2 галогеналкила. Более предпочтительной является группа R3, выбранная из группы, состоящей из водорода, метила, циклопропила и циклобутила. Предпочтительные группы R4. Предпочтительная R4 группа представляет собой метил, этил, циклобутил или циклопентил. Более предпочтительно R4 представляет собой метил или циклобутил. Предпочтительное соединение согласно настоящему изобретению представляет собой соединение формулы I, гдеR3 представляет собой водород, -CH3, -CH2CH2OH, -CH2CH2F, -CH2CHF2, изопропил, циклопропил,-CH2-циклопропил или циклобутил, причем указанная циклопропильная или циклобутильная группа может содержать в качестве заместителей одну или две группы, независимо выбранные из группы, состоящей из фтора, метила и циклобутила. Также предпочтительным является соединение формулы I, гдеR3 представляет собой водород, -CH3, -CH2CH2F, -CH2CHF2, циклопропил, или циклобутил, причем указанная циклопропильная или циклобутильная группа может содержать в качестве заместителя группу, выбранную из группы, состоящей из фтора, гидрокси и метила. Также предпочтительным является соединение формулы I, гдеR2 представляет собой хлор или -OCH3; иR3 представляет собой водород, -CH3, -CH2CH2F, -CH2CHF2, циклопропил, или циклобутил, причем указанная циклопропильная или циклобутильная группа может содержать в качестве заместителя группу, выбранную из группы, состоящей из фтора, гидрокси и метила. Также предпочтительным является соединение формулы I, гдеR3 представляет собой водород, -CH3, -CH2CH2F, -CH2CHF2, циклопропил или циклобутил, причем указанная циклопропильная или циклобутильная группа может содержать в качестве заместителя группу, выбранную из группы, состоящей из фтора, гидрокси и метила. Также предпочтительным является соединение формулы I, гдеR3 представляет собой водород, -CH3, циклопропил или циклобутил, причем указанная циклопропильная или циклобутильная группа может содержать в качестве заместителя группу, выбранную из группы, состоящей из фтора, гидрокси и метила. Также предпочтительным является соединение формулы I, гдеR3 представляет собой водород, -CH3, -CH2CH2OH, -CH2CH2F, -CH2CHF2, изопропил, циклопропил,-CH2-циклопропил, или циклобутил, причем указанная циклопропильная или циклобутильная группа может содержать в качестве заместителей одну или две группы, независимо выбранные из группы, состоящей из фтора и метила. Также предпочтительным является соединение согласно формуле I, гдеR3 представляет собой водород, -CH3, циклопропил, или циклобутил, причем указанная циклопропильная или циклобутильная группа может содержать в качестве заместителя группу, выбранную из группы, состоящей из фтора, гидрокси и метила. Также предпочтительным является соединение формулы II, гдеR4 представляет собой CH3. Также предпочтительным является соединение формулы II, в которомR4 представляет собой CH3. Указанные соединения формулы (I) или (II) можно получить с помощью множества процедур, известных в данной области, а также процедур, описанных ниже. Тем не менее, приведенное ниже обсуждение не предполагает ограничения объема настоящего изобретения. Например, конкретные этапы синтеза для каждого из описанных путей можно комбинировать различным образом или сочетать с этапами из различных схем для получения дополнительных соединений формулы (I) или (II). Продукты каждого этапа в приведенных ниже схемах можно выделить с помощью обычных способов, включая экстракцию,выпаривание, осаждение (преципитацию), хроматографию, фильтрацию, растирание в порошок, кристаллизацию и тому подобные. В данном изобретении следующие термины имеют указанные значения: "MeOH" относится к метанолу; "EtOH" относится к этанолу; "EtOAc" относится к этилацетату; "DMF" относится к диметилформамиду; "ДМСО" относится к диметилсульфоксиду; "ТФА" относится к трифторуксусной кислоте; Получение промежуточного продукта формулы (8) можно осуществить в соответствии с реакциями, показанными на схеме 1. Подходящее соединение формулы (8) представляет собой соединение, в котором (R1)q имеет значение, определенное для формулы I. В схеме 1, этап A, эфир тиазолоуксусной кислоты формулы (1) восстанавливали до тиазол-этанола формулы (2). Для специалиста в данной области должно быть очевидно, что существует множество восстановителей, таких как LiAlH4, NaBH4, LiBH4 и тому подобные, подходящих для применения в таком превращении. В предпочтительном способе применяют DIBAL в апротонном растворителе, таком как эфир, толуол или предпочтительно ТГФ, при температуре, равной приблизительно от -80 до 60C. В схеме 1, этап B, тиазол формулы (2) карбоксилировали для получения тиазол-карбоновой кислоты формулы (3). Например, тиазол (2) обрабатывали 2-3 эквивалентами подходящего основания, такого как LDA, литий бис(триметилсилил)амид или предпочтительно н-бутиллитий, в ТГФ или диэтиловом эфире при температуре, равной приблизительно от -80 до -70C, в течение приблизительно от 2 до 4 ч. Полученный дианион затем обрабатывали раствором газа CO2 в ТГФ или диэтиловом эфире, чтобы получить тиазол-карбоновую кислоту формулы (3). На этапе C тиазол-карбоновую кислоту формулы (3) дегидрировали в безводных условиях, чтобы образовался тиазол-лактон формулы (4). Например, раствор карбоновой кислоты формулы (3) в безводном толуоле или бензоле обрабатывали кислотным катализатором, таким как паратолуолсульфоновая-5 015559 кислота и нагревали до кипения с обратным холодильником в течение от 4 до 24 ч, чтобы циклизовать в лактон формулы (4). Применение ловушки Дина-Старка ускоряет реакцию путем удаления воды по мере ее образования. В схеме 1, этап D, тиазол-лактон формулы (4) переэтерифицировали в эфирный спирт формулы (5),применяя неорганическую кислоту, такую как концентрированная серная кислота, в присутствии метанола. Впоследствии, на этапе Е, спирт формулы (5) окисляли до альдегида формулы (6). Для специалиста в данной области должно быть очевидно, что существует множество способов такого окисления. В предпочтительном способе применяют TEMPO в инертном растворителе, таком как дихлорметан, в присутствии бромида калия, гипохлорита натрия и бикарбоната натрия. В схеме 1, этап F, альдегид формулы (6) преобразовывали в ацеталь формулы (7). Существуют различные способы образования ацеталя, доступные для специалиста в данной области. В предпочтительных условиях применяют кислотную ионообменную смолу с триметилортоформиатом в MeOH. На этапеG ацеталь-эфир формулы (7) гидролизовали до кислоты формулы (8), применяя неорганическое основание, такое как гидроксид натрия в подходящем полярном растворителе, таком как этанол. Легко понять, что соединение формулы (1) можно получить с помощью способов, аналогичных способам, описанным в данном изобретении, применяя процедуры, которые хорошо известны и признаны в данной области. Например, соединения формулы (1) получают путем циклизации тиоамида с галогенацетоацетатом. Если они недоступны для приобретения, тиоамиды можно легко получить из замещенных бензамидов, применяя способы, известные в данной области, например, с использованием реагента Лоуссона или пентасульфида фосфора. Схема 2 Получение соединений формулы (I) можно осуществить в соответствии со способами, показанными на схеме 2. Подходящее соединение формулы (8) представляет собой соединение, в котором (R1)q имеет значения, определенные для формулы (I), и подходящее соединение формулы (9) представляет собой соединение, в котором R2 имеет значения, определенные в формуле (I). В схеме 2, этап A, амин формулы (9) ацилировали кислотой формулы (8). Для специалиста в данной области очевидно, что существует множество способов, доступных для ацилирования карбоновых кислот. В предпочтительном способе применяют гидрат 1-гидроксибензотриазола и гидрохлорид 1-(3 диметиламинопропил)-3-этилкарбодиимида в присутствии амина, такого как диизопропилэтиламин, в инертном растворителе, таком как дихлорметан, ацетонитрил или предпочтительно ТГФ. В схеме 2, этап B, тиазол-амид формулы (10) подвергают внутримолекулярной циклизации с образованием тиазол-пиридинона формулы (11) с последующим снятием защитной группы tBOC с получением N-незамещенного азетидина. Циклизацию проводили в инертном растворителе, таком как этанол, в присутствии неорганической кислоты, такой как концентрированная HCl, и нагревали до температуры кипения с обратным холодильником указанного растворителя в течение от 1 до 24 ч. В N-незамещенный азетидин формулы (11), при том, что он сам является желательным продуктом для целей настоящего изобретения, также можно ввести заместители с получением других соединений согласно настоящему изобретению. Например, в схеме 2, этап C, указанный незамещенный азетидин (11) подвергали восстановительному алкилированию формальдегидом, ацетоном, циклобутаноном или другими альдегидами и кетонами, применяя цианоборгидрид натрия или триацетоксиборгидрид натрия. Азетидин (11) также подвергали восстановительному алкилированию кеталями или ацеталями, такими как (1-этоксициклопропил)окситриметилсилан или 2,5-дигидрокси-1,4-диоксан. В такие кетоны, альдегиды, кетали или ацетали можно ввести заместители, применяя процедуры, известные в данной области. Кроме того, азетидин (11) ацилировали возможно замещенными хлорангидридами, хлорформиатами или активированными карбоновыми кислотами, такими как хлорид трифторпропионила или ацетилхлорид.-6 015559 Легко понять, что соединения формулы (9) можно получить с помощью способов и процедур, которые описаны в данном изобретении или известны в данной области. Например, соединения формулы (9) получают путем нуклеофильного замещения в ароматическом ядре фтор- или хлорнитробензола коммерчески доступным трет-бутиловым эфиром 3-гидроксиазетидин-1-карбоновой кислоты. Последующее восстановление нитрогруппы указанного амина обеспечивает анилин (9). Схема 3 Получение соединений формулы (I) можно осуществить в соответствии со способами, изображенными на схеме 3. Подходящее соединение формулы (4) представляет собой соединение, в котором (R1)q имеет значения, определенные в формуле (I), и подходящее соединение формулы (9) представляет собой соединение, в котором R2 имеет значения, определенные в формуле (I). В схеме 3, этап A, проводят реакцию тиазол-лактона формулы (4) с амином формулы (9), применяя стандартный протокол Вайнреба (Weinreb) (Basha, Anwer; Lipton, M.; Weinreb, Steven M. Tetrahedron Letters, 1977, 48, 4171-4174), в результате получают амид формулы (12). Например, амин (9) растворяли в апротонном растворителе, таком как CH2Cl2 или предпочтительно толуол, и обрабатывали 2-2,5 М раствором триметилалюминия в толуоле. Полученный раствор перемешивали при температуре от приблизительно 0C до комнатной температуры в течение приблизительно от 5 до 60 мин, а затем обрабатывали тиазол-лактоном формулы (4). Полученный раствор перемешивали при температуре в диапазоне между приблизительно комнатной температурой и 110C в течение приблизительно от 3 до 24 ч, в результате получали амид формулы (12). В схеме 3, этап B, тиазол-амид формулы (12) циклизовали в условиях Мицунобу (Maligres, P. E. etal., J. Het. Chem. 2003, 40(2), 229-241) с образованием тиазол-лактама формулы (13). Например, указанный амид формулы (12) обрабатывали триалкил-или триарилфосфином, таким как Me3P, Ph3P, или предпочтительно Bu3P, и диалкилазодикарбоксилатом, таким как DEAD или DIAD. Реакцию проводили в инертном растворителе, таком как толуол, CH2Cl2, или предпочтительно ТГФ. На этапе C азетидин tBOC тиазол-лактам формулы (13) освобождали от защитной группы с образованием незамещенного азетидина формулы (14). Обычные условия снятия защитной группы для удаления tBOC-группы хорошо известны специалистам в данной области, и их можно найти в тексте у T.W.Green и P.G.M. Wuts в "Protective Groups in Organic Synthesis", John WileySons, Inc., 1991, 328-330. Предпочтительлные условия включают использование трифторуксусной кислоты или, в качестве альтернативы, 37% соляной кислоты в растворителе н-пропаноле при температуре от комнатной до приблизительно 90C. В указанный незамещенный азетидин формулы (14) при том, что он сам является желаемым продуктом в рамках настоящего изобретения, также можно ввести заместитель и получить другие соединения согласно настоящему изобретению, как показано в схеме 3, этап D, способом, аналогичным описанному в схеме 2, этап C. Альтернативный способ получения соединений формулы (I) можно провести в соответствии со способами, изображенными на схеме 4. В схеме 4, этап A, тиазолилдикарбоновую кислоту формулы (15) избирательно этерифицировали до тиазолилового эфира-кислоты формулы (16). Условия этерификации включают спиртовой растворитель,такой как метанол, в присутствии неорганической кислоты, такой как серная кислота, при температуре,равной приблизительно от 50C до температуры кипения, с обратным холодильником растворителя. В схеме 4, этап B, тиазолиловый эфир-кислоту формулы (16) ацилировали амином формулы (9) с получением тиазолилового эфира-амида формулы (17). Для специалиста в данной области должно быть очевидно, что доступно множество способов ацилирования карбоновых кислот. В предпочтительном способе применяют циклический ангидрид 1-пропанфосфоновой кислоты в качестве реагента реакции сочетания в инертном растворителе, таком как ТГФ, в присутствии органического амина, такого как Nметилморфолин. На этапе C эфир-амид формулы (17) восстанавливали до алкилгидрокси-амида формулы (18). Для специалиста в данной области очевидно, что существует множество способов восстановления сложных эфиров до спиртов, например, с применением литийалюмогидрида, диизобутилалюмогидрида, комплекса боран-метилсульфид или боргидрида лития. Пердпочтительные условия включают боргидрид лития в инертном растворителе, таком как ТГФ. В схеме 4, этап D, алкилгидрокси-амид формулы (18) циклизовали до тиазол-пиридинона формулы(19). Спирт сначала окисляли до формальдегида, применяя комплекс серный ангидрид-пиридин, который затем циклизовали с амидом in situ с образованием пиридинона. Реакция протекала в инертном растворителе, таком как ДМСО, при температуре от комнатной до приблизительно 100C. На этапе E азетидин тиазол-пиридинон формулы (19) освобождали от защитной группы, применяя способы, описанные ранее для схемы 3, этап D. Полученный незамещенный азетидин дополнительно подвергали реакции с получением соединений согласно настоящему изобретению, изображенных в формуле (I), как было ранее описано для схемы 2, этап C. Оцевидно, что соединения формулы (15) можно получить с помощью способов и процедур, описанных в данном изобретении или известных в данной области. Например, диэтиловый эфир 3 оксоглутаровой кислоты можно хлорировать сульфурилхлоридом и затем осуществить его реакцию с тиобензамидом с получением этилового эфира 2-фенил-4-этоксикарбонилметилтиазол-5-карбоновой кислоты. Диэтиловый эфир затем гидролизовали до дикислоты формулы (15). Получение промежуточного продукта формулы (22) можно осуществить в соответствии с реакциями, которые показаны на схеме 5. Подходящее соединение формулы (22) представляет собой соединение,в котором (R1)q имеет значения, определенные для формулы I. В схеме 5, этап A, 3-(2-бромтиазол-4-ил)-акриловую кислоту (20) преобразовывали в ацилазид, который затем подвергали перегруппировке Курциуса в изоцианат, который циклизовали в бромтиазолопиридинон формулы (21). Хлорангидрид легко получить с использованием оксалилхлорида в инертном растворителе, таком как дихлорметан. После выпаривания хлорангидрид используют в реакции с азидом натрия в смеси растворителей, таких как вода/ацетон/диоксан или ТГФ с получением ацилазида. После обработки ацилазид нагревали до высокой температуры, равной приблизительно от 180 до 250C, в теплоносителе Dowtherm A и диоксане в течение приблизительно от 30 мин до 4 ч. Изоцианат получали insitu и подвергали внутримолекулярной реакции с тиазолом, в результате чего получали бромтиазолопиридинон формулы (21). На этапе B бромтиазолопиридинон формулы (21) подвергали взаимодействию с фенилбороновой кислотой, чтобы получить фенилтиазолопиридинон формулы (22) в реакции перекрестного сочетания Сузуки. Для специалиста в данной области очевидно, что существует множество условий, пригодных для содействия таким реакциям перекрестного сочетания. В указанных условиях реакции применяется подходящий растворитель, такой как диоксан, толуол или диметоксиэтан с добавлением этанола и воды. Добавляли раствор неорганического основания, такого как карбонат натрия или калия. Реакцию проводили в присутствии палладиевого катализатора, такого как тетракистрифенилфосфин палладия (0), в инертной атмосфере при температуре, равной приблизительно от 70 до 100C, в течение приблизительно от 8 до 24 ч. В качестве альтернативы фенилтиазолопиридинон формулы (22) можно получить из лактона формулы (4), как показано в этапах C, D и E. В схеме 5, этап C, лактон формулы (4) подвергали взаимодействию с 2,4-диметоксибензиламином по протоколу Weinreb, как описано для схемы 3, этап A, чтобы получить тиазол-амид формулы (23). На этапе D указанный амид формулы (23) циклизовали с бензилтиазолопиридиноном формулы (24). Спирт окисляли до альдегида, применяя 1-гидрокси-1-оксо-1H-бензо[d][1,2]йодоксол-3-он, и затем последовательно подвергали взаимодействию с указанным амидом. Реакцию проводили в инертном растворителе, таком как этилацетат, при температуре от 40C до температуры кипения с обратным холодильником растворителя. На этапе E 2,4-диметоксибензильную защитную группу удаляли, применяя чистую ТФУ при температуре от 50 до 100C, чтобы получить тиазолопиридинон формулы (22). Очевидно, что бромтиазол формулы (20) можно получить с помощью способов и процедур, которые описаны в данном изобретении или которые известны в данной области. Например, 2-бромтиазол-4 карбальдегид можно удлинить до метилового эфира акриловой кислоты с помощью метил(трифенилфосфоранилиден)ацетата в реакции Виттига, после чего следовал гидролиз, чтобы получить бромтиазол-акриловую кислоту формулы (20). На схеме 6 показан еще один путь получения соединений формулы (I), в котором используется фенилтиазолопиридинон формулы (22). В схеме 6, этап А, фенилтиазолопиридинон формулы (22) объединяют с фенилбромидом формулы(25a) или (25b), в результате получают тиазолопиридинон формулы (19) или формулы (I). Указанную реакцию проводили в инертном растворителе, таком как ТГФ, или предпочтительно диоксан, с добавлением неорганического основания, такого как карбонат цезия. Применяли медный катализатор, такой как йодид меди(I), в присутствии симм-диметилэтилендиамина. Реакцию нагревали до температуры, равной от приблизительно 70C до температуры кипения с обратным холодильником. На этапе B очевидно, что защищенный азетидин формулы (19) можно легко преобразовать в конечные продукты формулы (I), как описано ранее, например как в схеме 3, этапы C и D. Схема 7 Получение соединения формулы (II) можно осуществить в соответствии со способом, изображенным на схеме 7, где R4 имеет значение, определенное для формулы (II). Азетидин формулы (Ia) окисляли до N-оксида азетидина формулы (II), применяя м-хлорпероксибензойную кислоту в инертном растворителе, таком как дихлорметан. Тест на связывание 125I-MCH и функциональный тест на связывание GTP35S применяли, чтобы продемонстрировать эффективность соединений согласно настоящему изобретению в качестве антагонистов MCHR1. Специалист в данной области сможет провести оба теста: тест на связывание 125I-MCH и функциональный тест на связывание GTP35S, применяя процедуры, описанные в данном изобретении,или процедуры, известные в данной области. Описание теста на связывание можно найти, например, вidentification of critical residues involved in binding and activation. Mol Pharmacol 58, 217-225. Описание функционального теста с GTPS, можно найти, например, y Gao, X., et al., 2004. Europium-labeled melanin-concentrating hormone analogues: ligands for measuring binding to melanin-concentrating hormone receptors 1 and 2. Anal Biochem 328, 187-195. Все лиганды, радиолиганды, растворители и реагенты, подходящие для проведения этих тестов,легко можно приобрести в коммерческих источниках, либо они легко могут быть получены специалистами в данной области. Тест на связывание I-MCH и функциональный тест на связывание GTP35S, в которых используют мембраны, выделенные из клеток AV-12, трансфецированных MCHR1 человека(Swiss-Prot, номер доступа Q99705), применяли, чтобы продемонстрировать эффективность соединений,описанных в данном изобретении в качестве антагонистов MCHR1. Связывание соединений с MCHR1 оценивали в конкурентном тесте на связывание, используя 125I-MCH, соединение согласно настоящему изобретению и мембраны клона 43, применяя методику близости сцинтилляций. Значения IC50 (определенные, как концентрация тестируемого соединения, необходимая для уменьшения специфичного связывания 125I-MCH на 50%) определяли путем аппроксимации результатов концентрация-ответ четырехпараметрической моделью (максимальный ответ, минимальный ответ, коэффициент Хилла, IC50), применяя электронные таблицы. Значения K1 рассчитывали из значений IC50, применяя аппроксимацию ЧенгаПрусова, как описано у Cheng et al. Biochem. Pharmacol., 22: 3099-3108 (1973). Примеры соединений демонстрировали Ki1 мкМ в тесте на связывание, описанном в данном изобретении. В частности, соединение из примера 37 проявляет среднюю Ki MCHR1, равную приблизительно 4 нМ. Таким образом, соединения согласно настоящему изобретению являются эффективными в качестве антагонистов MCHR1. Функциональный антагонизм активности MCH оценивали путем измерения способности тестируе- 10015559 мого соединения ингибировать стимулируемое MCH связывание GTP35S с мембранами, выделенными из клеток AV-12, экспрессирующих MCHR1 человека, применяя тест на сцинтилляционный тест на близость. Значения IC50 (определенные как концентрация тестируемого соединения, необходимая для уменьшения MCH-стимулированного связывания GTP35S на 50%) определяли путем аппроксимации результатов концентрация-ответ четырехпараметрической моделью (максимальный ответ, минимальный ответ, коэффициент Хилла, IC50) с применением электронных таблиц. После подтверждения конкурентного антагонизма с помощью анализа Шилда значения Kb рассчитывали по значениям IC50 для каждого антагониста и EC50 для MCH (определяли независимо), применяя модификацию аппроксимации ЧенгаПрусова, как описано у Leff и Dougal (Trends Pharmacol. Scl. (1993) 14: 110-112). Примеры соединений в функциональном тесте, описанном в данном изобретении, демонстрируют значения Kb1 мкМ. В частности, соединение из примера 28 демонстрирует значение Kb для MCHR1, равное приблизительно 6 нМ. Таким образом, соединения согласно настоящему изобретению являются эффективными антагонистамиMCHR1. Чтобы продемонстрировать эффективность in vivo, соединения согласно настоящему изобретению вводили перорально путем гаважа самцам крыс линии Long Evans с ожирением, индуцированным режимом питания (Харлан, Индиана), весящим 450-500 г. Животных держали раздельно в комнате с регулируемой температурой (24C) с обратным циклом 12 ч света/темноты (темнота с 10:00/22:00). Вода и пища (Teklad 95217, Харлан, Висконсин) были доступны без ограничения. Соединения вводили перорально в среде, которая состоит из 10% аравийской камеди и 0,15% сахарина в воде один раз в день перед началом темного периода в течение 3 дней. Потребление пищи и массу тела измеряли ежедневно в течение 3 дневного периода. Соединение из примера 29 давало уменьшение средней массы тела на приблизительно 7 г при дозе, равной 10 мг/кг, по сравнению со средой в качестве контроля. Результаты показывают, что соединения согласно настоящему изобретению можно применять для лечения ожирения. Как антагонисты связывания MCHR1 соединения согласно настоящему изобретению можно применять для лечения патологических состояний, в которых, как было показано, MCHR1 рецептор принимает участие, или заболеваний, связанных с действием MCH, у человека и не относящихся к человеку животных (в частности, домашних животных). Указанные заболевания, расстройства или патологические состояния, для лечения или предотвращения которых подходят соединения согласно настоящему изобретению, включают заболевания, описанные в данном изобретении и в международной заявке WO 2007/066174. Соединения согласно настоящему изобретению также можно применять в сочетании с другими стандартными терапевтическими агентами для лечения, предотвращения и/или снижения выраженности ожирения и связанных с ним заболеваний. Соединения согласно настоящему изобретению усиливают положительные эффекты от таких одобренных комбинированных терапевтических средств, при этом сводя к минимуму побочные эффекты благодаря возможному снижению потребности в таких комбинированных соединениях. Такие комбинированные препараты можно вводить отдельно или в комбинированной лекарственной форме. Примеры соединений, которые можно применять в комбинации с соединением формулы I или II, включают агенты для похудения (Meridia, Xenical), гипохолестеринемические агенты (такие как, например, ловастатин, симвастатин, правастатин, флувастатин и аторвастатин), агенты, контролирующие или модулирующие уровень глюкозы, соединения-антагонисты каннабиоида CB-1 (такие как, например, римонанбант (rimonanbant и тому подобные. При лечении не являющихся человеком не домашних животных соединения согласно настоящему изобретению можно применять для снижения увеличения веса и/или повышения эффективности усвоения пищи и/или увеличения безжировой массы тела. Соединение формулы I или II перед введением предпочтительно вводят в состав стандартной лекарственной формы. Таким образом, еще один вариант реализации настоящего изобретения представляет собой фармацевтический состав, включающий соединение формулы I или II и фармацевтический носитель. Настоящие фармацевтические составы получают с помощью известных процедур, применяя хорошо известные и легкодоступные ингредиенты. При изготовлении составов (лекарственных форм) согласно настоящему изобретению указанный активный ингредиент (соединение формулы I или II), как правило, смешивают с носителем, или разбавляют носителем, или заключают в носитель, который может иметь форму жидкости, таблетки, капсулы, саше, облатки или в другом контейнере. Если носитель служит разбавителем, он может быть твердым, полутвердым или жидким материалом, который действует как наполнитель, вспомогательное вещество или среда для активного ингредиента. Таким образом, указанные композиции могут быть в форме таблеток, пилюль, порошков, пастилок, саше, крахмальных облаток, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозоля (в твердом виде или в жидкой среде), мягких и твердых желатиновых капсул, суппозиториев, стерильных растворов для инъекций и стерильных упакованных порошков. Специалисту в данной области известны способы, реагенты и условия получения различных стандартных лекарственных форм, либо он сможет получить доступ к такой информации без проведения излишних экспериментов. Композиции согласно настоящему изобретению могут входить в состав лекарст- 11015559 венной формы, обеспечивающей быстрое, продолжительное или задержанное высвобождение указанного активного ингредиента после введения пациенту. Конкретная доза для введения определяется конкретными условиями в каждой конкретной ситуации. Эти условия включают конкретный путь введения, предшествующий анамнез пациента, патологическое состояние или симптом, от которого лечат, тяжесть патологического состояния/симптома, от которого лечат, и возраст и пол реципиента. Тем не менее, очевидно, что вводимую терапевтическую дозировку должен определять лечащий врач в свете соответствующих обстоятельств или, для не являющихся человеком реципиентов, ветеринар. Как правило, минимальная эффективная ежедневная доза соединения формулы I или II равна от приблизительно 0,1 мг до приблизительно 0,5 мг на 1 кг. Максимальная эффективная доза равна от приблизительно 1 до приблизительно 5 мг на 1 кг. Решение о конкретной дозе, подходящей для конкретного реципиента, принимает лечащий врач на основании конкретных обстоятельств, связанных с данным пациентом. Соответствующую дозу также можно определить в соответствии со стандартной практикой в области медицины, относящейся к "титрованию дозы" для реципиента, что означает, что первоначально вводят низкую дозу указанного соединения и последовательно постепенно увеличивают дозу до проявления желаемого терапевтического эффекта. Указанные соединения можно вводить множеством путей, включая пероральный, ректальный,трансдермальный, подкожный, местный, внутривенный, внутримышечный или интраназальный пути. Предпочтительным путем введения является пероральный. Примеры Не вдаваясь в подробности, предполагается, что специалист сможет на основании предшествующего описания осуществить на практике настоящее изобретение в полном объеме. Следующие примеры синтеза и примеры соединений приведены для более подробного описания настоящего изобретения. Они предназначены для иллюстрации, но не ограничения настоящего изобретения каким бы то ни было образом. Реагенты и исходные вещества легко доступны или могут быть легко синтезированы средним специалистом в данной области. Для специалиста в данной области будут очевидны возможные варианты процедур, описанных в следующих примерах. Названия соединений согласно настоящему изобретению получены с помощью компьютерной программы ChemDraw Ultra версии 7.0.1. Пример синтеза 1. Этиловый эфир [2-(4-хлорфенил)тиазол-4-ил]уксусной кислоты. Растворяли 4-хлортиобензамид (74,0 г, 431,1 ммоль) в EtOH (470 мл) и обрабатывали этил-4 хлорацетоацетатом (58,0 мл, 70,1 г, 426,0 ммоль). Механически перемешивали полученный раствор при нагревании с обратным холодильником в течение 2 ч. Охлаждали до комнатной температуры, добавляли воду (1000 мл) и экстрагировали Et2O (2000 мл, затем 2500 мл). Объединяли указанные органические растворы и промывали солевым раствором (950 мл). Концентрировали под вакуумом с получением масла, которое затвердевает при отстаивании (121,8 г). Перекристаллизовывали неочищенный материал из смеси изопропанол/вода с получением указанного в заголовке соединения (107,3 г, 89% выход). Масс-спектрометрия с ионизацией электрораспылением (ES/MS): отношение массы к заряду m/z (35Cl) 282,1 [M+1]+. Пример синтеза 2. 2-[2-(4-Хлорфенил)тиазол-4-ил]этанол. Растворяли этиловый эфир [2-(4-хлорфенил)тиазол-4-ил]уксусной кислоты (107,4 г, 381,2 ммоль) в ТГФ (800 мл) и охлаждали до 0-5C. Медленно добавляли DIBAL (1,0 М в ТГФ, 800 мл, 800 ммоль) в течение приблизительно 3,5 ч, поддерживая температуру 5C. После завершения добавления нагревали полученный раствор до комнатной температуры и механически перемешивали в течение ночи. Охлаждали указанный раствор до 0-5C и медленно добавляли еще DIBAL (150 мл), поддерживая температуру 5C. Перемешивали при комнатной температуре в течение 2,5 ч, затем охлаждали до 0-5C и медленно гасили в течение 5 ч водной насыщенной солью Рошеля (2900 мл), поддерживая температуру 10C. Экстрагировали смесь EtOAc (23300 мл) . Объединяли указанные органические растворы и концентрировали под вакуумом с получением масла (112,9 г). Растворяли масло в толуоле (600 мл) и концентрировали под вакуумом, затем повторяли. Сушили осадок под вакуумом в течение 6 ч с получением осадка,весящего 107,4 г (110%). ES/MS m/z (35Cl) 240,1 [M+1]+. Пример синтеза 3. 2-(4-Хлорфенил)-4-(2-гидроксиэтил)тиазол-5-карбоновая кислота. Растворяли 2-[2-(4-хлорфенил)тиазол-4-ил]этанол (107 г брутто, 91 г нетто, 380 ммоль) в ТГФ (1210 мл) и охлаждали до приблизительно -75C. Дегазировали охлажденный раствор под вакуумом и заполняли азотом три раза. Медленно добавляли n-BuLi (1,6 М в гексанах, 530 мл, 848 ммоль) на протяжении приблизительно 4 ч., поддерживая температуру -70C. Медленно добавляли полученный пурпурнокрасный раствор через трубочку в течение 3,5 ч в колбу, содержащую ТГФ при -75C, насыщенный газом CO2 (приблизительно 390 г), поддерживая температуру -60C. Насыщали полученную коричневую суспензию газом CO2 (приблизительно 355 г) и затем позволяли суспензии дойти до комнатной температуры, продолжая механическое перемешивание в течение ночи. Гасили реакцию IN HCl (3000 мл), охлаждали до 16C и собирали преципитат путем фильтрации. Ополаскивали твердый остаток гексанами(1400 мл) и сушили под вакуумом с получением 81,3 г (75%) указанного в заголовке соединения. ES/MS Смешивали 2-(4-хлорфенил)-4-(2-гидроксиэтил)тиазол-5-карбоновую кислоту (81,2 г, 286,2 ммоль) с p-TsOH моногидратом (32,0 г, 168,2 ммоль) и толуолом (1200 мл). Нагревали полученную суспензию до кипения с обратным холодильником, за это время твердый остаток растворялся. Механически перемешивали полученный раствор светло-коричневого цвета в течение 2 ч, применяя ловушку Дина-Старка для сбора воды (21 мл). Охлаждали указанный раствор до комнатной температуры и добавляли насыщенный водный NaHCO3 (1700 мл) и EtOAc (1700 мл). Отделяли органический раствор, затем экстрагировали водный слой EtOAc (21700 мл). Объединяли органические растворы, промывали солевым раствором (1700 мл) и концентрировали под вакуумом с получением твердого остатка. Смешивали твердый остаток с CH2Cl2 (500 мл) и концентрировали под вакуумом, повторяли два раза, в результате получали 60,1 г (79%) указанного в заголовке соединения. ES/MS m/z (35Cl) 266,0 [M+1]+. Пример синтеза 5. Метиловый эфир 2-(4-хлорфенил)-4-(2-гидроксиэтил)тиазол-5-карбоновой кислоты. Растворяли 2-(4-хлорфенил)-6,7-дигидропирано[4,3-d]тиазол-4-он (500 г, 1882 ммоль) в MeOH (5 л) и добавляли концентрированную серную кислоту (31 мл). Перемешивали указанный раствор при 55C в течение 15 ч, затем нагревали до 66C и продолжали перемешивание в течение еще 4,5 ч. Охлаждали раствор до 45C и концентрировали под вакуумом до половины исходного объема. Продолжали охлаждение суспензии до 20C. Выделяли преципитат путем фильтрации и промывали твердый остаток холодным MeOH. Сушили твердый остаток (420,5 г) под вакуумом в течение ночи. Концентрировали фильтрат до приблизительно 600 мл, фильтровали и промывали холодным MeOH, в результате получали дополнительный твердый остаток (40,7 г). Очищали неочищенный материал путем флэш-хроматографии, применяя 10% EtOAc/CH2Cl2 в качестве элюента, с получением (442 г, 80%) указанного в заголовке соединения. 1H ЯМР (400 МГц, CDCl3) :7,88 (двойной триплет, J=8,8, 4,7 Гц, 2H), 7,43 (двойной триплет, J=8,7,4,3 Гц, 2H), 4,05 (триплет, J=5,6 Гц, 2H), 3,90 (синглет, 3H), 3,43 (триплет, J=5,6 Гц, 2H), 3,32 (уширенный синглет, 1H). Пример синтеза 6. Метиловый эфир 2-(4-хлорфенил)-4-(2-оксоэтил)тиазол-5-карбоновой кислоты. Растворяли метиловый эфир 2-(4-хлорфенил)-4-(2-гидроксиэтил)тиазол-5-карбоновой кислоты (100 г, 336 ммоль) в CH2Cl2 (2 л) и обрабатывали бромидом калия (4,0 г, 33,6 ммоль) и TEMPO (1,1 г, 7,0 ммоль). Охлаждали раствор до -10C и добавляли раствор гипохлорита натрия (1 л, 0,25 М в воде) и водный бикарбонат натрия (1 л, 1,4 М). Перемешивали полученную суспензию при 0C в течение 15 мин и затем разбавляли водой (3,2 л) и CH2Cl2 (1,3 л). Удаляли органический раствор и экстрагировали водную фазу CH2Cl2 (1,3 л). Объединяли органические растворы и промывали солевым раствором (1,3 л), затем сушили, отфильтровывали и концентрировали с получением (91,5 г, 92%) указанного в заголовке соединения. 1H ЯМР (400 МГц, CDCl3):9,86 (триплет, J=l,5 Гц, 1H), 7,90 (двойной триплет, J=8,4, 4,4 Гц, 2H),7,43 (двойной триплет, J=8,6, 4,4 Гц, 2H), 4,32 (дублет, J=l,8 Гц, 2H), 3,89 (синглет, 3H). Пример синтеза 7. Метиловый эфир 2-(4-хлорфенил)-4-(2,2-диметоксиэтил)тиазол-5-карбоновой кислоты. Смешивали метиловый эфир 2-(4-хлорфенил)-4-(2-оксоэтил)тиазол-5-карбоновой кислоты (96,4 г,308 ммоль), ионообменную смолу Dowex 508 (33,3 г) и триметилортоформиат (147 мл) в MeOH (670 мл). Перемешивали указанную суспензию в течение ночи при комнатной температуре. Отфильтровывали через диатомит и ополаскивали MeOH (3300 мл). Перемешивали фильтрат при 0C в течение 2 ч и затем концентрировали до объема, равного приблизительно 250 мл. Собирали твердый остаток путем фильтрации, ополаскивали холодным MeOH и сушили в течение ночи при комнатной температуре с получением 88,2 г (84%) указанного в заголовке соединения. ES/MS m/z (35Cl) 342,0 [M+1]+. Пример синтеза 8. 2-(4-Хлорфенил)-4-(2,2-диметоксиэтил)тиазол-5-карбоновая кислота. Смешивали метиловый эфир 2-(4-хлорфенил)-4-(2,2-диметоксиэтил)тиазол-5-карбоновой кислоты(3,6 г, 10,5 ммоль) с EtOH (40 мл) и затем добавляли 2 М NaOH (6,8 мл). Механически перемешивали полученную суспензию в течение ночи и затем концентрировали под вакуумом. Растворяли твердый остаток в воде (40 мл), охлаждали до 0C и доводили pH до 5-6 с помощью 1 N HCl (13 мл). Перемешивали суспензию в течение 15 мин, собирали полученный преципитат и промывали твердый остаток водой(420 мл). Сушили твердый остаток в вакуумной печи в течение ночи с получением 3,3 г (96%) указанного в заголовке соединения. ES/MS m/z (35Cl) 326,0 [M-1]. Пример синтеза 9. трет-Бутиловый эфир 3-(2-метокси-4-нитрофенокси)азетидин-1-карбоновой кислоты. Растворяли 1-фтор-2-метокси-4-нитробензол (118 г, 689 ммоль) и трет-бутиловый эфир 3 гидроксиазетидин-1-карбоновой кислоты (125 г, 724 ммоль) в ТГФ (800 мл) и охлаждали до 0C в атмосфере азота. К раствору добавляли по каплям 1 М раствор трет-BuOK в ТГФ (1 л). После окончания добавления перемешивали полученный темно-коричневый раствор в течение 30 мин при 0C и затем разбавляли водой (1 л) в течение 10-минутного периода. Перемешивали смесь в течение 5 мин, затем экстрагировали с помощью трет-бутилметилового эфира (2). Объединяли полученные органические растворы и промывали солевым раствором (2700 мл), затем сушили и концентрировали. Сушили твердый остаток под вакуумом при 45C в течение 20 ч с получением 216 г (95%) указанного в заголовке соединения в виде желтого твердого остатка. 1H ЯМР (300 МГц, CDCl3) : 6,47 (дублет, 1H, J=8,5), 6,30 (дублет, 1H,J=2,6), 6,17 (двойной дублет, 1H, J=2,4, 8,5), 4,76 (мультиплет, 1H), 4,18 (мультиплет, 2H), 4,04 (мультиплет, 2H), 3,80 (синглет, 3H), 1,42 (синглет, 9H). Нитросоединения из таблицы ниже (примеры синтеза с 10 по 13) можно получить, по существу,следуя процедурам, которые описаны для примера синтеза 9.(210 г, 639 ммоль) в ТГФ (630 мл) и переносили вместе с MeOH (1680 мл) в чан из нержавеющей стали,содержащий 10% палладий-на-углероде, предварительно смоченный толуолом. Гидрировали указанную смесь на шейкере Парра в течение 2,5 ч. Удаляли катализатор путем фильтрации через диатомит и ополаскивали твердый остаток MeOH. Концентрировали полученный фильтрат под вакуумом и затем выпаривали осадок совместно с гептаном три раза (500 мл каждый раз) с получением 190 г (99%) указанного в заголовке соединения в виде твердого остатка светло-коричневого цвета, который незамедлительно использовали в следующей реакции. 1 Н ЯМР (300 МГц, CDCl3) : 6,48 (дублет, 1H, J=8,5), 6,30 (дублет, 1H, J=2,6), 6,17 (двойной дублет,1H, J=2,4, 8,5), 4,77 (мультиплет, 1H), 4,19 (мультиплет, 2H), 4,04 (мультиплет, 2H), 3,81 (синглет, 3H),3,59 (уширенный синглет, 2H), 1,42 (синглет, 9H).- 14015559 Анилиновые соединения из таблицы ниже (примеры синтеза 15 и 16) можно получить, по существу,следуя процедурам, которые описаны для примера синтеза 14. Пример синтеза 17. трет-Бутиловый эфир 3-(4-амино-2-цианофенокси)азетидин-1-карбоновой кислоты. Растворяли трет-бутиловый эфир 3-(2-циано-4-нитрофенокси)азетидин-1-карбоновой кислоты (1 г,3,13 ммоль) в сухом EtOH (12,53 мл). Добавляли насыщенный раствор NH4Cl (3,77 мл, 17,28 ммоль) и индий (2,2 г, 19,15 ммоль). Нагревали до кипения с обратным холодильником в течение 1 ч. Гасили смесь водой (50 мл) и отфильтровывали через диатомит. Нейтрализовали смесь буфером с pH=7 и экстрагировали с помощью CH2Cl2 (220 мл). Объединяли органические слои и промывали водой (30 мл). Сушили,отфильтровывали и концентрировали органический раствор. Очищали неочищенный материал с помощью флэш-хроматографии, применяя 0-50% EtOAc/гексаны в качестве элюента, чтобы обеспечить 660 мг (72%) желаемого продукта. 1H ЯМР (300 МГц, CDCl3) : 6,85 (дублет, 1H, J=3), 6,78 (двойной дублет,1H, J=6,l, 8,7), 6,44 (дублет, 1H, J=9), 4,82 (мультиплет, 1H), 4,24 (двойной дублет, 2H, J=3,0, 9,6), 4,02(двойной дублет, 2H, J=5,8, 9,8), 3,53 (уширенный синглет, 2H), 1,42 (синглет, 9H). Анилиновые соединения из таблицы ниже можно получить, по существу, следуя процедурам, которые описаны для примера синтеза 17. Пример синтеза 19. трет-Бутиловый эфир 3-(4-[2-(4-хлорфенил)-4-(2,2-диметоксиэтил)тиазол-5 карбонил]амино-2-метоксифенокси)азетидин-1-карбоновой кислоты. Растворяли 2-(4-хлорфенил)-4-(2,2-диметоксиэтил)тиазол-5-карбоновую кислоту (147 г, 448 ммоль),трет-бутиловый эфир 3-(4-амино-2-метоксифенокси)азетидин-1-карбоновой кислоты (120 г, 402 ммоль) и 1-гидроксибензотриазол гидрат (75 г, 490 ммоль) в ТГФ (1,2 л) и охлаждали до приблизительно 10C в атмосфере азота. Обрабатывали указанный раствор диизопропилэтиламином (117 мл, 67 3 ммоль) по каплям в течение 2 мин, сохраняя при этом температуру между 10-15C. Добавляли гидрохлорид 1-(3 диметиламинопропил)-3-этилкарбодиимида (93 г, 489 ммоль) к указанному раствору и перемешивали при комнатной температуре в течение 19 ч. Охлаждали раствор до 0C и разбавляли водой (1,2 л). Собирали преципитат путем фильтрации и растирали с водой (5700 мл). Сушили твердый остаток светлокоричневого цвета в течение 3 дней при 50C под вакуумом с получением 219 г (90%) указанного в заголовке соединения. 1H ЯМР (300 МГц, CDCl3) : 10,03 (синглет, 1H), 7,90 (мультиплет, 2H), 7,66 (дублет,1H, J=2,4), 7,42 (мультиплет, 2H), 6,88 (двойной дублет, 1H, J=2,4, 8,6), 6,57 (дублет, 1H, J=8,6), 4,86(9,1 г, 30,9 ммоль) в толуоле (100 мл) при комнатной температуре и обрабатывали триметилалюминием(22,0 мл, 2,0 М в толуоле). Перемешивали темно-красный раствор при комнатной температуре в течение 1 ч и добавляли твердый 2-(4-хлорфенил)-6,7-дигидропирано[4,3-d]тиазол-4-он (7,97 г, 30,0 ммоль). Нагревали полученный раствор до 50C и перемешивали в течение 2 ч. Охлаждали до комнатной температуры и медленно гасили насыщенным раствором соли Рошеля (5 мл). После прекращения интенсивного газовыделения добавляли дополнительный раствор соли Рошеля (30 мл) и энергично перемешивали в течение 2 ч. Отделяли органическую фазу, а водную фазу экстрагировали CH2Cl2 (250 мл). Объединяли органические части и промывали насыщенным раствором соли Рошеля (225 мл) и солевым раствором(25 мл). Сушили, фильтровали и концентрировали полученный органический раствор. Очищали неочищенный материал путем флэщ-хроматографии, применяя 5% MeOH (2 М NH3)/CH2Cl2 в качестве элюента с получением оранжевого твердого остатка. Дополнительно очищали материал путем растирания со смесью 1:1 CH2Cl2:диэтиловым эфиром, после чего следовала фильтрация с получением 12,77 г (76%) указанного в заголовке соединения в виде белого твердого остатка. ES/MS m/z (35Cl) 558,2 [М-1]-. Спирт-амидные соединения из таблицы ниже (примеры синтеза с 21 по 25) можно получить, по существу, следуя процедурам, которые описаны для примера синтеза 20. Растворяли трет-бутиловый эфир 3-(4-[2-(4-хлорфенил)-4-(2-гидроксиэтил)тиазол-5-карбонил] амино-2-метоксифенокси)азетидин-1-карбоновой кислоты (9,1 г, 30,9 ммоль) в ТГФ (100 мл) при комнатной температуре и обрабатывали три-н-бутилфосфином (6,2 мл, 24,8 ммоль) и диизопропилазодикарбоксилатом (5,0 г, 24,7 ммоль). Перемешивали полученный раствор при 50C в течение 5 ч, затем охлаждали до комнатной температуры и концентрировали под вакуумом до 1/4 объема. Разбавляли желтую смесь диэтиловым эфиром (100 мл) и собирали светло-желтый порошок путем фильтрации, дополнительной промывки диэтиловым эфиром (50 мл). Сушили твердый остаток под вакуумом с получением 9,7 г (79%) указанного в заголовке соединения в виде светло-желтого твердого остатка. ES/MS m/z (35Cl)- 16015559 542,2 [M+1]+, 564,2 [M+Na]+. Лактамные соединения из таблицы ниже (примеры синтеза с 27 по 31) можно получить, по существу, следуя процедурам, которые описаны для примера синтеза 26. Растворяли трет-бутиловый эфир 3-(4-[2-(4-хлорфенил)-4-(2,2-диметоксиэтил)тиазол-5-карбонил] амино-2-метоксифенокси)азетидин-1-карбоновой кислоты (18,9 г, 31,28 ммоль) и моногидрат п-толуолсульфоновой кислоты (19,7 г, 103,56 ммоль) в безводном толуоле (460 мл) и перемешивали механически при 95C в течение ночи. Охлаждали реакционную смесь и добавляли 1 N NaOH. Перемешивали смесь энергично при комнатной температуре в течение 1 ч. Экстрагировали водный слой с помощьюCH2Cl2 (2700 мл). Объединяли органические части, промывали солевым раствором (700 мл), сушили над MgSO4 и отфильтровывали. Концентрировали фильтрат под вакуумом с получением 13,0 г (85%) указанного в заголовке соединения. ES/MS m/z (35Cl) 440,0 [M+1]+. Пример 1 а. 5-[4-(Азетидин-3-илокси)-3-метоксифенил]-2-(4-хлорфенил)-5H-тиазоло[5,4-c]пиридин 4-он, гидрохлоридная соль. Смешивали трет-бутиловый эфир 3-(4-[2-(4-хлорфенил)-4-(2,2-диметоксиэтил)тиазол-5-карбонил] амино-2-метоксифенокси)азетидин-1-карбоновой кислоты (208 г, 344 ммоль) в EtOH (2,2 л) и обрабатывали концентрированной HCl (208 мл). Нагревали смесь до кипения с обратным холодильником в течение 1 ч и затем охлаждали до 0C. Собирали твердый остаток путем фильтрации и ополаскивали ледяным Et2O (4500 мл). Сушили твердый остаток под вакуумом при 55C в течение 2 дней с получением 159 г (97%) указанного в заголовке соединения в виде грязно-белого твердого остатка. 1H ЯМР (300 МГц, ДМСО-d6) : 9,37 (синглет, 2H), 8,15 (мультиплет, 2H), 7,75 (дублет, 1H, J=7,6), 7,66 (мультиплет,2H), 7,22 (дублет, 1H, J=7,5), 7,05 (дублет, 1H, J=7,3), 7,01 (двойной дублет, 1H, J=2,5, 8,7), 6,92 (дублет,1H, J=8,6), 5,09 (мультиплет, 1H), 4,45 (мультиплет, 2H), 4,04 (мультиплет, 2H), 3,82 (синглет, 3H). Пример синтеза 32. трет-Бутиловый эфир 3-4-[2-(4-хлорфенил)-4-оксо-4H-тиазоло[5,4-c]пиридин 5-ил]-2-фторфеноксиазетидин-1-карбоновой кислоты. Растворяли трет-бутиловый эфир 3-(4-[2-(4-хлорфенил)-4-(2-гидроксиэтил)тиазол-5-карбонил] амино-2-фторфенокси)азетидин-1-карбоновой кислоты (2 60 мг, 0,474 ммоль) в безводном ДМСО (3,16 мл), а затем добавляли триэтиламин (0,125 мл, 0,901 ммоль). Охлаждали смесь до 15C и добавляли порциями комплекс серный ангидрид-пиридин (133 мг, 0,820 ммоль). Перемешивали в течение приблизительно 2 ч (примечание: может понадобиться добавление PyrSO3 до тех пор, пока исходное вещество не израсходуется). Гасили смесь водой (10 мл) и экстрагировали с помощью CH2Cl2 (225 мл). Сушили,- 17015559 фильтровали и концентрировали до сухого состояния. Перерастворяли неочищенный материал в CH2Cl2 (1/9 мл) и добавляли ТФА (0,558 мл, 7,38 ммоль),и перемешивали до завершения реакции с помощью ХТС (1:1 EtOAc/гексаны). Гасили смесь водой (10 мл) и раствором 5 N NaOH до pH 8-10. Экстрагировали водный слой с помощью CH2Cl2 (225 мл). Сушили, отфильтровывали и концентрировали до белого твердого остатка. Растирали с Et2O с получением 46 мг (22%) твердого остатка светло-коричневого цвета. ES/MS m/z (35Cl) 428,0 [M+1]+. Пример 2. 2-(4-Хлорфенил)-5-[4-(1-циклобутилазетидин-3-илокси)-3-метоксифенил]-5H-тиазоло Способ 1. Растворяли трет-бутиловый эфир 3-(4-[2-(4-хлорфенил)-4-(2,2-диметоксиэтил)тиазол-5 карбонил]амино-2-метоксифенокси)азетидин-1-карбоновой кислоты (18,9 г, 31,28 ммоль) и моногидрат п-толуолсульфоновой кислоты (19,7 г, 103,56 ммоль) в безводном толуоле (460 мл) и перемешивали механически при 95C в течение ночи. Охлаждали реакционную смесь и добавляли 1 N NaOH. Перемешивали смесь энергично при комнатной температуре в течение 1 ч. Экстрагировали водный слой с помощью CH2Cl2 (2700 мл). Объединяли органические части, промывали солевым раствором (700 мл), сушили над MgSO4 и отфильтровывали. Концентрировали фильтрат под вакуумом с получением 13,0 гES/MS m/z 440,0 (35Cl) [M+1]+. Растворяли 5-[4-(азетидин-3-илокси)-3-метоксифенил]-2-(4-хлорфенил)-5H-тиазоло[5,4-c]пиридин 4-он (300 мг, 0,680 ммоль) и циклобутанон (76 мкл, 1,02 ммоль) в безводном 1,2-дихлорэтане (6,66 мл). Хорошо перемешивали и добавляли триацетоксиборгидрид натрия (500 мг, 2,26 ммоль). Перемешивали в течение ночи при комнатной температуре. Добавляли 1 N раствор NaOH и экстрагировали с помощьюCH2Cl2 (210 мл). Объединяли органические части и промывали водой (25 мл). Сушили с помощьюNa2SO4, отфильтровывали и концентрировали под вакуумом. Очищали неочищенный материал с помощью хроматографии на силикагеле, применяя градиент 0-10% 2 N NH3/MeOH в CH2Cl2. Собирали нужные фракции и удаляли растворитель с помощью пониженного давления. Перерастворяли материал вCHCl3 и добавляли 1 N раствор HCl (приблизительно 300 мкл). Удаляли растворитель с помощью пониженного давления и сушили под вакуумом при комнатной температуре в течение ночи с получением 161 мг (44%) указанного в заголовке соединения. ES/MS m/z 494,0 (35Cl) [M+1]+. Способ 2. Растворяли трет-бутиловый эфир 3-4-[2-(4-хлорфенил)-4-оксо-4H-тиазоло[5,4c]пиридин-5-ил]-2-метоксифеноксиазетидин-1-карбоновой кислоты (15,6 г, 28,9 ммоль) в CHCl3 (156 мл) и MeOH (156 мл). Добавляли концентрированную водную HCl (6 мл, 79,2 ммоль). Грели полученный раствор при 55-60C в течение ночи. Охлаждали реакционную смесь до комнатной температуры. Добавляли циклобутанон (12 г, 171,2 ммоль) при 5-10C. Затем добавляли порциями триацетоксиборгидрид натрия (43,6 г, 205,7 ммоль). Перемешивали смесь при комнатной температуре в течение ночи. Медленно гасили реакцию раствором Na2CO3 (210 мл) в воде (300 мл), чтобы довести pH смеси до 8. Добавляли воду (90 мл) и CHCl3 (120 мл) и отфильтровывали. Собирали фильтрат и промывали органический слой водой (150 мл). Концентрировали под вакуумом с получением белого твердого осадка 11,2 г (78%) указанного в заголовке соединения. Пример 3. 2-(4-Хлорфенил)-5-[4-(1-циклопропилазетидин-3-илокси)-3-метоксифенил]-5H-тиазоло[5,4-c]пиридин-4-он, гидрохлоридная соль. Смешивали молекулярные сита (100 мг, тип 3A), 5-[4-(азетидин-3-илокси)-3-метоксифенил]-2-(4 хлорфенил)-5H-тиазоло[5,4-c]пиридин-4-он (1,00 г, 2,27 ммоль), [(1-этоксициклопропил)окси]триметилсилан (688,3 мкл, 3,41 ммоль) и уксусную кислоту (651,3 мкл, 11,37 ммоль) в безводном метаноле (11 мл) и нагревали смесь до кипения с обратным холодильником в течение 3 ч. Охлаждали реакционную смесь до комнатной температуры, затем добавляли цианоборгидрид натрия (37 6 мг, 5,68 ммоль) и медленно нагревали до 40C в течение 1 ч. Охлаждали смесь и добавляли 1 N раствор NaOH, затем экстрагировали водный слой с помощьюCHCl3 (325 мл). Сушили органический слой с помощью Na2SO4, отфильтровывали и концентрировали. Очищали неочищенный материал с помощью хроматографии на силикагеле, применяя градиент 0-10% 2 N NH3/MeOH в CHCl3. Собирали желаемые фракции и удаляли растворитель с помощью пониженного давления. Перерастворяли полученный материал в CHCl3 и добавляли 1 N раствор HCl/Et2O (2,27 мл). Удаляли растворитель и сушили под вакуумом с получением 408 мг (35%) указанного в заголовке соединения. ES/MS m/z (35Cl) 480,0 [M+1]+. Пример 4. 5-[4-(1-Ацетилазетидин-3-илокси)-3-метоксифенил]-2-(4-хлорфенил)-5H-тиазоло[5,4c]пиридин-4-он. Растворяли 5-[4-(азетидин-3-илокси)-3-метоксифенил]-2-(4-хлорфенил)-5H-тиазоло[5,4-c]пиридин- 18015559 4-он (75 мг, 0,171 ммоль) и триэтиламин (52,5 мкл, 0,376 ммоль) в безводном CH2Cl2 (700 мкл). Охлаждали до 0C и добавляли ацетилхлорид (13,4 мкл, 0,188 ммоль). Позволяли нагреваться до комнатной температуры в течение ночи. Добавляли 1 N раствор HCl и экстрагировали с помощью CH2Cl2 (35 мл). Объединяли органические части и промывали водой (25 мл). Сушили органический слой с помощьюNa2SO4, отфильтровывали и концентрировали под вакуумом. Очищали полученный осадок с помощью ВЭЖХ на 5 мкм колонке 3075 мм XBridge C18; элюент: 34% вода (с 10 мМ NH4HCO3, добавленным до Охлаждали смесь 5-[4-(азетидин-3-илокси)-3-метоксифенил]-2-(4-хлорфенил)-5H-тиазоло[5,4-c]пиридин-4-она, гидрохлоридная соль (20 г, 42,0 ммоль), в метаноле (600 мл) до 15C. Добавляли уксусную кислоту (12,1 мл, 211,6 ммоль) и цианоборгидрид натрия (7 г, 111 ммоль). Добавляли формальдегид (10,2 мл, 136,45 ммоль, в виде раствора в воде) к вязкой смеси и перемешивали в течение 15 ч при комнатной температуре. Охлаждали смесь до 5C, добавляли насыщенный водный NaHCO3 (320 мл) и перемешивали смесь в течение 1 ч при комнатной температуре. Экстрагировали смесь с помощью CHCl3 (31 л). Объединяли органические растворы и промывали солевым раствором, затем сушили, отфильтровывали и концентрировали. Растворяли осадок в CHCl3 (240 мл) и разбавляли трет-бутилметиловым эфиром (700 мл). Собирали преципитат путем фильтрации и ополаскивали твердые остатки дополнительным третбутилметиловым эфиром. Сушили твердый остаток под вакуумом в течение 5 ч при комнатной температуре с получением 5,4 г (81%) указанного в заголовке соединения. ES/MS m/z (35Cl) 454 [M+1]+. Припер 5a. 2-(4-Хлорфенил)-5-[3-метокси-4-(1-метилазетидин-3-илокси)фенил]-5H-тиазоло[5,4c]пиридин-4-он, гидрохлоридная соль. Растворяли 2-(4-хлорфенил)-5-[3-метокси-4-(1-метилазетидин-3-илокси)фенил]-5H-тиазоло[5,4c]пиридин-4-он (10 6 г, 234 ммоль) в CHCl3 (2,1 л) и охлаждали полученный раствор до 15C. К раствору добавляли по каплям HCl (140 мл, 2 М в диэтиловом эфире) в течение 10 мин. Перемешивали смесь в течение 1 ч и разбавляли трет-бутилметиловым эфиром (2 л). Собирали преципитат путем фильтрации и промывали твердый остаток трет-бутилметиловым эфиром (3660 мл). Сушили твердый остаток при комнатной температуре в течение 4 дней под вакуумом с получением 115 г (100%). ES/MS m/z (35Cl) 454[M+1]+. Пример 5b. 2-(4-Хлорфенил)-5-[3-метокси-4-(1-метилазетидин-3-илокси)фенил]-5H-тиазоло[5,4c]пиридин-4-он, соль фумаровой кислоты. Растворяли 2-(4-хлорфенил)-5-[3-метокси-4-(1-метилазетидин-3-илокси)фенил]-5H-тиазоло[5,4c]пиридин-4-он (638 мг, 1,41 ммоль) в 1,4-диоксане при 100C. К раствору добавляли раствор фумаровой кислоты (5,64 мл, 1,41 ммоль, 0,25 М в воде). Перемешивали полученный раствор при 100C в течение 5 мин, затем при 50C в течение 1 ч. Концентрировали раствор с помощью потока газообразного азота до 3/4 объема. Нагревали смесь до 100C до тех пор пока твердые остатки не растворятся, затем медленно охлаждали до -10C. Собирали белый преципитат путем фильтрации и промывали твердые остатки холодным диоксаном (10 мл). Сушили твердый остаток при комнатной температуре в течение выходных с получением 500 мг (62%) указанного в заголовке соединения в виде тонкодисперсного белого порошка.ES/MS m/z (35Cl) 454 [M+1]+. Альтернативный способ получения соединения из примера 5b. Этап 1. Диэтиловый эфир 2-хлор-3-оксоглутаровой кислоты. Растворяли диэтиловый эфир 3-оксоглутаровой кислоты (1122 г, 5,327 моль) в CH2Cl2 (3 л) и охлаждали до -9C. К раствору медленно добавляли раствор сульфурилхлорида (374 г, 2,69 моль) в CH2Cl2 (3 л) в течение 3 ч. По окончании добавляли вторую порцию сульфурилхлорида (374 г, 2,69 моль) в CH2Cl2(3 л) в течение 4 ч. Перемешивали полученный охлажденный раствор в течение одного часа, затем нагревали до комнатной температуры и перемешивали в течение ночи. Охлаждали раствор на ледяной бане и медленно добавляли воду (8 л). Перемешивали в течение 15 мин, затем разделяли слои. Экстрагировали водный слой с помощью дополнительного CH2Cl2. Объединяли органические фазы и промывали насыщенным NaHCO3 (3 л). Сушили и концентрировали органический раствор с получением 1370 г (105%) указанного в заголовке соединения в виде бесцветного масла. Использовали полученный материал, как есть, в следующей реакции, без дополнительной очистки. ES/MS m/z (35Cl) 235 [M-1]-. Этап 2. Этиловый эфир 2-(4-хлорфенил)-4-этоксикарбонилметилтиазол-5-карбоновой кислоты. Растворяли диэтиловый эфир 2-хлор-3-оксоглутаровой кислоты (1370 г, 5,50 моль) в EtOH (8,5 л) и добавляли 4-хлортиобензамид (885 г, 5,00 моль). Нагревали полученную смесь до 75C и механически перемешивали в течение 5,5 ч. Охлаждали смесь до 45C, затем медленно добавляли воду (3,5 л) и пере- 19015559 мешивали в течение ночи. Собирали желтый преципитат и промывали твердые остатки 50% EtOH/воды(синглет, 2H), 4,19 (квартет, 2H, J=7,4), 1,36 (триплет, 3H, J=6,8), 1,27 (триплет, 3H, J=6,8). Этап 3. 4-Карбоксиметил-2-(4-хлорфенил)тиазол-5-карбоновая кислота. Растворяли этиловый эфир 2-(4-хлорфенил)-4-этоксикарбонилметилтиазол-5-карбоновой кислоты(99 г, 280 ммоль) в EtOH (500 мл) и добавляли 2 М NaOH (700 мл, 1400 ммоль). Нагревали полученную смесь до 50C в течение 1,5 ч, затем охлаждали раствор на ледяной бане и обрабатывали 2,5 М HCl (1 л),и перемешивали в течение 2 ч. Собирали преципитат путем фильтрации, промывки 50% EtOH/воды (500 мл) и затем промывки водой (1 л). Сушили в вакуумной печи в течение ночи при 45C с получением 80,2 г (95%) указанного в заголовке соединения. 1H ЯМР (ДМСО-d6, 500 МГц):13,66 (уширенный синглет,1H), 12,55 (уширенный синглет, 1H), 8,01 (дублет, 2H, J=8,6), 7,60 (дублет, 2H, J=8,9), 4,11 (синглет, 2H). Этап 4. 2-(4-Хлорфенил)-4-метоксикарбонилметилтиазол-5-карбоновая кислота. Смешивали 4-карбоксиметил-2-(4-хлорфенил)тиазол-5-карбоновую кислоту (145 г, 482 ммоль) вMeOH (900 мл) и обрабатывали серной кислотой (1,20 мл, 21,68 ммоль). Перемешивали смесь при нагревании с обратным холодильником в течение ночи, затем начинали перегонку MeOH, в результате получали концентрированный раствор. Собирали приблизительно 300 мл MeOH, затем нагревали с обратным холодильником в течение еще 5 ч. Фильтровали реакционную смесь и охлаждали фильтрат на ледяной бане в течение 1 ч. Собирали желтый преципитат путем фильтрации и ополаскивали охлажденнымMeOH. Сушили твердый остаток в вакуумной печи при 45C в течение ночи с получением 105 г указанного в заголовке соединения. Концентрировали указанный фильтрат до приблизительно 200 мл объема и собирали 20 г дополнительного материала. 1H ЯМР (ДМСО-d6, 500 МГц) :13,72 (уширенный синглет,1H), 8,00 (дублет, 2H, J=8,4), 7,59 (дублет, 2H, J=8,8), 4,21 (синглет, 2H), 3,64 (синглет, 3H). Этап 5. трет-Бутиловый эфир 3-(4-[2-(4-хлорфенил)-4-мефоксикарбонилметилтиазол-5 карбонил]амино-2-метоксифенокси)азетидин-1-карбоновой кислоты. Смешивали циклический ангидрид 1-пропанфосфоновой кислоты (50% в EtOAc) (528,7 г, 831,3 ммоль) и ТГФ(1110 мл) и охлаждали до 5C. Добавляли 2-(4-хлорфенил)-4 метоксикарбонилметилтиазол-5-карбоновую кислоту (185,0 г, 593,43 ммоль), а затем трет-бутиловый эфир 3-(4-амино-2-метоксифенокси)азетидин-1-карбоновой кислоты (192,2 г, 914,4 ммоль). Добавляли Nметилморфолин (99 мл, 12 47 ммоль) по каплям в течение 15 мин и удаляли ледяную баню незамедлительно после добавления. Нагревали реакционную смесь до 65C в течение 16 ч и гасили водой (555 мл). Разбавляли EtOAc (1110 мл) и разделяли слои. Промывали насыщенным бикарбонатом натрия (555 мл) и солевым раствором (555 мл). Перегоняли органический растворитель до тех пор, пока не останется 5% ТГФ и затем присоединяли этилацетат, при необходимости, до общего количества растворителя, равного 740 мл, к концу перегонки. Добавляли гептан (230 мл) при 75C и вводили затравку оригинального продукта при 55C. Позволяли остыть до комнатной температуры, фильтровали и дважды ополаскивали гептаном-EtOAc (2100 мл, 1:1). Сушили в вакуумной печи при 40C с получением 313,5 г (90%) указанного в заголовке соединения в виде оранжево-коричневого твердого остатка. ES/MS m/z (35Cl) 586 [M-1]-. Этап 6. трет-Бутиловый эфир 3-(4-[2-(4-хлорфенил)-4-(2-гидроксиэтил)тиазол-5-карбонил]амино 2-метоксифенокси)азетидин-1-карбоновой кислоты. Добавляли в колбу в инертной атмосфере 2 М ТГФ раствор боргидрида лития (1140 мл, 2280 ммоль) и помещали охлаждаться на ледяной бане. Тем временем в отдельном сосуде растворяли третбутиловый эфир 3-(4-[2-(4-хлорфенил)-4-метоксикарбонилметилтиазол-5-карбонил]амино-2-метоксифенокси)азетидин-1-карбоновой кислоты (2058 г, 3500 ммоль) в ТГФ (12,35 л). Взбалтывали до достижения полного растворения. Переносили этот раствор в заливочную воронку и начинали добавление медленным потоком к восстанавливающему агенту. Как только добавление завершено, удаляли ледяную баню и перемешивали в течение 30-90 мин. Гасили реакцию путем добавления ацетона (407 г, 7008 ммоль). Перемешивали при температуре окружающей среды в течение 30 мин и добавляли этилацетат(8230 мл) с водой (8230 мл). Отделяли слои и промывали верхний органический слой второй раз водой(8230 мл), а затем 5% солевым раствором (8230 мл). Отгоняли растворитель до тех пор, пока ТГФ не будет составлять 5% состава растворителя, добавляя EtOAc при необходимости. Уменьшали объем суспензии до 6200 мл и добавляли гептан (2050 мл). Позволяли суспензии медленно охладиться до комнатной температуры, отфильтровывали преципитат, промывали 1:1 гептаном/этилацетатом и сушили до постоянного веса в вакуумной печи при 40C с получением указанного в заголовке соединения (88%).ES/MS m/z (35Cl) 560 [M+1]+. Этап 7. трет-Бутиловый эфир 3-4-[2-(4-хлорфенил)-4-оксо-4H-тиазоло[5,4-c]пиридин-5-ил]-2 метоксифеноксиазетидин-1-карбоновой кислоты. Добавляли в реакционный сосуд трет-бутиловый эфир 3-(4-[2-(4-хлорфенил)-4-(2 гидроксиэтил)тиазол-5-карбонил]амино-2-метоксифенокси)азетидин-1-карбоновой кислоты (2520 г,4499 ммоль), ДМСО (5040 мл) и триэтиламин (1932 г, 18901 ммоль). Охлаждали полученную коричневую суспензию до 15C. В отдельном сосуде растворяли комплекс серный ангидрид-пиридин (2923 г,- 20015559 17997 ммоль) в ДМСО (12,6 л). Добавляли медленно раствор SO3-пиридина в реакционную смесь таким образом, чтобы сохранить любую экзотерму ниже 22C. Когда добавление завершено, нагревали реакционную смесь до 65C в течение 16 ч. После завершения реакции, поддерживали температуру на 65C и добавляли воду (17,64 л) медленным-средним по скорости потоком. Перемешивали полученную суспензию при 65C в течение 90 мин и отфильтровывали неочищенный продукт без охлаждения. Дважды ополаскивали неочищенный осадок водой, затем проводили промывку влажного осадка вытеснением с помощью ледяного метанола. Сушили влажный осадок для отделения MeOH в течение 30 мин и затем возвращали его в реакционный сосуд и суспендировали в метаноле (20,16 л). Нагревали до 65C в течение 10 мин, медленно охлаждали до комнатной температуры, фильтровали, промывали метанолом и сушили до постоянного веса в вакуумной печи при 40C с получением 2192 г (90%) указанного в заголовке соединения. ES/MS m/z (35Cl) 484 [M-tert +1]+. Этап 8. 5-[4-(Азетидин-3-илокси)-3-метоксифенил]-2-(4-хлорфенил)-5H-тиазоло[5,4-c]пиридин-4 он, гидрохлоридная соль. В реакционный сосуд добавляли трет-бутиловый эфир 3-4-[2-(4-хлорфенил)-4-оксо-4Hтиазоло[5,4-c]пиридин-5-ил]-2-метоксифеноксиазетидин-1-карбоновой кислоты (5,00 г, 9,26 ммоль) и нпропаналь (100 мл) и перемешивали как разбавленную суспензию. Добавляли 37% HCl (2,0 мл, 23,2 ммоль) при комнатной температуре в одну часть и нагревали до 65C в течение 16 ч. Прекращали нагрев и охлаждали до комнатной температуры, фильтровали и ополаскивали n-PrOH (10 мл) с получением не совсем белого твердого остатка. Сушили отфильтрованный осадок в вакуумной печи при 45C до постоянного веса с получением 4,216 г (96%) указанного в заголовке соединения. ES/MS m/z (35Cl) 440 [M+1]+. Этап 9. 2-(4-Хлорфенил)-5-[3-метокси-4-(1-метилазетидин-3-илокси)фенил]-5H-тиазоло[5,4-с]пиридин-4-он. Объединяли метанол (480 мл), трет-бутиловый эфир 3-4-[2-(4-хлорфенил)-4-оксо-4H-тиазоло[5,4c]пиридин-5-ил]-2-метоксифеноксиазетидин-1-карбоновой кислоты (60,00 г, 111,1 ммоль) и хлороформ(480 мл). К этому раствору добавляли медленно 35% водный HCl (28,4 г, 277 ммоль). Нагревали реакционную смесь до 50C в течение 15 ч. Охлаждали реакционную смесь до 10C. Густая суспензия появляется при температуре около 35C. Как только температура достигала 10C, добавляли формальдегид(27,33 г, 333 ммоль), и густая суспензия становилась менее вязкой во время перемешивания в течение 2,5 ч. Добавляли натрий триацетоксиборгидрид (76,53 г, 361 ммоль) тремя равными порциями и нагревали реакционную смесь до комнатной температуры. Добавляли раствор карбоната натрия в реакцию, пока pH не станет равен 8,1, и позволяли слоям разделиться. Промывали органический слой водой (300 мл). Отгоняли растворитель, пока объем раствора не станет равен 240 мл, и добавляли этилацетат (240 мл) с получением тонкой суспензии. Охлаждали реакционную смесь до комнатной температуры и фильтровали. Ополаскивали этилацетатом (180 мл) и сушили до постоянного веса под вакуумом при 50C, с получением 45,57 г (91%) указанного в заголовке соединения. ES/MS m/z (35Cl) 454 [M+1]+. Этап 10. 2-(4-Хлорфенил)-5-[3-метокси-4-(1-метилазетидин-3-илокси)фенил]-5H-тиазоло[5,4c]пиридин-4-он, соль фумаровой кислоты. Растворяли фумаровую кислоту (59,41 г, 0,5118 моль) в смеси метанол/вода (1900 мл, 1/1) путем нагревания до 60C. В отдельном сосуде растворяли 2-(4-хлорфенил)-5-[3-метокси-4-(1-метилазетидин-3 илокси)фенил]-5H-тиазоло[5,4-c]пиридин-4-он (200,0 г, 0,4406 моль) в метаноле (2000 мл) и нагревали до 65C. Как можно быстрее добавляли горячий раствор фумаровой кислоты. Позволяли температуре вернуться к значению 65C и оставляли на 15 мин. Охлаждали до 25C при 0,25C/мин и оставляли на 1 ч. Фильтровали и промывали реактор дважды метанолом (100 мл) и дважды ополаскивали отфильтрованный осадок метанолом (по 250 мл). Сушили под вакуумом при 40C до постоянного веса с получением 223 г (89%) указанного в заголовке соединения. Пример синтеза 33. 3,4-Дифтортиобензамид. Растворяли 3,4-дифторбензамид (4,95 г, 31,5 ммоль) в диэтиловом эфире (70 мл) и охлаждали смесь до 0C. Добавляли пятисернистый фосфор (7,0 г, 31,5 ммоль) и нагревали смесь до комнатной температуры в течение ночи. Фильтровали смесь и концентрировали фильтрат с получением 5,5 г (100%) желтого твердого остатка. 1H ЯМР (300 МГц, ДМСО-d6) : 9,99 (уширенный синглет, 1H), 9,54 (уширенный синглет, 1H), 7,89 (мультиплет, 1H), 7,75 (мультиплет, 1H), 7,46 (мультиплет, 1H). Тиазолопиридоновые соединения из таблицы ниже можно получить, применяя 4-трифторметилтиобензамид и 3,4-дифтортиобензамид, следуя, по существу, тем же процедурам, которые указаны в альтернативном пути из примера 5b, этапы с 1 по 7. Пример синтеза 36. 5-[4-(Азетидин-3-илокси)-3-метоксифенил]-2-(4-трифторметилфенил)-5Hтиазоло[5,4-c]пиридин-4-он. Растворяли трет-бутиловый эфир 3-2-метокси-4-[4-оксо-2-(4-трифторметилфенил)-4H-тиазоло[5,4c]пиридин-5-ил]феноксиазетидин-1-карбоновой кислоты (1,3 г, 2,27 ммоль) в дихлорметане (12 мл) и медленно добавляли трифторуксусную кислоту (6 мл). Перемешивали смесь в течение 1 ч и затем выпаривали. Нанесли осадок на 10 г SCX колонку с дихлорметаном. Промывали колонку метанолом, затем элюировали материал, применяя 1:1 дихлорметан:2N аммиак/метанол. Концентрировали с получением 0,909 г (85%) желаемого продукта в виде белого твердого остатка. MS/ES m/z 474,0 [M+1]+. Соединение свободного амина из таблицы ниже получено, следуя, по существу, процедуре, описанной для примера синтеза 36. Пример 6. 5-[4-(3-Циклобутилазетидин-3-илокси)-3-метоксифенил]-2-(4-трифторметилфенил) -5Hтиазоло[5,4-c]пиридин-4-он. Растворяли 5-[4-(азетидин-3-илокси)-3-метоксифенил]-2-(4-трифторметилфенил)-5H-тиазоло[5,4c]пиридин-4-он (0,909 г, 1,92 ммоль) в дихлорэтане (25 мл) и добавляли циклобутанон (0,502 мл, 6,72 ммоль), триацетоксиборгидрид натрия (0,814 г, 3,84 ммоль) и уксусную кислоту (0,22 мл, 3,84 ммоль). Перемешивали полученную смесь в течение ночи, добавляли насыщенный бикарбонат натрия и экстрагировали с помощью дихлорметана (3). Сушили смесь, применяя сульфат натрия, фильтровали и концентрировали. Очищали с помощью хроматографии на силикагеле, применяя 0-4,5% градиент 2N аммиака в метаноле/дихлорметане с получением 0,400 г (39%) желаемого продукта. MS/ES m/z 528,0 [M+1]+. Соединения из таблицы ниже получены, следуя, по существу, процедуре из примера 7, применяя подходящий кетон. Пример 9. 2-(4-Хлорфенил)-5-3-метокси-4-[1-(тетрагидропиран-4-ил)азетидин-3-илокси]фенил 5H-тиазоло[5,4-c]пиридин-4-он, гидрохлоридная соль. Суспендировали 5-[4-(азетидин-3-илокси)-3-метоксифенил]-2-(4-хлорфенил)-5H-тиазоло[5,4-c]пиридин-4-он (50 мг, 0,11 ммоль) в MeOH (5,68 мл). Добавляли тетрагидро-4H-пиран-4-он (15,7 мкл, 0,17 ммоль) и уксусную кислоту (9,8 мкл, 0,17 ммоль) и перемешивали при комнатной температуре в течение- 22015559 10 мин. Добавляли цианоборгидрид натрия (7,1 мг, 0,11 ммоль) и перемешивали при комнатной температуре в течение 6 ч. Добавляли дихлорметан к реакционной смеси для растворения твердого материала. Нанесли 2 г SCX2 на ионообменную колонку, смочили MeOH и элюировали под действием силы тяжести. Элюировали картридж SCX с использованием MeOH (приблизительно 3 объема) при пониженном давлении и вылили. Элюировали картридж SCX 7N NH3 в MeOH:дихлорметане (1:1) (приблизительно 5 объемов) при пониженном давлении и затем концентрировали под вакуумом. Растворяли полученный твердый остаток в дихлорметане (5 мл) и добавляли 4 N HCl в растворе диоксана (25 мкл). Выпаривали растворитель и супендировали твердый остаток в воде. Сушили сублимацией с получением (51 мг, 83%) указанного в заголовке соединения в виде белого твердого остатка. ES/MS m/z (35Cl) 524 [M+1]+. Соединения из таблицы ниже (примеры с 10 по 17) получены, следуя, по существу, процедуре из примера 9, применяя подходящий альдегид или кетон. Растворяли 2-(4-хлорфенил)-5-[3-метокси-4-(1-метилазетидин-3-илокси)фенил]-5H-тиазоло[5,4c]пиридин-4-он (402 мг, 0,886 ммоль) в CH2Cl2 (9 мл) и охлаждали до 0C. Обрабатывали раствор мхлорпероксибензойной кислотой (190 мг, 1,10 ммолей). Перемешивали раствор при 0C в течение 30 мин и затем собирали преципитат путем фильтрации, промывали дополнительным CH2Cl2 (приблизительно 10 мл) и сушили под вакуумом. Очищали смесь N-оксидов (цис- и транс-) с помощью флэшхроматографии, в качестве элюента использовали 25% MeOH (2N NH3)/CH2Cl2, с получением чистого стереоизомера 1 (220 мг). Концентрировали фильтрат, описанный выше, и очищали с помощью флэшхроматографии, в качестве элюента использовали 25% MeOH (2N NH3)/CH2Cl2, с получением чистого стереоизомера 1 (110 мг) и чистого стереоизомера 2 (47 мг). Объединяли и растирали в порошок материал изомера 1 в эфире, затем сушили под вакуумом с получением 320 мг. Растирали в порошок изомер 2 в- 23015559 эфире, затем сушили под вакуумом с получением 16 мг. Изомер 1; ES/MS m/z (35Cl) 470 [M+1]+; пример 18a. Изомер 2; ES/MS m/z (35Cl) 470 [M+1]+; пример 18b. Пример 19. 2-(4-Хлорфенил)-5-4-[1-(2,2-дифторэтил)азетидин-3-илокси]-3-метоксифенил-5Hтиазоло[5,4-c]пиридин-4-он, гидрохлоридная соль. Растворяли N-метил-N-метоксидифторацетамид (1,0 мл, 6,97 ммоль) в безводном ТГФ (6,17 мл). Охлаждали раствор до 0C и добавляли гидрид диизобутилалюминия (1,39 мл, 1,39 ммоль). Перемешивали в течение 1 ч или до завершения с помощью ХТС (1:1 EtOAc/гексан, окрашивание KMnO4 применяли для обнаружения образования альдегида без применения УФ). Добавляли 5% раствор HCl/EtOH в реакционную смесь и экстрагировали с помощью 1:1 CH2Cl2/Et2O. Объединяли органические слои и промывали солевым раствором. Сушили и фильтровали с использованием Na2SO4. Концентрировали до минимальных количеств органического растворителя. (Заметка: не сушили альдегид, поскольку он является низкомолекулярным и возможно высоко летучим). Добавляли раствор альдегида к суспензии 5-[4-(азетидин-3-илокси)-3-метоксифенил]-2-(4-хлорфенил)-5H-тиазоло[5,4-с]пиридин-4-она (350 мг, 0,800 ммоль) в MeOH (2,65 мл). Добавляли уксусную кислоту (0,227 мл, 3,98 ммоль) и энергично перемешивали. Добавляли цианоборгидрид натрия (131,5 мг,2,0 ммоль). Перемешивали в течение ночи при комнатной температуре. Добавляли насыщенный NaHCO3 раствор (10 мл), перемешивали в течение 30 мин и затем экстрагировали с помощью CH2Cl2 (210 мл). Сушили, фильтровали и концентрировали органический раствор. Очищали неочищенный материал с помощью флэш-хроматографии, применяя 0-10% MeOH (2 М NH3)/CH2Cl2 в качестве элюента с получением белого твердого остатка. Перерастворяли в CHCl3 и добавляли HCl/Et2Q (0,320 мл). Отфильтровывали гидрохлоридную соль с получением 177 мг (41%) указанного в заголовке соединения. ES/MS m/z(35Cl) 504,0 [M+1]+. Пример 20. 2-(4-Хлорфенил)-5-3-метокси-4-[1-(3,3,3-трифторпропил)азетидин-3-илокси]фенил 5H-тиазоло[5,4-c]пиридин-4-он, гидрохлоридная соль. Добавляли 3,3,3-трифторпропаналь (120 мг, 1,06 ммоль) в суспензию 5-[4-(азетидин-3-илокси)-3 метоксифенил]-2-(4-хлорфенил)-5H-тиазоло[5,4-c]пиридин-4-она (390 мг, 0,89 ммоль) в MeOH (2,96 мл). Добавляли уксусную кислоту (0,254 мл, 4,43 ммоль) и энергично перемешивали. Добавляли цианоборгидрид натрия (146,6 мг, 2,22 ммоль). Перемешивали в течение ночи при комнатной температуре. Добавляли насыщенный NaHCO3 (10 мл) и перемешивали в течение 30 мин. Экстрагировали смесь с помощьюCH2Cl2 (210 мл). Объединяли органический слой и промывали водой (5 мл). Сушили, фильтровали и концентрировали органический раствор. Очищали неочищенный материал с помощью флэшхроматографии, применяя 0-40% ТГФ (1% NH3/MeOH) в гептане в качестве элюента, с получением белого твердого остатка. Перерастворяли в CHCl3 и добавляли HCl/Et2O (0,32 мл). Отфильтровывали полученную гидрохлоридную соль, чтобы обеспечить 37 мг (7%) указанного в заголовке соединения. ES/MSm/z 536,0 (35Cl) [M+1]+. Соединение из таблицы ниже получено, следуя, по существу, процедуре, которая описана в примере 20. Пример синтеза 38. 3-(2-Бромтиазол-4-ил)метиловый эфир акриловой кислоты. Растворяли 2-бромтиазол-4-карбальдегид (3,00 г, 15,62 ммоль) в тетрагидрофуране (52 мл) и добавляли метил(трифенилфосфоранилиден)ацетат (5,33 г, 15,62 ммоль). Перемешивали полученную смесь в течение ночи при комнатной температуре. Разбавляли смесь водой и экстрагировали дважды, применяя диэтиловый эфир. Сушили объединенные органические фазы над сульфатом натрия, фильтровали и концентрировали. Очищали с помощью хроматографии на силикагеле, применяя 0-30% градиентEtOAc/гексанов, с получением 3,13 г (81%) указанного в заголовке соединения в виде белого твердого остатка. Пример синтеза 39. 3-(2-Бромтиазол-4-ил)акриловая кислота. Растворяли 3-(2-бромтиазол-4-ил)метиловый эфир акриловой кислоты (5,9 г, 23,78 ммоль) в тетрагидрофуране (48 мл) и добавляли раствор гидроксида лития (636 мг, 26,16 ммоль) в воде (10 мл). Перемешивали смесь в течение ночи. Экстрагировали смесь этилацетатом и промывали дважды водой. Окисляли водный слой с помощью IN HCl в воде до тех пор, пока смесь не достигнет pH 3-4. Отфильтровывали полученный белый твердый остаток, затем промывали твердый остаток этилацетатом, затем диэтиловым эфиром и затем водой. Сушили белый твердый остаток, с получением 5,05 г (91%) желаемого материала. Супендировали 3-(2-бромтиазол-4-ил)акриловую кислоту (2,00 г, 8,54 ммоль) в дихлорметане (17 мл) и добавляли оксалилхлорид (1,48 мл, 17,09 ммоль) и 2 капли диметилформамида. Перемешивали смесь при комнатной температуре в течение 2 ч и выпаривали. Растворяли азид натрия (1,67 г, 25,63 ммоль) в воде (12 мл) и ацетоне (12 мл) и охлаждали до 0C. Растворяли хлорангидрид в 1,4-диоксане (12 мл) и добавляли к азиду натрия. Перемешивали смесь в течение 1 ч при 0C. Разбавляли смесь водой и экстрагировали три раза этилацетатом. Сушили объединенные органические слои сульфатом натрия,фильтровали и выпаривали с получением желтого твердого остатка. Нагревали Dowtherm A (20 мл) до 230C и добавляли желтый твердый остаток, описанный выше,в диоксан (12 мл). Когда добавление завершено, перемешивали смесь при 230C в течение 1 ч. Охлаждали смесь до комнатной температуры и перемешивали в течение ночи. Разбавляли смесь диэтиловым эфиром, отфильтровывали полученный коричневый твердый остаток и промывали диэтиловым эфиром три раза. Растворяли основную часть твердого остатка в тетрагидрофуране и отфильтровывали оставшийся коричневый материал. Концентрировали и очищали посредством хроматографии на силикагеле,применяя 0-10% градиент метанола/дихлорметана, с получением 0,425 г (22% выход) указанного в заголовке соединения в виде желтого сухого остатка. 1H ЯМР (300 МГц, ДМСО-d6)11,95 (уширенный синглет, 1H), 7,44 (дублет, 1H, J=7,l Гц), 6,82 (дублет, 1H, J=7,l Гц). Пример синтеза 41. 2-(4-Циклопропоксифенил)-5H-тиазоло[5,4-c]пиридин-4-он. Растворяли 2-бром-5H-тиазоло[5,4-c]пиридин-4-он (0,218 г, 0,934 ммоль) в диметоксиэтане (5 мл),после чего добавляли EtOH (1 мл) и воду (1 мл). Добавляли 4-циклопропоксифенилбороновую кислоту(получить, как описано у Olofsson, K. et al., WO 2005123673) (0,185 г, 1,04 ммоль), а затем 2 М Na2CO3 (1 мл, 2 ммоль). Позволяли безводному газу аргону пузыриться через реакционную смесь в течение 15-20 мин. Добавляли Pd(PPh3)4 (33 мг, 0,27 мкмоль) и затем нагревали до 85C в атмосфере аргона. Через 18 ч выпаривали смесь до суспензии. Разбавляли смесь водой и перемешивали в течение 1 ч. Фильтровали и промывали твердые остатки диэтиловым эфиром, затем водой и затем снова диэтиловым эфиром. Сушили твердые остатки при комнатной температуре в течение ночи с получением желаемого материала в виде коричневого твердого остатка (0,214 г, 80%). 1H ЯМР (300 МГц, ДМСО-d6)11,7 (уширенный синглет, 1H), 8,01 (дублет, 2H, J=8,8 Гц), 7,42 (дублет, 1H, J=6, 9 Гц), 7,18 (дублет, 2H, J=8,8 Гц), 6,81(дублет, 1H, J=6,9 Гц), 3,93 (мультиплет, 1H), 0,80 (мультиплет, 2H), 0,67 (мультиплет, 2H). Получить тиазол-пиридон из таблицы ниже, по существу, следуя процедурам, которые описаны для примера синтеза 41. Пример синтеза 43. 2-(4-Хлорфенил)-4-(2-гидроксиэтил)тиазол-5-карбоновой кислоты 2,4 диметоксибензиламид. Растворяли 2,4-диметоксибензиламин (22,4 г, 134,0 ммоль) в CH2Cl2 (300 мл) и охлаждали до 0C. К раствору медленно добавляли раствор триметилалюминия (110 мл, 220 ммоль; 2MB толуоле) в течение 35 мин, поддерживая температуру ниже 10C. Перемешивали полученный раствор при комнатной температуре в течение 45 мин и затем снова охлаждали до 0C. Добавляли 2-(4-хлорфенил)-6,7 дигидропирано[4,3-d]тиазол-4-он (52,2 г, 120,6 ммоль), затем позволяли полученной суспензии нагреваться до комнатной температуры и перемешивали в течение ночи. Охлаждали реакционную смесь и осторожно гасили насыщенным раствором соли Рошеля (300 мл) в течение 30 мин. Добавляли CH2Cl2(750 мл), воду (400 мл) и диатомит (100 г) и перемешивали смесь при комнатной температуре в течение 30 мин, затем фильтровали. Собирали твердые остатки и растирали в порошок с CH2Cl2 (1 л) при 35C в течение 3 ч, затем фильтровали. Концентрировали фильтрат с получением указанного в заголовке соединения (32,2 г). Повторяли этап размельчения со вторым твердым осадком и получали дополнительные 20 г указанного в заголовке соединения (90% общий выход). 1H ЯМР (400 МГц, ДМСО-d6)9,01 (уширенный синглет, 1H), 7,96 (дублет, 2H, J=8,5), 7,57 (дублет, 2H, J=8,5), 7,15 (дублет, 1H, J=7,9), 6,57 (дублет,1H, J=2,6), 6,48 (двойной дублет, 1H, J=2,6, 8,5), 5,34 (триплет, 1H, J=4,3), 4,34 (дублет, 2H, J=6, 6), 3,81(синглет, 3H), 3,79 (мультиплет, 2H), 3,75 (синглет, 3H), 3,11 (триплет, 3H, J=6,6). Пример синтеза 44. 2-(4-Хлорфенил)-5-(2,4-диметоксибензил)-5H-тиазоло[5,4-c]пиридин-4-он. Смешивали 2,4-диметоксибензиламид 2-(4-хлорфенил)-4-(2-гидроксиэтил)тиазол-5-карбоновой кислоты (19,7 г, 45,5 ммоль) с EtOAc (400 мл) и обрабатывали полученную суспензию 1-гидрокси-1-оксо 1H-бензо[d][1,2]йодоксол-3-оном (36,0 г, 57,8 ммоль). Перемешивали смесь при 60C в течение 1,5 ч.- 25015559 Добавляли дополнительный 1-гидрокси-1-оксо-1H-бензо[d][1,2]йодоксол-3-он (18,0 г, 28,9 ммоль) и перемешивали смесь при 70C в течение ночи. Охлаждали смесь до комнатной температуры и затем разбавляли CH2Cl2 (600 мл). Фильтровали смесь и промывали твердые остатки дополнительным CH2Cl2(3500 мл). Промывали фильтрат NaHCO3 (4300 мл) и водой (300 мл). Сушили органическую часть,фильтровали и концентрировали под вакуумом. Очищали неочищенный материал с помощью флэшхроматографии, применяя 0,5% MeOH/CH2Cl2 в качестве элюента с получением 13,1 г (70%) указанного в заголовке соединения в виде светло-желто-оранжевого твердого остатка. 1H ЯМР (400 МГц, CDCl3)7,99 (дублет, 2H, J=8,l), 7,50 (дублет, 1H, J=7,4), 7,45 (дублет, 2H, J=8,8), 7,38 (дублет, 1H, J=8,8), 6,84(дублет, 1H, J=6,4), 6,46 (мультиплет, 2H), 5,16 (синглет, 2H), 3,84 (синглет, 3H), 3,78 (синглет, 3H). Пример синтеза 45. 2-(4-Хлорфенил)-5H-тиазоло[5,4-c]пиридин-4-он. Смешивали 2-(4-хлорфенил)-5-(2,4-диметоксибензил)-5H-тиазоло[5,4-c]пиридин-4-он (24,6 г, 59,6 ммоль) в трифторуксусной кислоте (143 мл) и грели при 70C в течение 2 ч. Охлаждали смесь до комнатной температуры и добавляли воду (325 мл) и насыщенный NaHCO3 (710 мл) при перемешивании. Добавляли ацетон (180 мл) и перемешивали полученную суспензию в течение 1 ч при комнатной температуре. Фильтровали и промывали твердые остатки водой (110 мл) и затем ацетоном (110 мл). Сушили твердые остатки в вакуумной печи при 60C в течение ночи. Растирали в порошок твердые остатки трижды с CH3CN (700 мл) при 60C и фильтровали. Сушили твердые остатки в вакуумной печи при 60C в течение ночи с получением 18,3 г (117%) указанного в заголовке соединения, которое еще содержит примеси соли. 1H ЯМР (400 МГц, ДМСО-d6)11,86 (синглет, 1H), 8,12 (дублет, 2H, J=8,2), 7,65 (дублет,2H, J=8,7), 7,49 (триплет, 1H, J=6,0), 6,91 (1H, J=6,6). Пример синтеза 46. трет-Бутиловый эфир 3-(4-бром-2-метоксифенокси)азетидин-1-карбоновой кислоты. Добавляли гидрид натрия (2,77 г, 60% в весовом отношении, 69,2 ммоль) к раствору третбутилового эфира 3-гидроксиазетидин-1-карбоновой кислоты (10,9 г, 62,9 ммоль) в диметилсульфоксиде(100 мл). Перемешивали полученную смесь в течение 30 мин и затем добавляли 3-бром-6-фторанизол(15,5 г, 75,5 ммоль). Нагревали смесь до 65C в течение ночи. Охлаждали смесь до комнатной температуры и затем разбавляли раствор насыщенным хлоридом аммония и солевым раствором и экстрагировали с помощью этилацетата. Промывали органические фазы пять раз солевым раствором, затем сушили над сульфатом натрия и фильтровали. Концентрировали и очищали посредством хроматографии на силикагеле, применяя 0-4 5% градиент этилацетата/гексана, с получением 10,4 г (46%) указанного в заголовке соединения в виде прозрачного масла. Пример синтеза 47. 3-(4-Бром-2-метоксифенокси)азетидин. Растворяли трет-бутиловый эфир 3-(4-бром-2-метоксифенокси)азетидин-1-карбоновой кислоты (2,9 г, 8,10 ммоль) в дихлорметане (45 мл) и медленно добавляли трифторуксусную кислоту (15 мл). Перемешивали смесь в течение 1 ч и затем выпаривали. Наносили осадок на две 10 г SCX колонки с помощью метанола. Промывали колонки метанолом, затем элюировали материал, используя 2N аммиак/метанол. Концентрировали с получением 2,09 г (88%) указанного в заголовке соединения в виде прозрачного масла. Пример синтеза 48. 3-(4-Бром-2-метоксифенокси)-1-циклобутилазетидин. Растворяли 3-(4-бром-2-метоксифенокси)азетидин (1,84 г, 7,13 ммоль) в дихлорэтане (80 мл). Добавляли циклобутанон (1,86 мл, 25 ммоль), триацетоксиборгидрид натрия (3,02 г, 14,3 ммоль) и уксусную кислоту (0,82 мл, 14,3 ммоль). Перемешивали смесь в течение ночи, затем добавляли насыщенный бикарбонат натрия и экстрагировали три раза, применяя дихлорметан. Сушили объединенные органические части над сульфатом натрия, фильтровали и концентрировали. Очищали с помощью хроматографии на силикагеле, применяя 0-3% градиент метанола/дихлорметана, с получением 1,2 6 г (56%) указанного в заголовке соединения. Пример синтеза 49. трет-Бутиловый эфир 3-(4-бромфенокси)азетидин-1-карбоновой кислоты. Объединяли 1-бром-4-фторбензол (10,1 г, 57,7 ммоль) и трет-бутил 3-гидроксиазетидин-1 карбоксилат (5,0 г, 28,9 ммоль) в ТГФ (144 мл) и перемешивали при комнатной температуре. Добавляли медленно трет-бутилат калия (75,7 мл, 57,7 ммоль, 1 М в ТГФ). Грели смесь при 70C в течение 4 ч. Отслеживали завершение реакции с помощью газовой хроматографии. Охлаждали смесь до комнатной температуры и гасили водой. Разбавляли смесь эфиром. Промывали органическую часть насыщеннымNH4Cl. Повторно экстрагировали водную фазу эфиром. Сушили объединенные органические фазы с помощью Na2SO4, фильтровали и концентрировали. Очищали материал с помощью флэш-хроматографии,применяя 5-10% EtOAc/гексаны, с получением 1,84 г (19% выход) указанного в заголовке соединения в виде белого твердого остатка. Пример 22. 5-[4-(1-Циклобутилазетидин-3-илокси)-3-метоксифенил]-2-(4-циклопропоксифенил)5H-тиазоло[5,4-c]пиридин-4-он. Суспендировали 3-(4-бром-2-метоксифенокси)-1-циклобутилазетидин (0,233 г, 0,746 ммоль), 2-(4 циклопропоксифенил)-5H-тиазоло[5,4-c]пиридин-4-он (0,212 г, 0,746 ммоль), карбонат цезия (0,486 г,1,49 ммоль) и 1,4-диоксан (5 мл) в колбе. Барботировали приповерхностным азотом в течение 15 мин.- 26015559 Добавляли в эту смесь йодид меди(1) (0,057 г, 0,298 ммоль), а затем симм-диметилэтилендиамин (64 мкл,0,596 ммоль). Нагревали смесь до 110C в атмосфере азота в течение ночи. Доводили реакцию до комнатной температуры и разбавляли водой, а затем гидроксидом аммония. Экстрагировали смесь, применяя дихлорметан (3). Сушили объединенные органические фазы, применяя сульфат натрия, фильтровали и концентрировали. Очищали материал с помощью флэшхроматографии, применяя 4,5% MeOH (2N NH3)/CH2Cl2, с получением 83 мг (22%) указанного в заголовке соединения в виде белого твердого остатка. MS/ES m/z 516,0 [M+1]+. Получить тиазол-пиридон из таблицы ниже можно, по существу, следуя процедуре, которая описана в примере 22. Добавляли 37% водный раствор HCl (0,25 мл, 2,94 ммоль) к раствору трет-бутил-3-(4-(2-(4 хлорфенил)-4-оксотиазоло[5,4-c]пиридин-5(4H)-ил)фенокси)азетидин-1-карбоксилата (0,5 г, 0,98 ммоль) в метаноле (20 мл). Грели смесь при 50C в течение 2 ч. Охлаждали смесь до 10C и затем добавляли 37% формальдегид (0,37 мл, 4,98 ммоль), а затем триацетоксиборгидрид натрия (1,3 г, 5,88 ммоль). Перемешивали смесь при комнатной температуре в течение 2 ч. Разбавляли смесь дихлорметаном. Промывали насыщенным раствором Na2CO3 и водой. Сушили органическую часть над Na2SO4, фильтровали и концентрировали. Очищали неочищенный материал с помощью флэш-хроматографии, применяя 5-10%MeOH/CH2Cl2 в качестве элюента. Растворяли твердый продукт в дихлорметане. Добавляли бутандиоевую кислоту (1 экв.). Перемешивали раствор в течение 15 мин и затем концентрировали до сухого состояния. Отфильтровывали твердый остаток с эфиром с получением 0,14 г (26%) указанного в заголовке соединения. ES/MS m/z (35Cl) 424 [M+1]+. Пример синтеза 51. 5-(4-(Азетидин-3-илокси)фенил)-2-(4-хлорфенил)тиазоло[5,4-с]пиридин-4(5H)он. Добавляли 37% водный раствор HCl (0,25 мл, 2,94 ммоль) к раствору трет-бутил-3-(4-(2-(4 хлорфенил)-4-оксотиазоло[5,4-c]пиридин-5(4H)-ил)фенокси)азетидин-1-карбоксилата (0,5 г, 0,98 ммоль) в метаноле (20 мл) и хлороформе (20 мл). Грели смесь при 50C в течение 2 ч. Охлаждали смесь до комнатной температуры и разбавляли дихлорметаном. Промывали смесь насыщенным раствором Na2CO3 и водой. Сушили органическую часть над Na2SO4, фильтровали и концентрировали с получением 0,44 г(0,31 мл, 5,4 ммоль). Перемешивали смесь при комнатной температуре в течение 1 ч, добавляли триацетоксиборгидрид натрия (1,4 г, 6,48 ммоль) и продолжали перемешивание при комнатной температуре в течение ночи. Разбавляли смесь дихлорметаном, затем промывали насыщенным раствором NaHCO3 и водой. Сущили органическую часть над Na2SO4, фильтровали и концентрировали. Очищали неочищенный материал с помощью флэш-хроматографии, применяя 0-10% MeOH/CH2Cl2 в качестве элюента. Растворяли твердый остаток в дихлорметане и добавляли 1 М HCl/эфир (1 экв.). Перемешивали раствор в- 27015559 течение 15 мин. Концентрировали твердый остаток и фильтровали с эфиром с получением 0,31 г (58%) указанного в заголовке соединения. ES/MS m/z (35Cl) 464 [M+1]+. Пример 26. 5-[4-(Азетидин-3-илокси)-3-метоксифенил]-2-(4-хлорфенил)-6,7-дигидро-5H-тиазоло [5,4-с] пиридин-4-он. Растворяли трет-бутиловый эфир 3-4-[2-(4-хлорфенил)-4-оксо-6,7-дигидро-4H-тиазоло[5,4-c]пиридин-5-ил]-2-метоксифеноксиазетидин-1-карбоновой кислоты (2,71 г, 5,00 ммоль) в CH2Cl2 (20 мл). Добавляли трифторуксусную кислоту (5,88 мл, 77,79 ммоль). Перемешивали при комнатной температуре в течение 1 ч и затем добавляли 5 N NaOH до pH 8-10. Собирали белый/желтый преципитат путем вакуумной фильтрации и промывали твердый остаток EtOAc, а затем Et2O. Сушили твердый остаток в течение ночи под вакуумом при приблизительно 50C с получением 2,21 г (99%) указанного в заголовке соединения. ES/MS m/z (35Cl) 442,0 [M+1]+. Пример 26a. 5-[4-(Азетидин-3-илокси)-3-метоксифенил]-2-(4-хлорфенил)-6,7-дигидро-5H-тиазоло[5,4-c]пиридин-4-он, гидрохлоридная соль. Растворяли трет-бутиловый эфир 3-4-[2-(4-хлорфенил)-4-оксо-6,7-дигидро-4H-тиазоло[5,4-c]пиридин-5-ил]-2-метоксифеноксиазетидин-1-карбоновой кислоты (3,33 г, 6,16 ммоль) в CH2Cl2 (21 мл) и добавляли трифторуксусную кислоту (7,25 мл). Перемешивали в течение 1 ч при комнатной температуре и затем добавляли 1 N NaOH, чтобы довести уровень pH до 8-10. Экстрагировали с помощью EtOAc(350 мл) и промывали водой (250 мл). Собирали грязно-белый твердый остаток путем вакуумной фильтрации (2,15 г, 79%). Перерастворяли часть неочищенного материала (300 мг, 0,68 ммоль) в CHCl3 и добавляли раствор 4 N HCl/диоксан (приблизительно 200 мкл). Удаляли органический растворитель при пониженном давлении до сухого состояния с получением 316 мг указанного в заголовке соединения.ES/MS m/z (35Cl) 442,0 [M+1]+. Свободные основания лактамных соединений из таблицы ниже (примеры синтеза с 52 по 55) можно получить, по существу, следуя процедуре, которая описана в примере 26.(4,0 мл, 69,8 ммоль) и формальдегидом (1,6 мл, 21,30 ммоль, в виде раствора в воде). Перемешивали смесь при комнатной температуре в течение 30 мин и затем обрабатывали цианоборгидридом натрия (1,3 г, 19,6 ммоль). Перемешивали смесь при комнатной температуре в течение ночи и концентрировали под вакуумом. Разделяли полученный осадок между CH2Cl2 (100 мд) и насыщенным NaHCO3 (100 мл). Удаляли органический раствор и экстрагировали водную фазу дополнительным CH2Cl2 (2100 мл). Объединяли органические растворы и промывали водой (50 мл), затем сушили, фильтровали и концентрировали под вакуумом. Очищали неочищенный материал с помощью флэщ-хроматографии, применяя 8% MeOH(2 М NH3) /CH2Cl2 в качестве элюента, с получением 1,6 г (50%) указанного в заголовке соединения в виде желтого твердого остатка. ES/MS m/z (35Cl) 456 [M+1]+. Пример 27 а. 2-(4-Хлорфенил)-5-[3-метокси-4-(1-метилазетидин-3-илокси)фенил]-6,7-дигидро-5Hтиазоло [5,4-c]пиридин-4-он, гидрохлоридная соль. Растворяли 2-(4-хлорфенил)-5-[3-метокси-4-(1-метилазетидин-3-илокси)фенил]-6,7-дигидро-5Hтиазоло[5,4-с]пиридин-4-он (2,1 г, 4,6 ммоль) в CH2Cl2 (25 мл) и обрабатывали 4,0 М HCl (1,3 мл, 5,2 ммоль, раствор в диэтиловом эфире). Перемешивали раствор в течение 10 мин. Добавляли дополнительный диэтиловый эфир (25 мл) и выделяли преципитат путем фильтрации. Промывали твердый остаток диэтиловым эфиром и сушили под вакуумом, с получением 2,08 г (92%) указанного в заголовке соединения. ES/MS m/z (35Cl) 456 [M+1]+. Пример 28. 2-(4-Хлорфенил)-5-[4-(1-изопропилазетидин-3-илокси)-3-метоксифенил]-6,7-дигидро 5H-тиазоло[5,4-c]пиридин-4-он, гидрохлоридная соль. Растворяли 5-[4-(азетидин-3-илокси)-3-метоксифенил]-2-(4-хлорфенил)-6,7-дигидро-5H-тиазоло[5,4-c]пиридин-4-он (1,0 г, 2,26 ммоль) и ацетон (250 мкл, 3,39 ммоль) в безводном 1,2-дихлорэтане. Добавляли триацетоксиборгидрид натрия (1,0 г, 4,53 ммоль) и перемешивали в течение ночи при комнатной температуре. Добавляли 1 N раствор NaOH к реакционной смеси и экстрагировали с помощью CH2Cl2 (225 мл). Объединяли органические части и промывали водой (225 мл). Сушили органический слой с помощьюNa2SO4, затем фильтровали и концентрировали под вакуумом. Растирали в порошок неочищенный желтый твердый остаток с Et2O и отфильтровывали. Промывали твердый остаток Et2O несколько раз и перерастворяли в CHCl3. Добавляли раствор 1 N HCl/Et2O (1,5 мл) и удаляли растворитель под вакуумом с получением 630 мг (53%) указанного в заголовке соединения. ES/MS m/z (35Cl) 484,2 [M+1]+. Соединения из таблицы ниже (примеры с 29 по 35) можно получить, по существу, следуя процедуре, которая описана в примере 28, применяя подходящее свободное основание и подходящий альдегид,соответственно.
МПК / Метки
МПК: A61K 31/437, C07D 513/04
Метки: производные, рецепторов, качестве, 5-[4-(азетидин-3-илокси)фенил]-2-фенил-5н-тиазоло[5,4-c]пиридин-4-она, использование
Код ссылки
<a href="https://eas.patents.su/30-15559-proizvodnye-5-4-azetidin-3-iloksifenil-2-fenil-5n-tiazolo54-cpiridin-4-ona-i-ih-ispolzovanie-v-kachestve-receptorov-mch.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 5-[4-(азетидин-3-илокси)фенил]-2-фенил-5н-тиазоло[5,4-c]пиридин-4-она и их использование в качестве рецепторов mch</a>
Предыдущий патент: Способ обработки наборов флуоресцентных изображений и устройство для его осуществления
Следующий патент: Способ лечения вирусного гепатита
Случайный патент: Устройство для приёма данных через спутник с использованием по меньшей мере двух поляризаций