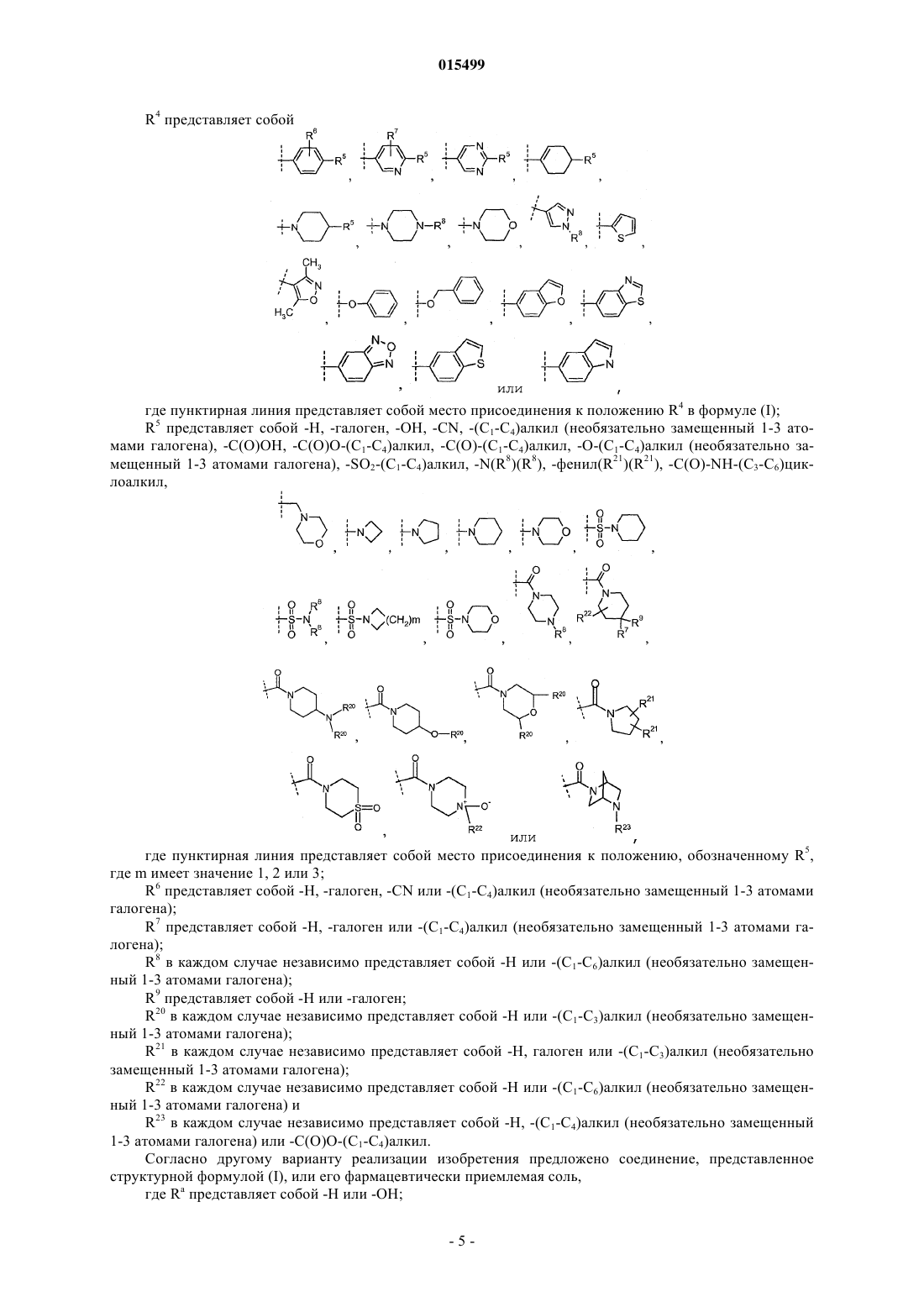
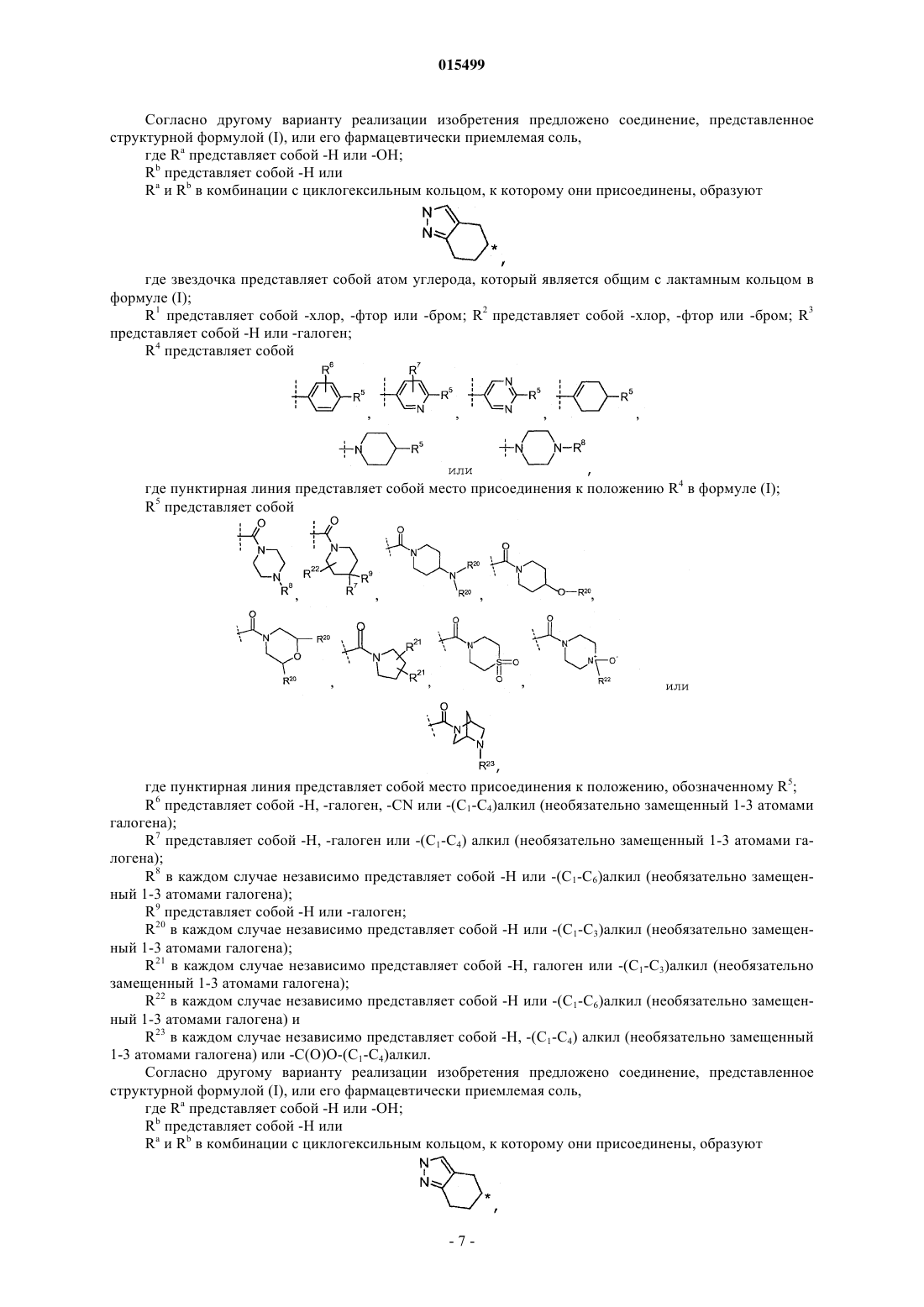
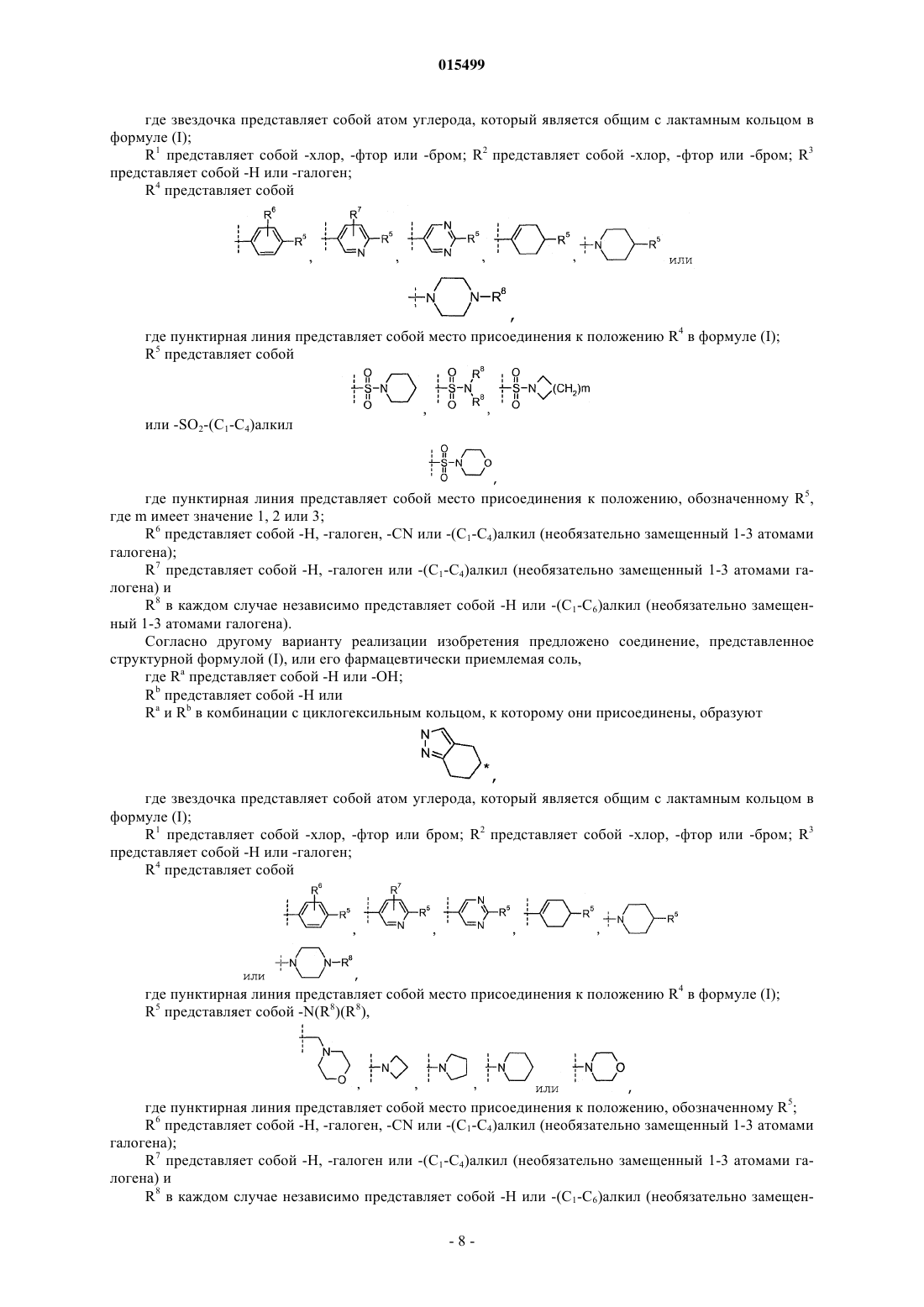
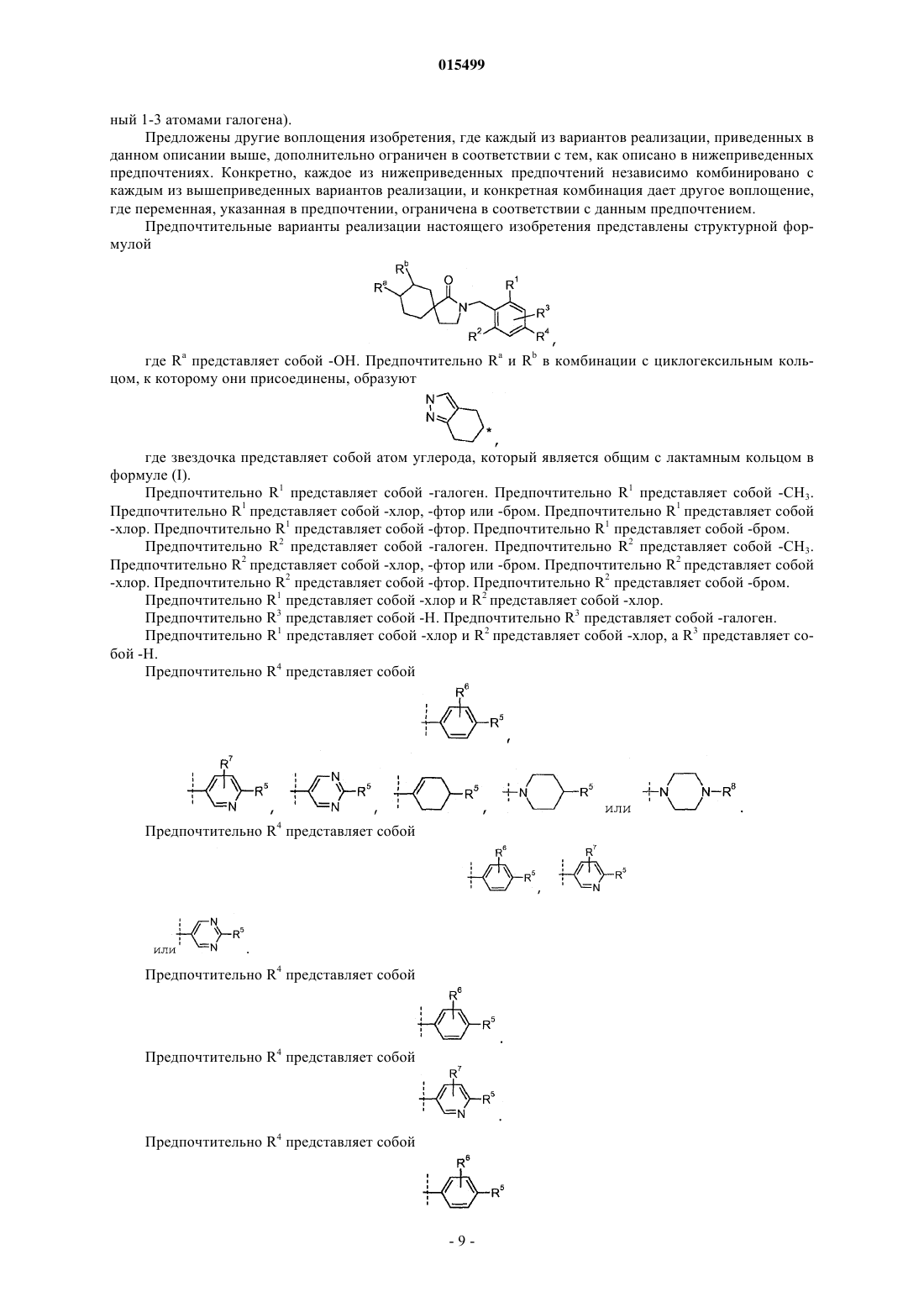
Ингибиторы 11-бета-гидроксистероид дегидрогеназы типа 1
Номер патента: 15499
Опубликовано: 31.08.2011
Авторы: Мэбри Томас Эдвард, Виннероски Леонард Лэрри, Снайдер Нэнси Джун, Уоллэйс Оуэн Брендан, Сюй Яньпин
Формула / Реферат
1. Соединение, представленное структурной формулой
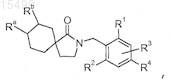
или его фармацевтически приемлемая соль,
где Ra представляет собой -Н или -ОН;
Rb представляет собой -Н или
Ra и Rb в комбинации с циклогексильным кольцом, к которому они присоединены, образуют
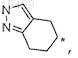
где звездочка представляет собой атом углерода, который является общим с лактамным кольцом;
R1 представляет собой -Н или -галоген;
R2 представляет собой -Н или -галоген;
R3 представляет собой -Н или -галоген;
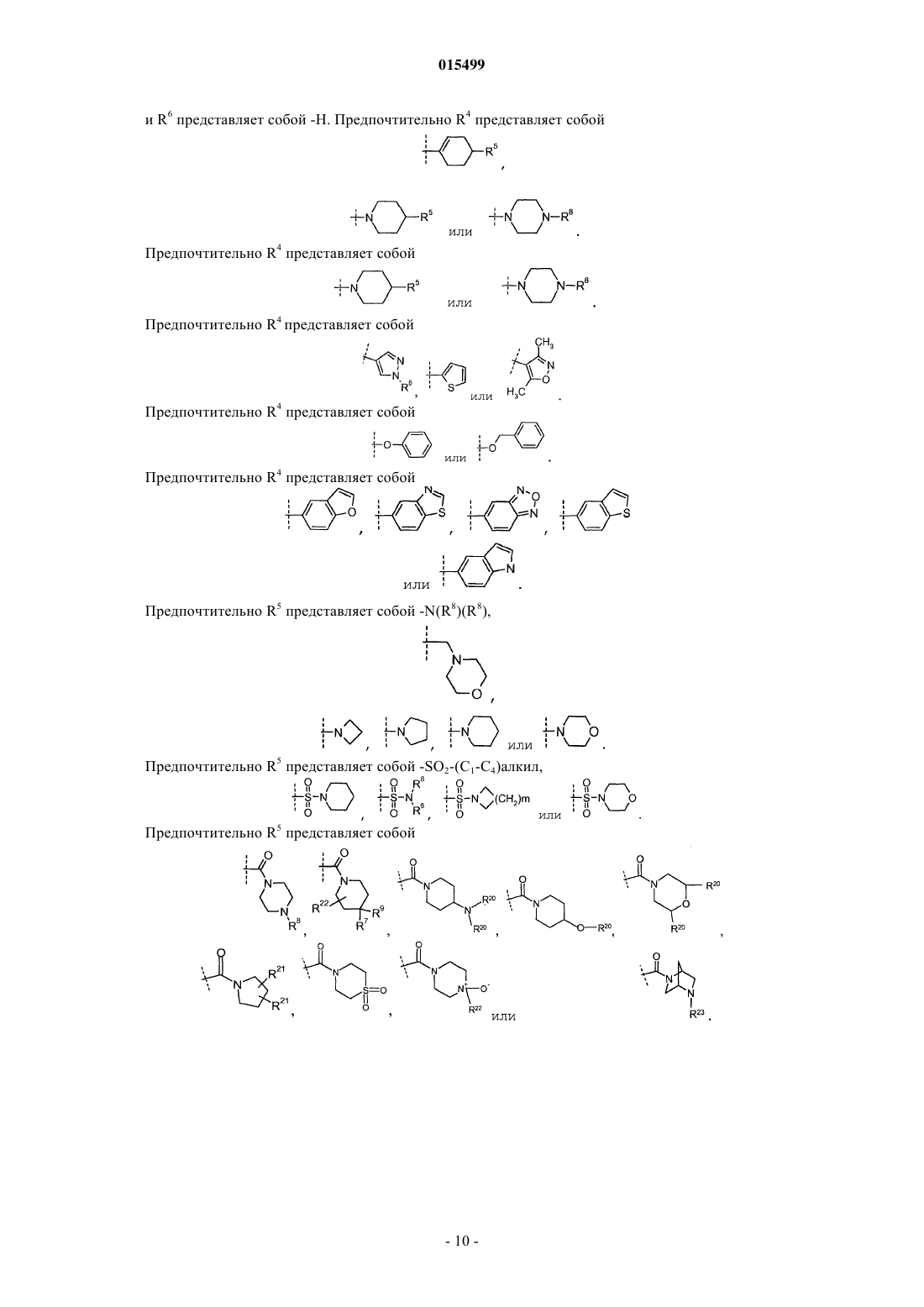
R4 представляет собой -галоген или
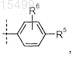
где пунктирная линия представляет собой место присоединения к положению R4;
R5 представляет собой -галоген, -С(О)ОН, -С(О)О-(С1-С4)алкил,
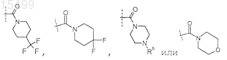
где пунктирная линия представляет собой место присоединения к положению, обозначенному R5;
R6 представляет собой -Н и
R8 представляет собой -(С1-C6)алкил (необязательно замещенный 1-3 атомами галогена).
2. Соединение по п.1, где Ra и Rb представляют собой водород, или его фармацевтически приемлемая соль.
3. Соединение по п.1, где Ra представляет собой -ОН и Rb представляет собой атом водорода, или его фармацевтически приемлемая соль.
4. Соединение по п.1, где Ra и Rb в комбинации с циклогексильным кольцом, к которому они присоединены, образуют
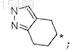
где звездочка представляет собой атом углерода, который является общим с лактамным кольцом, или его фармацевтически приемлемая соль.
5. Соединение по любому из пп.1-4, где R1 представляет собой -хлор и R2 представляет собой -хлор, a R3 представляет собой -Н, или его фармацевтически приемлемая соль.
6. Соединение по любому из пп.1-5, где R4 представляет собой
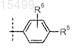
и R6представляет собой -Н, или его фармацевтически приемлемая соль.
7. Соединение по п.6, где R5 представляет собой
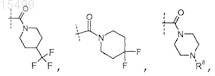
где R8представляет собой -(С1-C3)алкил (необязательно замещенный 1-3 атомами галогена), или
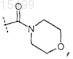
или его фармацевтически приемлемая соль.
8. Соединение по п.6, где R5 представляет собой
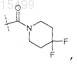
или его фармацевтически приемлемая соль.
9. Соединение по п.6, где R5 представляет собой
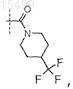
или его фармацевтически приемлемая соль.
10. Соединение по п.6, где R5 представляет собой
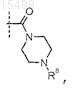
где R8представляет собой -(C1-С3)алкил (необязательно замещенный 1-3 атомами галогена), или его фармацевтически приемлемая соль.
11. Соединение по п.6, где R5 представляет собой хлор или фтор, или его фармацевтически приемлемая соль.
12. Соединение, которое представляет собой 2-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил) бифенил-4-илметил]-2-азаспиро[4,5]декан-1-он, или его фармацевтически приемлемая соль.
13. Соединение, которое представляет собой 2-{3,5-дихлор-4'-[4-(2-фторэтил)пиперазин-1-карбонил] бифенил-4-илметил}-2-азаспиро[4,5]декан-1-он, или его фармацевтически приемлемая соль.
14. Соединение по п.1, выбранное из группы, состоящей из
2-(4-бром-2,6-дихлорбензил)-2-азаспиро[4,5]декан-1-она;
2-(3,5-дихлор-4'-фторбифенил-4-илметил)-2-азаспиро [4,5]декан-1-она;
метилового эфира 3',5'-дихлор-4'-(1-оксо-2-азаспиро[4,5]дец-2-илметил)бифенил-4-карбоновой кислоты;
3',5'-дихлор-4'-(1-оксо-2-азаспиро[4,5]дец-2-илметил)бифенил-4-карбоновой кислоты;
2-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-2-азаспиро[4,5]декан-1-она;
2-{3,5-дихлор-4'-[4-(2-фторэтил)пиперазин-1-карбонил]бифенил-4-илметил}-2-азаспиро[4,5]декан-1-она;
2-(2,6-дихлор-4-морфолин-4-ил-бензил)-2-азаспиро [4,5]декан-1-она;
транс 2-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-8-гидрокси-2-азаспиро[4,5]декан-1-она;
цис 2-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-8-гидрокси-2-азаспиро[4,5]декан-1-она;
цис-[3,5-дихлор-4'-(4,4-дифторпиперидин-1-карбонил)бифенил-4-илметил]-8-гидрокси-2-азаспиро[4,5]декан-1-она;
транс[3,5-дихлор-4'-(4,4-дифторпиперидин-1-карбонил)бифенил-4-илметил]-8-гидрокси-2-азаспиро[4,5]декан-1-она;
цис 2-(3,5-дихлор-4'-фторбифенил-4-илметил)-8-гидрокси-2-азаспиро[4,5]декан-1-она;
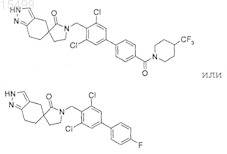
или его фармацевтически приемлемая соль.
15. Фармацевтическая композиция, которая содержит соединение по любому из пп.1-14, или его стереоизомер, или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
16. Применение соединения по любому из пп.1-14 или его фармацевтически приемлемой соли в терапии.
17. Применение соединения по любому из пп.1-14 или его фармацевтически приемлемой соли для приготовления лекарственного средства.
18. Промежуточное соединение для получения соединения по п.12, которое представляет собой
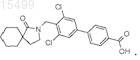
Текст
Дата публикации и выдачи патента Номер заявки В настоящем изобретении описаны новые соединения формулы (I) обладающие активностью антагонистов 11-HSD типа 1, а также способы получения таких соединений. Согласно другому варианту реализации изобретения описаны фармацевтические композиции, содержащие соединение формулы (I), а также способы применения данных соединений и композиций в лечении диабета, гипергликемии, ожирения, гипертензии,гиперлипидемии, метаболического синдрома и других состояний, ассоциированных с активностью 11-HSD типа 1.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 015499 Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США 60/745574, поданной 25 апреля 2006 г. Данное изобретение относится к соединениям, которые являются ингибиторами 11 гидроксистероиддегидрогеназы типа 1 ("11HSD1"), содержащим их фармацевтическим композициям и к применению данных соединений и композиций в лечении человека или животного, а также к новым промежуточным соединениям, подходящим для получения данных ингибиторов. Соединения согласно настоящему изобретению обладают способностью к эффективному и избирательному ингибированию 11HSD1,и как таковые являются полезными в лечении расстройств, реагирующих на модуляцию 11HSD1, таких как диабет, метаболический синдром, когнитивные расстройства и тому подобное. Глюкокортикоиды, действующие в печени, жировой ткани и мышцах, являются важными регуляторами метаболизма глюкозы, липидов и белков. Хронический избыток глюкокортикоидов ассоциирован с резистентностью к инсулину, висцеральным ожирением, гипертензией и дислипидемией, которые также являются классическими признаками метаболического синдрома. 11HSD1 катализирует превращение неактивного кортизона в активный кортизол и вовлечена в развитие метаболического синдрома. Данные,полученные для грызунов и людей, указывают на связь 11HSD1 с метаболическим синдромом. Эти данные дают возможность предположить, что лекарственное средство, которое специфически ингибирует 11HSD1 у пациентов с диабетом типа 2, будет понижать уровень глюкозы в крови за счет уменьшения глюконеогенеза в печени, уменьшать центральное ожирение, улучшать атерогенный липопротеиновый фенотип, снижать кровяное давление и уменьшать резистентность к инсулину. Действие инсулина в мышцах будет усилено, и также может быть увеличена секреция инсулина бета-клетками островков Лангерганса. Данные, полученные в результате исследований, выполненных на животных и на людях, указывают также на то, что избыток глюкокортикоидов приводит к ухудшению когнитивной функции. Результаты, полученные в последнее время, показывают, что инактивация 11HSD1 приводит к улучшению функции памяти как у людей, так и у мышей. Показано, что ингибитор 11HSD карбеноксолон улучшает когнитивную функцию у здоровых людей преклонного возраста и у пациентов с диабетом типа 2, а инактивация гена, ответственного за 11HSD1, препятствует развитию возрастных нарушений у мышей. Недавно показано, что избирательное ингибирование 11HSD1 фармацевтическим агентом улучшает функцию памяти у мышей. В последние годы появился ряд публикаций, где сообщается об агентах, которые ингибируют 11-HSD1, смотри международную заявку WO 2004/056744, в которой в качестве ингибиторов 11HSD раскрыты адамантилацетамиды, международную заявку WO 2005/108360, в которой в качестве ингибиторов 11HSD раскрыты пирролидин-2-оновые и пиперидин-2-оновые производные, и международную заявку WO 2005/108361, в которой в качестве ингибиторов 11HSD раскрыты адамантилпирролидин-2 оновые производные. Несмотря на то что имеется ряд терапевтических подходов для лечения заболеваний, связанных с 11HSD1, данные терапевтические подходы страдают тем, что имеют один или более недостатков, включающих плохую или недостаточную эффективность, неприемлемые побочные эффекты и противопоказания для некоторых групп пациентов. Соответственно существует необходимость в улучшении лечения с использованием альтернативных или улучшенных фармацевтических агентов, которые ингибируют 11HSD1 и лечат заболевания, при которых могло бы принести пользу ингибирование 11HSD1. В настоящем изобретении предложен такой вклад в данную область техники, основанный на обнаружении нового класса соединений, обладающих эффективной и избирательной ингибирующей активностью в отношении 11HSD1. В настоящем изобретении предложены соединения с различными структурами и активностями. Продолжает существовать необходимость в новых способах лечения диабета, метаболического синдрома и когнитивных расстройств, и задачей данного изобретения является удовлетворение этих и других потребностей. В настоящем изобретении предложено соединение, представленное структурной формулой (I) или его фармацевтически приемлемая соль,где Ra представляет собой -Н или -ОН; где звездочка представляет собой атом углерода, который является общим с лактамным кольцом вR4 представляет собой -ОН, -галоген, -CN, -(С 1-С 4)алкил (необязательно замещенный 1-3 атомами галогена), -(C1-C6)алкокси (необязательно замещенный 1-3 атомами галогена), -SCF3, -С(O)O(С 1 С 4)алкил, -O-СН 2-С(O)NH2, -(C3-С 8)циклоалкил, -O-фенил-С(O)O-(C1-C4)алкил, -СН 2-фенил, -NHSO2-(C1 С 4)алкил, -NHSO2-фенил (R21)(R21), -(C1-C4) алкил-С(О)N(R10)(R11), где пунктирная линия представляет собой место присоединения к положению R4 в формуле (I);R5 представляет собой -Н, -галоген, -ОН, -CN, -(C1-C4)алкил (необязательно замещенный 1-3 атомами галогена), -С(О)ОН, -С(О)О-(C1-C4)алкил, -С(О)-(C1-C4)алкил, -О-(C1-C4)алкил (необязательно замещенный 1-3 атомами галогена), -SO2-(C1-C4)алкил, -N(R8)(R8), -фенил(R21)(R21), -С(О)-NH-(С 3 С 6)циклоалкил, где пунктирная линия представляет собой место присоединения к положению, обозначенному R5; где m имеет значение 1, 2 или 3; где n имеет значение 0, 1 или 2 и где, если n имеет значение 0, "(СН 2)n" представляет собой связь;R8 в каждом случае независимо представляет собой -Н или -(C1-С 6)алкил (необязательно замещенный 1-3 атомами галогена);R20 в каждом случае независимо представляет собой -Н или -(C1-С 3)алкил (необязательно замещенный 1-3 атомами галогена);R21 в каждом случае независимо представляет собой -Н, галоген или -(C1-С 3)алкил (необязательно замещенный 1-3 атомами галогена);R22 в каждом случае независимо представляет собой -Н или -(C1-C6)алкил (необязательно замещенный 1-3 атомами галогена) иR23 в каждом случае независимо представляет собой -Н, -(С 1-С 4)алкил (необязательно замещенный 1-3 атомами галогена) или -С(О)О-(C1-C4)алкил. В настоящем изобретении предложены соединения формулы (I), которые являются полезными для эффективного и избирательного ингибирования 11HSD1. В настоящем изобретении дополнительно предложена фармацевтическая композиция, которая содержит соединение формулы (I) или его фармацевтическую соль и фармацевтически приемлемый носитель, разбавитель или эксципиент. Кроме того, в настоящем изобретении предложен способ лечения метаболического синдрома и сходных расстройств,который включает введение нуждающемуся в этом пациенту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Согласно одному варианту реализации настоящего изобретения предложены соединения формулы(I) или их фармацевтически приемлемая соль, такие как подробно описано выше. Хотя все соединения по настоящему изобретению являются полезными, некоторые соединения являются в особенности интересными и предпочтительными. В нижеприведенном перечне описано несколько групп предпочтительных соединений. Согласно другому варианту реализации изобретения предложено соединение, представленное структурной формулой (I), или его фармацевтически приемлемая соль,где Ra представляет собой -Н или -ОН; где звездочка представляет собой атом углерода, который является общим с лактамным кольцом в формуле (I);R4 представляет собой -ОН, -галоген, -CN, -(С 1-С 4)алкил (необязательно замещенный 1-3 атомами галогена), -(C1-С 6)алкокси (необязательно замещенный 1-3 атомами галогена), -SCF3, -С(O)O(С 1 С 4)алкил, -O-СН 2-С(O)NH2, -(С 3-С 8)циклоалкил, -O-фенил-С(O)O-(C1-C4)алкил, -СН 2-фенил, -NHSO2-(C1 С 4)алкил, -NHSO2-фенил (R21)(R21), -(C1-C4)алкил-С(О)N(R10)(R11), где пунктирная линия представляет собой место присоединения к положению R4 в формуле (I); где пунктирная линия представляет собой место присоединения к положению, обозначенному R5,где m имеет значение 1, 2 или 3,где n имеет значение 0, 1 или 2 и где, если n имеет значение 0, "(СН 2)n" представляет собой связь;R8 в каждом случае независимо представляет собой -Н или -(С 1-С 6)алкил (необязательно замещенный 1-3 атомами галогена);R9 представляет собой -Н или -галоген; каждый из R10 и R11 независимо представляет собой -Н или -(С 3-С 4)алкил или R10 и R11 вместе с атомом азота, к которому они присоединены, образуют пиперидинил, пиперазинил или пирролидинил;R20 в каждом случае независимо представляет собой -Н или -(C1-С 3)алкил (необязательно замещенный 1-3 атомами галогена);R21 в каждом случае независимо представляет собой -Н, галоген или -(С 1-C3)алкил (необязательно замещенный 1-3 атомами галогена);R22 в каждом случае независимо представляет собой -Н или -(С 1-С 6)алкил (необязательно замещенный 1-3 атомами галогена) иR23 в каждом случае независимо представляет собой -Н, -(C1-С 4)алкил (необязательно замещенный 1-3 атомами галогена) или -С(O)O-(С 1-C4)алкил. Согласно другому варианту реализации изобретения предложено соединение, представленное структурной формулой (I), или его фармацевтически приемлемая соль,где Ra представляет собой -Н или -ОН; где звездочка представляет собой атом углерода, который является общим с лактамным кольцом в формуле (I); где пунктирная линия представляет собой место присоединения к положению R4 в формуле (I);R5 представляет собой -Н, -галоген, -ОН, -CN, -(C1-C4)алкил (необязательно замещенный 1-3 атомами галогена), -С(О)ОН, -С(О)О-(С 1-C4)алкил, -С(О)-(С 1-C4)алкил, -О-(С 1-С 4)алкил (необязательно замещенный 1-3 атомами галогена), -SO2-(С 1-C4)алкил, -N(R8)(R8), -фенил(R21)(R21), -С(О)-NH-(С 3-С 6)циклоалкил, где пунктирная линия представляет собой место присоединения к положению, обозначенному R5,где m имеет значение 1, 2 или 3;R8 в каждом случае независимо представляет собой -Н или -(С 1-C6)алкил (необязательно замещенный 1-3 атомами галогена);R20 в каждом случае независимо представляет собой -Н или -(C1-С 3)алкил (необязательно замещенный 1-3 атомами галогена);R21 в каждом случае независимо представляет собой -Н, галоген или -(C1-С 3)алкил (необязательно замещенный 1-3 атомами галогена);R22 в каждом случае независимо представляет собой -Н или -(С 1-С 6)алкил (необязательно замещенный 1-3 атомами галогена) иR23 в каждом случае независимо представляет собой -Н, -(C1-С 4)алкил (необязательно замещенный 1-3 атомами галогена) или -С(О)О-(С 1-C4)алкил. Согласно другому варианту реализации изобретения предложено соединение, представленное структурной формулой (I), или его фармацевтически приемлемая соль,где Ra представляет собой -Н или -ОН; где звездочка представляет собой атом углерода, который является общим с лактамным кольцом в формуле (I); на), где пунктирная линия представляет собой место присоединения к положению R4 в формуле (I);-С(О)ОН, -С(O)O-(С 1-С 4)алкил, -С(О)-(С 1-C4)алкил, -О-(С 1-С 4)алкил (необязательно замещенный 1-3 атомами галогена), -SO2-(С 1-С 4)алкил, -N(R8)(R8), где пунктирная линия представляет собой место присоединения к положению, обозначенному R5,где m имеет значение 1, 2 или 3;R8 в каждом случае независимо представляет собой -Н или -(С 1-С 6)алкил (необязательно замещенный 1-3 атомами галогена);R20 в каждом случае независимо представляет собой -Н или -(C1-С 3)алкил (необязательно замещенный 1-3 атомами галогена);R21 в каждом случае независимо представляет собой -Н, галоген или -(C1-С 3)алкил (необязательно замещенный 1-3 атомами галогена);R22 в каждом случае независимо представляет собой -Н или -(С 1-C6)алкил (необязательно замещенный 1-3 атомами галогена) иR23 в каждом случае независимо представляет собой -Н, -(С 1-С 4)алкил (необязательно замещенный 1-3 атомами галогена) или -С(О)О-(С 1-C4)алкил.-6 015499 Согласно другому варианту реализации изобретения предложено соединение, представленное структурной формулой (I), или его фармацевтически приемлемая соль,где Ra представляет собой -Н или -ОН; где звездочка представляет собой атом углерода, который является общим с лактамным кольцом в формуле (I); где пунктирная линия представляет собой место присоединения к положению R4 в формуле (I); где пунктирная линия представляет собой место присоединения к положению, обозначенному R5;R8 в каждом случае независимо представляет собой -Н или -(С 1-C6)алкил (необязательно замещенный 1-3 атомами галогена);R20 в каждом случае независимо представляет собой -Н или -(C1-С 3)алкил (необязательно замещенный 1-3 атомами галогена);R21 в каждом случае независимо представляет собой -Н, галоген или -(C1-С 3)алкил (необязательно замещенный 1-3 атомами галогена);R22 в каждом случае независимо представляет собой -Н или -(С 1-С 6)алкил (необязательно замещенный 1-3 атомами галогена) иR23 в каждом случае независимо представляет собой -Н, -(С 1-С 4) алкил (необязательно замещенный 1-3 атомами галогена) или -С(O)O-(С 1-C4)алкил. Согласно другому варианту реализации изобретения предложено соединение, представленное структурной формулой (I), или его фармацевтически приемлемая соль,где Ra представляет собой -Н или -ОН;-7 015499 где звездочка представляет собой атом углерода, который является общим с лактамным кольцом в формуле (I); где пунктирная линия представляет собой место присоединения к положению R4 в формуле (I); где пунктирная линия представляет собой место присоединения к положению, обозначенному R5,где m имеет значение 1, 2 или 3;R8 в каждом случае независимо представляет собой -Н или -(С 1-С 6)алкил (необязательно замещенный 1-3 атомами галогена). Согласно другому варианту реализации изобретения предложено соединение, представленное структурной формулой (I), или его фармацевтически приемлемая соль,где Ra представляет собой -Н или -ОН; где звездочка представляет собой атом углерода, который является общим с лактамным кольцом в формуле (I); где пунктирная линия представляет собой место присоединения к положению R4 в формуле (I);R5 представляет собой -N(R8)(R8), где пунктирная линия представляет собой место присоединения к положению, обозначенному R5;R8 в каждом случае независимо представляет собой -Н или -(С 1-С 6)алкил (необязательно замещен-8 015499 ный 1-3 атомами галогена). Предложены другие воплощения изобретения, где каждый из вариантов реализации, приведенных в данном описании выше, дополнительно ограничен в соответствии с тем, как описано в нижеприведенных предпочтениях. Конкретно, каждое из нижеприведенных предпочтений независимо комбинировано с каждым из вышеприведенных вариантов реализации, и конкретная комбинация дает другое воплощение,где переменная, указанная в предпочтении, ограничена в соответствии с данным предпочтением. Предпочтительные варианты реализации настоящего изобретения представлены структурной формулой где звездочка представляет собой атом углерода, который является общим с лактамным кольцом в формуле (I). Предпочтительно R1 представляет собой -галоген. Предпочтительно R1 представляет собой -СН 3. Предпочтительно R1 представляет собой -хлор, -фтор или -бром. Предпочтительно R1 представляет собой где R8 представляет собой -(С 1-C3)алкил (необязательно замещенный 1-3 атомами галогена). Предпочтительно R5 представляет собой хлор или фтор. Предпочтительно R6 представляет собой -Н. Предпочтительно R6 представляет собой -галоген. Предпочтительно R6 представляет собой -(С 1-С 4)алкил (необязательно замещенный 1-3 атомами галогена). Предпочтительно R7 представляет собой -Н. Предпочтительно R7 представляет собой -галоген или-(С 1-С 4)алкил (необязательно замещенный 1-3 атомами галогена). Предпочтительно R7 представляет собой -галоген. Предпочтительно R7 представляет собой -(С 1-С 4)алкил (необязательно замещенный 1-3 атомами галогена). Предпочтительно R8 в каждом случае независимо представляет собой -Н. Предпочтительно R8 в каждом случае независимо представляет собой -(C1-С 3)алкил. Предпочтительно R8 в каждом случае независимо представляет собой -СН 3. Предпочтительно R9 представляет собой -Н. Предпочтительно R9 представляет собой -галоген. Предпочтительно R9 представляет собой -CF3. Предпочтительно R7 представляет собой -фтор и R9 представляет собой -фтор. Согласно другому варианту реализации изобретения предложено соединение, представленное структурной формулой (I), или его фармацевтически приемлемая соль,где Ra представляет собой -Н или -ОН; где звездочка представляет собой атом углерода, который является общим с лактамным кольцом в формуле (I);R4 представляет собой -галоген, где пунктирная линия представляет собой место присоединения к положению R4 в формуле (I);R5 представляет собой -Н, -хлор, -фтор, -СН 3, -CF3, -С(СН 3)3, -СН(СН 3)2, -O-С(СН 3)2 -С(O)O-СН 3,-N(-СН 3)(-СН 3), где пунктирная линия представляет собой место присоединения к положению, обозначенному R5,где m имеет значение 1, 2 или 3;R8 в каждом случае независимо представляет собой -Н или -СН 3, -СН 2-СН 3, -С(СН 3)3, -СН(СН 3)2;R20 в каждом случае независимо представляет собой -Н, -СН 3 иR22 в каждом случае независимо представляет собой -Н. Одно из предпочтительных вариантов реализации изобретения относится к соединениям формулы 2-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-2-азаспиро[4,5]декан-1-он и 2-3,5-дихлор-4'-[4-(2-фторэтил)пиперазин-1-карбонил]бифенил-4-илметил-2-азаспиро[4,5]декан-1 он. Другое воплощение изобретения относится к приведенному в данном описании получению новых промежуточных соединений, которые являются полезными для получения ингибиторов 11HSD1, соответствующих формуле (I), и для вариантов реализации, приведенных в данном описании. Другое воплощение изобретения относится к приведенному в данном описании получению новых промежуточных соединений, которые являются полезными для получения 2-[3,5-дихлор-4'-(4-трифторметилпиперидин-1 карбонил)бифенил-4-илметил]-2-азаспиро[4,5]декан-1-она и 2-3,5-дихлор-4'-[4-(2-фторэтил)пиперазин 1-карбонил]бифенил-4-илметил-2-азаспиро[4,5]декан-1-она или их фармацевтически приемлемой соли. У пациентов с диабетом типа 2 часто развивается "резистентность к инсулину", что приводит к нарушению гомеостаза глюкозы и к гипергликемии, которые являются причиной повышенной смертности и преждевременной смертности. Нарушение гомеостаза глюкозы ассоциировано с ожирением, гипертензией и изменениями в метаболизме липидов, липопротеинов и аполипопротеинов. Пациенты с диабетом типа 2 относятся к группе повышенного риска развития сердечно-сосудистых осложнений, например атеросклероза, коронарной болезни сердца, инсульта, заболевания периферических сосудов, гипертензии, нефропатии, невропатии и ретинопатии. Поэтому терапевтический контроль гомеостаза глюкозы,метаболизма липидов, ожирения и гипертензии является важным звеном в ведении и лечении пациентов с сахарным диабетом. Многие пациенты, у которых уже есть резистентность к инсулину, но еще не развился диабет типа 2, также относятся к группе риска развития "Х-синдрома" или "метаболического синдрома". Метаболический синдром характеризуется резистентностью к инсулину, сопровождающейся абдоминальным ожирением, гиперинсулинемией, высоким кровяным давлением, низким уровнем ЛПВП(липопротеинов высокой плотности), высоким уровнем ЛПОНП (липопротеинов очень низкой плотности), гипертензией, атеросклерозом, коронарной болезнью сердца и хронической почечной недостаточностью. Данные пациенты относятся к группе повышенного риска развития сердечно-сосудистых осложнений, перечисленных выше, независимо от того, развился у них сахарный клинический диабет или нет. Благодаря способности к ингибированию 11HSD1 настоящие соединения являются полезными в лечении широкого круга состояний и расстройств, при которых ингибирование 11HSD1 является благоприятным. Данные расстройства и состояния определены в данном описании как "диабетические расстройства" и "расстройства метаболического синдрома". Специалист в данной области техники способен идентифицировать "диабетические расстройства" и "расстройства метаболизма" по корреляции активности 11HSD1 с патофизиологией расстройства или с гомеостатическим ответом на расстройство. Соответственно данные соединения могут найти применение, например, в предотвращении, лечении или облегчении заболеваний или состояний, или ассоциированных с ними симптомов или осложнений, относящихся к "диабетическим расстройствам" и "расстройствам метаболического синдрома"."Диабетические расстройства" и "расстройства метаболизма" (метаболический синдром) включают диабет, диабет типа 1, диабет типа 2, гипергликемию, гиперинсулинемию, недостаточность функции бета-клеток, улучшение функции бета-клеток путем восстановления первой фазы инсулинового ответа,прандиальную гипергликемию, предупреждение апоптоза, нарушенную гликемию натощак (IFG), метаболический синдром, гипогликемию, гиперкалиемию/гипокалиемию, нормализацию уровня глюкагона,улучшение отношения ЛПНП (липопротеинов низкой плотности)/ЛПВП, уменьшение количества промежуточных приемов пищи, расстройства приема пищи, потерю массы, синдром поликистозных яичников (PCOS), ожирение вследствие диабета, латентный аутоиммунный диабет взрослых (LADA), инсулит,трансплантацию островковых клеток, детский диабет, диабет при беременности, поздние диабетические осложнения, микроальбуминурию/макроальбуминурию, нефропатию, ретинопатию, невропатию, диабетические язвы стопы, сниженную моторику кишечника вследствие введения глюкагона, синдром укороченной тонкой кишки, диарею, увеличение желудочной секреции, замедленную циркуляцию крови,эректильную дисфункцию, глаукому, послеоперационный стресс, уменьшение повреждения тканей органов, обусловленного реперфузией циркуляции крови после ишемии, ишемическое повреждение сердца, сердечную недостаточность, застойную сердечную недостаточность, инсульт, инфаркт миокарда,аритмию, преждевременную смерть, антиапоптоз, заживление ран, нарушение толерантности к глюкозе(НТГ), синдром инсулинорезистентности, метаболический синдром, X-синдром, гиперлипидемию, дислипидемию, гипертриглицеридемию, гиперлипопротеинемию, гиперхолестеринемию, артериосклероз,включая атеросклероз, глюкагоному, острый панкреатит, сердечно-сосудистые заболевания, гипертензию, гипертрофию сердца, желудочно-кишечные расстройства, ожирение, обусловленный ожирением диабет, диабетическую дислипидемию и тому подобное, но не ограничены ими. Соответственно в настоящем изобретении также предложен способ лечения "диабетических расстройств" и "расстройств метаболического синдрома", уменьшающий и/или исключающий один или более нежелательных побочных эффектов, связанных с существующими методиками лечения. Кроме того, в настоящем изобретении предложено соединение формулы (I), или его фармацевтическая соль, или фармацевтическая композиция, которая содержит соединение формулы (I), или его фармацевтическую соль и фармацевтически приемлемый носитель, разбавитель или эксципиент, для применения в ингибировании активности 11HSD1; для применения в ингибировании клеточного ответа,опосредованного активностью 11HSD1, у млекопитающего; для применения в снижении гликемического уровня у млекопитающего; для применения в лечении заболевания, обусловленного чрезмерной активностью 11HSD1; для применения в лечении диабетических и других расстройств метаболического синдрома у млекопитающего и для применения в лечении диабета, метаболического синдрома, ожирения, гипергликемии, атеросклероза, ишемической болезни сердца, инсульта, невропатии и в заживлении ран. Соответственно способы по данному изобретению включают профилактическое и терапевтическое введение соединения формулы (I). Дополнительно в настоящем изобретении предложено применение соединения формулы (I) или его фармацевтической соли в изготовлении лекарственного средства для ингибирования активности 11-HSD1; в изготовлении лекарственного средства для ингибирования клеточного ответа, опосредованного активностью 11HSD1, у млекопитающего; в изготовлении лекарственного средства для снижения гликемического уровня у млекопитающего; в изготовлении лекарственного средства для лечения заболевания, обусловленного чрезмерной активностью 11HSD1; в изготовлении лекарственного средства для лечения диабетических и других расстройств метаболического синдрома у млекопитающего и в изготовлении лекарственного средства для предупреждения или лечения диабета, метаболического синдрома,ожирения, гипергликемии, атеросклероза, ишемической болезни сердца, инсульта, невропатии и неудовлетворительного заживления ран. Дополнительно в настоящем изобретении предложен способ лечения состояний, вызванных чрезмерной активностью 11HSD1, у млекопитающего; способ ингибирования активности 11HSD1 у млекопитающего; способ ингибирования клеточного ответа, опосредованного активностью 11HSD1, у млекопитающего; способ снижения гликемического уровня у млекопитающего; способ лечения диабетических и других расстройств метаболического синдрома у млекопитающего; способ предупреждения или лечения диабета, метаболического синдрома, ожирения, гипергликемии, атеросклероза, ишемической болезни сердца, инсульта, невропатии и неудовлетворительного заживления ран; указанные способы включают введение млекопитающему, нуждающемуся в таком лечении, соединения формулы (I), или его фармацевтически приемлемой соли, или фармацевтической композиции, которая содержит соединение формулы (I), или его фармацевтическую соль, и фармацевтически приемлемый носитель, разбавитель или эксципиент, в количестве, достаточном для ингибирования активности 11HSD1. Кроме того, в настоящем изобретении предложена фармацевтическая композиция, которая содержит соединение формулы (I) или его фармацевтическую соль и фармацевтически приемлемый носитель,разбавитель или эксципиент, адаптированная для применения в ингибировании активности 11HSD1; адаптированная для применения в ингибировании клеточных ответов, опосредованных активностью 11HSD1; адаптированная для применения в снижении гликемического уровня у млекопитающего;- 13015499 адаптированная для применения в лечении диабетических и других расстройств метаболического синдрома у млекопитающего и адаптированная для применения в предупреждении или лечении диабета,метаболического синдрома, ожирения, гипергликемии, атеросклероза, ишемической болезни сердца, инсульта, невропатии и в заживлении ран. Согласно другому аспекту изобретения настоящие соединения вводят в комбинации с одним или более чем с одним другим активным веществом в любых подходящих пропорциях. Другие активные вещества могут быть выбраны, например, из противодиабетических средств, агентов, противодействующих ожирению, противогипертонических агентов, агентов для лечения осложнений, вызванных диабетом или ассоциированных с данным заболеванием, и агентов для лечения осложнений и расстройств, вызванных ожирением или ассоциированных с данным заболеванием. В нижеприведенном перечне описано несколько групп таких комбинаций. Обычно подразумевается, что каждый из вышеупомянутых агентов может быть комбинирован с другими вышеупомянутыми агентами с образованием дополнительных комбинаций. Соответственно согласно дополнительному воплощению изобретения настоящие соединения могут быть введены в комбинации с одним или более чем с одним противодиабетическим средством. Подходящие противодиабетические агенты включают инсулин, аналоги и производные инсулина,такие как аналоги и производные инсулина, раскрытые в ЕР 792290 (Novo Nordisk A/S), например NВ 29 тетрадеканоил дез (В 30) инсулин человека, ЕР 214826 и ЕР 705275 (Novo Nordisk A/S), например AspB28 инсулин человека, US 5504188 (Eli Lilly), например LysB28ProB29 инсулин человека, ЕР 368187 (Aventis),например Lantus, GLP-1 (глюкагоноподобный пептид) и производные GLP-1, такие как производныеGLP-1, раскрытые в WO 98/08871 (Novo Nordisk A/S), а также перорально активные гипогликемические агенты. Перорально активные гипогликемические агенты предпочтительно включают имидазолины, сульфонилмочевины, бигуаниды, меглитиниды, оксадиазолидиндионы, тиазолидиндионы, сенсибилизаторы инсулина, средства, усиливающие секрецию инсулина, такие как глимепирид, ингибиторы -глюкозидазы, агенты, действующие на АТФ-зависимый калиевый канал -клеток, например активаторы калиевых каналов, такие как активаторы калиевых каналов, раскрытые в WO 97/26265, WO 99/03861 иWO 00/37474 (Novo Nordisk A/S), или митиглинид, или такой блокатор калиевых каналов, какBTS-67582, натеглинид, антагонисты глюкагона, такие как антагонисты глюкагона, раскрытые вWO 99/01423 и WO 00/39088 (Novo Nordisk A/S и Agouron Pharmaceuticals, Inc.), антагонисты GLP-1,ингибиторы DPP-IV (дипептидилпептидазы IV), ингибиторы PTPase (протеинтирозинфосфатазы), ингибиторы ферментов печени, участвующих в стимуляции глюконеогенеза и/или гликогенолиза, модуляторы поглощения глюкозы, активаторы глюкокиназы (GK), такие как активаторы глюкокиназы, раскрытые в WO 00/58293, WO 01/44216, WO 01/83465, WO 01/83478, WO 01/85706, WO 01/85707 и WO 02/08209WO 03/15774 (AstraZeneca), ингибиторы GSK-3 (гликоген-синтаза-киназы-3), соединения, модифицирующие метаболизм липидов, такие как антилипидемические агенты, такие как ингибиторы HMG СоА(гидроксиметилглутарил-кофермент А-редуктазы) (статины), соединения, снижающие потребление пищи, лиганды PPAR (рецептора активатора пролиферации пероксисом), включая подтипы PPAR-alpha,PPAR-gamma и PPAR-delta, и агонисты RXR (ретиноидного X-рецептора), такие как ALRT-268, LG-1268 или LG-1069. Согласно другому воплощению настоящие соединения вводят в комбинации с инсулином или аналогом или производным инсулина, таким как NВ 29-тетрадеканоил дез (В 30) инсулин человека, AspB28 инсулин человека, LysB28ProB29 инсулин человека, Lantus, или со смешанным препаратом, содержащим один или более чем один из этих агентов. Согласно другому воплощению изобретения настоящие соединения вводят в комбинации с сульфонилмочевиной, такой как глибенкламид, глипизид, толбутамид, хлорпамидем, толазамид, глимепирид,гликазид и глибурид. Согласно другому воплощению изобретения настоящие соединения вводят в комбинации с бигуанидом, например с метформином. Согласно еще одному воплощению изобретения настоящие соединения вводят в комбинации с меглитинидом, например с репаглинидом или натеглинидом. Согласно еще одному воплощению изобретения настоящие соединения вводят в комбинации с тиазолидиндионовым сенсибилизатором инсулина, например с троглитазоном, циглитазоном, пиоглитазоном, розиглитазоном, изаглитазоном, дарглитазоном, энглитазоном, CS-011/CI-1037 или Т 174, или соединениями, раскрытыми в WO 97/41097, WO 97/41119, WO 97/41120, WO 00/41121 и WO 98/45292 (Dr.Reddy's Research Foundation). Согласно еще одному воплощению изобретения настоящие соединения могут быть введены в комбинации с сенсибилизатором инсулина, например, таким как GI 262570, YM-440, МСС-555, JTT-501,AR-H039242, KRP-297, GW-409544, CRE-16336, AR-H049020, LY510929, МВХ-102, CLX-0940, GW501516, или соединения, раскрытые в WO 99/19313, WO 00/50414, WO 00/63191, WO 00/63192,- 14015499WO 00/63193, такие как рагаглитазар (NN 622 или (-)DRF 2725) (Dr. Reddy's Research Foundation), и в WO 00/23425, WO 00/23415, WO 00/23451, WO 00/23445, WO 00/23417, WO 00/23416, WO 00/63153, WO 63196, WO 00/63209, WO 00/63190 и WO 00/63189 (Novo Nordisk A/S). Согласно другому воплощению изобретения настоящие соединения вводят в комбинации с ингибитором -глюкозидазы, например с воглибозой, эмиглитатом, миглитолом или акарбозой. Согласно другому воплощению изобретения настоящие соединения вводят в комбинации с агентом,действующим на АТР-зависимый калиевый канал -клеток, например с толбутамидом, глибенкламидом,глипизидом, гликазидом, BTS-67582 или репаглинидом. Согласно еще одному воплощению изобретения настоящие соединения могут быть введены в комбинации с натеглинидом. Согласно еще одному воплощению изобретения настоящие соединения вводят в комбинации с антилипидемическим агентом или антигиперлипидемическим агентом, например с холестирамином, колестиполом, клофибратом, гемфиброзилом, ловастатином, правастатином, симвастатином, питавастатином,розувастатином, пробуколом, декстротироксином, фенофибратом или аторвастином. Согласно еще одному воплощению изобретения настоящие соединения вводят в комбинации с соединениями, снижающими потребление пищи. Согласно другому воплощению изобретения настоящие соединения вводят в комбинации с более чем одним из вышеупомянутых соединений, например в комбинации с метформином и сульфонилмочевиной, такой как глибурид; сульфонилмочевиной и акарбозой; натеглинидом и метформином; репаглинидом и метформином, акарбозой и метформином; сульфонилмочевиной, метформином и троглитазоном; инсулином и сульфонилмочевиной; инсулином и метформином; инсулином, метформином и сульфонилмочевиной; инсулином и троглитазоном; инсулином и ловастатином и так далее. Основные термины, использованные в описании соединений в данном описании, употреблены в их обычных значениях. В контексте данного описания термины "(C1-С 3)алкил", "(С 1-С 4)алкил" или "(С 1-С 6)алкил" относятся к насыщенным алифатическим группам с линейной или разветвленной цепью, содержащим указанное количество атомов углерода, таким как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил,трет-бутил и тому подобное. Термин "(С 1-C6)алкокси" относится к C1-С 6 алкильной группе, присоединенной через атом кислорода, и включает такие группы, как например метокси, этокси, н-пропокси, изопропокси и тому подобное. Термин "галоген" относится к атому фтора, хлора, брома и йода. Термин"(С 3-C8)циклоалкил" относится к насыщенному или частично насыщенному карбоциклическому кольцу,содержащему от 3 до 8 атомов углерода, обычно от 3 до 7 атомов углерода. Примеры (С 3-С 8)циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и тому подобное, но не ограничены ими. Термин "необязательно замещенный" или "необязательные заместители" в контексте данного описания означает, что рассматриваемые группы являются либо незамещенными, либо замещенными одним или более чем одним указанным заместителем. Когда рассматриваемые группы замещены более чем одним заместителем, данные заместители могут быть одинаковыми или разными. Кроме того, когда используются термины "независимо" "независимо представляет собой" и "независимо выбран из", это означает, что рассматриваемые группы могут быть одинаковыми или разными. Некоторые из терминов,определенных в данном описании, в структурных формулах могут встречаться более одного раза, и в таком случае следует считать, что каждый термин определен независимо от других терминов. Подразумевается, что морские свинки, собаки, кошки, крысы, мыши, хомяки и приматы, включая человека, являются примерами пациентов в объеме значения термина "пациент". Предпочтительные пациенты включают человека. Термин "пациент" включает домашний скот. Домашний скот означает животных, которых разводят для получения пищевых продуктов. Примером домашнего скота являются жвачные ("cud-chewing") животные, такие как коровы, быки, телки, бычки, овцы, буйвол, бизон, козы и антилопы. Другие примеры домашнего скота включают свиней и птиц (домашних птиц), таких как куры,утки, индейки и гуси. Пациент, нуждающийся в лечении, представляет собой предпочтительно млекопитающего, в частности человека. Термины "лечение", "получать лечение" и "лечить" в контексте данного описания включают их общепринятые значения, то есть наблюдение и ведение пациента с целью предупреждения, снижения риска возникновения или развития данного состояния или заболевания, предотвращения, сдерживания, облегчения, ослабления, замедления, остановки, отсрочки или преломления тенденции прогрессирования заболевания или увеличения интенсивности проявлений заболевания и контролирования и/или лечения существующих признаков заболевания, расстройства или патологического состояния, перечисленных в данном описании, включая облегчение или ослабление симптомов или осложнений, или лечение или излечение заболевания, расстройства или состояния. Настоящий способ включает лекарственное лечение и/или профилактическое введение лекарственного средства в случае необходимости. В контексте данного описания термин "терапевтически эффективное количество" означает количество соединения по настоящему изобретению, которое способно ослабить симптомы различных патоло- 15015499 гических состояний, перечисленных в данном описании. Конкретная доза соединения, вводимого согласно данному изобретению, конечно, будет определяться в каждом случае конкретными обстоятельствами, включающими, например, то, какое соединение вводят, путь введения, состояние пациента и патологическое состояние, которое лечат. Термин "композиция" означает фармацевтическую композицию и подразумевается, что он включает фармацевтический продукт, содержащий активный(ые) ингредиент(ы), включая соединение(я) формулы (I), и инертный(ые) ингредиент(ы), который(ые) образует(ют) носитель. Соответственно фармацевтические композиции по настоящему изобретению включают любую композицию, приготовленную путем смешивания соединения по настоящему изобретению и фармацевтически приемлемого носителя. Термин "подходящий растворитель" относится к любому растворителю, инертному по отношению к проводимой реакции, который растворяет реагенты достаточно хорошо для получения среды, в которой можно осуществить желаемую реакцию, или к смеси растворителей, обладающей таким свойством. Термин "стандартная лекарственная форма" означает физически дискретные единицы, подходящие в качестве однократных доз для человека и других, не относящихся к человеку, животных, каждая единица содержит заданное количество активного вещества, которое согласно расчетам является достаточным для получения желаемого терапевтического эффекта, вместе с подходящим фармацевтическим носителем. Соединения по настоящему изобретению могут иметь один или более чем один хиральный центр и могут существовать в нескольких стереоизомерных конфигурациях. Ввиду наличия этих хиральных центров соединения по настоящему изобретению могут существовать в виде рацематов, в виде отдельных энантиомеров или смесей энантиомеров, а также в виде диастереомеров и смесей диастереомеров. Все такие рацематы, энантиомеры, диастереомеры и смеси включены в объем настоящего изобретения, независимо от того, являются они чистыми, частично очищенными или неочищенными смесями. Когда в примерах, приведенных в данном описании, присутствует молекула, содержащая хиральный центр или центры известной конфигурации, ее стереохимия указана в названии и в структурном представлении молекулы. Если стереохимия неизвестна или не определена, ее стереохимия не указана в названии или в структурном представлении молекулы. Воплощения изобретения включают примеры, приведенные в данном описании, и хотя приводимый пример может включать одну хиральную или конформационную форму или ее соль, дополнительные воплощения изобретения включают все другие стереомерные и/или конформационные формы соединений, приводимых в качестве примеров, а также их фармацевтически приемлемые соли. Данные воплощения включают любые выделенные энантиомеры, диастереомеры и/или конформеры этих структур, а также любые смеси, содержащие более одной формы. Кроме того, когда в молекуле присутствует двойная связь, или полностью или частично насыщенная кольцевая система, или более одного центра асимметрии, или связь с ограниченным вращением, могут быть образованы диастереомеры. Подразумевается, что любые диастереомеры, разделенные, чистые или частично очищенные диастереомеры или их смеси включены в объем изобретения. Кроме того, некоторые соединения по настоящему изобретению могут существовать в разных таутомерных формах и подразумевается, что любые таутомерные формы, которые могут образовывать данные соединения, включены в объем настоящего изобретения. В настоящем описании термин "энантиомерный избыток" означает увеличение доли одного энантиомера по сравнению с другим. Имеющийся удобный способ выражения достигаемого энантиомерного избытка представляет собой концепцию энантиомерного избытка или "э.и.", в которой используют следующее уравнение: где Е 1 представляет собой количество первого энантиомера, а Е 2 представляет собой количество второго энантиомера. Таким образом, если исходное отношение двух энантиомеров равно 50:50, то есть равно отношению энантиомеров в рацемической смеси, и достигается энантиомерный избыток, достаточный для получения конечного отношения, равного 70:30, то значение э.и. по отношению к первому энантиомеру будет составлять 40%. В то же время, если конечное отношение будет равно 90:10, то значение э.и. по отношению к первому энантиомеру будет составлять 80%. Предпочтительными являются значения э.и., превышающие 90%, еще более предпочтительными являются значения э.и., превышающие 95%, и наиболее предпочтительными являются значения э.и., превышающие 99%. Специалист в данной области техники может легко определить значение энантиомерного избытка при помощи стандартных методик и процедур, например посредством газовой хроматографии или жидкостной хроматографии высокого разрешения с использованием хиральной колонки. Принципы выбора соответствующей хиральной колонки, элюента и условий, необходимых для разделения энантиомерной пары, хорошо известны специалистам в данной области техники. Кроме того, конкретные стереоизомеры и энантиомеры соединений формулы (I) могут быть приготовлены специалистом в данной области техники при помощи хорошо известных методик и способов, например, подобных описанным в публикации J. Jacques, et al.,- 16015499"Enantiomers, Racemates, and Resolutions", John Wiley и Sons, Inc., 1981, и E.L. Eliel, S.H. Wilen," Stereochemistry of Organic Compounds", (Wiley-Interscience 1994), и в Европейской патентной заявке No. ЕР-А-838448 от 29 апреля 1998 г. Примеры способов разделения включают способы перекристаллизации или хиральной хроматографии. Когда соединение формулы (I) обозначено как "цис" или "транс", данное обозначение описывает позицию карбонила относительно Ra в 2-азаспиро[4,5]декан-1-оновом ядре. Соединение, обозначенное как "транс", имеет следующую позицию Ra1 относительно карбонила в соединении II и III, где Ra1 представляет собой -ОН и -O-Pg, где Pg представляет собой защитную группу, например -Si(фенил)2-С(СН 3)3 Соединение, обозначенное как "цис", имеет следующую позицию Ra1 относительно карбонила в соединении IV и V, где Ra1 представляет собой -ОН и -O-Pg, где Pg представляет собой защитную группу,например -Si(фенил)2-С(СН 3)3 Соединения формулы (I) могут быть получены средним специалистом в данной области техники с использованием ряда методик, некоторые из которых проиллюстрированы в методиках и схемах, приведенных ниже. Конкретный порядок стадий, требуемых для получения соединений формулы (I), зависит от того конкретного соединения, которое должно быть синтезировано, от исходного соединения и относительной лабильности замещенных групп. Соответствующие реагенты или исходные вещества легко доступны специалисту в данной области техники и, в случае их отсутствия в продаже, легко могут быть синтезированы средним специалистом в данной области техники в соответствии со стандартными методиками, обычно используемыми в данной области техники, и в соответствии с различными методиками и схемами, приведенными ниже. Следующие схемы, подготовительные примеры, примеры и методики приведены только с целью более полного разъяснения практического осуществления изобретения и никоим образом не должны быть истолкованы как ограничение объема изобретения. Специалисты в данной области техники должны понимать, что могут быть сделаны различные модификации, не выходя за пределы существа и объема изобретения. Все публикации, приведенные в описании изобретения, соответствуют уровню компетентности специалистов в той области техники, к которой относится данное изобретение. Оптимальное время проведения реакций, описанных в схемах, подготовительных примерах, примерах и методиках, может быть определено путем наблюдения за ходом реакции с помощью стандартных хроматографических методик. Кроме того, реакции по изобретению предпочтительно проводить в атмосфере инертного газа, такого как, например, аргон, азот. Выбор растворителя обычно не является критическим, поскольку используемый растворитель является инертным по отношению к проводимой реакции и растворяет реагенты достаточно хорошо для осуществления желаемой реакции. Соединения перед их использованием в следующих реакциях предпочтительно выделять и очищать. Некоторые соединения могут быть кристаллизованы из реакционного раствора в ходе их образования и затем собраны путем фильтрации, или растворитель, используемый в реакции, может быть удален путем экстракции, выпаривания или декантации. Промежуточные соединения и конечные продукты формулы (I) могут быть дополнительно очищены, при желании, с помощью общих методик, таких как перекристаллизация или хроматография на твердофазных носителях, таких как силикагель или окись алюминия. Специалисту должно быть понятно, что не все заместители совместимы со всеми условиями реакции. Эти соединения могут быть защищены или модифицированы на подходящей стадии синтеза с использованием методик, хорошо известных в данной области техники. Термины и аббревиатуры, использованные в приведенных схемах, подготовительных примерах,примерах и методиках, употребляются в их обычных значениях, если не указано иное. Например, в контексте данного описания нижеприведенные термины имеют следующие указанные значения: "psi" относится к фунт-силе на квадратный дюйм; "ТСХ" относится к тонкослойной хроматографии; "ВЭЖХ" относится к высокоэффективной жидкостной хроматографии; "Rf" относится к фактору задержки; "Rt" относится ко времени удержания; относится к химическому сдвигу в миллионных долях (ppm) по стандартной шкале относительно тетраметилсилана; "МС" относится к масс-спектрометрии, наблюдаемая масса относится к [М+Н], если не указано иное. "MC(APCI)" относится к масс-спектрометрии с химической ионизацией при атмосферном давлении, "УФ" относится к ультрафиолетовой спектрометрии,- 17015499 1H ЯМР" относится к спектрометрии протонного ядерного магнитного резонанса, "ЖХ/МС" относится к жидкостной хроматографии/масс-спектрометрии, "ГХ/МС" относится к газовой хроматографии/массспектрометрии. "ИК" относится к инфракрасной спектрометрии и для ИК-спектров приведены только максимумы поглощения, представляющие интерес, а не все наблюдаемые максимумы. "RT" относится к комнатной температуре."ТГФ" означает тетрагидрофуран, "LAH" означает алюмогидрид лития, "LDA" означает диизопропиламид лития, "ДМСО" означает диметилсульфоксид, "ДМФА" означает диметилформамид, "EtOAc" означает этилацетат, "Pd-C" означает палладий на углероде, "ДХМ" означает дихлорметан, "DMAP" означает диметиламинопиридин, "LiHMDS" означает гексаметилдисилазан лития, "ТФУ" означает трифторуксусную кислоту, "EDAC" означает N-этил-N'-(3-диметиламинопропил)карбодиимида гидрохлорид,"НОВТ" означает 1-гидроксибензотриазол, "Bn-9-BBN" означает бензил-9-борабицикло[3.3.1]нонан,"Pd(dppf)Cl2" означает [1,1'-бис-(дифенилфосфино)ферроцен)дихлорпалладий(II), "EDCI" означаетN-бромсукцинимид, "TsOH" означает пара-толуолсульфоновую кислоту, "DCE" означает дихлорэтан,"DAST" означает (диэтиламино)сератрифторид, "ЕА/Н" означает смесь этилацетат/гексаны, "Pd2(dba)3 означает бис-(дибензилиденацетон)палладий, "BINAP" означает 2,2'-бис-(дифенилфосфино-1,1'бинафталин, "NMP" означает N-метилпирролидин, "TMSCN" означает триметилсилилцианид, "TBAF" означает фторид тетрабутиламмония, "Tf2O" означает ангидрид трифторметансульфоновой кислоты,"TBSO" означает трет-бутилдиметилсиланилокси, "OTf" означает трифторметансульфонат, MeTi(Oi-Pr)3 означает метилтитан триизопропоксид, "BBr3" означает трибромид бора, "PBr3" означает трехбромистый фосфор, "Pd(PPh3)4" означает тетракис(трифенилфосфин)палладий(0), "ОАс" означает ацетат, "DME" означает диметилэтан, "Et2O" означает диэтиловый эфир, "(Ph3P)4Pd" означает тетракис(трифенилфосфин)палладий(0), "DMFDMA" означает N,N-диметилформамиддиметилацеталь, "Et3N" означает триэтиламин, "tBu" означает трет-бутил, "DIPEA" означает диизопропилэтиламин, "EDC" означает -(3 диметиламинопропил)-3-этилкарбодиимида гидрохлорид, "НОАс" означает уксусную кислоту, "boc" означает трет-бутоксикарбонил. В структурных формулах "Ph" означает фенил, "Me" означает метил,"Et" означает этил, "Bn" означает бензил, "МеОН" означает метанол, "OTf" означает трифторметансульфонат, "TIPSO" означает триизопропилсиланилокси, "TBSO" означает трет-бутилдиметилсиланилокси. Примеры, приведенные в данном описании, являются иллюстрацией заявленного здесь изобретения и предполагается, что они никоим образом не ограничивают объем заявленного изобретения. Названия препаратов и соединений в примерах генерированы с использованием AutoNom 2.2 в ChemDraw Ultra или AutoNom 2000 в MDL ISIS/Draw версия 2.5 SP1 от MDL Information Systems, Inc. или соответствуютChemical Abstracts Services. Для получения 1 Н ЯМР-спектров в указанном растворителе использовали спектрометр VarianINOVA 400 МГц. Для проведения ЖХ/МС использовали хроматограф Agilent HP1100, оснащенный массспектрометром (Agilent MSD SL). В качестве неподвижной фазы использовали колонку Waters XterraC18 (2,150 мм, 3,5 микрон) и в качестве стандартной методики элюирования использовали градиент 5-100% ацетонитрил/метанол (50:50) с 0,2% формиатом аммония в течение 3,5 мин с последующим элюированием в течение 0,5 мин 100% В, при температуре колонки 50 С и скорости потока 1,0 мл/мин. В качестве другой стандартной методики элюирования использовали градиент 5-100% ацетонитрил/метанол (50:50) с 0,2% формиатом аммония в течение 7,0 мин с последующим элюированием в течение 1,0 мин 100% В, при температуре колонки 50 С и скорости потока 1,0 мл/мин. Дополнительный МС-анализ с помощью масс-селективного детектора Agilent MSD (loop machine) представлял собой стандартный проточно-инжекционный анализ (FIA) (без колонки, скорость потока 0,5 мл/мин, 80% МеОН с 6,5 мМ ацетатом аммония, время выполнения 30 с). Схема А В соответствии со схемой А необязательно замещенный анилин превращают в соединение 2 и затем в соединение 3, которое содержит уходящую группу (Lg). Предпочтительно соединение 2 обрабатывают В соответствии со схемой В необязательно замещенный фенол (4) защищают (например, с помощью TBSCl) с получением соединения 5, и затем соединение 5 превращают в альдегид (6). Соединение 6 подвергают взаимодействию с соединением, содержащим защитную группу (Pg) и уходящую группу(Lg) с получением эфира соединения 7. Pg может представлять собой -СН 3 или -СН 2-фенил, и Lg может представлять собой мезилат или атом галогена. Предпочтительно Lg-Pg-соединение представляет собойICH3 или Br-СН 2-фенил. Данный альдегид восстанавливают с получением спирта (8) и затем превращают в соединение 9. Предпочтительно соединение 8 галогенизируют PBr3 с получением 2-бромметильного соединения. Методики введения и снятия защитных групп с образованием соединений формулы (Ia) и других хорошо известны специалистам и описаны в литературе (например, см. Greene and Wuts, Protective В соответствии со схемой С эфир циклогексанкарбоновой кислоты (10) подвергают взаимодействию с основанием, таким как LDA, и алкилируют в апротонном растворителе (предпочтительно ТГФ) бромацетонитрилом с получением соединения (11). Нитрил (11) восстанавливают и циклизируют с получением соединения (12), в соответствии с тем, как описано в литературе (смотри Reddy, P.A.; Hsiang,В.С.Н.; Latifi, Т.N.; Hill, M.W.; Woodward K.Е.; Rothman, S.M.; Ferrendelli, J.A.; Covey, D.F. J. Med. Chem.,1996, 39, 1898-1906). Соединение (12) обрабатывают основанием (предпочтительно NaH) и алкилируют соединением (3) с получением соединения (13). Затем проводят реакцию сочетания соединения (13) и производного фенилбороновой кислоты в присутствии катализатора, такого как тетракис(трифенилфосфин)палладий, с получением сложного эфира (14). В результате гидролиза соединения(14) получают кислоту (15), которую подвергают взаимодействию с амином с использованием стандартных условий синтеза амидов, например с использованием 1,1'-карбонилдиимидазола, с получением соединения (16). В соответствии со схемой D соединение (12) обрабатывают основанием (предпочтительно NaH) и алкилируют соединением (9) с получением соединения (17). Соединение (17) деблокируют с помощью подходящей методики, например с использованием водорода в присутствии катализатора, и полученный фенол подвергают взаимодействию с ангидридом трифторметансульфоновой кислоты и основанием,например пиридином, с получением соединения (18). Трифлат 18 подвергают взаимодействию с амином,таким как морфолин, в NMP (1-метил-2-пирролидиноне) с получением соединения (19) в соответствии с тем, как описано в литературе (смотри Xu G.; Wang, Y.G. Org. Lett., 2004, 6, 985-987). Схема Е В соответствии со схемой Е смесь цис/транс-изомеров эфира 4-гидроксициклогексанкарбоновой кислоты (20) блокируют подходящей защитной группой, такой как TBDPS (трет-бутилдифенилсилил) с получением соединения (21) (см. Greene and Wuts, Protective Groups in Organic Synthesis, Third Edition,John Wiley and Sons Inc., 1999). Сложный эфир (21) подвергают взаимодействию с основанием, таким какWoodward K.Е.; Rothman, S.M.; Ferrendelli, J.A.; Covey, D.F. J. Med. Chem., 1996, 39, 1898-1906). Соединение (23) обрабатывают основанием (предпочтительно NaH) и алкилируют соединением (9) с получением соединения (24) в виде смеси цис/транс-изомеров, которые разделяют с использованием стандартных методик очистки. В соответствии со схемой F снимают защиту с соединения (24) с помощью подходящей методики,например с использованием водорода в присутствии катализатора, с получением фенола (25), который подвергают взаимодействию с ангидридом трифторметансульфоновой кислоты и основанием, например пиридином, с получением соединения (26). Затем проводят реакцию сочетания соединения (26) с производным фенилбороновой кислоты в присутствии катализатора, такого как тетракис(трифенилфосфин)палладий, с получением сложного эфира (27). В результате гидролиза соединения (27) получают защищенную кислоту (28), которую подвергают взаимодействию с амином с использованием стандартных условий синтеза амидов, например с использованием 1,1'-карбонилдиимидазола, с получением после деблокирования спирта (29). Чистый транс- или цис-изомер спирта (29) может быть окислен и восстановлен в стандартных условиях с получением смеси цис/транс-изомеров спирта (30), которые разделяют с использованием стандартных методик очистки. Схема G В соответствии со схемой G соединение (31) окисляют с использованием стандартных условий, например с использованием TEMPO (2,2,6,6-тетраметил-1-пиперидинилокси) и NaOCl, с получением кетона (32). Рацемический пиразол (33) получают в результате постадийного взаимодействия кетона (32) сначала с трет-бутокси-бис-(диметиламино)метаном и затем с гидратом гидразина. Чистые энантиомеры получают в результате разделения энантиомеров путем хиральной ВЭЖХ. Получение 1. 3, 5-Дихлор-4-метиланилин. 1,3-Дихлор-2-метил-5-нитробензол (0,50 г, 2,43 ммоль) растворяли в ДМФА и обрабатывали дигидратом хлорида олова(II) (2,74 г, 12,1 ммоль) за один прием. Данную реакционную смесь перемешивали в течение 1 ч, разбавляли этилацетатом и фильтровали через целит. Фильтрат промывали четыре раза водой и дважды рассолом, сушили над MgSO4, фильтровали и концентрировали до получения темного- 21015499 масла. Данный остаток очищали путем хроматографии на силикагеле, используя для элюирования градиент (5-10%) этилацетата в гексанах, с получением 342 мг (80%) указанного в заголовке продукта в виде белых хлопьев. Получение 2. 5-Бром-1,3-дихлор-2-метилбензол. 3,5-Дихлор-4-метиланилин суспендировали в 48% HBr (5 мл) и воде (5 мл) и нагревали в потоке горячего воздуха до тех пор, пока температура смеси не приближалась к точке кипения. Данную суспензию охлаждали сначала до комнатной температуры и затем до 0 С в бане со льдом и рассолом. Добавляли по каплям раствор нитрита натрия (109 мг, 1,58 ммоль) в воде (2 мл). После завершения добавления реакционную смесь дополнительно перемешивали в течение 15 мин в охлаждающей бане. Добавляли растворCuBr (1,08 г, 7,53 ммоль) в 48% HBr (2 мл) и реакционную смесь нагревали до 50 С в течение 1 ч при интенсивном перемешивании. Реакционную смесь охлаждали до комнатной температуры, затем реакционную смесь разбавляли этилацетатом и удаляли водный слой. Органический слой промывали водой и рассолом, сушили над MgSO4, фильтровали через целит и концентрировали до получения оранжевого остатка. Данный остаток очищали путем хроматографии на силикагеле, используя для элюирования гексаны, с получением 164 мг (45%) продукта в виде желтого твердого вещества. Получение 3. 5-Бром-2-(бромметил)-1,3-дихлорбензол. Раствор 5-бром-1,3-дихлор-2-метилбензола (97 мг, 0,40 ммоль), N-бромсукцинимида (76 мг,0,425 ммоль) и перекиси бензоила (16 мг, 0,06 ммоль) в CCl4 (5 мл) нагревали до температуры дефлегмации в течение 3 ч в атмосфере N2. Реакционную смесь охлаждали до комнатной температуры и концентрировали до получения оранжевого остатка. Данный остаток очищали путем хроматографии на силикагеле, используя для элюирования гексаны, с получением 112 мг (87%) продукта в виде белых кристаллов. Получение 4. трет-Бутил-(3,5-дихлорфенокси)диметилсилан. 3,5-Дихлорфенол (1 кг, 6,13 моль) растворяли в 3 л диметилформамида и охлаждали до 0 С. Добавляли сначала имидазол (918,74 г, 6,75 моль), затем трет-бутилхлордиметилсилил хлорид (1017,13 г,6,75 моль). Данную смесь нагревали до комнатной температуры и перемешивали в течение 15 мин. Вливали в воду (6 л) и экстрагировали диэтиловым эфиром (4 л). Органический слой промывали 2 раза водой, затем 10% водным раствором хлорида лития, затем рассолом и сушили над сульфатом натрия. Фильтровали и концентрировали под вакуумом с получением 135 г масла. Получение 5. 2,6-Дихлор-4-гидроксибензальдегид. трет-Бутил-(3,5-дихлорфенокси)диметилсилан (425 г, 1,5 моль) растворяли в 4 л сухого тетрагидрофурана и охлаждали до -68 С. Медленно добавляли 1,1 экв. втор-бутиллития (103,1 г, 1,61 моль) при-68 С (в течение 1,75 ч). После завершения добавления реакционную смесь перемешивали при -70 С в течение 30 мин. Добавляли диметилформамид (168,5 г, 2,3 моль) и данную реакционную смесь перемешивали при -70 С в течение 1 ч. Добавляли 1 М соляную кислоту в воде (3,5 л) и данную реакционную смесь оставляли нагреваться до комнатной температуры. Реакционную смесь вливали в диэтиловый эфир(5 л), промывали водой, затем рассолом. Сушили над сульфатом натрия и концентрировали под вакуумом до получения оранжевого твердого вещества. Растирали с холодным дихлорметаном и фильтровали с получением 250 г (80%) бледно-желтого твердого вещества. Получение 6. 2,6-Дихлор-4-бензилоксибензальдегид. Смесь 2,6-дихлор-4-гидроксибензальдегида (250 г, 1,3 моль) и карбоната калия (361,8 г, 2,62 моль) в 2 л диметилформамида обрабатывали бензилбромидом (268,64 г, 1,57 моль). Данную реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Отфильтровывали твердое вещество и остаток вливали в 12 л воды. Отфильтровывали твердое вещество, промывали несколько раз водой, сушили на воздухе и растворяли в этилацетате. Сушили над сульфатом магния, фильтровали и концентрировали под вакуумом до уменьшения объема до 1,5 л. Оставляли перемешиваться в течение ночи, затем фильтровали. Твердое вещество промывали небольшим количеством гексана и сушили под вакуумом. Фильтрат концентрировали под вакуумом и растирали с гексаном с получением второй порции продукта, в сумме первый и второй выход продукта составлял 245 г (белые кристаллы). Процедуру повторяли еще раз с получением третьей порции продукта с выходом 80 г в виде светло-коричневого порошка (общий выход 88%): 1 Н ЯМР (400 МГц, ДМСО-d6)10,26 (с, 1 Н), 7,43 (м, 5 Н), 7,28 (с, 2 Н), 5,25 (с, 2 Н). Получение 7. (2,6-Дихлор-4-бензилоксифенил)метанол. Смесь 2,6-дихлор-4-бензилоксибензальдегида (245 г, 0,871 моль) и этанола (3 л), находящуюся при температуре 0 С, обрабатывали боргидридом натрия (32,97 г, 0,897 моль). Данную реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 ч. Реакционную смесь добавляли к насыщенному хлориду аммония (8 л). Эту смесь экстрагировали CH2Cl2 и органический слой сушилиNa2SO4. Растворитель удаляли под вакуумом с получением 247 г (100%) указанного в заголовке продукта. 1 Н ЯМР (400 МГц, ДМСО-d6)7,38 (м, 4 Н), 7,33 (м, 1 Н), 7,12 (с, 2 Н), 5,14 (с, 2 Н), 5,05 (т, 1 Н), 4,59 (д,2 Н). Получение 8. 2-Бромметил-1,3-дихлор-5-бензилоксибензол. Раствор (2,6-дихлор-4-бензилоксифенил)метанола (247 г, 0,872 моль) в ТГФ (2,5 л), находящийся при температуре 0 С, обрабатывали трехбромистым фосфором (94,45 г, 0,35 моль) и перемешивали в- 22015499 течение 30 мин при 0 С в атмосфере N2. Данную реакционную смесь вливали в насыщенный NaHCO3 и дважды экстрагировали этилацетатом. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением 269 г (89%) указанного в заголовке продукта. МС с ионизацией электрораспылением (ES) (m/z): 346 (М+1). Получение 9. 1-Цианометилциклогексанкарбоновой кислоты метиловый эфир. Раствор циклогексанкарбоновой кислоты метилового эфира (15,0 г, 0,105 моль) в ТГФ (150 мл), находящийся при температуре -78 С, обрабатывали 2 М раствором диизопропиламида лития в смеси гептан/ТГФ/этилбензол (63,3 мл, 0,126 моль) и перемешивали при -78 С в течение 20 мин в атмосфере N2. Данную реакционную смесь обрабатывали бромацетонитрилом (25,31 г, 0,211 моль) и перемешивали при-78 С в течение 15 мин. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Реакционную смесь подкисляли 1 н. HCl и затем реакционную смесь разбавляли этилацетатом и промывали водой. Органический слой сушили (Na2SO4) и растворитель удаляли под вакуумом с получением неочищенного продукта. В результате очистки на силикагеле с использованием градиента(0-30%) этилацетата в гексанах получали 7,78 г (41%) указанного в заголовке продукта. Rf=0,32 (3/1 гексаны/этилацетат). Получение 10. 2-Азаспиро[4,5]декан-1-он. Смесь 1-цианометилциклогексанкарбоновой кислоты метилового эфира (4,28 г, 23,6 ммоль) и гексагидрата хлорида кобальта(II) (2,81 г, 11,8 ммоль) в ТГФ (80 мл) и воде (40 мл), находящуюся при температуре 0 С, обрабатывали порциями боргидрида натрия (4,47 г, 0,118 моль) и нагревали до комнатной температуры и перемешивали в течение 48 ч в атмосфере N2. Данную реакционную смесь обрабатывали 28% гидроксидом аммония (3,1 мл) и фильтровали через суперсель Хифло (Hyflo). Из фильтрата под вакуумом удаляли растворитель и остаток разбавляли минимальным количеством воды и рассола и три раза экстрагировали смесью хлороформ:изопропанол (3:1). Органический слой сушили (Na2SO4) и растворитель удаляли под вакуумом с получением неочищенного продукта, который очищали на силикагеле, используя градиент (0-10%) метанола в CH2Cl2, с получением 1,95 г (54%) указанного в заголовке продукта. Rf=0,46 (9/1 CH2Cl2/метанол). МС (m/z): 154 (М+). Получение 11. 1-(2-Фторэтил)пиперазин-бис-трифторуксусной кислоты соль. Смесь 1-boc-пиперазина (4,08 г, 21,9 ммоль), 1-бром-2-фторэтана (16,68 г, 0,131 моль) иN,N-диизопропилэтиламина (17,0 г, 0,131 моль) в ацетонитриле (40 мл) нагревали до 50 С в течение 16 ч и затем нагревали до температуры дефлегмации дополнительно в течение 7 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель удаляли под вакуумом. Остаток обрабатывали 1 н.NaOH (25 мл) и дважды экстрагировали этилацетатом. Органический слой сушили Na2SO4 и неочищенный продукт очищали на силикагеле, используя градиент (0-10%) метанола в CH2Cl2, с получением 5,01 г(99%) 4-(2-фторэтил)пиперазин-1-карбоновой кислоты трет-бутилового эфира (Rf=0,36 (9/1 CH2Cl2/метанол, I2 краситель). Раствор 4-(2-фторэтил)пиперазин-1-карбоновой кислоты трет-бутилового эфира (2,0 г, 8,62 ммоль) обрабатывали ТФУ (10 мл) в CH2Cl2 (20 мл) и перемешивали при комнатной температуре в течение 2 ч. Растворитель удаляли под вакуумом с получением масла и затем добавляли диэтиловый эфир. Твердое вещество осаждали с получением суспензии, которую фильтровали в потоке N2. Сушили на фильтре с получением 2,73 г (88%) соли указанного в заголовке продукта. МС (m/z): 133 (М+). Получение 12. 2-(4-Бензилокси-2,6-дихлорбензил)-2-азаспиро[4,5]декан-1-он. Раствор 2-азаспиро[4,5]декан-1-она (0,50 г, 3,26 ммоль) в ДМФА (8 мл) обрабатывали 60% гидридом натрия (0,20 г, 5,0 ммоль) и перемешивали при комнатной температуре в течение 20 мин в атмосфере N2. Реакционную смесь охлаждали до 0 С, обрабатывали 2-бромметил-1,3-дихлор-5-бензилоксибензолом (1,24 г, 3,58 ммоль), перемешивали в течение 15 мин при 0 С, нагревали до комнатной температуры и перемешивали в течение 2 ч в атмосфере N2. Реакционную смесь подкисляли 1 н. HCl, реакционную смесь разбавляли диэтиловым эфиром и затем промывали водой. Органический слой сушилиNa2SO4 и растворитель удаляли под вакуумом с получением неочищенного продукта. В результате очистки на силикагеле с использованием градиента (0-100%) этилацетата в гексанах получали 1,23 г (90%) указанного в заголовке продукта. Rf=0,23 (3/1 этилацетат/гексаны). МС (m/z): 418 (М+). Получение 13. 2-(2,6-Дихлор-4-гидроксибензил)-2-азаспиро[4,5]декан-1-он. Смесь 2-(4-бензилокси-2,6-дихлорбензил)-2-азаспиро [4,5] декан-1-она (1,18 г, 2,82 ммоль) и 20% гидроксида палладия(II) на углероде (0,50 г) в этилацетате (100 мл) продували N2 и Н 2 и перемешивали в баллоне с Н 2 в течение 4 ч при комнатной температуре. К смеси добавляли сульфат натрия и фильтровали через суперсель Хифло (Hyflo). Растворитель удаляли под вакуумом и неочищенный продукт очищали на силикагеле, используя изократическое элюирование смесью хлороформ:трет-бутилметиловый эфир- 23015499 при температуре 0 С, обрабатывали трифторметансульфоновым ангидридом (0,87 г, 3,08 ммоль) и перемешивали в течение 1 ч при 0 С в атмосфере N2. Данную реакционную смесь разбавляли CH2Cl2 и промывали 1 н. HCl и водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением 0,83 г (82%) указанного в заголовке продукта. Rf=0,54 (1/1 гексаны/этилацетат). МС (m/z): 460 (М+). Получение 15. 4-(трет-Бутилдифенилсиланилокси)циклогексанкарбоновой кислоты этиловый эфир. Раствор цис/транс 4-гидроксициклогексанкарбоновой кислоты этилового эфира (21,3 г, 0,124 моль) и имидазола (10,10 г, 0,148 моль) в ДМФА (150 мл) обрабатывали трет-бутилдифенилхлорсилил хлоридом (37,39 г, 0,136 моль) и перемешивали в течение 72 ч при комнатной температуре. Данную реакционную смесь разбавляли диэтиловым эфиром и промывали 1 н. НС 1 и водой. Органический слой сушилиNa2SO4 и растворитель удаляли под вакуумом с получением неочищенного продукта. В результате очистки на силикагеле с использованием градиента (0-20%) этилацетата в гексанах получали 40,4 г (80%) указанного в заголовке продукта. Rf=0,49 и 0,29 (5/1 гексаны/этилацетат). Получение 16. 4-(трет-Бутилдифенилсиланилокси)-1-цианометилциклогексанкарбоновой кислоты этиловый эфир. Раствор 4-(трет-бутилдифенилсиланилокси)циклогексанкарбоновой кислоты этилового эфира(21,22 г, 51,7 ммоль) в ТГФ (200 мл), находящийся при температуре -78 С, обрабатывали 2 М раствором диизопропиламида лития в смеси гептан/ТГФ/этилбензол (31 мл, 62,0 ммоль) и перемешивали при -78 С в течение 15 мин в атмосфере N2. Данную реакционную смесь нагревали до -20 С и затем снова охлаждали до -78 С. Реакционную смесь обрабатывали бромацетонитрилом (9,30 г, 77,5 ммоль) и перемешивали при-78 С в течение 1 ч. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Реакционную смесь подкисляли 1 н. HCl, разбавляли этилацетатом и промывали водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением неочищенного продукта,который очищали на силикагеле, используя градиент (0-20%) этилацетата в гексанах, с получением 10,96 г (47%) указанного в заголовке продукта. Rf=0,25 и 0,21 (5/1 гексаны/этилацетат). МС (m/z): 450 (М+). Получение 17. 8-(трет-Бутилдифенилсиланилокси)-2-азаспиро[4,5]декан-1-он. Смесь 4-(трет-бутилдифенилсиланилокси)-1-цианометилциклогексанкарбоновой кислоты этилового эфира (7,19 г, 15,9 ммоль), гексагидрата хлорида кобальта(II) (1,90 г, 7,98 ммоль) в ТГФ (130 мл) и воды (65 мл), находящуюся при температуре 0 С, обрабатывали порциями боргидрида натрия (3,02 г,7,98 ммоль). Нагревали до комнатной температуры и перемешивали в течение 16 ч в атмосфере N2. Реакционную смесь нагревали до 50 С в течение 8 ч, охлаждали до комнатной температуры и перемешивали в течение 16 ч в атмосфере N2. Реакционную смесь обрабатывали 28% гидроксидом аммония (2 мл) и фильтровали через суперсель Хифло (Hyflo). Из фильтрата под вакуумом удаляли растворитель и остаток разбавляли минимальным количеством воды и рассола и три раза экстрагировали смесью хлороформ:изопропанол (3:1). Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением неочищенного продукта. В результате очистки на силикагеле с использованием градиента(9/1 CH2Cl2/метанол). МС (m/z): 408 (М+). Получение 18. цис/транс 2-(4-Бензилокси-2,6-дихлорбензил)-8-(трет-бутилдифенилсиланилокси)-2 азаспиро[4,5]декан-1-он. Раствор 8-(трет-бутилдифенилсиланилокси)-2-азаспиро[4,5]декан-1-она (2,37 г, 5,81 ммоль) в ДМФА (25 мл) обрабатывали 60% гидридом натрия (0,35 г, 8,72 ммоль) и перемешивали при комнатной температуре в течение 15 мин в атмосфере N2. Реакционную смесь охлаждали до 0 С, обрабатывали 5-бензилокси-2-бромметил-1,3-дихлорбензолом (2,21 г, 6,39 ммоль), перемешивали в течение 15 мин при 0 С, нагревали до комнатной температуры и перемешивали в течение 4 ч в атмосфере N2. Реакционную смесь подкисляли 1 н. HCl. Реакционную смесь разбавляли диэтиловым эфиром и промывали водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением неочищенного продукта. В результате очистки на силикагеле с использованием градиента (0-20%) этилацетата в гексанах получали 2,96 г изомера 1 (цис), Rf=0,46 (3/1 этилацетат/гексаны) и 0,236 г изомера 2 (транс), Rf=0,37(25 мл) и этилацетате (5 мл) продували N2 и Н 2 и перемешивали в баллоне с Н 2 в течение 16 ч при комнатной температуре. К смеси добавляли сульфат натрия и фильтровали через суперсель Хифло (Hyflo). Из фильтрата удаляли под вакуумом растворитель с получением 0,229 г (100%) указанного в заголовке продукта. Rf=0,22 (1/1 этилацетат/гексаны).- 24015499 Получение 20. Трифторметансульфоновой кислоты транс 4-[8-(трет-бутилдифенилсиланилокси)-1 оксо-2-азаспиро[4,5]дец-2-илметил]-3,5-дихлорфениловый эфир. Раствор 8-(трет-бутилдифенилсиланилокси)-2-(2,6-дихлор-4-гидроксибензил)-2-азаспиро[4,5]декан 1-она (0,229 г, 0,38 ммоль), пиридина (0,061 г, 0,77 ммоль) и 4-диметиламинопиридина (0,005 г,0,041 ммоль) в CH2Cl2 (25 мл), находящийся при температуре 0 С, обрабатывали трифторметансульфоновым ангидридом (0,167 г, 0,5 9 ммоль) и перемешивали в течение 1 ч при 0 С в атмосфере N2. Реакционную смесь разбавляли CH2Cl2 и промывали 1 н. HCl и водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением 0,230 г (82%) указанного в заголовке продукта. Rf=0,29(3/1 гексаны/этилацетат). Получение 21. транс 4'-[8-(трет-Бутилдифенилсиланилокси)-1-оксо-2-азаспиро[4,5]дец-2-илметил]3',5'-дихлорбифенил-4-карбоновой кислоты метиловый эфир. Смесь трифторметансульфоновой кислоты 4-[8-(трет-бутилдифенилсиланилокси)-1-оксо-2 азаспиро[4,5]дец-2-илметил]-3,5-дихлорфенилового эфира (0,23 г, 0,31 ммоль) и 4-метоксикарбонилфенилбороновой кислоты (0,068 г, 0,38 ммоль) в ТГФ (5 мл) и 2 М карбонате натрия (0,5 мл) продувалиN2. Данную реакционную смесь обрабатывали Pd(PPh3)4 (0,018 г, 0,015 ммоль) и нагревали до 80 С в течение 90 мин в атмосфере N2. Реакционную смесь охлаждали, разбавляли этилацетатом и промывали 1 н.HCl и водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением неочищенного продукта. В результате очистки на силикагеле с использованием градиента (0-100%) этилацетата в гексанах получали 0,22 г (100%) указанного в заголовке продукта. Rf=0,20 (3/1 гексаны/этилацетат). МС (m/z): 700 (М+). Получение 22. транс 4'-[8-(трет-Бутилдифенилсиланилокси)-1-оксо-2-азаспиро[4,5]дец-2-илметил]3',5'-дихлорбифенил-4-карбоновая кислота. Смесь соединения, полученного в получении 21 (0,22 г, 0,31 ммоль), в ТГФ (5 мл) и метанола(0,5 мл) обрабатывали 2 М гидроксидом лития (0,8 мл) и перемешивали в течение 16 ч при комнатной температуре. Реакционную смесь разбавляли этилацетатом и промывали 1 н. HCl и водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением 0,185 г (86%) указанного в заголовке продукта. Rf=0,11 (1/1 гексаны/этилацетат). МС (m/z): 700 (М+). Получение 23. транс 8-(трет-Бутилдифенилсиланилокси)-2-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-2-азаспиро[4,5]декан-1-он. Раствор соединения, полученного в получении 22 (0,183 г, 0,27 ммоль), в CH2Cl2 (8 мл) обрабатывали 1,1'-карбонилдиимидазолом (0,069 г, 0,43 ммоль) и перемешивали в течение 1 ч при комнатной температуре в атмосфере N2. Затем данную реакционную смесь обрабатывали 4-(трифторметил)пиперидином HCl (0,101 г, 0,53 ммоль) и диизопропилэтиламином (0,14 г, 1,09 ммоль) и перемешивали в течение 16 ч при комнатной температуре в атмосфере N2. Эту реакционную смесь разбавляли этилацетатом и промывали 1 н. HCl и водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением неочищенного продукта. В результате очистки на силикагеле с использованием градиента(0,013 г, 0,083 ммоль) в CH2Cl2 (30 мл) объединяли с раствором бромида калия (0,010 г, 0,083 ммоль) в воде (5 мл) и охлаждали до 0 С. К данной реакционной смеси, находящейся при температуре 0 С, добавляли раствор 5,25% NaOCl (3 мл) и NaHCO3 (0,133 г, 1,58 ммоль) и перемешивали в течение 30 мин. Реакционную смесь разбавляли этилацетатом и промывали водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением 0,5479 г (94%) указанного в заголовке продукта.Rf=0,43 (100% этилацетат). МС (m/z): 549 (М+). Получение 25. цис 8-(трет-Бутилдифенилсиланилокси)-2-(3,5-дихлор-4'-фторбифенил-4-илметил)-2 азаспиро[4,5]декан-1-он. Смесь трифторметансульфоновой кислоты 4-[8-(трет-бутилдифенилсиланилокси)-1-оксо-2 азаспиро[4,5]дец-2-илметил]-3,5-дихлорфенилового эфира (1,19 г, 1,63 ммоль) и 4-фторфенилбороновой кислоты (0,27 г, 1,93 ммоль) в ТГФ (24 мл) и 2 М карбонате натрия (2,4 мл) продували N2. Данную реакционную смесь обрабатывали Pd(PPh3)4 (0,094 г, 0,081 ммоль) и нагревали до 80 С в течение 90 мин в атмосфере N2. Реакционную смесь охлаждали, разбавляли этилацетатом и промывали 1 н. HCl и водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением неочищенного продукта. В результате очистки на силикагеле с использованием градиента (0-100%) этилацетата в гексанах получали 0,81 г (76%) указанного в заголовке продукта. Rf=0,47 (3/1 гексаны/этилацетат). МС (m/z): 700 (М+). Получение 26. 2-[3,5-Дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-2 азаспиро[4,5]декан-1,8-дион. Раствор цис 2-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-8- 25015499 гидрокси-2-азаспиро[4,5]декан-1-она (0,232 г, 0,39 ммоль) и 2,2,6,6-тетраметил-1-пиперидинилокси(TEMPO) (0,005 г, 0,032 ммоль) в CH2Cl2 (12 мл) объединяли с раствором бромида калия (0,004 г,0,033 ммоль) в воде (2 мл) и охлаждали до 0 С. Готовили раствор 5,25% NaOCl (1,13 мл) и NaHCO3(0,050 г, 0,5 9 ммоль) и добавляли к данной реакционной смеси, находящейся при температуре 0 С, и полученную смесь перемешивали в течение 30 мин. Реакционную смесь разбавляли этилацетатом и промывали водой. Органический слой сушили (Na2SO4) и растворитель удаляли под вакуумом с получением неочищенного продукта, который очищали на силикагеле, используя градиент (50-100%) этилацетата в гексанах, с получением 0,191 г (83%) указанного в заголовке продукта. Rf=0,32 (100% этилацетат). МС Раствор 2-азаспиро[4,5]декан-1-она (0,138 г, 0,901 ммоль) в ДМФА (5 мл) обрабатывали 60% гидридом натрия (0,054 г, 1,35 ммоль) и перемешивали при комнатной температуре в течение 15 мин в атмосфере N2. Данную реакционную смесь охлаждали до 0 С, обрабатывали 5-бром-2-(бромметил)-1,3 дихлорбензолом (0,316 г, 0,991 ммоль) и перемешивали в течение 15 мин при 0 С. Нагревали до комнатной температуры и перемешивали в течение 2 ч в атмосфере N2. Эту реакционную смесь подкисляли 1 н.HCl. Разбавляли диэтиловым эфиром и промывали водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением неочищенного продукта. В результате очистки на силикагеле с использованием градиента (0-100%) этилацетата в гексанах получали 0,258 г (73%) указанного в заголовке продукта. Rf=0,24 (3/1 этилацетат/гексаны). МС (m/z): 392 (М+). Пример 2. 2-(3,5-Дихлор-4'-фторбифенил-4-илметил)-2-азаспиро[4,5]декан-1-он. Смесь 2-(4-бром-2,6-дихлорбензил)-2-азаспиро[4,5]декан-1-она (0,091 г, 0,23 ммоль) и 4-фторфенилбороновой кислоты (0,097 г, 0,69 ммоль) в толуоле (6 мл) и 2 М карбонате натрия (0,8 мл) продували N2. Данную реакционную смесь обрабатывали Pd(PPh3)4 (0,013 г, 0,011 ммоль) и нагревали до 90 С в течение 2 ч в атмосфере N2. Реакционную смесь охлаждали и разбавляли этилацетатом и затем промывали 1 н. HCl и водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением неочищенного продукта. В результате очистки на силикагеле с использованием градиента Смесь 2-(4-бром-2,6-дихлорбензил)-2-азаспиро[4,5]декан-1-она (0,14 г, 0,36 ммоль) и 4-метоксикарбонилфенилбороновой кислоты (0,19 г, 1,05 ммоль) в толуоле (10 мл) и 2 М карбонате натрия (1,25 мл) продували N2. Данную реакционную смесь обрабатывали Pd(PPh3)4 (0,041 г, 0,035 ммоль) и нагревали до 90 С в течение 4 ч в атмосфере N2. Реакционную смесь охлаждали и разбавляли этилацетатом и затем промывали 1 н. HCl и водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением неочищенного продукта. В результате очистки на силикагеле с использованием градиента Раствор соединения, полученного в примере 3 (0,087 г, 0,19 ммоль), в метаноле (10 мл) обрабатывали 5 н. NaOH (0,60 мл) и перемешивали при комнатной температуре в течение 16 ч. Растворитель удаляли под вакуумом с получением остатка, который подкисляли 1 н. HCl. Данную смесь разбавляли этилацетатом и промывали водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением 0,086 г (100%) указанного в заголовке продукта. МС (m/z): 432 (М+). Раствор соединения, полученного в примере 4 (0,079 г, 0,18 ммоль), в CH2Cl2 (8 мл) обрабатывали 1,1'-карбонилдиимидазолом (0,047 г, 0,29 ммоль) и перемешивали в течение 1 ч при комнатной температуре в атмосфере N2. Затем данную реакционную смесь обрабатывали 4-(трифторметил)пиперидиномHCl (0,087 г, 0,46 ммоль) и диизопропилэтиламином (0,12 г, 0,92 ммоль) и перемешивали в течение 16 ч при комнатной температуре в атмосфере N2. Реакционную смесь разбавляли этилацетатом и промывали 1 н. HCl и водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением неочищенного продукта. В результате очистки на силикагеле с использованием градиента (0-10%) метанола в CH2Cl2 и последующей очистки на силикагеле с использованием изократического элюирования смесью этилацетат/гексаны (50/50) получали 0,067 г (64%) указанного в заголовке продукта. Rf=0, 68 Соединение примера 6 получали с помощью методики, по существу, аналогичной методике, описанной в примере 5, с использованием соединения, полученного в примере 4, и соли 1-(2-фторэтил)пиперазин-бис-трифторуксусной кислоты. В результате очистки на силикагеле получали 0,153 г указанного в заголовке продукта. Rf=0,42 (9:1 CH2Cl2:метанол). МС (m/z): 546 (М+). Пример 7. 2-(2,6-Дихлор-4-морфолин-4-ил-бензил)-2-азаспиро[4,5]декан-1-он. Раствор трифторметансульфоновой кислоты 3,5-дихлор-4-(1-оксо-2-азаспиро[4,5]дец-2 илметил)фенилового эфира (0,15 г, 0,32 ммоль) и морфолина (0,099 г, 1,13 ммоль) в 1-метил-2-пирролидине (2,5 мл) нагревали до 201 С в течение 1,5 ч в микроволновом химическом реакторе. Реакционную смесь охлаждали до комнатной температуры, обрабатывали 2 М LiOH (1 мл) и перемешивали 16 ч при комнатной температуре. Реакционную смесь разбавляли этилацетатом и промывали водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением неочищенного продукта. В результате очистки на силикагеле с использованием изократического элюирования 5% трет-бутилметиловым эфиром в хлороформе получали 0,064 г (50%) указанного в заголовке продукта. Rf=0,22 (9:1 хлороформ:трет-бутилметиловый эфир). МС (m/z): 3 97 (М+). Пример 8. транс 2-[3,5-Дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-8 гидрокси-2-азаспиро[4,5]декан-1-он. Смесь 8-(трет-бутилдифенилсиланилокси)-2-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-2-азаспиро[4,5]декан-1-она (0,19 г, 0,23 ммоль) в ТГФ (6 мл) и воды (3 мл) обрабатывали трифторуксусной кислотой (2 мл), нагревали до температуры дефлегмации и перемешивали в течение 2 ч в атмосфере N2. Реакционную смесь охлаждали, разбавляли этилацетатом и промывали водой и насыщенным NaHCO3. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением неочищенного продукта. В результате очистки на силикагеле с использованием градиента (50-100%) этилацетата в гексанах получали 0,89 г (57%) указанного в заголовке продукта. Rf=0,09 (100% этилацетат). МС (m/z): 583 (М+). Синтез соединения примера 9 выполняли с помощью методики, по существу, аналогичной методике, описанной в примере 8, с использованием изомера 1 (цис) 2-(4-бензилокси-2,6-дихлорбензил)-8-(третбутилдифенилсиланилокси)-2-азаспиро[4,5]декан-1-она, получали 0,185 г указанного в заголовке продукта. Rf=0,15 (100% этилацетат). МС (m/z): 583 (М+). Пример 10. цис-[3,5-Дихлор-4'-(4,4-дифторпиперидин-1-карбонил)бифенил-4-илметил]-8-гидрокси 2-азаспиро[4,5]декан-1-он. Соединение примера 10 получали с помощью методики, по существу, аналогичной методике, описанной в примере 8, с использованием изомера 1 (цис) 2-(4-бензилокси-2,6-дихлорбензил)-8-(третбутилдифенилсиланилокси)-2-азаспиро[4,5]декан-1-она и 4,4-дифторпиперидина HCl. В результате очистки на силикагеле получали 0,64 г указанного в заголовке продукта. Rf=0,14 (100% этилацетат). МС Раствор 2-[3,5-дихлор-4'-(4,4-дифторпиперидин-1-карбонил)бифенил-4-илметил]-2-азаспиро[4,5]декан-1,8-диона (0,386 г, 0,70 ммоль) в метаноле (10 мл), находящийся при температуре 0 С, обрабатывали боргидридом натрия (0,040 г, 1,06 ммоль) и перемешивали в течение 30 мин при 0 С. Данную реакционную смесь подкисляли 1 н. HCl, разбавляли этилацетатом и промывали водой. Органический слой сушили Na2SO4 и растворитель удаляли под вакуумом с получением смеси цис- и транс-изомеров. В результате очистки на силикагеле с использованием градиента (50-100%) этилацета в гексанах получали 0,073 г Синтез соединения примера 12 выполняли с помощью методики, по существу, аналогичной методике, описанной в примере 8, с использованием 8-(трет-бутилдифенилсиланилокси)-2-(3,5-дихлор-4'фторбифенил-4-илметил)-2-азаспиро[4,5]декан-1-она, получали 0,44 г указанного в заголовке продукта. Раствор 2-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-2-азаспиро[4,5]декане-1,8-диона (0,160 г, 0,27 ммоль) в толуоле (4 мл) обрабатывали трет-бутокси-бис(диметиламино)метаном (0,062 г, 0,36 ммоль), нагревали до 90 С и перемешивали в течение 2,5 ч в атмосфере N2. Реакционную смесь охлаждали и растворитель удаляли под вакуумом с получением масла,данное масло растворяли в метаноле (3 мл). Добавляли гидрат гидразина (0,015 г, 0,31 ммоль) и данную реакционную смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере N2. Растворитель удаляли под вакуумом с получением масла и затем масло растворяли в этилацетате. Органический слой экстрагировали водой, сушили Na2SO4 и растворитель удаляли с получением неочищенного продукта. В результате очистки на силикагеле с использованием градиента (0-10%) метанола в CH2Cl2 полу- 28015499 чали 0,109 г (66%) указанного в заголовке продукта. Rf=0,40 (9/1 CH2Cl2/метанол). МС (m/z): 605 (М+). Пример 14. Синтез соединения примера 14 выполняли с помощью методики, по существу, аналогичной методике, описанной в примере 13, с использованием цис-2-(3,5-дихлор-4'-фторбифенил-4-илметил)-8 гидрокси-2-азаспиро[4,5]декан-1-она, получали 0,319 г указанного в заголовке продукта. Rf=0,39 (9/1 Энантиомеры соединения примера 14 разделяли путем хиральной ВЭЖХ (колонка Chiralcel OD 835 см, изократическое элюирование смесью 50:50 3 А этанол:гептан с 0,2% диметилэтиламином,400 мл/мин, УФ-детектирование при 260 нм) с получением 120 мг энантиомера 1 (ее=97,0%) и 96 мг энантиомера 2 (95,6% ее). Аналитическая ВЭЖХ: колонка Chiralcel OD-H 4,6150 мм, изократическое элюирование смесью 50:50 3 А этанол:гептан с 0,2% диметилэтиламином, 0,6 мл/мин, УФ-детектирование при 250 нм, изомер 1 элюируется через 5,5 мин, изомер 2 элюируется через 6,6 мин. ES MC (m/z): 444 (М+). Пример 15 = изомер 1. Пример 16 = изомер 2. Примеры 17 и 18. Энантиомеры соединения примера 13 разделяли путем хиральной ВЭЖХ (колонка Chiralpak AD 533 см, изократическое элюирование смесью 60:40 3 А этанол:гептан с 0,2% диметилэтиламином,150 мл/мин, УФ-детектирование при 270 нм) с получением 32 мг энантиомера 1 (99% ее) и 28 мг энантиомера 2 (98,2% ее). Аналитическая ВЭЖХ: колонка Chiralpak AD-H 4,6150 мм, изократическое элюирование смесью 60:40 3 А этанол:гептан с 0,2% диметилэтиламином, 0,6 мл/мин, УФ-детектирование при 270 нм, изомер 1 элюируется через 11,6 мин, изомер 2 элюируется через 14,7 мин. ES MC (m/z): 605(М+). Пример 17 = изомер 1. Пример 18 = изомер 2. В следующем разделе описан ферментативный и функциональный анализ, применяемый для оценки соединений, предлагаемых согласно настоящему изобретению. Ферментативный анализ 11-HSD типа 1. Активность 11-HSD человека типа 1 измеряли, оценивая выработку НАДФН методом флуоресцентного анализа. При помощи автоматизированной системы Tecan Genesis 200 двадцать микролитров каждого раствора затем переносили в столбец 96-луночного полипропиленового планшета марки Nunc, в котором производят дальнейшее разбавление в 50 раз с последующим двукратным титрованием, десять раз в поперечном направлении планшета с добавлением дополнительного количества ДМСО. Затем планшеты переносили в систему Tecan Freedom 200 с 96-луночной головкой Tecan Temo и планшетным анализатором Ultra 384. Реагенты помещают в 96-луночные полипропиленовые планшеты Nunc и индивидуально распределяют по черным 96-луночным планшетам High Efficiency от Molecular Devices (емкость 40 мкл/лунку): 9 мкл/лунку субстрата (2,22 мМ НАДФ, 55,5 мкМ (микромоль) Кортизола, 10 мМ Трис (гидроксиметиламинометан), 0,25% Prionex, 0,1% Тритона Х 100), 3 мкл/лунку воды в лунки, содержащие соединение, или 3 мкл в лунки с контролями и стандартами, 6 мкл/лунку рекомбинантного фермента 11-HSD человека первого типа, 2 мкл/лунку раствора (разведения) соединения. Для окончательного расчета процентного ингибирования добавляли ряд лунок, которые представляли собой минимум и максимум определения: один набор содержал субстрат с 667 мкМ карбеноксолона (фон), а другой набор содержал субстрат и фермент, но не содержал тестируемого соединения (максимальный сигнал). Затем планшеты на 15 с помещали в шейкер (встряхивающее устройство) механической рукой Tecan, а затем закрывали и помещали в накопитель для инкубирования в течение 3 ч при комнатной температуре. По завершении инкубации механическая рука извлекала каждый планшет по отдельности из накопителя
МПК / Метки
МПК: C07D 487/10, A61P 3/10, C07D 209/44, C07D 403/10, C07D 401/10, A61K 31/4015
Метки: дегидрогеназы, 11-бета-гидроксистероид, ингибиторы, типа
Код ссылки
<a href="https://eas.patents.su/30-15499-ingibitory-11-beta-gidroksisteroid-degidrogenazy-tipa-1.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы 11-бета-гидроксистероид дегидрогеназы типа 1</a>
Предыдущий патент: Способ получения г-ксф человека
Следующий патент: Новые антагонисты мсн рецепторов
Случайный патент: Липидацилтрансфераза и содержащая ее пищевая или кормовая композиция