Новые антагонисты мсн рецепторов
Номер патента: 15500
Опубликовано: 31.08.2011
Авторы: Дао Ен, Спинадзе Патрик Джанпьетро, Гармен Дэвид Джозеф, Грин Стивен Джеймс, Хембр Эрик Джеймс, Люй Цзяньлян, Гардинир Кевин Мэттью, Амегадзи Алберт Кудзови
Формула / Реферат
1. Соединение формулы
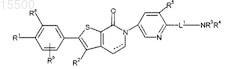
где ---- необязательно представляет собой связь, образующую двойную связь;
R1 независимо выбирают из группы, включающей водород, С1-С4 алкил, галоген, С1-С4галоалкил, С1-С4 алкокси, С1-С4галоалкокси и -О-С3-С4 циклоалкил;
Ra и Rb независимо представляют собой водород, фтор, хлор или метокси;
R2 представляет собой водород или метил;
L1 выбирают из группы, включающей связь, -ОСН2СН2-, -ОСН2СН2СН2-, -C(O)NHCH2CH2-, -C(O)CH2CH2-,
-NHC(O)CH2- и -NHC(O)CH2CH2-, -NHC(O)CH2CH2CH2- и -С(О)NHCH2CH2CH2-;
R3 и R4совместно с атомом азота, к которому они присоединены, образуют необязательно замещенное 4-7-членное гетероциклическое кольцо; или один из R3 и R4совместно с L1 в положении a, b, g или d по отношению к атому азота группы NR3R4 образует азотсодержащее 4-7-членное гетероциклическое кольцо, содержащее L1, а другой означает водород или C1-C4 алкил; при этом каждое 4-7-членное азотсодержащее гетероциклическое кольцо, образованное R3и R4 или L1и любым из R3 и R4, необязательно замещено одной или двумя группами, независимо выбранными из оксо, гидрокси, -OR6, C1-C4алкила, галогена, C1-C4 галоалкила, -C1-С3гидроксиалкила, -С(О)С1-С3 алкила, С3-С6 циклоалкила, NR6R6' и С1-С4 алкилNR6R6';
R5 представляет собой водород, галоген, циано, метил и метокси;
R6 и R6' независимо выбирают из группы, включающей водород, С1-С4алкил, -C1-С3гидроксиалкил, -C1-С3 галоалкил и С3-С4 циклоалкил, или R6и R6' совместно с атомом азота, к которому они присоединены, образуют 4-6-членное азотсодержащее гетероциклическое кольцо, необязательно замещенное группой, выбранной из галогена, C1-C2алкила и гидрокси;
или фармацевтически приемлемая соль, или энантиомер, диастереомер, или смесь диастереомеров указанного соединения.
2. Соединение по п.1, отличающееся тем, что
R1 представляет собой хлор, метокси, фтор, трифторметил или циклопропокси;
Ra и Rb независимо представляют собой водород, фтор или метокси;
R2 представляет собой водород;
L1 выбирают из группы, включающей связь, -С(О)СН2СН2-, -NHC(O)CH2CH2-, -NHC(O)CH2CH2CH2-,
-С(О)NHCH2CH2- и -C(O)NHCH2CH2CH2-;
R3 и R4совместно с атомом азота, к которому они присоединены, образуют необязательно замещенное 4-7-членное азотсодержащее гетероциклическое кольцо; или один из R3 и R4 совместно с L1 в положении a, b или g по отношению к атому азота группы NR3R4 образует 4-7-членное азотсодержащее гетероциклическое кольцо, содержащее L1, а другой означает водород или С1-С4алкил; при этом каждое 4-7-членное азотсодержащее гетероциклическое кольцо, образованное R3и R4 или L1и любым из R3 и R4, выбирают из азетидинила, пирролидинила, морфолино, пиперидинила, пиперазинила и диазепанила, и при этом каждое 4-7-членное азотсодержащее гетероциклическое кольцо необязательно замещено одной или двумя группами, независимо выбранными из ОН, OC1-С3алкила, OC1-C2 галоалкила, NHC1-С2гидроксиалкила, NH2, NHCH3, N(СН3)2, NHциклопропила, N(циклопропил)2, аминозамещенного пирролидинила, фторзамещенного пирролидинила, С(О)СН3 и NHC2-C3 галоалкила; и
R5 представляет собой водород или метил.
3. Соединение по п.1, отличающееся тем, что
R1 представляет собой хлор, метокси, фтор, трифторметил или циклопропокси;
Ra и Rb независимо представляют собой водород, фтор или метокси;
R2 представляет собой водород;
L1 представляет собой связь;
R3 и R4совместно с атомом азота, к которому они присоединены, образуют 4-7-членное азотсодержащее гетероциклическое кольцо, выбранное из группы, включающей пирролидинил, морфолино, пиперидинил и пиперазинил, при этом каждый из них необязательно замещен одной или двумя группами, независимо выбранными из ОН, фтора, OC1-C3алкила, OC1-C2 галоалкила, NHC1-С2гидроксиалкила, NH2, NHCH3, N(СН3)2, NHциклопропила, N(циклопропил)2, фторзамещенного пирролидинила, С(О)СН3 и NHC2-C3 галоалкила;
R5 представляет собой водород или метил.
4. Соединение по п.1, отличающееся тем, что
R1 представляет собой хлор, метокси, фтор, трифторметил или циклопропокси;
Ra и Rb независимо представляют собой водород, фтор или метокси;
R2 представляет собой водород;
L1 выбирают из группы, включающей связь, -С(О)СН2СН2-, -NHC(O)CH2CH2-, -NHC(O)CH2CH2CH2-,
-С(О)NHCH2CH2- и -C(O)NHCH2CH2CH2-;
R3 и R4совместно с атомом азота, к которому они присоединены, образуют необязательно замещенное 4-7-членное азотсодержащее гетероциклическое кольцо; или один из R3 и R4 совместно с L1 в положении a, b или g по отношению к атому азота группы NR3R4 образует 4-6-членное азотсодержащее гетероциклическое кольцо, содержащее L1, а другой означает водород или С1-С4алкил; при этом каждое 4-7-членное азотсодержащее гетероциклическое кольцо, образованное R3и R4 или L1и любым из R3 и R4, выбирают из азетидинила, пирролидинила, морфолино, пиперидинила, пиперазинила и диазепанила, при этом каждое 4-7-членное азотсодержащее гетероциклическое кольцо необязательно замещено одной или двумя группами, независимо выбранными из ОН, фтора, OC1-С3 алкила, OC1-С2галоалкила, NHC1-С2гидроксиалкила, NH2, NHCH3, N(СН3)2, NHциклопропила, N(циклопропил)2, аминозамещенного пирролидинила, фторзамещенного пирролидинила, С(О)СН3 и NHC2-C3 галоалкила; и
R5 представляет собой водород или метил.
5. Соединение, выбранное из группы, включающей
2-(4-хлорфенил)-6-[6-((S)-3-диметиламинопирролидин-1-ил)пиридин-3-ил]-6Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
2-(4-хлорфенил)-6-[6-((R)-3-диметиламинопирролидин-1-ил)-5-метилпиридин-3-ил]-6Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
2-(4-хлорфенил)-6-[6-((R)-3-диметиламинопирролидин-1-ил)пиридин-3-ил]-5,6-дигидро-4Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
2-(4-хлорфенил)-6-[6-((R)-3-диметиламинопирролидин-1-ил)-5-метилпиридин-3-ил]-5,6-дигидро-4Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
2-(4-хлорфенил)-6-(4-диметиламино-3,4,5,6-тетрагидро-2Н-[1,2']бипиридинил-5'-ил)-6Н-тиено[2,3-c]пиридин-7-он, дигидрохлорид;
6-{6-[(S)-3-(2,2-дифторэтиламино)пирролидин-1-ил]пиридин-3-ил}-2-(4-фторфенил)-6Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
2-(4-хлорфенил)-6-{6-[(R)-3-(2,2-дифторэтиламино)пирролидин-1-ил]пиридин-3-ил}-6Н-тиено[2,3-с]пиридин-7-он, гидрохлорид;
2-(4-хлорфенил)-6-[6-(4-метилпиперазин-1-ил)пиридин-3-ил]-6Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
6-[6-(R)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(4-трифторметоксифенил)-6Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
6-[6-(R)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(3-фтор-4-метоксифенил)-6Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
6-[6-(R)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(2-фтор-4-метоксифенил)-6Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
6-[6-(R)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(4-фторфенил)-6Н-тиено[2,3-е]пиридин-7-он, гидрохлорид;
6-[6-(3-(S)-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(2-фтор-4-метоксифенил)-5,6-дигидро-4Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
6-[6-(R)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(2-фтор-4-метоксифенил)-5,6-дигидро-4Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
6-[6-(S)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(4-трифторметоксифенил)-5,6-дигидро-4Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
6-[6-(R)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(4-трифторметоксифенил)-5,6-дигидро-4Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
6-[6-(S)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(4-метоксифенил)-5,6-дигидро-4Н-тиено[2,3-c] пиридин-7-он, гидрохлорид;
6-[6-(R)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(4-метоксифенил)-5,6-дигидро-4Н-тиено[2,3-c] пиридин-7-он, гидрохлорид;
6-[6-(S)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(4-трифторметилфенил)-5,6-дигидро-4Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
6-[6-(R)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(4-трифторметилфенил)-5,6-дигидро-4Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
6-[6-(S)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(3-фтор-4-метоксифенил)-5,6-дигидро-4Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
6-[6-(R)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(3-фтор-4-метоксифенил)-5,6-дигидро-4H-тиено[2,3-c]пиридин-7-он, гидрохлорид;
2-(4-циклопропоксифенил)-6-[6-(S)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-5,6-дигидро-4Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
6-[6-(S)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(4-фторфенил)-5,6-дигидро-4Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
6-[6-(R)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-2-(4-фторфенил)-5,6-дигидро-4Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
2-(3,4-дифторфенил)-6-[6-(R)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-6Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
2-(4-циклопропоксифенил)-6-[6-(S)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-6Н-тиено[2,3-с]пиридин-7-он, гидрохлорид;
2-(4-циклопропоксифенил)-6-[6-(R)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-6Н-тиено[2,3-с]пиридин-7-он, гидрохлорид;
2-(2,4-дифторфенил)-6-[6-(S)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-6Н-тиено[2,3-c]пиридин-7-он, дигидрохлорид;
2-(2,4-дифторфенил)-6-[6-(R)-(3-диметиламинопирролидин-1-ил)пиридин-3-ил]-6Н-тиено[2,3-е]пиридин-7-он, дигидрохлорид;
(±)-транс-2-(4-хлорфенил)-6-[6-(3-диметиламино-4-гидроксипирролидин-1-ил)пиридин-3-ил]-6Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
2-(4-хлорфенил)-6-[6-((R)-3-диметиламинопирролидин-1-ил)пиридин-3-ил]-6Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
2-(4-хлорфенил)-6-[6-((R)пирролидин-3-илокси)пиридин-3-ил]-6Н-тиено[2,3-е]пиридин-7-он, гидрохлорид;
2-(4-хлорфенил)-6-[6-((S)-3-метиламинопирролидин-1-ил)пиридин-3-ил]-6Н-тиено[2,3-е]пиридин-7-он, гидрохлорид;
2-(4-хлорфенил)-6-[6-((R)-3-метиламинолирролидин-1-ил)пиридин-3-ил]-6Н-тиено[2,3-е]пиридин-7-он, гидрохлорид;
6-[6-((R)-3-аминопирролидин-1-ил)пиридин-3-ил]-2-(4-хлорфенил)-6Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
2-(4-хлорфенил)-6-[6-((R)-3-метиламинопирролидин-1-ил)пиридин-3-ил]-5,6-дигидро-4Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
2-(4-хлорфенил)-6-[6-((R)-3-циклопропиламинопирролидин-1-ил)пиридин-3-ил]-5,6-дигидро-4Н-тиено[2,3-c]пиридин-7-он, гидрохлорид;
(±)-цис-2-(4-хлорфенил)-6-[6-(3-фтор-4-метиламинопирролидин-1-ил)пиридин-3-ил]-5,6-дигидро-4Н-тиено[2,3-c]пиридин-7-он, гидрохлорид.
Текст
ИСПРАВЛЕННОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ 2007.06.08 НОВЫЕ АНТАГОНИСТЫ МСН РЕЦЕПТОРОВ Настоящее изобретение относится к соединению, представляющему собой антагонист меланинконцентрирующего гормона формулы (I) где R1, Ra, Rb, R2, L1, R3, R4 и R5 такие, как определены в описании, или фармацевтически приемлемая соль, энантиомер, диастереомер или смесь диастереомеров указанного соединения, которые можно применять при лечении ожирения и связанных с ним заболеваний. Примечание: библиография отражает состояние при переиздании(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 015500 Область изобретения Настоящее изобретение относится к области медицины, в частности к области лечения ожирения и связанных с ним заболеваний. Уровень техники Меланин-концентрирующий гормон (melanin concentrating hormone, MCH) представляет собой нейропептид, содержащий остатки 19 аминокислот, образующийся в латеральной гипоталамической области и в неопределенной зоне (zona incerta). Имеется большое количество данных, подтверждающих активность МСН в отношении возбуждения аппетита. Как сообщалось, мыши с генотипом MCHR1-/- отличаются худобой и чрезвычайно быстрым обменом веществ, что указывает на то, что R1-изоформа обуславливает, по меньшей мере, некоторые из метаболических эффектов МСН. В публикации международной заявки WO 03/033476 А 1 описаны пиримидиноны в качестве антагонистов рецептора меланин-концентрирующего гормона. В публикации международной заявки WO 2005/047293 А 1 описаны соединения, которые, как указано, можно применять в качестве МСН антагонистов. В работе Dyck, В. et al. (Journal of Medicinal Chemistry (2006) 49(13) 3753-3756) в статье, озаглавленной "A Thienopyridazinone-Based Melanin-Concentrating Hormone Receptor 1 Antagonist with Potent InVivo Anorectic Properties" описаны соединения тиенопиридазинона, которые можно применять в качестве МСН антагонистов. В настоящее время существует потребность в высокоактивных, селективных и терапевтически эффективных препаратах для более эффективного регулирования пищевых привычек, минимизации риска развития ожирения, лечения и/или облегчения нарушений вследствие ожирения и связанных с ним заболеваний. В настоящем изобретении предложены особенно предпочтительные соединения, обладающие высокой активностью, селективностью и/или эффективностью in vivo в качестве МСН антагонистов, которые можно применять для лечения ожирения и связанных с ним заболеваний. Краткое описание изобретения Настоящее изобретение относится к соединению формулы I гденеобязательно представляет собой связь, образующую двойную связь;R1 независимо выбирают из группы, включающей водород, С 1-С 4 алкил, галоген, С 1-С 4 галоалкил,С 1-С 4 алкокси, С 1-С 4 галоалкокси и -О-С 3-С 4 циклоалкил;Ra и Rb независимо представляют собой водород, фтор, хлор или метокси;R2 представляет собой водород или метил;R3 и R4 совместно с атомом азота, к которому они присоединены, образуют необязательно замещенное 4-7-членное гетероциклическое кольцо; или один из R3 и R4 совместно с L1 в положении , ,илипо отношению к атому азота группы NR3R4 образует азотсодержащее 4-7-членное гетероциклическое кольцо, содержащее L1, а другой означает водород или C1-C4 алкил; при этом каждое 4-7-членное азотсодержащее гетероциклическое кольцо, образованное R3 и R4 или L1 и любым из R3 и R4, необязательно замещено одной или двумя группами, независимо выбранными из оксо, гидрокси, -OR6, C1-C4 алкила, галогена, С 1-С 4 галоалкила, -C1-С 3 гидроксиалкила, -С(О)С 1-С 3 алкила, С 3-С 6 циклоалкила, NR6R6' и С 1-С 4 алкилNR6R6';R6 и R6' независимо выбирают из группы, включающей водород, С 1-С 4 алкил, -C1-С 3 гидроксиалкил,-C1-С 3 галоалкил и С 3-С 4 циклоалкил, или R6 и R6' совместно с атомом азота, к которому они присоединены, образуют 4-6-члеиное азотсодержащее гетероциклическое кольцо, необязательно замещенное группой, выбранной из галогена, C1-С 2 алкила и гидрокси; или фармацевтически приемлемая соль или энантиомер, диастереомер или смесь диастереомеров указанного соединения. Настоящее изобретение также относится к соединению, выбранному из группы, включающей 2-(4-хлорфенил)-6-[6-S)-3-диметиламинопирролидин-1-ил)пиридин-3-ил]-6 Н-тиено[2,3-c]пиридин-7-он, гидрохлорид; 2-(4-хлорфенил)-6-[6-R)-3-диметиламинопирролидин-1-ил)-5-метилпиридин-3-ил]-6 Н-тиено[2,3c]пиридин-7-он, гидрохлорид; 2-(4-хлорфенил)-6-[6-R)-3-диметиламинопирролидин-1-ил)пиридин-3-ил]-5,6-дигидро-4 Нтиено[2,3-c]пиридин-7-он, гидрохлорид;-цис-2-(4-хлорфенил)-6-[6-(3-фтор-4-метиламинопирролидин-1-ил)пиридин-3-ил]-5,6-дигидро 4 Н-тиено[2,3-c]пиридин-7-он, гидрохлорид. Подробное описание изобретения Для целей настоящего изобретения в настоящем описании и/или прилагаемой формуле изобретения применяют следующие термины и определения, если не указано иное. Общепринятые химические термины, применяемые при описании рассматриваемых в документе соединений, употребляются в их обычном значении. Например, термин "C1-C4 алкил" относится к прямой или разветвленной алифатической цепи из 1-4 атомов углерода (или сколько указано) и их изомерам,в том числе, но не ограничиваясь ими, метилу, этилу, пропилу, изопропилу, н-бутилу и тому подобное,как указано в настоящем описании. Термин "С 3-С 6 циклоалкил" относится к насыщенному карбоциклическому кольцу, имеющему от 3 до 6 углеродных атомов, в том числе циклопропилу, циклобутилу, циклопентилу и циклогексилу. Аналогичным образом термин "С 3-С 4 циклоалкил" относится к группе, включающей циклопропил и циклобутил. Термин "С 3-С 6 галоалкил" включает термин "С 3-С 5 галоалкил" и т.д. Термин "галоген" относится к галогену, т.е. хлору, брому, йоду и фтору. Термин "С 1-С 4 галоалкил" относится к C1-C4 алкильной группе, замещенной одним, двумя, тремя или более атомами галогена, как указано в настоящем описании или допустимо с точки зрения химии. Примеры С 1-С 4 галоалкила включают, но не ограничиваются ими, трифторметил, хлорэтил и 2 хлорпропил. Аналогичным образом, "С 2-С 3 галоалкил" представляет собой метильную или этильную группу, замещенную атомами галогена в количестве от одного до максимально необязательного количества, предпочтительно атомами хлора или фтора. Для специалиста в данной области техники очевидно,что С 1-С 4 галоалкил включает C1-С 3 галоалкил и С 2-С 3 галоалкил."C1-C4 алкоксигруппа" представляет собой C1-C4 алкильную (или как указано) группу, присоединенную через атом кислорода. Примеры алкоксигрупп включают, но не ограничиваются ими, метокси (ОМе), этокси (-OEt), пропокси (-OPr), изопропокси (-OiPr), бутокси (-OBu) и т.д. Аналогичным образом термин "C1-С 3 алкокси" включает метокси (-ОМе), этокси (-OEt), пропокси (-OPr), изопропокси (-OiPr). Подобным образом C1-С 2 алкокси включает ОМе и OEt группы. Термин "С 1-С 4 галоалкокси" включает С 1-С 4 алкокси, где один или несколько атомов водорода в алкиле были заменены на галоген. Примеры галоалкоксигрупп включают дифторметокси, трифторметокси,2-галоэтокси, 2,2,2-трифторэтокси, 4,4,4-трифторбутокси и др. аналогичные группы, имеющие указанное количество углеродных атомов. Например, C1-С 2 галоалкокси включает OCF3 и OCH2CH2F группы и другие группы, имеющие один или два углеродных атома и подходящее количество атомов галогена. Термин "C1-С 3 гидроксиалкил" включает одновалентный радикал спирта, в том числе метанола,этанола, пропанола и изопропанола, присоединенный к другой группе в виде терминальной группы. Аналогичные термины используют для обозначения спиртов, имеющих указанное количество углеродных атомов. Например, C1-С 2 гидроксиалкил включает метанол и этанол. Согласно изобретению термин "C1-C4 алкил" также включает конкретный алкил, который при присоединении может приводить к появлению хиральности. Такие образующиеся хиральные соединения также являются объектами настоящего изобретения. Термины , , или относятся, соответственно, к 1, 2, 3 или 4 положениям атомов при отсчете в направлении против часовой стрелки от атома азота группы NR3R4 в формуле I. Термины ,, или обозначают положение в соединении формулы I, где один из R3 и R4 образует гетероциклическое кольцо совместно с атомом в цепи L1 (мостик L1). Для специалиста в данной области техники очевидно, что объединение R3 и R4 или объединение R3 или R4 с L1 с образованием 4-7-членного азотсодержащего гетероциклического кольца, как описано в настоящем документе, требует отщепления одного или двух атомов водорода от СН или СН 2 группы или, при необходимости, от одной или обеих объединяющихся групп. Кроме того, в настоящем описании подразумевается, что если один из R3 и R4 совместно с L1 образует (4-7-членное) азотсодержащее гетероциклическое кольцо, второй из R3 и R4 представляет собой атом водорода или возможный заместитель в вышеуказанном кольце, при этом возможные заместители определены ниже или указаны для конкретной группы соединений формулы I. Термин "азотсодержащий гетероциклический" означает насыщенный, частично ненасыщенный,полностью ненасыщенный или ароматический 4-, 5-, 6- или 7-членный (или как определено иначе), необязательно имеющий дополнительные гетероатомы, выбранные из азота и кислорода. Типичные гете-3 015500 роциклические группы включают азетидинил, морфолинил, пиперидил, пиперазинил, диазепанил и пирролидинил. Соответственно применяемый в настоящем документе термин "4-7-членная азотсодержащая гетероциклическая группа" включает по отдельности и/или в совокупности 4-6-, 5-6-, 5-7- и 4-7-членные азотсодержащие гетероциклические группы. Применяемый в настоящем документе термин "оксо" означает атом кислорода, присоединенный к углеродному атому, который является частью кольца или цепи, с образованием карбонильной группы. В настоящем изобретении предложены химически стабильные соединения, при этом специалисту в данной области известна конкретная комбинация заместителей в пределах определенной в настоящем документе области, которая обеспечивает химическую стабильность, в том числе соответствующее добавление или удаление атома (атомов) водорода с целью получения описанного и/или предполагаемого химически стабильного соединения. Термин "подходящий растворитель" относится к любому растворителю или смеси растворителей,инертных в условиях протекающей реакции, который обеспечивает достаточную солюбилизацию реагирующих веществ и создает среду для проведения требуемой реакции. Используемый в настоящем документе термин "пациент" относится к людям, домашним животным(например, собакам и кошкам и т.п.) и домашнему скоту. Термины "лечение", "лечить" и "лечащий" включают улучшение, прекращение, ограничение, замедление и обратное прогрессирование заболевания или снижение степени тяжести патологических симптомов ожирения и связанных с ним заболеваний. Используемый в настоящем документе термин "терапевтически эффективное количество" означает количество соединения согласно настоящему изобретению, т.е. соединения формулы I, которое способно обеспечивать излечение симптомов различных патологических состояний, описанных в настоящем документе. Термин "фармацевтически приемлемый" используется в настоящем документе как прилагательное и означает "по существу, невредный" для принимающего препарат пациента. Используемые в настоящем документе термины "заболевания, связанные с ожирением" или "связанные заболевания" относятся к симптомам, заболеваниям или состояниям, которые вызваны ожирением, обостряются при ожирении, спровоцированы ожирением или сопутствуют ожирению. Указанные заболевания, состояния и/или симптомы включают, но не ограничиваются ими, расстройства пищевого поведения (булимию, нервную анорексию и т.д.), диабеты, диабетические осложнения, диабетическую ретинопатию, депрессию, тревожное состояние, повышенное кровяное давление, внутримозговое кровоизлияние, застойную сердечную недостаточность, атеросклероз, ревматоидный артрит, инсульт, гиперлипидемию, гипертригликемию, гипергликемию и гиперлипопротеинемию. Фармацевтически приемлемые соли и методики их получения хорошо известны опытному специалисту в данной области. См., например, P. Stahl, et al. Handbook of Pharmaceutical Salts: Properties, Selections and Use (VCHA/Wiley-VCH, 200); S.M. Berge, et al., "Pharmaceutical Salts" Journal of PharmaceuticalSciences, Vol. 66, No. 1, January 1977. Предпочтительные соединения согласно изобретению Некоторые соединения, предложенные в настоящем изобретении, представляют особый интерес и являются предпочтительными. В предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы I, в которомRa и Rb независимо представляют собой водород, фтор или метокси;R3 и R4 совместно с атомом азота, к которому они присоединены, образуют необязательно замещенное 4-7-членное азотсодержащее гетероциклическое кольцо; или один из R3 и R4 совместно с L1 в положении ,илипо отношению к атому азота группы NR3R4 образует 4-7-членное азотсодержащее гетероциклическое кольцо, содержащее L1, а другой означает водород или С 1-С 4 алкил; при этом каждое 4-7-членное азотсодержащее гетероциклическое кольцо, образованное R3 и R4 или L1 и любым из R3 и R4,выбирают из азетидинила, пирролидинила, морфолино, пиперидинила, пиперазинила и диазепанила, и при этом каждое 4-7-членное азотсодержащее гетероциклическое кольцо необязательно замещено одной или двумя группами, независимо выбранными из ОН, OC1-С 3 алкила, OC1-C2 галоалкила, NHC1-C2 гидроксиалкила, NH2, NHCH3, N(СН 3)2, NHциклопропила, N(циклопропил)2, аминозамещенного пирролидинила, фторзамещенного пирролидинила, С(О)СН 3 и NHC2-C3 галоалкила; иR5 представляет собой водород или метил. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы I, в которомRa и Rb независимо представляют собой водород, фтор или метокси;R3 и R4 совместно с атомом азота, к которому они присоединены, образуют 4-7-членное азотсодержащее гетероциклическое кольцо, выбранное из группы, включающей пирролидинил, морфолино, пиперидинил и пиперазинил, при этом каждый из них необязательно замещен одной или двумя группами,независимо выбранными из ОН, фтора, OC1-С 3 алкила, ОС 1-С 2 галоалкила, NHC1-C2 гидроксиалкила,NH2, NHCH3, N(СН 3)2, NHциклопропила, N(циклопропил)2, фторзамещенного пирролидинила, С(О)СН 3 и NHC2-C3 галоалкила;R5 представляет собой водород или метил. В ещ одном предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы I, в которомRa и Rb независимо представляют собой водород, фтор или метокси;R3 и R4 совместно с атомом азота, к которому они присоединены, образуют необязательно замещенное 4-7-членное азотсодержащее гетероциклическое кольцо; или один из R3 и R4 совместно с L1 в положении ,илипо отношению к атому азота группы NR3R4 образует 4-6-членное азотсодержащее гетероциклическое кольцо, содержащее L1, а другой означает водород или С 1-С 4 алкил; при этом каждое 4-7-членное азотсодержащее гетероциклическое кольцо, образованное R3 и R4 или L1 и любым из R3 и R4,выбирают из азетидинила, пирролидинила, морфолино, пиперидинила, пиперазинила и диазепанила, при этом каждое 4-7-членное азотсодержащее гетероциклическое кольцо необязательно замещено одной или двумя группами, независимо выбранными из ОН, фтора, OC1-С 3 алкила, OC1-С 2 галоалкила, NHC1-C2 гидроксиалкила, NH2, NHCH3, N(CH3)2, NHциклопропила, N(циклопропил)2, аминозамещенного пирролидинила, фторзамещенного пирролидинила, С(О)СН 3 и NHC2-C3 галоалкила; иR5 представляет собой водород или метил. Получение соединений согласно настоящему изобретению Соединения формулы I можно получить с помощью различных процедур, известных в данной области техники и описанных ниже. Продукты, получаемые на каждой стадии в соответствии со схемой,приведенной ниже, можно выделить обычными способами, в том числе путем экстракции, испарения,осаждения, хроматографии, фильтрации, растирания в порошок, кристаллизации и т.п. На схемах, приведенных ниже, все вещества, если не указано иное, определены ранее, а подходящие реагенты являются хорошо известными в данной области техники. Схема 1 Синтез промежуточного соединения формулы (5) можно провести в соответствии с реакциями,представленными на схеме 1. Согласно схеме 1 на стадии 1 карбамат формулы (I) превращают в лактам формулы (3) с помощью реакции ацилирования Фриделя-Крафтса. Например, карбамат (1) растворяют в избытке фосфористого оксихлорида и обрабатывают фосфористым пентоксидом примерно при 100-130 С. Альтернативным образом, на стадии 2 лактам формулы (3) можно получить путем расширения цикла кетона формулы (2) за счет обработки гидроксиламином и избытком ацетата натрия в спиртовом растворителе, таком как МеОН или EtOH. Промежуточное соединение, представляющее собой имин,выделяют с помощью фильтрации и обрабатывают сильной кислотой, такой как полифосфорная кислота,примерно при 100-150 С с получением лактама (3). Бромирование тиофенового кольца с получением бромтиофена (4) проводят путем обработки бромом в подходящем растворителе, таком как уксусная кислота, вода или четыреххлористый углерод. В бромтиофен формулы (4) на стадии 4 вводят функциональную группу собразованием арилтиофена формулы (5) с помощью подходящей катализируемой металлом реакции кросс-сочетания, хорошо известной специалистам в данной области. Например, бромтиофен (4) обрабатывают арилборной кислотой в таком растворителе, как ацетонитрил, ДМФ, толуол, вода и т.д. В реакции арилирования участвуют основание, такое как карбонат калия, и палладиевый катализатор, такой как Pd(OAc)2, Pd(PPh3)4 илиPd(PPh3)2Cl2 и т.д., как правило, при добавлении фосфинового лиганда, такого как PPh3. Как понятно специалисту, соединения формулы (1) и (2) можно легко синтезировать способами,аналогичными описанным в настоящем документе, используя процедуры, хорошо известные в данной области. Например, соединения формулы (1) получают путем восстановления тиофен-3-ацетонитрила до амина и последующим взаимодействием с этилхлорформиатом. Кетон формулы (2) без труда получают согласно Aparajithan, K., et. al. J. Heterocyclic Chem. 1966, 3, 466. Схема 2 Синтез соединений формулы (8) можно осуществить способами, представленными на схеме 2. Подходящее соединение формулы (9) представляет собой соединение, в котором Х=Cl или Br и R2 определено при описании формулы (I). Подходящее соединение формулы (8) представляет собой соединение, в котором R1, Ra, Rb и R2 определены при описании формулы (I). Согласно схеме 2 на стадии 1 ацилазид формулы (6) подвергают циклизации при нагревании с образованием тиенопиридинона формулы (7). Например, ацилазид (6) растворяют в диоксане и добавляют по каплям в предварительно нагретую колбу (230 С), содержащую Dowtherm А. В бромтиенопиридинон формулы (7) вводят функциональную группу с образованием арилтиенопиридинона с помощью катализируемой металлом реакции кросс-сочетания, как описано выше для схемы 1, стадии 4. Согласно схеме 2 соединения формулы (8) можно также получить способами, представленными на стадиях 3, 4 и 5. На стадии 3 5-галотиофен формулы (9) превращают в арилтиофен формулы (10) путем проведения катализируемой металлом реакции кросс-сочетания с участием арилбороновой кислоты. Например, 5-галотиофен формулы (9), где X=Cl, растворяют в растворителе, таком как этанол, и обрабатывают арилбороновой кислотой в присутствии основания, такого как карбонат натрия, калия или цезия. Палладиевый катализатор добавляют в виде [1,3-бис-(2,6-диизопропилфенил)имидазол-2-илиден-(3 хлорпиридил)]палладий(II) дихлорида и реакцию проводят в диапазоне температур от примерно комнатной температуры до примерно температуры кипения с обратным холодильником выбранного растворителя. На стадии 4 ацеталь формулы (10) превращают в альдегид формулы (11) в кислой среде, при этом подходящие среды хорошо известны в данной области техники. Предпочтительные условия предполагают применение трифторуксусной кислоты. Согласно схеме 2 на стадии 5 альдегид формулы (11) подвергают циклизации за счет внутримолекулярной конденсации с получением тиенопиридинона формулы (8) в кислой среде. Предпочтительные условия предполагают применение трифторметансульфоновой кислоты в качестве растворителя в диапазоне температур примерно от 50 до 150 С в течение примерно от 1 до 5 ч. Продукт выделяют, выливая реакционную смесь в холодную воду, а затем отфильтровывая. Как можно легко понять, соединения формулы (6) и (9) можно синтезировать с помощью способов и процедур, которые описаны в настоящем документе или известны в данной области техники. Например, соединения формулы (6) получают путем превращения соответствующей кислоты (Gronowitz, S.;Ander, I. Chemica Scripta 1980, 15, 145) в хлорангидрид и последующей реакции с азидом натрия с получением ацилазида формулы (6). Соединения формулы (9) получают путем ацилирования 5-галотиофен-2 карбоновой кислоты с помощью 2,2-диэтоксиэтиламина. Синтез соединений формулы (I) можно осуществить способами, представленными на схеме 3. Подходящее соединение формулы (8 а) представляет собой соединение, в котором R1, Ra, Rb и R2 определены при описании формулы (I), а подходящее соединение формулы (12) представляет собой соединение, в котором L1, R3, R4 и R5 определены при описании формулы (I), а Х=Br, I или OS(O2)CF3 (трифлат). Например, соединение формулы (8 а) реагирует с соединением формулы (12) в условиях каталитической реакции кросс-сочетания, такой как арилирование амида по Бухвальду (Yin, J.; Buchwald, S. J. J.Am. Chem. Soc. 2002, 124(21), 6043-6048). При проведении реакции сочетания используют основание,например Cs2CO3, палладиевый реагент, например Pd2dba3, и фосфиновый лиганд, например Xantphos, в апротонном растворителе, таком как диоксан, толуол или бензол. Реакцию, как правило, проводят в диапазоне температур от примерно КТ до примерно температуры кипения с обратным холодильником выбранного растворителя. Альтернативным образом, реакцию проводят в присутствии меди. Например, соединение формулы(8 а) растворяют в толуоле или диоксане и обрабатывают соединением формулы (12), используя K2CO3 или предпочтительно Cs2CO3 (от 1,5 до 2,0 экв.), N,N'-диметилэтан-1,2-диамин (от 0,2 до 0,5 экв.) и CuI(от 0,1 до 0,5 экв.). Реакционную смесь перемешивают при температуре примерно от 80 до 110 С. Как можно легко понять, соединения формулы (12) можно без труда получить, используя способы,аналогичные описанным в настоящем документе, или с помощью процедур, которые хорошо известны и используются в данной области техники. Например, соединения формулы (12) получают с помощью реакции пиридилфторида или хлорида со спиртом или амином по механизму нуклеофильного замещения. Амидную связь получают путем ацилирования пиридилкарбоновой кислоты алкиламином. Соединения формулы (12), где L1 представляет собой функциональную группу кетона, можно получить с помощью реакции амида Вайнреба с (5-бром-2-пиридинил)литием. Специалисту в данной области техники известно, что характер и последовательность реакций зависит от природы L1. Также общеизвестно, что стадии,необходимые для получения соединения формулы (12), можно осуществить в любом порядке, в том числе после проведения реакции части соединения формулы (12) с соединением формулы (8 а), так что последующие стадии замещения, ацилирования, арилирования, алкилирование, восстановительного аминирования и т.д. обеспечивают образование соединения формулы (I). Соответственно, в R3 и R4 можно дополнительно вводить функциональные группы после реакции сочетания, используя стандартные способы, известные в данной области техники. Схема 4 Синтез соединений формулы (17) можно осуществить способами, представленными на схеме 4. Подходящее соединение формулы (13) представляет собой соединение, в котором R2 определено при описании формулы (I), a X представляет собой Br или I. Согласно схеме 4 на стадии 1 тиофенлактон формулы (13) превращают в амид формулы (15) с помощью обычной методики Вайнреба (Basha, Anwer; Lipton, M.; Weinreb, Steven M. Tetrahedron Letters,1977, 48, 4171). Например, аминопиридин формулы (14) растворяют в апротонном растворителе, таком как CH2Cl2 или толуол, и обрабатывают 2-2,5M раствором Me3Al в гексане. Образовавшийся раствор перемешивают при температуре в интервале от примерно 0 С до комнатной температуры и затем обрабатывают лактоном формулы (13). Образовавшийся раствор перемешивают в диапазоне между примерно комнатной температурой и 110 С в течение примерно от 3 до 24 ч с получением амида.-7 015500 Согласно схеме 4 на стадии 2 реакцию циклизации с образованием лактама формулы (16) можно осуществить по меньшей мере двумя различными способами, как описано ниже. Согласно первому способу спирт формулы (15) превращают в уходящую группу, предпочтительно мезилат, путем реакции с метансульфонилхлоридом в присутствии подходящего основания, такого как триэтиламин. Промежуточное соединение, представляющее собой мезилат, выделяют, обрабатывая водой и немедленно растворяют в полярном безводном растворителе, таком как ДМФ, и обрабатывают основанием, таким как гидрид натрия (1,5 экв.) примерно при 0-25 С. Согласно второму способу можно также использовать реакцию Мицунобу (Maligres, Р.E.; et al. J.Het. Chem. 2003, 40(2), 229-241). Например, амид формулы (12) растворяют в подходящем безводном растворителе, подобном ТГФ, CH2Cl2, толуолу и т.д., и обрабатывают триалкил- или триарилфосфином,таким как Me3P, Bu3P или Ph3P, и диалкилазодикарбоксилатом, таким как DEAD или DIAD, при температуре в интервале от примерно 0 С до комнатной температуры. Согласно схеме 4 на стадии 3 в лактам формулы (16) дополнительно вводят функциональную группу, используя катализируемую металлом реакцию кросс-сочетания, как описано для схемы 1, стадии 4, с получением арилтиофена формулы (17). Следует принимать во внимание, что соединения формулы (13) и (14) без труда можно получить способами, аналогичными описанным в настоящем документе, или путем применения процедур, которые хорошо известны и используются в данной области техники. Например, 2-тиофен-3-ил-этанол можно превратить в хлорформиат, используя трифосген, с последующей циклизацией с образованием лактона(тиофенлактона), путем применения кислоты Льюиса, такой как AlCl3. Затем тиофенлактон галогенируют, например, путем обработки йодом и бис(трифторацетокси)йодбензолом с получением соединения формулы (13). Галогенирование тиофенлактона с получением соединения (13) приводит к образованию смеси 2- и 3-галогентиофенлактонов. Требуемую фракцию в виде 2-галогенотиофенлактона (13, R2=H) можно выделить с помощью хроматографии (что подтверждается данными Н 1 ЯМР). Соединения формулы (13), где R2 представляет собой C1-C4 алкил, можно получить путем применения фракции в виде 3 галогентиофенлактона, описанной выше. 3-Галогентиофенлактон алкилируют с помощью подходящим образом замещенного алкильного субстрата, используя метод сочетания, такой как, например, реакция сочетания Сузуки (с алкилбороновой кислотой) с получением 3-алкилтиофенлактона. Затем 3 алкилтиофенлактон галогенируют с получением требуемого соединения формулы (13), где R2 представляет собой C1-C4 алкил. Соединения формулы (14) получают путем нуклеофильного ароматического замещения п-галонитропиридина спиртом или амином. Последующее восстановление нитрогруппы позволяет получить аминопиридин формулы (14). Схема 5 Синтез соединений формулы (21) можно осуществить согласно способам, представленным на схеме 5. Подходящее соединение формулы (18), (14) и (21) представляет собой соединение, в котором все группы определены при описании формулы (I). Согласно схеме 5 на стадии 1 аминотиофен формулы (18) превращают в бромтиофен формулы (19),используя реакцию, аналогичную реакции Зандмейера. Предпочтительные условия включают применение CuBr2 и трет-бутилнитрита в присутствии инертного растворителя, такого как ацетонитрил, при температуре в диапазоне от примерно комнатной температуры до температуры кипения растворителя с обратным холодильником. На стадии 2 бромтиофен формулы (19) реагирует с (триметилсилил)ацетиленом в ходе катализируемой палладием реакции кросс-сочетания с получением этинилтиофена формулы (20). Например,бромтиофен (19) обрабатывают (триметилсилил)ацетиленом в инертном растворителе, таком как ацетонитрил, ДМФ или толуол, при добавлении основания, такого как диизопропиламин, и палладиевого катализатора, такого как Pd(OAc)2, Pd(PPh3)4 или Pd(PPh3)2Cl2, и т.д., как правило, при добавлении фосфинового лиганда, такого как PPh3. Предпочтительные условия включают применение ДМФ и Pd(PPh3)2Cl2 при добавлении CuI при-8 015500 температуре от примерно 50 до 150 С. Наиболее предпочтительным является, когда реакция протекает в СВЧ-реакторе в течение примерно 30 мин. Согласно схеме 5 на стадии 3 этинилтиофен формулы (20) реагирует с аминопиридином формулы(14) с получением амида и затем подвергается циклизации in situ с получением тиенопиридинона формулы (21). Типичные условия предполагают применение методики Вайнреба, как описано для схемы 4, стадии 1, при использовании Me3Al в инертном растворителе, таком как толуол. Как можно легко понять, стадии синтеза соединений формулы (I), (17) и (21), представленные на предыдущих схемах, зависят от конкретного синтезируемого соединения, исходного соединения и относительной лабильности замещенных группировок. Также предполагают проведение различных стадий защиты и снятия защиты, которые могут быть необходимыми или полезными при осуществлении описанных выше реакций. Например, не требуется предварительного получения промежуточных соединений формулы (12) и (14) до проведения различных стадий сочетания или ацилирования, описанных в настоящем документе. Указанные промежуточные соединения также могут содержать защитные группы для защиты аминной или гидроксильной функциональной групп, которые после удаления указанных защитных групп вступали в реакцию с получением соединений, предложенных в изобретении. Выбор и применение подходящих защитных групп является хорошо известным в данной области техники (см.,например, Protecting Groups in Organic Synthesis, Theodora Greene (Wiley-Interscience. Демонстрация действия Все лиганды, радиолиганды, растворители и реагенты, используемые в указанных анализах, могут быть без труда приобретены на рынке или синтезированы специалистами в данной области техники. Полноразмерную кДНК для человеческого MCHR1 клонировали из кДНК мозга взрослого человека, полученной из библиотеки кДНК (Edge Biosystems, кат. 38356) с помощью стандартного метода полимеразной цепной реакции (ПЦР), используя следующие праймеры: смысловой, 5'GCCACCATGGACCTGGAAGCCTCGCTGC-3'; антисмысловой, 5'-TGGTGCCCTGACTTGGAGGTGTGC-3'. ПЦР проводили в конечном объеме 50 мкл, содержащем 5 мкл 10 исходного раствора ПЦР буфера, 1 мкл 10 мМ смеси dNTP (конечная концентрация 200 мкМ), 2 мкл 50 мМ MgSO4 (конечная концентрация 2 мМ), 0,5 мкл 20 мкМ растворов каждого праймера (конечная концентрация 0,2 мкМ), 5 мкл матричной кДНК, содержащей 0,5 нг ДНК, 0,5 мкл ДНК-полимеразы Platinum Taq High Fidelity (компания Gibco Life Technologies) и 36 мкл Н 2 О. ПЦР амплификацию осуществляют на термоциклере PerkinElmer 9600. Денатурацию проводят в течение 90 с при 94 С и повторяют последовательность амплификаций, включающую 94 С в течение 25 с, 55 С в течение 25 с и 72 С в течение 2 мин 30 раз, с последующем осуществлением конечной стадии элонгации при 72 С в течение 10 мин. Получение требуемого ПЦР продукта (1,1 кб) подтверждают методом электрофореза на геле агарозы, и диск экстрагируют из геля согласно Geneclean (Bio101), следуя инструкциям производителя. После экстракции клонируют кДНК фрагмент в pCR2,1-TOPO плазмид (Invitrogen Corp) для подтверждения идентичности и последовательности. Для получения клеточных линий, стабильно экспрессирующих MCHR1, субклонируют инсерт в(QIAGEN, Inc.), трансфицируют плазмиду посредством Fugene 6 (Roche Applied Science) в AV12 клетки,которые были предварительно трансфицированы с помощью смешанного G белка G15. Трансфицированые клетки выбирают с помощью G418 (800 мкг/мл) в течение 10-14 дней и отдельные колонии выделяют из культуральных планшетов. G418-устойчивые колонии также выбирают для MCHR1 экспрессии путем измерения МСН-стимулированных кратковременных Са 2+-токов во флуорометрическом планшетридере (FLIPR, Molecular Devices). Как правило, индивидуальные клоны высеивают в 96-луночные планшеты при концентрации 60000 клеток на лунку в 100 мкл питательной среды (модифицированная по способу Дульбекко среда Игла(DMEM), 5% фетальной телячьей сыворотки, 2 мМ L-глутамина, 10 мМ HEPES, 1 мМ пирувата натрия,0,5 мг/мл Zeocin и 0,5 мг/мл Geneticin). После выдержки в течение 24 ч при 37 С среду удаляют и заменяют на 50 мкл буфера, содержащего краситель (сбалансированный солевой раствор Хенкса (HBSS), содержащий 25 мМ HEPES, 0,04% Pluronate 127 и 8 мкМ Fluo3, оба компонента из Molecular Probes. После инкубации в течение 60 мин с содержащим краситель буфером при комнатной температуре, буфер аспирируют и заменяют на 100 мкл HEPES/HBBS. Планшет с клетками и планшет с соединениями, содержащий 2 мкМ МСН в буфере, помещают в FLIPR и снимают основные показания в течение 10 с. Затем FLIPR отбирает 100 мкл 2 мкМ МСН (для создания конечной концентрации в пробе 1 мкМ МСН) в планшет с клетками и считывает в течение 105 с для регистрации полного пика кальциевого потока в ответ на присутствие агониста (1 мкМ МСН). Для корректировки вариаций количества клеток клонов в различных лунках, МСН отклик нормализуют относительно отклика, индуцированного эпинефрином. При анализе 125I-МСН связывания и функционального GTP35S связывания используют мембраны,выделенные из клона, обозначенного как клон 43. Как правило, клетки из 20 колб Т 225 обрабатывают,промывая монослои холодным фосфатным буферным раствором (PBS), туда же переносят клетки и повторно суспендируют клеточную массу в (10 мл/г пасты) мембранном буфере с рН 7,4 (250 мМ сахарозы,-9 015500 50 мМ HEPES, рН 7,5, 1 мМ MgCl2 и ингибиторы протеазы (1 таблетка Complete - EDTA (Roche Diagnostics), на 100 мл мембранного буфера). Клетки гомогенизировали с помощью гомогенизатора с приводом от двигателя Teflon-glass Potter-Elvehjem, используя 5-10 ударов, а затем центрифугировали при 260 г в течение 15 мин при 4 С. Надосадочную жидкость собирают, и осадок повторно суспендируют в мембранном буфере, повторно гомогенизируют и снова центрифугируют при 260 г в течение 15 мин при 4 С в общей сложности 3 раза. Затем осадок можно отбросить. Объединенные надосадочные жидкости центрифугируют при 30000 г в течение 60 мин при 4 С. Мембранный осадок повторно суспендируют в мембранном буфере, при этом достигается концентрация белка 3-5 мг/мл (Pierce BCA анализ с применением бычьего сывороточного альбумина в качестве стандарта). Аликвоты хранят при -80 С. Связывание соединений с MCHR1 оценивают с помощью конкурентно-связывающего анализа, используя 125I-МСН, тестируемое соединение и мембраны клона 43. Анализы выполняют в 96-луночных планшетах с белым прозрачным дном Costar 3632 в суммарном объеме 200 мкл, содержащем 25 мМ(ДМСО), 4-12 мкг мембран клона 43, 200 пМ 125I-MCH (NEN), 2,5 мг/мл гранул пшеничных зародышей для агглютининового сцинтилляционного бесконтактного анализа (WGA-SPA гранулы, Amersham Inc., в настоящее время GE Healthcare) и изменяющуюся дозу тестируемого соединения. Неспецифическое связывание определяют в присутствии 0,1 мкМ немеченого МСН. Связанные I-MCH определяют, помещая запаянные планшеты в Microbeta Trilux (Perkin Elmer Life and Analytical Sciences Inc.) и подсчитывают после 12 ч выдержки. Значения IC50 (определенные как концентрация тестируемого соединения, требуемая для уменьшения специфического связывания 125I-МСН на 50%) определяют путем приведения в соответствие данных концентрация-отклик к 4-параметровой модели (максимальный отклик, минимальный отклик, коэффициент Хилла, IC50) с помощью Excel (Microsoft Corp.). Значения Ki рассчитывают из значений IC50, применяя приближение Ченга-Прусоффа (Cheng-Prusoff), как описано в работе Cheng et al. (Relationship between the inhibition constant (Ki) and the concentration of inhibitor which causes 50% inhibition (IC50) of anenzymatic reaction, Biochem. Pharmacol., 22: 3099-3108 (1973. Приведенные в качестве примеров соединения демонстрируют Ki1 мкМ в условиях проводимого исследования связывания. В частности, соединение согласно примеру 55 демонстрирует среднее значение MCHR1 Ki, равное примерно 9 нМ. Функциональный антагонизм МСН активности оценивают путем измерения способности тестируемого соединения ингибировать МСН-стимулированное связывание GTP35S с мебранами клона 43. Анализы выполняют в планшетах Costar 3632 с белым прозрачным дном в суммарном объеме 200 мкл, содержащем 50 мМ Hepes, pH 7,4, 5 мМ MgCl2, 10 мкг/мл сапонина, 1,0 мг/мл бычьего сывороточного альбумина, 100 мМ NaCl, 3 мкМ GDP, 0,3 нМ GTP35S, 10 нМ МСН (приблизительно равного ЕС 90), 0,4 мг/мл мембран клона 43, 5,0 мг/мл гранул пшеничных зародышей для агглютининового сцинтилляционного бесконтактного анализа (WGA-SPA beads, Amersham Inc., в настоящее время GE Healthcare) и изменяемую дозу тестируемого соединения. Планшеты запаивают и оставляют на 16-18 ч при 4 С. После выдерживания в течение 1 ч планшеты оставляют на некоторое время для достижения равновесия с температурой окружающей среды, определяют связанные GTP35S путем подсчета в Microbeta Trilux (PerkinElmer Life и Analytical Sciences Inc). Значения IC50 (определенные как концентрация тестируемого соединения, необходимая для уменьшения МСН-стимулированного GTP35S связывания на 50%) определяют путем приведения в соответствие данных концентрация-отклик к 4-параметровой модели (максимальный отклик, минимальный отклик, коэффициент Hill, IC50) с помощью Excel (Microsoft Corp.). После подтверждения наличия конкурирующего антагонизма с помощью анализа Шилда (Schild), рассчитывают значения Ki из значений IC50 для каждого антагониста и ЕС 50 для МСН (определенного независимо) путем применения модификации приближения Ченга-Прусоффа, как описано Leff и Dougal (Trends Pharmacol. Sci. (1993) 14: 110-112). Приведенные в качестве примеров соединения демонстрируют значения Kb1 мкМ в условиях функционального анализа, описанных в настоящем документе. В частности, соединение согласно примеру 5 демонстрирует значение MCHR1 Kb, равное примерно 7 нМ. Для демонстрации эффективности in vivo соединений согласно настоящему изобретению указанные соединения перорально вводили через зонд самцам крыс Лонга-Эванса (Harlan, IN), страдающим от ожирения, вызванного высококалорийной диетой, весившим 450-500 г. Наполнитель состоял из 10% гуммиарабика и 0,15% раствора сахарина в воде. Животных содержали по отдельности в помещении с регулируемой температурой (24 С) при 12 часовой смене светлого и темного периодов (темный период 10:00/22:00). Вода и еда (Teklad 95217,Harlan, WI) были доступны ad libitum (без ограничений). Соединения дозировали перорально один раз в день перед наступлением темного периода в течение 3 дней. Ежедневно в течение трех дней измеряли потребление пищи и изменение массы тела. Соединение согласно примеру 5 обеспечивало среднее снижение массы тела на примерно 11 г на 10 мг/кг относительно крыс контрольной группы, принимавших один наполнитель.- 10015500 Применение В качестве антагонистов связывания MCHR1 соединения, предложенные в настоящем изобретении,можно применять при лечении патологических состояний у человека и животных (особенно домашних животных), при которых MCHR1 рецептор, как показано, играет важную роль. За счет ингибирования активности МСН соединения, предложенные в настоящем изобретении, проявляют анорексическое действие. То есть соединения, предложенные в настоящем изобретении, можно применять в качестве препаратов, подавляющих аппетит и/или препаратов, снижающих вес, с целью лечения ожирения. Таким образом, эти соединения можно применять для лечения состояний, обусловленных ожирением, обостряющихся при ожирении, являющихся следствием ожирения или сопутствующих ожирению. При лечении животных, не относящихся к домашним, соединения, предложенные в настоящем изобретении, можно применять для снижения привеса и/или улучшения эффективности использования пищи и/или увеличения массы тела худого животного. Соединения, предложенные в настоящем изобретении, можно вводить различными способами, том числе пероральным, ректальным, трансдермальным, подкожным, внутривенным, внутримышечным и интраназальным. Составы на основе указанных соединений предпочтительно получают до введения, при этом выбор состава в случае каждого конкретного пациента остается за лечащим врачом. Соответственно, другой аспект настоящего изобретения представляет собой фармацевтическую композицию, содержащую эффективное количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, разбавитель или наполнитель. Индивидуальная вводимая доза устанавливается в зависимости от конкретных обстоятельств в каждом конкретном случае. Эти обстоятельства включают способ введения, предшествующую историю болезни пациента, патологическое состояние или симптом, подвергаемые лечению, степень тяжести состояния/симптома, подвергаемых лечению, и возраст и пол реципиента. Однако следует иметь в виду,что вводимая терапевтическая доза устанавливается врачом с учетом соответствующих факторов или ветеринаром для реципиентов-животных. В целом, эффективная минимальная дневная доза соединения формулы I составляет примерно от 10 до 200 мг в день. Как правило, эффективная максимальная доза составляет примерно от 200 до 1000 мг в день. Точную дозу можно определить в соответствии со стандартной практикой, имея медицинские навыки "определения дозы" реципиенту; то есть путем первоначального введения низкой дозы соединения с последующим постепенным увеличением дозы до тех пор, пока не будет наблюдаться требуемый терапевтический эффект. Фармацевтические композиции, предложенные в настоящем изобретении, можно адаптировать для указанных различных способов введения и можно вводить пациенту, например, в форме таблеток, капсул, крахмальных капсул, саше (papers), лепешек, пластинок, эликсиров, мазей, трансдермальных повязок, аэрозолей, средств для ингаляции, суппозиторий, растворов и суспензий. Сумма активных ингредиентов в такой композиции составляет от 0,1 до 99,9 вес.% состава (см. Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co. (1990), где в общем обсуждаются составы, способы введения препаратов и т.д.). Примеры Нижеследующие примеры только иллюстрируют методы синтеза препаратов и способность заявителей получать соединения, предложенные в настоящем изобретении, на основе представленных схем и/или их известных модификаций. Указанные примеры не являются ограничивающими и не исчерпываются соединениями, которые уже были синтезированы или могут быть получены. Используемые в настоящем документе сокращения определены согласно Aldrichimica Acta, Vol. 17, No. 1, 1984 и, как правило, известны специалистам в данной области техники или могут быть установлены с минимальными усилиями. Другие сокращения, используемые при описании экспериментов, представляют собой Nметил-2-пирролидинон (NMP), трет-бутилметиловый эфир (МТВЕ) и комнатная температура (КТ). Названия соединений, предложенных в настоящем изобретении, соответствуют ChemDraw Ultra, version 7.0,1. Названия солей приводят в виде свободное основание плюс сопряженная кислота. Препаративный пример 1. 2-Тиофен-3-ил-этиламин гидрохлорид. Комплекс борметилсульфида (30,4 мл, 304,4 ммоль) медленно добавляют к раствору тиофен-3-илацетонитрила (25,0 г, 203,0 ммоль) в тетрагидрофуране (450 мл). Реакционную смесь нагревают при кипении с обратным холодильником в течение 16 ч и затем охлаждают до комнатной температуры. Реакцию медленно гасят метанолом (50 мл) до тех пор, пока не наблюдается пенообразование. К этой смеси медленно добавляют метанол (100 мл), который насыщают хлористым водородом. Перед концентрированием в вакууме смесь перемешивают при комнатной температуре в течение 20 мин. В смесь добавляют метанол (100 мл) и концентрируют в вакууме. Образовавшееся твердое вещество суспендируют в диэтиловом эфире (200 мл) и фильтруют с получением 31,1 г (94%) неочищенного вышеназванного соединения. MS/ES m/z 128,3 [М+Н]+. Препаративный пример 2. Этиловый эфир (2-тиофен-3-ил-этил)карбаминовой кислоты. Диизопропилэтиламин (54,0 г, 418,0 ммоль) добавляют к суспензии 2-тиофен-3-ил-этиламин гидрохлорида в дихлорметане (400 мл) и смесь перемешивают в течение 40 мин при комнатной температуре.- 11015500 Смесь охлаждают до 0 С и в течение 15 мин добавляют по каплям этилхлорформиат (22,7 г, 209,0 ммоль). После завершения добавления реакционную смесь перемешивают в течение 1 ч при 0 С. Промывают 10% бисульфатом натрия (500 мл). Водную часть экстрагируют дихлорметаном (2100 мл) и объединенные органические порции высушивают над Na2SO4, фильтруют и концентрируют в вакууме. Образовавшийся остаток очищают с помощью хроматографии на силикателе, используя в качестве элюента 100% дихлорметан, с получением 22,6 г (60%) вышеназванного соединения. MS/ES m/z 200,3 Вышеназванное соединение получают с помощью, по существу, следующих процедур, разработанных в Aparajithan, K.; Thompson, А.С; Sam, J. J. Heterocyclic. Chem. 1966, 3, 466. 4,5 Дигидроциклопента[b]тиофен-6-он (Bonini, В.F.; et al. Eur. J. Org. Chem. 2004, 4442 и приведенные там ссылки) (0,658 г, 4,77 ммоль) растворяют в МеОН (50 мл) и добавляют гидроксиламин гидрохлорид(0,365 г, 5,25 ммоль) и NaOAc (2,35 г, 28,62 ммоль). Реакционную смесь перемешивают при комнатной температуре всю ночь. Органический растворитель удаляют в вакууме и остаток обрабатывают EtOAc(60 мл). Фильтруют через слой силикателя, промывают EtOAc и концентрируют. Остаток обрабатывают РРА (30 г), нагревая до 130 С на масляной бане при периодическом перемешивании в течение 30 мин. Реакцию оставляют охлаждаться до комнатной температуры и выливают в ледяную воду (100 мл). Экстрагируют CH2Cl2 (3150 мл). Промывают объединенные органические фазы 0,1 М NaOH (100 мл), высушивают над Na2SO4 и концентрируют. Материал очищают хроматографией, элюируя смесью 75%EtOAc/гексан, с получением 0,521 г (71%) вышеназванного соединения. MS/ES m/z 154,1 [М+Н]+. Альтернативная процедура: 5,6-дигидро-4H-тиено[2,3-с]пиридин-7-он. Пентоксид фосфора (32,1 г, 225,8 ммоль) добавляют к раствору этилового эфира 2-тиофен-3-илэтил)карбаминовой кислоты (22,5 г, 112,9 ммоль) в оксихлориде фосфора (167 мл) и реакционную смесь нагревают при 110 С в течение 3 ч 45 мин. Смесь охлаждают до комнатной температуры и концентрируют в вакууме. Остаток растворяют в дихлорметане (50 мл) и выливают в 300 г льда. Устанавливают рН смеси 7 с помощью 5N гидроксида натрия и экстрагируют дихлорметаном (4100 мл). Объединенные органические порции высушивают (Na2SO4), фильтруют и концентрируют в вакууме. Образовавшийся остаток очищают хроматографией на силикагеле, элюируя смесью 0-70% этилацетат/гексан, с получением 8,38 г (48%) вышеназванного соединения. MS/ES m/z 154,3 [М+Н]+. Препаративный пример 4. 2-Бром-5,6-дигидро-4 Н-тиено[2,3-c]пиридин-7-он.(30 мл). Охлаждают до 0 С и по каплям добавляют Br2 (1,8 мл, 34,51 ммоль). Реакционную смесь перемешивают при 0 С в течение 1 ч. Реакционную смесь разбавляют водой (100 мл) и экстрагируют EtOAc(3100 мл). Объединенные органические фазы промывают 5% Na2SO3 (250 мл), насыщенным NaHCO3(2,04 г, 8,79 ммоль) суспендируют в CH2Cl2 (30 мл). Обрабатывают оксалилхлоридом (1,5 мл, 17,58 ммоль), а затем добавляют ДМФ (3 капли). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин с получением прозрачного раствора и продолжают перемешивание в течение 1,5 ч. Избыток реагента и растворитель удаляют в вакууме. Образовавшийся остаток растворяют в 1,4 диоксане (10 мл), помещают в воронку и добавляют по каплям к раствору NaN3 (1,8 г, 26,37 ммоль) в воде (10 мл) и ацетоне (10 мл) при 0 С. Во время добавления поддерживают температуру реакционной смеси ниже 5 С. Перемешивают смесь при 0 С в течение 1 ч. Разбавляют водой (15 мл) и экстрагируютEtOAc (330 мл). Органические фазы объединяют и концентрируют в вакууме без нагревания. Образовавшийся остаток растворяют в EtOAc (50 мл) и промывают водой (30 мл) и соляным раствором (20 мл). Высушивают над Na2SO4, фильтруют и концентрируют в вакууме без нагревания с получением неочищенного промежуточного соединения, представляющего собой ацилазид.- 12015500 Неочищенный ацилазид растворяют в 1,4-диоксане (10 мл) и помещают в капельную воронку, которую присоединяют к колбе, содержащей Dowtherm A (15 мл) и ловушку Дина-Старка и холодильник. Смесь Dowtherm А нагревают до 230 С и добавляют по каплям раствор ацилазида. Во время добавления температура реакционной смеси падает до 160 С, а после поднимается до 230 С. Низкокипящий растворитель собирают в ловушке Дина-Старка. Реакционную смесь перемешивают при 230 С в течение 1 ч. Охлаждают до комнатной температуры и разбавляют гексаном (40 мл). Осадок получают с помощью фильтрации и промывают гексаном (220 мл) с получением 1,838 г (91%) вышеназванного соединения. 1MS/ES m/z (81Br) 229,8 [М-Н]-. Препаративный пример 6. (2,2-Диэтоксиэтил)амид 5-хлортиофен-2-карбоновой кислоты. 5-Хлортиофен-2-карбоновую кислоту (100 г, 0,60 моль) и дихлорметан (1000 мл) добавляют в 3 л трехгорлую круглодонную колбу, оборудованную подвесной мешалкой, входным отверстием/выходным отверстием для азота, капельной воронкой и термопарой. Образовавшийся раствор перемешивают в атмосфере азота при охлаждении до 4 С. Через воронку в течение 12 мин добавляют 2,2 диэтиоксиэтиламин (88,5 мл, 0,60 моль) в дихлорметане (35 мл). К охлажденной смеси добавляют 1-(3 диметиламинопропил)-3-этилкарбодиимид гидрохлорид (123 г, 0,64 моль). Добавляют дополнительное количество дихлорметана (165 мл) и перемешивают реакционную смесь в течение 22 ч при комнатной температуре. Реакцию гасят водой (1000 мл) и разделяют образовавшиеся фазы. Повторно экстрагируют водную фазу дихлорметаном (500 мл) и органические фазы объединяют. Высушивают над сульфатом натрия и очищают через слой силикагеля, элюируя дихлорметаном, а затем смесью 1% MeOH в дихлорметане и затем смесью 10% МеОН в дихлорметане, с получением 108 г (65%) вышеназванного соединения в виде твердого белого вещества. 1 Н ЯМР (500 МГц, CDCl3):1,19 (т, J=7,5 Гц, 6H), 3,48-3,57 (м, 4H), 3,68-3,74 (м, 2H), 3,68-3,74 (м,2H), 6,37 (уш.с, 1H), 6,85 (д, J=3,5 Гц, 1 Н), 7,26 (д, J=3,5 Гц, 1H). Препаративный пример 7. (2,2-Диэтиоксиэтил)амид 5-(4-хлорфенил)тиофен-2-карбоновой кислоты.EtOH (1000 мл) помещают в 2 л трехгорлую круглодонную колбу, оборудованную подвесной мешалкой,дефлегматором, входным отверстием/выходным отверстием для азота, капельной воронкой и термопарой. Образовавшуюся суспензию нагревают в течение 35 мин, затем добавляют активированный уголь(5,8 г) и нагревают в течение дополнительных 30 мин. Образовавшуюся суспензию фильтруют через стеклянный микроволоконный фильтр и промывают твердое вещество с помощью EtOH (500 мл). При пониженном давлении удаляют из фильтрата растворитель до тех пор, пока не останется 15-20% растворителя. К указанному фильтрату добавляют воду (1300 мл) и перемешивают образовавшуюся суспензию при комнатной температуре в течение 1 ч, затем при 0-5 С в течение 0,5 ч. Суспензию фильтруют, твердое вещество промывают водой (1000 мл) и высушивают с получением 66 г неочищенного (2,2 диэтиоксиэтил)амида 5-(4-хлорфенил)тиофен-2-карбоновой кислоты. Неочищенный(2,2 диэтиоксиэтил)амид 5-(4-хлорфенил)тиофен-2-карбоновой кислоты кипятят с обратным холодильником в гептане (1625 мл) в течение 1 ч, затем фильтруют через стеклянный микроволоконный фильтр. Фильтрат переносят в круглодонную колбу и удаляют растворитель до тех пор, пока не останется 725 мл растворителя. Смесь перемешивают в условиях охлаждения в течение 40 мин. Образовавшуюся суспензию фильтруют, промывают гептаном (100 мл) и высушивают с получением 41 г продукта (64%) в виде твердого белого вещества. 1 Н ЯМР (500 МГц, CDCl3):1,25 (т, J=7,0 Гц, 6 Н), 3,57-3,62 (м, 4 Н), 3,73-3,79 (м, 2 Н), 4,62 (т, J=5,5 Гц, 1 Н), 6,20 (уш.с, 1 Н), 7,24 (д, J=4,5 Гц, 1 Н), 7,38 (д, J=9,0 Гц, 2 Н), 7,45 (д, J=4,5 Гц, 1 Н), 7,54 (д, J=9,0 Гц, 2 Н). Препаративный пример 8. (2-Оксоэтил)амид 5-(4-хлорфенил)тиофен-2-карбоновой кислоты. В 250 мл трехгорлую круглодонную колбу, оборудованную подвесной мешалкой, входным отверстием/выходным отверстием для азота и термопарой, добавляют воду (21 мл), а затем трифторуксусную кислоту (100 г). При перемешивании к раствору ТФК (трифторуксусной кислоты) добавляют одной порцией (2,2-диэтиоксиэтил)амид 5-(4-хлорфенил)тиофен-2-карбоновой кислоты (25 г, 0,07 моль). Реакционную смесь перемешивают в течение 4 ч, выливают в лед/воду (1200 мл) и перемешивают в течение 1,25 ч. Образовавшуюся суспензию фильтруют и твердое вещество промывают водой (500 мл) и гептаном (500 мл) и затем высушивают с получением 18,65 г (95%) вышеназванного соединения в виде желтобелого твердого вещества. LC-MS/ES m/z (35Cl) 278 (М-Н)-. 1 Смешивают 2-бром-5,6-дигидро-4 Н-тиено[2,3-c]пиридин-7-он (1,024 г, 4,42 ммоль), 4 метоксифенилбороновую кислоту (0,671 г, 4,42 ммоль), Na2CO3 (0,94 г, 8,83 ммоль) в воде (10 мл), диметоксиэтане (75 мл) и СН 3 ОН (50 мл). Продувают азотом в течение 5 мин. Добавляют Pd(PPh3)4 (0,153 г,0,1325 ммоль) и кипятят образовавшуюся смесь с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры и разбавляют водой (100 мл). Экстрагируют EtOAc(3100 л) и концентрируют. Остаток обрабатывают EtOAc (40 мл), твердое вещество собирают и промывают EtOAc (20 мл) и Et2O (220 мл) с получением вышеназванного соединения (0,950 г). Фильтрат концентрируют и очищают образовавшийся остаток хроматографией с получением дополнительного количества продукта (0,140 г). Суммарный выход составляет 1,090 г (95%). MS/ES m/z 260,0 [М+Н]+. Препаративный пример 10. 2-(4-Фторфенил)-5,6-дигидро-4H-тиено[2,3-c]пиридин-7-он. Тетракис(трифенилфосфин)палладий(0) (0,075 г, 0,065 ммоль) добавляют к дегазированному раствору 2-бром-5,6-дигидро-4 Н-тиено[2,3-c]пиридин-7-она (0,5 г, 2,15 ммоль), 4-фторфенилбороновой кислоты (0,30 г, 2,15 ммоль) и карбоната натрия (0,46 г, 4,30 ммоль) в N,N-диметилформамиде (21 мл), метаноле (5 мл) и воде (1 мл). Реакционную смесь нагревают при 90 С в течение 16 ч. Реакционную смесь оставляют охлаждаться до комнатной температуры и выливают в воду (75 мл). Образовавшееся твердое вещество фильтруют и высушивают в вакууме при 80 С с получением 0,40 г (75%) вышеназванного соединения. MS/ES m/z 248,0 [М+Н]+. Промежуточные соединения, перечисленные ниже в таблице, получают с помощью реакций сочетания Сузуки, по существу, как описано в синтезе препаративного примера 9 или препаративного примера 10, используя подходящую арилбороновую кислоту и 2-бром-5,6-дигидро-4 Н-тиено[2,3-c]пиридин-7 он или 2-бром-6 Н-тиено[2,3-c]пиридин-7-он. Препаративный пример 29, альтернативный вариант получения. Трифторметансульфоновую кислоту (3 мл, 0,03 моль) и (2-оксоэтил)амид 5-(4-хлорфенил)тиофен-2 карбоновой кислоты (1 г, 0,004 моль) помещают в 25 мл трехгорлую круглодонную колбу, снабженную мешалкой, ловушкой Дина-Старка, входным отверстием/выходным отверстием для подачи азота и термопарой. Реакционную смесь нагревают до 95 С в течение 2 ч, затем охлаждают до 40 С и выливают в холодную воду (20 мл, 1,11 моль). Смесь перемешивают в течение 10 мин. Образовавшуюся суспензию фильтруют и твердое вещество промывают водой (100 мл). Высушивают с получением неочищенного 2(4-хлорфенил)-6 Н-тиено[2,3-c]пиридин-7-она (0,95 г, 0,004 моль) в виде коричневого твердого вещества. Смешивают 5-бром-2-фторпиридин (1,00 г, 5,68 ммоль) и N,N-диметилпиперидин-4-ил-амин (1,50 г, 11,70 ммоль) и нагревают до 80 С в течение 64 ч. Проводят разделение реакционной смеси междуCH2Cl2 (5 мл) и IN NaOH (8 мл). Органическую фазу собирают, а водную фазу экстрагируют дополнительным количеством CH2Cl2 (220 мл). Органические растворы объединяют, затем высушивают, фильтруют и концентрируют. Неочищенный материал очищают флэш-хроматографией, используя в качестве элюента смесь 5% МеОН (2N NH3)/CH2Cl2, с получением 1,49 г (92%) вышеназванного соединения в виде твердого белого вещества. 1 Н ЯМР (CDCl3)1,46 (дкв, 2 Н, J=4,0, 11,8 Гц), 1,86 (уш.д, 2 Н, J=12,8 Гц), 2,26 (с, 6 Н), 2,32 (м, 1 Н),2,80 (дт, 2 Н, J=2,7, 12,8 Гц), 4,23 (уш.д, 2 Н, J=13,2 Гц), 6,53 (д, 1 Н, J=8,9 Гц), 7,46 (дд, 1 Н, J=2,8, 9,0 Гц),8,13 (д, 1 Н, J=2,6 Гц). Промежуточные соединения, перечисленные ниже в таблице, получают с помощью процедуры, по существу, описанной в синтезе препаративного примера 30, с применением 5-бром-2-фторпиридина и подходящего амина или спирта. Смесь диметилпирролидин-3-(S)-ил-амина (3,0 г, 26,3 ммоль), 5-бром-2-фторпиридина (4,62 г, 26,3 ммоль), карбоната калия (7,98 г, 57,8 ммоль) в ацетонитриле (91 мл) нагревают при 80 С всю ночь. Оставляют смесь охлаждаться до комнатной температуры, фильтруют с CH2Cl2 и концентрируют. Неочищенный материал очищают флэш-хроматографией, элюируя смесью 5% МеОН (2N NH3)/CH2Cl2, с получением 3,55 г (50%) вышеназванного соединения. LC-MS/ES m/z (81Br) 272,3 [М+Н]+. Промежуточные соединения, перечисленные ниже в таблице, получают с помощью процедуры, по существу, описанной в синтезе препаративного примера 37, путем применения подходящего амина и 5 бром-2-фторпиридина. 1,1'-Карбонилдиимидазол (8,3 г, 51 ммоль) добавляют одной порцией к раствору 1-трет-бутилового эфира пирролидин-1,3-дикарбоновой кислоты (10,0 г, 46,5 ммоль) в дихлорметане (155 мл) при комнатной температуре. Оставляют смесь перемешиваться в течение 15 мин. Медленно добавляют N,Oдиметилгидроксиламин гидрохлорид (5,4 г, 55,8 ммоль). Реакционную смесь перемешивают при комнат- 16015500 ной температуре всю ночь. Смесь разбавляют дихлорметаном (200 мл), промывают водой (2300 мл),насыщенным солевым раствором (200 мл), высушивают над Na2SO4, фильтруют и концентрируют. Неочищенный материал очищают флэш-хроматографией и элюируют смесью 50-100% этилацетат/гексан с получением 10,8 г (90%) вышеназванного соединения. LC-MS/ES m/z 203,0 [М-t-Bu+H]+. Препаративный пример 41. трет-Бутиловый эфир -2-(метоксиметилкарбамоил)морфолин-4 карбоновой кислоты. Вышеназванное соединение получают с помощью процедуры, по существу, описанной в синтезе препаративного примера 40, путем применения 4-трет-бутилового эфира морфолин-2,4-дикарбоновой кислоты в качестве исходного материала. LC-MS/ES 219 [М-t-Bu+H]+. Препаративный пример 42. трет-Бутиловый эфир -3-(5-бромпиридин-2-карбонил)пирролидин-1 карбоновой кислоты. Вышеназванное соединение получают по способу согласно J. Org. Chem. 2004, 69, 250-262 и Tetrahedron Letter 2000, 41, 4335-4338. н-BuLi (3,2 мл, 5,1 ммоль) добавляют по каплям к суспензии 2,5-дибромпиридина (1,0 г, 4,2 ммоль) в осушенном толуоле (50 мл) при -80 С в атмосфере азота. Оставляют смесь перемешиваться при -80 С в течение 2 ч. Медленно добавляют раствор трет-бутилового эфира 3-(метоксиметилкарбамоил)пирролидин-1-карбоновой кислоты (1,4 г, 5,5 ммоль) в осушенном толуоле (10 мл). Реакционную смесь оставляют перемешиваться в течение 1 ч при -78 С, затем нагревают до -10 С. Смесь гасят насыщенным NH4Cl(1 мл) и нагревают до комнатной температуры. Органическую фазу отделяют и концентрируют. Неочищенный материал очищают флэш-хроматографией, элюируя смесью 10-20% этилацетат/гексан, с получением 0,61 г (43%) вышеназванного соединения. LC-MS/ES m/z (79Br) 299 [М-t-Bu+H]+. Препаративный пример 43. Трет-бутиловый эфир -2-(5-бромпиридин-2-карбонил)морфолин-4 карбоновой кислоты. Вышеназванное соединение получают с помощью процедуры, по существу, описанной в синтезе препаративного примера 42, используя трет-бутиловый эфир 2-(метоксиметилкарбамоил)морфолин-4 карбоновой кислоты в качестве исходного материала. LOMS/ES (81Br) 317,0 [М-t-Bu+H]+. Препаративный пример 44. -(5-Бромпиридин-2-ил)пирролидин-3-ил-метанон. Раствор трет-бутилового эфира 3-(5-бромпиридин-2-карбонил)пирролидин-1-карбоновой кислоты(0,65 г, 1,8 ммоль) в 4M HCl перемешивают в диоксане (3,7 мл) при 0 С в течение 1 ч. Реакционную смесь концентрируют, разбавляют смесь CH2Cl2, промывают 5N NaOH (15 мл) и экстрагируют водную фазу CH2Cl2. Объединенную органическую фазу промывают соляным раствором, высушивают надNa2SO4, фильтруют и концентрируют. Неочищенный материал очищают флэш-хроматографией, элюируя смесью 10% МеОН (2N NH3)/CH2Cl2, с получением 0,4 г (85%) вышеназванного соединения. LC-MS/ESm/z (81Br) 257,0 [М+Н]+. Препаративный пример 45. -(5-Бромпиридин-2-ил)морфолин-2-ил-метанон. Вышеназванное соединение получают с помощью процедуры, по существу, описанной в синтезе препаративного примера 44, используя трет-бутиловый эфир 2-(5-бромпиридин-2-карбонил)морфолин-4 карбоновой кислоты в качестве исходного материала. GC (81Br) 272 [M+]. Препаративный пример 46. -(5-Бромпиридин-2-ил)-(1-метилпирролидин-3-ил)метанон. К раствору (5-бромпиридин-2-ил)пирролидин-3-ил-метанона (0,35 г, 1,35 ммоль) в метаноле (68 мл) добавляют уксусную кислоту (0,15 мл, 2,7 ммоль) и формальдегид (0,33 г, 4,1 ммоль, 37% водный раствор). Через 15 мин добавляют триацетоксиборгидрид натрия (0,86 г, 4,1 ммоль) и оставляют смесь перемешиваться при комнатной температуре в течение 1 ч. Реакционную смесь концентрируют, растворяют в CH2Cl2 и промывают насыщенным NaHCO3. Водную фазу экстрагируют CH2Cl2. Объединенную органическую фазу промывают водой, высушивают над Na2SO4, фильтруют и концентрируют. Неочищенный материал очищают флэш-хроматографией, элюируя смесью 5-10% MeOH (2N NH3)/CH2Cl2, с получением 0,17 г (47%) вышеназванного соединения. LC-MS/ES m/z (79Br) 270 [M+Н]+. Препаративный пример 47. -(5-Бромпиридин-2-ил)-(4-метилморфолин-2-ил)метанон. Вышеназванное соединение получают с помощью процедуры, по существу, описанной в синтезе препаративного примера 46, используя (5-бромпиридин-2-ил)морфолин-2-ил-метанон в качестве исходного материала. GC-MS (81Br) 286 [M+]. Препаративный пример 48. [(R)-1-(5-Бром-3-метилпиридин-2-ил)пирролидин-3-ил]диметиламин. 2,5-Дибром-3-метилпиридин (2,00 г, 7,97 ммоль) смешивают с диметил-(R)-пирролидин-3-иламином (2,40 г, 20,72 ммоль) и моногидратом п-толуолсульфоновой кислоты (0,39 г, 2,07 ммоль) в запаянной трубке и нагревают при 100 С всю ночь. Разбавляют EtOAc (100 мл), промывают насыщеннымNaHCO3 (340 мл), высушивают над Na2SO4, фильтруют и концентрируют. Неочищенный материал очищают хроматографией, элюируя смесью 2% NH3 Н 2 О в 1:1 CH3OH:EtOAc, с получением 2,09 г (99%) вышеназванного соединения. LC-MS/ES m/z (79Br) 284,3 [M+Н]+. Препаративный пример 49. трет-Бутиловый эфир [(S)-1-(5-бромпиридин-2-ил)пирролидин-3 ил]карбаминовой кислоты. 5-Бром-2-фторпиридин (5,20 г, 29,53 ммоль) и трет-бутиловый эфир (S)-пирролидин-3-ил- 17015500 карбаминовой кислоты (5,50 г, 29,53 ммоль) растворяют в ацетонитриле (100 мл) и кипятят с обратным холодильником с K2CO3 (8,90 г, 64,96 ммоль) в течение 3 ч. Реакционную смесь фильтруют и промываютEtOAc (100 мл). Фильтрат концентрируют и образовавшийся неочищенный материал очищают хроматографией на силикагеле, элюируя смесью 40% EtOAc/гексан, с получением 2,76 г (27%) вышеназванного соединения. LC-MS/ES m/z (81Br) 344,3 [M+Н]+. Препаративный пример 50. трет-Бутиловый эфир [(R)-1-(5-бромпиридин-2-ил)пирролидин-3 ил]карбаминовой кислоты. Вышеназванное соединение получают, по существу, с помощью процедуры, описанной в синтезе препаративного примера 49, используя 5-бром-2-фторпиридин (6,26 г, 35,61 ммоль) и трет-бутиловый эфир (R)-пирролидин-3-ил-карбаминовой кислоты (6,632 г, 35,61 ммоль), с получением 3,77 г (30%) вышеназванного соединения. LC-MS/ES m/z (81Br) 344,3 [М+Н]+. Препаративный пример 51. (R)-1-(5-Бромпиридин-2-ил)пирролидин-3-иламин. трет-Бутиловый эфир [(R)-1-(5-бромпиридин-2-ил)пирролидин-3-ил]карбаминовой кислоты (9,17 г,26,9 ммоль) растворяют в CH2Cl2 (45 мл), добавляют ТФК (10 мл) и перемешивают при комнатной температуре всю ночь. Избыток реагента удаляют в вакууме. Остаток разбавляют CH2Cl2 (100 мл) и промывают 1,0 М NaOH (100 мл). Водную фазу экстрагируют CH2Cl2 (3100 мл). Органические фазы объединяют, высушивают с помощью Na2SO4, фильтруют и концентрируют с получением 6,03 г (93%) вышеназванного соединения. MS/ES m/z (79Br) 242 [М+Н]+. Препаративный пример 52. (S)-1-(5-Бромпиридин-2-ил)пирролидин-3-иламин. Вышеназванное соединение получают, по существу, с помощью процедуры, описанной в синтезе препаративного примера 51, используя трет-бутиловый эфир [(3)-1-(5-бромпиридин-2-ил)пирролидин-3 ил]карбаминовой кислоты в качестве исходного материала. MS/ES m/z (79Br) 242 [М+Н]+. Препаративный пример 53. (S)-1-(5-Бромпиридин-2-ил)пирролидин-3-ол. 5-Бром-2-фторпиридин (10,33 г, 57,39 ммоль) в ТГФ (50 мл) нагревают с (S)-3 гидроксипирролидином (5,00 г, 57,39 ммоль) и Et3N (9,2 мл, 68,87 ммоль) в СВЧ-реакторе при 120 С в течение 45 мин. Разбавляют EtOAc (150 мл) и промывают насыщенным NaHCO3 (250 мл) и водой (100 мл). Высушивают с помощью Na2SO4, фильтруют и концентрируют. Неочищенный материал очищают хроматографией, элюируя смесью 100% EtOAc, с получением 10,13 г (72%) вышеназванного соединения.et al. WO 2005103032), растворяют в CH2Cl2 (50 мл) и охлаждают до 0 С. Смесь обрабатывают Et3N (5,0 мл, 35,93 ммоль), а затем MsCl (2,4 мл, 30,4 ммоль). Смесь перемешивают при 0 С в течение 30 мин, а затем при комнатной температуре в течение 1 ч. Разбавляют CH2Cl2 (100 мл) и промывают H2O (100 мл) и соляным раствором (100 мл). Высушивают с помощью Na2SO4, фильтруют и концентрируют. Неочищенный материал очищают хроматографией, элюируя смесью 50-70% EtOAc/гексан, с получением 8,86 г(97%) вышеназванного соединения. MS/ES m/z (79Br) 321,0 [М+Н]+. Препаративный пример 55. (S)-1-(5-Бромпиридин-2-ил)пирролидин-3-иловый эфир метансульфоновой кислоты. Вышеназванное соединение синтезируют, по существу, с помощью процедуры, описанной в синтезе препаративного примера 54, из (S)-1-(5-бромпиридин-2-ил)пирролидин-3-ола (10,13 г, 41,19 ммоль) с получением 12,54 г (94%) вышеназванного соединения.(R)-1-(5-Бромпиридин-2-ил)пирролидин-3-иловый эфир метансульфоновой кислоты (0,23 г, 0,71 ммоль) и (R)-3-фторпирролидин гидрохлорид (107 мг, 0,85 ммоль) растворяют в ДМФ (5 мл) и добавляют Cs2CO3 (0,69 г, 2,13 ммоль). Нагревают до 70 С всю ночь. Разбавляют EtOAc (100 мл) и промывают Н 2 О (3100 мл). Высушивают с помощью Na2SO4, фильтруют и концентрируют. Неочищенный материал очищают хроматографией, элюируя смесью 75-100% EtOAc/гексан, с получением 0,22 г (100%) вышеназванного соединения. 1(м, 1 Н), 5,34-5,40 (м, 1 Н), 6,28 (д, J=9,0 Гц, 1 Н), 7,51 (дд, J=9,0, 2,4 Гц, 1 Н), 8,18 (д, J=2,4 Гц, 1 Н). Вышеназванное соединение синтезируют, по существу, с помощью процедуры, описанной в синтезе препаративного примера 56, используя соответствующий амин и (S)-1-(5-бромпиридин-2 ил)пирролидин-3-иловый эфир метансульфоновой кислоты.(S)-1-(5-Бромпиридин-2-ил)пирролидин-3-иловый эфир метансульфоновой кислоты (3,07 г, 9,48 ммоль) и циклопропиламин (1,7 мл, 23,68 ммоль) растворяют в ТГФ (20 мл). Смесь обрабатывают в СВЧ-реакторе при 130 С в течение 6 ч. Смесь разбавляют EtOAc (100 мл) и промывают насыщеннымNaHCO3 (25 мл). Органическую часть высушивают над Na2SO4, фильтруют и концентрируют. Неочищенный материал очищают хроматографией, элюируя с применением градиента 75-100% EtOAc/гексан с получением 1,638 г (61%) вышеназванного соединения. LC-MS/ES m/z (79Br) 283,0 [М+Н]+. Препаративный пример 59. N-[(R)-1-(5-Бромпиридин-2-ил)пирролидин-3-ил]-2,2-дифторацетамид. трет-Бутиловый эфир [(R)-1-(5-бромпиридин-2-ил)пирролидин-3-ил]карбаминовой кислоты (4,24 г,12,43 ммоль) растворяют в CH2Cl2 (10 мл) и добавляют ТФК (5 мл). Перемешивают при комнатной температуре в течение 1 ч. Избыток реагента испаряют. Образовавшийся неочищенный материал растворяют в CH2Cl2 (50 мл) и охлаждают до 0 С. Добавляют дифторуксусную кислоту (1,78 г, 18,64 ммоль),EDCI (3,57 г, 18,64 ммоль), HOBt (2,52 г, 18,64 ммоль) и Et3N (5,2 мл, 37,3 ммоль). Реакционную смесь перемешивают при 0 С в течение 30 мин и при комнатной температуре всю ночь. Разбавляют CH2Cl2(100 мл) и промывают 0,1 М NaOH (250 мл) и H2O (100 мл). Раствор высушивают с помощью Na2SO4,фильтруют и концентрируют. Неочищенный материал очищают, элюируя смесью 100% EtOAc, с получением 1,98 г (50%) вышеназванного соединения. MS/ES m/z (79Br) 321,0 [М+Н]+. Промежуточные соединения, перечисленные ниже, синтезируют с помощью процедуры, по существу, описанной в синтезе препаративного примера 59, используя трет-бутиловый эфир (R) или (S)-[1-(5 бромпиридин-2-ил)пирролидин-3-ил]карбаминовой кислоты. Для получения препаративного примера 61 используют трифторуксусный ангидрид (1 экв.) и триэтиламин (1,2 экв.).N-[(R)-1-(5-Бромпиридин-2-ил)пирролидин-3-ил]-2,2-дифторацетамид (1,98 г, 6,19 ммоль) растворяют в ТГФ (50 мл) и охлаждают до 0 С. Добавляют по каплям 1,0 М ВН 3 ТГФ комплекс в ТГФ (18,6 мл,18,6 ммоль). Смесь перемешивают при 0 С в течение 10 мин и затем кипятят с обратным холодильником в течение 4 ч. Смесь охлаждают до 0 С и гасят СН 3 ОН (5 мл) и насыщенным NH4Cl (20 мл). Смесь перемешивают при 0 С в течение 5 мин и при комнатной температуре в течение 30 мин. Разбавляют Н 2 О (50 мл) и экстрагируют EtOAc (280 мл). Органическую порцию высушивают с помощью Na2SO4, фильтруют и концентрируют. Неочищенный материал очищают хроматографией, элюируя смесью 50-70%EtOAc/гексан, с получением 1,01 г (50%) вышеназванного соединения. MS/ES m/z (79Br) 306,0 [М+Н]+. Препаративный пример 63. [(S)-1-(5-Бромпиридин-2-ил)пирролидин-3-ил]-(2,2-дифторэтил)амин. 1 М ВН 3-ТГФ (78 мл, 78 ммоль) добавляют через шприц к раствору N-[(S)-1-(5-бромпиридин-2 ил)пирролидин-3-ил]-2,2-дифторацетамида (8,3 г, 25 ммоль) в тетрагидрофуране (65 мл) и нагревают смесь при кипячении с обратным холодильником всю ночь. Реакционную смесь охлаждают до 0 С и медленно гасят 5N NaOH до тех пор, пока не наблюдается газовыделение. Материал концентрируют в- 19015500 вакууме с целью удаления ТГФ. Остаток разбавляют водой (150 мл) и экстрагируют CH2Cl2 (3150 мл). Объединенные органические фазы высушивают над Na2SO4, фильтруют и концентрируют до сухого остатка. К остатку в дихлорметане (75 мл) добавляют триацетоксиборогидрид натрия (35,4 г, 167 ммоль). При энергичном перемешивании добавляют по каплям трифторуксусную кислоту (150 мл). Через 10 мин смесь концентрируют в вакууме и разбавляют CH2Cl2 (150 мл). Смесь охлаждают в ледяной бане и медленно подщелачивают до рН 9 посредством 5N NaOH. Основную смесь перемешивают всю ночь. Смесь разбавляют водой (200 мл) и экстрагируют CH2Cl2 (3150 мл). Объединенные органические фазы высушивают над Na2SO4, фильтруют и концентрируют до сухого остатка. Очищают хроматографией с получением 6,38 г (85%) вышеназванного соединения. MS/ES m/z (79Br) 306,0 [М+Н]+. Препаративный пример 64. [(R)-1-(5-Бромпиридин-2-ил)пирролидин-3-ил]-(2,2,2-трифторэтил) амин. Вышеназванное соединение синтезируют с помощью процедуры, по существу, описанной в синтезе препаративного примера 62, используя N-[(R)-1-(5-бромпиридин-2-ил)пирролидин-3-ил]-2,2,2 трифторацетамид (1,25 г, 3,55 ммоль), с получением 1,07 г (93%) вышеназванного соединения. MS/ES(R)-1-(5-Бромпиридин-2-ил)пирролидин-3-иламин (1,60 г, 6,63 ммоль) растворяют в СН 3 ОН (915 мл). Добавляют (1-этоксициклопропокси)триметилсилан (2,7 мл, 13,49 ммоль) и НОАс (1,9 мл, 33,15 ммоль) и перемешивают при комнатной температуре в течение 3 ч. Добавляют NaBH3CN (4,2 г, 66,30 ммоль) и кипятят с обратным холодильником всю ночь. Смесь охлаждают до 0 С, гасят 2,0 М NaOH (15 мл) и разбавляют H2O (100 мл). Экстрагируют EtOAc (3100 мл). Объединенные органические фазы промывают 1,0 М NaOH (50 мл), Н 2 О (100 мл) и соляным раствором (50 мл). Раствор высушивают с помощью Na2SO4, фильтруют и концентрируют. Неочищенный материал очищают хроматографией, элюируя смесью 0,5% Et3N, 5% СН 3 ОН и 95% CHCl3, с получением 1,20 г (56%) вышеназванного соединения.MS/ES m/z (79Br) 322 [М+Н]+. Препаративный пример 66. N-[(R)-1-(5-Бромпиридин-2-ил)пирролидин-3-ил]-2-метоксиацетамид. Метоксиацетилхлорид (208 мкл, 2,27 ммоль) добавляют к раствору (R)-1-(5-бромпиридин-2 ил)пирролидин-3-иламина (0,5 г, 2,07 ммоль) и триэтиламина (317 мкл, 2,27 ммоль) в дихлорметане (10 мл) с температурой 0 С. Удаляют ледяную баню и реакцию перемешивают всю ночь. Реакционную смесь промывают 10% водным NaHSO4 (20 мл). Органическую часть отделяют и водную часть экстрагируют дихлорметаном (210 мл). Объединенные органические фазы высушивают над Na2SO4, фильтруют и концентрируют до сухого остатка. Очищают путем применения хроматографии (от 0 до 5%[М+Н]+. Препаративный пример 67. 2-[(R)-1-(5-Бромпиридин-2-ил)пирролидин-3-иламино]этанол. Раствор йода (727 мг, 2,86 ммоль) в тетрагидрофуране (5 мл) добавляют по каплям с помощью капельной воронки в смесь N-[(R)-1-(5-бромпиридин-2-ил)пирролидин-3-ил]-2-метоксиацетамида (500 мг,1,59 ммоль) и боргидрида натрия (217 мг, 6,05 ммоль) в тетрагидрофуране (5 мл) течение 15 мин. Бесцветную смесь нагревают с обратным холодильником всю ночь, затем охлаждают до комнатной температуры и медленно гасят МеОН до тех пор, пока не наблюдается пенообразование. Материал концентрируют в вакууме. К остатку добавляют 1N NaOH (20 мл) и экстрагируют смесь дихлорметаном (320 мл). Объединенные органические фазы высушивают над Na2SO4, фильтруют и концентрируют до сухого остатка. Очищают путем применения хроматографии (0 до 10% MeOH/CH2Cl2) с получением 120 мг (26%) вышеназванного соединения. LC-MS/ES m/z (79Br) 286,2 [М+Н]+. Препаративный пример 68. 1-(5-Бромпиридин-2-ил)-4-метилпиперазин. 2-Фтор-5-бромпиридин (2,15 г, 12,22 ммоль) нагревают с 1-метилпиперазином (3,4 мл, 30,54 ммоль) в ТГФ (10 мл) в СВЧ-реакторе при 120 С в течение 45 мин. Разбавляют EtOAc (60 мл), затем промывают(12 мл). Нагревают до 50 С и перемешивают в герметичном сосуде в течение 3 дней. Смесь разбавляют насыщенным бикарбонатом натрия и экстрагируют три раза дихлорметаном. Органические фазы высушивают над сульфатом натрия, фильтруют и выпаривают. Очищают хроматографией на силикагеле,элюируя смесью 0-15% метанол (2N NH3)/CH2Cl2 с получением 1,73 г (100%) вышеназванного соединения в виде желтого масла. 1H ЯМР (CDCl3):1,43 (с, 9 Н), 1,77 (м, 4 Н), 2,08 (уш.с, 1 Н), 2,60 (м, 4 Н), 2,72 (уш.с, 1 Н), 3,27 (м,1 Н), 3,65 (м, 1 Н), 4,29 (м, 1 Н). Препаративный пример 70. трет-Бутиловый эфир -транс-3-диметиламино-4-гидроксипир- 20015500 ролидин-1-карбоновой кислоты. Вышеназванное соединение синтезируют, по существу, с помощью процедур, описанных в синтезе препаративного примера 69, с получением 0,676 г (95%) желтого масла. MS/ES m/z 231 [М+Н]+. Препаративный пример 71. трет-Бутиловый эфир -цис-4'-фтор-[1,3']бипирролидинил-1'карбоновой кислоты. трет-Бутиловый эфир 4'-гидрокси-[1,3']бипирролидинил-1'-карбоновой кислоты (573 мг, 2,24 ммоль) растворяют в дихлорметане (15 мл) и охлаждают смесь до -78 С. Добавляют по каплям трифторид диэтиламиносеры (504 мг, 3,13 ммоль) и затем оставляют смесь нагреваться до комнатной температуры. Смесь перемешивают всю ночь. Раствор испаряют и очищают хроматографией на силикагеле,элюируя смесью 0-3% метанол (2N NH3)/CH2Cl2, с получением 520 мг (89%) вышеназванного соединения в виде желтого масла. 1 Н ЯМР (ДМСО-d6):1,37 (с, 9 Н), 1,61-1,67 (м, 4 Н), 2,43-2,54 (м, 4 Н), 2,86 (уш.с, 1 Н), 3,30-3,41 (м,1 Н), 3,45-3,60 (м, 1 Н), 5,09-5,25 (м, 1 Н). Препаративный пример 72. трет-Бутиловый эфир -цис-3-диметиламино-4-фторпирролидин-1 карбоновой кислоты. Вышеназванное соединение синтезируют, по существу, с помощью процедуры, описанной в синтезе препаративного примера 71 с получением 1,9 г (78%) продукта в виде желтого масла. 1 Н ЯМР (ДМСО-d6):1,44 (с, 9 Н), 2,28 (с, 6 Н), 2,89 (м, 1 Н), 3,29 (м, 1 Н), 3,42-3,81 (м, 3 Н), 5,26-5,35 трет-Бутиловый эфир 4'-гидрокси-[1,3']бипирролидинил-1'-карбоновой кислоты (751 мг, 2,93 ммоль) растворяют в дихлорметане (13 мл) и смесь охлаждают до 0C. Добавляют трифторуксусную кислоту (2,5 мл, 33,1 ммоль) и нагревают смесь до комнатной температуры в течение 1 ч. Легколетучие вещества удаляют с помощью пониженного давления и затем очищают, используя до двух 10 г картриджей для катионно-обменной хроматографии. Материал промывают метанолом, затем материал элюируют 2N аммиаком в метаноле с получением 460 мг (99%) вышеназванного соединения в виде прозрачного масла. 1 Н ЯМР (ДМСО-d6)1,60 (м, 4 Н), 2,31 (с, 1 Н), 2,41 (м, 5 Н), 2,53 (м, 1 Н), 2,81 (м, 1 Н), 2,93 (м, 1 Н),3,94 (с, 1 Н). Нижеследующие соединения синтезируют путем снятия защиты соответствующих карбаматов, используя трифторуксусную кислоту, как, по существу, описано в синтезе препаративного примера 73.[1,3']Бипирролидинил-4'-ол (4 52 мг, 2,89 ммоль) растворяют в ацетонитриле (10 мл) и добавляют 5 бром-2-фторпиридин (764 мг, 4,34 ммоль) и диизопропилэтиламин (1,26 мл, 7,23 ммоль). Смесь кипятят с обратным холодильником в течение 3 дней. Смесь разбавляют насыщенным бикарбонатом натрия и экстрагируют дихлорметаном (3). Объединяют органические фракции, высушивают над сульфатом натрия, фильтруют и испаряют. Очищают хроматографией на силикагеле, элюируя смесью 0-7,5% метанолm/z (79Br) 312,0 [М+Н]+. Вышеназванные соединения получают, по существу, как описано в синтезе препаративного примера 77, используя 5-бром-2-фторпиридин и соответствующие пирролидины. Препаративный пример 81. -транс-1-(5-Бромпиридин-2-ил)-4-метиламинопирролидин-3-ол. трет-Бутиловый эфир 6-окса-3-аза-бицикло[3,1,0]гексан-3-карбоновой кислоты (1,50 г, 8,10 ммоль) растворяют в метиламине (15 мл, 40% раствор в воде). Нагревают до 50 С и перемешивают в герметичном сосуде всю ночь. Смесь разбавляют насыщенным бикарбонатом натрия и экстрагируют дихлорметаном (3). Органическую фазу высушивают над сульфатом натрия, фильтруют и испаряют. Очищают хроматографией на силикагеле, элюируя смесью 0-10% метанол (2N NH3)/CH2Cl2, с получением 1,87 г(97%) трет-бутилового эфира 3-гидрокси-4-метиламинопирролидин-1-карбоновой кислоты в виде желтого масла. трет-Бутиловый эфир 3-гидрокси-4-метиламинопирролидин-1-карбоновой кислоты (750 мг, 3,26 ммоль) растворяют в дихлорметане (20 мл) и охлаждают смесь до 0 С. Добавляют трифторуксусную кислоту (4 мл, 52,9 ммоль) и нагревают смесь до комнатной температуры в течение 1 ч. Легколетучие вещества удаляют при пониженном давлении и затем используют 10 г картридж для катионно-обменной хроматографии. Материал промывают метанолом и затем материал элюируют 2N аммиаком в метаноле с получением 430 мг (100%) 4-метиламинопирролидин-3-ола в виде прозрачного масла. 4-Метиламинопирролидин-3-ол (430 мг, 3,29 ммоль) растворяют в ацетонитриле (10 мл) и добавляют 5-бром-2-фторпиридин (868 мг, 4,93 ммоль) и диизопропилэтиламин (0,688 мл, 3,95 ммоль). Смесь кипятят с обратным холодильником в течение 3 дней. Смесь разбавляют насыщенным бикарбонатом натрия и экстрагируют дихлорметаном (3). Органические фракции объединяют, высушивают над сульфатом натрия, фильтруют и выпаривают. Очищают хроматографией на силикагеле, элюируя смесью 0-7,5% метанола в дихлорметане с 2N аммиаком с получением 352 мг (37%) вышеназванного соединения в виде желтой пены. MS/ES m/z (79Br) 272,0 [M+Н]+. Препаративный пример 82. -транс-1-(5-Бромпиридин-2-ил)-4-[(3,4-диметоксибензил)метиламино]пирролидин-3-ол. 1-(5-Бромпиридин-2-ил)-4-метиламинопирролидин-3-ол (0,347 г, 1,28 ммоль) растворяют в дихлорэтане (10 мл) и добавляют вератральдегид (212 мг, 1,28 ммоль), триацетоксиборгидрид натрия (405 мг,1,91 ммоль) и уксусную кислоту (125 мл, 2,18 мкмоль). Смесь перемешивают при комнатной температуре всю ночь. Смесь разбавляют насыщенным бикарбонатом натрия и экстрагируют дихлорметаном (3). Объединенные органические слои высушивают над сульфатом натрия, фильтруют и выпаривают. Образовавшийся остаток очищают хроматографией на силикагеле, элюируя смесью 0-9% метанол (2NNH3)/CH2Cl2, с получением 390 мг (72%) вышеназванного соединения в виде твердого белого вещества.-цис-[1-(5-Бромпиридин-2-ил)-4-фторпирролидин-3-ил]-(3,4 диметоксибензил)метиламин. Вышеназванное соединение получают, по существу, с помощью процедур, описанных в синтезе препаративного примера 71,путем примененияPd2(dba)3 (12 мг, 0,0132 ммоль) и кипятят реакционную смесь с обратным холодильником всю ночь. Разбавляют EtOAc (100 мл) и водой (100 мл). Нерастворившийся остаток собирают путем фильтрации. Промывают водой (220 мл) и EtOAc (220 мл) и высушивают в вакуумной печи с получением 0,403 г (76%) вышеназванного соединения. LC-MS/ES (35Cl) 399,0 [М+Н]+. Пример 1. 4-[2-(4-Хлорфенил)-7-оксо-4,7-дигидро-5 Н-тиено[2,3-с]пиридин-6-ил]-2-метокси-N-(2 пирролидин-1-ил-этил)бензамид, гидрохлорид. Метиловый эфир 5-[2-(4-хлорфенил)-7-оксо-4,7-дигидро-5 Н-тиено[2,3-c]пиридин-6-ил]пиридин-2 карболовой кислоты (0,099 г, 0,25 ммоль) смешивают с 2-пирролидин-1-ил-этиламином (34 мг) в толуоле(5 мл). Добавляют Al(CH3)3 (130 мкл, 0,26 ммоль) и смесь перемешивают при 60 С всю ночь. Охлаждают до 0 С и гасят водой (5 мл). Разбавляют EtOAc (20 мл) и отфильтровывают нерастворившийся остаток. Фильтрат разбавляют EtOAc (50 мл), промывают насыщенным NaHCO3 (230 мл), высушивают надNa2SO4, фильтруют и концентрируют. Неочищенный материал очищают хроматографией, элюируя смесью 10% СН 3 ОН (2N NH3)/CH2Cl2, с получением 0,058 г продукта. Материал растворяют в CH2Cl2 (5 мл) и обрабатывают 1,0 М HCl в EtOH (118 мкл). Перемешивают при комнатной температуре в течение 5 мин и концентрируют с получением 0,051 г, (39%) вышеназванного соединения. LC-MS/ES (35Cl) 481,2 Смешивают 2-(4-хлорфенил)-6 Н-тиено[2,3-c]пиридин-7-он (0,2575 г, 0,98 ммоль), [(S)-1-(5 бромпиридин-2-ил)пирролидин-3-ил]диметиламин (Goodfellow, V.; et. al. US 2005012853) (0,3184 г, 1,18 ммоль) и Cs2CO3 (0,64 г, 1,96 ммоль) в диоксане (25 мл). Суспензию дегазируют, продувая азотом в течение 5 мин. Добавляют CuI (37 мг, 0,20 ммоль) и N,N'-диметилэтилендиамин (35 мг). Реакционную смесь перемешивают при 100 С всю ночь. Охлаждают до комнатной температуры и разбавляют EtOAc (100 мл). Раствор промывают Н 2 О/NH3 Н 2 О (230 мл/2 мл). Органическую фазу высушивают над Na2SO4,фильтруют и концентрируют. Неочищенный материал очищают хроматографией, элюируя смесью 2%NH3H2O, 50% CH3OH/EtOAc, с получением 0,258 г продукта. Материал растворяют в CH2Cl2 (5 мл) и обрабатывают 1,0 М HCl в EtOH (0,57 мл) с получением 0,278 г (58%) вышеназванного соединения. LCMS/ES m/z (35Cl) 451,2 (М+Н)+. Нижеследующие препараты и соединения из примеров, перечисленные ниже в таблице, по существу, синтезируют, как описано в примере 2, используя подходящий 5,6-дигидро-4 Н-тиено[2,3-c]пиридин 7-он или 6 Н-тиено[2,3-c]пиридин-7-он и подходящий 5-бромпиридин. Используют примерно от 0,1 до 0,3 экв. CuI, от 1,6 до 2,0 экв. Cs2CO3 и от 0,34 до 0,4 экв. N,N'-диметилэтилендиамина. (R)-1-(5 Бромпиридин-2-ил)пирролидин-3-ол получают согласно Stenkamp, D. et al. WO 2005103032. Альтернативный способ (примеры 10-62). К охлажденной реакционной смеси добавляют концентрированный NH4OH (5 мл). Через 10 мин смесь выливают в воду (50 мл). Образовавшееся твердое вещество фильтруют и промывают водой (2) и затем Et2O (2). Очищают хроматографией (0-10% МеОН/CH2Cl2) с получением вышеназванного соединения. Если указано, получают хлористоводородную соль путем добавления одного эквивалента 1 М хлористого водорода в этаноле, затем осаждения эфиром и фильтрования вышеназванных соединений. Альтернативный способ (примеры 63-67, препаративный пример 93). Неочищенную реакционную смесь охлаждают до комнатной температуры и фильтруют, промывая твердое вещество этилацетатом. Раствор выпаривают и очищают хроматографией на силикагеле, элюируя смесью 0-6% метанол (2NNEt3)/CH2Cl2 с получением белого твердого вещества. Твердое вещество растворяют в метаноле и добав- 23015500 ляют хлорид аммония. Смесь выпаривают с получением вышеназванного соединения.
МПК / Метки
МПК: A61K 31/4365, C07D 495/04, A61P 3/04
Метки: антагонисты, новые, мсн, рецепторов
Код ссылки
<a href="https://eas.patents.su/30-15500-novye-antagonisty-msn-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Новые антагонисты мсн рецепторов</a>
Предыдущий патент: Ингибиторы 11-бета-гидроксистероид дегидрогеназы типа 1
Следующий патент: Жатка валковая полуприцепная или прицепная
Случайный патент: Способ полимеризации этилена












