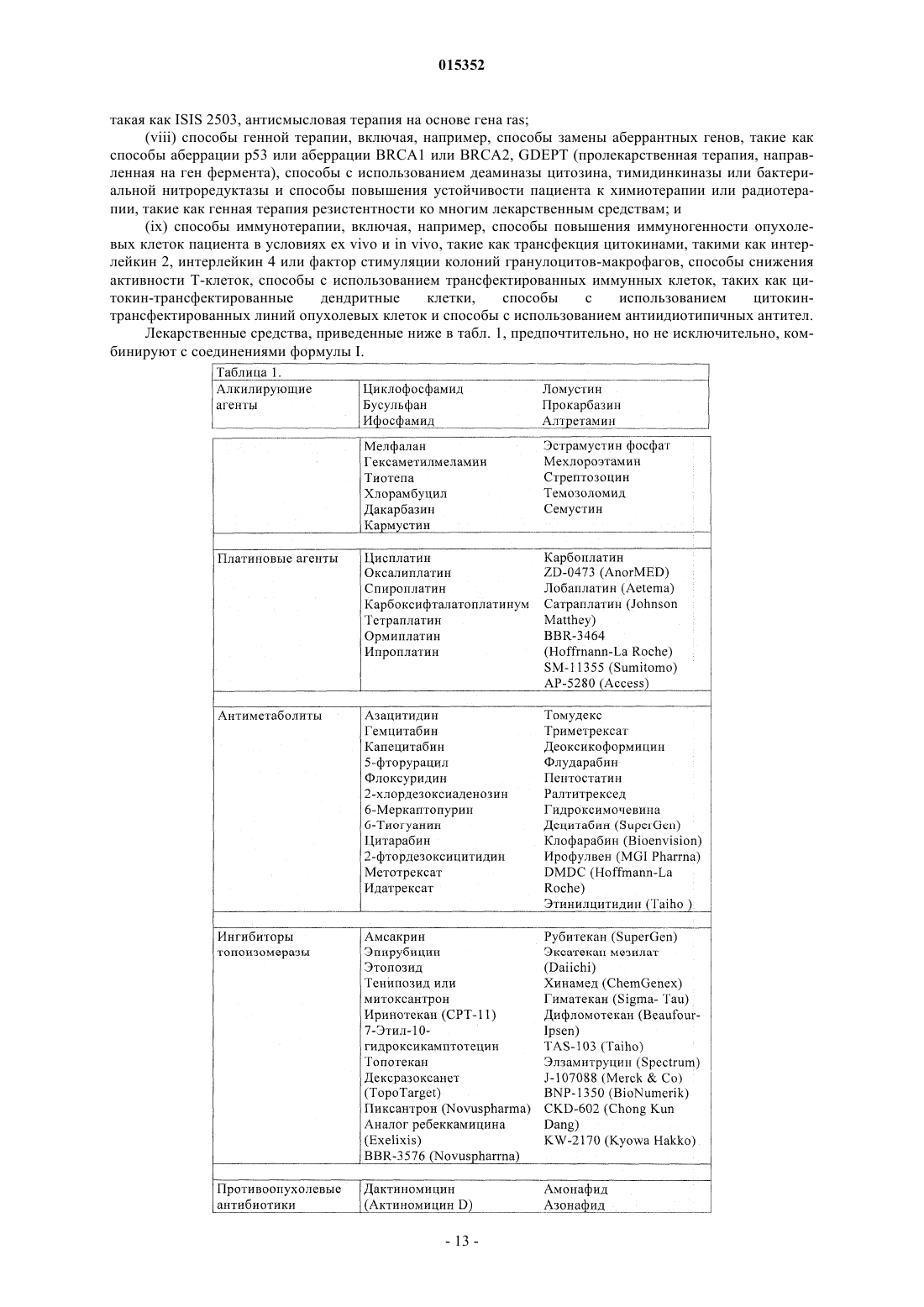
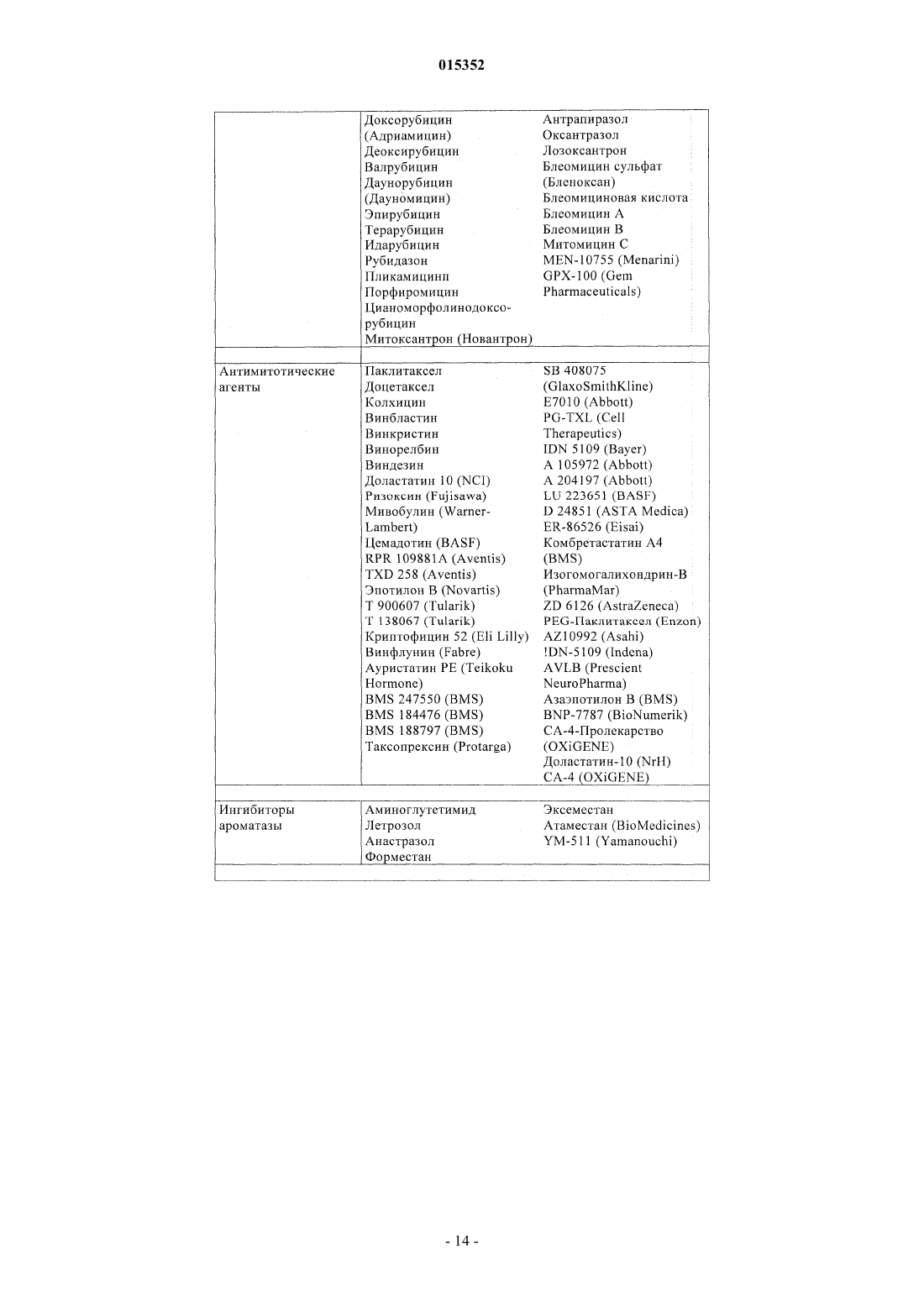
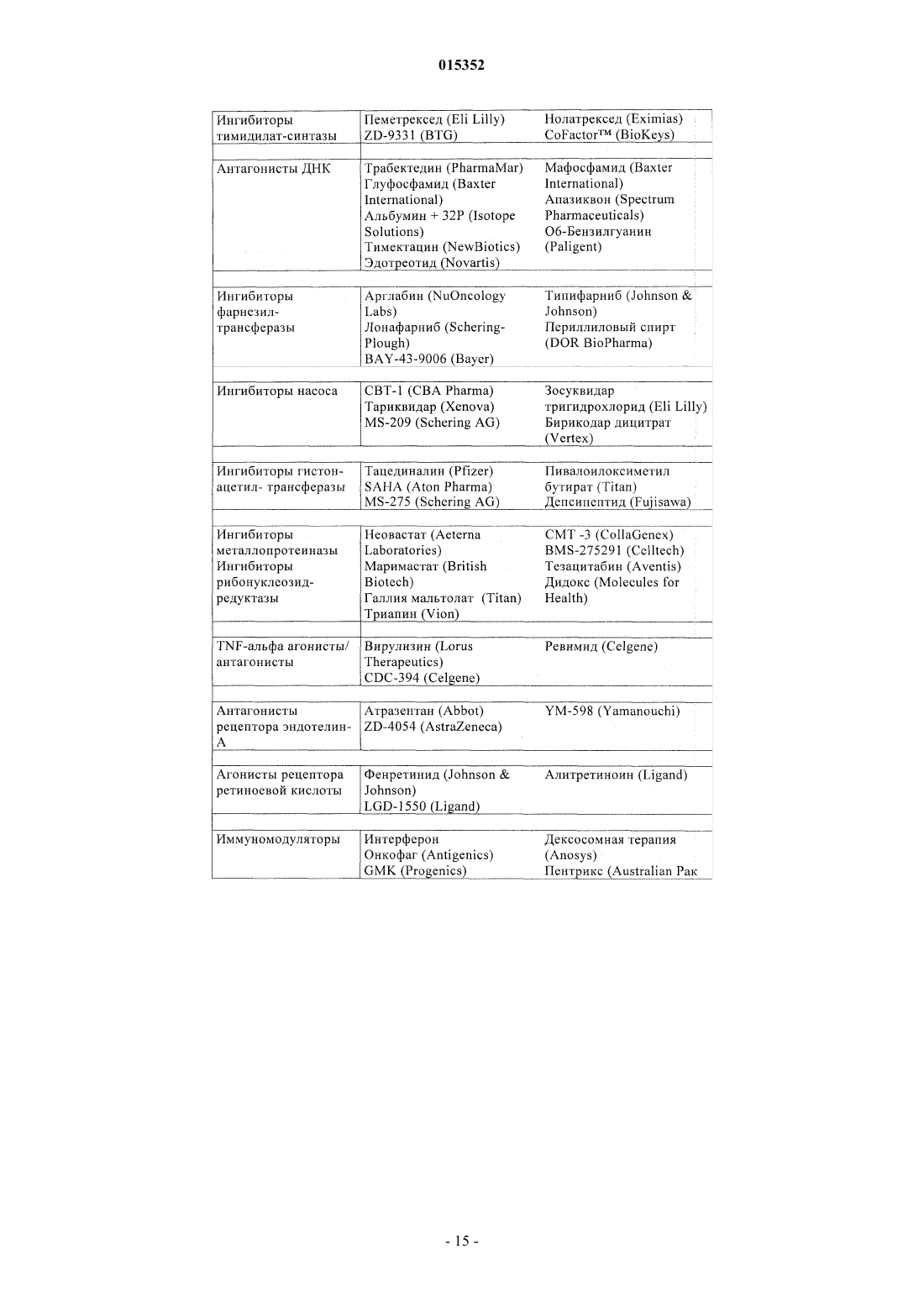
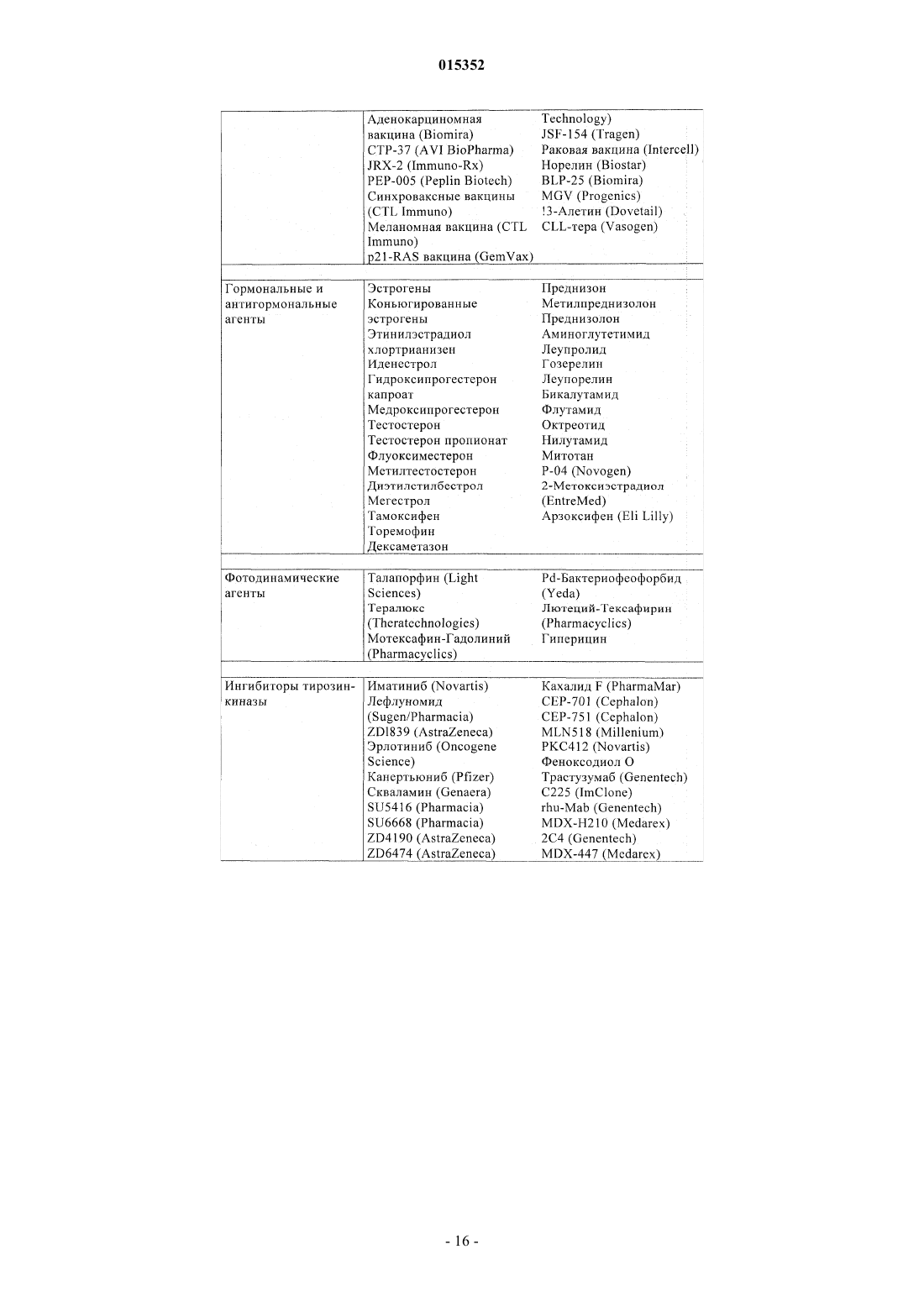
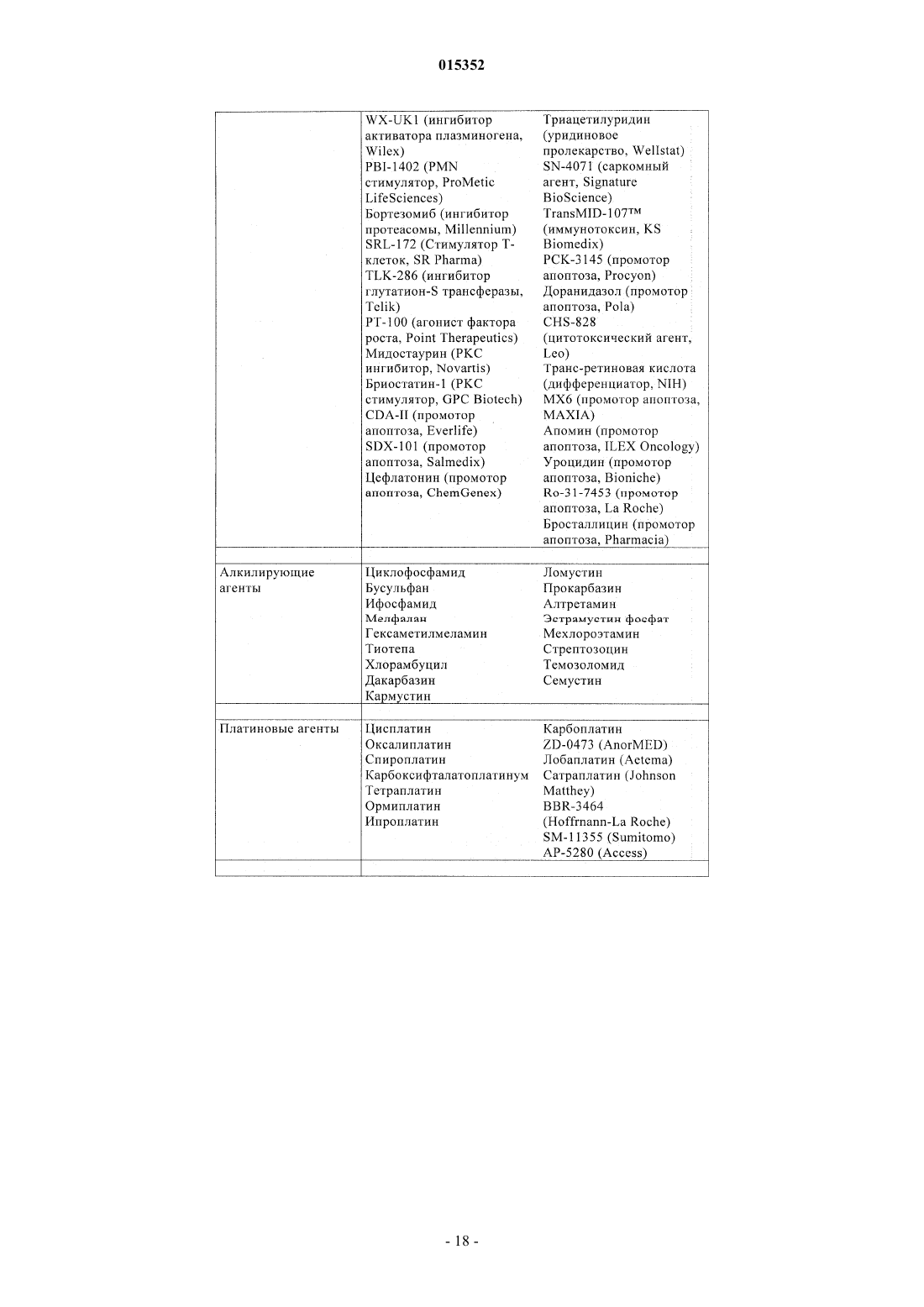
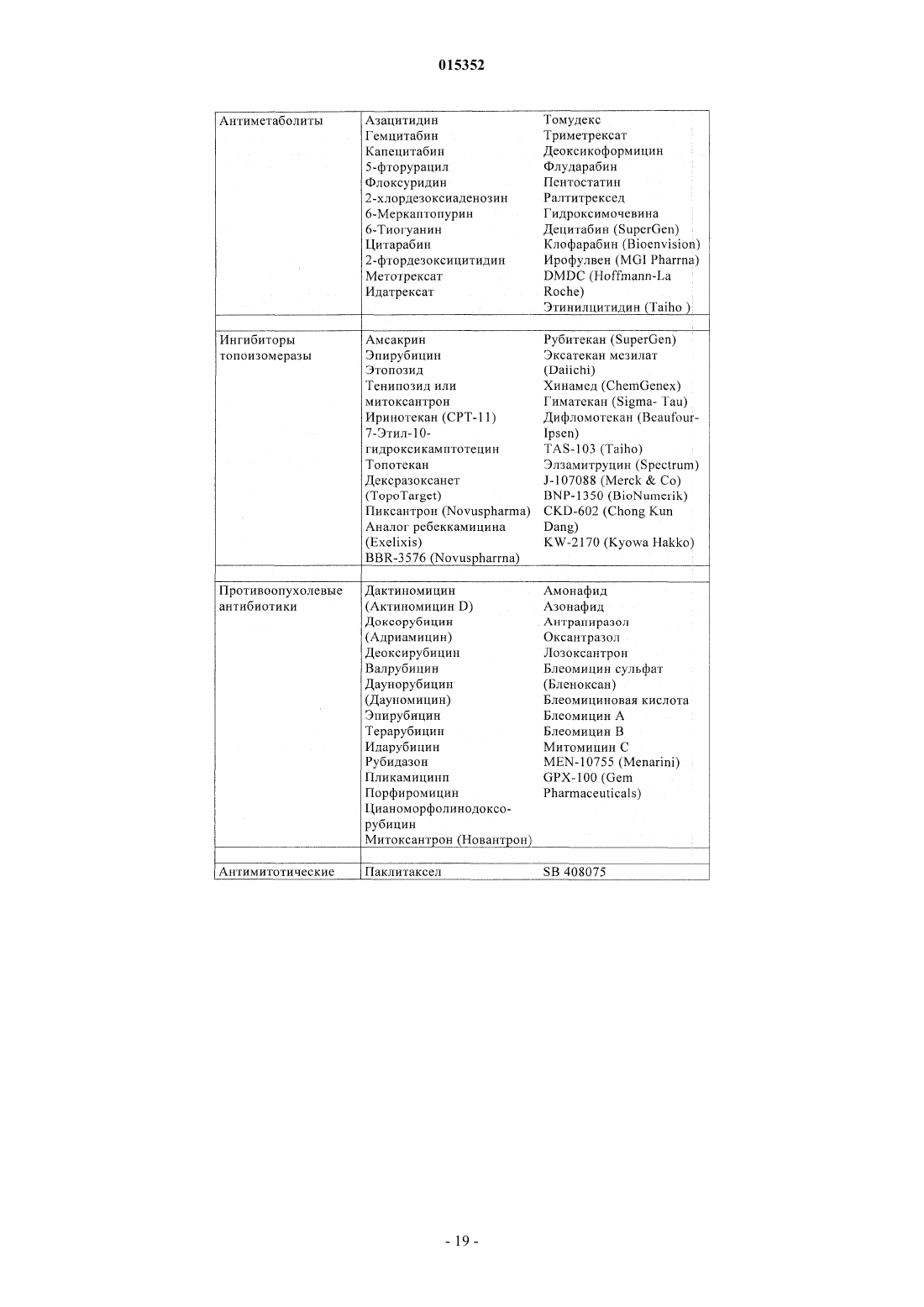
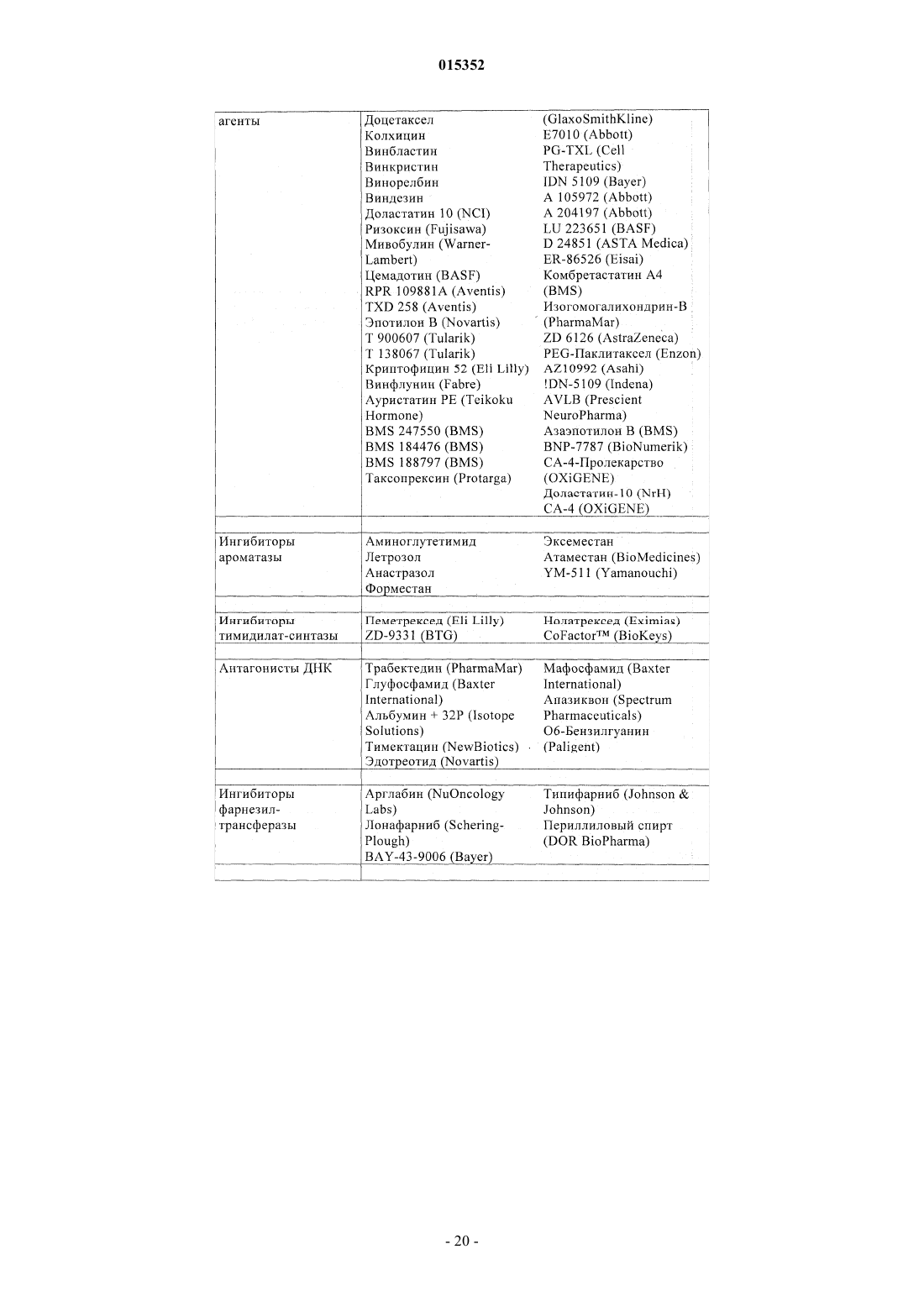
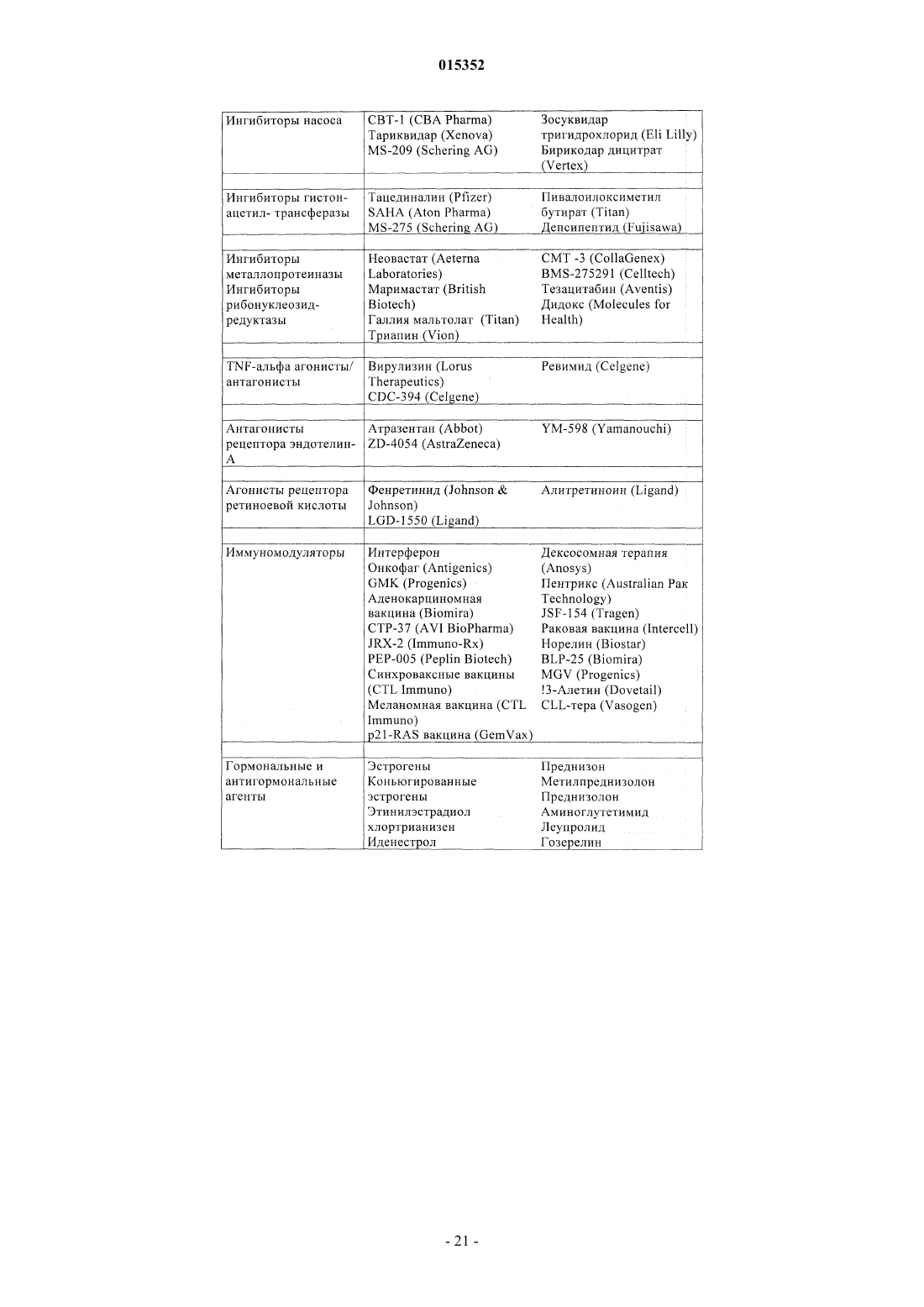
Замещенные 5-фенил-3,6-дигидро-2-оксо-2h-1,3,4-тиадиазины
Номер патента: 15352
Опубликовано: 30.06.2011
Авторы: Блаукат Андрее, Шультц Мелани, Дорш Дитер, Шадт Оливер
Формула / Реферат
1. Соединения формулы I
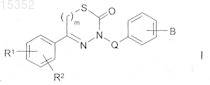
в которой
R1 представляет собой Н, A, Hal, ОН, ОА, SO2A, NO2, COOH, COOA или CN,
R2 представляет собой Н,
В представляет собой NHCOO(CH2)nR3 или NHCO(CH2)nR3,
Q отсутствует или представляет собой линейный или разветвленный алкилен, содержащий 1-4 атома углерода,
R3 представляет собой R1, Het, алкил, содержащий 1-6 атомов углерода, или циклоалкил, содержащий 3-8 атомов углерода, каждый из которых незамещен или одно-, двух-, трех- или четырехзамещен R4,
R4 представляет собой A, Hal, ОН, ОА, SH, SA, SOA, SO2A, NO2, NH2, NHA, NAA', SO2NH2, SO2NHA, SO2NAA', CONH2, CONHA, CONAA', NACOA', NASO2A', COOH, СООА или CN, Het представляет собой моно- или бициклический насыщенный или ароматический гетероцикл, содержащий от 1 до 4 атомов N, О и/или S, который может быть незамещен или одно-, двух- или трехзамещен R4, СНО, СОА, =S, =NH, =NA и/или =O (карбонильным кислородом),
А, А', каждый независимо друг от друга, представляет собой неразветвленный или разветвленный алкил, содержащий 1-10 атомов углерода, в котором 1-7 атомов водорода могут быть заменены F, Cl и/или Br, циклоалкил, содержащий 3-8 атомов углерода, или циклоалкилалкилен, содержащий 4-10 атомов углерода,
Hal представляет собой F, Cl, Br или I,
m представляет собой 0 или 1,
n представляет собой 0, 1, 2 или 3,
и их фармацевтически пригодные сольваты, соли и стереоизомеры, включая их смеси во всех соотношениях.
2. Соединения по п.1, в которых Het представляет собой моноциклический насыщенный или ароматический гетероцикл, содержащий от 1 до 2 атомов N и/или О, который может быть незамещен или одно- или двухзамещен А, и их фармацевтически пригодные сольваты, соли и стереоизомеры, включая их смеси во всех соотношениях.
3. Соединения по п.1 или 2, в которых Q представляет собой СН2, СН(СН3) или СН(СН2СН3), и их фармацевтически пригодные сольваты, соли и стереоизомеры, включая их смеси во всех соотношениях.
4. Соединения по одному из пп.1-3, в которых R3 представляет собой Het или алкил, содержащий 1-6 атомов углерода, или циклоалкил, содержащий 3-8 атомов углерода, каждый из которых незамещен или одно-, двух-, трех- или четырехзамещен R4, и их фармацевтически пригодные сольваты, соли и стереоизомеры, включая их смеси во всех соотношениях.
5. Соединения по одному из пп.1-4, в которых R4 представляет собой ОН, NH2, NHA или NAA', и их фармацевтически пригодные сольваты, соли и стереоизомеры, включая их смеси во всех соотношениях.
6. Соединения по одному из пп.1-5, в которых А, А', каждый независимо друг от друга, представляют собой неразветвленный или разветвленный алкил, содержащий 1-6 атомов углерода, в котором 1-5 атомов водорода могут быть заменены F и/или хлором, и их фармацевтически пригодные сольваты, соли и стереоизомеры, включая их смеси во всех соотношениях.
7. Соединения по одному из пп.1-6, в которых Het представляет собой пиперидинил, пирролидинил, морфолин-4-ил, пиперазинил, 1,3-оксазолидин-3-ил, имидазолидинил, пиридил, пиримидинил, фуранил, тиенил, тиазолил, индолил или индазолил, где радикалы также могут быть одно- или двухзамещены А, и их фармацевтически пригодные сольваты, соли и стереоизомеры, включая их смеси во всех соотношениях.
8. Соединения по одному из пп.1-7, в которых
R1 представляет собой Н, Hal, А, ОН, ОА, SO2A, CN, NO2, СООА или СООН,
R2 представляет собой Н,
В представляет собой NHCOO(CH2)nR3 или NHCO(CH2)nR3,
Q представляет собой СН2, СН(СН3) или СН(СН2СН3),
R3 представляет собой Het или алкил, содержащий 1-6 атомов углерода, или циклоалкил, содержащий 3-8 атомов углерода, каждый из которых незамещен или одно-, двух-, трех- или четырехзамещен R4,
R4 представляет собой ОН, NH2, NHA или NAA',
А, А', каждый независимо друг от друга, представляют собой неразветвленный или разветвленный алкил, содержащий 1-6 атомов углерода, в котором 1-5 атомов водорода могут быть заменены F и/или хлором,
Het представляет собой моноциклический насыщенный или ароматический гетероцикл, содержащий от 1 до 2 атомов N и/или О, который может быть незамещен или одно- или двухзамещен А,
Hal представляет собой F, Cl, Br или I,
m представляет собой 0 или 1,
n представляет собой 0, 1, 2 или 3,
и их фармацевтически пригодные сольваты, соли и стереоизомеры, включая их смеси во всех соотношениях.
9. Соединения по п.1, выбранные из группы, включающей
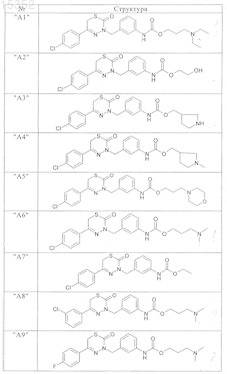
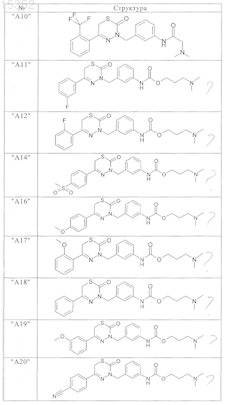
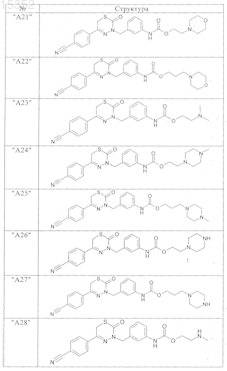
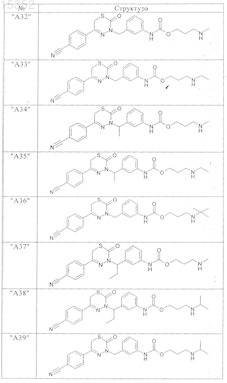
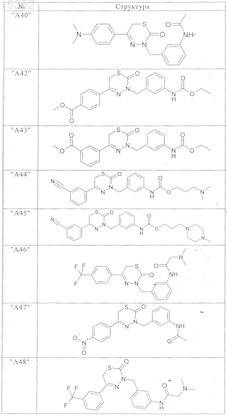
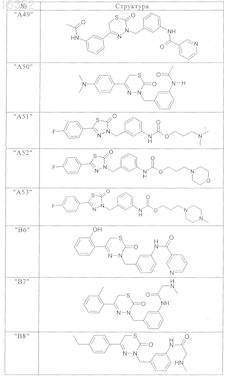
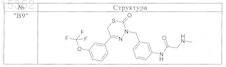
и их фармацевтически пригодные сольваты, соли и стереоизомеры, включая их смеси во всех соотношениях.
10. Способ получения соединений формулы I по одному из пп.1-9 и их фармацевтически пригодных солей, сольватов и стереоизомеров, который характеризуется тем, что соединение формулы Ia
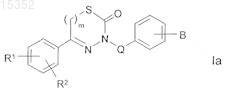
в которой
В представляет собой NH2 и
R1, R2и Q имеют значения, указанные в п.1,
превращают в соединение формулы I, в котором В представляет собой NHCOO(CH2)nR3, путем взаимодействия соединения формулы Ia со связующим реагентом, выбранным из группы:
а) изопроилиден хлорформиата,
б) n-нитрофенил хлорформиата,
в) дифосгена,
г) трифосгена,
и соединением формулы II
![]()
в которой n и R3 имеют значения, указанные в п.1,
и/или основание или кислоту формулы I превращают в одну из его солей.
11. Лекарственное средство, содержащее по меньшей мере одно соединение формулы I по пп.1-9 и/или его фармацевтически пригодные соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях, и необязательно наполнители и/или вспомогательные вещества.
12. Применение соединений по пп.1-9 и их фармацевтически пригодных солей, сольватов и стереоизомеров, включая их смеси во всех соотношениях, для приготовления лекарственного средства для лечения заболеваний, где заболевание, подвергаемое лечению, представляет собой солидную опухоль.
13. Применение по п.12, где солидную опухоль выбирают из группы опухолей плоского эпителия, мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы, кишечника, печени, головного мозга, предстательной железы, мочеполового тракта, лимфатической системы, желудка, гортани и/или легкого.
14. Применение по п.12, где солидную опухоль выбирают из группы моноцитарного лейкоза, аденокарциномы легкого, мелкоклеточного рака легкого, рака поджелудочной железы, глиобластом и рака молочной железы.
15. Применение по п.13, где солидную опухоль выбирают из группы аденокарциномы легкого, мелкоклеточного рака легкого, рака поджелудочной железы, глиобластом, рака толстой кишки и рака молочной железы.
16. Применение соединений по пп.1-9 и их фармацевтически пригодных солей, сольватов и стереоизомеров, включая их смеси во всех соотношениях, для приготовления лекарственного средства для лечения заболеваний, где заболевание, подвергаемое лечению, представляет собой опухоль крови и иммунной системы.
17. Применение по п.16, где опухоль выбирают из группы острого миелоидного лейкоза, хронического миелоидного лейкоза, острого лимфолейкоза и/или хронического лимфолейкоза.
18. Лекарственное средство, содержащее по меньшей мере одно соединение формулы I по одному из пп.1-9 и/или его фармацевтически пригодные сольваты и стереоизомеры, включая их смеси во всех соотношениях, и по меньшей мере один дополнительный активный компонент лекарственного средства.
19. Набор, состоящий из отдельных пакетов.
(а) эффективного количества соединения формулы I по одному из пп.1-9 и/или его фармацевтически пригодных сольватов, солей и стереоизомеров, включая их смеси во всех соотношениях, и
(б) эффективного количества дополнительного активного компонента лекарственного средства.
Текст
(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE) 015352 Предпосылки создания изобретения Объектом изобретения является выявление новых соединений, обладающих ценными свойствами, в частности тех, которые могут применяться для приготовления лекарственных средств. Настоящее изобретение относится к соединениям и к применению соединений, которые принимают участие в ингибировании, регуляции и/или модуляции передачи сигналов с помощью киназ, в особенности тирозинкиназ и/или серин/треонин киназ, а также к фармацевтическим композициям, которые содержат указанные соединения, и к применению соединений для лечения заболеваний, индуцированных киназой. В частности, настоящее изобретение относится к соединениям и к применению соединений, которые принимают участие в ингибировании, регуляции и/или модуляции сигналов с помощью Met киназы. Одним из основных механизмов, с помощью которого осуществляется клеточная регуляция, является трансдукция внеклеточных сигналов через мембрану, что, в свою очередь, модулирует биохимические пути передачи сигналов в клетке. Фосфорилирование белков представляет собой один путь, с помощью которого внеклеточные сигналы передаются от молекулы к молекуле, что в результате приводит к ответной реакции в клетке. Эти каскады трансдукции сигналов в высокой степени регулируются и часто перекрываются, очевидно, вследствие существования многих протеинкиназ, а также фосфатаз. Фосфорилирование белков преимущественно происходит в остатках серина, треонина или тирозина, поэтому протеинкиназы классифицируют по специфичности их участков фосфорилирования, то есть серин/треониновые киназы и тирозинкиназы. Поскольку фосфорилирование представляет собой широкораспространенный процесс в клетках, а фенотипы клеток значительно зависят от активности этих путей,то в настоящее время полагают, что многие болезненные состояния и/или заболевания могут быть вызваны или аберрантной активацией или функциональными мутациями в молекулярных компонентах киназных каскадов. Следовательно, характеристике этих белков и соединений, способных регулировать их активность, уделяется пристальное внимание (для обзора см. Weinstein-Oppenheimer и др. Pharma. .Therap., 2000, 88, 229-279). Роль рецепторной тирозинкиназы Met в образовании и развитии опухолей у людей и возможность ингибирования HGF (фактор роста гепатоцитов)-зависимой активации Met описаны S. Berthou и др. вOncogene, т. 23,31, cc. 5387-5393 (2004). Ингибитор SU11274, раскрытый в этом источнике, пирролиндолиновое соединение, потенциально пригоден для борьбы со злокачественным новообразованием. Другой ингибитор Met киназы для лечения злокачественного новообразования описан J.G. Christensen и др. в Cancer Res. 2003, 63(21), 7345-55. Дальнейший ингибитор тирозинкиназы для борьбы со злокачественным новообразованием описан Н. Hov и др. в Clinical Cancer Research т. 10, 6686-6694 (2004). Соединение РНА-665752, производное индола, направлено против HGF рецептора c-Met. Кроме того, в этом документе описано, что HGF и Met оказывают существенное влияние на злокачественность различных видов рака, таких как, например,множественная миелома. Поэтому является желательным синтезировать небольшие соединения, которые специфически ингибируют, регулируют и/или модулируют передачу сигналов с помощью тирозинкиназ и/или серин/треонин киназ, в частности Met киназы, и это составляет задачу настоящего изобретения. Было обнаружено, что соединения в соответствии с изобретением и их соли обладают чрезвычайно ценными фармакологическими свойствами, а также хорошей переносимостью. Более подробно, настоящее изобретение относится к соединениям формулы I, которые ингибируют,регулируют и/или модулируют передачу сигналов Met киназами, к композициям, которые содержат эти соединения, и к способам их применения для лечения заболеваний и состояний, индуцированных Met киназой, таких как ангиогенез, рак, образование, рост и распространение опухолей, артериосклероз, заболевания глаз, такие как дегенерация желтого пятна, связанная со старением, образование новых сосудов в хориоидальной оболочке и диабетическая ретинопатия, воспалительные заболевания, артрит,тромбоз, фиброз, гломерулонефрит, нейродегенерация, псориаз, рестеноз, заживление ран, отторжение трансплантата, нарушения обмена веществ и заболевания иммунной системы, а также аутоиммунные заболевания, цирроз, диабет и заболевания кровеносных сосудов, включая нестабильность и проницаемость, и др., у млекопитающих. Солидные опухоли, в особенности быстрорастущие опухоли, можно подвергать лечению с применением ингибиторов Met киназы. Такие солидные опухоли включают моноцитарный лейкоз, рак головного мозга, мочеполового тракта, лимфатической системы, желудка, гортани и легкого, включая аденокарциному легкого и мелкоклеточный рак легкого. Настоящее изобретение относится к способам регуляции, модуляции или ингибирования Met киназы для предотвращения и/или лечения заболеваний, связанных с нерегулируемой или нарушенной активностью Met киназы. В частности, соединения формулы I также могут применяться для лечения определенных типов злокачественных новообразований. Кроме того, соединения формулы I могут применяться для обеспечения дополнительного или синергетического действий при определенных существующих химиотерапиях при лечении злокачественных новообразований и/или могут применяться для восстановления эффективности определенных существующих химиотерапий и лучевых терапий.-1 015352 Соединения формулы I также могут применяться для выделения и исследования активности или экспрессии Met киназы. Дополнительно, они чрезвычайно пригодны для применения в диагностических способах при заболеваниях, связанных с нерегулируемой или нарушенной активностью Met киназы. Может быть продемонстрировано, что соединения в соответствии с изобретением обладают антипролиферативным действием в условиях in vivo на модели ксенотрансплантированной опухоли. Соединения в соответствии с изобретением вводятся пациенту с гиперпролиферативным заболеванием, например, для ингибирования роста опухоли, для уменьшения воспаления, связанного с лимфопролиферативным заболеванием, для ингибирования отторжения трансплантата или неврологического повреждения в результате восстановления ткани и т.д. Эти соединения пригодны для профилактических или терапевтических целей. Как используется настоящее изобретение, термин "лечение" применяется для обозначения как предотвращения заболеваний, так и лечения ранее существующих состояний. Предотвращение пролиферации достигают путем введения соединений в соответствии с изобретением до явного развития заболевания, например для предотвращения роста опухолей, предотвращения метастатического роста,уменьшения рестеноза, связанного с сердечно-сосудистой хирургией и т.д. Альтернативно, соединения применяются для лечения продолжающихся заболеваний путем стабилизации или улучшения клинических симптомов у пациента. Хозяин или пациент может принадлежать к любому виду млекопитающих, например, такому как приматы, предпочтительно человек; грызуны, включая мышей, крыс и хомячков, кролики; лошади, коровы, собаки, коты и т.д. Животные модели представляют интерес для экспериментальных исследований,поскольку они обеспечивают модель для лечения заболевания человека. Чувствительность определенной клетки к лечению с помощью соединений в соответствии с изобретением может быть определена при исследованиях в условиях in vitro. В общем случае культуру клеток объединяют с соединением в соответствии с изобретением при различных концентрациях в течение периода времени, достаточного для того, чтобы позволить активным веществам индуцировать гибель клетки или ингибировать миграцию, обычно в интервале времени приблизительно от одного часа до одной недели. Для исследования в условиях in vitro можно использовать культивируемые клетки из образца биопсии. Затем подсчитывают жизнеспособные клетки, оставшиеся после обработки. Доза будет изменяться в зависимости от конкретного применяемого соединения, конкретного заболевания, состояния пациента и т.д. Обычно терапевтическая доза будет достаточной для существенного уменьшения нежелательной популяции клеток в ткани-мишени, при поддержании жизнеспособности пациента. Лечение в общем случае продолжают до тех пор, пока не будет достигнуто существенное уменьшение, например по меньшей мере приблизительно 50% уменьшения популяции клеток, представляющих интерес, при этом лечение можно продолжать до тех пор, пока, по существу, в организме не будет определяться нежелательные клетки. Для идентификации пути сигнальной трансдукции и определения взаимодействия между различными сигнальными путями различными учеными были разработаны приемлемые модели или модельные системы, например модели на основе культур клеток (например, Khwaja и др., ЕМВО, 1997, 16, 2783-93) и модели трансгенных животных (например, White и др., Oncogene, 2001, 20, 7064-7072). С целью проверки определенных этапов каскада для сигнальной трансдукции можно использовать соединения, которые препятствуют этому процессу (например, Stephens и др., Biochemical J., 2000, 351, 95-105). Соединения в соответствии с изобретением могут также быть полезными в качестве реагентов для тестирования зависимых от киназы путей сигнальной трансдукции у животных и/или на моделях культур клеток, а также на любом из клинических расстройств, указанных в данной заявке. Измерение киназной активности представляет собой известный способ, который может осуществить любой специалист в данной области. Общие аналитические системы для определения киназной активности с субстратами, например гистоном (например, Alessi и др., FEBS Lett. 1996, 399, 3, стр. 333-338) или основным миелиновым белком описаны в литературе (например, Campos-Gonzalez, R. и Glenney, Jr.,J.R. 1992, J. Biol. Chem. 267, стр. 14535). Для идентификации ингибиторов киназы доступными являются различные аналитические системы. В исследовании сцинтилляционной схожести (Sorg и др., J. of Biomolecular Screening, 2002, 7, 11-19) и анализе флэш-планшетов измеряют радиоактивное фосфорилирование белка или пептида в качестве субстрата с АТР. В присутствии ингибиторного соединения не выявляется никакого сигнала или выявляется снижение радиоактивного сигнала. Кроме того, в качестве аналитических способов являются полезными способы гомогенного переноса энергии флуоресцентного резонанса с разрешением во времени(HTR-FRET) и флуоресцентной поляризации (FP) (Sills и др., J. Biomolecular Screening, 2002, 191-214). В других нерадиоактивных способах анализа на основе ELISA используются специфические фосфоантитела (фосфо-АВ). Фосфо-АВ связываются только с фосфорилированным субстратом. Это связывание может быть определено с использованием вторичного антиовечьего антитела, конъюгированного с пероксидазой, с помощью хемолюминисценции (Ross и др., 2002, Biochem. J.). Существует много заболеваний, связанных с нарушением регулирования пролиферации клеток и клеточной гибели (апоптоза). Состояния, которые представляют интерес, включают, но не ограничиваясь только ими, следующие состояния. Соединения в соответствии с изобретением являются полезными для-2 015352 лечения разнообразных состояний, при которых существует пролиферация и/или миграция клеток гладкой мускулатуры и/или воспалительных клеток в слой интимы сосудов, что приводит к ограниченному потоку крови через этот сосуд, например, в случае неоинтимальных окклюзивных повреждений. Окклюзивные заболевания трансплантированных сосудов, которые представляют интерес, включают атеросклероз, коронарное сосудистое заболевание после трансплантации, стеноз в результате пересадки вен,перианастомотический рестеноз в результате введения протеза, рестеноз после ангиопластики или внедрения стента и т.п. Уровень техники Другие тиадиазиноны описаны в WO 03/037349. 4,5-Дигидропиразолы для лечения злокачественного новообразования описаны в WO 03/079973 А 2. Производные хинолина описаны в качестве Met киназы в ЕР 1411046 А 1. Производные пирролиндолина описаны в качестве ингибиторов Met киназы из WO 02/096361 А 2. Сущность изобретения Изобретение относится к соединениям формулы IR1 представляет собой Н, A, Hal, ОН, ОА, SO2A, NO2, COOH, COOA или CN,R2 представляет собой Н,В представляет собой NHCOO(CH2)nR3 или NHCO(CH2)nR3,Q отсутствует или представляет собой линейный или разветвленный алкилен, содержащий 1-4 атомов углерода,R3 представляет собой R1, Het, алкил, содержащий 1-6 атомов углерода, или циклоалкил, содержащий 3-8 атомов углерода, каждый из которых незамещен или одно-, двух-, трех- или четырехзамещен R4,R4 представляет собой A, Hal, ОН, ОА, SH, SA, SOA, SO2A, NO2, NH2, NHA, NAA', SO2NH2,SO2NHA, SO2NAA', CONH2, CONHA, CONAA', NACOA', NASO2A', COOH, COOA или CN,Het представляет собой моно- или бициклический насыщенный или ароматический гетероцикл, содержащий от 1 до 4 атомов N, О и/или S, который может быть незамещен или одно-, двух- или трехзамещен R4, CHO, COA, =S, =NH, =NA и/или =O (карбонильным кислородом),А, А', каждый независимо друг от друга, представляет собой неразветвленный или разветвленный алкил, содержащий 1-10 атомов углерода, в котором 1-7 атомов водорода могут быть заменены F, Cl и/или Br, циклоалкил, содержащий 3-8 атомов углерода или циклоалкилалкилен, содержащий 4-10 атомов углерода,Hal представляет собой F, Cl, Br или I,m представляет собой 0 или 1,n представляет собой 0, 1, 2 или 3,и их фармацевтически пригодные сольваты, соли и стереоизомеры, включая их смеси во всех соотношениях. Изобретение также относится к оптически активным формам (стереоизомерам), энантиомерам, рацематам, диастереомерам, а также гидратам и сольватам указанных соединений. Под сольватами соединений подразумевают аддукты молекул инертного растворителя на соединениях, которые образуются благодаря их силе взаимного притяжения. Сольваты представляют собой, например, моногидраты или дигидраты или алкоголяты. Под фармацевтически пригодными производными подразумевают, например, соли соединений в соответствии с изобретением, а также так называемые пролекарства соединений. Под производными пролекарств подразумевают соединения формулы I, которые являются модифицированными, например, алкильной или ацильной группами, сахарами или олигопептидами, и которые быстро расщепляются в организме с образованием активных соединений в соответствии с изобретением. Это понятие также включает производные биоразлагаемых полимеров соединений в соответствии с изобретением, как описано, например, в Int. J. Pharm. 115, 61-67 (1995). Выражение "эффективное количество" обозначает количество лекарственного средства или фармацевтического активного компонента, которое вызывает в ткани, системе, животном или человеке биологическую или медицинскую ответную реакцию, которую предполагает или желает получить, например,исследователь или лечащий врач. Дополнительно выражение "терапевтически эффективное количество" обозначает то количество,которое имеет следующие последствия по сравнению с соответствующим субъектом, который не получал этого количества: улучшение лечения, излечение, предотвращение или элиминацию заболевания,-3 015352 синдрома, состояния, жалобы, расстройства или побочных действий, или также уменьшение прогрессирования заболевания, жалобы, расстройства или побочных действий или также уменьшения прогрессирования заболевания, жалобы или расстройства. Выражение "терапевтически эффективное количество" также охватывает количества, которые эффективны для повышения нормальной физиологической функции. Изобретение также относится к применению смесей соединений формулы I, например смесей двух диастереомеров, например, в соотношении 1:1, 1:2, 1:3, 1:4, 1:5, 1:10, 1:100 или 1:1000. Особенно предпочтительными являются смеси стереоизомерных соединений. Изобретение относится к соединениям формулы I и их солям, и к способу получения соединений формулы I в соответствии с пп.1-11 и их фармацевтически приемлемых производных, солей, сольватов и стереоизомеров, который характеризуется тем, что соединение формулы IaR1, R2, m и Q имеют значения, указанные в п.1,превращают в соединение формулы I, в котором В представляет собой NHCOO(CH2)nR3,путем взаимодействия соединения формулы Ia со связующим реагентом, выбранным из группы: а) изопроилиден хлорформиата,б) n-нитрофенил хлорформиата,в) дифосгена,г) трифосгена,и соединением формулы II НО(СН 2)nR3 II 3 в которой n и R имеют значения, указанные в п.1,и/или основание или кислоту формулы I превращают в одну из его солей. При указании выше и ниже, радикалы R1, R2, Q и В имеют значения, указанные для формулы I, если специально не указано иначе. А или А' представляет собой алкил, который является неразветвленным (линейным) или разветвленным и имеет 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода. А предпочтительно представляет собой метил, кроме того, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил, а также пентил,1-, 2- или 3-метилбутил, 1,1-, 1,2- или 2,2-диметилпропил, 1-этилпропил, гексил, 1-, 2-, 3- или 4 метилпентил, 1,1-, 1,2-, 1,3-, 2,2-, 2,3- или 3,3-диметилбутил, 1- или 2-этилбутил, 1-этил-1-метилпропил,1-этил-2-метилпропил, 1,1,2- или 1,2,2-триметилпропил, более предпочтительно, например, трифторметил. А наиболее предпочтительно представляет собой алкил, содержащий 1, 2, 3, 4, 5 или 6 атомов углерода, предпочтительно метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил,гексил, трифторметил, пентафторэтил или 1,1,1-трифторэтил. Циклоалкил предпочтительно представляет собой циклопропил, циклобутил, циклопентил, циклогексил или циклогептил. Циклоалкилалкилен предпочтительно представляет собой циклопропилметил, циклобутилметил,циклопентилметил, циклогексилметил или циклогептилметил. Независимо от дальнейших замещений, Het предпочтительно представляет собой, например, 2- или 3-фурил, 2- или 3-тиенил, 1-, 2- или 3-пирролил, 1-, 2-, 4- или 5-имидазолил, 1-, 3-, 4- или 5-пиразолил, 2-,4- или 5-оксазолил, 3-, 4- или 5-изоксазолил, 2-, 4- или 5-тиазолил, 3-, 4- или 5-изотиазолил, 2-, 3- или 4 пиридил, 2-, 4-, 5- или 6-пиримидинил, более предпочтительно 1,2,3-триазол-1-, -4- или -5-ил, 1,2,4 триазол-1-, -3- или -5-ил, 1- или 5-тетразолил, 1,2,3-оксадиазол-4- или -5-ил, 1,2,4-оксадиазол-3- или -5 ил, 1,3,4-тиадиазол-2- или -5-ил, 1,2,4-тиадиазол-3- или -5-ил, 1,2,3-тиадиазол-4- или -5-ил, 3- или 4 пиридазинил, пиразинил, 1-, 2-, 3-, 4-, 5-, 6- или 7-индолил, 4- или 5-изоиндолил, индазолил, 1-, 2-, 4- или 5-бензимидазолил, 1-, 3-, 4-, 5-, 6- или 7-бензопиразолил, 2-, 4-, 5-, 6- или 7-бензоксазолил, 3-, 4-, 5-, 6 или 7- бензизоксазолил, 2-, 4-, 5-, 6- или 7-бензотиазолил, 2-, 4-, 5-, 6- или 7-бензизотиазолил, 4-, 5-, 6 или 7-бенз-2,1,3-оксадиазолил, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолил, 1-, 3-, 4-, 5-, 6-, 7- или 8-изохинолил, 3-,4-, 5-, 6-, 7- или 8-циннолинил, 2-, 4-, 5-, 6-, 7- или 8-хиназолинил, 5- или 6-хиноксалинил, 2-, 3-, 5-, 6-, 7 или 8-2 Н-бензо-1,4-оксазинил, более предпочтительно 1,3-бенздиоксол-5-ил, 1,4-бенздиоксан-6-ил, 2,1,3 бензотиадиазол-4-, -5-ил или 2,1,3-бензоксадиазол-5-ил или дибензофуранил. Гетероциклические радикалы также могут быть частично или полностью гидрированы.-4 015352 Независимо от дальнейших замещений Het также может представлять собой, например, 2,3 дигидро-2-, -3-, -4- или -5-фурил, 2,5-дигидро-2-, -3-, -4- или 5-фурил, тетрагидро-2- или -3-фурил, 1,3 диоксолан-4-ил, тетрагидро-2- или -3-тиенил, 2,3-дигидро-1-, -2-, -3-, -4- или -5-пирролил, 2,5-дигидро-1-,-2-, -3-, -4- или -5-пирролил, 1-, 2- или 3-пирролидинил, тетрагидро-1-, -2- или -4-имидазолил, 2,3 дигидро-1-, -2-, -3-, -4- или -5-пиразолил, тетрагидро-1-, -3- или -4-пиразолил, 1,4-дигидро-1-, -2-, -3- илиHet предпочтительно представляет собой моноциклический насыщенный или ароматический гетероцикл, содержащий от 1 до 2 атомов N и/или О, который может быть одно- или двухзамещен А и/или=O (карбонильным кислородом). Het более предпочтительно представляет собой пиперидинил, пирролидинил, морфолин-4-ил, пиперазинил, 1,3-оксазолидин-3-ил, имидазолидинил, пиридил, пиримидинил,фуранил, тиенил, тиазолил, индолил или индазолил, где радикалы также могут быть одно- или двухзамещены А.R1 предпочтительно представляет собой Н, Hal, А, ОН, ОА, SO2A, CN, NO2, СООА или СООН, в частности Cl, наиболее предпочтительно 4-Cl.R2 предпочтительно представляет собой Н или Hal. В предпочтительно представляет собой NHCOO(CH2)nR3, кроме того, NHCO(CH2)nR3. Радикал В предпочтительно находится в мета-положении по отношению к Q.Q предпочтительно представляет собой СН 2, СН(СН 3) или СН(СН 2 СН 3).R3 предпочтительно представляет собой Het или алкил, содержащий 1-6 атомов углерода, или циклоалкил, содержащий 3-8 атомов углерода, каждый из которых незамещен или одно-, двух-, трех- или четырехзамещен R4.R3 более предпочтительно представляет собой 2-гидроксиэтил, пирролидинил, N-метилпирролидинил-, морфолин-4-ил, 3-(N,N-диэтиламино)пропил, 3-(N,N-диметиламино)пропил, метил,этил, пропил, пиридил, 1-метилпиперазин-4-ил, пиперазин-4-ил,R4 предпочтительно представляет собой ОН, амино, метиламино, диметиламино, этиламино, диэтиламино, трет-бутиламино, изопропиламино,Hal предпочтительно представляет собой F, Cl или Br, но также и I, более предпочтительно F илиCl. Для всего изобретения все радикалы, которые встречаются более одного раза, могут быть одинаковыми или разными, то есть их значения являются независимыми друг от друга. Соединения формулы I могут иметь один или несколько хиральных центров и поэтому могут встречаться в разных стереоизомерных формах. Формула I охватывает все эти формы. Таким образом, изобретение относится, в частности, к соединениям формулы I, в которых по меньшей мере один из указанных радикалов имеет одно из предпочтительных значений, указанных выше. Некоторые предпочтительные группы соединений могут быть представлены следующими подформулами Ia-Ii, которые соответствуют формуле I и в которых значения радикалов существенно не отличаются от значений, приведенных для формулы I, но в которых в Ia R1 представляет собой Н, Hal, А, ОН, ОА, SO2A, CN, NO2, СООА или СООН; в Ib R2 представляет собой Н или Hal; в Ic Het представляет собой моноциклический насыщенный или ароматический гетероцикл, содержащий от 1 до 2 атомов N и/или О, который может быть незамещен или одно- или двухзамещен А; в Id Q представляет собой СН 2, СН(СН 3) или СН(СН 2 СН 3); в Ie R3 представляет собой Het или алкил, содержащий 1-6 атомов углерода, или циклоалкил, содержащий 3-8 атомов углерода, каждый из которых незамещен или одно-, двух-, трех- или четырехзамещен R4; в If R4 представляет собой ОН, NH2, NHA или NAA'; в Ig А, А', каждый независимо друг от друга, представляет собой неразветвленный или разветвленный алкил, содержащий 1-6 атомов углерода, в котором 1-5 атомов водорода могут быть заменены F и/или хлором; в Ih Het представляет собой пиперидинил, пирролидинил, морфолин-4-ил, пиперазинил, 1,3 оксазолидин-3-ил, имидазолидинил, пиридил, пиримидинил, фуранил, тиенил, тиазолил, индолил или индазолил, где радикалы также могут быть одно- или двухзамещены А;-5 015352 в Ii R1 представляет собой Н, Hal, А, ОН, ОА, SO2A, CN, NO2, СООА или СООН,R2 представляет собой Н или Hal,R1 и R2 вместе также представляют собой метилендиокси,В представляет собой NHCOO(CH2)nR3 или NHCO(CH2)nR3,Q представляет собой СН 2, СН(СН 3) или СН(СН 2 СН 3),R3 представляет собой Het или алкил, содержащий 1-6 атомов углерода, или циклоалкил, содержащий 3-8 атомов углерода, каждый из которых незамещен или одно-, двух-, трех- или четырехзамещен R4,R4 представляет собой ОН, NH2, NHA или NAA',А, А', каждый независимо друг от друга, представляет собой неразветвленный или разветвленный алкил, содержащий 1-6 атомов углерода, в котором 1-5 атомов водорода могут быть заменены F и/или хлором,Het представляет собой моноциклический насыщенный или ароматический гетероцикл, содержащий от 1 до 2 атомов N и/или О, который может быть незамещен или одно- или двухзамещен А,Hal представляет собой F, Cl, Br или I,m представляет собой 0 или 1,n представляет собой 0, 1, 2 или 3; и его фармацевтически пригодные производные, соли, сольваты, таутомеры и стереоизомеры, включая их смеси во всех соотношениях. Соединения формулы I, а также исходные вещества для их получения могут, кроме того, быть получены при помощи методов, известных per se, как описано в литературе (например, в стандартных работах, таких как Houben-Weyl, Methoden der organischen Chemie [Методы органической химии], GeorgThieme-Verlag, Штутгарт), в соответствии с условиями реакций, которые известны и приемлемы для указанных реакций. Также при этом можно применять разнообразные модификации, которые известные perse, но о которых здесь подробно не упоминается. Исходные соединения формул Ia и II, как правило, известны. Однако если они являются новыми, то они могут быть получены методами, известными per se. Соединения формулы I предпочтительно могут быть получены путем взаимодействия соединения формулы Ia со связующим реагентом, выбранным из группы: а) изопроилиден хлорформиата,б) n-нитрофенил хлорформиата,в) дифосгена,г) трифосгена,с соединением формулы II. Взаимодействие предпочтительно осуществляют путем реакции в одном сосуде. Обычно реакцию осуществляют в инертном растворителе. В зависимости от применяемых условий, продолжительность реакции находится в интервале от нескольких минут до 14 дней, температура реакции находится в интервале приблизительно от -15 до 150,обычно в интервале от -5 до 90, более предпочтительно в интервале от 20 до 60 С. Примерами подходящих инертных растворителей являются углеводороды, такие как гексан, петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, такие как трихлорэтилен, 1,2 дихлорэтан, четыреххлористый углерод, хлороформ или дихлорметан; спирты, такие как метанол, этанол, изопропанол, н-пропанол, н-бутанол или трет-бутанол; простые эфиры, такие как диэтиловый эфир,диизопропиловый эфир, тетрагидрофуран (ТГФ) или диоксан; гликолевые эфиры, такие как этиленгликольмонометиловый или моноэтиловый эфир, этиленгликольдиметиловый эфир (диглим); кетоны, такие как ацетон или бутанон; амиды, такие как ацетамид, диметилацетамид или диметилформамид (ДМФА); нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид (ДМСО); сероуглерод,карбоновые кислоты, такие как муравьиная кислота или уксусная кислота, нитросоединения, такие как нитрометан или нитробензол; сложные эфиры, такие как этилацетат, или смеси указанных растворителей. Особенно предпочтительными являются ТГФ, дихлорметан и/или ДМФА. Обычно реакцию осуществляют в присутствии вещества, связывающего кислоту, предпочтительно органического основания, такого как DIPEA, триэтиламин, диметиланилин, пиридин или хинолин. Прибавление гидроксида щелочного или щелочно-земельного металла, карбоната или бикарбоната или другой соли слабой кислоты щелочных или щелочно-земельных металлов, предпочтительно калия,натрия, кальция или цезия, также может являться благоприятным. Фармацевтические соли и другие формы Соединения, раскрытые в изобретении, могут использоваться в своей заключительной, несолевой форме. С другой стороны, настоящее изобретение также относится к применению таких соединений в форме их фармацевтически приемлемых солей, которые могут быть получены с помощью разнообразных органических и неорганических кислот и оснований в соответствии со способами, хорошо известными в данной области техники. Фармацевтически приемлемые формы солей соединений формулы I готовят, главным образом, при использовании традиционных способов. В случае, если соединение формулы I содержит группу карбоновой кислоты, то его приемлемая соль может быть образована с помо-6 015352 щью реакции соединения с приемлемым основанием для получения соответствующей соли присоединения основания. Примерами таких оснований являются гидроксиды щелочных металлов, включая гидроксид калия, гидроксид натрия и гидроксид лития; гидроксиды щелочно-земельных металлов, такие как гидроксид бария и гидроксид кальция; алкоксиды щелочных металлов, например, этанолят калия и пропанолят натрия; а также различные органические основания, такие как пиперидин, диэтаноламин и Nметилглутамин. Сюда также включены соли алюминия соединений формулы I. Для некоторых соединений формулы I соли присоединения кислоты могут быть образованы путем обработки указанных соединений фармацевтически приемлемыми органическими и неорганическими кислотами, например гидрогалогенидами, такими как гидрохлорид, гидробромид или гидройодид; другими минеральными кислотами и их соответствующими солями, такими как сульфат, нитрат или фосфат и др.; и алкил- и моноарилсульфонатами, такими как этансульфонат, толуолсульфонат и бензолсульфонат; и другими органическими кислотами и их соответствующими солями, такими как ацетат, трифторацетат, тартрат, малеат, сукцинат, цитрат, бензоат, салицилат, аскорбат и др. Таким образом, фармацевтически приемлемые соли присоединения кислоты соединений формулы I включают следующие соли, но не ограничиваясь только ими: ацетат, адипат, альгинат, аргинат, аспартат, бензоат, бензолсульфонат (безилат), бисульфат, бисульфит, бромид, бутират, камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат, цитрат, циклопентанпропионат, диглюконат, дигидрофосфат, динитробензоат, додецилсульфат, этансульфонат, фумарат, галактерат (из слизевой кислоты), галактуронат, глюкогептаноат, глюконат, глутамат, глицерофосфат, гемисукцинат, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, йодид, изотионат, изобутират, лактат, лактобионат, малат, малеат, малонат, манделат, метафосфат, метансульфонат, метилбензоат, моногидрофосфат, 2-нафталинсульфонат,никотинат, нитрат, оксалат, олеат, пальмоат, пектинат, персульфат, фенилацетат, 3-фенилпропионат,фосфат, фосфонат, фталат. Кроме того, основные соли соединений в соответствии с изобретением включают, но не ограничиваясь только ими, соли алюминия, аммония, кальция, меди, железа(III), железа(II), лития, магния, марганца(III), марганца(II), калия, натрия и цинка. Предпочтительными среди перечисленных выше солей являются аммонийные; соли щелочных металлов натрия и калия; и соли щелочно-земельных металлов кальция и магния. Соли соединений формулы I, которые имеют происхождение от фармацевтически приемлемых органических нетоксических оснований, включают, но не ограничиваясь только ими, соли первичных, вторичных и третичных аминов, замещенных аминов, также включая природные замещенные амины, циклические амины и основные ионообменные смолы, например аргинин, бетаин, кофеин,хлорпрокаин, холин, N,N'-дибензилэтилендиамин (бензатин), дициклогексиламин, диэтаноламин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, Nэтилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лидокаин, лизин, меглумин, N-метил-D-глюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурины,теобромин, триэтаноламин, триэтиламин, триметиламин, трипропиламин и трис-(гидроксиметил)метиламин (трометамин). Соединения в соответствии с настоящим изобретением, которые включают основные азотсодержащие группы, могут быть кватернизированы с помощью таких агентов, как С 1-С 4-алкилгалогениды, например метил-, этил-, изопропил- и трет-бутилхлориды, бромиды и йодиды; ди-С 1-С 4-алкилсульфаты,например диметил-, диэтил- и диамилсульфаты; С 10-С 18-алкилгалогениды, например децил-, додецил-,лаурил-, миристил- и стеарилхлориды, бромиды и йодиды; и арил-С 1-С 4-алкилгалогениды, например бензилхлорид и фенетилбромид. Указанные соли позволяют получать как растворимые в воде, так и растворимые в масле соединения в соответствии с изобретением. Предпочтительные фармацевтические соли, указанные выше, включают, но не ограничиваясь только ими, ацетат, трифторацетат, безилат, цитрат, фумарат, глюконат, гемисукцинат, гиппурат, гидрохлорид, гидробромид, изотионат, манделат, меглумин, нитрат, олеат, фосфонат, пивалат, фосфат натрия,стеарат, сульфат, сульфосалицилат, тартрат, тиомалат, тозилат и трометамин. Кислотно-аддитивные соли основных соединений формулы I получают путем приведения в контакт формы свободных оснований с достаточным количеством желаемой кислоты для получения соли традиционным способом. Свободное основание можно регенерировать путем приведения в контакт формы соли с основанием и выделения свободного основания традиционным способом. Формы свободного основания в некоторой степени отличаются от своих соответствующих форм солей своими определенными физическими свойствами, такими как растворимость в полярных растворителях, однако во всем остальном соли являются эквивалентными своим соответствующим формам свободных оснований для целей настоящего изобретения. Как было указано, фармацевтически приемлемые соли присоединения основания соединений формулы I образуются с металлами или аминами, такими как щелочные металлы и щелочно-земельные металлы или органические амины. Предпочтительные металлы представляют собой натрий, калий, магний и кальций. Предпочтительные органические амины представляют собой N,N'-дибензилэтилендиамин,хлорпрокаин, холин, диэтаноламин, этилендиамин, N-метил-D-глюкамин и прокаин. Соли присоединения основания кислых соединений в соответствии с изобретением получают путем-7 015352 приведения в контакт формы свободной кислоты с достаточным количеством желаемого основания для получения соли традиционным способом. Форма свободной кислоты может быть регенерирована путем приведения в контакт формы соли с кислотой и выделения формы свободной кислоты известным способом. Формы свободной кислоты в некоторой степени отличаются от своих соответствующих форм солей определенными физическими свойствами, такими как растворимость в полярных растворителях, однако во всем остальном соли являются эквивалентными своим соответствующим формам свободных кислот для целей настоящего изобретения. Если соединение в соответствии с изобретением включает более чем одну группу, которая способна к образованию фармацевтически приемлемых солей этого типа, то изобретение также охватывает составные соли. Примеры типичных составных форм солей включают, но не ограничиваясь только ими,битартрат, диацетат, дифумарат, димеглумин, дифосфат, динатрий и тригидрохлорид. В свете описанного выше можно увидеть, что выражение фармацевтически приемлемая соль в контексте данной заявки предназначено для обозначения активного компонента, который включает соединение формулы I в форме своей соли, особенно в том случае, если указанная форма соли обеспечивает указанному активному компоненту улучшенные фармакокинетические свойства по сравнению со свободной формой указанного активного компонента или другой солью указанного активного компонента,которые использовались ранее. Фармацевтически приемлемая форма соли активного компонента может также изначально обеспечивать желаемое фармакокинетическое свойство указанному активному компоненту, которым он ранее не обладал, а также может даже положительно влиять на фармакодинамику указанного активного компонента в отношении его терапевтической активности в организме. Изобретение, кроме того, относится к лекарственным средствам, содержащим по меньшей мере одно соединение формулы I и/или его фармацевтически пригодные производные, сольваты и стереоизомеры, включая их смеси во всех соотношениях, и, необязательно, наполнители и/или вспомогательные вещества. Лекарственные препараты могут вводиться в виде дозированных единиц, которые содержат заранее установленное количество активного компонента на дозированную единицу. Такая единица может включать, например, от 0,5 мг до 1 г, предпочтительно от 1 до 700 мг, более предпочтительно от 5 до 100 мг соединения в соответствии с изобретением, в зависимости от состояния, подвергаемого лечению, способа введения, а также возраста, веса тела и состояния пациента, или фармацевтические композиции могут вводиться в виде дозированных единиц, которые содержат заранее установленное количество активного компонента на дозированную единицу. Предпочтительными дозированными единицами лекарственных препаратов являются те, которые содержат суточную дозу или часть суточной дозы, как указано выше, или соответствующую порцию их активного компонента. Лекарственные средства этого типа также могут быть получены способом, который хорошо известен в области фармацевтики. Лекарственные препараты могут адаптироваться для введения при помощи любого подходящего способа, например путем перорального (включая буккальное или подъязычное), ректального, назального,местного (включая буккальное, подъязычное или трансдермальное), вагинального или парентерального(включая подкожное, внутримышечное, внутривенное или внутрикожное) введения. Такие препараты могут быть приготовлены с помощью любого способа, известного в области фармацевтики, например путем объединения активного компонента с наполнителем(ями) или вспомогательным(ыми) веществом(ами). Лекарственные препараты, адаптированные для перорального введения, могут вводиться в виде отдельных единиц, таких как, например, капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных жидкостях; пищевых пен или пенистых пищевых продуктов; или жидких эмульсий масло-в-воде или жидких эмульсий вода-в-масле. Так, например, в случае перорального введения в виде таблетки или капсулы, активный компонент может быть объединен с пероральным, нетоксичным и фармацевтически приемлемым инертным наполнителем, таким как, например, этанол, глицерин, вода и т.п. Порошки получают путем измельчения соединения до подходящего небольшого размера и смешивания его с фармацевтическим наполнителем,измельченным аналогичным способом, таким как, например, пищевой углеводород, такой как, например,крахмал или маннит. Также можно добавлять ароматизатор, консервант, диспергирующее вещество и краситель. Капсулы получают путем приготовления порошковой смеси, как описано выше, и заполняют ею желатиновые капсулы определенной формы. Перед заполнением капсул к порошковой смеси можно добавлять скользящие и смазывающие вещества, такие как, например, высокодисперсная кремниевая кислота, тальк, стеарат магния, стеарат кальция или полиэтиленгликоль в твердой форме. Для улучшения доступности лекарственного средства, заключенного в капсулу, также можно добавлять дезинтегрирующее вещество или солюбилизатор, такой как, например, агар-агар, карбонат кальция или карбонат натрия. Дополнительно, если это является желательным или необходимым, в смесь также можно добавлять подходящие связующие, смазывающие вещества, дезинтеграторы, а также красители. Подходящими свя-8 015352 зующими являются крахмал, желатин, природные сахара, такие как, например, глюкоза или -лактоза,подсластители, приготовленные из кукурузы, естественных и синтетических резин, такие как, например,аравийская камедь, трагакантовая камедь или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п. Смазывающие вещества, которые могут применяться в таких дозированных формах,включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Дезинтеграторы включают, но не ограничиваясь только ими, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и т.п. Лекарственные средства в виде таблеток получают, например, путем приготовления порошковой смеси, гранулирования или сухого прессования смеси, добавления смазывающего вещества и дезинтегратора и прессования полученной смеси в таблетки. Порошковую смесь готовят путем смешивания соединения, измельченного подходящим образом, с разбавителем или основанием,как описано выше, и необязательно со связующим, таким как, например, карбоксиметилцеллюлоза, альгинат, желатин или поливинилпирролидон, замедлителем растворения, таким как, например, парафин,усилителем поглощения, таким как, например, четвертичная соль, и/или абсорбентом, таким как, например, бентонит, каолин или дикальцийфосфат. Порошковую смесь можно гранулировать путем смачивания со связующим, таким как, например, сироп, крахмальная паста, слизь акации или растворы целлюлозы или полимерных веществ и прессования ее через сито. В качестве альтернативы грануляции, порошковую смесь можно пропускать через таблетировочную машину, получая куски неправильной формы,которые распадаются, образуя гранулы. Гранулы можно замасливать путем добавления стеариновой кислоты, стеарата, талька или минерального масла для предотвращения слипания в таблетировочной литейной форме. После этого смазанную смесь спрессовывают, получая таблетки. Соединения в соответствии с изобретением также можно объединять с сыпучим инертным наполнителем и затем подвергать прямому прессованию, получая таблетки без осуществления стадий грануляции или сухого прессования. Таблетки также можно покрывать прозрачным или светонепроницаемым защитным слоем, состоящим из шеллакового запечатывающего слоя, слоя сахара или полимерного вещества и глянцевого слоя воска. К этим покрытиям также можно добавлять красители для возможности различения между разными дозируемыми единицами. Жидкости для перорального введения, такие как, например, раствор, сиропы и эликсиры, могут быть приготовлены в виде дозируемых единиц таким образом, чтобы они содержали заранее установленное количество соединения. Сиропы могут быть получены путем растворения соединения в водном растворе с подходящим ароматизатором, тогда как эликсиры готовят с применением нетоксичного спиртового наполнителя. Суспензии могут быть приготовлены путем диспергирования соединения в нетоксичном наполнителе. Также можно добавлять солюбилизаторы и эмульсификаторы, такие как, например,этоксилированные изостеариловые спирты и полиоксиэтиленовые эфиры сорбита, консерванты, ароматические добавки, такие как, например, масло мяты перечной, или натуральные заменители сахара, или сахарин, или другие искусственные заменители сахара и т.п. Лекарственные препараты для перорального введения в виде дозированных единиц могут быть инкапсулированы в микрокапсулы, если это является желательным. Также лекарственный препарат может быть приготовлен таким образом, чтобы пролонгировать или замедлить высвобождение, например, путем применения покрытий или заделывания требуемого вещества в полимеры, воск и т.п. Соединения формулы I и их соли, сольваты и физиологически функциональные производные также могут вводиться в виде липосомных систем доставки, таких как, например, небольшие однослойные пузырьки, большие однослойные пузырьки и многослойные пузырьки. Липосомы могут быть образованы с помощью различных фосфолипидов, таких как, например, холестерин, стеариламин или фосфатидилхолины. Соединения формулы I и их соли, сольваты и физиологически функциональные производные также могут доставляться с помощью моноклональных антител в качестве индивидуальных носителей, к которым присоединены молекулы соединения. Соединения также могут быть соединены с растворимыми полимерами в качестве нацеливающих носителей лекарственных средств. Такими полимерами могут являться поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидофенол, полигидроксиэтиласпартамидофенол или полиэтиленоксид полилизина, замещенный пальмитоиловыми радикалами. Кроме того, соединения можно связывать с биоразлагаемыми полимерами, которые пригодны для обеспечения контролируемого высвобождения лекарственного средства, например полимолочной кислотой, поликапролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями,полидигидроксипиранами, полицианоакрилатами и перекрестно-сшитыми или амфипатическими блоксополимерами гидрогелей. Лекарственные препараты, адаптированные для трансдермального введения, могут вводиться в виде независимых пластырей для удлиненного, тесного контакта с эпидермисом реципиента. Таким образом, например, активный компонент может доставляться из пластыря путем ионофореза, как, в общем,описано в Pharmaceutical Research, 3(6), 318 (1986). Фармацевтические композиции, адаптированные для местного введения, могут быть приготовлены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спрееев, аэрозолей или ма-9 015352 сел. Для лечения глаз или других наружных тканей, например рта и кожи, предпочтительно применяются лекарственные препараты в виде местной мази или крема. Для приготовления лекарственного препарата в виде мази активный компонент может применяться с парафиновым или смешивающимся с водой мазевым основанием. Альтернативно, для получения крема активный компонент может быть приготовлен с основой для крема типа масло-в-воде или основой вода-в-масле. Лекарственные препараты, адаптированные для местного введения в глаза, включают глазные капли, в которых активный компонент растворен или суспендирован в подходящем носителе, предпочтительно в водном растворителе. Лекарственные препараты, адаптированные для местного введения в полость рта, включают лепешки, пастилки и жидкости для полоскания рта. Лекарственные препараты, адаптированные для ректального введения, могут вводиться в виде суппозиториев или клизм. Лекарственные препараты, адаптированные для интраназального введения, в которых носитель представляет собой твердое вещество, включают крупный порошок, имеющий размер частичек, например, в интервале 20-500 мкм, который вводится путем вдыхания, то есть путем быстрого вдоха через нос из контейнера, содержащего порошок, который придерживают возле носа. Подходящие лекарственные препараты для введения в виде интраназального аэрозоля или носовых капель с жидкостью в качестве носителя включают растворы активного вещества в воде или вмасле. Лекарственные препараты, адаптированные для введения путем ингаляции, включают тонкоизмельченные частички в виде пыли или тумана, которые могут быть получены с помощью различных диспергирующих устройств под давлением с аэрозолями, распылителями или инсуффляторами. Лекарственные препараты, адаптированные для вагинального введения, могут вводиться в виде пессариев, тампонов, кремов, гелей, паст, пен или аэрозолей. Лекарственные препараты, адаптированные для парентерального введения, включают водные или неводные стерильные растворы для инъекций, содержащие антиоксиданты, буферы, бактериостатические вещества и растворенные вещества, с помощью которых лекарственное средство поддерживается изотоническим по отношению к крови реципиента, подвергаемого лечению; и водные или неводные стерильные суспензии, которые могут содержать суспензионную среду и загустители. Лекарственные препараты могут вводиться с помощью емкостей для однократного или многократного введения, например,запечатанных ампул и флаконов, и храниться в лиофилизированном состоянии, при этом непосредственно перед введением необходимо только добавить стерильную жидкость-носитель, например воду для инъекций. Растворы и суспензии для инъекций, приготовленные согласно рецептуре, могут быть приготовлены из стерильных порошков, гранул и таблеток. Также является очевидным, что дополнительно к предпочтительным вышеописанным составляющим, лекарственные препараты также могут содержать другие вещества, которые используются в данной области для конкретных типов лекарственных средств; например, лекарственные препараты, пригодные для перорального введения, могут содержать ароматизаторы. Терапевтически эффективное количество соединения формулы I зависит от многих факторов,включая, например, возраст и вес животного, определенное состояние, которое необходимо лечить, и его тяжесть, природу лекарственного средства и способ введения, и в конченом счете оно может быть определено лечащим врачом или ветеринаром. Тем не менее, эффективное количество соединения в соответствии с изобретением для лечения роста опухолей, например рака ободочной кишки или молочной железы, как правило, находится в интервале от 0,1 до 100 мг/кг веса тела реципиента (млекопитающего) в сутки и предпочтительно обычно находится в интервале от 1 до 10 мг/кг веса тела в сутки. Следовательно, действующее суточное количество для взрослого млекопитающего весом 70 кг обычно может составлять от 70 до 700 мг, причем это количество может вводиться в виде отдельной дозы один раз в день или обычно в виде циклов частичных доз (таких как, например, два, три, четыре, пять или шесть раз) в день,таким образом, что общая суточная доза является аналогичной. Эффективное количество его соли или сольвата или физиологически функционального производного может быть определено в виде доли эффективного количества соединения в соответствии с изобретением per se. Также можно предположить,что аналогичные дозы пригодны для лечения других состояний, описанных выше. Кроме того, изобретение относится к лекарственным средствам, содержащим по меньшей мере одно соединение формулы I и/или его фармацевтически пригодные производные, сольваты и стереоизомеры, включая их смеси во всех соотношениях, и по меньшей мере один дополнительный активный компонент лекарственного средства. Изобретение также относится к комплекту (набору), состоящему из отдельных пакетов:(а) эффективного количества соединения формулы I и/или его фармацевтически пригодных производных, сольватов и стереоизомеров, включая их смеси во всех соотношениях, и(б) эффективного количества дополнительного активного компонента лекарственного средства. Комплект включает подходящие емкости, такие как коробки, индивидуальные бутылки, пакеты или ампулы. Комплект может включать, например, отдельные ампулы, каждая из которых содержит эффек- 10015352 тивное количество соединения формулы I и/или его фармацевтически пригодных производных, сольватов и стереоизомеров, включая их смеси во всех соотношениях, и эффективное количество дополнительного активного компонента лекарственного средства в растворенной или лиофиллизированной форме. Применение. Соединения согласно настоящему изобретению пригодны в качестве фармацевтически активных компонентов для млекопитающих, в особенности для людей, для лечения заболеваний, вызванных тирозинкиназой. Эти заболевания включают пролиферацию опухолевых клеток, патологическую неоваскуляризацию (или ангиогенез), которые вызывают рост солидных опухолей, неоваскуляризацию глаза (диабетическую ретинопатию, дегенерацию желтого пятна, связанную со старением и т.д.) и воспаление(псориаз, ревматоидный артрит и т.д.). Настоящее изобретение охватывает применение соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения или предотвращения злокачественного новообразования. Предпочтительные карциномы для лечения выбирают из группы рака головного мозга, рака мочеполового тракта, рака лимфатической системы, рака желудка,рака гортани и рака легкого. Дальнейшей группой предпочтительных типов рака являются моноцитарный лейкоз, аденокарцинома легкого, мелкоклеточный рак легкого, рак поджелудочной железы, глиобластомы и рак молочной железы. Также охватывается применение соединений согласно п.1 в соответствии с изобретением и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения или предотвращения заболевания, в которое вовлечен ангиогенез. Такое заболевание, в которое вовлечен ангиогенез, представляет собой заболевание глаз, такое как васкуляризация сетчатки, диабетическая ретинопатия, дегенерация желтого пятна, связанная со старением, и т.п. Применение соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения или предотвращения воспалительных заболеваний также подпадает под объем настоящего изобретения. Примерами таких воспалительных заболеваний являются ревматоидный артрит, псориаз, контактный дерматит, аллергическая реакция замедленного типа и т.п. Также охватывается применение соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения или предотвращения заболевания, индуцированного тирозинкиназой, или состояния, индуцированного тирозинкиназой, у млекопитающего, при котором в этом способе терапевтически эффективное количество соединения в соответствии с изобретением вводят больному млекопитающему, нуждающемуся в таком лечении. Терапевтическое количество изменяется в зависимости от конкретного заболевания и легко может быть определено специалистом в данной области. Настоящее изобретение также охватывает применение соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения или предотвращения васкуляризации сетчатки. Способы лечения или предотвращения глазных заболеваний, такие как диабетическая ретинопатия и дегенерация желтого пятна, связанная со старением, также являются частью изобретения. Применение для лечения или предотвращения воспалительных заболеваний, таких как ревматоидный артрит, псориаз,контактный дерматит и аллергическая реакция замедленного типа, а также лечение или предотвращение патологий костей из группы, включающей остеосаркому, остеоартрит и рахит, также подпадает под объем настоящего изобретения. Выражение "заболевания или состояния, индуцированные тирозинкиназой" относится к патологическим состояниям, которые зависят от активности одной или нескольких тирозикиназ. Тирозинкиназы непосредственно или опосредованно принимают участие в путях передачи сигналов различных активностей клеток, включая пролиферацию, адгезию, миграцию и дифференциацию. Заболевания, связанные с активностью тирозинкиназы, включают пролиферацию опухолевых клеток, патологическую неоваскуляризацию, которая стимулирует рост солидных опухолей, неоваскуляризацию глаза (диабетическую ретинопатию, дегенерацию желтого пятна, связанную со старением, и т.д.) и воспаление (псориаз, ревматоидный артрит и т.д.). Соединения формулы I могут вводиться пациентам для лечения злокачественного новообразования,в особенности быстрорастущих опухолей. Изобретение также относится к применению соединений формулы I, и их фармацевтически пригодных производных, сольватов и стереоизомеров, включая их смеси во всех соотношениях, для приготовления лекарственного средства для лечения заболеваний, при которых играет роль ингибирование,регуляция и/или модуляция передачи сигналов с помощью киназы. Предпочтение в настоящем изобретении отдается Met киназе. Предпочтительным является применение соединений формулы I, и их фармацевтически пригодных производных, сольватов и стереоизомеров, включая их смеси во всех соотношениях, для приготовления лекарственного средства для лечения заболеваний, на которые оказывает влияние ингибирование тирозинкиназ соединениями в соответствии с п.1.- 11015352 Особенно предпочтительным является применение для приготовления лекарственного средства для лечения заболеваний, на которые оказывает влияние ингибирование Met киназы соединениями в соответствии с п.1. Наиболее предпочтительным является применение для лечения заболевания, где заболевание представляет собой солидную опухоль. Солидную опухоль предпочтительно выбирают из группы опухолей легкого, плоского эпителия,мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы, кишечника, печени, головного мозга, предстательной железы, мочеполового тракта, лимфатической системы,желудка и/или гортани. Солидную опухоль также предпочтительно выбирают из группы, включающей аденокарциному легкого, мелкоклеточный рак легкого, рак поджелудочной железы, глиобластомы, рак толстой кишки и рак молочной железы. Кроме того, предпочтительным является применение для лечения опухоли крови и иммунной системы, предпочтительно для лечения опухоли, выбранной из группы, включающей острый миелоидный лейкоз, хронический миелоидный лейкоз, острый лимфолейкоз и/или хронический лимфолейкоз. Описанные соединения формулы I могут вводиться в комбинации с другими известными лекарственными средствами, включая противораковые средства. Как используется в настоящем изобретении,термин "противораковое средство" относится к любому средству, которое вводят пациенту со злокачественным новообразованием для лечения рака. Противоопухолевое лечение, описанное в изобретении, может применяться в виде монотерапии,или дополнительно к соединению по изобретению можно также применять обычные хирургические методы, или радиотерапию, или химиотерапию. Такая химиотерапия может включать один или несколько следующих классов противоопухолевых средств:(i) антипролиферативные/противоопухолевые/повреждающие ДНК лекарственные средства и их комбинации, которые применяются в медицинской онкологии, такие как алкилирующие средства (например, цисплатин, карбоплатин, циклофосфамид, азотный иприт, мельфалан, хлорамбуцил, бусульфан и нитрозомочевины); антиметаболиты (например, антифолаты, такие как фторпиримидины, такие как 5 фторурацил и тегафур, ралтитрексед, метотрексат, арабинозид цитозина, гидроксимочевина и гемцитабин); противоопухолевые антибиотики (например, антрациклины, такие как адриамицин, блеомицин,доксорубицин, дауномицин, эпирубицин, идарубицин, митомицин-С, дактиномицин и митрамицин); антимитотические средства (например, алкалоиды барвинка, такие как винкристин, винбластин, виндезин и винорелбин и таксоиды, такие как таксол и таксотер); ингибиторы топоизомеразы (например, эпиподофиллотоксины, такие этопозид и тенипозид, амсакрин, топотекан, иринотекан и камптотецин); и цитодифференцирующие средства (например, ретиноевая кислота, полностью находящаяся в трансконфигурации, 13-цис-ретиноевая кислота и фенретинид);(ii) цитостатические средства, такие как антиэстрогены (например, тамоксифен, торемифен, ралоксифен, дролоксифен и йодоксифен), ингибиторы рецептора эстрогена (например, фульвестрант); антиандрогены (например, бикалутамид, флутамид, нилутамид и ципротерон ацетат), антагонисты LHRH или агонисты LHRH (например, гозерелин, лейпрорелин и бузерелин), прогестогены (например, мегестрол ацетат), ингибиторы ароматазы (например, анастрозол, летрозол, воразол и эксеместан) и ингибиторы 5-редуктазы, такие как финастерид;(iii) средства, которые ингибируют инвазию злокачественных клеток (например, ингибиторы металлопротеиназы, такие как маримастат, и ингибиторы функции рецептора урокиназного активатора плазминогена);(iv) ингибиторы действия фактора роста, например, такие ингибиторы включают антитела к фактору роста, антитела к рецептору фактора роста (например, анти-erbb2 антитело трастузумаб [Herceptin] и анти-erbbl антитело цетуксимаб [С 225]), ингибиторы фарнезилтрансферазы, ингибиторы тирозинкиназы и ингибиторы серин-треонин киназы, например, ингибиторы семейства фактора роста эпидермиса(гефитиниб,AZD1839),N-(3-этинилфенил)-6,7-бис(2 метоксиэтокси)хиназолин-4-амин (эрлотиниб, OSI-774) и 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3 морфолинопропокси)хиназолин-4-амин (CI 1033, например, ингибиторы семейства фактора роста производных тромбоцитов и, например, ингибиторы семейства фактора роста гепатоцитов;(v) антиангиогенные вещества, такие как те, которые ингибируют действие фактора роста эндотелия сосудов, (например, антитело к фактору роста клеток эндотелия сосудов бевацизумаб [Avastin],соединения, которые описаны в опубликованных международных заявках на патент WO 97/22596, WO 97/30035, WO 97/32856 и WO 98/13354) и соединения, которые действуют по другому механизму (например, линомид, ингибиторы действия интегрина v3 и ангиостатин);(vi) вещества, повреждающие сосуды, такие как комбретастатин А 4 и соединения, описанные в международных заявках на патент WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 и(vii) антисмысловая терапия, например, такая, которая направлена на вышеперечисленные мишени,- 12015352 такая как ISIS 2503, антисмысловая терапия на основе гена ras;(viii) способы генной терапии, включая, например, способы замены аберрантных генов, такие как способы аберрации р 53 или аберрации BRCA1 или BRCA2, GDEPT (пролекарственная терапия, направленная на ген фермента), способы с использованием деаминазы цитозина, тимидинкиназы или бактериальной нитроредуктазы и способы повышения устойчивости пациента к химиотерапии или радиотерапии, такие как генная терапия резистентности ко многим лекарственным средствам; и(ix) способы иммунотерапии, включая, например, способы повышения иммуногенности опухолевых клеток пациента в условиях ex vivo и in vivo, такие как трансфекция цитокинами, такими как интерлейкин 2, интерлейкин 4 или фактор стимуляции колоний гранулоцитов-макрофагов, способы снижения активности Т-клеток, способы с использованием трансфектированных иммунных клеток, таких как цитокин-трансфектированные дендритные клетки,способы с использованием цитокинтрансфектированных линий опухолевых клеток и способы с использованием антиидиотипичных антител. Лекарственные средства, приведенные ниже в табл. 1, предпочтительно, но не исключительно, комбинируют с соединениями формулы I. Комбинированное лечение этого типа можно осуществлять с помощью одновременного, последовательного или отдельного дозирования отдельных компонентов для лечения. В комбинированных продуктах этого типа используют соединения в соответствии с изобретением. Исследования. Соединения формулы I, описанные в примерах, исследовались в анализах, описанных ниже, и было обнаружено, что они обладают ингибирующей активностью по отношению к киназе. Из литературы известны другие исследования, и они легко могут быть осуществлены специалистом в данной области (см.,например, Dhanabal и др., Cancer Res. 59:1 89-197; Xin и др., J. Biol. Chem. 274:9116-9121; Sheu и др.,Anticancer Res. 18:443 5-4441; Ausprunk и др., Dev. Biol. 38:237-248; Gimbrone и др., J. Natl. Cancer Inst. 52:413-427; Nicosia и др., In Vitro 18:538-549).- 23015352 Измерение активности Met киназы. Согласно данным производителя (Met, активная, upstate,каталога 14-526), Met киназу экспрессировали для получения белка в клетках насекомых (Sf21; S. frugiperda) и затем очищали с помощью аффинной хроматографии в виде "N-концевого 6 Н-меченого" рекомбинантного белка человека в бакуловирусном экспрессионном векторе. Активность киназы может быть измерена с помощью различных доступных измерительных систем. В исследовании сцинтилляционной схожести (Sorg и др., J. of. Biomolecular Screening, 2002, 7, 11-19),анализе флэш-планшетов или теста связывания на фильтре измеряют радиоактивное фосфорилирование белка или пептида в качестве субстрата с помощью радиоактивно меченного АТР (32 Р-АТР, 33 Р-АТР). В присутствии ингибиторного соединения может быть обнаружено снижение радиоактивного сигнала или отсутствие сигналов. Кроме того, в качестве методов исследования являются полезными способы гомогенного переноса энергии флуоресцентного резонанса с разрешением во времени (HTR-FRET) и флуоресцентной поляризации (FP) (Sills и др., J. Biomolecular Screening, 2002, 191-214). В других нерадиоактивных способах анализа на основе ELISA используются специфические фосфо-антитела (фосфо-АВ). Фосфо-АВ связываются только с фосфорилированным субстратом. Это связывание может быть определено с использованием вторичного антитела, конъюгированного в пероксидазой, с помощью хемолюминисценции (Ross и др., 2002, Biochem. J.). Метод флэш-планшетов (Met киназа). Используемыми тестируемыми планшетами являлись микротитровальные планшеты на 96 лунокFlashplateR от Perkin Elmer ( кат. SMP200). Компоненты киназной реакции, описанные ниже, питетировали в планшет для исследования. Met киназу и субстрат поли Ala-Glu-Lys-Tyr (pAGLT, 6:2:5:1), инкубировали в течение 3 ч при комнатной температуре с радиоактивно меченным 33 Р-АТР в присутствии и отсутствии тестируемых веществ в общем объеме 100 мкл. Реакцию останавливали с помощью 150 мкл 60 мМ раствора EDTA. После инкубирования дополнительно в течение 30 мин при комнатной температуре, супернататны отфильтровывали с отсасыванием и лунки три раза промывали каждый раз 200 мкл 0,9% раствора NaCl. Связанную радиоактивность в крови измеряли с помощью прибора для измерения сцинтилляции (Topcount NXT, Perkin-Elmer). Используемое истинное значение составляло киназную реакцию без ингибитора. Это приблизительно должно находиться в интервале 6000-9000 имп./мин. Используемое значение фармакологического нуля представляло собой стауроспорин в конечной концентрации 0,1 мМ. Значения ингибирования (IC50) определяли с помощью RS1MTS программы. Условия киназной реакции на лунку: 30 мкл буфера для исследования 10 мкл тестируемого субстрата в буфере для исследования с 10% ДМСО 10 мкл АТР (конечная концентрация 1 мкМ холодн., 0,35 мкКи 33 Р-АТР) 50 мкл Met киназы/субстратной смеси в буфере для исследования(10 нг фермента/лунку, 50 нг pAGLT/лунку). Используемые растворы. Буфер для исследования: 50 мМ HEPES 3 мМ хлорид магния 3 мкМ ортованадат натрия 3 мМ хлорид марганца(II) 1 мМ дитиотреит (DTT) рН 7,5 (устанавливали с помощью гидроксида натрия). Стоп-раствор: 60 мМ Titriplex III (EDTA) 33 Р-АТР: Perkin-Elmer;Poly-Ala-Glu-Lys-Tyr, 6:2:5:1:Sigmaкат. P1152. При указании выше и ниже, вся температура приведена в градусах Цельсия (С). В последующих примерах "обычная обработка" обозначает, что при необходимости добавляют воду, рН устанавливают,при необходимости, на значение от 2 до 10 в зависимости от состава конечного продукта, смесь экстрагируют этилацетатом или дихлорметаном, фазы разделяют, органическую фазу высушивают над сульфатом натрия и выпаривают и остаток очищают при помощи хроматографии на силикагеле и/или кристаллизации. Rf значения на силикагеле: элюент: этилацетат/метанол 9:1. Масс-спектрометрия (MS):APCI-MS (химическая ионизация при атмосферном давлении - масс-спектрометрия) (М+Н)+. Время удерживания RT [мин]: определение с помощью ВЭЖХ- 24015352 Колонка: ChromolithPerformance RP-18e (Merck KGaA, Cat. 1,02129,0001) Элюенты: Элюент A: 0,1M водный NaH2PO4 Элюент В: ацетонитрил + 10% воды Скорость потока: 4 мл/мин Градиент: 0 мин 1% В 1 мин 1% В 7 мин 99% В 8 мин 99% В Длина волны (определение): 220 нм Пример 1. Приготовление 3-диэтиламинопропил 3-[5-(4-хлорфенил)-2-оксо-2H-1,3,4-тиадиазин-3-илметил] фенилкарбамата ("А 1") осуществляли аналогично следующей схеме: а) Если требуемые галоацетофеноны не являются коммерчески доступными, то они могут быть получены аналогично следующей схеме синтеза: 5,57 г 3,4-диметоксиацетофенона растворяли в 60 мл простого диэтилового эфира и 30 мл 1,4-диоксана в 250 мл трехгорлой колбе, оборудованной магнитной мешалкой, конденсатором, термометром, капельной воронкой с уравновешиванием давления и сушильной трубкой, и по каплям добавляли 1,54 мл брома при перемешивании при КТ, при этом образовывался осадок только через короткое время. Смесь перемешивали при КТ дополнительно в течение 1 ч, при этом осадок повторно растворялся, температуру повышали приблизительно до 3 С, и образовывался светложелтый прозрачный раствор. Его выливали на лед, тщательно перемешивали и осадок, образованный между фазами, отфильтровали с отсасыванием. Его промывали водой и затем небольшим количеством простого МТБ эфира и высушивали (=К 1). Маточную жидкость экстрагировали простым МТВ эфиром,высушивали, фильтровали и упаривали насухо. Остаток растирали в порошок с небольшим количеством простого МТВ эфира, отфильтровали с отсасыванием и высушивали (=К 2). К 1 и К 2 объединяли, получая 2'-бром-4-хлорацетофенон, tпл. 91-92; выход: 5,88 г (76%).b) 8,09 мл гидроксида гидразиния медленно по каплям добавляли к раствору 25,65 г Оэтилдитиокарбоната калия в 24 мл воды при перемешивании и смесь перемешивали при комнатной температуре дополнительно в течение 6 ч. Смесь оставляли отстаиваться при комнатной температуре в течение 16 ч, затем добавляли 12 мл воды и смесь экстрагировали простым эфиром. Объединенные эфирные фазы высушивали, фильтровали и упаривали насухо, получая 16,4 г этилгидразинкарботионата. с) 5,17 г этилгидразинкарботионата (43 ммоль) добавляли к раствору 10,04 г 2'-бром-4 хлорацетофенона (43 ммоль) в 40 мл ацетонитрила и смесь перемешивали при КТ в течение 3 ч, при этом постепенно образовывался белый осадок. Реакционную смесь фильтровали с отсасыванием, промывали небольшим количеством ацетонитрила и затем простым эфиром и высушивали, получая 6,59 г (68%) 5(4-хлорфенил)-3,6-дигидро-1,3,4-тиадиазин-2-она.d) 4,19 г 3-нитробензил бромида и 9,95 г карбоната калия добавляли к раствору 4,00 г 5-(4 хлорфенил)-3,6-дигидро-1,3,4-тиадиазин-2-она в 80 мл ацетонитрила и смесь перемешивали при 80 С дополнительно в течение 2 ч. Смесь вливали в воду, 2 раза экстрагировали простым диэтиловым эфиром,- 25015352 высушивали, фильтровали и упаривали насухо. К остатку добавляли небольшое количество простого диэтилового эфира, который кристаллизовали и высушивали в вакуумном сушильному шкафу при 50 С,получая 5,5 г (86%) 5-(4-хлорфенил)-3-(3-нитробензил)-3,6-дигидро-1,3,4-тиадиазин-2-она. е) 5,47 г 5-(4-хлорфенил)-3-(3-нитробензил)-3,6-дигидро-1.3,4-тиадиазин-2-она растворяли в 100 мл ТГФ и затем добавляли 1,3 г никеля Ренея. После этого пропускали водород до тех пор, как исходное вещество уже не обнаруживалось. Для обычной обработки катализатор отфильтровали, промывали ТГФ и фильтрат упаривали насухо и перекристаллизовывали из дихлорметана/простого диэтилового эфира,получая 4,6 г (94%) 3-(3-аминобензил)-5-(4-хлорфенил)-3,6-дигидро-1,3,4-тиадиазин-2-она.f) 199 мг (0,6 ммоль) 3-(3-аминобензил)-5-(4-хлорфенил)-3,6-дигидро-1,3,4-тиадиазин-2-она растворяли в 4 мл ТГФ при перемешивании в 8 мл колбе, добавляли 107 мкл диизопропилэтиламина, смесь охлаждали на бане лед/вода, по каплям добавляли 78 мкл изопропилиден хлорформиата и затем смесь перемешивали при 70 С в течение 1 ч. После этого смесь охлаждали до комнатной температуры и добавляли 107 мкл (0,72 ммоль) 3-диэтиламинопропан-1-ола и смесь нагревали в колбе с обратным холодильником в течение 96 ч. Для обычной обработки реакционную смесь разводили 30 мл дихлорметана, встряхивали с 20 мл 1 н. HCl и 20 мл 2 н. NaOH, высушивали над сульфатом натрия, упаривали насухо и очищали путем хроматографии (дихлорметан/метанол: 9:1). Объединенные фракции, содержащие продукт, упаривали насухо и кристаллизовали из простого диэтилового эфира/петролейного эфира 40-60, получая 128 мг 3-диэтиламинопропил 3-[5-(4-хлорфенил)-3,6-дигидро-2-оксо-2H-1,3,4-тиадиазин-3-илметил]фенил карбамата ("А 1), tпл. 115-117; HPLC (100%): RT: 4,67 мин. Пример 2 а. Приготовление N-3-[5-(5-хлор-2-гидроксифенил)-2-оксо-2H-1,3,4-тиадиазин-3-илметил]фенил-2 метиламиноацетамида ("В 1") осуществляли аналогично следующей схеме: 2 а.1. 87,6 мг Boc-N-метилглицина добавляли к раствору 260 мг EDCI HCl [N-этил-N,N(диметиламинопропил)карбодиимида] и 169 мг DMAP (диметиламинопиридина) в 20 мл дихлорметана и 3 капель ДМФА и смесь перемешивали в течение 30 мин. Затем добавляли раствор 200 мг "2be" (из примера 2b) в дихлорметане и смесь перемешивали при комнатной температуре в атмосфере N2 в течение 16 ч. При осуществлении обычной обработки получали "2 аа". 2 а.2. 10 мл 20% этанольного раствора KOH добавляли к раствору 150 мг "2 аа" в 10 мл этанола при 0 С. Смесь перемешивали при комнатной температуре в течение 10 мин, подвергали обычной обработке,получая "2ab". Его растворяли в дихлорметане и 2 мл ТФК добавляли при 0 С и смесь перемешивали при комнатной температуре в течение 20 мин. При осуществлении обычной обработки получали "В 1". Пример 2b. ПриготовлениеN-3-[5-(5-хлор-2-гидроксифенил)-2-оксо-2H-1,3,4-тиадиазин-3-илметил]фенил ацетамида ("В 2") осуществляли аналогично следующей схеме: 2b.1. 17,8 г триэтиламина по каплям добавляли к раствору 15 г 4-хлор-2-гидроксиацетофенона в 300 мл дихлорметана и смесь охлаждали до 0 С. Добавляли 12,72 г пивалилхлорида и смесь перемешивали в атмосфере N2 в течение 16 ч. При осуществлении обычной обработки получали "2ba" 2b.2. Раствор 15,68 г брома в 200 мл 1,4-диоксана по каплям добавляли к раствору 25 г "2ba" в 600 мл 1,4-диоксана при 0 С. Смесь перемешивали дополнительно в течение 3 ч и подвергали обычной обработке, получая "2bb" в 100 мл трет-бутанола добавляли к раствору 45 г "2bb" в 400 мл трет-бутанола. Смесь кипятили при 80 С в атмосфере N2 в течение 16 ч. Смесь охлаждали, подвергали обычной обработке, получая 2b.4. 4 г "2bc" добавляли к смеси 5,075 г карбоната калия в 40 мл ДМФА и смесь перемешивали в течение 30 мин. Затем добавляли раствор 2,64 г м-нитробензилбромида в ДМФА и смесь перемешивали при комнатной температуре в атмосфере N2 в течение 16 ч. Смесь подвергали обычной обработке, очищали путем колоночной хроматографии (гексан:этилацетат = 95:5), получая 1,2 г "2bd" 2b.5. Раствор 1,87 г NH4Cl в 10 мл воды добавляли к раствору 1,8 г "2bd" в 20 мл метанола. Добав- 27015352 ляли 1,3 г железного порошка и и смесь кипяти в колбе с обратным холодильником в течение 3 ч. Смесь охлаждали, фильтровали, подвергали обычной обработке, получая 900 мг "2be" 2b.6. 27,2 мг ацетилхлорида и раствор 150 мг "2be" в ТГФ добавляли к суспензии 16,6 мг NaH (60% в минеральном масле) в ТГФ при 0 С. Смесь перемешивали при комнатной температуре в течение 16 ч,подвергали обычной обработке, получая 120 мг "2bf 2b.7. 10 мл 20% этанольного раствора KOH добавляли к раствору 120 мг "2bf в 10 мл этанола при 0 С. Смесь перемешивали при комнатной температуре в течение 10 мин, подвергали обычной обработке,получая 60 мг "В 2". Следующие соединения получали аналогично приготовлению "В 2":IC50: 10 нМ - 1 мкМ = А 1 мкМ - 10 мкМ = В 10 мМ = С Следующие примеры относятся к лекарственным средствам. Пример А. Флаконы для инъекций. рН раствора 100 г активного компонента формулы I и 5 г Na2HPO4 в 3 л бидистиллированной воды устанавливали на 6,5, используя 2 н. соляную кислоту, стерилизовали фильтрацией, переносили во флаконы для инъекций, лиофилизировали в стерильных условиях и запечатывали в стерильных условиях. Каждый флакон для инъекций содержит 5 мг активного компонента. Пример Б. Суппозитории. Смесь 20 г активного компонента формулы I расплавляли с 100 г соевого лецитина и 1400 г какаового масла, разливали в пресс-формы и охлаждали. Каждый суппозиторий содержит 20 мг активного компонента. Пример В. Раствор. Раствор приготавливали с 1 г активного компонента формулы I, 9,38 г NaH2PO42 H2O, 28,48 гNa2HPO412 H2O и 0,1 г бензалконийхлорида в 940 мл бидистиллированной воды. рН раствора устанавливали на 6,8 и объем раствора доводили до 1 л и стерилизовали путем облучения. Этот раствор может использоваться в форме глазных капель. Пример Г. Мазь. 500 мг активного компонента формулы I смешивали с 99,5 г вазелина в асептических условиях. Пример Д. Таблетки. Смесь 1 кг активного компонента формулы I, 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния спрессовывали для получения таблеток обычным способом таким образом, чтобы каждая таблетка содержала 10 мг активного компонента. Пример Е. Драже. Таблетки спрессовывали аналогично примеру Д и затем покрывали обычным способом покрытием из сахарозы, картофельного крахмала, талька, трагаканта и красителя. Пример Ж. Капсулы. 2 кг активного компонента формулы I помещали в твердые желатиновые капсулы обычным способом таким образом, чтобы каждая капсула содержала 20 мг активного компонента. Пример З. Ампулы. Раствор 1 кг активного компонента формулы I в 60 л бидистиллированной воды стерилизовали фильтрацией, переносили в ампулы, лиофилизировали в стерильных условиях и запечатывали в стерильных условиях. Каждая ампула содержит 10 мг активного компонента.
МПК / Метки
МПК: A61K 31/54, C07D 285/08, C07D 417/12, A61K 31/541, A61P 35/00, C07D 285/18, A61K 31/433
Метки: 5-фенил-3,6-дигидро-2-оксо-2h-1,3,4-тиадиазины, замещенные
Код ссылки
<a href="https://eas.patents.su/30-15352-zameshhennye-5-fenil-36-digidro-2-okso-2h-134-tiadiaziny.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные 5-фенил-3,6-дигидро-2-оксо-2h-1,3,4-тиадиазины</a>
Предыдущий патент: Антагонисты il-17a и il-17f и способы их применения
Следующий патент: Применение солей тиотропия для лечения персистирующей астмы средней тяжести
Случайный патент: Способ нормализованной когерентной амплитудной и относительной фазовой модуляции для многопользовательских систем связи