Антибактериальные агенты
Номер патента: 15198
Опубликовано: 30.06.2011
Авторы: Браун Дэвид Риалл, Хайдон Дэвид Джон, Чаплевски Ллойд Джорж, Коллинз Ян
Формула / Реферат
1. Применение соединения, которое представляет собой замещенный бензамид или пиридиламид формулы (I), или его соли, гидрата или сольвата для изготовления лекарственного препарата, используемого для лечения бактериальной инфекции
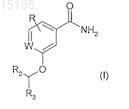
где R обозначает водород или 1, 2 или 3 заместителя, выбранных из водорода, галогена, ОН и NH2;
W обозначает C(R1)- или =N-;
R1 обозначает водород или фтор и R2 обозначает метил, водород или фтор;
R3 обозначает радикал формулы (Alk1)m-(Z)p-(Alk2)n-Q, где m, p и n независимо равны 0 или 1, при условии, что по меньшей мере один из m, n и р равен 1,
Z обозначает -О-, -S-, -S(O)-, -S(O2)-, -S(O3)-, NH, -N(CH3)-, -N(CH2CH3)-, -C(=O)-, -O-C(=O)-, -C(=O)-O-, или возможно замещенный двухвалентный моноциклический карбоциклический или гетероциклический радикал, содержащий 3-6 атомов в кольце; или возможно замещенный двухвалентный бициклический гетероциклический радикал, содержащий 5-10 атомов в кольце, или нафтил;
Alk1 и Alk2 обозначают возможно замещенные C1-С6алкилен, С2-С6алкенилен или С2-С6алкинилен, которые могут заканчиваться или прерываться -О-, -S-, -S(O)-, -S(O2)-, -S(O3)-, -NH-, -N(CH3)- или -N(CH2CH3)-; и
Q обозначает водород, галоген, нитрил (CN) или гидроксил, или возможно замещенный моноциклический карбоциклический или гетероциклический радикал, содержащий 3-7 атомов в кольце, или возможно замещенный двухвалентный бициклический гетероциклический радикал, содержащий 5-10 атомов в кольце; при этом,
возможно замещенный означает замещенный 1-4 совместимыми заместителями, каждый из которых независимо выбран из (С1-С6)алкила, (С2-С6)алкенила, (С2-С6)алкинила, (C1-С6)алкокси, гидрокси, гидрокси (C1-С6)алкила, меркапто, меркапто(С1-С6)алкила, (C1-С6)алкилтио, галогена, полностью или частично фторированного (С1-С3)алкила, (С1-С3)алкокси или (C1-С3)алкилтио, нитро, нитрила (-CN), оксо (=O), фенила, фенокси, моноциклического гетероарила или гетероарилокси, содержащего 5 или 6 атомов в кольце, -COORA, -CORA, -OCORA, -SO2RA, -CONRARB, -SO2NRARB, -NRARB, OCONRARB, -NRBCORA,
-NRBCOORA, -NRBSO2ORA или -NRACONRARB, где RA и RB независимо обозначают водород или (С1-С6)алкил или, в случае когда RA и RB соединены с одним и тем же атомом N, RA и RB, взятые вместе с этим атомом азота, могут образовать циклическое азотсодержащее кольцо, и
где гетероциклил включает гетероарил и означает моно- или бициклический неароматический радикал, содержащий один или более гетероатомов, выбранных из S, N и О, и гетероарил относится к моно- или бициклическому ароматическому радикалу, содержащему один или более гетероатомов, выбранных из S, N и О.
2. Применение по п.1, отличающееся тем, что галоген представляет собой фтор, бром или хлор.
3. Применение по п.1, отличающееся тем, что полностью или частично фторированный (С1-С3)алкил, (C1-С3)алкокси или (C1-С3)алкилтио представляют собой трифторметил, трифторметокси или трифторметилтио.
4. Применение по п.1, отличающееся тем, что соединение имеет формулу (IA)
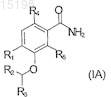
где R4и R5 независимо обозначают фтор или хлор или один из R4 и R5обозначает водород, а другой обозначает фтор или хлор и R1, R2и R3 указаны в п.1.
5. Применение по п.1, отличающееся тем, что соединение имеет формулу (IB)
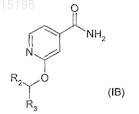
где R2обозначает водород, метил или фтор и R3указан в п.1.
6. Применение по любому из пп.1-5, отличающееся тем, что R1и R2 обозначают водород.
7. Применение по любому из предыдущих пунктов, отличающееся тем, что р равен 0 и m и/или n равен 1.
8. Применение по любому из пп.1-6, отличающееся тем, что р равен 1, Z обозначает возможно замещенный гетероарил, содержащий от 3 до 6 атомов в кольце, или возможно замещенный бициклический гетероарильный радикал, содержащий от 5 до 10 атомов в кольце, который соединен с -(Alk1)m- частью R3и с -(Alk2)n-Q частью R3 через атомы углерода или азота.
9. Применение по п.8, отличающееся тем, что двухвалентный радикал Z выбран из следующих радикалов, возможно замещенных в любой ориентации:
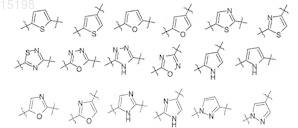
10. Применение по п.8, отличающееся тем, что двухвалентный радикал Z выбран из следующих радикалов, возможно замещенных в любой ориентации:
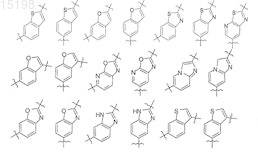
11. Применение по п.8, отличающееся тем, что двухвалентный радикал Z выбран из следующих радикалов, возможно замещенных в любой ориентации:
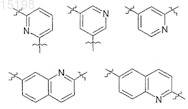
12. Применение по любому из пп.1-6, отличающееся тем, что р равен 1 и Z обозначает возможно замещенный моноциклический неароматический карбоциклический или гетероциклический радикал с 3-6 атомами в кольце или возможно замещенный бициклический неароматический карбоциклический или гетероарильный радикал, содержащий от 5 до 10 атомов в кольце, который соединен с -(Alk1)m- частью R3 и с -(Alk2)n-Q частью R3 через атомы углерода или азота.
13. Применение по п.12, отличающееся тем, что двухвалентный радикал Z выбран из возможно замещенных следующих радикалов в любой ориентации:
![]()
14. Применение по любому из пп.8-13, отличающееся тем, что Q является водородом.
15. Применение по любому из пп.1-13, отличающееся тем, что Q обозначает радикал, выбранный из любых двухвалентных радикалов, указанных в любом из пп.8-11 с одной ненасыщенной валентностью, насыщенной водородом или возможным заместителем.
16. Применение по любому из пп.8-15, отличающееся тем, что n равен 0.
17. Применение по любому из пп.8-16, отличающееся тем, что m равен 0.
18. Применение по любому из предыдущих пунктов, отличающееся тем, что длина радикала R3 не превышает длину неразветвленной насыщенной углеводородной цепи с 14 атомами углерода.
19. Применение по любому из пп.1-17, отличающееся тем, что длина радикала R3 эквивалентна длине неразветвленного насыщенного углеводородного радикала, содержащего от 6 до 12 или от 9 до 12 атомов углерода.
20. Применение по любому из предыдущих пунктов, отличающееся тем, что Alk1и Alk2, если они имеются, являются возможно замещенными линейным C1-С6алкиленом, С2-С6алкениленом или С2-С6алкиниленом, каждый из которых может оканчиваться или прерываться -О-, -S-, -S(O)-, -S(O2)-, -NH-, -N(CH3)- или
-N(CH2CH3)-, -С(=O)-, -O-(C=O)-, -С(=O)-O-.
21. Применение по любому из предыдущих пунктов, отличающееся тем, что R и любые возможные заместители, содержащиеся в Alk1, Alk, Z и Q, выбраны из метила, этила, циклопропила, оксо, гидроксила, галогена, циано, ацетила, амино, метиламино, диметиламино, ацетиламино, карбаматной группы и СН2ОН.
22. Применение по п.4, отличающееся тем, что R2обозначает водород и R3обозначает радикал, выбранный из радикалов формул А-Н:
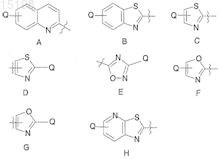
где Q указан в п.1 и где любой незамещенный атом углерода в кольце может быть замещен.
23. Применение по п.22, отличающееся тем, что Q представляет собой водород или возможно замещенный фенил.
24. Применение по п.4, отличающееся тем, что R2является водородом и R3является возможно замещенным хинолин-2-илом, бензотиазол-2-илом, тиазолпиридин-2-илом, тиазол-2-илом, тиазол-4-илом, тиазол-5-илом, оксазол-2-илом, оксазол-4-илом, оксадиазол-3-илом или оксадиазол-5-илом.
25. Применение по п.24, отличающееся тем, что R3замещен возможно замещенным фенилом.
26. Применение по любому из пп.22-24, отличающееся тем, что любой возможный заместитель в R3 выбран из метила, -ОСН3, -CF3, -OCF3, этила, циклопропила, оксо, гидроксила, -F, -Cl, -Br, циано, ацетила, амино, метиламино, диметиламино, ацетиламино, карбаматной группы, -CONH2, нитро, -СООН и -СН2ОН.
27. Применение по любому из пп.8-13, 15, 20, 22-25, отличающееся тем, что возможные заместители, содержащиеся в Alk1, Alk2, Z и Q, выбраны из 1-4 совместимых заместителей, каждый из которых может независимо означать (С1-С6)алкил, (С2-С6)алкенил, (С2-С6)алкинил, (C1-С6)алкокси, гидрокси, гидрокси (С1-С6)алкил, меркапто, меркапто(С1-С6)алкил, (С1-С6)алкилтио, галоген, полностью или частично фторированный (C1-С3)алкил, (C1-С3)алкокси или (C1-С3)алкилтио, нитро, нитрил (-CN), оксо (=O), фенил, фенокси, моноциклический гетероарил или гетероарилокси, содержащие 5 или 6 атомов в кольце, -COORA,
-CORA, -OCORA, -SO2RA, -CONRARB, -SO2NRARB, -NRARB, OCONRARB, -NRBCORA, -NRBCOORA,
-NRBSO2ORA или -NRACONRARB, где RA и RB независимо обозначают водород или (С1-С6)алкил или, в случае когда RA и RB соединены с одним и тем же атомом N, RA и RB, взятые вместе с этим атомом азота, могут образовать циклическое азотсодержащее кольцо.
28. Соединение, которое представляет собой замещенный бензамид или пиридиламид формулы (IС), или его соль, гидрат или сольват
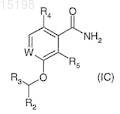
где W обозначает =C(R1)- или =N-; R1 обозначает водород или фтор и R2 обозначает водород, метил или фтор; R4 и R5независимо обозначают фтор или хлор или один из R4и R5 обозначает водород, в то время как другой является фтором или хлором; и R3обозначает радикал, выбранный из радикалов следующих формул А-Н, где каждое свободное положение в кольце может быть замещено:
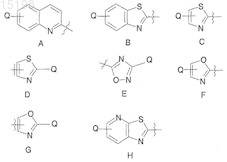
где Q обозначает водород, галоген, нитрил или гидроксил; или возможно замещенный моноциклический карбоциклический или гетероциклический радикал, содержащие 3-6 атомов в кольце, или возможно замещенный бициклический гетероциклический радикал, содержащий 5-10 атомов в кольце, причем возможно замещенный означает замещенный 1-4 совместимыми заместителями, каждый из которых независимо выбран из (С1-С6)алкила, (С2-С6)алкенила, (С2-С6)алкинила, (С1-С6)алкокси, гидрокси, гидрокси(С1-С6)алкила, меркапто, меркапто(С1-С6)алкила, (С1-С6)алкилтио, галогена, полностью или частично фторированного (C1-С3)алкила, (C1-С3)алкокси или (C1-С3)алкилтио, нитро, нитрила (-CN), оксо (=O), фенила, фенокси, моноциклического гетероарила или гетероарилокси, содержащего 5 или 6 атомов в кольце, -COORA, -CORA, -OCORA, -SO2RA, -CONRARB, -SO2NRARB, -NRARB, OCONRARB, -NRBCORA,
-NRBCOORA, -NRBSO2ORA или -NRACONRARB, где RA и RB независимо обозначают водород или (C1-С6)алкил или, в случае когда RA и RB соединены с одним и тем же атомом N, RA и RB, взятые вместе с этим атомом азота, могут образовать циклическое азотсодержащее кольцо.
29. Соединение по п.28, отличающееся тем, что W обозначает =СН- и R2является водородом.
30. Соединение по п.28, отличающееся тем, что Q в радикале R3 является водородом или возможно замещенным фенилом.
31. Соединение по п.28 или 29, отличающееся тем, что R3является возможно замещенным хинолин-2-илом, бензотиазол-2-илом, тиазолпиридин-2-илом, тиазол-2-илом, тиазол-4-илом, тиазол-5-илом, оксадиазол-3-илом, оксадиазол-5-илом, оксазол-2-илом, оксазол-4-илом, оксазол-5-илом.
32. Соединение по п.30, отличающееся тем, что R3замещен возможно замещенным фенилом.
33. Соединение по любому из пп.28-32, отличающееся тем, что любой возможный заместитель в R3 выбран из метила, -ОСН3, -CF3, -OCF3, этила, циклопропила, оксо, гидроксила, -F, -Cl, -Br, циано, ацетила, амино, метиламино, диметиламино, ацетиламино, карбаматной группы, -CONH2, нитро, -СООН и
-СН2ОН.
34. Соединение, которое представляет собой пиридиламид формулы (ID) или его соль, гидрат или сольват
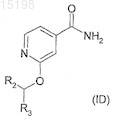
где R2обозначает водород, метил или фтор и R3имеет значения, указанные в п.28.
35. Соединение по п.34, отличающееся тем, что R2обозначает водород.
36. Соединение по п.34 или 35, отличающееся тем, что Q в радикале R3 является водородом или возможно замещенным фенилом.
37. Соединение по п.34 или 35, отличающееся тем, что R3является возможно замещенным хинолин-2-илом, бензотиазол-2-илом, тиазолпиридин-2-илом, тиазол-2-илом, тиазол-4-илом, тиазол-5-илом, оксадиазол-3-илом, оксадиазол-5-илом, оксазол-2-илом, оксазол-4-илом, оксазол-5-илом.
38. Соединение по п.37, отличающееся тем, что R3замещен возможно замещенным фенилом.
39. Соединение по любому из пп.34-38, отличающееся тем, что любой возможный заместитель в R3 выбран из метила, -ОСН3, -CF3, -OCF3, этила, циклопропила, оксо, гидроксила, -F, -Cl, -Br, циано, ацетила, амино, метиламино, диметиламино, ацетиламино, карбаматной группы, -CONH2, нитро, -СООН и -СН2ОН.
40. Соединение по любому из пп.28, 30-32 или 36-38, отличающееся тем, что возможные заместители, содержащиеся в Q, выбраны из 1-4 совместимых заместителей, каждый из которых может независимо означать (С1-С6)алкил, (С2-С6)алкенил, (С2-С6)алкинил, (С1-С6)алкокси, гидрокси, гидрокси (С1-С6)алкил, меркапто, меркапто(С1-С6)алкил, (С1-С6)алкилтио, галоген, полностью или частично фторированный (C1-C3)алкил, (C1-С3)алкокси или (C1-С3)алкилтио, нитро, нитрил (-CN), оксо (=O), фенил, фенокси, моноциклический гетероарил или гетероарилокси, содержащие 5 или 6 атомов в кольце, -COORA, -CORA,
-OCORA, -SO2RA, -CONRARB, -SO2NRARB, -NRARB, OCONRARB, -NRBCORA, -NRBCOORA, -NRBSO2ORA или -NRACONRARB, где RA и RB независимо обозначают водород или (C1-С6)алкил или, в случае когда RA и RB соединены с одним и тем же атомом N, RA и RB, взятые вместе с этим атомом азота, могут образовать циклическое азотсодержащее кольцо.
41. Фармацевтическая композиция, содержащая соединение по любому из пп.28-39, и фармацевтически приемлемый носитель.
42. Антибактериальная композиция, содержащая соединение по любому из пп.28-39 в количестве, эффективном для ингибирования роста бактерий, вместе с фармацевтически приемлемым носителем.
43. Применение соединения по любому из пп.28-39 для лечения бактериальной инфекции.
44. Способ лечения бактериальной инфекции, включающий введение субъекту страдающему от такой инфекции, соединения по любому из пп.28-39 в количестве, достаточном для ингибирования роста бактерий.
45. Способ обработки бактериального загрязнения субстрата, включающий нанесение на участок такого загрязнения соединения по любому из пп.28-39 в количестве, достаточном для ингибирования роста бактерий.
Текст
Браун Дэвид Риалл, Коллинз Ян,Чаплевски Ллойд Джорж, Хайдон Дэвид Джон (GB) Дементьев В.Н. (RU) Изобретение отностится к применению соединения, которое представляет собой замещенный бензамид или пиридиламид формулы (I), или его соли, гидрата или сольвата для изготовления лекарственного препарата, используемого для лечения бактериальной инфекции где R обозначает водород или 1, 2 или 3 заместителя, выбранных из водорода, галогена, ОН и NH2; W обозначает C(R1)или =N-; R1 обозначает водород или фтор и R2 обозначает метил, водород или фтор; R3 обозначает радикал формулы(Alk1)m-(Z)p-(Alk2)n-Q, где m, p и n независимо равны 0 или 1, при условии, что по меньшей мере один из m, n и р равен 1,Z обозначает -О-, -S-, -S(O)-, -S(O2)-, -S(O3)-, NH, -N(CH3)-, -N(CH2CH3)-, -C(=O)-, -O-C(=O)-, -C(=O)-O-, или возможно замещенный двухвалентный моноциклический карбоциклический или гетероциклический радикал, содержащий 3-6 атомов в кольце; или возможно замещенный двухвалентный бициклический гетероциклический радикал, содержащий 5-10 атомов в кольце или нафтил; Alk1 и Alk2 обозначают возможно замещенные C1-С 6 алкилен, С 2-С 6 алкенилен или С 2-С 6 алкинилен, которые могут заканчиваться или прерываться -О-, -S-, -S(O)-, -S(O2)-, -S(O3)-, -NH-, -N(СН 3)- или-N(CH2CH3)-; и Q обозначает водород, галоген, нитрил (CN) или гидроксил, или возможно замещенный моноциклический карбоциклический или гетероциклический радикал, содержащий 3-7 атомов в кольце, или возможно замещенный двухвалентный бициклический гетероциклический радикал, содержащий 5-10 атомов в кольце.(71)(73) Заявитель и патентовладелец: БИОТА ЮРОП ЛИМИТЕД (GB) 015198 Данное изобретение относится к классу замещенных бензамидов и пиридиламидов в качестве антибактериальных агентов, к новым членам этого класса как таковым и к фармацевтическим композициям,содержащим такие соединения. Предпосылки создания изобретения Известны многие классы антибактериальных агентов, включая пенициллины и цефалоспорины,тетрациклины, сульфонамиды, монобактамы, флуорхинолоны и хинолоны, аминогликозиды, гликопептиды, макролиды, полимиксины, линкозамиды, триметоприм и хлорамфеникол. Основные механизмы действия этих классов антибактериальных агентов отличаются друг от друга. Резистентность бактерий ко многим антибактериальным агентам является большой проблемой. Соответственно, существует постоянная необходимость в создании альтернативных антибактериальных агентов, особенно тех, которые имеют механизмы действия, фундаментально отличающиеся от механизма действия известных классов соединений. Среди грамположительных патогенов, таких как стафилококки, стрептококки, микробактерии и энтерококки, появились резистентные штаммы, с которыми особенно трудно бороться. Примерами таких штаммов являются Staphylococcus aureus (MRSA), резистентный к метициллину, негативный в отношении коагулазы staphylococci (MRCNS), резистентный к пенициллину Streptococcus pneumoniae и резистентный в отношении многих лекарств Enterococcus faecium. Вследствие быстрого возникновения резистентных ко многим лекарствам бактерий огромное значение имеет разработка антибактериальных агентов с новыми механизмами действия, которые эффективны против растущего числа резистентных бактерий, в особенности резистентных к ванкомицину enterococci и резистентных к бета-лактамным антибиотикам бактерий, таких как резистентные к метициллину Staphylococcus aureus. Деление клеток представляет значительный интерес для фармацевтической промышленности как мишень, поскольку оно включает группу консервативных целевых белков, которые все являются существенными для жизнеспособности широкого класса бактерий, их активность полностью отличается от активности белков, участвующих в процессе деления клеток у млекопитающих. Ряд соединений, которые действуют на компоненты механизма деления клеток, уже был описан (Ohashi, Y. et al. J. Bacteriol. 181,1348-1351 (1999), Jennings, L.D. et al. Bioorg. Med. Chem. 12, 5115-5131 (2004), Sutherland, A.G. et al. Org.Biol. Chem. 280, 39709-39715 (2005. До сих пор большинство усилий было направлено на белок FtsZ,так как он обладает несколькими видами биохимической активности, которые можно определить in vitro. К сожалению, большинство соединений, описанных до сих пор, или имеют относительно низкую активность, нежелательные фармакологические свойства, или неизвестную специфичность. Сущность изобретения Данное изобретение основано на обнаружении того факта, что класс замещенных бензамидов и пиридиламидов обладает антибактериальной активностью, о чем свидетельствует ингибирование роста бактерий членами этого класса. Соединения эти проявляют активность в отношении штаммов грамположительных бактерий, таких как стафилококки, клостридии, листерии и бациллы, например, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus haemolyticus и Staphylococcus saprophyticus,Bacillus subtilis, Bacillus anthracis и Bacillus cereus. Хотя это изобретение не ограничено какой-либо конкретной гипотезой, касающейся механизма действия указанных соединений, в настоящее время считают,что такая активность опосредована соединениями, ингибирующими деление клеток за счет связыванияFtsZ. Подробное описание изобретения Согласно широкому аспекту данного изобретения предусмотрено применение соединения, которое представляет собой замещенный бензамид или пиридиламид формулы (I) или его соли, гидрата или сольвата при изготовлении лекарственного препарата, используемого для лечения бактериальной инфекции.R обозначает водород или 1, 2 или 3 заместителя, выбранных из водорода, галогена, ОН и NH2;R1 обозначает водород или фтор и R2 обозначает метил, водород или фтор;(Alk1)m-(Z)p-(Alk2)n-Q,где m, p и n независимо равны 0 или 1, при условии, что по меньшей мере один из m, n и р равен 1,Z обозначает -О-, -S-, -S(O)-, -S(O2)-, -S(O3)-, NH, -N(CH3)-, -N(CH2CH3)-, -C(=O)-, -O-C(=O)-,-C(=O)-O- или возможно замещенный двухвалентный моноциклический карбоциклический или гетероциклический радикал, содержащий 3-6 атомов в кольце; или возможно замещенный двухвалентный бициклический гетероциклический радикал, содержащий 5-10 атомов в кольце или нафтил;Alk1 и Alk2 обозначают возможно замещенные C1-С 6 алкилен, С 2-С 6 алкенилен или С 2-С 6 алкинилен, которые могут заканчиваться или прерываться -О-, -S-, -S(O)-, -S(O2)-, -S(O3)-, -NH-, -N(CH3) или -N(CH2CH3)-; иQ обозначает водород, галоген, нитрил (CN) или гидроксил или возможно замещенный моноциклический карбоциклический или гетероциклический радикал, содержащий 3-7 атомов в кольце или возможно замещенный двухвалентный бициклический гетероциклический радикал, содержащий 5-10 атомов в кольце; при этом,возможно замещенный означает замещенный от одного до четырех совместимыми заместителями,каждый из которых независимо выбран из (C1-С 6)алкила, (С 2-С 6)алкенила, (С 2-С 6)алкинила, (С 1 С 6)алкокси, гидрокси, гидрокси (C1-С 6)алкила, меркапто, меркапто(С 1-С 6)алкила, (C1-С 6)алкилтио, галогена, полностью или частично фторированного (C1-С 3)алкила, (C1-С 3)алкокси или (C1-С 3)алкилтио, нитро, нитрила (-CN), оксо(=O), фенила, фенокси, моноциклический гетероарила или гетероарилокси, содержащего 5 или 6 атомов в кольце, -COORA, -CORA, -OCORA, -SO2RA, -CONRARB, -SO2NRARB,-NRARB, OCONRARB, -NRBCORA, -NRBCOORA, -NRBSO2ORA или -NRACONRARB, где RA и RB независимо обозначают водород или (C1-С 6)алкил, или в случае когда RA и RB соединены с одним и тем же атомом N,RA и RB, взятые вместе с этим атомом азота, могут образовать циклическое азотосодержащее кольцо, и где гетероциклил включает гетероарил, и, означает моно- или бициклический неароматический радикал, содержащий один или более гетероатомов, выбранных из S, N и О, и гетероарил относится к моно- или бициклическому ароматическому радикалу, содержащему один или более гетероатомов, выбранных из S, N и О. Согласно другим широким аспектам данное изобретение охватывает:(i) способ лечения бактериальной инфекции у субъекта, страдающего от такой инфекции, включающий введение этому субъекту такого количества соединения формулы (I), указанной выше, которое достаточно для ингибирования роста бактерий;(ii) способ устранения бактериального загрязнения субстрата, включающий нанесение на участок этого загрязнения такого количества соединения формулы (I), указанной выше, которое достаточно для ингибирования роста бактерий;(iii) применение соединения формулы (I), указанной выше, для для изготовления препарата для лечения бактериальной инфекции. Некоторые члены класса соединений формулы (I), указанной выше, считаются новыми, и изобретение включает все такие новые члены этого класса. Данное изобретение также включает новые соединения, которые являются замещенными бензамидами или пиридиламидами формулы (IC) или их солями, гидратами или сольватами:R1 обозначает водород или фтор и R2 обозначает водород, метил или фтор;R4 и R5 независимо обозначают фтор или хлор, или один из R4 и R5 обозначает водород, в то время,как другой является фтором или хлором; и R3 обозначает радикал, выбранный из радикалов следующих формул А-Н, где каждое свободное положение в кольце может быть замещено: где Q обозначает водород, галоген, нитрил или гидроксил; или возможно замещенный моноциклический карбоциклический или гетероциклический радикал, содержащие 3-6 атомов в кольце или возможно замещенный бициклический гетероциклический радикал, содержащий 5-10 атомов в кольце, причем возможно замещенный означает замещенный от одного до четырех совместимыми заместителями,каждый из которых независимо выбран из (C1-С 6)алкила, (С 2-С 6)алкенила, (С 2-С 6)алкинила, (С 1 С 6)алкокси, гидрокси, гидрокси (C1-С 6)алкила, меркапто, меркапто(С 1-С 6)алкила, (C1-С 6)алкилтио, галогена, полностью или частично фторированного (C1-С 3)алкила, (C1-С 3)алкокси или (C1-С 3)алкилтио, нитро, нитрила (-CN), оксо (=O), фенила, фенокси, моноциклический гетероарила или гетероарилокси, содержащего 5 или 6 атомов в кольце, -COORA, -CORA, -OCORA, -SO2RA, -CONRARB, -SO2NRARB, -NRARB,OCONRARB, -NRBCORA, -NRBCOORA, -NRBSO2ORA или -NRACONRARB где RA И RB независимо обозначают водород или (C1 - С 6)алкил, или, в случае, когда RA и RB соединены с одним и тем же атомом N, RA и RB, взятые вместе с этим атомом азота, могут образовать циклическое азотосодержащее кольцо. Терминология Используемый в данном описании термин "(Ca-Cb)алкил", где а и b являются целыми числами, относится к линейному или разветвленному алкильному радикалу, содержащему от "а" до "b" атомов углерода. Так, например, когда а равен 1 и b равен 6, термин включает этил, этил, н-пропил, изопропил, нбутил, изобутил, втор. бутил, трет. бутил, н-пентил и н-гексил. Используемый термин "двухвалентный (Ca-Cb)алкилен", где а и b являются целыми числами, относится к насыщенной углеводородной цепи, содержащей от "а" до "b" атомов углерода и две ненасыщенные валентности. Например, этот термин охватывает метилен, этилен, н-пропилен и н-бутилен. Используемые термин "(Ca-Cb)алкенил, где а и b являются целыми числами, относится к линейному или разветвленному алкенилу, содержащему от "а" до "b" атомов углерода и по меньшей мере одну двойную связь или Е-, или Z-стереохимии, где это возможно. Этот термин включает, например, винил, аллил,1-й 2-бутенил и 2 -метил-2-пропенил. Используемый термин "двухвалентный (Ca-Cb)алкенилен" означает углеводородную цепь, содержащую от "а" до "b" атомов углерода, по меньшей мере, одну двойную связь и две ненасыщенные валентности. Например, этот термин включает -СН = СН- (винилен), -СН = СН - СН 2-, -СН 2 - СН = СН-,-СН-СН-СН 2-СН 2-, -СН=СН-СН 2-СН 2-СН 2-, -СН=СН-СН=СН-, -СН=СН-СН=СН-СН 2-, -СН=СН-СН=СН-СН 2-СН 2-, -СН=СН-СН 2-СН=СН- и -СН=СН-СН 2-СН 2-СН=СН-. Применяемый в данной заявке термин "Ca-Cbалкинил", где а и b являются целыми числами, означает линейный или разветвленный углеводородный радикал, содержащий от "а" до "b" атомов углерода и, в дополнение по меньшей мере одну тройную связь. Этот термин включает, например, этинил, 1 пропинил, 1- и 2-бутинил, 2-метил, 2-пропинил, 2-пентинил, 3-пентинил, 4-пентинил, 2-гексинил, 3 гексинил, 4-гексинил и 5-гексинил. Применяемый термин "двухвалентный (Ca-Cb)алкинилен, где а и b являются целыми числами, означает двухвалентную углеводородную цепь, содержащую от "а" до "b" атомов углерода и, по меньшей мере, одну тройную связь. Этот термин включает, например, -СC-, -CC-СН 2- и -СН 2-СС-. Используемый термин "циклоалкил" относится к моноциклическому или мостиковому моноциклическому насыщенному карбоциклическому радикалу, содержащему 3-8 атомов углерода, и включает,например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и бицикло[2.2.1]-гепт-1-ил. Применяемый в данной заявке термин "арил" относится к моно- или бициклическому карбоциклическому ароматическому радикалу, примерами которого являются фенил и нафтил. Используемый, не являющийся узаконенным, термин "гетероарил" относится к моно- или бициклическому ароматическому радикалу, содержащему один или более гетероатомов, выбранных из S, N и О,и включает радикалы, содержащие два таких моноциклических кольца или одно такое моноциклическое кольцо и один моноциклический арил, которые являются конденсированными или непосредственно связанными ковалентной связью. Примеры таких радикалов включают тиенил, бензтиенил, фурил, бензфурил, пирролил, имидазо-3 015198 лил, бензимидазолил, тиазолил, бензтиазолил, тиазолопиридинил, изотиазолил, бензизотиазолил, пиразолил, оксазолил, бензоксазолил, изоксазолил, бензизоксазолил, изотиазолил, триазолил, бензтриазолил,тиадиазолил, оксадиазолил, пиридинил, пиридазинил, пиримидинил, триазинил, индолил и индазолил. Используемый, не имеющий строго определения термин "гетероциклил" или "гетероциклический радикал" включает "гетероарил", определение которого дано выше, и, кроме того, означает моно- или бициклический неароматический радикал, содержащий один или более гетероатомов, выбранных из S, N и О. Примеры этих радикалов включают пирролил, фуранил, тиенил, пиперидинил, имидазолил, оксазолил, изоксазолил, тиазолил, тиадиазолил, пиразолил, пиридинил, пирролидинил, пиримидинил, морфолинил, пиперазинил, индолил, морфолинил, бензфуранил, пиранил, изоксазолил, бензимидазолил, метилен - диоксифенил, этилендиоксифенил, малеимидную группу и сукцинимидную группу. Если иное не указано в контексте описания, термин "замещенный", относящийся здесь к любому радикалу, означает радикал, замещенный от 1 до 4 совместимыми заместителями, каждый из которых может независимо означать, например, (С 1-С 6)алкил, (С 2-С 6)алкенил, (С 2-С 6)алкинил, (C1-С 6)алкокси,гидрокси, гидрокси (С 1-С 6)алкил, меркапто, меркапто(С 1-С 6)алкил, (С 1-С 6)алкилтио, галоид (включая фтор, бром и хлор), полностью или частично фторированный (C1-С 3)алкил, (C1-С 3)алкокси или (C1 С 3)алкилтио, такой как трифторметил, трифторметокси и трифторметилтио, нитро, нитрил (-CN), оксо(=O), фенил, фенокси, моноциклический гетероарил или гетероарилокси, содержащие 5 или 6 атомов, в кольце, -COORA, -CORA, -OCORA, -SO2RA, -CONRARB, -SO2NRARB, -NRARB, OCONRARB, -NRBCORA, NRBCOORA, -NRBSO2ORA или -NRACONRARB где RA и RB независимо обозначают независимо водород или (С 1-С 6)алкил, или, в случае, когда RA и RB соединены с одним и тем же атомом N, RA и RB, взятые вместе с этим атомом азота, могут образовать циклическое аминосодержащее кольцо. Когда заместителем является фенил, фенокси или моноциклический гетероарил или гетероарилокси с 5 или 6 атомами в кольце, фенил или гетероарил могут сами быть замещены любым из перечисленных выше заместителей кроме фенила, фенокси, гетероарила или гетероарилокси. "Возможным заместителем" или "заместителем" может быть одна из перечисленных выше групп. Применяемый здесь термин "соль" включает соли присоединения к основанию, к кислоте и четвертичные соли. Соединения по изобретению, являющиеся кислыми, могут образовать соли, включая фармацевтически приемлемые соли, с основаниями, такими как гидроокиси щелочных металлов, например,гидроокиси натрия и калия; гидроокиси щелочно-земельных металлов, например, гидроокиси кальция,бария и магния; с органическими основаниями, например, с N-метил-D-глюкамином, холин- трис (гидроксиметил)аминометаном, L-аргинином, L-лизином, N-этилпиперидином, дибензиламином и т.п. Соединения формулы (I), являющиеся основными, могут образовать соли, включая фармацевтически приемлемые соли, с неорганическими кислотами, например, с галоидводородными кислотами, такими как соляная или бромисто-водородная кислоты, серная кислота, азотная кислота или фосфорная кислота и т.п.; и с органическими кислотами, например, с уксусной, винной, янтарной, фумаровой, малеиновой,яблочной, салициловой, лимонной, метансульфокислотой, п-толуол-сульфокислотой, глутаминовой, молочной и миндальной кислотами и т.п. Подходящие соли можно найти в Handbook of PharmaceuticalSalts: Properties, Selection, and Use by Stahl and Wermuth (Wiley-VCH, Wemheim, Germany, 2002). Термин "сольват" применяется для описания молекулярного комплекса, содержащего соединение по изобретению и стехиометрическое количество одного или более фармацевтически приемлемых растворителей, например, этанола. Термин "гидрат" применяется, когда растворителем является вода. Соединения по изобретению, которые содержат один или более существующих или возможных хиральных центров вследствие наличия асимметричных атомов углерода, могут существовать в виде ряда энантиомеров или диастереомеров с R- или S -стереохимией у каждого хирального центра. Данное изобретение включает все такие энантиомеры и диастереомеры и их смеси. Аспекты изобретения Конкретный подкласс соединений, используемых в качестве антибактериальных агентов согласно данному изобретению, включает соединения формулы (IA) где R4 и R5 независимо обозначают фтор или хлор или один из R4 и R5 обозначает водород, а другой обозначает фтор или хлор, и R1, R2 и R3 указаны выше для формулы (I). Другой конкретный подкласс соединений, являющихся антибактериальными агентами согласно данному изобретению, образуют соединения формулы (IB): где R2 и R3 указаны выше для формулы (I). Узкий подкласс соединений, являющихся антибактериальными агентами согласно данному изобретению, включая соединения формулы (IA), указанной выше, составляют соединения, в которых R1 и R2 обозначают водород; в соединениях формулы (IB), приведенной выше, R2 обозначает водород. В радикале R3 "р" может быть равен 0, а "m" и/или "n" может равняться 1. Или же "р" может равняться 1 и Z может обозначать возможно замещенный карбоциклический или гетероарильный радикал,содержащий 3-6 атомов в кольце, или возможно замещенный бициклический карбоциклический или гетероарильный радикал, содержащий 5-10 атомов в кольце, который связан с -(Alk1)m-частью R3 и с(Alk2)n-Q-частью R3 через атомы углерода или азота. Примеры двухвалентных радикалов Z по этому варианту включают радикалы, выбранные из указанных ниже, в любой ориентации: Согласно другому альтернативному варианту "р" равен 1 и Z обозначает возможно замещенный моноциклический неароматический карбоциклический или гетероциклический радикал, содержащий 3-6 атомов в кольце или возможно замещенный бициклический неароматический карбоциклический или гетероциклический радикал, содержащий 5-10 атомов в кольце, который связан с -(Alk1)m-частью R3 и с(Alk2)n-Q-частью R3 через атомы углерода или азота. Примеры радикалов Z, которые могут быть замещенными, по этому варианту включают следующие группы, в любой ориентации: В соединениях, которых касается данное изобретение, и в любом из подклассов или вариантов таких соединений, обсужденных выше, Q может обозначать водород. Однако Q может также быть радика-5 015198 лом, выбранным из любых двухвалентных радикалов Z, которые особо описаны выше, но с одной из ненасыщенных валентностей, которая насыщена водородом или возможным заместителем. В соединениях, которых касается данное изобретение, и в любом из подклассов или вариантов таких соединений, описанных выше, "n" и/или "m" может быть равен 0. Во всех соединениях и классах соединений, которых касается данное изобретение, является типичным, чтобы радикал R3 не превышал длину неразветвленной насыщенной углеводородной цепи, содержащей 14 атомов углерода, то есть его длина не должна превышать примерно 16 ангстрем. Например, эта длина может быть эквивалентна длине неразветвленной насыщенной углеводородной цепи с 6 - 12 атомами углерода или 9-12 такими атомами, то есть цепи, содержащей от примерно 6 до примерно 14 таких атомов углерода и от примерно 10 до примерно 14 ангстрем, соответственно. В соединениях, которых касается данное изобретение, Alk1 и Alk2 , когда они имеются, могут быть,например, возможно замещенными линейными C1-С 6 алкиленом, С 2-С 6 алкениленом или С 2 С 6 алкиниленом, каждый из которых может заканчиваться или прерываться группами -О-, -S-, -S(O)-,-S(O2), -NH-, -N(CH3)-, или -N(CH2CH3)-, -С(=O)-, -O-(С=O)-, -С(=O)-O-. Любые возможные заместители R и любые возможные заместители, содержащиеся в Alk1, Alk2, Z иQ могут быть выбраны, например, из метила, -ОСН 3, -CF3, -OCF3, этила, циклопропила, оксогруппы, гидроксила, F, Cl, Br, цианогруппы, ацетила, аминогруппы, метиламиногруппы, диметиламино, ацетиламино, карбаматной группы, -CONH2, нитро, -СООН и -СН 2 ОН. Соединения формулы (IC) per se и их соли, гидраты или сольваты составляют особый аспект изобретения.R1 обозначает водород или фтор и R2 обозначает водород, метил или фтор;R4 и R5 независимо обозначают фтор или хлор, или один из R4 и R5 обозначает водород, в то время,как другой является фтором или хлором; иR3 обозначает радикал, выбранный из радикалов следующих формул А-Н, где каждое свободное положение в кольце может быть замещено: где Q обозначает водород, галоген, нитрил или гидроксил; или возможно замещенный моноциклический карбоциклический или гетероциклический радикал, содержащие 3-6 атомов в кольце или возможно замещенный бициклический гетероциклический радикал, содержащий 5-10 атомов в кольце, причем возможно замещенный означает замещенный от одного до четырех совместимыми заместителями,каждый из которых независимо выбран из (С 1-С 6)алкила, (С 2-С 6)алкенила, (С 2-С 6)алкинила, (С 1 С 6)алкокси, гидрокси, гидрокси (С 1-С 6)алкила, меркапто, меркапто(С 1-С 6)алкила, (С 1-С 6)алкилтио, галогена, полностью или частично фторированного (C1-С 3)алкила, (C1-С 3)алкокси или (C1-С 3)алкилтио, нитро, нитрила (-CN), оксо (=O), фенила, фенокси, моноциклический гетероарила или гетероарилокси, содержащего 5 или 6 атомов в кольце, -COORA, -CORA, -OCORA, -SO2RA, -CONRARB, -SO2NRARB, -NRARB,OCONRARB, -NRBCORA, -NRBCOORA, -NRBSO2ORA или -NRACONRARB где RA и RB независимо обозначают водород или (С 1-С 6)алкил, или, в случае, когда RA и RB соединены с одним и тем же атомом N, RA иRB, взятые вместе с этим атомом азота, могут образовать циклическое азотосодержащее кольцо. В соединениях формулы (IC) предпочтительно, чтобы W обозначал =С- и R2 обозначал водород. В соединениях формулы (IC) Q в радикале R3 может быть водородом или возможно замещенным фенилом.-6 015198 В конкретном подклассе соединений (IC) R3 является возможно замещенными хинолин-2-илом,бензотиазол-2-илом, тиазол-2-илом, тиазол-4-илом, тиазол-5-илом, оксадиазол-3-илом, оксадиазол-5 илом, оксазол-2-илом, оксазол-4-илом, оксазол-5-илом или тиазол пиридин-2-илом. Возможными заместителями, которые могут содержаться в R3 соединения per se по изобретению включают радикалы, выбранные из метила, -ОСН 3, -CF3, -OCF3, этила, циклопропила, оксогруппы, гидроксила, F, Cl, Br, цианогруппы, ацетила, аминогруппы, метиламиногруппы, диметиламино, ацетиламино, карбаматной группы, -CONH2, нитро, -СООН и -СН 2 ОН. Соединения формулы (ID) per se, их соли, гидраты или сольваты также составляют особый аспект изобретения. где R2 обозначает водород, метил или фтор и R3 имеет значения, указанные для формулы (IC). Конкретные примеры соединений, которых касается данное изобретение, включают соединения,описанные в примерах ниже. Известные многочисленные пути подхода к синтезу соединений формулы (I), которых касается данное изобретение, но все они основаны на известных методах, известных специалисту в области органического синтеза. Так, соединения формулы (I) могут быть получены способами, известными из обычной литературы и известными специалистам. Типичными литературными источниками являются "Advanced Organic Chemistry", 4th Edition (Wiley), J. March, "Comprehensive Organic Transformation", 2nd Edition (Wiley), R.C. larock, "Handbook of Heterocyclic Chemistry", 2nd Edition (Pergamon), A.R. Katritzky), обзорные статьи, такие как опубликованные в "Synthesis", "Acc. Chem. Res.", "Chem. Rev." или первичные источники, которые можно найти при поиске online или из вторичных источников, таких как "ChemicalAbstracts" или "Beilstein". Соединения (I) могут быть получены, например, путем введения радикала (Alk1)m-(Z)p-(Alk2)n-Q в гидроксильную группу соединения формулы (II). Подробности подхода к синтезу и схемы получения промежуточных соединений (II) приведены в следующих ниже примерах. Как указано выше, соединения, которых касается данное изобретение, являются антибактериальными агентами, так как они ингибируют рост бактерий. Следовательно, они пригодны для лечения бактериальной инфекции у людей и животных, например, других млекопитающих, птиц и рыб. Соединения эти включают такие соединения, которые ингибируют рост грамположительных микроорганизмов, таких как Bacillus subtilis и Staphylococcus aureus, некоторые из соединений являются также активными в отношении некоторых грамотрицательных организмов. Следует иметь в виду, что величина конкретных доз для любого конкретного пациента будет зависеть от различных факторов, включая активность конкретного применяемого соединения, возраст, вес,общее состояние здоровья, пол, питание, время введения, путь введения, скорость выделения, комбинацию лекарств и степень серьезности болезни, лечение которой проводится. Как это требуется в фармацевтической практике, безопасные и разрешенные дозы определяют при клинических испытаниях, и дневные дозы могут меняться в широких пределах и подбираются в зависимости от индивидуальных требований в каждом конкретном случае. Однако обычно доза, подобранная для каждого метода введения соединения самого по себе, составляет от 0,0001 до 150 мг/кг веса. Такую дозу можно принимать,например, от 1 до 5 раз в день. При внутривенном введении подходящая дневная доза равна от 0,0001 до 150 мг/кг веса. Дневную дозу можно вводить одноразово или несколькими порциями по принятой схеме приема. Соединения, которых касается данное изобретение, могут быть приготовлены для любого пути введения в соответствии с их фармакокинетическими свойствами, например для введения перорально, топическим путем или в виде парентеральных растворов и суспензий. Вводимые перорально композиции могут быть в виде таблеток, капсул, порошков, гранул, леденцов, гелевых или жидких препаратов. Таблетки и капсулы для орального введения могут быть в виде стандартных доз и могут содержать обычные эксципиенты, такие как связующие агенты, например, сироп, смола акации, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например, лактозу, сахар, маисовый крахмал, фосфат кальция,сорбит или глицин; смазочный агент для таблеток, например стеарат магния, тальк, полиэтиленгликоль-7 015198 или двуокись кремния; дезинтегранты, например, картофельный крахмал, или приемлемые смачивающие агенты, такие как лаурилсульфат натрия. Таблетки могут иметь покрытие, полученное методами, хорошо известными в обычной фармацевтической практике. Оральные жидкие препараты могут быть в виде,например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть в виде сухого продукта, который затем восстанавливают при помощи воды или другого подходящего носителя перед применением. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, например, сорбит, сироп, метилцеллюлозу, сироп глюкозы, желатин, гидрированные съедобные жиры; эмульгаторы, например, лецитин, моноолеат сорбитана или смола акации; неводные носители (которые могут включать съедобные масла), например, миндальное масло, фракционированное кокосовое масло, эфиры масел, такие как эфиры глицерина, пропиленгликоль или этиловый спирт; консерванты, например, метил- или пропил-п-оксибензоат или сорбиновая кислота, и, если желательно, ароматизирующие или окрашивающие добавки. Для топического нанесения на кожу лекарство вводится в состав крема, лосьона или мази. Кремы или мази являются обычными составами, например, описанными в обычных фармацевтических учебниках, таких как British Pharmacopoeia. При топическом введении в глаз применяют лекарство в виде раствора или суспензии в подходящем стерильном водном или неводном носителе. Могут быть включены добавки, например буферные вещества, такие как метабисульфит натрия или эдетат динатрия; консерванты, включая бактерицидные и фунгицидные агенты, такие как ацетат фенилртути или нитрат фенилртути, бензалконий хлорид или хлоргексидин, и загущающие агенты, такие как гипромеллоза. Активный ингредиент может также вводиться парентерально в стерильной среде или подкожно,или внутривенно, или внутримышечно, или в подложечную ямку, или путем инфузии в виде стерильных водных или масляных суспензий для инъекции. В зависимости от используемых носителя и концентрации лекарство может быть суспендировано или растворено в носителе. Адъюванты, такие как локальный анестетик, консервант и буферные агенты, могут быть растворены в носителе. Поскольку соединения, которых касается данное изобретение, являются антибактериально активными и ингибируют рост бактерий, они также могут применяться для обработки бактериального загрязнения субстрата, такого как больничные инструменты или рабочие поверхности. Для обработки загрязненного субстрата соединения могут наноситься на участок такого загрязнения в количестве, достаточном для ингибирования роста бактерий. Следующие ниже примеры иллюстрируют синтез соединений, которых касается данное изобретение. Аналитический метод Аналитические методы применяют для характеристики соединений, к ним относятся HPLC-MS ЯМР (NMR) Спектры NMR соответствовали структурам соединений. Точки плавления измеряли на приборе Stuart Scientific SMP 10 и не корректировались. Указанные величины выхода не оптимизированы.- 11015198 Экспериментальные методики Схема 1: (a) SOCl2, толуол, обратный холодильник; (b) водный NH3. Общий метод превращения карбоновой кислоты в амид карбоновой кислоты Метод А. 3-Гидроксибензамид 3-гидроксибензойную кислоту (110,5 г, 0,8 мол, 1 экв) суспендировали в толуоле (500 мл) и медленно при комнатной температуре добавляли тионилхлорид (88,0 мл, 1,2 мол, 1,5 экв.). Раствор нагревали с обратным холодильником в течение 5 ч. Затем реакционную смесь охлаждали до комнатной температуры и концентрировали под вакуумом. Остаток растворяли в тетрагидрофуране (300 мл) и охлаждали в бане со смесью льда-метанола. По каплям медленно добавляли концентрированный водный раствор аммиака (около 300 мл) и перемешивали смесь в течение 16 ч. Реакционную смесь концентрировали под вакуумом и полученный твердый продукт суспендировали в воде и отфильтровывали. Твердый продукт промывали дополнительным количеством воды (х 3) и затем сушили под вакуумом, получая 3 гидроксибензамид в виде твердого вещества неправильного белого цвета (79,9 г, 72,8 %); т.пл. 167168 С.HPLC-MS (метод 1): m/z 136 [M - H]-, Rt = 1,21 мин. 1 Н NMR (d6 - DMSO)= 9,53 (s, Ш), 7,78 (s,1H), 7,30-7,15 (m, 4H), 6,88 (d, J = 8 Hz, 1H). Схема 2: (a) RX, K2CO3, NaI, DMF, 60C Общий способ алкилирования фенолов с применением алкилгалогенидов (Метод В) К раствору 3-гидроксибензамида (200 мг, 1,46 ммол, 1 экв) в DMF (3 мл) добавляли К 2 СО 3 (302 мг,2,19 ммол, 1,5 экв) и NaI (43,5 мг, 0,29 ммол, 0,2 экв). Суспензию перемешивали в течение 5 мин, после чего вводили н-нонилхлорид (0,32 мл, 1,61 ммол, 1,1 экв). Полученную смесь нагревали до 80 С и выдерживали при этой температуре в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры и распределяли между EtOAc и водой. Органическую фазу отделяли, промывали водой(х 2), сушили (MgSO4), фильтровали и концентрировали под вакуумом, получая бесцветный твердый продукт. В случае 3-н-нонилоксибензамида этот продукт перемешивали в течение 5 мин с МеОН (0,5 мл) (3-н-нонилоксибензамид частично растворим в МеОН) и затем отфильтровывали, получая целевое соединение в виде бесцветного твердого продукта (116 мг, 30%).HPLC-MS (метод 3): m/z 264 [М + Н]+, Rt = 1,80 мин. 1H NMR (d6 - DMSO)= 7,95 (s, 1H), 7,447,31 (m, 4 Н), 7,06 (ddd, J = 8 Hz, J = 2 Hz, J = 1 Hz, 1H), 3,99 (t, J = 6,5 Hz, 2H), 1,72 (quintet, J = 6,5 Hz,2H), 1,42 (m, 2H), 1,34-1,26 (m, 10H), 0,86 (t, J = 6,5 Hz, 3H). Примечание 1. Конечная стадия очистки зависела от природы группы R. Другие способы очистки, использовавшиеся при проведении лабораторных опытов, включали: 1. Перекристаллизацию (например, из чистого МеОН, смеси EtOAc/гексаны, CH3CN). 2. Колоночную хроматографию с нормальной фазой (силикагель). 3. Препаративную ВЭЖХ или препаративную ХЖС (TLC). Примечание 2. В случае водорастворимых целевых соединений водную фазу концентрировали под вакуумом и затем промывали МеОН. Метанольные фракции концентрировали под вакуумом и очищали сырой продукт методом препаративной HPLC.- 12015198 Примеры 2-44 (таблица А). Соединения в примерах 2-44 были получены по методу В, схема 2. Таблица названий соединений по примерам 2-44: Схема 3: (a) ROH, PPh3 - PS, DIAD, Et3N, THF, комнатная температура Общий способ алкилирования фенолов с применением спиртов по реакции Мицуноби (Mitsunobu) Метод С. К суспензии трифенилфосфина (1,4 г, 3 ммол, на основе загрузки 2,15 ммол/г [куплен у фирмы Argonaut], 1,5 экв) на полимерном носителе, набухший в THF (20 мл) при комнатной температуре добавляли диизопропилазодикарбоксилат (0,47 мл, 2,4 ммол, 1,2 экв). Смесь встряхивали в течение 5 мин, затем добавляли 3-гидроксибензамид (274 мг, 2 ммол, 1 экв), триэтиламин (0,28 мл, 2 ммол, 1 экв) и цис-5- деценол (313 мг, 2 ммол, 1 экв). Полученную суспензию встряхивали при комнатной температуре в течение 16 ч и затем фильтровали. Полученную смолу промывали THF (х 3) и затем объединенные фильтрат и промывные растворы концентрировали при пониженном давлении с получением сырого продукта в виде- 16015198 бесцветного полутвердого вещества. Его очищали методом хроматографии на колонке, элюируя смесьюEtOAc/гексана (градиент 20-40%), получали целевое соединение в виде белого твердого продукта (390 мг, 71%), т.пл. 98-100 С.(m, 2 Н), 1,79 (m, 2 Н), 1,51 (m, 2 Н), 1,34-1,28 (m, 4 Н), 0,88 (t, J = 7,0 Hz, 3 Н). Примечание 1: В некоторых случаях применяли диэтилазодикарбоксилат (0,38 мл, 2,4 ммол, 1,2 экв) вместо диизопропилазодикарбоксилата. Примечание 2: В некоторых случаях применяли трифенилфосфин без носителя. В случае фенолов,содержащих фтор, нельзя было обнаружить наличие образовавшегося продукта при применении трифенилфосфина на полимерном носителе. По этой причине реакцию проводили с трифенилфосфином. Примеры 46-61 (таблица В). Таблица названий соединений по примерам 46-61:CH3CN (100 мл). Смесь перемешивали в течение 10 мин при комнатной температуре, затем добавляли 1,6 дибромгексан (9,76 г, 40 ммол, 4 экв). Полученную смесь перемешивали при температуре 60 С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры, нерастворившиеся твердые частицы отфильтровывали и фильтрат выпаривали досуха при пониженном давлении. Остаток отбирали в EtOAc и воде. Органическую фазу отделяли и последовательно промывали раствором K2CO3, водой и рассолом. Высушивали при помощи MgSO4 и выпаривали до небольшого объема при пониженном давлении. Осажденный твердый продукт отфильтровывали и промывали смесью EtOAc/пентан с получением желательного соединения в виде белого твердого продукта (2,0 г, 67 %), т.пл. 115-117 С. HPLC - MS (метод 1): m/z 300 [М]+, 302 [М + 2 Н]+, Rt = 4,08 мин. 6-[3-Аминокарбонил)фенокси]гексил-(трифенил)фосфиния бромид Смесь 3-[(6-бромгексил)окси]бензамида (2,10 г, 7 ммол, 1 экв) и трифенилфосфина (1,93 г, 7,35 ммол, 1,05 экв) в CH3CN (30 мл) нагревали с обратным холодильником в течение 72 ч. Растворитель выпаривали при пониженном давлении и остаток растирали в порошок с сухим Et2O до его отверждения. Твердый продукт фильтровали и высушивали под вакуумом с получением целевого продукта в виде белого твердого вещества (4,0 г, 100%). HPLC-MS (метод 1): m/z 482 [М - Br]+, Rt = 3,65 мин. Пример 62. 3-[(Z)-(3-тиенил)-6-гептенил]оксибензамид(2,0 г, 3,55 ммол, 1,2 экв) в безводном толуоле (28 мл) добавляли раствор бис(триметилсилил)амида калия (0,5 М, 7,1 мл, 3,55 ммол, 1,2 экв) в толуоле медленно по каплям в течение 15 мин при температуре 0 С в атмосфере N2. Темно-оранжевый раствор перемешивали еще в течение 20 мин при температуре 0 С и охлаждали до -78 С, сразу же добавляли тиофен-3-карбоксальдегид, температуре давали подняться от -78 С до комнатной температуры. Светло-желтую смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь резко охлаждали насыщенным водным раствором NH4Cl (20 мл) и растворитель выпаривали при пониженном давлении. Остаток отбирали CH2Cl2 и водой, органическую фазу отделяли, промывали рассолом и высушивали (Na2SO4). Выпаривали продукт при пониженном давлении,- 19015198 и остаток очищали методом хроматографии на колонке с силикагелем, элюируя смесью EtOAc/гексан(градиент 10-50%), с получением целевого соединения в виде твердого продукта неправильного белого цвета (300 мг, 35%), т.пл. = 71-73 С. 1 Н NMR показал, что он состоял из смеси Z: Е (90 : 10) изомеров. К раствору 3-[(Z)-(3-тиенил)-6-гептенил]оксибензамида, полученного в примере 62 (260 мг, 0,82 ммол) в МеОН (8 мл) добавляли 10% Pd/C (30 мг). Смесь перемешивали в атмосфере Н 2 при комнатной температуре в течение 3 дн. Катализатор удаляли фильтрованием через слой целита, растворитель выпаривали при пониженном давлении до небольшого объема. Осадок отфильтровывали и промывали смесью EtO/пентан с получением целевого соединения в виде твердого продукта белого цвета (130 мг, 48%),т.пл. = 97-100 С. HPLC-MS (метод 1): т/z 318 [М + Н]+, Rt = 4,87 мин. Пример 64. 3-[(Z)-7-(5-хлор-2-фурил)-6-гептенил]оксибензамид Это соединение получали из 6-[3-(аминокарбонил)фенокси] гексил (трифенил) фосфония бромида по методу Е. Выход 72%, т.пл. 53-56 С. 1 Н NMR показал, что он состоял из смеси изомеров Z:Е (81:19).HPLC-MS (метод 1): m/z 334 [М + Н]+, Rt = 4,80 мин. Схема 5: (a) Br(CH2)nBr (n = 5,8), K2CO3, CH3CN, 60 С; (б) комплекс ацетилида лития и этилендиамина [LiCCH(H2NCH2CH2NH2)], DMSO, комн. темп. Метод F. Комплекс ацетилида лития с этилендиамином (305 мг, 3,3 ммол, 1,1 экв) помещали в трехгорлую колбу, дегазировали, промывали N2 и суспендировали в DMSO (2 мл). К перемешиваемой суспензии медленно по каплям добавляли раствор 3-[(7-бромгептил)окси]бензамида (943 мг, 3 ммол, 1 экв) в DMSO(2 мл) при комнатной температуре в атмосфере азота. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Затем смесь разбавляли 1 N раствором HCl и экстрагировали EtOAc (х 3). Соединенные органические экстракты промывали рассолом, сушили (Na2SO4) и выпаривали досуха при пониженном давлении. Сырой продукт очищали методом хроматографии на колонке с силикагелем,элюируя смесью EtOAc/гексан, 20%, с получением целевого соединения в виде твердого продукта белого цвета (100 мг, 13%), т.пл. 82-83 С. HPLC-MS (метод 1): m/z 260 [М + Н]+, Rt = 4,26 мин. Это соединение получали по методу D. Выход 32%, т.пл. = 114-116 С. HPLC-MS (метод 1): m/z 356m/z 302 [М + Н]+, Rt = 5,02 мин. Схема 6: (а) Комплекс ацетилида лития с этилендиаменом [LiCCH(H2NCH2CH2NH2)], DMSO,комн. темп.; (б) п-толуолсульфокислота, EtOH, обр. холод.; (в) 3-гидроксибензамид, PPh3-PS, DIAD,Et3N, THF, комн. темп.(Метод G). Раствор коммерчески доступного 2-[(8-бромоктил)окси]тетрагидро-2 Н-пирана (1,0 г, 3,4 ммол, 1 экв) в DMSO (5 мл) медленно по каплям при комнатной температуре в атмосфере N2 добавляли к перемешиваемой суспензии комплекса ацетилида лития с этилендиамином (350 мг, 3,8 ммол, 1,1 экв) вDMSO (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и разбавляли н-пентаном (50 мл). Органическую фазу промывали 1 N раствором HCl (220 мл) и водой (220 мл), высушивали (Na2SO4) и выпаривали досуха при пониженном давлении. Остаток (бесцветная жидкость, 570 мг, выход 70%) растворяли в 95%-ном EtOH (20 мл) вместе с п-толуолсульфокислотой (150 мг) и нагревали смесь с обратным холодильником в течение 2,5 ч. После охлаждения выпаривали при пониженном давлении растворитель. Остаток очищали на силикагеле методом хроматографии, элюируя смесью EtOAc/гексан (градиент 10-30%) с получением целевого соединения в виде бесцветного масла Получали это соединение из 3-гидроксибензамида и 10-ундецин-1-ола по методу С, схема 3. Т.пл. = 111-112 С, HPLC-MS (метод 1): m/z 274 [М + Н]+, Rt = 4,61 мин. Схема 7: (a) SOCl3, толуол, обр. холод.; (б) водный раствор NH3; (в) n-Non-Br, K2CO3, Nal, DMF,60 С; (г) 10-ундецинол, PPh3-PS, DIAD, Et3N, THF, комн.темп. Это соединение получали из коммерчески доступной 2-хлор-5-гидроксибензкарбоновой кислоты по методу А, схема 1. Выход равнялся 28%, т. пл. = 159-161 С, HPLC-MS (метод 1): m/z 170 [М - Н]-, Rt = 1,48 мин. Пример 68. 2-Хлор-5-(нонилокси)бензамид Это соединение получали из 2-хлор-5- гидроксибензамида по методу В, схема 2. Выход 80%. Это соединение получали из 2-хлор-5-гидроксибензамида по методу С, схема 3. Выход был равен 13%. HPLC-MS (метод 1): m/z 322 [М + Н]+, Rt = 4,94 мин. Схема 8: (а) BBr3, CH2Cl2, комн.темп.; (б) R1 - Br, K2CO3, Nal, DMF, 60 С; (в) R2OH, PPh3-PS, DIAD,Et3N, THF, комн.темп.(Метод Н). Раствор трибромида бора (1,0 М в CH2Cl2, 23,6 мл, 23,6 ммол, 2 экв) по каплям медленно добавляли к перемешиваемому раствору 2-фтор-5-метоксибензолкарбоксамида (2,0 г, 11,8 ммол, 1 экв) вCH2Cl2 (60 мл) при комнатной температуре в атмосфере N2. Реакционную смесь перемешивали при комнатной температуре в течение 48 ч. Растворитель удаляли при пониженном давлении, остаток растворяли в воде (120 мл) и экстрагировали EtOAc (4100 мл). Объединенные органические экстракты промывали водой (2100 мл), высушивали (Na2SO4) и фильтровали через слой силикагеля. Фильтрат выпаривали досуха при пониженном давлении с получением целевого соединения в виде твердого продукта серого цвета (1,50 г, 82%). Примеры 70-75 (таблица С). Соединения в примерах 70-72 были получены из 2-фтор-5-гидроксибензамида по методу В, схема 2,а соединения по примерам 73-75 были получены из 2-фтор-5-гидроксибензамида по методу С, схема 3. Таблица названий соединений по примерам 70-75 Это соединение получали из коммерчески доступной 6-хлор-2-фтор-3-метоксибензкарбоновой кислоты по методу А, схема 1. Выход составил 85%, т.пл. = 154-156 С, HPLC-MS (метод 1): m/z 245 [М + Н Это соединение получали из 6-хлор-2-фтор-3-метоксибензамида по методу Н. Выход равнялся 90%. Пример 76. 6-Хлор-2-фтор-3-(нонилокси)бензамид Это соединение получали из 6-хлор-2-фтор-3-гидроксибензамида по методу В, схема 2. Выход составил 73%, т.пл. = 75-77 С, HPLC-MS (метод 1): m/z 316 [М + Н]+, Rt = 5,27 мин. Схема 10: (а) BBr3, CH2Cl2, комн. тем.; (б) R-Br, K2CO3, Nal, DMF, 60 С. Это соединение получали из коммерчески доступного 2-хлор-6-фтор-3-метоксибензамида по методу Н. Выход был равен 78%. Пример 77. 2-Хлор-6-фтор-3-(гексилокси)бензамид Это соединение получали из 2-хлор-6-фтор-3-гидроксибензамида по методу В, схема 2. Выход был равен 30%, т.пл. = 66-68 С, HPLC-MS (метод 1): m/z 274 [М + Н]+, Rt = 2,78 мин. Пример 78. 2-хлор-6-фтор-3-(нонилокси)бензамид Это соединение получали из 2-хлор-6-фтор-3-гидроксибензамида по методу В, схема 2. Выход был равен 15%, т. пл. = 64-66 С, HPLC-MS (метод 1): m/z 316 [М + H]+, Rt = 5,13 мин. Схема 11: (a) SOCl2, толуол, обр. холод.; (б) водный раствор NH3; (в) BBr3, CH2Cl2, комн. темп.; (г) Это соединение получали из коммерчески доступной 2,4,6-трифтор-3-метоксибензкарбоновой кислоты по методу А, схема 1. Выход составил 85%, т.пл. = 102 С, HPLC-MS (метод 1): m/z 206 [М + Н]+,Rt = 2,40 мин. Это соединение получали из 2,4,6-трифтор-3-метоксибензамида по методу Н. Выход был равен 100%, HPLC - MS (метод 1): m/z 190 [М - Н]-, Rt = 1,07 мин. Пример 79. 2,4,6-трифтор-3-(гексилокси)бензамид Это соединение получали из 2,4,6-трифтор-3-гидроксибензамида согласно методу В, схема 2. Выход составил 54%, т.пл. = 89-90 С, HPLC - MS: m/z 276 [М + Н]+, Rt = 4,36 мин. Схема 12: (а BBr3, CH2Cl2, комн. темп.; (б) n - Hex - Br, K2CO3, Nal, DMF, 60C. Это соединение получали из коммерчески доступного 2,4-дифтор-3-метоксибензамида по методу Н. Выход был равен 98%. HPLC-MS (метод 1): m/z 172 [М -Н]-, Rt= 1,03 мин. Пример 80. 2,4-Дифтор-3-(гексилокси)бензамид Это соединение получали из 2,4-дифтор-3-гидроксибензамида по методу В, схема 2. Выход был равен 51%, т.пл. = 86-87 С. Схема 13: (a) SOCl2, толуол, обр. холод.; (б) водный раствор NH3; (в) BBr3, CH2Cl2, комн. темп.; (г) Это соединение получали из коммерчески доступной 2,6-дифтор-3-метоксибензойной кислоты по методу А, схема 1. Выход составил 84%, т.пл. = 167-169 С, HPLC-MS (метод 1): m/z 188 [М + Н]+, Rt = 2 мин. Это соединение получали из 2,6-дифтор-3-метоксибензамида по методу Н. Выход был равен 78%.HPLC - MS (метод 1): m/z 172 [М - Н]-, Rt = 1,25 мин. Примеры 81-88 (таблица D) Соединения по примерам 81-83 были получены из 2,6-дифтор-3-гидроксибензамида по методу В,схема 2. Соединения по примерам 84-88 были получены из 2,6-дифтор-3-гидроксибензамида по методу С, схема 3. Таблица названий соединений по примерам 81-88 Смесь 2,6-дифтор-3-гидроксибензамида (1,2 г, 7 ммол, 1 экв), К 2 СО 3 (2,87 г, 21 ммол, 3 экв) и метилбромацетата (69 мл, 7,35 ммол, 1,05 экв) в DMF (30 мл) перешивали при комнатной температуре в течение 18 ч. Смесь разбавляли водой и экстрагировали EtOAc (480 мл). Соединенные органические экстракты высушивали (MgSO4) и выпаривали досуха при пониженном давлении. Полученный продукт применяли на следующей стадии без очистки. HPLC-MS (метод 1): m/z 246 [М + Н]+, Rt = 2,08 мин. 2- [3-(Аминокарбонил)-2,4-дифторфенокси]уксусная кислота(1 г, 25 ммол, 3,6 экв) в воде (20 мл) и изопропиловом спирте (5 мл). Смесь перемешивали с обратным холодильником в течение 1,5 ч, разбавляли водой (40 мл) и экстрагировали CH2Cl2 (40 мл). Водную фазу подкисляли до рН 1 концентрированным раствором HCl. Осадок отфильтровывали и сушили под вакуумом, получая целевое соединение (130 мг, 8%), т.пл. = 152-153 С. HPLC - MS (метод 1): m/z 312 [М-Н + 2CH3CN]-, Rt = 0,91 мин. Пример 89. Гексил-2-[3-(аминокарбонил)-2,4-дифторфенокси]ацетат н-Бромгексан (0,077 мл, 0,55 ммол, 1,05 экв) добавляли к суспензии 2-[3-(аминокарбонил)-2,4 дифторфенокси]уксусной кислоты (120 мг, 0,52 ммол, 1 экв) и К 2 СО 3 (215 мг, 1,56 ммол, 3 экв) в DMF (3 мл) и смесь перемешивали при 70 С в течение 1,5 ч. После охлаждения до комнатной температуры смесь выливали в воду (25 мл), полученный осадок отфильтровывали и промывали водой (220 мл). После сушки технический продукт растирали в порошок, перемешивая с гексаном (10 мл), фильтровали и промывали гексаном (310 мл), получали целевое соединение в виде твердого вещества белого цвета (99 мг, 60%), т.пл. = 108 С. HPLC-MS: m/z 316 [М + Н]+, Rt = 4,09 мин. Схема 15: (а) Комплекс ацетилида лития с этилендиамином [LiCCH(H2NCH2CH2NH2)], DMSO,комн. темп.; (b) п-толуолсульфокислота, EtOH, обр.хол.; (с) ClCH2COCl, CH2Cl2, комн. темп.; (d) K2CO3,Nal, DMF, 60C.- 27015198 Это соединение получали из коммерчески доступного 2-[(8-бромгексил)окси]тетрагидро-2 Н-пирана по методу G. Общий выход составил 55%, бесцветное масло. 7-Октинил-2-хлорацетат(300 мг, 2,4 ммол, 1,2 экв) в CH2Cl2 (6 мл) при температуре -5 С. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 4 ч. Растворитель удаляли при пониженном давлении и остаток очищали методом колоночной хроматографии на двуокиси кремния, элюируя смесью EtOAc/ гексан (10%), получали целевое соединение в виде жидкости бледно-желтого цвета (450 мг, 100%). Пример 90. 7-Октинил-2-[3-(аминокарбонил)-2,4-дифторфенокси]ацетат Это соединение получали из 2,6-дифтор-3-гидроксибензамида по методу В, схема 2. Выход был равен 13%, т.пл. = 130-132 С. HPLC-MS (метод 1): m/z 340 [М + Н]+, Rt = 3,93 мин. Схема 16: (a) ZnEt2, CH2I2, толуол, комн.темп. Раствор диэтилцинка (1,1 М в толуоле, 1,84 мл, 2,02 ммол, 1 экв) добавляли к раствору соединения по примеру 52 (500 мг, 2,02 ммол, 1 экв) в сухом толуоле (1 мл) при комнатной температуре в атмосфере азота. Медленно по каплям добавляли дийодметан (0,244 мл, 3,03 ммол, 1,5 экв) и реакционную смесь перемешивали при комнатной температуре в течение 5 дн. Смесь разбавляли водой (40 мл) и экстрагировали CH2Cl2 (440 мл). Объединенные органические экстракты высушивали (MgSO4), удаляли растворители при пониженном давлении. По данным HPLC-MS сырой остаток состоял из исходного вещества(80%) и целевого продукта (20%). Повторяли реакцию еще раз, в толуоле (15 мл), используя диэтилцинк(1,1 М в толуоле, 6,1 мл, 6,6 ммол, 3,3 экв) и дийодметан (0,244 мл, 3,03 ммол, 1,5 экв). Смесь перемешивали при 50 С в течение 5 дней, разбавляли водой (80 мл) и экстрагировали CH2Cl2 (450 мл). Объединенные органические экстракты сушили (MgSO4) и удаляли растворители при пониженном давлении. Остаток растирали в порошок с пентаном (15 мл), отфильтровывали осадок, промывали пентаном и получали 196 мг белого вещества, т.пл. = 104-105 С. По данным HPLC-MS продукт состоял из исходного вещества (65%) и целевого соединения (35%), HPLC-MS (метод 1): m/z 303 [М + Н + CH3CN]+, Rt = 4,83 мин. Схема 17: (a) Br(CH2)9OH, K2CO3, Nal, DMF, 60 С; (b) толуолсульфонилхлорид, Et3N, CH2Cl2, комн. темп.; (с) NaCN, H2O/EtOH, 75 С. Это соединение получали по методу В, схема 2. Выход 75%, т.пл. = 118-120 С, HPLC-MS (метод 1): Толуолсульфонилхлорид (410 мг, 2,15 ммол, 1,5 экв) и триэтиламин (0,40 мл, 2,88 ммол, 2 экв) добавляли к раствору 3-[(9-гидроксинонил)окси]бензамида (400 мг, 1,43 ммол, 1 экв) в CH2Cl2 (4 мл), реакционную смесь перемешивали 6 дн при комнатной температуре. Добавляли насыщенный раствор NaHCO3 (40 мл), экстрагировали смесь CH2Cl2 (330 мл). Объединенные органические экстракты сушили(MgSO4) и выпаривали при пониженном давлении растворитель. Остаток очищали на двуокиси кремния в хроматографической колонке, элюируя смесью СН 3 ОН/CH2Cl2 (2%), и получали целевой продукт в виде твердого вещества белого цвета (428 мг, 69%), т.пл. = 78-80 С. HPLC-MS (метод 1): m/z 434 [М + Н]+,Rt = 4,90 мин. Пример 93. 3-[(9-Цианононил)окси]бензамид Цианид натрия (60 мг, 1,22 ммол, 1,3 экв) добавляли к раствору 9-[3(аминокарбонил)фенокси]нонил-4 метилбензсульфоната (407 мг, 0,94 ммол, 1 экв) в воде (10 мл) и 95% ном EtOH (8 мл), перемешивали смесь при 75 С в течение 2 дн. После охлаждения до комнатной температуры разбавляли смесь водой (10 мл) и экстрагировали CH2Cl2 (310 мл). Объединенные органические экстракты высушивали (MgSO4) и удаляли растворитель при пониженном давлении. Сырой остаток очищали методом хроматографии на колонке с силикагелем, элюируя смесью EtOAc/гексан (50%), получали целевое соединение в виде продукта белого цвета (57 мг, 21%). Т.пл. = 96-97 С, HPLC - MS (метод 1): m/z 289 [М + Н]+, Rt = 4,16 мин. Схема 18: (а) н- Non -Br, K2CO3) Nal, DMF, 60 С; (b) LiOH, NaOCH3, MeOH, обр.холод.
МПК / Метки
МПК: A61K 31/4245, A61K 31/4155, A61K 31/423, A61K 31/427, A61K 31/4184, A61K 31/166, A61K 31/352, A61K 31/343, A61K 31/422, A61K 31/4025, A61K 31/381, A61K 31/428, A61K 31/429, A61K 31/4192, A61P 31/04, A61K 31/341
Метки: антибактериальные, агенты
Код ссылки
<a href="https://eas.patents.su/30-15198-antibakterialnye-agenty.html" rel="bookmark" title="База патентов Евразийского Союза">Антибактериальные агенты</a>












