Замещенные производные морфолина и тиоморфолина
Номер патента: 15120
Опубликовано: 30.06.2011
Авторы: Ханжин Николай, Венсель Торнее Кристиан, Уотсон Уилльям Патрик, Роттлендер Марио, Ритзен Андреас
Формула / Реферат
1. Замещенное производное морфолина или тиоморфолина общей формулы I
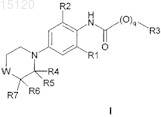
где q равно 0 или 1;
W представляет О или S;
R1 выбирают из группы, состоящей из галогена, циано, C1-6-алк(ен/ин)ила, С3-8-циклоалк(ен)ила, С3-8-циклоалк(ен)ил-С1-6-алк(ен/ин)ила, галоген-С1-6-алк(ен/ин)ила, галоген-С3-8-циклоалк(ен)ила, галоген-С3-8-циклоалк(ен)ил-С1-6-алк(ен/ин)ила, C1-6-алк(ен/ин)илокси, С3-8-циклоалк(ен)илокси и С3-8-циклоалк(ен)ил-С1-6-алк(ен/ин)илокси;
R2 выбирают из группы, состоящей из галогена, циано, C1-6-алк(ен/ин)ила, С3-8-циклоалк(ен)ила, С3-8-циклоалк(ен)ил-С1-6-алк(ен/ин)ила, галоген-С1-6-алк(ен/ин)ила, галоген-С3-8-циклоалк(ен)ила, галоген-С3-8-циклоалк(ен)ил-С1-6-алк(ен/ин)ила, C1-6-алк(ен/ин)илокси, С3-8-циклоалк(ен)илокси, С3-8-циклоалк(ен)ил-С1-6-алк(ен/ин)илокси, необязательно замещенного фенила и необязательно замещенного пиридила; где фенил и пиридил необязательно замещены одним или более заместителями, независимо представляющими галоген, C1-6-алк(ен/ин)ил, С3-8-циклоалк(ен)ил или С3-8-циклоалк(ен)ил-С1-6-алк(ен/ин)ил;
R3 выбирают из группы, состоящей из C1-10-алк(ен/ин)ила, С3-8-циклоалк(ен)ила, С3-8-циклоалк(ен)ил-С1-6-алк(ен/ин)ила, Ar-C1-6-алк(ен/ин)ила, Ar-С3-8-циклоалк(ен)ила, Ar-С3-8-циклоалк(ен)ил-С1-6-алк(ен/ин)ила и Ar;
каждый из R4, R5, R6 и R7 независимо выбирают из группы, состоящей из водорода и Ar; и
Ar представляет ароматическую систему, состоящую из 5-10 атомов углерода, где 0, 1, 2, 3 или 4 атома углерода заменены гетероатомами, независимо выбранными из N, S или О, необязательно замещенную одним или более заместителями, независимо выбранными из гидрокси, галогена, C1-6-алк(ен/ин)ила, С3-8-циклоалк(ен)ила, С3-8-циклоалк(ен)ил-С1-6-алк(ен/ин)ила, галоген-С1-6-алк(ен/ин)ила, C1-6-алк(ен/ин)илокси, С3-8-алк(ен/ин)илокси, ацила, нитро или циано, -CO-NH-C1-6-алк(ен/ин)ила, -CO-N(C1-6-алк(ен/ин)ил)2, -NH2, -NH-C1-6-алк(ен/ин)ила, -N(C1-6-алк(ен/ин)ил)2, -S-C1-6-алк(ен/ин)ила, -SO2-С1-6-алк(ен/ин)ила, -SO2N(C1-6-алк(ен/ин)ил)2 и -SO2NH-C1-6-алк(ен/ин)ила; или два соседних заместителя могут вместе с ароматической группой, к которой они присоединены, образовывать 4-8-членное кольцо, которое необязательно содержит 1, 2 или 3 гетероатома;
в виде свободного основания или его соли.
2. Соединение по п.1, где q=0.
3. Соединение по п.1, где q=1.
4. Соединение по любому из пп.1-3, где W представляет атом кислорода.
5. Соединение по любому из пп.1-3, где W представляет атом серы.
6. Соединение по любому из пп.1-5, где R1 выбирают из группы, состоящей из галогена, циано, C1-6-алк(ен/ин)ила, галоген-С1-6-алк(ен/ин)ила и C1-6-алк(ен/ин)илокси.
7. Соединение по любому из пп.1-6, где R2 выбирают из группы, состоящей из галогена, циано, С1-6-алк(ен/ин)ила, галоген-С1-6-алк(ен/ин)ила, С1-6-алк(ен/ин)илокси, необязательно замещенного фенила и необязательно замещенного пиридила.
8. Соединение по п.7, где необязательно замещенный фенил и необязательно замещенный пиридил могут быть замещены одним или более заместителями, независимо выбранными из галогена или C1-6-алк(ен/ин)ила.
9. Соединение по любому из пп.1-8, где R3 выбирают из группы, состоящей из C1-10-алк(ен/ин)ила, С3-8-циклоалк(ен)ил-C1-6-алк(ен/ин)ила, Ar-C1-6-алк(ен/ин)ила и Ar.
10. Соединение по любому из пп.1-8, где любой Ar может быть замещен одним или более заместителями, независимо выбранными из галогена, C1-6-алк(ен/ин)ила, галоген-С1-6-алк(ен/ин)ила или C1-6-алк(ен/ин)илокси.
11. Замещенное производное морфолина по п.1, где
q равно 0 или 1;
W представляет О или S;
R1 и R2 независимо выбирают из группы, состоящей из галогена, галоген-С1-6-алк(ен/ин)ила, C1-6-алк(ен/ин)ила и циано;
R3 выбирают из группы, состоящей из C1-10-алк(ен/ин)ила, С3-8-циклоалк(ен)ил-С1-6-алк(ен/ин)ила, Ar-C1-6-алк(ен/ин)ила и Ar; и
R4, R5, R6 и R7 независимо выбирают из группы, состоящей из водорода и Ar;
или его соли.
12. Соединение по любому из пп.1-11, которое выбирают из группы, включающей
N-(2-бром-4-морфолин-4-ил-6-трифторметилфенил)-2-(4-фторфенил)ацетамид;
2-циклопентил-N-(2-бром-6-трифторметил-4-морфолин-4-илфенил)ацетамид;
N-(2-бром-4-морфолин-4-ил-6-трифторметилфенил)-3-циклопентилпропионамид;
N-(2-хлор-6-циано-4-морфолин-4-илфенил)-3-циклогексилпропионамид;
2-циклопентил-N-(2,6-диметил-4-тиоморфолин-4-илфенил)ацетамид;
2-циклопентил-N-[2,6-диметил-4-(2-фенилморфолин-4-ил)фенил]ацетамид;
2-циклопентил-N-[2,6-диметил-4-(2-фенилтиоморфолин-4-ил)фенил]ацетамид;
2-циклопентил-N-[2,6-диметил-4-(3-пиридин-3-ил-тиоморфолин-4-ил)фенил]ацетамид;
2-циклопентил-N-{2,6-диметил-4-[2-(4-трифторметилфенил)тиоморфолин-4-ил]фенил}ацетамид;
N-{4-[2-(2-хлорфенил)тиоморфолин-4-ил]-2,6-диметилфенил}-2-циклопентилацетамид;
2-бицикло[2.2.1]гепт-2-ил-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид;
2-циклогексил-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид;
3-(3,4-дифторфенил)-N-(2,6-диметил-4-морфолин-4-илфенил)пропионамид;
2-циклопентил-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид;
бутиловый эфир (2,6-диметил-4-морфолин-4-илфенил)карбаминовой кислоты;
2-(4-хлорфенил)-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид;
(2,6-диметил-4-морфолин-4-илфенил)амид 2,3-дигидробензофуран-2-карбоновой кислоты;
3-циклогексил-N-(2,6-диметил-4-морфолин-4-илфенил)пропионамид;
3-циклопентил-N-(2,6-диметил-4-морфолин-4-илфенил)пропионамид;
N-(2,6-диметил-4-морфолин-4-илфенил)-2-(4-фторфенил)ацетамид;
N-(2,6-диметил-4-морфолин-4-илфенил)-2-тиофен-2-илацетамид;
N-(2,6-диметил-4-морфолин-4-илфенил)-3,3-диметилбутирамид;
(2,6-диметил-4-морфолин-4-илфенил)амид гексановой кислоты;
2-циклогептил-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид;
бензиловый эфир (2,6-диметил-4-морфолин-4-илфенил)карбаминовой кислоты;
2-хлорбензиловый эфир (2,6-диметил-4-морфолин-4-илфенил)карбаминовой кислоты;
(2,6-диметил-4-морфолин-4-илфенил)амид 3,5,5-триметилгексановой кислоты;
(2,6-диметил-4-морфолин-4-илфенил)амид октановой кислоты;
(2,6-диметил-4-морфолин-4-илфенил)амид гептановой кислоты;
N-(2,6-диметил-4-морфолин-4-илфенил)-2-фенилацетамид;
2-(3,4-дихлорфенил)-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид;
2-(4-аллилокси-3-хлорфенил)-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид;
N-(2,6-диметил-4-морфолин-4-илфенил)-2-(3-трифторметилфенил)ацетамид;
N-(2,6-диметил-4-морфолин-4-илфенил)-2-нафталин-2-илацетамид;
3-(3-хлорфенил)-N-(2,6-диметил-4-морфолин-4-илфенил)пропионамид;
N-(2,6-диметил-4-морфолин-4-илфенил)-2-(3,4-диметилфенил)ацетамид;
2-(3-бромфенил)-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид;
2-(3-хлорфенил)-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид;
N-(2,6-диметил-4-морфолин-4-илфенил)-2-п-толилацетамид;
N-(2,6-диметил-4-морфолин-4-илфенил)-2-м-толилацетамид;
2-(3,4-дифторфенил)-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид;
N-(2,6-диметил-4-морфолин-4-илфенил)-2-(3-фторфенил)ацетамид;
N-(2-бром-4-морфолин-4-ил-6-трифторметилфенил)-3-циклогексилпропионамид;
N-(2-бром-4-морфолин-4-ил-6-трифторметилфенил)-2-(3-фторфенил)ацетамид;
N-(2-бром-4-морфолин-4-ил-6-трифторметилфенил)пропионамид;
N-(2-бром-4-морфолин-4-ил-6-трифторметилфенил)бутирамид;
N-(2-хлор-4-морфолин-4-ил-6-трифторметилфенил)-2-(3-фторфенил)ацетамид;
N-(2-хлор-4-морфолин-4-ил-6-трифторметилфенил)-2-циклопентилацетамид;
2-циклопентил-N-{2,6-диметил-4-[2-(4-трифторметилфенил)морфолин-4-ил]фенил}ацетамид;
N-{4-[2-(2-хлорфенил)морфолин-4-ил]-2,6-диметилфенил}-2-циклопентилацетамид;
2-циклопентил-N-{4-[2-(4-фторфенил)морфолин-4-ил]-2,6-диметилфенил}ацетамид;
2-(2-хлорфенил)-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид;
(2,6-диметил-4-морфолин-4-илфенил)амид пентановой кислоты;
(2,6-диметил-4-морфолин-4-илфенил)амид 4-метилпентановой кислоты;
2-циклопент-2-енил-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид;
(2,6-диметил-4-морфолин-4-илфенил)амид 5-метилгексановой кислоты;
(2,6-диметил-4-морфолин-4-илфенил)амид 3-метилпентановой кислоты;
(2,6-диметил-4-морфолин-4-илфенил)амид гекс-5-еновой кислоты;
(2,6-диметил-4-морфолин-4-илфенил)амид 3-этилпентановой кислоты;
2-циклопентил-N-(4-морфолин-4-ил-2-пиридин-3-ил-6-трифторметилфенил)ацетамид;
2-циклопентил-N-(5-морфолин-4-ил-3-трифторметилбифенил-2-ил)ацетамид;
2-циклопентил-N-(4'-фтор-5-морфолин-4-ил-3-трифторметилбифенил-2-ил)ацетамид;
2-циклопентил-N-(4'-метил-5-морфолин-4-ил-3-трифторметилбифенил-2-ил)ацетамид;
2-циклопентил-N-(3'-метил-5-морфолин-4-ил-3-трифторметилбифенил-2-ил)ацетамид;
2-циклопентил-N-(3',4'-дифтор-5-морфолин-4-ил-3-трифторметилбифенил-2-ил)ацетамид;
2-(4-фторфенил)-N-(4-морфолин-4-ил-2-пиридин-3-ил-6-трифторметилфенил)ацетамид;
2-циклопентил-N-(2,6-диэтил-4-морфолин-4-илфенил)ацетамид;
2-циклопентил-N-(2,6-диизопропил-4-морфолин-4-илфенил)ацетамид;
2-циклопентил-N-(2,6-дифтор-4-морфолин-4-илфенил)ацетамид;
(2,6-дифтор-4-морфолин-4-илфенил)амид гексановой кислоты;
N-(2,6-дифтор-4-морфолин-4-илфенил)-3,3-диметилбутирамид;
N-(2,6-дифтор-4-морфолин-4-илфенил)-2-(3-фторфенил)ацетамид;
2-циклопент-2-енил-N-(2,6-дифтор-4-морфолин-4-илфенил)ацетамид;
2-бицикло[2.2.1]гепт-2-ил-N-(2,6-дифтор-4-морфолин-4-илфенил)ацетамид;
2-бицикло[2.2.1]гепт-2-ил-N-(2-метил-4-морфолин-4-ил-6-трифторметилфенил)ацетамид;
(2-метил-4-морфолин-4-ил-6-трифторметилфенил)амид 5-метилпентановой кислоты;
(2-метил-4-морфолин-4-ил-6-трифторметилфенил)амид 5-метилгексановой кислоты;
2-циклопент-2-енил-N-(2-метил-4-морфолин-4-ил-6-трифторметилфенил)ацетамид;
2-циклопентил-N-(2-метил-4-морфолин-4-ил-6-трифторметилфенил)ацетамид;
(2-метил-4-морфолин-4-ил-6-трифторметилфенил)амид гексановой кислоты;
3,3-диметил-N-(2-метил-4-морфолин-4-ил-6-трифторметилфенил)бутирамид;
2-(3,4-дифторфенил)-N-(2-метил-4-морфолин-4-ил-6-трифторметилфенил)ацетамид;
(2-метокси-6-метил-4-морфолин-4-илфенил)амид гексановой кислоты;
2-циклопентил-N-(2-метокси-6-метил-4-морфолин-4-илфенил)ацетамид;
N-(2-метокси-6-метил-4-морфолин-4-илфенил)-3,3-диметилбутирамид;
2-(3,4-дифторфенил)-N-(2-метокси-6-метил-4-морфолин-4-илфенил)ацетамид;
2-циклопент-2-енил-N-(2-метокси-6-метил-4-морфолин-4-илфенил)ацетамид;
2-(3-фторфенил)-N-(2-метокси-6-метил-4-морфолин-4-илфенил)ацетамид;
2-бицикло[2.2.1]гепт-2-ил-N-(2-метокси-6-метил-4-морфолин-4-илфенил)ацетамид;
(2-метокси-6-метил-4-морфолин-4-илфенил)амид 4-метилпентановой кислоты;
(2-метокси-6-метил-4-морфолин-4-илфенил)амид 5-метилгексановой кислоты;
N-(2-хлор-6-метил-4-морфолин-4-илфенил)-2-(3-фторфенил)ацетамид и
N-(2-хлор-6-метил-4-морфолин-4-илфенил)-2-циклопентилацетамид.
13. Фармацевтическая композиция, включающая один или более фармацевтически приемлемых носителей или разбавителей и одно или более соединений по любому из пп.1-12.
14. Применение фармацевтической композиции по п.13 для усиления потока ионов в калиевых каналах у млекопитающего, такого как человек.
15. Применение по п.14 для лечения расстройства или заболевания, восприимчивого к усиленному потоку ионов в калиевых каналах, которое предпочтительно является расстройством или заболеванием центральной нервной системы.
16. Применение по п.15, где подлежащее лечению расстройство или заболевание выбирают из группы, состоящей из припадков, тревожных расстройств, невропатической боли и мигреневой боли и нейродегенеративных расстройств.
17. Применение по п.16, где приступы выбирают из группы, состоящей из острых припадков, конвульсий, эпилептического статуса, эпилепсий, таких как эпилептические синдромы и эпилептические припадки.
18. Применение по п.16, где тревожные расстройства выбирают из группы, состоящей из тревоги и расстройств и заболеваний, связанных с приступами паники, агорафобии, панического расстройства с агорафобией, панического расстройства без агорафобии, агорафобии без истории панического расстройства, специфической фобии, социальной фобии и других специфических фобий, обсессивно-компульсивных расстройств, посттравматических стрессов, острых стрессовых расстройств, генерализованных тревожных расстройств, тревожных расстройств, связанных с общим состоянием здоровья, тревожных расстройств, вызываемых веществами, тревожных расстройств, связанных с разлукой, регулируемых расстройств, боязни деятельности, гипохондриальных расстройств, тревожных расстройств, связанных с общим состоянием здоровья, и тревожных расстройств, вызываемых веществами, и тревожных расстройств, которые конкретно не определены.
19. Применение по п.16, где расстройства невропатической боли и расстройства мигреневой боли выбирают из группы, состоящей из аллодинии, гипералгезической боли, фантомной боли, невропатической боли, связанной с диабетической невропатией, невропатической боли, связанной с тригеминальной невралгией, и невропатической боли, связанной с мигренью.
20. Применение по п.16, где нейродегенеративные расстройства выбирают из группы, состоящей из болезни Альцгеймера, хореи Хантингтона, рассеянного склероза, амиотрофического латерального склероза, болезни Крейтцфельдта-Якоба, болезни Паркинсона, энцефалопатии, вызванной СПИДом или инфицированием вирусами коревой краснухи, вирусами герпеса, borrelia или неизвестными патогенами, вызванных травмой нейродегенераций, состояний нейронального гипервозбуждения, такого как при синдроме отмены лекарств или интоксикация, и нейродегенеративных заболеваний периферической нервной системы, таких как полиневропатии и полиневриты.
Текст
ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ МОРФОЛИНА И ТИОМОРФОЛИНА Настоящее изобретение относится к производным морфолина и тиоморфолина общей формулы(I) или к их фармацевтически приемлемым солям и их применению 015120 Область техники Настоящее изобретение относится к новым замещенным производным морфолина и тиоморфолина,которые являются открывателями каналов ионов калия семейства KCNQ. Указанные соединения можно использовать для лечения расстройств и заболеваний, которые реагируют на открытие каналов ионов калия семейства KCNQ, причем одним из таких заболеваний является эпилепсия. Уровень техники Ионные каналы являются клеточными белками, которые регулируют поток ионов, включая ионы калия, кальция, хлора и натрия внутрь клетки и отток этих ионов из нее. Такие каналы присутствуют во всех клетках животных и человека и участвуют в различных процессах, включая нейрональную передачу, мышечные сокращения и клеточную секрецию. У человека имеется более 70 генов, которые кодируют подтипы калиевых каналов (Jentsch NatureReviews Neuroscience, 2000, 1, 21-30), причем они отличаются большим разнообразием в отношении как их строения, так и функций. Нейрональные калиевые каналы, которые находятся в мозге, ответственны,главным образом, за поддержание отрицательного мембранного потенциала покоя, а также контролируют реполяризацию после потенциала действия. Одной из субпопуляцией генов калиевых каналов является семейство KCNQ. Мутации в четырех из пяти KCNQ генов, как было показано, лежат в основе заболеваний, включая сердечную аритмию, глухоту и эпилепсию (Jentsch Nature Reviews Neuroscience, 2000, 1, 21-30). Считают, что KCNQ 4 ген кодирует молекулярную корреляцию калиевых каналов, находящихся во внешних клетках волосков улитки уха и в клетках волосков вестибулярного аппарата типа I, причем его мутации могут привести к форме наследственной глухоты.KCNQ 1 (KvLQT1) комбинирован с продуктом KCNE1 (минимальный белок K(+)-каналов) гена в сердце для создания в сердце K(+)-тока, подобного замедленному выпрямителю. Мутации в этом канале могут вызвать одну из форм наследственного синдрома длинного QT типа 1 (LQT1), также они связаны с формой глухоты (Robbins Pharmacol. Ther, 2001, 90, 1-19). Гены KCNQ 2 и KCNQ 3 были открыты в 1988 г. и, по-видимому, мутируют в наследственную форму эпилепсии, известную как легкая форма наследственных судорог новорожденных (Rogawski Trends inNeurosciences, 2000, 23, 393-398). Белки, кодируемые KCNQ 2 и KCNQ 3 генами, локализованы в пирамидальных нейронах коры головного мозга и гиппокампа человека в участках мозга, связанных с возникновением и распространением припадка (Cooper et al. Proceedings National Academy of Science USA,2000, 97, 4914-4919).KCNQ 2 и KCNQ 3 представляют собой две субъединицы калиевых каналов, которые формируют"М-токи" при экспрессии in vitro. M-ток представляет собой неактивирующий калиевый ток, обнаруженный во многих типах нейрональных клеток. В каждом типе клеток он доминирует в регулировании мембранной возбудимости, так как является единственным постоянным током в интервале инициирования потенциала действия (Marrion Annual Review Physiology, 1997, 59, 483-504). Модуляция М-тока оказывает сильное воздействие на нейрональную возбудимость, например активация тока снижает нейрональную возбудимость. Открыватели указанных KCNQ каналов или активаторы М-тока снижают избыточную нейрональную активность и могут быть поэтому использованы для лечения припадков и других заболеваний и расстройств, характеризующихся избыточной нейрональной активностью, такой как нейрональная гипервозбудимость, включая конвульсивные расстройства, эпилепсию и невропатическую боль. Ретигабин (D-23129; этиловый эфир N-(2-амино-4-(4-фторбензиламино)фенил)карбаминовой кислоты) и его аналоги раскрыты в ЕР 554543. Ретигабин представляет собой противосудорожное соединение с широким спектром действия и эффективными противосудорожными характеристиками как in vitro,так и in vivo. Он активен после перорального и внутрибрюшинного введения крысам и мышам в ряде противосудорожных тестов, включая электрически индуцируемые припадки, припадки, индуцируемые химическими агентами - пентилентетразолом, пикротоксином и N-метил-D-аспартатом (NMDA) и в генетической модели на животных, DBA/2 мышах (Rostock et al. Epilepsy Research, 1996, 23, 211-223). Кроме того, ретигабин является активным в модели возбуждения миндалины мозжечка сложных частичных припадков, что указывает далее на то, что указанное соединение потенциально пригодно для противосудорожной терапии. В клинических испытаниях ретигабин в последнее время продемонстрировал эффективность в снижении частоты припадков у пациентов с эпилепсией (Bialer et al. Epilepsy Research, 2002,51, 31-71). Было показано, что ретигабин активирует K(+)-ток в нейрональных клетках и что фармакологические характеристики индуцированного таким образом тока демонстрируют соответствие с опубликованными фармакологическими данными для М-канала, которые недавно были скоррелированы с KCNQ 2/3K(+)-каналом гетеромультимера. Это дает возможность предположить, что активация KCNQ 2/3 каналов может быть ответственна за некоторую противосудорожную активность указанного агента (Wickenden etal. Molecular Pharmacology, 2000, 58, 591-600) и что другие агенты, действующие в соответствии с таким же механизмом, могут найти аналогичное применение.(Wickenden et al. Society for Neuroscience Abstracts, 2002, 454.7), и была высказана гипотеза, что модуляторы калиевых каналов активны как при невропатической боли, так и при эпилепсии (Schroder et al.Neuropharmacology, 2001, 40, 888-898). Было также показано, что ретигабин оказывает благоприятное воздействие при невропатической боли в моделях на животных (Blackburn-Munro and Jensen European Journal of Pharmacology, 2003, 460,109-116), и поэтому предполагается, что открыватели KCNQ каналов могут найти применение при лечении болевых расстройств, включая невропатическую боль. Сообщается, что локализация мРНК KCNQ каналов в мозге и других отделах центральной нервной системы связана с болью (Goldstein et al. Society for Neuroscience Abstracts, 2003, 53.8). В дополнение к роли в невропатической боли экспрессия мРНК для KCNQ 2-5 в тригеминальном и дорсальном корешковых нервных узлах и в тригеминальном хвостатом ядре дает возможность предположить, что открыватели указанных каналов могут также влиять на сенсорный процессинг мигреневой боли (Goldstein et al. Society for Neuroscience Abstracts, 2003, 53.8). Недавние сообщения демонстрируют, что мРНК для KCNQ 3 и 5, в дополнении к KCNQ 2, экспрессируются в астроцитах и глиальных клетках. Таким образом, каналы KCNQ 2, 3 и 5 могут помочь модулировать синаптическую активность в ЦНС и внести вклад в нейрозащитные функции открывателейKCNQ каналов (Noda et al., Society for Neuroscience Abstracts, 2003, 53.9). Ретигабин и другие KCNQ модуляторы могут таким образом демонстрировать защиту против нейродегенеративных аспектов эпилепсии, так как было показано, что ретигабин предотвращает лимбическую нейродегенерацию и экспрессию маркеров апоптоза после индуцированного каиновой кислотой эпилептического статуса у крыс (Ebert et al. Epilepsia, 2002, 43 Suppl 5, 86-95). Это может оказаться важным для профилактики прогрессирующей эпилепсии у пациентов, т.е. оказаться антиэпилептогенным. Было также показано, что ретигабин задерживает развитие гиппокампального возбуждения у крыс, в другой модели развития эпилепсии (Tober et al. European Journal of Pharmacology, 1996, 303, 163-169). Таким образом, предполагается, что указанные свойства ретигабина и других модуляторов KCNQ могут предотвратить нейрональные повреждения, вызываемые избыточной нейрональной активацией и такие соединения могут быть использованы для лечения нейродегенеративных заболеваний и могут модифицировать заболевания (или быть антиэпилептогенными) у пациентов, страдающих эпилепсией. Принимая во внимание что противосудорожные соединения, такие как бензодиазепины и хлорметиазол, используют в клиниках для лечения синдрома прекращения употребления этанола, и что другие противосудорожные соединения, например габапентин, оказываются чрезвычайно эффективными при указанном синдроме в моделях на животных (Watson et al. Neuropharmacology, 1997, 36, 1369-1375), авторы ожидают, что другие противосудорожные соединения, такие как открыватели KCNQ, окажутся эффективными в указанных условиях. мРНК для KCNQ 2 и 3 подгрупп обнаружены в участках мозга, связанных с тревогой и эмоциональным поведением, таким как биполярное расстройство, например, в гиппокампе и мозжечковой миндалине (Saganich et al. Journal of Neuroscience, 2001, 21, 4609-4624), и сообщается, что ретигабин активен в некоторых моделях на животных с похожим на тревогу поведением (Hartz et al. Journal of Psychopharmacology, 2003, 17 suppl. 3, A28, B16), и другие используемые в клиниках противосудорожные соединения используют для лечения биполярного психоза. Итак, открыватели KCNQ могут быть полезны для лечения тревожных расстройств и биполярного расстройства.WO 200196540 раскрывает использование модуляторов М-тока, возникающего в результате экспрессии KCNQ 2 и KCNQ 3 генов при бессоннице, тогда как в WO 2001092526 сообщается, что модуляторы KCNQ 5 могут быть использованы для лечения нарушений сна.WO 01/022953 раскрывает использование ретигабина для профилактики и лечения невропатической боли, такой как аллодиния, гипералгезическая боль, фантомная боль, невропатическая боль, связанная с диабетической невропатией, и невропатическая боль, связанная с мигренью.WO 02/049628 раскрывает использование ретигабина для лечения тревожных расстройств, таких как беспокойство, генерализованное тревожное расстройство, приступов паники, обсессивнокомпульсивного расстройства, социальной фобии, боязни деятельности, посттравматического стресса,реакции на сильный стресс, регулируемых расстройств, гипохондриальных расстройств, тревожного расстройства, связанного с разлукой, агорафобии и специфических фобий. В заявке WO 97/15300 раскрыто использование ретигабина для лечения нейродегенеративных расстройств, таких как болезнь Альцгеймера; хорея Хантингтона; таких склерозов, как рассеянный склероз и амиотрофический латеральный склероз; болезни Крейтцфельдта-Якоба; болезни Паркинсона; вызванной СПИДом энцефалопатии и других, связанных с инфекцией энцефалопатий, вызываемых вирусами коревой краснухи, вирусами герпеса, borrelia и неизвестными патогенами, вызываемых травмами нейродегенераций, состояния нейронального гипервозбуждения, такие как при синдроме отмены лекарств или интоксикация, и нейродегенеративные нарушения периферической нервной системы, такие как полиневропатии и полиневриты.-2 015120 Поэтому возникает существенная необходимость в новых соединениях, которые являются эффективными открывателями калиевых каналов семейства KCNQ. Необходимы также новые соединения с улучшенными характеристиками по сравнению с характеристиками известных соединений, которые являются открывателями калиевых каналов семейства KCNQ,такие как ретигабин. Желательно улучшение одного или более из следующих параметров: времени полураспада, клиренса, селективности, взаимодействия с другими лекарствами, биодоступности, эффективности, формулируемости, химической стабильности, метаболической стабильности, мембранной проницаемости, растворимости и терапевтического индекса. Улучшение указанных параметров может привести к таким усовершенствованиям, как упрощенный дозовый режим за счет уменьшения необходимого количества доз в день; простота введения пациентам при приеме многих лекарств; уменьшение побочных эффектов; повышение терапевтического индекса; улучшение переносимости или повышение совместимости. Сущность изобретения Одной из целей настоящего изобретения является создание новых соединений, которые являются эффективными открывателями калиевых каналов семейства KCNQ. Соединениями настоящего изобретения являются замещенные производные морфолина и тиоморфолина общей формулы I или их соли где q, W, R1, R2, R3, R4, R5, R6 и R7 имеют указанные далее значения. В настоящем изобретении предложено соединение формулы I для применения в качестве лекарственного средства. Настоящее изобретение далее относится к фармацевтической композиции, включающей соединение формулы I и его применению. В настоящем изобретении предложена фармацевтическая композиция, включающая соединение формулы I и фармацевтически приемлемый носитель или разбавитель. В настоящем изобретении предложено применение соединения формулы I для получения лекарственного средства для лечения припадков, тревожных расстройств, невропатической боли и мигреневой боли или нейродегенеративных расстройств. Настоящее изобретение, кроме того, относится к применению соединения формулы I в способе лечения припадков, тревожных расстройств, невропатической боли и мигреневой боли или нейродегенеративных расстройств. Подробное описание настоящего изобретения Настоящее изобретение относится к замещенным производным морфолина и тиоморфолина, которые являются эффективными открывателями KCNQ калиевых каналов. Соответственно, настоящее изобретение относится к замещенным производным морфолина и тиоморфолина общей формулы IR2 выбирают из группы, состоящей из галогена, циано, C1-6-алк(ен/ин)ила, С 3-8-циклоалк(ен)ила,С 3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)ила,галоген-С 1-6-алк(ен/ин)ила,галоген-С 3-8-циклоалк(ен)ила,галоген-С 3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)ила,C1-6-алк(ен/ин)илокси,С 3-8-циклоалк(ен)илокси,-3 015120 С 3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)илокси, необязательно замещенного фенила и необязательно замещенного пиридила; где фенил и пиридил необязательно замещены одним или более заместителями, независимо представляющими галоген, C1-6-алк(ен/ин)ил, С 3-8-циклоалк(ен)ил или С 3-8-циклоалк(ен)ил-С 1-6 алк(ен/ин)ил;R3 выбирают из группы, состоящей из C1-10-алк(ен/ин)ила, С 3-8-диклоалк(ен)ила,С 3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)ила, Ar-C1-6-алк(ен/ин)ила, Ar-С 3-8-циклоалк(ен)ила, Ar-С 3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)ила и Ar; и каждый из R4, R5, R6 и R7 независимо выбирают из группы, состоящей из водорода и Ar; в виде свободного основания или его соли. В одном из вариантов соединения формулы I q=0; в другом варианте соединения формулы I q=1. В следующем варианте соединения формулы I W представляет атом кислорода; в другом вариантеW представляет атом серы. В следующем варианте соединения формулыR1 выбирают из группы,состоящей из С 3-8-циклоалк(ен)ила, С 3-8-циклоалк(ен)ил-C1-6-алк(ен/ин)ила, галоген-С 3-8-циклоалк(ен)ила, галоген-С 3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)ила, С 3-8-циклоалк(ен)илокси и С 3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)илокси. В другом варианте R1 выбирают из группы, состоящей из галогена, галоген-С 1-6-алк(ен/ин)ила, С 1-6 алк(ен/ин)ила и циано. Обычно R1 выбирают из группы, состоящей из галогена, циано, С 1-6-алк(ен/ин)ила, галоген-С 1-6 алк(ен/ин)ила и C1-6-алк(ен/ин)илокси. Для дальнейшей иллюстрации изобретения (но без ограничений настоящего изобретения) одним из вариантов R1 является галоген; другим вариантом R1 является циано; другим вариантом R1 является C1-6-алк(ен/ин)ил; другим вариантом R1 является галоген-C1-6-алк(ен/ин)ил; другим вариантом R1 является C1-6-алк(ен/ин)илокси. В следующем варианте соединения формулы I R2 выбирают из группы, состоящей из С 3-8-циклоалк(ен)ила, С 3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)ила, галоген-С 3-8-циклоалк(ен)ила, галоген-С 3-8 циклоалк(ен)ил-С 1-6-алк(ен/ин)ила, С 3-8-циклоалк(ен)илокси и С 3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)илокси; в другом варианте R2 выбирают из группы, состоящей из галогена, галоген-С 1-6-алк(ен/ин)ила,C1-6-алк(ен/ин)ила и циано. Обычно R2 выбирают из группы, состоящей из галогена, циано, C1-6-алк(ен/ин)ила, галоген-С 1-6 алк(ен/ин)ила, С 1-6-алк(ен/ин)илокси, необязательно замещенного фенила и необязательно замещенного пиридила. Для дальнейшей иллюстрации (но без ограничений настоящего изобретения) одним из вариантов R2 является галоген; другим вариантом R2 является циано; другим вариантом R2 является C1-6-алк(ен/ин)ил; другим вариантом R2 является галоген-С 1-6-алк(ен/ин)ил; другим вариантом R2 является C1-6-алк(ен/ин)илокси; другим вариантом R2 является необязательно замещенный фенил; другим вариантом R2 является необязательно замещенный пиридил. В следующем варианте R2 необязательно замещенный фенил и необязательно замещенный пиридил могут быть замещены одним или более заместителями, которые независимо выбирают из группы,состоящей из галогена или С 1-6-алк(ен/ин)ила. В другом варианте R2 фенил и пиридил не замещены. В еще одном варианте R2 необязательно замещенный фенил и необязательно замещенный пиридил замещены одним заместителем. В еще одном варианте R2 необязательно замещенный фенил и необязательно замещенный пиридил замещены двумя заместителями. В еще одном варианте R2 необязательно замещенный фенил и необязательно замещенный пиридил замещены тремя заместителями. В следующем варианте соединения формулы I R3 выбирают из группы, состоящей из С 3-8-циклоалк(ен)ила, Ar-C3-8-циклоалк(ен)ила и Ar-С 3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)ила. Обычно R3 выбирают из группы, состоящей из C1-10-алк(ен/ин)ила, С 3-8-циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, Ar-C1-6-алк(ен/ин)ила и Ar. Для дальнейшей иллюстрации (но без ограничений настоящего изобретения) одним из вариантов R3 является C1-10-алк(ен/ин)ил; другим вариантом R3 является С 3-8-циклоалк(ен)ил-C1-6-алк(ен/ин)ил; другим вариантом R3 является Ar-C1-6-алк(ен/ин)ил; другим вариантом R3 является Ar.-4 015120 В следующем варианте соединения формулы I Ar выбирают из группы, состоящей из необязательно замещенного фурана, необязательно замещенного тиазола, необязательно замещенного хинолина, необязательно замещенного индола, необязательно замещенного пиримидина, необязательно замещенного пиррола и необязательно замещенного оксазола. В другом варианте Ar выбирают из группы, состоящей из необязательно замещенного фенила, необязательно замещенного тиофена и необязательно замещенного нафтила. В другом варианте Ar выбирают из группы, состоящей из необязательно замещенного фенила, необязательно замещенного тиофена, необязательно замещенного нафтила и необязательно замещенного 2,3-дигидробензофурана. В другом варианте Ar выбирают из группы, состоящей из необязательно замещенного фенила и необязательно замещенного пиридина. В одном из вариантов настоящего изобретения Ar представляет необязательно замещенный фенил,необязательно замещенный нафтил, необязательно замещенный тиофен или необязательно замещенный 2,3-дигидробензофуран. Обычно Ar выбирают из группы, состоящей из необязательно замещенного фенила, необязательно замещенного нафтила, необязательно замещенного пиридина, необязательно замещенного 2,3-дигидробензофурана и необязательно замещенного тиофена. Для дальнейшей иллюстрации (но без ограничений настоящего изобретения) одним из вариантов Ar является необязательно замещенный фенил; другим вариантом Ar является необязательно замещенный нафтил; другим вариантом Ar является необязательно замещенный пиридин; другим вариантом Ar является необязательно замещенный 2,3-дигидробензофуран; другим вариантом Ar является необязательно замещенный тиофен. В следующем варианте соединения формулы I Ar относится к необязательно замещенным ароматическим системам, состоящим из 5-10 атомов углерода. Обычно такие необязательно замещенные ароматические системы, состоящие из 5-10 атомов углерода, выбирают из необязательно замещенного фенила и необязательно замещенного нафтила. В следующем варианте соединения формулы I Ar относится к необязательно замещенным ароматическим системам, состоящим из 5-10 атомов углерода, где 1, 2, 3 или 4 атома углерода заменены гетероатомами, независимо выбранными из N, S или О. В следующем варианте соединения формулы I такую необязательно замещенную ароматическую систему, состоящую из 5-10 атомов углерода, где 1, 2, 3 или 4 атома углерода заменены гетероатомами,выбирают из группы, состоящей из необязательно замещенного пиридина, необязательно замещенного тиофена, необязательно замещенного фурана, необязательно замещенного тиазола, необязательно замещенного хинолина, необязательно замещенного индола, необязательно замещенного 2,3-дигидробензофурана, необязательно замещенного пиримидина, необязательно замещенного пиррола и необязательно замещенного оксазола. Обычно такую необязательно замещенную ароматическую систему, состоящую из 5-10 атомов углерода, где 1, 2, 3 или 4 атома углерода заменены гетероатомами, выбирают из группы, состоящей из необязательно замещенного пиридина, необязательно замещенного 2,3-дигидробензофурана и необязательно замещенного тиофена. В следующем варианте соединения формулы IAr необязательно замещен одним или более заместителями, независимо выбранными из гидрокси, ацила, нитро или циано, -CO-NH-C1-6-алк(ен/ин)ила, -CO-N(С 1-6-алк(ен/ин)ил)2, -NH2,-NH-C1-6-алк(ен/ин)ила,-N(C1-6-алк(ен/ин)ил)2,-S-C1-6-алк(ен/ин)ила,-SO2-C1-6-алк(ен/ин)ила,-SO2N(C1-6-алк(ен/ин)ил)2 и -SO2NH-С 1-6-алк(ен/ин)ила, или два соседних заместителя могут вместе с ароматической группой, к которой они присоединены, образовать 4-8-членное кольцо, которое необязательно содержит 1, 2 или 3 гетероатома; в другом варианте Ar необязательно замещен одним или более заместителями, независимо выбранными из галогена, C1-6-алк(ен/ин)ила, С 3-8-циклоалк(ен)ила, С 3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)ила, галоген-С 1-6-алк(ен/ин)ила, C1-6-алк(ен/ин)илокси или С 3-8-алк(ен/ин)илокси; в другом варианте Ar необязательно замещен одним или более заместителями, независимо выбранными из галогена или галоген-C1-6-алк(ен/ин)ила. В следующем варианте настоящего изобретения Ar замещен одним или более заместителями, независимо выбранными из галогена, С 1-6-алк(ен/ин)ила, галоген-С 1-6-алк(ен/ин)ила, С 1-6-алк(ен/ин)илокси. Для дальнейшей иллюстрации настоящего изобретения (без ограничений) можно указать, что в одном из вариантов Ar замещен галогеном; в другом варианте Ar замещен C1-6-алк(ен/ин)илом; в другом варианте Ar замещен галоген-С 1-6-алк(ен/ин)илом; в другом варианте Ar замещен С 1-6-алк(ен/ин)илокси; в другом варианте Ar является незамещенным; в другом варианте Ar замещен 1 заместителем; в другом варианте Ar замещен 2 заместителями;-5 015120 в другом варианте Ar замещен 3 заместителями. Один из вариантов относится к соединениям общей формулы I, где по меньшей мере один из R4 иR5 не представляет Ar. Другой вариант относится к соединениям общей формулы I, где по меньшей мере один из R6 и R7 не представляет Ar. Еще один вариант относится к соединениям общей формулы I, где по меньшей мере три из R4, R5,R6 и R7 не представляют Ar. Еще один вариант относится к соединениям общей формулы I, где не больше чем один из R3, R4,R5, R6 и R7 включает Ar. Еще один вариант относится к соединениям общей формулы I, где не более чем два из R3, R4, R5,R6 и R7 включают Ar. Еще один вариант относится к соединениям общей формулы I, где не более чем три из R3, R4, R5,R6 и R7 включают Ar. Еще один вариант относится к соединениям общей формулы I, где R3 не включает Ar. Еще один вариант относится к соединениям общей формулы I, где R4 не включает Ar. Еще один вариант относится к соединениям общей формулы I, где R5 не включает Ar. Еще один вариант относится к соединениям общей формулы I, где R6 не включает Ar. Еще один вариант относится к соединениям общей формулы I, где R7 не включает Ar. Один из вариантов относится к соединениям общей формулы I, где стереоконфигурация атома углерода, к которому присоединены R4 и R5, является S-конфигурацией. Другой вариант относится к соединениям общей формулы I, где стереоконфигурация атома углерода, к которому присоединены R4 и R5, является R-конфигурацией. Еще один вариант относится к соединениям общей формулы I, где стереоконфигурация атома углерода, к которому присоединены R6 и R7, является S-конфигурацией. Еще один вариант относится к соединениям общей формулы I, где стереоконфигурация атома углерода, к которому присоединены R6 и R7, является R-конфигурацией. Еще один вариант относится к соединениям общей формулы I, где стереоконфигурация атома углерода, к которому присоединены R4 и R5, идентична стереоконфигурации атома углерода, к которому присоединены R6 и R7. Еще один вариант относится к соединениям общей формулы I, где стереоконфигурация атома углерода, к которому присоединены R4 и R5, отличается от стереоконфигурации атома углерода, к которому присоединены R6 и R7. Соединения, представленные в следующем списке, иллюстрируют настоящее изобретение, причем этот список никоим образом не следует рассматривать как ограничительный:N-(2-хлор-6-метил-4-морфолин-4-илфенил)-2-циклопентилацетамид в виде свободных оснований или их солей. Каждое из этих соединений рассматривается как конкретный вариант и может быть содержанием отдельных пунктов формулы изобретения. Настоящее изобретение включает также соли соединений настоящего изобретения, обычно фармацевтически приемлемые соли. Соли настоящего изобретения включают соли присоединения кислот, соли металлов, соли аммония и соли алкилированного аммония. Соли настоящего изобретения являются предпочтительно солями присоединения кислот. Соли присоединения кислот настоящего изобретения предпочтительно являются фармацевтически приемлемыми солями соединений настоящего изобретения, образованными с нетоксичными кислотами. Соли присоединения кислот включают соли как неорганических, так и органических кислот. Примеры подходящих неорганических кислот включают хлористо-водородную, бромисто-водородную, йодисто-водородную,фосфорную, серную, сульфаминовую, азотную кислоты и т.п. Примеры подходящих органических кислот включают муравьиную, уксусную, трихлоруксусную, трифторуксусную, пропионовую, бензойную,коричную, лимонную, фумаровую, гликолевую, итаконовую, молочную, метансульфоновую, малеиновую, яблочную, малоновую, миндальную, щавелевую, пикриновую, пировиноградную, салициловую,янтарную, метансульфоновую, этансульфоновую, виннокаменную, аскорбиновую, памовую,бисметиленсалициловую, этандисульфоновую, глюконовую, цитраконовую, аспарагиновую, стеариновую, пальмитиновую, EDTA, гликолевую, п-аминобензойную, глутаминовую, бензолсульфоновую,п-толуолсульфоновую кислоты, теофиллинуксусные кислоты, а также 8-галогентеофиллины, например 8-бромтеофиллин и т.п. Дальнейшие примеры фармацевтически приемлемых неорганических или органических солей присоединения кислот включают фармацевтически приемлемые соли, перечисленные вJ. Pharm. Sci. 1977, 66, 2, включенном в данное описание для ссылки. Гидраты, которые способны образовывать соединения настоящего изобретения, также рассматриваются как соли присоединения кислот. Примеры солей металлов включают соли лития, натрия, калия, магния и т.п. Примеры солей аммония и алкилированного аммония включают соли аммония, метил-, диметил-,триметил-, этил-, гидроксиэтил-, диэтил-, н-бутил-, втор-бутил-, трет-бутил-, тетраметиламмония и т.п. Далее, соединения настоящего изобретения могут существовать в несольватированной форме или в форме сольватов с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п. Обычно для целей настоящего изобретения сольватированные формы рассматривают как эквиваленты несольватированных форм. Соединения настоящего изобретения могут содержать один или более из асимметричных центров и подразумевается, что любые оптические изомеры (т.е. энантиомеры или диастереомеры), как выделенные, чистые или частично очищенные оптические изомеры и любые их смеси, включая рацемические смеси, т.е. смеси стереоизомеров, включены в объем настоящего изобретения. Рацемические формы можно разделить на оптические антиподы известными способами, например используя разделение их диастереомерных солей с помощью оптически активных кислот и выделяя оптически активные аминосоединения путем обработки основанием. Другой способ разделения рацематов на оптические антиподы основан на использовании оптически активных матриц. Рацемические соединения настоящего изобретения можно также разделить на их оптические антиподы, например, фракционной кристаллизацией. Соединения настоящего изобретения можно также разделить, используя образование диастереомерных производных. Можно использовать дополнительные способы разделения оптических изомеров, известные специалистам в данной области. Такие способы включают способы, обсуждающиеся J. Jaques, A. Collet and S. Wilen в "Enantiomers, Racemates, and Resolutions", John Wiley и Sons,New York (1981). Оптически активные соединения можно также получить из оптически активных исходных материалов или используя стереоселективный синтез. Кроме того, если в молекуле присутствуют двойная связь или полностью или частично насыщенная кольцевая система, могут образовываться геометрические изомеры. Подразумевается, что любые геометрические изомеры, как выделенные, чистые или частично очищенные геометрические изомеры или их смеси, включены в объем настоящего изобретения. Аналогично, геометрические изомеры могут образовывать молекулы с затрудненным вращением. Они также должны быть включены в объем настоящего изобретения. Кроме того, некоторые из соединений настоящего изобретения могут существовать в различных таутомерных формах, и подразумевается, что любые таутомерные формы, которые такие соединения способны образовать, включены в объем настоящего изобретения.-8 015120 Настоящее изобретение также охватывает пролекарственные формы настоящего изобретения, которые после введения претерпевают химическое превращение в процессе метаболизма, прежде чем становятся фармакологически активными веществами. Обычно такие пролекарственные формы являются функциональными производными соединений общей формулы I, которые легко превращаются in vivo в нужные соединения формулы I. Обычные способы для выбора и получения подходящих производных пролекарственных форм раскрыты, например, в "Design of Prodrugs", ed. H. Bundgaard, Elsevier, 1985. Настоящее изобретение также охватывает активные метаболиты настоящего изобретения. В одном из аспектов настоящего изобретения предложено соединение формулы I или его соль для применения в качестве лекарственного средства. В одном из вариантов настоящее изобретение относится к применению одного или более из соединений в соответствии с настоящим изобретением в способе лечения. Подлежащее лечению расстройство или заболевание восприимчиво к усиленному потоку ионов в калиевых каналах, таких как каналы калиевых ионов семейства KCNQ. Такое расстройство или заболевание является предпочтительно расстройством или заболеванием центральной нервной системы. В еще одном варианте настоящего изобретения предложены фармацевтическая композиция, включающая один или более из фармацевтически приемлемых носителей или разбавителей и одно или более из соединений формулы I или его солей. Следующий вариант настоящего изобретения относится к применению соединения формулы I или его соли для получения фармацевтической композиции для лечения заболевания или расстройства,при котором полезны открыватели калиевых каналов KCNQ, такие как открыватель калиевых каналовKCNQ 2. Обычно такое расстройство или заболевание выбирают из группы, состоящей из припадков,тревожных расстройств, невропатической боли и мигреневой боли или нейродегенеративных нарушений. В одном из вариантов соединения настоящего изобретения можно вводить в виде единственного терапевтически эффективного соединения. В другом варианте соединения настоящего изобретения можно вводить как часть комбинированного лечения, т.е. соединения настоящего изобретения можно вводить в комбинации с другими терапевтически эффективными соединениями, обладающими, например, противосудорожными свойствами. Эффекты таких других соединений, обладающих противосудорожными свойствами, могут включать, но ими не ограничиваясь, активности в отношении ионных каналов, таких как натриевые, калиевые или кальциевые каналы; возбуждающих аминокислотных систем, например блокады или модуляции NMDA рецепторов; ингибирующих нейротрансмиттерных систем, например усиления выделения GABA, или блокадыGABA-захвата; или эффектов стабилизации мембран. Существующие в настоящее время противосудорожные лекарства включают, но ими не ограничиваются, тиагабин, карбамазепин, натрийвалпроат, ламотригин, габпентин, прегабалин, этосуксимид, леветирацетам, фенитоин, топирамат, зонисамид, также как и члены классов бензодиазепинов и барбитуратов. Считают, что соединения настоящего изобретения можно использовать для усиления потока ионов в потенциалозависимых калиевых каналах у млекопитающих, таких как человек. Поэтому считают, что соединения настоящего изобретения можно использовать для лечения расстройств или заболеваний, восприимчивых к усиленному потоку ионов в потенциалозависимых калиевых каналах, таких как каналы калиевых ионов семейства KCNQ. Такое расстройство или заболевание является предпочтительно расстройством или заболеванием центральной нервной системы. В одном из вариантов расстройство или заболевание выбирают из группы, состоящей из расстройств, связанных с припадками; таких как острые припадки, судороги, эпилептический статус, и эпилепсий, таких как эпилептические синдромы и эпилептические приступы; в частности судороги, эпилепсия и эпилептический статус. В другом варианте расстройство или заболевание выбирают из группы, состоящей из невропатической боли и мигреневой боли; такой как аллодиния, гипералгезическая боль, фантомная боль, невропатическая боль, связанная с диабетической невропатией, невропатическая боль, связанная с тригеминальной невралгией, и невропатическая боль, связанная с мигренью, в частности аллодиния, гипералгезическая боль, фантомная боль, невропатическая боль, связанная с диабетической невропатией, и невропатическая боль, связанная с мигренью. В еще одном варианте расстройство или заболевание выбирают из группы, состоящей из тревожного расстройства; такого как беспокойство, и расстройства и заболевания, связанные с приступом паники,агорафобия, приступы паники с агорафобией, приступы паники без агорафобии, агорафобия без истории расстройств паники, специфической фобии, социальной фобии и других специфических фобий; обсессивно-компульсивных расстройств, посттравматических стрессов, острых стрессов, генерализованного тревожного расстройства, тревожных расстройств, связанных с общим состоянием здоровья, тревожных расстройств, вызываемых веществами, тревожных расстройствах, связанных с разлукой, регулируемых-9 015120 расстройств, боязни деятельности, гипохондриальных нарушений и тревожных расстройств, не конкретизированных; в частности беспокойство, генерализованное тревожное расстройство, состояние паники,обсессивно-компульсивное расстройство, социальные фобии, боязнь действия, посттравматический стресс, реакция на сильный стресс, регулируемые расстройства, гипохондриальные расстройства, тревожные расстройства, связанные с разлукой, агорафобия, специфические фобии, тревожные расстройства, связанные с общим состоянием здоровья и тревожные расстройства, вызываемые веществами. В еще одном варианте расстройство или заболевание выбирают из группы, состоящей из нейродегенеративных расстройств, таких как болезнь Альцгеймера, хорея Хантингтона, рассеянный склероз,амиотрофический латеральный склероз, болезнь Крейтцфельдта-Якоба, болезнь Паркинсона, энцефалопатии, вызванные СПИДом или инфицированием вирусами коревой краснухи, вирусами герпеса, borrelia и неизвестными патогенами, вызванные травмой нейродегенерации, состояния нейронального гипервозбуждения, такие как при синдроме отмены лекарств или интоксикация, и нейродегенеративные заболевания периферической нервной системы, такие как полиневропатии и полиневриты; в частности болезнь Альцгеймера, хорея Хантингтона, рассеянный склероз, амиотрофический латеральный склероз, вызванная СПИДом энцефалопатия и другие, связанные с инфекцией энцефалопатии, которые вызывают вирусы коревой краснухи, вирусы герпеса, borrelia и неизвестные патогены, болезнь Крейтцфельдта-Якоба,болезнь Паркинсона, вызванные травмами нейродегенерации. В еще одном варианте расстройство или заболевание выбирают из группы, состоящей из состояния нейронального гипервозбуждения, такого как при синдроме отмены лекарств или интоксикации. В еще одном варианте расстройство или заболевание выбирают из группы, состоящей из биполярных расстройств. В еще одном варианте расстройство или заболевание выбирают из группы, состоящей из нарушений сна, таких как бессонница. Термин "лечение", использованный в связи с заболеванием или расстройствами, включает также профилактику, ингибирование и облегчение, в зависимости от обстоятельств. В одном из вариантов было обнаружено, что соединения настоящего изобретения оказывают воздействие на калиевые каналы семейства KCNQ, в частности подгруппы KCNQ 2. В настоящем изобретении предложены соединения, демонстрирующие положительный результат в одном или более из следующих тестов."Относительный отток через KCNQ 2 каналы", который является мерой эффективности соединения в отношении нужного канала."Максимальный электрошок", который является способом оценки припадков, вызываемых неспецифической стимуляцией ЦНС с использованием электрических методик."Припадки, вызываемые пилокарпином", припадки, вызываемые пилокарпином, часто бывает трудно лечить многими существующими противосудорожными лекарствами и, таким образом, являются моделью "невосприимчивых к лекарствам припадков"."Тесты определения электрического порога припадков" и "Тесты определения химического порога припадков". С помощью этих моделей определяют пороговые значения, при которых начинаются припадки, поэтому они являются моделями, которые определяют, могут ли испытуемые соединения задержать инициирование припадка."Возбуждение мозжечковой миндалины", используют как способ оценки развития заболевания, так как у здоровых животных в этой модели припадки становятся более сильными, когда животное подвергают дальнейшей стимуляции."Электрофизиологическая пэтч-кламп регистрация в CHO-клетках" и "Электрофизиологическая регистрация KCNQ 2, KCNQ 2/KCNQ 3 или KCNQ 5 каналов в ооцитах". В этих тестах регистрируются активируемые напряжением KCNQ 2, KCNQ 2/KCNQ 3 или KCNQ 5 токи. В одном из вариантов соединения являются KCNQ 2 активными при значении ЭК 50 менее чем 15000 нМ например менее чем 10000 нМ по результатам теста "Относительный отток через KCNQ 2 каналы". В другом варианте соединения являются KCNQ 2 активными при значении ЭК 50 менее чем 2000 нМ, например менее чем 1500 нМ по результатам теста "Относительный отток через KCNQ 2 каналы". В еще одном варианте соединения являются KCNQ 2 активными при значении ЭК 50 менее чем 200 нМ, например менее чем 150 нМ по результатам теста "Относительный отток через KCNQ 2 каналы". Описание теста "Относительный отток через KCNQ 2 каналы" приведено далее. В одном из вариантов соединения демонстрируют ЭД 50 менее чем 15 мг/кг в тесте "Максимальный электрошок". В другом варианте соединения демонстрируют ЭД 50 менее чем 5 мг/кг в тесте "Максимальный электрошок". Описание теста "Максимальный электрошок" приведено далее. В одном из вариантов соединения демонстрируют ЭД 50 менее чем 5 мг/кг в тестах "Определение- 10015120 электрического порога судорог" и "Определение химического порога судорог", которые раскрыты далее. Некоторые соединения обладают немногими или клинически незначительными побочными эффектами. Поэтому некоторые из соединений тестируют в моделях, определяющих нежелательные седативное, гипотермическое и атаксическое действия соединений. Некоторые из соединений обладают высоким терапевтическим индексом между противосудорожной эффективностью и побочными эффектами, такими как ухудшение локомоторной активности или атаксические эффекты, определяемые при осуществлении теста с вращающимся стержнем. Такие соединения, как ожидается, будут хорошо переноситься пациентами, позволяя использовать высокие дозы,прежде чем проявятся побочные эффекты. Тем самым соответствие с лечением, как ожидается, будет хорошим, и можно будет вводить высокие дозы, что позволит сделать лечение более эффективным для пациентов, введение которым других лекарств вызывало побочные эффекты. Нелимитирующий аспект настоящего изобретения относится к соединениям в соответствии с приводимыми далее вариантами 1-10. 1. Замещенное производное морфолина или тиоморфолина общей формулы IR1 и R2 независимо выбирают из группы, состоящей из галогена, галоген-С 1-6-алк(ен/ин)ила,C1-6-алк(ен/ин)ила и циано;R4, R5, R6 и R7 независимо выбирают из группы, состоящей из водорода и Ar; в виде свободного основания или его соли. 2. Соединение в соответствии с вариантом 1, которое выбирают из группы, состоящей изN-(2,6-диметил-4-морфолин-4-илфенил)-2-(3-фторфенил)ацетамида. 3. Фармацевтическая композиция, включающая один или более из фармацевтически приемлемых носителей или разбавителей и одно или более из соединений в соответствии с любым из вариантов 1 и 2. 4. Применение фармацевтической композиции в соответствии с вариантом 3 для усиления потока ионов в потенциалозависимых калиевых каналах млекопитающих, таких как человек. 5. Применение в соответствии с вариантом 4 для лечения расстройства или заболевания, восприимчивых к усиленному потоку ионов в потенциалозависимых калиевых каналах, причем такое расстройство или заболевание является предпочтительно расстройством или заболеванием центральной нервной системы. 6. Применение в соответствии с вариантом 5, отличающееся тем, что расстройство или заболевание выбирают из группы, состоящей из припадков, таких как судороги, эпилепсия и эпилептический статус. 7. Применение в соответствии с вариантом 5, отличающееся тем, что расстройство или заболевание выбирают из группы, состоящей из невропатической и мигреневой боли, таких как аллодиния, гипералгезическая боль, фантомная боль, невропатическая боль, связанная с диабетической невропатией, и невропатическая боль, связанная с мигренью. 8. Применение в соответствии с вариантом 5, отличающееся тем, что расстройство или заболевание выбирают из группы, состоящей из тревожных расстройства, таких как беспокойство, генерализованное тревожное расстройство, паника, обсессивно-компульсивное расстройство, социальные фобии, боязнь действия, посттравматический стресс, реакция на сильный стресс, регулируемые расстройства, гипохондриальные расстройства, тревожные расстройства, связанные с разлукой, агорафобия, специфические фобии, тревожные расстройства, связанные с общим состоянием здоровья, и тревожные расстройства,вызываемые веществами. 9. Применение в соответствии с вариантом 5, отличающееся тем, что расстройство или заболевание выбирают из группы, состоящей из нейродегенеративных нарушений, таких как болезнь Альцгеймера,хорея Хантингтона, рассеянный склероз, амиотрофический латеральный склероз, энцефалопатия, индуцируемая СПИДом, и другие энцефалопатии, связанные с инфекцией, вызываемые вирусами коревой краснухи, вирусами герпеса, borrelia и неизвестными патогенами, болезнь Крейтцфельдта-Якоба, болезнь Паркинсона, вызванные травмой нейродегенерации. 10. Применение в соответствии с вариантом 5, отличающееся тем, что расстройство или заболевание выбирают из группы, состоящей из состояний нейронального гипервозбуждения, таких как при синдром отмены лекарств или при интоксикации. Определения Термин "гетероатом" относится к атомам азота, кислорода или серы. Термин "галоген" означает фтор, хлор, бром или йод. Выражение "С 3-6-алк(ен/ин)ил" означает C1-6-алкильную, С 2-6-алкенильную или С 2-6-алкинильную группу. Термин "С 1-6-алкил" относится к разветвленной или неразветвленной алкильной группе, содержащей от 1 до 6 атомов углерода включительно, включая (но ими не ограничиваясь) метил, этил, 1-пропил,2-пропил, 1-бутил, 2-бутил, 2-метил-2-пропил и 2-метил-1-пропил. Аналогичным образом, С 2-6-алкенил и С 2-6-алкинил соответственно обозначают такие группы, содержащие от 2 до 6 атомов углерода, включая одну двойную связь и одну тройную связь соответственно, включая (но ими не ограничиваясь) этенил,пропенил, бутенил, этинил, пропинил и бутинил. Выражение "С 1-10-алк(ен/ин)ил" означает С 1-10-алкильную, С 2-10-алкенильную или С 2-6-алкинильную группу. Термин "C1-10-алкил" относится к разветвленной или неразветвленной алкильной группе, содержащей от 1 до 6 атомов углерода включительно, включая (но ими не ограничиваясь) метил, этил, 1-пропил,2-пропил, 1-бутил, 2-бутил, 1-пентил, 1-гексил, 1-гептил, 1-октил, 1-нонил, 1-децил, 2-метил-2-пропил и 2-метил-1-пропил. Аналогичным образом, С 2-10-алкенил и С 2-10-алкинил соответственно обозначают такие группы, содержащие от 2 до 6 атомов углерода, включая одну двойную связь и одну тройную связь соответственно, включая (но ими не ограничиваясь) этенил, пропенил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил, деценил, этинил, пропинил, бутинил, пентинил, гексинил, гептинил, октинил,нонинил и децинил.- 12015120 Выражение "С 3-8-циклоалк(ен)ил" означает С 3-8-циклоалкильную или циклоалкенильную группу. Термин "С 3-8-циклоалкил" обозначает моноциклический или бициклический карбоцикл,содержащий от 3 до 8 атомов углерода, включая (но ими не ограничиваясь) циклопропил, циклопентил,циклогексил,циклогептил,циклооктил,[1.1.1]бициклопентил,бицикло[2.2.1]гептил,[2.2.2]бициклооктил и [3.3.0]бициклооктил и т.д. Термин "С 3-8-циклоалкенил" обозначает моноциклический или бициклический карбоцикл, содержащий от 3 до 8 атомов углерода и включает одну двойную связь. Термин "галоген-С 1-6-алк(ен/ин)ил" обозначает C1-6-алк(ен/ин)ил, замещенный одним или более атомами галогенов, включая (но им не ограничиваясь) трифторметил. Аналогичным образом, галоген-С 3-8-циклоалк(ен)ил обозначает С 3-8-циклоалк(ен)ил, замещенный одним или более из атомов галогенов. В выражении галоген-С 3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)ил термины C1-6-алк(ен/ин)ил и галогенС 3-8-циклоалк(ен)ил имеют указанные выше значения. Если два соседних заместителя вместе с ароматической группой, к которой они присоединены, образуют 4-8 членное кольцо, которое необязательно содержит 1, 2 или 3 гетероатома, тогда кольцевая система образуется 4-8 атомами, выбранными из 4-8 атомов углерода и 0-3 гетероатомов, выбранных из N, S или О. Такие два соседних заместителя могут вместе образовать:-(CH2)a-CH2-, -CH-CH-(CH2)b-, -CH2-CH=CH-(CH2)c, -CH=CH-CH=CH-, -(CH2)a-O-, -O-(CH2)b-O-,-CH2-O-(CH2)с-O-, -CH2-O-CH2-O-CH2-, -(CH2)a-S-, -S-(CH2)b-S-, -CH2-S-(CH2)c-S-, -CH2-S-CH2-S-CH2-,-(CH2)a-NH-, -NH-(CH2)b-NH-, -CH2-NH-(CH2)c-NH-, -CH=CH-NH-, -O-(CH2)b-NH-, -CH2-O-(CH2)c-NHили -O-(CH2)c-NH-CH2-, -S-(CH2)b-NH-, -N=CH-NH-, -N=CH-O- или -N=CH-S- или -N=N-NH-, где b равно 1, 2 или 3, а равно 2, 3 или 4 и с равно 1 или 2. Термин "Ar" относится к необязательно замещенным ароматическим системам, состоящим из 5-10 атомов углерода, где 0, 1, 2, 3 или 4 атома углерода могут быть заменены гетероатомами, независимо выбранными из N, S или О. Примерами таких Ar групп являются необязательно замещенный фенил, необязательно замещенный нафтил, необязательно замещенный пиридин, необязательно замещенный тиофен, необязательно замещенный фуран, необязательно замещенный тиазол, необязательно замещенный хинолин, необязательно замещенный индол, необязательно замещенный 2,3-дигидробензофуран, необязательно замещенный пиримидин, необязательно замещенный пиррол и необязательно замещенный оксазол.Ar может быть замещен одним или более заместителями, независимо выбранными из гидрокси, галогена, С 1-6-алк(ен/ин)ила, С 3-8-циклоалк(ен)ила, С 3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)ила,галоген-С 1-6-алк(ен/ин)ила,C1-6-алк(ен/ин)илокси,С 3-8-алк(ен/ин)илокси,ацила,нитро или циано,-CO-NH-C1-6-алк(ен/ин)ила,-CO-N(C1-6-алк(ен/ин)ил)2,-NH2,-NH-C1-6-алк(ен/ин)ила,-N(C1-6-алк(ен/ин)ил)2, -S-C1-6-алк(ен/ин)ила, -SO2-C1-6-алк(ен/ин)ила, -SO2N(C1-6-алк(ен/ин)ил)2 и-SO2NH-С 1-6-алк(ен/ин)ила; или два соседних заместителя могут вместе с ароматической группой, к которой они присоединены, образовывать 4-8 членное кольцо, которое необязательно содержит 1, 2 или 3 гетероатома. Если Ar замещен CO-NH-C1-6-алк(ен/ин)илом или CO-N(C1-6-алк(ен/ин)ил)2, тогда атом углерода СО группы присоединен к Ar. Если Ar замещен NH2, NH-C1-6-алк(ен/ин)илом илиN(C1-6-алк(ен/ин)ил)2, тогда атом азота присоединен к Ar. Если Ar замещен -S-C1-6-алк(ен/ин)илом, -SO2-C1-6-алк(ен/ин)илом, -SO2N(С 1-6-алк(ен/ин)ил)2 или-SO2NH-C1-6-алк(ен/ин)илом, тогда атом серы присоединен к Ar. Термин "ацил" относится к формильной, C1-6-алк(ен/ин)илкарбонильной, С 3-8-циклоалк(ен)илкарбонильной, Ar-карбонильной, Ar-C1-6-алк(ен/ин)илкарбонильной или С 3-8-циклоалк(ен)илС 1-6-алк(ен/ин)илкарбонильной группе, где C1-6-алк(ен/ин)ил, С 3-8-циклоалк(ен)ил и Ar имеют указанные выше значения. Термины "С 3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)ил", "Ar-C1-6-алк(ен/ин)ил", "C1-6-алк(ен/ин)илокси" иAr имеют указанные выше значения. Аналогичным образом, С 3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)илокси обозначает такие группы, в которых С 3-8-циклоалк(ен)ил и C1-6-алк(ен/ин)илокси имеют указанные выше значения. Выражения Ar-С 3-8-циклоалк(ен)ил и Ar-С 3-8-циклоалк(ен)ил-C1-6-алк(ен/ин)ил обозначают такие группы, в которых C1-6-алк(ен/ин)ил, С 3-8-циклоалк(ен)ил и Ar имеют указанные выше значения.- 13015120 Фармацевтические композиции. Настоящее изобретение относится также к фармацевтической композиции. Соединения настоящего изобретения или его соли можно вводить отдельно или в комбинации с фармацевтически приемлемыми носителями или разбавителями в виде разовой или множественных доз. Фармацевтические композиции в соответствии с настоящим изобретением могут быть приготовлены с фармацевтически приемлемыми носителями или разбавителями, а также с другими известными адъювантами и эксципиентами в соответствии с обычными способами, такими как те, что раскрыты в Remington: The Science and Practice ofPharmacy, 19 Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA, 1995. Фармацевтические композиции могут быть специально созданы для введения любым подходящим способом, таким как пероральный, ректальный, назальный, пульмонарный, местный (включая буккальный и сублингвальный), трансдермальный, интрацистернальный, внутрибрюшинный, вагинальный и парентеральный (включая подкожный, внутримышечный, интратекальный, внутривенный и интрадермальный) способ, причем предпочтителен пероральный способ введения. Следует понимать, что предпочтительный способ будет зависеть от общего состояния и возраста подлежащего лечению субъекта, от природы подлежащего лечению расстройства или заболевания и выбранного активного ингредиента. Фармацевтические композиции, созданные как комбинации соединения настоящего изобретения и фармацевтически приемлемых носителей, затем легко вводят в различных дозированных формах, пригодных для раскрытых способов введения. Композиции удобно представлять в виде единичных дозированных форм способами, известными специалистам-фармацевтам. Соединения настоящего изобретения обычно используют в виде свободных веществ или в виде их фармацевтически приемлемых солей. Одним из примеров является соль присоединения кислоты соединения, находящего применение свободного основания. Если соединение настоящего изобретения содержит свободное основание, такие соли получают обычным способом, обрабатывая раствор или суспензию свободного основания настоящего изобретения химическим эквивалентом фармацевтически приемлемой кислоты. Представительные примеры приведены выше. Фармацевтические композиции для перорального введения могут быть твердыми или жидкими. Твердые дозированные формы для перорального введения включают, например, капсулы, таблетки, драже, пилюли, пастилки, порошки, гранулы и маленькие таблетки, например, помещенные в твердые желатиновые капсулы в форме порошков или гранул или, например, в форме лепешек или пастилок. В случае необходимости фармацевтические композиции для перорального введения можно получить с покрытиями, такими как кишечно-растворимые покрытия, или они могут быть приготовлены таким образом, чтобы обеспечить контролируемое выделение активного ингредиента, такое как замедленное или пролонгированное выделение, в соответствии со способами, хорошо известными специалистам. Жидкие дозированные формы для перорального введения включают, например, растворы, эмульсии, суспензии, сиропы и эликсиры. Композиции настоящего изобретения, пригодные для перорального введения, могут быть в виде дискретных единиц, таких как капсулы или таблетки, каждая из которых содержит определенное количество активного ингредиента, и которые могут содержать подходящий эксципиент. Кроме того, композиции для перорального введения могут быть в форме порошков или гранул, растворов или суспензий в водной или не водной жидкости или в виде эмульсий типа масло-в-воде или вода-в-масле. Подходящие фармацевтические носители включают инертные твердые разбавители или наполнители, стерильные водные растворы и различные органические растворители. Примерами твердых носителей служат лактоза, белая глина, сахароза, циклодекстрин, тальк, желатин, агар, пектин, акация, стеарат магния, стеариновая кислота, низшие алкиловые эфиры целлюлозы, кукурузный крахмал, картофельный крахмал, смолы и т.п. Примерами жидких носителей служат сиропы, арахисовое масло, оливковое масло,фосфолипиды, жирные кислоты, амины жирных кислот, полиоксиэтилен и вода. Носитель или разбавитель могут включать любые известные специалистам материалы с замедленным выделением, такие как глицерилмоностеарат или глицерилдистеарат, отдельно или в смеси с воском. Можно использовать любые добавки, обычно используемые для таких целей, такие как красители,вкусовые агенты, консерванты и т.д., при условии, что они совместимы с активными ингредиентами. Количество твердого носителя может меняться, но обычно составляет от около 25 мг до около 1 г. Если используют жидкий носитель, препараты могут быть в форме сиропов, эмульсий, мягких желатиновых капсул и стерильных жидкостей для инъекций, таких как водные или не водные жидкие суспензии или растворы. Таблетки можно получить, смешивая активный ингредиент с обычными адъювантами или разбавителями и затем прессуя полученную смесь в обычной машине для прессования таблеток. Фармацевтические композиции для парентерального введения включают стерильные водные растворы и не водные растворы для инъекций, дисперсии, суспензии или эмульсии, также как стерильные порошки, которые необходимо перед использованием снова превратить в стерильные растворы или дисперсии для инъекций. Формы депо для инъекций также включены в объем настоящего изобретения.- 14015120 Для парентерального введения можно использовать растворы соединений настоящего изобретения в стерильном водном растворе, водном растворе пропиленгликоля, водном растворе витамина Е или в кунжутном или арахисовом масле. Такие водные растворы следует соответствующим образом буферировать при необходимости, и жидкий разбавитель сначала сделать изотоничным, используя достаточное количество солевого раствора или глюкозы. Водные растворы особенно подходят для внутривенного,внутримышечного, подкожного и внутрибрюшинного введения. Используемые стерильные среды можно легко получить стандартными способами, хорошо известными специалистам в данной области. Растворы для инъекций можно получить, растворяя активный ингредиент и возможные добавки в части растворителя для инъекций, предпочтительно стерильной воде, доводя раствор до нужного объема,стерилизуя раствор и заполняя им подходящие ампулы или сосуды. Можно добавлять любые подходящие добавки, которые обычно используют специалисты, такие как регулирующие тоничность агенты,консерванты, антиоксиданты и т.д. Другие подходящие формы введения включают суппозитории, спреи, мази, кремы, гели, средства для ингаляции, накожные пластыри, имплантаты и т.д. Типичная дозированная форма находится в интервале от около 0,001 до около 100 мг/кг веса тела в день, предпочтительно от около 0,01 до около 50 мг/кг веса тела в день и более предпочтительно от около 0,05 до около 10 мг/кг веса тела в день, которую вводят в виде одной или более доз, например от 1 до 3 доз. Точная величина дозы зависит от частоты введения и способа введения, пола, возраста, веса и общего состояния подлежащего лечению субъекта, природы и тяжести расстройства или заболевания, подлежащего лечению, и любых сопровождающих заболеваний, подлежащих лечению, и других факторов,очевидных специалистам в данной области Композиции удобно представлять в единичной дозированной форме способами, известными специалистам в данной области. Типичная единичная дозированная форма для перорального введения один или более раз в день,например от 1 до 3 раз в день, может содержать от 0,01 до около 1000 мг, например от около 0,01 до 100 мг, предпочтительно от около 0,05 до около 500 мг и более предпочтительно от около 0,5 до около 200 мг. Для парентерального способа введения, такого как внутривенное, интратекальное, внутримышечное и аналогичные способы введения, обычные дозы составляют около половины доз, используемых для перорального введения. Типичные примеры рецептур для композиций настоящего изобретения следующие. 1) Таблетки, содержащие 5,0 мг соединения настоящего изобретения, в расчете на свободное основание. 2) Таблетки, содержащие 0,5 мг соединения настоящего изобретения в расчете на свободное основание. Под выражением "соединение настоящего изобретения" подразумевают любой из вариантов формулы I, как здесь раскрыто. В следующем аспекте настоящее изобретение относится к способу получения соединения настоящего изобретения, как раскрыто далее. Получение соединений настоящего изобретения Соединения настоящего изобретения общей формулы I, где q, W, R1, R2, R3, R4, R5, R6 и R7 имеют указанные выше значения, можно получить способами, представленными на схемах и раскрытыми далее. Схема 1 В соединениях общих формул I-XV q, W, R1, R2, R3, R4, R5, R6 и R7 имеют указанные для формулы I значения. Соединения общей формулы II, III, VI, VIII и XI или получают из коммерческих источников или получают стандартными способами, известными специалистам в данной области. В другом варианте соединения общей формулы III, где R2 представляет галоген, такой как Cl, Br или I (схема 1), получают, используя региоселективное электрофильное ароматическое замещение, хорошо известное специалистам в данной области, используя соответствующие электрофильные соединения, такие как N-хлорсукцинимид, N-бромсукцинимид, бром, йод или хлорид йода, в подходящем растворителе, таком как уксусная кислота, как раскрыто в "Electrophilic Halogenations" by P.B.D. de la Mare,Cambridge University Press, Cambridge, 1976. Нитрогруппу в соединениях общей формулы III, IX и XIII (схемы 1, 4 и 6) можно восстановить, используя соответствующие восстанавливающие агенты, такие как порошок цинка или железа в присутствии кислоты, такой как уксусная кислота или водная хлористо-водородная кислота, или используя газообразный водород или формиат аммония в присутствии подходящего катализатора гидрирования, такого как палладий на активированном угле, в подходящих растворителях, таких как метанол, этанол или тетрагидрофуран, при соответствующих температурах или под действием ультразвука, до получения анилинов общей формулы IV, V и XIV соответственно. В другом варианте хлорид олова(II) или дитионит натрия можно использовать в качестве восстанавливающих агентов в условиях, хорошо известных спе- 17015120 циалистам в данной области. Соединения общей формулы I и VII (схемы 1-4) можно получить, осуществляя взаимодействие соединения общей формулы V и VI соответственно с подходящими электрофильными реагентами, такими как (но ими не ограничиваясь) соответствующим образом замещенные хлорангидриды, бромангидриды,иодангидриды, ангидриды карбоновой кислоты, активированные сложные эфиры, хлорформиаты, с добавлением или без добавления оснований, таких как пиридин, триалкиламины, карбонат калия, оксид магния или алкоголят лития, натрия или калия, в подходящем растворителе, таком как этилацетат, диоксан, тетрагидрофуран, ацетонитрил или диэтиловый эфир, при соответствующей температуре, такой как комнатная температура или температура кипения. В другом варианте соединения общей формулы I и V (схемы 2 и 3) можно получить, используя реакцию образования C-N связи с использованием палладиевого катализатора для соответствующим образом замещенных соединений общей формулы VII и VI и соответствующим образом замещенных морфолинов или тиоморфолинов, как раскрыто S.L. Buchwald et al. (M.C. Harris, X. Hang и S.L. Buchwald,Organic Letters, 2002, 4, 2885). Соединения общей формулы V и XV (схемы 1 и 6) можно получить, осуществляя взаимодействие соединения общей формулы IV и XIV с соответствующим образом замещенными бис-(2-галогеноэтил)эфирами и с добавлением или без добавления оснований, таких как триалкиламины,карбонат калия или алкоголят лития, натрия или калия, в подходящем растворителе, таком как диметилсульфоксид или N,N-диметилформамид, при соответствующей температуре, такой как комнатная температура или температура кипения. В другом варианте соединения общей формулы V (схема 3) можно получить, осуществляя взаимодействие соединения общей формулы VI с соответствующим образом замещенными производными морфолина или тиоморфолина в присутствии палладиевого катализатора, такого как бис-(дибензилиденацетон)палладий с добавлением подходящего фосфинового лиганда, такого как-2,2'-бис-(дифенилфосфино)-1,1'-бинафтил, в присутствии основания, такого как карбонат калия или алкоголят лития, натрия или калия, в подходящем растворителе, таком как толуол или тетрагидрофуран,при соответствующей температуре, такой как комнатная температура или температура кипения. Соединения общей формулы IX (схема 4) можно получить, осуществляя взаимодействие соединения общей формулы VIII с соответствующим образом замещенными морфолинами или тиоморфолинами и с добавлением или без добавления оснований, таких как карбонат калия, в подходящем растворителе,таком как диметилсульфоксид или N,N-диметилформамид, при соответствующей температуре, такой как комнатная температура или температура кипения. Соединения общей формулы I, где R2 представляет Ar или Het (схема 5), можно получить из соединений общей формулы X, используя реакции кросс-сочетания, известные специалистам в данной области, такие как реакция сочетания Сузуки, реакция сочетания Стиле, или другие реакции кросс-сочетания с использованием катализатора переходного металла (D.W. Knight, "Coupling reactions between sp2 carboncenters" в Comprehensive Organic Synthesis, v. 3, p. 481-520, Pergamon Press, 1991). Соединения общей формулы VI (схема 7) можно получить из соединений общей формулы XI, используя электрофильное ароматическое замещение, хорошо известное специалистам в данной области,используя соответствующие электрофильные соединения, такие как N-бромсукцинимид или бром в подходящем растворителе, таком как уксусная кислота, как раскрыто P.B.D. de la Mare и J.H. Ridd,"Preparative methods of aromatic halogenation" in Aromatic substitutions, p. 105-115, Butterworths ScientificPublications, London, 1959. Соединения общей формулы XII (схема 6) можно получить, осуществляя взаимодействие соединения общей формулы XI с п-толуолсульфонилхлоридом с добавлением или без добавления оснований,таких как пиридин, триалкиламины, карбонат калия, бикарбонат натрия, оксид магния или алкоголят лития, натрия или калия, в подходящем растворителе, таком как пиридин, этилацетат, диоксан, тетрагидрофуран, ацетонитрил или диэтиловый эфир, при соответствующей температуре, такой как комнатная температура или температура кипения. Соединения общей формулы XIII (схема 6) можно получить из соединений общей формулы XII,используя реакции нитрования, известные специалистам в данной области, такие как реакция с концентрированной азотной кислотой, нитритом натрия или нитратом натрия, в подходящем растворителе, таком как ледяная уксусная кислота, уксусный ангидрид, трифторуксусная кислота, концентрированная серная кислота или их смеси, при соответствующих температурах, например, как раскрыто P.B.D. de laScientific Publications, London, 1959. Соединения общей формулы V (схема 6) можно получить, обрабатывая соединения общей формулы XV в сильных кислотных условиях, таких как водный раствор серной кислоты или водная хлористоводородная кислота, при соответствующей температуре, такой как комнатная температура или температура кипения.- 18015120 Примеры Аналитические данные LC-MC получают, используя прибор РЕ Sciex API 150EX, снабженный системой фотоионизации при атмосферном давлении и системой Shimadzu LC-8A/SLC-10A LC. Колонка: 304,6 мм Waters Symmetry C18 колонка с размером частиц 3,5 мкм. Система растворителей: А - вода/трифторуксусная кислота (100:0,05) и В - вода/ацетонитрил/трифторуксусная кислота (5:95:0,03). Метод: элюирование с линейным градиентом 90% А до 100% В в течение 4 мин и при скорости потока 2 мл/мин. Степень чистоты определяют, интегрируя спектры УФ (254 нм) и ELSD. Время удерживания (tR) выражают в минутах. Препаративную LC-MC-очистку осуществляют на том же самом приборе, используя химическую ионизацию при атмосферном давлении. Колонка: 5020 мм YMC ODS-A с размером частиц 5 мкм. Метод: элюирование с линейным градиентом 80% А до 100% В в течение 7 мин и при скорости потока 22,7 мл/мин. Отбор фракций осуществляют, используя МС детектирование с разделением потока. Аналитические результаты LC-MC-TOF (TOF - время пролета) получают, используя прибор микромасс LCT 4-ways MUX, снабженный детекторной системой Waters 2488/Sedex 754. Колонка: 304,6 мм Waters Symmetry C18 колонка с размером частиц 3,5 мкм. Система растворителей: А - вода/трифторуксусная кислота (100:0,05) и В - вода/ацетонитрил/трифторуксусная кислота (5:95:0,03). Метод: элюирование с линейным градиентом 90% А до 100% В в течение 4 мин и при скорости потока 2 мл/мин. Степень чистоты определяют, интегрируя спектры УФ (254 нм) и ELSD. Время удерживания (tR) выражают в минутах. Результаты GC-MC получают, используя газовый хроматограф Varian CP 3800, укомплектованный колонкой Phenomenex (Zebron ZB-5, длина: 15 м, внутренний диаметр: 0,25 мм), соединенный с массспектрометром Varian Saturn, 2000 iontrap. Метод: длительность 15 мин, поток в колонке 1,4 мл/мин (газ-носитель гелий), градиент температуры: 0-1 мин, 60 С; 1-13 мин, 60-300 С; 13-15 мин, 300 С. 1 Н ЯМР спектры записывают на частоте 500,13 МГц, используя прибор Bruker Avance DRX500. В качестве растворителей используют дейтерированные хлороформ (99,8% D) или диметилсульфоксид(99,8% D). В качестве внутреннего стандарта используют ТМС. Величины химических сдвигов выражают в частях на миллион. Для указания мультиплетности сигналов ЯМР используют следующие сокращения:s = синглет, d = дублет, t = триплет, q = квартет, qui = квинтет, h = гептет, dd = дублет дублета, ddd = дублет дублета дублета, dt = дублет триплета, dq = дублет квартета, tt = триплет триплетов, m = мультиплет и b = широкий синглет. Микроволновые эксперименты осуществляют в запаянных ампулах или реакторах, используя синтезатор Emrys Synthesizer или оптимизатор Emrys Optimizer EXP от Personal Chemistry или приборMilestone Microsynth от Milestone. Если реакционную смесь нагревают в микроволновом приборе, тогда перед следующей стадией процесса ее охлаждают до 25 С. Получение промежуточных соединений. 2,6-Диметил-4-морфолин-4-илфениламин. бис-(Дибензилиденацетон)палладий (2,88 г) и -2,2'-бис-(дифенилфосфино)-1,1'-бинафтил(4,69 г) добавляют к сухому толуолу (175 мл очищенный аргоном) и перемешивают в течение 15 мин в атмосфере аргона. Последовательно добавляют трет-бутоксид калия (7,06 г), морфолин (8,7 мл) и 4-бром-2,6-диметиланилин (10,03 г). Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 16 ч в атмосфере аргона, охлаждают и фильтруют через диоксид кремния(200 г). Добавляют солевой раствор (250 мл) и полученную смесь экстрагируют этилацетатом (3200 мл). Объединенные органические фазы сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт растворяют в диэтиловом эфире (250 мл), фильтруют через диоксид кремния (200 г) и концентрируют в вакууме, получая 8,5 г (41% выход) указанного в заголовке соединения в виде темного масла. Продукт используют без дальнейшей очистки.N-(4-Бром-2,6-диметилфенил)-2-циклопентилацетамид. 4-Бром-2,6-диметиланилин (5,92 г) и циклопентилацетилхлорид (4,87 мл) растворяют в ацетонитриле (26 мл) и нагревают до 150 С в течение 10 мин в запаянной ампуле для микроволновой обработки. Реакционную смесь охлаждают до 0 С, продукт отфильтровывают и промывают холодным ацетонитрилом (50 мл), получая 8,43 г (92% выход) указанного в заголовке соединения в виде твердого вещества коричневого цвета. Сырой продукт используют без дальнейшей очистки.LC-MC (m/z) 312 (МН+); tR=3,10, (UV, ELSD) 89%, 99%. 1 Н ЯМР (500 МГц, CDCl3): 1,22 (м, 2 Н), 1,52 (м, 2 Н), 1,63 (м, 2 Н), 1,77 (м, 2 Н), 2,06 (с, 6 Н), 2,31 (м,1 Н), 2,64 (д, 2 Н), 7,15 (с, 2 Н), 9,98 (шир.с, 1 Н). 2-Бром-4-нитро-6-трифторметилфениламин. Бром (0,60 мл), растворенный в уксусной кислоте (11 мл), добавляют по каплям к раствору 4-нитро 2-трифторметилфениламина (2,4 г) в уксусной кислоте (12 мл). Реакционную смесь нагревают до 120 С в течение 2,5 ч, выливают в воду (400 мл) и фильтруют. Собранное твердое вещество промывают водой(200 мл) и сушат в вакууме, получая 3,03 г (91% выход) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1 Н ЯМР (500 МГц, ДМСО-d6): 7,08 (с, 2 Н), 8,23 (д, 1 Н), 8,51 (Д, 1 Н). 2-Бром-6-трифторметилбензол-1,4-диамин. Водную хлористо-водородную кислоту (2 М, 45 мл) медленно добавляют к смеси цинковой пыли(8,6 г) и 2-бром-4-нитро-6-трифторметилфениламина (2,5 г) в тетрагидрофуране (50 мл). Реакционную смесь перемешивают в течение 1 ч, фильтруют и нейтрализуют, используя насыщенный водный раствор бикарбоната натрия (100 мл). Добавляют воду (100 мл) и полученную смесь экстрагируют этилацетатом(2100 мл). Объединенные органические фазы промывают водой (2200 мл) и солевым раствором(200 мл), сушат над сульфатом натрия и концентрируют в вакууме, получая 2,22 г (98% выход) указанного в заголовке соединения в виде твердого вещества красного цвета. 1 Н ЯМР (500 МГц, ДМСО-d6): 4,55 (с, 2 Н), 4,91 (с, 2 Н), 6,76 (д, 1 Н), 7,01 (д, 1 Н). 2-Бром-4-морфолин-4-ил-6-трифторметилфениламин. 2-Бром-6-трифторметилбензол-1,4-диамин (2,21 г), бис-(2-бромэтил)эфир (1,30 мл) иN,N-диизопропилэтиламин (4,64 мл) перемешивают в N,N-диметилформамиде (19 мл) и нагревают до 180 С в течение 30 мин в запаянной ампуле для микроволновой обработки. Добавляют насыщенный водный раствор бикарбоната (100 мл) и сырую смесь экстрагируют этилацетатом (100 мл). Органическую фазу промывают водой (100 мл) и солевым раствором (100 мл), сушат над сульфатом натрия и концентрируют в вакууме. Сырой продукт очищают, используя флэш-хроматографию, получая 1,78 г (63%) указанного в заголовке соединения в виде твердого вещества желтого цвета.(2,01 г) и 2-амино-3-хлор-5-нитробензонитрила (0,50 г) в тетрагидрофуране (40 мл). Реакционную смесь перемешивают в течение 2 ч, нейтрализуют, используя насыщенный водный раствор карбоната натрия(50 мл), и экстрагируют этилацетатом (350 мл). Объединенные органические фазы сушат над сульфатом натрия и концентрируют в вакууме, получая 0,42 г (99% выход) указанного в заголовке соединения в виде твердого вещества красного цвета. 1 Н ЯМР (500 МГц, ДМСО-d6): 4,89 (с, 2 Н), 5,13 (с, 2 Н), 6,64 (д, 1 Н), 6,89 (д, 1 Н). 2-Амино-3-хлор-5-морфолин-4-илбензонитрил. 2,5-Диамино-3-хлорбензонитрил (387 мг), бис-(2-бромэтил)эфир (0,35 мл) и N,N-диизопропилэтиламин (1,25 мл) перемешивают в N,N-диметилформамиде (4 мл) и нагревают до 180 С в течение 30 мин в запаянной ампуле для микроволновой обработки. Добавляют насыщенный водный раствор бикарбоната (20 мл) и сырую смесь экстрагируют этилацетатом (20 мл). Органическую фазу промывают водой (20 мл) и солевым раствором (20 мл), сушат над сульфатом натрия и концентрируют в вакууме, получая 0,50 г (91%) указанного в заголовке соединения в виде твердого вещества коричневого цвета.LC-MC (m/z) 238 (МН+); tR=2,31, (DV, ELSD) 85%, 95%. 1 Н ЯМР (500 МГц, ДМСО-d6): 2,97 (м, 4 Н), 3,69 (м, 4 Н), 5,59 (с, 2 Н), 7,04 (д, 1 Н), 7,29 (д, 1 Н). трет-Бутиловый эфир [2-(4-фторфенил)-2-гидроксиэтил]карбаминовой кислоты. К перемешиваемому раствору трет-бутилового эфира карбаминовой кислоты (0,22 г) в ацетонитриле (6 мл) добавляют последовательно при 0 С: гидроксид натрия (52 мг) в воде (5 мл); через 2 мин трет-бутилгипохлорит (139 мкл); через 10 мин дигидрат осмата (VI) калия (9 мг) в воде (1 мл); через 1 мин гидрохинин (антрахинон-1,4-диил)диэфир (26 мг) в ацетонитриле (4 мл); через 3 мин ацетонитрил (6,7 мл) и фосфатный буфер (3,3 мл, 0,5 М, рН 7,65);- 20015120 через 5 мин достаточное количество моногидрата бифосфата натрия, чтобы довести рН до 7,65; и наконец 4-фторстирол. Реакцию гасят после перемешивания в течение 3 ч при 25 С, используя сульфит натрия (0,20 г) в воде (2 мл) при 0 С. Фазы разделяют и водный слой экстрагируют этилацетатом (320 мл). Объединенные органические фазы промывают водой (150 мл), сушат над сульфатом натрия, концентрируют в вакууме и очищают, используя флэш-хроматографию, получая 90 мг (57%) указанного в заголовке соединения в виде бесцветного масла. 1 Н ЯМР (500 МГц, CDCl3): 1,45 (с, 9 Н), 3,18 (м, 1 Н), 3,23 (м, 1 Н), 3,44 (м, 1 Н), 4,83 (м, 1 Н), 4,92(шир.с, 1 Н), 7,04 (т, 2 Н), 7,34 (м, 2 Н). Следующие соединения получают аналогичным образом. трет-Бутиловый эфир [2-гидрокси-2-(4-трифторметилфенил)этил]карбаминовой кислоты. Выход: 82%. 1 Н ЯМР (500 МГц, CDCl3): 1,44 (с, 9 Н), 3,26 (м, 1 Н), 3,52 (м, 2 Н), 4,40 (шир.с, 1 Н), 4,92 (шир.с, 1 Н),7,49 (д, 2 Н), 7,61 (д, 2 Н). трет-Бутиловый эфир [2-(2-хлорфенил)-2-гидроксиэтил]карбаминовой кислоты. Выход: 61%. 1 Н ЯМР (500 МГц, CDCl3): 1,44 (с, 9 Н), 3,32 (м, 1 Н), 3,51 (м, 1 Н), 4,23 (м, 1 Н), 5,08 (шир.с, 1 Н), 5,19(шир.с, 1 Н), 7,20 (м, 1 Н), 7,28 (м, 1 Н), 7,59 (м, 1 Н). 2-(4-Фторфенил)морфолин. Раствор трет-бутилового эфира [2-(4-фторфенил)-2-гидроксиэтил]карбаминовой кислоты (90 мг) в дихлорметане (1 мл) и трифторуксусную кислоту (1 мл) перемешивают при 25 С в течение 1 ч и затем концентрируют в вакууме. Остаток разделяют между этилацетатом (5 мл) и насыщенным водным раствором карбоната калия (5 мл). Органическую фазу сушат над сульфатом натрия, концентрируют в вакууме и снова растворяют в сухом тетрагидрофуране (3 мл) и триэтиламине (54 мкл). Хлорацетилхлорид(31 мкл) в сухом тетрагидрофуране (1 мл) добавляют по каплям при 0 С. Через 30 мин реакционную смесь разбавляют этилацетатом (10 мл) и промывают смесью вода/солевой раствор (1:1,310 мл). Органическую фазу сушат над сульфатом натрия, концентрируют в вакууме и снова растворяют в третбутаноле (5 мл). Добавляют трет-бутоксид калия (79 мг) и реакционную смесь перемешивают при 25 С в течение 1,5 ч. Реакцию гасят насыщенным водным раствором аммонийхлорида (30 мл) и экстрагируют этилацетатом (230 мл). Объединенные органические фазы сушат над сульфатом натрия, концентрируют в вакууме и испаряют совместно с толуолом (25 мл). Остаток растворяют в сухом толуоле (5 мл) в атмосфере аргона и обрабатывают натрий бис-(2-метоксиэтокси)алюминийгидридом (70% в толуоле,205 мкл) по каплям и перемешивают при 25 С в течение 5 ч. Реакцию гасят при 0 С, используя 10% водный раствор гидроксида натрия (5 мл), и полученную смесь экстрагируют диэтиловым эфиром (215 мл). Объединенные органические фазы сушат над сульфатом натрия и концентрируют в вакууме, получая 60 мг (94%) указанного в заголовке соединения в виде бесцветного масла.LC-MC (m/z) 182 (МН+); tR=1,06, (UV, ELSD) 78%, 98%. Следующие соединения получают аналогичным образом. 2-(4-Трифторфенил)морфолин. Выход: 85%. LC-MC (m/z) 232 (MH+); tR=1,59, (UV, ELSD) 79%, 99%. 2-(2-Хлорфенил)морфолин. Выход: 86%. LC-MC (m/z) 198 (MH+); tR=1,21, (UV, ELSD) 66%, 99%. 4-Бром-2-метокси-6-метилфениламин. К 2-метокси-6-метилфениламину (10,0 г), растворенному в ацетонитриле (200 мл), добавляютN-бромсукцинимид (14,3 г) и реакционную смесь нагревают до 145 С в течение 15 мин в запаянной ампуле для микроволновой обработки. Сырую смесь фильтруют через целит, разбавляют диэтиловым эфиром (200 мл), промывают гидроксидом натрия (2 М, 2100 мл) и солевым раствором (1100 мл). Органическую фазу сушат над сульфатом магния, концентрируют в вакууме и очищают, используя флэшхроматографию, получая 3,4 г (26%) указанного в заголовке соединения в виде твердого вещества черного цвета. 1 Н ЯМР (500 МГц, ДМСО-d6): 2,06 (с, 3 Н), 3,77 (с, 3 Н), 4,55 (с, 2 Н), 6,78 (д, 1 Н), 6,82 (д, 1 Н). Следующие соединение получают аналогичным образом. 4-Бром-2-метил-6-трифторметилфениламин. Выход: 80%. GC-MC (m/z) 254 (М+); tR=3,73. 2-Метокси-6-метил-4-морфолин-4-илфениламин. бис-(Дибензилиденацетон)палладий (0,63 г) и (2'-дициклогексилфосфанилбифенил-2-ил)диметиламин (0,68 г) добавляют к сухому толуолу (100 мл очищенный аргоном) и перемешивают в течение 15 мин в атмосфере аргона. Последовательно добавляют трет-бутоксид калия (3,70 г), морфолин (4,0 мл) и 4-бром-2-метокси-6-метилфениламин (3,40 г). Реакционную смесь нагревают при кипении с обратным холодильником в течение 16 ч в атмосфере аргона, охлаждают и фильтруют через диоксид кремния(50 г). Добавляют гидроксид натрия (2 М, 200 мл) и смесь экстрагируют этилацетатом (3200 мл). Объединенные органические фазы промывают солевым раствором (1, 200 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт очищают, используя флэш-хроматографию, получая 1,0 г(29% выход) указанного в заголовке соединения в виде масла черного цвета. 1 Н ЯМР (500 МГц, ДМСО-d6): 2,05 (с, 3 Н), 2,91 (т, 4 Н), 3,69 (т, 4 Н), 3,74 (с, 3 Н), 3,95 (с, 2 Н), 6,23 (д,1 Н), 6,39 (д, 1 Н). Следующее соединение получают аналогичным образом. 2-Метил-4-морфолин-4-ил-6-трифторметилфениламин. Выход: 28%. 1H ЯМР (500 МГц, ДМСО-d6): 2,13 (с, 3 Н), 2,93 (т, 4 Н), 3,70 (т, 4 Н), 4,67 (с, 2 Н), 6,75 (д, 1 Н), 6,99 (д,1 Н). 4-(3,5-Дифтор-4-нитрофенил)морфолин. 2,4,6-Трифторнитробензол (4,95 г) и карбонат калия (4,63 г) смешивают в сухом диметилсульфоксиде (40 мл) и охлаждают до 10 С в атмосфере аргона. Добавляют морфолин (2,56 мл), реакционную смесь оставляют нагреваться до 25 С и перемешивают в атмосфере аргона в течение 16 ч. Реакционную смесь концентрируют в вакууме. Добавляют солевой раствор (50 мл) и продукт экстрагируют этилацетатом (350 мл). Объединенные органические фазы сушат над сульфатом магния и концентрируют в вакууме. Сырой материал очищают, используя флэш-хроматографию, получая 2,49 г (37% выход) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1 Н ЯМР (500 МГц, ДМСО-d6): 3,43 (т, 4 Н), 3,69 (т, 4 Н), 6,87 (д, 2 Н). 2,6-Дифтор-4-морфолин-4-илфениламин. Концентрированную хлористо-водородную кислоту (4,2 мл) медленно добавляют к смеси цинковой пыли (3,3 г) и 4-(3,5-дифтор-4-нитрофенил)морфолина (2,49 г) в тетрагидрофуране (40 мл), охлажденном до 0 С. Затем реакционную смесь перемешивают в течение 1 ч при 0 С и в течение 2 ч при 25 С. Реакционную смесь фильтруют через целит (10 г), концентрируют в вакууме и очищают, используя флэшхроматографию, получая 1,96 г (90% выход) указанного в заголовке соединения в виде твердого вещества белого цвета.H ЯМР (500 МГц, ДМСО-d6): 2,94 (т, 4 Н), 3,69 (т, 4 Н), 4,53 (с, 2 Н), 6,57 (м, 2 Н). 2-Хлор-4-нитро-6-трифторметилфениламин. 4-Нитро-2-трифторметилфениламин (5,6 г) и N-хлорсукцинимид (4,0 г) суспендируют в ацетонитриле (15 мл) и нагревают до 150 С в течение 10 мин в запаянной ампуле для микроволновой обработки. Добавляют этилацетат (80 мл) и органическую фазу промывают 5% водным раствором NaOH (250 мл),водой (250 мл) и солевым раствором (250 мл). Органическую фазу сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт очищают, используя флэш-хроматографию, получая 4,9 г (75% выход) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1 Н ЯМР (500 МГц, CDCl3): 5,35 (шир.с, 2 Н), 8,35 (шир.с, 1 Н), 8,37 (шир.с, 1 Н). Следующее соединение получают аналогичным образом. 2-Хлор-6-метил-4-нитрофениламин. Выход: 95%. 1 Н ЯМР (500 МГц, ДМСО-d6): 2,22 (с, 3 Н), 6,56 (шир.с, 2 Н), 7,89 (д, 1 Н), 8,00 (д, 1 Н).N-(2-Хлор-6-метил-4-нитрофенил)-2-циклопентилацетамид. 2-Хлор-6-метил-4-нитрофениламин (6,0 г) и циклопентилацетилхлорид (5,1 г) растворяют в ацетонитриле (45 мл) и нагревают до 150 С в течение 20 мин в запаянной ампуле для микроволновой обработки. Реакционную смесь охлаждают до 0 С, выпавший в осадок продукт собирают фильтрованием и промывают холодным ацетонитрилом, получая 5,5 г (58%) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1 Н ЯМР (500 МГц, ДМСО-d6): 1,24 (м, 2 Н), 1,58 (м, 4 Н), 1,78 (м, 2 Н), 2,27 (м, 1 Н), 2,30 (с, 3 Н), 2,38(д, 2 Н), 8,15 (д, 1 Н), 8,18 (д, 1 Н), 9,83 (с, 1 Н). Следующее соединение получают аналогичным образом.- 22015120 2-Хлор-6-трифторметилбензол-1,4-диамин. Уксусную кислоту (13 мл) медленно добавляют к смеси цинковой пыли (12,4 г) и 2-хлор-4-нитро-6 трифторметилфениламина (4 г) в тетрагидрофуране (40 мл). Реакционную смесь перемешивают в течение 1 ч, фильтруют через диоксид кремния и концентрируют в вакууме. Сырой продукт очищают, используя флэш-хроматографию, получая 2,9 г (83%) указанного в заголовке соединения в виде твердого вещества черного цвета. 1 Н ЯМР (500 МГц, CDCl3): 3,44 (шир.с, 2 Н), 4,16 (шир.с, 2 Н), 6,77 (д, 1 Н), 6,86 (д, 1 Н). Следующие соединения получают аналогичным образом.(516 мг) смешивают в ацетонитриле (45 мл) и нагревают до 165 С в течение 1 ч в запаянной ампуле для микроволновой обработки. Сырую смесь концентрируют в вакууме, снова растворяют в этилацетате(100 мл), промывают водой (2100 мл) и солевым раствором (1100 мл). Органическую фазу сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт очищают, используя флэшхроматографию, получая 940 мг (24%) указанного в заголовке соединения в виде масла черного цвета. 1 Н ЯМР (500 МГц, CDCl3): 3,02 (м, 4 Н), 3,84 (м, 4 Н), 4,30 (шир.с, 2 Н), 6,97 (д, 1 Н), 7,06 (д, 1 Н).(1,80 мл) и паратолуолсульфонилхлорид (2,00 г) растворяют в пиридине (4 мл) и нагревают до 160 С в течение 10 мин в запаянной ампуле для микроволновой обработки. Полученную суспензию разбавляют этилацетатом (10 мл) и промывают хлористо-водородной кислотой (2 М, 10 мл) и солевым раствором(10 мл). Органическую фазу сушат над сульфатом натрия, концентрируют в вакууме и суспендируют в 65% азотной кислоте (15 мл) и воде (60 мл). Последовательно добавляют уксусную кислоту (60 мл) и нитрит натрия (0,99 г) и реакционную смесь нагревают до 100 С в течение 12 ч. Полученную смесь охлаждают до 25 С, выливают в ледяную воду (200 мл) и фильтруют, получая 2,07 г (58%) указанного в заголовке соединения в виде твердого вещества желтого цвета. 1 Н ЯМР (500 МГц, CDCl3): 1,06 (д, 12 Н), 2,43 (с, 3 Н), 3,19 (м, 2 Н), 6,29 (с, 1 Н), 7,28 (д, 2 Н), 7,59 (д,2 Н), 7,97 (с, 2 Н).(50 мл) добавляют дигидрат хлорида олова(II) (11,2 г) и полученную смесь нагревают до 80 С в течение 1,5 ч. Затем ее выливают на лед (300 мл), сильно подщелачивают, используя твердый гидроксид натрия(3100 мл). Объединенные органические фазы сушат над сульфатом натрия и концентрируют в вакууме. Сырой продукт очищают, используя флэш-хроматографию, получая 2,60 г (76%) указанного в заголовке соединения в виде твердого вещества не совсем белого цвета. 1 Н ЯМР (500 МГц, CDCl3): 0,95 (д, 12 Н), 2,40 (с, 3 Н), 3,02 (м, 2 Н), 3,68 (шир.с, 2 Н), 5,74 (с, 1 Н), 6,39(с, 2 Н), 7,23 (д, 2 Н), 7,60 (д, 2 Н). 2,6-Диизопропил-4-морфолин-4-илфениламин. Смесь N-(4-амино-2,6-диизопропилфенил)-4-метилбензолсульфонамида (346 мг), бис-(2-бромэтил)эфира (151 мкл), N,N-диизопропилэтиламина (0,53 мл) и N-метилпирролидина (1,0 мл) нагревают до 180 С в течение 20 мин в запаянной ампуле для микроволновой обработки. Полученную смесь разбавляют этилацетатом (20 мл), промывают солевым раствором (30 мл) и насыщенным водным раствором карбоната калия (30 мл) и сушат над сульфатом натрия. Органическую фазу концентрируют в вакууме и снова растворяют в смеси серной кислоты (1,9 мл) и воды (0,1 мл) и перемешивают при 40 С в течение 3 ч. Добавляют лед (30 мл) и воду (30 мл) и полученную смесь подщелачивают, используя твердый карбонат калия. Полученную смесь экстрагируют этилацетатом (320 мл), объединенные органические фазы сушат над сульфатом натрия и концентрируют в вакууме, получая 260 мг (99%) указанного в заголовке соединения в виде твердого вещества белого цвета. 1 Н ЯМР (500 МГц, CDCl3): 1,26 (д, 12 Н), 2,95 (м, 2 Н), 3,06 (м, 4 Н), 3,49 (шир.с, 2 Н), 3,87 (м, 4 Н),6,69 (с, 2 Н).(4 мл) и нагревают до 160 С в течение 10 мин в запаянной ампуле для микроволновой обработки. Полученную суспензию разбавляют этилацетатом (10 мл), промывают хлористо-водородной кислотой (2 М,10 мл) и солевым раствором (10 мл). Органическую фазу сушат над сульфатом натрия, концентрируют в вакууме и суспендируют в 65% азотной кислоте (15 мл) и воде (60 мл). Последовательно добавляют уксусную кислоту (60 мл) и нитрит натрия (0,99 г) и реакционную смесь нагревают при 100 С в течение 12 ч. Полученную смесь охлаждают до 25 С и выливают в ледяную воду (200 мл), подщелачивают, используя твердый гидроксид натрия, и экстрагируют этилацетатом (350 мл). Объединенные органические фазы промывают солевым раствором (1100 мл), сушат над сульфатом натрия и концентрируют в вакууме, получая 0,31 г (9%) указанного в заголовке соединения в виде сиропа желтого цвета. 1N-(4-Амино-2,6-диэтилфенил)-4-метилбензолсульфонамид. Раствор дитионита натрия (772 мг) в воде (6 мл) добавляют к раствору N-(2,6-диэтил-4 нитрофенил)-4-метилбензолсульфонамида (309 мг) в тетрагидрофуране (6 мл) и полученную смесь перемешивают при 50 С в течение 20 ч. После охлаждения воду насыщают карбонатом калия и экстрагируют этилацетатом (210 мл). Объединенные органические фазы сушат над сульфатом натрия, концентрируют в вакууме и очищают, используя флэш-хроматографию, получая 70 мг (25%) указанного в заголовке соединения в виде твердого вещества не совсем белого цвета. Продукт используют непосредственно в следующей реакции без получения спектральных характеристик.(33 мкл), N,N-диизопропилэтиламина (115 мкл) и N-метилпирролидина (0,3 мл) нагревают до 180 С в течение 20 мин в запаянной ампуле для микроволновой обработки. Полученную смесь разбавляют этилацетатом (20 мл), промывают солевым раствором (30 мл), насыщенным водным раствором карбоната калия (30 мл) и сушат над сульфатом натрия. Органическую фазу концентрируют в вакууме, получая 78 мг (91%) указанного в заголовке соединения.LC-MC (m/z) 389 (МН+); tR=2,77, (UV, ELSD) 57%, 98%. Сырой продукт используют без дальнейшей очистки.(3,4-Дифторфенил)ацетилхлорид. К (3,4-дифторфенил)уксусной кислоте (2,0 г), растворенной в 1,2-дихлорэтане (5 мл), добавляют тионилхлорид (5 мл) и полученную смесь кипятят с обратным холодильником в течение 16 ч в атмосфере аргона. Сырую смесь концентрируют в вакууме, получая 2,2 г (100%) указанного в заголовке соединения в виде масла желтого цвета. 1H ЯМР (500 МГц, CDCl3): 4,10 (с, 2 Н), 7,00 (м, 1 Н), 7,11 (м, 1 Н), 7, 17 (м, 1 Н). Следующее соединение получают аналогичным образом.(3-Фторфенил)ацетилхлорид. Выход: 99%. 1 Н ЯМР (500 МГц, CDCl3): 4,13 (с, 2 Н), 6,92 (м, 1 Н), 7,01 (м, 2 Н), 7,34 (м, 1 Н). Соединения настоящего изобретения Соли присоединения кислот соединений настоящего изобретения можно легко получить, используя способы, известные специалистам в данной области. Пример 1. 1a. N-(2-Бром-4-морфолин-4-ил-6-трифторметилфенил)-2-(4-фторфенил)ацетамид. 2-Бром-4-морфолин-4-ил-6-трифторметилфениламин (0,236 г) и 4-фторфенилацетилхлорид(0,105 мл) растворяют в ацетонитриле (5 мл) и нагревают до 150 С в течение 10 мин в запаянной ампуле для микроволновой обработки. Добавляют воду (25 мл) и продукт экстрагируют этилацетатом (325 мл). Органические фазы промывают солевым раствором (50 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт очищают, используя флэш-хроматографию, получая 0,027 г (9%) указанного в заголовке соединения в виде твердого вещества не совсем белого цвета.(дд, 2 Н), 7,46 (д, 1 Н), 9,78 (с, 1 Н). Следующие соединения получают аналогичным образом. 1b. 2-Циклопентил-N-(2-бром-6-трифторметил-4-морфолин-4-илфенил)ацетамид. Выход: 22%. LC-MCS (m/z) 436 (МН+); tR=2,95, (UV, ELSD) 97%, 98%. 1 Н ЯМР (500 МГц, ДМСО-d6): 1,20 (м, 2 Н), 1,50 (м, 2 Н), 1,60 (м, 2 Н), 1,77 (м, 2 Н), 2,24 (м, 1 Н), 2,26(д, 2 Н), 3,23 (м, 4 Н), 3,72 (м, 4 Н), 7,15 (д, 1 Н), 7,32 (д, 1 Н), 9,40 (с, 1 Н). Пример 2. 2 а. 2-Циклопентил-N-(2,6-диметил-4-тиоморфолин-4-илфенил)ацетамид. бис-(Дибензилиденацетон)палладий (37 мг) и (2'-дициклогексилфосфанилбифенил-2-ил)диметиламин (38 мг) смешивают в сухом дегазированном толуоле (2 мл) в атмосфере аргона в течение 5 мин. К этой смеси добавляют N-(4-бром-2,6-диметилфенил)-2-циклопентилацетамид (200 мг), трет-бутоксид калия (90 мг) и тиоморфолин (80 мг) и реакционную смесь нагревают до 90 С в запаянной 4 мл ампуле в атмосфере аргона в течение 16 ч, охлаждают и фильтруют через диоксид кремния (2 г). Добавляют смесь вода/солевой раствор (1:1, 4 мл всего) и полученную смесь экстрагируют этилацетатом (32 мл). Объединенные органические фазы сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт очищают, используя препаративную LC-MC, получая 5,6 мг (3% выход) указанного в заголовке соединения.LC-MC-TOF (m/z) 333 (МН+); tR=2,03, (UV, ELSD) 98%, 100%. Следующие соединения получают аналогичным образом. 2b. 2-Циклопентил-N-[2,6-диметил-4-(2-фенилморфолин-4-ил)фенил]ацетамид. Выход: 3%. LC-MC-TOF (m/z) 393 (МН+); tR=3,11, (UV, ELSD) 96%, 98%. 2 с. 2-Циклопентил-N-[2,6-диметил-4-(2-фенилтиоморфолин-4-ил)фенил]ацетамид. Выход: 4%. LC-MC-TOF (m/z) 409 (МН+); tR=3,30, (UV, ELSD) 99%, 98%. 2d. 2-Циклопентил-N-[2,6-диметил-4-(3-пиридин-3-ил-тиоморфолин-4-ил)фенил]ацетамид. Выход: 12%. LC-MC-TOF (m/z) 410 (МН+); tR=2,00, (UV, ELSD) 99%, 100%. 2e. 2-Циклопентил-N-2,6-диметил-4-[2-(4-трифторметилфенил)тиоморфолин-4-ил]фенилацетамид. Выход: 6%. LC-MC (m/z) 477 (МН+); tR=3,64, (UV, ELSD) 95%, 100%. 2f. N-4-[2-(2-Хлорфенил)тиоморфолин-4-ил]-2,6-диметилфенил-2-циклопентилацетамид. Выход: 20%. LC-MC-TOF (m/z) 444 (МН+); tR=3,59, (UV, ELSD) 89%, 100%. 2g. 2-Циклопентил-N-2,6-диметил-4-[2-(4-трифторметилфенил)морфолин-4-ил]фенилацетамид. Выход: 26%. LC-MC (m/z) 461 (МН+); tR=3,55, (UV, ELSD) 90%, 95%. 2h. N-4-[2-(2-Хлорфенил)морфолин-4-ил]-2,6-диметилфенил-2-циклопентилацетамид. Выход: 35%. LC-MC (m/z) 427 (МН+); tR=3,44, (UV, ELSD) 77%, 95%. 2i. 2-Циклопентил-N-4-[2-(4-фторфенил)морфолин-4-ил]-2,6-диметилфенилацетамид. Выход: 17%. LC-MC (m/z) 411 (МН+); tR=3,17, (UV, ELSD) 98%, 99%.- 25015120 Пример 3. 3 а. 2-Бицикло[2.2.1]гепт-2-ил-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид. Бицикло[2.2.1]гепт-2-илуксусную кислоту (0,41 г) нагревают до 50 С в течение 2 ч в атмосфере аргона в смеси 1:1 тионилхлорида и 1,2-дихлорэтана (10 мл всего). Растворители удаляют в вакууме и полученный хлорангидрид снова растворяют в ацетонитриле (5 мл) и добавляют 2,6-диметил-4-морфолин 4-илфениламин (0,50 г). Реакционную смесь нагревают до 150 С в течение 10 мин в запаянной ампуле для микроволновой обработки. Добавляют воду (25 мл) и продукт экстрагируют этилацетатом (325 мл). Объединенные органические фазы промывают солевым раствором (50 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт очищают, используя флэш-хроматографию, получая 0,074 г(9%) указанного в заголовке соединения в виде твердого вещества не совсем белого цвета.(м, 1 Н), 2,20 (м, 2 Н), 3,05 (м, 4 Н), 3,71 (м, 4 Н), 6,62 (с, 2 Н), 8,92 (с, 1 Н). Следующие соединения получают аналогичным образом. 3b. 2-Циклогексил-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид. Выход: 19%. LC-MC-TOF (m/z) 331 (МН+); tR=2,21, (UV, ELSD) 97%, 100%. 1 Н ЯМР (500 МГц, ДМСО-d6): 0,98 (м, 2 Н), 1,22 (м, 4 Н), 1,68 (м, 6 Н), 2,07 (с, 6 Н), 2,15 (д, 2 Н), 3,05(с, 2 Н), 7,10 (м, 1 Н), 7,34 (м, 2 Н), 8,97 (с, 1 Н). Пример 4. 4 а. 2-Циклопентил-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид. 2,6-Диметил-4-морфолин-4-илфениламин (0,50 г) и циклопентилацетилхлорид (0,53 мл) растворяют в ацетонитриле (5 мл) и нагревают до 150 С в течение 10 мин в запаянной ампуле для микроволновой обработки. Добавляют воду (25 мл) и продукт экстрагируют этилацетатом (325 мл). Органические фазы промывают солевым раствором (50 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт очищают, используя флэш-хроматографию, получая 0,138 г (20%) указанного в заголовке соединения в виде твердого вещества не совсем белого цвета.(м, 1 Н), 2,25 (д, 2 Н), 3,05 (дд, 4 Н), 3,71 (дд, 4 Н), 6,63 (с, 2 Н), 8,94 (с, 1 Н). Следующие соединения получают аналогичным образом. 4b. Бутиловый эфир (2,6-диметил-4-морфолин-4-илфенил)карбаминовой кислоты. Выход: 2%. LC-MC-TOF (m/z) 307 (МН+); tR=2,25, (UV/ELSD) 99%, 100%. 4 с. 2-(4-Хлорфенил)-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид. Выход: 8%. LC-MC-TOF (m/z) 359 (МН+); tR=2,16, (UV, ELSD) 98%, 100%. 1 Н ЯМР (500 МГц, ДМСО-d6): 2,01 (с, 6 Н), 3,04 (дд, 4 Н), 3,60 (с, 2 Н), 3,71 (дд, 4 Н), 6,62 (с, 2 Н), 7,39(м, 4 Н), 3,71 (м, 4 Н), 6,63 (с, 2 Н), 8,94 (с, 1 Н). Пример 5. 5 а. 2-Циклогептил-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид. Циклогептилуксусную кислоту (0,45 г) и одну каплю N,N-диметилформамида перемешивают при 25 С в течение 2 ч в атмосфере аргона в смеси 1:1 оксалилхлорида (2 М в дихлорметане) и 1,2-дихлорэтана (12 мл всего). Растворители удаляют в вакууме и полученный хлорангидрид снова растворяют в ацетонитриле (8 мл), добавляют 2,6-диметил-4-морфолин-4-илфениламин (0,50 г) и окись магния (0,20 г). Реакционную смесь перемешивают при 25 С в течение 16 ч в атмосфере аргона и затем фильтруют через целит (10 г). Органическую фазу концентрируют в вакууме и сырой продукт очищают,используя флэш-хроматографию, получая 0,133 г (16%) указанного в заголовке соединения в виде твердого вещества не совсем белого цвета.(с, 6 Н), 2,18 (д, 2 Н), 3,05 (м, 4 Н), 3,71 (м, 4 Н), 6,63 (с, 2 Н), 8,94 (с, 1 Н). Пример 6. 6 а. Бензиловый эфир (2,6-диметил-4-морфолин-4-илфенил)карбаминовой кислоты. Бензилхлорформиат (32 мг) добавляют к раствору 0,15 М 2,6-диметил-4-морфолин-4-илфениламина и 0,30 М N,N-диизопропилэтиламина в 1,2-дихлорэтане (1 мл). Ампулу встряхивают в течение 16 ч и содержимое концентрируют в вакууме. Добавляют водный раствор гидроксида натрия (1 М, 2 мл) и сырую смесь экстрагируют смесью изопропилацетат/тетрагидрофуран (4:1, 2,5 мл). Органическую фазу концентрируют в вакууме и снова растворяют в диметилсульфоксиде (0,5 мл), 0,2 мл которого обрабатывают, используя препаративную очистку LC-MC, получая 9,5 мг (47% выход) указанного в заголовке соединения в виде масла.LC-MC (m/z) 341 (МН+); tR=2,28, (UV, ELSD) 100%, 100%. Следующие соединения получают аналогичным образом. 6b. 2-Хлорбензиловый эфир (2,6-диметил-4-морфолин-4-илфенил)карбаминовой кислоты. Выход: 33%. LC-MC (m/z) 375 (МН+); tR=2,53, (UV, ELSD) 99%, 100%. 6 с. (2,6-Диметил-4-морфолин-4-илфенил)амид 3,5,5-триметилгексановой кислоты. Выход: 36%. LC-MC (m/z) 347 (МН+); tR=2,53, (UV, ELSD) 99%, 100%. 6d. (2,6-Диметил-4-морфолин-4-илфенил)амид октановой кислоты. Выход: 47%. LC-MC (m/z) 333 (МН+); tR=2,47, (UV, ELSD) 99%, 100%. 6 е. (2,6-Диметил-4-морфолин-4-илфенил)амид гептановой кислоты Выход: 40%. LC-MC (m/z) 319 (МН+); tR=2,20, (UV, ELSD) 91%, 99%. 6f. N-(2,6-Диметил-4-морфолин-4-илфенил)-2-фенилацетамид Выход: 35%. LC-MC (m/z) 325 (МН+); tR=1,80, (UV, ELSD) 99%, 100%. Пример 7. 7 а. 2-(3,4-Дихлорфенил)-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид. 3,4-Дихлорфенилуксусную кислоту (39 мг) перемешивают при 25 С в течение 2 ч в атмосфере аргона в смеси 1:1 оксалилхлорида (2 М в дихлорметане) и 1,2-дихлорэтана (1 мл всего). Растворители удаляют в вакууме и к полученному хлорангидриду добавляют раствор 0,15 М 2,6-диметил-4-морфолин-4 илфениламина и 0,30 М N,N-диизопропилэтиламина в 1,2-дихлорэтане (1 мл). Ампулу встряхивают в течение 16 ч и содержимое концентрируют в вакууме. Добавляют водный раствор гидроксида натрия(1 М, 2 мл) и сырую смесь экстрагируют смесью изопропилацетат/тетрагидрофуран (4:1, 2,5 мл). Органическую фазу концентрируют в вакууме и снова растворяют в диметилсульфоксиде (0,5 мл), 0,2 мл раствора обрабатывают, используя препаративную очистку LC-MC, получая 2,7 мг (11% выход) указанного в заголовке соединения в виде масла.LC-MC (m/z) 394 (МН+); tR=2,40, (UV, ELSD) 80%, 100%. Следующие соединения получают аналогичным образом. 7b. 2-(4-Аллилокси-3-хлорфенил)-N-(2,6-диметил-4-морфолин-4-илфенил)ацетамид. Выход: 14%. LC-MC (m/z) 415 (МН+); tR=2,40, (UV, ELSD) 91%, 100%. 7 с. N-(2,6-Диметил-4-морфолин-4-илфенил)-2-(3-трифторметилфенил)ацетамид. Выход: 18%. LC-MC (m/z) 393 (МН+); tR=2,31, (UV, ELSD) 97%, 100%. 7d. N-(2,6-Диметил-4-морфолин-4-илфенил)-2-нафталин-2-илацетамид. Выход: 16%. LC-MC (m/z) 375 (МН+); tR=2,27, (UV, ELSD) 83%, 100%. 7 е. 3-(3-Хлорфенил)-N-(2,6-диметил-4-морфолин-4-илфенил)пропионамид. Выход: 10%. LC-MC (m/z) 373 (МН+); tR=2,23, (UV, ELSD) 71%, 94%. 7f. N-(2,6-Диметил-4-морфолин-4-илфенил)-2-(3,4-диметилфенил)ацетамид. Выход: 44%. LC-MC (m/z) 353 (МН+); tR=2,21, (UV, ELSD) 80%, 100%.N-[(диметиламино)-1 Н-1,2,3-триазоло[4,5-b]пиридин-1-илметилен]-N-метилметанаминия (1,66 г) смешивают в сухом N,N-диметилформамиде (3 мл) и перемешивают в атмосфере аргона в течение 2 мин. К реакционной смеси добавляют 2,6-диметил-4-морфолин-4-илфениламин (0,50 г), растворенный в сухомN,N-диметилформамиде (2 мл), и смесь перемешивают при 25 С в атмосфере аргона в течение 16 ч. Добавляют этилацетат (20 мл) и органическую фазу промывают смесью насыщенный водный раствор хлорида аммония/вода (1:1, 20 мл), водой (20 мл), смесью солевой раствор/вода (1:1, 20 мл), сушат над сульфатом магния, концентрируют в вакууме и очищают, используя флэш-хроматографию, получая 0,28 г(40% выход) указанного в заголовке соединения в виде твердого вещества белого цвета.(т, 4 Н), 3,71 (т, 4 Н), 6,62 (с, 2 Н), 8,94 (с, 1 Н). Следующие соединения получают аналогичным образом. 7 о. (2,6-Диметил-4-морфолин-4-илфенил)амид 4-метилпентановой кислоты. Выход: 28%. LC-MC (m/z) 305 (МН+); tR=1,88, (UV, ELSD) 98%, 99%. 1 Н ЯМР (500 МГц, ДМСО-d6): 0,91 (д, 6 Н), 1,49 (м, 2 Н), 1,57 (м, 1 Н), 2,06 (с, 6 Н), 2,27 (т, 2 Н), 3,05(т, 4 Н), 4,99 (дд, 1 Н), 5,04 (дд, 1 Н), 5,84 (м, 1 Н), 6,63 (с, 2 Н), 8,95 (с, 1 Н). 7t. (2,6-Диметил-4-морфолин-4-илфенил) амид 3-этилпентановой кислоты. 3-Этилпентановую кислоту (0,79 г) и тионилхлорид (0,44 мл) смешивают в ацетонитриле (10 мл) и нагревают до 110 С в течение 5 мин в запаянной ампуле для микроволновой обработки. К реакционной смеси добавляют 2,6-диметил-4-морфолин-4-илфениламин (1,25 г), растворенный в ацетонитриле(10 мл) и нагревают до 150 С в течение 15 мин в запаянной ампуле для микроволновой обработки. К сырой смеси добавляют смесь насыщенный водный раствор бикарбоната натрия/солевой раствор/вода(1:1:1, 50 мл) и ее экстрагируют этилацетатом (350 мл). Объединенные органические фазы сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт перекристаллизовывают из горячего толуола, и продукт собирают фильтрованием, промывают холодным толуолом и сушат в вакууме, получая 0,59 г (30% выход) указанного в заголовке соединения в виде твердого вещества не совсем белого цвета.(1b,15 мг),3-пиридилбороновую кислоту (21 мг), водный раствор карбоната калия (5 М, 90 мкл) и ацетат палладия(II) (1 мг) смешивают в ацетоне (2 мл) и нагревают до 130 С в течение 20 мин в запаянной ампуле для микроволновой обработки. Реакционную смесь фильтруют через диоксид кремния (500 мг), концентрируют в вакууме, снова растворяют в диметилсульфоксиде (0,5 мл) и очищают, используя препаративнуюLC-MC (m/z) 434 (МН+); tR=1,89, (UV,ELSD) 99%, 99%. Следующие соединения получают аналогичным образом. 8b. 2-Циклопентил-N-(5-морфолин-4-ил-3-трифторметилбифенил-2-ил)ацетамид. Выход: 46%. LC-MC (m/z) 433 (МН+); tR=3,16, (UV, ELSD) 96%, 99%. 8 с. 2-Циклопентил-N-(4'-фтор-5-морфолин-4-ил-3-трифторметилбифенил-2-ил)ацетамид. Выход: 20%. LC-MC (m/z) 451 (МН+); tR=3,18, (UV, ELSD) 99%, 99%. 8d. 2-Циклопентил-N-(4'-метил-5-морфолин-4-ил-3-трифторметилбифенил-2-ил)ацетамид. Выход: 51%. LC-MC (m/z) 447 (МН+); tR=3,32, (UV, ELSD) 97%, 99%. 8 е. 2-Циклопентил-N-(3'-метил-5-морфолин-4-ил-3-трифторметилбифенил-2-ил)ацетамид. Выход: 37%. LC-MC (m/z) 447 (МН+); tR=3,33, (UV, ELSD) 99%, 99%. 8f. 2-Циклопентил-N-(3',4'-дифтор-5-морфолин-4-ил-3-трифторметилбифенил-2-ил)ацетамид. Выход: 51%. LC-MC (m/z) 469 (МН+); tR=3,29, (UV, ELSD) 99%, 99%. 8g. 2-(4-Фтор фенил)-N-(4-морфолин-4-ил-2-пиридин-3-ил-6-трифторметилфенил)ацетамид. Выход: 25%. LC-MC (m/z) 460 (МН+); tR=1,81, (UV, ELSD) 94%, 99%. Пример 9. 9 а. 2-Циклопентил-N-(2,6-диэтил-4-морфолин-4-илфенил)ацетамид.(0,95 мл) и воду (50 мкл) перемешивают при 40 С в течение 3 ч. Добавляют лед (30 мл) и воду (30 мл) и полученную смесь подщелачивают, используя твердый карбонат калия. Полученную смесь экстрагируют этилацетатом (320 мл), объединенные органические фазы сушат над сульфатом натрия и концентрируют в вакууме. Остаток снова растворяют в тетрагидрофуране (1 мл) и смешивают с пиридином (49 мкл) и циклопентилацетилхлоридом (44 мкл). Полученную смесь перемешивают в течение 1 ч при 25 С, разбавляют этилацетатом (20 мл) и промывают 10% водным раствором бикарбоната натрия (20 мл) и солевым раствором (20 мл). Органическую фазу сушат над сульфатом натрия, концентрируют в вакууме и очищают, используя флэш-хроматографию, получая 35 мг (51%) указанного в заголовке соединения в виде твердого вещества желто-коричневого цвета.LC-MC (m/z) 345 (МН+); tR=2,27, (UV, ELSD) 84%, 98%. 9b. 2-Циклопентил-N-(2,6-диизопропил-4-морфолин-4-илфенил)ацетамид. К раствору 2,6-диизопропил-4-морфолин-4-илфениламина (279 мг) и пиридина (245 мкл) в тетрагидрофуране (2 мл) добавляют циклопентилацетилхлорид (210 мкл) и полученную смесь перемешивают в течение 1 ч при 25 С. Реакционную смесь разбавляют этилацетатом (20 мл), промывают 10% водным раствором бикарбоната натрия (20 мл) и солевым раствором (20 мл). Органическую фазу сушат над сульфатом натрия, концентрируют в вакууме и очищают, используя флэш-хроматографию. В результате перекристаллизации сырого материала коричневого цвета из горячей смеси этилацетат/гептан получают 122 мг (33%) указанного в заголовке соединения в виде твердого вещества белого цвета.H ЯМР (500 МГц, CDCl3): 1,19 (д, 12 Н), 1,27 (м, 2 Н), 1,60 (м, 2 Н), 1,68 (м, 2 Н), 1,93 (м, 2 Н), 2,40 (м,1 Н), 2,41 (м, 2 Н), 3,05 (м, 2 Н), 3,17 (м, 4 Н), 3,87 (м, 4 Н), 6,49 (с, 1 Н), 6,70 (с, 2 Н). Пример 10. 10 а. 2-Циклопентил-N-(2,6-дифтор-4-морфолин-4-илфенил)ацетамид. 2,6-Дифтор-4-морфолин-4-илфениламин (0,20 г) и циклопентилацетилхлорид (149 мкл) растворяют в ацетонитриле (4 мл) и нагревают до 150 С в течение 10 мин в запаянной ампуле для микроволновой обработки. Реакционную смесь концентрируют в вакууме и очищают, используя флэш-хроматографию,получая 228 мг (75%) указанного в заголовке соединения в виде твердого вещества белого цвета.(д, 2 Н), 3,14 (м, 4 Н), 3,70 (м, 4 Н), 6,68 (д, 2 Н), 9,20 (с, 1 Н). Следующие соединения получают аналогичным образом. 10b. (2,6-Дифтор-4-морфолин-4-илфенил)амид гексановой кислоты. Выход: 84%. LC-MC (m/z) 313 (МН+); tR=2,60, (UV, ELSD) 99%, 98%. 1 Н ЯМР (500 МГц, ДМСО-d6): 0,87 (т, 3 Н), 1,29 (м, 4 Н), 1,57 (квинтет, 2 Н), 2,27 (т, 2 Н), 3,14 (т, 4 Н),3,70 (т, 4 Н), 6,68 (д, 2 Н), 9,22 (с, 1 Н). 10 с. N-(2,6-Дифтор-4-морфолин-4-илфенил)-3,3-диметилбутирамид. Выход: 58%. LC-MC (m/z) 313 (МН+); tR=2,49, (UV, ELSD) 99%, 99%.
МПК / Метки
МПК: A61K 31/541, C07D 295/12, A61P 25/22, A61K 31/4406, A61K 31/5355, C07D 279/12, C07D 265/06, C07D 417/04
Метки: производные, замещенные, морфолина, тиоморфолина
Код ссылки
<a href="https://eas.patents.su/30-15120-zameshhennye-proizvodnye-morfolina-i-tiomorfolina.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные морфолина и тиоморфолина</a>
Предыдущий патент: Многокомпонентный фильтр с улучшенным усилением аромата
Следующий патент: Способ и аппарат для конверсии биомассы
Случайный патент: Способ удаления sox из газа с использованием полиэтиленгликоля












