Производные морфолина в качестве ингибиторов повторного захвата норадреналина
Номер патента: 9960
Опубликовано: 28.04.2008
Авторы: Касес-Томас Мануэль Хавьер, Ман Тереза, Мастерс Джон Джозеф, Вальтер Магнус Вильхельм, Кэмпбелл Гордон Ян, Рюдик Элен Катрин Эжени
Формула / Реферат
1. Соединение формулы
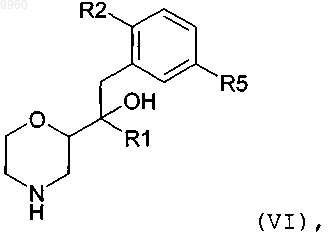
в которой R1 представляет собой C1-C6алкил (необязательно замещенный 1, 2 или 3 атомами фтора) или C3-C6циклоалкил, где одна связь C-C в циклоалкильном компоненте необязательно заменяется на связь O-C;
R2 представляет собой C1-C4алкил (необязательно замещенный 1, 2 или 3 атомами фтора),
C1-C4алкокси (необязательно замещенный 1, 2 или 3 атомами фтора) или фенил (необязательно замещенный 1, 2 или 3 атомами фтора); и R5 представляет собой Н или F; или его фармацевтически приемлемая соль.
2. Соединение по п.1 формулы
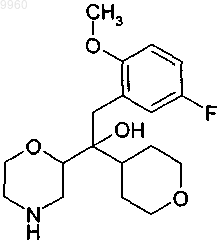
или его фармацевтически приемлемая соль.
3. Соединение по п.1 формулы
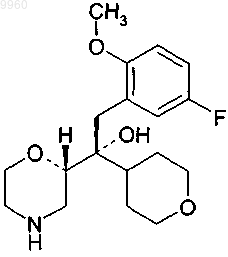
или его фармацевтически приемлемая соль.
4. Гидрохлоридная соль соединения по п.2 или 3.
5. Фармацевтическая композиция, содержащая соединение по любому из пп.1-3 или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым разбавителем, эксципиентом или носителем.
6. Применение соединения по любому из пп.1-3 или его фармацевтически приемлемой соли в терапии для лечения ADHD, когнитивных расстройств, расстройства поведения, депрессии, оппозиционного вызывающего расстройства, приливов или вазомоторных симптомов.
7. Применение соединения по любому из пп.1-3 или его фармацевтически приемлемой соли для производства медикамента для лечения ADHD, когнитивных расстройств, расстройства поведения, депрессии, оппозиционного вызывающего расстройства, приливов или вазомоторных симптомов.
8. Способ получения соединения формулы (VI), включающий стадию снятия защитной группы соединения формулы
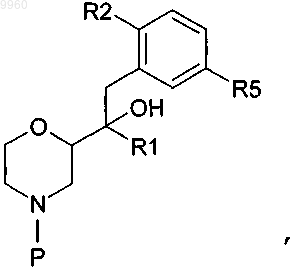
в которой Р представляет собой N-защитную группу и все другие радикалы являются такими, как определено для формулы (VI) в п.1, с получением соединения формулы (VI), необязательно с последующей стадией образования фармацевтически приемлемой соли.
Текст
009960 Данное изобретение относится к новым соединениям морфолина и к их использованию в селективном ингибировании повторного захвата норадреналина. Селективное ингибирование повторного захвата норадреналина является относительно новым методом действия для лечения аффективных расстройств. Обнаружено, что норадреналин играет важную роль в нарушениях вегетативной функции, связанной с аффективными, тревожными и когнитивными расстройствами. Атомоксетина гидрохлорид является селективным ингибитором повторного захвата норадреналина и производится для лечения гиперактивного расстройства дефицита внимания (ADHD). Ребоксетин также является селективным ингибитором повторного поглощения норадреналина и производится для лечения депрессии. В WO 99/15177 раскрыто использование ребоксетина для леченияWO 2004/018441 раскрыты определенные производные морфолина в качестве селективных ингибиторов повторного захвата норадреналина. В соответствии с настоящим изобретением обеспечено соединение формулыRy представляет собой Н или C1-C4 алкил; каждая группа Rz независимо представляет собой Н или C1-C4 алкил, при условии, что не больше,чем 3 группы Rz могут быть C1-C4 алкилом;C-C в циклоалкильном компоненте необязательно заменяется на связь O-C, S-C или С=С;C4-С 7 циклоалкилалкил (необязательно замещенный 1, 2 или 3 атомами галогена и/или 1 заместителем,выбранным из C1-C4 алкокси и гидрокси), где одна связь C-C в циклоалкильном компоненте необязательно заменяется на связь O-C, S-C или С=С; или CH2Ar2; иAr1 и Ar2 каждый независимо представляет собой фенильное кольцо либо 5- или 6-членное гетероарильное кольцо, каждое из которых необязательно замещено 1, 2 или 3 заместителями (в зависимости от числа доступных положений замещения), каждый заместитель независимо выбран из C1-C4 алкила (необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкокси (необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкилтио (необязательно замещенного 1, 2 или 3 атомами галогена),-СО-О(C1-C4 алкил), циано, -NRR, -CONRR, гало и гидрокси, и/или 1 заместителем, выбранным из пиридила, тиофенила, фенила, бензила и фенокси, каждый из которых необязательно замещен в кольце 1, 2 или 3 заместителями, каждый заместитель независимо выбран из галогена, C1-C4 алкила (необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкокси (необязательно замещенного 1, 2 или 3 атомами галогена), карбокси, нитро, гидрокси, циано, -NRR, -CONRR, SO2NRR и SO2R; и каждый R независимо представляет собой Н или C1-C4 алкил; или его фармацевтически приемлемая соль. В данном описании термин " C1-C4 алкил" означает моновалентный незамещенный насыщенный углеводородный радикал с прямой или разветвленной цепью, который имеет от 1 до 4 атомов углерода. Таким образом, термин " C1-C4 алкил" включает, например, метил, этил, н-пропил, изопропил, н-бутил,изобутил, втор-бутил и трет-бутил. В данном описании термин " C1-C4 алкокси" означает моновалентный незамещенный насыщенный углеводородный радикал с прямой или разветвленной цепью, который имеет от 1 до 4 атомов углерода,связанный с замещаемым положением с помощью двухвалентного радикала О. Таким образом, термин "C1-C4 алкокси" включает, например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси,втор-бутокси и трет-бутокси. В данном описании термин " C1-C4 алкилтио" означает моновалентный незамещенный насыщенный углеводородный радикал с прямой или разветвленной цепью, который имеет от 1 до 4 атомов углерода,связанный с замещаемым положением с помощью двухвалентного радикала S. Таким образом, термин "-1 009960 В данном описании термин "C3-C6 циклоалкил" означает моновалентный незамещенный насыщенный циклический углеводородный радикал, который имеет от 3 до 6 атомов углерода. Таким образом,термин "C3-C6 циклоалкил" включает, например, циклопропил, циклобутил, циклопентил и циклогексил. В данном описании термин "C4-С 7 циклоалкилалкил" означает моновалентный незамещенный насыщенный циклический углеводородный радикал, который имеет от 3 до 6 атомов углерода, связанный с замещаемым положением с помощью двухвалентного незамещенного насыщенного углеводородного радикала с прямой или разветвленной цепью, который имеет, как минимум 1 атом углерода. Таким образом, термин "C4-С 7 циклоалкил" включает, например, циклопропилметил, циклопропилэтил, циклобутилметил, циклопентилметил и циклогексилметил. В данном описании фраза "где одна связь C-C в циклоалкильном компоненте необязательно заменяется на связь O-C, S-C или C=C" означает, что или (i) любые два соседних атома углерода в цилкоалкильном кольце могут быть связаны с помощью двойной связи предпочтительнее, чем с помощью одинарной связи (с, соответственно, уменьшенным количеством заместителей на каждом атоме углерода),или (ii) один из любых двух соседних атомов C в цилкоалкильном кольце (и любые заместители на них) могут быть заменены на атом кислорода или серы. Примеры групп, включенных в эту фразу, когда она используется в сочетании с термином C3-C6 циклоалкил, включают, например и Примеры групп, включенных в эту фразу, когда она используется в сочетании с терминомC4-С 7 циклоалкилалкил, включают, например и В данном описании термин "C2-C6 алкенил" означает моновалентный незамещенный ненасыщенный углеводородный радикал с прямой или разветвленной цепью, который имеет от 2 до 6 атомов углерода и который содержит, как минимум, одну углерод-углеродную двойную связь. Таким образом, термин"C1-C4 алкенил" включает, например, этенил, пропенил, 2-метил-2-пропенил и бутенил. В данном описании термин "C3-C6 циклоалкокси" означает моновалентный незамещенный насыщенный циклический углеводородный радикал, который имеет от 3 до 6 атомов углерода в кольце, связанном с замещаемым положением с помощью двухвалентного радикала О. Таким образом, термин"C3-C6 циклоалкоксил" включает, например, циклопропокси. В данном описании термин "C1-C4 алкилсульфонил" означает моновалентный незамещенный насыщенный углеводородный радикал с прямой или разветвленной цепью, который имеет от 1 до 4 атомов углерода, связанный с замещаемым положением с помощью двухвалентного радикала SO2. Таким образом, термин "C1-C4 алкилсульфонил" включает, например, метилсульфонил. В данном описании термины, подобные упомянутым выше определениям, конкретизирующим различное количество атомов С, имеют аналогичное значение. В частности, "C1-C6 алкил" означает моновалентный незамещенный насыщенный углеводородный радикал с прямой или разветвленной цепью, который имеет от 1 до 6 атомов углерода. Таким образом, термин "C1-C6 алкил" представляет большее число соединений, чем включено в подгруппу "C1-C4 алкил", и также включает, например, н-пентил,3-метилбутил, 2-метилбутил, 1-метилбутил, 2,2-диметилпропил, н-гексил, 4-метилпентил и 3-метилпентил. В частности, "C1-C2 алкил" означает моновалентный незамещенный насыщенный углеводородный радикал, который имеет 1 или 2 атома углерода. Таким образом, термин "C1-C2 алкил" представляет подгруппу соединений в пределах термина "C1-C4 алкил" и включает метил и этил. В данном описании термин "гало" или "галоген" означает F, Cl, Br или I. В данном описании термин "фенокси" означает моновалентный незамещенный фенильный радикал,связанный с замещаемым положением с помощью двухвалентного радикала О. В данном описании термин "5-членное гетероарильное кольцо" означает 5-членное ароматическое кольцо, включающее один или более гетероатомов, каждый из которых независимо выбран из N, О и S. Предпочтительно в кольце присутствуют не более трех гетероатомов. Более предпочтительно в кольце присутствуют не более двух гетероатомов. Более предпочтительно в кольце присутствует не более одного гетероатома. Термин включает, например, тиазолил, изотиазолил, оксазолил, изоксазолил, тиофенил,фуранил, пирролил, имидазолил, триазолил, оксадиазолил и тиадиазолил."Тиадиазолил", как используется в данном изобретении, включает 4- и 5-(1,2,3-тиадиазолил),3- и 5-(1,2,4-тиадиазолил), 3-(1,2,5-тиадиазолил), 2-(1,3,4-тиадиазолил). В данном описании "6-членное гетероарильное кольцо" означает 6-членное ароматическое кольцо,включающее один или более гетероатомов, каждый из которых независимо выбран из N, О и S. Предпочтительно в кольце присутствуют не более трех гетероатомов. Более предпочтительно в кольце присутствуют не более двух гетероатомов. Более предпочтительно в кольце присутствует не более одного гетероатома. Термин включает, например, пиридил, пиримидил, пиразинил, пиридазинил и триазинил."Триазинил", как используется в данном изобретении, включает 2-(1,3,5-триазинил),3-, 5- и 6-(1,2,4-триазинил) и 4- и 5-(1,2,3-триазинил). В данном описании термин "орто" относится к положению на ароматическом кольце Ar1, которое является соседним к положению, в котором Ar1 связан с остальной частью соединения формулы (I). В данном описании термин "N-защитная группа" означает функциональную группу, которая делает атом N, к которому она присоединена, химически неактивным при реакционных условиях, которымN-защищенное соединение впоследствии подвергается, за исключением случаев, когда указанный защищенный атом N также связанный с атомом Н, и за исключением случаев, когда такие условия специально выбраны для удаления N-защитной группы. Выбор N-защитной группы будет зависеть от последующих реакционных условий, и подходящие N-защитные группы для заданных ситуаций будут известны специалисту в данной области техники. Дополнительная информация относительно подходящихN-защитных групп, включая способы их введения и снятия, содержится в хорошо известном руководстве"Protective Groups in Organic Synthesis", Theodora W. Greene and Peter G.M. Wuts, John WileySons, Inc.,New York, 1999, p. 494-653. Примеры N-защитных групп включают карбаматные защитные группы -CO-ORA, где RA, например, представляет собой метил, этил,9-флуоренилметил (Fmoc), 2,2,2-трихлорэтил (Troc), 2-триметилсилилэтил (Teoc), трет-бутил (Boc),аллил (Alloc), бензил (Cbz) или р-метоксибензил (Moz); амидные защитные группы -CO-RB, где RB представляет собой, например, Н, метил, бензил или фенил; алкиламинные защитные группы -RC, где RC, например, представляет собой метил, трет-бутил,аллил, [2-(триметилсилилэтокси]метил, бензил, 4-метоксибензил, 2,4-диметоксибензил, дифенилметил или трифенилметил (тритил); сульфонамидные защитные группы -SO2-RD, где RD, например, представляет собой метил, бензил,фенил или фенил, замещенный от 1 до 5 заместителями, каждый из которых независимо выбран из метила, трет-бутила, метокси и нитро. В некоторых случаях используемые реакционные условия означают, что обычно предпочтительными являются N-защитные группы, стойкие при сильно основных условиях и/или в присутствии сильных нуклеофилов (таких как металлоорганические реагенты). Примеры таких предпочтительныхN-защитных групп включают алкиламинные защитные группы -RC, где RC, например, представляет собой метил, трет-бутил, аллил, [2-(триметилсилил)этокси]метил, бензил, 4-метоксибензил,2,4-диметоксибензил, дифенилметил или трифенилметил (тритил). Бензил является особенно предпочтительной N-защитной группой. В предпочтительном осуществлении настоящего изобретения X представляет собой ОН,C1-C4 алкокси или NH2. Более предпочтительно X представляет собой OH или NH2. Наиболее предпочтительно X представляет собой ОН. В предпочтительном осуществлении настоящего изобретения Rx представляет собой Н или метил. Наиболее предпочтительно Rx представляет собой Н. В предпочтительном осуществлении настоящего изобретения Ry представляет собой Н или метил. Наиболее предпочтительно Ry представляет собой Н. В предпочтительном осуществлении настоящего изобретения каждая группа Rz независимо представляет собой Н или метил при условии, что не больше, чем 3 группы Rz могут быть метилом. Наиболее предпочтительно каждый Rz представляет собой Н. В предпочтительном осуществлении настоящего изобретения R1 представляет собой C1-C6 алкилC1-C6 алкил (необязательно замещенный 1, 2 или 3 атомами галогена и/или 1 заместителем, выбранным из C1-C4 алкокси (необязательно замещенного 1, 2 или 3 атомами фтора), циано и гидрокси). Более предпочтительно R1 представляет собой C1-C6 алкил (необязательно замещенный 1, 2 или 3 атомами галогена). Более предпочтительно R1 представляет собой C1-C6 алкил (необязательно замещенный 1, 2 или 3 атомами фтора). Примеры характерных значений для R1 в пределах данного осуществления включают метил, этил, изопропил, изобутил, н-бутил, 3,3,3-трифторпропил и 4,4,4-трифторбутил. В предпочтительном осуществлении настоящего изобретения R1 представляет собой C2-C6 алкенил(необязательно замещенный 1, 2 или 3 атомами галогена). В предпочтительном осуществлении настоящего изобретения R1 представляет собойC3-C6 циклоалкил (необязательно замещенный 1, 2 или 3 атомами галогена и/или 1 заместителем, выбранным из C1-C4 алкокси и гидрокси), где одна связь C-C в циклоалкильном компоненте необязательно заменяется на связь O-C, S-C или С=С. Более предпочтительно R1 представляет собой C3-C6 циклоалкилC1-C4 алкокси и гидрокси), где одна связь C-C в циклоалкильном компоненте необязательно заменяется на связь O-C. Более предпочтительно R1 представляет собой C3-C6 циклоалкил, где одна связь C-C в циклоалкильном компоненте необязательно заменяется на связь O-C. Примеры характерных значений дляR1 в пределах данного осуществления включают циклопропил, циклопентил и тетрагидропиранил (в частности тетрагидро-2 Н-пиран-4-ил). В предпочтительном осуществлении настоящего изобретения R1 представляет собойC3-C6 циклоалкил (необязательно замещенный 1, 2 или 3 атомами галогена и/или 1 заместителем, выбранным из C1-C4 алкокси и гидрокси). Более предпочтительно R1 представляет собой C3-C6 циклоалкил. Примеры характерных значений для R1 в пределах данного осуществления включают циклопропил и циклопентил. В предпочтительном осуществлении настоящего изобретения R1 представляет собойC3-C6 циклоалкил (необязательно замещенный 1, 2 или 3 атомами галогена и/или 1 заместителем, выбранным из C1-C4 алкокси и гидрокси), где одна связь C-C в циклоалкильном компоненте заменяется на связь O-C, S-C или С=С. Более предпочтительно R1 представляет собой C3-C6 циклоалкил (необязательно замещенный 1, 2 или 3 атомами галогена и/или 1 заместителем, выбранным из C1-C4 алкокси и гидрокси),где одна связь C-C в циклоалкильном компоненте заменяется на связь O-C. Более предпочтительно R1 представляет собой C3-C6 циклоалкил, где одна связь C-C в циклоалкильном компоненте заменяется на связь O-C. Пример характерного значения для R1 в пределах данного осуществления представляет собой тетрагидропиранил (в частности, тетрагидро-2 Н-пиран-4-ил). В предпочтительном осуществлении настоящего изобретения R1 представляет собойC4-С 7 циклоалкилалкил (необязательно замещенный 1, 2 или 3 атомами галогена и/или 1 заместителем,выбранным из C1-C4 алкокси и гидрокси), где одна связь C-C в циклоалкильном компоненте необязательно заменяется на связь O-C, S-C или С=С. В предпочтительном осуществлении настоящего изобретения R1 представляет собойC4-С 7 циклоалкилалкил (необязательно замещенный 1, 2 или 3 атомами галогена и/или 1 заместителем,выбранным из C1-C4 алкокси и гидрокси). В предпочтительном осуществлении настоящего изобретения R1 представляет собойC4-С 7 циклоалкилалкил (необязательно замещенный 1, 2 или 3 атомами галогена и/или 1 заместителем,выбранным из C1-C4 алкокси и гидрокси), где одна связь C-C в циклоалкильном компоненте необязательно заменяется на связь O-C, S-C или С=С. В предпочтительном осуществлении настоящего изобретения R1 представляет собой CH2Ar2, гдеAr2 является таким, как определено выше. Более предпочтительно R1 представляет собой CH2Ar2, где Ar2 представляет собой фенильное или пиридильное (предпочтительно 2-пиридильное) кольцо, каждое из которых может быть замещено 1, 2 или 3 заместителями, каждый заместитель независимо выбран изC1-C4 алкила (необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкокси (необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкилтио (необязательно замещенного 1, 2 или 3 атомами галогена), гало и гидрокси. Более предпочтительно R1 представляет собой CH2Ar2, где Ar2 представляет собой фенильное кольцо, необязательно замещенное, как описано в предыдущем предложении. Более предпочтительно R1 представляет собой CHrAr2, где Ar2 представляет собой фенильное кольцо, необязательно замещенное 1 или 2 заместителями, каждый заместитель независимо выбран из C1-C4 алкила (необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкокси (необязательно замещенного 1, 2 или 3 атомами галогена), гало и гидрокси. Примеры характерных значений для R1 в пределах данного осуществления включают фенилметил и (2-метоксифенил) метил.-4 009960 В предпочтительном осуществлении настоящего изобретения Ar1 представляет собой фенильное кольцо либо 5- или 6-членное гетероарильное кольцо; каждое из которых замещено в орто-положении заместителем, выбранным из C1-C4 алкила (необязательно замещенного 1, 2 или 3 атомами галогена),C1-C4 алкокси (необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкилтио (необязательно замещенного 1, 2 или 3 атомами галогена), -СО-О(C1-C4 алкил), циано, -NRR, -CONRR, гало, гидрокси,пиридила, тиофенила, фенила, бензила и фенокси, каждый из этих орто-заместителей необязательно замещен в кольце (если кольцо присутствует) 1, 2 или 3 заместителями, каждый заместитель независимо выбран из галогена, C1-C4 алкила необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкокси(необязательно замещенного 1, 2 или 3 атомами галогена), карбокси, нитро, гидрокси, циано, -NRR,-CONRR, SO2NRR и SO2R; и каждое из которых (дополнительно к орто замещению) необязательно дополнительно замещено 1 или 2 заместителями, каждый заместитель независимо выбран из C1-C4 алкила(необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкокси (необязательно замещенного 1,2 или 3 атомами галогена), C1-C4 алкилтио (необязательно замещенного 1, 2 или 3 атомами галогена),-СО-О(C1-C4 алкил), циано, -NRR, -CONRR, гало и гидрокси. Более предпочтительно Ar1 представляет собой фенильное кольцо или пиридильное (предпочтительно 2-пиридильное) кольцо, каждое из которых замещено и необязательно дополнительно замещено, как описано в предыдущем предложении. Более предпочтительно Ar1 представляет собой группу формулыR2 представляет собой C1-C4 алкил (необязательно замещенный 1, 2 или 3 атомами галогена),C1-C4 алкокси (необязательно замещенный 1, 2 или 3 атомами галогена), C1-C4 алкилтио (необязательно замещенный 1, 2 или 3 атомами галогена), гало, гидрокси, пиридил, тиофенил, фенил (необязательно замещенный 1, 2 или 3 заместителями, каждый заместитель независимо выбран из галогена, C1-C4 алкила(необязательно замещенного 1, 2 или 3 атомами галогена) или C1-C4 алкокси (необязательно замещенного 1, 2 или 3 атомами галогена или фенокси (необязательно замещенный 1, 2 или 3 атомами галогена);R6 (если присутствует) представляет собой Н или гало (предпочтительно Н). Более предпочтительно Ar1 представляет собой группу формулы (а), в которой А представляет собой CR6;R2 представляет собой C1-C4 алкил (необязательно замещенный 1, 2 или 3 атомами фтора),C1-C4 алкокси (необязательно замещенный 1, 2 или 3 атомами фтора), гало или фенил (необязательно замещенный 1, 2 или 3 атомами фтора); R3 представляет собой Н;R6 представляет собой Н или гало. Более предпочтительно Ar1 представляет собой группу формулы (а),в которой А представляет собой CR6;R6 представляет собой Н. Примеры характерных значений для Ar1 включают 2-метоксифенил, 2-этоксифенил,2-трифторметоксифенил, 2-фенилфенил, 2-(3-фтор-фенил)фенил, 2-хлор-фенил, 2-метокси-5-фторфенил, 2-хлор-6-фтор-фенил и 2-фенил-5-фтор-фенил. Следует отметить, что соединение формулы (I), описанное выше, будет иметь, как минимум, два асимметрических атома углерода. В данном описании, если в структурной формуле не указана стереохимия в одном или более хиральных центрах, то она включает все возможные стереоизомеры и все возможные смеси стереоизомеров (включая, но не ограничиваясь, рацемические смеси), которые могут быть получены в результате стереоизомерии в каждом из одного или больше хиральных центров.-5 009960 Таким образом, соединения, определенные формулой (I) выше, включают каждый из индивидуальных стереоизомеров и их все возможные смеси. Несмотря на то, что все стереоизомеры и их смеси рассматриваются настоящим изобретением,предпочтительные осуществления включают энантиомерно и диастереомерно чистые соединения формулы (I). Как используется в данном изобретении, термин "энантиомерно чистый" относится к энантиомерному избытку, который составляет более 90%, предпочтительно более 95%, более предпочтительно более 99%. Как используется в данном изобретении, термин "диастереомерно чистый" относится к диастереомерному избытку, который составляет более 90%, предпочтительно более 95%, более предпочтительно более 99%. В предпочтительном осуществлении настоящего изобретения описано соединение формулы в которой X, Rx, Ry, Rz, R1 и Ar1 вляются такими, как определено выше для формулы (I); или его фармацевтически приемлемая соль. Предпочтительно указанное соединение формулы (II) является, как энантиомерно чистым, так и диастереомерно чистым. В предпочтительном осуществлении настоящего изобретения описано соединение формулы в которой X, R1 и Ar1 являются такими, как определено выше для формулы (I); или его фармацевтически приемлемая соль. В предпочтительном осуществлении настоящего изобретения описано соединение формулы (III), в которомX представляет собой ОН или NH2;C1-C4 алкокси и гидрокси), где одна связь C-C в циклоалкильном компоненте необязательно заменяется на связь O-C, S-C или С=С; или CH2Ar2, где Ar2 представляет собой фенильное или пиридильное (предпочтительно 2-пиридильное) кольцо, каждое из которых может быть замещено 1, 2 или 3 заместителями,каждый заместитель независимо выбран из C1-C4 алкила (необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкокси (необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкилтио (необязательно замещенного 1, 2 или 3 атомами галогена), гало и гидрокси; иAr1 представляет собой фенильное кольцо или 5- или 6-членное гетероарильное кольцо; каждое из которых замещено в орто-положении заместителем, выбранным из C1-C4 алкила (необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкокси (необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкилтио (необязательно замещенного 1, 2 или 3 атомами галогена), -СО-О(C1-C4 алкил),циано, -NRR, -CONRR, гало, гидрокси, пиридила, тиофенила, фенила, бензила и фенокси, каждый из этих орто-заместителей необязательно замещен в кольце (если кольцо присутствует) 1, 2 или 3 заместителями, каждый заместитель независимо выбран из галогена, C1-C4 алкила (необязательно замещенного 1,2 или 3 атомами галогена), C1-C4 алкокси (необязательно замещенного 1, 2 или 3 атомами галогена), карбокси, нитро, гидрокси, циано, -NRR, -CONRR, SO2NRR и SO2R; и каждое из которых (дополнительно к орто-замещению) необязательно дополнительно замещено 1 или 2 заместителями, каждый заместитель независимо выбран из C1-C4 алкила (необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкокси (необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкилтио (необязательно замещенного 1, 2 или 3 атомами галогена),-СО-О(C1-C4 алкил), циано, -NRR, -CONRR, гало и гидрокси; или его фармацевтически приемлемая соль. В предпочтительном осуществлении настоящего изобретения описано соединение формулы в которой X представляет собой ОН или NH2;R1 представляет собой C1-C6 алкил (необязательно замещенный 1, 2 или 3 атомами галогена и/или 1 заместителем, выбранным из C1-C4 алкокси (необязательно замещенного 1, 2 или 3 атомами фтора), циано и гидрокси); C3-C6 циклоалкил (необязательно замещенный 1, 2 или 3 атомами галогена и/или 1 заместителем, выбранным из C1-C4 алкокси и гидрокси), где одна связь C-C в циклоалкильном компоненте необязательно заменяется на связь O-C; или CH2Ar2, где Ar2 представляет собой фенильное кольцо,необязательно замещенное 1, 2 или 3 заместителями, каждый заместитель независимо выбран изR2 представляет собой C1-C4 алкил (необязательно замещенный 1, 2 или 3 атомами галогена),C1-C4 алкокси (необязательно замещенный 1, 2 или 3 атомами галогена), C1-C4 алкилтио (необязательно замещенный 1, 2 или 3 атомами галогена), гало, гидрокси, пиридил, тиофенил, фенил (необязательно замещенный 1, 2 или 3 заместителями, каждый заместитель независимо выбран из галогена, C1-C4 алкила(необязательно замещенного 1, 2 или 3 атомами галогена) или C1-C4 алкокси (необязательно замещенного 1, 2 или 3 атомами галогена или фенокси (необязательно замещенный 1, 2 или 3 атомами галогена);R6 (если присутствует) представляет собой Н; или его фармацевтически приемлемая соль. В предпочтительном осуществлении настоящего изобретения описано соединение формулы в которой X представляет собой ОН или NH2;R1 представляет собой C1-C6 алкил (необязательно замещенный 1, 2 или 3 атомами фтора),C3-C6 циклоалкил, где одна связь C-C в циклоалкильном компоненте необязательно заменяется на связьO-C, или CH2Ar2, где Ar2 представляет собой фенильное кольцо, необязательно замещенное 1 или 2 за-7 009960 местителями, каждый заместитель независимо выбран из C1-C4 алкила (необязательно замещенного 1, 2 или 3 атомами галогена), C1-C4 алкокси (необязательно замещенного 1, 2 или 3 атомами галогена), гало и гидрокси;R5 представляет собой Н или F; или его фармацевтически приемлемая соль. В предпочтительном осуществлении настоящего изобретения описано соединение формулы в котором R1 представляет собой C1-C6 алкил (необязательно замещенный 1, 2 или 3 атомами фтора) или C3-C6 циклоалкил, где одна связь C-C в циклоалкильном компоненте необязательно заменяется на связь O-C;R5 представляет собой Н или F; или его фармацевтически приемлемая соль. Конкретные осуществления настоящего изобретения включают следующие соединения: 1-[1,1'-бифенил]-2-ил-2-морфолин-2-илпропан-2-ол,1-[5-фтор-2-(метилокси)фенил]-2-морфолин-2-илбутан-2-ол,2-морфолин-2-ил-1-2-[(трифторметил)окси]фенилбутан-2-ол,1-[1,1'-бифенил]-2-ил-2-морфолин-2-илбутан-2-ол,1-[5-фтор-2-(метилокси)фенил]-3-метил-2-морфолин-2-илбутан-2-ол,3-метил-1-[(2-метилокси)фенил]-2-морфолин-2-илбутан-2-ол,1-[(2-этилокси)фенил]-3-метил-2-морфолин-2-илбутан-2-ол,3-метил-2-морфолин-2-ил-1-2-[(трифторметил)окси]бутан-2-ол,1-[1,1'-бифенил]-2-ил-3-метил-2-морфолин-2-илбутан-2-ол,1-(4-фтор[1,1'-бифенил]-2-ил)-3-метил-2-морфолин-2-илбутан-2-ол,1-[5-фтор-2-(метилокси)фенил]-4-метил-2-морфолин-2-илпентан-2-ол,1-[2-(этилокси)фенил]-4-метил-2-морфолин-2-илпентан-2-ол,4-метил-2-морфолин-2-ил-1-2[(трифторметил)окси]фенилпентан-2-ол,1-[1,1'-бифенил]-2-ил-4-метил-2-морфолин-2-илпентан-2-ол,1-(4-фтор[1,1'-бифенил]-2-ил)-4-метил-2-морфолин-2-илпентан-2-ол,1-циклопентил-2-[5-фтор-2-(метилокси)фенил]-1-морфолин-2-илэтанол,1-циклопентил-2-[2-(этилокси)фенил]-1-морфолин-2-илэтанол,1-циклопентил-1-морфолин-2-ил-2-2-[(трифторметил)окси]фенилэтанол,2-[1,1'-бифенил]-2-ил-1-циклопентил-1-морфолин-2-илэтанол,1-циклопентил-2-(4-фтор[1,1'-бифенил]-2-ил)-1-морфолин-2-илэтанол,2-[5-фтор-2-(метилокси)фенил]-1-морфолин-2-ил-1-тетрагидро-2 Н-пиран-4-илэтанол,1-морфолин-2-ил-1-тетрагидро-2 Н-пиран-4-ил-2-2-[(трифторметил)окси]фенилэтанол,2-[1,1'-бифенил]-2-ил-1-морфолин-2-ил-1-тетрагидро-2 Н-пиран-4-илэтанол,2-(3'-фтор-бифенил-2-ил)-1-морфолин-2-ил-1-(тетрагидропиран-4-ил)этанол,5,5,5-трифтор-1-(5-фтор-2-метоксифенил)-2-морфолин-2-илпентан-2-ол,5,5,5-трифтор-2-морфолин-2-ил-1-(2-трифторметоксифенил)пентан-2-ол,1-[1,1'-бифенил]-2-ил-5,5,5-трифтор-2-морфолин-2-илпентан-2-ол,6,6,6-трифтор-1-[5-фтор-2-(метилокси)фенил]-2-морфол-2-илгексан-2-ол,1-[1,1'-бифенил]-2-ил-6,6,6-трифтор-2-морфолин-2-илгексан-2-ол,1-циклопропил-2-[-2-(метилокси)фенил]-1-морфолин-2-илэтанол,1-циклопропил-2-[-2-(этилокси)фенил]-1-морфолин-2-илэтанол,2-[1,1'-бифенил]-2-ил-1-циклопропил-1-морфолин-2-илэтанол,1,3-бис-(2-метоксифенил)-2-морфолин-2-илпропан-2-ол,1-(2-метоксибензил)-2-(2-метоксифенил)-1-морфолин-2-илэтиламин,2-морфолин-2-ил-1,3-дифенилпропан-2-ол,1-(2-метоксифенил)-2-морфолин-2-илгексан-2-ол,-8 009960 2-морфолин-1-1-бифенил-2-илгексан-2-ол,1-(2-хлор-6-фтор-фенил)-4-метил-2-морфолин-2-илпентан-2-ол и 1-(2-хлор-фенил)-4-метил-2-морфолин-2-илпентан-2-ол и их фармацевтически приемлемые соли. Соединения, описанные в данном изобретении, являются ингибиторами повторного захвата норадреналина. Биогенные переносчики амина контролируют количество биогенных нейромедиаторов амина в синаптической щели. Ингибирование соответствующего переносчика приводит к повышению концентрации данного нейромедиатора в синаптической щели. Соединения формулы (I) и их фармацевтически приемлемые соли предпочтительно имеют величину Ki менее 600 нм на переносчике норадреналина, как было определено путем использования сцинтилляционного анализа близости, описанного ниже. Более предпочтительные соединения формулы (I) и их фармацевтически приемлемые соли имеют величину Ki менее 100 нм на переносчике норадреналина. Еще более предпочтительные соединения формулы (I) и их фармацевтически приемлемые соли имеют величину Ki менее 50 нм на переносчике норадреналина. Особенно предпочтительные соединения формулы (I) и их фармацевтически приемлемые соли имеют величину Ki менее 20 нм на переносчике норадреналина. Предпочтительно соединения,описанные в данном изобретении, селективно ингибируют переносчик норадреналина относительно переносчиков серотонина и допамина, как минимум, в пять раз, более предпочтительно, как минимум, в десять раз, как было определено путем применения сцинтилляционного анализа близости, описанного ниже. Кроме того, соединения, описанные в данном изобретении, предпочтительно устойчивы к действию кислот. Преимущественно они имеют уменьшенное взаимодействие (как в качестве субстрата, так и в качестве ингибитора) с ферментом печени цитохромом Р 450 (CYP2D6). То есть они предпочтительно проявляют менее 75% метаболизма на маршруте CYP2D6 согласно анализу субстрата CYP2D6, описанному ниже, также они предпочтительно проявляют IC506 мкМ, согласно анализу ингибитора CYP2D6,описанному ниже. Принимая во внимание их фармакологическую активность, соединения, описанные в данном изобретении, показаны для лечения расстройств центральной и/или периферической нервной системы, в частности расстройств, связанных с нарушением метаболизма норадреналина у млекопитающих, особенно у людей, включая детей, юношей и взрослых. Термин "нарушение метаболизма норадреналина", используемый в данном описании, относится к уменьшению количества нейромедиатора норадреналина в синаптической щели ниже такого значения,которое могло бы считаться нормальным или желательным для видов или индивидуума в пределах данного вида. Поэтому фраза "расстройства, связанные с нарушением метаболизма норадреналина у млекопитающих", относится к расстройствам, связанным с уменьшением количества нейромедиатора норадреналина в синаптической щели ниже такого значения, которое могло бы считаться нормальным или желательным для видов или индивидуума в пределах данного вида, который рассматривается. Расстройства, связанные с нарушением метаболизма норадреналина у млекопитающих, включают,например, состояния нервной системы, выбранные из группы, которая включает расстройство привыкания и синдром отмены,расстройство регулирования (включая угнетенное настроение, беспокойство, смешанные беспокойство и угнетенное настроение, нарушение поведения, смешанные нарушения поведения и настроения),психическое расстройство и расстройство познавательной способности, связанное с возрастом(включая болезнь Альцгеймера),алкогольную зависимость,аллергии (в частности, аллергический ринит),нервную анорексию,апатию,астму,расстройство дефицита внимания (АДД), вызванное общемедицинскими состояниями, гиперактивное расстройство дефицита внимания (ADHD), включая, преимущественно, невнимательный вид ADHD и, преимущественно, гиперактивно-импульсивный вид ADHD (необязательно путем комбинированного лечения одним или более стимуляторами, такими как метилфенидат, амфетамин и декстроамфетамин),биполярные расстройства,нервную булимию,синдром хронической усталости,хронический или острый стресс,когнитивные расстройства (которые более подробно обсуждаются ниже, но включают галлюцинации, деменции, расстройства памяти, умеренную когнитивную недостаточность (MCI), когнитивную недостаточность, связанную с шизофренией (CIAS) и когнитивные расстройства, не указанные иным образом),расстройства коммуникации (включая заикание, выраженное расстройство речи, смешанное рецептивно-экспрессивное расстройство речи, фонологическое расстройство и расстройство коммуникации, не-9 009960 указанное иным образом), расстройство поведения, циклотимическое расстройство, деменцию по типу Альцгеймера (DAT), депрессию (включая юношескую депрессию и легкую депрессию),психическую депрессию,эмоциональную дисрегуляцию (включая эмоциональную дисрегуляцию, связанную с ADHD, пограничное расстройство личности, биполярное расстройство, шизофрению, шизоаффективный психоз и перемежающийся взрывной психоз),фибромиалгию и другие соматоформные расстройства (включая соматизированное расстройство,расстройство конверсии, болевое расстройство, ипохондрию, дисморфическое телесное расстройство,недифференцированное соматоформное расстройство и соматоформное расстройство, не указанное иным образом),генерализованное расстройство страха,приливы или вазомоторные симптомы,гипотензивные состояния, включая ортостатическую гипотензию,расстройства контроля импульсов (включая интермиттирующее взрывное расстройство, клептоманию, пироманию, патологическую страсть к азартным играм, трихотилломанию и расстройство контроля импульсов, не указанное иным образом),недержание (т.е. энурез, стрессовое недержание, истинное стрессовое недержание и смешанное недержание),расстройство дыхания,расстройство возбуждения,неспособность к обучению (включая расстройства, относящиеся к развитию речевых и языковых навыков, такие как расстройство развития артикуляции, расстройство развития выразительной речи и расстройство развития языкового восприятия; расстройства обучения, такие как расстройство чтения,математическое расстройство, расстройство письменной речи и расстройство обучения, не указанное иным образом; и расстройства моторных навыков, такие, как расстройство развития координации),манию,мигрени,невропатическую боль,никотиновую зависимость,ожирение (т.е. уменьшение веса пациентов, страдающих ожирением и имеющих лишний вес),обсессивно-компульсивные расстройства и спектр болезней, относящихся к ним,оппозиционное вызывающее расстройство, боли, включая хронические боли, невропатические боли и антиноцицептивные боли,паническое расстройство,болезнь Паркинсона (в частности, для лечения дискинезии, укачиваний, равновесия, координации,депрессии и мотивации),периферическую нейропатию,изменения личности, вызванные общемедицинским состоянием (включая лабильный тип, расторможенный тип, агрессивный тип, апатичный тип, параноидный тип, комбинированный тип и не уточненный тип),первазивные расстройства развития коммуникации (включая аутистическое расстройство, расстройство Аспергера, расстройство Ретта, детское расстройство разрушения, и первазивное расстройство развития, не указанное иным образом),посттравматический стресс,предменструальное дисфорическое расстройство (т.е. предменструальный синдром и дисфорическое расстройство поздней лютеиновой фазы),псориаз,расстройство, выражающееся в употреблении психоактивных веществ,психотическое расстройство (включая шизофрению, шизоаффективные и шизоморфные расстройства),аффективное сезонное расстройство,расстройство сна (такое, как нарколепсия и энурез),социальные фобии (включая расстройство страха перед обществом),специфическое расстройство развития,селективное ингибирование поглощения серотонина (SSRI),синдром "выдыхания" (т.е. когда пациенту не удалось получить удовлетворительные результаты от лечения SSRI после первичного удовлетворительного лечения),расстройства TIC (например, болезнь Туретта),табачную зависимость и мультиинфарктную деменцию. Соединения, описанные в данном изобретении, частично подходят для лечения гиперактивного расстройства дефицита внимания, ADHD. Соединения, описанные в данном изобретении, также частично подходят для лечения шизофрении.- 10009960 Термин "когнитивные расстройства" (также встречающийся под различными названиями, такими как "когнитивная неспособность", "когнитивная недостаточность", "когнитивный дефицит", "когнитивное ухудшение", "когнитивная дисфункция" и т.п.) относится к дисфункции, снижению или потере одной или больше когнитивных функций, процессу приобретения, сохранения и применения знаний. Когнитивная дисфункция включает когнитивные изменения, связанные со старением ("возрастное ухудшение памяти"), а также изменения, вызванные другими причинами. Наиболее распространено когнитивное ухудшение, вызванное делирием или деменцией, но оно также может встречаться в ряде других медицинских или нейропсихиатрических расстройств. Более фокальные когнитивные недостаточности диагностируют, применяя критерии, описанные в Diagnostic and Statistical Manual of Mental Disorders, FourthEdition, Text Revision (DSM-IV-TR, 2000), American Psychiatric Association, Washington, D.C., как или расстройства памяти (влияющие на память) или когнитивное расстройство, не указанное иным образом(NOS), которое включает дисфункцию организации, ухудшения зрительного восприятия пространства/зрительного восприятия структуры, дефициты внимания, дезориентацию, и т.д. Эти более фокальные когнитивные расстройства также вызваны многими разнообразными причинами, некоторые из которых имеют неизвестную этиологию. Делирий характеризуется нарушением сознания с уменьшением возможности сосредоточить, поддержать или переместить внимание и изменением когнитивной способности, развивающейся за короткий период времени. Делирий очень распространен и встречается, в среднем, у более чем 50 пациентов больницы и даже еще более распространен у пациентов домов престарелых и у тех, кто имеет неизлечимые заболевания. Расстройства, включенные в раздел "Делирий" DSM-IV-TR, перечислены в соответствии с их предполагаемой этиологией: делирий, вызванный общемедицинским состоянием; делирий, вызванный приемом веществ (т.е. злоупотреблением наркотиками, медицинскими препаратами или воздействием токсинов); делирий множественной этиологии или делирий, не указанный иным образом (с неопределенной этиологией). Как было описано Wise и др. 2002) Delirium (Confusional States), In Wise andthe Medically 111, Second Edition, American Psychiatric Publishing, Inc., Washington, D.C., Chapter 15,p. 257-272, Table 15-4), типичные этиологические основы делирия включают инфекцию, отмену алкоголя и наркотиков, острые метаболические состояния, травмы различных видов, патологии центральной нервной системы, гипоксию, нехватку витаминов, эндокринопатии, острые сосудистые состояния, токсины или лекарства, и тяжелые металлы, но не ограничиваются ими. Деменция - хроническое состояние, обычно с постепенным ухудшением памяти и других интеллектуальных функций и других когнитивных навыков, острая настолько, чтобы препятствовать выполнению ежедневной деятельности. Хотя деменция может встречаться в любом возрасте, она, главным образом,влияет на людей пожилого возраста, присутствуя более чем у 15% лиц в возрасте свыше 65 лет и у 40% лиц в возрасте свыше 80 лет. Деменция, вызванная болезнью Альцгеймера, является особенно распространенной. Когнитивные ухудшения и/или деменции, не связанные с болезнью Альцгеймера, включают,например, те, которые вызваны или связаны со следующими заболеваниями: сосудистыми заболеваниями; болезнью Паркинсона; болезнью с тельцами Леви (диффузной болезнью с тельцами Леви); ВИЧ/СПИД; умеренными когнитивными ухудшениями; умеренными нейрокогнитивными расстройствами; возрастными ухудшениями памяти; неврологическими и/или психиатрическими состояниями, включая эпилепсию и лечение эпилепсии; опухолями, кистами, повреждениями мозга, или другими воспалительными болезнями мозга; множественным склерозом; синдромом Дауна; синдромом Ретта; прогрессивным наднуклеарным параличом; синдромом деменции лобной доли большого мозга; шизофренией и относящимися к ней психиатрическими расстройствами; нейролептиками; травматическими поражениями мозга (закрытой черепно-мозговой травмой), деменцией боксеров(dementia pugilistica), и другими травмами головы; гидроцефалией нормального давления; хирургией (включая хирургию шунтирования коронарной артерии) и анестезией, электрошоковой терапией, раком и лечением раковых заболеваний. Деменции также перечислены в разделе "Деменции" DSM-IV-TR согласно предполагаемой этиологии: деменция по типу Альцгеймера, сосудистая деменция, деменция, вызванная другими общемедицинскими состояниями (например, вирус иммунодефицита человека [ВИЧ], травма головы, болезнь Паркинсона, болезнь Хантингтона), персистирующая деменция, вызванная действием веществ (т.е. вызван- 11009960 ная злоупотреблением наркотиками, медикаментами или воздействием токсинов), деменция множественной этиологии или деменция, не указанная иным образом (неопределенной этиологии). Как описаноPublishing, Inc., Washington, D.C., Chapter 16, p. 273-306, Table 16-1), типичные этиологические основы основных синдромов деменции включают дегенеративные расстройства (корковые и подкорковые), сосудистые расстройства, расстройства миелинизации, травматические состояния, неопластические расстройства, гидроцефалические расстройства, воспалительные состояния, инфекции, токсические состояния, метаболические расстройства и психиатрические расстройства, но не ограничиваются ими. Расстройство памяти характеризуется ее ухудшением при отсутствии других значимых сопутствующих когнитивных ухудшений. Расстройства, приведенные в разделе "Расстройства памяти"DSM-IV-TR, также перечислены в соответствии с предполагаемой этиологией: расстройство памяти,вызванное общемедицинским состоянием, персистирующее расстройство памяти, вызванное воздействием веществ, или расстройство памяти, не указанное иным образом. Когнитивное расстройство, не указанное иным образом, в DSM-IV-TR охватывает проявления,которые характеризуются когнитивной дисфункцией, которая, предположительно, вызвана либо общемедицинским состоянием, либо применением веществ, и которые не отвечают критериям любого из расстройств, перечисленных в другом месте в разделе DSM-IV-TR под названием "Делирий, деменция и расстройства памяти и другие когнитивные расстройства." Деменция, расстройства памяти и когнитивные расстройства, не указанные иным образом, встречаются у пациентов, имеющих широкий спектр других расстройств, включая болезнь Хантингтона (хорею); болезнь Пика; спинально-церебеллярную атаксию (по типам 1-11); кортикобазальную дегенерацию с преимущественным поражением базальных ганглиев; нейроакантоцитоз; дентато-рубро-паллидо-льюисову атрофию (DRPLA); системную красную волчанку; интоксикацию тяжелыми металлами; алкогольную деменцию (энцефалопатию Вернике); эмбриональный алкогольный синдром; однократный или многократные инсульты, включая мелкие сосуды (деменция Бинсвангера: подкорковая артериосклеротическая энцефалопатия) и крупные сосуды (полиинфарктная деменция); аноксическую энцефалопатию; опухоли; родовую гипоксию; преждевременные роды; врожденные нарушения метаболизма; неврофиброматоз (по типу I); туберкулезный склероз; болезнь Халлервордена-Шпатца; болезнь Вильсона; последствия инфекционных заболеваний (например, туберкулеза, вирусного энцефалита, бактериального менингита); субдуральную гематому; подкорковую деменцию; болезнь Крейцфельда-Якоба; болезнь Герстманна-Штройсслера-Шейнкера; общий парез; сифилис,но не ограничиваясь ими. Как подробно обсуждалось выше, когнитивная неспособность может присутствовать у пациентов,страдающих от ряда расстройств, включая деменцию или делирий, или может быть вызвана широким многообразием причин. Соединения, которые описываются в данном изобретении, являются полезными для лечения или предотвращения когнитивной неспособности, связанной или вызванной расстройствами, этиология которых описана выше, включая расстройства, формально классифицированные вDSM-IV-TR. Для удобства читателя номера кодов или описания DSM-IV-TR представлены ниже."Коды ICD-9-CM" относятся к кодам, например, для выбранных медицинских состояний и расстройств,вызванных действием лекарств, которые содержатся в International Classification of Diseases, 9th Revision,Clinical Modification. Примеры когнитивных расстройств различной этиологии или связанных с различными расстройствами, вызывающие особый интерес, которые могут быть предотвращены или вылечены путем применения соединений, описанных в данном изобретении, включают, но не ограничиваются улучшение когнитивных функций и организующих функций (способность планировать, начинать,организовывать, выполнять, контролировать и корректировать свое собственное поведение) у нормальных субъектов и у субъектов, проявляющих когнитивную дисфункцию; лечение когнитивной недостаточности и дефицита внимания, связанных с внутриутробным воздействием веществ, допускающих злоупотребление, включая никотин, алкоголь, метамфетамин, кокаин и героин; лечение когнитивного ухудшения, вызванного хроническим злоупотреблением алкоголя и наркотиков (персистирующая деменция, вызванная действием веществ), побочное влияние медикаментов и лечение наркозависимости и синдрома отмены; лечение когнитивной недостаточности у пациентов с синдромом Дауна; лечение недостаточности функционирования нормальной памяти в сочетании с основными депрессивными и биполярными расстройствами; лечение когнитивного ухудшения, связанного с депрессией, задержкой умственного развития, биполярным расстройством, или шизофренией; лечение синдромов деменции, связанных с манией, расстройством конверсии и симуляцией; лечение проблем внимания, префронтальной функции организации или памяти, вызванных травмой или инсультом; лечение когнитивной дисфункции у женщин в климактерическом или постклимактерическом периоде и у женщин, проходящих гормонозаместительную терапию; лечение когнитивной недостаточности и усталости, вызванных или связанных с раковыми заболеваниями или лечением раковых заболеваний (когнитивная недостаточность связана с различным лечением раковых заболеваний, включая краниальное облучение, обычную химиотерапию (химиотерапию стандартных доз, химиотерапию высоких доз и гематопоэтическую (стволовую) трансплантацию, и биологические агенты). Соединения, описанные в данном соединении, также полезны в способе лечения пациентов, страдающих от или восприимчивых до психоза, включающем введение указанному пациенту эффективного количества первого ингредиента, который представляет собой нейролептик, в сочетании с эффективным количеством второго ингредиента, который представляет собой соединение формулы (I). В изобретении также описана фармацевтическая композиция, включающая первый ингредиент, который представляет собой нейролептик, и второй ингредиент, который представляет собой соединение формулы (I). В общем выражении данного аспекта настоящего изобретения, первый ингредиент - это соединение, которое действует как нейролептик. Нейролептиком может быть или типичный нейролептик, или атипичный нейролептик. Несмотря на полезность как типичного, так и нетипичного нейролептика для данных способов и композиций, описанных в данном изобретении, предпочтительно, чтобы первым ингредиентом соединения был атипичный нейролептик.- 14009960 Типичные нейролептики включают, но не ограничиваются хлорпромазин, 2-хлор-10-(3-диметиламинопропил)фенотиазин, описанный в патенте США 2645640. Его фармакология была рассмотрена (Crismon, Psychopharmacol. Bul., 4, 151 (October 1967); дроперидол, 1-(1-[3-(п-фторбензоил)пропил]-1,2,3,6-тетрагидро-4-пиридил)-2-бензимидазолинон,описанный в патенте США 3141823; галоперидол, 4-[4-(4-хлорфенил)-4-гидрокси-1-пиперидинил]-1-(4-фторфенил)-1-бутанон, описанный в патенте США 3438991. Сообщалось об его эффективности при лечении психоза (Beresford andWard, Drugs, 33, 31-49 (1987); тиоридазин, 1 гидрохлорид 1-гидрокси-10-[2-(1-метил-2-пиридинил)этил]-2-(метилтио)фенотиазина, описанный Bourquin и др. (Helv. Chim. Acta, 41, 1072 (1958. Сообщалось об его применении в качестве нейролептика (Axelsson, и др., Curr. Ther. Res., 21, 587 (1977; трифторперазин, гидрохлорид 10-[3-(4-метил-1-пиперазинил)пропил]-2-трифторметилфентиазина,описанный в патенте США 2921069. Атипичные нейролептики включают, но не ограничиваются оланзапин, 2-метил-4-(4-метил-1-пиперазинил)-10 Н-тиено[2,3-b][1,5]бенздиазепин, известное соединение, описанное в патенте США 5229382 в качестве полезного для лечения шизофрении, шизоморфного расстройства, острой мании, умеренных тревожных состояний и психоза; клозапин, 8-хлор-11-(4-метил-1-пиперазинил)-5 Н-дибензо[b,e][1,44]диазепин, описанный в патенте США 3539573. Была описана его клиническая эффективность при лечении шизофрении (Hanes, et al.,Psychopharmacol. Bull., 24, 62 (1988; рисперидон, 3-[2-[4-(6-фтор-1,2-бензоизоксазол-3-ил)пиперидино]этил]-2-метил-6,7,8,9-тетрагидро 4 Н-пиридо[1,2-а]пиримидин-4-он, применение которого при лечении психотических заболеваний описано в патенте США 4804663; сертиндол, 1-[2-[4-[5-хлор-1-(4-фторфенил)-1 Н-индол-3-ил]-1-пиперидинил]этил]имидазолидин-2 он, описанный в патенте США 4710500. Его применение при лечении шизофрении описано в патентах США 5112838 и 5238945; кветиапин, 5-[2-(4-дибензо[b,f][1,4]тиазепин-11-ил-1-пиперазинил)этокси]этанол, и его активность в анализах, которая демонстрирует полезность для лечения шизофрении, описанный в патенте США 4879288. Кветиапин обычно вводят в виде его (Е)-2-бутенэдиоатной соли (2:1); зипразидон, 5-[2-[4-(1,2-бензоизотиазол-3-ил)-1-пиперазинил]этил]-6-хлор-1,3-дигидро-2 Н-индол-2 он, который обычно вводится в виде моногидрата гидрохлорида. Соединение описано в патентах США 4831031 и 5312925. Его активность при анализах, которая демонстрирует полезность при лечении шизофрении, описана в патенте США 4831031; арипипразол(Абилифай),7-[4-[4-(2,3-дихлорфенил)-1-пиперазинил]бутокси]-3,4-дигидрокарбостирил (патенты США 4734416 и 5006528), который является новым нейролептиком, показанным для лечения шизофрении. Понятно, что в то время как применение нейролептика в качестве первого ингредиента соединения является предпочтительным, сочетания двух и более нейролептиков могут применяться в качестве первого ингредиента при необходимости или по желанию. Аналогично, в то время как применение одного соединения формулы (I) в качестве второго ингредиента соединения является предпочтительным, сочетания двух и более соединений формулы (I) могут применяться в качестве первого ингредиента при необходимости или по желанию. Несмотря на то что все сочетания первого и второго ингредиента соединений являются полезными и ценными, определенные сочетания являются особо ценными и предпочтительными, как изложено ниже: оланзапин/соединение формулы (I); клозапин/соединение формулы (I); рисперидон/соединение формулы (I); сертиндол/соединение формулы (I); кветиапин/соединение формулы (I); зипразидон/соединение формулы (I); арипипразол/соединение формулы (I). В общем, предпочтительными являются сочетания и способы лечения с применением оланзапина в качестве первого ингредиента. Особенно предпочтительным является то, что, если первым ингредиентом является оланзапин, чтобы он был в своей форме II, описанной в патенте США 5736541. Хотя форма II оланзапина является предпочтительной, понятно, что, как используется в данном описании,термин "оланзапин" включает все сольваты и полиморфные формы, если не указано иначе. Состояния, которые могут быть вылечены путем дополнительного лечения, рассматриваемого в данном изобретении, включают шизофрению, шизоморфные заболевания, биполярное расстройство,острую манию и шизоаффективные расстройства. Названия, данные этим состояниям, представляют собой многочисленные болезненные состояния. В следующем списке приведен ряд таких болезненных состояний, многие из которых классифицированы в DSM-IV-TR. Номера кодов DSM-IV-TR для таких- 15009960 болезненных состояний, там, где они имеются, приведены ниже для удобства читателя. Данное изобретение также включает применение одного или более соединений формулы (I) в сочетании с одним или более традиционными агентами лечения болезни Альцгеймера для предотвращения или лечения когнитивной дисфункции у пациентов, страдающих болезнью Альцгеймера. В изобретении также описана фармацевтическая композиция, включающая первый ингредиент, который представляет собой традиционный агент для лечения болезни Альцгеймера, и второй ингредиент, который представляет собой соединение формулы (I). Традиционные агенты для лечения болезни Альцгеймера включают ингибиторы распада ацетилхолина (т.е. ингибиторы холинестеразы или ацетилхолинестеразы) в синапсах, например донепезил (Арицепт), ривастигмин (Экселон), галантамин (Реминил), и такрин(Когнекс); селективный ингибитор моноамина оксидазы селегилин (Элдеприл) и мемантин(Наменда), новый, одобренный FDA (Управлением по контролю продуктов и лекарств) антагонист рецепторов NMDA для лечения средней и тяжелой болезни Альцгеймера. Модафинил (Провигил) также применяется для лечения болезни Альцгеймера. Данное изобретение также включает применение одного или более соединений формулы (I) в сочетании с одним или более традиционными агентами для лечения когнитивной дисфункции при болезни Паркинсона. В изобретении также описана фармацевтическая композиция, включающая первый ингредиент, который представляет собой традиционный агент для лечения болезни Паркинсона и второй ингредиент, который представляет собой соединение формулы (I). Традиционные агенты для лечения болезни Паркинсона включают леводопу; леводопу/карбидопу (Синемет); Сталево (карбидопу/леводопу/энтакапон); агонисты допамина, например бромокриптин; Мирапекс (прамипексол),Пермакс (перголид) и Реквип (ропинирол); ингибиторы СОМТ, например толкапон и энтакапон; Селегилин (Депренил; Элдеприл); пропранолол; примидон; холиноблокаторы, например Когентин,Артан, Акинетон, Дисипал и Кемадрин; и амантадин. В каждом комбинированном лечении, приведенном выше, указанные первый и второй ингредиенты могут вводиться одновременно, по отдельности или последовательно. Аналогично, указанные композиции включают комбинированные лекарства одновременного, раздельного или последовательного применения. Термин "лечение", используемый в данном описании, относится и к радикальному, и к профилактическому лечению расстройств, связанных с нарушением метаболизма норадрекалина. Таким образом,термин "лечение" предназначен для ссылки на все процессы, где могут быть замедление, прерывание,приостановка, регулирование или остановка прогрессирования расстройств, описанных в данном изобретении, но не обязательно указывающий на полную ликвидацию всех симптомов, и предназначен включать профилактическое и терапевтическое лечение таких расстройств. Соединения, описанные в данном изобретении, также показаны для лечения расстройств, которые можно вылечить путем повышения количества нейротрансмиттеров норадреналина в синаптической щели млекопитающего выше того значения, которое считалось бы нормальным или желаемым для видов млекопитающих, или для индивидуумов в этих видах, которые рассматриваются. В другом осуществлении данного изобретения описана фармацевтическая композиция, включающая соединение формулы (I) или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым разбавителем, наполнителем или носителем. В другом осуществлении данного изобретения описано соединение формулы (I) или его фармацевтически приемлемая соль для применения в лечении. В другом осуществлении данного изобретения описано соединение формулы (I) или его фармацевтически приемлемая соль для применения в качестве ингибитора повторного захвата норадреналина. Предпочтительно такое ингибирование встречается в клетках млекопитающих (включая мембранные препараты клеток млекопитающих), особенно обнаруженные в центральной и/или периферической нервной системе. Более предпочтительно такое ингибирование встречается в клетках центральной нервной системы млекопитающих, особенно людей. В другом осуществлении данного изобретения описано соединение формулы (I) или его фармацевтически приемлемая соль для лечения расстройств, связанных с нарушением метаболизма норадреналина у млекопитающих.- 16009960 В другом осуществлении данного изобретения описано применение соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарства, ингибирующего повторный захват норадреналина. В другом осуществлении данного изобретения описано применение соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарства для лечения расстройств, связанных с нарушением метаболизма норадреналина у млекопитающих. В другом осуществлении данного изобретения описан способ ингибирования повторного захвата норадреналина у млекопитающих, включающий введение пациенту, который в этом нуждается, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В другом осуществлении данного изобретения описан способ лечения расстройств, связанных с нарушением метаболизма норадреналина у млекопитающих, включающий введение пациенту, который в этом нуждается, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Данное изобретение включает фармацевтически приемлемые соли соединения формулы (I). Подходящие соли включают кислые соли присоединения, включая соли, образованные неорганическими кислотами, например соляной, бромоводородной, азотной, серной или фосфорной кислотами, или органическими кислотами, такими как органические карбоновые или органические сульфоновые кислоты, например ацетоксибензойная, лимонная, гликолевая, манделовая-1, манделовая-d1, манделовая-d, малеиновая, моногидрат антивинной кислоты, гидроксималеиновая, фумаровая, лактобионовая, яблочная, метансульфоновая, напсиловая, нафталиндисульфоновая, нафтойная, щавелевая, пальмитиновая, фенилуксусная, пропионовая, пиридилгидроксипировиноградная, салициловая, стеариновая, янтарная, сульфаниловая, винная-1, винная-d1, винная-d, 2-гидроксиэтансульфоновая, толуол-п-сульфоновая и ксинафоиновая кислоты. Соединения, описанные в данном изобретении, могут применяться в качестве лекарств для людей и в ветеринарной медицине. Соединения могут вводиться различными маршрутами, например перорально или ректально, локально или парентерально, например путем инъекции, и применяются обычно в форме фармацевтической композиции. Такие композиции могут быть приготовлены хорошо известными в фармацевтике способами, и обычно включают, как минимум, одно активное соединение, объединенное с фармацевтически применимым разбавителем, наполнителем или носителем. При изготовлении композиций, описанных в данном изобретении, активный ингредиент обычно смешивают с носителем или разбавляют носителем и/или вкладывают в носитель, который может, например, быть в форме капсулы, саше, бумаги или другого контейнера. Там, где носитель служит в качестве разбавителя, он может представлять собой твердый,полутвердый или жидкий материал, действующий в качестве основы, наполнителя или среды для активного ингредиента. Таким образом, композиция может быть в форме таблеток, лепешек, саше, облаток,эликсиров, суспензий, растворов, сиропов, аэрозолей (в виде твердого вещества или в жидкой среде),мазей, содержащих, например, вплоть до 10% массы активного соединения, мягких и твердых желатиновых капсул, суппозиториев, растворов для инъекций и суспензий и стерильно упакованных порошков. Некоторые примеры подходящих носителей представляют собой лактозу, декстрозу, растительные масла, бензиловые спирты, алкиленгликоли, полиэтиленгликоли, триацетат глицерина, углеводы, такие как крахмал и вазелин, сахарозный сорбит, маннит, крахмалы, гуммиарабик, фосфат кальция, альгинаты,трагакант, желатин, сироп, метилцеллюлозу, метил- и пропилгидробензоат, тальк, стеарат магния и минеральное масло. Соединения формулы (I) могут также быть лиофилизованы, и полученные лиофилизаты применяться, например, для производства препаратов для инъекций. Указанные препараты могут быть стерилизованы и/или могут содержать вспомогательные вещества, такие как смазывающие вещества, консерванты, стабилизаторы и/или увлажняющие агенты, эмульгаторы, соли, чтобы влиять на осмотическое давление, буферные вещества, красители, отдушки и/или одно или более дополнительных активных соединений, например один или более витаминов. Композиции, описанные в данном изобретении, могут быть составлены таким образом, чтобы обеспечить быстрое, продолжительное или замедленное высвобождение активного ингредиента после введения пациенту, которое было произведено путем использования хорошо известных процедур. Композиции предпочтительно составлены в единичной дозированной форме, каждая доза содержит приблизительно от 5 до приблизительно 500 мг, большей частью приблизительно от 25 до приблизительно 300 мг активного ингредиента. Термин "единичная дозированная форма" относится к физически дискретным единицам, подходящим для людей и других млекопитающих в качестве однократных доз, каждая единица содержит предварительно определенное количество активного вещества, рассчитанного для получения желаемого лечебного эффекта, объединенного с подходящим фармацевтическим носителем. Соединения согласно настоящему изобретению могут быть получены с помощью традиционных способов органической химии. Общие схемы, описывающие пути синтеза для получения соединений согласно настоящему изобретению, описаны ниже. Для ясности, Rx, Ry и Rz показаны, как Н, однако понимают, что аналогичные способы могут применяться для других возможных значений Rx, Ry и Rz.- 17009960 Промежуточные соединения формул (X), (XI), (XII), (XV) и (XVI) могут быть получены, как показано ниже (где Р представляет собой N-защитную группу, и R7 и R8, которые могут быть одинаковыми или разными, каждый представляет собой C1-C4 алкил (необязательно замещенный одной группой OMe),или взяты вместе с атомом N, к которому они присоединены, образуя пирролидин, пиперидин или морфолин):N-защищенный этаноламин подвергают реакции с 2-хлоракрилонитрилом, получая продукт присоединения Михаэля, который потом обрабатывают основанием in situ, например трет-бутоксидом калия, получая соединение формулы (X). Соединение формулы (X) потом может быть гидролизовано в H2SO4/этаноле, давая эфир формулы (XI). Он, в свою очередь, может быть превращен в амид Вайнреба формулы (XII) добавлением раствора (XI) к предварительно смешанному растворуN,N'-диметилгидроксиламина и триметилалюминия. Альтернативно, соединение формулы (X) может быть гидролизировано в H2O/HCl, давая кислоту формулы (XV). Она, в свою очередь, может быть превращена в амид формулы (XVI) с помощью реакции раствора (XV) с оксалилхлоридом или SOCl2, получая ацилхлорид, который потом подвергают реакции с амином формулы R7R8NH, как, например, диметиламином или морфолином. Предпочтительные энантиомеры амидов (XII) и (XVI), показанные ниже,могут быть получены с помощью хиральной хроматографии Подходящие N-защитные группы будут известны специалисту в данной области техники. Дополнительная информация относительно подходящих N-защитных групп содержится в хорошо известном руководстве "Protective Groups in Organic Synthesis", Theodora W. Greene and Peter G.M. Wuts, John WileySons, Inc., New York, 1999, p.494-653. Бензил является особенно предпочтительной N-защитной группой.N-защищенные соединения формулы (I), в которых X представляет собой NH2, могут быть получены из соединений формулы (X), как показано ниже В способе А промежуточное соединение (X) обрабатывают избытком реактива ГриньяраAr1CH2MgBr, получая N-защищенное соединение формулы (I), в котором X представляет собой NH2 и R1 представляет собой CH2Ar2, где Ar2=Ar1. В синтезе В промежуточное соединение (X) обрабатывают одним эквивалентом реактива Гриньяра R1MgBr, с последующей обработкой одним эквивалентом реактива Гриньяра Ar1CH2MgBr, получая N-защищенное соединение формулы (I), в котором X представляет собойNH2. Альтернативно, реактив Гриньяра Ar1CH2MgBr можно добавлять сразу после R1MgBr. Предпочтительно к реакционной смеси между добавлением реактивов Гриньяра добавляют кислоту Льюиса, как,например, изопропоксид титана (см. Charette, А.В.; Gagnon, A.; Janes, M.; Mellon, С.; Tetrahedron Lett,1998, 39 (29), 5147-5150 и Charette, А.В.; Gagnon, A.; Tetrahedron: Asymmetry, 1999, 10 (10), 1961-1968).N-защищенные соединения формулы (I), в которых X представляет собой OH и R1 представляет собой CH2Ar2, где Ar2=Ar1, могут быть получены из соединений формулы (XI), как показано ниже Промежуточное соединение (XI) обрабатывают избытком реактива Гриньяра Ar1CH2MgBr, получаяN-защищенное соединение формулы (I), в котором X представляет собой ОН и R1 представляет собойN-защищенные соединения формулы (I), в которых X представляет собой ОН, могут быть получены из амида Вайнреба формулы (XII) или амида формулы (XVI), как показано ниже К раствору (XII) или (XVI) добавляют раствор необходимого реактива Гриньяра R1MgBr, получая,после обработки соединение формулы (XIII). Если реакцию проводят, используя предпочтительные энантиомеры (XII)b или (XVI)b, то реакция протекает с сохранением стереохимии с получением (XIII)b К раствору кетона формулы (XIII) добавляют раствор реактива Гриньяра Ar1CH2MgBr, получаяN-защищенное соединение формулы (I), в котором X представляет собой ОН. Если реакцию проводят,используя предпочтительный энантиомер (XIII)b, то реакция протекает стереоселективно с получением Кетоны формулы (XIII) также можно получить другим путем, как показано ниже Раствор N-защищенного морфолинона обрабатывают сильным основанием, как, например, диизопропиламид лития. К этому раствору добавляют альдегид R1CHO. Восстановлением морфолинкарбонильной группы, используя, например, комплекс боран-THF, с последующим окислением спирта, используя, например, условия окисления по Сверну, получают соединение формулы (XIII), которое может быть дальше подвергнуто реакции, как описано на предыдущей схеме, для получения N-защищенного соединения формулы (I), в котором X представляет собой ОН.N-защищенные соединения согласно настоящему изобретению, в которых X представляет собойC1-C4 алкокси, могут быть синтезированы с помощью стандартного алкилирования N-защищенных соединений формулы (I), в которых X=ОН, как показано ниже Подходящие сильные основания будут известны специалисту в данной области техники и включают, например, гидрид натрия. Также подходящие алкилирующие агенты будут известны специалисту в данной области техники и включают, например, C1-C4 алкил галогениды, как, например, метилйодид.N-защищенные соединения согласно настоящему изобретению, в которых X представляет собойNH(C1-C4 алкил), могут быть синтезированы обработкой соединения формулы (I), в котором X=NH2, в условиях восстановительного алкилирования или используя подходящие алкилирующие агенты, известные специалисту в данной области техники, включая, например, C1-C4 алкил галогениды, как, например,метил йодид.N-защищенные соединения согласно настоящему изобретению могут быть получены, используя стандартную органическую химию, для получения дополнительных N-защищенных соединений согласно настоящему изобретению. Например, соединениями металлоорганического типа между производным Соединения формулы (I) могут быть получены снятием защитных групп промежуточных Дополнительная информация относительно подходящих методов снятия защитных групп содержится в хорошо известном руководстве "Protective Groups in Organic Synthesis", на которое ссылались выше. Таким образом, в другом осуществлении настоящего изобретения обеспечен способ получения соединений формулы (I), включающий стадию снятия защитных групп соединения формулы в которых Р представляет собой N-защитную группу, и все другие радикалы являются такими, как определено выше для формулы (I), с получением соединения формулы (I), необязательно с последующей стадией образования фармацевтически приемлемой соли. Примеры соединений согласно настоящему изобретению могут быть получены с помощью традиционных способов органической химии из этилового эфира N-бензилморфолин-2-карбоновой кислоты 1 или N-бензилморфолинона, как приведено на схемах 1-4 Превращение 1 в амид Вайнреба 2, с последующей обработкой подходящим реактивом Гриньяра,приводит к кетонам формулы (XIII), в которых Р представляет собой бензил, как перечислено в табл. 1. Таблица 1 Циклопропилзамещенный кетон 77 альтернативно может быть получен из N-бензил морфолинона,как приведено на схеме 2 Схема 2 Обработкой N-бензилморфолинона сильным основанием, как, например, диизопропиламид лития, с последующим добавлением циклопропил метилальдегида получают 75. Восстановлением 75, например комплексом боран-THF, получают 76. Добавлением раствора 76 к предварительно смешанному раствору диметилсульфоксида и оксалилхлорида получают 77. Реакцией кетонов, перечисленных в табл. 1, с приемлемо замещенным бензильным реактивом Гриньяра получают N-бензил замещенные третичные спирты, перечисленные в табл. 2 (где R2, R5 и R6 представляют собой Н, если не указанно другое), как приведено на схеме 3. Схема 3 Дебензилированием и образованием соли, как подробно описано на схеме 4, получают соли третичных спиртов, перечисленные в табл. 2 (где R2, R5 и R6 представляют собой Н, если не указано другое) Соединения примеров 1-32 и 35-38 могут быть получены в энантиомерно чистой форме с помощью этого синтеза, используя хирально чистый эфир 1. Разделение 1 на его энантиомеры может достигаться с помощью хиральной ВЭЖХ. Превращение эфира в амид Вайнреба не нарушает хиральный центр, таким образом получая хирально чистый амид 2. Превращение амида Вайнреба в кетон также не нарушает хиральный центр, таким образом получая хирально чистые кетоны 3-10, 77 и 82. Альтернативно, может быть проведено хиральное разделение амида 2 с помощью хиральной ВЭЖХ, получая его энантиомеры. Альтернативно, может быть проведено хиральное разделение кетонов 3-10, 77 и 82 с помощью хиральной ВЭЖХ, получая их энантиомеры. Хиральное разделение эфира, амида или кетонов также может достигаться другими методами, известными специалистам в данной области техники, как, например, фракционная кристаллизация диастереомерных солей, образованных хиральными кислотами. Добавление бензильного реактива Гриньяра (схема 3) является стереоселективным процессом и предоставляет в основном один диастереомер только с небольшими количествами второго диастереомера. Во время удаления бензильной группы не наблюдается эпимеризация. Альтернативно, энантиомерно чистые продукты получают превращением в N-защищенный аналог, как, например, бутилоксикарбонил или карбобензилокси, с последующим разделением с помощью хиральной ВЭЖХ. Удаление N-защитной группы приводит к энантиомерно высоко обогащенным продуктам. В экспериментальных методиках, описанных ниже, используются следующие сокращения: ВЭЖХ = высокоэфективная жидкостная хроматография;Tmass = температура реакционной смеси. Полученные аналитические данные LCMS относятся к(i) 6-минутному циклу, выполненному на колонке (C18 503 мм, 5 мкм), используя градиент [от 90% Н 2 О (+0,04% муравьиной кислоты) до 90% ACN (+0,04% муравьиной кислоты)] в течение 4 мин и потом удерживая в течение 2 мин; или к(ii) 12-минутному циклу, выполненному на колонке (C18 1003 мм 5 мкм), используя градиент [от 90% Н 2 О (+0,04% муравьиной кислоты) до 90% ACN (+0,04% муравьиной кислоты)] в течение 9 мин и потом удерживая в течение 3 мин. Общие методики синтезов для получения примеров 1-32 и 35-38. Общая методика 1. Получение N-бензил морфолин алкил кетонов. К раствору карбоксамида 2 в безводном THF при 0 С добавляют раствор необходимого реактива Гриньяра (1,2-3 экв. одной или двумя аликвотами). Реакционную смесь нагревают до комнатной температуры и оставляют при перемешивании в течение от 45 мин до 2 ч перед гашением или 1 М соляной кислотой, или насыщенным раствором хлорида аммония и экстракцией или в DCM, или в этил ацетате. Объединенные органические слои сушат над сульфатом магния, фильтруют и концентрируют в вакууме,получая соответствующие алкил кетоны 3-10, 77 и 82. Общая методика 2. Получение N-бензил третичных спиртов. К раствору кетонов 3-10, 77 и 82 в безводном THF при 0 С добавляют раствор необходимого бензильного реактива Гриньяра (1,1-1,5 экв.). Реакционную смесь оставляют нагреваться до комнатной температуры и оставляют при перемешивании в течение 1-2 ч перед гашением путем добавления холодной воды. После экстракции водного слоя DCM объединенные органические слои промывают солевым раствором, сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получая указанные в заглавии N-бензильные третичные спирты. Подробности очистки перечислены для индивидуальных соединений. Общая методика 3. Дебензилирование N-бензильных третичных спиртов. К раствору необходимого N-бензильного третичного спирта в безводном DCM добавляют основание Хюнига (Argonaut, 3,56 ммоль/г, 2-4 экв.) на твердом носителе и -хлорэтил хлорформиат (от 3 до 10 экв.) при комнатной температуре в атмосфере азота. Реакционную смесь нагревают до 40 С и реакцию контролируют с помощью анализа FIA+ и LCMS. После окончания реакции реакционную смесь фильтруют и смолу промывают DCM. Объединенные органические фазы концентрируют в вакууме. Добавляют метанол и раствор нагревают при 60 С в течение от 1,5 до 8 ч. После полного израсходования исходных веществ метанольный раствор выпаривают, получая продукт, который дальше очищают, как подробно описано для индивидуальных соединений. Общая методика 4. Превращение аминов в гидрохлоридные соли. К раствору необходимого амина в безводном диэтиловом эфире (5-10 мл) добавляют соляную кислоту (1,2 экв., 1 М раствор в диэтиловом эфире). Эфир продувают потоком азота или удаляют в вакууме и образцы или сушат под высоким вакуумом в течение нескольких часов, или сушат вымораживаем (ацетонитрил/вода 1/1 [об./об.]), получая гидрохлоридные соли с приблизительно количественным выходом. Общая методика 5. Получение реактивов Гриньяра и бензильных реактивов Гриньяра. Такие реактивы получали из необходимого галогенида или бензил галогенида, используя способы,известные специалистам в данной области техники (см., например, Fieser, L.F. and Fieser, M.F. "Reagentstry", John Wiley and Sons Inc., 3rd Ed., p. 558-561). Необходимые галогениды или бензил галогениды или коммерчески доступны, или получены, используя способы, ранее опубликованные в литературе. Получение промежуточных соединений для синтеза примеров 1-32. 4-Бензилморфолин-2-карбонитрил В 1-литровый реактор с механической мешалкой, охлаждаемый с помощью ледяной бани, загружают N-бензилэтаноламин (172,2 г; 1 экв. доступный от Aldrich Chemical Company). По каплям добавляют 2-хлоракрилонитрил (100 г; 1 экв. доступный от Aldrich Chemical Company) в течение 2 мин. Температуру поддерживают между 23 и 29 С с помощью ледяной бани и потом водяной бани при 15 С. После перемешивания в течение одной ночи при комнатной температуре (водяная баня) смесь растворяют в тетрагидрофуране и перемещают в 2-литровый реактор, который охлаждают до -5 С с помощью бани лед/NaCl. Общий объем тетрагидрофурана составляет 1,35 л. Порциями добавляют трет-бутоксид калия(148 г; 1,1 экв.) в течение 1 ч, поддерживая температуру реакции при 02 С. Через 1 ч после перемешивания при 0 С смесь гасят насыщенным NaHCO3 (500 мл). Водный слой экстрагируют диэтиловым эфиром (500 мл). Органические слои сушат над MgSO4 и выпаривают досуха. Указанное в заглавии соединение (149,8 г; 65%) получают после фильтрования 250 г сухого остатка через 1 кг SiO2, элюируя со следующим градиентом: 5% AcOEt - 95% н-гептан 2,5 л,10% AcOEt - 90% н-гептан 2 л,15% AcOEt - 85% н-гептан 2 л,20% AcOEt - 80% н-гептан 5 л. Альтернативно, это промежуточное соединение может быть получено, как указано ниже. В 1600-литровый эмалированный реактор под N2 последовательно загружают 2-хлоракрилонитрил(33,2 кг, 37 9 моль) и толуол (114 л) при 21 С. Потом добавляют N-бензилэтаноламин (57 кг, 377 моль) и после реакционную смесь встряхивают при комнатной температуре в течение приблизительно 17 ч. Потом смесь разбавляют толуолом (336 л), охлаждают до приблизительно -12 С и частями (10) добавляют трет-бутоксид калия-13CTmassприблизительно -2 С. Смесь после встряхивают при приблизительно 0 С в течение 2,5 ч,потом гасят добавлением воды (142,5 л), поддерживая приблизительно 2CTmassприблизительно 8 С. Водный слой отделяют через 35 мин после перемешивания, позволяя смеси достичь 15 С, и слой толуола промывают водой (142,5 л), и водный слой отделяют. Органический слой потом концентрируют при пониженном давлении (150 мбар), поддерживая Tmass60C для того, чтобы отогнать 162 кг толуола. Фильтраты потом разбавляют толуолом (114 л) и обрабатывают SiO2 (силикагель Merck 60, 0,063-0,1 мм,74,1 кг) при встряхивании при комнатной температуре в течение 1,25 ч. SiO2 отфильтровывают и промывают толуолом (2114 л). Потом фильтраты концентрируют при пониженном давлении (150 мбар), поддерживая Tmass 60C для того, чтобы отогнать 351,8 кг толуола. Гидрохлорид 4-бензилморфолин-2-карбоновой кислоты (91) В 500-милилитровый реактор под N2 последовательно загружают толуол (36,72 мл) и 2-хлоракрилонитрил (10,7 г, 122,23 ммоль) при комнатной температуре. Потом в течение 5 мин добавляют N-бензил этаноламин (18,36 г, 121,14 ммоль) и реакционную смесь после встряхивают при комнатной температуре в течение 16 ч. Потом смесь разбавляют толуолом (110,16 мл), охлаждают до -5 С и медленно в течение 30 мин добавляют 2M раствор трет-бутоксида калия в THF (121,14 ммоль), поддерживая температуру при от -5 до 0 С. После смесь встряхивают при приблизительно от -5 до 0 С в течение 1 ч,потом гасят добавлением воды (45,9 мл). Водный слой отделяют и слой толуола промывают водой(45,9 мл) и потом смесь нагревают до комнатной температуры. Органический слой потом концентрируют при пониженном давлении при 40 С. Потом смесь разбавляют толуолом (100 мл) и экстрагируют 6NHClводн. (162 мл). Этот водный слой нагревают при кипении с обратным холодильником в течение 1 ч 30 мин, потом смесь оставляют при перемешивании при комнатной температуре в течение ночи. После кристаллизации 91 твердое вещество фильтруют, промывают 6N HClводн. (40 мл) и сушат при пониженном давлении при 40 С (19 г, выход=61%).(50 мл), DMF (0,014 мл, 1% моль) и оксалилхлорид (1,86 мл, 21,35 ммоль). Смесь нагревают при 60-65 С в течение 2 ч перед охлаждением до 0 С. Потом в течение 15 мин добавляют морфолин (6,93 г,79,60 ммоль) в дихлорэтане (20 мл), поддерживая температуру ниже 10 С. Гетерогенный раствор после встряхивают в течение 1 ч 30 мин при комнатной температуре и гасят водой (30 мл). Двухфазную смесь отфильтровывают через Hyflo Super Cel (10 г), потом после разделения органический слой концентрируют при пониженном давлении. К смеси добавляют изопропанол (80 мл) и 12N HClводн. (1,61 мл,19,41 ммоль), перемешивают в течение 10 мин и концентрируют при пониженном давлении. К смеси добавляют изопропанол (13 мл), нагревают до кипения с обратным холодильником до образования гомогенного раствора, потом его охлаждают до комнатной температуры. Осадок фильтруют, промывают изопропанолом (10 мл) и сушат под вакуумом при 40 С в течение ночи, получая 92 в виде не совсем белого порошка с общим выходом 79%. Этиловый эфир 4-бензилморфолин-2-карбоновой кислоты (1)(1030 мл) обрабатывают концентрированной серной кислотой (165 мл), прибавляя ее частями (экзотермическая реакция, температура реакционной смеси поднимается от температуры окружающей среды до 65 С). Потом смесь нагревают при кипении с обратным холодильником в течение 66 ч. Раствор охлаждают и потом концентрируют в вакууме до половины объема, основность повышают водным карбонатом калия (остерегаться вспенивания) и продукт экстрагируют в диэтиловом эфире. Органическую фазу сушат над сульфатом магния, фильтруют и выпаривают досуха в вакууме, получая масло. Это вещество переносят в дальнейшем под высоким вакуумом. Выход=121,3 г (87%). Альтернативно, соединение 1 может быть синтезировано, как указано ниже. В 100-литровый реактор, соединенный с газопромывной колонной, наполненной 1N NaOH (60 л),наполняют в атмосфере азота 4-бензилморфолин-2-карбонитрилом (1867 г, 9,23 моль) и этанолом(20 л). При Tmass=15-20C к раствору в течение 20 мин добавляют концентрированную серную кислоту(2,76 л, 50 моль) (сильно экзотермическая реакция). Раствор нагревают до кипения с обратным холодильником в течение 2,5 дней. Потом под вакуумом отгоняют 10 л растворителя и реакционную смесь охлаждают до Tmass=20-25C. В течение 25 мин добавляют воду (40 л), с последующим добавлением раствора Na2CO3 (1/2 насыщенный, 18 л) и NaHCO3 (1/2 насыщенный, 7 л), достигая рН 7. Добавляют этилацетат (15 л) и фазы перемешивают в течение 15 мин. Органическую фазу отделяют и водную фазу экстрагируют этилацетатом (210 л). Объединенные органические слои выпаривают досуха под вакуумом, получая 1 в виде масла, которое имеет цвет от желтого до коричневого (1992 г, 87%). Этиловый эфир 4-бензилморфолин-2-карбоновой кислоты (1b) Соединение 1 может быть разделено на его энантиомеры с помощью хиральной ВЭЖХ при следующих условиях: Daicel Chiralpak OJ 20 мкм; 25 см; 100% EtOH+0,3% DMEA; 0,4 мл/мин; выявление при 260 нм. Желаемый энантиомер (1b) имеет пик, элюируя при RT=20,25 мин. Метоксиметиламид 4-бензилморфолин-2-карбоновой кислоты (2)(200 мл) в атмосфере азота при 0 С по каплям добавляют раствор триметилалюминия (2 М раствор в гексане, 34 мл, 67,6 ммоль) в течение 30 мин. Реакционную смесь нагревают до комнатной температуры и оставляют при перемешивании в течение 1 ч. Потом в течение 30 мин по каплям добавляют раствор эфира 1 (6,74 г, 27 ммоль) в безводном DCM (100 мл) и реакционную смесь оставляют при перемешивании в течение ночи перед гашением осторожным добавлением раствора фосфатного буфера (динатрий гидрофссфата, рН 8). Осадок отделяют фильтрованием через подушку целита и остаток промывают хлороформом. Органическую фазу потом концентрируют в вакууме и промывают водой. Водный слой повторно экстрагируют хлороформом и органические фазы объединяют, промывают солевым раствором, сушат над сульфатом магния и растворитель выпаривают в вакууме, получая 2 в виде желтого масла. Альтернативно, реакция может быть проведена, как указано ниже: после добавления раствора эфира 1 (1 экв.) реакционную смесь оставляют при перемешивании в течение 1 ч перед гашением добавлением раствора фосфатного буфера (динатрий гидрофосфата, рН 8), с последующим добавлением воды. Водный слой повторно экстрагируют DCM и органические фазы объединяют, сушат над сульфатом магния и DCM,выпаривают в вакууме, получая 2 в виде желтого масла (3,36 г, 47%). ММ 264,33; C14H20N2O3; 1 Соединение 2 может быть разделено на его энантиомеры с помощью хиральной ВЭЖХ при следующих условиях: Daicel Chiralpak OJ 20 мкм; 25 см; н-гептан/изопропанол 80:20 об./об.; 0,4 мл/мин; детектирование при 220 нм. Желаемый энантиомер (2b) имеет пик, элюируемый при (RT=8,25 мин). Альтернативно, соединение (2b) может быть синтезировано, в основном как изложено выше для соединения 2, используя соединение (1b) вместо соединения 1. Бромид 2-фенил-5-фтор бензила Указанное в заглавии соединение получают в 5 стадий из коммерчески доступной (Aldrich) 5-фторсалициловой кислоты, следуя литературным методикам (JACS, 2000, 122, 4020-4028). ММ 265,13; C13H10BrF; 1 Н ЯМР (CDCl3): 7,48-7,38 (5 Н, м), 7,26-7,19 (1 Н, м), 7,05 (1 Н, тд, 8,3 Гц, 2,8 Гц), 4,39 (2 Н, с); 19 К раствору 2-метокси-5-фторбензальдегида (11,093 г, 1 экв., доступный от Aldrich Chemical Company) в метаноле при -10 С в атмосфере азота частями добавляют NaBH4 (7,515 г, 2,7 экв.). Раствор нагревают до комнатной температуры и через 30 мин растворитель удаляют при пониженном давлении и помещают в дихлорметан. Этот раствор выливают на воду со льдом и затем экстрагируют дихлорметаном. Органические фракции собирают и сушат (MgSO4) и растворитель удаляют при пониженном давлении, получая указанное в заглавии соединение в виде масла (9,794 г, 87%). ММ 156,16; C8H9FO2; 1 Чистый (5-фтор-2-метоксифенил)-метанол (19,587 г, 1 экв.) добавляют к чистому SOCl2 (42,2 мл,4,6 экв.) при -78 С в атмосфере азота и раствор потом нагревают до комнатной температуры и перемешивают до тех пор, пока не прекратится выделение газа. В колбу добавляют эквивалентный объем безводного толуола и раствор нагревают до 60 С. Для охлаждения реакционный раствор выливают на воду со льдом. Слой толуола отделяют и сушат (MgSO4), и растворитель удаляют при пониженном давлении. Неочищенное вещество сублимируют (60-80 С/0,05 мбар), получая указанное в заглавии соединение в виде белого твердого вещества (13,40 г, 61%). ММ 174,60; C8H8ClFO; 1N2. Раствор 5-фтор-2-метоксибензил хлорида (116 г, 0,664 моль, 1,5 экв.) в диэтиловом эфире (200 мл) загружают в капельную воронку. Добавляют кристаллы йода и небольшое количество раствора хлорида 5-фтор-2-метоксибензила и реакционную смесь перемешивают для начала реакции. Потом по каплям добавляют остаток раствора хлорида 5-фтор-2-метоксибензила, поддерживая температуру реакционной смеси ниже 28 С. Смесь перемешивают в течение 5 мин при 19 С и после завершения добавления образуется белая суспензия. 1-[4-(Фенилметил)морфолин-2-ил]этан-1-он (3) Соединение 3 получают из 2 (0,730 г, 2,8 ммоль) и коммерчески доступного (Aldrich) бромида метил магния (1 М раствор в THF, 3 мл, 3 ммоль, 1,1 экв.) в безводном THF (25 мл), следуя общей методике 1 после очистки с помощью автоматизированной колоночной хроматографии (элюент Соединение 4 получают из 2 (0,70 г, 2,65 ммоль) и коммерчески доступного (Aldrich) бромида этил магния (2,65 мл, 7,94 ммоль, 3 экв.) в безводном THF (25 мл), следуя общей методике 1, в виде желтого масла (583 мг, 89%). ММ 249,36; C15H23NO2. Соединение 5 получают из 2 (3,018 г, 11,4 ммоль) и коммерчески доступного (Aldrich) хлорида изопропил магния (2 М раствор в THF, 17,1 мл, 34,3 ммоль, 3 экв.) в THF (100 мл), следуя общей методике 1,- 28009960 в виде желтого масла (2,68 г, 89%); ММ 263,38; C16H25NO2; Соединение 6 получают из 2 (10 г, 37 ммоль) в безводном тетрагидрофуране (50 мл) и коммерчески доступного (Aldrich) бромида изобутил магния (2 М раствор в диэтиловом эфире, 56 ммоль, 28 мл,1,5 экв.), следуя общей методике 1. После перемешивания в течение 1 ч реакцию гасят добавлением водной соляной кислоты (150 мл). THF удаляют в вакууме и добавляют диэтиловый эфир после корректировки рН добавлением насыщенного раствора бикарбоната натрия. Органические фазы объединяют, сушат над сульфатом магния и растворитель удаляют в вакууме. 6 выделяют с чистотой 80% (8,7 г, 67% относительно чистого продукта). ММ 261,37; C16H23NO2;(Aldrich) бромида циклопентил магния (2 М раствор в диэтиловом эфире, 19,1 мл, 38,2 ммоль,3 экв.), следуя общей методике 1, с количественным выходом в виде желтого масла. ММ 273,38; C17H23NO2; Соединение 8 получают в безводном ТГФ (30 мл) из 2 (2,84 г, 10,74 ммоль) и хлорида 4-тетрагидропиранил магния (Chem. Ber. 98, 1965, 3757) (2 М раствор в тетрагидрофуране, 6,5 мл,13 ммоль, 1,2 экв.), следуя общей методике 1. Через 30 мин добавляют дополнительный 4-хлорид тетрагидропиранил магния (2 М раствор в диэтиловом эфире, 6,5 мл, 13 ммоль, 1 экв.). После перемешивания в течение 2 ч реакционную смесь гасят добавлением раствора хлорида аммония (30 мл) и этил ацетата(30 мл). Водный слой повторно экстрагируют этилацетатом (30 мл) и органические фазы объединяют,сушат над сульфатом магния и растворители удаляют в вакууме. Полученный осадок очищают с помощью ионообменной хроматографии, получая 8 в виде желтого масла (2,98 г, 96%). ММ 289,38; C17H23NO3;LCMS: (6-минутный способ); m/z 290 [М+Н]+, RT=2,20 мин. Альтернативно, соединение 8 может быть получено, как указано ниже. а) Нейтрализация 92. Соединение 92 (97 г) суспендируют в толуоле (485 мл) при механическом перемешивании и добавляют карбонат натрия (3,68N, 97 мл, 1,2 экв.). Потом смесь разбавляют водой (194 мл) и перемешивают в течение 45 мин при комнатной температуре. Потом двухфазную смесь фильтруют через Hyflo SuperCel и перемещают в делительную воронку. Водный слой отделяют и органический слой (594,3 г) концентрируют при пониженном давлении при 40 С до массы 348 г. Добавляют толуол (150 мл) и органический слой концентрируют в таких же условиях до массы 347 г. Свободное основание соединения 92, в виде толуолового раствора, потом разбавляют безводным THF (300 г) и раствор готов для добавления к реактиву Гриньяра.b) Получение реактива Гриньяра. Инертную 3-литровую 3-горлую колбу наполняют THF (50 мл) и стружками магния (9 г,0,370 моль, 1,25 экв.). Смесь нагревают до Tmass=60C и добавляют йод (0,150 г) и- 29009960 4-хлортетрагидропиран (1 мл). Инициирование реакции наблюдается в пределах 5 мин. Потом смесь нагревают до Tmass=63-68C и в течение 1 ч добавляют остаток 4-хлортетрагидропирана (39,19 мл, разведенные 188 мл THF), поддерживая Tmass приблизительно при 68 С. После 40 мин встряхивания реакционную смесь охлаждают до комнатной температуры.c) Реакция Гриньяра. Толуол/THF раствор нейтрализованного 92 добавляют к реактиву Гриньяра при 20-25 С в течение 45 мин. После смесь встряхивают при комнатной температуре в течение 1 ч. Потом реакционную смесь гасят добавлением при 0-5 С к смеси уксусная кислота/H2O (44,3 мл уксусной кислоты и 245 мл Н 2 О). Водный слой отделяют и отбрасывают и органический слой промывают H2O (60 мл). Водный слой отделяют и органический слой промывают 2N NaOH (100 мл). Водный слой отделяют и органический слой концентрируют при пониженном давлении при 40 С до 230 г. К осадку добавляют IPA (1 л) и концентрируют, как изложено выше, получая 230 г 8 в виде свободного основания. Инертный 6-литровый реактор загружают THF (242,5 мл), магний (54,47 г, 2240 ммоль) и 5% от общего количества 4-хлортетрагидропирана (12,28 мл, 112 ммоль). Потом добавляют небольшое количество метил йодида (0,5 мл) и один кристалл йода. Реакционную смесь перемешивают и нагревают до 64-66 С. После инициирования реакции в течение 135 мин медленно добавляют оставшийся 4-хлортетрагидропиран (233,22 мл, 2127 ммоль), разбавленный THF (890 мл). Смесь нагревают в течение дополнительных 30 мин перед охлаждением до 0 С. Потом в течение 180 мин между 0-4 С добавляют амид Вайнреба 2b (370 г, 1400 ммоль), разбавленный в THF (2777 мл), и смесь перемешивают в течение дополнительных 60 мин. Потом к смеси добавляют уксусную кислоту (48 мл, 0,83 ммоль) с последующим добавлением смеси 55/45:об./об.:насыщенного NH4Cl/H2O (2590 мл), поддерживая температуру ниже 9 С. Органический слой промывают смесью 60/40: об./об.: насыщенного NH4Cl/H2O (500 мл) и после разделения к органическому раствору добавляют толуол (1800 мл) и воду (1800 мл). Потом после экстракции добавляют воду (1100 мл) к толуоловой смеси, основность которой повышают 3,68 МNa2CO3 водн. (148 мл). Органический слой сушат над MgSO4, фильтруют и концентрируют при пониженном давлении досуха, получая соединение 8b в виде свободного основания (400,8 г, выход 98,6%). Альтернативно, соединение 8b может быть получено, как указано ниже. К раствору 8 (3,15 г, 10,8 ммоль) в изопропаноле (20 мл) добавляют R-(-)-миндальную кислоту(1,65 г, 10,8 ммоль). Через 2 мин после встряхивания при комнатной температуре получают гомогенный раствор. Кристаллизация начинается через 5 мин после встряхивания, образуется легко перемешиваемая суспензия. Эту суспензию после перемешивают в течение 21 ч при комнатной температуре. Твердое вещество отфильтровывают и промывают изопропанолом (2 мл). Белые кристаллы сушат под вакуумом при 40 С в течение 5 ч, получая 1,8 г 8b соли R-миндальной кислоты с выходом 37,5% и ее 99,2%. К перемешанной суспензии 8b соли R-миндальной кислоты (500 мг, 1,13 ммоль) в толуоле (5 мл) по каплям добавляют 0,5N K2CO3 (2,4 мл, 1,2 ммоль). Получают двухфазный раствор. Свободное основание 8b полностью находится в органическом слое, который отделяют, концентрируют с помощью роторного испарителя и сушат под вакуумом при 40 С, получая 8b в виде масла с выходом 98%. 5,5,5-Трифтор-1-[4-(фенилметил)морфолин-2-ил]бутан-1-он (9) Соединение 9 получают из 2 (1,38 г, 5,23 ммоль) и бромида 3,3,3-трифторпропил магния (20,9 мл,10,50 ммоль, 2 экв.) в безводном THF (45 мл), следуя общей методике 1. 3,3,3-Трифторпропил бромид магния получают из коммерчески доступного (Aldrich) 3,3,3-трифторпропил бромида, следуя общей методике 5. Очисткой с помощью ионообменной хроматографии получают 9 в виде масла (1,24 г, 78,7%). ММ 301,31; C15H18F3NO2;
МПК / Метки
МПК: C07D 265/30, A61K 31/5377, A61P 25/22, A61K 31/5375, C07D 413/06
Метки: норадреналина, повторного, захвата, производные, ингибиторов, морфолина, качестве
Код ссылки
<a href="https://eas.patents.su/30-9960-proizvodnye-morfolina-v-kachestve-ingibitorov-povtornogo-zahvata-noradrenalina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные морфолина в качестве ингибиторов повторного захвата норадреналина</a>
Предыдущий патент: Гербицидные смеси
Следующий патент: Жилой дом вторичной застройки
Случайный патент: Игровой автомат












