Замещенные 6,5-гетеробициклические производные
Формула / Реферат
1. Соединение формулы
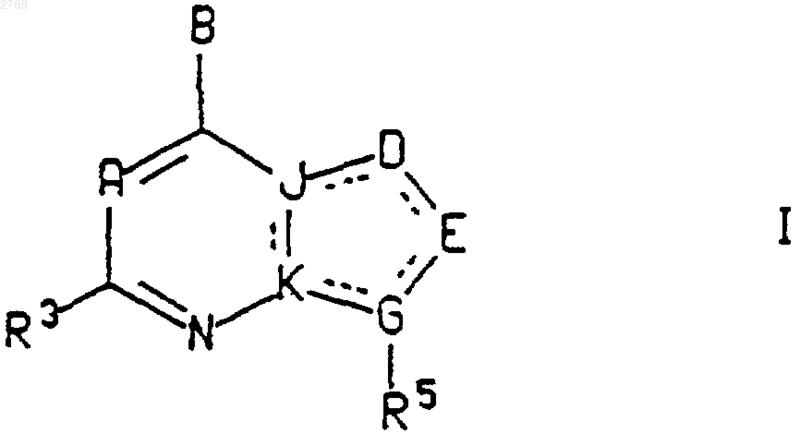
или его фармацевтически приемлемая соль, где пунктирные линии представляют собой возможные двойные связи;
А представляет собой азот или CR7;
В представляет собой -NR1R2, -CR1R2R10, -C(=CR2R11)R1, -NHCR1R2R10, -OCR1R2R10, -SCR1R2R10, -CR2R10NHR1, -CR2R10OR1, -CR2R10SR1 или -COR2;
J и K, каждый независимо, представляет собой азот или углерод, а оба J и K не представляют собой азот;
D и Е, каждый независимо, выбран из азота, CR4, C=O, C=S, серы, кислорода, CR4R6 и NR8;
G представляет собой азот или углерод;
кольцо, содержащее D, Е, G, К и J, в формуле I может быть насыщенным или ненасыщенным 5-членным кольцом, и может возможно содержать одну или две двойных связи, и может возможно содержать от одного до трех гетероатомов в кольце, и может возможно иметь одну или две группы С=O или С=S;
R1 представляет собой C1-С6алкил, возможно замещенный одним или двумя заместителями, независимо выбранными из гидрокси, фторо, хлоро, бромо, йодо, -O-(С1-С4алкила), СF3, -С(=O)O-(С1-С4алкила), -ОС(=O)(С1-С4алкила), -ОС(=O)N(С1-С4алкил)(С1-С2алкила), -NНСО(С1-С4алкила), -СООН, -СОО(С1-С4алкила), -СОNН(С1-С4алкила), -СОN(С1-С4алкил)(С1-С2алкила), -S(С1-C4алкила), -CN, -NO2, -SO(C1-С4алкила), -SO2(C1-С4алкила), -SO2NН(С1-С4алкила) и -SO2N(C1-С4алкил)(С1-С2алкила), где каждая из С1-С4алкильных групп в упомянутых выше R1 группах возможно может содержать одну или две двойных или тройных связи;
R2 представляет собой С1-С12алкил, который возможно может содержать от одной до трех двойных или тройных связей, арил или (C1-С4алкилен)арил, где указанный арил и арильная группировка указанного (С1-С4алкилен)арила выбрана из фенила, нафтила, тиенила, бензотиенила, пиридила, хинолила, пиразинила, пиримидинила, имидазолила, фуранила, бензофуранила, бензотиазолила, изотиазолила, пиразолила, пирролила, индолила, пирролопиридила, оксазолила и бензоксазолила; С3-С8циклоалкил или (С1-С6алкилен)(С3-С8циклоалкил), где один или два атома углерода указанного циклоалкила и 5-8-членных циклоалкильных группировок указанного (С1-С6алкилен)(С3-С8циклоалкила) могут быть возможно и независимо заменены на атом кислорода или серы или NZ2, где Z2 выбран из водорода, С1-С4алкила, бензила и С1-С4алканоила, и где каждая из упомянутых выше R2 групп возможно может быть замещена заместителями в количестве от одного до трех, независимо выбранными из хлоро, фторо, гидрокси и С1-С4алкила, или одним заместителем, выбранным из бромо, йодо, C1-С6алкокси, -ОС(=O)(С1-С6алкила), -ОС(=O)N(С1-С4алкил)(С1-С2алкила), -S(С1-С6алкила), амино, -NH(С1-С2алкила), -N(С1-С2алкил)(С1-С4алкила), -N(С1-С4алкил)-СО-(С1-С4алкила), -NНСО(C1-C4алкила), -СООН, -СОО(С1-С4алкила), -СОNH(C1-C4алкила), -CON(C1-C4aлкил)(C1-С2алкила), -SH, -CN, -NO2, -SO(С1-C4алкила), -SO2(С1-С4алкила), -SO2NН(С1-С4алкила) и -SO2N(С1-С4алкил)(С1-С2алкила);
-NR1R2 или CR1R2R10 могут образовывать насыщенное 3-8-членное карбоциклическое кольцо, которое возможно может содержать от одной до трех двойных связей, и где один или два кольцевых атома углерода таких 5-8-членных колец возможно и независимо могут быть заменены на атом кислорода или серы или NZ3, где Z3 представляет собой водород, С1-С4алкил, бензил или С1-C4алканоил;
R3 представляет собой С1-С4алкил, -O(С1-С4алкил) или -S(С1-С4алкил);
каждый R4 независимо представляет собой водород, (C1-С6алкил), фторо, хлоро, бромо, йодо, гидрокси, циано, амино, (С1-С2алкилен)-ОН, CF3, СН2SСН3, нитро, -O(С1-С4алкил), -N(С1-С4алкил)(С1-С2алкил), -S(C1-С4алкил), -СО(С1-С4алкил), -С(=O)Н или -С(=O)O(С1-С4алкил);
R6 представляет собой водород, метил или этил;
R8 представляет собой водород или С1-C4алкил;
R5 представляет собой фенил, замещенный заместителями R13 в количестве от одного до трех, независимо выбранными из фторо, хлоро, С1-С6алкила, -O(С1-С6алкила), бромо, йодо и -S(С1-С6алкила);
R7 представляет собой водород, С1-C4алкил, галогено (например хлоро, фторо, йодо или бромо), гидрокси, -O(С1-С4алкил), -С(=O)(С1-С4алкил), -С(=O)O(С1-С4алкил), -ОСF3, -CF3, -CH2OH или -СН2O(С1-С2алкил);
R10 представляет собой водород, гидрокси, метокси или фторо;
R11 представляет собой водород или С1-С4алкил; и
при условии, что: а) когда оба J и K представляют собой углерод, a D представляет собой CR4 и Е представляет собой азот, тогда G не может быть азотом; б) когда оба J и K представляют собой углерод и D и G представляют собой азот, тогда Е не может быть CR4, CR4R6, C=O или C=S; в) когда оба J и K представляют собой углерод и D и Е представляют собой углерод, тогда G не может быть азотом; г) когда G представляет собой углерод, тогда G должен быть связан двойной связью с Е; и д) в кольце, содержащем J, K, D, Е и G, не может быть двух двойных связей, соседних друг другу;
и фармацевтически приемлемые соли таких соединений.
2. Соединения по п.1, где В представляет собой -NR1R2, -NHCHR1R2, -OCHR1R2, и R1 представляет собой C1-С6алкил, который возможно может быть замещен одной группой фторо или С1-С4алкокси и который возможно может содержать одну двойную или тройную связь, и R2 представляет собой С1-С4алкил или (С1-С2алкил)-СО-(С1-С2алкил), который возможно может содержать одну двойную или тройную связь.
3. Соединения по п.1, где В представляет собой -CHR1R2, -NR1R2, -NHCHR1R2, -OCHR1R2, -SCHR1R2, и R1 представляхт собой C1-С6алкил, который возможно может быть замещен одной группой гидрокси, фторо, CF3, циклопропил или С1-С4алкокси и который возможно может содержать одну двойную или тройную связь, и R2 представляет собой бензил или C1-С6алкил, который возможно может содержать одну двойную или тройную связь, где указанные С1-С6алкил и фенильная группировка указанного бензила возможно могут быть замещены одной группой фторо, гидрокси, CF3, циклопропил, С1-С2aлкил, С1-С2алкокси или хлоро.
4. Соединения по п.1, где R3 представляет собой метил.
5. Соединения по п.1, где R4, R6 и R8 представляют собой водород или метил.
6. Соединения по п.1, где R5 представляет собой ди- или тризамещенный фенил, в котором два или три заместителя независимо выбраны из С1-С4алкила, O-(С1-С4алкила), хлоро, фторо, бромо и йодо.
7. Соединения по п.1, где R3 представляет собой метил, этил или метокси и каждый из R4, R6 и R8 независимо представляет собой водород, метил или этил.
8. Соединения по п.1, где А представляет собой N, СН или ССН3.
9. Соединения по п.1, где А представляет собой СН, J и K представляют собой углерод, a D, Е и G представляют собой азот.
10. Соединения по п.1, где J и D представляют собой азот, а K и G представляют собой углерод и Е представляет собой СН, ССН3 или СС2Н5.
11. Соединения по п.1, где J и K представляют собой углерод, a D=EG представляет собой O-С(СН3)=С, O-СН=С, S-С(СН3)=С, S-CH=C, N(СН3)-С(СН3)=С, NНС(СН3)=С, NНС(СН3СН2)=С, N(СН3)-СН=С, O-N=C, S-N=C, N(СН3)-N=С, O-CH2N или S-СН2N.
12. Соединение по п.1, где В представляет собой -CHR1R2, -NCHR1R2 или -OCHR1R2, а группа CHR1R2 радикала В представляет собой циклопентановое кольцо, тетрагидрофурановое кольцо или тетрагидротиенильное кольцо.
13. Соединение по п.1, где NR1R2 группа радикала В представляет собой пятичленное насыщенное или ненасыщенное гетероциклическое кольцо.
14. Соединение по п.13, где NR1R2 представляет собой пиррольное кольцо, пирролидиновое кольцо, тиазолидиновое кольцо или морфолиновое кольцо.
15. Фармацевтическая композиция для лечения, предупреждения или подавления расстройства, лечение которого может быть осуществлено или лечению которого можно способствовать посредством антагонизации КВФ (кортикотропин высвобождающего фактора), включая, но не ограничиваясь расстройствами, вызванными КВФ или которым способствовал КВФ, в частности расстройства, выбранного из воспалительных расстройств, таких как ревматоидный артрит и остеоартрит, боль, астма, псориаз и аллергии; расстройства генерализованной тревоги; панического расстройства; фобий; обсессивно-компульсивного расстройства; посттравматического стрессового расстройства; нарушений сна, вызванных стрессом; перцепции боли, такой как фибромиалгия; эмоциональных расстройств, таких как депрессия, в том числе основная депрессия, однократная эпизодическая депрессия, рецидивирующая депрессия, вызванная злоупотреблениями детская депрессия, эмоциональные расстройства, ассоциированные с предменструальным синдромом, и послеродовая депрессия; дистемии; биполярных расстройств; циклотимии; синдрома хронической усталости; вызванной стрессом головной боли; рака; синдрома раздраженного кишечника, болезни Крона; синдрома раздраженной толстой кишки; послеоперационного илеуса; язвы; диареи; лихорадки, вызванной стрессом; инфекций вируса иммунодефицита человека (ВИЧ); нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона; желудочно-кишечных заболеваний; нарушений аппетита, таких как анорексия и нервно-психическая булимия; геморрагического стресса; химических зависимостей и аддикций (например зависимостей от алкоголя, кокаина, героина, бензодиазепинов или других лекарственных средств); симптомов лекарственной и алкогольной абстиненции; вызванных стрессом психотических эпизодических состояний; эутиреоидного синдрома слабости; синдрома несоответствующего антидиуретического гормона (АДГ); ожирения; бесплодия; травм головы; травм спинного мозга; ишемического нейронального повреждения (например церебральной ишемии, такой как церебральная гиппокампальная ишемия); экситотоксического нейронального повреждения; эпилепсии; удара; иммунных дисфункций, в том числе иммунных дисфункций, вызванных стрессом (например свиного стресс-синдрома, вызванной перевозкой бычьей лихорадки, конской пароксизмальной фибрилляции и дисфункций у цыплят, вызванных их безвыгульным содержанием, стресса у овцы, вызванного стрижкой, или стресса у собак, связанного с взаимоотношениями человек-животное); мышечных спазм; недержания мочи; старческой деменции Альцгеймеровского типа; мультиинфарктной деменции; бокового амиотрофического склероза; гипертензии; тахикардии; застойной сердечной недостаточности; остеопороза; преждевременных родов; и гипогликемии, у млекопитающего, содержащая соединение по п.1 в количестве, которое является эффективным при лечении такого расстройства, и фармацевтически приемлемый носитель.
16. Способ лечения, предупреждения или подавления расстройства, лечение которого может быть осуществлено или лечению которого можно способствовать посредством антагонизации КВФ (кортикотропин высвобождающего фактора), включая, но не ограничиваясь расстройствами, вызванными КВФ или которым способствовал КВФ, в частности расстройства, выбранного из воспалительных расстройств, таких как ревматоидный артрит и остеоартрит, боль, астма, псориаз и аллергии; расстройства генерализованной тревоги; панического расстройства; фобий; обсессивно-компульсивного расстройства; посттравматического стрессового расстройства; нарушений сна, вызванных стрессом; перцепции боли, такой как фибромиалгия; эмоциональных расстройств, таких как депрессия, в том числе основная депрессия, однократная эпизодическая депрессия, рецидивирующая депрессия, вызванная злоупотреблениями детская депрессия, эмоциональные расстройства, ассоциированные с предменструальным синдромом, и послеродовая депрессия; дистемии; биполярных расстройств; циклотимии; синдрома хронической усталости; вызванной стрессом головной боли; рака; синдрома раздраженного кишечника, болезни Крона; синдрома раздраженной толстой кишки; послеоперационного илеуса; язвы; диареи; лихорадки, вызванной стрессом; инфекций вируса иммунодефицита человека (ВИЧ); нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона; желудочно-кишечных заболеваний; нарушений аппетита, таких как анорексия и нервно-психическая булимия; геморрагического стресса; химических зависимостей и аддикций (например зависимостей от алкоголя, кокаина, героина, бензодиазепинов или других лекарственных средств); симптомов лекарственной и алкогольной абстиненции; вызванных стрессом психотических эпизодических состояний; эутиреоидного синдрома слабости; синдрома несоответствующего антидиуретического гормона (АДГ); ожирения; бесплодия; травм головы; травм спинного мозга; ишемического нейронального повреждения (например церебральной ишемии, такой как церебральная гиппокампальная ишемия); экситотоксического нейронального повреждения; эпилепсии; удара; иммунных дисфункций, в том числе иммунных дисфункций, вызванных стрессом (например свиного стресс-синдрома, вызванной перевозкой бычьей лихорадки, конской пароксизмальной фибрилляции и дисфункций у цыплят, вызванных их безвыгульным содержанием, стресса у овцы, вызванного стрижкой, или стресса у собак, связанного с взаимоотношениями человек-животное); мышечных спазм; недержания мочи; старческой деменции Альцгеймеровского типа; мультиинфарктной деменции; боковюую амиотрофического склероза; гипертензии; тахикардии; застойной сердечной недостаточности; остеопороза; преждевременных родов; и гипогликемии, у млекопитающего, при котором субъекту, нуждающемуся в указанном лечении, вводят соединение по п.1 в количестве, которое является эффективным при лечении такого расстройства.
17. Способ лечения или предупреждения расстройства или состояния, лечение или предупреждение которого может быть осуществлено или лечению или предупреждению которого можно способствовать посредством ингибирования КВГ (кортикотропин высвобождающий гормон) связывающего белка, у млекопитающего, при котором указанному млекопитающему вводят соединение по п.1 в количестве, ингибирующем КВГ связывающий белок.
18. Фармацевтическая композиция для лечения или предупреждения расстройства или состояния, лечение или предупреждение которого может быть осуществлено или лечению или предупреждению которого можно способствовать посредством ингибирования КВГ связывающего белка, у млекопитающего, содержащая соединение по п.1 в количестве, ингибирующем КВГ связывающий белок, и фармацевтически приемлемый носитель.
19. Соединение по п.10 или 11, где А представляет собой N или СН, R3 представляет собой метил, а R4, R6 и R8, каждый независимо, представляет собой водород или метил.
20. Соединение по п.19, где R5 представляет собой ди- или тризамещенный фенил, где два или три заместителя независимо выбраны из С1-С4алкила, O-(С1-С4алкила), хлоро, фторо, бромо и йодо.
21. Соединение формулы
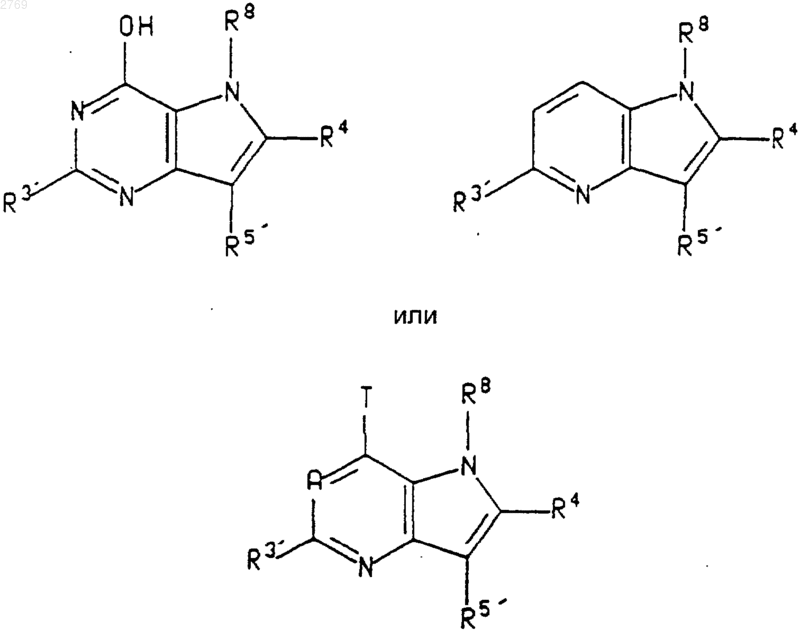
где R3' представляет собой С1-С4алкил, R5' представляет собой водород, метил, хлоро, бромо, -СООН или -СОО(С1-С4алкил), Т представляет собой хлоро, бромо, йодо или трифлат, R8 представляет собой водород или C1-С4алкил, а R4 представляет собой водород, (С1-С6алкил), фторо, хлоро, бромо, йодо, гидрокси, циано, амино, (С1-С2алкилен)-ОН, СF3, СН2SCН3, нитро, -O(С1-С4алкил), -N(С1-С4алкил)(С1-С2алкил), -S(C1-C4aлкил), -СО(С1-С4алкил), -С(=O)Н или -С(=O)O(С1-С4алкил).
22. Соединение по п.1, которое представляет собой
7-(1-этилпропокси)-5-метил-3-(2,4,6-триметилфенил)-пиразоло[1,5-а]-пиримидин;
[2,5-диметил-3-(2,4,6-триметилфенил)-пиразоло[1,5-а]пиримидин-7-ил]-(1-этилпропил)-амин;
(1-этилпропил)-[5-метил-3-(2,4,6-триметилфенил)-пиразоло[1,5-а]-пиримидин-7-ил]-амин;
7-(1-этилпропокси)-2,5-диметил-3-(2,4,6-триметилфенил)-пиразоло[1,5-а]пиримидин;
[2,5-диметил-3-(2,4,6-триметилфенил)-пиразоло[1,5-а]пиримидин-7-ил]-этилпропиламин;
[6-бром-5-бромметил-3-(2,4,6-триметилфенил)-3Н-[1,2,3]триазоло[4,5-b]-пиридин-7-ил]-(1-этилпропил)-амин;
(1-этилпропил)-[5-метил-3-(2,4,6-триметилфенил)-3Н-[1,2,3]-триазоло[4,5-b]-пиридин-7-ил]-амин;
[6-бром-5-метил-3-(2,4,6-триметилфенил)-3Н-[1,2,3]триазоло[4,5-b]-пиридин-7-ил]-(1-этилпропил)-метиламин;
7-(1-этилпропокси)-5-метил-3-(2,4,6-триметилфенил)-3Н-[1,2,3]-триазоло[4,5-b]пиридин;
4-(1-этилпропокси)-2,5-диметил-7-(2,4,6-триметилфенил)-5Н-пирроло[3,2-d]пиримидин;
(+)-2,5-диметил-4-(тетрагидрофуран-3-илокси)-7-(2,4,6-триметилфенил)-5Н-пирроло[3,2-d]пиримидин;
2,5-диметил-4-(S)-(тетрагидрофуран-3-илокси)-7-(2,4,6-триметилфенил)-5Н-пирроло[3,2-d]пиримидин;
2,5-диметил-4-(1-пропилбутокси)-7-(2,4,6-триметилфенил)-5Н-пирроло[3,2-d]пиримидин; или
4-вторбутилсульфанил-2,5-диметил-7-(2,4,6-триметилфенил)-5Н-пирроло[3,2-d]пиримидин;
или фармацевтически приемлемую соль такого соединения.
Текст
1 Предпосылки изобретения Изобретение относится к некоторым фармацевтически активным замещенным 6,5-гетеробициклическим производным, содержащим их фармацевтическим композициям и способам воздействия ими на субъект, нуждающийся в их антагонистической активности в отношении кортикотропин высвобождающего фактора. Замещенные гетероциклические производные по данному изобретению проявляют активность как антагонисты кортикотропин высвобождающего фактора (гормона) КВФ (КВГ). Антагонисты КВФ упомянуты в патентах США 4605642 и 5063245, относящихся к пептидам и пиразолинонам соответственно. На них также ссылаются в следующих документах: заявка РСТ/IВ 95/00439, которая указывает США и которая была подана 6 июня 1995 года и опубликована 14 декабря 1995 года; заявкаPCT/IB 95/00373, которая указывает США и которая была подана 18 мая 1995 года и опубликована 21 декабря 1995 года; заявка на патент США 08/448539, которая была подана в РСТ 12 ноября 1993 года и введена в национальную фазу США 14 июня 1995 года; Международная заявка WO 95/10506, которая была подана 12 октября 1993 года и опубликована 20 апреля 1995 года, и заявка на патент США 08/481413, которая была подана в ведомство РСТ 26 ноября 1993 года и введена в национальную фазу США 24 июля 1995 года; заявка на патент США 08/254820, которая была подана 19 апреля 1995 года; предварительная заявка на патент США 60/008396, которая была подана 8 декабря 1995 года; и предварительная заявка на патент США 60/006333, которая была подана 8 ноября 1995 года. Содержание упомянутых выше патентных заявок во всей полноте представлено в этом документе ссылками. Важность антагонистов КВФ изложена в литературе [Р. Black, Scientific American SCIENCEMEDICINE, 1995, р. 16-25; Т. Lovenberg et al., Current Pharmaceutical Design, 1995,1,305-316; патент США 5063245, на который выше дана ссылка]. Недавний обзор различных активностей, которыми обладают антагонисты КВФ, также приведен здесь ссылкой [М.J.(1991)]. На основе исследования, описанного в этих двух и других источниках, антагонисты КВФ эффективны при лечении широкого спектра заболеваний, связанных со стрессом, эмоциональных расстройств, таких как депрессия,основное депрессивное расстройство, однократная эпизодическая депрессия, рецидивирующая депрессия, детская депрессия, вызванная злоупотреблениями, послеродовая депрессия, дистемия, биполярные расстройства и циклотимия; синдрома хронической усталости; нарушений аппетита, таких как анорексия и нервнопсихическая булимия; расстройства генерализо 002769 2 ванной тревоги; панического расстройства; фобий; обсессивно-компульсивного расстройства; посттравматического стрессового расстройства; перцепции боли, такой как фибромиалгия; головной боли; желудочно-кишечных заболеваний; геморрагического стресса; язв; психотических эпизодических состояний, вызванных стрессом; лихорадки; диареи; послеоперационного илеуса; гиперчувствительности толстой кишки; синдрома раздраженного кишечника; болезни Крона; синдрома раздраженной толстой кишки; воспалительных расстройств, таких как ревматоидный артрит и остеоартрит; боли; астмы; псориаза; аллергий; остеопороза; преждевременных родов; гипертензии; застойной сердечной недостаточности; нарушений сна; нейродегенеративных болезней, таких как болезнь Альцгеймера, старческая деменция Альцгеймера, мультиинфарктная деменция, болезнь Паркинсона и болезнь Хантингтона; травмы головы; ишемического нейронального повреждения; экситотоксического нейронального повреждения; эпилепсии; удара; травмы спинного мозга; психосоциальной карликовости; синдрома эутиреоидной слабости; синдрома несоответствующего антидиуретического гормона; ожирения; химических зависимостей и аддикций; симптомов лекарственной и алкогольной абстиненции; бесплодия; рака; мышечных спазм; недержания мочи; гипогликемии и иммунных дисфункций, в том числе иммунных дисфункций, вызванных стрессом, ослабления иммунитета и инфекций вируса иммунодефицита человека; и инфекций,вызванных стрессом у человека и животных. Также считают, что соединения по этому изобретению являются ингибиторами КВГ связывающего белка, и следовательно их можно применять при лечении расстройств, лечение которых может быть осуществлено или которому можно способствовать посредством ингибирования такого белка. Примерами таких расстройств являются болезнь Альцгеймера и ожирение. Сущность изобретения Настоящее изобретение относится к соединениям формулы или их фармацевтически приемлемым солям,где пунктирные линии представляют собой возможные двойные связи; А представляет собой азот или CR7; В представляет собой -NR1R2, -CR1R2R10,-(=CR2R11)R1,-NHCR1R2R10,-OCR1R2R10,1 2 10 2 10 1J и K каждый независимо представляет собой азот или углерод, а оба J и K не представляют собой азот;D и Е каждый независимо выбран из азота,CR4, C=O, C=S, серы, кислорода, CR4R6 и NR8;G представляет собой азот или углерод; кольцо, содержащее D, Е, G, K и J, в формуле I может быть насыщенным или ненасыщенным 5-членным кольцом, и может возможно содержать одну или две двойных связи, и может возможно содержать от одного до трех гетероатомов в кольце, и возможно может иметь одну или две группы С=O или C=S;R1 представляет собой C1-С 6 алкил, возможно замещенный одним или двумя заместителями, независимо выбранными из гидрокси,фторо, хлоро, бромо, йодо, -O-(С 1-С 4 алкила),СF3,-С(=O)O-(С 1-С 4 алкила),-OC(=O)(C1 С 4 алкила), -ОС(=O)N(С 1-С 4 алкил)(С 1-С 2 алкила),-СООН,-СОО(С 1-NНСO(С 1-C4 алкила),С 4 алкила),-СОNН(С 1-С 4 алкила),-СОN(C1 С 4 алкил)(С 1-С 2 алкила), -S(С 1-C4 алкила), -CN,-NO2, -SO(С 1-С 4 алкила), -SO2(C1-С 4 алкила),-SO2NН(С 1-С 4 алкила) и -SO2N(С 1-С 4 алкил)(С 1 С 2 алкила), где каждая из С 1-C4 алкильных групп в упомянутых выше R1 группах возможно может содержать одну или две двойных или тройных связи;R2 представляет собой С 1-С 12 алкил, который возможно может содержать от одной до трех двойных или тройных связей, арил или (С 1 С 4 алкилен)арил, где указанный арил и арильная группировка указанного (С 1-C4 алкилен)арила выбрана из фенила, нафтила, тиенила, бензотиенила, пиридила, хинолила, пиразинила, пиримидинила, имидазолила, фуранила, бензофуранила, бензотиазолила, изотиазолила, пиразолила, пирролила, индолила, пирролопиридила,оксазолила и бензоксазолила; С 3-С 8 циклоалкил или (С 1-С 6 алкилен)(С 3-С 8 циклоалкил), где один или два атома углерода указанного циклоалкила и 5-8-членных циклоалкильных группировок указанного (C1-С 6 алкилен)(С 3-С 8 циклоалкила) могут быть возможно и независимо заменены на атом кислорода или серы или NZ2, где Z2 выбран из водорода, С 1-C4 алкила, бензила и С 1C4 алканоила и где каждая из упомянутых вышеR2 групп возможно может быть замещена заместителями в количестве от одного до трех, независимо выбранными из хлоро, фторо, гидрокси и С 1-C4 алкила, или одним заместителем, выбранным из бромо, йодо, C1-С 6 алкокси,-ОС(=O)(С 1-С 6 алкила),ОС(=O)N(С 1-С 4 алкил)-NR1R2 или CR1R2R10 могут образовывать насыщенное 3-8-членное карбоциклическое кольцо, которое возможно может содержать от одной до трех двойных связей и где один или два кольцевых атома углерода таких 5-8 членных колец возможно и независимо могут быть заменены на атом кислорода или серы илиR3 представляет собой С 1-C4 алкил, -O(С 1 С 4 алкил) или -S(С 1-C4 алкил); каждый R4 независимо представляет собой водород, (С 1-С 6 алкил), фторо, хлоро, бромо,йодо, гидрокси, циано, амино, (С 1-С 2 алкилен)ОН, СF3, СН 2SСН 3, нитро, -O(С 1-С 4 алкил),-N(С 1-C4 алкил)(С 1-С 2 алкил),-S(C1-С 4 алкил),-СО(С 1-С 4 алкил), -С(=O)Н или -С(=O)O(С 1 С 4 алкил);R8 представляет собой водород или С 1C4 алкил;R5 представляет собой фенил, замещенный заместителями R13 в количестве от одного до трех, независимо выбранными из фторо, хлоро,C1-С 6 алкила, -O(С 1-С 6 алкила), бромо, йодо иR11 представляет собой водород или С 1 С 4 алкил; и при условии, что: а) когда оба J и K представляют собой углерод, a D представляет собойCR4 и Е представляет собой азот, тогда G не может быть азотом; б) когда оба J и K представляют собой углерод и D и G представляют собой азот, тогда Е не может быть CR4, CR4R6,C=О или C=S; в) когда оба J и K представляют собой углерод и D и Е представляют собой углерод, тогда G не может быть азотом; г) когда G представляет собой углерод, тогда G должен быть связан двойной связью с Е; и д) в кольце,содержащем J, K, D, Е и G, не может быть двух двойных связей, соседних друг другу; и к фармацевтически приемлемым солям таких соединений. Если кольцо, содержащее D, Е, G, K и J,является 5-членным гетероароматическим кольцом, то оно может представлять собой, например, пиразоло, имидазоло, тиофено, фурано,тиазоло, оксазоло, триазоло или тиадиазоло. Термин "алкил", используемый в этом документе, если не указано иначе, включает в себя насыщенные одновалентные углеводородные радикалы, имеющие нормальные, разветвленные или циклические группировки или их комбинации. 5 Термин "алкокси", используемый в этом документе, если не указано иначе, означает -Оалкил, где "алкил" является таким, как определено выше. Примерами более конкретных воплощений соединений формулы I являются следующие соединения, в которых (R)n представляет собой заместители в количестве от нуля до двух, причем каждый заместитель является таким, как определено выше в определении формулы I. Более конкретные воплощения этого изобретения включают в себя соединения вышеуказанной формулы I, где В представляет собой-SCHR1R2, и R1 представляет собой С 1-С 6 алкил,который возможно может быть замещен одной группой гидрокси, фторо, СF3 или С 1-C4 алкокси и который возможно может содержать одну двойную или тройную связь; и R2 представляет собой бензил или С 1-С 6 алкил, который может возможно содержать одну двойную или тройную связь, где указанные С 1-С 6 алкил и фенильная группировка указанного бензила возможно могут быть замещены одной группой фторо,СF3, C1-С 2 алкил, С 1-С 2 алкокси или хлоро. Другие более конкретные воплощения этого изобретения включают в себя соединения формулы I, где R3 представляет собой метил,этил или метокси; R4 и R6 выбраны из водорода,метила и этила; R5 представляет собой ди- или тризамещенный фенил, в котором два или три заместителя на указанном фениле независимо выбраны из групп С 1-C4 алкил, -О-(C1-C4 алкил),хлоро, фторо, бромо и йодо. Другие более конкретные воплощения данного изобретения включают в себя соединения формулы I, где В представляет собой или содержит NR1R2 или CR1R2R10 группировку,которая образует насыщенное или ненасыщенное 5-членное карбоциклическое кольцо, в котором один из атомов углерода в кольце возможно может быть заменен на атом серы или кислорода. Другие более конкретные воплощения данного изобретения включают в себя соединения формулы I, где А представляет собой азот или CR7, а R7 представляет собой водород или метил. Другие более конкретные воплощения данного изобретения включают в себя соединения формулы I, где В представляет собой 8 Другие более конкретные воплощения данного изобретения включают в себя соединения формулы I, где А представляет собой СН; J и K представляют собой углерод, a D, Е и G представляют собой азот. Другие более конкретные воплощения данного изобретения включают в себя соединения формулы I, где J и D представляют собой азот, K и G представляют собой углерод, а Е представляет собой СН, СН 3 или CC2H5. Другие более конкретные воплощения данного изобретения включают в себя соединения формулы I, где В содержит -NR1R2 или-CR1R2R10 группировку, которая является насыщенным или ненасыщенным 3-5-членным кольцом. Другие более конкретные воплощения данного изобретения включают в себя соединения формулы I, где J и K представляют собой углерод, a D=E=G представляет собой OС(СН 3)=С, O-СН=С, S-С(СН 3)=С, S-CH=C,N(СН 3)-С(СН 3)=С, N(СН 3)-СН=С, O-N=C, SN=C, N(СН 3)-N=С, O-CH2N, S-CH2N или NHС(С 1-С 2 алкил)=С. Примеры предпочтительных соединений формулы I 7-(1-этилпропокси)-5-метил-3-(2,4,6-триметилфенил)-пиразоло[1,5-а]-пиримидин;[6-бром-5-метил-3-(2,4,6-триметилфенил)3 Н-[1,2,3]триазоло[4,5-b]-пиридин-7-ил]-(1 этилпропил)-метиламин; и 7-(1-этилпропокси)-5-метил-3-(2,4,6-триметилфенил)-3 Н-[1,2,3]триазоло[4,5-b]-пиридин. Другие соединения формулы I включают в себя следующие: 4-(1-этилпропокси)-2,7-диметил-8-(2,4,6 триметилфенил)-пирроло[1,2-а]пиримидин;(1-этилпропил)-[5-метил-3-(2,4,6-триметилфенил)-изоксазоло[4,5-b]пиридин-7-ил]амин; и 7-(1-этилпропокси)-5-метил-3-(2,4,6-триметилфенил)-изоксазоло[4,5-b]пиридин. Изобретение также относится к фармацевтической композиции для лечения, предупреждения или подавления расстройства, лечение которого может быть осуществлено или лечению которого можно способствовать посредством антагонизации КВФ (кортикотропин высвобождающего фактора), включая, но не ограничиваясь расстройствами, вызванными КВФ или которым способствовал КВФ, в частности расстройства, выбранного из воспалительных расстройств, таких как ревматоидный артрит и остеоартрит, боль, астма, псориаз и аллергии; расстройства генерализованной тревоги; панического расстройства; фобий; обсессивно 002769 14 компульсивного расстройства; посттравматического стрессового расстройства; нарушений сна, вызванных стрессом; перцепции боли, такой как фибромиалгия; эмоциональных расстройств, таких как депрессия, в том числе основная депрессия, однократная эпизодическая депрессия, рецидивирующая депрессия, вызванная злоупотреблениями детская депрессия, эмоциональные расстройства, ассоциированные с предменструальным синдромом, и послеродовая депрессия; дистемии; биполярных расстройств; циклотимии; синдрома хронической усталости; вызванной стрессом головной боли; рака; синдрома раздраженного кишечника, болезни Крона; синдрома раздраженной толстой кишки; послеоперационного илеуса; язвы; диареи; лихорадки, вызванной стрессом; инфекций вируса иммунодефицита человека (ВИЧ); нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона; желудочно-кишечных заболеваний; нарушений аппетита, таких как анорексия и нервно-психическая булимия; геморрагического стресса; химических зависимостей и аддикций(например зависимостей от алкоголя, кокаина,героина, бензодиазепинов или других лекарственных средств); симптомов лекарственной и алкогольной абстиненции; вызванных стрессом психотических эпизодических состояний; эутиреоидного синдрома слабости; синдрома несоответствующего антидиуретического гормона(АДГ); ожирения; бесплодия; травм головы; травм спинного мозга; ишемического нейронального повреждения (например церебральной ишемии, такой как церебральная гиппокампальная ишемия); экситотоксического нейронального повреждения; эпилепсии; удара; иммунных дисфункций, в том числе иммунных дисфункций, вызванных стрессом (например свиной стресс-синдром, вызванная перевозкой бычья лихорадка, конская пароксизмальная фибрилляция и дисфункции у цыплят, вызванные их безвыгульным содержанием, стресс у овцы, вызванный стрижкой, или стресс у собак, связанный с взаимоотношениями человек-животное); мышечных спазм; недержания мочи; старческой деменции Альцгеймеровского типа; мультиинфарктной деменции; бокового амиотрофического склероза; гипертензии; тахикардии; застойной сердечной недостаточности; остеопороза; преждевременных родов; и гипогликемии, у млекопитающего, содержащей соединение формулы I или его фармацевтически приемлемую соль в количестве, которое является эффективным при лечении такого расстройства, и фармацевтически приемлемый носитель. Изобретение также относится к способу лечения, предупреждения или подавления расстройства, лечение которого может быть осуществлено или лечению которого можно способствовать посредством антагонизации КВФ (кортикотропин высвобождающего фактора), включая, 15 но не ограничиваясь расстройствами, вызванными КВФ или которым способствовал КВФ, в частности расстройства, выбранного из воспалительных расстройств, таких как ревматоидный артрит и остеоартрит, боль, астма, псориаз и аллергии; расстройства генерализованной тревоги; панического расстройства; фобий; обсессивно-компульсивного расстройства; посттравматического стрессового расстройства; нарушений сна, вызванных стрессом; перцепции боли,такой как фибромиалгия; эмоциональных расстройств, таких как депрессия, в том числе основная депрессия, однократная эпизодическая депрессия, рецидивирующая депрессия, вызванная злоупотреблениями детская депрессия, эмоциональные расстройства, ассоциированные с предменструальным синдромом, и послеродовая депрессия; дистемии; биполярных расстройств; циклотимии; синдрома хронической усталости; вызванной стрессом головной боли; рака; синдрома раздраженного кишечника, болезни Крона; синдрома раздраженной толстой кишки; послеоперационного илеуса; язвы; диареи; лихорадки, вызванной стрессом; инфекций вируса иммунодефицита человека (ВИЧ); нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона; желудочно-кишечных заболеваний; нарушений аппетита, таких как анорексия и нервно-психическая булимия; геморрагического стресса; химических зависимостей и аддикций(например зависимостей от алкоголя, кокаина,героина, бензодиазепинов или других лекарственных средств); симптомов лекарственной и алкогольной абстиненции; вызванных стрессом психотических эпизодических состояний; эутиреоидного синдрома слабости; синдрома несоответствующего антидиуретического гормона(АДГ); ожирения; бесплодия; травм головы; травм спинного мозга; ишемического нейронального повреждения (например церебральной ишемии, такой как церебральная гиппокампальная ишемия); экситотоксического нейронального повреждения; эпилепсии; удара; иммунных дисфункций, в том числе иммунных дисфункций, вызванных стрессом (например свиного стресс-синдрома, вызванной перевозкой бычьей лихорадки, конской пароксизмальной фибрилляции и дисфункций у цыплят, вызванных их безвыгульным содержанием, стресса у овцы,вызванного стрижкой, или стресса у собак, связанного с взаимоотношениями человекживотное); мышечных спазм; недержания мочи; старческой деменции Альцгеймеровского типа; мультиинфарктной деменции; бокового амиотрофического склероза; гипертензии; тахикардии; застойной сердечной недостаточности; остеопороза; преждевременных родов; и гипогликемии, у млекопитающего, при котором субъекту, нуждающемуся в указанном лечении, вводят соединение формулы I или его фармацевтически приемлемую соль в количестве, которое являет 002769 16 ся эффективным при лечении такого расстройства. Изобретение также относится к способу лечения или предупреждения расстройства или состояния, лечение или предупреждение которого может быть осуществлено или лечению или предупреждению которого можно способствовать посредством ингибирования КВГ связывающего белка, у млекопитающего, при котором указанному млекопитающему вводят соединение формулы I или его фармацевтически приемлемую соль в количестве, ингибирующем КВГ связывающий белок. Изобретение также относится к фармацевтической композиции для лечения или предупреждения расстройства или состояния, лечение или предупреждение которого может быть осуществлено или лечению или предупреждению которого можно способствовать посредством ингибирования КВГ связывающего белка, у млекопитающего, содержащей соединение формулы I или его фармацевтически приемлемую соль в количестве, ингибирующем КВГ связывающий белок, и фармацевтически приемлемый носитель. Изобретение включает в себя все оптические изомеры и другие стереоизомеры соединений формулы I. Когда такие соединения содержат один или более чем один хиральный центр,следует понимать, что изобретение включает в себя как рацемические смеси, так и все индивидуальные энантиомеры и диастереомеры таких соединений и их смеси. Подробное описание изобретения Следующие соединения формул II, III, IV иV можно применять в качестве промежуточных соединений в синтезе соединений формулы I где Т представляет собой хлоро, бромо, йодо или -ОSО 2 СF3; W представляет собой циано-,формил или -СОО(С 0-С 4 алкил), и A, J, K, D, Е,G, R3 и R5 являются такими, как определено выше относительно формулы I. Соединения формулы I могут быть получены как описано ниже. На схемах реакций и в Соединения формулы I, где В представляет собой -NR1R2 или NHCR1R2R11, могут быть получены взаимодействием соединения формулыII, где Т представляет собой хлоро, бромо или йодо, с соединением формулы ВН в присутствии основания, с металлорганическим соединением или без металлорганического соединения,такого как Сu(I)Х, где Х представляет собой хлоро, бромо или йодо, или кислоты (такой как п-TsOH (Ts = Тозил) или другой стерически затрудненный фенол), или равнозначного реагента, известного квалифицированным специалистам. Подходящие растворители для этой реакции включают в себя ДМСО (диметилсульфоксид), NМП (N-метилпирролидон), диметилацетамид и ТГФ (тетрагидрофуран). Избыток ВН можно использовать как в качестве реагента,так и основания. Также можно использовать другие основания, такие как карбонат калия или 20 натрия, триалкиламин, (С 1-С 4 алкоголят) калия или натрия и гидрид натрия. Когда R7 является электронакцепторной группой, такой как-СОО(С 1-С 4 алкил) или CN, реакцию обычно проводят при температуре между приблизительно комнатной и приблизительно 100 С. Когда R7 является не электронакцепторной группой, температура реакции обычно может колебаться в пределах от приблизительно 50 С до приблизительно 270 С, а давление обычно может колебаться от приблизительно 27,6 кПа до приблизительно 2068,4 кПа (от 4 до 300 psi). Можно применять реактор для работы под давлением. Кроме того, соединения формулы I могут быть получены взаимодействием соединения формулы II, где Т представляет собой бромо или йодо, с 1 эквивалентом или избытком ВН и основанием, таким как карбонат калия или натрия или (C1-C4 алкоголят) натрия или калия, в присутствии палладиевого(II) или палладиевого(0) катализатора, такого как Pd(OAc)2 или Рd(РРh3)4, вместе с рацемическим или хиральным фосфиновым реагентом, таким как 2,2 бис(дифенилфосфино)-1,1-бинафтил (БИНАФ). Кроме того,заранее приготовленный Рd(II)(БИНАФ) можно использовать в подходящем инертном (т.е. инертном по отношению к рассматриваемой реакции) растворителе, таком как толуол, ксилол, диоксан или сульфолан, при температуре от приблизительно комнатной до приблизительно 180 С предпочтительно при температуре, приблизительно равной температуре дефлегмации. Соединения формулы I, где В представляет собой-NHCR R R , могут быть получены взаимодействием соединений формулы II, где Т представляет собой хлоро, бромо или йодо, с соединением формулы ВН в присутствии основания, которое способно депротонировать ВН (например гидрид натрия или калия, или металлорганическое основание, такое как диизопропиламид натрия, бис(триметилсилил)амид натрия, диизопропиламид лития, бис(триметилсилил)амид лития,С 1-С 4 алкоголят натрия или нбутиллитий), в инертном органическом растворителе, таком как тетрагидрофуран, ацетонитрил, диметилсульфоксид, ацетон, С 2-С 5cпирт,хлороформ, бензол, ксилол, толуол, N,Nдиметилформамид (ДМФ), метиленхлорид, 1 метил-2-пирролидинон или смеси двух или более чем двух вышеуказанных растворителей(например ДМСО и ТГФ), при температуре от приблизительно 0 С до приблизительно 180 С,предпочтительно от приблизительно 50 С до приблизительно 180 С. Соединения формулы I, где В представляет собой -CR1R2R11, -C(C=CR2R12)R1, -CR2R11NHR1,-CR2R11OR1, -CR2R11SR1 или -C(O)R2, могут быть получены из соединений формулы III, гдеW представляет собой циано, формил или карбокси, как описано ниже. Взаимодействие соединений формулы III,где W представляет собой циано, с реактивом Гриньяра, содержащим группу R2, в инертном растворителе, таком как ТГФ, глим, эфир или диоксан, будет приводить к соответствующим соединениям формулы I, где В представляет собой -COR2. Дальнейшее взаимодействие соединений формулы I, где В представляет собойCOR2, с реактивом Гриньяра, содержащим R1, с использованием растворителя, такого как растворители, упомянутые выше, будет приводить к соответствующим соединениям формулы I,где В представляет собой -CR1R2OH. Взаимодействие соединений формулы III, где W представляет собой формил, с реактивом Гриньяра,содержащим группу R2, в эфирном растворителе, таком как растворители, упомянутые выше,будет приводить к соответствующим соединениям формулы I, где В представляет собой-CHR2OH. Соединения формулы I, где В представляет собой -CR1R2R11 или -C(C=CR2R11)R1, могут быть получены традиционными способами. Так,взаимодействие соединения формулы I, где В представляет собой -CR1R2OH (где R1 и R2 являются такими, как определено для R1 и R2 соответственно за исключением того, что R1 может не являться R1 и R2 может не являтьсяR2), с кислотой, такой как концентрированная серная кислота в уксусной кислоте, или внутренней солью Бургесса (Burgess), такой как метиловый эфир гидроксида (карбоксисульфамоил)триэтиламмония, будет приводить к соединению формулы I, где В представляет собой-C(=CR2R11)R1, с использованием в качестве катализатора палладия на угле (Pd/C) или диоксида платины в (С 1-С 4)спиртовом растворителе будет приводить к соединению формулы I, где В представляет собой -CHR1R2. Взаимодействие соединения формулы I, где В представляет собой -CR1R2OH, с трифторидом диэтиламиносеры или трифенилфосфином/четыреххлористым углеродом в инертном растворителе, таком как четыреххлористый углерод, будет приводить к соединению формулы I, где В представляет собой -CR1R2F или -CR1R2Cl, соответственно. Восстановление соединения формулы I,где В представляет собой -COR2, борогидридом натрия в инертном растворителе, таком как (C1C4)cпирт, будет приводить к соединению формулы I, где В представляет собой -CHR2OH. Алкилирование соединения формулы I, где В представляет собой -CHR2OH, алкилгалогенидом (таким как алкилйодид) в присутствии основания, такого как гидрид натрия (NaH), при комнатной температуре в инертном растворителе, таком как толуол, ТГФ, диоксан или эфир,будет приводить к соответствующему соедине 002769-CHR2OR1. Соединения формулы I, где В представляет собой CR2R10NHR1, могут быть получены традиционными способами, такими как восстановительное аминирование соответствующих соединений формулы I, где В представляет собой-C(O)R2, соответствующим амином и восстановителем (таким как цианоборогидрид натрия,триацетоксиборогидрид натрия или алюмогидридом лития) в соответствующем инертном растворителе, таком как C1-C4 спирт или уксусная кислота. Превращение соединений формулы I, где В представляет собой -C(O)R2, в соединения формулы I, где В представляет собой -C(S)R2,может быть осуществлено хорошо известными традиционными способами (например, с использованием Lawesson's реагента или сульфида фосфора (V) (P2S5. Восстановление соединений формулы I, где В представляет собой-C(S)R2, восстановителем, таким как борогидрид натрия или алюмогидрид лития, дает соответствующие соединения формулы I, где В представляет собой -CHR2SH. Алкилирование соединений формулы I, где В представляет собой -CHR2SH, алкилгалогенидом (таким как алкилйодид) в присутствии основания, такого как гидрид натрия, в инертном растворителе,таком как ТГФ, ДМФ или толуол, при приблизительно комнатной температуре будет приводить к соответствующим соединениям формулыI, где В представляет собой -CHR2SR1. Соединения формулы II могут быть получены из соединений формулы IV или V как описано выше. Соединения формулы II, где Т представляет собой хлоро, бромо или йодо, могут быть получены взаимодействием соединений формулы IV с РОТ 3 в количестве от 1 эквивалента до избыточного количества (где Т представляет собой хлоро, бромо или йодо) в присутствии или отсутствии ди(С 1-С 4 алкил)анилина, предпочтительно диэтиланилина, в растворителе или без растворителя (такого как дихлорэтан, ДМФ,диметилсульфоксид (ДМСО) или ацетамид) при температуре от приблизительно комнатной до приблизительно 180 С, предпочтительно от приблизительно 100 С до приблизительно 150 С. Кроме того, соединения формулы II, где Т представляет собой хлоро, бромо или йодо,могут быть получены взаимодействием соответствующих соединений формулы II, где Т представляет собой -ОSО 2 СF3, с галогенидом натрия или калия в подходящем инертном растворителе, таком как ТГФ, сульфолан, ДМСО, ДМФ или ацетонитрил, при температуре от приблизительно 60 С до приблизительно 180 С. Соединения формулы II, где Т представляет собой-OSO2CF3, могут быть получены взаимодействием соединений формулы IV с Tf2O в присутствии основания, такого как триэтиламин или 23 пиридин, в соответствующем инертном растворителе, таком как ТГФ, метиленхлорид, диоксан, эфир или толуол, при температуре от приблизительно 0 С до приблизительно 50 С,предпочтительно от приблизительно 0 С до приблизительно комнатной. Кроме того, соединения формулы II, где Т представляет собой хлоро, бромо или йодо, могут быть получены взаимодействием соединений формулы V с (С 1-С 7 алкил)-нитритом иCu(I)T2 (где Т представляет собой хлоро, бромо или йодо) в соответствующем инертном растворителе, таком как ацетонитрил, ацетон, метиленхлорид, ТГФ, диоксан, бензол, толуол, дихлорэтан, ДМФ, ДМСО или N-метилпирролидон (NМП), при температуре от приблизительно комнатной до приблизительно 150 С,предпочтительно от приблизительно 40 С до приблизительно 100 С. Соединения формулы IV могут быть получены взаимодействием соответствующих соединений формулы V с нитритом натрия(NaNO2) в водном растворе кислоты, такой как серная кислота, уксусная кислота или фосфорная кислота, в органическом растворителе или без органического растворителя, предпочтительно в ацетонитриле (СН 3 СN) или ацетоне. Соединения формулы III, где W представляет собой циано, могут быть получены взаимодействием соединений формулы II, где Т представляет собой хлоро, бромо или йодо, с цианидом калия, цианидом меди, цианидом натрия или цианидом ди(С 1-С 4 алкил)алюминия в соответствующем инертном растворителе, таком как диметилсульфоксид, ДМФ, толуол или ксилол,при температуре от приблизительно комнатной до приблизительно 180 С, предпочтительно от приблизительно 60 С до приблизительно 150 С,в или без Pd(II)OAc или Рd(0)(РРh3)4. Соединения формулы III, где W представляет собой -СНО или -СООН, могут быть получены взаимодействием соединений формулы II,где Т представляет собой бромо или йодо, с литийорганическим реагентом, таким как третBuLi, втор-BuLi или н-BuLi, в соответствующем инертном растворителе, таком как ТГФ, диоксан, эфир, бензол или метиленхлорид, при температуре от приблизительно -120 С до приблизительно комнатной, предпочтительно от приблизительно -110 С до приблизительно -60 С, с последующим прекращением реакции добавлением подходящего электрофила, такого как ДМФ или CO2 (газообразного или в виде сухого льда) с получением соединений формулы III, гдеW представляет собой -СНО и -СООН соответственно. Следует понимать, что можно применять знания основной органической химии, чтобы изменять стадии последовательностей реакций,описанные здесь, в зависимости от возможности осуществления реакции. Например, можно использовать защитную группу на любой стадии 24 разных синтезов, описанных выше, на которой это можно осуществить, или можно восстанавливать эфирную группу до соответствующей С 1 С 4 алкильной группы на любой удобной стадии. Соединения формул I-XVIII, где R3 представляет собой хлоро, бромо, -СОО(С 1-С 4 алкил) или-СООН, можно превращать в соответствующие соединения, где R3 представляет собой (С 1 С 4 алкил),-O(С 1-С 4 алкил),фторо,-S(С 1 С 4 алкил), на любой удобной стадии, в зависимости от назначения, в синтезах, упомянутых выше, применяя способы, описанные в литературе. Соединения формулы I-XVIII, где R3 представляет собой -O(C1-С 4 алкил) или -S(С 1 С 4 алкил), могут быть получены взаимодействием соответствующих соединений, где R3 представляет собой хлоро, бромо или йодо, с нуклеофилом, таким как С 1-С 4cпирт или С 1 С 4 алкантиол, в присутствии органического или неорганического основания. Подходящие основания для такой реакции включают в себя натрий и гидрид натрия. Соединения формулы IXVIII, где R3 представляет собой фторо, могут быть получены взаимодействием соответствующих соединений, где R3 представляет собой хлоро, с фторидом тетрабутиламмония в подходящем инертном растворителе, таком как ДМСО, метиленхлорид или тетрагидрофуран. Предпочтительным растворителем является тетрагидрофуран. Восстановление сложного эфира или карбоновой кислоты с использованием алюмогидрида лития/хлорида алюминия (LiАlН 4/АlСl3) в соответствующем инертном растворителе, таком как ТГФ, эфир или диоксан, при температуре от приблизительно 100 С до приблизительно комнатной будет приводить к соответствующему соединению, где R3 представляет собой СН 3. Превращение соединений, где В представляет собой -СООН, в соответствующие соединения,где В представляет собой -СО(С 1-С 3 алкил),можно осуществлять с применением хорошо известных традиционных способов алкилирования. Восстановление соединений, где В представляет собой -СО(С 1-С 3 алкил), с применением хорошо известных традиционных способов будет приводить к соответствующим соединениям, где R3 представляет собой одно из(С 1-С 4 алкил) производных. Соединения формулы IV-a, где А представляет собой CR7 и G, J и K являются углеродами, могут быть получены нагреванием соединений формулы VI-a с соответствующим соединением формулы R3 С(O)СR7COО(C1-C4 алкил) в присутствии кислоты или кислоты Льюиса в растворителе или без растворителя, как показано на cхеме 1. Примерами таких условий реакции являются: а) нагревание в полифосфорной кислоте; б) нагревание в толуоле, бензоле или ксилоле в присутствии кислотного катализатора(такого как п-ТsОН, серная кислота или НСl(г с применением ловушки Дина-Старка; или в)(Ph2O) или Dowtherm А в присутствии кислоты Льюиса, такой как SnСl4, ZnCl2/HCl или АlСl3. Соединения формулы VI-a могут быть получены с применением способов, описанных в научной литературе (Gazz. Chim. Ital.: 111. р 167172 (1981); Chem. Pharm. Bull.: 24, 3001-3010Heterocycl. Chem., 28, 2053-2055 (1991); J. Heterocycl. Chem., 29, 251-253 (1992). Соединения формул V-a и IV-a', где R представляет собой С 1-С 4 алкил, могут быть получены нагреванием соединений формулы VI,где W представляет собой -CN и -СОО(С 1 С 4 алкил), соответственно, с соответствующимR3 С(O)СH2CОО(C1-C4 алкилом) в присутствии кислоты Льюиса, такой как SnCl4, AlCl3, ТiCl3 или ZnCl2, в инертном растворителе, таком как дихлорэтан, при приблизительно температуре дефлегмации, как показано на схеме 2. Основной гидролиз соединения формулы V-a или IVa' с гидроксидом натрия в H2O/(C1-C4 спирте) при температуре дефлегмации или с гидроксидом лития в воде/ТГФ или воде/диоксане при температуре от приблизительно комнатной до приблизительно температуры дефлегмации, а затем декарбоксилирование посредством нагревания на масляной бане при температуре от приблизительно 140-180 С будет приводить к соединению формулы V-b или IV-b, соответственно. Соединения формул V-a и IV-a' можно превращать в соединения формулы II-а, а соединения формул V-b и IV-b можно превращать в соединения формулы II-b способами, описанными выше. Превращение соединений формулыII-а в соединения формулы II-в можно осуществлять с применением способов, аналогичных способам, описанным выше для превращения соединений, где R3 представляет собой-COO(C1-С 4 алкил), в соединения, где R3 представляет собой С 1-С 4 алкил. Соединения формулы VI могут быть получены с применением способов, описанных в литературе (Liebigs Ann Chem., 1534-1546, 1979;N и G, J и K являются углеродами, могут быть получены, как показано на схеме 3, взаимодействием соединений формулы VI-с (R3CO)2O,R3 СОOH или R3CO(ОC1-C2 алкил)3 в уксусной кислоте или соответствующем инертном органическом растворителе, таком как толуол, диоксан, ацетонитрил, метиленхлорид или хлороформ, при температуре от приблизительно 25 С до приблизительно 150 С, предпочтительно при приблизительно температуре дефлегмации, а затем нагреванием в 85%-ной фосфорной кислоте или водном растворе кислоты, такой как уксусная кислота, соляная кислота или серная кислота, предпочтительно в 50-85%-ной фосфорной кислоте. Соединения формулы Vb могут быть получены, как показано на схеме 3, нагреванием соответствующих соединений формулыVI с избытком соответствующего соединения формулы R3 СОNH2. Соединения формулы IV-d могут быть получены, как показано на схеме 4, взаимодействием соединений формулы IX с соответствующим реагентом,имеющим формулуR3C(O)СHR7 СОО(C1-C4 алкил) в растворителе формулы R3COOH при температуре от приблизительно 60 С до приблизительно 180 С, предпочтительно при приблизительно температуре дефлегмации. Соединения формулы I-N могут быть получены, как показано на схеме 5, взаимодействием соответствующих соединений формулы Х с (C1-С 7 алкил)нитритом с или без CuBr2, CuCl2 или CuJ2 в соответствующем инертном растворителе, таком как ацетонитрил, ацетон, метиленхлорид, хлороформ, бензол или толуол,предпочтительно ацетонитрил, при температуре от приблизительно 25 С до приблизительно 150 С, предпочтительно от приблизительно 60 С до приблизительно 100 С. Соединения формулы I-L и I-M могут быть получены, как показано на схеме 6, взаимодействием соединений формулы XI, где Х представляет собой S или О, с соединением формулы R4CHO или R4CH(OC1-C2aлкил)2 и кислотным катализатором, таким как п-TsOH, HCl,HBr, H2SO4 или НСl в толуоле, ксилоле или бензоле, предпочтительно толуоле, с водой в количестве от одного до десяти эквивалентов, при температуре от приблизительно 70 С до приблизительно 160 С с использованием ловушки Дина-Старка или в присутствии безводного сульфата натрия. Соединения формулы I-K и I-U могут быть получены взаимодействием соответствующих соединений формулы XI с трифосгеном или тиофосгеном соответственно и основанием, таким как триэтиламин или пиридин, в соответствующем инертном растворителе, таком как метиленхлорид, ТГФ, диоксан, эфир, бензол или хлороформ, предпочтительно метиленхлорид 27 или сухой ТГФ, при температуре от приблизительно 0 С до приблизительно 25 С. Соединения формулы I-V, I-W и I-Х могут быть получены, как показано на схеме 7, из соединений формулы XII. Соединения формулыXIII могут быть получены взаимодействием соответствующих соединений формулы XII с гидроксиламином в кислой (например, в трифторуксусной кислоте) или щелочной (например в NaOAc или NaOH и гидрохлориде гидроксиламина в смеси С 1-С 4cпирта и воды) среде при температурах от приблизительно 25 С до приблизительно 150 С, предпочтительно при приблизительно температуре дефлегмации. Соединения формулы XIV могут быть получены нагреванием соответствующих соединений формулы XIII в уксусном ангидриде, трифторуксусном ангидриде или Tf2O, в растворителе или без растворителя, такого как уксусная кислота или метиленхлорид, в присутствии соответствующего основания в виде амина, такого как триэтиламин или пиридин. Соединения формулы I-V, I-W и I-Х могут быть получены нагреванием соответствующих соединений формулыXIV и пиридина в инертном растворителе, таком как ДМФ, ДМСО, NMP, сульфолан или ацетамид, при температуре от приблизительно 80 С до приблизительно 180 С. Соединения формулы I-G могут быть получены, как показано на cхеме 8, восстановлением соответствующих соединений формулыXVII. Это восстановление можно выполнять,применяя традиционные способы, известные в литературе, для восстановления нитрогруппы до аминогруппы. Такие способы включают в себя гидрирование или восстановление железом в уксусной кислоте. При восстановлении или нагревании в соответствующем растворителе, таком как C1-C4cпирт, ацетонитрил, толуол, ТГФ,метиленхлорид или уксусная кислота, может происходить циклизация. Превращение соединений формулы XVI в соединения формулы XVII можно осуществлять, применяя способы, аналогичные способам,описанным выше, для превращения соединений формулы V, где W представляет собой циано, в соединения формулы I, где В представляет собой группу, имеющую атом углерода, непосредственно связанный с бициклическим кольцом. Наилучшим способом для превращения циано в группу -СООН является кислотный гидролиз,например нагревание цианосоединения в 5085%-ной фосфорной кислоте или 50-90%-ной уксусной кислоте, предпочтительно фосфорной кислоте. Наилучшим способом для превращения циано в -CO(C1-С 4 алкил) является взаимодействие цианосоединения с реактивом Гриньяра при температуре от приблизительно 0 С до приблизительно 25 С в эфире, ТГФ или диоксане. Наилучшим способом для превращения циано в группу -СНО является восстановление гидридом диизобутилалюминия в ТГФ, диоксане 28 или эфире при температуре от приблизительно-78 С до приблизительно 25 С, предпочтительно от приблизительно -78 С до приблизительно-40 С. Соединения формулы XVI могут быть получены взаимодействием соединений формулыXV, где Hal представляет собой хлор, бром или йод, с натриевой, калиевой или литиевой сольюPd(II) или Pd(0) катализатора при температуре от приблизительно -78 С до приблизительно 130 С. Кроме того, соединения формулы XVII могут быть получены, когда соединения формулы XV подвергают металл-галогенному обмену(например, с использованием литийорганического реагента, такого как трет-BuLi, втор-BuLi или BuLi при -78 С в эфире, ТГФ или диоксане), с последующим прекращением реакции путем добавления электрофила, такого какXVIII. Соединения формулы XIX-a могут быть получены взаимодействием соответствующих соединений формулы XVIII с тионилхлоридом,а затем восстановлением. Взаимодействие соединений формулы XIX-a с основанием (таким как литийорганический реагент, например диизопропиламид лития или BuLi), с последующим прекращением реакции путем добавления электрофила (такого как диоксид углерода) будет приводить к соответствующим соединениям формулы XIX-b, где R21 представляет собой-СООН. Соединения формулы XIX-c, где R21 представляет собой -C(OH)R4, могут быть получены подобным образом добавлением к соответствующему соединению формулы XIX-a электрофила формулы C1-С 3 алкил-СНО. Соединения формулы XVII могут быть получены взаимодействием соединений формулы XIX-c с ПХХ (хлорхромиатом пиридиния) с применением хорошо известных традиционных ПХХ способов окисления. Соединения формулы II-d, II-е и II-f, где Т представляет собой хлоро, бромо или йодо и D,Е, R3, R5 и R7 являются такими, как определено в формуле I, могут быть получены, как показано на cхеме 9, способами, аналогичными способам,описанным на cхеме 2. Кроме того, соединения формулы от II-d до II-f могут быть получены с применением способов, аналогичных способам,описанным в литературе (Pharm. Bull, 5, 229231, 1957; Monatsh Chem, 100, 671-678, 1969; J.Chem. Abstr., 1939, 4988). Соли присоединения кислоты соединений формулы могут быть получены традиционным способом путем обработки раствора или суспен 29 зии соответствующего свободного основания одним химическим эквивалентом фармацевтически приемлемой кислоты. Для того, чтобы выделить соли, можно применять традиционные методики концентрирования или кристаллизации. Примерами подходящих кислот являются уксусная, молочная, янтарная, малеиновая, винная, лимонная, глюконовая, аскорбиновая, бензойная, коричная, фумаровая, серная, фосфорная, соляная, бромисто-водородная, йодистоводородная, сульфаминовая кислоты, сульфокислоты, такие как метансульфокислота, бензолсульфокислота, п-толуолсульфокислота и родственные кислоты. Соединения формулы I и их фармацевтически приемлемые соли (в дальнейшем называемые как "активные соединения по изобретению") можно вводить отдельно или вместе с фармацевтически приемлемыми носителями, в однократных или разделенных дозах. Подходящие фармацевтические носители включают в себя инертные твердые разбавители или наполнители, стерильные водные растворы, масла(например кунжутное масло, арахисовое масло) и различные органические растворители. Кроме того, фармацевтические композиции, образованные смешиванием новых соединений формулы I и фармацевтически приемлемых носителей, можно легко вводить в разнообразных формах дозы, таких как таблетки, масляный гель, порошки, пастилки, сиропы, растворы для инъекций и им подобные. Эти фармацевтические композиции могут, если требуется, содержать дополнительные ингредиенты, такие как корригенты, связывающие агенты, эксципиенты и им подобные. Таким образом, для целей перорального введения, таблетки, содержащие различные эксципиенты, такие как цитрат натрия,карбонат кальция и фосфат кальция, можно применять с различными разрыхлителями, такими как крахмал, метилцеллюлоза, альгиновая кислота и некоторые комплексные силикаты,вместе со связывающими агентами, такими как поливинилпирролидон, сахароза, желатин и аравийская камедь. Кроме того, смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк, часто можно применять для целей приготовления таблеток. Твердые композиции подобного типа также можно применять в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах. Предпочтительные материалы для этого включают в себя лактозу или молочный сахар и высокомолекулярные полиэтиленгликоли. Когда для перорального введения требуются водные суспензии или эликсиры, их необходимый активный ингредиент можно объединять с различными подсластителями или корригентами, красящими веществами или красителями и, если требуется,эмульгаторами или суспендирующими агентами, вместе с разбавителями, такими как вода, 002769 30 этанол, пропиленгликоль, глицерин или их комбинациями. Для парентерального введения можно применять растворы, содержащие активное соединение по изобретению или его фармацевтически приемлемую соль в кунжутном или арахисовом масле, водном пропиленгликоле или в стерильном водном растворе. Такие водные растворы, если необходимо, следует соответствующим образом забуферить, а жидким разбавитель сначала сделать изотоническим при помощи достаточного количества физиологического раствора или глюкозы. Эти конкретные водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. Все применяемые стерильные водные среды легко доступны при помощи традиционных методик, известных квалифицированным специалистам. Эффективные дозировки для активных соединений по изобретению будут зависеть от назначенного пути введения и факторов, таких как возраст и вес пациента, обычно известных врачу. Также дозировки будут зависеть от конкретного заболевания, которое лечат. Например,для того чтобы лечить заболевания, вызванные стрессом, воспалительные расстройства, болезнь Альцгеймера, желудочно-кишечные заболевания, нервно-психическую анорексию, геморрагический стресс и симптомы синдрома абстиненции от алкоголя и лекарственного средства, суточная доза обычно будет колебаться в пределах от приблизительно 0,1 до приблизительно 50 мг/кг веса тела пациента. Известны способы, которые можно применять для определения антагонистической активности активных соединений по изобретению и их фармацевтически приемлемых солей по отношению к КВФ (Endocrinology, 116, 1653-1659(1985); Peptides, 10, 179-188 (1985. Активности связывания для соединений формулы I, выраженные как величины ИK50, обычно колеблются в пределах от приблизительно 0,5 наномолярной до приблизительно 10 микромолярной. Известны способы, которые можно применять для определения ингибирующей активности соединений формулы I по отношению к КВФ связывающему белку (Brain Research, (1997), 745(1,2), 248-255). Настоящее изобретение иллюстрируют следующие примеры. Однако следует понимать,что изобретение не ограничивается конкретными подробностями этих примеров. Спектры протонного ядерного магнитного резонанса (1 Н ЯМР) и спектры С 13 ядерного магнитного резонанса (С 13 ЯМР) измеряют для растворов в дейтерохлороформе (CDCl3), а позиции пиков выражают в частях на миллионную долю поля(ТМС). Формы пиков обозначают следующим образом: s - синглет; d - дублет; t - триплет; q квартет; m - мультиплет; b - широкая. 31 Следующие сокращения применяют в примерах: Рh=фенил; iРr=изопропил. Пример 1. 7-(1-Этилпропокси)-5-метил-3(2,4,6-триметилфенил)-пиразоло[1,5-а]пиримидин. Раствор 3-пентанола (140 мг, 1,5 ммоль) в 1 мл сухого ТГФ обрабатывают 60%-ным гидридом натрия в масле (28 мг, 0,7 ммоль) и перемешивают при комнатной температуре в течение 10 мин. Добавляют раствор 7-хлор-5-метил 3-(2,4,6-триметилфенил)-пиразоло[1,5-а]пиримидина (75 мг, 0,262 ммоль) в 1 мл сухого ТГФ и полученную смесь нагревают с обратным холодильником в течение 5 ч. Смесь гасят водой и экстрагируют этилацетатом. Органический слой промывают рассолом, сушат и концентрируют с получением неочищенного материала. Остаток очищают колоночной хроматографией на силикагеле с использованием смеси хлороформ: этилацетат (3:7) в качестве элюента с получением 75 мг (88%) указанного в заголовке соединения. 1H ЯМР (СDСl3)7,97 (s, 1H), 6,97 (s, 2H),6,03 (s, 1H), 4,56 (m, 1H), 2,53 (s, 3H), 2,32 (s,3H), 2,13 (s, 6H), 2,10 (m, 4H), 1,09 (t, 6H) млн-1. Пример 2. [2,5-Диметил-3-(2,4,6-триметилфенил)-пиразоло[1,5-а]пиримидин-7-ил]-(1 этилпропил)-амин. Смесь 7-хлор-2,5-диметил-3-(2,4,6-триметилфенил)-пиразоло[1,5-а]-пиримидина (60 мг,0,2 ммоль) и 1-этилпропиламина (4 мл) в 1 мл Nметилпирролидинона нагревают на масляной бане при 125 С в течение 15 ч. Смесь гасят водой и экстрагируют этилацетатом. Органический слой сушат, концентрируют и очищают колоночной хроматографией на силикагеле с использованием 20%-ного этилацетата в гексане в качестве элюента с получением 35 мг указанного в заголовке соединения в виде желтого твердого вещества. 1 Н ЯМР (CDCl3)6,96 (s, 2H), 6,00 (d, 1H),5,77 (s, 1H), 3,47 (m, 1H), 2,43 (s, 3H), 2,32 (s,3H), 2,22 (s, 3H), 2,05 (s, 6H), 1,5-1,9 (m, 4H),1,04 (t, 6H) млн-1. Пример 3. (1-Этилпропил)-[5-метил-3-(2,4,6-триметилфенил)-пиразоло[1,5-а]пиримидин-7 ил]-амин. Смесь 7-хлор-5-метил-3-(2,4,6-триметилфенил)-пиразоло[1,5-а]пиримидина (190 мг, 0,63 ммоль) и 1-этилпропиламина (4 мл) в 1 мл Nметилпирролидинона нагревают на масляной бане при 125 С в течение 15 ч. Смесь гасят водой и экстрагируют этилацетатом. Органический слой сушат, концентрируют и очищают колоночной хроматографией на силикагеле с использованием элюента - от хлороформа до 2%-ного метанола в хлороформе с получением 195 мг (87%) указанного в заголовке соединения в виде зеленого твердого вещества. 1 3H), 2,09 (s, 3H), 2,16 (s, 6H), 1,6-1,9 (m, 4H),1,05 (t, 6H) млн-1. Пример 4. 7-(1-Этилпропокси)-2,5-диметил-3-(2,4,6-триметилфенил)-пиразоло-[1,5-а] пиримидин. К суспензии 60%-ного гидрида натрия в масле (160 мг) в 4 мл ДМСО добавляют 3 пентанол (853 мг), а затем 7-хлор-2,5-диметил 3-(2,4,6-триметилфенил)-пиразоло[1,5-а]пиримидин (580 мг) при комнатной температуре. Смесь нагревают при 88 С в течение ночи. Смесь гасят водой и экстрагируют этилацетатом. Органический слой сушат, концентрируют и очищают колоночной хроматографией на силикагеле с использованием 10%-ного гексана в хлороформе в качестве элюента с получением указанного в заголовке соединения в виде оранжевого масла. 1H ЯМР (CDCl3)6,96 (s, 2H), 5,95 (s, 1H),4,52 (m, 1H), 2,48 (s, 3H), 2,33 (s, 3H), 2,27 (s,3H), 2,03 (s, 6H), 1,75-2,00 (m, 4H), 1,08 (t, 6H) млн-1. Пример 5. [2,5-Диметил-3-(2,4,6-триметилфенил)-пиразоло[1,5-а]пиримидин-7-ил]этилпропиламин. Смесь 7-хлор-5-метил-3-(2,4,6-триметилфенил)-пиразоло[1,5-а]пиримидина (200 мг, 0,66 ммоль) и N-пропилэтиламина (2 мл) в 1 мл Nметилпирролидинона нагревают на масляной бане при 135C в течение 4 ч. Смесь гасят водой и экстрагируют этилацетатом. Органический слой сушат, концентрируют и очищают колоночной хроматографией на силикагеле с использованием элюента - от гексана до 10%-ного этилацетата в гексанес получением 150 мг указанного в заголовке соединения в виде прозрачного зеленого масла. 1(t, 3H), 0,98 (t, 3H) млн-1. Пример 6. [6-Бром-5-бромметил-3-(2,4,6 триметилфенил)-3 Н-[1,2,3]триазоло[4,5-b]пиридин-7-ил]-(1-этилпропил)-амин. К раствору бутилнитрита (119 мг, 1,15 ммоль) и CuBr2 (205 мг, 0,919 ммоль) в 16 мл ацетонитрила добавляют N4-(1-этилпропил)-6 метил-N2-(2,4,6-триметилфенил)-пиридин-2,3,4 триамин (250 мг, 0,766 ммоль). Полученную смесь нагревают при 65 С в течение 1,5 ч. Смесь охлаждают до комнатной температуры и добавляют 2 н. HCl (16 мл). Смесь нейтрализуют 2 н. NaOH и экстрагируют этилацетатом. Органический слой промывают рассолом, сушат и концентрируют с получением коричневого масла. Масляный остаток очищают колоночной хроматографией на силикагеле с использованием смеси гексан:этилацетат (1:1) в качестве элюента с получением 61 мг [6-бром-5 бромметил-3-(2,4,6-триметилфенил)-3 Н-[1,2,3] триазоло[4,5-b]пиридин-7-ил]-(1-этилпропил) 33 амина в виде белых кристаллов. Т.пл. 123125 С. 1H ЯМР (CDCl3)7,06 (s, 2H), 5,53 (d, 1H),5,22 (m, 1H), 4,67 (s, 2H), 2,39 (s, 3H), 1,96 (s, 6H),1,6-1,9 (m, 4H), 1,09 (t, 6H) млн-1 и 103 мг [6-бром-5 метил-3-(2,4,6-триметилфенил)-3 Н-[1,2,3]триазоло[4,5-b]пиридин-7-ил]-(1-этилпропил)-амина в виде белого твердого вещества. Т.пл. 115-117 С. 1H ЯМР (CDCl3)7,04 (s, 2H), 5,36 (d, 1H), 5,21 (m,1H), 2,64 (s, 3H), 2,38 (s, 3H), 1,95 (s, 6H), 1,6-1,9 (m,4H), 1,05 (t, 6H) млн-1. Пример 7. (1-Этилпропил)-[5-метил-3-(2,4,6-триметилфенил)-3 Н-[1,2,3]триазоло-[4,5-b]пиридин-7-ил]-амин. Смесь бутилнитрита (119 мг, 1,15 ммоль) иN4-(1-этилпропил)-6-метил-N2-(2,4,6-триметилфенил)-пиридин-2,3,4-триамина (250 мг, 0,766 ммоль) в безводном ацетонитриле (16 мл) нагревают при 65 С в течение 2 ч. Смесь охлаждают до комнатной температуры и добавляют 2 н. HCl (16 мл). Смесь нейтрализуют 2 н. NaOH и экстрагируют этилацетатом. Органический слой промывают рассолом, сушат и концентрируют с получением 250 мг неочищенного продукта в виде коричневого масла. Масляный остаток очищают колоночной хроматографией на силикагеле с использованием хлороформа в качестве элюента с получением 201 мг указанного в заголовке соединения в виде золотистожелтого твердого вещества. Т.пл. 131-133 С. 1 Н ЯМР (СDСl3)7,022 (s, 2H), 6,20 (s,1H), 5,44 (d, 1H), 3,65 (m, 1H), 2,50 (s, 3H), 2,36(s, 3H), 1,96 (s, 6H), 1,5-1,8 (m, 4H), 1,03 (t, 6H) млн-1. Пример 8. [6-Бром-5-метил-3-(2,4,6-триметилфенил)-3 Н-[1,2,3]триазоло[4,5-b]пиридин 7-ил]-(1-этилпропил)-метиламин. К раствору [6-бром-5-метил-3-(2,4,6-триметилфенил)-3 Н-[1,2,3]триазоло[4,5-b]пиридин 7-ил]-(1-этилпропил)-амина (50 мг, 0,12 ммоль) в сухом ТГФ (1,5 мл) добавляют 2,5 М н-BuLi в гексане (0,14 ммоль) при -78 С. После перемешивания при -78 С в течение 10 мин, при этой температуре добавляют 0,5 мл метилйодида,затем смесь оставляют нагреваться до комнатной температуры и перемешивают в течение от 15 мин до 2 ч. Смесь гасят водой и экстрагируют этилацетатом. Органический слой промывают рассолом, сушат и концентрируют с получением 46 мг коричневого масла. Остаток очищают колоночной хроматографией на силикагеле с использованием смеси хлороформ:гексан (1:1) в качестве элюента с получением указанного в заголовке соединения в виде золотистого масла. 1 34 Смесь 4-(1-этилпропокси)-6-метил-N2-(2,4,6-триметилфенил)-пиридин-2,3-диамина (50 мг,0,153 ммоль) и бутилнитрита (24 мг, 0,229 ммоль) в 4 мл ацетонирила нагревают при 65 С в течение 2 ч. Добавляют дополнительное количество бутилнитрита (0,13 мл) и полученную смесь нагревают при 65 С в течение 2 ч. Смесь гасят водой и экстрагируют этилацетатом. Органический слой сушат и концентрируют с получением 58 мг коричневого масла. Масло очищают колоночной хроматографией на силикагеле с использованием 5%-ного этилацетата в гексане в качестве элюента с получением 46 мгH ЯМР (СDСl3)7,04 (s, 2H), 6,60 (s, 1H),5,26 (m, 1H), 2,57 (s, 3H), 2,38 (s, 3H), 1,94 (s,6H), 1,8-2,0 (m, 4H), 1,07 (t, 6H) млн-1. Пример 10. 4-(1-Этилпропокси)-2,5-диметил-7-(2,4,6-триметилфенил)-5 Н-пирроло[3,2-d] пиримидин. К раствору 3-пентанола (0,09 мл, 0,883 ммоль) в сухом ТГФ добавляют 60%-ный NaH в масле (20 мг, 0,500 ммоль) и перемешивают в течение 5 мин. К реакционной смеси добавляют раствор 4-хлор-2,5-диметил-7-(2,4,6-триметилфенил)-5 Н-пирроло[3,2-d]пиримидина (50 мг,0,166 ммоль) в сухом ТГФ и полученную смесь нагревают с обратным холодильником в течение 2 ч. Смесь гасят водой и экстрагируют этилацетатом. Органический слой промывают рассолом, отделяют, сушат и концентрируют до сухого состояния с получением указанного в заголовке соединения в виде белого твердого вещества. 1H ЯМР (CDCl3)6,92 (s, 3H), 5,43 (m,1H), 4,02 (s, 3H), 2,56 (s, 3H), 2,29 (s, 3H), 2,08 (s,6H), 1,8 (m, 4H), 0,99 (t, 6H) млн-1. Указанные в заголовках соединения примеров 11-14 получают способом, аналогичным способу, описанному в примере 10, из 4-хлор-2 метил-5-замещенного-7-(замещенный-фенил)5 Н-пирроло[3,2-d]пиримидина или 7-хлор-5 метил-1-замещенного-3-(замещенный-фенил)1 Н-пирроло[3,2-b]пиридина и соответствующего спирта или тиола и основания. Пример 11. (+)-2,5-Диметил-4-(тетрагидрофуран-3-илокси)-7-(2,4,6-триметилфенил)-5 Нпирроло[3,2-d]пиримидин. 1H ЯМР (CDCl3)6,97 (s, 1H), 6,94 (s, 2H),4,34 (m, 1H), 4,13 (s, 3H), 2,63 (s, 3H), 2,30 (s,3H), 2,07 (s, 6H), 1,7-1,9 (m, 2H), 1,48 (d, 3H),1,09 (t, 3H) млн-1. Указанные в заголовках соединения примеров 15-18 получают применяя следующую методику. МЕТОДИКА ДЛЯ ПРИМЕРОВ 15-18 Смесь 4-хлор-2-метил-5-замещенного-7(замещенный-фенил)-5 Н-пирроло[3,2-d]пиримидина или метилового эфира 7-бром-1,5-диметил 3-(2,4,6-триметилфенил)-1 Н-пирроло[3,2-b]пиридин-6-карбоновой кислоты (1 ммоль) и соответствующего амина в ДМСО (2 мл) нагревают на масляной бане при 130 С до тех пор, пока все исходное сырье не израсходуется. Смесь гасят водой и экстрагируют этилацетатом. Органический слой сушат и концентрируют до сухого состояния с получением производных соответствующих 4-алкиламино-2-метил-5-замещенного-7-(замещенный-фенил)-5 Н-пирроло[3,2-d] пиримидина или метилового эфира 7-алкиламино-1,5-диметил-3-(2,4,6-триметилфенил)-1 Нпирроло[3,2-b]пиридин-6-карбоновой кислоты. Для очистки можно использовать колоночную хроматографию на силикагеле. Пример 15. [2,5-Диметил-7-(2,4,6-триметилфенил)-5 Н-пирроло[3,2-d]пиримидин-4-ил](1-этилпропил)-амин. 1[3,2-b]пиридин-6-карбоновая кислота. Смесь метилового эфира 7-(1-этилпропиламино)-1,5-диметил-3-(2,4,6-триметилфенил)-1 Н-пирроло[3,2-b]пиридин-6-карбоновой кислоты и NaOH в смеси МеОН и воды (1:1) нагревают с обратным холодильником в течение ночи. Полученную смесь подкисляют 2 н. HCl до рН 4-5 и экстрагируют хлороформом. Органический слой сушат и концентрируют с получением указанного в заголовке соединения. 1H ЯМР (CDCl3)7,02 (s, 1H), 6,82 (s, 2H),3,98 (s, 3H), 3,78 (m, 1H), 2,59 (s, 3H), 2,07 (s,3H), 2,00 (s, 6H), 1,64 (m, 4H), 0,90 (t, 6H) млн-1. Пример 20. [1,5-Диметил-3-(2,4,6-триметилфенил)-1 Н-пирроло[3,2-b]пиридин-7-ил]-(1 этилпропил)-амин. Смесь 7-(1-этилпропиламино)-1,5-диметил-3-(2,4,6-триметилфенил)-1 Н-пирроло[3,2-b] пиридин-6-карбоновой кислоты нагревают на масляной бане при 150-160 С до тех пор, пока все исходное сырье не израсходуется. 1(1,55 мл) в 20 мл бензола нагревают с обратным холодильником в течение 4,5 ч. Реакционную смесь охлаждают до комнатной температуры и добавляют 50 мл 18,5%-ной HCl в воде. Бензольный слой отделяют и повторно экстрагируют 18,5%-ной HCl. Водные слои объединяют и нейтрализуют гидроксидом аммония и перемешивают при комнатной температуре в течение ночи. Выпавший осадок отфильтровывают с получением указанного в заголовке соединения(0,256 г) в виде желтого твердого вещества. Бензольный слой концентрируют и очищают колоночной хроматографией на силикагеле с использованием 5%-ного метанола в хлороформе в качестве элюента с получением дополнительного количества (1,450 г) указанного в заголовке соединения. 1H ЯМР (CDCl3)7,24 (s, 1H), 6,95 (s, 2H),4,75 (brs, 2H), 2,32 (s, 3H), 2,13 (s, 6 Н) млн-1. ПОДГОТОВИТЕЛЬНЫЙ ПРИМЕР Б. 5 Метил-4-(2,4,6-триметилфенил)-2 Н-пиразол-3 иламин. Указанное в заголовке соединение получают в виде белого твердого вещества способом, аналогичным способу, описанному в под 1[1,5-а]пиримидин-7-он. Метилацетоацетат (0,38 мл) добавляют к раствору 5-метил-4-(2,4,6-триметилфенил)-2 Нпиразол-3-иламина (641 мг, 2,98 ммоль) в 4 мл уксусной кислоты. Реакционную смесь нагревают с обратным холодильником в течение ночи. Смесь концентрируют до сухого состояния и остаток очищают колоночной хроматографией на силикагеле с использованием 5%-ного метанола в хлороформе в качестве элюента с получением 560 мг (65,5%) указанного в заголовке соединения в виде белого твердого вещества. 1[1,5-а]пиримидин-7-он. Метилацетоацетат (0,7 мл) добавляют к раствору 4-(2,4,6-триметилфенил)-2 Н-пиразол 3-иламина (1,120 г, 5,57 ммоль) в 5 мл уксусной кислоты и полученную смесь нагревают с обратным холодильником в течение двух дней. Реакционную смесь охлаждают, при этом образуется белое твердое вещество. Добавляют этанол (6 мл), смесь перемешивают при комнатной температуре в течение ночи и фильтруют с получением белого твердого вещества, которое перекристаллизовывают из этанола с получением 673 мг (45,2%) указанного в заголовке соединения в виде белых кристаллов. 1H ЯМР (ДМСО-d6)11,9 (s, 1H), 7,7 (s,1H), 6,95 (s, 2H), 5,55 (s, 1H), 2,25 (s, 3H), 2,20 (s,3H), 2,0 (s, 6H) млн-1. ПОДГОТОВИТЕЛЬНЫЙ ПРИМЕР Д. 7 Хлор-5-метил-3-(2,4,6-триметилфенил)-пиразоло[1,5-а]пиримидин. Суспензию 5-метил-3-(2,4,6-триметилфенил)-4 Н-пиразоло[1,5-а]пиримидин-7-она (590 мг, 2,2 ммоль) в 9 мл РОСl3 обрабатывают диэтиланилином (0,7 мл) и полученную смесь перемешивают с обратным холодильником в течение 15 ч. Реакционную смесь концентрируют до сухого состояния. Остаток обрабатывают ледяной водой и перемешивают в течение 20 мин,затем экстрагируют хлороформом. Органический слой сушат и концентрируют с получением оранжевого масла, которое кристаллизуется при стоянии. Материал очищают колоночной хроматографией на силикагеле с использованием хлороформа в качестве элюента с получением 590 мг (94%) указанного в заголовке соединения в виде желтого твердого вещества.H ЯМР (CDCl3)8,08 (s, 1H), 6,98 (s, 2H),6,86 (s, 1H), 2,56 (s, 3H), 2,33 (s, 3H), 2,09 (s, 6H) млн-1. ПОДГОТОВИТЕЛЬНЫЙ ПРИМЕР Е. 7 Хлор-2,5-диметил-3-(2,4,6-триметилфенил)-пиразол[1,5-а]пиримидин. Указанное в заголовке соединение получают в виде масла способом, аналогичным способу, описанному в подготовительном примере Д, из 2,5-диметил-3-(2,4,6-триметилфенил)-4 Нпиразоло[1,5-а]пиримидин-7-она. 1[3,2-d]пиримидин-4-ол. Смесь 3-амино-1-метил-4-(2,4,6-триметилфенил)-1 Н-пирроло-2-карбонитрила (0,4 ммоль) и уксусного ангидрида (0,043 мл) в уксусной кислоте (0,01 мл) нагревают с обратным холодильником до тех пор, пока все исходное сырье не израсходуется. Реакционную смесь концентрируют до сухого состояния. Остаток гасят водой и экстрагируют этилацетатом. Органические экстракты промывают рассолом и концентрируют до сухого состояния. Остаток суспендируют в 0,5 мл 85%-ной фосфорной кислоты и нагревают при 130 С в течение 1 ч. Смесь охлаждают и вливают в смесь воды со льдом, перемешивают до тех пор, пока не образуется твердое вещество. Твердое вещество фильтруют с получением 2,5-диметил-7-(2,4,6-триметилфенил)5 Н-пирроло[3,2-d]пиримидин-4-ола. Другим способом завершения работы является экстракция. Ледяную воду экстрагируют хлороформом. Органический слой сушат и концентрируют до сухого состояния с получением целевого продукта. 1 Н ЯМР (CDCl3)6,92 (s, 2H), 6,88 (s,1H),4,14 (s, 3H), 2,43 (s, 3H), 2,29 (s, 3H), 2,09 (s, 6H) млн-1. Следующие соединения могут быть получены аналогичным способом: 2,5-диметил-7-(2,6-диметил-4-хлорфенил)5 Н-пирроло[3,2-d]пиримидин-4-ол; 2,5-диметил-7-(2,6-диметил-4-бромфенил)5 Н-пирроло[3,2-d]пиримидин-4-ол; 2-метил-7-(2,4,6-триметилфенил)-5 Н-пирроло[3,2-d]пиримидин-4-ол; 2-метил-7-(2,6-диметил-4-хлорфенил)-5 Нпирроло[3,2-d]пиримидин-4-ол; 2-метил-7-(2,6-диметил-4-бромфенил)-5 Нпирроло[3,2-d]пиримидин-4-ол; и 2-метил-7-(2,4,6-триметилфенил)-5 Н-пирроло[3,2-d]пиримидин-4-ол. ПОДГОТОВИТЕЛЬНЫЙ ПРИМЕР З. 4 Хлор-2,5-диметил-7-(2,4,6-триметилфенил)-5 Нпирроло[3,2-d]пиримидин. Смесь 2,5-диметил-7-(2,4,6-триметилфенил)-5 Н-пирроло[3,2-d]пиримидин-4-ола 39 ммоль) в РОСl3 (1,3 мл) нагревают с обратным холодильником до тех пор, пока все исходное сырье не израсходуется (приблизительно 1-3 ч). Реакционную смесь концентрируют до сухого состояния. Остаток вливают в смесь льда с водой и экстрагируют этилацетатом. Органический слой сушат и концентрируют до сухого состояния с получением указанного в заголовке соединения. 1 Н ЯМР (CDCl3)7,18 (s, 1H), 6,95 (s, 2H),4,16 (s, 3H), 2,69 (s, 3H), 2,31 (s, 3H), 2,05 (s, 6H) млн-1. ПОДГОТОВИТЕЛЬНЫЙ ПРИМЕР И. Метиловый эфир 7-амино-1,5-диметил-3-(2,4,6 триметилфенил)-1 Н-пирроло[3,2-b]пиридин-6 карбоновой кислоты. Смесь 3-амино-1-метил-4-(2,4,6-триметилфенил)-1 Н-пирроло-2-карбонитрила (2 ммоль),метилацетоацетата (4 ммоль) и SnCl4 (4 ммоль) в 1,2-дихлорэтане нагревают с обратным холодильником в течение приблизительно 6 ч до тех пор, пока все исходное сырье не израсходуется. Смесь гасят ацетоном, увеличивают основность смеси насыщенным NаНСО 3, затем фильтруют через Celite. Фильтрат концентрируют до сухого состояния. Остаток гасят водой и экстрагируют хлороформом. Хлороформный слой промывают рассолом, сушат и концентрируют до сухого состояния с получением метилового эфира 7-амино-1,5-диметил-3-(2,4,6-триметилфенил)-1 Н-пирроло[3,2-b]пиридин-6-карбоновой кислоты. Продукт можно очистить растиранием в порошок. 1 Н ЯМР (CDCl3)6,91 (s, 2H), 6,85 (s, 1H),6,28 (brs, 2H), 4,10 (s, 3H), 3,89 (s, 3H), 2,62 (s,3H), 2,28 (s, 3H), 2,09 (s, 6H) млн-1. ПОДГОТОВИТЕЛЬНЫЙ ПРИМЕР К. Метиловый эфир 7-бром-1,5-диметил-3-(2,4,6 триметилфенил)-1 Н-пирроло[3,2-b]пиридин-6 карбоновой кислоты. Смесь метилового эфира 7-амино-1,5 диметил-3-(2,4,6-триметилфенил)-1 Н-пирролоCuBr2 в ацетонитриле нагревают при 60-70 С до тех пор, пока все исходное сырье не израсходуется. Смесь гасят водой и экстрагируют этилацетатом. Органический слой сушат и концентрируют до сухого состояния с получением указанного в заголовке соединения. 1H ЯМР (CDCl3)7,09 (s, 1H), 6,94 (s, 2H),4,16 (s, 3H), 3,98 (s, 3H), 2,52 (s, 3H), 2,30 (s, 3H),2,04 (s, 6H) млн-1. Также в незначительном количестве можно получить метиловый эфир 2,7-дибром-1,5 диметил-3-(2,4,6-триметилфенил)-1 Н-пирроло[3,2-b]пиридин-6-карбоновой кислоты. 1 или его фармацевтически приемлемая соль, где пунктирные линии представляют собой возможные двойные связи; А представляет собой азот или CR7; В представляет собой -NR1R2, -CR1R2R10,-NHCR1R2R10,-OCR1R2R10,-C(=CR2R11)R1,1 2 10 2 10 1J и K, каждый независимо, представляет собой азот или углерод, а оба J и K не представляют собой азот;G представляет собой азот или углерод; кольцо, содержащее D, Е, G, К и J, в формуле I может быть насыщенным или ненасыщенным 5-членным кольцом, и может возможно содержать одну или две двойных связи, и может возможно содержать от одного до трех гетероатомов в кольце, и может возможно иметь одну или две группы С=O или С=S;R1 представляет собой C1-С 6 алкил, возможно замещенный одним или двумя заместителями, независимо выбранными из гидрокси,фторо, хлоро, бромо, йодо, -O-(С 1-С 4 алкила),СF3,-С(=O)O-(С 1-С 4 алкила),-ОС(=O)(С 1 С 4 алкила), -ОС(=O)N(С 1-С 4 алкил)(С 1-С 2 алкила),-СООН,-СОО(С 1-NНСО(С 1-С 4 алкила),С 4 алкила),-СОNН(С 1-С 4 алкила),-СОN(С 1 С 4 алкил)(С 1-С 2 алкила), -S(С 1-C4 алкила), -CN,-NO2, -SO(C1-С 4 алкила), -SO2(C1-С 4 алкила),-SO2NН(С 1-С 4 алкила) и -SO2N(C1-С 4 алкил)(С 1 С 2 алкила), где каждая из С 1-С 4 алкильных групп в упомянутых выше R1 группах возможно может содержать одну или две двойных или тройных связи;R2 представляет собой С 1-С 12 алкил, который возможно может содержать от одной до трех двойных или тройных связей, арил или (C1 С 4 алкилен)арил, где указанный арил и арильная группировка указанного (С 1-С 4 алкилен)арила выбрана из фенила, нафтила, тиенила, бензотиенила, пиридила, хинолила, пиразинила, пиримидинила, имидазолила, фуранила, бензофуранила, бензотиазолила, изотиазолила, пиразолила, пирролила, индолила, пирролопиридила,оксазолила и бензоксазолила; С 3-С 8 циклоалкил или (С 1-С 6 алкилен)(С 3-С 8 циклоалкил), где один или два атома углерода указанного циклоалкила и 5-8-членных циклоалкильных группировок указанного (С 1-С 6 алкилен)(С 3-С 8 циклоалкила) могут быть возможно и независимо заменены на 41 атом кислорода или серы или NZ2, где Z2 выбран из водорода, С 1-С 4 алкила, бензила и С 1 С 4 алканоила, и где каждая из упомянутых вышеR2 групп возможно может быть замещена заместителями в количестве от одного до трех, независимо выбранными из хлоро, фторо, гидрокси и С 1-С 4 алкила, или одним заместителем, выбранным из бромо, йодо, C1-С 6 алкокси,-ОС(=O)(С 1-С 6 алкила), -ОС(=O)N(С 1-С 4 алкил)(С 1 С 2 алкила),-S(С 1-С 6 алкила),амино,-NH(С 1 С 2 алкила), -N(С 1-С 2 алкил)(С 1-С 4 алкила), -N(С 1 С 4 алкил)-СО-(С 1-С 4 алкила), -NНСО(C1-C4 алкила),-СООН, -СОО(С 1-С 4 алкила), -СОNH(C1-C4 алкила),-CON(C1-C4aлкил)(C1-С 2 алкила), -SH, -CN, -NO2,-SO(С 1-C4 алкила), -SO2(С 1-С 4 алкила), -SO2NН(С 1 С 4 алкила) и -SO2N(С 1-С 4 алкил)(С 1-С 2 алкила);-NR1R2 или CR1R2R10 могут образовывать насыщенное 3-8-членное карбоциклическое кольцо, которое возможно может содержать от одной до трех двойных связей, и где один или два кольцевых атома углерода таких 5-8 членных колец возможно и независимо могут быть заменены на атом кислорода или серы илиR3 представляет собой С 1-С 4 алкил, -O(С 1 С 4 алкил) или -S(С 1-С 4 алкил); каждый R4 независимо представляет собой водород, (C1-С 6 алкил), фторо, хлоро, бромо,йодо, гидрокси, циано, амино, (С 1-С 2 алкилен)ОН, CF3, СН 2SСН 3, нитро, -O(С 1-С 4 алкил),-N(С 1-С 4 алкил)(С 1-С 2 алкил),-S(C1-С 4 алкил),-СО(С 1-С 4 алкил), -С(=O)Н или -С(=O)O(С 1 С 4 алкил);R8 представляет собой водород или С 1C4 алкил;R5 представляет собой фенил, замещенный заместителями R13 в количестве от одного до трех, независимо выбранными из фторо, хлоро,С 1-С 6 алкила, -O(С 1-С 6 алкила), бромо, йодо иR11 представляет собой водород или С 1 С 4 алкил; и при условии, что: а) когда оба J и K представляют собой углерод, a D представляет собойCR4 и Е представляет собой азот, тогда G не может быть азотом; б) когда оба J и K представляют собой углерод и D и G представляют собой азот, тогда Е не может быть CR4, CR4R6,C=O или C=S; в) когда оба J и K представляют собой углерод и D и Е представляют собой углерод, тогда G не может быть азотом; г) когда G представляет собой углерод, тогда G должен 42 быть связан двойной связью с Е; и д) в кольце,содержащем J, K, D, Е и G, не может быть двух двойных связей, соседних друг другу; и фармацевтически приемлемые соли таких соединений. 2. Соединения по п.1, где В представляет собой -NR1R2, -NHCHR1R2, -OCHR1R2, и R1 представляет собой C1-С 6 алкил, который возможно может быть замещен одной группой фторо или С 1-С 4 алкокси и который возможно может содержать одну двойную или тройную связь, и R2 представляет собой С 1-С 4 алкил или(С 1-С 2 алкил)-СО-(С 1-С 2 алкил), который возможно может содержать одну двойную или тройную связь. 3. Соединения по п.1, где В представляет собой -CHR1R2, -NR1R2, -NHCHR1R2, -OCHR1R2,-SCHR1R2, и R1 представляет собой C1-С 6 алкил,который возможно может быть замещен одной группой гидрокси, фторо, CF3, циклопропил или С 1-С 4 алкокси и который возможно может содержать одну двойную или тройную связь, и R2 представляет собой бензил или C1-С 6 алкил, который возможно может содержать одну двойную или тройную связь, где указанные С 1 С 6 алкил и фенильная группировка указанного бензила возможно могут быть замещены одной группой фторо, гидрокси, CF3, циклопропил, С 1 С 2aлкил, С 1-С 2 алкокси или хлоро. 4. Соединения по п.1, где R3 представляет собой метил. 5. Соединения по п.1, где R4, R6 и R8 представляют собой водород или метил. 6. Соединения по п.1, где R5 представляет собой ди- или тризамещенный фенил, в котором два или три заместителя независимо выбраны из С 1-С 4 алкила, O-(С 1-С 4 алкила), хлоро, фторо,бромо и йодо. 7. Соединения по п.1, где R3 представляет собой метил, этил или метокси и каждый из R4,R6 и R8 независимо представляет собой водород,метил или этил. 8. Соединения по п.1, где А представляет собой N, СН или ССН 3. 9. Соединения по п.1, где А представляет собой СН, J и K представляют собой углерод, aD, Е и G представляют собой азот. 10. Соединения по п.1, где J и D представляют собой азот, а K и G представляют собой углерод и Е представляет собой СН, ССН 3 или СС 2 Н 5. 11. Соединения по п.1, где J и K представляют собой углерод, a D=EG представляет собой OС(СН 3)=С, O-СН=С, S-С(СН 3)=С, S-CH=C, N(СН 3)С(СН 3)=С, NНС(СН 3)=С, NНС(СН 3 СН 2)=С, N(СН 3)СН=С, O-N=C, S-N=C, N(СН 3)-N=С, O-CH2N или SСН 2N. 12. Соединение по п.1, где В представляет собой -CHR1R2, -NCHR1R2 или -OCHR1R2, а группа CHR1R2 радикала В представляет собой циклопентановое кольцо, тетрагидрофурановое кольцо или тетрагидротиенильное кольцо. 43 13. Соединение по п.1, где NR1R2 группа радикала В представляет собой пятичленное насыщенное или ненасыщенное гетероциклическое кольцо. 14. Соединение по п.13, где NR1R2 представляет собой пиррольное кольцо, пирролидиновое кольцо, тиазолидиновое кольцо или морфолиновое кольцо. 15. Фармацевтическая композиция для лечения, предупреждения или подавления расстройства,лечение которого может быть осуществлено или лечению которого можно способствовать посредством антагонизации КВФ (кортикотропин высвобождающего фактора), включая, но не ограничиваясь расстройствами, вызванными КВФ или которым способствовал КВФ, в частности расстройства, выбранного из воспалительных расстройств, таких как ревматоидный артрит и остеоартрит, боль, астма,псориаз и аллергии; расстройства генерализованной тревоги; панического расстройства; фобий; обсессивно-компульсивного расстройства; посттравматического стрессового расстройства; нарушений сна, вызванных стрессом; перцепции боли, такой как фибромиалгия; эмоциональных расстройств,таких как депрессия, в том числе основная депрессия, однократная эпизодическая депрессия, рецидивирующая депрессия, вызванная злоупотреблениями детская депрессия, эмоциональные расстройства, ассоциированные с предменструальным синдромом, и послеродовая депрессия; дистемии; биполярных расстройств; циклотимии; синдрома хронической усталости; вызванной стрессом головной боли; рака; синдрома раздраженного кишечника,болезни Крона; синдрома раздраженной толстой кишки; послеоперационного илеуса; язвы; диареи; лихорадки, вызванной стрессом; инфекций вируса иммунодефицита человека (ВИЧ); нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона; желудочно-кишечных заболеваний; нарушений аппетита, таких как анорексия и нервнопсихическая булимия; геморрагического стресса; химических зависимостей и аддикций (например зависимостей от алкоголя, кокаина, героина, бензодиазепинов или других лекарственных средств); симптомов лекарственной и алкогольной абстиненции; вызванных стрессом психотических эпизодических состояний; эутиреоидного синдрома слабости; синдрома несоответствующего антидиуретического гормона (АДГ); ожирения; бесплодия; травм головы; травм спинного мозга; ишемического нейронального повреждения (например церебральной ишемии, такой как церебральная гиппокампальная ишемия); экситотоксического нейронального повреждения; эпилепсии; удара; иммунных дисфункций, в том числе иммунных дисфункций, вызванных стрессом (например свиного стресс-синдрома,вызванной перевозкой бычьей лихорадки, конской пароксизмальной фибрилляции и дисфункций у цыплят, вызванных их безвыгульным содержанием,стресса у овцы, вызванного стрижкой, или стресса у собак, связанного с взаимоотношениями человек 002769 44 животное); мышечных спазм; недержания мочи; старческой деменции Альцгеймеровского типа; мультиинфарктной деменции; бокового амиотрофического склероза; гипертензии; тахикардии; застойной сердечной недостаточности; остеопороза; преждевременных родов; и гипогликемии, у млекопитающего, содержащая соединение по п.1 в количестве, которое является эффективным при лечении такого расстройства, и фармацевтически приемлемый носитель. 16. Способ лечения, предупреждения или подавления расстройства, лечение которого может быть осуществлено или лечению которого можно способствовать посредством антагонизации КВФ (кортикотропин высвобождающего фактора), включая, но не ограничиваясь расстройствами, вызванными КВФ или которым способствовал КВФ, в частности расстройства,выбранного из воспалительных расстройств,таких как ревматоидный артрит и остеоартрит,боль, астма, псориаз и аллергии; расстройства генерализованной тревоги; панического расстройства; фобий; обсессивно-компульсивного расстройства; посттравматического стрессового расстройства; нарушений сна, вызванных стрессом; перцепции боли, такой как фибромиалгия; эмоциональных расстройств, таких как депрессия, в том числе основная депрессия, однократная эпизодическая депрессия, рецидивирующая депрессия, вызванная злоупотреблениями детская депрессия, эмоциональные расстройства,ассоциированные с предменструальным синдромом, и послеродовая депрессия; дистемии; биполярных расстройств; циклотимии; синдрома хронической усталости; вызванной стрессом головной боли; рака; синдрома раздраженного кишечника, болезни Крона; синдрома раздраженной толстой кишки; послеоперационного илеуса; язвы; диареи; лихорадки, вызванной стрессом; инфекций вируса иммунодефицита человека (ВИЧ); нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона; желудочнокишечных заболеваний; нарушений аппетита,таких как анорексия и нервно-психическая булимия; геморрагического стресса; химических зависимостей и аддикций (например зависимостей от алкоголя, кокаина, героина, бензодиазепинов или других лекарственных средств); симптомов лекарственной и алкогольной абстиненции; вызванных стрессом психотических эпизодических состояний; эутиреоидного синдрома слабости; синдрома несоответствующего антидиуретического гормона (АДГ); ожирения; бесплодия; травм головы; травм спинного мозга; ишемического нейронального повреждения (например церебральной ишемии, такой как церебральная гиппокампальная ишемия); экситотоксического нейронального повреждения; эпилепсии; удара; иммунных дисфункций, в том числе иммунных дисфункций, вызванных стрессом перевозкой бычьей лихорадки, конской пароксизмальной фибрилляции и дисфункций у цыплят, вызванных их безвыгульным содержанием, стресса у овцы, вызванного стрижкой, или стресса у собак, связанного с взаимоотношениями человек-животное); мышечных спазм; недержания мочи; старческой деменции Альцгеймеровского типа; мультиинфарктной деменции; бокового амиотрофического склероза; гипертензии; тахикардии; застойной сердечной недостаточности; остеопороза; преждевременных родов; и гипогликемии, у млекопитающего,при котором субъекту, нуждающемуся в указанном лечении, вводят соединение по п.1 в количестве, которое является эффективным при лечении такого расстройства. 17. Способ лечения или предупреждения расстройства или состояния, лечение или предупреждение которого может быть осуществлено или лечению или предупреждению которого можно способствовать посредством ингибирования КВГ (кортикотропин высвобождающий гормон) связывающего белка, у млекопитающего, при котором указанному млекопитающему вводят соединение по п.1 в количестве, ингибирующем КВГ связывающий белок. 18. Фармацевтическая композиция для лечения или предупреждения расстройства или состояния, лечение или предупреждение которого может быть осуществлено или лечению или предупреждению которого можно способствовать посредством ингибирования КВГ связывающего белка, у млекопитающего, содержащая соединение по п.1 в количестве, ингибирующем КВГ связывающий белок, и фармацевтически приемлемый носитель. 19. Соединение по п.10 или 11, где А представляет собой N или СН, R3 представляет собой метил, а R4, R6 и R8, каждый независимо, представляет собой водород или метил. 20. Соединение по п.19, где R5 представляет собой ди- или тризамещенный фенил, где два или три заместителя независимо выбраны из С 1 С 4 алкила, O-(С 1-С 4 алкила), хлоро, фторо, бромо и йодо. 21. Соединение формулы 46 где R3 представляет собой С 1-С 4 алкил, R5 представляет собой водород, метил, хлоро, бромо,-СООН или -СОО(С 1-С 4 алкил), Т представляет собой хлоро, бромо, йодо или трифлат, R8 представляет собой водород или C1-С 4 алкил, а R4 представляет собой водород, (С 1-С 6 алкил), фторо, хлоро, бромо, йодо, гидрокси, циано, амино,(С 1-С 2 алкилен)-ОН, СF3, СН 2SCН 3, нитро,-O(С 1-С 4 алкил),-N(С 1-С 4 алкил)(С 1-С 2 алкил),-S(C1-C4aлкил), -СО(С 1-С 4 алкил), -С(=O)Н или-С(=O)O(С 1-С 4 алкил). 22. Соединение по п.1, которое представляет собой 7-(1-этилпропокси)-5-метил-3-(2,4,6-триметилфенил)-пиразоло[1,5-а]-пиримидин;-2,5-диметил-4-(тетрагидрофуран-3-илокси)-7-(2,4,6-триметилфенил)-5 Н-пирроло[3,2-d] пиримидин; 2,5-диметил-4-(S)-(тетрагидрофуран-3-илокси)-7-(2,4,6-триметилфенил)-5 Н-пирроло[3,2-d] пиримидин; 2,5-диметил-4-(1-пропилбутокси)-7-(2,4,6 триметилфенил)-5 Н-пирроло[3,2-d]пиримидин; или 4-втор-бутилсульфанил-2,5-диметил-7-(2,4,6-триметилфенил)-5 Н-пирроло[3,2-d]пиримидин; или фармацевтически приемлемую соль такого соединения.
МПК / Метки
МПК: C07D 471/04, C07D 487/04, A61K 31/519
Метки: замещенные, производные, 6,5-гетеробициклические
Код ссылки
<a href="https://eas.patents.su/24-2769-zameshhennye-65-geterobiciklicheskie-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные 6,5-гетеробициклические производные</a>
Предыдущий патент: Пиразоло [3,4 - d] пиримидины с противоконвульсивным, противоаллергическим / противоастматическим действием
Следующий патент: Способ получения циталопрама
Случайный патент: Система электромагнитной защиты












