Замещенные бициклические пиримидоновые производные
Номер патента: 14918
Опубликовано: 29.04.2011
Авторы: Саади Мурад, Иэш Филипп, Шерез Натали, Словински Франк, Локхед Алистер
Формула / Реферат
1. Пиримидоновое производное, представленное формулой (I), или его соль, его сольват или его гидрат
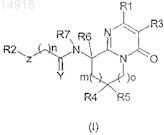
где Y представляет собой два атома водорода, атом кислорода;
Z представляет собой связь, атом кислорода, атом азота, замещенный атомом водорода или C1-3 алкильной группой;
R1 представляет собой 2-, 3- или 4-пиридиновое кольцо или 2-, 4- или 5-пиримидиновое кольцо, при этом указанное кольцо необязательно замещено C1-6 алкильной группой, C1-6 алкоксигруппой или атомом галогена;
R2 представляет собой бензольное кольцо или нафталиновое кольцо; указанные кольца необязательно замещены 1-4 заместителями, выбранными из C1-6 алкильной группы, C3-7 циклоалкильной группы, C3-7 циклоалкил-C1-6 алкильной группы, атома галогена, C1-2 пергалогенированной алкильной группы, C1-3 галогенированной алкильной группы, гидроксильной группы, C1-6 алкоксигруппы, необязательно замещенной C3-5 циклоалкильной группой, C1-2 пергалогенированной алкоксигруппы, C1-6 алкилсульфонильной группы, нитро, циано, амино, C1-6 моноалкиламиногруппы или С2-12 диалкиламиногруппы, ацетоксигруппы или аминосульфонильной группы;
R3 представляет собой атом водорода, C1-6 алкильную группу или атом галогена;
R4 представляет собой атом водорода;
R5 представляет собой атом водорода;
R6 представляет собой атом водорода, C1-6 алкильную группу или атом галогена;
R7 представляет собой атом водорода или C1-6 алкильную группу и
n имеет значение от 0 до 3; m имеет значение от 0 до 1; o имеет значение от 0 до 2.
2. Пиримидоновое производное или его соль, его сольват или его гидрат по п.1, где R1 представляет собой незамещенное 4-пиридиновое кольцо или незамещенное 4-пиримидиновое кольцо.
3. Пиримидоновое производное, или его соль, или его сольват, или его гидрат по п.1, где
R1 представляет собой 3- или 4-пиридиновое кольцо, альтернативно 4- или 5-пиримидиновое кольцо; при этом указанное кольцо необязательно замещено C1-2 алкильной группой, C1-2 алкоксигруппой или атомом галогена;
R2 представляет собой бензольное кольцо или нафталиновое кольцо; где указанные кольца необязательно замещены 1-4 заместителями, выбранными из C1-3 алкильной группы, C3-5 циклоалкильной группы, С3-5 циклоалкил-C1-4 алкильной группы, атома галогена, C1-3 галогеналкильной группы, гидроксильной группы, C1-3 алкоксигруппы, необязательно замещенной С3-5 циклоалкильной группой, C1-2 пергалогенированной алкоксигруппы, C1-6 алкилсульфонильной группы, нитро, циано, амино, C1-3 моноалкиламиногруппы или C2-6диалкиламиногруппы;
R3 представляет собой атом водорода, C1-3 алкильную группу или атом галогена;
R4 представляет собой атом водорода;
R5 представляет собой атом водорода;
R6 представляет собой атом водорода, C1-3 алкильную группу или атом галогена и/или
R7 представляет собой атом водорода или C1-3 алкильную группу;
Y представляет собой два атома водорода, атом кислорода;
Z представляет собой связь, атом кислорода, атом азота, замещенный атомом водорода или C1-3 алкильной группой;
n имеет значение от 0 до 3; m имеет значение от 0 до 1 и o имеет значение от 1 до 2.
4. Пиримидоновое производное, или его соль, или его сольват, или его гидрат по п.1, где
R1 представляет собой незамещенное 4-пиридиновое кольцо или 4-пиримидиновое кольцо;
R2 представляет собой бензольное кольцо или нафталин; при этом указанное кольцо необязательно замещено 1-4 заместителями, выбранными из C1-3 алкильной группы, C1-2 пергалогенированной алкильной группы, C3-4 циклоалкильной группы, C3-4 циклоалкил-C1-3 алкильной группы, атома галогена, гидроксильной группы, нитро, циано, амино, C1-3 алкоксигруппы, необязательно замещенной C3-4 циклоалкильной группой, C1-2 пергалогенированной алкоксигруппы или C1-3 алкилсульфонильной группы;
R3 представляет собой атом водорода или атом галогена;
R4 представляет собой атом водорода;
R5 представляет собой атом водорода;
R6 представляет собой атом водорода, C1-6 алкильную группу;
R7 представляет собой атом водорода;
Y представляет собой два атома водорода или атом кислорода;
Z представляет собой связь, атом кислорода, атом азота, замещенный атомом водорода;
n имеет значение от 0 до 1; m имеет значение от 0 до 1 и o имеет значение от 1 до 2.
5. Пиримидоновое производное, представленное формулой (III)
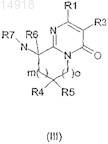
где R1, R2, R3, R4, R5, R6, R7, m и o определены для соединения формулы (I) по п.1.
6. Пиримидоновое производное или его соль, его сольват или его гидрат по п.1, которое выбрано из группы, включающей
(+/-) N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 2-метокси-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-2-фенилацетамид;
(+/-) фенил(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4Н-пиридо[1,2-а]пиримидин-9-ил)карбамат;
(+/-) N-(4-фторфенил)-N'-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил) мочевина;
(+/-) N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-N'-фенилмочевина;
(+/-) 9-[(2-метоксибензил)амино]-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-4-он;
(+/-) 3-фтор-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 4-изопропокси-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 2-хлор-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 4-фтор-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 3-циано-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 2-хлор-5-фтор-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 4-фтор-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-2-(трифторметил)бензамид;
(+/-) 4-метокси-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-3-(трифторметил)бензамид;
(+/-) N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-2-(трифторметил)бензамид;
(+/-) 2-хлор-4-фтор-5-нитро-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-2-нафтамид;
(+/-) 3-хлор-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 2,6-диметокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 3-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 2-фтор-6-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 4-фтор-2-метокси-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 4-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 2-этокси-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) N-(3-бром-4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-2-метоксибензамид;
(+/-) 4-амино-5-хлор-2-метокси-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-2-(трифторметокси)бензамид;
(+/-) 2-изопропокси-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 2-(циклопропилметокси)-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 4-амино-5-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 4-фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил) бензамид;
(+/-) 2-(циклопропилметокси)-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-2-нафтамид;
(+/-) 3-хлор-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 5-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил) бензамид;
(+/-) 4-амино-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-4-трифторметилбензамид;
(+/-) 5-(этилсульфонил)-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 2,3-диметокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(-) 4-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+) 4-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 5-бром-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 2-{[(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4Н-пиридо[1,2-а]пиримидин-9-ил)амино]карбонил} фенилацетат;
(+/-) 2-гидрокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 4-хлор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+) 4-хлор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(-) 4-хлор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 4-хлор-2-метокси-N-метил-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+) 4-фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил) бензамид;
(-) 4-фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил) бензамид;
(+/-) 5-хлор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 4-фтор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 4-амино-5-хлор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а] пиримидин-9-ил)бензамид;
(+/-) 2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-4-трифторметилбензамид;
(+/-) 2-фтор-6-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил) бензамид;
(+/-) 5-бром-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 4-диметиламино-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 2,4-диметокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид;
(+/-) 4-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин-8-ил)бензамид;
(+/-) 4-фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин-8-ил)бензамид;
(+/-) 4-амино-5-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин-8-ил)бензамид;
(+/-) 5-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин-8-ил)бензамид;
(+/-) 4-хлор-2-метокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин-8-ил)бензамид;
(+/-) 4-фтор-2-метокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин-8-ил)бензамид;
(+/-) 4-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил) бензамид;
(+/-) 4-фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил) бензамид;
(+/-) 5-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил) бензамид;
(+/-) 4-амино-5-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(+/-) 4-амино-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(+/-) 2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(+/-) 5-(аминосульфонил)-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а] азепин-10-ил)бензамид;
(+/-) 2-гидрокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(+/-) 5-бром-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил) бензамид;
(+/-) 2,4-диметокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(+/-) 2-{[(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)амино]карбонил} фенилацетат;
(+/-) 2,3-диметокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(+/-) 2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)-5-(трифторметокси)бензамид;
(+/-) 2,5-диметокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(+) 4-фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(-) 4-фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(+/-) 4-хлор-2-метокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бен-замид;
(+/-) 5-бром-2-метокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(+/-) 4-фтор-2-метокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(+/-) 2-метокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(+/-) 5-хлор-2-метокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(+/-) 4-амино-2-метокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(+/-) 2-{[(4-оксо-2-пиридин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)амино]карбонил}фенилацетат;
(+/-) 2,4-диметокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(+) 4-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;
(-) 4-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид.
7. Лекарственное средство для профилактического и/или терапевтического лечения заболевания, вызванного аномальной активностью GSK3b, включающее в качестве активного ингредиента вещество, выбранное из группы, включающей пиримидоновое производное, представленное формулой (I), или его соль, или его сольват, или его гидрат по п.1.
8. Применение соединения по пп.1-3 для получения лекарственного средства для профилактического и/или терапевтического лечения заболевания, вызванного аномальной активностью GSK3b.
9. Применение соединения по пп.1-3 для получения лекарственного средства для профилактического и/или терапевтического лечения нейродегенеративного заболевания, вызванного аномальной активностью GSK3b.
10. Применение соединения по п.9, где нейродегенеративное заболевание выбрано из группы, включающей болезнь Альцгеймера, болезнь Паркинсона, тауопатии, гепатоцеребральную дистрофию, болезнь Гентингтона, болезнь Приона, включая сосудистую деменцию, острый инсульт, травматические поражения, цереброваскулярные нарушения, травму головного мозга, травму спинного мозга, амиотрофический боковой склероз, периферические невропатии, ретинопатии и глаукому.
11. Применение соединения по пп.1-4 для получения лекарственного средства для профилактического и/или терапевтического лечения инсулиннезависимого диабета, ожирения, малярии, биполярных расстройств, шизофрении, остеопороза, алопеции или рака, вызванного аномальной активностью GSK3b.
12. Применение соединения по п.11, где рак представляет собой рак молочной железы, немелкоклеточную карциному легкого, рак щитовидной железы, T- или B-клеточные лейкозы или индуцированные вирусами опухоли.
13. Применение соединения по пп.1-3 для получения лекарственного средства для лечения или профилактики вызванного аномальной активностью GSK3b Pemphigus vulgaris.
14. Применение соединения по пп.1-3 для получения лекарственного средства для лечения вызванной аномальной активностью GSK3b нейтропении, индуцицированной химиотерапией рака.
Текст
ЗАМЕЩЕННЫЕ БИЦИКЛИЧЕСКИЕ ПИРИМИДОНОВЫЕ ПРОИЗВОДНЫЕ Пиримидоновое производное, представленное формулой (I), или его соль, его сольват или его гидрат, где Y представляет собой два атома водорода, атом кислорода; Z представляет собой связь, атом кислорода, атом азота, замещенный атомом водорода или C1-3 алкильной группой; R1 представляет собой 2, 3 или 4-пиридиновое кольцо или 2, 4 или 5-пиримидиновое кольцо, при этом указанное кольцо, необязательно, является замещенным; R2 представляет собой бензольное кольцо или нафталиновое кольцо; указанные кольца, необязательно, являются замещенными; R3 представляет собой атом водорода, C1-6 алкильную группу или атом галогена; R4 представляет собой атом водорода; R5 представляет собой атом водорода; R6 представляет собой атом водорода, C1-6 алкильную группу или атом галогена; R7 представляет собой атом водорода илиC1-6 алкильную группу; n имеет значение от 0 до 3; m имеет значение от 0 до 1; o имеет значение от 0 до 2. Изобретение также относится к лекарственному средству, включающему указанное производное или его соль в качестве активного ингредиента, которое применяют для профилактического и/или терапевтического лечения заболевания, вызванного аномальной активностью GSK3, такого как болезнь Альцгеймера.(71)(73) Заявитель и патентовладелец: САНОФИ-АВЕНТИС (FR); МИЦУБИСИ ТАНАБЕ ФАРМА КОРПОРЕЙШН (JP) 014918 Область изобретения Настоящее изобретение относится к соединениям, которые являются полезными в качестве активного ингредиента лекарственного средства для профилактического и/или терапевтического лечения нейродегенеративных заболеваний, вызванных аномальной активностью GSK3. Предпосылки изобретенияGSK3 (киназа 3 гликогенсинтазы) представляет собой пролин-направленную серинтреонинкиназу, которая играет важную роль в контроле метаболизма, дифференциации и выживания. Изначально она была идентифицирована как фермент, способный к фосфорилированию и, следовательно, ингибированию гликогенсинтазы. Позднее было признано, что GSK3 идентична киназе 1 tau-белка (TPK1), ферменту, который фосфорилирует tau-белок в эпитопах, которые, как также было обнаружено, являются гиперфосфорилированными при болезни Альцгеймера и некоторых таупатиях. Интересно, что фосфорилирование GSK3 протеинкиназой B (AKT) приводит к потере ее киназной активности, и было сделано предположение, что такое ингибирование может опосредовать некоторые эффекты нейротрофических факторов. Кроме того, фосфорилирование ферментом GSK3 -катенина белка, вовлеченного в выживание клеток, приводит к его разложению зависимым от убиквитинилирования протеасомным путем. Таким образом, оказалось, что ингибирование GSK3 активности может привести к нейротрофической активности. Действительно, есть свидетельства того, что литий, неконкурентный ингибитор GSK3,усиливает невритогенез в некоторых моделях, а также повышает выживаемость нейронов через индукцию факторов выживания, таких как BcI-2, и ингибирование экспрессии проапоптических факторов, таких как P53 и Bax. Проведенные в последнее время исследования показали, что -амилоид повышает GSK3 активность и фосфорилирование tau-белка. Кроме того, это гиперфосфорилирование, также как и нейротоксические эффекты -амилоида блокируются хлоридом лития и антисмысловой мРНК GSK3. Эти наблюдения являются серьезным основанием для предположения, что GSK3 может быть связывающим звеном между двумя основными патологическими процессами в болезни Альцгеймера: аномальный процессинг APP (амилоидный белок-предшественник) и гиперфосфорилирование tau-белка. Хотя гиперфосфорилирование tau приводит к дестабилизации нейронного цитоскелета, патологические последствия аномальной активности GSK3, скорее всего, имеют место не только в результате патологического фосфорилирования tau-белка, поскольку, как указано выше, чрезмерная активность этой киназы может влиять на выживаемость через модуляцию экспрессии апоптических и антиапоптических факторов. Кроме того, было показано, что -амилоидиндуцированное усиление активности GSK3 приводит к фосфорилированию и, следовательно, ингибированию пируватдегидрогеназы, основного фермента в продукции энергии и синтезе ацетилхолина. Все вместе, эти экспериментальные наблюдения показывают, что GSK3 может найти применение в лечении нейропатологических последствий и дефицита познавательной способности и внимания, связанных с болезнью Альцгеймера, а также другими острыми и хроническими нейродегенеративными заболеваними и другими патологиями, где имеет место дерегуляция GSK3 (Nature reviews, vol. 3, June,2004, p. 479-487; Trends in Pharmacological Sciences, vol. 25, No. 9, Sept., 2004, p. 471-480; Journal of neurochemistry, 2004, 89, 1313-1317; Medicinal Research Reviews, vol. 22, No. 4, 373-384, 2002). Нейродегенеративные заболевания включают, но не ограничиваются этим, болезнь Паркинсона,таупатии (например, фронтотемпоральные деменции, кортикобазальную дегенерацию, болезнь Пика,прогрессивный супрануклеартный паралич), гепатоцеребральную дистрофию, болезнь Гентингтона (TheJournal of biological chemistry, vol. 277, No. 37, Issue of September, 13, p. 33791-33798, 2002), болезнь Приона (Biochem. J., 372, p. 129-136, 2003) и другие деменции, включая сосудистые деменции; острый инсульт и другие травматические поражения; цереброваскулярные нарушения (например, возрастная дегенерация желтого пятна); травмы головного и спинного мозга; амиотрофический боковой склероз (European Journal of Neuroscience, vol. 22, p. 301-309, 2005) периферические невропатии; ретинопатии и глаукому. Последние исследования также показали, что ингибирование GSK3 приводит к нейронной дифференциации эмбриональных стволовых клеток (ESC) и поддерживает обновление человеческих и мышиных ESC и сохранение их множественной активности. Это говорит о том, что ингибиторы GSK3 могли бы найти применение в восстановительной медицине (Nature Medicine, 10, p. 55-63, 2004). Ингибиторы GSK3 также могут найти применение в лечении других расстройств нервной системы, таких как биполярные расстройства (маниакально-депрессивное заболевание). Например, в течение более чем 50 лет в качестве стабилизатора настроения и основного лечения при биполярных расстройствах использовали литий. Терапевтическое действие лития наблюдали при дозах (1-2 мМ), при которых он является непосредственным ингибитором GSK3. Хотя механизм действия лития неясен, ингибиторыGSK3 можно было бы использовать для имитации стабилизирующих настроение эффектов лития. Изменения в Akt-GSK3 сигнальной активности также имеет место в патогенезе шизофрении.-1 014918 Кроме того, ингибирование GSK3 могло бы быть полезным в лечении рака, такого как колоректальный рак, рак предстательной железы, рак молочной железы, немелкоклеточная карцинома легкого,рак щитовидной железы, T- или B-клеточные лейкозы и некоторые индуцированные вирусами опухоли. Например, было показано увеличение активной формы GSK3 в опухолях у пациентов с колоректальным раком и ингибирование GSK3 в колоректальных раковых клетках активирует p53-зависимый апоптоз и антагонизирует (подавляет) рост опухоли. Ингибирование GSK3 также усиливает TRAIL-индуцированный апоптоз в клеточных линиях рака предстательной железы. GSK3 также играет определенную роль в динамике митотического веретена, и ингибиторы GSK3 препятствуют движению хромосом и приводят к стабилизации микротрубочек и прометафаза-подобной остановке подобно тому, что наблюдают при низких дозах таксола. Другие возможные применения для ингибиторов GSK3 включают терапевтическое лечение инсулиннезависимого диабета (такого как диабет типа II), ожирения и алопеции. Полученные в последнее время данные генетики человека и исследований животных указывают на роль пути Wnt/LPR5 как основного регулятора приращения костной массы. Ингибирование GSK3 приводит в результате к активации канонического Wnt сигнала. Поскольку недостаточная сигнальная активность Wnt причастна к расстройствам снижения костной массы, ингибиторы GSK3 также можно использовать для лечения расстройств снижения костной массы, костных патологий, остеопороза. Ингибиторы GSK3 человека могут также ингибировать pfGSK3, ортолог этого фермента, обнаруженный в Plasmodium falciparum, а следовательно, их можно использовать для лечения малярии (Biochimica et Biophysica Acta, 1697, 181-196, 2004). В соответствии с полученными в последнее время данными ингибиторы GSK3 можно было бы использовать для лечения или профилактики Pemphigus vulgaris. Проведенные недавно исследования показали, что лечение ингибитором GSK3 улучшало восстановление нейтрофилов и мегакариоцитов. Поэтому ингибиторы GSK3 должны быть полезными для лечения нейтропении, вызванной химиотерапией рака. Раскрытие изобретения Целью настоящего изобретения является обеспечение соединений, полезных в качестве активного ингредиента лекарственного средства для профилактического и/или терапевтического лечения заболевания, вызванного аномальной активностью GSK3, более конкретно нейродегенеративных заболеваний. Более конкретно целью является обеспечение новых соединений, полезных в качестве активного ингредиента лекарственного средства, которое делает возможным профилактику и/или лечение нейродегенеративных заболеваний, таких как болезнь Альцгеймера. Таким образом, авторами настоящего изобретения были идентифицированы соединения, обладающие ингибиторной активностью против GSK3. Как результат, было обнаружено, что соединения, представленные приведенной ниже формулой (I), обладают желаемой активностью и являются полезными в качестве активного ингредиента лекарственного средства для профилактического и/или терапевтического лечения указанных выше заболеваний. Настоящее изобретение, таким образом, обеспечивает в качестве объекта изобретения пиримидоновые производные, представленные формулой (I), или их соли, их сольваты или их гидраты где Y представляет собой два атома водорода, атом серы, атом кислорода или C1-2 алкильную группу и атом водорода;Z представляет собой связь, атом кислорода, атом азота, замещенный атомом водорода или C1-3 алкильной группой, атом серы, метиленовую группу, необязательно замещенную одной или двумя группами, выбранными из C1-6 алкильной группы, гидроксильной группы, C1-6 алкоксигруппы, C1-2 пергалогенированной алкильной группы или аминогруппы;R1 представляет собой 2, 3 или 4-пиридиновое кольцо или 2, 4 или 5-пиримидиновое кольцо, при этом указанное кольцо необязательно замещено C1-6 алкильной группой, C1-6 алкоксигруппой или атомом галогена;R2 представляет собой бензольное кольцо или нафталиновое кольцо; при этом указанные кольца необязательно замещены 1-4 заместителями, выбранными из C1-6 алкильной группы, C3-7 циклоалкильной группы, C3-7 циклоалкил-C1-6 алкильной группы, атома галогена, C1-2 пергалогенированной алкильной группы, C1-3 галогенированной алкильной группы, гидроксильной группы, C1-6 алкоксигруппы, не-2 014918 обязательно замещенной С 3-5 циклоалкильной группой, C1-2 пергалогенированной алкоксигруппы, C1-6 алкилсульфонильной группы, нитро, циано, амино, C1-6 моноалкиламиногруппы или C2-12 диалкиламиногруппы, ацетоксигруппы или аминосульфонильной группы;R3 представляет собой атом водорода, C1-6 алкильную группу или атом галогена;R4 представляет собой атом водорода или C1-6 алкильную группу;R5 представляет собой атом водорода, C1-6 алкильную группу, необязательно замещенную 1-4 заместителями, выбранными из атома галогена, фенильной группы, гидроксильной группы или C1-6 алкоксигруппы;R6 представляет собой атом водорода, C1-6 алкильную группу или атом галогена;R7 представляет собой атом водорода или C1-6 алкильную группу иn имеет значение от 0 до 3;m имеет значение от 0 до 1;o имеет значение от 0 до 2. В соответствии с другим аспектом настоящего изобретения обеспечивается лекарственное средство,включающее в качестве активного ингредиента вещество, выбранное из группы, включающей пиримидоновые производные, представленные формулой (I), и их физиологически приемлемые соли, и их сольваты, и их гидраты. В качестве предпочтительных вариантов воплощения лекарственного средства обеспечиваются указанное выше лекарственное средство, которое используют для профилактического и/или терапевтического лечения заболеваний, вызванных аномальной активностью GSK3, и указанное выше лекарственное средство, которое используют для профилактического и/или терапевтического лечения нейродегенеративных заболеваний и, кроме того, других заболеваний, таких как инсулиннезависимый диабет (такой как диабет типа II) и ожирение; малярия, биполярные расстройства (маниакальнодепрессивное расстройство); шизофрения; алопеция или рак, такой как колоректальный рак, рак предстательной железы, рак молочной железы, немелкоклеточная карцинома легкого, рак щитовидной железы,T- или B-клеточные лейкозы и некоторые индуцированные вирусами опухоли, и костные патологии. Такое лекарственное средство могло бы найти применение в восстановительной медицине. В качестве следующих вариантов воплощения настоящего изобретения обеспечиваются указанное выше лекарственное средство, где заболевания представляют собой нейродегенеративные заболевания и выбраны из группы, включающей болезнь Альцгеймера, болезнь Паркинсона, таупатии (например,фронтотемпоральные деменции, кортикобазальную дегенерацию, болезнь Пика, прогрессивный супрануклеартный паралич), гепатоцеребральную дистрофию, болезнь Гентингтона, болезнь Приона и другие деменции, включая сосудистые деменции; острый инсульт и другие травматические поражения; цереброваскулярные нарушения (например, возрастная дегенерация желтого пятна); травмы головного и спинного мозга; амиотрофический боковой склероз, периферические невропатии; ретинопатии и глаукому, и указанное выше лекарственное средство в форме фармацевтической композиции, содержащей указанное выше вещество в качестве активного ингредиента вместе с одной или несколькими фармацевтическими добавками. В качестве следующих вариантов воплощения настоящего изобретения обеспечивается указанное выше лекарственное средство, где костные патологии представляют собой остеопороз. Настоящее изобретение, кроме того, обеспечивает ингибитор активности GSK3, включающий в качестве активного ингредиента вещество, выбранное из группы, включающей пиримидоновые производные формулы (I), и их соли, и их сольваты, и их гидраты. В соответствии со следующими аспектами настоящего изобретения обеспечивается способ для профилактического и/или терапевтического лечения нейродегенеративных заболеваний, вызванных аномальной активностью GSK3, который включает стадию введения пациенту профилактически и/или терапевтически эффективного количества вещества, выбранного из группы, включающей пиримидоновые производные формулы (I), и их физиологически приемлемые соли, и их сольваты, и их гидраты; и применение вещества, выбранного из группы, включающей пиримидоновые производные формулы (I), и их физиологически приемлемые соли, и их сольваты, и их гидраты для получения указанного выше лекарственного средства. Как использовано в настоящей заявке, C1-6 алкильная группа представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, например метильную группуC1-6 алкоксигруппа представляет собой алкилоксигруппу, содержащую от 1 до 4 атомов углерода,например метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу и т.п.; атом галогена представляет собой атом фтора, хлора, брома или иода;C1-2 пергалогенированная алкильная группа представляет собой алкильную группу, где все атомы-3 014918 водорода замещены галогеногруппой, например CF3 или C2F5-,C1-3 галогенированная алкильная группа представляет собой алкильную группу, где по меньшей мере один атом водорода замещен атомом галогена;C1-6 моноалкиламиногруппа представляет собой аминогруппу, замещенную одной C1-6 алкильной группой, например метиламиногруппу, этиламиногруппу, пропиламиногруппу, изопропиламиногруппу,бутиламиногруппу, изобутиламиногруппу, трет-бутиламиногруппу, пентиламиногруппу, изопентиламиногруппу и т.п.;C2-12 диалкиламиногруппа представляет собой аминогруппу, замещенную двумя C1-6 алкильными группами, например диметиламиногруппу, этилметиламиногруппу, диэтиламиногруппу, метилпропиламиногруппу и диизопропиламиногруппу и т.п. Удаляемая группа L представляет собой группу, которая может легко отщепляться и замещаться,такая группа, например, может представлять собой тозил, мезил, бромид и т.п. Соединения, представленные указанной выше формулой (I), могут образовывать соль. Когда присутствует кислотная группа, примеры соли включают соли щелочных металлов и щелочно-земельных металлов, такие как соли лития, натрия, калия, магния и кальция; соли аммиака и соли аминов, такие как метиламин, диметиламин, триметиламин, дициклогексиламин, трис-(гидроксиметил)аминометан, N,Nбис-(гидроксиэтил)пиперазин, 2-амино-2-метил-1-пропанол, этаноламин, N-метилглюкамин и L-глюкамин; или соли с основными аминокислотами, такими как лизин, -гидроксилизин и аргинин. Основноаддитивные соли кислотных соединений получают с использованием стандартных процедур, хорошо известных из уровня техники. Когда присутствует основная группа, примеры включают соли с минеральными кислотами, такими как хлористо-водородная кислота, бромисто-водородная кислота; соли с органическими кислотами, такими как уксусная кислота, пропионовая кислота, винная кислота, фумаровая кислота, малеиновая кислота, яблочная кислота, щавелевая кислота, янтарная кислота, лимонная кислота, бензойная кислота и т.п. Кислотно-аддитивные соли основных соединений получают с использованием стандартных процедур, хорошо известных из уровня техники, которые включают, но не ограничиваются этим, растворение свободного основания в водно-спиртовом растворе, содержащем соответствующую кислоту, и выделение соли путем упаривания раствора или взаимодействие свободного основания и кислоты в органическом растворителе, в этом случае соль выделяется непосредственно, или ее осаждают при помощи второго органического растворителя, или ее можно получить концентрированием раствора. Кислоты, которые можно использовать для получения кислотно-аддитивных солей, предпочтительно включают такие кислоты, которые при объединении со свободным основанием дают фармацевтически приемлемые соли,т.е. соли, анионы которых являются относительно безвредными для организма животного в фармацевтических дозах таких солей, при этом не нанося ущерба благоприятным свойствам, присущим свободному основанию, за счет побочных эффектов, которые могут вызывать такие анионы. Хотя приемлемые для медицины соли основных соединений являются предпочтительными, все кислотно-аддитивные соли включены в объем настоящего изобретения. Помимо пиримидоновых производных, представленных указанной выше формулой (I), и их солей,их сольваты и гидраты также входят в объем настоящего изобретения. Пиримидоновые производные, представленные указанной выше формулой (I), могут содержать один или несколько асимметрических атомов углерода. Что касается стереохимии таких асимметрических атомов углерода, они могут независимо находиться как в (R)-, так и в (S)-конфигурации, и производные могут существовать в виде стереоизомеров, таких как оптические изомеры или диастереоизомеры. Любые стереоизомеры в чистой форме, любые смеси стереоизомеров, рацематы и т.п. входят в объем настоящего изобретения. Примеры соединений по настоящему изобретению представлены в табл. 1 ниже. Однако объем настоящего изобретения не ограничивается этими соединениями. Объект настоящего изобретения включает также соединения, представленные формулой (I), где m,n, o определены выше, и:(1) R1 представляет собой 3- или 4-пиридиновое кольцо, альтернативно 4- или 5-пиримидиновое кольцо; при этом указанное кольцо необязательно замещено C1-2 алкильной группой, C1-2 алкоксигруппой или атомом галогена; и/или(2) R2 представляет собой бензольное кольцо или нафталиновое кольцо; где указанные кольца, необязательно, замещены 1-4 заместителями, выбранными из C1-3 алкильной группы, С 3-5 циклоалкильной группы, C3-5 циклоалкил-C1-4 алкильной группы, атома галогена, C1-2 пергалогенированной алкильной группы, гидроксильной группы, C1-3 алкоксигруппы, необязательно замещенной C3-5 циклоалкильной группой, C1-2 пергалогенированной алкоксигруппы, C1-6 алкилсульфонильной группы, нитро, циано,амино, C1-3 моноалкиламиногруппы или C2-6 диалкиламиногруппы; и/или(3) R3 представляет собой атом водорода, C1-3 алкильную группу или атом галогена;(4) R4 представляет собой атом водорода или C1-3 алкильную группу; и/или(5) R5 представляет собой атом водорода, C1-3 алкоксикарбонильную группу или C1-3 алкильную-4 014918 группу, необязательно замещенную 1-4 заместителями, выбранными из атома галогена, фенильной группы, гидроксильной группы или C1-3 алкоксигруппы; и/или(6) R6 представляет собой атом водорода, C1-3 алкильную группу или атом галогена; и/или(7) R7 представляет собой атом водорода или C1-3 алкильную группу; и/или(8) Y представляет собой два атома водорода, атом кислорода или C1-2 алкильную группу и атом водорода; и/или(9) Z представляет собой связь, атом кислорода, атом азота, замещенный атомом водорода или C1-3 алкильной группой, метиленовую группу, необязательно замещенную одной или двумя группами, выбранными из C1-3 алкильной группы, гидроксильной группы, C1-3 алкоксигруппы, C1-2 пергалогенированной алкильной группы или аминогруппы; и/или(10) n имеет значение от 0 до 3;(11) m имеет значение от 0 до 1; o имеет значение от 1 до 2; и, более конкретно, где R1, R2, R3, R4,R5, R6, R7, m, n, o, Y и Z определены выше. Следующий объект настоящего изобретения включает соединения, представленные формулой (I),где m, n и o определены выше и:(1) R1 представляет собой незамещенное 4-пиридиновое кольцо или 4-пиримидиновое кольцо; и/или(2) R2 представляет собой бензольное кольцо или нафталин; при этом указанное кольцо необязательно замещено 1-4 заместителями, выбранными из C1-3 алкильной группы, C1-2 пергалогенированной алкильной группы, C3-4 циклоалкильной группы, C3-4 циклоалкил-C1-3 алкильной группы, атома галогена,гидроксильной группы, нитро, циано, амино, C1-3 алкоксигруппы, необязательно замещенной C3-4 циклоалкильной группой, C1-2 пергалогенированной алкоксигруппы или C1-3 алкилсульфонильной группы; и/или(3) R3 представляет собой атом водорода или атом галогена; и/или(4) R4 представляет собой атом водорода; и/или(5) R5 представляет собой атом водорода; и/или(6) R6 представляет собой атом водорода, C1-6 алкильную группу;(7) R7 представляет собой атом водорода; и/или(8) Y представляет собой два атома водорода или атом кислорода; и/или(10) n имеет значение от 0 до 1; и/или(11) m имеет значение от 0 до 1, o имеет значение от 1 до 2 и, более конкретно, где R1, R2, R3, R4,R5, R6, R7, m, n, o, Y и Z определены выше. Следующий объект настоящего изобретения включает группу соединений табл. 1 формулы, представленной ниже: 1) (+/-) N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид; 2) (+/-) 2-метокси-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9 ил)бензамид; 3) (+/-) N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-2-фенилацетамид; 4) (+/-) фенил(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4 Н-пиридо[1,2-а]пиримидин-9-ил)карбамат; 5) (+/-) N-(4-фторфенил)-N1-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)мочевина; 6)-6 014918 46) (+/-) 2-гидрокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9 ил)бензамид; 47) (+/-) 4-хлор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-9-ил)бензамид; 48) (+) 4-хлор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-9-ил)бензамид; 49) (-) 4-хлор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4 Н-пиридо[1,2 а]пиримидин-9-ил)бензамид; 50) (+/-) 4-хлор-2-метокси-N-метил-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-9-ил)бензамид; 51) (+) 4-фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид; 52) (-) 4-фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид; 53) (+/-) 5-хлор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-9-ил)бензамид; 54) (+/-) 4-фтор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-9-ил)бензамид; 55) (+/-) 4-амино-5-хлор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4Hпиридо[1,2-а]пиримидин-9-ил)бензамид; 56) (+/-) 2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-4-трифторметил-бензамид; 57) (+/-) 2-фтор-6-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-9-ил)бензамид; 58) (+/-) 2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид; 59) (+/-) 5-бром-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-9-ил)бензамид; 60) (+/-) 4-диметиламино-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4Hпиридо[1,2-а]пиримидин-9-ил)бензамид; 61) (+/-) 2,4-диметокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-9-ил)бензамид. Следующий объект настоящего изобретения включает группу соединений табл. 2 формулы, представленной ниже: 1) (+/-) 4-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин 8-ил)бензамид; 2) (+/-) 4-фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин 8-ил)бензамид; 3) (+/-) 4-амино-5-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8-тетрагидропирроло[1,2 а]пиримидин-8-ил)бензамид; 4) (+/-) 5-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин 8-ил)бензамид; 5) (+/-) 4-хлор-2-метокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин-8 ил)бензамид; 6) (+/-) 4-фтор-2-метокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин-8 ил)бензамид. Следующий объект настоящего изобретения включает группу соединений табл. 3 формулы, представленной ниже: 1) (+/-) 4-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид; 2) (+/-) 4-фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид; 3) (+/-) 5-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид; 4) (+/-) 4-амино-5-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид; 5) (+/-) 4-амино-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид; 6) (+/-) 2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10 ил)бензамид; 7) (+/-) 5-(аминосульфонил)-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид;(+/-) 2-[(4-оксо-2-пиридин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)амино]карбонилфенилацетат; 24) (+/-) 2,4-диметокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10 ил)бензамид; 25) (+) 4-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид; 26) (-) 4-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид. Следующий объект настоящего изобретения относится также к способам получения пиримидоновых соединений, представленных указанной выше формулой (I). Эти соединения можно получить, например, в соответствии со способами, описанными ниже. Способ получения Пиримидоновые соединения, представленные указанной выше формулой (I), можно получить в соответствии со способом, описанным на схеме 1. Схема 1 На представленной выше схеме определения R1, R2, R3, R4, R5, R6, R7, m, n, o, Y и Z указаны выше для соединения формулы (I). Следуя этому способу, пиримидоновое производное, представленное формулой (III) выше, где R1,R3, R4, R5, R6, R7, m и o определены для соединения формулы (I), подвергают взаимодействию с осно-8 014918 ванием, таким как триэтиламин, карбонат натрия или карбонат калия, в растворителе, таком как тетрагидрофуран, N-метилпирролидон, N,N-диметилацетамид или хлороформ, при подходящей температуре в пределах от 0 до 130 С в обычной воздушной атмосфере, затем с соединением формулы (II), где R2, Z, Y и n определены для соединения формулы (I) и L представляет собой удаляемую группу, предпочтительно группу хлора, бромидную или мезильную группу, с получением соединения указанной выше формулы(I). Альтернативно, соединения формулы (I), где Y представляет собой два атома водорода, можно получить путем восстановительного аминирования соединения формулы (II), где Y представляет собой атом кислорода и L представляет собой атом водорода, при помощи соединения формулы (III), где R1,R3, R4, R5, R6, m и о определены для соединения формулы (I) и R7 представляет собой водород, в соответствии со способами, хорошо известными специалистам в данной области. Соединение формулы (II) является коммерчески доступным, или его можно синтезировать в соответствии со способами, хорошо известными специалистам в данной области. Соединение формулы (III) можно получить в соответствии со способом, представленным на схеме 2. Схема 2 На представленной выше схеме определения R1, R2, R3, R4, R5, R6, m и o указаны выше. В соответствии с этим способом 3-кетоэфир формулы (IV), где R1 и R3 определены для соединения формулы (I), R представляет собой алкильную группу, такую как, например, метил или этил, подвергают взаимодействию с соединением формулы (V), где R4, R5, R6, m и o определены для соединения формулы(I) и Pg представляет собой подходящую защитную группу, такую как, например, фталимидогруппа. Реакцию можно осуществить в присутствии основания, такого как карбонат калия, в спиртовом растворителе, таком как метанол, этанол и т.п., или без растворителя при подходящей температуре в пределах от 25 до 140C в обычной воздушной атмосфере. Кроме того, соединение формулы (III), где R3 представляет собой атом водорода, можно подвергнуть галогенированию для получения соединений формулы (III), где R3 представляет собой атом галогена, такой как атом брома или атом хлора. Реакцию можно осуществить в кислотной среде, такой как уксусная кислота или пропионовая кислота, в присутствии бромсукцинимида, или хлорсукцинимида, или брома. Кроме того, соединения формулы (IV), где R3 представляет собой атом фтора, можно получить способом, аналогичным описанному в Tetrahedron Letters, vol. 30, No.45, p. 6113-6116, 1989. Кроме того, соединения формулы (IV), где R3 представляет собой атом водорода, можно получить способом, аналогичным описанному в патенте DE 2705582. В качестве следующего объекта настоящее изобретение относится также к соединениям формулы(III) в качестве промежуточных соединений для соединений формулы (I). Соединение формулы (IV) является коммерчески доступным, или его можно синтезировать в соответствии со способами, хорошо известными специалистам в данной области. Например, соединения формулы (IV), где R1 представляет собой пиридиновое кольцо или пиримидиновое кольцо, необязательно замещенное C1-6 алкильной группой, C1-6 алкоксигруппой или атомом галогена, можно получить путем взаимодействия, соответственно, изоникотиновой кислоты или пиримидинкарбоновой кислоты, необязательно замещенной C1-6 алкильной группой, C1-6 алкоксигруппой или галогеном, с соответствующим моноэфиром малоновой кислоты. Реакцию можно осуществить с использованием способов, хорошо известных специалистам в данной области, например в присутствии агента сочетания, такого как 1,1'-карбонил-бис-1H-имидазол, в растворителе, таком как тетрагидрофуран, при температуре в пределах от 20 до 70C. Соединение формулы (V) можно синтезировать в соответствии со способами, хорошо известными специалистам в данной области. Например, соединение формулы (V), где m, o, R4, R5 и R6 определены для соединения формулы (I),а подходящую защитную группу Pg, такую как, например, фталимидогруппа, можно получить в соответствии со способом, представленным на схеме 3, исходя из соединения формулы (VI). Условия, которые можно использовать, указаны в химических примерах.Chemie (1987), (7), 647-8. Archiv der Pharmazie (Weinheim, Germany) (1989), 322(8), 499-505. Соединение формулы (VII) и формулы (V) можно синтезировать в соответствии со способом, описанным в WO 96/14844. В указанных выше реакциях иногда возникает необходимость в защите и удалении защиты функциональной группы. Подходящую защитную группу Pg можно выбрать в зависимости от функциональной группы, и можно использовать способ, описанный в литературе. Примеры защитных групп, способов введения и удаления защиты представлены, например, в Protective Groups in Organic Synthesis Greene etal., 3 rd Ed. (John WileySons, Inc., New York) 1999. Соединения по настоящему изобретению обладают ингибиторной активностью против GSK3. Следовательно, соединения по настоящему изобретению являются полезными в качестве активного ингредиента для получения лекарственного средства, которое делает возможным профилактическое и/или терапевтическое лечение заболевания, вызванного аномальной активностью GSK3, и, более конкретно,нейродегенеративных заболеваний, так как болезнь Альцгеймера. Кроме того, соединения по настоящему изобретению также являются полезными в качестве активного ингредиента для получения лекарственного средства для профилактического и/или терапевтического лечения нейродегенеративных заболеваний, таких как болезнь Паркинсона, таупатии (например, фронтотемпоральные деменции, кортикобазальная дегенерация, болезнь Пика, прогрессивный супрануклеартный паралич), гепатоцеребральная дистрофия, болезнь Гентингтона, болезнь Приона и другие деменции, включая сосудистые деменции; острый инсульт и другие травматические поражения; цереброваскулярные нарушения (например, возрастная дегенерация желтого пятна); травмы головного и спинного мозга; амиотрофический боковой склероз, периферические невропатии; ретинопатии и глаукома; и других заболеваний, таких как инсулиннезависимый диабет (такой как диабет типа II) и ожирение; малярии, маниакально-депрессивного расстройства; шизофрении; алопеции; рака, такого как колоректальный рак, рак предстательной железы,рак молочной железы, немелкоклеточная карцинома легкого, рак щитовидной железы, T- или Bклеточные лейкозы, некоторые индуцированные вирусами опухоли, и при костных патологиях. Такое лекарственное средство могло бы найти применение в восстановительной медицине. Настоящее изобретение также относится к способу лечения нейродегенеративных заболеваний, вызванных аномальной активностью GSK3, и указанных выше заболеваний, который включает введение млекопитающему, нуждающемуся в этом, эффективного количества соединения формулы (I). В качестве активного ингредиента лекарственного средства по настоящему изобретению можно использовать вещество, которое выбирают из группы, включающей соединение, представленное указанной выше формулой (I), и его фармакологически приемлемые соли, его сольваты и его гидраты. Такое вещество можно вводить per se в качестве лекарственного средства по настоящему изобретению, однако желательно введение лекарственного средства в форме фармацевтической композиции, которая включает указанное выше вещество в качестве активного ингредиента и одну или несколько фармацевтических добавок. В качестве активного ингредиента лекарственного средства по настоящему изобретению можно использовать два или более из указанных выше веществ в сочетании. Указанную выше фармацевтическую композицию можно дополнить активным ингредиентом, представляющим собой другое лекарственное средство для лечения указанных выше заболеваний. Тип фармацевтической композиции конкретно не ограничен, и композиция может быть представлена в виде любой композиции для перорального или парентерального введения. Например, фармацевтическую композицию можно сформулировать в форме фармацевтических композиций для перорального введения, таких как гранулы, мелкие гранулы,порошки, твердые капсулы, мягкие капсулы, сиропы, эмульсии, суспензии, растворы и т.п., или в форме фармацевтических композиций для парентерального введения, таких как инъекции для внутривенного,внутримышечного или подкожного введения, инфузии для введения капельным путем, препараты для чрескожного введения, препараты для введения через слизистую, назальные капли, ингалянты, суппозитории и т.п. Инъекции или инфузии для введения капельным путем можно получить в виде порошковых препаратов, например в форме лиофилизированных препаратов, и их можно использовать путем растворения непосредственно перед применением в соответствующей водной среде, такой как физиологический раствор. Препараты с замедленным высвобождением, например препараты с полимерным покрытием, можно вводить непосредственно интрацеребральным путем.- 10014918 Типы фармацевтических добавок, используемых для получения фармацевтической композиции, содержание фармацевтических добавок относительно активного ингредиента и способы получения фармацевтической композиции может соответствующим образом выбрать специалист в данной области. В качестве фармацевтических добавок можно использовать неорганические или органические вещества или твердые или жидкие вещества. Как правило, фармацевтические добавки можно вводить в пропорции в пределах от 1 до 90 мас.% в расчете на массу активного ингредиента. Примеры эксципиентов, используемых для получения твердых фармацевтических композиций,включают, например, лактозу, сахарозу, крахмал, тальк, целлюлозу, декстрин, каолин, карбонат кальция и т.п. Для получения жидких композиций для перорального введения можно использовать традиционный инертный разбавитель, такой как вода или растительное масло. В дополнение к инертному разбавителю жидкая композиция может содержать вспомогательные добавки, такие как смачивающие вещества, вещества, способствующие суспендированию, подсластители, ароматизаторы, красители и консерванты. Жидкую композицию можно использовать для заполнения капсул, полученных из абсорбируемого материала, такого как желатин. Примеры растворителей или сред для суспендирования, используемых для получения композиций для парентерального введения, например инъекций, суппозиториев, включают воду, пропиленгликоль, полиэтиленгликоль, бензиловый спирт, этилолеат, лецитин и т.п. Примеры материалов основы, используемых для суппозиториев, включают, например, масло какао, эмульгированное масло какао, лауриловый липид, witepsol. Доза и частота введения лекарственного средства по настоящему изобретению конкретно не ограничены, и их соответствующим образом можно выбрать в зависимости от условий, таких как назначение профилактического и/или терапевтического лечения, тип заболевания, масса тела или возраст пациента,тяжесть заболевания и т.п. Как правило, суточная доза для перорального введения взрослому находится в пределах от 0,01 до 1,000 мг (масса активного ингредиента), и такую дозу можно вводить раз в день или несколько раз в день раздельными порциями или раз в несколько дней. Когда лекарственное средство используют в качестве инъекции, введение предпочтительно можно осуществлять непрерывным прерывистым способом при суточной дозе от 0,001 до 100 мг (масса активного ингредиента) для взрослого пациента. Химические примеры Пример 1. (+/-) 2-Метокси-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамид (соединение 2 табл. 1). 1.1. (+/-) 2-(2-Метокси-3,4,5,6-тетрагидропиридин-3-ил)-1H-изоиндол-1,3(2H)-дион. К раствору 13,474 г (91,1 ммоль) тетрафторбората триметилоксония в 294 мл безводного дихлорметана добавляли 22,25 г (91,1 ммоль) (+/-)-3-фталимидопиперидин-2-она (Heterocycles (1996), 42(2), 53742, Enantiomer (2001), 6(5), 275-279, Synthesis (1991), (5), 417-20) и полученную смесь перемешивали при комнатной температуре в течение 12 ч. Смесь гидролизовали при помощи насыщенного водного раствора гидрокарбоната натрия, экстрагировали дихлорметаном, сушили над сульфатом натрия и растворитель выпаривали с получением 23,22 г (99%) чистого продукта в виде желтого масла. Соединение использовали как таковое на следующей стадии. ЯМР 1H (CDCl3; 200 МГц)(м.д.): 7,92-7,66 (м, 4 Н); 4,87-4,69 (м, 1H); 3,74-3,60 (м, 2H); 3,56 (с,3H); 2,40-1,62 (м, 4 Н). 1.2. (+/-) 2-(2-Амино-3,4,5,6-тетрагидропиридин-3-ил)-1H-изоиндол-1,3(2H)-дион, гидрохлорид(1:1). К раствору 23,224 г (89,92 ммоль) (+/-) 2-(2-метокси-3,4,5,6-тетрагидропиридин-3-ил)-1H-изоиндол 1,3(2H)-диона, растворенного в 409 мл метанола, добавляли при комнатной температуре 4,81 г(89,92 ммоль) хлорида аммония. Полученную смесь перемешивали при температуре кипения с обратным холодильником в течение 12 ч. Охлажденный раствор упаривали для удаления растворителя. Остаток растирали в порошок с диэтиловым эфиром и фильтровали с получением 23,8 г (95%) чистого продукта в виде белого порошка. Т.пл.: 242-244 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 8,92 (ушир. с, 2H); 8,02-7,85 (м, 4H); 5,28 (т, 1H); 3,58-3,12 (м,2H); 2,15-1,78 (м, 4H). 1.3.(+/-) 2-(4-Оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-1Hизоиндол-1,3(2H)-дион. К суспензии 9,166 г (32,17 ммоль) гидрохлорида (+/-) 2-(2-амино-3,4,5,6-тетрагидропиридин-3-ил)1H-изоиндол-1,3(2H)-диона (1:1) в 50 мл толуола добавляли метанолят натрия (свежеполученный из 0,754 г (32,77 ммоль) натрия в 10 мл метанола) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь упаривали досуха, растворяли в 50 мл толуола и добавляли 4,87 г(25,21 ммоль) этил 3-(пиридин-4-ил)-3-оксопропионата. Полученный раствор перемешивали при температуре кипения с обратным холодильником в течение 12 ч. Охлажденный раствор упаривали для удаления растворителя. Смесь растворяли в дихлорметане, промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и упари- 11014918 вали досуха. Остаток хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол/водный раствор аммиака (29%) в соотношении 97/3/0,3, с получением 3,2 г (34%) желаемого соединения в виде белого порошка. Т.пл.: 211-213 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 8,50 (д, 2H); 8,09-7,78 (м, 4H); 7,60 (д, 2H); 7,08 (с, 1H); 5,605,39 (м, 1H); 4,28-4,06 (м, 1H); 3,88-3,65 (м, 1H); 2,55-2,08 (м, 4H). 1.4. (+/-) 9-Амино-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-4-он. К раствору 3,2 г (8,59 ммоль) (+/-) 2-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-9-ил)-1H-изоиндол-1,3(2H)-диона, растворенного в 24 мл этанола, добавляли 2,09 мл(43 ммоль) гидразингидрата и полученную смесь перемешивали при температуре кипения с обратным холодильником в течение 2 ч. Смесь фильтровали и полученное твердое вещество растирали в порошок с дихлорметаном в течение 24 ч, фильтровали и полученные фильтраты упаривали досуха. Полученный остаток очищали на силикагеле, элюируя смесью дихлорметан/метанол в соотношении от 98/2 до 96/4, с получением 1,37 г (66%) желаемого соединения в виде коричневого порошка. Т.пл.: 144-146 С. ЯМР 1H (CDCl3; 200 МГц)(м.д.): 8,77 (д, 2H); 7,85 (д, 2H); 6,89 (с, 1 Н); 4,26-3,91 (м, 3H); 2,48-1,61(м, 6H). 1.5. (+/-) 2-Метокси-N-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9 ил)бензамид. К раствору 0,080 г (0,33 ммоль) (+/-) 9-амино-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-4-она, растворенного в 2,2 мл тетрагидрофурана, добавляли 60 мкл (0,40 ммоль) триэтиламина и 50 мкл (0,40 ммоль) 2-метоксибензоилхлорида. Полученную смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли воду и смесь экстрагировали дихлорметаном. Экстракты промывали насыщенным водным раствором хлорида аммония, сушили и упаривали. Остаток растирали в порошок с диэтиловым эфиром и фильтровали с получением 0,105 г (84%) чистого продукта в виде желтого порошка. Т.пл.: 155-157 С. ЯМР 1H (CDCl3; 200 МГц)(м.д.): 9,26 (ушир. с, 1 Н); 8,76 (д, 2H); 8,30 (д, 1H); 7,88 (д, 2H); 7,52 (т,1H); 7,22-7,03 (м, 2H); 6,92 (с, 1H); 5,26-5,08 (м, 1H); 4,55 (дт, 1H); 3,93 (с, 3H); 3,92-3,71 (м, 1H); 3,082,85 (м, 1H); 2,38-1,94 (м, 2H); 1,78-1,53 (м, 1 Н). Пример 2. (+/-) 9-[(2-Метоксибензил)амино]-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-4-он, гидрохлорид (2:1) (соединение 7 табл. 1). К раствору 0,080 г (0,33 ммоль) (+/-) 9-амино-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-4-она в 2 мл толуола добавляли 0,045 г (0,33 ммоль) 2-метоксибензальдегида и полученный раствор кипятили с обратным холодильником в течение 3 ч в аппарате Дина-Старка. Полученную смесь сушили над сульфатом натрия, фильтровали и упаривали. Остаток растворяли в 2 мл метанола, рН доводили до 6 при помощи уксусной кислоты и добавляли 0,042 г (0,66 ммоль) цианоборогидрида натрия. Полученную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали, остаток растворяли в дихлорметане, промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и упаривали. Основание преобразовывали в его гидрохлоридную соль с получением 0,081 г чистого продукта. Т.пл.: 230-232 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,76 (ушир. с, 1H); 8,90 (д, 2H); 8,50 (д, 2H); 7,60-7,29 (м, 2H); 7,38 (с, 1H); 7,13-6,88 (м, 2H); 4,70-4,49 (м, 1 Н); 4,36 (дд, 2H); 4,06-3,65 (м, 2H); 3,72 (с, 3H); 2,70-1,87 (м,4H). Пример 3. (+/-) N-(4-Оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-N'фенилмочевина (соединение 6 табл. 1). К раствору 0,07 г (0,29 ммоль) (+/-) 9-амино-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-4-она, растворенного в 1 мл дихлорметана при 10C добавляли 0,034 г (0,29 ммоль) фенилизоцианата, растворенного в 1 мл при 10 С. Полученную смесь перемешивали при 10 С в течение 30 мин. Смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали и остаток хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол/водный раствор аммиака (29%) в соотношении 90/10/1. Остаток растирали в порошок с диэтиловым эфиром и фильтровали с получением 0,088 г (84%) чистого продукта в виде коричневого порошка. Т.пл.: 254-256 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 8,90 (ушир. с, 1H); 8,61 (д, 2H); 8,03 (д, 2H); 7,43 (д, 2H); 7,27(т, 2H); 7,11 (с, 1H); 6,92 (т, 1H); 6,72 (ушир. с, 1H); 4,95-4,78 (м, 1 Н); 4,17-3,73 (м, 2H); 2,39-2,18 (м, 1 Н); 2,13-1,60 (м, 3H). Пример 4. (+/-) Фенил(4-оксо-2-пиридин-4-ил-6,7,8,9-теотрагидро-4H-пиридо[1,2-а]пиримидин-9- 12014918 ил)карбамат (соединение 4 табл. 1). К раствору 0,07 г (0,29 ммоль) (+/-) 9-амино-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-4-она, растворенного в 4 мл тетрагидрофурана при 0C добавляли 29,2 мкл (0,29 ммоль) триэтиламина и 50 мкл (0,32 ммоль) фенилхлороформиата. Полученную смесь перемешивали при 0 С в течение 45 мин и нагревали при комнатной температуре в течение 16 ч. Добавляли насыщенный водный раствор хлорида аммония и реакционную смесь экстрагировали этилацетатом. Экстракты сушили и упаривали. Остаток растирали в порошок с диэтиловым эфиром и фильтровали с получением 0,068 г (65%) чистого продукта в виде белого порошка. Т.пл.: 193-195 С. ЯМР 1H (CDCl3; 200 МГц)(м.д.): 8,72 (д, 2H); 8,22 (ущир. с, 1H); 8,04 (д, 2H); 7,50-7,35 (м, 2H); 7,30-7,08 (м, 3H); 7,12 (с, 1H); 4,89-4,70 (м, 1H); 3,92 (т, 2H); 2,35-1,80 (м, 4 Н). Пример 5.(+/-) 2-Метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-9-ил)бензамид (соединение 14 табл. 1). 5.1. (+/-) 2-(4-Оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4 Н-пиридо[1,2-а]пиримидин-9-ил)-1Hизоиндол-1,3(2H)-дион. По аналогии со способом, описанным в примере 1 (стадия 1.3), с использованием этил 3-(4 пиримидинил)-3-оксопропионата (полученного способом, аналогичным описанному в патенте DE 2705582) вместо этил 3-(пиридин-4-ил)-3-оксопропионата получали указанное соединение в виде белого порошка. Т.пл.: 279,9-280,9 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,21 (с, 1H); 8,75 (д, 1H); 8,01-7,81 (м, 4 Н); 7,52 (д, 1 Н); 7,19(с, 1H); 5,58-5,40 (м, 1H); 4,26-4,09 (м, 1H); 3,89-3,68 (м, 1H); 2,48-2,02 (м, 4 Н). 5.2. (+/-) 9-Амино-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-4-он. По аналогии со способом, описанным в примере 1 (стадия 1.4), с использованием (+/-) 2-(4-оксо-2 пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-1H-изоиндол-1,3(2H)-диона вместо (+/-) 2-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-1H-изоиндол 1,3(2H)-диона получали указанное соединение в виде коричневого порошка. Т.пл.: 111-113 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,29 (с, 1H); 8,99 (д, 1 Н); 8,43 (д, 1 Н); 7,18 (с, 1 Н); 4,02-3,75(м, 3H); 2,25 (ушир. с; 2 Н); 2,23-1,75 (м, 3H); 1,74-1,48 (м, 1 Н). 5.3. (+/-) 2-Метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9 ил)бензамид. По аналогии со способом, описанным в примере 1 (стадия 1.5), с использованием (+/-) 9-амино-2 пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-4-она вместо (+/-) 9-амино-2-пиридин 4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-4-она получали указанное соединение в виде белого порошка. Т.пл.: 249-251 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,30 (с, 1 Н); 9,02 (д, 1 Н); 8,96 (ушир. с, 1 Н); 8,18 (д, 1 Н); 7,83(д, 1 Н); 7,58-7,43 (м, 1H); 7,28-7,14 (м, 2H); 7,07 (т, 1H); 5,26-5,08 (м, 1H); 4,11-3,75 (м, 2H); 3,88 (с, 3H); 2,26-2,44 (м, 1 Н); 2,18-1,69 (м, 3H). Пример 6. (-) 4-Хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-9-ил)бензамид (соединение 42 табл. 1). 196 мг (0,476 ммоль) (+/-) 4-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4Hпиридо[1,2-а]пиримидин-9-ил)бензамида (соединение 29 табл. 1) выделяли при помощи хиральной препаративной ВЭЖХ (CHIRALCEL OD-I 20 мкм 35080 мм), элюируя смесью метанол/дихлорметан/диизопропилэтиламин/гептан, с получением 95 мг чистого продукта, полученного в форме свободного основания. Т.пл.: 174-176 С. []D20=-46,9 (с=0,387, DMSO). ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,40 (с, 1 Н); 9,15 (д, 1 Н); 9,05 (д, 1 Н); 8,25 (д, 1H); 7,90 (д,1H); 7,35 (с, 1H); 7,3 (с, 1 Н); 7,15 (д, 1H); 5,20 (м, 1H); 4,11-3,85 (м, 2H); 3,35 (с, 3H); 2,44-1,80 (м, 4H). Пример 7. (+) 4-Хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-9-ил)бензамид (соединение 43 табл. 1). 196 мг (0,476 ммоль) (+/-) 4-хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4Hпиридо[1,2-а]пиримидин-9-ил)бензамида (соединение 29 табл. 1) выделяли при помощи хиральной препаративной ВЭЖХ (CHIRALCEL OD-I 20 мкм 35080 мм), элюируя смесью метанол/дихлорметан/диизопропилэтиламин/гептан, с получением 100 мг чистого продукта, полученного в форме свободного основания. Т.пл.: 175-177 С. []D20=+42,5 (c=0,287, DMSO). ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,40 (с, 1H); 9,15 (д, 1H); 9,05 (д, 1 Н); 8,25 (д, 1H); 7,90 (д,1H); 7,35 (с, 1H); 7,3 (с, 1H); 7,15 (д, 1H); 5,20 (м, 1H); 4,11-3,85 (м, 2H); 3,35 (с, 3H); 2,44-1,80 (м, 4H).- 13014918 Пример 8. (+/-) 4-Хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8-тетрагидропирроло[1,2 а]пиримидин-8-ил)бензамид (соединение 1 табл. 2). 8.1. 2-(2-Метокси-4,5-дигидро-3H-пиррол-3-ил)изоиндол-1,3-дион. По аналогии со способом, описанным в примере 1 (стадия 1.1), с использованием 2-(2-оксопирролидин-3-ил)изоиндол-1,3-диона (полученного способом, аналогичным описанному в Heterocycles(1996), 42(2), 537-42, Enantiomer (2001), 6(5), 275-279, Synthesis (1991), (5), 417-20) вместо 3-фталимидопиперидин-2-она получали указанное соединение в виде белого порошка. Т.пл.: 139-141 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 7,95-7,70 (м, 4 Н); 5,20 (дд, 1 Н); 3,90-3,50 (м, 5H); 2,50-2,10 (м,2H). 8.2. 2-(2-Амино-4,5-дигидро-3H-пиррол-3-ил)изоиндол-1,3-дион гидрохлорид (1:1). По аналогии со способом, описанным в примере 1 (стадия 1.2), с использованием 2-(2-метокси-4,5 дигидро-3H-пиррол-3-ил)изоиндол-1,3-диона вместо 2-(2-метокси-3,4,5,6-тетрагидропиридин-3-ил)-1Hизоиндол-1,3(2H)-диона получали указанное соединение в виде белого порошка. Т.пл.: 121-123 С. ЯМР 1 Н (DMSO-d6; 200 МГц)(м.д.): 9,25-8,80 (ушир. с, 3H); 7,95-7,70 (м, 4 Н); 5,65 (дд, 1 Н); 3,903,50 (м, 2H); 2,50-2,20 (м, 2H). 8.3. 2-(4-Оксо-2-пиримидин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин-8-ил)изоиндол-1,3 дион. По аналогии со способом, описанным в примере 1 (стадия 1.3), с использованием этил 3-(4 пиримидинил)-3-оксопропионата (полученного способом, аналогичным описанному в патенте DE 2705582) вместо этил 3-(пиридин-4-ил)-3-оксопропионата и с использованием 2-(2-амино-4,5-дигидро 3H-пиррол-3-ил)изоиндол-1,3-диона получали указанное соединение в виде белого порошка. Т.пл.: 180-182 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,25 (с, 1H); 8,85 (д, 1 Н); 8,01-7,80 (м, 5H); 7,25 (с, 1 Н); 5,90(дд, 1 Н); 4,40-3,90 (м, 2H); 2,80-2,60 (м, 2H). 8.4. 8-Амино-2-пиримидин-4-ил-7,8-дигидро-6H-пирроло[1,2-а]пиримидин-4-он. По аналогии со способом, описанным в примере 1 (стадия 1.4), с использованием 2-(4-оксо-2 пиримидин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин-8-ил)-изоиндол-1,3-диона вместо (+/-) 2-(4 оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-1H-изоиндол-1,3(2H)-диона получали указанное соединение в виде коричневого порошка. Т.пл.: 187-189 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,40 (с, 1H); 9,10 (д, 1 Н); 8,40 (д, 1 Н); 7,30 (с, 1H); 4,30 (дд,1H); 4,20-3,70 (м, 2H); 2,00-1,70 (м, 2H). 8.5. (+/-) 4-Хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин-8-ил)бензамид. По аналогии со способом, описанным в примере 1 (стадия 1.5), с использованием 8-амино-2 пиримидин-4-ил-7,8-дигидро-6 Н-пирроло[1,2-а]пиримидин-4-она вместо (+/-) 9-амино-2-пиридин-4-ил 6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-4-она получали указанное соединение в виде белого порошка. Т.пл.: 237-239 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,35 (с, 1H); 9,02 (д, 1 Н); 8,96 (ушир. д, 1 Н); 8,20 (д, 1 Н); 7,80(д, 1 Н); 7,35-7,20 (м, 2H); 7,15 (дд, 1 Н); 5,55 (дд, 1 Н); 4,20-3,80 (м, 5H); 2,60-2,20 (м, 2H). Пример 9. (+/-) 4-Фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид (соединение 2 табл. 3). 9.1. 2-(7-Метокси-3,4,5,6-тетрагидро-2 Н-азепин-6-ил)-1H-изоиндол-1,3(2H)-дион. По аналогии со способом, описанным в примере 1 (стадия 1.1), с использованием моногидрохлорида -аминокапролактама (коммерчески доступный) вместо 3-фталимидопиперидин-2-она получали указанное соединение в виде желтого масла. ЯМР 1H CDCl3; 200 МГц)(м.д.): 7,92-7,66 (м, 4 Н); 5,10 (д, 1H); 3,90-3,70 (м, 1H); 3,50 (с, 3H); 3,40-3,30 (м, 1H); 2,70-2,50 (м, 1 Н); 2,1 (м, 1 Н); 1,90-1,20 (м, 4H). 9.2. Гидрохлорид 2-(2-иминоазепан-3-ил)-1H-изоиндол-1,3(2H)-диона (1:1). По аналогии со способом, описанным в примере 1 (стадия 1.2), с использованием 2-(7-метокси 3,4,5,6-тетрагидро-2 Н-азепин-6-ил)-1H-изоиндол-1,3(2H)-диона вместо 2-(2-метокси-3,4,5,6-тетрагидропиридин-3-ил)-1H-изоиндол-1,3(2H)-диона получали указанное соединение в виде белого порошка. Т.пл.: 120-122 С. ЯМР 1 Н (CDCl3; 200 МГц)(м.д.): 9,40 (ушир. с, 1 Н); 8,70 (ушир. с, 1 Н); 8,20-7,60 (м, 4 Н); 5,28(ушир. т, 1 Н); 3,90-3,40 (м, 3H); 2,30-1,30 (м, 5 Н). 9.3. (+/-) 2-(4-Оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)-1Hизоиндол-1,3(2H)-дион. По аналогии со способом, описанным в примере 1 (стадия 1.3), с использованием этил 3-(4- 14014918 пиримидинил)-3-оксопропионата (полученного по аналогии со способом, описанным в патенте DE 2705582) вместо этил 3-(пиридин-4-ил)-3-оксопропионата и с использованием гидрохлорида 2-(2 иминоазепан-3-ил)-1H-изоиндол-1,3(2H)-диона (1:1) получали указанное соединение в виде белого порошка. Т.пл.: 250-252 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,30 (с, 1H); 8,60 (д, 1H); 8,00 (м, 3H); 7,40 (м, 1H); 7,20 (м,2H); 4,70 (д, 2H); 3,50 (м, 2H); 2,00-1,50 (м, 4H); 1,3 (м, 1 Н). 9.4. (+/-) 10-Амино-2-пиримидин-4-ил-7,8,9,10-тетрагидропиримидо[1,2-а]азепин-4(6 Н)-он. По аналогии со способом, описанным в примере 1 (стадия 1.4), с использованием (+/-) 2-(4-оксо-2 пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)-1H-изоиндол-1,3(2H)-диона вместо (+/-) 2-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-1H-изоиндол 1,3(2H)-диона получали указанное соединение в виде коричневого порошка. Т.пл.: 157-159 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,30 (с, 1H); 9,00 (д, 1H); 8,40 (д, 1H); 7,20 (с, 1H); 5,00-4,80(+/-) 4-Фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2 а]азепин-10-ил)бензамид. По аналогии со способом, описанным в примере 1 (стадия 1.5), с использованием (+/-) 10-амино-2 пиримидин-4-ил-7,8,9,10-тетрагидропиримидо[1,2-а]азепин-4(6 Н)-она вместо (+/-) 9-амино-2-пиридин-4 ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-4-она получали указанное соединение в виде белого порошка. Т.пл.: 324-326 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,32 (м, 2H); 9,05 (д, 2H); 8,25 (д, 1H); 8,00 (т, 1H); 7,30 (с,1H); 7,15 (д, 1H); 6,90 (дд, 1H); 5,40 (д, 1 Н); 5,00 (дд, 1 Н); 4,00 (с, 3H); 2,20-1,80 (м, 5H); 1,30 (м, 1 Н). Пример 10. (+) 4-Фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид (соединение 15 табл. 3). 143 мг(+/-) 4-фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10 гексагидропиримидо[1,2-а]азепин-10-ил)бензамида (соединение 2 табл. 3) выделяли при помощи хиральной препаративной ВЭЖХ (CHIRALCEL OD-CSP 50250), элюируя этанолом, с получением 0,033 г чистого продукта, полученного в форме свободного основания, tR: 9,0 мин. Т.пл.: 241,7 С. []D20=+4,6 (с=0,167, DMSO).(м.д.): 9,32 (м, 2H); 9,05 (д, 2H); 8,25 (д, 1H); 8,00 (т, 1 Н); 7,30 (с, 1 Н); 7,15 (д, 1H); 6,90 (дд, 1H); 5,40 (д, 1H); 5,00 (дд, 1H); 4,00 (с, 3H); 2,20-1,80 (м, 5H); 1,30 (м, 1 Н). Пример 11. (-) 4-Фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2 а]азепин-10-ил)бензамид (соединение 16 табл. 3). 143 мг(+/-) 4-фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10 гексагидропиримидо[1,2-а]азепин-10-ил)бензамида (соединение 2 табл. 3) выделяли при помощи хиральной препаративной ВЭЖХ (CHIRALCEL OD-CSP 50x250), элюируя этанолом, с получением 0,035 г чистого продукта, полученного в форме свободного основания, tR: 7,1 мин. Т.пл.: 232,7-233,2 С. []D20=-5,3 (c=0,135, DMSO).(м.д.): 9,32 (м, 2H); 9,05 (д, 2H); 8,25 (д, 1H); 8,00 (т, 1H); 7,30 (с, 1 Н); 7,15 (д, 1H); 6,90 (дд, 1H); 5,40 (д, 1H); 5,00 (дд, 1H); 4,00 (с, 3H); 2,20-1,80 (м, 5H); 1,30 (м, 1 Н). Пример 12. (+/-) 4-Хлор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4Hпиридо[1,2-а]пиримидин-9-ил)бензамид (соединение 47 табл. 1). 12.1. 2-(2-Метокси-3-метил-3,4,5,6-тетрагидропиридин-3-ил)-1H-изоиндол-1,3(2H)-дион. По аналогии со способом, описанным в примере 1 (стадия 1.1), с использованием 2-(3-метил-2 оксопиперидин-3-ил)-1H-изоиндол-1,3(2H)-диона (полученного способом, аналогичным описанному вLiebigs Annalen der Chemie (1987), (7), 647-8. Archiv der Pharmazie (Weinheim, Germany) (1989), 322(8),499-505, (Heterocycles (1996), 42(2), 537-42, Enantiomer (2001), 6(5), 275-279, Synthesis (1991), (5), 417-20 вместо 3-фталимидопиперидин-2-она получали указанное соединение в виде желтого масла. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 7,80 (м, 4 Н); 3,40 (м, 4 Н); 2,30-2,10 (м, 1 Н); 1,90-1,70 (м, 5H); 1,65-1,40 (м, 2H). 12.2. Гидрохлорид 2-(2-амино-3-метил-3,4,5,6-тетрагидропиридин-3-ил)-1H-изоиндол-1,3(2H)диона (1:1). По аналогии со способом, описанным в примере 1 (стадия 1.2), с использованием 2-(2-метокси-3 метил-3,4,5,6-тетрагидропиридин-3-ил)-1H-изоиндол-1,3(2H)-диона вместо 2-(2-метокси-3,4,5,6-тетрагидропиридин-3-ил)-1H-изоиндол-1,3(2H)-диона получали указанное соединение в виде белого порошка. Т.пл.: 165-167 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 7,70-7,10 (м, 4 Н); 3,20-3,00 (м, 2H); 2,40-2,20 (м, 1 Н); 1,801,60 (м, 3H), 1,20 (с, 3H). 12.3. (+/-) 2-(1-Метил-5-оксо-7-пиримидин-4-ил-1,2,3,4,4 а,5-гексагидронафталин-1-ил)-1H-изоин- 15014918 дол-1,3(2H)-дион. По аналогии со способом, описанным в примере 1 (стадия 1.3), с использованием этил 3-(4 пиримидинил)-3-оксопропионата (полученного по аналогии со способом, описанным в патенте DE 2705582) вместо этил 3-(пиридин-4-ил)-3-оксопропионата и с использованием гидрохлорида 2-(2-амино 3-метил-3,4,5,6-тетрагидропиридин-3-ил)-1H-изоиндол-1,3(2H)-диона (1:1) получали указанное соединение в виде белого порошка. Т.пл.: 184-186 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,25 (с, 1H); 8,80 (д, 1H); 8,00 (д, 2H); 7,80 (м, 4 Н); 7,20 (с,1H); 4,30-4,10 (дт, 1H); 3,80-3,60(м, 1H); 2,50 (м, 1H); 2,15 (с, 3H); 2,10-1,80 (м, 2H). 12.4. (+/-) 5-Амино-5-метил-3-пиримидин-4-ил-6,7,8,8 а-тетрагидронафталин-1(5H)-он. По аналогии со способом, описанным в примере 1 (стадия 1.4), с использованием (+/-) 2-(1-метил-5 оксо-7-пиримидин-4-ил-1,2,3,4,4 а,5-гексагидронафталин-1-ил)-1H-изоиндол-1,3(2H)-диона вместо (+/-) 2-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4 Н-пиридо[1,2-а]пиримидин-9-ил)-1H-изоиндол-1,3(2H)диона получали указанное соединение в виде коричневого порошка. Т.пл.: 138-140 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,25 (с, 1H); 9,00 (д, 1 Н); 8,40 (д, 2H); 7,15 (с, 1 Н); 4,00-3,70(+/-) 4-Хлор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4Hпиридо[1,2-а]пиримидин-9-ил)бензамид. По аналогии со способом, описанным в примере 1 (стадия 1.5), с использованием (+/-) 5-амино-5 метил-3-пиримидин-4-ил-6,7,8,8 а-тетрагидронафталин-1(5 Н)-она вместо (+/-) 9-амино-2-пиридин-4-ил 6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-4-она получали указанное соединение в виде белого порошка. Т.пл.: 192-194 С. ЯМР 1 Н (DMSO-d6; 200 МГц)(м.д.): 9,30 (с, 1H); 9,00 (д, 1 Н); 8,80 (ушир. с, 1H); 8,20 (д, 1H); 7,50(м, 1H); 2,20-1,90 (м, 3H); 1,70 (с, 3H). Пример 13. (+) 4-Хлор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4Hпиридо[1,2-а]пиримидин-9-ил)бензамид (соединение 48 табл. 1). 480 мг (1,13 ммоль) (+/-) 4-хлор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9 тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамида (соединение 47 табл. 1) выделяли при помощи хиральной препаративной ВЭЖХ (CHIRALCEL OD-CSP 20 мкм 25050 мм), элюируя смесью изопропанол/гептан, с получением 181 мг чистого продукта, полученного в форме свободного основания. Т.пл.: 181,7 С. []D20=+132,4 (c=0,2618, DMSO). ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,30 (с, 1H); 9,00 (д, 1 Н); 8,80 (ушир. с, 1H); 8,20 (д, 1H); 7,50(м, 1H); 2,20-1,90 (м, 3H); 1,70 (с, 3H). Пример 14. (-) 4-Хлор-2-метокси-N-9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4Hпиридо[1,2-а]пиримидин-9-ил)бензамид (соединение 49 табл. 1). 480 мг (1,13 ммоль) (+/-) 4-хлор-2-метокси-N-(9-метил-4-оксо-2-пиримидин-4-ил-6,7,8,9 тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)бензамида (соединение 47 табл. 1) выделяли при помощи хиральной препаративной ВЭЖХ (CHIRALCEL OD-CSP 20 мкм 25050 мм), элюируя смесью изопропанол/гептан, с получением 202 мг чистого продукта, полученного в форме свободного основания. Т.пл.: 182, 7 С. []D20=-126,1 (с=0,4055, DMSO). ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,30 (с, 1H); 9,00 (д, 1 Н); 8,80 (ушир. с, 1H); 8,20 (д, 1H); 7,50(м, 1H); 2,20-1,90 (м, 3H); 1,70 (с, 3H). Пример 15. (+/-) 4-Хлор-2-метокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8-тетрагидропирроло[1,2 а]пиримидин-8-ил)бензамид (соединение 5 табл. 2). 15.1. (+/-) 2-(4-Оксо-2-пиридин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин-8-ил)изоиндол 1,3-дион. По аналогии со способом, описанным в примере 1 (стадия 1.3), с использованием этил 3-(4 пиридинил)-3-оксопропионата (полученного способом, аналогичным описанному в патенте DE 2705582) и с использованием 2-(2-амино-4,5-дигидро-3H-пиррол-3-ил)изоиндол-1,3-диона получали указанное соединение в виде белого порошка. Т.пл.: 224-226 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 8,60 (д, 2H); 8,00-7,70 (м, 6H); 7,05 (с, 1H); 5,90 (т, 1H); 4,404,20 (м, 1H); 3,80-4,10 (м, 1 Н); 2,70-2,40 (м, 2H). 15.2. (+/-) 8-Амино-2-пиридин-4-ил-7,8-дигидро-6H-пирроло[1,2-а]пиримидин-4-он. По аналогии со способом, описанным в примере 1 (стадия 1.4), с использованием 2-(4-оксо-2 пиридин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин-8-ил)изоиндол-1,3-диона вместо (+/-) 2-(4- 16014918 оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-1H-изоиндол-1,3(2H)-диона получали указанное соединение в виде коричневого порошка. Т.пл.: 187-189 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 8,70 (д, 2H); 8,00 (д, 2H); 7,00 (с, 1 Н); 4,40-4,20 (м, 1 Н); 3,904,10 (м, 1 Н); 3,90-3,60 (м, 1 Н); 2,60-2,30 (м, 1 Н); 1,70-2,00 (м, 1 Н). 15.3. (+/-) 4-Хлор-2-метокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8-тетрагидропирроло[1,2-а]пиримидин-8-ил)бензамид. По аналогии со способом, описанным в примере 1 (стадия 1.5), с использованием 8-амино-2 пиридин-4-ил-7,8-дигидро-6H-пирроло[1,2-а]пиримидин-4-она вместо (+/-) 9-амино-2-пиридин-4-ил 6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-4-она получали указанное соединение в виде белого порошка. Т.пл.: 303-305 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 8,90 (д, 1H); 8,70 (д, 2H); 8,00 (д, 2H); 7,80 (д, 1H); 7,25 (с,1H); 7,15-6,90 (м, 2H); 5,50 (м, 1H); 4,20 (м, 1H); 3,95-3,70 (м, 4 Н); 2,60 (м, 1 Н); 2,20 (м, 1 Н). Пример 16. (+/-) 4-Фтор-2-метокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2 а]азепин-10-ил)бензамид (соединение 19 табл. 3). 16.1.(+/-) 2-(4-Оксо-2-пиридин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)-1Hизоиндол-1,3(2H)-дион. По аналогии со способом, описанным в примере 1 (стадия 1.3), с использованием этил 3-(пиридин 4-ил)-3-оксопропионата и с использованием гидрохлорида 2-(2-иминоазепан-3-ил)-1H-изоиндол-1,3(2H)диона (1:1) получали указанное соединение в виде белого порошка. Т.пл.: 250-252 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 8,40 (д, 2H); 8,00-7,80 (м, 4 Н); 7,50 (д, 2H); 7,08 (с, 1H); 5,65(ушир.д, 1H); 5,10 (ушир.д, 1 Н); 3,75(м, 1 Н); 2,80-2,3 (м, 1 Н); 2,10-1,70 (м, 4 Н); 1,4(м, 1 Н). 16.2. (+/-) 10-Амино-2-пиридин-4-ил-7,8,9,10-тетрагидропиримидо[1,2-а]азепин-4(6 Н)-он. По аналогии со способом, описанным в примере 1 (стадия 1.4), с использованием (+/-) 2-(4-оксо-2 пиридин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)-1H-изоиндол-1,3(2H)-диона вместо(+/-) 2-(4-оксо-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-9-ил)-1H-изоиндол 1,3(2H)-диона получали указанное соединение в виде коричневого порошка. Т.пл.: 181-183 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 8,70 (д, 2H); 8,10 (д, 2H); 7,50 (д, 2H); 7,10 (с, 1H); 4,90(ушир.д, 1H); 4,25 (д, 1 Н); 3,75(ддд, 1 Н); 2,00-1,70 (м, 2H); 1,60-1,20 (м, 4H). 16.3. (+/-) 4-Фтор-2-метокси-N-(4-оксо-2-пиридин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид. По аналогии со способом, описанным в примере 1 (стадия 1.5), с использованием (+/-) 10-амино-2 пиридин-4-ил-7,8,9,10-тетрагидропиримидо[1,2-а]азепин-4(6 Н)-она вместо (+/-) 9-амино-2-пиридин-4-ил 6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-4-она получали указанное соединение в виде белого порошка. Т.пл.: 218-220 С. ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,40 (д, 1 Н); 8,80 (д, 2H); 8,00 (м, 3H); 7,20-6,85 (м, 3H); 5,40(м, 1H); 5,00 (м, 1 Н); 3,95 (с, 3H); 3,65 (м, 1 Н); 2,25-1,15 (м, 6H). Пример 17. (+) 4-Фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-9-ил)бензамид (соединение 51 табл. 1). 0,556 г (1,42 ммоль) (+/-) 4-фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4Hпиридо[1,2-а]пиримидин-9-ил)бензамида выделяли при помощи хиральной препаративной ВЭЖХ (DaicelCHIRALCEL OD-H 20 мкм 50220 мм), элюируя этанолом, с получением 0,162 г чистого продукта, полученного в форме свободного основания. Т.пл.: 240 С (разл.). []D20=+54,7 (с=0,321, DMSO). ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,40 (с, 1H); 9,05 (д, 1 Н); 8,90 (д, 1 Н); 8,20 (д, 1H); 7,90 (дд,1H); 7,25 (с, 1H); 7,10 (дд, 1 Н); 6,90 (ддд, 1 Н); 5,15 (м, 1 Н); 4,00 (м, 2H); 3,90 (с, 3H); 2,30 (м, 1 Н); 2,10 (м,2H); 1,80 (м, 1 Н). Пример 18. (-) 4-Фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4H-пиридо[1,2 а]пиримидин-9-ил)бензамид (соединение 52 табл. 1). 0,556 г (1,42 ммоль) (+/-) 4-фтор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-6,7,8,9-тетрагидро-4Hпиридо[1,2-а]пиримидин-9-ил)бензамида выделяли при помощи хиральной препаративной ВЭЖХ (Daicel- 17014918 Пример 19. (+) 4-Хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2-а]азепин-10-ил)бензамид (соединение 25 табл. 3). 19.1. (-) 10-Амино-2-пиримидин-4-ил-7,8,9,10-тетрагидропиримидо[1,2-а]азепин-4(6 Н)-он. 20 г (77,73 ммоль) 9.4 (+/-) 10-амино-2-пиримидин-4-ил-7,8,9,10-тетрагидропиримидо[1,2-а]азепин 4(6 Н)-она (соединение 9.4 примера 9) выделяли при помощи хиральной препаративной ВЭЖХ (Daicel(+) 4-Хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2 а]азепин-10-ил)бензамид. По аналогии со способом, описанным в примере 1 (стадия 1.5), с использованием (-) 10-амино-2 пиримидин-4-ил-7,8,9,10-тетрагидропиримидо[1,2-а]азепин-4(6 Н)-она вместо (+/-) 9-амино-2-пиридин-4 ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-4-она получали указанное соединение в виде белого порошка. Т.пл.: 210-212 С. []D20=+8,99 (с=0,403, DMSO). ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,47 (ушир.д, 1 Н); 9,40 (с, 1 Н); 8,90 (д, 1 Н); 8,20 (м, 2H); 7,55(с, 1H); 7,10 (м, 2H); 7,15 (д, 1H); 5,50 (м, 2H); 4,00 (с, 3H); 3,55 (м, 1H); 2,50 (ушир.д, 1 Н); 2,20 (м, 2H); 1,80-1,40 (м, 3H). Пример 20. (-) 4-Хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2 а]азепин-10-ил)бензамид (соединение 26 табл. 3). 20.1 (+) 10-Амино-2-пиримидин-4-ил-7,8,9,10-тетрагидропиримидо[1,2-а]азепин-4(6 Н)-он. 20 г (77,73 ммоль) (+/-) 10-амино-2-пиримидин-4-ил-7,8,9,10-тетрагидропиримидо[1,2-а]азепин 4(6 Н)-она выделяли при помощи хиральной препаративной ВЭЖХ (Daicel CHIRALPACK AD 20 мкм 50220 мм), элюируя этанолом, с получением 9,17 г чистого продукта, полученного в форме свободного основания. Т.пл.: 118 С. []D20=+59,97 (c=0,691, DMSO). ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,3 (с, 1H); 9,0 (д, 1 Н); 8,4 (д, 1 Н); 7,2 (с, 1H); 5,0-4,8 (м, 1H); 4,25 (д, 1H); 3,8-3,6 (дд, 1 Н); 2,0-1,2 (м, 6H). 20.2.(-) 4-Хлор-2-метокси-N-(4-оксо-2-пиримидин-4-ил-4,6,7,8,9,10-гексагидропиримидо[1,2 а]азепин-10-ил)бензамид. По аналогии со способом, описанным в примере 1 (стадия 1,5), с использованием (+) 10-амино-2 пиримидин-4-ил-7,8,9,10-тетрагидропиримидо[1,2-а]азепин-4(6 Н)-она вместо (+/-) 9-амино-2-пиридин-4 ил-6,7,8,9-тетрагидро-4H-пиридо[1,2-а]пиримидин-4-она получали указанное соединение в виде белого порошка. Т.пл.: 212-214 С. []D20=-8,8 (c=0,510, DMSO). ЯМР 1H (DMSO-d6; 200 МГц)(м.д.): 9,47 (ушир.д, 1 Н); 9,40 (с, 1H); 8,90 (д, 1H); 8,20 (м, 2H); 7,55(с, 1H); 7,10 (м, 2H); 7,15 (д, 1H); 5,50 (м, 2H); 4,00 (с, 3H); 3,55 (м, 1H); 2,50 (ушир.д, 1 Н); 2,20 (м, 2H); 1,80-1,40 (м, 3H). Химические структуры и физические данные для соединений указанной выше формулы (I), иллюстрирующие настоящее изобретение, представлены в табл. 1. Соединения были получены в соответствии со способами, описанными в примерах. В таблице m и o имеют значение 1, Ph представляет собой фенильную группу, Me представляет собой метильную группу, (Rot.) указывает левовращающие или правовращающие характеристики энантиомерного соединения. Химические структуры и физические данные для соединений указанной выше формулы (I), иллюстрирующие настоящее изобретение, представлены в табл. 2. Соединения были получены в соответствии со способами, описанными в примерах. В таблице m имеет значение 0 и o имеет значение 1, (Rot.) указывает левовращающие или правовращающие характеристики энантиомерного соединения. Химические структуры и физические данные для соединений указанной выше формулы (I), иллюстрирующие настоящее изобретение, представлены в табл. 3. Соединения были получены в соответствии со способами, описанными в примерах. В таблице m имеет значение 1 и o имеет значение 0, (Rot.) указывает левовращающие или правовращающие характеристики энантиомерного соединения. Пример испытания: ингибиторная активность лекарственного средства по настоящему изобретению против GSK3 Можно использовать два разных протокола. В первом протоколе: 7,5 мкм пре-фосфорилированного GS1 пептида и 10 мкМ АТФ (содержащего 300000 имп/мин 33P-АТФ) инкубировали в 25 мМ трис-HCl, рН 7,5, 0,6 мМ DTT, 6 мМ MgCl2, 0,6 мМEGTA, 0,05 мг/мл BSA буфера в течение 1 ч при комнатной температуре в присутствии GSK3 (общий объем реакции: 100 мкл). Во втором протоколе: 4,1 мкм пре-фосфорилированного GS1 пептида и 42 мкМ АТФ (содержащего 260,000 имп/мин 33P-АТФ) инкубировали в 80 мМ Mes-NaOH, рН 6,5, 1 мМ ацетата Mg, 0,5 мМ EGTA,5 мМ 2-меркаптоэтанола, 0,02% Tween 20, 10% глицеринового буфера в течение 2 ч при комнатной температуре в присутствии GSK3. Ингибиторы солюбилизировали в DMSO (конечная концентрация растворителя в реакционной среде 1%). Реакцию останавливали с использованием 100 мкл раствора, полученного из 25 г полифосфорной кислоты (85% Р 2 О 5), 126 мл 85% H3PO4, H2O до 500 мл, и затем разбавленного до 1:100 перед использо- 28014918 ванием. Аликвоту реакционной смеси затем переносили на катионообменные фильтры Whatman P81 и промывали раствором, описанным выше. Включение 33P радиоактивности определяли методом жидкостной сцинтилляционной спектрометрии. Фосфорилированный GS-1 пептид имел следующую последовательность:NH2-YRRAAVPPSPSLSRHSSPHQS(P)EDEE-COOH (Woodgett J.R. (1989) Analytical Biochemistry,180, 237-241. Ингибиторную активность соединений по настоящему изобретению в отношении GSK3 выражали в виде ИК 50, и, в качестве иллюстрации, диапазон значений ИК 50 для соединений в табл. 1 и 2 находится в пределах от 0,1 наномолярной до 3 микромолярной концентрации. Например, соединение 33 табл. 1 показывает ИК 50=0,005 мкМ. Пример составов(1). Таблетки. Указанные ниже ингредиенты смешивали обычным способом и прессовали с использованием обычного устройства. Соединение примера 1 30 мг Кристаллическая целлюлоза(2). Мягкие капсулы. Указанные ниже ингредиенты смешивали обычным способом и полученной смесью заполняли мягкие капсулы. Соединение примера 1 30 мг Оливковое масло(1). Парентеральные препараты. Указанные ниже ингредиенты смешивали обычным способом с получением препарата для инъекций, содержащегося в 1-мл ампуле. Соединение примера 1 3 мг Хлорид натрия Дистиллированная вода для инъекций Промышленная применимость Соединения по настоящему изобретению обладают ингибиторной активностью в отношенииGSK3 и являются полезными в качестве активного ингредиента лекарственного средства для профилактического и/или терапевтического лечения заболеваний, вызванных аномальной активностью GSK3, и,более конкретно, нейродегенеративных заболеваний. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Пиримидоновое производное, представленное формулой (I), или его соль, его сольват или его гидрат где Y представляет собой два атома водорода, атом кислорода;Z представляет собой связь, атом кислорода, атом азота, замещенный атомом водорода или C1-3 алкильной группой;
МПК / Метки
МПК: A61K 31/519, C07D 471/04
Метки: пиримидоновые, замещенные, бициклические, производные
Код ссылки
<a href="https://eas.patents.su/30-14918-zameshhennye-biciklicheskie-pirimidonovye-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные бициклические пиримидоновые производные</a>
Предыдущий патент: Пестицидные смеси, включающие фенилсемикарбазон
Следующий патент: Пиридин[3,4-b]пиразиноны
Случайный патент: Способ формирования соединительного шва












