Замещенные 6,6-гетеро-бициклические производные
Формула / Реферат
1. Соединение формулы

где пунктирные линии представляют собой возможные двойные связи;
А является азотом или CR7;
В является -NR1R2, -CR1R2R10, -C(=CR2R11)R1, -NHCR1R2R10, -OCR1R2R10, -SCR1R2R10, -CR2R10NHR1, -CR2R10OR1 или -COR2;
G является азотом или CR4 и связан простой связью со всеми атомами, к которым он присоединен, или G является углеродом и связан двойной связью с К;
К является CR6, когда он связан двойной связью с G или Е; либо К является С=O или CR6R12, когда он связан простой связью с обоими соседними атомами кольца;
D и Е, каждый независимо, является С=O, кислородом, CR4R6 или NR8, когда связан простой связью с обоими соседними атомами кольца, либо азотом или CR4, когда связан двойной связью с соседним атомом кольца;
6-членное кольцо, которое содержит D, Е, К и G, может содержать от одной до трех двойных связей, от нуля до двух гетероатомов, выбранных из кислорода и азота, и от нуля до двух С=O групп, где атомы углерода таких групп являются частью кольца, а атомы кислорода являются заместителями на кольце;
R1 является С1-С6алкилом, возможно замещенным одним или двумя заместителями, независимо выбранными из гидрокси, фторо-, хлоро-, бромо-, иодо-, С1-С4алкокси, СF3, -С(=O) (С1-С4алкила), -С(=O)-O-(С1-С4)алкила, -ОС(=O) (С1-С4алкила), -ОС(=O)N(С1-С4алкил)(С1-С2алкила), -NHCO(С1-С4алкила), -СОNН(С1-С4ал-кила), -СОN(С1-С4алкил)(С1-С2алкила) и -SO2 (С1-С4алкила), где каждая из С1-С4алкильных групп в ранее упомянутых R1 группах может возможно содержать одну или две двойные связи;
R2 является С1-С12алкилом, который может возможно содержать от одной до трех двойных или тройных связей, арилом или (С1-С4алкилен)арилом, где указанный арил и арильная группировка указанного (С1-С4алкилен)арила выбраны из фенила, пиридила и тиазолила; С3-С8циклоалкилом или (С1-С6алкилен)(С3-С8циклоалкилом), где один или два атома углерода указанного циклоалкила и 5-8-членных циклоалкильных группировок указанного (С1-С6алкилен)(С3-С8циклоалкила) могут возможно и независимо быть заменены атомом кислорода или серы и где каждая из ранее упомянутых R2 групп может возможно быть замещена заместителями в количестве от одного до трех, независимо выбранными из хлоро-, фторо-, гидрокси и С1-С4алкила, или одним заместителем, выбранным из С1-С6алкокси, -ОС(=О)(С1-С6алкила), -ОС(=О)N(С1-С4алкил)(С1-С2алкила), амино, -NН(С1-С2алкила), -N(С1-С2алкил)(С1-С4алкила), -N(С1-С4алкил)-СО-(С1-С4алкила), -NНСО(С1-С4алкила), -СОNН(С1-С4алкила), -CON(С1-С4aлкил)(С1-С2алкила) и -SO2(С1-С4алкила);
-NR1R2 или CR1R2R10 может образовывать кольцо, выбранное из
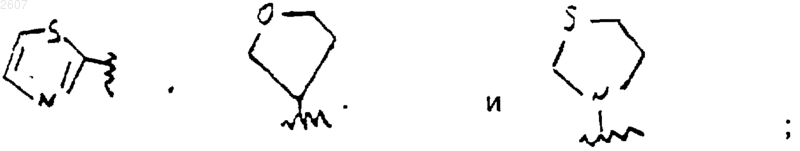
R3 является водородом или С1-С4алкилом;
каждый R8 и R12 независимо выбран из водорода и С1-С2алкила;
каждый R4 и R6, который присоединен к атому углерода, независимо выбран из водорода, С1-С6алкила и хлоро-;
R5 является замещенным фенилом, где указанный фенил замещен заместителями в количестве от двух до четырех, независимо выбранными из С1-С6алкила;
R7 является водородом или метилом;
R10 является водородом, гидрокси, метокси или фторо-; и
R11 является водородом или С1-С4алкилом;
при условии, что в кольце, содержащем D, Е, К и G формулы I, не может быть двух двойных связей, соседних друг с другом;
при дополнительном условии, что если (1) В является NR1R2 и NR1R2 не образует кольцо или образует гетероарильное кольцо, содержащее азот, или если (2) В является CR1R2R10 и CR1R2R10 не образует кольцо или образует арильное или гетероарильное кольцо, или если (3) В является OCR1R2R10, и CR1R2R10 является алкилом, то бициклическое ядро, содержащее А, D, Е, К и G, не может представлять собой

где R7 является водородом, метилом или галогено; R4 или R6 является водородом или алкилом, R5 является фенилом, пиридилом или пиримидилом, R3 является водородом или алкилом и R8 является водородом или алкилом, за исключением того, что соединение формулы I может представлять собой
8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-3,4-дигидро-1Н-пиридо[2,3-b]пи-разин-2-он;
8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-1,2,3,4-тетрагидропиридо[2,3-b]пиразин;
8-(1-этилпропокси)-1,6-диметил-4-(2,4,6-триметилфенил)-3,4-дигидро-1Н-пиридо[2,3-b]пиразин-2-он;
8-(1-этилпропокси)-1,6-диметил-4-(2,4,6-триметилфенил)-1,2,3,4-тетрагидропиридо[2,3-b]пиразин;
или фармацевтически приемлемую соль такого соединения,
и фармацевтически приемлемая соль такого соединения.
2. Соединение по п.1, где В является -NR1R2, -NНСНR1R2 или -OCHR1R2, R1 является С1-С6алкилом, который может возможно быть замещен одним фторо- или С1-С4алкоксигруппой и может возможно содержать одну двойную связь, и R2 является С1-С4алкилом или -(С1-С2 алкил)-СО-(С1-С2алкилом), который может возможно содержать одну двойную или тройную связь.
3. Соединение по п.1, где В является -CHR1R2, -NR1R2, -NHCHR1R2, -OCHR1R2 или -SCHR1R2, R1 является С1-С6алкилом, который может возможно быть замещен одной гидрокси, циклопропилфторо-, CF3 или С1-С4алкоксигруппой и может возможно содержать одну двойную связь; и R2 является бензилом или С1-С4алкилом, который может возможно содержать одну двойную или тройную связь, и где указанный С1-С6алкил и фенильная группировка указанного бензила могут возможно быть замещены одной фторо-, циклопропильной, гидрокси, СF3, С1-С2алкильной, С1-С2алкоксильной или хлорогруппой.
4. Соединение по п.1, где А является N, СH или ССН3.
5. Соединение по п.1, где G является азотом.
6. Соединение по п.1, где G является углеродом и кольцо, содержащее D, Е, К и G, является бензольным кольцом.
7. Соединение по п.1, где G является N; и Е--К являетёя СН2-СН2, СН=СН, С(O)-СН2 или СН2-С(O).
8. Соединение по п.1, где G является N; D--E--K является С(O)-O-СН2, СН2-O-СН2, С(O)-СН2-СН2, С(O)-СН=СН, СН2-СН2-СН2-, СН2-СН2-С(O), СН=СН-С(O), СН=СН-СН2, CH=CH-NH, СН=СН-NСН3.
9. Соединение по п.1, где R3 является метилом и каждый из R4, R6, R8 и R12 является водородом.
10. Соединение по п.1, где R5 является ди- или тризамещенным фенилом, в котором два или три заместителя независимо выбраны из С1-С4алкила.
11. Соединение по п.1, где R3 является метилом или этилом и каждый R4, R6, R8 и R12 является, независимо, водородом или метилом.
12. Соединение по п.1, где В является -CHR1R2, -NHCHR1R2 или -OCHR1R2 и группа CHR1R2 в В является тетрагидрофурановым кольцом.
13. Фармацевтическая композиция для лечения, предупреждения или ингибирования (а) расстройства, лечение которого может быть осуществлено антагонизированием КВФ или лечению которого может способствовать антагонизирование КВФ, или (б) расстройства, выбранного из воспалительных расстройств, таких как ревматоидный артрит и остеоартрит, боль, астма, псориаз и аллергии; расстройства генерализованной тревоги; паники; фобий; обсессивно-компульсивного расстройства; посттравматического стрессового расстройства; расстройств сна, вызванных стрессом; перцепции боли, такой как фибромиалгия; эмоциональных расстройств, таких как депрессия, включая сильную депрессию, однократную эпизодическую депрессию, повторяющуюся депрессию, детскую депрессию, вызванную злоупотреблениями, эмоциональные расстройства, связанные с предменструальным синдромом, и послеродовую депрессию; дистимии; биполярных расстройств, циклотимии; синдрома хронической усталости; головной боли, вызванной стрессом; рака; синдрома раздраженного кишечника, гранулематозной болезни (болезни Крона); слизистого колита; послеоперационного илеуса; язвы; диареи; лихорадки, вызванной стрессом; инфекций вируса иммунодефицита человека (ВИЧ); нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона; желудочно-кишечных заболеваний; расстройств приема пищи, таких как анорексия и нервно-психическая булимия; геморрагического стресса; химических зависимостей и аддикций (например, зависимостей от алкоголя, кокаина, героина, бензодиазепинов, или других лекарственных препаратов); симптомов лекарственной и алкогольной абстиненции; вызванных стрессом психотических эпизодов; синдрома эутиреоидной слабости; синдрома несоответствующего антидиаретического гормона (АДГ); ожирения; бесплодия; травм головы; травмы спинного мозга, ишемического нейронального повреждения (например, церебральной ишемии, такой как церебральная гиппокампальная ишемия); эксцитотоксического нейронального повреждения; эпилепсии; удара; иммунных дисфункций, включая иммунные дисфункции, вызванные стрессом (например, синдром стресса свиньи, лихорадка крупного рогатого скота, вызванная перевозкой, конская пароксизмальная фибрилляция и дисфункции, вызванные безвыгульным содержанием у цыплят, стресс у овец, вызванный стрижкой, или стресс у собак, связанный сo взаимодействием человек-животное); мышечных спазмов; недержания мочи; старческой деменции Альцгеймеровского типа; мультиинфарктной деменции; бокового амиотрофического склероза; гипертензии; тахикардии; застойной сердечной недостаточности; остеопороза; преждевременных родов; и гипогликемии, у млекопитающего, содержащая такое количество соединения по п.1, которое эффективно при лечении такого расстройства, и фармацевтически приемлемый носитель.
14. Способ лечения, предупреждения или ингибирования (а) расстройства, лечение которого может быть осуществлено антагонизированием КВФ или лечению которого может способствовать антагонизирование КВФ, или (б) расстройства, выбранного из воспалительных расстройств, таких как ревматоидный артрит и остеоартрит, боль, астма, псориаз и аллергии; расстройства генерализованной тревоги; паники; фобий; обсессивно-компульсивного расстройства; посттравматического стрессового расстройства; расстройств сна, вызванных стрессом; перцепции боли, такой как фибромиалгия; эмоциональных расстройств, таких как депрессия, включая сильную депрессию, однократную эпизодическую депрессию, повторяющуюся депрессию, детскую депрессию, вызванную злоупотреблениями, эмоциональные расстройства, связанные с предменструальным синдромом, и послеродовую депрессию; дистимии; биполярных расстройств, циклотимии; синдрома хронической усталости; головной боли, вызванной стрессом; рака; синдрома раздраженного кишечника, гранулематозной болезни (болезни Крона); слизистого колита; послеоперационного илеуса; язвы; диареи, лихорадки, вызванной стрессом; инфекций вируса иммунодефицита человека (ВИЧ); нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона; желудочно-кишечных заболеваний; расстройств приема пищи, таких как анорексия и нервно-психическая булимия; геморрагического стресса; химических зависимостей и аддикций (например, зависимостей от алкоголя, кокаина, героина, бензодиазепинов или других лекарственных препаратов); симптомов лекарственной и алкогольной абстиненции; вызванных стрессом психотических эпизодов; синдрома эутиреоидной слабости; синдрома несоответствующего антидиаретического гормона (АДГ); ожирения; бесплодия; травм головы; травмы спинного мозга, ишемического нейронального повреждения (например, церебральной ишемии, такой как церебральная гиппокампальная ишемия); эксцитотоксического нейронального повреждения; эпилепсии; удара; иммунных дисфункций, включая иммунные дисфункции, вызванные стрессом (например, синдром стресса свиньи, лихорадка крупного рогатого скота, вызванная перевозкой, конская пароксизмальная фибрилляция и дисфункции, вызванные безвыгульным содержанием у цыплят, стресс у овец, вызванный стрижкой, или стресс у собак, связанный со взаимодействием человек-животное); мышечных спазмов; недержания мочи; старческой деменции Альцгеймеровского типа; мультиинфарктной деменции; бокового амиотрофического склероза; гипертензии; тахикардии; застойной сердечной недостаточности; остеопороза; преждевременных родов; и гипогликемии, у млекопитающего, при котором нуждающемуся в указанном лечении субъекту вводят такое количество соединения по п.1, которое эффективно при лечении такого расстройства.
15. Способ лечения или предупреждения расстройства или состояния, лечение или предупреждение которого может быть осуществлено ингибированием КВГ связывающего белка или лечению или предупреждению которого может способствовать ингибирование КВГ связывающего белка, у млекопитающего, включая человека, при котором указанному млекопитающему вводят количество соединения по п.1, ингибирующее КВГ связывающий белок.
16. Фармацевтическая композиция для лечения или предупреждения расстройства или состояния, лечение или предупреждение которого может быть осуществлено ингибированием КВГ связывающего белка или лечению или предупреждению которого может способствовать ингибирование КВГ связывающего белка у млекопитающего, включая человека, содержащая количество соединения по п.1, ингибирующее КВГ связывающий белок, и фармацевтически приемлемый носитель.
17. Соединение по п.3, где G является углеродом и кольцо, содержащее D, Е, К и G является бензольным кольцом.
18. Соединение по п.17, где R3 является метилом.
19. Соединение по п.18, где R5 является ди- или тризамещенным фенилом в орто- или пара-положениях, в котором два или три заместителя независимо выбраны из С1-С4алкила.
20. Соединение по п.3, где G является N; D--E--K является С(С0-С1алкил)-O-С(С0-С1алкил)(С0-С1алкилом).
21. Соединение по п.3, где G является N; D--E--K является СН2-O-СН2.
22. Соединение по п.21, где R3 является метилом.
23. Соединение по п.22, где R5 является ди- или тризамещенным фенилом в орто- или пара-положениях, в котором два или три заместителя независимо выбраны из С1-С4алкила.
24. Соединение по п.3, где G является N; D--E--K является O-С(С0-С1алкил)(С0-С1алкил)-С(С0-С1алкил)(С0-С1алкилом) или N(С0-С1 aлкил)-С(С0-С1алкил)(С0-С1алкил)-С(С0-С1ал-кил)(С0-С1алкилом).
25. Соединение по п.3, где G является N; D--E--K является О-СН2-СН2 или O-СН=СН.
26. Соединение по п.25, где R3 является метилом.
27. Соединение по п.26, где R5 является ди- или тризамещенным фенилом в орто- или пара-положениях, в котором два или три заместителя независимо выбраны из С1-С4алкила.
28. Соединение по п.3, где G является N; D--E--K является NН-СН2-СН2, NMe-CH2-CH2-N-R5, NH-CH=CH-N-R5 или NСН3-СН=СН-N-R5.
29. Соединение по п.28, где R3 является метилом.
30. Соединение по п.29, где R5 является ди- или тризамещенным фенилом в орто- или пара-положениях, в котором два или три заместителя независимо выбраны из С1-С4алкила.
31. Соединение по п.3, где G является N; D--E--K является N=С(С0-С1алкил)-С(=O), N(С0-С1алкил)-С(=O)-С(С0-С1алкилом), С(=O)-N(С0-С1алкил)-С(=O), C(C1)=N-C(=O), С(С0-С1алкил)=N-С(=O), CH2CH2CH2, CH2-СН2-С(=O), СН2-N(С0-С1алкил)-С(=O).
32. Соединение по п.31, где R3 является метилом.
33. Соединение по п.32, где R5 является ди- или тризамещенным фенилом в орто- или пара-положениях, в котором два или три заместителя независимо выбраны из С1-С4алкила.
34. Соединение по п.1, где указанное соединение является
4-(бутилэтиламино)-2,6-диметил-8-(2,4,6-триметилфенил)-5,8-дигидро-6Н-пиридо[2,3-d]пиримидин-7-оном;
8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-3,4-дигидро-1Н-пиридо[2,3-b]пи-разин-2-оном;
8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-1,2,3,4-тетрагидропиридо[2,3-b]пиразином;
8-(1-этилпропокси)-1,6-диметил-4-(2,4,6-триметилфенил)-3,4-дигидро-1Н-пиридо[2,3-b]пиразин-2-оном;
5-(1-этилпропокси)-7-метил-1-(2,4,6-триметилфенил)-1,4-дигидро-2Н-3-окса-1,8-диаза-нафталином;
5-(1-этилпропокси)-7-метил-1-(2,4,6-триметилфенил)-1,2-дигидро-3-окса-1,8-диазанафталин-4-оном;
8-(1-этилпропокси)-1,6-диметил-4-(2,4,6-триметилфенил)-1,2,3,4-тетрагидропиридо[2,3-b]пиразином;
(1-этилпропил)-[2-метил-8-(2,4,6-триметилфенил)хинолин-4-ил]амином;
4-(1-этилпропокси)-2-метил-8-(2,4,6-триметилфенил)хинолином;
2-метил-4-(тетрагидрофуран-3-илокси)-8-(2,4,6-триметилфенил)хинолином;
5-(1-этилпропокси)-7-метил-1-(2,4,6-триметилфенил)-3,4-дигидро-1Н-[1,8]нафтиридин-2-оном;
5-(1-этилпропиламино)-7-метил-1-(2,4,6-триметилфенил)-3,4-дигидро-1Н-[1,8]нафтиридин-2-оном;
5-(1-этилпропокси)-7-метил-1-(2,4,6-триметилфенил)-3,4-дигидро-1Н-пиридо-[2,3-d]пиримидин-2-оном;
4-(1-этилпропокси)-2,6-диметил-8-(2,4,6-триметилфенил)-8-Н-птеридин-7-оном;
5-(1-этилпропокси)-7-метил-1-(2,4,6-три-метилфенил)-1,2,3,4-тетрагидро-[1,8]нафтиридином;
8-(1-этилпропокси)-2,6-диметил-4-(2,4,6-триметилфенил)-4Н-пиридо-[2,3-b]пиразин-3-оном;
4-хлор-5-(1-этилпропокси)-7-метил-1-(2,4,6-триметилфенил)-1Н-пиридо-[2,3-d]пиримидин-2-оном;
5-(1-этилпропокси)-7-метил-1-(2,4,6-триметилфенил)-1Н-пиридо-[2,3-d]пиримидин-2,4-дионом;
1-(4-бром-2,6-диметилфенил)-5-(1-этилпропокси)-7-метил-1,4-дигидро-2Н-3-окса-1,8-диазанафталином;
1-(4-хлор-2,6-диметилфенил)-5-(1-этилпропокси)-7-метил-1,4-дигидро-2Н-3-окса-1,8-диазанафталином;
или фармацевтически приемлемой солью такого соединения.
35. Соединение по п.1, представляющее собой
8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-3,4-дигидро-1Н-пиридо[2,3-b]пиразин-2-он;
8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-1,2,3,4-тетрагидропиридо[2,3-b]пиразин;
8-(1-этилпропокси)-1,6-диметил-4-(2,4,6-триметилфенил)-3,4-дигидро-1Н-пиридо[2,3-b]пиразин-2-он;
8-(1-этилпропокси)-1,6-диметил-4-(2,4,6-триметилфенил)-1,2,3,4-тетрагидропиридо[2,3-b]пиразин;
или фармацевтически приемлемую соль такого соединения.
36. Соединение формулы
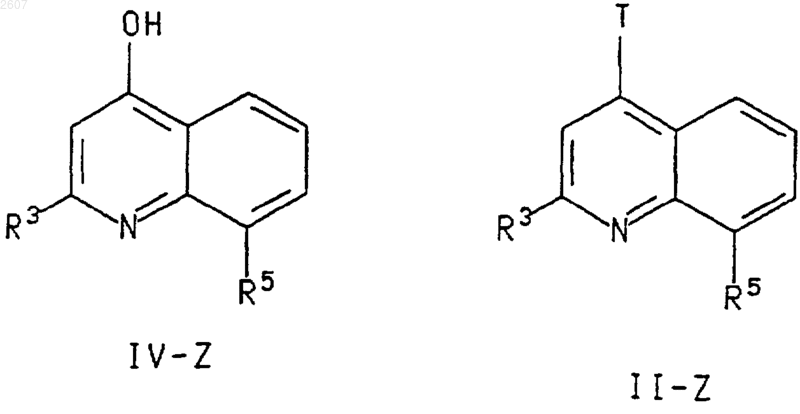
где R3, R7 и R5 являются такими, как определено в п.1, и Т является Cl, Вr, I или OTf.
Текст
1 Предпосылки изобретения Это изобретение относится к некоторым фармацевтически активным замещенным 6,6 гетеробициклическим производным, фармацевтическим композициям, их содержащим, и способам введения их субъектам, нуждающимся в их активности антагониста кортикотропин высвобождающего фактора. Замещенные гетероциклические производные, заявленные в этом случае, проявляют активность как антагонисты кортикотропин высвобождающего фактора (гормона) КВФ (КВГ). Антагонисты КВФ упоминаются в патентах США 4605642 и 5063245 по отношению к пептидам и пиразолинонам, соответственно. На них также ссылаются в следующих случаях: РСТ заявка РСТ/IВ 95/00439 на патент (WO 95/33750), в которой указаны США и которая была подана 6 июня 1995 года и опубликована 14 декабря 1995 года; РСТ заявка PCT/IB 95/00373 на патент (WO 95/34563), в которой указаны США и которая была подана 18 мая 1995 года и опубликована 21 декабря 1995 года; заявка 08/448539 на патент США (WO 94/13676,опубликована 13 июня 1994 года), которая была подана в РСТ 12 ноября 1993 года и вступила в национальную фазу США 14 июня 1995 года; РСТ заявка WO 95/10506 на патент, которая была подана 12 октября 1993 года и опубликована 20 апреля 1995 года и заявка 08/481413 на патент США (WO 94/13677, опубликована 23 июня 1994 года), которая была подана в РСТ 26 ноября 1993 года и вступила в национальную фазу США 24 июля 1995 года; заявка 08/254820 на патент США (WO 95/33727, опубликована 14 декабря 1995 года), которая была подана 19 апреля 1995 года. Все упомянутые выше патентные заявки включены сюда полностью путем ссылки. Важность антагонистов изложена в литературе, например Р. Black, Scientific AmericanSCIENCEMEDICINE, 1995, p.16-25; Т. Lovenberg, et al., Current Pharmaceutical Design,1995, 1, 305-316; и патент США 5063245, на который ссылались выше. Недавно описание различных активностей, которыми обладают антагонисты КВФ, было сделано в M.J. Owens et al.,Pharm. Rev., Vol.43, pages 425-473 (1991), также включенной сюда путем ссылки. Основываясь на исследованиях, описанных в этих двух и других ссылках, антагонисты КВФ эффективны при лечении широкого ряда заболеваний, связанных со стрессом, эмоциональных расстройств, таких как депрессия, сильная депрессия, однократная эпизодическая депрессия, повторяющаяся депрессия, вызванная злоупотреблениями детская депрессия, послеродовая депрессия, дистимия,биполярные расстройства и циклотимия; синдрома хронической усталости; расстройств приема пищи, таких как анорексия и нервнопсихическая булимия; расстройства генерализованной тревоги; панического расстройства; фо 002607 2 бий; обсессивно-компульсивного расстройства; посттравматического стрессового расстройства; перцепции боли, такой как фибромиалгия; головной боли; желудочно-кишечных заболеваний; геморрагического стресса; язв; вызванных стрессом психотических эпизодов; лихорадки; диареи; послеоперационного илеуса, гиперчувствительности толстой кишки; синдрома раздраженного кишечника; гранулематозной болезни (болезни Крона); слизистого колита; воспалительных заболеваний, таких как ревматоидный артрит и остеоартрит; боли; астмы; псориаза; аллергий; остеопороза; преждевременных родов; гипертензии; застойной сердечной недостаточности; расстройств сна; нейродегенеративных заболеваний, таких как болезнь Альцгеймера, старческая деменция Альцгеймеровского типа, мультиинфарктная деменция, болезнь Паркинсона и болезнь Хантингтона; травмы головы; ишемического нейронального повреждения; эксцитотоксического нейронального повреждения; эпилепсии; удара; травмы спинного мозга; психосоциальной недоразвитости; синдрома эутиреоидной слабости; синдрома несоответствующего антидиаретического гормона; ожирения; химических зависимостей и аддикций; симптомов лекарственной и алкогольной абстиненции; бесплодия; рака; мышечных спазмов; недержания мочи; гипогликемии и иммунных дисфункций; включающих в себя иммунные дисфункции, вызванные стрессом,подавление иммунитета и инфекции вируса иммунодефицита человека; и вызванных стрессом инфекций у человека и животных. Соединения по настоящему изобретению также считаются ингибиторами КВГ связывающего белка и, таким образом, пригодны при лечении расстройств, лечение которых может быть осуществлено или лечению которого может способствовать ингибирование этого белка. Примерами таких расстройств являются болезнь Альцгеймера и ожирение. Краткое изложение сущности изобретения Настоящее изобретение относится к соединениям формулы где пунктирные линии представляют собой возможные двойные связи; А является азотом или CR7; В являетсяG является азотом или CR4 и связан простой связью со всеми атомами, к которым он присоединен, или G является углеродом и связан двойной связью с К; К является CR6, когда он связан двойной связью с G или Е; либо К является С=O илиCR6R12, когда он связан простой связью с обоими соседними атомами кольца;D и Е, каждый независимо, является С=O,кислородом, CR4R6 или NR8, когда связан простой связью с обоими соседними атомами кольца, либо азотом или CR4, когда связан двойной связью с соседним атомом кольца; 6-членное кольцо, которое содержит D, Е,К и G, может содержать от одной до трех двойных связей, от нуля до двух гетероатомов, выбранных из кислорода и азота, и от нуля до двух С=O групп, где атомы углерода таких групп являются частью кольца, а атомы кислорода являются заместителями на кольце;R1 является C1-С 6 алкилом, возможно замещенным одним или двумя заместителями,независимо выбранными из гидрокси, фторо-,хлоро-, бромо-, иодо-, С 1-С 4 алкокси, CF3,-С(=O)(С 1-С 4 алкила), -С(=O)-O-(С 1-С 4)алкила,-ОС(=O)(С 1-С 4 алкила), -ОС(=O)N(С 1-С 4 алкил)-SO2(С 1-С 4 алкила), где каждая из С 1-С 4 алкильных групп в ранее упомянутых R1 группах может возможно содержать одну или две двойные связи;R2 является С 1-С 12 алкилом, который может возможно содержать от одной до трех двойных или тройных связей, арилом или (С 1-С 4 алкилен) арилом, где указанный арил и арильная группировка указанного (С 1-С 4 алкилен)арила выбраны из фенила, пиридила и тиазолила; С 3-С 8 циклоалкилом или(С 1-С 6 алкилен)(С 3-С 8 циклоалкилом), где один или два атома углерода указанного циклоалкила и 5-8-членных циклоалкильных группировок указанного (С 1-С 6 алкилен)(С 3-С 8 циклоалкила) могут возможно и независимо быть заменены атомом кислорода или серы, и где каждая из ранее упомянутых R2 групп может возможно быть замещена заместителями, в количестве от одного до трех, независимо выбранными из хлоро-, фторо-, гидрокси и С 1-С 4 алкила, или одним заместителем, выбранным из С 1-С 6 алкокси, -ОС(=О)(С 1-С 6 алкила),-ОС(=О)N(С 1-С 4 алкил)(С 1-С 2 алкила),амино,-NH(С 1-С 2 алкила), -N(С 1-С 2 алкил)(С 1-С 4 алкила),-N(С 1-С 4 алкил)-СО-(С 1-С 4 алкила), -NНСО(С 1-С 4 алкила), -СОNН(С 1-С 4 алкила), -СОN(С 1-С 4 алкил)(С 1-С 2 алкила) и -SО 2(С 1-С 4 алкила);R3 является водородом или С 1-С 4 алкилом; каждый R8 и R12 независимо выбран из водорода и С 1-С 2 алкила; каждый R4 и R6, который присоединен к атому углерода, независимо выбран из водорода, С 1-С 6 алкила и хлоро-;R5 является замещенным фенилом, где указанный фенил замещен заместителями в ко 002607 4 личестве от двух до четырех, независимо выбранными из С 1-С 6 алкила;R7 является водородом или метилом;R11 является водородом или С 1-С 4 алкилом; при условии, что в кольце, содержащем D,Е, К и G формулы I, не может быть двух двойных связей, соседних друг к другу; при дополнительном условии, что если (1) В является NR1R2, и NR1R2 не образует кольцо или образует гетероарильное кольцо, содержащее азот, или если (2) В является CR1R2R10, иCR1R2R10 не образует кольцо или образует арильное или гетероарильное кольцо, или если(3) В является OCR1R2R10, и CR1R2R10 является алкилом, то бициклическое ядро, содержащее А,D, Е, К и G, не может представлять собойR4 или R6 является водородом или алкилом,R5 является фенилом, пиридилом или пиримидилом,R3 является водородом или алкилом, иR8 является водородом или алкилом, за исключением того, что соединение формулы I может представлять собой 8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-3,4-дигидро-1 Н-пиридо[2,3-b]пиразин-2-он; 8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-1,2,3,4-тетрагидропиридо[2,3-b] пиразин; 8-(1-этилпропокси)-1,6-диметил-4-(2,4,6 триметилфенил)-3,4-дигидро-1 Н-пиридо[2,3-b] пиразин-2-он; 8-(1-этилпропокси)-1,6-диметил-4-(2,4,6 триметилфенил)-1,2,3,4-тетрагидропиридо[2,3b]пиразин; или фармацевтически приемлемую соль такого соединения,и фармацевтически приемлемым солям таких соединений. Примерами более конкретных воплощений формулы I являются следующие, где Х является кислородом или NR8, где R8 является таким, как определено выше, каждая пунктирная линия обозначает возможную двойную связь, и (R)n представляет собой заместители, в количестве от нуля до четырех, где такие заместители являются такими, как определено выше в определении формулы I. Более конкретные воплощения этого изобретения включают в себя соединения формулыI, где В является -CHR1R2, -NR1R2, -NHCHR1R2,-OCHR1R2 или -SCHR1R2, a R1 является С 1-С 6 алкилом, который может возможно быть замещен одной гидрокси, фторо-, CF3 или С 1-С 4 алкоксигруппой и может возможно содержать одну двойную связь; а R2 является бензилом или С 1-С 6 алкилом, который может возможно содержать одну двойную или тройную связь, где ука 002607 6 занный С 1-С 6 алкил и фенильная группировка указанного бензила могут возможно быть замещены одним фторо-, гидрокси, С 1-С 2 алкилом,С 1-С 2 алкокси или группой хлоро-. Другие более конкретные воплощения этого изобретения включают в себя соединения формулы I, где В представляет собой или содержит NR1R2 или CR1R2R10 группировку, которая образует насыщенное или ненасыщенное 5 членное карбоциклическое кольцо, где один из атомов углерода кольца может быть замещен атомом кислорода или серы. Другие более конкретные воплощения изобретения включают соединения формулы I,где R3 является метилом или этилом; каждый изR4, R6, R8 и R12 независимо является водородом или метилом; и R5 является ди- или тризамещенным фенилом, где заместители в количестве до трех могут быть независимо выбраны из С 1-С 4 алкила. Другие более конкретные воплощения изобретения включают соединения формулы I,где А является N, СН или ССН 3. Другие более конкретные воплощения изобретения включают соединения формулы I,где G является N. Другие более конкретные воплощения изобретения включают соединения формулы I,где G является углеродом и кольцо, содержащееD, Е, К и G, является бензольным кольцом. Другие более конкретные воплощения изобретения включают соединения формулы I,где G является N; D является NH илиN(метилом); и ЕК является СН 2-СН 2, СН=СН,С(O)-СН 2 или СН 2-С(O). Другие более конкретные воплощения изобретения включают соединения формулы I,где G является N и DEK является С(O)-OСН 2, СН 2-O-СН 2, С(O)-СН 2-СН 2, С(O)-СН=СН,СН 2-СН 2-СН 2-, СН 2-СН 2-С(O), СН=СН-С(O),СН=СН-СН 2, CH=CH-NH или СН=СН-NСН 3. Примерами предпочтительных соединений по изобретению являются 4-(бутилэтиламино)-2,6-диметил-8-(2,4,6 триметилфенил)-5,8-дигидро-6 Н-пиридо[2,3-d]пиримидин-7-он; 8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-3,4-дигидро-1 Н-пиридо[2,3-b]пиразин-2-он; 8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-1,2,3,4-тетрагидропиридо[2,3-b] пиразин; 4-(1-этилпропокси)-2-метил-8-(2,4,6-триметилфенил)хинолин; 5-(1-этилпропокси)-7-метил-1-(2,4,6-триметилфенил)-1,4-дигидро-2 Н-3-окса-1,8-диазанафталин; 5-(1-этилпропокси)-7-метил-1-(2,4,6-триметилфенил)-1,2-дигидро-3-окса-1,8-диазанафталин-4-он;(1-этилпропил)-[2-метил-8-(2,4,6-триметилфенил)хинолин-4-ил]амин. Другими примерами соединений формулы 9 8-(этилпропиламино)-6-метил-4-(2,4,6-триметилфенил)-1,2,3,4-тетрагидропиридо[2,3b]пиразин; 8-(бутилэтиламино)-6-метил-4-(2,4,6-триметилфенил)-1,2,3,4-тетрагидропиридо[2,3-b] пиразин; 4-(1-гидроксиметилпропокси)-2-метил-8(2,4,6-триметилфенил)хинолин; 4-(1-гидроксиметилпропиламино)-2-метил 8-(2,4,6-триметилфенил)хинолин; 4-(1-этилпропиламино)-2-метил-8-(2,4,6 триметилфенил)хинолин; 4-диэтиламино-2-метил-8-(2,4,6-триметилфенил)хинолин; 4-(этилпропиламино)-2-метил-8-(2,4,6-триметилфенил)хинолин; 4-(бутилэтиламино)-2-метил-8-(2,4,6-триметилфенил)хинолин; 5-(1-гидроксиметилпропокси)-7-метил-1(2,4,6-триметилфенил)-1,4-дигидро-2 Н-3-окса 1,8-диазанафталин; 5-(1-гидроксиметилпропиламино)-7-метил 1-(2,4,6-триметилфенил)-1,4-дигидро-2 Н-3-окса 1,8-диазанафталин; 5-(1-этилпропиламино)-7-метил-1-(2,4,6 триметилфенил)-1,4-дигидро-2 Н-3-окса-1,8 диазанафталин; 5-диэтиламино-5-метил-1-(2,4,6-триметилфенил)-1,4-дигидро-2 Н-3-окса-1,8-диазанафталин; 5-(этилпропиламино)-7-метил-1-(2,4,6-триметилфенил)-1,4-дигидро-2 Н-3-окса-1,8-диазанафталин; и 5-(бутилэтиламино)-6-метил-4-(2,4,6-триметилфенил)-1,4-дигидро-2 Н-3-окса-1,8-диазанафталин. Изобретение также относится к фармацевтической композиции для лечения, предупреждения или ингибирования (а) расстройства, лечение которого может быть осуществлено антагонизированием КВФ или лечению которого может способствовать антагонизирование КВФ,включая, но не ограничиваясь расстройствами,вызванными КВФ или которым способствовал КВФ, или (б) расстройства, выбранного из воспалительных расстройств, таких как ревматоидный артрит и остеоартрит, боль, астма, псориаз и аллергии; расстройства генерализованной тревоги; паники; фобий; обсессивно-компульсивного расстройства; посттравматического стрессового расстройства; расстройств сна, вызванных стрессом; перцепции боли, такой как фибромиалгия; эмоциональных расстройств, таких как депрессия, включая сильную депрессию, однократную эпизодическую депрессию, повторяющуюся депрессию, детскую депрессию, вызванную злоупотреблениями, эмоциональные расстройства, связанные с предменструальным синдромом, и послеродовую депрессию; дистимии; биполярных расстройств, циклотимии; синдрома хронической усталости; головной боли, вызванной стрессом; рака; синдрома раздраженно 002607 10 го кишечника, гранулематозной болезни (болезни Крона); слизистого колита; послеоперационного илеуса; язвы; диареи, вызванной стрессом лихорадки; инфекций вируса иммунодефицита человека (ВИЧ); нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона; желудочнокишечных заболеваний; расстройств приема пищи, таких как анорексия и нервно-психическая булимия; геморрагического стресса; хмических зависимостей и аддикций (например зависимостей от алкоголя, никотина, кокаина, героина,бензодиазепинов, или других лекарственных препаратов); симптомов лекарственной и алкогольной абстиненции; вызванных стрессом психотических эпизодов; синдрома эутиреоидной слабости; синдрома несоответствующего антидиаретического гормона (АДГ); ожирения; бесплодия; травм головы; травмы спинного мозга,ишемического нейронального поражения (например, церебральной ишемии, такой как церебральная гиппокампальная ишемия); эксцитотоксического нейронального повреждения; эпилепсии; удара; иммунных дисфункций, включающих в себя иммунные дисфункции, вызванные стрессом (например, синдром стресса свиньи, лихорадка крупного рогатого скота, вызванная перевозкой, конская пароксизмальная фибрилляция и дисфункции, вызванные безвыгульным содержанием у цыплят, стресс у овец,вызванный стрижкой, или стресс у собак, связанный сo взаимодействием человек-животное); мышечных спазмов; недержания мочи; старческой деменции Альцгеймеровского типа; мультиинфарктной деменции; бокового амиотрофического склероза; гипертензии; тахикардии; застойной сердечной недостаточности; остеопороза; преждевременных родов; и гипогликемии, у млекопитающего, включая человека, которая содержит количество соединения формулы I или его фармацевтически приемлемой соли,которое эффективно при лечении такого расстройства, и фармацевтически приемлемый носитель. Изобретение относится также к способу лечения, предупреждения или ингибирования(а) расстройства, лечение которого может быть осуществлено антагонизированием КВФ или лечению которого может способствовать антагонизирование КВФ, включая, но не ограничиваясь расстройствами, вызванными КВФ или которым способствовал КВФ, или (б) расстройства, выбранного из воспалительных расстройств, таких как ревматоидный артрит и остеоартрит, боль, астма, псориаз и аллергии; расстройства генерализованной тревоги; паники; фобий; обсессивно-компульсивного расстройства; посттравматического стрессового расстройства; расстройств сна, вызванных стрессом; перцепции боли, такой как фибромиалгия; эмоциональных расстройств, таких как депрессия, включая сильную депрессию, однократную 11 эпизодическую депрессию, повторяющуюся депрессию, детскую депрессию, вызванную злоупотреблениями, эмоциональные расстройства, связанные с предменструальным синдромом, и послеродовую депрессию; дистимии; биполярных расстройств, циклотимии; синдрома хронической усталости; головной боли, вызванной стрессом; рака; синдрома раздраженного кишечника, гранулематозной болезни (болезни Крона); слизистого колита; послеоперационного илеуса; язвы; диареи; вызванной стрессом лихорадки; инфекций вируса иммунодефицита человека (ВИЧ); нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона; желудочнокишечных заболеваний; расстройств приема пищи, таких как анорексия и нервно-психическая булимия; геморрагического стресса; вызванных стрессом психотических эпизодов, синдрома эутиреоидной слабости; синдрома несоответствующего антидиаретического гормона (АДГ); ожирения; бесплодия; травм головы; травмы спинного мозга, ишемического нейронального поражения (например церебральной ишемии,такой как церебральная гиппокампальная ишемия); эксцитотоксического нейронального повреждения; эпилепсии, удара; иммунных дисфункций, включая иммунные дисфункции, вызванные стрессом (например, синдром стресса свиньи, лихорадка крупного рогатого скота,вызванная перевозкой, конская пароксизмальная фибрилляция и дисфункции, вызванные безвыгульным содержанием у цыплят, стресс у овец, вызванный стрижкой, или стресс у собак,связанный сo взаимодействием человек-животное); мышечных спазмов; недержания мочи; старческой деменции Альцгеймеровского типа; мультиинфарктной деменции; бокового амиотрофического склероза; химических зависимостей и аддикций (например, зависимостей от алкоголя, никотина, кокаина, героина, бензодиазепинов или других лекарственных препаратов); симптомов лекарственной и алкогольной абстиненции; гипертензии; тахикардии; застойной сердечной недостаточности; остеопороза; преждевременных родов; и гипогликемии, у млекопитающего, включая человека, при котором субъекту, нуждающемуся в указанном лечении,вводят количество соединения формулы I или его фармацевтически приемлемой соли, которое является эффективным при лечении таких расстройств. Это изобретение также относится к способу лечения или предупреждения расстройства или состояния, лечение или предупреждение которого может быть осуществлено ингибированием КВГ связывающего белка или лечению которого может способствовать ингибирование КВГ связывающего белка, у млекопитающего,включая человека, при котором указанному млекопитающему вводят количество соединения формулы I или его фармацевтически прием 002607 12 лемой соли, ингибирующее КВГ связывающий белок. Это изобретение также относится к фармацевтической композиции для лечения или предупреждения расстройства или состояния, лечение или предупреждение которых может быть осуществлено ингибированием КВГ связывающего белка или лечению которого может способствовать ингибирование КВГ связывающего белка, у млекопитающего, включая человека,содержащей ингибирующее КВГ связывающий белок количество соединения формулы I, или его фармацевтически приемлемой соли, и фармацевтически приемлемый носитель. Это изобретение включает в себя все оптические изомеры и другие стереоизомеры соединений формулы I. Когда такие соединения содержат один или более чем один хиральный центр, понятно, что изобретение включает в себя рацемические смеси, а также индивидуальные энантиомеры и диастереомеры таких соединений и их смеси. Соединения по этому изобретению включают в себя соединения, идентичные соединениям, описанным выше, но при условии, что один или более атомов водорода, азота или углерода замещены их изотопами (например изотопами трития или углерода-14). Такие соединения пригодны, как средства для исследований и диагностики при фармакокинетических изучениях метаболизма и в тестах на связывание. Подробное описание изобретения Следующие соединения, имеющие формулы от II до V, пригодны как промежуточные при синтезе соединений формулы I. В вышеуказанных соединениях формул IIV Т является хлоро-, бромо-, йодо- или-СОО(С 0-С 4 алкил), и A, D, Е, К, G, R3 и R5 являются такими, как определено выше по отношению к формуле I. Способы получения соединений и композиций по этому изобретению описаны ниже. В последующем обсуждении и схемах реакций отIV и V, если не указано иначе, являются такими,как определено выше.-NR1R2 или -NHCR1R2R11, могут быть получены путем взаимодействия соединения формулы II,где Т является хлоро-, бромо- или йодо-, с соединением формулы ВН, в присутствии основания, в присутствии или в отсутствие металлоорганического соединения, такого как Cu(I)X, где Х является хлоро-, бромо- или йодо-, или кислоты (такой как пара-ТзОН (Тз=тозил) или другой стерически затрудненный фенол), или эквивалентного агента, известного специалистам. Подходящие для этой реакции растворители включают в себя ДМСО, НМП и ТГФ. Избыток ВН может быть использован как реагент и как основание. Могут также быть использованы другие основания, такие как карбонат калия или натрия, триалкиламин, (C1-С 4 алкоксид) калия или натрия, или гидрид натрия. Когда R7 является электрон-акцепторной группой, такой как-СОО(C1-С 4 алкил) или CN, реакцию обычно проводят при температуре между приблизительно комнатной температурой и приблизительно 130 С. Когда R7 является не-электронакцепторной группой, температура реакции может обычно варьировать от приблизительно 50 С до приблизительно 270 С и давление может обычно варьировать от приблизительно 27,58 кПа (4 фунтов/кв.дюйм) до приблизительно 2,07 МПа (300 фунтов/кв.дюйм). Можно использовать реактор давления. 17 Альтернативно, соединения формулы I могут быть получены путем взаимодействия соединения формулы II, где Т является бромо- или йодо-, с 1 эквивалентом или избытком ВН, и основанием, таким как карбонат натрия или калия, или (С 1-С 4 алкоксид) натрия или калия, в присутствии катализатора палладия(II) или палладия(0), такого как Pd(OAc)2 или Рd(РРh3)4,вместе с рацемическим или хиральным фосфино агентом, таким как 2,2-бис(дифенилфосфино)1,1-бинафтил (БИНАФ). Альтернативно, заранее приготовленный Рd(II) (БИНАФ) может быть использован непосредственно в подходящем инертном (например, инертном по отношению к реакции, выполняемой в настоящий момент) растворителе, таком как толуол, ксилол, или диоксан или сульфолан, при температуре от приблизительно комнатной температуры до приблизительно 180 С, предпочтительно при приблизительно температуре дефлегмации. Соединения формулы I, где В является-OCR1R2R11, -SCR1R2R11 или -NHCR1R2R11, могут быть получены путем взаимодействия соединений формулы II, где Т является хлоро-,бромо- или йодо-, с соединением формулы ВН в присутствии основания, которое способно депротонировать ВН (например, гидрид натрия или калия, или металлоорганическое основание,такое как диизопропиламид натрия, бис(триметилсилил)амид натрия, диизопропиламид лития,бис(триметилсилил)амид лития, C1-С 4 алкоксид натрия или н-бутиллитий), в подходящем инертном растворителе, таком как тетрагидрофуран,ацетонитрил, диметилсульфоксид, ацетон, C2-С 5 спирт, хлороформ, бензол, ксилол, толуол, N,Nдиметилформамид (ДМФ), метиленхлорид, 1 метил-2-пирролидинон (НМП), или смесь двух или более вышеуказанных растворителей (например, ДМСО и ТГФ), при температуре от приблизительно 0 до приблизительно 180 С,предпочтительно от приблизительно 50 до приблизительно 180 С. Соединения формулы I, где В является-CR R OR , -CR R SR или -C(O)R2, могут быть получены из соединений формулы III, гдеW является циано, формилом или карбокси, как описано ниже. Взаимодействие соединений формулы III,где W является циано, с реактивом Гриньяра,содержащим R2 группу, приведет к образованию соответствующих соединений формулы I, где В является -COR2. Дальнейшее взаимодействие соединений формулы I, где В является COR2, с реактивом Гриньяра, содержащим R1, приведет к образованию соответствующих соединений формулы I, где В является -CR1R2OH. Взаимодействие соединений формулы III, где W является формилом, с реактивом Гриньяра, содержащим R2 группу, приведет к образованию соответствующих соединений формулы I, где В является -CHR2OH. Подходящие растворители 18 для вышеуказанных реакций Гриньяра включают в себя эфирные растворители, такие как ТГФ, эфир, диоксан и глим. Соединения формулы I, где В является-CR1R2R11 или -C(C=CR2R11)R1, могут быть получены общепринятыми способами. Например,взаимодействие соединения формулы I, где В является -CR1'R2'OH (где R1' и R2' определены как R1 и R2, соответственно, исключая то, что R1' может не быть R1 и R' может не быть R2), с кислотой, такой как концентрированная серная кислота в уксусной кислоте, или внутренней солью Бургесса, такой как метиловый эфир(карбоксисульфамоил)триэтиламмония гидроксида, приведет к образованию соединения формулы I, где В является -C(=CR2R11)R1. Гидрогенизация соединения формулы I, где В является -C(=CR2R11)R1, с применением катализатора палладия на угле (Pd/C) или катализатора оксида платины в С 1-С 4 алканольном растворителе, этилацетате, бензоле или ТГФ, приведет к образованию соединения формулы I, где В является -CHR1R2. Взаимодействие соединения формулы I, где В является -CR1R2OH с трифторидом диэтиламиносеры или трифенилфосфин/четыреххлористым углеродом в инертном органическом растворителе, таком как четыреххлористый углерод, приведет к образованию соединения формулы I, где В является -CR1R2F или -CR1R2Cl соответственно. Восстановление соединения формулы I,где В является -COR2, с боргидридом натрия в подходящем инертном растворителе, таком как(C1-С 4)алканол, приведет к образованию соединения формулы I, где В является -CHR2OH. Алкилирование соединения формулы I, где В является -CHR2OH, алкил галогенидом (таким как алкилйодид) в присутствии основания, такого как гидрид натрия (NaH), при приблизительно комнатной температуре, в инертном органическом растворителе, таком как ДМФ, эфир,ДМСО, диоксан, или ТГФ, приведет к образованию соответствующего соединения формулы I,где В является -CHR2OR1. Соединения формулы I, где В является-CHR2R10NHR1, могут быть получены общепринятыми способами, такими как гидроаминирование соответствующих соединений формулы I,где В является -C(O)R2 с подходящим амином и восстанавливающим агентом (таким как цианоборгидрид натрия, триацетоксиборгидрид натрия или тетрагидрид литий алюминия) в подходящем инертном растворителе, таком как C1 С 4 алканол или уксусная кислота. Превращение соединений формулы I, где В является -C(O)R2 в соединения формулы I, где В является -C(S)R2 может быть обеспечено использованием стандартных способов, хорошо известных специалистам (например, используя реагент Лавессона (Lawesson) или пентасульфид дифосфора (P2S5. Восстановление соединений формулы I, где В является -C(S)R2 с помощью 19 восстанавливающего агента, такого как боргидрид натрия в (C1-С 4)алканоле или тетрагидрид литий алюминия в ТГФ или эфире, при температуре от приблизительно комнатной температуры до приблизительно температуры дефлегмации, приводит к получению соответствующих соединений формулы I, где В является(таким как алкилиодид), в присутствии основания, такого как гидрид натрия, в таком инертном растворителе как ДМФ, при температуре от приблизительно комнатной температуры до приблизительно температуры дефлегмации,приведет к образованию соответствующих соединений формулы I, где В является -CHR2SR1. Соединения формулы II могут быть получены из соединений формулы IV или V, как описано ниже. Соединения формулы II, где Т является хлоро-, бромо- или йодо-, могут быть получены путем взаимодействия соединений формулы IV с РОТ 3, в количестве от одного эквивалента до избытка, где Т является хлоро-, бромо- или йодо-, в присутствии или в отсутствие ди(C1 С 4 алкил)анилина, предпочтительно диэтиланилина, с растворителем или без растворителя (такого как дихлорэтан, ДМФ, диметилсульфоксид(ДМСО) или ацетамид), при температуре от приблизительно комнатной температуры до приблизительно 180 С, предпочтительно от приблизительно 100 до приблизительно 150 С. Альтернативно, соединения формулы II, где Т является хлоро-, бромо- или йодо-, могут быть получены путем взаимодействия соответствующих соединений формулы II, где Т является-OSO2 СF3, с галогенидом натрия или калия, в подходящем инертном растворителе, таком как сульфолан, ДМСО, ДМФ или ацетонитриле, при температуре от приблизительно 60 до приблизительно 180 С. Соединения формулы II, где Т является -ОSО 2 СF3, могут быть получены взаимодействием соединений формулы IV с Tf2O в присутствии основания, такого как триэтиламин или пиридин, в подходящем инертном растворителе, таком как ТГФ, метиленхлорид, диоксан, эфир или толуол, при температуре от приблизительно 0 до приблизительно 50 С, предпочтительно от приблизительно 0 С до приблизительно комнатной температуры. Альтернативно, соединения формулы II,где Т является хлоро-, бромо- или йодо-, могут быть получены путем взаимодействия соединений формулы V с (C1-С 7 алкил)нитритом и(НМП), при температуре от приблизительно комнатной температуры до приблизительно 20 150 С, предпочтительно от приблизительно 40 до приблизительно 100 С. Соединения формулы III, где W является циано, могут быть получены путем взаимодействия соответствующих соединений формулы II,где Т является хлоро-, бромо- или йодо-, с цианидом калия, цианидом меди, цианидом натрия или цианидом ди(С 1-С 4 алкил)алюминия в подходящем инертном растворителе, таком как диметилсульфоксид, ДМФ, толуоле или ксилоле,при температуре от приблизительно комнатной температуры до приблизительно 180 С, предпочтительно при приблизительно 60 до приблизительно 150 С, в присутствии или в отсутствие-СНО или -СООН, могут быть получены путем взаимодействия соединений формулы II, где Т является бромо- или йодо-, с литийорганическим реагентом, таким как трет-BuLi, втор-BuLi или н-BuLi, в подходящем инертном растворителе, таком как ТГФ, диоксан, эфир, бензол или метиленхлорид, при температуре от приблизительно -120 С до приблизительно комнатной температуры, предпочтительно от приблизительно -110 до приблизительно -60 С, за чем следует остановка реакции с помощью подходящего электрофила, такого как ДМФ или СО 2(газ или сухой лед), для получения соединений формулы III, где W является -СНО или -СООН,соответственно. Понятно, что знание общей органической химии может применяться во всех случаях, когда нужно заменить одну из последовательностей реакций, здесь описанных. Изменение последовательности реакции основано на осуществимости конкретной реакции на конкретном этапе последовательности, например использование защитной группы на любой стадии синтеза, которая выполнима, или восстановление эфирной группы до соответствующей С 1-С 4 алкильной группы на любой удобной стадии синтеза. Соединения формулы (I), где R3 является бромо-, хлоро-, -СОО(С 1-С 4 алкилом) или-СООН, могут быть превращены в соответствующие соединения, где R3 является (С 1-С 4 алкилом), -O(С 1-С 4 алкилом), F или -S(С 1-С 4 алкилом), способами, описанными в литературе. Может не быть необходимости осуществления данного превращения на последней стадии конкретного синтеза, а скорее его может быть более удобно осуществлять на более ранней стадии. Соединения формулы I или других формул, описанных здесь, где R3 является -O-(С 1-С 4 алкилом) или -S(С 1-С 4 алкилом), могут быть получены путем взаимодействия соответствующих соединений, где R3 является хлоро-, бромоили йодо-, с нуклеофилом, таким как С 1-С 4 алканол или С 1-С 4 алкантиол, с органическим или неорганическим основанием. Подходящие основания для этой реакции включают натрий и гидрид натрия. Соединения формулы I или любых 21 других формул, описанных здесь, где R3 является фторо-, могут быть получены путем взаимодействия соответствующих соединений, где R3 является хлоро-, с фторидом тетрабутиламмония в подходящем инертном растворителе, таком как ДМСО, метиленхлорид или тетрагидрофуран. Тетрагидрофуран является предпочтительным. Температура реакции может варьировать от приблизительно комнатной температуры до приблизительно 180 С. Восстановление соединения, где R3 является эфиром, с использованием LiAlH4/AlCl3 в подходящем инертном растворителе, таком как ТГФ, эфир или диоксан, при температуре от приблизительно комнатной температуры до приблизительно 100 С,приводит к образованию соответствующего соединения, где R3 является метилом. Превращение соединений, где В является -СООН, в соответствующие соединения, где В является-CO(С 1-С 3 алкилом) может быть осуществлено при использовании хорошо известных способов. Восстановление соединений, где В является-СО(С 1-С 3 алкилом), с использованием стандартных способов, описанных в литературе,приведет к получению соединений, где R3 является одним из ряда (С 1-С 4 алкил) производных. Соединения формулы IV-a, где правая сторона шестичленного кольца представляет собой бензольное, пиридиновое, пиримидиновое или пиридазиновое кольцо, (R)n представляет собой заместители, в количестве от нуля до трех, как определено для формулы IV, а R3, R5 и R7 являются такими, как определено выше по отношению к формуле IV, могут быть получены, как показано на cхеме 1, начиная с соединений формулы VI-a, где 6-членное кольцо представляет собой бензольное, пиридиновое, пиримидиновое или пиридазиновое кольцо, (R)n представляет собой заместители, в количестве от нуля до трех, которые являются заместителями,определенными ранее для соединений формулыVII-a могут быть получены путем сочетания Сузуки (Suzuki coupling), сочетания Стилля(Stille coupling) или биарильного синтеза Уллмана (Ullman biaryl synthesis), как описано в литературе (См. Tetrahedron Lett., 37, 1043-1044,1996; Tetrahedron, 36, 3111-4, 1995; J. Chem. Soc.Chem. Commun., 2551-2553, 1995; J. Org. Chem,49, 5237-5243, 1984; Synlett, 765-766, 1995; Synlett, 207, 1992). Примерами подходящих условий реакции являются (а) взаимодействие соединений формулы VI-a, где X1 является Вr или I, сR5-B(OH)2 и основанием, таким как водный карбонат натрия, водная гидроксид натрия,Ва(ОН)2, Сs2 СО 3, К 3 РO4, 10% ТIOН, (C1-C4 алкоксид) натрия или калия, в присутствии каталитического количества (от 0,5 до 50 мол.%) соединения Pd(0) или Pd(II), вместе с рацемическим или хиральным фосфиновым лигандом,предпочтительно Pd(PPh3)4, в подходящем инертном растворителе, таком как диметокси 002607 22 этан (ДМЭ), N,N-диметилформамид (ДМФ),бензол, диметилацетамид (ДМА), C1-C6 алканол,такой как этанол, диоксан, N-метилпирролидинон (НМП) или диоксан, при температуре от приблизительно 25 до приблизительно 150 С,предпочтительно от приблизительно комнатной температуры до приблизительно 120 С. Альтернативно, соединения формулы VII-a могут быть получены при использовании способов, описанных в литературе (См. Tetrahedron,49, 49-64, 1993; Chem. Ber., 93, 2479-2484, 1960;Chem. Pharm. Bull., 31,3460-3464, 1983). Соединения формулы VIII-а могут быть получены с использованием известных способов для восстановления нитро группы до амино группы. Предпочтительным способом является гидрогенизация с использованием 5-10% палладия на угле (Pd/C), при давлении от приблизительно 96,53 кПа (14 фунтов/кв.дюйм) до приблизительно 379,21 кПа (55 фунтов/кв.дюйм),при приблизительно комнатной температуре, в инертном растворителе, таком как этилацетат,бензол, ТГФ или C1-C4 алканол. Соединения формулы IV-a могут быть получены нагреванием соединений формулы VIIIa соединения формулы Р 3-С(O)-СH(R7)-СОO(C1C2 алкила), в присутствии кислоты или кислоты Льюиса, при наличии растворителя или без него. Примерами таких условий реакции являются а) нагревание в полифосфорной кислоте; б) нагревание в толуоле, бензоле или ксилоле в присутствии кислого катализатора (такого как параТзОН, серная кислота, НСl (г, при использовании прибора ловушки Дина-Старка (Dean-Stark); и в) нагревание в подходящем растворителе,таком как дихлорэтан, Ph2O или Dowtherm А, в присутствии кислоты Льюиса, такой как SnCl4,ZnCl2/HCl или АlСl3. Соединения формулы IV-b и V-a, где правая сторона шестичленного кольца представляет собой бензольное, пиридиновое, пиримидиновое или пиридазиновое кольцо, (R)n являются заместителями, как определено в формуле IV, в количестве от одного до трех, a R3, R5 и R7 являются такими, как определено выше по отношению к формуле IV, могут быть получены, как показано на схеме 2, начиная с соединений формулы VI-b, где 6-членное кольцо представляет собой бензольное, пиридиновое, пиримидиновое или пиридазиновое кольцо, (R)n представляет собой заместители, в количестве от нуля до трех, которые являются заместителями,определенными ранее для соединений формулыIV, X1 является Вr или I, a W1 является CN,-CONH2 или -СОО(C1-C2 алкилом). Превращение соединений формулы VI-b в VIII-b может быть осуществлено способами, аналогичными способам, описанным выше для превращения соединений формулы VI-a в соединения формулы 23 Соединения формулы IV-b и V-a могут быть получены нагреванием соединений формулы VIII-b, где W1 является -СОО(C1-C2 алкилом) и CN, соответственно, с подходящимR3 С(O)СH2COO(C1-C4 алкилом), в присутствии кислоты Льюиса, такой как SnCl3, AlCl3, TiCl3 или ZnCl2 в дихлорэтане, при температуре дефлегмации, как показано на схеме 2. Основной гидролиз IV-b и V-a с гидроксидом натрия в Н 2O/(C1-C4 спирте) при температуре дефлегмации или с гидроксидом лития в воде/ТГФ или воде/диоксане при температуре между комнатной температурой до температуры дефлегмации, с последующей декарбоксилизацией путем нагревания на масляной бане при температуре от приблизительно 140 до приблизительно 180 С, дает соединения формулы IV-c и V-b,соответственно. Соединения формулы IV-d могут быть получены, как показано на схеме 3 взаимодействием соединений формулы VIII-b, где W1 является-СОО(C1-C2 алкилом) или -CONH2, c (R3CO)2O или R3COOH или R3C(ОC1-C2 алкил)3, в уксусной кислоте или в подходящем инертном органическом растворителе, таком как толуол, диоксан, ацетонитрил, метиленхлорид или хлороформ, при температуре от приблизительно 25 до приблизительно 150 С, предпочтительно при температуре дефлегмации, с последующим нагреванием в 85% фосфорной кислоте или водной кислоте, приблизительно такой как уксусная кислота, соляная кислота или серная кислота, предпочтительно 50-85% фосфорной кислоте. Альтернативно, нагревание соединений формулы VIII-b, где W1 является -СОО(C1-C2 алкилом) или -CONH2, с соединением формулыR3CONH2 при температуре от приблизительно 180 до приблизительно 230 С приведет к образованию соединения формулы IV-d. Соединения формулы V-c могут быть получены, как показано на схеме 3, путем нагревания соединений формулы VIII-b, где W1 является CN, с избытком соединения, имеющего формулу R3CONH2 при приблизительно температуре дефлегмации. Соединения формулы I-A, где Х является О, S или NR8, могут быть получены, как показано на схеме 4, начиная с соединений формулыIX. Соединения формулы X, где R4 является Н и Х является О, могут быть получены путем восстановления соответствующих соединений формулы IX, используя, например, LiAlH4, или гидрид диизобутилалюминия в ТГФ, этиловом эфире или диоксане, при температуре от приблизительно комнатной температуры до приблизительно температуры дефлегмации. Соединения формулы X, где R4 является водородом и Х является серой, могут быть получены с помощью стандартных способов, известных в литературе, для превращения -СН 2OН групп в соответствующие -CH2SH группы. Окисление соединений формулы X, где R4 является Н и Х является О с ХХП (хлорхроматом пиридиния), 002607 24 используя способы, описанные в литературе,приведет к соответствующим соединениям, содержащим формильную группу. Присоединение по Гриньяру (с использованием реактива Гриньяра формулы R4MgBr) к такой формильной группе приведет к образованию соединения формулы X, где R4 является таким, как определено ранее для формулы I. Гидроаминирование такой формильной группы с применением стандартных методов, описанных в литературе, приведет к получению соединений формулы X, гдеR4 является Н и Х является N. Альтернативно,превращение карбоновой кислоты соединений формулы IX в соответствующие -CONR8 группы, с последующим восстановлением с применением ВН 3 ДМС или LiAlH4, приведет к получению соединений формулы X, где R4 является Н и Х является NR8. Соединения формул I-А и I-С могут быть получены из соединений формул Х и IX, соответственно, как показано на схеме 4, при взаимодействии соединений формулы X, где Х является S, NR8 или О, с соединением формулыR6CHO или R6CH(OC1-C2 алкил)2 и кислым катализатором (таким как пара-ТзОН, HCl, HBr,H2SO4 или НСl) в инертном растворителе, таком как толуол, ксилол или бензол, предпочтительно толуол, с количеством воды, равном от нуля до десяти эквивалентам, при температуре от приблизительно 70 до приблизительно 160 С, в приборе Дина-Старка (Dean-Stark) или в присутствии безводного сульфата натрия. Соединения формулы I-B и I-D могут быть получены путем взаимодействия соединений формулы Х иIX соответственно, с трифосгеном или тиофосгеном и основанием, таким как триэтиламин или пиридин в инертном органическом растворителе, таком как метиленхлорид, ТГФ, диоксан,эфир, бензол, хлороформ, предпочтительно в метиленхлориде или сухом ТГФ, при температуре от приблизительно 0 до приблизительно 25 С. Соединения формулы I-G, I-Е, I-Q и I-F могут быть получены, как показано на схеме 5,начиная с соединений формулы X, где Х является ОН. Соединения формулы XI могут быть получены при взаимодействии соединений формулы Х с избытком тионилхлорида в безводном метиленхлориде при приблизительно комнатной температуре. Растворитель и избыток тионилхлорида затем удаляли и остаток реагировал с соединением, имеющим формулу Na-, К- илиLi-CR4(COOC1-C4aлкил)2 или Na-, К- или LiCR4(CN), в подходящем растворителе, таком как ДМСО, ТГФ, НМП, сульфолан, или C1-C4 алканол, при температуре от приблизительно комнатной температуры до приблизительно 100 С,предпочтительно при приблизительно комнатной температуре. Соединения формулы I-Q могут быть получены, используя стандартные способы амидной циклизации, известные в литературе. Такие способы включают в себя кислую 25 циклизацию (такую как нагревание в 40-85% фосфорной кислоте при температуре от приблизительно 100 до приблизительно 150 С; нагревание в водной уксусной кислоте/HCl, или основной гидролиз, декарбоксилирование, с последующей амидной циклизацией). Соединения формулы I-Е могут быть получены путем бромирования соединений формулы I-Q с последующим основным отщеплением (таким какDBU или DBN). Соединения формулы I-F и I-G могут быть получены путем восстановления соединений формулы I-Q и I-Е, соответственно,стандартными способами восстановления, такими как нагревание с ВН 3 ДМС или ВН 3 в ТГФ, или с LiAlH4 в ТГФ. Соединения формул от I-Н до I-L, где (R)n представляет собой заместители, в количестве от нуля до трех, такие как R4, R6, R8, R9 или R12,могут быть получены, начиная с соединений формулы XII, где Х является NR8, О или S, как показано на cхеме 6. Соединения формулы XIII могут быть получены путем взаимодействия соответствующих соединений формулы XII с ацилгалогенидом (таким как X1CH(R6)COL (X1 является хлоро-, бромо-, йодо-, мезилатом или тозилатом, a L является хлоро-, бромо- или йодо- в присутствии основания, такого как три(C1-C4 алкил)амин, пиридин или замещенный пиридин, в подходящем растворителе, таком как метиленхлорид, хлороформ, ТГФ, ДМСО, диоксан, эфир или диметоксиэтан (ДМЭ), при температурах от приблизительно 0 до приблизительно 180 С, предпочтительно от приблизительно комнатной температуры до приблизительно 60 С. Соединения формулы I-H могут быть получены путем взаимодействия соединений формулы XIII с основанием. Подходящие основания для использования в этой реакции включают натрий, гидрид натрия, гидрид калия,диизопропиламид лития, бутиллитий, бис(триметилсилил)амид лития, диизопропиламид натрия и карбонат натрия или калия. Алкилирование соединений, имеющих формулы I-H с основанием, с последующим быстрым охлаждением алкил галогенидом в подходящем растворителе,таком как эфир, ТГФ, метиленхлорид, диоксан,бензол, толуол или ДМЭ, в присутствии или в отсутствие HMPA, при температуре от приблизительно -78 С до приблизительно комнатной температуры, приведет к получению соединений формулы I-J. Подходящие для этой реакции основания включают диизопропиламид лития,бис(триметилсилил)амид лития, диизопропиламид натрия и бутиллитий. Взаимодействие соединений, имеющих формулу I-H или I-J с восстанавливающим агентом, таким как ВН 3 ДМС,ВН 3, гидридом диизобутилалюминия или гидридом литийалюминия, приведет к образованию соединений формулы I-K или I-I, соответственно. Взаимодействие соединений формулы I-H или I-J с РОСl3 или PCl5, с последующим взаи 002607R62Zn), приведет к получению соединений формулы I-I или I-K с дополнительным R6 заместителем у атома, соседнего к группировке N-R5. Соединения формул от I-M до I-P могут быть получены, как показано на cхеме 7, способами, аналогичными способам, описанным наcхеме 6. Образование двойной связи, как показано в формулах I-N, I-O и I-P, может быть достигнуто путем бромирования с последующим отщеплением, при использовании стандартных способов, известных в литературе. Альтернативно,соединения формулы I-N, I-O и I-P могут быть получены путем взаимодействия соединений формулы I-М с основанием, и путем быстрого охлаждения PhSeSePh, PhSSO2Ph, PhSSOPh,PhSSPh или эквивалентным агентом, с последующим окислением с NaIO4 и отщеплением основанием. Моноциклические пиридиновые или пиримидиновые исходные агенты, такие как соединения формул IX, Х и XIV, могут быть получены способами, аналогичными способам,описанным в РСТ Заявке РСТ/IВ 95/00373 на патент, в которой указаны США и которая была подана 18 мая 1995 года и опубликована 21 декабря 1995 года. Соли соединений формулы, полученные присоединением кислоты, могут быть получены общепринятым способом обработки раствора или суспензии соответствующего свободного основания одним химическим эквивалентом фармацевтически приемлемой кислоты. Общепринятые методики концентрирования или кристаллизации могут быть использованы для выделения солей. Примерами подходящих солей являются уксусная, молочная, янтарная, малеиновая, винная, лимонная, глюконовая, аскорбиновая, бензойная, коричная, фумаровая, серная,фосфорная, соляная, бромисто-водородная, иодисто-водородная, сульфаминовая, сульфоновые кислоты, такие как метансульфоновая, бензолсульфоновая, паратолуолсульфоновая и родственные кислоты. Соединения формулы I и их фармацевтически приемлемые соли (здесь и далее называемые собирательно как активные соединения по этому изобретению) могут быть введены отдельно или в комбинации с фармацевтически приемлемыми носителями, либо в виде разовой,либо в виде множественной дозы. Подходящие фармацевтические носители включают инертные твердые разбавители или наполнители, стерильные водные растворы, масла (например масло арахиса, масло кунжута) и различные органические растворители. Фармацевтические композиции, образованные комбинированием новых соединений формулы I и фармацевтически приемлемых носителей, могут быть затем легко введены в ряде лекарственных форм, таких как таблетки, порошки, лепешки, эмульсии, 27 масляные мягкие гели, сиропы, инъецируемые растворы и тому подобное. Эти фармацевтические композиции могут, при желании, содержать дополнительные ингредиенты, такие как корригенты, связующие агенты, эксципиенты и тому подобное. Таким образом, в целях перорального введения, таблетки, содержащие различные эксципиенты, такие как цитрат натрия,карбонат кальция и фосфат кальция, могут быть использованы вместе с различными разрыхлителями, такими как крахмал, метилцеллюлоза,альгиновая кислота и некоторые сложные силикаты, вместе со связующими агентами, такими как поливинилпирролидон, сахароза, желатин и акация. Дополнительно, смазывающие агенты,такие как стеарат магния, натрий лаурилсульфат и тальк, часто полезны для целей таблетирования. Твердые композиции подобного типа могут также быть использованы как наполнители в мягких и твердых заполняемых желатиновых капсулах. Предпочтительные для этого материалы включают в себя лактозу или молочный сахар и высокомолекулярные полиэтиленгликоли. Когда для перорального введения желательны водные суспензии или эликсиры, основной активный ингредиент в них может быть комбинирован с различными подслащивающими агентами или корригентами, красящими веществами или красками и, при желании, эмульгаторами или суспензирующими агентами, вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин и их комбинациями. Для парентерального введения могут быть использованы растворы, содержащие активное соединение по этому изобретению или его фармацевтически приемлемую соль в масле кунжута или арахиса, водном пропиленгликоле или в стерильном водном растворе. Такие водные растворы должны быть забуферены при необходимости и жидкий разбавитель сначала превращен в изотонический достаточным количеством солевого раствора или глюкозы. Эти конкретные водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. Используемые стерильные водные среды все легко доступны с помощью стандартных методов, известных специалистам. Эффективные дозировки для активных соединений по этому изобретению будут зависеть от выбранного пути введения и факторов, таких как возраст и масса пациента, что обычно известно врачу. Дозировки будут также зависеть от конкретного заболевания, подлежащего лечению. Например, суточная доза для болезней,вызванных стрессом, воспалительных расстройств, болезни Альцгеймера, желудочнокишечных заболеваний, нервно-психической анорексии, геморрагического стресса и симптомов лекарственной и алкогольной абстиненции,будет обычно варьировать от приблизительно 28 0,1 до приблизительно 50 мг/кг массы тела пациента, подлежащего лечению. Способы, которые могут быть использованы для определения активности активных соединений этого изобретения и их фармацевтически приемлемых солей, как антагонистов КВФ, описаны в Endocrinology, 116, 1653-1659(1985) и в Peptides, 10, 179-188 (1985). Связывающие активности соединений формулы I, выраженные как значения IC50, обычно варьируют от приблизительно 0,5 наномолярной до приблизительно 10 микромолярной. Способы, которые могут быть использованы для определения ингибирующей КВФсвязывающий белок активности соединений формулы I, описаны в Brain Research, (1997),745 (1,2), 248-256. Настоящее изобретение иллюстрируется следующими примерами. Должно быть понятно,однако, что данное изобретение не ограничено специфическими деталями этих примеров. Точки плавления не откорректированы. Протонные спектры ядерного магнитного резонанса (1 Н ЯМР) и С 13 ядерного магнитного резонанса (С 13 ЯМР) были измерены для растворов в дейтерохлороформе (CDCl3) и положения пиков были выражены в частях на миллион (млн-1) от тетраметилсилана (ТМС). Формы спектра обозначены следующим образом: s, синглет; d, дублет; t,триплет; q, квартет; m, мультиплет; b, широкий. В примерах использованы следующие сокращения: Рh=фенил; iРr=изопропил; МСВР(1 мл) нагревали на масляной бане при 135 С в течение 15 ч. Реакционную смесь быстро охлаждали водой и экстрагировали этил ацетатом. Органический слой сушили и концентрировали для получения 114 мг сырого вещества. Очистка на колонке с силикагелем при использовании смеси 5% этилацетата в гексане, как элюента,приводила к получению 50 мг указанного в заголовке соединения в виде бесцветного масла. 1[2,3-b]пиразин-2-он. К охлажденному раствору 2-хлор-N-[4-(1 этилпропокси)-6-метил-2-(2,4,6-триметилфениламино)пиридин-3-ил]ацетамида (40 мг, 0,099 ммоль) в сухом ТГФ добавили 1,0 М бис 29 триметилсилиламида лития (LiN(SiМе 3)2) в ТГФ(0,3 мл, 0,3 ммоль) при -78 С и перемешивали при этой температуре в течение 1 ч, затем нагревали до комнатной температуры в течение 30 мин. Смесь быстро охлаждали водой и экстрагировали этилацетатом. Органический слой сушили и концентрировали до получения 38 мг указанного в заголовке соединения в виде желто-коричневых кристаллов. Кристаллы очищали колоночной хроматографией на силикагеле, используя смесь 5% этилацетата в гексане как элюент с получением 29 мг (81%) указанного в заголовке соединения в виде белых кристаллов,т.пл. 179-181 С. 1[2,3-b]пиразин-2-она (13 мг, 0,0354 ммоль) и 2 М комплекса борана диметилсульфида (ВН 3 ДМС)(0,044 мл, 0,0884 ммоль) в 2 мл сухого ТГФ нагревали при температуре дефлегмации в течение 2 ч. Смесь быстро охлаждали 0,2 мл метанола и 0,2 мл концентрированной соляной кислоты(НСl) и полученную смесь перемешивали при комнатной температуре в течение 2 ч, а затем концентрировали до сухого состояния. Остаток разводили водой, нейтрализовали насыщенным бикарбонатом натрия и экстрагировали этил ацетатом. Органический слой промывали рассолом, сушили и концентрировали до получения 14,7 мг указанного в заголовке соединения в виде коричневых кристаллов. Кристаллы очищали колоночной хроматографией на силикагеле, используя смесь 10% этилацетата в гексане как элюент, с получением 9 мг указанного в заголовке соединения в виде бесцветного масла. 1[2,3-b]пиразин-2-она (50 мг, 0,136 ммоль) с температурой -78 С в 3 мл сухого ТГФ добавляли 1,0 М LiN[Si(СН 3)3]2 в ТГФ (0,14 мл, 0,14 ммоль) при температуре -78 С. После перемешивания при этой температуре в течение 20 мин, реакционную смесь нагревали до комнатной температуры и перемешивали при комнатной температуре в течение ночи. Смесь быстро охлаждали водой и насыщенным хлоридом аммония и экстрагировали этилацетатом. Органический экстракт промывали рассолом, сушили и концен 002607 30 трировали до получения 51 мг золотистого масла. Масло очищали колоночной хроматографией на силикагеле, используя смесь 10% этилацетата в гексане как элюент, с получением 41 мг (79%) указанного в заголовке соединения в виде золотистого масла. 1(5,8 мг,52,7 ммоль) в сухом ТГФ (5 мл) добавляли гидрид натрия (NaH) по частям в течение периода в 10 мин. Добавляли раствор 4-хлор-2-метил-8(2,4,6-триметилфенил)хинолина(4,0006 г,13,52 ммоль) в сухом ТГФ (10 мл). После перемешивания при комнатной температуре, также как для 10 мин, добавляли 15 мл сухого ДМСО. Полученную смесь нагревали при 12 С на масляной бане в течение 1,5 ч. Смесь быстро охлаждали водой и экстрагировали ЭтОАс. Органический слой отделяли, высушивали, фильтровали и концентрировали до получения указанного в заголовке соединения в виде 5,002 г желтого твердого вещества. 1(s, 3 Н), 2,36 (s, 3H), 1,89 (s, 6H), 1,84 (m, 4H),1,02 (t, 6H) млн-1. Желтое вещество получали как соответствующую соль HCl и концентрировали до сухого состояния. Остаток растирали в порошок с гексаном до получения грязно-белого вещества. Твердое вещество перекристаллизовывали из ЭтОАс с получением 4,020 г (78%) белых кристаллов, т.пл. 153-156 С. 1(79 мг, 0,231 ммоль), 37% водного формальдегида (0,1 мл) и пара-ТзОН (22 мг, 0,116 ммоль) в 10 мл толуола нагревали при температуре дефлегмации, используя прибор Дина-Старка(Dean-Stark) в течение 3 ч. Смесь разводили водой и экстрагировали этилацетатом. Органический слой отделяли, высушивали и концентрировали до получения 100 мг сырого вещества. Сырое вещество очищали колоночной хроматографией на силикагеле, используя смесь 2% метанола в хлороформе как элюент, с получением 40 мг (50%) указанного в заголовке соединения в виде прозрачного масла. 31 Н ЯМР (СDСl3)6,90 (s, 2H), 6,04 (s, 1H),4,87 (2 набора s, 4H), 4,16 (m, 1H), 2,28 (s, 3 Н),2,19 (s, 3H), 2,14 (s, 6H), 1,67 (m, 4H), 0,94 (t, 6H) млн-1. Пример 7. 5-(1-Этилпропокси)-7-метил-1(2,4,6-триметилфенил)-1,2-дигидро-3-окса-1,8 диазанафталин-4-он. Указанное в заголовке соединение получали способом, аналогичным способу, описанному в примере 6, начиная с 4-(1-этилпропокси)-6 метил-2-(2,4,6-триметилфениламино)никотиновой кислоты до получения указанного в заголовке соединения в виде масла. 1[2,3-b]пиразин-2-она (50 мг, 0,131 ммоль) и 2 М ВН 3 ДМС (0,16 мл, 0,32 ммоль) в 3 мл сухого ТГФ нагревали при температуре дефлегмации в течение 3 ч. Смесь быстро охлаждали 0,5 мл 1HHCl и полученную смесь перемешивали при комнатной температуре в течение 20 мин, затем концентрировали до сухого состояния. Остаток быстро охлаждали водой, нейтрализовали насыщенным бикарбонатом натрия и экстрагировали этилацетатом. Органический слой промывали рассолом, высушивали и концентрировали до получения 38 мг указанного в заголовке соединения в виде коричневых кристаллов. Кристаллы очищали колоночной хроматографией на силикагеле, используя смесь 10% этилацетата в гексане как элюент, с получением 22 мг указанного в заголовке соединения в виде бесцветного масла. 1(m, 4H), 0,99 (t, 6H) млн-1. Пример 9. (1-Этилпропил)-[2-метил-8(2,4,6-триметилфенил)хинолин-4-ил]амин. Смесь 4-бром-2-метил-8-(2,4,6-триметилфенил)хинолина (130 мг, 0,365 ммоль), 1 этилпропиламина (0,13 мл, 1,095 ммоль),Pd(OAc)2 (1,7 мг, 0,073 ммоль), БИНАФ (4,55 мг, 0,0073 ммоль) и трет-бутоксида натрия (49 мг, 0,51 ммоль) в 2 мл толуола нагревали при 130-150 С на масляной бане в течение 5 ч. Смесь быстро охлаждали водой и экстрагировали изопропиловым эфиром. Органический экстракт сушили и концентрировали до получения 160 мг сырого вещества. Сырое вещество очищали колоночной хроматографией на силикагеле, с использованием смеси от 5 до 15% метанола в хлороформе как элюент, с получением 78 мг (62%) указанного в заголовке соединения в виде светло-желтого масла. 1(m, 1H), 2,42 (s, 3 Н), 2,36 (s, 3 Н), 1,90 (s, 6H),1,6-1,8 (m, 4H), 1,20 (t, 6H) млн-1. Соответствующую соль HCl получали в виде светложелтого твердого вещества. 1 Н ЯМР (СDСl3)9,87 (brs, 1H), 9,80 (s,1H), 9,62 (d, 1H), 7,62 (t, 1H), 7,44 (d, 1H), 6,33(s, 1H), 3,62 (m, 1H), 2,55 (s, 3H), 2,37 (s, 3 Н),2,34 (s, 3 Н), 2,15 (m, 4H), 1,87 (s, 6H), 0,97 (t, 6H) млн-1. Пример 10. 2-метил-4-(тетрагидрофуран-3 илокси)-8-(2,4,6-триметилфенил)хинолин. Указанное в заголовке соединение получали в виде светло-желтого твердого вещества,начиная с 3-гидрокситетрагидрофурана и 4 хлор-2-метил-8-(2,4,6-триметилфенил)хинолина,используя процедуру, аналогичную процедуре,описанной в примере 5. 1(m, 2H), 6,96 (s, 2H), 6,49 (s, 1H), 5,13 (m, 1H),4,14 (d, 2H), 3,8-4,1 (m, 4H), 2,51 (s, 3 Н), 2,36 (s,3 Н), 2,15-2,20 (m, 2H), 1,89 (s, 6H) млн-1. Пример 11. 5-(1-Этилпропокси)-7-метил-1(2,4,6-триметилфенил)-3,4-дигидро-1 Н-[1,8]нафтиридин-2-он. Смесь диметилового эфира 2-[4-(1 этилпропиламино)-6-метил-2-(2,4,6-триметилфениламино)пиридин-3-илметил]малоновой кислоты (100 мг, 0,219 ммоль), 85% фосфорной кислоты (3 мл) и воды (3 мл) нагревали при температуре дефлегмации в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и экстрагировали этилацетатом. Органический слой промывали рассолом, сушили над безводным MgSO4,фильтровали и концентрировали до сухого состояния до получения 91 мг прозрачного масла. Масло очищали колоночной хроматографией на силикагеле, используя смесь 10% метанола(t, 6H) млн-1. Пример 12. 5-(1-Этилпропиламино)-7 метил-1-(2,4,6-триметилфенил)-3,4-дигидро-1 Н[1,8]нафтиридин-2-он. Указанное соединение получали в виде желто-коричневого твердого вещества, т.пл. 124-126 С, используя способ, аналогичный способу, описанному в примере 11, начиная с диметилового эфира 2-[4-(этилпропиламино)-6 метил-2-(2,4,6-триметилфениламино)пиридин-3 илметил]малоновой кислоты и водной фосфорной кислоты. 1[2,3-d]пиримидин-2-он. К смеси 3-аминометил-4-N-(1-этилпропил)-6-метил-2-N-(2,4,6-триметилфенил)пиридин-2,4-диамина (100 мг, 0,293 ммоль) в сухом ТГФ добавляли трифосген (34 мг, 0,114 ммоль) при 0 С. Реакционную смесь оставляли постепенно нагреваться до комнатной температуры и перемешивали в течение 1 ч. Смесь быстро охлаждали водой и экстрагировали этилацетатом. Органический слой высушивали и концентрировали до сухого состояния до получения 100 мг (92,5%) желто-коричневого твердого вещества. Вещество очищали колоночной хроматографией на силикагеле, используя в качестве элюента градиент от 20 до 40% ЭтОАц в гексане, с получением 75 мг (69,4%) указанного в заголовке соединения в виде белого кристаллического вещества, т.пл. 258-260 С. 1(t, 6H) млн-1. Пример 14. 4-(1-Этилпропокси)-2,6 диметил-8-(2,4,6-триметилфенил)-8 Н-птеридин 7-он. К раствору 6-(1-этилпропокси)-2-метил-4N-(2,4,6-триметилфенил)пиримидин-4,5-диамина (100 мг, 0,305 ммоль) в 2 мл этанола добавляли пировиноградную кислоту (30 мг, 0,335 ммоль) и полученную смесь нагревали при температуре дефлегмации в течение 1 ч. Добавляли дополнительные 60 мг пировиноградной кислоты и полученную смесь нагревали при температуре дефлегмации в течение ночи. Смесь быстро охлаждали водой и экстрагировали хлороформом. Органический слой промыли водой и рассолом, высушивали над сульфатом натрия,фильтровали и концентрировали до получения масляного остатка. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента градиент от гексана до смеси 15% этилацетата в гексане, с получением указанного в заголовке соединения в виде желтого твердого вещества. 1H ЯМР (СDСl3)6,99 (s, 2H), 5,39 (m,1H), 2,61 (s, 3 Н), 2,40 (s, 3 Н), 2,35 (s, 3 Н), 1,88 (s,6H), 1,7-1,9 (m, 4H), 0,99 (t, 6H) млн-1. Пример 15. 5-(1-Этилпропокси)-7-метил-1(2,4,6-триметилфенил)-1,2,3,4-тетрагидро-[1,8] нафтиридин. Указанное в заголовке соединение получали с 86% выходом в виде прозрачного масла способом, аналогичным способу, описанному в примере 8, начиная с 5-(1-этилпропокси)-7-метил-1-(2,4,6-триметилфенил)-3,4-дигидро-1 Н[1,8]нафтиридин-2-она и ВН 3 ДМC в ТГФ.(250 мг, 0,763 ммоль) и пировиноградной кислоты (67 мг, 0,763 ммоль) в 8 мл ЭтОН нагревали при температуре дефлегмации в течение ночи. Реакционную смесь охлаждали с образованием светло-желтого кристаллического осадка, который фильтровали до получения 83 мг указанного в заголовке соединения, т.пл. 215217 С. Фильтрат концентрировали до сухого состояния с получением дополнительных 200 мг желаемого продукта в виде желтого твердого вещества. 1H ЯМР (CDCl3)6,93 (s, 3 Н), 6,56 (s, 1 Н),4,31 (m, 1H), 2,35 (s, 3 Н), 2,34 (s, 6H), 2,30 (s,3H), 1,76 (m, 4H), 0,97 (t, 6H) млн-1. Соединения, указанные в заголовке примеров 19 и 20, были получены, начиная с [2-(4 бром(или хлор)-2,6-диметилфениламино)-4-(1 этилпропокси)-6-метилпиридин-3-ил]метанола и 37% водного формальдегида, используя процедуру, аналогичную процедуре, описанной в примере 6. Пример 19. 1-(4-Бром-2,6-диметилфенил)5-(1-этилпропокси)-7-метил-1,4-дигидро-2 Н-3 окса-1,8-диазанафталин. Исходное соединение является прозрачным маслом. 1 35 Исходное соединение является прозрачным маслом. 1(103 мг, 0,315 ммоль) в 4 мл сухого ТГФ добавляли хлорацетилхлорид (36 мг, 0,315 ммоль) и триэтиламин (32 мг, 0,315 ммоль) при 0 С. Смесь нагревали до комнатной температуры и перемешивали при комнатной температуре в течение ночи. Смесь быстро охлаждали водой и экстрагировали этилацетатом. Органический слой высушивали и концентрировали до получения 125 мг коричневого остатка. Коричневый остаток очищали колоночной хроматографией на силикагеле, используя смесь 10% этилацетата в гексане как элюент, с получением 59 мг указанного в заголовке соединения в виде желтокоричневого твердого вещества, т.пл. 79-82 С. 1(s, 2H), 2,28 (s, 3H), 2,24 (s, 3H), 2,16 (s, 6H). Получение Б. 4-Xлор-2,6-диметил-8-(2,4,6 триметилфенил)-5,8-дигидро-6 Н-пиридо[2,3-d] пиримидин-7-он. Смесь этилового эфира 3-[4-хлор-2-метил 6-(2,4,6-триметилфениламино)пиримидин-5-ил]2-метилпропионовой кислоты (173 мг, 0,46 ммоль) и пара-ТзОН (56 мг) в 10 мл толуола нагревали при температуре дефлегмации, используя прибор ловушку Дина-Старка в течение 9 ч. Смесь быстро охлаждали водой и экстрагировали этилацетатом. Органический экстракт промывали рассолом, высушивали и концентрировали до получения 184 мг сырого вещества. Сырое вещество очищали колоночной хроматографией на силикагеле, используя смесь 10% этилацетата как элюент, с получением 95 мг указанного в заголовке соединения в виде белых кристаллов, т.пл. 136-139 С, после перекристаллизации из этилового эфира. 1(607 мг, 2,88 ммоль) и метилацетацетона (607 мг, 5,75 ммоль) в полифосфорной кислоте (3 мл) нагревали при 170 С на масляной бане в течение 2,5 ч. Смесь быстро охлаждали водой и экс 002607 36 трагировали дважды хлороформом. Органический слой промывали рассолом, высушивали и концентрировали до получения указанного в заголовке соединения в виде масла. Масло откачали в вакууме, затем растерли в порошок со смесью эфира и гексана для получения 642 мг(81%) указанного в заголовке соединения в виде бежевого твердого вещества. Вещество перекристаллизовывали из этилацетата до получения бежевого твердого вещества, т.пл. 250 С. 1(2,5 мл) нагревали при 130 С на масляной бане в течение 3 ч. Смесь охлаждали и выливали в ледяную воду и экстрагировали этилацетатом. Органический слой промывали рассолом, высушивали и концентрировали до получения 350 мг сырого вещества в виде коричневого масла. Масляный остаток очищали колоночной хроматографией на силикагеле, используя хлороформ как элюент, с получением 316 мг (87%) указанного в заголовке соединения в виде желтого масла. 1(182 мг, 1,8 ммоль) в 5 мл метиленхлорида перемешивали при комнатной температуре в течение 1 ч. Смесь быстро охлаждали водой и экстрагировали хлороформом. Органический слой промывали рассолом, высушивали и концентрировали до получения 587 мг указанного в заголовке соединения в виде коричневого стекловидного тела. Вещество было сразу использовано для следующей реакции. 1H ЯМР (CDCl3)8,02 (d, 1H), 7,65 (t, 1H),7,55 (d, 1H), 7,24 (s, 1H), 6,97 (s, 2H), 2,62 (s,3H), 2,37 (s, 3H), 1,85 (s, 6H) млн-1. Получение Е. 4-Бром-2-метил-8-(2,4,6-триметилфенил)хинолин. Смесь 2-метил-8-(2,4,6-триметилфенил)хинолин-4-илового эфира трифторметансульфоновой кислоты (426 мг, 1 ммоль) и бромида калия(КВr) (809 мг, 1,1 ммоль) в смеси 1 мл сухого ДМСО и 3 мл сухого ТГФ нагревали при 120 С на масляной бане в течение 3 ч. Смесь быстро охлаждали водой, экстрагировали этилацетатом. Органический слой высушивали и концентрировали до получения 358 мг указанного в заго 37 ловке соединения в виде грязно-белого вещества. 1 где пунктирные линии представляют собой возможные двойные связи; А является азотом или CR7; В являетсяG является азотом или CR4 и связан простой связью со всеми атомами, к которым он присоединен, или G является углеродом и связан двойной связью с К; К является CR6, когда он связан двойной связью с G или Е; либо К является С=O илиCR6R12, когда он связан простой связью с обоими соседними атомами кольца;D и Е, каждый независимо, является С=O,кислородом, CR4R6 или NR8, когда связан простой связью с обоими соседними атомами кольца, либо азотом или CR4, когда связан двойной связью с соседним атомом кольца; 6-членное кольцо, которое содержит D, Е,К и G, может содержать от одной до трех двойных связей, от нуля до двух гетероатомов, выбранных из кислорода и азота, и от нуля до двух С=O групп, где атомы углерода таких групп являются частью кольца, а атомы кислорода являются заместителями на кольце;R1 является С 1-С 6 алкилом, возможно замещенным одним или двумя заместителями,независимо выбранными из гидрокси, фторо-,хлоро-, бромо-, иодо-, С 1-С 4 алкокси, СF3, -С(=O)(С 1-С 4 алкила), где каждая из С 1-С 4 алкильных групп в ранее упомянутых R1 группах может возможно содержать одну или две двойные связи;R2 является С 1-С 12 алкилом, который может возможно содержать от одной до трех двойных или тройных связей, арилом или (С 1-С 4 алкилен)арилом, где указанный арил и арильная группировка указанного (С 1-С 4 алкилен)арила выбраны из фенила, пиридила и тиазолила; С 3 С 8 циклоалкилом или (С 1-С 6 алкилен)(С 3-С 8 циклоалкилом), где один или два атома углерода 38 указанного циклоалкила и 5-8-членных циклоалкильных группировок указанного (С 1-С 6 алкилен)(С 3-С 8 циклоалкила) могут возможно и независимо быть заменены атомом кислорода или серы и где каждая из ранее упомянутых R2 групп может возможно быть замещена заместителями в количестве от одного до трех, независимо выбранными из хлоро-, фторо-, гидрокси и С 1-С 4 алкила, или одним заместителем, выбранным из С 1-С 6 алкокси, -ОС(=О)(С 1-С 6 алкила),-ОС(=О)N(С 1-С 4 алкил)(С 1-С 2 алкила),амино,-NН(С 1-С 2 алкила), -N(С 1-С 2 алкил)(С 1-С 4 алкила),-N(С 1-С 4 алкил)-СО-(С 1-С 4 алкила), -NНСО(С 1-С 4 алкила),-СОNН(С 1-С 4 алкила),-CON(С 1-С 4R3 является водородом или С 1-С 4 алкилом; каждый R8 и R12 независимо выбран из водорода и С 1-С 2 алкила; каждый R4 и R6, который присоединен к атому углерода, независимо выбран из водорода, С 1-С 6 алкила и хлоро-;R5 является замещенным фенилом, где указанный фенил замещен заместителями в количестве от двух до четырех, независимо выбранными из С 1-С 6 алкила;R7 является водородом или метилом;R11 является водородом или С 1-С 4 алкилом; при условии, что в кольце, содержащем D,Е, К и G формулы I, не может быть двух двойных связей, соседних друг с другом; при дополнительном условии, что если (1) В является NR1R2 и NR1R2 не образует кольцо или образует гетероарильное кольцо, содержащее азот, или если (2) В является CR1R2R10, иCR1R2R10 не образует кольцо или образует арильное или гетероарильное кольцо, или если(3) В является OCR1R2R10, и CR1R2R10 является алкилом, то бициклическое ядро, содержащее А,D, Е, К и G, не может представлять собой где R7 является водородом, метилом или галогено; R4 или R6 является водородом или алкилом, R5 является фенилом, пиридилом или пиримидилом, R3 является водородом или алкилом и R8 является водородом или алкилом, за исключением того, что соединение формулы I может представлять собой 8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-3,4-дигидро-1 Н-пиридо[2,3-b]пиразин-2-он; 39 8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-1,2,3,4-тетрагидропиридо[2,3-b] пиразин; 8-(1-этилпропокси)-1,6-диметил-4-(2,4,6 триметилфенил)-3,4-дигидро-1 Н-пиридо[2,3b]пиразин-2-он; 8-(1-этилпропокси)-1,6-диметил-4-(2,4,6 триметилфенил)-1,2,3,4-тетрагидропиридо[2,3b]пиразин; или фармацевтически приемлемую соль такого соединения,и фармацевтически приемлемая соль такого соединения. 2. Соединение по п.1, где В является-NR1R2, -NНСНR1R2 или -OCHR1R2, R1 является С 1-С 6 алкилом, который может возможно быть замещен одним фторо- или С 1-С 4 алкоксигруппой и может возможно содержать одну двойную связь, и R2 является С 1-С 4 алкилом или -(С 1-С 2 алкил)-СО-(С 1-С 2 алкилом), который может возможно содержать одну двойную или тройную связь. 3. Соединение по п.1, где В является-SCHR1R2, R1 является С 1-С 6 алкилом, который может возможно быть замещен одной гидрокси,циклопропилфторо-, CF3 или С 1-С 4 алкоксигруппой и может возможно содержать одну двойную связь; и R2 является бензилом или С 1 С 4 алкилом, который может возможно содержать одну двойную или тройную связь, и где указанный С 1-С 6 алкил и фенильная группировка указанного бензила могут возможно быть замещены одной фторо-, циклопропильной, гидрокси,СF3, С 1-С 2 алкильной, С 1-С 2 алкоксильной или хлорогруппой. 4. Соединение по п.1, где А является N, СH или ССН 3. 5. Соединение по п.1, где G является азотом. 6. Соединение по п.1, где G является углеродом и кольцо, содержащее D, Е, К и G, является бензольным кольцом. 7. Соединение по п.1, где G является N; и ЕК является СН 2-СН 2, СН=СН, С(O)-СН 2 или СН 2-С(O). 8. Соединение по п.1, где G является N;DEK является С(O)-O-СН 2, СН 2-O-СН 2,С(O)-СН 2-СН 2, С(O)-СН=СН, СН 2-СН 2-СН 2-,СН 2-СН 2-С(O), СН=СН-С(O), СН=СН-СН 2,CH=CH-NH, СН=СН-NСН 3. 9. Соединение по п.1, где R3 является метилом и каждый из R4, R6, R8 и R12 является водородом. 10. Соединение по п.1, где R5 является диили тризамещенным фенилом, в котором два или три заместителя независимо выбраны из С 1 С 4 алкила. 11. Соединение по п.1, где R3 является метилом или этилом и каждый R4, R6, R8 и R12 является, независимо, водородом или метилом.CHR1R2 в В является тетрагидрофурановым кольцом. 13. Фармацевтическая композиция для лечения, предупреждения или ингибирования (а) расстройства, лечение которого может быть осуществлено антагонизированием КВФ или лечению которого может способствовать антагонизирование КВФ, или (б) расстройства, выбранного из воспалительных расстройств, таких как ревматоидный артрит и остеоартрит, боль,астма, псориаз и аллергии; расстройства генерализованной тревоги; паники; фобий; обсессивно-компульсивного расстройства; посттравматического стрессового расстройства; расстройств сна, вызванных стрессом; перцепции боли, такой как фибромиалгия; эмоциональных расстройств, таких как депрессия, включая сильную депрессию, однократную эпизодическую депрессию, повторяющуюся депрессию,детскую депрессию, вызванную злоупотреблениями, эмоциональные расстройства, связанные с предменструальным синдромом, и послеродовую депрессию; дистимии; биполярных расстройств, циклотимии; синдрома хронической усталости; головной боли, вызванной стрессом; рака; синдрома раздраженного кишечника, гранулематозной болезни (болезни Крона); слизистого колита; послеоперационного илеуса; язвы; диареи; лихорадки, вызванной стрессом; инфекций вируса иммунодефицита человека (ВИЧ); нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона; желудочно-кишечных заболеваний; расстройств приема пищи, таких как анорексия и нервно-психическая булимия; геморрагического стресса; химических зависимостей и аддикций (например, зависимостей от алкоголя, кокаина, героина, бензодиазепинов,или других лекарственных препаратов); симптомов лекарственной и алкогольной абстиненции; вызванных стрессом психотических эпизодов; синдрома эутиреоидной слабости; синдрома несоответствующего антидиаретического гормона (АДГ); ожирения; бесплодия; травм головы; травмы спинного мозга, ишемического нейронального повреждения (например, церебральной ишемии, такой как церебральная гиппокампальная ишемия); эксцитотоксического нейронального повреждения; эпилепсии; удара; иммунных дисфункций, включая иммунные дисфункции, вызванные стрессом (например,синдром стресса свиньи, лихорадка крупного рогатого скота, вызванная перевозкой, конская пароксизмальная фибрилляция и дисфункции,вызванные безвыгульным содержанием у цыплят, стресс у овец, вызванный стрижкой, или стресс у собак, связанный сo взаимодействием человек-животное); мышечных спазмов; недержания мочи; старческой деменции Альцгеймеровского типа; мультиинфарктной деменции; 41 бокового амиотрофического склероза; гипертензии; тахикардии; застойной сердечной недостаточности; остеопороза; преждевременных родов; и гипогликемии, у млекопитающего, содержащая такое количество соединения по п.1,которое эффективно при лечении такого расстройства, и фармацевтически приемлемый носитель. 14. Способ лечения, предупреждения или ингибирования (а) расстройства, лечение которого может быть осуществлено антагонизированием КВФ или лечению которого может способствовать антагонизирование КВФ, или (б) расстройства, выбранного из воспалительных расстройств, таких как ревматоидный артрит и остеоартрит, боль, астма, псориаз и аллергии; расстройства генерализованной тревоги; паники; фобий; обсессивно-компульсивного расстройства; посттравматического стрессового расстройства; расстройств сна, вызванных стрессом; перцепции боли, такой как фибромиалгия; эмоциональных расстройств, таких как депрессия, включая сильную депрессию, однократную эпизодическую депрессию, повторяющуюся депрессию, детскую депрессию, вызванную злоупотреблениями, эмоциональные расстройства, связанные с предменструальным синдромом, и послеродовую депрессию; дистимии; биполярных расстройств, циклотимии; синдрома хронической усталости; головной боли, вызванной стрессом; рака; синдрома раздраженного кишечника, гранулематозной болезни (болезни Крона); слизистого колита; послеоперационного илеуса; язвы; диареи, лихорадки, вызванной стрессом; инфекций вируса иммунодефицита человека (ВИЧ); нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона; желудочно-кишечных заболеваний; расстройств приема пищи, таких как анорексия и нервнопсихическая булимия; геморрагического стресса; химических зависимостей и аддикций (например, зависимостей от алкоголя, кокаина,героина, бензодиазепинов или других лекарственных препаратов); симптомов лекарственной и алкогольной абстиненции; вызванных стрессом психотических эпизодов; синдрома эутиреоидной слабости; синдрома несоответствующего антидиаретического гормона (АДГ); ожирения; бесплодия; травм головы; травмы спинного мозга, ишемического нейронального повреждения (например, церебральной ишемии,такой как церебральная гиппокампальная ишемия); эксцитотоксического нейронального повреждения; эпилепсии; удара; иммунных дисфункций, включая иммунные дисфункции, вызванные стрессом (например, синдром стресса свиньи, лихорадка крупного рогатого скота,вызванная перевозкой, конская пароксизмальная фибрилляция и дисфункции, вызванные безвыгульным содержанием у цыплят, стресс у овец, вызванный стрижкой, или стресс у собак, 002607 42 связанный сo взаимодействием человекживотное); мышечных спазмов; недержания мочи; старческой деменции Альцгеймеровского типа; мультиинфарктной деменции; бокового амиотрофического склероза; гипертензии; тахикардии; застойной сердечной недостаточности; остеопороза; преждевременных родов; и гипогликемии, у млекопитающего, при котором нуждающемуся в указанном лечении субъекту вводят такое количество соединения по п.1, которое эффективно при лечении такого расстройства. 15. Способ лечения или предупреждения расстройства или состояния, лечение или предупреждение которого может быть осуществлено ингибированием КВГ связывающего белка или лечению или предупреждению которого может способствовать ингибирование КВГ связывающего белка, у млекопитающего, включая человека, при котором указанному млекопитающему вводят количество соединения по п.1,ингибирующее КВГ связывающий белок. 16. Фармацевтическая композиция для лечения или предупреждения расстройства или состояния, лечение или предупреждение которого может быть осуществлено ингибированием КВГ связывающего белка или лечению или предупреждению которого может способствовать ингибирование КВГ связывающего белка у млекопитающего, включая человека, содержащая количество соединения по п.1, ингибирующее КВГ связывающий белок, и фармацевтически приемлемый носитель. 17. Соединение по п.3, где G является углеродом и кольцо, содержащее D, Е, К и G, является бензольным кольцом. 18. Соединение по п.17, где R3 является метилом. 19. Соединение по п.18, где R5 является диили тризамещенным фенилом в орто- или параположениях, в котором два или три заместителя независимо выбраны из С 1-С 4 алкила. 20. Соединение по п.3, где G является N;DEK является СН 2-O-СН 2. 22. Соединение по п.21, где R3 является метилом. 23. Соединение по п.22, где R5 является диили тризамещенным фенилом в орто- или параположениях, в котором два или три заместителя независимо выбраны из С 1-С 4 алкила. 24. Соединение по п.3, где G является N; 27. Соединение по п.26, где R5 является диили тризамещенным фенилом в орто- или параположениях, в котором два или три заместителя независимо выбраны из С 1-С 4 алкила. 28. Соединение по п.3, где G является N;DEK является NН-СН 2-СН 2, NMe-CH2-CH2N-R5, NH-CH=CH-N-R5 или NСН 3-СН=СН-N-R5. 29. Соединение по п.28, где R3 является метилом. 30. Соединение по п.29, где R5 является диили тризамещенным фенилом в орто- или параположениях, в котором два или три заместителя независимо выбраны из С 1-С 4 алкила. 31. Соединение по п.3, где G является N;DEK является N=С(С 0-С 1 алкил)-С(=O), N(С 0 С 1 алкил)-С(=O)-С(С 0-С 1 алкилом), С(=O)-N(С 0 С 1 алкил)-С(=O), C(C1)=N-C(=O), С(С 0-С 1 алкил)=N-С(=O), CH2CH2CH2, CH2-СН 2-С(=O),СН 2-N(С 0-С 1 алкил)-С(=O). 32. Соединение по п.31, где R3 является метилом. 33. Соединение по п.32, где R5 является диили тризамещенным фенилом в орто- или параположениях, в котором два или три заместителя независимо выбраны из С 1-С 4 алкила. 34. Соединение по п.1, где указанное соединение является 4-(бутилэтиламино)-2,6-диметил-8-(2,4,6 триметилфенил)-5,8-дигидро-6 Н-пиридо[2,3-d] пиримидин-7-оном; 8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-3,4-дигидро-1 Н-пиридо[2,3-b]пиразин-2-оном; 8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-1,2,3,4-тетрагидропиридо[2,3-b] пиразином; 8-(1-этилпропокси)-1,6-диметил-4-(2,4,6 триметилфенил)-3,4-дигидро-1 Н-пиридо[2,3-b] пиразин-2-оном; 5-(1-этилпропокси)-7-метил-1-(2,4,6-триметилфенил)-1,4-дигидро-2 Н-3-окса-1,8-диазанафталином; 5-(1-этилпропокси)-7-метил-1-(2,4,6-триметилфенил)-1,2-дигидро-3-окса-1,8-диазанафталин-4-оном; 8-(1-этилпропокси)-1,6-диметил-4-(2,4,6 триметилфенил)-1,2,3,4-тетрагидропиридо[2,3b]пиразином; 44 5-(1-этилпропиламино)-7-метил-1-(2,4,6 триметилфенил)-3,4-дигидро-1 Н-[1,8]нафтиридин-2-оном; 5-(1-этилпропокси)-7-метил-1-(2,4,6-триметилфенил)-3,4-дигидро-1 Н-пиридо-[2,3-d]пиримидин-2-оном; 4-(1-этилпропокси)-2,6-диметил-8-(2,4,6 триметилфенил)-8-Н-птеридин-7-оном; 5-(1-этилпропокси)-7-метил-1-(2,4,6-триметилфенил)-1,2,3,4-тетрагидро-[1,8]нафтиридином; 8-(1-этилпропокси)-2,6-диметил-4-(2,4,6 триметилфенил)-4 Н-пиридо-[2,3-b]пиразин-3 оном; 4-хлор-5-(1-этилпропокси)-7-метил-1(2,4,6-триметилфенил)-1 Н-пиридо-[2,3-d]пиримидин-2-оном; 5-(1-этилпропокси)-7-метил-1-(2,4,6-триметилфенил)-1 Н-пиридо-[2,3-d]пиримидин-2,4 дионом; 1-(4-бром-2,6-диметилфенил)-5-(1-этилпропокси)-7-метил-1,4-дигидро-2 Н-3-окса-1,8 диазанафталином; 1-(4-хлор-2,6-диметилфенил)-5-(1-этилпропокси)-7-метил-1,4-дигидро-2 Н-3-окса-1,8-диазанафталином; или фармацевтически приемлемой солью такого соединения. 35. Соединение по п.1, представляющее собой 8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-3,4-дигидро-1 Н-пиридо[2,3-b]пиразин-2-он; 8-(1-этилпропокси)-6-метил-4-(2,4,6-триметилфенил)-1,2,3,4-тетрагидропиридо[2,3-b] пиразин; 8-(1-этилпропокси)-1,6-диметил-4-(2,4,6 триметилфенил)-3,4-дигидро-1 Н-пиридо[2,3-b] пиразин-2-он; 8-(1-этилпропокси)-1,6-диметил-4-(2,4,6 триметилфенил)-1,2,3,4-тетрагидропиридо[2,3b]пиразин; или фармацевтически приемлемую соль такого соединения. 36. Соединение формулы
МПК / Метки
МПК: C07D 471/04, A61P 25/28, A61K 31/517
Метки: производные, замещенные, 6,6-гетеро-бициклические
Код ссылки
<a href="https://eas.patents.su/23-2607-zameshhennye-66-getero-biciklicheskie-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные 6,6-гетеро-бициклические производные</a>
Предыдущий патент: Фунгицидные 2-метоксибензофеноны.
Следующий патент: Фармацевтические композиции, содержащие шипучую кислотно-основную пару