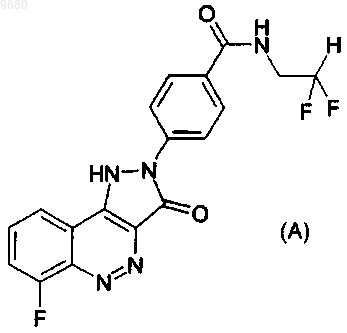
7- аминоалкилиденил-гетероциклические хинолоны и нафтиридоны
Номер патента: 14554
Опубликовано: 30.12.2010
Авторы: Сюй Сяодун, Мэсилаг Марк Дж., Грант Юджин Б.III., Сюй Сяоцин, Вейднер-Уэллс Мишель Энн, Пэджет Стивен Дэвид
Формула / Реферат
1. Соединение, имеющее структуру, представленную формулой (I)
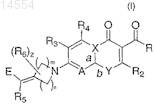
где n представляет целое число от 1 до 3;
m представляет целое число от 1 до 3;
z представляет целое число от 0 до 2;
R представляет гидрокси;
R2 представляет собой водород;
R3 и R4независимо выбраны из водорода, галогена или C1-C8алкила;
R5 выбран из водорода, галогена, циано, CO2R13, C1-C8алкила, необязательно замещенного метиленом или гидрокси;
R6 независимо выбран из C1-C8алкила, гидрокси, C1-C8алкоксиимино и галогена;
R13 представляет собой водород или C1-C8алкил;
Е выбран из группы, состоящей из:
1)
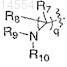
где q означает 1;
R7 и R8, каждый независимо, выбраны из водорода и C1-C8 алкила;
R9 и R10, каждый независимо, выбраны из водорода, C1-C8алкила, необязательно замещенного NH2, фенилС1-С8алкила, С2-С6ацила или C1-C8алкоксикарбонила, или альтернативно, R9 и R10 соединяются вместе, образуя гетероциклическое кольцо, содержащее атом азота, с которым они связаны, такое как 1,3-дигидро-1,3-диоксоизоиндол-2-ил, пиперидинил, пирролидинил, морфолинил, пиперазинил, необязательно замещенный бензилом или СНО;
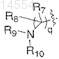
2)
![]()
где q такой, как определен выше;
R7 и R8, каждый, представляют водород;
R9 выбран из водорода или C1-C8алкоксикарбонила; и
3) С2-С8алкенила;
А выбран из N и C(R11), где R11 выбран из водорода, галогена, C1-C8алкокси, необязательно замещенного атомами галогена;
X представляет собой С, а представляет собой двойную связь и b представляет собой простую связь и
Y представляет собой N(R1), где R1выбран из (С3-С6)циклоалкила, необязательно замещенного галогеном, 6-членного арила, необязательно замещенного атомами галогена, и пиридинила, необязательно замещенного заместителями, выбранными из атомов галогена и NH2;
при условии, что если А представляет собой C(R11), X представляет собой С и Y представляет собой N(R1), тогда R11 и R1могут соединиться вместе, образуя 6-членное гетероциклическое кольцо, необязательно замещенное одной или несколькими C1-C8алкильными группами;
или его оптический изомер, диастереомер или энантиомер; его фармацевтически приемлемая соль, гидрат или пролекарство.
2. Соединение по п.1, где А представляет собой С(ОСН3), C(OCHF2), CH, CCl или N.
3. Соединение по п.1, где А представляет собой C(R11), X представляет собой С, Y представляет собой N(R1) и R11 и R1 могут соединиться вместе, образуя 6-членное гетероциклическое кольцо, необязательно замещенное одной или несколькими C1-C8алкильными группами.
4. Соединение по п.1, где Y представляет собой N(R1) и R1 выбран из (С3-С6)циклоалкила или пиридинила.
5. Соединение по п.1, где Е представляет собой
6. Соединение по п.1, где m равно 1 и n равно 1, m равно 2 и n равно 2 или m равно 1 и n равно 3.
7. Соединение по п.1, где z равно 0 или R6 представляет собой метил и z равно 1.
8. Соединение по п.4, где R7 и R8представляют собой водород.
9. Соединение по п.8, где R9 представляет собой водород, метил или этил и R10 представляет собой водород.
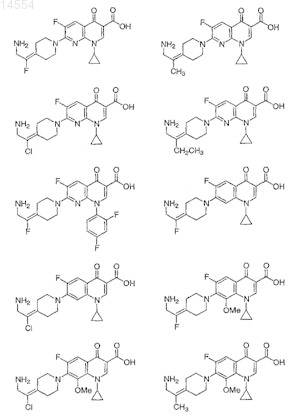
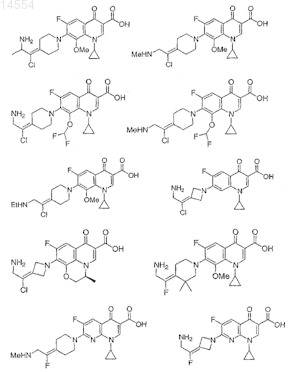
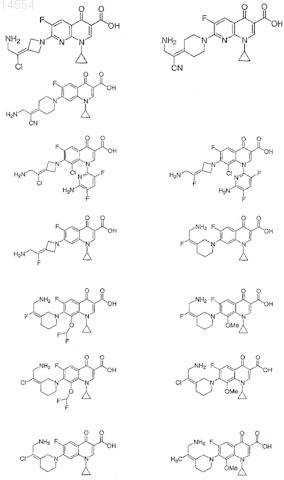
10. Соединение по п.1, выбранное из группы, состоящей из

11. Соединение по п.1, имеющее формулу
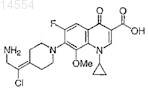
12. Соединение по п.1, имеющее формулу
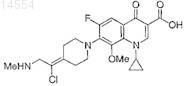
13. Соединение по п.1, имеющее формулу
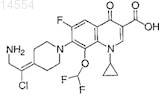
14. Способ лечения субъекта, имеющего состояние, вызванное или внесенное бактериальной инфекцией, который включает введение указанному млекопитающему терапевтически эффективного количества соединения по п.1.
15. Способ профилактики субъекта от возможного приобретения им состояния, вызванного или внесенного бактериальной инфекцией, который включает введение субъекту профилактически эффективной дозы соединения по п.1.
Текст
Настоящее изобретение относится к соединениям, имеющим структуру, представленную формулой (I), где n, m, z, R, R2, R3, R4, R5, R6, A, E, X, Y, а и b такие, как определены в формуле изобретения; или их оптическому изомеру, диастереомеру или энантиомеру; их фармацевтически приемлемой соли, гидрату или пролекарству. 014554 Перекрестная ссылка на родственную заявку Данная заявка представляет собой частичное продолжение заявки серийный номер 10/937238, поданной 9 сентября 2004 г. Область техники Данное изобретение относится к новым антимикробным соединениям, композициям, их содержащим, и применениям и тех и других. Предшествующий уровень техники В химической и медицинской литературе описываются соединения, которые, как сообщают, являются антимикробными, т.е. способными убивать или подавлять рост или репродукцию микроорганизмов,таких как бактерии. Например, такие антибактериальные средства описаны в Antibiotics, Chemotherapeutics, and Antibacterial Agents for Disease Control (M. Greyson, editor, 1982), E. Gale et al., The Molecular Basis of Antibiotic Action 2d edition (1981), Recent Research Developments in Antimicrobial AgentsChemotherapy (S.G. Pandalai, Editor, 2001), Quinolone Antimicrobial Agents (John S. Wolfson., David С. Hooper,Editors, 1989), and F. O'Grady, H.P. Lambert, R.G. Finch, D. Greenwood, Martin Dedicoat, "Antibiotic andChemotherapy, 7th edn." (1997). Механизмы действия этих антибактериальных средств различаются. Однако, как правило, считают,что они функционируют, действуя по одному или нескольким путям: ингибируя синтез или восстановление клеточных стенок (бактерий); изменяя проницаемость клеточных стенок (бактерий); ингибируя синтез белка; или ингибируя синтез нуклеиновых кислот. Например, антибактериальные средства на основе бета-лактама действуют путем ингибирования незаменимых пенициллин-связывающих белков (РВР) в бактериях, которые ответственны за синтез клеточных стенок бактерий. В качестве другого примера,хинолоны действуют, по крайней мере, частично, путем ингибирования синтеза ДНК, тем самым препятствуя репликации клеток. Фармакологические характеристики антимикробных средств и их пригодность для какого-либо заданного клинического применения различаются. Например, классы антимикробных средств (и представители внутри класса) могут различаться по 1) их относительной эффективности действия против различных типов микроорганизмов, 2) их чувствительности к развитию резистентности микроорганизмов и 3) их фармакологическим характеристикам, таким как биодоступность и биораспределение. Следовательно, выбор подходящего антимикробного средства в данной (определенной) клинической ситуации требует анализа многих факторов, включая тип вовлеченного в ситуацию организма, желаемый способ введения, место(расположение) инфекции, подлежащей лечению, и другие соображения. Однако многие такие попытки, направленные на разработку улучшенных антимикробных средств,приводят к неоднозначным результатам. В самом деле, разработано несколько антимикробных средств,которые оказались действительно клинически приемлемыми, исходя из их спектра антимикробной активности, упразднения резистентности микроорганизмов и фармакологии. Таким образом, по-прежнему сохраняется потребность в антимикробных средствах широкого спектра действия, которые были бы эффективными против резистентных микробов. Некоторые производные 1,4-дигидрохинолона, нафтиридина или родственных гетероциклических соединений, как известно в данной области, обладают антимикробной активностью и они описаны в нижеследующих ссылках: R. Albrecht Prog. Drug Research, vol. 21, p.9 (1977); J. Wolfson et al., "The Fluoroquinolones: Structures, Mechanisms of Action and Resistance, and Spectra of Activity In Vitro", Antimicrob.N1-(5-Amino-2,4-difluorophenyl) Group" J. Med. Chem., vol. 46, pp. 1905-1917 (2003); Японская патентная публикация 06263754; публикация европейской патентной заявки 487030; международная публикация патентной заявки WO0248138; международная публикация патентной заявки WO9914214; публикация патентной заявки США 2002/0049192; международная публикация патентной заявки WO02085886; публикация европейской патентной заявки 572259; международная публикация патентной заявкиWO0136408; патент США 5677456; публикация европейской патентной заявки 362759; патент США 5688791; патент США 4894458; публикация европейской патентной заявки 677522; патент США 4822801; патент США 5256662; патент США 5017581; публикация европейской патентной заявки 304087; международная публикация патентной заявки WO0136408; международная публикация патентной заявки WO02085886; японская патентная публикация 01090184; международная публикация патент-1 014554 ной заявки WO9209579; международная публикация патентной заявки WO0185728; публикация европейской патентной заявки 343524; японская патентная публикация 10130241; публикация европейской патентной заявки 413455; международная публикация патентной заявки WO0209758; международная публикация патентной заявки WO0350107; международная публикация патентной заявки WO9415933; международная публикация патентной заявки WO9222550; японская патентная публикация 07300472; международная публикация патентной заявки WO0314108; международная публикация патентной заявкиWO0071541; международная публикация патентной заявки WO0031062 и патент США 5869670.WO03050107 описывает ряд антибактериальных средств на основе дигидрохинолона, нафтиридина и родственных гетероциклических соединений. Особый интерес представляет раскрытие соединений формулы где R8 и R8' представляют собой водород, алкил, замещенный алкил, алкиламино или арилалкил, R9 представляет собой водород, алкил, алкиламино, диалкиламино, арил, арилалкил или тригалогеналкил иX представляет собой гидрокси, алкокси, ацилокси, амино или замещенную амино. Публикация европейской патентной заявки 362759 раскрывает антибактериальные средства на основе 1,4-дигидрохинолона и нафтиридина формулы где W представляет собой C1-3 алкилиден и R5 и R6 представляют собой водород или алкил. Международная публикация патентной заявки WO99/14214 и патент США 6329391 раскрывают антибактериальные средства на основе хинолона с С 7-пиперидинил, С 7-азетидинил или С 7-пирролидинилзаместителями формулы Особый интерес представляют собой те соединения, в которых R7 представляет собой амино, аминоалкил или замещенный аминоалкил и R9 выбран из водорода, (C1-C4)алкила, (C2-C6)алкенила, (C2C6)алкинила или (C3-C6) конденсированного или спироциклоалкильного кольца. В случае соединений с замещенным пиперидином в 7-положении хинолонкарбоновой кислоты среди предпочтительных заместителей находятся 3-амино-4-метил, 3-амино-4,4-диметил, 3-амино-4-спироциклопропил, 3-амино-6 циклопропил, 3-аминометил, 4-аминометил и 3-метиламино. Для соединений с замещенным пирролидином в 7-положении хинолонкарбоновой кислоты, предпочтительные заместители включают 3-(1 аминоэтил), 3-аминометил, 4-(1-аминоэтил)-2,2-диметил и 2-аминометил. Для соединений с азетидином в качестве заместителя в 7-положении хинолонкарбоновой кислоты, в число предпочтительных примеров включены соединения, имеющие заместители 3-амино, 3-аминометил и 3-(1-амино-1-метил)этил. В публикации европейской патентной заявки 241206 А 2 раскрываются соединения формулыR5R6N-(CH2)n-, в которой n равно 0 или 1 и R5 и R6 являются одинаковыми или различными и каждый представляет собой атом водорода, (C1-C3)алкильную группу или арилалкильную группу, и m равно 1 или 2, где каждый символ является таким, как определен в описании вышеупомянутой публикации. Для пиперидинового заместителя в 7-положении хинолонкарбоновой кислоты, в число предпочтительных примеров входят соединения, имеющие заместители 4-амино-3-метил, 4-метиламино-3-метил, 4 гидрокси-3-метил. Публикация европейской патентной заявки 0394553 В 1 раскрывает антивирусные соединения формулы где R21, R22 и R23, каждый, независимо представляет собой атом водорода, атом галогена, амино,(C1-C6)алкил, (C1-C8)алкокси или амино(C1-C8)алкил и два из них могут объединиться друг с другом с образованием спирокольца, и n равно 1 или 2. Публикация европейской патентной заявки 0572259 А 1 раскрывает антивирусные соединения формулы где R6 и R7 могут быть одинаковыми или различными, и каждый представляет собой атом водорода или низшую алкильную группу, m равно 0 или 1, n' равно 1 или 2, n" равно 1, 2, 3 или 4, и R8 представляет собой атом водорода, низшую алкильную группу, гидроксигруппу или низшую алкоксигруппу. В международной публикации патентной заявки WO9324479 раскрываются соединения формулы где Z представляет собой аминорадикал, R1 представляет собой водород (необязательно гидроксилированный низший алкил) радикал, ацильный радикал, полученный из карбоновой кислоты, радикал алкилкарбоновой кислоты или арилсульфокислоты или ариламинокарбонильный радикал, R2 представляет собой атом кислорода, и n равно 0 или 1. Примеры бактериальных инфекций, устойчивых к терапии антибиотиками, сообщались и раньше; но они и до настоящего времени продолжают представлять значительную опасность для здоровья людей во всем мире. Развитие резистентности микроорганизмов (возможно в результате интенсивного использования антибактериальных средств на протяжении длительного периода времени) представляет возрастающий интерес в медицинской науке. Термин "резистентность" может быть определен как существование организмов внутри популяции данного вида микробов, которые обладают меньшей чувствительностью к действию данного антимикробного средства. Эта резистентность имеет особенно важное значение в окружающих средах, таких как госпитали и частные лечебницы, где относительно высокие скорости распространения инфекции и где интенсивное использование антибактериальных средств - обычное явление. См., например, W. Sanders, Jr. et al., "Inducible Beta-lactamases: Clinical and Epidemiologic Implications for the Use of Newer Cephalosporins", Review of Infectious Diseases, p.830 (1988). Известно, что патогенные бактерии приобретают резистентность индивидуальными путями, имеющими, свой, отличный от других, механизм, включая инактивацию антибиотика бактериальными ферментами (например, -лактамазы, гидролизующие пенициллин, и цефалоспорины); удаление антибиотика, используя насосы истечения; модификация мишени антибиотика посредством мутации и генетической рекомбинации (например, резистентность к пенициллину у Neiserria gonorrhoeae); и приобретение легко переносимого гена из внешнего источника с образованием резистентной мишени (например, резистентность к метициллину у Staphylococcus-aureus). Существуют некоторые грамположительные патогенные микроорганизмы, такие как ванкомицин-резистентные Enterococcus faecium, которые резистентны к практически всем коммерчески доступным антибиотикам.-3 014554 Следовательно, существующие антибактериальные средства имеют ограниченную способность в преодолении угрозы приобретения возникновения резистентности. Поэтому было бы полезно разработать новые антибактериальные средства, которые можно было бы использовать против резистентных микробов. Краткое изложение существа изобретения Авторами был обнаружен новый ряд хинолонов и родственных соединений, которые являются эффективными против резистентных микробов и обеспечивают значительные преимущества в проявлении активности в сравнении с другими соединениями подобного типа в данной области. В частности, изобретение относится к соединениям, имеющим структуру, отвечающую формуле (I)n представляет целое число от 1 до 3;m представляет целое число от 1 до 3;z представляет целое число от 1 до 3;R3 и R4 независимо выбраны из водорода, галогена, амино, гидрокси, алкокси, алкилтио, алкила, алкенила и алкинила;R6 независимо выбран из алкила, гидрокси, алкокси, алкилтио, алкенила, алкинила, арила, алкоксиимино и галогена; или R5 и R6 соединяются вместе, образуя (4-7)членное карбоциклическое кольцо, где каждый атом углерода кольца может быть необязательно замещен R12 и этот R12 выбран из группы, состоящей из галогена, амино, гидрокси, алкокси, алкилтио, алкила, алкенила, алкинила, оксо, алкоксиимино и гидроксиимино; Е выбран из группы, состоящей из где q означает целое число от 1 до 3;R7 и R8, каждый, независимо выбран из водорода и алкила, или R7 и R8 соединяются вместе, образуя(3-6)членное карбоциклическое кольцо, или любой из R7 или R8 может быть соединен, независимо, с любым из R9 или R10, образуя гетероциклическое кольцо, содержащее атом азота, с которым связан R9 илиR10, и эти R9 и R10, каждый, независимо, выбран из водорода, алкила, ацила, алкоксикарбонила или сульфонила или альтернативно, R9 и R10 соединяются вместе, образуя гетероциклическое кольцо, содержащее атом азота, с которым они связаны;R7 и R8, каждый, независимо выбран из водорода и алкила или R7 и R8 соединяются вместе, образуяX выбран из С и N, где если X представляет собой С, а представляет собой двойную связь и b представляет собой простую связь, и если X представляет собой N, а представляет собой простую связь и b представляет собой двойную связь; иY представляет собой N(R1), тогда R11 и R1 могут соединиться вместе, образуя 6-членное гетероциклическое кольцо, или если А представляет C(R11), X представляет собой С и Y представляет собой N(R1), тогда R2 и R1 могут соединиться вместе, образуя моноциклическое или бициклическое гетероциклическое кольцо, или если А представляет собой C(R11), X представляет собой С иY представляет собой N(R1), тогда R2 и R могут соединиться вместе с образованием 5-членного гетероциклического кольца; или их оптическому изомеру, диастереомеру или энантиомеру; их фармацевтически приемлемой соли, гидрату или пролекарству. Кроме того, в данном изобретении предполагаются способы применения соединений по данному изобретению в качестве исходных продуктов. Было установлено, что соединения по данному изобретению и композиции, содержащие эти соединения, являются эффективными антимикробными средствами против обширного ряда патогенных микроорганизмов с преимуществами в проявлении активности против резистентных микробов. Соответственно, настоящее изобретение также относится к способу лечения субъекта, имеющего состояние, вызванное или внесенное бактериальной инфекцией, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы 1. Кроме того, данное изобретение относится к способу профилактики от возможного приобретения состояния, вызванного или внесенного бактериальной инфекцией, который включает введение указанному субъекту профилактически эффективной дозы фармацевтической композиции соединения формулы 1. Подробное описание изобретения Данное изобретение предлагает соединения формулы (I) Формула I где а, b, n, m, z, R, R2, R3, R4, R5, R6, A, E, X и Y такие, как определены выше в разделе "Краткое изложение существа изобретения". В связи с вышеупомянутым описанием, ниже приводятся толкования некоторых, используемых в нем, определений. Если не оговорено особо, согласно стандартной номенклатуре, используемой на протяжении описания данного изобретения, первой описывается концевая часть обозначенной боковой цепи, а затем соседняя функциональная группа по направлению к точке присоединения. Если не оговорено иначе, термины "алкил", "алкенил" и "алкинил", независимо от того, используется ли этот термин сам по себе или как часть замещающей группы, включают прямые и разветвленные цепи, содержащие от 1 до 8 атомов углерода, или любое число (атомов углерода) в этом диапазоне. Термин "алкил" относится к углеводородам с прямой или разветвленной цепью. "Алкенил" относится к углеводороду с прямой или разветвленной цепью с по крайней мере одной углерод-углеродной двойной связью. "Алкинил" относится к углеводороду с прямой или разветвленной цепью с по крайней мере одной углерод-углеродной тройной связью. Например, алкильные радикалы включают метил, этил, нпропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, 3-(2-метил)бутил, 2-пентил, 2 метилбутил, неопентил, н-гексил, 2-гексил и 2-метилпентил. "Алкокси" радикалы представляют собой кислород-содержащие простые эфиры, полученные из ранее описанных алкильных групп с прямой или разветвленной цепью. "Циклоалкильные" группы содержат от 3 до 8 углеродов в кольце и предпочтительно от 5 до 7 углеродов в кольце. Алкильная, алкенильная, алкинильная, циклоалкильная группа и алкоксигруппы могут быть независимо замещены одним или несколькими представителями группы,включая, но не ограничиваясь ими, гидроксиимино, галоген, алкил, алкенил, алкинил, циклоалкил, алкокси, оксо, алкоксиимино, арил, гетероарил, гетероцикло, CN, нитро, -OCOR13, -OR13, -SR13, -SOR13,-SO2R13, -COOR13, -NR13R14, -CONR13R14, -OCONR13R14, -NHCOR13, -NHCOOR13 и -NHCONR13R14, где R13 и R14 независимо выбраны из водорода, алкила, алкенила, алкинила, циклоалкила, арила, гетероарила,гетероцикло, арилалкила, гетероарилалкила и гетероциклоалкила, или альтернативно R14 и R15 могут соединиться вместе с образованием гетероциклического кольца, содержащего атом азота, с которым они связаны. Используемый здесь термин "ацил", независимо от того, используется ли он сам по себе или как-5 014554 часть замещающей группы, означает органический радикал, содержащий от 2 до 6 атомов углерода (разветвленная или прямая цепь), полученный из органической кислоты посредством удаления гидроксильной группы. Используемый здесь термин "Ас", независимо от того, используется ли он сам по себе или как часть замещающей группы, означает ацетил. Термин "гало" или "галоген" означает фтор, хлор, бром или иод. (Моно-, ди-, три- и пер-)галогеналкил представляет собой алкильный радикал, замещенный независимой заменой в нем атомов водорода галогеном."Арил" или "Ar" независимо от того, используется ли он сам по себе или как часть замещающей группы, представляет собой карбоциклический ароматический радикал, включая, но не ограничиваясь ими, фенил, 1- или 2-нафтил и т.п. Карбоциклический ароматический радикал может быть замещен независимой заменой 1-3 атомов водорода в нем арилом, гетероарилом, галогеном, ОН, CN, меркапто, нитро,амино, (C1-C8)алкилом, (C2-C8)алкенилом, (C1-C8)алкоксилом, (C1-C8)алкилтио, (C1-C8)алкиламино,диC1-C8)алкил)амино, (моно-, ди-, три- и пер-)галогеналкилом, формилом, карбокси, алкоксикарбонилом, (C1-C8)алкил-СО-O-, (C1-C8)алкил-CO-NH- или карбоксамидом. Иллюстративные арильные радикалы включают, например, фенил, нафтил, бифенил, фторфенил, дифторфенил, бензил, бензоилоксифенил,карбоэтоксифенил, ацетилфенил, этоксифенил, феноксифенил, гидроксифенил, карбоксифенил, трифторметилфенил, метоксиэтилфенил, ацетамидофенил, толил, ксилил, диметилкарбамилфенил и т.п. "Ph" или "РН" обозначает фенил. "Bz" означает бензоил. Термин "гетероарил", независимо от того, используется ли он сам по себе или как часть замещающей группы, относится к циклическому, полностью ненасыщенному радикалу, содержащему от пяти до десяти атомов в кольце, из которых один кольцевой атом выбран из S, О и N; 0-2 атома кольца представляют собой дополнительные гетероатомы, независимо выбранные из S, О и N; и оставшиеся атомы кольца представляют собой углероды. Радикал может быть присоединен к остатку молекулы посредством любого из атомов кольца. Типичные гетероарильные группы включают, например, пиридинил, пиразинил, пиримидинил, пиридазинил, пирролил, пиразолил, имидазолил, тиазолил, оксазолил, изоксазолил,тиадиазолил, триазолил, триазинил, оксадиазолил, тиенил, фуранил, хинолинил, изохинолинил, индолил,изотиазолил, N-оксопиридил, 1,1-диоксотиенил, бензотиазолил, бензоксазолил, бензотиенил, хинолинилN-оксид, бензимидазолил, бензопиранил, бензизотиазолил, бензизоксазолил, бензодиазинил, бензофуразанил, индазолил, индолизинил, бензофурил, циннолинил, хиноксалинил, пирролопиридинил, фуропиридинил (такой как фуро[2,3-c]пиридинил, фуро[3,2-b]пиридинил или фуро[2,3-b]пиридинил), имидазопиридинил (такой как имидазо[4,5-b]пиридинил или имидазо[4,5-c]пиридинил), нафтиридинил, фталазинил, пуринил, пиридопиридил, хиназолинил, тиенофурил, тиенопиридил и тиенотиенил. Гетероарильная группа может быть замещена независимой заменой 1-3 атомов водорода в ней арилом, гетероарилом,галогеном, ОН, CN, меркапто, нитро, амино, (C1-C8)алкилом, (C1-C8)алкоксилом, (C1-C8)алкилтио, (C1C8)алкиламино, диC1-C8)алкил)амино, (моно-, ди-, три- и пер-)галогеналкилом, формилом, карбокси,алкоксикарбонилом, (C1-C8)алкил-СО-О-, (C1-C8)алкил-CO-NH- или карбоксамидом. Гетероарил может быть замещен моно-оксо с получением, например, 4-оксо-1 Н-хинолина. Термины "гетероцикл," "гетероциклический" и "гетероцикло" относятся к необязательно замещенной, полностью насыщенной, частично насыщенной или неароматической циклической группе, которая представляет собой, например, (4-7)членную моноциклическую, (7-11)членную бициклическую или (1015)членную трициклическую кольцевую систему, которая имеет по крайней мере один гетероатом в по крайней мере одном содержащем атом углерода кольце. Каждое кольцо гетероциклической группы, содержащей гетероатом, может иметь 1, 2 или 3 гетероатома, выбранные из атомов азота, атомов кислорода и атомов серы, и эти гетероатомы азота и серы могут быть, кроме того, необязательно окислены. Атомы азота могут быть необязательно кватернизованы. Гетероциклическая группа может быть присоединена к любому гетероатому или атому углерода. Гетероциклическая группа может быть замещена независимой заменой 1-3 атомов водорода на ней арилом, гетероарилом, галогеном, ОН, CN, меркапто, нитро,амино, (C1-C8)алкилом, (C1-C8)алкоксилом, (C1-C8)алкилтио, (C1-C8)алкиламино, диC1-C8)алкил)амино,(моно-, ди-, три- и пер-)галогеналкилом, формилом, карбокси, алкоксикарбонилом, (C1-C8)алкил-СО-О-,(C1-C8)алкил-CO-NH- или карбоксамидом. Типичные моноциклические гетероциклические группы включают пирролидинил; оксетанил; пиразолинил; имидазолинил; имидазолидинил; оксазолинил; оксазолидинил; изоксазолинил; тиазолидинил; изотиазолидинил; тетрагидрофурил; пиперидинил; пиперазинил; 2-оксопиперазинил; 2 оксопиперидинил; 2-оксопирролидинил; 4-пиперидонил; тетрагидропиранил; тетрагидротиопиранил; тетрагидротиопиранил-сульфон; морфолинил; тиоморфолинил; тиоморфолинил-сульфоксид; тиоморфолинил-сульфон; 1,3-диоксолан; диоксанил; тиетанил; тииранил; 2-оксазепинил; азепинил; и т.п. Типичные бициклические гетероциклические группы включают хинуклидинил; тетрагидроизохинолинил; дигидроизоиндолил; дигидрохиназолинил (такой как 3,4-дигидро-4-оксохиназолинил); дигидробензофурил; дигидробензотиенил; бензотиопиранил; дигидробензотиопиранил; дигидробензотиопиранил-сульфон; бензопиранил; дигидробензопиранил; индолинил; хромонил; кумаринил; изохроманил; изоиндолинил; пиперонил; тетрагидрохинолинил и т.п. Термин "карбоциклический" относится к насыщенному или ненасыщенному, неароматическому,-6 014554 моноциклическому, углеводородному кольцу, содержащему от 3 до 7 атомов углерода. Замещенный арил, замещенный гетероарил и замещенный гетероцикл могут быть также замещены вторым замещенным арилом, вторым замещенным гетероарилом или вторым замещенным гетероциклом с получением, например, 4-пиразол-1-илфенила или 4-пиридин-2-илфенила. Обозначенные числа углеродных атомов (например, C1-C8 или С 1-8) относятся независимо к числу углеродных атомов в алкильной или циклоалкильной части или алкильной части большего заместителя,в котором алкил появляется в виде префиксного корня. Если не оговорено особо, то подразумевается, что определение любого заместителя или переменной в конкретном месте в молекуле не зависит от его определений в другом месте в той же молекуле. Очевидно, что специалист в данной области техники может подобрать заместители и схемы замещения на соединениях по данному изобретению таким образом, чтобы обеспечить соединения, которые будут химически стабильными и которые можно легко синтезировать способами, известными в данной области, а также теми способами, которые представлены в данном описании. Термин "гидрокси-защитная группа" относится к группам, известным в данной области для такой цели. Обычно используемые гидрокси-защитные группы раскрываются, например, в публикации Т. Н.(1991), содержание которой входит в настоящее описание посредством ссылки. Иллюстративные гидроксил-защитные группы включают, но ими не ограничиваются, тетрагидропиранил; бензил; метилтиометил; этилтиометил; пивалоил; фенилсульфонил; трифенилметил; тризамещенный силил, такой как триметилсилил, триэтилсилил, трибутилсилил, триизопропилсилил, трет-бутилдиметилсилил, три-третбутилсилил, метилдифенилсилил, этилдифенилсилил, трет-бутилдифенилсилил; ацил и ароил, такой как ацетил, бензоил, пивалоилбензоил, 4-метоксибензоил, 4-нитробензоил и арилацил. В тех случаях, когда соединения по данному изобретению имеют по крайней мере один стереогенный центр, они могут, соответственно, существовать в виде энантиомеров. В тех случаях, когда соединения обладают двумя или большим числом стереогенных центров, они могут, кроме того, существовать в виде диастереомеров. Кроме того, некоторые из кристаллических форм соединений могут существовать в виде полиморфных модификаций и такие полиморфные формы, как таковые, как подразумевают, входят в настоящее изобретения. Кроме того, некоторые из соединений могут образовывать сольваты с водой (т.е. гидраты) или обычными органическими растворителями, и такие сольваты, как предполагают,также входят в объем данного изобретения. Некоторые из соединений по данному изобретению могут иметь транс- и цис-изомеры. Кроме того,в тех случаях, когда способы получения соединений по данному изобретению приводят к получению смеси стереоизомеров, эти изомеры могут быть разделены обычными методами, такими как препаративная хроматография. Соединения могут быть получены в виде единственного стереоизомера или в рацемической форме в виде смеси некоторого числа возможных стереоизомеров. Нерацемические формы можно получить либо в результате синтеза, либо путем разделения. Соединения могут быть, например,разделены на их составляющие (раздельные) энантиомеры обычными методами, такими как образование диастереомерных пар путем солеобразования. Соединения могут быть также разделены путем ковалентного связывания с хиральным вспомогательным веществом, с последующим хроматографическим разделением и/или кристаллографическим разделением, и удалением хирального вспомогательного вещества. Альтернативно, соединения могут быть разделены, используя хиральную хроматографию. Выражение "фармацевтически приемлемая соль" обозначает одну или несколько солей свободного основания или свободной кислоты, которые обладают требуемой фармакологической активностью свободного основания или свободной кислоты, по обстановке, и которые ни биологически, ни в других отношениях не причиняют вреда. Эти соли можно получить из неорганических или органических кислот. Примерами неорганических кислот являются хлористо-водородная кислота, бромисто-водородная кислота, серная кислота или фосфорная кислота. Примерами органических кислот являются уксусная кислота, пропионовая кислота, гликолевая кислота, молочная кислота, пировиноградная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфокислота,этансульфокислота, п-толуолсульфокислота, бензолсульфокислота, салициловая кислота и т.п. Кроме того, походящими солями являются соли неорганических или органических оснований, таких как KOH,NaOH, Ca(OH)2, Al(OH)3, пиперидин, морфолин, этиламин, триэтиламин и т.п. В объем данного изобретения также включены гидратные формы соединений, которые содержат различные количества воды, например, гидратные, полугидратные и сесквигидратные формы. Кроме того, данное изобретение включает в свой объем пролекарства соединений по данному изобретению. В общем, такие пролекарства могут представлять собой функциональные производные соединений, которые легко могут превращаться in vivo в требуемое соединение. Соответственно, в способах лечения по данному изобретению, термин "введение" охватывает лечение различных описанных расстройств соединением, конкретно раскрытым в настоящем описании, или соединением, которое конкретно не раскрывается, но которое превращается in vivo в предлагаемое в данном изобретении соединение после введения пациенту. Обычные методики выбора и способы получения подходящих пролекарственных производных-7 014554 описаны, например, в "Design of Prodrugs", ed. H. Bundgaard, Elsevier, 1985. Термин "субъект" включает, без ограничения, любое животное или искусственно модифицированное животное. В качестве конкретного примера (осуществления), субъектом является человек. Термин "резистентный к лекарственному средству (лекарственно-устойчивый)" или "резистентность к лекарственному средству" относится к особенностям микроорганизма выживать в присутствии имеющегося в распоряжении в настоящее время антимикробного средства, такого как антибиотик, при его обычной эффективной концентрации. Табл. 1 содержит неограничивающий перечень предпочтительных соединений формулы I. Таблица 1 Общая реакционная схема для получения соединений При получении соединений по данному изобретению, для увеличения выхода требуемого продукта порядок синтетических стадий может варьироваться. Кроме того, для специалиста в данной области очевидно, что разумный подход к выбору реакций, растворителей и температур является важным компонентом для успешного протекания синтеза. Хотя определение оптимальных условий и т.д. носит рутинный характер, следует иметь в виду, что целый ряд соединений может быть образован способом, подобным,- 11014554 представленному на нижеприведенных схемах. Исходные продукты, используемые для получения соединений по данному изобретению, известны,они могут быть получены опубликованными синтетическими способами или являются доступными от коммерческих поставщиков (продавцов). Признается, что специалист в области органической химии может легко осуществлять обычные манипулирования с органическими соединениями без дополнительной направляющей инструкции; т.е. осуществление таких манипуляций зависит полностью от среднего уровня компетентности и практики специалиста в данной области. Эти манипулирования включают, но ими не ограничиваются, восстановление карбонильных соединений до их соответствующих спиртов, окисление, ацилирование, ароматические замещения, как электрофильные, так и нуклеофильные, этерификацию (получение простых эфиров или сложных эфиров) и омыление и т.п. Примеры этих манипуляций детально обсуждаются в обычных учебных пособиях, как, например, March, Advanced Organic Chemistry (Wiley), Carey and Sundberg, Advanced Organic Chemistry (vol.2), FeiserFeiser, Reagents for Organic Synthesis (16 vol.), L. Paquette, Encyclopedia of Reagents for Organic Synthesis (8 vol.), FrostFleming, Comprehensive Organic Synthesis (9 vol.) и т.п. Специалисту в данной области очевидно, что определенные реакции протекают наилучшим образом, когда присутствующую в молекуле другую функциональность маскируют или защищают, тем самым избегая протекания каких-либо нежелательных побочных реакций и/или повышая выход реакции. Чтобы повысить выход реакций или избежать протекания нежелательных реакций, специалист в данной области часто использует защитные группы. Примеры осуществления таких действий можно найти, например, в Т. Greene, Protecting Groups in Organic Synthesis. Общие способы получения гетероциклических соединений, используемых для получения соединений по данному изобретению, описаны в нижеследующих ссылках, которые в качестве ссылок включены в настоящее описание (включая статьи, перечень которых имеется в ссылках): патент США 6329391,публикация европейской патентной заявки 342849, международная публикация патентной заявкиWO9711068, публикация европейской патентной заявки 195316, публикация европейской патентной заявки 1031569, патент США 6025370, публикация европейской патентной заявки 153828, публикация европейской патентной заявки 191451, публикация европейской патентной заявки 153163, публикация европейской патентной заявки 230053, публикация европейской патентной заявки 976749, международная публикация патентной заявки WO 0118005, международная публикация патентной заявки WO 9407873,патент США 4777253, публикация европейской патентной заявки 421668, международная публикация патентной заявки WO 0248138, публикация европейской патентной заявки 230295, международная публикация патентной заявки WO 9914214, публикация патентной заявки США 20020049223, международная публикация патентной заявки WO 9921849, международная публикация патентной заявки WO 9729102, международная публикация патентной заявки WO 0334980, международная публикация патентной заявки WO 0209758, международная публикация патентной заявки WO 09619472, патентная публикация Германии DE 3142854, международная публикация патентной заявки WO 0334980, международная публикация патентной заявки WO 0328665, публикация европейской патентной заявки 47005,международная публикация патентной заявки WO 0311450 и публикация европейской патентной заявки 688772. Соединения по данному изобретению можно получить несколькими путями. Универсальные методологии получения соединений по данному изобретению показаны на схеме I ниже, где L представляет собой удаляемую группу, такую как фтор или хлор: и по крайней мере один из R9 и R10 представляет собой водород, может потребоваться защита концевого азота для осуществления селективного превращения в требуемый продукт (схема II). В таком случае, для маскировки концевого амина, как в соединении V, могут быть использованы обычные, защищающие амин, группы, известные специалистам в данной области техники, такие как третбутоксикарбонил (Boc), бензилоксикарбонил (Cbz), бензил (Bn), 9-флуоренилметоксикарбонил (Fmoc),аллилоксикарбонил (Alloc), 2-триметилсилилэтоксикарбонил (Teoc), N-формил, N-ацетил, N-бензоил или фталимид. После присоединения боковой цепи, защитная группа может быть удалена в обычных условиях, известных специалистам в данной области, с получением требуемого продукта VII. VII может быть в дальнейшем превращен, например, путем алкилирования, в другие соединения по данному изобретению Р= защитная группа Методологии получения соединений по данному изобретению, где X представляет собой N и Y представляет собой C(R1), показаны на схеме III ниже: и по крайней мере один из R9 и R10 представляет собой водород, может потребоваться защита концевого азота для осуществления селективного превращения в желаемый продукт (схема IV). В таком случае, для маскировки концевого амина, как в соединении V, могут быть использованы обычные, защищающие амин, группы, известные специалистам в данной области техники, такие как третбутоксикарбонил (Вос), бензилоксикарбонил (Cbz), бензил (Bn), 9-флуоренилметоксикарбонил (Fmoc),аллилоксикарбонил (Alloc), 2-триметилсилилэтоксикарбонил (Теос), N-формил, N-ацетил, N-бензоил или фталимид. После присоединения боковой цепи, защитная группа может быть удалена в обычных условиях, известных специалистам в данной области, с получением требуемого продукта XIII. XIII может быть в дальнейшем превращен, например, путем алкилирования, в другие соединения по данному изобретению XIV. Схема IV и оба R9 и R10 представляют собой водород, селективное алкилирование амина боковой цепи LXI- 14014554 может быть осуществлено путем защиты амина обычной защитной группой, такой как Boc, используя реагенты и условия, очевидные для специалистов в данной области, с получением LXII (схема XXXVI). Затем защищенный амин (LXII) обрабатывают избытком (2 эквивалентов) основания, таким как, но им не ограничиваясь, гидрид натрия, в соответствующем инертном растворителе, таком как диметилформамид или тетрагидрофуран, а затем соответствующим алкилирующим агентом R9X с получением bocзащищенного вторичного амина в виде соответствующего сложного эфира LXIII. Обычно, реакцию проводят при температурах в диапазоне от -20 до 60 С в течение от 1 до 48 ч в зависимости от реакционной способности алкилирующего агента. Обычные алкилирующие агенты включают алкилиодиды (такие как метилиодид), алкилбромиды и алкилсульфонаты. Сложный эфир LXIII может быть гидролизован в щелочных условиях с получением соответствующей карбоновой кислоты LXIV. Гидролиз сложного эфира может быть осуществлен способами, хорошо известными специалистам в данной области техники, в частности, используя основание, такое как гидроксид щелочных металлов (например, гидроксид натрия) или карбонат щелочных металлов, в подходящем растворителе, таком как вода, метанол, этанол или водно-спиртовые смеси, при температуре в диапазоне от 20 до 100 С в течение от 1 до 48 ч. Удаление амино-защитной группы в условиях, очевидных специалисту в данной области техники, дает вторичный амин LXV. В случае, когда защитной группой является Вос, для снятия защиты могут быть использованы реагенты, такие как трифторуксусная кислота, необязательно с метиленхлоридом в качестве сорастворителя, или хлористо-водородная кислота в диоксане. Схема XXXVI Р"=защитная группа Изредка, амины боковой цепи являются недостаточно реакционноспособными для введения в гетероциклические структуры (II или X) в условиях, проиллюстрированных на схемах I-IV, в частности, когда А представляет собой C(R11), где R11 представляет собой алкокси. Гетероциклическое кольцо может быть активировано по отношению к нуклеофильной атаке добавлением кислоты Льюиса, такой как, но не ограничиваясь ими, трифторид бора, триацетоксиборат и хлорид лития. Предпочтительный способ активирования описан в патенте США 5157117. Ядро хинолона обрабатывают триацетоксиборатом, полученным in situ, в растворителе, таком как, но им не ограничиваясь, уксусная кислота или пропионовая кислота, и нагревают в течение от 1 до 24 ч при температуре от 60 до 120 С. Диацилхинолинилборат(XV) выделяют фильтрацией после удаления растворителя. Схема V иллюстрирует этот предпочтительный способ активации. Схема V- 15014554 Другой предпочтительный способ активации гетероциклического кольца по отношению к нуклеофильной атаке проиллюстрирован на схеме XXXVII. В этом способе, производное хинолонкарбоновой кислоты или сложного эфира (хинолонкарбоновой кислоты) (т.е. соединение II, где R представляет собой водород или низший алкил и L представляет собой удаляемую группу) обрабатывают трифторид бораэфиратом, предпочтительно в подходящем растворителе, таком как ТГФ, в течение от 1 до 48 ч при температурах в диапазоне от 0 до 60 С. После охлаждения, продукт LXVI может быть осажден из реакционной смеси добавлением подходящего растворителя, такого как диэтиловый эфир, и хелат выделен фильтрацией полученного твердого вещества. Схема XXXVII Получение предшественника - амина III боковой цепи Схема VI иллюстрирует синтез амина III боковой цепи, где Е представляет собойR7 и R8 представляют собой водород и q равно 1. Тризамещенные или тетразамещенные алкилидены XX можно получить олефинированием по Петерсону, Виттигу или Wadsworth-Horner-Emmons соответствующим образом замещенного кетона (XVI) в растворителе, таком как, но не ограничиваясь ими,тетрагидрофуран, диметилсульфоксид или метиленхлорид, в течение от 1 до 24 ч при температуре от-78 до 120 С в присутствии основания, такого как, но ими не ограничиваясь, н-бутиллитий, гидрид натрия или карбонат калия. Полученный сложный эфир (XVII) может быть восстановлен восстановителем,таким как, но ими не ограничиваясь, диизобутилалюминийгидрид, литийтриэтилборгидрид или натрийборгидрид, в растворителе, таком как, но ими не ограничиваясь, толуол, метиленхлорид или тетрагидрофуран, в течение от 1 до 24 ч при температуре от 0 до 120 С, с получением соответствующего спиртаXVIII, где q=1. Превращение спирта XVIII в удаляемую группу XIX, такую как, но ими не ограничиваясь, хлорид, бромид, мезилат или тозилат, в обычных условиях и замещение удаляемой группы соответствующим образом замещенным амином в растворителе, таком как, но ими не ограничиваясь, диметилформамид, диметилсульфоксид или тетрагидрофуран, в течение от 1 до 24 ч при температуре от 0 С до 120 С превращает спирт XVIII в амин XX. Удаление защитной группы, Р, в обычных условиях, известных специалистам в данной области, дает амин III, где Е представляет собойR7 и R8 представляют собой водород и q равно 1. Альтернативно, непосредственное замещение спирта XVIII фталимидом и диалкилазодикарбоксилатом может быть осуществлено посредством реакции Мицунобу с получением XXI. Удаление фталимида (XXI) обработкой гидразином в растворителе,таком как метанол или этанол, приводит к получению амина (XX), где R9 и R10 представляют собой водород. Альтернативные способы снятия защиты включают обработку метиламином в метаноле или 6 н хлористо-водородной кислотой. Защитная группа Р может быть удалена с XXI в обычных условиях, известных специалистам в данной области техники, с получением амина V, где R7 и R8 представляют собой водород и R9 и Р" вместе с азотом, к которому они присоединены, образуют фталимидную группу. Специалисту в данной области очевидно, что превращение кетона XVI в олефин XVII может привести к получению геометрических изомеров (схема VI), в частности, в случае, когда XVI является асимметричным (т.е. значение m не равно n). В таком случае, геометрические изомеры могут быть разделены рядом методов, известных специалистам в данной области, включая селективную рекристаллизацию, флэш-хроматографию, высокоэффективную жидкостную хроматографию и т.п. Кроме того, должно быть очевидно, что разделение может быть осуществлено на различных стадиях способа синтеза, включая стадии получения промежуточных соединений XVII, XVIII, XIX или XXI, или альтернативно, на стадии получения конечного продукта XX. Схема XXXVIII иллюстрирует синтез амина боковой цепи LXX, где Е представляет собойR5 представляет собой циано, R7 и R8 представляют собой водород и q равно 1. Тетразамещенные алкилидены LXVII можно получить реакцией олефинирования по Wadsworth-Horner-Emmons соответствующим образом замещенного кетона (XVI) в растворителе, таком как, но не ограничиваясь ими, тетрагидрофуран, диметилсульфоксид или метиленхлорид, в течение от 1 до 24 ч при температуре от -78 С до 120 С в присутствии основания, такого как, но не ограничиваясь ими, н-бутиллитий, гидрид натрия или карбонат калия. Цианозамещенные алкенилбромиды могут быть подвергнуты реакции бром-магниевого обмена с i-PrMgBr в инертном растворителе, такой как ТГФ, при температурах в диапазоне от -78 до-20 С. Полученное магнийорганическое соединение, в виде раствора в подходящем растворителе, таком как ТГФ, может быть обработано электрофильным соединением, таким как формальдегид, необязательно стабилизированный бис(2,6-дифенилфеноксидом)метилалюминия, в подходящем растворителе, таком как метиленхлорид, в течение от 1 до 24 ч при температурах в диапазоне от -20 до 37 С, с получением спирта LXVIII. Непосредственное замещение спирта LXVIII фталимидом и диалкилазодикарбоксилатом можно осуществить реакцией Мицунобу, получая LXIX. Удаление фталимида LXIX обработкой гидразином в растворителе, таком как метанол или этанол, дает амин (LXX), где R9 и R10 представляют собой водород. Альтернативные способы снятия защиты включают обработку метиламином в метаноле или нагревание с 6 н хлористо-водородной кислотой. Защитная группа Р может быть удалена с LXX в обычных условиях, известных специалистам в данной области техники, с получением амина V, где R5 представляет собой циано, R7 и R8 представляют собой водород и R9 и Р" вместе с азотом, к которому они присоединены, образуют фталимидную группу. Р представляет собой защитную группу. Кроме того, циано группа соединения LXIX может быть превращена в альтернативные функциональные группы, такие как карбокси или алкоксикарбонил, с получением аминов LXXI или LXXII (схемаXXXIX). Например, основной гидролиз нитрила LXIX в присутствии гидроксида щелочных металлов,такого как гидроксид калия, в подходящем растворителе, таком как вода, метанол, этанол или водноспиртовые смеси, при температуре в диапазоне от 20 до 100 С в течение от 1 до 48 ч, с последующим кислотным гидролизом фталимидной группы, в присутствии, например, 6 н хлористо-водородной кислоты при температуре в диапазоне от 60 до 100 С в течение от 1 до 48 ч дает соответствующее производное аминокислоты LXXI, где R9 и R10 представляют собой водород. Альтернативно, кислотный гидролиз нитрила LXIX минеральной кислотой в присутствии спирта при температуре в диапазоне от 20 до 200 С в течение от 30 мин до 48 ч, необязательно при облучении микроволнами, дает соответствующее производное сложного эфира аминокислоты LXXII, где R9 и R10 представляют собой водород. Подходящие минеральные кислоты включают, без ограничения, серную кислоту. Подходящие спирты включают, но им не ограничиваются, этанол. Хотя схема XXXIX иллюстрирует превращение нитрила LXIX в производное аминокислоты LXXI и производное сложного эфира аминокислоты LXXII, в которых азот кольца связан с защитной группой, осуществляя вышеприведенные превращения, азот кольца можно также связать с кольцом хинолона или нафтиридона как в соединении VIII. Схема XXXIX Р представляет собой защитную группу. Схема XXII иллюстрирует превращение спиртов формулы XVIII в соединения формулы III, где Е представляет собой алкенил (LVIII). Кроме того, схема в общих чертах описывает синтез соединений формулы III, где Е представляет собойR7 и R8 представляют собой водород и R9 представляет собой ацил, алкоксикарбонил или сульфонил (LX). Окисление спирта XVIII посредством любого из ряда подходящих окислителей, таких как периодинан Десс-Мартина, реагент Кори-Кима или реагент Свема, дает соответствующий альдегид (LVI). Альдегид может быть подвергнут активируемой основанием реакции олефинирования, такой как, но не ограничиваясь ею, реакции Виттига, с получением LVII, где Rc представляет собой водород или алкил. Удаление защитной группы Р с LVII в обычных условиях, известных специалистам в данной области техники, приводит к получению амина III, где Е представляет собой алкенил (LVIII). Схема XX также иллюстрирует превращение спиртов формулы XVIII в соединения формулы III, где E представляет собойR7 и R8 представляют собой водород и R9 представляет собой ацил, алкоксикарбонил или сульфонил (LX) . Реакция спирта XVIII с ацилирующим агентом в присутствии аминного основания, такого как- 18014554 пиридин, в инертном растворителе, таком как дихлорметан, тетрагидрофуран или толуол, при температурах в диапазоне от -20 до 60 С в течение 1-48 ч дает соединения формулы III, где Е представляет собойR7 и R8 представляют собой водород и R9 представляет собой ацил (LIX). Ацилирующие агенты включают галогенангидриды (кислот), ангидриды кислот и кислоты, в присутствии активирующего агента, такого как дициклогексилкарбодиимид, EDCl, BOP-Cl, ВОР, PyBOP, и т.п. Спирты формулы XVIII могут быть превращены в соединения формулы III, где E представляет собойR7 и R8 представляют собой водород и R9 представляет собой алкоксикарбонил (LIX), реакцией с карбонилирующим агентом в присутствии аминного основания, такого как пиридин, в инертном растворителе, таком как дихлорметан, тетрагидрофуран или толуол, при температурах в диапазоне от -20 до 60 С в течение 1-48 ч. Карбонилирующие агенты включают хлорформиаты, фторформиаты, азидоформиаты и пирокарбонаты. Спирты формулы XVIII могут быть превращены в соединения формулы III, где Е представляет собойR7 и R8 представляют собой водород и R9 представляет собой сульфонил (LIX), реакцией с сульфонилхлоридом или ангидридом сульфокислоты в присутствии аминного основания, такого как пиридин, в инертном растворителе, таком как дихлорметан, тетрагидрофуран или толуол, при температурах в диапазоне от -20 до 60 С в течение 1-48 ч. Удаление защитной группы, Р, с LIX в обычных условиях, известных специалистам в данной области, дает амин III, где Е представляет собойR7 и R8 представляют собой водород и R9 представляет собой ацил, алкоксикарбонил или сульфонил (LX). Схема XXIIP представляет собой защитную группу. Схема VII иллюстрирует прямое превращение кетона XVI в олефин XX, используя активированную основанием реакцию олефинирования, такую как, но не ограничиваясь ими, способы олефинирования по Виттигу, Wadsworth-Homer-Emmons или Петерсону. Альтернативно, амин XX можно получить реакцией метатезиса олефинов, исходя из олефина XXII с концевой двойной связью, используя соответствующим образом замещенный амин XXIII. Удаление защитной группы, Р с XX в обычных условиях, известных специалистам в данной области, дает амин III, где Е представляет собой Схема VII иллюстрирует гидроксилирование XXIV с диоксидом селена с получением аллилового спирта XXV. Превращение осуществляют в растворителе, таком как, но не ограничиваясь ими, метиленхлорид, толуол или тетрагидрофуран, при температуре от 25 до 150 С, необязательно в присутствии соокислителя, такого как трет-бутилгидропероксид. Удаление защитной группы, Р с XXV в обычных условиях, известных специалистам в данной области, дает амин III, где Е представляет собой Р представляет собой защитную группу. Схема IX иллюстрирует получение ,-ненасыщенного карбонильного соединение XXVI, где R7 такой, как определен ранее, используя реакцию олефинирования по Петерсону, Виттигу или WadsworthHorner-Emmons соответствующим образом замещенного кетона (XVI) в растворителе, таком как, но не ограничиваясь ими, тетрагидрофуран, диметилсульфоксид или метиленхлорид, в течение от 1 до 24 ч при температуре от -78 до 120 С в присутствии основания, такого как, но не ограничиваясь ими, нбутиллитий, гидрид натрия или карбонат калия. Полученное карбонильное соединение (XXVI) может быть восстановлено восстановителем, таким как, но не ограничиваясь ими, диизобутилалюминийгидрид,литийтриэтилборгидрид или натрийборгидрид, в растворителе, таком как, но не ограничиваясь ими, толуол, метиленхлорид или тетрагидрофуран, в течение от 1 до 24 ч при температуре от 0 до 120 С с получением соответствующего спирта XXVII. Альтернативно, карбонильное соединение может быть подвергнуто нуклеофильному присоединению с соответствующим образом замещенным металлоорганическим соединением (R8M, где M представляет собой металл), таким как разновидность литийорганического соединения или реактив Гриньяра, с получением соответствующего спирта XXVII, где R8 представляет собой алкил. Подходящие растворители для последнего превращения включают дизтиловый эфир,тетрагидрофуран или толуол, при температуре в диапазоне от -78 до 20 С в течение от 30 мин до 48 ч. В тех случаях, когда один из R7 или R8 представляет собой водород, превращение спиртовой функциональной группы в XXVII в удаляемую группу, такую как, но не ограничиваясь ими, бромид, мезилат или тозилат, как в XXVIII, в обычных условиях и замещение удаляемой группы соответствующим образом за- 20014554 мещенным амином в растворителе, таком как, но не ограничиваясь ими, диметилформамид, диметилсульфоксид или тетрагидрофуран, в течение от 1 до 24 ч при температуре от 0 до 120 С превращает спирт XXVII в амин XXX. Удаление защитной группы, Р с XXX в обычных условиях, известных специалистам в данной области, дает амин III, где Е представляет собой и один из R7 и R8 представляет собой водород. Альтернативно, когда один из R7 и R8 представляет собой водород, прямое замещение спирта XXVII фталимидом и диалкилазодикарбоксилатом может быть осуществлено посредством реакции Мицунобу с последующим удалением фталимида гидразином в растворителе, таком как метанол или этанол, получая амин XXX. Защитную группу, Р, можно удалить сXXIX в обычных условиях, известных специалистам в данной области, с получением амина V, где R8 представляет собой водород и R9 и Р" вместе с азотом, с которым они связаны, образуют фталимидную группу. Схема IXR5 представляет собой водород, могут быть галогенированы соответствующим галогенирующим агентом, таким как, но ими не ограничиваясь, 1-бром-2,5-пирролидиндион, 1,1,1-трис(ацетилокси)-1,1 дигидро-2-бензиодоксол-3(Н)-он и бромид тетраалкиламмония или тионилхлорид, с получением XXXII. Алкилиден XXXII может быть восстановлен восстановителем, таким как, но ими не ограничиваясь, диизобутилалюминийгидрид, литийтриэтилборгидрид или натрийборгидрид, в растворителе, таком как, но ими не ограничиваясь, толуол, метиленхлорид или тетрагидрофуран, в течение от 1 до 24 ч при температуре от 0 до 120 С, получая соответствующий спирт XXXIII. Альтернативно, карбонильное соединение может быть подвергнуто нуклеофильному присоединению с соответствующим образом замещенным металлоорганическим соединением, таким как разновидность литийорганического соединения или реактив Гриньяра, с получением соответствующего спирта XXXIII, где R6 представляет собой алкил. Подходящие растворители для последнего превращения включают диэтиловый эфир, тетрагидрофуран или толуол, при температурах в диапазоне от -78 до 20 С в течение от 30 мин до 48 ч. В тех случаях, когда- 21014554 один из R7 или R8 представляет собой водород, превращение спиртовой функциональной группы вXXXIII в удаляемую группу, такую как, но не ограничиваясь ими, бромид, мезилат или тозилат, как вXXXIV, в обычных условиях и замещение удаляемой группы соответствующим образом замещенным амином в растворителе, таком как, но не ограничиваясь ими, диметилформамид, диметилсульфоксид или тетрагидрофуран, в течение от 1 до 24 ч при температуре от 0 до 120 С превращает XXXIV в амин и один из R7 и R8 представляет собой водород. Альтернативно, в тех случаях, когда R7 или R8 представляет собой водород, непосредственное замещение спирта XXXIII фталимидом и диалкилазодикарбоксилатом может быть осуществлено согласно реакции Мицунобу с последующим удалением фталимида обработкой гидразином в растворителе, таком как метанол или этанол, с получением аминаXXXVI. Защитная группа, Р, может быть удалена с XXXV в обычных условиях, известных специалистам в данной области, с получением амина V, где R8 представляет собой водород и R9 и Р" вместе с азотом, к которому они присоединены, образуют фталимидную группу. Схема X Схема XI иллюстрирует синтез амина III боковой цепи, где Е представляет собойR7 и R8 представляют собой водород и R5 представляет собой замещенный или с разветвленной цепью алкил. В схеме XI, галогенированное карбонильное соединение XXXVII, где Ra представляет собой- 22014554 водород или алкил, можно получить аналогичным способом, как и галогенированное карбонильное соединение XXXII. Карбонильное соединение XXXVII, где Ra представляет собой водород или алкил, может быть восстановлено восстановителем, таким как, но ими не ограничиваясь, диизобутилалюминийгидрид, литийтриэтилборгидрид или натрийборгидрид, в растворителе, таком как, но ими не ограничиваясь, толуол, метиленхлорид или тетрагидрофуран, в течение от 1 до 24 ч при температуре от 0 до 120 С,с получением соответствующего спирта XXXVIII, где Ra представляет собой водород или алкил, один изRb представляет собой водород и другой Rb представляет собой гидроксил. Альтернативно, карбонильное соединение XXXVII, где Ra представляет собой алкил, может быть подвергнуто нуклеофильному присоединению с соответствующим образом замещенным металлоорганическим соединением, таким как разновидность литийорганического соединения или реактив Гриньяра, с получением соответствующего спирта XXXVIII, где Ra представляет собой алкил, один из Rb представляет собой алкил и другой Rb представляет собой гидроксил. Наконец, карбонильное соединение XXXVII, где Ra представляет собой водород или алкил, или спирт XXXVIII, где Ra представляет собой водород или алкил, один из Rb представляет собой водород и другой Rb представляет собой гидроксил, могут быть фторированы, используя нуклеофильный фторирующий реагент, такой как, но не ограничиваясь ими, (Nэтилэтанаминато)трифторсера. (DAST) или бис(2-метоксиэтил)аминосера-трифторид (Deoxofluor), в подходящем растворителе, таком как метиленхлорид, в течение от 1 до 24 ч при температуре от 0 до 60 С, с получением XXXVIII, где в случае карбонильного соединения XXXVII в качестве субстрата, Ra представляет собой водород или алкил и Rb представляет собой фтор, и где в случае спирта XXXVIII в качестве субстрата, Ra представляет собой водород или алкил, один из Rb представляет собой водород и другой Rb представляет собой фтор. Галогенированный алкилиден XXXVIII может быть карбонилирован в присутствии катализатора переходных металлов, такого как, но не ограничиваясь ими, ацетат палладия,дикарбонилбис(трифенилфосфин)никель или тетракис(трифенилфосфин)палладий, в атмосфере моноксида углерода в присутствии второй добавки, такой как метанол, необязательно в качестве растворителя, или в растворителе, таком как, но не ограничиваясь ими, диметилсульфоксид или тетрагидрофуран, в течение от 1 до 24 ч при температуре от 0 до 120 С, получая сложный эфир XXXIX. XXXIX может быть восстановлен восстановителем, таким как, но не ограничиваясь ими, диизобутилалюминийгидрид, литийтриэтилборгидрид или натрийборгидрид, в растворителе, таком как, но ими не ограничиваясь, толуол, метиленхлорид или тетрагидрофуран, в течение от 1 до 24 ч при температуре от 0 до 120 С, с получением соответствующего спирта XL, где q=1. Превращение спирта XL в удаляемую группу XLI, такую как, но не ими не ограничиваясь, бромид, мезилат или тозилат, в обычных условиях и замещение удаляемой группы соответствующим образом замещенным амином в растворителе, таком как, но не ограничиваясь ими, диметилформамид, диметилсульфоксид или тетрагидрофуран, в течение от 1 до 24 ч при температуре от 0 до 120 С превращает спирт XL в амин XLIII. Удаление защитной группы, Р с XLIII в обычных условиях, известных специалистам в данной области, дает амин III, где Е представляет собойR7 и R8 представляют собой водород и R5 представляет собой CRaRaRb. Альтернативно, прямое замещение спирта XL фталимидом и диалкилазодикарбоксилатом может быть осуществлено посредством реакции Мицунобу, получая XLII. Удаление фталимида XLII обработкой гидразином в растворителе,таком как метанол или этанол, дает амин XLIII. Защитную группу, Р, можно удалить с XLII в обычных условиях, известных специалистам в данной области, с получением амина V, где R7 и R8 представляют собой водород, R9 и Р" вместе с азотом, к которому они присоединены, образуют фталимидную группу, и Схема XII иллюстрирует синтез амина боковой цепи III, где Е представляет собой один из R7 или R8 представляет собой водород и другой представляет собой алкил, R5 представляет собой замещенный или с разветвленной цепью алкил, и q равно 1. Соединение XXXVIII, полученное, как описано выше, может быть карбонилировано в присутствии катализатора переходных металлов, такого как, но не ограничиваясь ими, ацетат палладия, дикарбонилбис(трифенилфосфин)никель или тетракис(трифенилфосфин)палладий, в атмосфере моноксида углерода в присутствии металлоорганического реагента R7M, где R7 такой, как определен ранее, и включает реагенты, такие как трибутилоловогидрид или соединения алкилиндия (Organic Letters 2003, 5(7), 1103-1106), в растворителе, таком как, но не ограничиваясь ими, метанол, диметилсульфоксид или тетрагидрофуран, в течение от 1 до 24 ч при температуре от 0 до 120 С, получая XLIV, где R7 такой, как определен ранее. Карбонильное соединение XLIV может быть восстановлено восстановителем, таким как, но ими не ограничиваясь, диизобутилалюминийгидрид, литийтриэтилборгидрид или натрийборгидрид, в растворителе, таком как, но ими не ограничиваясь, толуол, метиленхлорид или тетрагидрофуран, в течение от 1 до 24 ч при температуре от 0 до 120 С,получая соответствующий спирт XLV. Альтернативно, карбонильное соединение может быть подвергнуто нуклеофильному присоединению с соответствующим образом замещенным металлоорганическим соединением, таким как разновидность литийорганического соединения или реактив Гриньяра, получая соответствующий спирт XLV, где R8 представляет собой алкил. Подходящие растворители для последнего превращения включают диэтиловый эфир, тетрагидрофуран или толуол, при температуре в диапазоне от -78 до 20 С в течение от 30 мин до 48 ч. В тех случаях, когда один из R7 или R8 представляют собой- 24014554 водород, превращение спиртовой функциональной группы в XLV в удаляемую группу, такую как, но не ограничиваясь ими, бромид, мезилат или тозилат, как в XLVI, в обычных условиях и замещение удаляемой группы соответствующим образом замещенным амином в растворителе, таком как, но ими не ограничиваясь, диметилформамид, диметилсульфоксид или тетрагидрофуран, в течение от 1 до 24 ч при температуре от 0 до 120 С превращает спирт XLV в амин XLVIII. Удаление защитной группы, Р с XLVIII в обычных условиях, известных специалистам в данной области, дает амин III, где Е представляет собой один из R7 и R8 представляют собой водород и другой представляет собой алкил, R5 представляет собой замещенный или с разветвленной цепью алкил и q равно 1. Альтернативно, в тех случаях, когда один из R7 или R8 представляет собой водород, непосредственное замещение спирта XLV фталимидом и диалкилазодикарбоксилатом может быть осуществлено посредством реакции Мицунобу с последующим удалением фталимида гидразином в растворителе, таком как метанол или этанол, приводит к получению амина XLVIII. Защитную группу, Р, можно удалить с XLVIII в обычных условиях, известных специалистам в данной области, с получением амина V, где один из R7 и R8 представляет собой водород и другой представляет собой алкил, R9 и Р вместе с азотом, к которому они присоединены, образуют фталимидную группу, R5 представляет собой замещенный или с разветвленной цепью алкил и g равно 1. Схема XII Схема XIII иллюстрирует превращение кетона XVIa в олефин LIII, используя протокол Робинсона проведения активируемой основанием реакции аннелирования с винилсиланом согласно Stork-Jung (Tetrahedron Letters, 2001, 42, 9123). Конденсация кетона XVIa с аллилиодидом XLIX, где Rc представляет собой алкильную группу и Р' представляет собой гидрокси-защитную группу (Tetrahedron Letters, 2001,42, 9123) дает алкилированный кетон L. Эпоксидирование кетона L эпоксидирующими агентами, такими как, но не ограничиваясь ими, диметилдиоксиран или м-хлорпербензойная кислота, дает оксиран LI. Протодесилилирование LI в присутствии средств, таких как, но не ограничиваясь ими, фторид тетра-нбутиламония или поли(фторид водорода)пиридиния и водная кислота, с сопутствующим размыканием- 25014554 эпоксидного кольца дает кетон LII. Аннелирование LII (образование полициклической конденсированной структуры) может быть осуществлено обработкой LII основанием, таким как, но не ограничиваясь им, метоксид натрия, с получением LIII. ,-ненасыщенный кетон LIII может быть восстановлен восстановителем, таким как, но не ограничиваясь ими, диизобутилалюминийгидрид, литийтриэтилборгидрид или натрийборгидрид, в растворителе, таком как, но не ограничиваясь ими, толуол, метиленхлорид или тетрагидрофуран, в течение от 1 до 24 ч при температуре от 0 до 120 С, получая, после удаления гидроксизащитной группы, соответствующий спирт LIV, где один из R12 представляет собой водород и другойR12 представляет собой гидрокси. Альтернативно, LIII можно подвергнуть нуклеофильному присоединению с соответствующим образом замещенным металлоорганическим реагентом, таким как разновидность литийорганического соединения или реактив Гриньяра, с получением, после удаления гидроксизащитной группы, соответствующего спирта LIV, где один из R12 представляет собой алкил, и другой R12 представляет собой гидрокси. Подходящие растворители для последнего превращения включают диэтиловый эфир, тетрагидрофуран или толуол, при температуре в диапазоне от -78 до 20 С в течение от 30 мин до 48 ч. Наконец, карбонильное соединение LIII может быть фторировано, используя нуклеофильный фторирующий реагент, такой как, но не ограничиваясь ими, (N-этилэтанаминато)трифторсера(DAST) или трифторид бис(2-метоксиэтил)аминосеры (Deoxofluor), в подходящем растворителе, таком как метиленхлорид, в течение от 1 до 24 ч при температуре от 0 до 60 С, получая после удаления гидроксизащитной группы, спирт LIV, где R12 представляет собой фтор. Схема XIII Спирт LIV может быть превращен в удаляемую группу, такую как, но не ограничиваясь ими, бромид, мезилат или тозилат, в обычных условиях. Замещение удаляемой группы соответствующим образом замещенным амином в растворителе, таком как, но не ограничиваясь ими, диметилформамид, диметилсульфоксид или тетрагидрофуран, в течение от 1 до 24 ч при температуре от 0 до 120 С превращает LIV в амин LV. Удаление защитной группы, Р с LV в обычных условиях, известных специалистам в данной области, дает соответствующий вторичный амин III, где Е представляет собойR7 и R8 представляют собой водород и R5 и R6 соединяются вместе, образуя 6-членное карбоцикли- 26014554 ческое кольцо, и q равно 1. Альтернативно, прямое замещение гидроксильной группы спирта LIV фталимидом и диалкилазодикарбоксилатом может быть осуществлено посредством реакции Мицунобу с последующим удалением фталимида гидразином в растворителе, таком как метанол или этанол, дает амин LV, где R9 и R10 представляют собой водород. Экспериментальная часть Получение предшественника - гетероциклических ядер Все гетероциклические ядра, такие как 1-циклопропил-1,4-дигидро-6,7-дифтор-8-метокси-4 оксохинолин-3-карбоновая кислота, 7-хлор-1-циклопропил-6-фтор-4-оксо-1,4-дигидронафтиридин-3 карбоновая кислота, 9,10-дифтор-2,3-дигидро-3-метил-7-оксо-7 Н-пиридо[l,2,3-de]-1,4-бензоксазин-6 карбоновая кислота, 1-циклопропил-1,4-дигидро-6,7-дифтор-4-оксохинолин-3-карбоновая кислота, 7 хлор-1-(2,4-дифторфенил)-6-фтор-4-оксо-1,4-дигидронафтиридин-3-карбоновая кислота, 1-циклопропил 1,4-дигидро-6,7-дифтор-5-метил-4-оксо-хинолинкарбоновая кислота, 1-(1R,2S)-2-фторциклопропил-1,4 дигидро-6,7-дифтор-5-метил-4-оксохинолинкарбоновая кислота, 1-(6-амино-3,5-дифтор-2-пиридинил)-8 хлор-6,7-дифтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота и 1-циклопропил-1,4-дигидро-7-фтор 8-метокси-4-оксохинолин-3-карбоновая кислота, получают согласно способам, опубликованным в литературе (см. выше обсуждение об общих способах получения гетероциклических ядер) или приобретают от коммерческих источников. Получение предшественника А - получение диацилхинолинилборатов Соединение 19 (формула XV; L=F, A=C-OMe, R1=циклопропил, R2=H, R3=F, R4=H) Диацилхинолинилбораты получают по методике, сообщаемой в патенте США 5157117. Смесь борной кислоты (2,4 г, 38,7 ммоль) уксусного ангидрида (13,8 мл, 146 ммоль) и хлорид цинка (52 мг; 0,38 ммоль) нагревают до 110 С в течение 1,5 ч, обрабатывают уксусной кислотой (51 мл) и дают возможность перемешиваться в течение дополнительного часа при 110 С. Полученной смеси дают возможность охладиться до 60 С, обрабатывают 1-циклопропил-1,4-дигидро-6,7-дифтор-8-метокси-4-оксохинолин-3 карбоновой кислотой (18) (7,3 г, 25,9 ммоль) и уксусной кислотой (26 мл). Полученный раствор нагревают до 60 С в течение 5 ч, охлаждают до комнатной температуры и концентрируют в вакууме. Остаток обрабатывают водой (50 мл) и твердое вещество собирают фильтрацией. Полученное твердое вещество промывают водой (350 мл) и сушат, получая указанное в заголовке соединение в виде белого твердого вещества, которое используют, как таковое, в следующей реакции. Такую же методику, как описано выше, используют для превращения каждой из перечисленных в табл. 2 соответствующих гетероциклических карбоновых кислот в соответствующее диацилборатное производное (17, 21, 23 и 83).(10,08 г; 34,14 ммоль) и трифторид бора-эфират (30 мл; 236 ммоль) в безводном ТГФ (150 мл) нагревают при температуре образования флегмы в атмосфере азота в течение 36 ч. После охлаждения, добавляют простой эфир (250 мл). Полученное белое твердое вещество собирают фильтрацией, промывают простым эфиром и сушат, получая дифторборатный эфир 1-циклопропил-1,4-дигидро-6,7-дифтор-8-метокси-4 оксохинолин-3-карбоновой кислоты (223) в виде белого твердого вещества (7,29 г; выход 63%). MC 344 Дифторборатный эфир 1-циклопропил-1,4-дигидро-6,7-дифтор-5-метил-4-оксохинолинкарбоновой кислоты (224) Это соединение получают способом, аналогичным получению дифторборатного эфира 1 циклопропил-1,4-дигидро-6,7-дифтор-8-метокси-4-оксохинолин-3-карбоновой кислоты (223), но исходя из 1-циклопропил-1,4-дигидро-6,7-дифтор-5-метил-4-оксохинолинкарбоновой кислоты (полученной, как описано в Bioorganic and Medicinal Chemistry 1995, 3, 1699), с получением (224) в виде белого порошка Дифторборатный эфир 1-[(1R,2S)-2-фторциклопропил]-1,4-дигидро-6,7-дифтор-8-метокси-4 оксохинолин-3-карбоновой кислоты (225) Это соединение получают способом, аналогичным (получению) дифторборатного эфира 1 циклопропил-1,4-дигидро-6,7-дифтор-8-метокси-4-оксохинолин-3-карбоновой кислоты (223), но исходя из 1-[(1R,2S)-2-фторциклопропил]-1,4-дигидро-6,7-дифтор-5-метил-4-оксохинолинкарбоновой кислоты(полученной, как описано в WO 01/072738), получая (225) в виде серого твердого вещества (49%). МС 362 (M+Н). Получение предшественника В - боковая цепь III Схема XIV(26) получают по адаптированной методике из Synthesis 1995, 756. Раствор 25 (250 мг, 1,10 ммоль) , фталимида (208 мг, 1,40 ммоль) и трифенилфосфина (366 мг, 1,40 ммоль) в сухом ТГФ (10 мл) обрабатывают диэтилазодикарбоксилатом (0,25 мл, 1,40 ммоль), добавляемым с помощью шприца в темноте в атмосфере азота. Через 5 ч реакционную смесь обрабатывают водой (10 мл), разбавляют этилацетатом (50 мл), промывают 10% водным бикарбонатом натрия (225 мл) и сушат (MgSO4). Очистка флэшхроматографией (элюент: смесь 0-30% этилацетат/гексаны) дает указанное в заголовке соединение (389 мг, 78%) в виде белой пены. МС 357 (M+Н). 4-[2-(1,3-дигидро-1,3-диоксо-2 Н-изоиндол-2-ил)этилиден]-1-пиперидин трифторацетат (27). Раствор 26 (380 мг, 1,03 ммоль) растворяют в CH2Cl2 (50 мл) и обрабатывают трифторуксусной кислотой (1 мл) при комнатной температуре. Через 1 ч реакционную смесь концентрируют в вакууме, получая указанное в заголовке соединение 27 (363 мг, 100%) в виде масла. МС 257 (М+Н). 1-(трет-Бутоксикарбонил)-4-пиперидинон подвергают взаимодействию с каждым из соответствующих фосфоноацетатов, представленных в табл. 3, и продукты подвергают последовательности операций как при синтезе 27, с получением соответствующих спиртов (28-30, 84) и производных аминов (31-33,85).
МПК / Метки
МПК: C07D 498/06, C07D 401/04, A61K 31/47, C07D 471/04, A61P 31/04, A61K 31/435
Метки: нафтиридоны, аминоалкилиденил-гетероциклические, хинолоны
Код ссылки
<a href="https://eas.patents.su/30-14554-7-aminoalkilidenil-geterociklicheskie-hinolony-i-naftiridony.html" rel="bookmark" title="База патентов Евразийского Союза">7- аминоалкилиденил-гетероциклические хинолоны и нафтиридоны</a>
Предыдущий патент: Фармацевтические композиции для лечения заболеваний, связанных с нейротрофинами
Следующий патент: Ингибитор bcrp/abcg2
Случайный патент: Практически безводное порообразующее вещество и способ его получения