Фармацевтические композиции для лечения заболеваний, связанных с нейротрофинами
Номер патента: 14553
Опубликовано: 30.12.2010
Авторы: Кодзолино Федерико, Гуарна Антонио, Гарачи Энрико, Торча Мария
Формула / Реферат
1. Фармацевтическая композиция, содержащая в качестве активного ингредиента по меньшей мере одно или несколько производных 3-азабицикло[3.2.1]октана с общей формулой (I)
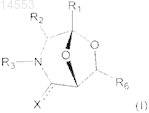
где R1представляет собой Н,
R2 выбран из группы, состоящей из Н, C1-8-алкила, C2-8-алкенила, С2-8-алкинила, циклопропила, циклобутила, циклопентила, циклогексила, циклогептила, циклооктила, норборнанила, канфанила, адамантанила, фенила, бифенила и нафтила, фенила-, бифенила-, нафтила-C1-8-алкила, пиридина-, имидазола-, пиррола-, индола-, триазолов-, пирролидина-, пиперидина-C1-8-алкила, аминоС1-8-алкила, аминофенила, -бифенила, -нафтила, C1-8-алкилоксифенила, -бифенила, -нафтила, гидроксифенила,
-бифенила, -нафтила, гидроксиС1-8-алкила, карбоксиС1-8-алкила, метилоксикарбонилС1-8-алкила, карбоксифенила, -бифенила, -нафтила I, карбоксилоксифенила, -бифенила, -нафтила, алкилсарбамонилфенила, -бифенила, -нафтила I, и боковых цепей аминокислот, или
R1 и R2, взятые вместе, являются C1-4-алкилом, С2-4-алкенилом, циклопропилом циклобутилом, циклопентилом, циклогексилом, циклогептилом, циклооктилом, норборнанилом, канфанилом, адамантанилом или бензоконденсированным циклопропилом, циклобутилом, циклопентилом, циклогексилом, циклогептилом, циклооктилом, норборнанилом, санфанилом, адамантанилом циклоалкилом, образующим 3-, 4-, 5- или 6-членные мостики,
R3 выбран из группы, состоящей из Н, C1-8-алкила, C2-8-алкенила, C2-8-алкинила, циклопропила, циклобутила, циклопентила, циклогексила, циклогептила, циклооктила, норборнанила, канфанила, адамантанила, фенила, бифенила и нафтила, фенила-, бифенила-, нафтила- C1-8-алкила, пиридина-, имидазола-, пиррола-, индола-, триазолов-, пирролидина-, пиперидина-C1-8-алкила, RR'N-C1-8-алкила, RR'N-фенила, -бифенила, -нафтила, RO-C1-8-алкила, RO(O)C-C1-8-алкила, R(O)С-С1-8-алкила, RC(O)N(R)C1-8-алкила, RO-фенила, -бифенила, -нафтила, RО(O)С-фенила, -бифенила, -нафтила, R(O)C-фенила, -бифенила, -нафтила, RС(O)O-фенила, -бифенила, -нафтила, RС(O)N(R)фенила, -бифенила, -нафтила,
-СН(аминокислотная боковая цепь)CO2R, -СН(аминокислотная боковая цепь)С(O)NR, -CH(CO2R)-аминокислотная боковая цепь, СН(CONRR')-аминокислотная боковая цепь, Fmoc, Boc и Cbz,
R6 выбран из группы, состоящей из Н, С1-8-алкила, С2-8-алкенила, C2-8-алкинила, циклопропила, циклобутила, циклопентила, циклогексила, циклогептила, циклооктила, норборнанила, канфанила, адамантанила, фенила, бифенила, нафтила, фенила-, бифенила-, -нафтилаC1-8-алкила, пиридина, имидазола, пиррола, индола, триазолов, пирролидина, пиперидина, пиридина-, имидазола-, пиррола-, индола-, триазолов-, пирролидина-, пиперидина-C1-8-алкила; -C(O)R, -C(O)OR, -C(O)NRR', CH2OR, CH2NRR',
-C(O)NH-СН(аминокислотная боковая цепь)С(O)ОR, CH2NR-Fmoc, CH2NR-Boc и CH2NR-CBz,
X представляет собой О,
и где группы алкила, алкенила, алкинила, циклопропила, циклобутила, циклопентила, циклогексила, циклогептила, циклооктила, норборнанила, канфанила, адамантанила, фенила, бифенила и нафтила и гетероциклические группы, указанные выше, могут быть замещены одним или несколькими остатками, выбранными из группы, состоящей из галогена, циано, нитро, амино, гидрокси, карбоксила, карбонила и
C1-6-алкила, где указанная фармацевтическая композиция предназначена для использования при лечении заболеваний, связанных с дефектом функции нейротрофинов.
2. Фармацевтическая композиция по п.1, где производные 3-азабицикло[3.2.1]октана формулы (I) выбраны из соединений, имеющих следующие формулы:
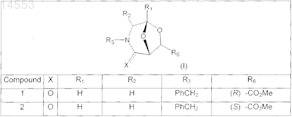

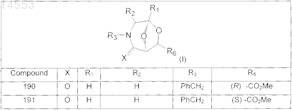
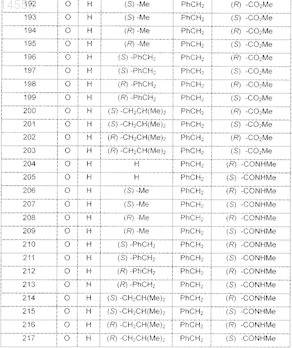
3. Фармацевтическая композиция по любому из пп.1-3, дополнительно содержащая фармацевтически приемлемые эксципиенты и/или разбавители.
4. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой (I) по п.1 для получения фармацевтических композиций для лечения:
i) нейродегенеративных, воспалительных, токсических, травматических или васкулярных нарушений центральной, периферической или вегетативной нервной системы, нервных поражений, вторичных к гипоксии, ишемии, ожогам, химиотерапии, токсическим соединениям различного происхождения (в том числе алкоголю), инфекциям, травме (включая хирургическую травму), происходящей от аксотомии мотонейронов, сенсорной, двигательной или сенсорно-двигательной невропатий или автономных дисфункций, вторичных к разнообразным патологиям, генетических заболеваний, нервных патологий разнообразного происхождения, корнеальных заболеваний различного происхождения, патологий вследствие пониженной подвижности желудочно-кишечного тракта или вследствие атонии мочевого пузыря, эндокринных неопластических патологий, клинических состояний, при которых благоприятной является стимуляция процессов обучения, и всех патологических состояний, возникающих вследствие апоптических процессов нервных клеток;
ii) заболеваний приобретенного иммунодефицита вследствие пониженной или отсутствующей биологической доступности NGF;
iii) состояний, при которых может быть благоприятной стимуляция неоангиогенеза;
iv) глазных патологий.
5. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой (I) по п.4, где указанные нейродегенеративные, воспалительные, токсические, травматические или васкулярные нарушения центральной, периферической или вегетативной нервной системы выбраны из болезни Альцгеймера (AD), бокового амиотрофического склероза (ALS), болезни Хантингтона, рассеянного склероза, эпилепсии, синдрома Дауна, глухоты, связанной с поражением слухового нерва, и болезни Меньера.
6. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой (I) по п.4, где указанные нервные повреждения, вторичные к инфекциям, выбраны из полиовируса и вируса ВИЧ.
7. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой (I) по п.4, где указанные генетические нарушения выбраны из болезни Шарко-Мари-Тута, болезни Refsum, абеталипопротеинемии, болезни Танжье, болезни Краббе, метахроматической лейкодистрофии, болезни Фабри, болезни Дежерина-Сотта.
8. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой (I) по п.4, где указанные нервные патологии разнообразного происхождения выбраны из диффузной атрофии коры головного мозга, деменции, ассоциированной с болезнью телец Леви, болезни Пика, мезолимбокортикальной деменции, нейронного восковидного липофусциноза, таламической дегенерации, кортикостриоспинальной дегенерации, кортикобазальной ганглиозной дегенерации, церебромозжечковой дегенерации, семейной деменции со спастическим парапарезом, заболевания полиглюкозановых телец, синдрома Шая-Дрейджера, оливопонтомозжечковой атрофии, прогрессирующего супрануклеарного паралича, мышцы деформирующей дистонии, болезни Галлерворден-Шпатца, синдрома Мейгса, семейного тремора, синдрома Жилль де ла Туретта, синдрома хорея-акантоцитоза, атаксии Фридрайха, кортикомозжечковой семейной атрофии Холмса, болезни Герстманн-Страусслер-Шнейкера, прогрессирующей спинальной мышечной атрофии, спастической нижней параплегии, перонеальной мышечной атрофии, гипертрофической интерстициальной полиневопатии и полиневритической атаксической наследственной патологии.
9. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой (I) по п.4, где указанные глазные патологии выбраны из невропатии глазных нервов, гетинальной дегенерации, офтальмоплегии и глаукомы, а указанные корнеальные заболевания различного происхождения выбраны из нейротрофических язв, послетравматических и послеинфекционных корнеальных заболеваний.
10. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой (I) по п.5, где указанные патологии вследствие пониженной подвижности желудочно-кишечного тракта или вследствие атонии мочевого пузыря выбраны из интерстициального цистита или диабетического цистита.
11. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой (I) по п.4, где указанные состояния, при которых может быть благоприятной стимуляция неоангиогенеза, выбраны из инфаркта миокарда, удара, церебральных аневризм, гастродуоденальных язв, заживления раны и периферических васкулопатий.
12. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой (I) по п.5, где указанное приобретенное иммунодефицитное заболевание является иммунодефицитом старения.
13. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой (I) по пп.1-3 в качестве реагентов для стимуляции роста in vivo, и/или in vitro, и/или ex vivo выживания нервных клеток.
14. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой (I) по п.13, где указанные нервные клетки выбраны из группы, состоящей из допаминергических, холинергических, сенсорных нервных клеток, стриарных клеток, кортикальных клеток, клеток полосатого тела, гиппокампа, мозжечка, обонятельной луковицы, периводопроводных клеток, клеток ядер шва, locus coeruleus (голубое пятно), ганглий дорсальных корешков, нервных клеток симпатической нервной системы, низших двигательных нейронов, нервных клеток ствола и клеток, происходящих из нервных бляшек.
15. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой (I) по пп.1-3 для получения сред для культивирования и хранения, пригодных для консервирования эксплантированных роговиц, предназначенных для трансплантации.
16. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой (I) по пп.1-2, меченых реагентами и возможно обработанных процедурами, пригодными для целей получения в медицине изображений, для анализа изображения ткани или органов, содержащих рецепторы нейротрофинов.
17. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой (I) по п.16 для мониторинга использования и эффективности лекарственных средств или для установления диагноза заболеваний млекопитающих, в которых принимают участие рецепторы нейротрофинов.
Текст
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С НЕЙРОТРОФИНАМИ Настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве активных соединений производные 3-азабицикло[3.2.1]октана с общей формулой (I), действующих в качестве агонистов нейротрофинов человека. Кроме того, такие соединения формулы (I) применяются для получения фармацевтических композиций для лечения заболеваний, в которых проявляется дефект функции нейротрофинов, особенно фактора роста нервов (NGF), таких как нейродегенеративные заболевания центральной нервной системы (ЦНС), приобретенный иммунодефицит вследствие пониженной биовосприимчивости NGF или патологических состояний, в которых может быть благоприятной стимуляция неоангиогенеза. 014553 Область изобретения Настоящее изобретение относится к фармацевтическим композициям, содержащим производные 3-азабицикло[3.2.1]октана с общей формулой (I), полезным при лечении патологий, в которых изменяются функции нейротрофинов, особенно фактора роста нервов (NGF). Уровень техники Многочисленные белковые и полипептидные факторы регулируют рост и/или выживание клеток. Первым из таких факторов, который был идентифицирован или функционально охарактеризован, былNGF. Позже были идентифицированы другие факторы, которые проявляют свою активность на разных популяциях нервных клеток. Все эти белки сообща называют "нейротрофинами".NGF при взаимодействии со специфическими поверхностными рецепторами предотвращают гибель нервной клетки во время эмбрионального развития и на всем протяжении взрослой жизни. Доказано, что введение NGF является благоприятным при патологических условиях, таких как дегенеративные и ишемические нарушения центральной нервной системы (ЦНС), спинальные нарушения и токсичность возбуждающих аминокислот. Фактически, вместе с другими нейротрофическими факторами NGF стимулирует нейронную генерацию и поддерживает нейронные функции. Терапевтические использования NGF были ограничены его слабой способностью преодолевать гематоэнцефалический барьер частично вследствие молекулярного размера нативного фактора. Таким образом, разработка непептидных соединений, способных специфически имитировать активности природного лиганда, является полезным подходом для устранения таких ограничений. Рассматриваемыми примерами таких соединений являются а) сложные эфиры форбола, которые имитируют NGF предположительно модификацией активности PKCc; b) ганглиозид и другие несвязанные с ним липидные соединения, которые способствуют прорастанию нейронов из ганглий дорсальных корешков или других нейронов симпатической нервной системы; с) триап(1,1,3-трициано-2-амино-1-пропен), небольшое соединение, способное поддерживать выживание и индуцировать рост в РС 12-клетках. Во всех указанных выше клетках активность молекул не опосредуется взаимодействием с рецепторами NGF. Разработка новых непептидных соединений, способных взаимодействовать со специфическими рецепторами, таким образом действующих в качестве агонистов или антагонистов нейротрофинов человека, имеет самое большое значение, так как они могут быть использованы в качестве лекарственных средств для лечения нарушений, связанных с недостаточной или чрезмерной активностью нейротрофинов. Сущность изобретения Авторами изобретения неожиданно обнаружено, что производные 3-азабицикло[3.2.1]октана с общей формулой (I) являются активными в качестве агонистов нейротрофинов человека, поэтому они являются полезными для получения фармацевтических композиций для лечения заболеваний, в которых функции нейротрофинов, особенно функции NGF, характеризуются дефектами. Таким образом, предметом настоящего изобретения является фармацевтическая композиция, содержащая в качестве активного ингредиента по меньшей мере одно соединение среди производных 3-азабицикло[3.2.1]октана с общей формулой (I)R1 и R2, взятые вместе, являются C1-4-алкилом, С 2-4-алкенилом, циклопропилом циклобутилом, циклопентилом, циклогексилом, циклогептилом, циклооктилом, норборнанилом, канфанилом, адамантанилом или бензоконденсированным циклопропилом циклобутилом, циклопентилом, циклогексилом, циклогептилом, циклооктилом, норборнанилом, санфанилом, адамантанилом циклоалкилом, образующим 3-, 4-, 5- или 6-членные мостики,R3 выбран из группы, состоящей из Н, C1-8-алкила, C2-8-алкенила, C2-8-алкинила, циклопропила,циклобутила, циклопентила, циклогексила, циклогептила, циклооктила, норборнанила, канфанила, адамантанила, фенила, бифенила и нафтила, фенила-, бифенила-, нафтила-C1-8-алкила, пиридина-, имидазо-1 014553 ла-, пиррола-, индола-, триазолов-, пирролидина-, пиперидина-C1-8-алкила, RR'N-C1-8-алкила, RR'Nфенила, -бифенила, -нафтила, RO-C1-8-алкила, RO(O)C-C1-8-алкила, R(O)C-C1-8-алкила, RC(O)N(R)C1-8 алкила, RO-фенила, -бифенила, -нафтила, RO(O)C-фенила, -бифенила, -нафтила, R(O)C-фенила,-бифенила, -нафтила, RC(O)O-фенила, -бифенила, -нафтила, RC(O)N(R)фенила, -бифенила, -нафтила, СН(аминокислотная боковая цепь)CO2R, -СН(аминокислотная боковая цепь)С(O)NR, -CH(CO2R)аминокислотная боковая цепь, CH(CONRR')-аминокислотная боковая цепь, Fmoc, Boc и Cbz,R6 выбран из группы, состоящей из Н, C1-8-алкила, C2-8-алкенила, C2-8-алкинила, циклопропила,циклобутила, циклопентила, циклогексила, циклогептила, циклооктила, норборнанила, канфанила, адамантанила, фенила, бифенила, нафтила, фенила-, бифенила-, -нафтила C1-8-алкила, пиридина, имидазола,пиррола, индола, триазолов, пирролидина, пиперидина, пиридина-, имидазола-, пиррола-, индола-, триазолов-, пирролидина-, пиперидина-C1-8-алкила; -C(O)R, -C(O)OR, -C(O)NRR', CH2OR, CH2NRR',-C(O)NH-СН(аминокислотная боковая цепь)С(O)OR, CH2NR-Fmoc, CH2NR-Boc и CH2NR-CBz;X представляет собой О,и где группы алкила, алкенила, алкинила, циклопропила, циклобутила, циклопентила, циклогексила, циклогептила, циклооктила, норборнанила, канфанила, адамантанила, фенила, бифенила и нафтила и гетероциклические группы, указанные выше, могут быть замещены одним или несколькими остатками,выбранными из группы, состоящей из галогена, циано, нитро, амино, гидрокси, карбоксила, карбонила иC1-8-алкила, где указанная фармацевтическая композиция предназначена для использования при лечении заболеваний, связанных с дефектом функции нейротрофинов. Следующим предметом изобретения являются новые производные 3-азабицикло[3.2.1]октана с общей формулой (I). Следующим предметом изобретения является применение производных 3-азабицикло[3.2.1]октана с общей формулой (I) для получения фармацевтических композиций, применимых для лечения:i) нейродегенеративных нарушений центральной нервной системы, таких как болезнь Альцгеймера(AD), боковой амиотрофический склероз (ALS), болезнь Хантингтона, невропатии, нервное повреждение, вызванное гипоксией, ишемией или травмой, включая апоптоз нервных клеток;ii) заболеваний типа приобретенной иммунологической недостаточности, связанной с пониженной биологической доступностью NGF, таких как иммунологическая недостаточность вследствие старения;(iii) заболеваний, при которых, как оказалось, стимуляция неоангиогенеза является благоприятной,таких как инфаркт миокарда, удар или периферические васкулопатии;(iv) патологий глаз, таких как кератит разнообразной этиологии, глаукома, дегенеративные или воспалительные состояния сетчатки. Следующим предметом изобретения является применение указанных выше производных 3-азабицикло[3.2.1]октана с общей формулой (I) для получения культуры и среды для хранения, применимых для консервирования эксплантированных роговиц, предназначенных для трансплантации, и использование для стимуляции роста in vivo, и/или in vitro и/или ex vivo выживания нервных клеток. Предметом изобретения является также применение указанных выше производных 3-азабицикло[3.2.1]октана с общей формулой (I), меченных подходящими реагентами (контрастными агентами,радиоактивными изотопами, флуоресцентными агентами и т.п.) и обработанных любой процедурой,применимой для целей получения изображения в медицине, для анализа изображения ткани или органов,содержащих рецепторы нейротрофинов, либо in vitro, либо in vivo, особенно для мониторинга использования и эффективности лекарственных средств, а также для установления диагноза заболеваний млекопитающего, в которых принимают участие рецепторы нейротрофинов. Характеристики и преимущества фармацевтических композиций по изобретению будут подробно указаны в следующем описании. Краткое описание графических материалов На фиг. 1 показано влияние настоящих соединений на выживание клеток РС 12 в безсывороточных условиях с использованием hrNGF в качестве внутреннего стандарта в соответствии с приведенным здесь ниже разделом "Биологическая активность". Результаты выражали как выживание, индуцированное соединениями/самопроизвольное выживание 100 для соединений, указанных на оси х. На фиг. 2 показано влияние настоящих соединений на пролиферативную активность клеточной линии РС 3 в безсывороточных условиях, оцененное при помощи использования hrNGF в качестве внутреннего стандарта в соответствии с разделом "Биологическая активность". Результаты представлены в терминах индекса стимуляции, т.е. как отношение между включением 3 Н-тимидина (среднее значениеSD(стандартное отклонение стимулированных культур и включением 3 Н-тимидина нестимулированных культур для соединений, указанных на оси х. Фиг. 3 иллюстрирует способность настоящих соединений (I) индуцировать продуцирование VGF клетками РС 12, оцененную, как описано здесь ниже в разделе "Биологическая активность", по сравнению с hrNGF. Контролем является VGF с Kda 68. На фиг. 4 а и 4b показана способность настоящих соединений вытеснять 125I-NGF-связывание с клетками РС 12 при помощи кривой вытеснения, полученной анализом образовавшейся радиоактивности,-2 014553 связанной с клетками, в присутствии настоящих соединений или в присутствии hrNGF с применением соответствующего программного обеспечения (графит 4) в соответствии с разделом "Биологическая активность". На фиг. 4 а показана кривая вытеснения, полученная с настоящим соединением 9, используемым в качестве конкурента. Анализ данных обнаруживал Kd 165 нМ 0,05. На фиг. 4b показана кривая вытеснения, полученная с использованием hrNGF в качестве конкурента. Анализ данных обнаружил Kd 114 пМ 0,01. На фиг. 5 показана способность настоящих соединений 272, 325, 9 и 91 индуцировать аутофосфорилирование Trk-A с использованием hrNGF в качестве внутреннего стандарта в соответствии с разделом "Биологическая активность". На фиг. 6 показаны результаты, полученные для настоящих соединений 9 и 325 и для комбинации этих же двух соединений в анализе выживания РС 12 в безсывороточной среде в соответствии с разделом"Биологическая активность". Результаты представлены как выживание, индуцированное соединениями/самопроизвольное выживание 100. Подробное описание изобретения В настоящем изобретении выражение "аминокислотная цепь" означает остатки боковых цепей природных L- или D-аминокислот или редких или не встречающихся в природе аминокислот. Если не оговорено особо, термины алкил, алкенил, алкинил, арил, арилалкил, циклоалкил и гетероцикл, используемые в настоящем изобретении, должны иметь следующие значения:C1-8-алкил, С 2-8-алкенил и С 2-8-алкинил относятся к неразветвленным или разветвленным алкильным радикалам, имеющим только одинарные связи, по меньшей мере одну двойную связь, по меньшей мере одну тройную связь соответственно; примеры алкильных групп в соответствии с настоящим изобретением включают в себя метил, этил, пропил, изопропил, бутил, пентил, гексил, гептил, октил; примеры алкенильных групп в соответствии с настоящим изобретением включают, но не ограничиваются перечисленным, этенил, пропенил, 1-бутенил, цис-2-бутенил, транс-2-бутенил, 2-метил-1-пропенил, 1-пентенил,цис-2-петенил, транс-2-пентенил, 2-метил-2-бутенил; примеры алкинильных групп в соответствии с настоящим изобретением включают, но не ограничиваются перечисленным, этинил, пропинил, 1-бутинил,2-бутинил, 1-пентинил, 3-метил-1-бутинил; термин "циклоалкил" означает кольцо, содержащее атомы углерода, обычно имеющие 3-8 членов,предпочтительно 5 или 6 членов; примеры циклоалкильных групп включают в себя, но не ограничиваются перечисленным, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, норборнанил, камфанил, адамантил; термин "арил" означает группу, содержащую одно или несколько ненасыщенных колец, причем каждое кольцо имеет 5-8 членов, предпочтительно 5 или 6 членов; примеры арильных групп включают в себя, но не ограничиваются перечисленным, фенил, бифенил и нафтил; термин "гетероцикл" относится к насыщенным или ароматическим гетероциклам, содержащим один или несколько гетероатомов, предпочтительно один или несколько N-атомов; примеры гетероциклов включают, но не ограничиваются перечисленным, пиридин, имидазол, пиррол, индол, триазолы,пирролидин, пиперидин; термин "арилалкил" означает группу, имеющую алкил и арильный заместитель, как указано выше; в качестве примера арилалкил включает в себя, но не ограничивается перечисленным, этилфенил, изобутилфенил, бензил, этилбензил, пропилбензил, изопропилбензил, бутилбензил, изобутилбензил, циклогексилбензил, стирил и дифенил. В настоящем изобретении группы флуоренилметоксикарбонил, трет-бутоксикарбонил, карбоксибензил, бензил, фенил и ацетил указываются с использованием обычных терминов Fmoc, Boc, Cbz, Bn,Ph и Ас соответственно. В соответствии с настоящим изобретением алкильные, алкенильные, алкинильные, циклоалкильные, арильные и гетероциклические группы могут быть замещены одним или несколькими остатками,предпочтительно одним или двумя остатками, выбранными из группы, состоящей из галогена, циано,нитро, амино, гидрокси, карбоксила, карбонила и C1-6-алкила. Термин "галоген" относится к фтору, хлору, брому и йоду. Среди соединений с общей формулой (I) конкретные соединения, указанные в следующих табл. 1 и 2, имеют особый интерес по причине их агонистической активности против нейротрофинов, и особенноNGF человека, и поэтому они являются соединениями, предпочтительно используемыми для получения фармацевтических композиций в соответствии с изобретением. Кроме того, настоящее изобретение относится к производным 3-азабицикло[3.2.1]октанов, которые были получены заявителями и описаны здесь впервые, т.е. производным 3-азабицикло[3.2.1]октана (I),указанным выше, за исключением соединений 1, 2, 5, 7, 8, 9, 10, 12, 13, 17, 19, 20, 21, 32, 34, 35, 36, 38,40, 44, 58, 60, 64, 65, 66, 70, 75, 76, 77, 78, 79, 83, 87, 91, 95, 99, 101, 103, 138, 145, 152, 154, 163, 164, 168,172, 174, 176, 178, 184, 186, 192, 322, 324. Перечисленные выше соединения действительно уже описаны в J. Org. Chem., 1999, 64, 7347, Organic Letters, 2000, 2, 3987-3990, Bioorganic and Med. Chem., 2001, 9, 1625-1632, Eur. J. Org. Chem., 2002,873-880 и в заявке на Европейский патент 00104135.9-2117 и в Международной публикацииWO 01/64686; в таких документах описаны также способы получения этих соединений. Новые производные 3-азабицикло[3.2.1]октанов с общей формулой (I) можно получить следующим способом. Новые соединения общей формулы (I), описанные впервые в настоящей заявке, могут быть получены в соответствии с процедурой, описанной, как указано ниже, и представленной в следующей схеме 1:(3 с) подвергали взаимодействию с активированным производным винной кислоты, как, например, диацетилоксивинным ангидридом 4 (R,R или S,S), или с кислотным производным винной кислоты, как,например, защищенным монометиловым эфиром 6 (R,R или S,S), в присутствии агентов сочетания или активирующих агентов, или восстановительному аминированию защищенными производными эритролактола 5 (R,R, полученного из D-арабинозы, или S,S, полученного из L-арабинозы). Получали соответствующие амиды 7 и 9 (в схеме 1 показаны только R,R-энантиомеры, но аналогично получали S,S-энантиомеры) или амин 8 (в схеме 1 показаны только R,S-энантиомеры, но аналогично получали S,R-энантиомеры). В случае амидоспирта 9 соответствующий альдегид или кетон 10 получают окислением. КогдаR3 представляет собой Н в амине 8, можно применять Fmoc. Дальнейшую циклизацию соединений 7, 8 и 10 (схема 1) осуществляют обработкой SOCl2 и МеОН (условия реакции i) с последующей обработкой серной кислотой, абсорбированной на SiO2 в кипящем с обратным холодильником толуоле (условия реакции II) или обработкой трифторуксусной кислотой (TFA) как таковой или в метиленхлориде (условия реакции III). Таким образом, исходя из амидов 7 и 10 получают соединения I, у которых X представляет собой О и R6 представляет собой -СООМе и которые имеют экзоконфигурацию. В случае применения амина 8 получали соединения I, у которых X представляет собой Н,Н и группа R6 представляет собой-СН 2 ОН и которые имеют эндоконфигурацию. Конфигурации R,R или S,S стереоцентров у головного положения С-1 мостика и у С-7 (имеющего карбоксильную или гидроксиметильную группу) зависит от того, применяют ли винную кислоту или исходный эритролактон. Соединения I могут быть модифицированы в соответствии со схемой 2. Соединения формулы (I) (типа амида), где X представляет собой О, могут быть восстановлены с использованием комплекса ВН 3 с диметилсульфидом либо в соответствующие сложные аминоэфиры I (X представляет собой Н,Н, R6 представляет собой СООМе) или в соответствующий аминоспирт I (X представляет собой Н,Н и R6 представляет собой СН 2 ОН). Такие соединения могут быть защищены у атома азота. Гидролиз сложного аминоэфира I (X представляет собой Н,Н, R6 представляет собой СООМе) может быть осуществлен в кислотных или основных условиях с получением соответствующей аминокисло-6 014553 ты I (X представляет собой Н,Н, R6 представляет собой СООН). Аминокислоту получают также окислением по Джону или с использованием PDC в ДМФ из аминоспирта I (X представляет собой Н,Н и R6 представляет собой СН 2 ОН) также после обмена бензильной группы на Boc или Fmoc. При активации карбоксильной группы взаимодействием с амином NHR7R8 или аминокислотой образуется амидная связь. Настоящие производные 3-азабицикло[3.2.1]октана общей формулы (I), в свободной форме или в форме фармацевтически приемлемых солей, могут быть использованы для получения фармацевтических композиций по обычным способам получения фармацевтического препарата. Такие фармацевтические композиции могут быть изготовлены общепринятым способом и могут включать один или несколько фармацевтически приемлемых эксципиентов и/или разбавителей. Введение таких препаратов возможно посредством любого общепринятого пути, такого как парентеральный в форме раствора или суспензии,пероральный, окулярный, назальный, местный и т.п. Готовые препаративные формы производных 3-азабицикло[3.2.1]октана с общей формулой (I) включают таблетки, капсулы, пилюли, гранулы, растворы, дисперсии, суспензии, липосомные препараты, микросферы, наносферы, кремы и мази, эмульсии и аэрозоли, которые могут также быть получены путем, который позволяет осуществлять регулируемое или замедленное высвобождение активного соединения. Такие фармацевтические композиции могут содержать по меньшей мере одно из настоящих соединений формулы (I) в качестве активного ингредиента, возможно даже в комбинации с другим активным ингредиентом или соадъювантом, выбранным в соответствии с патологическими состояниями. Фармацевтические композиции, содержащие соединения изобретения, являются подходящими для фармацевтического лечения патологических состояний, связанных с активностью нейротрофинов. Настоящие производные 3-азабицикло[3.2.1]октана с общей формулой (I) проявляют активность агонистов нейротрофинов, особенно NGF, так как они обладают способностью взаимодействовать с комплексом NGF с рецептором при определенных уровнях аффинности. Соединения-агонисты обладают способностью индуцировать биологический сигнал нейротрофинов. Соединения-агонисты нейротрофинов являются подходящими, например, для получения фармацевтических композиций, полезных при лечении:i) нейродегенеративных, воспалительных, токсических, травматических или васкулярных нарушений центральной, периферической или вегетативной нервной системы (таких как болезнь Альцгеймера(AD), боковой амиотрофический склероз (ALS), болезнь Хантингтона, рассеянный склероз, эпилепсия,синдром Дауна, глухота, связанная с поражением слухового нерва, болезнь Меньера), нервных поражений, вторичных к гипоксии, ишемии, ожогам, химиотерапии, токсическим соединениям различного происхождения (в том числе алкоголю), инфекциям (таким как полиовирус или вирус ВИЧа), травмам(включая хирургические травмы), происходящим от аксотомии мотонейронов, сенсорной, двигательной или сенсорно-двигательной невропатии или автономных дисфункций, вторичных к разнообразным патологиям (таким как диабет, почечная недостаточность или другие системные заболевания), генетических нарушений (такие как болезнь Шарко-Мари-Тута, болезнь Refsum, абеталипопротеинемия, болезнь Танжье, болезнь Краббе, метахроматическая лейкодистрофия, болезнь Фабри, болезнь Дежерина-Сотта),нервных патологий разнообразного происхождения (таких как диффузная атрофия коры головного мозга, деменция, ассоциированная с болезнью телец Леви, болезнь Пика, мезолимбокорковая деменция,нейронный восковидный липофусциноз, таламическая дегенерация, кортикостриоспинальная дегенерация, кортикобазальная ганглиозная дегенерация, церебромозжечковая дегенерация, семейная деменция со спастическим парапарезом, заболевание полиглюкозановых телец, синдром Шая-Дрейджера, оливопонтомозжечковая атрофия, прогрессирующий супрануклеарный паралич, мышцы деформирующая дистония, болезнь Галлерворден-Шпатца, синдром Мейгса, семейный тремор, синдром Жилль де ла Туретта, синдром хорея-акантоцитоза, атаксия Фридрайха, кортикомозжечковая семейная атрофия Холмса,болезнь Герстманн-Страусслер-Шнейкера, прогрессирующая спинальная мышечная атрофия, спастическая нижняя параплегия, перонеальная мышечная атрофия, гипертрофическая интерстициальная полиневропатия, полиневритная атаксическая наследственная патология), некоторых глазных патологий (таких как невропатии глазных нервов, гетинальная дегенерация, офтальмоплегия, глаукома), корнеальных заболеваний различного происхождения (таких как нейротрофические язвы, послетравматические или послеинфекционные корнеальные заболевания), патологии вследствие пониженной подвижности желудочно-кишечного тракта или вследствие атонии мочевого пузыря (такой как интерстициальный цистит или диабетический цистит), эндокринных неопластических патологий (таких как пролактинома), клинических состояний, при которых благоприятной является стимуляция процессов обучения (в частности,при деменциях и послетравматических состояниях), помимо всех патологических состояний, возникающих вследствие апоптических процессов нервных клеток;ii) заболеваний приобретенного иммунодефицита вследствие пониженной или отсутствующей биологической доступности NGF (таких как иммунодефицит старения);iii) состояний, при которых может быть благоприятной стимуляция неоангиогенеза (таких как инфаркт миокарда, удар, церебральные аневризмы, гастродуоденальные язвы, заживление раны, периферические васкулопатии);iv) глазных патологий (таких как корнеальные патологии разнообразного происхождения и глаукома). Вышеуказанные настоящие производные 3-азабицикло[3.2.1]октана общей формулы (I) являются также пригодными для получения среды для культивирования и хранения, полезной для консервации эксплантируемых роговиц, предназначенных для трансплантации. Кроме того, при мечении подходящими реагентами (контрастными агентами, радиоактивными изотопами, флуоресцентными агентами и т.п.) и, возможно, обработке любой другой процедурой, применимой для целей получения в медицине изображений, настоящие производные 3-азабицикло[3.2.1]октана общей формулы (I) могут быть использованы для анализа изображения ткани или органов, содержащих рецепторы нейротрофинов, либо in vitro, либо in vivo. Особенно такие меченые соединения могут быть использованы либо для мониторинга использования и эффективности лекарственных средств, либо для установления диагноза заболеваний млекопитающего, в которых принимают участие рецепторы нейротрофинов. В общем адекватно доказано, что настоящие соединения, обладающие агонистической активностью для нейротрофинов, в частности агонистической активностью для NGF, заменяют биологическую активность нейротрофинов и NGF. Кроме того, настоящие соединения, являющиеся агонистами нейротрофинов, могут быть использованы для стимуляции роста in vivo, in vitro или ex vivo и/или выживания нервных клеток, включающих,но не ограничивающихся перечисленным, допаминергические, холинергические, сенсорные нервные клетки, стриарные клетки, кортикальные клетки, клетки полосатого тела, гиппокампа, мозжечка, обонятельной луковицы, периводопроводные клетки, клетки ядер шва, locus coeruleus (голубое пятно), ганглий дорсальных корешков, нервные клетки симпатической нервной системы, низшие двигательные нейроны,нервные клетки ствола или клетки, происходящие из нервных бляшек. Следующие примеры представлены для неограничивающей иллюстрации настоящего изобретения. Пример 1. Получение метил-3-бензил-2-оксо-(1S,5S,7R)-6,8-диокса-3-азабицикло[3.2.1]октан-7 экзокарбоксилата (соединение формулы (I), где X представляет собой О, R1 представляет собой Н, R2 представляет собой Bn, R6 представляет собой (R)-COOMe) (соединение 1). Раствор R,R-винного ангидрида 4 (4 г) (получен, как описано Lucas H.J., Baumgarten W., J. Am.Chem. Soc., 1941, 63, 1654) в безводном дихлорметане (23 мл) и 3 а (где X и X' представляют собой ОМе,R1 представляет собой Н, R2 представляет собой Н и R3 представляет собой Bn) (3 г), полученного, как описано Kermak W.O.; Perkin W.H., Robinson R., J. Chem. Soc., Trans, 1922, 121, 1872, подвергают взаимодействию при комнатной температуре в течение 15 ч. После выпаривания растворителя 7 а (7 г) получают в виде масла. К сырому продукту 7 а в СН 3 ОН (40 мл) по каплям при 0 С добавляют тионилхлорид(0,8 мл) и затем смесь нагревают при 60 С в течение 15 ч. После выпаривания растворителя сырой продукт, растворенный в толуоле (8 мл), быстро добавляют к кипящей с обратным холодильником суспензии (1,6 г) H2SO4/SiO2 (30 мас.% H2SO4) в толуоле (12,5 мл). Спустя 15 мин одну треть растворителя отгоняют и образовавшуюся горячую смесь фильтруют на короткой подушке NaHCO3. После выпаривания растворителя сырой продукт очищают хроматографией, получая при этом чистое указанное в заголовке соединение (2,8 г). 1 Н ЯМР (CDCl3) : 7,32-7,16 (м, 5 Н), 5,84 (д, J = 2,0 Гц, 1 Н), 4,96 (с, 1 Н), 4,74 (с, 1 Н), 4,52 (с, 2 Н),3,77 (с, 3H), 3,34 (дд, J1 = 12,0 Гц, J2 = 2,0 Гц, 2 Н), 3,08 (J = 12,0 Гц, 1 Н). Т.пл. 82, []25D = -49 (с 1,0,CHCl3). Пример 2. Получение метил-(1R,5R,7S)-3-бензил-2-оксо-6,8-диокса-3-азабицикло[3.2.1]октан-7 экзокарбоксилата (соединение формулы (I), где X представляет собой О, R1 и R2 представляют собой Н,R3 представляет собой Bn, R6 представляет собой (S)-COOMe) (соединение 191). По такой же процедуре, как в примере 1, исходя из ангидрида S,S-винной кислоты 4, получают указанное в заголовке соединение. 1 Н ЯМР (CDCl3) : 7,40-7,10 (м, 5 Н), 5,85 (д, J = 2,0 Гц, 1 Н), 4,97 (с, 1 Н), 4,74 (с, 1 Н), 4,52 (с, 2 Н),3,79 (с, 3H), 3,34 (дд, J1 = 12,0 Гц, J2 = 2,0 Гц, 2 Н), 3,09 (J = 12,0 Гц, 1 Н). Т.пл. 83, []25D = +48 (с 1,0,CHCl3). Пример 3. Получение метил-(1S,5S,7R)-3-бензил-6,8-диокса-3-азабицикло[3.2.1]октан-7-экзокарбоксилата (соединение формулы (I), где X представляет собой Н, R1 и R2 представляют собой Н, R3 представляет собой Bn, R6 представляет собой (R)-COOMe) (соединение 40). Раствор BH3Me2S (1 М, 2,5 мл) медленно добавляют при 0 С к раствору в безводном ТГФ (65 мл) соединения формулы (I), где X представляет собой О, R1 представляет собой Н, R2 представляет собой Н,R3 представляет собой Bn, R6 представляет собой (R)-COOMe (соединение 1) (2,8 г), полученного, как описано выше в примере 1. Смесь перемешивают в течение 18 ч при комнатной температуре и затем добавляют этанол (3 мл), раствор NaOH (3 M, 2 мл) и H2O (150 мл). После экстракции диэтиловым эфиром органическую фазу отделяют и упаривают, получая при этом после хроматографии чистое указанное в заголовке соединение (2 г) в виде бесцветного масла. 1 Н ЯМР (CDCl3) : 7,30-7,23 (м, 5 Н), 5,62 (с, 1 Н), 4,78 (с, 1 Н), 4,60 (с, 1 Н), 3,74 (с, 3H), 3,55 (пд, 2 Н),-8 014553 2,84 (д, J = 13 Гц, 1 Н), 2,76 (д, J = 10 Гц, 1 Н), 2,50 (дд, J1 = 10 Гц, J2 = 2 Гц, 1 Н), 2,30 (д, J = 11 Гц, 1 Н).(соединение формулы (I), где X представляет собой Н, R1, R2 и R3 представляют собой Н, R6 представляет собой (R)-COOMe) (соединение 34). К суспензии соединения формулы (I), где X, R1 и R2 представляют собой Н, R3 представляет собойBn, R6 представляет собой (R)-COOMe) (соединение 40) (2 г), полученного, как описано выше в примере 3, и 10% Pd/C (1,3 г) в метаноле (40 мл) добавляют формиат аммония (2,4 г). Смеси дают возможность кипятиться с обратным холодильником в течение 1 ч, фильтруют на целите и промывают СН 3 ОН. Раствор упаривают, получая при этом указанное в заголовке соединение (1,3 г) в виде бесцветного масла. 1 Н ЯМР (CDCl3) : 5,53 (с, 1 Н), 4,72 (с, 1 Н), 4,49 (с, 1 Н), 3,71 (с, 3H), 3,17 (дд, J1 = 13,6 Гц, J2 = 1,8 Гц, 1 Н), 2,83 (м, 2 Н), 2,68 (д, J = 13,6 Гц, 1 Н), 2,55 (ушир.,1 Н). []25D = -55 (с 0,7, CHCl3). Пример 5. Получение (1S,5S,7R)-6,8-диокса-3-азабицикло[3.2.1]октан-7-экзокарбоновой кислоты(соединение 32). Соединение формулы (I), где X представляет собой Н, R1, R2 и R3 представляют собой Н, R6 представляет собой (R)-COOMe (соединение 34), полученное, как описано в примере 4 (0,5 г), растворяют в растворе HCl (4 н., 12 мл). После выдерживания 18 ч при комнатной температуре раствор упаривают, получая при этом указанное в заголовке соединение в виде соли с HCl (0,5 г). 1 Н ЯМР (D2O) : 5,95 (с, 1 Н), 5,06 (с, 1 Н), 5,04 (с, 1 Н), 3,58 (м, 2 Н), 3,34 (м, 2 Н). []25D = -38,3 (с 1,1,H2O). Пример 6. Получение метил-(1S,5S,7R)-3-трет-бутоксикарбонил-6,8-диокса-3-азабицикло[3.2.1]октан-7-экзокарбоксилата (соединение формулы (I), где X, R1 и R2 представляют собой Н, R3 представляет собой Boc, R6 представляет собой (R)-COOMe) (соединение 42).(R)-COOMe (соединение 34) (0,8 г), полученного, как описано в примере 4. Реакционную смесь выдерживают в течение 18 ч при комнатной температуре, растворитель упаривают и остаток обрабатывают раствором NaHCO3 (5%) и экстрагируют диэтиловым эфиром. После выпаривания растворителя сырой продукт очищают хроматографией, получая при этом указанное в заголовке соединение (0,8 г) в виде белого твердого вещества. 1 Н ЯМР (CDCl3) : 5,64 и 5,58 (ротамеры) (с, 1 Н), 4,65 и 4,60 (ротамеры) (с, 1 Н), 4,51 (с, 1 Н), 3,72 (с,3H), 4,00-3,60 (м, 2 Н), 3,20 (м, 1 Н), 2,92 (м, 1 Н), 1,43 (с, 9 Н). Пример 7. Получение (1S,5S,7R)-3-трет-бутоксикарбонил-6,8-диокса-7-экзогидроксиметил-3-азабицикло[3.2.1]октана (соединение формулы (I), где X, R1 и R2 представляют собой Н, R3 представляет собой Boc, R6 представляет собой (R)-CH2OH) (соединение 62). К раствору в МеОН (15 мл) (соединение формулы (I), где X, R1 и R2 представляют собой Н, R3 представляет собой Boc, R6 представляет собой (R)-СООМе) (соединение 42) (0,8 г), полученного, как описано в примере 6, при 0 С небольшими порциями добавляют NaBH4 (0,6 г). После выдерживания смеси 10 мин при комнатной температуре смесь упаривают и сырой продукт очищают хроматографией, получая при этом указанное в заголовке соединение (0,5 г) в виде бесцветного масла. 1 Н ЯМР (CDCl3) : 5,50 и 5,44 (ротамеры) (с, 1 Н), 4,32 и 4,27 (ротамеры) (с, 1 Н), 4,18 (м, 1 Н), 3,883,67 (м, 2 Н), 3,56 (д, J = 5,5 Гц, 2 Н), 3,21 (м, 1 Н), 2,96 (м, 1 Н), 1,92 (б, 1 Н), 1,43 (с, 9 Н). []25D = -30 (с 1,0,МеОН). Пример 8. Получение (1S,5S,7R)-3-(9-флуоренилметоксикарбонил)7-эндогидроксиметил-6,8-диокса-3-азабицикло[3.2.1]октана (соединение формулы (I), где X, R1 и R2 представляют собой Н, R3 представляет собой Fmoc, R6 представляет собой (R)-CH2OH) (соединение 61). К раствору в ТГФ (R,R)-2,3-O-изопропилиден-D-эритрозы 5 (1,8 г) (получена из D-арибинозы, как описано Thompson D.K., Hubert C.N., Wightman R.H., Tetrahedron, 1993, 49, 3827-3840) при 0 С добавляют 2,2-диэтоксиэтиламин 3 а (где W = W представляют собой OEt, R1, R2 и R3 представляют собой Н)(1,7 мл), затем в виде небольших порций добавляют NaBH(OAc)3 (3,1 г). Спустя 18 ч смесь разбавляют насыщенным раствором NaHCO3 и экстрагируют этилацетатом. Органическую фазу упаривают с получением масла, которое хроматографируют, получая при этом продукт 8 а (где W и W представляют собойOEt, R1, R2 и R3 представляют собой Н) в виде желтоватого масла (1,9 г). 1 Н ЯМР (CDCl3) : 4,83 (ушир., 2 Н), 4,59 (т, J = 5,5 Гц, 1 Н), 4,32 (м, 2 Н), 3,75-3,45 (м, 6 Н), 3,05-2,83(м, 2 Н), 2,79 (д, J = 5,5 Гц, 2 Н), 1,44 (с, 3H), 1,34 (с, 3H), 1,21 (т, J = 7,0 Гц, 6 Н). []20D = -8,4 (с 0,54,CHCl3). К раствору 8 а (где W и W представляют собой OEt, R1, R2 и R3 представляет собой Н) (1,7 г) в ацетоне (40 мл) при 0 С добавляют Fmoc-O-Su (2,1 г) и водный раствор Na2CO3H2O (0,75 г в 40 мл). Смесь выдерживают в течение 18 ч при комнатной температуре и экстрагируют CH2Cl2, затем растворитель выпаривают и остаток хроматографируют, получая при этом продукт 8 а (где W и W представляют собойOEt, R1 и R2 представляет собой Н, R3 представляет собой Fmoc) в виде желтоватого масла (2,2 г). 1 Н ЯМР (CDCl3) : 7,73 (д, J = 7,3 Гц, 2 Н), 7,56 (м, 2 Н), 7,34 (м, 4 Н), 4,63 (м, 2 Н), 4,47-4,14 (м, 3H),4,19 (т, J = 4,9 Гц, 1 Н), 3,74-3,02 (м, 10H), 1,42-1,04 (м, 12 Н). []20D = -34 (с 0,38, МеОН). Соединение 8 а (где W и W представляют собой OEt, R1 и R2 представляют собой Н и R3 представляет собой Fmoc) (1,9 г), растворенное в трифторуксусной кислоте (8 мл), выдерживают в течение 18 ч при комнатной температуре. После выпаривания TFA сырой продукт, растворенный в МеОН, фильтруют на короткой подушке NaHCO3, затем растворитель выпаривают и остаток хроматографируют, получая при этом указанное в заголовке соединение в виде белого твердого вещества (1 г). 1 Н ЯМР (CDCl3) : 7,77 (д, J = 7,0 Гц, 2 Н), 7,57 (д, J = 7,0 Гц, 2 Н), 7,38 (м, 4 Н), 5,51 (с, 1 Н), 4,92-2,95(1S,5S,7S)-3-(9-флуоренилметоксикарбонил)-6,8-диокса-3-азабицикло[3.2.1]октан-7-эндокарбоновой кислоты (соединение формулы (I), где X, R1 и R2 представляют собой Н, R3 представляет собой Fmoc, R6 представляет собой (S)-COOH) (соединение 39). К раствору соединения формулы (I), где X, R1 и R2 представляют собой Н, R3 представляет собойFmoc, R6 представляет собой (R)-CH2OH (соединение 61) (0,9 г), полученному в соответствии с примером 8, в ацетоне (75 мл) добавляют реагент Джонса при 0 С [получен медленным добавлением H2SO4(2,8 мл) к раствору CrO3 (1,5 г) в H2O (20 мл) при 0 С]. Смесь выдерживают в течение 18 ч при комнатной температуре и затем добавляют изопропанол, фильтруют на целите и упаривают. Сырой продукт растворяют в EtOAc (45 мл) и экстрагируют 10% NaHCO3 в воде. После отделения водную фазу подкисляют до рН 1 при помощи HCl и экстрагируют EtOAc. Упаривание органической фазы дает сырой продукт, который хроматографируют, получая при этом указанное в заголовке соединение (0,7 г) в виде белого твердого вещества. 1 Н ЯМР (CDCl3) : 7,75 (м, 2 Н), 7,53 (д, J = 7,0 Гц, 2 Н), 7,38 (м, 4 Н), 5,56 (с, 1 Н), 4,74-4,45 (м, 4 Н),4,23-3,91 (м, 4 Н), 3,29-3,11 (м, 2 Н). Т.пл. 79-82 С, []20D = -53 (с 0,5, CHCl3). Пример 10. Получение (1R,5R,7R)-3-(9-флуоренилметоксикарбонил)-6,8-диокса-3-азабицикло[3.2.1]октан-7-эндокарбоновой кислоты (соединение формулы (I), где X, R1 и R2 представляют собой Н, R3 представляет собой Fmoc, R6 представляет собой (R)-COOH) (соединение 218). Раствор (1R,5R,7S)-3-(9-флуоренилметоксикарбонил)-7-эндогидроксиметил-6,8-диокса-3-азабицикло[3.2.1]октана (соединение формулы (I), где X, R1 и R2 представляют собой Н, R3 представляет собойL-арабинозы) такой же процедурой, как описано выше в примере 8 для его энантиомера, обрабатывают,как описано выше в примере 9 для его энантиомера, получая при этом 1,4 г указанного в заголовке соединения в виде белого твердого вещества. Т.пл. 71-81 С, []20D = +52,9 (с 0,50, CHCl3). Пример 11. Получение метил-3-бензил-5-фенил-2-оксо-(1S,5S,7R)-6,8-диокса-3-азабицикло[3.2.1]октан-7-экзокарбоксилата (соединение формулы (I), где X представляет собой О, R1 представляет собой Ph, R2 представляют собой Н, R3 представляет собой Bn, R6 представляет собой (R)-COOMe)(R,R)-винной кислоты 6 (2,49 г, 5,33 ммоль) и DIPEA (5,4 мл). Смесь перемешивают при комнатной температуре в течение 2 ч, растворитель выпаривают, получая при этом масло, которое экстрагируют этилацетатом. Раствор промывают 5% раствором KHSO4 и 5% NaHCO3 в воде. После выпаривания растворителя остаток очищают хроматографией, получая при этом 8b (X представляет собой О, R1 представляет собой Ph, R2 представляет собой Н, R3 представляет собой Bn) (3,2 г) в виде бесцветного масла. 1 Н ЯМР : 7,90-7,85 (м, 2 Н), 7,61-7,22 (м, 8 Н), 5,39 (д, J = 5,1 Гц, 1 Н), 5,11 (д, J = 5,1 Гц, 1 Н), 4,884,10 (м, 4 Н), 3,80 (с, 3H), 1,49 (с, 3H), 1,31 (с, 3H). Раствор 8b (3,2 г) (где X представляет собой О, R1 представляет собой Ph, R2 представляет собой Н,R3 представляет собой Bn) в толуоле (80 мл) быстро добавляют к суспензии H2SO4/SiO2 (30 мас./мас.%,1,4 г) в толуоле при кипячении с обратным холодильником (120 мл). Спустя 15 мин одну треть растворителя выпаривают и горячую оставшуюся смесь фильтруют на короткой подушке NaHCO3. После выпаривания растворителя остаток очищают хроматографией, получая при этом 2,4 г указанного в заголовке соединения в виде бесцветного твердого вещества. 1 Н ЯМР : 7,62-7,59 (м, 2 Н), 7,41-7,24 (м, 8 Н), 5,16 (с, 1 Н), 4,92 (с, 1 Н), 4,61 (м, 2 Н), 3,74 (с, 3H),3,46 (м, 2H). Т.пл. 113-114 С, []25D = -64,0 (с 1, CHCl3). Пример 12. Получение метил-3-бензил-5-фенил-(1S,5S,7R)-6,8-диокса-3-азабицикло[3.2.1]октан-7 экзокарбоксилата (соединение формулы (I), где X и R2 представляют собой Н, R1 представляет собой Ph,R3 представляет собой Bn, R6 представляет собой (R)-COOMe) (соединение 120). К раствору в сухом ТГФ (25 мл) (соединение формулы (I), где X представляет собой О, R1 представляет собой Ph, R2 представляет собой Н, R3 представляет собой Bn, R6 представляет собой(R)-COOMe (соединение 17), полученного, как описано в примере 11 (2,5 ммоль), при 0 С по каплям добавляют BH3 Me2S (10 М, 0,5 мл, 4,9 ммоль). Смесь выдерживают в течение 16 ч и затем добавляют EtOH(1 мл), 3 М NaOH (1 мл) и H2O (20 мл). После экстракции смеси диэтиловым эфиром и выпаривания растворителя остаток очищают хроматографией, получая при этом 1 г указанного в заголовке соединения в виде бесцветного твердого вещества. 1 Н ЯМР : 7,72-7,58 (м, 2 Н), 7,52-7,19 (м, 8 Н), 5,00 (с, 1 Н), 4,86 (с, 1 Н), 3,75 (м, 2 Н), 3,78 (с, 3H),3,62 (м, 2 Н), 3,16 (д, J = 11,2, 4 Н), 2,93 (д, J = 11,6, 2 Н), 2,63 (д, J = 11,0, 2 Н). Т.пл. 97 С, []25D = 13,0 (с 1,CHCl3). Пример 13. Получение метил-(1S,4S,7R)-3,4-дибензил-2-оксо-6,8-диокса-3-азабицикло[3.2.1]октан 7-экзокарбоксилата (соединение формулы (I), где X представляет собой О, R1 представляет собой Н, R2 представляет собой (S)-Bn, R3 представляет собой Bn, R6 представляет собой (R)-COOMe) (соединение 12). К раствору L-фенилаланинола 3 с (где W представляет собой Н, W представляет собой ОН, R1 представляет собой Н, R2 представляет собой Bn, R3 представляет собой Н) (5 г) в МеОН (150 мл) добавляют бензальдегид (3,3 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, затем небольшими порциями в течение 2 ч при 0 С добавляют 1,2 г NaBH4. Растворитель выпаривают и остаток экстрагируют 50 мл HCl при рН 2. Водный раствор экстрагируют Et2O, обрабатывают Na2CO3 до достижения рН 9 и затем экстрагируют CHCl3. Органическую фазу выпаривают, получая при этомN-бензил-(L)-фенилаланинол в виде белого твердого вещества (7 г) 3 с (где W представляет собой Н, W представляет собой ОН, R1 представляет собой Н, R2 представляет собой Bn, R3 представляет собой Bn). 1 Н ЯМР (CDCl3) , м.д.: 7,34-7,06 (м, 10H), 3,73 (с, 2 Н), 3,31 (дд, J = 6,2, 12,5 Гц, 1 Н), 3,00-2,81 (м,1 Н), 2,80-2,66 (м, 2 Н), 2,62 (дд, J = 6,2, 12,5 Гц, 1 Н). К раствору N-бензил-(L)-фенилаланинола 3 с (2,8 г) в 23 мл CHCl3 при 0 С добавляют DIPEA (4 мл),HOBt (2,1 мл) и раствор метилового эфира (2R,3R)-2,3-О-изопропилиденвинной кислоты (6) (2,4 г) в 23 мл CHCl3. Затем добавляют 1,7 г DIPC. После выдерживания 72 ч при комнатной температуре растворитель выпаривают и сырой остаток очищают хроматографией, получая при этом желтоватое твердое вещество (2,4 г) 9 с (где W представляет собой Н, W представляет собой ОН, R1 представляет собой Н, R2 представляет собой Bn, R3 представляет собой Bn). 1 Н ЯМР (CDCl3) , м.д.: (смесь ротамеров 2:1), основные 7,40-7,05 (м, 10H), 5,28 (д, J = 6,0 Гц,1 Н), 4,81 (д, J = 6,0 Гц, 1 Н), 4,75 (д, J = 16,4 Гц, 1 Н), 4,0 (д, J = 16,4 Гц, 1 Н), 3,79 (с, 3H), 3,70 (м, 1 Н), 3,60(м, 1 Н), 3,46 (м, 1 Н), 3,04 (м, 1 Н), 1,52 (с, 3H), 1,49 (с, 3H). []25D = -72 (с 0,5, CHCl3). Соединение 9 с (где W представляет собой Н, W представляет собой ОН, R1 представляет собой Н,R2 представляет собой Bn, R3 представляет собой Bn) окисляют в соединение 10 (где W представляет собой О, W представляет собой О, R1 представляет собой Н, R2 представляет собой Bn, R3 представляет собой Bn) по способу окисления Сверна. 4,5 г спирта (9 с) в 20 мл CH2Cl2 окисляют, как обычно, обработкой оксалилхлоридом, ДМСО и DIPEA. После обычной обработки соединение (10) (5 г) получают в виде желтого твердого вещества. 1 Н ЯМР (CDCl3) , м.д.: 9,44 (с, 1 Н), 7,40-7,00 (м, 10H), 5,33 (д, J = 6,2 Гц, 1 Н), 4,92 (д, J = 6,2 Гц,1 Н), 4,89 (д, J = 18,7 Гц, 1 Н), 3,79 (с, 3H), 3,53 (дд, J = 9,8, 4,3 Гц, 1 Н), 3,44 (д, J = 18,7 Гц, 1 Н), 3,41 (дд,J = 13,9, 4,3 Гц, 1 Н), 3,12 (дд, J = 13,9, 9,8 Гц, 1 Н), 1,54 (с, 3H), 1,45 (с, 3H). Продукт добавляют в толуоле (15 мл) к суспензии 2,5 г SiO2 и H2SO4 в 30 мл кипящего с обратным холодильником толуола в течение 30 мин. Через 15 мин одну треть растворителя отгоняют и горячую оставшуюся смесь фильтруют на короткой подушке NaHCO3. После выпаривания растворителя остаток очищают хроматографией, получая при этом 3,2 г указанного в заголовке соединения. 1 Н ЯМР (CDCl3) , м.д.: 7,40-7,15 (м, 8 Н), 7,03 (м, 2 Н), 5,51 (с, 1 Н), 5,33 (д, J = 15,0 Гц, 1 Н), 4,97 (с,1 Н), 4,71 (с, 1 Н), 4,03 (д, J = 15,0 Гц, 1 Н), 3,75 (с, 3H), 3,32 (дд, J = 10,7, 3,7 Гц, 3H), 3,15 (дд, J = 13,5,3,7 Гц, 1 Н), 2,75 (дд, J = 13,5, 10,7 Гц, 1 Н). Пример 14. Получение (1S,4S,7R)-3,4-дибензил-6,8-диокса-7-экзогидроксиметил-3-азабицикло[3.2.1]октана (соединение формулы (I), где X и R1 представляют собой Н, R2 представляет собой(S)-Bn, R3 представляет собой Bn, R6 представляет собой (R)-CH2OH) (соединение 184). К раствору в 100 мл безводного ТГФ соединения формулы (I), где X представляет собой О, R1 представляет собой Н, R2 представляет собой (S)-Bn, R3 представляет собой Bn, R6 представляет собой(3 мл, 10 М) в ТГФ. После выдерживания 38 ч при комнатной температуре реакционную смесь обрабатывают сухим EtOH (6 мл) и 10% NaOH (6 мл), затем разбавляют 50 л воды и экстрагируют Et2O. После выпаривания растворителя остаток очищают хроматографией, получая при этом 1,7 г указанного в заголовке соединения в виде желтоватого твердого вещества. 1 Н ЯМР (CDCl3) , м.д.: 7,40-7,00 (м, 10H), 5,11 (с, 1 Н), 4,39 (т, J = 5,1 Гц, 1 Н), 4,24 (с, 1 Н), 3,81 (д,J = 13,6 Гц, 1 Н), 3,63 (д, J = 13,6 Гц, 1 Н), 3,52 (м, 2 Н), 3,00 (м, 1 Н), 3,00-2,80 (м, 2 Н), 2,94 (д, J = 11,6 Гц,1 Н), 2,45 (дд, J = 11,6, 1,8 Гц, 1 Н). []25D = -59 (с 0,2, CHCl3).- 11014553 Биологическая активность Биологическую активность 3-азабицикло[3.2.1]октанов формулы (I) оценивали различными анализами: индукцией выживания РС 12-клеток в безсывороточных условиях, индукцией пролиферативной активности в клеточной линии РС 3 простатической карциномы, индукцией полипептидного синтезаVGF, вытеснением связывания к 125I-NGF специфическому поверхностному рецептору и индукцией аутофосфорилирования Trk-A. Во всех этих анализах в качестве внутреннего стандарта использовали рекомбинантный (hr)NGF человека. Влияние соединений на выживание РС 12-клеток в безсывороточных условиях Биологическую активность 3-азабицикло[3.2.1]октанов формулы (I) испытывали на способность индуцировать выживание клеток РС 12 в безсывороточной среде с использованием hrNGF в качестве внутреннего стандарта. Клетки Р 12 отделяли от колб с тканью при помощи PBS-EDTA (физиологического раствора, в который добавлена этилендиаминотетрауксусная кислота) и промывали один раз PBS для удаления остаточных количеств сыворотки. Клетки затем разводили в среде RPMI-1640 без фенолового красного, дополненной пенициллином и стрептомицином, и культивировали в 96-луночных планшетах при конечной концентрации 5103/лунку. Стандартную кривую получали добавлением в трех повторностях культур с различными концентрациями hrNGF в диапазоне между 1-25 нг/мл. Соединения добавляли в трех повторностях при конечной концентрации 1, 10, 100 мкМ. Клетки затем культивировали в течение 60 ч при 37 С в увлажненной атмосфере с 5% CO2. Затем к каждой лунке планшетов добавляли 10 мкл бромида(3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия (МТТ, 0,5 мг/мл в изопропаноле), планшеты защищали от света и выдерживали при 37 С в течение 4 ч. В конце инкубации к каждой лунке добавляли 100 мкл 50% диметилформамида (в 20% SDS, рН 7,4). Колориметрическую реакцию детектировали 96-луночным (планшет)-ридером регистрацией поглощения при 570 нм. Результаты выражали как выживание, индуцированное соединениями/самопроизвольное выживание 100. На фиг. 1 показаны результаты, полученные с 10 мкМ наиболее репрезентативных соединений и с 1 нМ hrNGF. Влияние соединений на пролиферативную активность клеточной линии PC3 Способность 3-азабицикло[3.2.1]октанов формулы (I), указанных в табл. 1-4, индуцировать пролиферацию клеточной линии PC3 в безсывороточных условиях испытывали с использованием hrNGF в качестве внутреннего стандарта. Клетки PC3 культивировали в трех повторностях в 24-луночных планшетах при конечной концентрации 104 клеток/мл (конечный объем 500 мкл) в среде RPMI 1640 в присутствии или в отсутствие 1, 10,100 мкМ соединений или различных концентраций (между 1-25 нг/мл) hrNGF в качестве внутреннего стандарта. Клетки инкубировали в течение 60 ч в увлажненной атмосфере с 5% CO2. В конце инкубации к каждой лунке добавляли 0,5 мкКи 3 Н-тимидина и клетки выдерживали в течение 8 ч. Клетки затем промывали 6 раз PBS, лизировали 0,1% тритоном Х 100 в 0,1 М фосфатном буфере и радиоактивность регистрировали в счетчике -сцинтилляции. Результаты выражали как отношение между включением(среднее значение SD) 3 Н-тимидина стимулированных культур и включением 3 Н-тимидина нестимулированных культур. На фиг. 2 показаны результаты, полученные с 10 мкМ выбранных соединений или с 1 нМ hrNGF в качестве внутреннего стандарта. Индуцирование продуцирования VGF клетками РС 12 3-Азабицикло[3.2.1]октаны формулы (I) с замещениями, указанными в табл. 1-4, испытывали также на способность индуцировать продуцирование VGF клетками РС 12. 5106 клеток РС 12 культивировали в присутствии или в отсутствие 1, 10, 100 мкМ указанных выше соединений или 4 нМ hrNGF в качестве внутреннего стандарта в течение 24 ч в увлажненной атмосфере с 5% CO2. Клетки лизировали в 25%NP-40 в PBS, дополненном 1 мМ PMSF (метилфенил) и 1 мМ лейпептином, и концентрацию белка измеряли в каждом образце анализом Бредфорда. Равные количества белков (30 мкг) загружали в 8% системуSDS-полиакриламидный гель, подвергали электрофорезу, блоттингу на нитроцеллюлозной мембране и окрашивали моноклональными антителами против VGF и затем конъюгированным с пероксидазой антимышиным IgG. Реакцию визуализировали усовершенствованным хемилюминесцентным реагентом (ECL,Amersham) по инструкции производителя. На фиг. 3 показаны результаты, полученные с 10 мкМ выбранными соединениями ( 91, 9, 323,270) или с 10 нМ hrNGF. VGF индуцируется выбранными соединениями, так же как hrNGF. Вытеснение связывания 125I-NGF с клетками РС 12 Способность выбранных соединений вытеснять связывание NGF со специфическим поверхностным рецептором оценивали посредством классических способов связывания йодированного лиганда. Клетки РС 12 отделяли от колб с тканью при помощи PBS-EDTA, промывали средой HKR (10 мМBSA) и инкубировали в трех поверхностях в среде HKR с 0,1 нМ 125I-NGF в присутствии или в отсутствие изменяемых концентраций соединений, которые должны быть анализированы, или hrNGF в качестве внутреннего стандарта. Кривую вытеснения получали анализом образовавшейся радиоактивности, свя- 12014553 занной с клетками, в присутствии соединений или hrNGF адекватным программным обеспечением (графит 4). На фиг. 4 показана кривая вытеснения, полученная с соединением 9, используемого в качестве конкурента. Анализ данных обнаруживал Kd 165 мМ 0,05. На фиг. 4b показана кривая вытеснения, полученная с использованием hrNGF в качестве конкурента. Анализ данных обнаруживал Kd 114 пМ 0,01,как уже указывалось. Аутофосфорилирование Trk-A Для оценки способности 3-азабицикло[3.2.1]октанов формулы (I), указанных в табл. 1-4, индуцировать аутофосфорилирование Trk-A клетки РС 12 культивировали в среде, дополненной 5% FBS, в течение 48 ч, промывали и уравновешивали безсывороточной средой в течение 2 ч. 2,5106 клеток затем стимулировали 10 мкМ выбранными соединениями в течение 30 мин или с 10 нМ hrNGF в качестве положительного контроля. Клетки затем лизировали 0,5% тритона Х 100 в PBS, дополненном ингибиторами протеазы (PMSF, апротинином, пепстанином, лейпептином) и ингибиторами фосфатазы. Концентрацию белков в каждом образце оценивали анализом Бредфорда и равные количества (50 мкг) белков загружали на систему SDS-полиакриламидный гель, подвергали электрофорезу и блоттингу на нитроцеллюлозной мембране. Мембраны окрашивали кроличьими антителами против (Tyr 490 и Tyr 674/675)-фосфорилированной Trk-A (Cell Signaling Technology), используемыми при конечном разведении 1:1000. После промывания мембраны окрашивали HRP-конъюгированным антикроличьим IgG и реакцию визуализировали с применением реагентов ECL по инструкциям производителя. На фиг. 5 показаны результаты, полученные с соединениями 272, 325, 9, 91 и с hrNGF, используемым в качестве внутреннего стандарта. Выбранные соединения способны индуцировать аутофосфорилирование Trk-A, таким образом стимулируя трансдукцию биологических сигналов. Синергическая активность Синергическую активность многих комбинаций 3-азабицикло[3.2.1]октанов формулы (I), указанных в табл. 1-4, оценивали в анализе выживания РС 12 в безсывороточных условиях. Клетки РС 12 засевали в 96-луночных планшетах при концентрации 5103/лунку и культивировали в трех повторностях в присутствии или в отсутствие 5 мкМ выбранных соединений или многих комбинацией тех же соединений при конечной концентрации 10 мкМ. 0,5 нМ hrNGF использовали в качестве внутреннего стандарта. После выдерживания 60 ч при 37 С во влажной атмосфере с 5% CO2 к каждой лунке планшетов добавляли 10 мкл бромида 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия (МТТ,0,5 мг/мл в изопропаноле), планшеты защищали от света и выдерживали при 37 С в течение 4 ч. В конце инкубации к каждой лунке добавляют 100 мкл 50% диметилформамида (в 20% SDS, рН 7,4). Колориметрическую реакцию детектировали 96-луночным (планшетом)-ридером регистрацией поглощения у 570 нм. Результаты выражали как выживание, индуцированное соединениями/самопроизвольное выживание 100. На фиг. 6 показано, что выбранные комбинации 2 соединений (91 и 325) индуцируют более высокую активность выживания, чем сумма активностей, индуцированных одним соединением. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, содержащая в качестве активного ингредиента по меньшей мере одно или несколько производных 3-азабицикло[3.2.1]октана с общей формулой (I)R1 и R2, взятые вместе, являются C1-4-алкилом, С 2-4-алкенилом, циклопропилом циклобутилом, циклопентилом, циклогексилом, циклогептилом, циклооктилом, норборнанилом, канфанилом, адамантанилом или бензоконденсированным циклопропилом, циклобутилом, циклопентилом, циклогексилом, циклогептилом, циклооктилом, норборнанилом, санфанилом, адамантанилом циклоалкилом, образующим 3-, 4-, 5- или 6-членные мостики,- 13014553R3 выбран из группы, состоящей из Н, C1-8-алкила, C2-8-алкенила, C2-8-алкинила, циклопропила,циклобутила, циклопентила, циклогексила, циклогептила, циклооктила, норборнанила, канфанила, адамантанила, фенила, бифенила и нафтила, фенила-, бифенила-, нафтила-C1-8-алкила, пиридина-, имидазола-, пиррола-, индола-, триазолов-, пирролидина-, пиперидина-C1-8-алкила, RR'N-C1-8-алкила, RR'Nфенила, -бифенила, -нафтила, RO-C1-8-алкила, RO(O)C-C1-8-алкила, R(O)С-С 1-8-алкила, RC(O)N(R)C1-8 алкила, RO-фенила, -бифенила, -нафтила, RO(O)C-фенила, -бифенила, -нафтила, R(O)C-фенила,-бифенила, -нафтила, RC(O)O-фенила, -бифенила, -нафтила, RC(O)N(R)фенила, -бифенила, -нафтила,-СН(аминокислотная боковая цепь)CO2R, -СН(аминокислотная боковая цепь)С(O)NR, -CH(CO2R)аминокислотная боковая цепь, СН(CONRR')-аминокислотная боковая цепь, Fmoc, Boc и Cbz,R6 выбран из группы, состоящей из Н, С 1-8-алкила, С 2-8-алкенила, C2-8-алкинила, циклопропила,циклобутила, циклопентила, циклогексила, циклогептила, циклооктила, норборнанила, канфанила, адамантанила, фенила, бифенила, нафтила, фенила-, бифенила-, -нафтила C1-8-алкила, пиридина, имидазола,пиррола, индола, триазолов, пирролидина, пиперидина, пиридина-, имидазола-, пиррола-, индола-, триазолов-, пирролидина-, пиперидина-C1-8-алкила; -C(O)R, -C(O)OR, -C(O)NRR', CH2OR, CH2NRR',-C(O)NH-СН(аминокислотная боковая цепь)C(O)OR, CH2NR-Fmoc, CH2NR-Boc и CH2NR-CBz,X представляет собой О,и где группы алкила, алкенила, алкинила, циклопропила, циклобутила, циклопентила, циклогексила, циклогептила, циклооктила, норборнанила, канфанила, адамантанила, фенила, бифенила и нафтила и гетероциклические группы, указанные выше, могут быть замещены одним или несколькими остатками,выбранными из группы, состоящей из галогена, циано, нитро, амино, гидрокси, карбоксила, карбонила иC1-6-алкила, где указанная фармацевтическая композиция предназначена для использования при лечении заболеваний, связанных с дефектом функции нейротрофинов. 2. Фармацевтическая композиция по п.1, где производные 3-азабицикло[3.2.1]октана формулы (I) выбраны из соединений, имеющих следующие формулы: 3. Фармацевтическая композиция по любому из пп.1-3, дополнительно содержащая фармацевтически приемлемые эксципиенты и/или разбавители. 4. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой(I) по п.1 для получения фармацевтических композиций для лечения:i) нейродегенеративных, воспалительных, токсических, травматических или васкулярных нарушений центральной, периферической или вегетативной нервной системы, нервных поражений, вторичных к гипоксии, ишемии, ожогам, химиотерапии, токсическим соединениям различного происхождения (в том числе алкоголю), инфекциям, травме (включая хирургическую травму), происходящей от аксотомии мотонейронов, сенсорной, двигательной или сенсорно-двигательной невропатий или автономных дисфункций, вторичных к разнообразным патологиям, генетических заболеваний, нервных патологий разнообразного происхождения, корнеальных заболеваний различного происхождения, патологий вследствие пониженной подвижности желудочно-кишечного тракта или вследствие атонии мочевого пузыря, эндокринных неопластических патологий, клинических состояний, при которых благоприятной является стимуляция процессов обучения, и всех патологических состояний, возникающих вследствие апоптических процессов нервных клеток;ii) заболеваний приобретенного иммунодефицита вследствие пониженной или отсутствующей биологической доступности NGF;iii) состояний, при которых может быть благоприятной стимуляция неоангиогенеза;iv) глазных патологий. 5. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой(I) по п.4, где указанные нейродегенеративные, воспалительные, токсические, травматические или васкулярные нарушения центральной, периферической или вегетативной нервной системы выбраны из болезни Альцгеймера (AD), бокового амиотрофического склероза (ALS), болезни Хантингтона, рассеянного склероза, эпилепсии, синдрома Дауна, глухоты, связанной с поражением слухового нерва, и болезни Меньера. 6. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой(I) по п.4, где указанные нервные повреждения, вторичные к инфекциям, выбраны из полиовируса и вируса ВИЧ. 7. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой(I) по п.4, где указанные генетические нарушения выбраны из болезни Шарко-Мари-Тута, болезни Refsum, абеталипопротеинемии, болезни Танжье, болезни Краббе, метахроматической лейкодистрофии, бо- 16014553 лезни Фабри, болезни Дежерина-Сотта. 8. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой(I) по п.4, где указанные нервные патологии разнообразного происхождения выбраны из диффузной атрофии коры головного мозга, деменции, ассоциированной с болезнью телец Леви, болезни Пика, мезолимбокортикальной деменции, нейронного восковидного липофусциноза, таламической дегенерации,кортикостриоспинальной дегенерации, кортикобазальной ганглиозной дегенерации, церебромозжечковой дегенерации, семейной деменции со спастическим парапарезом, заболевания полиглюкозановых телец, синдрома Шая-Дрейджера, оливопонтомозжечковой атрофии, прогрессирующего супрануклеарного паралича, мышцы деформирующей дистонии, болезни Галлерворден-Шпатца, синдрома Мейгса, семейного тремора, синдрома Жилль де ла Туретта, синдрома хорея-акантоцитоза, атаксии Фридрайха, кортикомозжечковой семейной атрофии Холмса, болезни Герстманн-Страусслер-Шнейкера, прогрессирующей спинальной мышечной атрофии, спастической нижней параплегии, перонеальной мышечной атрофии,гипертрофической интерстициальной полиневопатии и полиневритической атаксической наследственной патологии. 9. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой(I) по п.4, где указанные глазные патологии выбраны из невропатии глазных нервов, гетинальной дегенерации, офтальмоплегии и глаукомы, а указанные корнеальные заболевания различного происхождения выбраны из нейротрофических язв, послетравматических и послеинфекционных корнеальных заболеваний. 10. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой(I) по п.5, где указанные патологии вследствие пониженной подвижности желудочно-кишечного тракта или вследствие атонии мочевого пузыря выбраны из интерстициального цистита или диабетического цистита. 11. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой(I) по п.4, где указанные состояния, при которых может быть благоприятной стимуляция неоангиогенеза,выбраны из инфаркта миокарда, удара, церебральных аневризм, гастродуоденальных язв, заживления раны и периферических васкулопатий. 12. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой(I) по п.5, где указанное приобретенное иммунодефицитное заболевание является иммунодефицитом старения. 13. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой(I) по пп.1-3 в качестве реагентов для стимуляции роста in vivo, и/или in vitro, и/или ex vivo выживания нервных клеток. 14. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой(I) по п.13, где указанные нервные клетки выбраны из группы, состоящей из допаминергических, холинергических, сенсорных нервных клеток, стриарных клеток, кортикальных клеток, клеток полосатого тела, гиппокампа, мозжечка, обонятельной луковицы, периводопроводных клеток, клеток ядер шва, locuscoeruleus (голубое пятно), ганглий дорсальных корешков, нервных клеток симпатической нервной системы, низших двигательных нейронов, нервных клеток ствола и клеток, происходящих из нервных бляшек. 15. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой(I) по пп.1-3 для получения сред для культивирования и хранения, пригодных для консервирования эксплантированных роговиц, предназначенных для трансплантации. 16. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой(I) по пп.1-2, меченых реагентами и возможно обработанных процедурами, пригодными для целей получения в медицине изображений, для анализа изображения ткани или органов, содержащих рецепторы нейротрофинов. 17. Применение одного или нескольких производных 3-азабицикло[3.2.1]октана с общей формулой(I) по п.16 для мониторинга использования и эффективности лекарственных средств или для установления диагноза заболеваний млекопитающих, в которых принимают участие рецепторы нейротрофинов.
МПК / Метки
МПК: A61K 31/551, A61K 31/55, A61K 31/553, A61K 31/554
Метки: нейротрофинами, композиции, лечения, заболеваний, фармацевтические, связанных
Код ссылки
<a href="https://eas.patents.su/20-14553-farmacevticheskie-kompozicii-dlya-lecheniya-zabolevanijj-svyazannyh-s-nejjrotrofinami.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические композиции для лечения заболеваний, связанных с нейротрофинами</a>












