Способ лечения рака, фармацевтические композиции, содержащие 2-хинолоны
Номер патента: 3933
Опубликовано: 30.10.2003
Авторы: Гийоме Жераль, Дарро Франсис, Жозеф Бенуа, Фридман Арман, Кисс Роберт
Формула / Реферат
1. Способ лечения рака, включающий введение эффективного количества противоопухолевого агента, выбранного из цитотоксических агентов, и эффективного количества соединения, выбранного из соединений формулы
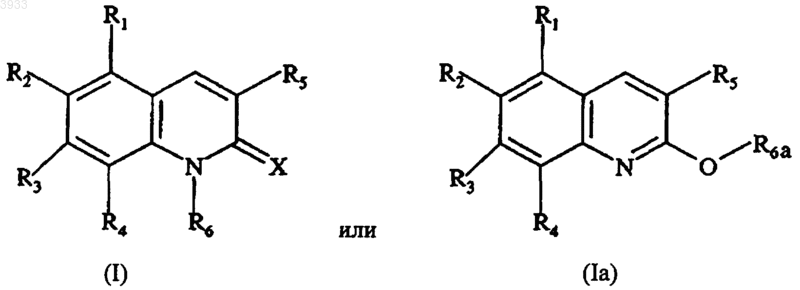
где X выбирают из =O, =S и =N-NH-R7, R7 представляет собой фенильную или пиридильную группу,
R1, R2, R3 и R4 независимо друг от друга выбирают из H, OH, C1-C4алкильной группы, C1-C4алкоксигруппы, группы -OCO-R8, R8 представляет собой C1-C4алкильную группу и группу, производную от сахарида, по меньшей мере один из заместителей R1, R2, R3 или R4 отличен от H, и R2 и R3 вместе возможно образуют метилендиоксигруппу,
R5 представляет собой фенильную группу или фенильную группу, замещенную от 1 до 3 раз группами, выбранными из H, OH, C1-C4алкоксигруппы, группы -OCO-R8, фенил(C1-C4алкокси)-группы, группы -O-SO2-R8', R8' представляет собой C1-C4алкильную группу или группу CF3 и группу, производную от сахарида,
R6 выбирают из H, C1-C4алкильной группы, группы -CO-R9 и группы -A-R10,
R6a выбирают из C1-C4алкильной группы, группы -CO-R9 и группы -A-R10,
R9 является C1-C4алкильной группой,
A является C1-C4алкиленовой группой,
R10 выбирают из 5- или 6-членных гетероциклических групп, содержащих от 1 до 4 гетероатомов, выбранных из кислорода, серы и азота, CN группы, группы -COOR11, -CONR12R13, группы -NR14R15 и группы -COR16,
R11, R12, R13, R14, R15 и R16 независимо выбирают из атома водорода, C1-C4алкильной группы и фенил(C1-C4алкильной)группы,
R4 и R6 вместе также возможно образуют -CO-CH2-CH2-группу.
2. Способ по п.1, в котором указанное соединение является соединением формулы (I),
где R1 представляет собой C1-C4алкоксигруппу,
R2 представляет собой атом водорода,
R3 представляет собой C1-C4алкоксигруппу,
R4 представляет собой атом водорода.
3. Способ по п.2, в котором указанное соединение является соединением формулы (I),
где R5 представляет собой 4-(C1-C4алкокси)фенильную группу.
4. Способ по п.3, в котором
R1 представляет собой метоксигруппу,
R3 представляет собой метоксигруппу и
R5 представляет собой 4-метоксифенильную группу.
5. Способ по п.4, в котором указанное соединение представляет собой 5,7-диметокси-3-(4-метоксифенил)-1,2-дигидро-2-хинолинон.
6. Способ по п.4, в котором указанное соединение представляет собой 3-[5,7-диметокси-3-(4-метоксифенил)-2-оксо-1,2-дигидро-1-хинолинил]пропаннитрил.
7. Способ по п.4, в котором указанное соединение представляет собой 1-[2-(1H-1,2,3,4-тетразол-5-ил)этил]-5,7-диметокси-3-(4-метоксифенил)-1,2-дигидро-2-хинолинон.
8. Способ по п.4, в котором указанное соединение представляет собой N,N-диэтил-3-[5,7-диметокси-3-(4-метоксифенил)-2-оксо-1,2-дигидро-1-хинолинил]пропанамид.
9. Фармацевтическая композиция, воздействующая на пролиферацию клоногенных клеток в опухолях и содержащая эффективное количество соединения, выбранного из соединений формулы
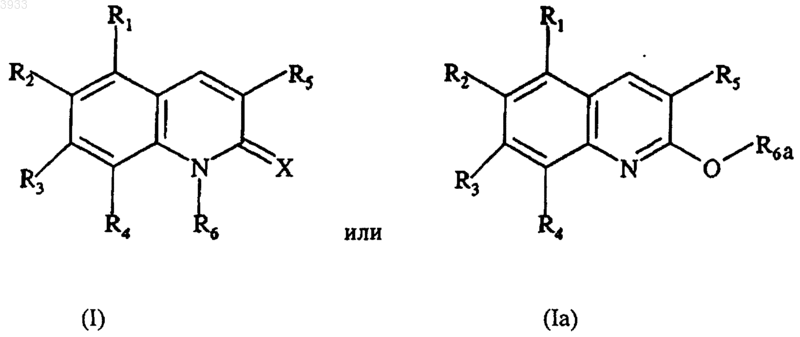
где X выбирают из =O, =S и =N-NH-R7, а R7 представляет собой фенильную или пиридильную группу,
R1, R2, R3 и R4 независимо друг от друга выбирают из H, OH, C1-C4алкильной группы, C1-C4алкоксигруппы, группы -OCO-R8, R8 представляет собой C1-C4алкильную группу, и группу, производную от сахарида, по меньшей мере один из заместителей R1, R2, R3 или R4 отличен от H, и R2 и R3 вместе возможно образуют метилендиоксигруппу,
R5 представляет собой фенильную группу или фенильную группу, замещенную от 1 до 3 раз группами, выбранными из H, OH, C1-C4алкоксигруппы, группы -OCO-R8, фенил(C1-C4алкокси)группы, группы -O-SO2-R8', R8' представляет собой C1-C4алкильную группу или группу CF3, и группу, выбранную из сахарида,
R6 выбирают из H, C1-C4алкильной группы, группы -CO-R9 и группы -A-R10,
R6a выбирают из группы -CO-R9 и группы -A-R10,
R9 является C1-C4алкильной группой,
A является C1-C4алкиленовой группой,
R10 выбирают из 5- или 6-членных гетероциклических групп, содержащих от 1 до 4 гетероатомов, выбранных из кислорода, серы и азота, CN группы, группы -COOR11, -CONR12R13, группы -NR14R15 и группы -COR16,
R11, R12, R13, R14, R15 и R16 независимо выбирают из атома водорода, C1-C4алкильной группы и фенил(C1-C4алкильной) группы,
R4 и R6 вместе возможно образуют -CO-CH2-CH2-группу.
10. Композиция по п.9, в которой указанное соединение является соединением формулы (I),
где R1 представляет собой C1-C4алкоксигруппу,
R2 представляет собой атом водорода,
R3 представляет собой C1-C4алкоксигруппу,
R4 представляет собой атом водорода.
11. Композиция по п.10, в которой указанное соединение является соединением формулы (I), где R5 представляет собой 4-(C1-C4алкокси)фенильную группу.
12. Композиция по п.11, в которой указанное соединение является соединением формулы (I), R1 представляет собой метоксигруппу, R3 представляет собой метоксигруппу и R5 представляет собой 4-метоксифенильную группу.
13. Композиция по п.12, в которой указанное соединение представляет собой 5,7-диметокси-3-(4-метоксифенил)-1,2-дигидро-2-хинолинон.
14. Композиция по п.12, в которой указанное соединение представляет собой 3-[5,7-диметокси-3-(4-метоксифенил)-2-оксо-1,2-дигидро-1-хинолинил]пропаннитрил.
15. Композиция по п.12, в которой указанное соединение представляет собой 1-[2-(1H-1,2,3,4-тетразол-5-ил)этил]-5,7-диметокси-3-(4-метоксифенил)-1,2-дигидро-2-хинолинон.
16. Композиция по п.12, в которой указанное соединение представляет собой N,N-диэтил-3-[5,7-диметокси-3-(4-метоксифенил)-2-оксо-1,2-дигидро-1-хинолинил]пропанамид.
17. Соединение формулы
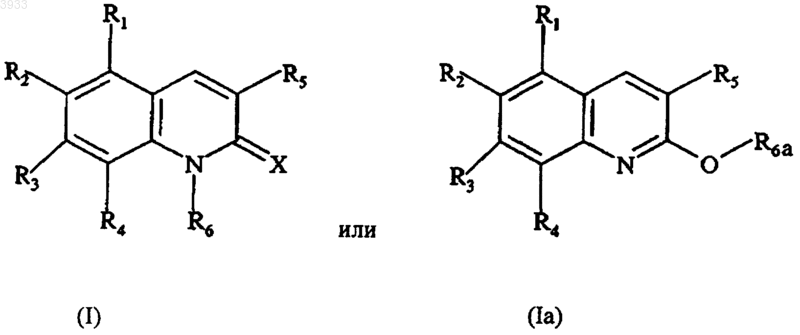
где X выбирают из =O, =S и =N-NH-R7, а R7 представляет собой фенильную или пиридильную группу,
R1, R2, R3 и R4 независимо друг от друга выбирают из H, OH, C1-C4алкильной группы, C1-C4алкоксигруппы, группы -OCO-R8, а R8 представляет собой C1-C4алкильную группу, и группу, производную от сахаршфр, по меньшей мере один из заместителей R1, R2, R3 или R4 является иным, чем H, и R2 и R3 вместе возможно образуют метилендиоксигруппу,
R5 представляет собой фенильную группу или фенильную группу, замещенную от 1 до 3 раз группами, выбранными из H, OH, C1-C4алкоксигруппы, группы -OCO-R8, фенил(C1-C4алкокси)группы, группы -O-SO2-R8', R8' представляет собой C1-C4алкильную группу или группу CF3, и группу, производную от сахарида,
R6 выбирают из C1-C4алкильной группы, группы -CO-R9 и группы -A-R10,
R6a выбирают из группы -CO-R9 и группы -A-R10,
R9 является C1-C4алкильной группой,
A является C1-C4алкиленовой группой,
R10 выбирают из 5- или 6-членных гетероциклических групп, содержащих от 1 до 4 гетероатомов, выбранных из кислорода, серы и азота, CN группы, группы -COOR11, -группы -NR12R13, группы -NR14R15 и группы -COR16,
R11, R12, R13, R14, R15 и R16 независимо выбирают из атома водорода, C1-C4алкильной группы и фенил(C1-C4алкильной) группы,
R4 и R6 вместе возможно также образуют -CO-CH2-CH2-группу.
18. Соединение по п.17, представляющее собой 3-[5,7-диметокси-3-(4-метоксифенил)-2-оксо-1,2-дигидро-1-хинолинил]пропаннитрил.
19. Соединение по п.17, представляющее собой 1-[2-(1H-1,2,3,4-тетразол-5-ил)этил]-5,7-диметокси-3-(4-метоксифенил)-1,2-дигидро-2-хинолинон.
20. Соединение по п.17, представляющее собой N,N-диэтил-3-[5,7-диметокси-3-(4-метоксифенил)-2-оксо-1,2-дигидро-1-хинолинил]пропанамид.
21. Соединение формулы
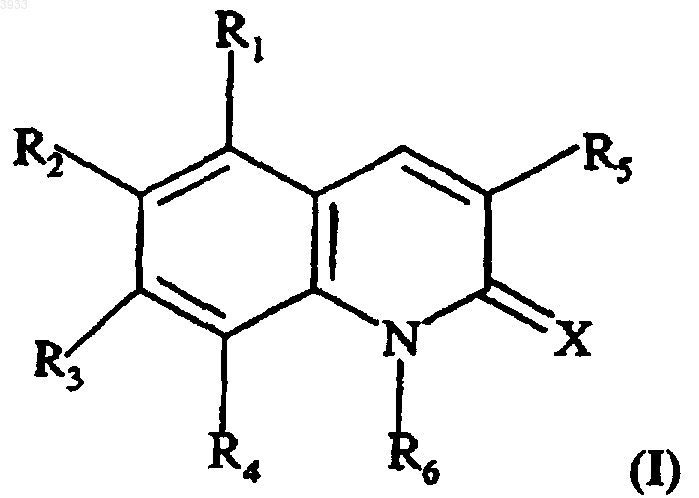
где X выбирают из =O, =S и =N-NH-R7, а R7 представляет собой фенильную или пиридильную группу,
R1, R2, R3 и R4 независимо друг от друга выбирают из H, OH, C1-C4алкильной группы, C1-C4алкоксигруппы, группы -OCO-R8, R8 представляет собой C1-C4алкильную группу, и группу, производную от сахарида, по меньшей мере один из заместителей R1, R2, R3 или R4 отличен от H, и R2 и R3 вместе возможно образуют метилендиоксигруппу,
R5 представляет собой фенильную группу или фенильную группу, замещенную от 1 до 3 раз группами, выбранными из H, OH, C1-C4алкоксигруппы, группы -OCO-R8, фенил(C1-C4алкокси)группы, группы -O-SO2-R8', а R8' представляет собой C1-C4алкильную группу или группу CF3, и группу, производную от сахарида,
R6 выбирают из группы -A-R10,
A является C1-C4алкиленовой группой,
R10 выбирают из 5- или 6-членных гетероциклических групп, содержащих от 1 до 4 гетероатомов, выбранных из кислорода, серы и азота, CN группы, группы -COOR11, -CONR12R13, группы -NR14R15 и группы -COR16,
R11, R12, R13, R14, R15 и R16 независимо выбирают из атома водорода, C1-C4алкильной группы и фенил(C1-C4алкильной) группы.
22. Соединение формулы
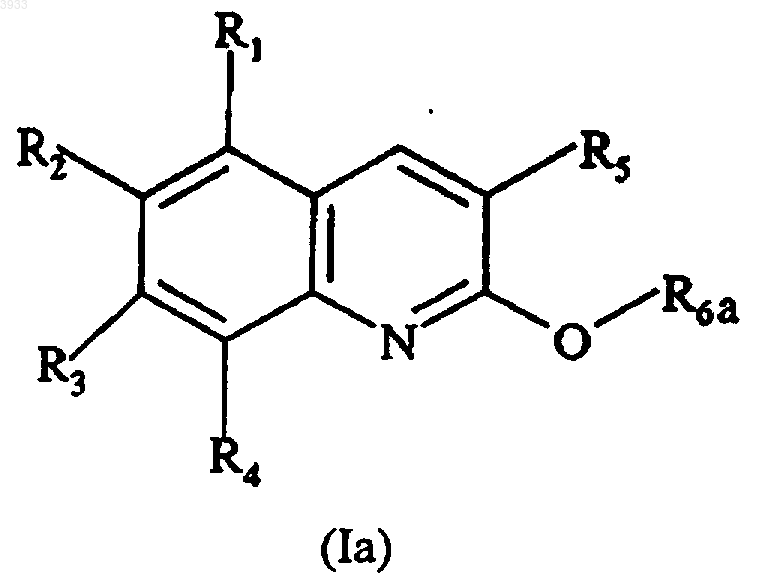
где R1, R2, R3 и R4 независимо друг от друга выбирают из H, OH, C1-C4алкильной группы, C1-C4алкоксигруппы, группы -OCO-R8, а R8 представляет собой C1-C4алкильную группу, и группу, производную от сахарида, по меньшей мере один из заместителей R1, R2, R3 и R4 является иным, чем H, и R2 и R3 вместе возможно образуют метилендиоксигруппу,
R5 представляет собой фенильную группу или фенильную группу, замещенную от 1 до 3 раз группами, выбранными из H, OH, C1-C4алкоксигруппы, группы -OCO-R8, фенил(C1-C4алкокси)группы, группы -O-SO2-R8', а R8' представляет собой C1-C4алкильную группу или группу CF3, и группу, производную от сахарида,
R6a выбирают из группы -CO-R9 и группы -A-R10,
R9 является C1-C4алкильной группой,
A является C1-C4алкиленовой группой,
R10 выбирают из 5- или 6-членных гетероциклических групп, содержащих от 1 до 4 гетероатомов, выбранных из кислорода, серы и азота, CN группы, группы -COOR11, -CONR12R13, группы -NR14R15 и группы -COR16,
R11, R12, R13, R14, R15 и R16 независимо выбирают из атома водорода, C1-C4алкильной группы и фенил(C1-C4алкильной)группы.
23. Соединение по п.17, в котором R11 представляет собой фенил(C1-C4алкильную)группу.
24. Фармацевтическая композиция по п.9, в которой соединение формулы (I) представляет собой соединение по п.17 или 23.
Текст
1 Область техники Настоящее изобретение относится к медицине, а именно к фармацевтическим композициям, содержащим 2-хинолоны или их производные, а также к области химии новых производных хинолинов. Уровень техники В ЕР-А-0024638 уже было раскрыто терапевтическое применение некоторых 2 хинолонов для увеличения синтеза глюкозы. ВWO-A-93/11115 было раскрыто применение 2 хинолонов, в особенности замещенных в 7 положении хлором, в качестве агонистов NMAрецептора. Дополнительно в WO-A-94/02145 было раскрыто применение 2-арил-4-хинолонов в качестве противоопухолевых агентов. Раковые заболевания представляют собой расстройство соматических генов, в ходе которого усиливаются генетические дисфункции, по мере того, как развивается процесс роста опухоли от состояния предракового повреждения до злокачественной трансформации, раковая опухоль становится метастатической и часто - устойчивой к цитотоксическим лекарственным средствам. Несмотря на значительные усилия, которые прилагаются во всех развитых странах, в частности, в ходе экспериментальных и клинических исследовательских программ, смертность от различных раковых заболеваний (твердых опухолей и гематологических неоплазий) остается недопустимо высокой. Во многих странах раковые заболевания являются второй по счету из наиболее распространенных причин смерти после сердечно-сосудистых заболеваний. Среди вновь диагностированных раковых заболеваний распределение между твердыми опухолями и гематологическими неоплазиями(костного мозга, крови, лимфатической системы) показывает, что 9 из 10 раковых заболеваний представляют собой твердые опухоли. В противоположность картине, которая наблюдается в гематологической онкологии (успешное лечение от 40 до 90% раковых заболеваний клеток крови), лишь небольшое число запущенных или распространенных твердых опухолей поддается одному химиотерапевтическому лечению. Частично по этой причине возросла общая смертность от раковых заболеваний в США с 1973 по 1992 г. К сожалению, нельзя однозначно утверждать, что эту тенденцию можно изменить только за счет появления наряду с существующим арсеналом химиотерапевтических средств новых противоопухолевых лекарственных препаратов, таких как таксаны (паклитаксель и доцетаксель), которые препятствуют образованию микротрубочек (W.P. McGuire et al., Am. Intern.Med., 1989), ингибиторы топоизомеразы I, являющиеся производными камптотецина (топотекан и иринотекан), винорелбин (новый алка 003933(новый цитотоксический антиметаболит), ралтитрексед (ингибитор тимидилат синтетазы) и милтефозин (первый представитель семейства алкиллизофосфолипидов). Эти лекарственные препараты добавляют или в ходе первичного курса лечения, или повторного курса лечения к лекарственным средствам, специфическая активность которых в настоящее время хорошо изучена, таким как доксорубицин, цисплатин,винкристин, метотрексат и 5-фторурацил. Причиной одной из наиболее сложных насущных проблем противораковой химиотерапии является тот факт, что многие популяции злокачественных клеток проявляют значительную устойчивость к существующим цитотоксическим препаратам. Обычно такая ситуация является результатом существования генов устойчивости ко многим веществам или частоты генетических мутаций в определенных видах опухолей. Таким образом, лечение раковых заболеваний требует новых подходов, дополняющих те,которые используются в настоящее время,предназначенных для более успешной борьбы с разрастанием и гетерогенностью множества опухолей и приобретением устойчивости "ко многим цитотоксическим препаратам". Некоторые среди этих новых подходов уже кажутся обнадеживающими. К ним относятся индукция апоптоза, ингибирование развития в опухоли кровеносных сосудов и метастатических процессов, не говоря о генной терапии и иммунотерапии. Сущность изобретения Авторов изобретения заинтересовал другой подход. Поставленная цель состояла в том,чтобы сделать популяцию опухолевых клеток более чувствительной к стандартным противораковым способам лечения для достижения двойной выгоды: 1) повышения цитотоксической активности и, следовательно, эффективности и 2) снижения частоты и тяжести некоторых побочных эффектов путем снижения дозы, которое могло бы последовать за вызванным повышением противоопухолевой эффективности. Эта стратегия лежит в основе открытия композиций, способных вызывать весьма значительное повышение цитотоксической активности испытанных противораковых лекарственных средств. Эти композиции обладают способностью как стимулировать выздоровление клоногенных клеток в опухоли, таким образом делая их более чувствительными к обычному лечению цитотоксическими агентами, так и ингибировать пролиферацию клоногенных клеток,таким образом внося вклад в регрессию опухоли. Раскрытие сущности изобретения Таким образом, объектом настоящего изобретения является применение соединений,формулы которых приведены ниже, при лече 3 нии раковых заболеваний с помощью по меньшей мере одного противоопухолевого агента,выбранного из цитотоксических агентов, соединения, обладающего активностью в отношении пролиферации клоногенных клеток в опухолях,причем соединения выбирают из соединений формулы где Х выбирают из =O, =S и =N-NH-R7, a R7 представляет собой фенильную или пиридильную группу,R1, R2, R3 и R4 независимо друг от друга выбирают из Н, ОН, C1-C4 алкильной группы,C1-C4 алкоксигруппы, группы -OCO-R8, a R8 представляет собой С 1-С 4 алкильную группу, и сахаридного производного, причем по меньшей мере один из заместителей R1, R2, R3 и R4 является иным, чем Н, и R2 и R3 вместе могут образовывать метилендиоксигруппу,R5 представляет собой фенильную группу или фенильную группу, замещенную от 1 до 3 группами, выбранными из Н, ОН, C1-C4 алкоксигруппы, группы -OCO-R8, фенил(С 1-С 4 алкокси) группы, группы -O-SO2-R8', a R8' представляет собой C1-C4 алкильную группу или группу СF3, и сахаридного производного,R6 выбирают из Н, C1-C4 алкильной группы, группы -CO-R9 и группы -A-R10,R6a выбирают из C1-C4 алкильной группы,группы -CO-R9 и группы -A-R10,R9 является C1-C4 алкильной группой,А является C1-C4 алкиленовой группой,R10 выбирают из 5- или 6-членных гетероциклических групп, содержащих от 1 до 4 гетероатомов, выбранных из кислорода, серы и азота, CN группы, группы -COOR11, -CONR12R13,группы -NR14R15 и группы -COR16,R11, R12, R13, R14, R15 и R16 независимо выбирают из атома водорода, C1-C4 алкильной группы и фенил(С 1-С 4 алкильной) группы,R4 и R6 вместе могут также образовывать группу -СО-СН 2-СН 2-. Цитотоксические агенты могут применяться в обычных дозах, и в этом случае улучшается их эффективность, или в меньших дозах, определяемых возрастанием противоопухолевой эффективности. В одном из предпочтительных вариантов осуществления изобретения используется соединение, представляющее собой соединение формулы (I), в которомR1 представляет собой C1-C4 алкоксигруппу,R2 представляет собой атом водорода,R3 представляет собой C1-C4 алкоксигруппу,R4 представляет собой атом водорода, 003933R5 представляет собой 4-(C1-C4 алкокси) фенильную группу,и наиболее предпочтительно соединение формулы (I), в которомR1 представляет собой метоксигруппу,R3 представляет собой метоксигруппу иR5 представляет собой 4-метоксифенильную группу. Также было обнаружено, что, по крайней мере, часть соединений формулы (I) сами по себе проявляют противоопухолевую активность. Объектом настоящего изобретения также является композиция, обладающая активностью в отношении пролиферации клоногенных клеток в опухолях, которая препятствует размножению клоногенных клеток или путем стимулирования пролиферации и выздоровления, или путем ингибирования пролиферации и содержит эффективное количество соединения формулы где Х выбирают из =O, =S и =N-NH-R7, a R7 представляет собой фенильную или пиридильную группу,R1, R2, R3 и R4 независимо друг от друга выбирают из Н, ОН, C1-C4 алкильной группы,C1-C4 алкоксигруппы, группы -OCO-R8, a R8 представляет собой C1-C4 алкильную группу, и сахаридного производного, причем по меньшей мере один из заместителей R1, R2, R3 и R4 является иным, чем Н, и R2 и R3 вместе могут образовывать метилендиоксигруппу,R5 представляет собой фенильную группу или фенильную группу, замещенную от 1 до 3 группами, выбранными из Н, ОН, C1-C4 алкоксигруппы, группы -OCO-R8, фенил(С 1-С 4 алкокси) группы, группы -O-SO2-R8', a R8' представляет собой C1-C4 алкильную группу или группу СF3, и сахаридного производного,R6 выбирают из Н, C1-C4 алкильной группы, группы -CO-R9 и группы -A-R10,R6a выбирают из C1-C4 алкильной группы,группы -CO-R9 и группы -A-R10,R9 является C1-C4 алкильной группой,А является C1-C4 алкиленовой группой,R10 выбирают из 5- или 6-членных гетероциклических групп, содержащих от 1 до 4 гетероатомов, выбранных из кислорода, серы и азота, CN группы, группы -COOR11, -CONR12R13,группы -NR14R15 и группы -COR16,R11, R12, R13, R14, R15 и R16 независимо выбирают из атома водорода, C1-C4 алкильной группы и фенил(С 1-С 4 алкильной) группы,R4 и R6 вместе могут также образовывать группу -СО-СН 2-СН 2-. 5 Также объектом настоящего изобретения являются новые соединения, а именно соединения формулы где Х выбирают из =O, =S и =N-NH-R7, a R7 представляет собой фенильную или пиридильную группу,R1, R2, R3 и R4 независимо друг от друга выбирают из Н, ОН, C1-C4 алкильной группы,C1-C4 алкоксигруппы, группы -OCO-R8, a R8 представляет собой C1-C4 алкильную группу, и сахаридного производного, причем по меньшей мере один из заместителей R1, R2, R3 и R4 является иным, чем Н, и R2 и R3 вместе могут образовывать метилендиоксигруппу,R5 представляет собой фенильную группу или фенильную группу, замещенную от 1 до 3 группами, выбранными из Н, ОН, C1-C4 алкоксигруппы, группы -OCO-R8, фенил(С 1-С 4 алкокси) группы, группы -O-SO2-R8', a R8' представляет собой C1-C4 алкильную группу или группу СF3, и сахаридного производного,R6 выбирают из Н, C1-C4 алкильной группы, группы -CO-R9 и группы -A-R10,R6a выбирают из C1-C4 алкильной группы,группы -CO-R9 и группы -A-R10,R9 является C1-C4 алкильной группой,А является C1-C4 алкиленовой группой,R10 выбирают из 5- или 6-членных гетероциклических групп, содержащих от 1 до 4 гетероатомов, выбранных из кислорода, серы и азота, CN группы, группы -COOR11, -CONR12R13,группы -NR14R15 и группы -COR16,R11, R12, R13, R14, R15 и R16 независимо выбирают из атома водорода, C1-C4 алкильной группы и фенил(С 1-С 4 алкильной) группы,R4 и R6 вместе могут также образовывать группу -СО-СН 2-СН 2-,за исключением соединений, в которых Х=O, R6=Н и два заместителя из R1, R2, R3 и R4 представляют собой ОН или ОСН 3. При химиотерапевтическом лечении раковых заболеваний цитотоксическими агентами соединения формул (I) и (Iа) можно вводить в начале химиотерапевтического лечения как сразу, так и через несколько дней после начала лечения (например, в течение от 5 до 7 дней), и в зависимости от схемы химиотерапии в начале каждого лечебного цикла (например, в течение от 2 до 5 дней) по ходу каждого курса лечения. Соединения формул (I) и (Iа) преимущественно вводят путем вливания (как правило, в течение от 1 до 3 ч) дозы от 5 до 50 мг/кг/день или до 2000 мг/м 2/день. Для достижения максимального эффекта в отношении воспроизводства (ингибирования или стимуляции) клоногенных клеток, соединения формул (I) и (Iа) следует вводить таким об 003933 6 разом, чтобы их концентрация в тканях была настолько высокой, насколько это возможно предусмотреть. При лечении острых фаз предпочтительным является внутривенный путь введения с использованием готовых к употреблению инфузионных растворов (в пакетах, бутылках и т.д.), предназначенных для введения без каких-либо модификаций путем внутривенного вливания при помощи инфузионной линии с рекомендованной скоростью; лиофилизатов, которые следует растворить перед внутривенным вливанием при помощи фармацевтических растворов, известных специалистам в данной области; в поддерживающих методах лечения также можно предусмотреть пероральный путь, когда химиотерапии благоприятствует пероральное введение цитостатических агентов. В этом случае можно использовать пастилки (для перорального или подъязычного всасывания), таблетки с немедленным или отсроченным высвобождением действующего начала, пероральные растворы, суспензии, гранулы, гелевые капсулы и т.д. Цитотоксические агенты можно выбирать из:ii) алкилирующих агентов, выбранных из производных платины (цисплатина, карбоплатина, оксалиплатина);iii) соединений, выбранных из других групп алкилирующих агентов- циклофосфамида, ифосфамида, хлорметрина, мелфалана, хлорамбуцила, эстрамустина,- бусульфана, митомицина С,- нитрозомочевин: ВСNU (кармустина),CCNU (ломустина), фотемустина, стрептозоцина,- триазинов или их производных: прокарбазина, дакарбазина,- пипобромана,- этилениминов: алтретамина, триэтилентиофосфорамида,iv) соединений, выбранных из других групп антиметаболических агентов- антифолических агентов: метотрексата,ралтитрекседа,- антипиримидиновых агентов: 5-фторурацила (5-FU), цитарбина (Аrа-С),- гидроксимочевины,- антипуриновых агентов: пуринэтола, тиогуанина, пентостатина, кларибина,- цитотоксических индукторов синтеза нуклеозидов: гемцитабина;v) соединений, выбранных из других групп тубулин-аффинных агентов- винка-алкалоидов, которые разрушают митотическое веретено: винкристина, винбластина, виндезина, навелбина,- агентов, которые блокируют деполимеризацию митотического веретена: паклитакселя,доцетакселя,- агентов, которые вызывают расщепление ДНК путем ингибирования топоизомеразы II: этопозида, тенипозида,- ингибиторов топоизомеразы I, которые вызывают расщепление ДНК: топотекана, иринотекана;vi) агентов для разделения или фрагментации ДНК, таких как блеомицин;vii) одного из следующих соединений: пликамицина, L-аспарагиназы, митогуазона,дакарбазина;(например, ципротерона) или нестероидного антиандрогенного агента (флутамида, нилутамида). В частности, соединения формул (I) и (Iа) могут сочетаться со всеми основными методами лечения цитотоксическими агентами, использующимися в полихимиотерапии твердых опухолей, такими как доксорубицин,алкилирующие агенты: оксазофорины(циклофосфамид, ифосфамид, хлорамбуцил,мелфалан),нитрозомочевины,митомицин С,антиметаболиты, такие как метотрексат, 5FU, Аrа-С, капцитабин,агенты, взаимодействующие с тубулином: винка-алкалоиды (винкристин, винбластин,виндезин, навелбин), таксоиды (паклитаксель,доцетаксель), производные эпиподофиллотоксина (этопозид, тенипозид),блеомицин,ингибиторы топоизомеразы I: топотекан,иринотекан. Аналогично, соединения формул (I) и (Iа) могут сочетаться с основными методами лечения цитотоксическими агентами, использующимися в онкогематологии для лечения раковых заболеваний крови:- хронических лимфоидных лейкемий: мехлоретамин, хлорамбуцил, циклофосфамид,мелфалан, ифосфамид. Как правило, соединения формулы (I) можно получить в соответствии со следующими схемами реакций. Схема 1 В качестве алкилирующего реагента можно использовать реагент типа XR6, в котором Х=I, Вr или Сl. В одном из вариантов для присоединения группы R6 = CH2-CH2-R (соответствующей группе -A-R10, определенной выше) можно использовать соединение CH2=CH-R. Схема 3 В дополнение можно превратить некоторые или все алкоксигруппы в гидроксильные группы в соответствии с известными методами. Аналогично гидроксильные группы могут быть 9 превращены в сложноэфирные или сульфонатные в соответствии с известными методами. Аналогично можно превратить группу -ACOOR11, в которой R11 представляет собой алкильную или фенилалкильную группу, в группу-А-СООН, и превратить группу -А-СООН в группу -A-CONR12R13 в соответствии с известными методами. Соединения, в которых R4 и R6 образуют группу -СО-СН 2-СН 2-, могут быть получены путем циклизации соединения, в котором R4 = Н и R6 = -СН 2-СН 2-СООН. Сведения, подтверждающие возможность осуществления изобретения Пример 1. 5,7-Диметокси-3-(4-метоксифенил)-1,2-дигидро-2-хинолинон (соединение 1). а) N-(3,5-Диметоксифенил)-2-(4-метоксифенил)ацетамид (соединение 2). 500 мг (3,3 ммоль) 3,5-диметоксианилина растворяют в толуоле (7 мл) в атмосфере азота при 0 С. К среде по каплям добавляют раствор 4-метоксифенилацетил хлорида (0,5 мл, 3,3 ммоль) в 5 мл толуола. Реакционную смесь перемешивают при комнатной температуре 1 ч и затем гидролизуют холодным раствором гидрокарбоната натрия. Двухфазную систему энергично перемешивают 30 мин и затем органическую фазу собирают. Водную фазу экстрагируют этилацетатом (дважды). Органическую фазу сушат над MgSO4 и затем упаривают. Полученный остаток кристаллизуют из петролейного эфира, выход составил 810 мг (82%) соединения 2. т.пл. 135-137 С (толуол) ИК (KBr) n 3292, 1658, 1615 см-1 1 Н ЯМР (250 МГц, СDСl3): д 3.66 (с, 2 Н,CH2), 3.74 (с, 6 Н, ОСН 3), 3.82 (с, 3H, ОСН 3), 6.20 0,31 мл (4,0 ммоль, 1,5 эквивалентов) N,Nдиметилформамида добавляют по каплям к 1,75 мл (20,0 ммоль, 7,5 экв.) РОСl3 в атмосфере азота при -30 С. Раствор перемешивают 15 мин при 10 до комнатной температуры при перемешивании и затем нагревают при 75 С в течение 2,5 ч. В конце реакции образовавшийся раствор выливают на колотый лед, нейтрализуют 30% водным раствором аммиака и затем экстрагируют дихлорметаном. Органическую фазу сушат надMgSO4 и затем упаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (элюент: 3/7 EtOAc/PE), выход составил 270 мг (30%) соединения 3. т.пл. 156-157 С (толуол) 1 Н ЯМР (250 МГц, CDCl3): д 3.87 (с, 3H,OCH3), 3.93 (с, 3H, OCH3), 3.95 (с, 3H, OCH3),6.52 (д, 1H, J=2.0 Гц, НAr), 6.97-7.01 (м, 3H, НAr),6.95 (д, 2 Н, J = 8.7 Гц, НАr), 8.35 (с, 1 Н, НAr). 13 С ЯМР (62.9 МГц, CDCl3): д 55.3, 55.7,55.8, 98.6, 98.9, 113.6 (2), 115.8, 125.9, 130.5,131.0 (2), 133.8, 149.0, 150.5, 156.0, 159.4, 162.1.(CRL8246) Соединение 3 (250 мг, 0,76 ммоль), растворенное в уксусной кислоте (1,2 мл, 26,25 ммоль на ммоль 3) и воде (0,04 мл, 2,77 ммоль на ммоль 3), нагревают с обратным холодильником 3 ч. Уксусную кислоту удаляют упариванием. Полученный остаток переносят в воду, нейтрализуют 25% раствором гидроксида натрия и,наконец, экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Остаток переносят в этилацетат, эта операция вызывает кристаллизацию целевого продукта. Кристаллы,полученные таким образом, отфильтровывают,выход составил 200 мг (85%) соединения 1. Общий выход синтеза, проведенного для получения соединения 1, составляет 21%. т.пл. 254-255 С (ЕtOАс) ИК (KBr) n 1664, 1628, 1573, 1518 см-1 1 Н ЯМР (250 МГц, DMSO-d6): д 3.78 (с,3H, OCH3), 3.81 (с, 3H, OCH3), 3.89 (с, 3H,OCH3), 6.35 (д, 1 Н, J = 2.0 Гц, НAr) - 6.45 (д, 1 Н,J = 2.0 Гц, НAr), 6.95 (д. 2 Н, J = 7.5 Гц, НAr), 7.66 530 мг (1,70 ммоль) соединения 1 растворяют в 15 мл уксусной кислоты в инертной атмосфере. Коммерчески доступный раствор 48% НВr в воде (2,65 мл) добавляют по каплям (экзотермическая реакция) к реакционной смеси. Полученный раствор нагревают с обратным холодильником при перемешивании 5 ч. После охлаждения, реакционную смесь разбавляют водой и затем нейтрализуют 10% раствором гидроксида натрия (рН = 6-7). Продукт экстрагируют дихлорметаном (дважды). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с двуокисью кремния (элюент: 9/1 CH2Cl2/СН 3 ОН), выход составил 175 мг (35%) соединения 4. т.пл. 275-276 С (ЕtOАс) ИК (КВr) n 1628, 1604, 1558, 1518 см-1 1 Н ЯМР (250 МГц, DMSO-d6): д 3.80 (с,3H, OCH3), 3.89 (с. 3H, OCH3), 6.35 (д, 1H, J = 2.5 Гц, НAr) 6.43 (д, 1 Н, J = 2.5 Гц, НАr), 6.78 (д,2 Н, J = 7.5 Гц, НAr), 7.55 (д, 2 Н, J = 7.5 Гц, НAr)7.92 (с, 1 Н, HAr), 9.48 (с, 1 Н, ОН), 11.72 (уширенный с, 1 Н, NH) 13 С ЯМР (62.90 МГц, DMSO-d6): д 55.4,55.9, 90.0, 93.0, 104.7, 114.8 (2), 126.9, 127.4,129.6, 129.8 (2), 140.4, 156.6, 156.9, 161.6, 161.8 МС (ионный пучок): м/з 298 (М+1)+ Анализ. Вычислено для C17H15NO4: С,68.68; Н, 5.09; N, 4.71. Найдено: С, 68.90; Н, 5.09; N, 4.90. Пример 3. 5,7-Дигидрокси-3-(4-гидроксифенил)-1,2-дигидро-2-хинолинон (соединение 5). 1,0 г (3,2 ммоль) соединения 1 растворяют в 15 мл уксусной кислоты в инертной атмосфере. В реакционную смесь добавляют по каплям коммерчески доступный раствор 48% НВr в воде (5 мл) (экзотермическая реакция). Полученный раствор нагревают с обратным холодильником при перемешивании в течение 3 дней. После охлаждения реакционную массу разбавляют водой и затем нейтрализуют 10% раствором гидроксида натрия (рН = 6-7). Продукт экстрагируют дихлорметаном (дважды). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (элюент: 9/1 СН 2 Сl2/CН 3 ОН),выход составил 320 мг (37%) соединения 5. 100 мг (0,32 ммоль) соединения 1 растворяют в 15 мл толуола (горячее растворение) в инертной атмосфере. К реакционной смеси добавляют 260 мг (0,64 ммоль, 2 экв.) реагента Лоэссона (Lawesson's reagent). Полученный раствор нагревают с обратным холодильником в течение 18 ч. После охлаждения упаривают толуол. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (элюент: 9/1 CH2Cl2/EtOAc), выход составил 81 мг 600 мг (1,93 ммоль) соединения 1 растворяют в 30 мл безводного N.N-диметилформамида (ДМФА) в атмосфере азота. При 0 С 93 мг (3,86 ммоль, 2 эквивалента) NaH, предварительно промытого петролейным эфиром, до 13 бавляют порциями к реакционному раствору(экзотермическая реакция). К среде добавляют раствор йодистого метила (0,48 мл, 7,72 ммоль,4 экв.), разбавленного 5 мл ДМФА. Реакционную смесь нагревают при 90 С в течение 18 ч. После охлаждения к реакционной массе добавляют воду и затем раствор перемешивают 15 мин. Полученный твердый осадок собирают путем фильтрования через керамическую воронку и затем промывают водой. Твердый осадок растворяют в CH2Cl2 и промывают дважды водой. Полученную органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (8/2 СН 2 Сl2/ЕtOАс), выход составил 408 мг (68%) соединения 7 и 157 мг (25%) производного 7 а. Соединение 7 т.пл. 125 С (ЕtOАс/РЕ) ИК (КВr) n 1635, 1596, 1590, 1514 см-1 1 Н ЯМР (250 МГц, СDСl3) д 3.73 (с, 3H,NСН 3), 3.83 (с, 3H, OCH3), 3.91 (с, 6 Н, OCH3),6.30 (д, 1 Н, J = 2.0 Гц, НAr), 6.37 (д, 1 Н, J = 2.0 Гц, НAr), 6.94 (д, 2 Н, J = 7.5 Гц, НAr), 7.67 (д, 2 Н,J = 7.5 Гц, НAr), 8.12 (с, 1 Н, НAr). 13 С ЯМР (62.90 МГц, СDСl3): д 30.3, 55.3,55.5, 55.8, 90.2, 92.6, 106.1, 113.5 (2), 127.0,130.0, 130.1 (2), 130.2, 141.7, 157.6, 159.1, 162.2 408 мг (1,3 ммоль) соединения 7 растворяют в 15 мл уксусной кислоты в инертной атмосфере. Коммерчески доступный раствор 48% НВr в воде (2 мл) добавляют по каплям (экзотермическая реакция) к реакционной смеси. Полученный раствор нагревают с обратным холодильником при перемешивании 5 ч. После охлаждения реакционную смесь разбавляют водой и затем нейтрализуют 10% раствором гидроксида натрия (рН = 6-7). Продукт экстрагируют дихлорметаном (дважды). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (элюент: 7/3 CH2Cl2/EtOAc), выход составил 220 мг (56%) соединения 8. т.пл. 204-205 С (ЕtOАс) 1 Н ЯМР (250 МГц, DMSO-d6): д 3.63 (с,3H, NСН 3), 3.89 (с, 3H, OCH3), 3.90 (с, 3H,OCH3), 6.46 (д, 1 Н, J = 1.9 Гц, НAr), 6.54 (д, 1 Н, J 1. Метод А: 200 мг (0,61 ммоль) соединения 7 растворяют в 15 мл уксусной кислоты в инертной атмосфере. Коммерчески доступный раствор 48% НВr в воде (1 мл) добавляют по каплям (экзотермическая реакция) к реакционной смеси. Целевой раствор нагревают с обратным холодильником при перемешивании в течение 3 дней. После охлаждения реакционную смесь разбавляют водой и затем нейтрализуют 10% раствором гидроксида натрия (рН = 6-7). Продукт экстрагируют дихлорметаном (дважды). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (элюент: 9/1 15 2. Метод В: 1,0 г (3,1 ммоль) соединения 7 растворяют в 15 мл дихлорметана в инертной атмосфере. При 0 С к реакционной смеси по каплям добавляют 1,81 мл (19,0 ммоль, 6 экв.) трибромида бора (экзотермическая реакция). Полученный раствор перемешивают при комнатной температуре 18 ч. Реакционную смесь гидролизуют добавлением (по каплям) воды и затем нейтрализуют 10% раствором гидроксида натрия (рН = 6-7). Продукт экстрагируют дихлорметаном (дважды). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток очищают на колонке с двуокисью кремния (элюент: 9/1 СН 2 Сl2/МеОН), выход составил 688 мг (76%) соединения 9. т.пл. 280 С (EtOAc) 1 Н ЯМР (250 МГц, DMSO d-6): д 3.53 (с,3H, СН 3), 6.25 (с, 2 Н, НAr), 6.76 (д, 2 Н, J = 8.8 Гц,НAr), 7.47 (д, 2 Н, J = 8.8 Гц, НAr), 7.92 (с, 1 Н,НAr), 9.42 (с, 1 Н, ОН), 10.00 (с, 1 Н, ОН), 10.35 (с,1 Н, ОН) 13 С ЯМР (62.90 МГц, DMSOd-6): д 29.7,91.8, 96.5, 103.5, 114.7 (2), 124.3, 128.4, 129.7 (3),141.7, 155.9, 156.7, 160.6, 161.1. 30 МС (ионный пучок): м/з 284 (М+1)+ Анализ. Вычислено для C16H13NO4: С,67.84; Н, 4.63; N, 4.94. Найдено: С, 67.68; Н, 4.46; N, 4.78. Пример 8. 5,7-Диметокси-3-(4-метоксифенил)-1-метил-1,2-дигидро-2-хинолинтион 500 мг (1,5 ммоль) соединения 7 растворяют в 30 мл толуола в атмосфере азота. К реакционной смеси добавляют 870 мг (2,1 ммоль, 1,4 экв.) реагента Лоэссона. Реакционную смесь нагревают с обратным холодильником 12 ч. После охлаждения растворитель удаляют упариванием. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (3/7(ДМФА) в атмосфере азота. При 0 С, 115 мг (4,8 ммоль, 1,5 экв.) NaH, предварительно промытого петролейным эфиром, порциями добавляют к реакционному раствору (экзотермическая реакция). Затем к среде добавляют раствор этилбромацетата (0,72 мл, 6,4 ммоль, 2 экв.) в 5 мл ДМФА. Реакционную смесь нагревают при 90 С 2-3 ч. После охлаждения к реакционной смеси добавляют воду, а затем ее перемешивают 15 мин. Раствор экстрагируют этилацетатом (дважды). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (7/3 СН 2 Сl2/ЕtOАс), выход составил 890 мг (70%) соединения 11 и 318 мг (25%) производного 11 а. Соединение 11: т.пл. 160-161C (EtOAc/PE) ИК (KBr) 1735, 1647, 1609 см-1 1 Н ЯМР (250 МГц, CDCl3): д 1.6 (t, 3H, J = 7.1 Гц, СООCH2CH3), 3.83 (с, 3H, OCH3), 3.87 (с,3H, OCH3), 3.92 (с, 3H, OCH3), 4.22 (кв, 2H,J=7.1 Гц, СОOCH2 СН 3), 5.10 (с, 2H, СН 2 СО),6.14 (д, 1 Н, J = 2.0 Гц, HAr), 6.30 (д, 1 Н, J = 2.0 Гц, НAr), 6.94 (д, 2H, J = 7.5 Гц, НAr), 7,69 (д, 2H,J = 7.5 Гц, НAr), 8.18 (с, 1 Н, НAr). 13 С ЯМР (62.90 МГц, СDСl3): д 14.2, 44.8,55.3, 55.5, 55.9, 61.6, 90.0, 92.8, 106.2, 113.5 (2),126.6, 129.6, 130.1 (2), 131.0, 141.1, 157.8, 159.2,161.9, 162.5, 168.4. МС (ионный пучок): м/з 398 (М+1)+ Анализ. Вычислено для C22H23NO6: С,66.49; Н, 5.83; N, 3.52. Найдено: С, 66.60; Н, 6.03; N, 3.75. Соединение 11 а. Этил-2-([5,7-диметокси-3(4-метоксифенил)-2-хинолинил]окси)ацетат.(32,0 ммоль, 10 экв.), в атмосфере азота. При 0 С к реакционному раствору добавляют 2-3 капли Тритона Б. Смесь перемешивают 4 ч при комнатной температуре. ДМФА и метилакрилат удаляют упариванием при пониженном давлении. Полученный остаток переносят в этилацетат и промывают дважды водой. Полученную органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Сырой продукт очищают хроматографией на колонке с двуокисью кремния (8/2 CH2Cl2/EtOAc), выход составил 1,06 г (83%) соединения 12. т.пл. 100-101C (EtOAc) ИК (KBr) 1725,1638 см-1 1 Н ЯМР (250 МГц, CDCl3): д 2.78 (т. 2 Н, J 300 мг (0,96 ммоль) соединения 1 растворяют в 10 мл безводного N,N-диметилформамида (ДМФА) в атмосфере азота. При 0 С 35 мг (1,40 ммоль, 1,5 экв.) NaH, предварительно промытого петролейным эфиром, порциями добавляют к реакционному раствору (экзотермическая реакция). К раствору добавляют раствор бензилбромацетата (0,31 мл, 1,90 ммоль, 2 экв.), разбавленного 5 мл ДМФА. Реакционную смесь нагревают при 90 С 2 ч. После охлаждения к реакционной смеси добавляют воду и затем ее перемешивают 15 мин. Раствор экстрагируют дихлорметаном (дважды). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (элюент: СН 2 Сl2), выход составил 317 мг (72%) соединения 13 и 88 мг (20%) производного 13 а. Соединение 13: т.пл. 199-200 С (промытый Et2O) ИК (КВr) 1748, 1642, 1617 см-1 1 Н ЯМР (250 МГц, СDCl3): д 3.68 (с, 3H,OCH3), 3.84 (с, 3H, OCH3), 3.92 (с, 3H, OCH3),5.16 (с, 2 Н, СН 2), 5.21 (с, 2 Н, СН 2), 6.03 (д, 1 Н,J=2.0 Гц, НAr), 6.27 (д, 1 Н, J=2.0 Гц, НAr), 6.94 (д,2 Н, J = 7.5 Гц, НAr), 7.25-7.32 (m, 5 Н, НAr), 7.68 Растворяют 1,0 г (2,2 ммоль) бензилового эфира 13 растворяют в диоксане (30 мл) в круглодонной колбе. К реакционному раствору добавляют 10% палладий на угле (100 мг). Реакцию дебензилирования осуществляют при использовании аппарата Парра (Parr apparatus) при давлении водорода 40 psi (0,28 МПа) и комнатной температуре в течение 4 ч. Реакционную смесь фильтруют через целит и фильтрат упаривают при пониженном давлении. Полученный кристаллический продукт промывают эфиром,выход составил 764 мг (95%) соединения 14. Т.пл. 179-180 С (промытый Et2O) ИК (КВr) 1732, 1614, 1583 см-1 1 Н ЯМР (250 МГц, DMSO-d6): д 3.77 (с,3H, OCH3), 3.85 (с, 3H, OCH3), 3.91 (с, 3H,OCH3), 5.02 (с, 2 Н, CH2), 6.46 (с, 1 Н, НAr), 6.47 150 мг (0,48 ммоль) соединения 1 растворяют в 10 мл безводного N,N-диметилформамида (ДМФА) в присутствии 782 мг (4,8 ммоль, 10 экв.) бензилакрилата в атмосфере азота. При 0 С к реакционному раствору добавляют 2-3 капли Тритона Б. Раствор перемешивают 18 ч при комнатной температуре. Растворители удаляют путем упаривания при пониженном давлении. Полученный остаток переносят в этилацетат и промывают дважды водой. Полученную органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. 20 Сырой продукт очищают хроматографией на колонке с двуокисью кремния (4/6 EtOAc/PE),выход составил 200 мг (88%) соединения 15. т.пл. 124-125 С (Et2O/PE) ИК (КВr) 1731, 1635, 1600 см-1 1(30 мл). К реакционному раствору добавляют 10% палладий на угле (100 мг). Реакцию дебензилирования проводят в аппарате Парра при давлении водорода 40 psi (0,28 МПа) в течение 48 ч. Реакционную среду фильтруют через целит и фильтрат упаривают при пониженном давлении, выход составил после промывки эфиром 780 мг (97%) соединения 16. т.пл. 194-195 С (промытый Et2O) ИК (КВr) 1724, 1637, 1612, 1604 см-1 1 Н ЯМР (250 МГц, DMSO-d6): д 2.60 (т,2 Н, J = 7.5 Гц, COCH2), 3.78 (с, 3H, OCH3), 3.90(ДМФА) в атмосфере азота. При 0 С к реакционному раствору добавляют 353 мг (2,6 ммоль) гидроксибензотриазола и 540 мг (2,6 ммоль) циклогексилкарбодиимида. Реакционную смесь перемешивают 10 мин при 0 С, с последующим добавлением 0,26 мл (2,6 ммоль) диэтиламина. Полученный раствор перемешивают в течение 2 ч при 0 С и затем в течение 24 ч при комнатной температуре. Дициклогексилмочевину удаляют фильтрованием. Фильтрат экстрагируют этилацетатом (дважды). Собранную органическую фазу промывают несколько раз водой. Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (7/3 CH2Cl2/EtOAc), выход составил 680 мг (60%) соединения 17. т.пл. 137-138 С (промытый ЕtOАс) ИК (КВr) 1636, 1617 см-1 1 Н ЯМР (250 МГц, CDCl3): д 1.07-1.21 (м,6 Н, СН 3), 2.78 (т, 2 Н, J = 8.0 Гц, СOCH2), 3.30(ДМФА) в атмосфере азота. При 0 С 115 мг (4,8 ммоль, 1,5 экв.) NaH, предварительно промытого петролейным эфиром, добавляют порциями к реакционному раствору (экзотермическая реак 003933 22 ция). К смеси добавляют раствор 2-хлор-N,Nдиэтилацетамида (0,88 мл, 6,4 ммоль, 2 экв.),разбавленного 5 мл ДМФА. Реакционную смесь нагревают при 90 С 3 ч. После охлаждения к реакционной смеси добавляют воду. Реакционный раствор экстрагируют этилацетатом (дважды). Полученную органическую фазу сушат надMgSO4 и затем упаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (7/3(ДМФА) в атмосфере азота. При 0 С 115 мг (4,8 ммоль, 1,5 экв.) NaH, промытого предварительно петролейным эфиром, добавляют порциями к реакционному раствору (экзотермическая реакция). Раствор бромацетонитрила (0,45 мл, 6,4 ммоль, 2 экв.), разбавленного 5 мл ДМФА, добавляют к среде. Реакционную смесь нагревают 3 ч при 90 С. После охлаждения к реакционной смеси добавляют воду. Реакционный раствор экстрагируют этилацетатом (дважды). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (7/3 CH2Cl2/EtOAc), выход составил 683 мг (61%) соединения 19 и 336 мг(12 ммоль) акрилонитрила растворяют в 10 мл безводного N,N-диметилформамида (ДМФА) в атмосфере азота. При 0 С к реакционному раствору добавляют 2 капли Тритона Б. Реакцию контролируют с помощью тонкослойной хроматографии. По завершении реакции растворители удаляют упариванием. Остаток переносят в этилацетат и промывают несколько раз водой. Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с двуокисью кремния 350 мг (0,90 ммоль) соединения 20 и 0,42 мл (1,53 ммоль) азида трибутилолова растворяют в 20 мл безводного толуола в атмосфере аргона. Реакционный раствор перемешивают при 105 С 65 ч. После охлаждения растворитель удаляют упариванием при пониженном давлении. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (9/1NaH (4,8 ммоль, 1,5 экв.), предварительно промытого в петролейном эфире, порциями добавляют к реакционному раствору (экзотермическая реакция). В среду добавляют раствор хлористого 3-диметиламинопропила (777 мг, 7,3 ммоль, 2,25 экв.) в 5 мл ДМФА. Реакционную смесь нагревают 2-3 ч при 90 С. После охлаждения к реакционной смеси добавляют воду и перемешивают в течение 15 мин. Раствор экстрагируют этилацетатом (дважды). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (8/2 Et2O/MeOH и затем 9/1(ДМФА) в атмосфере азота. При 0 С 29 мг (1,2 ммоль, 1,5 экв.) NaH, предварительно промытого петролейным эфиром, добавляют порциями к реакционному раствору (экзотермическая реакция). К раствору добавляют раствор 2 диметиламиноэтил хлорида (230 мг, 2,5 ммоль,3 экв.) в 5 мл ДМФА. Реакционную смесь нагревают 2-3 ч при 90 С. После охлаждения к реакционной смеси добавляют воду, а затем перемешивают в течение 15 мин. Раствор экстрагируют этилацетатом (дважды). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (3/7 Et2O/EtOAc и затем 9/1 63 мг Р 2O5 и 500 мг РРА вносят в круглодонную колбу и затем смесь перемешивают 1 ч при 120 С в атмосфере азота. Добавляют соединение 16 (100 мг, 0,26 ммоль) и затем реакционную смесь и перемешивают 45 мин при 120 С. После охлаждения добавляют 2N раствор гидроксида натрия до достижения значения рН 6-7. Сырой продукт экстрагируют CH2Cl2 (дважды). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с двуокисью кремния 682 мг (2,0 ммоль) соединения 10 растворяют в 30 мл безводного ТГФ в атмосфере азота. Добавляют 3,5 мл йодистого метила (56 ммоль, 28 экв.), разбавленного 5 мл ТГФ, при комнатной температуре и реакционную смесь затем перемешивают 18 ч в инертной атмосфере. Появившийся в конце реакции осадок отфильтровывают на воронке Бюхнера (промывают ТГФ), выход составил 761 мг (79%) соединения 25. т.пл. 156-157 С (промытый ТГФ) 1 Н ЯМР (250 МГц, CDCl3): д 2.44 (с, 3H,SСН 3), 3.88 (с, 3H, OCH3), 4.02 (с, 3H, OCH3),4.28 (с, 3H, OCH3), 5.03 (с, 3H, NСН 3), 6.70 (д,1 Н, J = 1.5 Гц, НAr), 7.03 (д, 2 Н, J = 8.5 Гц, НAr),7.37 (уширенный с, 1 Н, НAr), 7.37 (уширенный с,1 Н, НAr), 7.45 (д, 2 Н, J=8.5 Гц, НAr), 8.71 (с, 1 Н,НAr). 13 С ЯМР (62.90 МГц, CDCl3): д 20.8, 46.5,55.4, 56.7, 58.5, 92.9, 101.0, 114.4 (2), 117.6,125.8, 128.9, 130.7 (2), 135.9, 138.8, 144.2, 157.4,160.3, 167.7. Полученное соединение быстро используют на следующей стадии.(2,8 ммоль, 7 экв.) фенилгидразина растворяют в 5 мл безводного этанола. Реакционную смесь нагревают 18 ч при 90 С в запаянной трубке. После охлаждения этанол удаляют упариванием при пониженном давлении. Остаток переносят в СН 2 Сl2 и затем промывают дважды раствором 29 гидрокарбоната натрия. Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Остаток переносят в метанол,в котором полученный продукт выпадает в осадок. Образовавшийся продукт отделяют фильтрованием (промывают СН 3 ОН), выход составил 102 мг (60%) соединения 26. т.пл. 148-149 С (промытый СН 3 ОН) ИК (КВr) 3340, 1602, 1599 см-1 1 Н ЯМР (250 МГц, CDCl3): д 3.58 (с, 3H,СН 3), 3.85 (с, 3H, OCH3), 3.86 (с, 3H, OCH3), 3.88 150 мг (0,31 ммоль) соединения 25 и 237 мг (2,2 ммоль, 7 экв.) 2-гидразинпиридина растворяют в 5 мл безводного этанола. Реакционную смесь нагревают 18 ч при 90 С в закрытой пробирке. После охлаждения этанол удаляют упариванием при пониженном давлении. Остаток переносят в СН 2 Сl2 и затем промывают дважды раствором бикарбоната натрия. Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Остаток переносят в метанол, в котором полученный продукт выпадает в осадок. Этот продукт отфильтровывают 0,46 мл (4,1 ммоль) о-анизидина разбавляют толуолом (7 мл) при 0 С в атмосфере азота. К среде добавляют по каплям раствор 4 метоксифенилацетилхлорида (0,63 мл, 4,1 ммоль) в 5 мл толуола. Реакционную смесь перемешивают при комнатной температуре 1 ч и затем среду гидролизуют холодным раствором гидрокарбоната натрия. Двухфазную систему энергично перемешивают 30 мин и органическую фазу затем собирают. Водную фазу экстрагируют этилацетатом (дважды). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток переносят в петролейный эфир, который вызывает выпадение в осадок желаемого продукта. Образовавшиеся таким образом кристаллы собирают фильтрованием, выход составил 1,0 г (91%) соединения 30. т.пл. 47-48 С (толуол) ИК (KBr) n 3375, 1667, 1597 см-1 1 Н ЯМР (250 МГц, CDCl3): д 3.68 (с, 2 Н,СН 2), 3.72 (с, 3H, OCH3), 3.82 (с, 3H, OCH3), 6.79 0,31 мл (4,0 ммоль, 1,5 экв.) N,Nдиметилформамида добавляют по каплям к 1,75 мл (19 ммоль, 7,5 экв.) РОСl3 в атмосфере азота при -30 С. Смесь перемешивают 15 мин и затем добавляют 723 мг амида 30 (2,7 ммоль). Реакционную смесь нагревают до комнатной температуры при перемешивании и затем нагревают при 75 С 1,5 ч. В конце реакции полученный раствор выливают на колотый лед, нейтрализуют 30% водным раствором аммиака и затем экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и затем упаривают. Полученный остаток растворяют в 4,75 мл ледяной уксусной кислоты и 0,15 мл воды и полученный раствор затем нагревают с обратным холодиль 31 ником 3 ч. Уксусную кислоту удаляют упариванием. Остаток растворяют в воде, нейтрализуют 25% раствором гидроксида натрия и, наконец,экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Остаток переносят в этилацетат, который вызывает выпадение в осадок целевого продукта. Полученные таким образом кристаллы отфильтровывают, выход составил 75 мг (10%) соединения 31. Общий выход соединения 31 составил 9%. т.пл. 148-149 С (EtOAc) ИК (KBr) n 1652, 1625, 1606, 1541 см-1 1 Н ЯМР (250 МГц, DMSO-d6): д 3.79 (с,3H, OCH3), 3.90 (с, 3H, OCH3), 6.99 (д, 2 Н, J = 8.8 Гц, НAr), 7.09-7.15 (м, 2 Н, НAr), 7.29 (дд, 1 Н, J 1,0 г (6,5 ммоль) 2,5-диметоксианилина растворяют в толуоле (7 мл) в атмосфере азота при 0 С. Раствор 4-метоксифенилацетил хлорида (1,0 мл, 6,5 ммоль), разбавленного 5 мл толуола, по каплям добавляют к смеси. Реакционную смесь перемешивают при комнатной температуре 1 ч и затем гидролизуют холодным раствором гидрокарбоната натрия. Двухфазную систему энергично перемешивают 30 мин, после чего собирают органическую фазу. Водную фазу экстрагируют этилацетатом (дважды). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток переносят в минимальное количество петролейного эфира, который вызывает выпадение в осадок конечного продукта. Образовавшиеся кристаллы отфильтровывают на воронке Бюхнера, выход составил 1,83 г (93%) соединения 32. т.пл. 89-90 С (толуол) 1 Н ЯМР (250 МГц, CDCl3): д 3.67 (с, 3H,OCH3), 3.68 (с, 2 Н, СН 2), 3.75 (с, 3H, OCH3), 3.81 0,31 мл (4,0 ммоль, 1,5 экв.) N,Nдиметилформамида добавляют по каплям к 1,75 мл (20 ммоль, 7,5 экв.) РОСl3 в атмосфере азота при -30 С. Смесь перемешивают 15 мин при-30 С и затем добавляют 813 мг амида 32 (2,7 ммоль). Реакционную смесь нагревают до комнатной температуры при перемешивании и затем ее нагревают при 75 С 1,5 ч. После этого периода раствор выливают на колотый лед, нейтрализуют 30% водным раствором аммиака и затем экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и затем упаривают. Полученный остаток переносят в 4,75 мл ледяной уксусной кислоты и 0,15 мл воды и полученный раствор затем нагревают с обратным холодильником 3 ч. Уксусную кислоту удаляют упариванием. Остаток растворяют в воде, нейтрализуют 25% раствором гидроксида натрия и затем наконец экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Остаток переносят в этилацетат, который вызывает выпадение в осадок целевого соединения. Полученные таким образом кристаллы отфильтровывают, выход составил 378 мг (45%) соединения 33. Общий выход проведенного синтеза, в соответствии с которым получают соединение 33,составил 42%. т.пл. 186-187 С (ЕtOАс) ИК (КВr) n 1639, 1571, 1515 см-1 1 Н ЯМР (250 МГц, CDCl3): д 3.85 (с, 3H,OCH3), 3.90 (с, 3H, OCH3), 3.92 (с, 3H, OCH3),6.49 (д, 1 Н, J = 8.7 Гц, НAr), 6.84 (д, 1 Н, J = 8.7 Гц, НAr) 6.97 (д, 2 Н, J = 8.8 Гц, НAr), 7.74 (д, J = 8.8 Гц, НAr), 8.19 (с, 1 Н, НАr), 9.25 (уширенный с,1 Н, NH). 13 С ЯМР (62.90 МГц, CDCl3): д 55.2, 55.8,56.2, 101.1, 109.7, 111.4, 113.6 (2), 128.7, 128.8,130.0 (2), 131.4, 131.7, 139.4, 149.8, 159.5, 161.3. МС (ионный пучок): м/з 312 (М+1)+ Анализ. Вычислено для C18H17NO4: С,69.44; Н, 5.50; N, 4.50. Найдено: С, 69.71; Н, 5.59; N, 4.70. Пример 27. 5,7-Диметил-3-фенил-1,2 дигидро-2-хинолинон (соединение 34). а). N-(3,5-Диметоксифенил)-2-фенилацетамид (соединение 35). 33 при 0 С. К смеси добавляют по каплям раствор фенилацетил хлорида (0,86 мл, 6,5 ммоль) в 10 мл толуола. Реакционную смесь перемешивают при комнатной температуре 1 ч и затем гидролизуют холодным раствором гидрокарбоната натрия. Двухфазную систему энергично перемешивают 30 мин и органическую фазу затем собирают. Водную фазу экстрагируют этилацетатом (дважды). Органическую фазу сушат надMgSO4 и затем упаривают. Полученный остаток кристаллизуют из толуола, выход составил 1,55 г (87%) соединения 35. т.пл. 109-111 С (толуол) ИК (KBr) n 3286, 1657, 1616 см-1 1 Н ЯМР (250 МГц, CDCl3): д 3.70 (с, 2 Н,CH2), 3.74 (с, 6 Н, OCH3), 6.21 (т, 1 Н, J = 2.2 Гц,НAr), 6.66 (д, 2 Н, J = 2.2 Гц, НAr), 7.09 (уширенный с, 1 Н, NH), 7.30-7.40 (м, 5 Н, НAr). 13 С ЯМР (62.90 МГц, CDCl3): д 44.9, 55.4 0,64 мл (8,3 ммоль, 1,5 экв.) N,Nдиметилформамида добавляют по каплям к 3,8 мл (41,0 ммоль, 7,5 экв.) РОСl3 в атмосфере азота при -30 С. Среду перемешивают 15 мин при-30 С и затем добавляют 1,5 г амида 35 (5,5 ммоль). Реакционную смесь нагревают до комнатной температуры при перемешивании и затем нагревают при 75 С 2,5 ч. В конце реакции этот раствор выливают на колотый лед, нейтрализуют 30% водным раствором аммиака и затем экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и затем упаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (элюент: 3/7 34 В круглодонной колбе смешивают вместе 1,52 г (9,9 ммоль) 3,5-диметоксианилина и 2,30 г(12 ммоль, 1,2 экв.) этилформилфенилацетата в атмосфере азота. Смесь перемешивают 1 ч при комнатной температуре. Затем добавляют раствор триметилсилилполифосфата (PPSE), свежеприготовленного из 4,56 г (0,03 моль) Р 2 О 5,10,9 мл (0,17 моль) гексаметилдисилоксана и 50 мл 1,2-дихлорэтана. Полученную смесь выдерживают при 100 С 2 ч. Затем нагревание прекращают и к реакционной массе добавляют лед. После этого смесь нейтрализуют насыщенным раствором гидрокарбоната натрия (добавляют порциями, реакция экзотермическая). Продукт экстрагируют дихлорметаном (должно быть использовано большое количество). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Остаток переносят в этилацетат, который вызывает выпадение в осадок желаемого соединения. Целевой продукт выделяют путем фильтрования через воронку Бюхнера. После частичного концентрирования фильтрата, конечный продукт вновь выпадает в осадок. Твердое вещество вновь выделяют фильтрованием, эту операцию повторяют несколько раз. Соединение 34 (444 мг) получают с выходом 16%. т.пл. 257-258 С (ЕtOАс) ИК (KBr) n 1668, 1631, 1569, 1514 см-1 1 Н ЯМР (250 МГц, DMSO-d6): д 3.81 (с,3H, OCH3), 3.89 (с, 3H, OCH3), 6.36 (д, 1 Н, J = 1.8 Гц, НAr), 6.45 (д, 1H, J = 1.8 Гц, НAr), 7.287.42 (м, 3H, НAr), 7.69 (д, 2 Н, 1 = 7.0 Гц, НAr),8.00 (с, 1H, HAr), 11.81 (уширенный с, 1 Н, NH). 13 С ЯМР (62.90 МГц, DMSO-d6): d 55.5,56.0, 90.0, 93.1, 104.5, 126.9, 127.3, 127.9 (2),128.4 (2), 131.4, 136.7, 140.8, 156.8, 161.4, 162.2. 1,37 мл (0,01 ммоль) о-анизидина растворяют в толуоле (14 мл) в атмосфере азота при 0 С. К смеси добавляют по каплям раствор фенилацетил хлорида (1,62 мл, 0,01 ммоль) в 5 мл толуола. Реакционную смесь перемешивают при комнатной температуре 1 ч и затем гидролизуют холодным раствором бикарбоната натрия. Двухфазную систему энергично перемешивают 30 мин и органическую фазу затем собирают. Водную фазу экстрагируют этилацетатом (дважды). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток растворяют в минималь 35 ном количестве толуола, который вызывает выпадение в осадок целевого продукта. После фильтрования через воронку Бюхнера, выход составил 2,7 г (92%) соединения 37. т.пл. 80-81 С (толуол) [т.пл. 85 С; С. Yamagami et al., Chem. Pharm. Bull. 1984, 32, 50035009] ИК (КВr) n 3287, 1652, 1598 см-1 1 Н ЯМР (250 МГц, CDCl3): д 3.72 (с, 3H,СН 3), 3.76 (с, 2 Н, СН 2), 6.81 (дд, 1 Н, J = 8.0, 1.8 Гц, НAr), 6.91-7.05 (м, 2 Н, НAr), 7.21-7.37 (м, 4 Н,НAr), 7.80 (уширенный с, 1 Н, NH), 8.35 (дд, 1H,J=8.0, 1.8 Гц, НAr). 13 С ЯМР (62.90 МГц, CDCl3): д 45.2, 55.7,109.9, 119.5, 121.1, 123.7, 127.4, 127.6, 129.0 (2),129.6 (2), 134.6, 147.8, 168.8. МС (ионный пучок): м/з 242 (M+1)+ 1,3 мл (1,68 ммоль, 1,5 экв.) N,Nдиметилформамида добавляют по каплям к 7,3 мл (78 ммоль, 7 экв.) РОCl3 в атмосфере азота при -30 С. Реакционную смесь перемешивают 15 мин при -30 С и затем добавляют 2,7 г амида 37 (0.01 ммоль). Реакционную смесь нагревают до комнатной температуры при перемешивании и затем нагревают при 75 С 1,5 ч. В конце реакции полученный раствор выливают на колотый лед, нейтрализуют 30% водным раствором аммиака и затем экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и затем упаривают. Остаток очищают хроматографией на колонке с двуокисью кремния (3/7EtOAc/PE), выход составил 650 мг (21%) хлорпроизводного. После растворения указанного производного в 3,8 мл ледяной уксусной кислоты и 0,12 мл воды, полученный раствор нагревают с обратным холодильником в течение 3 ч. Уксусную кислоту удаляют упариванием. Остаток растворяют в воде, нейтрализуют 25% раствором гидроксида натрия и затем наконец экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Остаток переносят в этилацетат, который вызывает кристаллизацию целевого продукта. Полученные кристаллы отфильтровывают, что дает 237 мг (40%) соединения 38. Общий выход проведенного синтеза по получению соединения 38 составляет 8%. т.пл. 188-189C (EtOAc) ИК (КВr) n 1646, 1607, 1569 см-1 1 Н ЯМР (250 МГц, DMSO-d6): д 3.92 (с,3H, OCH3), 7.13-7.16 (м, 2 Н, НAr), 7.30-7.46 (м,4 Н, НAr), 7.74-7.77 (м, 2 Н, НAr), 8.09 (с, 1 Н, НAr),10.98 (уширенный с, 1 Н, NH). 13 С ЯМР (62.90 МГц, DMSO-d6): д 56.5,111.3, 120.3, 120.4, 122.4, 128.3 (2), 128.4, 128.7,129.2 (2), 132.6, 136.7, 138.2, 145.9, 161.1.(CRL8321) растворяют в уксусном ангидриде и пиридине (8 мл, об./об.) в атмосфере азота при 0 С. Реакционную смесь перемешивают при комнатной температуре 18 ч. Среду гидролизуют добавлением воды (10 мл) и затем экстрагируют дихлорметаном (дважды). Органическую фазу сушат над MgSO4 и затем упаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (1/9 EtOAc/(CRL8246) растворяют в 10 мл безводного N,Nдиметилформамида (ДМФА) в атмосфере азота. При 0 С 47 мг (1,92 ммоль, 1,5 экв.) гидрида натрия, предварительно промытого петролейным эфиром, добавляют порциями в реакционный раствор (экзотермическая реакция). Затем к смеси добавляют 4-хлорбутиронитрил (0,23 мл,2,57 ммоль, 2 экв.) и иодид натрия (20 мг). Реакционную смесь нагревают 3 ч при 90 С. После охлаждения и упаривания ДМФА к остатку до 37 бавляют воду. Водный раствор экстрагируют этилацетатом (дважды). Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (9/1 CH2Cl2/EtOAc), выход составил 151 мг (31%) соединения 40 а и 161 мг (33%) производного 40. Соединение 40: т.пл. 157-158 С (ЕtOАс) ИК (KBr) n 1639, 1609, 1597, 1575, 1517 см-1 1 Н ЯМР (250 МГц, CDCl3): д 2.10-2.21 (m,2 Н, СH2), 2.52 (т, 2 Н, J = 7.2 Гц, СН 2 СН), 3.83 (с,3H, OCH3), 3.92 (с, 3H, OCH3), 3.93 (с, 3H,OCH3), 4.43 (т, 2 Н, J = 7.2 Гц, NСН 2), 6.31 (д,1 Н, J = 2.2 Гц, НAr), 6.42 (д, 1 Н, J = 2.2 Гц, НAr),6.94 (д, 2 Н, J = 8.8 Гц, НAr), 7.66 (д, 2 Н, J = 8.8 Гц, НAr), 8.15 (с, 1 Н, НAr). 13 С ЯМР (62.90 МГц, СDCl3): д 15.3, 23.6,41.8, 55.4, 55.9, 56.0, 89.6, 93.1. 106.4, 113.6 (2),119.5, 126.7, 129.6, 130.1 (2), 130.8, 140.7, 157.9,159.3, 161.2, 162.8. МС (ионный пучок): м/з 379 (M1) Анализ. Вычислено для C22H22N2O4: С,69.83; Н, 5.86; N, 7.40. Найдено: С, 69.61; Н, 5.97; N, 7.32. 2-([5,7-Диметокси-3-(4-метоксифенил)-2 хинолинил]окси)бутаннитрил (соединение 40 а). 38 238 мг (1,6 ммоль) 3,5-диметоксианилина растворяют в толуоле (7 мл) в атмосфере азота при 0 С. К смеси по каплям добавляют раствор 4-бензилфенилацетил хлорида (0,5 мл, 1,7 ммоль) в 5 мл толуола. Реакционную смесь перемешивают при комнатной температуре 2 ч и затем гидролизуют холодным раствором гидрокарбоната натрия. Двухфазную систему энергично перемешивают 30 мин и органическую фазу затем собирают. Водную фазу экстрагируют этилацетатом (дважды). Органическую фазу сушат над MgSO4 и затем упаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (4/6 EtOAc/PE), выход составил 300 мг (81%) соединения 41. т.пл. 122-123 С (EtOAc/PE) ИК (KBr) n 291, 1659, 1610, 1595, 1513 см-1 1 Н ЯМР (250 МГц, CDCl3): д 3.66 (с, 2 Н,СН 2), 3.74 (с, 3H, OCH3), 3.75 (с, 3H, OCH3), 5.08 0,31 мл (4,0 ммоль, 1,5 экв.) N,Nдиметилформамида добавляют по каплям 1,75 мл (19 ммоль, 7,5 экв.) РОСl3 в атмосфере азота при -30 С. Смесь перемешивают 15 мин при-30 С и затем добавляют 1,02 г амида 41 (2,7 ммоль). Реакционную смесь нагревают до комнатной температуры при перемешивании и затем нагревают при 75 С 1,5 ч. В конце реакции полученный раствор выливают на колотый лед,нейтрализуют 30% водным раствором аммиака и затем экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и затем упаривают. Остаток растворяют в 4,75 мл ледяной уксусной кислоты и 0,15 мл воды и полученный раствор затем нагревают с обратным холодильником 3 ч. Уксусную кислоту удаляют упариванием. Остаток растворяют в воде, нейтрализуют 25% раствором гидроксида натрия и затем наконец экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Остаток переносят в этилацетат, который вызывает выпадение в осадок целевого продукта. Полученные таким об 39 разом кристаллы отфильтровывают, выход составил 200 мг (20%) соединения 42. т.пл. 234-235 С (ЕtOАс) ИК (KBr): n 1629, 1608, 1569, 1515 см-1 1 Н ЯМР (250 МГц, DMSO-d6): д 3.81 (с,3H, OCH3), 3.90 (с, 3H, OCH3), 5.15 (с, 2 Н, СН 2),6.37 (с, 1 Н, НAr), 6.45 (с, 1 Н, НAr), 7.04 (д, 2 Н, J = 8.8 Гц, НAr), 7.31-7.49 (м, 5 Н, НAr), 7.69 (д, 2 Н, 5 1,5 г (12,0 ммоль) п-анизидина растворяют в толуоле (7 мл) в атмосфере азота при 0 С. К среде добавляют по каплям раствор фенилацетила хлорида (1,61 мл, 12,2 ммоль) в 20 мл толуола. Реакционную смесь перемешивают при комнатной температуре 2 ч и затем гидролизуют холодным раствором гидрокарбоната натрия. Двухфазную систему энергично перемешивают 30 мин и органическую фазу затем собирают. Водную фазу экстрагируют этилацетатом (дважды). Органическую фазу сушат над MgSO4 и затем упаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (3/7 EtOAc/PE), выход составил 2,6 г (89%) соединения 43. т.пл. 118-119 С (EtOAc/PE) ИК (KBr): n 3290, 1650, 1603, 1545, 1513 см-1 1 Н ЯМР (250 МГц, CDCl3): д 3.72 (с, 2 Н,СH2), 3.77 (с, 3H, OCH3), 6.81 (д, 2 Н, J = 9.0 Гц,НAr), 7.00 (уширенный с, 1 Н, NH), 7.28-7.43 (м,7 Н, НAr). 13 С ЯМР (62.90 МГц, CDCl3): д 44.8, 55.6,114.2 (2), 121.9 (2), 127.7, 129.3 (2), 129.7 (2),130.8, 134.7, 156.7, 169.1. МС (ионный пучок): 242 (M1) Анализ. Вычислено для C15H15NO2: С,74.67; Н, 6.27; N, 5.80. Найдено: С, 74.79; Н, 6.14; N, 5.95. 40 0,96 мл (12,4 ммоль, 1,5 экв.) N,Nдиметилформамида добавляют по каплям к 5,4 мл (58 ммоль, 7,5 экв.) РОСl3, в атмосфере азота при -30 С. Смесь перемешивают 15 мин при-30 С и затем добавляют 2,0 г амида 43 (8,3 ммоль). Реакционную смесь нагревают до комнатной температуры при перемешивании и затем нагревают при 75 С 1,5 ч. В конце реакции указанный раствор выливают на колотый лед,нейтрализуют 30% водным раствором аммиака и затем экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и затем упаривают. Полученный остаток растворяют в 12,2 мл ледяной уксусной кислоты и 0,4 мл воды и полученный раствор затем нагревают с обратным холодильником 3 ч. Уксусную кислоту удаляют упариванием. Остаток растворяют воде, нейтрализуют 25% раствором гидроксида натрия и затем наконец экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Остаток переносят в этилацетат, который вызывает выпадение в осадок целевого продукта. Полученные таким образом кристаллы отфильтровывают, выход составил 585 мг (28%) соединения 44. т.пл. 243-244 С (ЕtOАс) ИК (KBr) n 1645, 1618, 1569, 1503 см-1 1 Н ЯМР (250 МГц, DMSO-d6): д 3.80 (с,3H, OCH3), 7.16 (дд, 1 Н, J = 2.5, 8.9 Гц, НAr), 7.28 170 мг (0,55 ммоль) соединения 8 растворяют в трифторметансульфонилуксусном ангидриде и пиридине (8 мл, об./об.) в атмосфере азота при 0 С, в атмосфере азота. Реакционную смесь перемешивают при комнатной температуре 2 ч. Смесь гидролизуют добавлением воды(дважды). Органическую фазу сушат над MgSO4 и затем упаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (1/9 ЕtOАс/СH2Cl2), выход составил 194 мг (80%) соединения 45. т.пл. 144-145 С (ЕtOАс) 200 мг (0,64 ммоль) соединения 8 растворяют в уксусном ангидриде и пиридине (8 мл,об./об.) при 0 С в атмосфере азота. Реакционную смесь перемешивают при комнатной температуре 18 ч, гидролизуют добавлением воды(дважды). Органическую фазу сушат над MgSO4 и затем упаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (1/9 EtOAc/CH2Cl2), выход составил 165 мг (73%) соединения 46. т.пл. 148-149 С (ЕtOАс/РЕ) ИК (КВr): n 1751, 1639, 1601, 1508 см-1 1 Н ЯМР (250 МГц, СDCl3): д 2.31 (с, 3H,СН 3), 3.72 (с, 3H, NCH3), 3.90 (с, 6 Н, СН 3), 6.28 1,0 г (9,3 ммоль) 4-метиланилина растворяют в толуоле (10 мл) в атмосфере азота при 0 С. К смеси добавляют раствор фенилацетилхлорида (1,25 мл, 9,4 ммоль) в 20 мл толуола. Реакционную смесь перемешивают при комнатной температуре 2 ч и затем гидролизуют холодным раствором гидрокарбоната натрия. Двухфазную систему энергично перемешивают 30 мин и органическую фазу затем собирают. Водную фазу экстрагируют этилацетатом (дважды). Органическую фазу сушат над MgSO4 и 42 затем упаривают. Полученный остаток очищают хроматографией на колонке с двуокисью кремния (3/7 EtOAc/PE), выход составил 1,9 г (92%) соединения 47. т.пл.119-120 С (ЕtOАс) ИК (KBr) n 3310, 1657, 1604, 1536, 1514 см-1 1 Н ЯМР (250 МГц, CDCl3): д 2.28 (с, 3H,СН 3), 3.70 (с, 2 Н, CH2), 7.06 (д, 1 Н, J = 8.5 Гц,НAr), 7.25-7.38 (m, 9H, НAr). 13 С ЯМР (62.90 МГц, CDCl3): д 21.0, 44.9,120.1 (2), 127.7, 129.3 (2), 129.5 (2), 129.6 (2),134.2, 134.7, 135.2, 169.2. МС (ионный пучок): 226 (М 1) Анализ. Вычислено для C15H15NO: С,79.97; Н, 6.71; N, 6.22. Найдено: С, 80.23; Н, 6.87; N, 6.11. 0,41 мл (5,3 ммоль, 1,5 экв.) N,Nдиметилформамида добавляют по каплям к 3,3 мл (25 ммоль, 7 экв.) РОСl3 в атмосфере азота при -30 С. Смесь перемешивают 15 мин при-30 С и затем добавляют 800 мг амида 47 (3,5 ммоль). Реакционную смесь нагревают до комнатной температуры при перемешивании и затем нагревают при 75 С 1,5 ч. В конце реакции полученный раствор выливают на колотый лед,нейтрализуют 30% водным раствором аммиака и затем экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и затем упаривают. Полученный остаток растворяют в 5,4 мл ледяной уксусной кислоты и 0,2 мл воды и полученный раствор затем нагревают с обратным холодильником 3 ч. Уксусную кислоту удаляют упариванием. Остаток растворяют в воде, нейтрализуют 25% раствором гидроксида натрия и затем, наконец, экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и затем упаривают при пониженном давлении. Остаток переносят в этилацетат, который вызывает выпадение в осадок целевого продукта. Полученные таким образом кристаллы отфильтровывают, выход составил 80 мг (10%) соединения 48. т.пл. 212-213 С (ЕtOАс) ИК (КВr): n 1657, 1570 см-1 1 Н ЯМР (250 МГц, DMSO-d6): д 2.35 (с,3H, СН 3), 7.25 (д, 1 Н, J = 8.5 Гц, НAr), 7.33-7.48 43 Анализ. Вычислено для C16H13NO: С,81.68; Н, 5.57; N, 5.95. Найдено: С, 81.78; Н, 5.39; N, 6.11. Далее будут приведены результаты фармакологического тестирования, демонстрирующего свойства соединений формулы I и Iа, как самих по себе, так и в сочетании с цитотоксическими агентами. 1 - Воздействие (стимулирование или ингибирование пролиферации) на размножение клоногенных клеток (клоногенный тест). Применяемый тест описан в Hamburger et(New England J. Med., 298, 1321-1327). Клетка считается клоногенной, если она способна к пролиферации и может давать колонию клеток."Стволовые клетки опухоли человека" - это клетки, которые являются источником клетокнеопластов, составляющих основу данной опухоли. Стволовые клетки опухоли ответственны за рецидивные процессы, которые могут наблюдаться после хирургического удаления первичных опухолей, а также за образование метастазов. В опухоли или в опухолевой клеточной линии клоногенные стволовые клетки отличаются от других опухолевых клеток или от линий рассматриваемых клеток-неопластов тем, что они сохраняют свою способность к пролиферации в отсутствии какого-либо твердого носителя. В этом тесте опухолевые клетки выращивают на полутвердой подложке, состоящей из агара. Лишь те клетки, которые не требуют для своего роста твердой подолжки (т.е. клетки с высоким опухолеобразующим потенциалом,известные по M.I. Dawson et al., Cancer Res. 1995; 55: 4446-4451 как "независимые от опоры клетки"; эти клетки также известны как клоногенные в связи с "клональным ростом"), способны расти на такой агарозной подложке. Более конкретно, на такой среде нормальные клетки, растущие в "связанной манере" ("зависимые от опоры клетки", по терминологии M.I. Dawson), такие, например, как фибробласты, не выживают. В популяции опухолевых клеток именно эти клоногенные клетки (ассоциирующиеся с неограниченным числом клеточных делений; пролиферация этих клеток по M.I. Dawson является "независимым от опоры [клональным] ростом") способны расти на подобной подложке. Процентное содержание этих клоногенных клеток в опухоли или в клеточной линии составляет от 0,1 до 0,001%. Неклоногенные клетки (ассоциирующиеся с ограниченным числом клеточных делений) не растут в условиях этого теста, так как они требуют для своего роста,протекающего в "связанной манере", твердой основы ("зависимый от опоры [связанный] рост" по терминологии M.I. Dawson et al Cancer Res. 1995; 55: 4446-4451). Было измерено влияние соединений (I) и(Iа), на рост клеточных колоний, полученных выращиванием, например, опухолевых линий 44 млекопитающих MCF7 и МХТ и колоректальной линии НТ-29, на полужидкой культуральной среде, известной как "легкий агар". На такой среде растут и выживают только клоногеннные клетки, классифицированные по M.I.Dawson как "независимые от опоры [клональные] клетки". Рост этих клеток в подобной "несвязанной манере" служит свидетельством их опухолеобразующей способности. Ингибирование увеличения размеров опухоли, в которой развивалось большее число клоногенных клеток, становится затем доказательством усиленной цитотоксической активности. С другой стороны, этот тест может также выявить, что некоторое соединение способно ингибировать размножение/пролиферацию клоногенных клеток, снижая таким образом способность опухоли к росту и уменьшая популяцию опухолевых клеток. Исследуемые линии опухолевых клеток культивируют в чашках площадью 25 см 2. После этого их обрабатывают трипсином, и клетки полностью диссоциируют друг от друга. Процентное содержание живых клеток определяют после прокрашивания трипановым синим. Готовят суспензию клеток в 0,3% агарозном растворе с концентрацией от 5-104 до 15-104 клеток/мл(в зависимости от типа рассматриваемых клеток). Далее инокулируют по 200 мкл этой суспензии в чашки Петри диаметром 35 мм, содержащие 3 мл основного слоя (нижний агар),представляющего собой 0,5% агарозу. В свою очередь, к 200 мкл клеточной суспензии добавляют 1,8 мл верхнего слоя (верхний агар), представляющего собой 0,3% агарозу. Затем чашки помещают в инкубатор при 37 С, 5% СО 2 и 70% влажности до начала обработки. Обработку проводят через от 1 до 2 ч после инокуляции. Тестируемые соединения готовят в концентрациях, в 100 раз превышающих желаемые концентрации, и 50 мкл этих растворов для обработки помещают на слой верхнего агара в соответствующие чашки. В настоящем исследовании конечные концентрации тестируемых продуктов составляли 10-5, 10-7 и 10-9 М. Затем чашки помещают в инкубатор на 21 день. На 21-й день на верхний слой помещают 100 мкл раствора ММТ (бромид 3-(4,5-диметилтиазол-2 ил)-2,5-дифенилтетразолиния, приготовленный в среде RPMI 1640) с концентрацией 1 мг/мл на 3 ч при 37 С. По истечении этого времени клеточные колонии фиксируют добавлением в каждую чашку 2 мл формалина. После фиксации в течение 24 ч формалин испаряется, и число окрашенных клеточных колоний, представляющих собой метаболитически активные клетки, площадь поверхности которых превышает 100 мкм 2, определяют при помощи инверсного микроскопа. Среднее число клонов клоногенных клеток, определенное для каждого из изученных экспериментальных условий, выражается в про 45 центах относительно среднего числа клонов клоногенных клеток, определенных в контрольных условиях, и принятого за 100%. Эти значения, выраженные в процентах относительно контрольных условий для всех тестированных продуктов, приведены в табл. I. Таблица I Клоногенные тесты- Результаты, сведенные в таблице, представляют собой средние значениястандартные средние ошибки (SEM), установленные по результатам по меньшей мере 6 измерений Таким образом, воздействуя на клоногенное поведение опухоли, соединения формул (I) и (Iа)- либо увеличивают (например, CRL 8315),по сравнению с контролем (культуральная среда не обрабатывается соединениями формул (I) или (Ia, среднее число клонов клоногенных клеток, следовательно, делая большее число опухолевых клеток чувствительными к цитотоксическим агентам (так как клоногенные клетки более чувствительны к цитотоксическим агентам во время фазы пролиферации),- либо снижают (например, CRL 8283) число клоногенных клеток благодаря прямой токсичности (приводящей в итоге, также и здесь, к уменьшению опухоли). 2 - Цитотоксическая активность в отношении неклоногенных клеток: "ММТ тест". Влияние соединений формул (I) и (Iа) на неклоногенные клетки оценивали при помощи ММТ колориметрического теста. Принцип ММТ теста основан на митохондриальном восстановлении метаболитически активными живыми клетками ММТ, продукта желтого цвета (бромида 3-(4,5-диметилтиазол-2 ил)-2,5-дифенилтетразолия) в формазан, про 003933 46 дукт синего цвета. Количество полученного таким образом формазана прямо пропорционально количеству живых клеток, присутствующих в культуральной(ых) лунке(ах). Это количество формазана измеряют спектрофотометрически. Клеточные линии выращивают в виде монослойной культуры при 37 С в закрытых культуральных чашах, содержащих MEM 25 MMHEPES (MEM - минимально необходимая среда) основную среду. Эта среда подходит для роста ряда различных диплоидных или первичных клеток мелкопитающих. К этой среде далее добавляют- 5% FCS (фетальной сыворотки крупного рогатого скота), прогретой при 56 С в течение 1 ч, для инактивации комплемента,- 0,6 мг/мл L-глутамина,- 200 UI/мл пенициллина,- 200 мкг/мл стрептомицина,- 0,1 мг/мл гентамицина. 12 использованных раковых клеточных линий человека были получены из Американской Коллекции Типовых Культур (АТСС,Rockville, MD, USA). Были использованы следующие клеточные линии:- U-373MG (код АТСС: НТВ-17) и U87MG (код АТСС: НТВ-14), две разновидности глиобластомы,- SW 1088 (код АТСС: НТВ-12), астроцитома,- А 549 (код АТСС: CCL-185) и А-427 (код АТСС: НТВ-53), две крупноклеточных разновидности рака легких,- НТС-15 (код АТСС: ССД-225) и LoVo(код АТСС: CCL-229), две разновидности колоректального рака,- T-47D (код АТСС: НТВ-133) и MCF7(код АТСС: НТВ-22), две разновидности рака молочной железы,- J82 (код АТСС: НТВ-1) и Т 24 (код АТСС: НТВ-4), две разновидности рака мочевого пузыря,- РС-3 (код АТСС: CRL-1435), рак простаты. В ходе эксперимента 100 мкл клеточной суспензии, содержащей от 20000 до 50000 (в зависимости от используемого типа клеток) клеток на 1 мл культуральной среды, инокулируют 96-луночные плоскодонные многолуночные планшеты и инкубируют при 37 С в атмосфере, содержащей 5% СO2, при 70% влажности. После инкубации в течение 24 ч культуральную среду заменяют 100 мкл свежей среды,содержащей либо различные тестируемые соединения в концентрациях, в интервале от 10-5 до 10-10 М, либо растворитель, предназначенный для растворения тестируемых продуктов (контрольные условия). После инкубации в течение 72 ч при указанных выше условиях культуральную среду заменяют 100 мкл желтоватого раствора ММТ, растворенного до концентрации 1 мг/мл в RPMI 1640. Микропланшеты повторно 47 инкубируют в течение 3 ч при 37 С и затем центрифугируют в течение 10 мин при 400xg. Далее желтоватый раствор ММТ удаляют и синие кристаллы формазана, образующиеся в клетках,растворяют в 100 мкл ДМСО. Затем микропланшеты встряхивают в течение 5 мин. Интенсивность образующейся в результате синей окраски, и, следовательно, конверсию желтого продукта ММТ в синий формазан клетками,которые остаются живыми в конце эксперимента, количественно оценивают спектрофотометрически с использованием многоканального спектрофотометра Dynatech Immunoassay System при длине волны 570 и 630 нм, соответст 003933 48 вующих максимуму поглощения формазана и фоновому сигналу. Встроенное программное обеспечение спектрофотометра рассчитывает величины средних оптических плотностей и стандартное отклонение (SD), а также величины стандартных средних ошибок (SEM). В качестве примера в табл. II приведены значения средней оптической плотности, полученной при концентрации 10-5 М для 12 вышеуказанных линий опухолевых клеток, выраженные в процентах относительно средней оптической плотности, измеренной в контрольных условиях (соответствующей 100%). Таблица IIа ху = среднее значениестандартная средняя ошибка Контрольные условия = 100% Оказывается, что некоторые из рассмотренных соединений обладают слабым ингибирующим эффектом, который может достигать 20-30% от общей клеточной пролиферации исследуемых опухолевых линий, и эти соединения не проявляют какой-либо клеточной специфичности. 3 - Определение максимальной переносимой дозы (MTD). Оценку максимальной переносимой дозы проводили на мышах B6D2F1/Jico в возрасте от 4 до 6 недель. Соединения вводили внутрибрюшинно дозами, постепенно возрастающими от 2,5 до 160 мг/кг. Величину MTD (выраженную в мг/кг) определяли из наблюдений степени выживаемости животных по прошествии 14 дневного периода после единичного введения исследуемого продукта. В течение этого периода также наблюдали изменения в весе животных. Если величина MTD превышает 160 мг/кг,то величину MTD по умолчанию приравнивают к 160 мг/кг. Результаты оценки максимальных переносимых доз (MTD) приведены в следующей таблице. Таблица III Максимальные переносимые дозы Соединения серии CRL Продукты этой серии не проявляют прямой токсичности и, следовательно, могут быть использованы in vivo при высоких концентрациях в тканях и, соответственно, в высоких дозах. 4 - Определение противоопухолевой invivo активности в сочетании с цитотоксическими агентами. Тесты были проведены на следующих моделях:- гормон-чувствительная аденокарцинома молочной железы мыши МХТ (HS-MXT),- лимфома Р 388,в присутствии или отсутствии цитотоксических агентов, таких как циклофосфамид, этопозид,доксорубицин или винкристин. При определении величины MTD продукта его противоопухолевую активность in vivo характеризовали в дозах MTD/2, MTD/4 и MTD/8 на модели аденокарциномы молочной железы мыши HS-MXT или на модели лимфомы Р 388. Дозу, проявившую лучшую противоопухолевую активность на этих различных моделях, отбирали и использовали в условиях комбинированного лечения цитотоксическими агентами. Во всех примерах, представленных ниже,независимо от модели (аденокарцинома молочной железы HS-MXT или лимфома Р 388) контрольные условия представлены группой из 9 мышей, которым в течение 5 недель подряд по 5 раз в неделю (понедельник, вторник, среда, четверг, пятница) вводили 0,2 мл физиологического солевого раствора, содержащего растворитель,применяемый для растворения различных применяемых соединений формул (I) и (Iа). В этих тестах были определены следующие параметры:i). Степень выживаемости мышей. Степень выживаемости определяли в виде соотношения Т/С: Это отношение представляет собой среднее время выживания срединной мыши из группы мышей, подвергшихся лечению, относительно среднего времени выживания срединной мыши в группе контрольных мышей. Таким образом, соединение вызывает значительноеii). Pocт опухоли (лакуна) путем измерения площади привитых опухолей HS-MXT или Р 388 два раза в неделю (понедельник и пятница). Эту площадь рассчитывали путем умножения величин двух наибольших перпендикулярных осей опухоли. Длины этих осей измеряли при помощи скользящего кронциркуля. 4.1. Аденокарцинома молочной железы мыши (HS-MXT). Модель гормон-чувствительной МХТ (HSMXT) аденокарциномы молочной железы мыши, привитой 4- и 6-недельным B6D2F1/Jico мышам, получена из молочных протоков молочной железы (Watson С. et al. Cancer Res. 1977; 37: 3344-48). Результаты, полученные при применении соединений 1 и 20, отдельно или в сочетании с цитотоксическими агентами, будут приведены по ходу описания примера. А - соединение 1 или CRL 8246. Способ лечения 1 и 1 а. Вводится только соединение 1. Первую инъекцию продукта проводят на седьмой день после прививки (D7) и далее в течение четырех недель подряд по 5 инъекций в неделю (понедельник, вторник, среда, четверг, пятница) дозами по 20 мг/кг. Способ лечения 2. Вводится только циклофосфамид (СРА). Первую инъекцию продукта проводят на четырнадцатый день после прививки (D14) и далее в течение трех недель подряд по 3 инъекции в неделю (понедельник, среда, пятница) дозами по 10 мг/кг. Способ лечения 3. Соединение 1 вводят в сочетании с циклофосфамидом. В этом случае первую инъекцию соединения 1 проводят на седьмой день после прививки (D7) и далее в течение четырех недель подряд по 5 инъекций в неделю (понедельник,вторник, среда, четверг, пятница) дозами по 20 мг/кг, а первую инъекцию циклофосфамида проводят на четырнадцатый день после прививки (Д 14) и далее в течение трех недель подряд по 3 инъекции в неделю (понедельник, среда,пятница) дозами по 10 мг/кг. Способ лечения 4. Вводится только этопозид (EТО). Первую инъекцию продукта проводят на четырнадцатый день после прививки (D14) и далее в течение трех недель подряд по 3 инъекции в неделю(понедельник, среда, пятница) дозами по 10 мг/кг. Способ лечения 5. Вводится только доксорубицин (DOX). Первую инъекцию продукта проводят на четырнадцатый день после прививки (D14) и далее в течение трех недель подряд по 3 инъекции в неделю (понедельник, среда, пятница) дозами по 5 мг/кг. Способ лечения 6. Соединение 1 вводят в сочетании с этопозидом. В этом случае первую инъекцию соединения 1 проводят на седьмой день после прививки (D7) и далее в течение четырех недель подряд по 5 инъекций в неделю (понедельник,вторник, среда, четверг, пятница) дозами по 20 мг/кг, а первую инъекцию этопозида проводят на четырнадцатый день после прививки (D14) и далее в течение трех недель подряд по 3 инъекции в неделю (понедельник, среда, пятница) дозами по 10 мг/кг. Способ лечения 7. Соединение 1 вводят в сочетании с доксорубицином. В этом случае первую инъекцию соединения 1 проводят на седьмой день после прививки (D7) и далее в течение четырех недель подряд по 5 инъекций в неделю (понедельник,вторник, среда, четверг, пятница) дозами по 20 мг/кг, а первую инъекцию адриамицина проводят на четырнадцатый день после прививки(D14) и далее в течение трех недель подряд по 3 инъекции в неделю (понедельник, среда, пятница) дозами по 5 мг/кг. Полученные результаты, отражающие времена выживания для соединения 1, приведены в табл. IV и V. Таблица IV Способ лечения 1 (соединение 1) 2 (СРА) 3 (соединение 1 + СРА) Эти результаты показывают, что совместное введение соединения 1 с цитотоксическими агентами: циклофосфамидом, этопозидом, или доксорубицином, существенно повышает среднее время выживания срединной мыши из различных групп мышей, подвергшихся лечению,относительно среднего времени выживания срединной мыши из группы контрольных мышей. Далее это увеличение среднего времени выживания срединной мыши из различных групп мышей, подвергшихся совместному лечению,существенно больше того, которое получено при введении только цитотоксических агентов. Кроме того, исследования роста опухолей привели к следующим результатам для соединения 1. Табл VI ниже показывает (в процентном отношении) уменьшение (-) или увеличение(+) площади HS-MXT опухолей, вызванное различными способами лечения 1, 2 и 3 из примера 1, в сравнении с контрольными условиями на 31 день после прививки опухоли, т.е. после 19 введений соединения 1 и 8 введений циклофосфамида, вводимого совместно или иным образом. На 31 день после прививки 89% контрольных животных еще живы (т. е. 8 из 9 животных). Таблица VI Способ лечения 1 (соединение 1) 2 (СРА) 3 (соединение 1 + СРА) Эти результаты показывают, что совместное введение соединения 1 с циклофосфамидом вызывает более существенное уменьшение роста HS-MXT опухолей, большее, чем уменьшение, вызванное при лечении, включающем соединение 1 или только циклофосфамид. В - соединение 21 или CRL 8256. Другой пример относится к соединению 21, применяемому отдельно или в сочетании с этопозидом. Способ лечения 10. Вводится только соединение 21. Первую инъекцию продукта проводят на седьмой день после прививки (D7) и далее в течение пяти недель подряд по 5 инъекций в неделю (понедельник, вторник, среда, четверг, пятница) дозами по 40 мг/кг. Способ лечения 20. Вводится только этопозид (ЕТО). Первую инъекцию продукта проводят на седьмой день после прививки (D7) и далее в течение трех не 55 дель подряд по 3 инъекции в неделю (понедельник, среда, пятница) дозами по 10 мг/кг. Способ лечения 30. Соединение 21 вводят в сочетании с этопозидом. В этом случае первую инъекцию соединения 21 проводят на седьмой день после прививки (D7) и далее в течение пяти недель подряд по 5 инъекций в неделю (понедельник,вторник, среда, четверг, пятница) дозами по 40 мг/кг, а первую инъекцию этопозида проводят на седьмой день после прививки (D7) и далее в течение трех недель подряд по 3 инъекции в неделю (понедельник, среда, пятница) дозами по 10 мг/кг. В табл. VII приведены результаты измерения времен выживания, полученные при использовании соединения 21. Таблица VII Способ лечения 10 (соединение 21) 20 (ЕТО) 30 (соединение 21 + ЕТО) Эти результаты показывают, что совместное введение соединения 21 с этопозидом вызывает весьма существенное увеличение среднего времени выживания срединной мыши из различных групп мышей, подвергшихся такому лечению, относительно среднего времени выживания срединной мыши из группы контрольных мышей. Далее это увеличение среднего времени выживания срединной мыши из группы мышей, подвергшихся совместному лечению,существенно больше того, которое получено при введении только этого 2-хинолона или этого цитотоксического агента отдельно. 4.2. Лимфома Р 388. Мышам CDF1 в возрасте от 4 до 6 недель прививали кусочек опухоли Р 388 (из лабораторного банка опухолей) подкожно в правый бок в день D0. Для достижения условий, близких к клинической реальности, мы ждали до пятого дня после прививки (Д 5), чтобы начать лечение. Причиной этому служит то, что по прошествии этого времени подкожные опухоли Р 388 поддаются прощупыванию. Ниже по ходу примера приведены результаты, полученные с использованием соединения 1 (CRL 8246) и 20 (CRL 8247), введенного одиночно или в сочетании с винкристином. Способ лечения 1. Вводится только соединение 1. Первую инъекцию продукта проводят на пятый день после прививки (D5) и далее в течение пяти недель подряд по 5 инъекций в неделю (понедельник, вторник, среда, четверг, пятница) дозами по 40 мг/кг. Способ лечения 2. Вводится только соединение 20. Первую инъекцию продукта проводят на пятый день после прививки (D5) и далее в течение пяти недель подряд по 5 инъекций в неделю (понедель 56 ник, вторник, среда, четверг, пятница) дозами по 40 мг/кг. Способ лечения 3. Вводится только винкристин (VCR). Первую инъекцию продукта проводят на пятый день после прививки (D5) и далее в течение трех недель подряд по 3 инъекции в неделю (понедельник, среда, пятница) дозами по 0,63 мг/кг. Способ лечения 4. Соединение 1 вводят в сочетании с винкристином. В этом случае первую инъекцию соединения CRL8246 проводят на пятый день после прививки (D5) и далее в течение пяти недель подряд по 5 инъекций в неделю (понедельник, вторник, среда, четверг, пятница) дозами по 40 мг/кг, а первую инъекцию винкристина проводят на пятый день после прививки (D5) и далее в течение трех недель подряд по 3 инъекции в неделю (понедельник, среда, пятница) дозами по 0,63 мг/кг. Способ лечения 5. Соединение 20 вводят в сочетании с винкристином. В этом случае первую инъекцию соединения CRL8247 проводят на пятый день после прививки (D5) и далее в течение пяти недель подряд по 5 инъекций в неделю (понедельник, вторник, среда, четверг, пятница) дозами по 40 мг/кг, а первую инъекцию винкристина проводят на пятый день после прививки (D5) и далее в течение трех недель подряд по 3 инъекции в неделю (понедельник, среда, пятница) дозами по 0,63 мг/кг. Табл. IX показывает результаты по измерению времен выживания мышей, полученные в процессе осуществления описанных выше способов лечения 1-5. Таблица IX Способ лечения 1 (соединение 1) 2 (соединение 20) 3 (VCR) 4 (соединение 1 + VCR) 7 (соединение 20 + VCR) Эти результаты показывают, что совместное введение соединений 1 и 21 с винкристином весьма существенно повышает среднее время выживания срединной мыши из различных групп мышей, подвергшихся такому лечению,относительно среднего времени выживания срединной мыши из группы контрольных мышей. Далее это увеличение среднего времени выживания срединной мыши из различных групп мышей, подвергшихся совместному лечению,существенно больше того, которое получено при введении только этих двух соединений или винкристина отдельно. Ниже будут приведены примеры, иллюстрирующие способы применения соединений формул (I) и (Iа) в моно- и полихимиотерапевтических протоколах с цитотоксическими агентами. В этих протоколах соединения формул (I) и (Iа) для простоты будут называться "2 хинолонами". А. Твердые опухоли. 1). Рак легких. 1.1. Для крупных клеток (запущенная стадия). Этот курс лечения повторяют 8 раз. 1.2. Для мелких клеток (поздняя стадия). 58 Курс лечения может включать повторение этого 4-недельного цикла. Курс лечения включает повторение этого цикла каждый 21 день. 2). Опухоли молочной железы.- CMF протокол в качестве дополнительного лечения для операбельной опухоли молочной железы (G. Bonnadonna et al., N. Engl. J. Каждый цикл повторяют каждые 28 дней,курс лечения включает 6 циклов.- АС протокол (В. Fisher et at., J. Can. Oncol.; 1990; 8: 1483-1496) в качестве дополнительного лечения: Этот курс лечения повторяют 6 раз каждые 21 день. Каждый цикл повторяют каждые 21 день,и курс лечения включает 6 циклов. 1.3. Крупноклеточный рак бронхов, локально запущенный или метастатический. Каждый цикл повторяют каждый 21 день,курс лечения включает 4 цикла.- Опухоли молочной железы с метастазами:- FAC протокол (A.U. Buzdar et al., Cancer 1981; 47: 2537-2542) и его различные применения дополняют вливаниями 2-хинолона в соответствии со следующей (не ограничивающей) схемой: Каждый цикл повторяют каждые 3 недели до тех пор, пока диагностируется прогресс заболевания. Этот курс лечения повторяют каждые 28 дней до тех пор, пока диагностируется прогресс заболевания.Oncol. 1991; 9: 1736-1739): Каждый цикл повторяют каждый 21 день до тех пор, пока диагностируется прогресс заболевания. Этот цикл повторяют каждые 3-5 недель,курс лечения включает 6 циклов. Этот курс лечения повторяют каждые 4 недели. Курс лечения включает два цикла с интервалом 21 день, после чего требуется оценка. С вливаниями 2-хинолона также может сочетаться лечение метастатических опухолей молочной железы с использованием таксоидов,например:Natl Cancer Inst. 1991; 83: 1797-1805) при лечении метастатических форм, которые могут быть устойчивыми к антрациклинам: Этот цикл повторяют каждый 21 день до тех пор, пока диагностируется прогресс заболевания.Oncol. 1996; 14: 58-65) в локально запущенных или метастатических опухолях молочной железы, устойчивых или рецидивирующих после цитотоксической химиотерапии (включавшей лечение антрациклином), или рецидивирующих в ходе дополнительного лечения: Этот курс лечения повторяют каждые 3 недели.- MMC-VBC протокол (С. Brambilla et al.,Tumori, 1989; 75: 141-144): Этот цикл повторяют каждый 21 день для курса лечения из двух циклов или до тех пор,пока заболевание прогрессирует;
МПК / Метки
МПК: C07D 215/22, A61P 35/00, A61K 31/47
Метки: рака, лечения, композиции, содержащие, фармацевтические, способ, 2-хинолоны
Код ссылки
<a href="https://eas.patents.su/30-3933-sposob-lecheniya-raka-farmacevticheskie-kompozicii-soderzhashhie-2-hinolony.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения рака, фармацевтические композиции, содержащие 2-хинолоны</a>
Предыдущий патент: Глиоксаль как топливная присадка
Следующий патент: Микрокапсулы с инициируемым щелочами высвобождением активнодействующего ингредиента
Случайный патент: Водный препарат эритропоэтина человека












