Иммуномодулирующие гетероциклические соединения
Формула / Реферат
1. Соединение 4-(6-фтор-3-оксо-1,3-дигидропиразоло[4,3-с]циннолин-2-ил)-N-(2,2-дифторэтил)бензамид формулы (А)
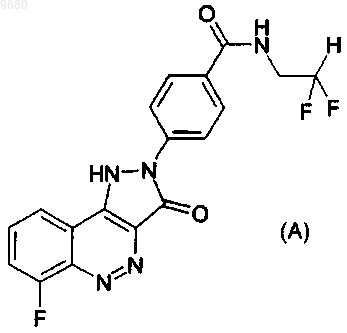
или его фармацевтически и/или ветеринарно приемлемая соль.
2. Применение соединения по п.1 для изготовления иммуноингибирующих средств.
Текст
009680 Область техники Настоящее изобретение относится к новым гетероциклическим соединениям, способам их получения, применению для получения лекарственных средств для клинического лечения медицинских состояний, на которые может благотворно воздействовать иммуномодуляция, например аутоиммунного заболевания, ревматоидного артрита, рассеянного склероза, диабета, астмы, трансплантации, системной красной волчанки и псориаза. Более конкретно, настоящее изобретение относится к новым гетероциклическим соединениям, которые являются антагонистами CD80, способными ингибировать взаимодействие между CD80 и CD28, пригодными для иммуноингибирования. Уровень техники Иммунная система обладает способностью контролировать гомеостаз между активацией и инактивацией лимфоцитов с помощью различных регуляторных механизмов в процессе и после иммунного ответа. Среди этих механизмов есть такие, которые специфически ингибируют и/или выключают иммунный ответ. Так, когда антиген представлен молекулами МНС к Т-клеточному рецептору, Т-клетки становятся соответствующим образом активированными только в присутствии дополнительных костимулирующих сигналов. В отсутствие этих дополнительных сигналов активации лимфоцитов нет и индуцируется либо состояние функциональной инактивации, называемое анергией, либо толерантность, или Тклетки специфически удаляются с помощью апоптоза. Один такой "костимулирующий" сигнал включает взаимодействие CD80 на специализированных антиген- презентирующих клетках с CD28 на Т-клетках, и показано, что этот сигнал важен для полной Тклеточной активации. (Lenschow et al. (1996) Annu. Rev. Immunol, 14, 233- 258). Поэтому было бы желательно получить соединения, которые ингибируют взаимодействие CD80/CD28. Раскрытие изобретения Согласно настоящему изобретению предлагается соединение 4-(6-фтор-3-оксо-1,3 дигидропиразоло[4,3-с]циннолин-2-ил)-N-(2,2-дифторэтил)бензамид формулы (А) или его фармацевтически и/или ветеринарно приемлемая соль, которые могут быть использованы для изготовления иммуноингибирующих средств. Соединение общей формулы (А) представляет собой антагонист CD80. Он ингибирует взаимодействие между CD80 и CD80 и, следовательно, активацию Т клеток, тем самым модулируя иммунный ответ. Изобретение включает применение соединения формулы (А) или его приемлемой фармацевтически или приемлемой в ветеринарии соли для производства лекарственных препаратов для лечения состояний, на которые может благотворно воздействовать иммуномодуляция, и в частности, для иммуноингибирования. Способ иммуномодуляции, и в частности, иммуноингибирования, у млекопитающих, включая людей, заключающийся во введении млекопитающему, нуждающемуся в таком лечении, эффективную иммуномодулирующую дозу лекарственных препаратов, содержащих соединения формулы (А) или его приемлемой фармацевтически или приемлемой в ветеринарии соли. Состояния, на которые благотворно воздействует иммуномодуляция, включают острый рассеянный энцефаломиелит, недостаточность надпочечников, аллергический васкулит и гранулматоз, амилоидоз,анкилозирующий спондилоартрит, астму, аутоиммунную болезнь Аддисона, аутоиммунную алопецию,аутоиммунный хронический активный гепатит, аутоиммунную гемолитическую анемию, аутоиммуннуюNeutrogena, аутоиммунную тромбоцитопеническую пурпуру, болезнь Бехчета, церебеллярную дегенерацию, хронический активный гепатит, хроническую воспалительную демиелинизирующую полирадикулоневропатию, хроническую нейропатию с моноклональной гаммопатией, классический узелковый полиартериит, врожднную гиперплазию надпочечников, криопатии, герпетиформный дерматит, диабет,миастенический синдром Итон-Ламберта, энцефаломиелит, приобретенный буллзный эпидермолиз,узелковую эритему, глютензависимую энтеропатию, синдром Гудпасчера, синдром Гийена-Барре, тиреоидит Хашимото, гипертиреоз, идиопатический гемохроматоз, идиопатический мембранозный гломерулонефрит, изолированный васкулит центральной нервной системы, болезнь Кавасаки, болезнь минимальных изменений (почек), смешанные васкулиты, смешанную соединительнотканную болезнь, мультифокальную моторную невропатию с блоком проведения импульсов, рассеянный склероз, тяжлую псевдопаралитическую миастению, синдром пляшущих глаз, пемфигоид, пузырчатку, злокачественную(болезнь Такаясу), височный артериит, облитерирующий тромбоангиит, типа I и типа II аутоиммунный полигландулярный синдром, язвенный колит, увеит, гранулматоз Вегенера. Соли солеобразующих соединений по изобретению включают физиологически приемлемые соли присоединения кислоты ил основные соли. Пригодные соли присоединения кислоты получают из кислот,образующих нетоксические соли. Примеры включают соли: ацетат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камзилат, цитрат, эдизилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат,никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, сахарат,стеарат, сукцинат, тартрат, тозилат и трифторацетат, соответствующие основные соли получают из оснований, образующих нетоксические соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Методы Предлагаемое соединение относится к соединениям общей формулы (I) где R4 обозначает сложноэфирную или амидную группу; радикал R4X предпочтительно находится в положении 4 фенильного кольца;R4 обозначает кислотную карбоксильную группу (-СООН) или сложноэфирную группу (эфир данной кислоты), или C(=O)NR6R7, -NR7C(=O)OR6 или -NR7C(=O)OR6, все по определению выше. Когда R4 обозначает сложноэфирную группу, примеры включают сложноэфирные группы -COOR,где R обозначает метил, этил, н- или изопропил, н-, вт- или трет- бутил, или бензил.R6, в тех случаях, когда он присутствует, обозначает Н или радикал формулы -(Alk)m-Q, где m, Alk и Q имеют значение по определению выше. Если m обозначает 1, Alk может обозначать, например, линейный или разветвлнный C1-C6 алкиленовый радикал, такой как -СН 2-, -СН 2 СН 2-, -СН 2 СН 2 СН 2- и -CH2CH(CH3)CH2. Alk может также обозначать, например, двухвалентный радикал циклопропилен, циклопентилен или циклогексилен. Радикал Alk, необязательно, может быть замещнным, например иметь заместители ОН, оксо, CF3, метокси или этокси. Радикал Alk, необязательно, может содержать гетероатом, например, в виде простой эфирной, тиоэфирной или аминосвязи. Группа Q может, например, обозначать водород; -NR9R10, где R9 и R10 могут быть одинаковыми или различными и выбираются из водорода, метила, этила, н- или изопропила или трет- бутила; сложноэфирную группу, например метиловый, этиловый или бензиловый эфир; или необязательно замещнную арильную, арилокси, циклоалкильную, циклоалкенильную или гетероциклическую группу, например,фенильную, фенокси, циклопентильную, циклогексильную, фурильную, тиенильную, хинуклидильную,пиперидильную или пиперазинильную группу.R7, в тех случаях, когда он присутствует, обозначает Н или C1-C6 алкил, например метил, этил, нили изопропил, н-, вт- или трет- бутил; или R6 и R7, вместе с атомом или с атомами, с которыми они связаны, образуют моноциклический гетероцикл, содержащий 5, 6 или 7 атомов в цикле. В настоящем изобретении R4 обозначает C(=O)NR6R7. Соединения в которых R4 представляет собой амидную группу -C(=O)NR6R7, можно получать по реакции соответствующего амина HNR6R7 с соединением формулы (II) с амидированием кислотной карбоксильной группы: символы R1 означает F, R3 отсутствует, X обозначает связь, R6 и R7 имеют значение по определению, данному выше, в связи с формулой (I). Соединения (II) (т.е. соединения (I), в которых R4 означает кислотную карбоксильную группу) можно получать по реакции соединения формулы (III) с гидразином формулы (IV) В результате этой реакции может получиться смесь изомеров положения (IIA) и (IIB) Соединения (I), в которых R4 обозначает сложноэфирную или амидную группу, можно также получать из интермедиата (III) по реакции с соответствующим гидразином (IVA) где R4 обозначает сложноэфирную или амидную группу. В результате реакции может получиться смесь сложноэфирных или амидных аналогов карбоновых кислот (IIA) и (IIB), из которой можно выделить нужный изомер сложного эфира или амида. Или же, карбоновую кислоту (II) можно просто этерифицировать или амидировать. Соединение по изобретению относится к подгруппе соединений общей формулы (IC) где X и R4 имеют значение по определению выше. В этой подгруппе радикал R4X- может находиться в положении 4 фенильного ядра. Эта подгруппа включает, в частности, соединения, в которых X обозначает связь, a R4 обозначает -C(=O)NR6R7, где R6 и R7 имеют значение по определению выше. Например, в таких соединениях R6 может обозначать хинуклидил, a R7 может обозначать водород.R6 и R7 имеют значение по определению выше. Например, в таких соединениях R6 может обозначать хинуклидил, a R7 может обозначать водород. Соединением по изобретению является 4-(6-фтор-3-оксо-1,3-дигидропиразоло[4,3-с]циннолин-2 ил)-N-(2,2-дифторэтил)бензамид формулы (А) или его применимые в фармацевтике или в ветеринарии соль. Как указывалось выше, изобретение включает применение соединения формулы (А) и его применимых в фармацевтике или в ветеринарии солей для изготовления иммуноингибирующих средств. Ясно,что для таких средств конкретный уровень дозы для каждого конкретного пациента будет зависеть от ряда факторов, включая активность конкретного применяемого соединения, возраст, вес тела, общее состояние здоровья, пол, питание, время введения, способ введения, скорость экскреции, комбинацию лекарственных препаратов и причину и тяжесть конкретного заболевания, подлежащего лечению. Оптимальные уровни доз и частота прима доз определяется клиническими испытаниями. Иммуноингибирующие средства для перорального применения могут быть в виде таблеток, капсул,порошков, гранул, лепшек, жидких или гелеобразных препаратов, таких как растворы или суспензии для перорального или местного применения или стерильные растворы или суспензии для парентерального применения. Таблетки и капсулы для перорального применения могут быть в виде выпускаемой стандартной дозы и могут содержать обычные эксципиенты, такие как связующие, например сироп, аравийская камедь, желатин, сорбит, смола трагаканта или поливинилпирролидон; наполнители, например лактозу, сахар, маисовый крахмал, фосфат кальция, сорбит или глицин; смазку для таблетирования, например стеарат магния, тальк, полиэтиленгликоль или оксид кремния; вещества, способствующие измельчению, например картофельный крахмал, или приемлемые поверхностно-активные вещества, такие как лаурилсульфат натрия. Таблетки могут быть покрыты оболочкой в соответствии с методами, хорошо известными в обычной фармацевтической практике. Оральные жидкие препараты могут быть, например,в форме водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут выпускаться в сухом виде (в виде тврдого продукта), который перед употреблением восстанавливается в присутствии воды или другого подходящего носителя. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, например сорбит, сироп, метилцеллюлозу, сироп глюкозы, желатин, гидрированные пищевые жиры; эмульгаторы, например лецитин, сорбитан моноолеат или аравийская камедь; неводные носители (которые могут включать пищевые масла), например миндальное масло, фракционированное кокосовое масло, маслообразные эфиры, такие как глицерин, пропиленгликоль или этиловый спирт; консерванты, например метил- или пропиловый эфир пгидроксибензойной кислоты или сорбиновая кислота, и при желании, обычные добавки, придающие вкус и запах, или красители. Для местного применения на коже лекарственный препарат может быть приготовлен в виде крема,лосьона или мази. Составы крема или мази, которые можно использовать для лекарственного препарата,являются обычными составами, хорошо известными в технике, например, описанными в стандартных учебниках по фармации, таких как British Pharmacopoeia. Для местного применения в офтальмологии лекарственный препарат можно приготовить в виде раствора или суспензии в подходящем стерильном водном или неводном носителе. Могут также быть включены добавки, например, буферы, такие как метабисульфит натрия или динатрия эдеат; консерванты, включая бактерицидные и фунгицидные агенты, такие как фенил-ртуть ацетат или нитрат, бензалкония хлорид или хлоргексидин, и загустители, такие как гипромеллоза. Активный ингредиент можно вводить также парентерально в стерильной среде. В зависимости от применяемого носителя и используемой концентрации лекарственный препарат может быть в носителе в суспендированном или растворнном виде. Предпочтительно, адъюванты, такие как местные анестетики,консерванты и буферизующие агенты, могут быть растворены в носителе. В описании могут быть использованы следующие сокращения: ДМФА Диметилформамид ДМАА Диметилацетамид ДМСО ДиметилсульфоксидHBTU Гексафторфосфат О-бензотриазол-1-ил-N,N,N',N'-тетраметилурония ВЭЖХ Высокоэффективная жидкостная хроматография ЖХ-МС(LCMS) Жидкостная хроматография-масс-спектрометрия ЯМР Спектроскопия ядерного магнитного резонанса Моногидрат мезоксалата натрия (5,00 г, 27,8 ммоля) растворяют в 1 М соляной кислоте (50 мл), получают бесцветный мутный раствор. К этой смеси при перемешивании при комнатной температуре по каплям прибавляют фенилгидразин (3,00 г, 2,72 мл, 27,8 ммоля). Образуется жлтый осадок, через 90 мин его отфильтровывают и промывают водой (50 мл). Осадок растирают со смесью этилацетат/гексан[1:1], отфильтровывают и сушат в вакууме. Титульное соединение выделяют в виде жлтого порошка(4.74 г, 22,7 ммоля, 82%). LCMS: m/z 207 [М-Н]+. Или же продукт можно экстрагировать из водной фазы этилацетатом (2250 мл), органическую фазу сушить сульфатом магния, отфильтровать и растворитель отогнать в вакууме. Стадия 2. Получение (фенилгидразон)малоноилдихлорида (дихлорангидрида (фенилгидразон)малоновой кислоты)(Фенилгидразон)малоновую кислоту (1,00 г, 4,80 ммоля) смешивают в атмосфере инертного газа с сухим хлороформом (15 мл), получают жлтую суспензию. Смесь перемешивают при комнатной температуре и порциями прибавляют пятихлористый фосфор (2,19 г, 10,5 ммоля). Реакционную смесь кипятят в течение 1,5 ч, получают зелный раствор. Смесь охлаждают до комнатной температуры и прибавляют гексан (15 мл). Образуется зелный осадок, его отфильтровывают и сушат в вакууме. Титульное соединение выделяют в виде порошка зелного цвета (645 мг, 2,63 ммоля, 53%). Стадия 3. Получение метилового эфира 4-гидроксициннолин-3-карбоновой кислоты Дихлорангидрид (фенилгидразон)малоновой кислоты (2,45 г, 0,01 ммоля) в инертной атмосфере смешивают с 1,2-дихлорэтаном (15 мл), получают жлтую суспензию. Прибавляют по каплям четырххлористый титан (1,89 г, 1,09 мл), образуется коричневый раствор. Смесь кипятят в течение ночи и и прибавляют метанол (15 мл). Продолжают перемешивание ещ в течение 30 мин и летучие отгоняют в вакууме. Прибавляют воду (100 мл) и полученную суспензию экстрагируют н-бутанолом (250 мл). Объединнные органические вытяжки промывают водой (220 мл) и упаривают в вакууме. Титульное соединение выделяют в виде тврдого вещества зелного цвета (1,04 г, 5,10 ммоля, 51%). LCMS: m/z 205[М+Н]+. Стадия 4. Получение метилового эфира 4-хлорциннолин-3-карбоновой кислоты К метиловому эфиру 4-гидроксициннолин-3-карбоновой кислоты (0,50 г, 2,45 ммоля) по каплям в атмосфере инертного газа прибавляют хлористый тионил (8,15 г, 5 мл). Смесь кипятят 1,5 ч, охлаждают до комнатной температуры и избыток хлористого тионила отгоняют в вакууме. К остатку прибавляют толуол (5 мл). Смесь перемешивают при комнатной температуре в течение ночи. Осадок отфильтровывают и сушат в вакууме. Титульное соединение выделяют в виде тврдого вещества бурого (коричневого) цвета (248 мг, 1,11 ммоля, 45%). LCMS: m/z 223 [М+Н]+. Стадия 5. Получение 4-(3-оксо-1,3-дигидро-2H-пиразоло[4,3-с]циннолин-2-ил)бензойной кислоты 4-Гидроксибензойную кислоту (68,4 мг, 0,45 ммоля) при комнатной температуре смешивают с этанолом (5 мл), получают суспензию кремового цвета. Прибавляют метиловый эфир 4-хлорциннолин-3 карбоновой кислоты (100 мг, 0.45 ммоля) и смесь нагревают при 45-50 С в течение 1 ч. Охлаждают до комнатной температуры и растворитель отгоняют в вакууме. К остатку прибавляют этилацетата (10 мл). Смесь перемешивают при комнатной температуре в течение 1 ч. Осадок отфильтровывают и сушат в вакууме. Титульное соединение получают в виде коричневого порошка (120 мг, 0,39 ммоля, 86%).= 7,92 Гц, 1 Нарил); 8,33 (д, J = 8,85 Гц, 2 Нарил); 14,64 (с, NH). Или же реакцию можно проводить при комнатной температуре. В этом случае для проведения реакции может потребоваться более продолжительное время, 2-3 ч. Пример 2. Получение N-[(диметиламино)пропил]-4-(3-оксо-1,3-дигидро-2 Н-пиразоло[4,3-с]циннолин-2-ил)бензамидаHBTU (30,3 мг, 0,08 ммоля). Перемешивают при комнатной температуре в течение 2 ч. Продукт очищают препаративной ВЭЖХ. Титульное соединение выделяют в виде тврдого вещества красного цвета 4-(3-Оксо-1,3-дигидро-2 Н-пиразоло[4,3-с]циннолин-2-ил)бензойную кислоту (52 мг, 0,17 ммоля) смешивают с ДМФА (2 мл). Прибавляют диизопропилэтиламин (22 мг, 29 мкл, 0,17 ммоля) и бензиламин (18,2 мг, 18,6 мкл, 0,17 ммоля), а затем HBTU (64,5 мг, 0,17 ммоля). Смесь перемешивают при комнатной температуре в течение 4 ч. Продукт очищают препаративной ВЭЖХ. Титульное соединение выделяют в виде тврдого вещества красного цвета (6,6 мг, 0,02 ммоля, 10%). LCMS: m/z 396 [М+Н]+. Пример 4. Стадия 1. Получение 4-(3-оксо-1,3-дигидро-2 Н-пиразоло[4,3-с]циннолин-2-ил)бензоилхлорида-6 009680 прибавляют хлористый тионил (90 мл). Смесь кипятят в течение 2 ч под азотом. Получают тмнокрасный раствор, охлаждают до комнатной температуры и избыток хлористого тионила отгоняют в вакууме. К остатку прибавляют толуол (30 мл) и смесь перемешивают при комнатной температуре под азотом до прекращения выпадения осадка. Осадок отфильтровывают и промывают толуолом (230 мл). Титульное соединение выделяют в виде тврдого вещества красного цвета (2,20 г, 6,77 ммоля, 88%). LCMS:m/z 321 [М+Н]+ (метиловый эфир, полученный в результате того, что образец готовили в метаноле). Стадия 2. Получение N-[(циклогексиламино)пропил]-4-(3-оксо-1,3-дигидро-2H-пиразоло[4,3-с]циннолин-2-ил)бензамидаN-циклогексил-1,3-пропандиамин (52 мг, 0,60 ммоля). Смесь перемешивают в течение 30 мин. Прибавляют воду, получают тмно-красную суспензию. Экстрагируют н-бутанолом (220 мл). Объединнные органические вытяжки промывают водой и упаривают в вакууме до тех пор, пока не начнт выпадать осадок. Прибавляют гексан (20 мл) и этилацетата (10 мл), осадок отфильтровывают и сушат в вакууме. Продукт выделяют в виде темно-красного порошка (82 мг, 0,18 ммоля, 62%). LCMS: m/z 445 [М+Н]+. Пример 5. Стадия 1. Получение [(2-фторфенил)гидразон]малоновой кислоты Моногидрат мезоксалата натрия (2,21 г, 12,3 ммоля) растворяют в 1 М соляной кислоте (50 мл), получают бесцветный мутный раствор. К этой смеси при перемешивании при комнатной температуре порциями прибавляют 2-фторфенилгидразина гидрохлорид (2,00 г, 12,3 ммоля). Образуется жлтый осадок,к смеси прибавляют воду (50 мл) и продолжают перемешивание в течение ночи. Прибавляют этилацетат(150 мл), интенсивно перемешивают до растворения осадка. Фазы разделяют и водный слой промывают этилацетатом (50 мл). Объединнные органические вытяжки сушат сульфатом магния, фильтруют и растворитель отгоняют в вакууме. Титульное соединение выделяют в виде жлтого порошка (2,55 г, 11,7 ммоля, 92%). LCMS: m/z 227 [М+Н]+. Стадия 2. Получение дихлорангидрида [(2-фторфенил)гидразон]малоновой кислоты ([(2 фторфенил)гидразон]малоноилдихлорида):(2-Фторфенилгидразон)малоновую кислоту (1,33 г, 5,88 ммоля) смешивают в атмосфере инертного газа с сухим хлороформом (20 мл), получают жлтую суспензию. Смесь перемешивают при комнатной температуре и порциями прибавляют пятихлористый фосфор (2,69 г, 12,9 ммоля). Реакционную смесь кипятят в течение 2 ч, получают тмно-жлтый раствор. Смесь охлаждают до комнатной температуры и упаривают в вакууме, пока не начнт выпадать осадок. Осадок отфильтровывают, промывают гексаном(30 мл) и сушат в вакууме. Титульное соединение выделяют в виде порошка жлтого цвета (760 мг, 2,89 ммоля, 49%). Стадия 3. Получение метилового эфира 8-фтор-4-гидроксициннолин-3-карбоновой кислоты: Дихлорангидрид (2-фторфенилгидразон)малоновой кислоты (19,4 г, 74 ммоля) в инертной атмосфере смешивают с 1,2-дихлорэтаном (100 мл), получают жлтую суспензию. Прибавляют по каплям четырххлористый титан (13.9 г, 8.08 мл, 74 ммоля), образуется коричневый раствор. Смесь кипятят в течение-7 009680 ночи. Прибавляют дополнительное количество четырххлористого титана (13,9 г, 8,08 мл, 74 ммоля) и продолжают нагревать ещ в течение 24 ч. Реакционную смесь охлаждают до 0-5 С и по каплям прибавляют метанол (50 мл). Продолжают перемешивание при комнатной температуре ещ в течение 1 ч и летучие отгоняют в вакууме. Прибавляют воду (300 мл) и полученную суспензию экстрагируют этилацетатом (3100 мл). Объединнные органические вытяжки сушат сульфатом магния, фильтруют и упаривают в вакууме. Получают тврдое вещество жлтого цвета (12 г, сырой продукт). LCMS: m/z 223 [М+Н]+. Стадия 4. Получение 4-(6-фтор-3-оксо-1,3-дигидро-2H-пиразоло[4,3-с]циннолин-2-ил)бензойной кислоты Сырой эфир 8-фтор-4-гидроксициннолин-3-карбоновой кислоты из предыдущей стадии (1,00 г, 4,95 ммоля) растворяют в хлористом тиониле (50 мл). Раствор кипятят 2-3 ч до прекращения выделения газа. Реакционную смесь охлаждают до комнатной температуры и избыточный хлористый тионил отгоняют в вакууме. Сырой интермедиат сушат азеотропной перегонкой с толуолом (325 мл). Получают темнокоричневое тврдое вещество, к которому прибавляют этанол (25 мл). Прибавляют 4-гидразинбензойную кислоту (640 мг, 4,21 ммоля) и смесь перемешивают при комнатной температуре в течение ночи. Осадок отфильтровывают, суспендируют в 1 М HCl (100 мл), фильтруют, промывают гексаном (50 мл) и сушат в вакууме. Продукт выделяют в виде тврдого вещества коричневого цвета (890 мг сырого продукта). Сырую 4-(6-фтор-3-оксо-1,3-дигидро-2 Н-пиразоло[4,3-с]циннолин-2-ил)бензойную кислоту из предыдущей стадии (1,45 г) растворяют в хлористом тиониле (50 мл). Раствор 2 нагревают при 70 С 2-3 ч до прекращения выделения газа. Реакционную смесь охлаждают до комнатной температуры и избыточный хлористый тионил отгоняют в вакууме. Остаток сушат азеотропной перегонкой с толуолом (220 мл),получают тврдое вещество. Осадок отфильтровывают, промывают толуолом и сушат в вакууме. Продукт выделяют в виде жлтого порошка (670 мг, 1,95 ммоля). LCMS: m/z 339 [М+Н]+ (метиловый эфир,полученный в результате приготовления образца в метаноле). Стадия 2. Получение 4-(6-фтор-3-оксо-1,3-дигидро-2H-пиразоло[4,3-с]циннолин-2-ил)-N(пирролидин-1-илбутил)бензамида 4-(6-Фтор-3-оксо-1,3-дигидро-2 Н-пиразоло[4,3-с]циннолин-2-ил)бензоилхлорид (100 мг, 0,29 ммоля) растворяют в сухом ДМАА (2 мл). Прибавляют диизопропилэтиламин (75 мг, 101 мкл, 0,58 ммоля), а затем 1-(4-аминобутил)пирролидин (41 мг). Перемешивают при комнатной температуре в течение ночи. Прибавляют воду (5 мл) и н-бутанол (5 мл). Фазы разделяют. Органическую фазу промывают водой (25 мл). Летучие отгоняют в вакууме. Продукт выделяют в виде порошка коричневого цвета (50 мг, 0,11 4-(6-Фтор-3-оксо-1,3-дигидро-2H-пиразоло[4,3-с]циннолин-2-ил)бензоилхлорид (100 мг, 0,29 ммоля) растворяют в сухом ДМАА (2 мл). Прибавляют диизопропилэтиламин (75 мг, 101 мкл, 0,58 ммоля), а затем 4-амино-1,2,2,6,6-пентаметилпиперидин (49 мг, 0,29 ммоля). Перемешивают при комнатной температуре в течение ночи. Прибавляют воду (5 мл) и н-бутанол (5 мл). Фазы разделяют. Органическую фазу промывают водой (25 мл) и раствор упаривают в вакууме. Титульное соединение выделяют в виде тврдого вещества темно-красного цвета (50 мг, 0,105 ммоля, 36%). LCMS: m/z 477 [М+Н]+. Пример 8. Стадия 1. Получение 2-(4-нитрофенил)-1,2-дигидро-3H-пиразоло[4,3-с]циннолин-3-она К метиловому эфиру 4-гидроксидиннолин-3-карбоновой кислоты (10,0 г, 49 ммолей) в атмосфере инертного газа по каплям прибавляют хлористый тионил (326 г, 200 мл). Смесь кипятят 2,5 ч, охлаждают до комнатной температуры и избыток хлористого тионила отгоняют в вакууме. К остатку прибавляют толуол (100 мл) и отгоняют в вакууме. Эту процедуру повторяют, добавляя и отгоняя ещ 100 мл толуола Получают коричневый полужидкий остаток, его растворяют в метаноле (200 мл). Смесь перемешивают при комнатной температуре в течение ночи. Нагревают при 40-45 С в течение 1 ч и охлаждают до комнатной температуры. Осадок отфильтровывают, растирают с этанолом (100 мл) и сушат в вакууме. Титульное соединение выделяют в виде тврдого вещества бурого (коричневого) цвета (8,42 г, 27,4 ммоля, 70%). LCMS: m/z 308 [М+Н]+. Стадия 2. Получение 2-(4-аминофенил)-1,2-дигидро-3 Н-пиразоло[4,3-с]циннолин-3-она 2-(4-Нитрофенил)-1,2-дигидро-3 Н-пиразоло[4,3-с]циннолин-3-он (11,4 г, 37,2 ммоля) суспендируют в смеси этанола (100 мл) и воды (100 мл). Добавляют порошок железа (11,1 г, 200 ммолей) и хлористый алюминий (5,34 г, 100 ммолей). Смесь нагревают при 80 С в течение ночи, охлаждают до комнатной температуры и подщелачивают до рН 9-10, добавляя карбонат калия. Осадок удаляют фильтрованием через слой целита (Celite). Фильтрат экстрагируют н-бутанолом (2200 мл). Объединнные органические вытяжки упаривают в вакууме, получают тврдый остаток красного цвета. Растирают с метанолом(100 мл), отфильтровывают и сушат в вакууме. Титульное соединение получают в виде тмно-красного порошка (5,58 г, 20,1 ммоля, 57%). LCMS: m/z 278 [М+Н]+. Стадия 3. Получение N-[3-(диметиламино)пропил]-N-[4-(3-оксо)-1,3-дигидро-2 Н-пиразоло[4,3 с]циннолин-2-ил)фенилмочевины 2-(4-Аминофенил)-1,2-дигидро-3H-пиразоло[4,3-с]циннолин-3-он (44 мг, 6 ммоля) суспендируют в толуоле (0,5 мл) в атмосфере азота при 0-5 С. Прибавляют ДМАА (0,5 мл), а затем N,N'карбонилдиимидазол (26 мг, 0,16 ммоля). Смесь перемешивают в течение 1 ч при 0-5 С, а затем смешивают с раствором 3-диметиламинопропиламина (18 мг, 0,18 ммоля) в толуоле (0,5 мл). Перемешивание продолжают в течение 1 ч и продукт очищают препаративной ВЭЖХ. Титульное соединение выделяют в виде порошка тмно-красного цвета (2,6 мг, 6 мкмолей, 4%). LCMS:m/z406[M+H]+. Пример 9. Получение этилового эфира 4-(3-оксо-1,3-дигидро-2H-пиразоло[4,3-с]циннолин-2 ил)бензойной кислоты Титульное соединение получают по методике, описанной в примере 1, стадия 5, но вместо 4 гидразинбензойной кислоты берут е этиловый эфир. MS: MH+ = 335,2 Результаты Анализ биомолекулярных взаимодействий BIAcore Биотинилированная человеческая молекула CD80 (hCD80-ВТ) представляет собой рекомбинантную растворимую форму мебраносвязанной рецепторной молекулы (CD80), которая связывается с CD28 для инициации Т-клеточной активации. Взаимодействие между CD80 и CD28 интенсивно исследовалось(Collins et al, 2002). Биотинилированная человеческая молекула HLA-A2-tax представляет собой рекомбинантную растворимую форму мембраносвязанной рецепторной молекулы, которую используют в данном примере в качестве контрольного белка, при этом не предполагается, что она реагирует с соединениями. Система BIAcore S51 используется для скрининга соединений из вышеприведнных примеров 14. Сенсорный чип СМ 5 серии S помещают на BIAcore S51. Стрептавидин присоединяют по карбоксиметильной группе на поверхности обычной реакцией присоединения аминов. Поверхность чипа активируют с помощью 0,2 М EDC/0,05 M NHS с последующим связыванием стрептавидина (0,25 мг/мл в 10 мМ ацетата натрия рН 5,0) и насыщением незанятых сайтов с помощью 1 М этилендиамина. Сенсорный чип BIAcore S51 имеет два раздельных сенсорных участка для иммобилизации белков.hCD80-ВТ иммобилизуют на покрытой стрептавидином поверхности одного сенсорного участка до тех пор, пока не наблюдается ответ около 3000 RU. Белок для контроля неспецифического связывания соединения иммобилизуют на втором сенсорном участке. Контрольный белок, применяемый в этих экспериментах, представляет собой биотинилированную растворимую форму человеческого HLA белка. Ряды разведения соединений (1000-0,05 нМ) готовят в рабочем буфере (10 нМ, рН 7,4, 140 мМBIAcore S51 пропускают при скорости потока 30 мкл/мин, используя рабочий буфер. Вводят(инъецируют) растворы соединений и стандарта ДМСО для корректировки данных с учтом влияния растворителя. Данные записываются автоматически и их анализируют с помощью программного обеспечения BIAcore S51 Evaluation. Взаимодействие между СВ 80 и эндогенным белковым лигандом (CD28) является высокоспецифическим, но сравнительно слабым, с KD 4750 нМ и скоростью выключения (off-rate) выше 0,2 с-1. В случае соединений из примеров 2, 3, 4, 6, 7 наблюдается более высокая аффинность к и более продолжительное время пребывания на CD80, чем на CD28, при этом значения KD составляют менее 100 нМ и скорости выключения (off-rate) 210-2, это указывает, что циннолины способны эффективно конкурировать с эндогенным лигандом. Взаимодействие циннолинов с контрольным белком не обнаруживается.revisited". Ингибирование продуцирования интерлейкина-2 (IL-2) человеческими Т клетками Jurkat Метод Человеческие клетки Raji помещают (диспенсер) с концентрацией 2105 клеток в лунке в средеRPMI-1640, дополненной 10% фетальной телячьей сыворотки, 1% пенициллина/стрептомицина, 1% глутамина (среда RJPMI) в 96-луночном U-образном (круглодонном) микротитрационном планшете. Исследуемые соединения (раствор в 100% ДМСО) разводят в восемь раз до нужной конечной концентрации в среде RPMI и добавляют до требуемой конечной концентрации до общего объма 200 мкл в лунке. После инкубации в течение 20 мин при 37 С добавляют Т клетки Jurkat в концентрации 2105 клеток/лунка. К культурам прибавляют моноклональное антитело к CD3 (UCHT1, RD Systems) с конечной концентрацией 1 мкг/мл, и, где указано, добавляют также моноклональное антитело к CD28 (CD28.2, BDPharmingen) в концентрации 2,5 мкл/мл. Клетки культивируют при 37 С в течение 5 ч, после чего планшеты центрифугируют и супернатанты собирают для анализа ELISA IL-2 с использованием парного набора IL-2 Eli-pair (DIACLONE Research, Besanon, France) в соответствии с инструкциями производителя. Анализ методом гомогенной время-разрешнной флуоресценции Вещества, полученные в описанных выше примерах, испытывают методом гомогенной времяразрешнной флуоресценции (HTRF) в бесклеточной среде с целью определения их активности в качестве ингибиторов взаимодействия CD80-CD28. По методике анализа европий и аллофикоцианин (АРС) ассоциируются с CD28 и СВ 80 опосредованно (через линкерные антитела) с образованием комплекса, который помещает европий и АРС в непосредственной близости, вызывая сигнал. Комплекс содержит следующие шесть белков: флуоресцентную метку 1, линкерное антитело 1, слитый белок CD28, слитый белок CD80, линкерное антитело 2 и флуоресцентную метку 2. В нижеприведнной таблице эти реагенты описаны более подробно. При образовании комплекса европий и АРС сближаются (находятся в тесной близости) и возникает сигнал. Неспецифическое взаимодействие измеряют, заменяя мышиный Fab фрагмент (С 215) на гибридный белок CD80-мышиный Fab фрагмент (1,9 мкг/мл). Анализ проводят в чрных 384-луночных планшетах при конечном объме 30 мкл. Буфер для анализа: 50 мМ Tris-HCl, 150 мМ NaCl pH 7,8, содержащий 0,1%BSA (вес./об.), добавляемый непосредственно перед применением. Соединения добавляют к вышеуказанным реагентам в серийных концентрациях в интервале 100 мкМ-1,7 нМ. Реакционную смесь инкубируют в течение 4 ч при комнатной температуре. Производят двойные измерения с помощью счтчика Wallac Victor 1420 Multilabel Counter. Первое измерение: возбуждение 340 нм, эмиссия 665 нм, время запаздывания 50 мкс, время отображения 200 мкс. Второе измерение: возбуждение 340 нм, эмиссия 615 нм, время запаздывания 50 мкс, время ото- 11009680 бражения 200 мкс. При подсчте делаются поправки на флуоресцентный переход, гашение и флуоресцентный фон. ЕС 50 активность испытуемых соединений регистрируются следующим образом: ЕС 50: 10 мкМ,= 1-10 мкМ,10 мкМ. Соединение из примеров 1-8 имеют следующую активность в описанном выше анализе HTRF: Пример 1 Пример 2 Пример 3 Пример 4 Пример 5 Пример 6 Пример 7 Пример 8 Пример 9 Дополнительные примеры Дополнительные примеры соединений по изобретению синтезируют методами, аналогичными методам, приведнным выше в примерах 1-8. Структура синтезированных соединений показана в следующей таблице вместе с их активностью в описанном выше анализе HTRF. Таблица
МПК / Метки
МПК: A61P 19/02, C07D 519/00, A61P 37/00, A61P 17/06, A61P 3/10, C07D 487/04, A61K 31/5025
Метки: иммуномодулирующие, соединения, гетероциклические
Код ссылки
<a href="https://eas.patents.su/30-9680-immunomoduliruyushhie-geterociklicheskie-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Иммуномодулирующие гетероциклические соединения</a>
Предыдущий патент: Производные 4-(7-гало-2-хино(кса-) линилокси)фенокси-пропионовой кислоты в качестве противоопухолевых средств
Следующий патент: Таблетка дерамцикланфумарата и способ её приготовления
Случайный патент: Статор флотационной камеры












