Пиримидинил бензотиофеновые соединения
Номер патента: 14426
Опубликовано: 30.12.2010
Авторы: Ванг Кью Мэй, Ших Чуан, Чжан Бо, Лин Хо-Шен, Ричетт Майкл Энрико, Данке Карл Роберт
Формула / Реферат
1. Соединение формулы I
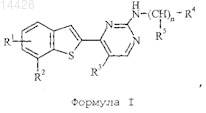
где R1 представляет собой водород, гидрокси, галоген, метилтио, аминосульфонил, пирид-2-иламино, 3-метиламинокарбонилфенил, -C(O)NR8R9, -(СН2)0-1NHSO2R12, -CH2NHCONHR13, -NHC(O)R14 или пирролидинонил, необязательно замещенный этилоксикарбонилом;
R2 представляет собой водород, гидрокси, галоген, циано, (С1-С4)алкил или (С1-С4)алкокси;
R3 представляет собой водород, галоген или метил;
R4 представляет собой
(a) -NR6R7или
(b) аминометилциклогексил, пиперидинил, 2,2,6,6-тетраметилпиперидин-4-ил, 2,2,6,6-тетраметилпиперидин-4-илэтенил, 4-(С1-С4)алкилпиперидин-4-ил или пирролидинил;
где (b) может быть необязательно замещен заместителем, выбранным из группы, которая включает (С2-С4)алкенил, (С3-С6) циклоалкил, C(O)R10 и (С1-С4)алкил, необязательно замещенный галогеном, (С1-С4)алкокси или (С3-С6) циклоалкилом;
R5 представляет собой водород, когда n обозначает 1-7, или гидрокси, когда n обозначает 2-7;
R6 представляет собой водород или (C1-C4)алкил;
R7 выбран из группы, которая включает водород, (C1-C4)алкил, пиперидин-4-ил, необязательно замещенный (С1-С4)алкилом, пиперидинилкарбонил, необязательно замещенный (C1-C4)алкилом, пирролидин-3-ил, необязательно замещенный (C1-C4)алкилом, и пирролидинилкарбонил, необязательно замещенный (C1-C4)алкилом;
альтернативно, R6 и R7вместе с азотом, к которому они присоединены, образуют кольцо, выбранное из группы, которая включает пиперазинил, гомопиперазинил, 4-диметиламинопиперидин-1-ил, 3-диметиламинопирролидин-1-ил или гексагидропирроло[3,4-с]пирролил;
где кольцо может быть необязательно замещено заместителем, выбранным из (С2-С4)алкенила, (С3-С6)циклоалкила, C(O)R10 и от одного до трех (С1-С4)алкильных заместителей, необязательно замещенных гидрокси;
R8 представляет собой водород или (С1-С4)алкил;
R9 представляет собой водород, (C1-C4)алкил, (C1-C4)алкокси, (С3-С6)циклоалкил, тиазолил, имидазолил, пиридил, фенил, необязательно замещенный галогеном, 2-гидрокси-2-фенилэтил, имидазолилэтил, 6-хлорпирид-3-илметил или фуран-2-ил-(С1-С4алкил);
альтернативно, R8 и R9вместе с азотом, к которому они присоединены, образуют гетероцикл, выбранный из группы, которая включает морфолинил и тиазинил;
R10 представляет собой водород, (С1-С4)алкил или NHR11;
R11 представляет собой водород или (C1-C4)алкил;
R12 представляет собой (С1-С4)алкил, трифтор(С1-С4)алкил, бензил или (С3-С6)циклоалкил;
R13 представляет собой (С1-С4)алкил, (С3-С6)циклоалкил или бензил, необязательно замещенный (С1-С4)алкилом, галогеном или (С1-С4)алкокси;
R14 представляет собой (С3-С6)циклоалкил, пиперидинил, индолилметил или бензил, необязательно замещенный 3-диметиламино-2-гидроксипропокси;
при условии, что когда R4 представляет собой пиперидинил, R1 представляет собой -C(O)NR8R9; и
n обозначает 1-7, при условии, что n обозначает только 1, когда R4 представляет собой
-аминометилциклогексил или 2,2,6,6-тетраметилпиперидин-4-илэтенил; или
его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1 представляет собой -C(O)NR8R9и R2 представляет собой водород; или его фармацевтически приемлемая соль.
3. Соединение по п.1 или 2, где где n обозначает 2-3; R4 представляет собой -NR6R7, пиперидинил или 4-(С1-С4)алкилпиперидин-4-ил и R5 представляет собой водород; где R4 может быть необязательно замещен (С1-С4)алкилом; или его фармацевтически приемлемая соль.
4. Соединение по пп.1-3, где R6 и R7вместе с азотом, к которому они присоединены, образуют пиперазинил, необязательно замещенный (С1-С4)алкилом; или его фармацевтически приемлемая соль.
5. Соединение по пп.1-4, где R8 представляет собой водород или (С1-С4)алкил и R9 представляет собой (С1-С4)алкил или (С3-С6)циклоалкил, или, альтернативно, R8 и R9вместе с азотом, к которому они присоединены, образуют морфолинил; или его фармацевтически приемлемая соль.
6. Соединение по п.1, которое представляет собой метиламид 2-{5-метил-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-ил}бензо[b]тиофен-4-карбоновой кислоты; или его фармацевтически приемлемая соль.
7. Фармацевтическая композиция, включающая соединения по любому по пп.1-6 или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым наполнителем, носителем или разбавителем.
8. Применение соединения формулы I по пп.1-6 или его фармацевтически приемлемой соли при лечении рака у млекопитающих.
9. Применение по п.8 для лечения рака, выбранного из множественной миеломы, рака толстой кишки, крупноклеточного рака легких, глиобластомы и рака яичников.
10. Применение соединения по пп.1-6 или его фармацевтически приемлемой соли для лечения воспалительных заболеваний, выбранных из ревматоидного артрита и хронического обструктивного заболевания легких у млекопитающих.
Текст
(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Данке Карл Роберт, Лин Хо-шен, Ших Чуань, Ванг Кью Мэй, Чжан Бо, Ричетт Майкл Энрико (US) Представитель: Настоящее изобретение предлагает соединения формулы I которое используют для лечения рака и воспалительных заболеваний. 014426 Протеин киназы модулируют широкое разнообразие биологических процессов в клетках, особенно те, которые переносят сигналы от клеточных мембран к внутриклеточным мишеням и координируют комплексные клеточные функции. Много внеклеточных раздражителей, которые вызывают клеточные реакции, чтобы они происходили внутри клеток, действуют через воздействующие на них протеин киназы и пути, регулируемые этими киназами. Поэтому одна или больше клеточных реакций, таких как клеточная пролиферация, дифференциация, миграция, активация факторов транскрипции, контроль синтеза протеина, регулирование клеточного цикла, секреция гормонов и цитокинов/хемокинов и метаболизм гликогена, могут регулироваться этими внеклеточными раздражителями. Примеры таких раздражителей включают различные стрессовые сигналы окружающей среды (например, окислительный стресс; тепловой шок, ультрафиолетовое излучение, бактериальный эндотоксин, Н 2 О 2), воспалительные цитокины(например, фактор некроза опухолей(TNF-) и интерлейкин-6 (IL-6 и факторы роста (например, эпидермальный фактор роста (EGF) и трансформирующий фактор роста бета (TGF-. Вследствие важности фосфорилирования протеина в регулировании многих аспектов жизни клетки,анормальная активность протеинкиназы приведет к анормальному фосфорилированию ключевых функциональных протеинов и энзимов и, таким образом, будет связана со многими заболеваниями человека, в частности с теми, которые вовлечены в пролиферативные и воспалительные реакции, такие как рак, ревматоидный артрит (RA), хроническое обструктивное заболевание легких (COPD), воспалительная болезнь кишечника, остеоартрит, астма, а также сердечно-сосудистые и неврологические расстройства. Соответственно, в медицинской химии была приложена значительная попытка разработки терапевтических агентов, нацеленных на протеин киназы, для лечения заболеваний у людей.IKK является ключевой киназой, регулирующей воспаление и пути, связанные со стрессом, и, поэтому, она связана с развитием многих заболеваний человека. Например, внутрисуставное введение доминантно-негативной IKK существенно снизило серьезность адъювант-вызванного артрита у крыс (так РР et al., Arthritis Rheum. (2001) 44(8), 1897-1907). Нокаутированные клетки IKбета имеют существенные дефекты в экспрессирующих цитокинах, хемокинах или молекулах адгезии, индуцированных TNF, которые вовлечены в воспалительное заболевание, такое как RA и COPD. Вследствие условного или тканеспецифического нокаутирования IKбета, найдено, что эта киназа необходима для выживания и пролиферации периферийных В-клеток и для предотвращения апоптоза, опосредованного TNF Li Z-W,Omori AS, Labuda T., Karin M., Rickert RC, "IKK is required for peripheral В cell survival and proliferation",The J. Immunol., (2003), 170:4630-4637; Maeda S, Chang L., et al. "IKK is required for prevention of apoptosis mediated by cell-bound but not by circulating TNFa" Immunity, (2003), 19:725-737). Кроме того, удаление IKK из миелоидных клеток также снизило рост рака, связанного с колитом (Greten FR et al, Cell,(2004), 118:285-296). К тому же, некоторые группы продемонстрировали, что ингибиторы IKK киназы могут вызывать ингибирование роста клеток и/или увеличение TNF- или TRAIL-индуцированной смерти клеток в различных клеточных линиях рака (Takaomi et al. Clinical Cancer Res., (2005), Vol 11:1974-82;Hideshima et al., JBC, (2002) 277:16639-47; Lam et al. Clinical Cancer Res., (2005), vol 11:28-40). Настоящее изобретение предлагает новые пиримидинил бензотиофеновые соединения, которые,как считают, имеют клиническое применение для лечения рака и воспалительных заболеваний вследствие ингибирования IKK. Краткое описание изобретения Настоящее изобретение предлагает соединения формулы IR4 представляет собой (a) -NR6R7 или (b) аминометилциклогексил, пиперидинил, 2,2,6,6 тетраметилпиперидин-4-ил, 2,2,6,6-тетраметилпиперидин-4-илэтенил, 4-(С 1-С 4)алкилпиперидин-4-ил или пирролидинил; где (b) может быть необязательно замещен заместителем, выбранным из группы, которая включаетR6 представляет собой водород или (С 1-С 4)алкил;R7 выбран из группы, которая включает водород, (C1-C4)алкил, пиперидин-4-ил, необязательно замещенный (С 1-С 4)алкилом, пиперидинилкарбонил, необязательно замещенный (С 1-С 4)алкилом, пирролидин-3-ил, необязательно замещенный (С 1-С 4)алкилом, и пирролидинилкарбонил, необязательно замещенный (С 1-С 4)алкилом; альтернативно, R6 и R7 вместе с азотом, к которому они присоединены, образуют кольцо, выбранное из группы, которая включает пиперазинил, гомопиперазинил, 4-диметиламинопиперидин-1-ил, 3 диметиламинопирролидин-1-ил или гексагидропирроло[3,4-с]пирролил; где кольцо может быть необязательно замещено заместителем, выбранным из (С 2-С 4)алкенила, (С 3 С 6)циклоалкила, C(O)R10 и от одного до трех (С 1-С 4)алкильных заместителей, необязательно замещенных гидрокси;R8 представляет собой водород или (С 1-С 4)алкил;R9 представляет собой водород, (С 1-С 4)алкил, (С 1-С 4)алкокси, (С 3-С 6)циклоалкил, тиазолил, имидазолил, пиридил, фенил, необязательно замещенный галогеном, 2-гидрокси-2-фенилэтил, имидазолилэтил, 6-хлорпирид-3-илметил или фуран-2-ил-(С 1-С 4 алкил); альтернативно, R8 и R9 вместе с азотом, к которому они присоединены, образуют гетероцикл, выбранный из группы, которая включает морфолинил и тиазинил;R11 представляет собой водород или (С 1-С 4)алкил;-аминометилциклогексил или 2,2,6,6-тетраметилпиперидин-4-илэтенил; или их фармацевтически приемлемую соль. Настоящее изобретение предлагает способ лечения множественной миеломы у млекопитающего,включающий введение млекопитающему, который нуждается в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также предлагает способ лечения рака толстой кишки у млекопитающего,включающий введение млекопитающему, который нуждается в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также предлагает способ лечения крупноклеточного рака легких у млекопитающего, включающий введение млекопитающему, который нуждается в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также предлагает способ лечения глиобластомы у млекопитающего, включающий введение млекопитающему, который нуждается в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также предлагает способ лечения рака яичников у млекопитающего, включающий введение млекопитающему, который нуждается в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также предлагает способ лечения ревматоидного артрита у млекопитающего, включающий введение млекопитающему, который нуждается в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также предлагает способ лечения хронического обструктивного заболевания легких у млекопитающего, включающий введение млекопитающему, который нуждается в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также предлагает фармацевтическую композицию, которая содержит соединение формулы I или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым наполнителем, носителем или разбавителем. Данное изобретение также предлагает применение соединения формулы I или фармацевтически приемлемой соли для изготовления лекарственного средства для лечения рака, в частности множественной миеломы, рака толстой кишки, крупноклеточного рака легких, глиобластомы и рака яичников. Дополнительно, данное изобретение предлагает соединение формулы I или его фармацевтически приемлемую соль для применения при лечении рака у млекопитающего, в частности множественной миеломы,рака толстой кишки, крупноклеточного рака легких, глиобластомы и рака яичников. К тому же, данное изобретение предлагает фармацевтическую композицию, подходящую для лечения рака, в частности множественной миеломы, рака толстой кишки, крупноклеточного рака легких, глиобластомы и рака яичников, которая содержит соединение формулы 1 или его фармацевтически приемлемую соль в комбина-2 014426 ции с одним или больше фармацевтически приемлемыми наполнителями, носителями или разбавителями. Данное изобретение также предлагает применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения воспалительных заболеваний, в частности ревматоидного артрита и хронического обструктивного заболевания легких. Дополнительно,настоящее изобретение предлагает соединение формулы I или его фармацевтически приемлемую соль для применения при лечении воспалительных заболеваний, в частности ревматоидного артрита и хронического обструктивного заболевания легких. К тому же, данное изобретение предлагает фармацевтическую композицию, подходящую для лечения воспалительных заболеваний, в частности ревматоидного артрита и хронического обструктивного заболевания легких, которая содержит соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или больше фармацевтически приемлемыми наполнителями, носителями или разбавителями. Изобретение также предлагает соединение формулы IIR4' представляет собой пиперидин-4-ил, необязательно замещенный С 1-С 4 алкилом, пиперазин-4-ил,необязательно замещенный от одного до трех С 1-С 4 алкильными заместителями, один из которых необязательно замещен гидрокси; 3-диметиламинопирролидин-1-ил; -аминометилциклогексил; гомопиперазинил; гексагидро-пирроло[3,4-с]пиррол; или RaRbN-(С 1-С 4)алкил; при условии, что, когда R4' представляет собой пиперидинил, R1' представляет собой -СО (X);Ra и Rb независимо представляют собой Н или метил; и-аминометилциклогексил; или их фармацевтически приемлемую соль. Детальное описание изобретения Общие химические термины, которые используются в формулах выше, имеют их обыкновенные значения. Например, термин "(С 1-С 4)алкил" включает алкилы с прямой или разветвленной цепью, например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил. Термин "(С 1 С 4)алкокси" включает метокси, этокси, пропокси и бутокси. Термин "(С 3-С 6)циклоалкил" включает циклопропил, циклобутил, циклопентил и циклогексил. Термин "(С 2-С 4)алкенил" включает алкенилы с прямой или разветвленной цепью, например, этенил, пропенил, изопропенил, бутенил, изобутенил, вторбутенил и трет-бутенил. Термин "галоген" включает фтор, хлор, бром и йод. Специалист в данной области техники примет во внимание, что определенные соединения формулыI имеют по меньшей мере один хиральный центр. Настоящее изобретение включает все индивидуальные энантиомеры или диастереомеры, а также смеси энантиомеров и диастереомеров указанных соединений,включая рацематы. Предпочтительно соединения формулы I, содержащие по меньшей мере один хиральный центр, существуют в форме индивидуальных энантиомеров или диастереомеров. Индивидуальные энантиомеры или диастереомеры могут быть получены, исходя из хиральных реагентов, или с помощью стереоселективных или стереоспецифических способов синтеза. Альтернативно, индивидуальные энантиомеры или диастереомеры могут быть выделены из смесей с помощью стандартных способов хиральной хроматографии или кристаллизации. Специалисту в данной области будет понятно, что большинство или все соединения согласно настоящему изобретению способны образовывать соли. Соединения согласно настоящему изобретению представляют собой амины и соответственно будут реагировать с любой из многочисленных неорганических и органических кислот с образованием фармацевтически приемлемых кислотно-аддитивных солей. Такие фармацевтически приемлемые кислотно-аддитивные соли и общая методология их получения хорошо известны из уровня техники. См., например, P. Stahl, et al., HANDBOOK OF PHARMACEUTICAL SALTS: PROPERTIES, SELECTION AND USE, (VCHA/Wiley-VCH, 2002); S.M. Berge, et al., "Pharmaceutical Salts", Journal of Pharmaceutical Sciences, vol 66,1, January 1977. Такие соли включают соли,образованные со следующими кислотами: уксусная кислота, лимонная кислота, этансульфоновая кислота, фумаровая кислота, гликолевая кислота, глюкуроновая кислота, глутаровая кислота, хлористоводо-3 014426 родная кислота, молочная кислота, малеиновая кислота, d-яблочная кислота, 1-яблочная кислота, dминдальная кислота, 1-миндальная кислота, метансульфоновая кислота, нападисиликовая (нафталиндисульфоновая) кислота, щавелевая кислота, фосфорная кислота, янтарная кислота, серная кислота, dвинная кислота, 1-винная кислота и толуолсульфоновая кислота. Несмотря на то что все соединения формулы I полезны при лечении рака, предпочтительными являются определенные классы соединений. В следующих абзацах описаны такие предпочтительные классы:f) R6 и R7 вместе с азотом, к которому они присоединены, образуют пиперазинил, необязательно замещенный от одного до трех (С 1-С 4)алкилами;h) R1 представляет собой -C(O)NR8R9 и присоединен в 6-положении бензотиофена, R представляет собой от одного до трех (С 1-С 4)алкильных заместителей, и R9 представляет собой (С 1-С 4)алкил или (С 2 С 6)циклоалкил;i) R1 представляет собой -C(O)NR8R9; R2 представляет собой водород; R3 представляет собой водород, галоген или метил; R4 представляет собой -NR R7, пиперидинил или 4-(С 1-С 4)алкилпиперидин-4-ил; где R4 может быть необязательно замещен (С 1-С 4)алкилом; R5 представляет собой водород; R6 и R7 вместе с азотом, к которому они присоединены, образуют пиперазинил, необязательно замещенный (С 1 С 4)алкилом; R8 представляет собой водород или (С 1-С 4)алкил; R9 представляет собой (C1-C4)алкил илиj) соединение, выбранное из группы, которая включает три-гидрохлорид циклопропиламида 2-5 хлор-2-[3-(4-метилпиперазин-1-ил)-пропиламино]-пиримидин-4-ил-бензо[b]тиофен-4-карбоновой кислоты и ди-гидрохлорид циклопропиламида 2-5-метил-2-[3-(4-метилпиперазин-1-ил)-пропиламино]пиримидин-4-ил-бензо[b]тиофен-4-карбоновой кислоты. Соединения согласно настоящему изобретению могут быть получены с помощью ряда методик, некоторые из которых проиллюстрированы на схемах ниже. Для специалиста в данной области техники будет понятно, что для получения соединений Формулы I отдельные стадии на приведенных ниже схемах могут быть изменены. Конкретный порядок стадий, необходимый для получения соединений формулы I, зависит от конкретного соединения,которое синтезируют, исходного соединения и относительной лабильности замещенных компонентов. Ради ясности некоторые заместители были исключены на приведенных ниже схемах, и это обстоятельство не ограничивает информацию, представленную на схемах. Продукты и промежуточные соединения выделяют после проведения стандартных способов экстракции и хроматографии или кристаллизации. Как используется в данной заявке, термин "подходящая защитная группа" обозначает известную защитную группу, как например группы, описанные в T.W.Greene, "Protecting Groups in Organic Synthesis",John Wiley and Sons, New York, N.Y., 1991. Продукты и промежуточные соединения выделяют после проведения стандартных способов экстракции и хроматографии или кристаллизации. Соединения формулы I могут быть получены, как описано на следующей схеме. Схема I Замещенный или незамещенный бензо[b]тиофен сначала металлируют бутиллитием, потом проводят реакцию с низшим (C1-C4)триалкилборонатным эфиром, таким как триизопропилборат, с получением при обработке бороновой кислоты (1). В качестве альтернативы бутиллития, когда X представляет собой водород, промежуточная 2-бороновая кислота может быть синтезирована, если R1 представляет собой бром или йод, и металлирована во 2-м положении диизопропиламином лития в ТГФ, с последующим-4 014426 добавлением триалкилборонатного эфира. Соединение (1) потом подвергают реакции связывания, катализируемой палладием, используя реагент, такой как PdCl2 (dppb) в полярном апротонном растворителе,таком как 1,4-диоксан, с 2,4-дихлорпиримидином (2) при повышенной температуре (70-110 С) с получением галогенпиримидина (3). Галоген во 2-м положении галогенпиримидина (3) потом вытесняют с помощью (4) или избытка (4), часто при повышенных температурах (95 С), или в присутствии основания,такого как гидрид натрия или карбонат лития, с получением формулы I. Первичные амины (4) или являются коммерчески доступными, или могут быть получены с помощью 1) реакций замещения азида натрия, амина или защищенного амина на алкилгалогенидных или алкилсульфонатных субстратах или с помощью 2) восстановительного аминирования альдегидов или кетонов, которые известны из уровня техники. Специалисту в области химических превращений будет ясно,что первичный амин (4) может содержать вторую аминогруппу, которая либо является 1) менее реакционноспособной в реакции замещения, как вторичный амин, либо 2) защищена от замещения с помощью любой защитной группы, такой как трет-бутилкарбаматы, фталидины или бензилкарбаматы, которая впоследствии может быть удалена кислотным гидролизом, обработкой гидразином или гидрогенизацией,соответственно. Если R1 представляет собой бром, то также могут быть проведены некоторые известные функциональные превращения групп. Например, с помощью карбонилирования, катализируемого палладием,используя реагент, такой как Pd(OAc)2/dppf, где R1 = бром, в метаноле получают метиловый эфир. Его потом дополнительно подвергают известным эфирным превращениям, таким как гидролиз до кислоты или аминолиз до амида. Полученная выше свободная кислота также может быть связана с аминами в присутствии разнообразных дегидратирующих реагентов, известных специалисту в данной области техники, с получением амидов. Подобным образом, специалисту в данной области техники известны кислотные функции N-метоксиамидов, которые являются подходящими субстратами для получения кетонов и т.п., с помощью реакции с гетероариллитиевыми реагентами. Специалист в данной области техники также примет во внимание, что не все заместители в соединениях формулы I будут толерантными в определенных условиях реакции, которые используются при синтезе соединений. Эти заместители могут быть введены на подходящей стадии синтеза или могут быть защищены, а потом защитная группа, при необходимости или желании, может быть удалена. Специалист в данной области техники примет во внимание, что защитные группы могут быть удалены на любой подходящей стадии синтеза соединений согласно настоящему изобретению. Способы введения и удаления азот- и кислород-защитных групп, хорошо известны из уровня техники; см., например, Greene andWuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons, New York, Chapter 7 (1999). К тому же, специалист в данной области техники примет во внимание, что во многих случаях порядок, в котором вводят компоненты, не является критическим. Конкретный порядок стадий, необходимых для получения соединений формулы I, зависит от конкретного соединения, которое синтезируют, исходного соединения и относительной лабильности замещенных компонентов. Пример получения 1. [1,4-Бис(дифенилфосфино)бутан]дихлорпалладий(II) ([dppb]PdCl2) Бис(бензонитрил)дихлорпалладий(II) (20,0 г, 52,1 ммоль) растворяют в трихлорметане (CHCl3) (200 мл), потом порциями добавляют раствор 1,4-бис(дифенилфосфино)бутана в CHCl3 (200 мл) в течение 20 мин. После перемешивания в течение 40 мин желтое твердое вещество фильтруют, промывают CHCl3(200 мл) и сушат в вакуумном сушильном шкафу в течение ночи, получая указанное в заглавии соединение (30,6 г, выход 97%). Пример получения 2. трет-Бутиловый эфир 4-(3-аминопропил)пиперазин-1-карбоновой кислоты(А) Получение трет-бутилового эфира 4-(3-бромпропил)пиперазин-1-карбоновой кислоты 1,3-Дибромпропан (6,78 мл, 66,8 ммоль) добавляют к перемешиваемому раствору трет-бутилового эфира пиперазин-1-карбоновой кислоты (4,15 г, 22,2 ммоль) и диизопропилэтиламина (7,73 мл, 44,4 ммоль) в безводном 1,4-диоксане (40 мл). Полученную смесь нагревают на масляной бане при 90 С в течение 20 ч. К смеси добавляют этилацетат (160 мл) и полунасыщенный водный бикарбонат натрия(NaHCO3) (120 мл) при температуре окружающей среды. Органический слой отделяют, сушат над сульфатом магния, фильтруют и концентрируют. Неочищенное масло хроматографируют на силикагеле и элюируют 2 М NH3/MeOH в дихлорметане 0-3%, получая указанное в заглавии соединение в виде темного масла (4,80 г, выход 70%).(В) Получение трет-бутилового эфира 4-(3-азидопропил)пиперазин-1-карбоновой кислоты Азид натрия (2,24 г, 34,2 ммоль) добавляют к перемешиваемому раствору трет-бутилового эфира 4(3-бромпропил)пиперазин-1-карбоновой кислоты (4,80 г, 15,6 ммоль) в безводном DMF (40 мл). Полученную смесь нагревают на масляной бане при 55 С в атмосфере азота в течение 3 дней. К смеси добавляют этилацетат (160 мл) и полунасыщенный водный хлорид натрия (NaCl) (200 мл) при температуре окружающей среды. Органический слой отделяют, промывают полунасыщенным водным NaCl (200 мл),сушат над сульфатом магния, фильтруют и концентрируют, получая указанное в заглавии соединение в виде темного масла (3,88 г, выход 92%).-5 014426 эфира 4-(3-азидопропил)пиперазин-1-карбоновой кислоты (2,05 г, 7,61 ммоль) в растворе ТГФ (10 мл)/ацетонитрил (30 мл)/вода (4 мл). Полученную смесь перемешивают в течение 16 ч. После концентрирования и последующей хроматографии на силикагеле, элюируя 2 М NH3/CH3OH в дихлорметане 020%, получают указанное в заглавии соединение в виде прозрачного масла (1,76 г, выход 95%) . Пример получения 3. трет-Бутиловый эфир 5-(2-аминоэтил)гексагидропирроло[3,4-с]пиррол-2 карбоновой кислоты Используя способ получения трет-бутилового эфира 4-(3-аминопропил)пиперазин-1-карбоновой кислоты, указанное в заглавии соединение синтезируют из трет-бутилового эфира гексагидропирроло[3,4-с]пиррол-2-карбоновой кислоты. Пример получения 4. 3-(4-Изопропилпиперазин-1-ил)пропиламинN-(3-Бромпропил)фталимид (16,7 г, 62,4 ммоль) добавляют к перемешиваемому раствору 1 изопропил-пиперазина (8,00 г, 62,4 ммоль) и диизопропилэтиламина (8,06 г, 62,4 ммоль) в безводном 1,4 диоксане (300 мл). Полученную смесь нагревают на масляной бане при 90 С в течение 20 ч. К смеси добавляют хлороформ (300 мл) и полунасыщенный водный NaCl (200 мл) при температуре окружающей среды. Органический слой отделяют, сушат над сульфатом магния, фильтруют и концентрируют. Неочищенное масло хроматографируют на силикагеле и элюируют 2 М NH3/CH3OH в дихлорметане 0-5%,получая указанное в заглавии соединение в виде желто-коричневого масла (17,4 г, выход 87%).(В) Получение 3-(4-изопропилпиперазин-1-ил)пропиламина Гидразин (8,63 г, 270 ммоль) добавляют к перемешиваемой суспензии 2-[3-(4-изопропилпиперазин 1-ил)пропил]изоиндол-1,3-диона (17,0 г, 53,9 ммоль) в безводном этаноле (400 мл). Полученную смесь нагревают на масляной бане при 75 С в течение 16 ч. К смеси добавляют дихлорметан (300 мл) при температуре окружающей среды и суспензию оставляют перемешиваться в течение 10 мин. После фильтрования и концентрирования получают указанное в заглавии соединение в виде желто-коричневого масла(8,12 г, выход 81%). Используя способы получения 3-(4-изопропилпиперазин-1-ил)пропиламина, следующие амины синтезируют из подходящего N-(бромалкил)фталимида и соответствующих аминов: Пример получения 10. 3-(3,5-цис-Диметилпиперазин-1-ил)пропиламин Используя способ получения 3-(4-изопропилпиперазин-1-ил)пропиламина, указанное в заглавии соединение получают из N-(3-бромпропил)фталимида и 2,6-цис-диметилпиперазина в виде желтокоричневого масла. Пример получения 11. 3-(3,5-цис-Диметил-4-метилпиперазин-1-ил)пропиламин Используя способ получения 3-(4-изопропилпиперазин-1-ил)пропиламина, 2-[3-(3,5-цис-диметилпиперазин-1-ил)пропил]изоиндол-1,3-дион получают в виде белого твердого вещества (выход 92%) . К перемешиваемому раствору этого белого твердого вещества (10,0 г, 33,1 ммоль) в ацетонитриле (120 мл) при температуре окружающей среды добавляют формалин (27 мл, 331 ммоль), раствор оставляют перемешиваться в течение 10 мин. К реакционной смеси последовательно добавляют цианоборгидрид натрия(5,21 г, 82,9 ммоль) и уксусную кислоту (3 мл), и полученную смесь перемешивают в течение еще 2 ч. После концентрирования неочищенный продукт растворяют в дихлорметане (150 мл), промывают насыщенным водным NaHCO3 (60 мл 2), сушат и концентрируют. После хроматографии на силикагеле,элюируя 2 M NH3/CH3OH в дихлорметане 0-6%, получают 2-[3-(3,5-дис-диметил-4-метилпиперазин-1 ил)пропил]изоиндол-1,3-дион в виде желто-коричневого масла (7,90 г, выход 75%). К перемешиваемому раствору этого желто-коричневого масла (7,0 г, 22 ммоль) в безводном метаноле (250 мл) добавляют гидразин (5,69 г, 177 ммоль), полученную смесь нагревают на масляной бане при 65 С в течение 16 ч, получая суспензию. Суспензию концентрируют до объема 60 мл. После фильтрования и концентрирования получают указанное в заглавии соединение в виде желто-коричневого масла (4,01 г, выход 97%). Используя способ получения 3-(4-изопропилпиперазин-1-ил)пропиламина, следующие соединения получают из N-(2-бромэтил)фталимида и соответствующих аминов и выделяют в виде желто-6 014426 коричневого масла:(А) Получение трет-бутилового эфира 4-(3-гидроксипропил)пиперидин-1-карбоновой кислоты Ди-трет-бутил дикарбонат (3,66 г, 16,8 ммоль) добавляют к перемешиваемому раствору 3 пиперидин-4-ил-пропан-1-ола (1,60 г, 11,2 ммоль) в безводном дихлорметане (20 мл) при температуре окружающей среды в атмосфере азота. Полученную смесь оставляют перемешиваться в течение 2 ч. Смесь непосредственно очищают хроматографией на силикагеле и элюируют МеОН в дихлорметане 03%, получая указанное в заглавии соединение в виде прозрачного масла (2,40 г, выход 88%).(В) Получение трет-бутилового эфира 4-(3-азидопропил)пиперидин-1-карбоновой кислоты Метансульфонилхлорид (0,690 мл, 8,92 ммоль) добавляют к перемешиваемому раствору третбутилового эфира 4-(3-гидроксипропил)пиперидин-1-карбоновой кислоты (1,67 г, 6,86 ммоль) и коллидина (1,27 мл, 9,61 ммоль) в безводном дихлорметане (20 мл) при 0 С в атмосфере азота. Полученную смесь оставляют перемешиваться при 0 С в течение 30 мин, потом при температуре окружающей среды в течение 1,5 ч. Смесь непосредственно очищают хроматографией на силикагеле и элюируют MeOH в дихлорметане 0-3%, получая мезилатный продукт (2,05 г). Мезилатный продукт (0,730 г, 2,27 ммоль) растворяют в безводном DMF (8 мл), потом добавляют NaN3 (0,325 г, 5,00 ммоль), и потом смесь нагревают при 55 С в течение 18 ч. Смесь разбавляют дихлорметаном (40 мл), потом ее промывают водой (15 мл 3) при температуре окружающей среды. Органический слой сушат над карбонатом натрия и концентрируют, получая указанное в заглавии соединение (0,566 г, выход 92%).(С) Получение трет-бутилового эфира 4-(3-аминопропил)пиперидин-1-карбоновой кислоты Трифенилфосфин (0,657 г, 2,50 ммоль) добавляют к перемешиваемому раствору трет-бутилового эфира 4-(3-азидопропил)пиперидин-1-карбоновой кислоты (0,560 г, 2,09 ммоль) в ТГФ (2 мл)/CH3CN (5 мл)/H2O (1 мл) и смесь перемешивают при температуре окружающей среды в течение 18 ч. После концентрирования и последующей хроматографии на силикагеле, элюируя 2 M NH3/MeOH в дихлорметане 0-15%, получают указанное в заглавии соединение в виде прозрачного масла (0,420 г, выход 83%) . Пример получения 15. 3-(1-Метилпиперидин-4-ил)пропиламин(А) Получение 3-(1-метилпиперидин-4-ил)пропан-1-ола Формалин (6,33 г, 211 ммоль) добавляют к перемешиваемому раствору 3-(пиперидин-4-ил)пропан 1-ола (3,02 г, 21,1 ммоль) в ацетонитриле (30 мл) при температуре окружающей среды. Раствор оставляют перемешиваться в течение 20 мин. К реакционной смеси последовательно добавляют цианоборгидрид натрия (3,31 г, 52,7 ммоль) и уксусную кислоту (3 мл), и полученную смесь перемешивают в течение еще 2 ч. После концентрирования неочищенный продукт растворяют в дихлорметане (150 мл), промывают насыщенным водным NaHCO3 (60 мл 2), сушат и концентрируют. Неочищенный продукт хроматографируют на силикагеле и элюируют 2 М NH3/CH3OH в дихлорметане 0-15%, получая указанное в заглавии соединение в виде масла (2,70 г).(В) Получение 3-(1-метилпиперидин-4-ил)пропиламина Используя способ получения трет-бутилового эфира 4-(3-аминопропил)пиперидин-1-карбоновой кислоты, указанное в заглавии соединение получают и выделяют в виде масла. Пример получения 16. 4-(Бензо[b]тиофен-2-ил)-2-хлорпиримидин Водный раствор Na2CO3 (2 N, 45 мл) добавляют к перемешиваемой смеси тианафта-2-бороновой кислоты (8,00 г, 44,8 ммоль) и 2,4-дихлорпиримидина (6,69 г, 44,8 ммоль) в 1,4-диоксане (100 мл) при 60 С. Полученную смесь оставляют перемешиваться в атмосфере азота в течение 30 с, потом к смеси добавляют порошкообразный [dppb]PdCl2 (1,35 г, 2,24 ммоль). Полученную смесь незамедлительно нагревают на масляной бане при 90 С в течение 14 ч. К смеси добавляют 600 мл CHCl3 и 400 мл полунасыщенного водного раствора NaCl при температуре окружающей среды. Органический слой отделяют, и водный слой потом экстрагируют CHCl3 (100 мл) . Объединенные органические слои сушат над сульфатом натрия (Na2SO4), фильтруют и концентрируют, получая влажное твердое вещество. К смеси добавляют метиленхлорид (25 мл) и диэтиловый эфир (10 мл) и суспензию обрабатывают ультразвуком и фильтруют, получая желто-коричневое твердое вещество. Твердое вещество потом растворяют в 80 мл теплого дихлорметана и хроматографируют на силикагеле (колонка ISCO Redi Sep, 120 г), получая ука-7 014426 занное в заглавии соединение в виде белого твердого вещества (6,78 г, выход 57%). Используя способ получения 4-(бензо[b]тиофен-2-ил)-2-хлорпиримидина, следующие соединения синтезируют из тианафта-2-бороновой кислоты и соответствующих 2,4-дихлорпиримидинов: Пример получения 20. 4-(Бензо[b] тиофен-2-ил)-5-бром-2-хлорпиримидин н-Бутиллитий (20,7 мл, 1,6 М в гексане) по каплям добавляют к перемешиваемому раствору бензо[b]тиофену (4,12 г, 30,1 ммоль) в безводном ТГФ (50 мл) при -78 С в атмосфере азота. Полученный раствор оставляют перемешиваться при -78 С в течение 15 мин. Цитированный бензо[b]тиофен потом через канюлю в течение 20 мин добавляют к перемешиваемому раствору 5-бром-2-хлор-пиримидина(5,95 г, 30,1 ммоль) в безводном ТГФ (100 мл) при -30 С. После завершения добавления раствор оставляют перемешиваться при -30 С в течение дополнительных 30 мин, потом при 0 С в течение еще 30 мин. Реакционную смесь гасят уксусной кислотой (1,99 г, 33,1 ммоль), потом через 5 мин ее обрабатывают раствором DDQ (7,17 г, 31,6 ммоль) в безводном ТГФ (150 мл) порциями при 10 С. Смесь перемешивают в течение 20 мин при 10 С, потом концентрируют, получая темное твердое вещество. Твердое вещество потом суспендируют в хлороформе (500 мл), и суспензию обрабатывают ультразвуком и фильтруют через прокладку из силикагеля. Твердое вещество промывают дополнительными 700 мл хлороформа. Объединенные фильтраты концентрируют, получая твердое вещество. Твердое вещество повторно суспендируют в дихлорметане (20 мл)/диэтиловом эфире (20 мл), и суспензию обрабатывают ультразвуком и фильтруют, получая указанное в заглавии соединение в виде желтоватого твердого вещества (9,62 г, выход 98%) . Пример получения 21. Циклопропиламид 2-(5-бром-2-хлорпиримидин-4-ил)-бензо[b]тиофен-4 карбоновой кислоты(А) Получение 2-(5-бром-2-хлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты Бутиллитий (2,5 М в гексане, 14,1 мл) добавляют по каплям к перемешиваемому раствору бензо[b]тиофен-4-карбоновой кислоты (3,00 г, 16,8 ммоль) в безводном ТГФ (50 мл) при -78 С в атмосфере азота. Полученную смесь оставляют перемешиваться в течение 45 мин при -78 С, потом ее добавляют через канюлю к перемешиваемому холодному раствору 5-бром-2-хлорпиримидина (3,26 г, 16,8 ммоль) в безводном ТГФ (50 мл) при -30 С. После завершения добавления реакционную смесь перемешивают в течение 30 мин при -30 С, потом при температуре окружающей среды в течение еще 1,5 ч. Уксусную кислоту (2,4 мл) добавляют к реакционной смеси через 5 мин, потом добавляют 2,3-дихлор-5,6-дициано 1,4-бензохинон (4,01 г, 17,7 ммоль), растворенный в ТГФ (10 мл). Смесь оставляют перемешиваться в течение 10 мин, потом по каплям обрабатывают HCl (37%, 30 мл), потом смесь перемешивают в течение еще 1 ч. ТГФ выпаривают, и смесь превращается в суспензию. Твердое вещество отфильтровывают,промывают водой (100 мл 2) и потом сушат под вакуумом. Сухое твердое вещество суспендируют в дихлорметане (45 мл) и этаноле (5 мл) и перемешивают в течение 30 мин. После фильтрования твердое вещество повторно суспендируют в эфире (50 мл), и суспензию перемешивают в течение еще 30 мин. После фильтрования и высушивания в вакууме указанное в заглавии соединение получают в виде желтого твердого вещества (2,64 г, выход 42%).(В) Получение циклопропиламида 2-(5-бром-2-хлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты Диизопропилэтиламин (1,19 мл, 6,82 ммоль), гидрохлорид 1-[3-(диметиламино)пропил]-3 этилкарбодиимида (0,650 г, 3,41 ммоль) и 1-гидроксибензотриазол (0,460 г, 3,41 ммоль) последовательно добавляют к перемешиваемой суспензии 2-(5-бром-2-хлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты (1,20 г, 3,25 ммоль) в безводном дихлорметане (25 мл) при температуре окружающей среды в атмосфере азота. Полученную светлую суспензию обрабатывают циклопропиламином (0,190 г, 3,41 ммоль), потом реакционную смесь оставляют перемешиваться в течение 5 ч. Реакционную смесь разбавляют дихлорметаном (50 мл), потом промывают водой (100 мл). Водный слой экстрагируют дихлорметаном (100 мл 2), предотвращая осаждение в водном слое. Объединенные органические слои концентрируют и потом повторно суспендируют в дихлорметане (1 мл)/диэтиловом эфире (9 мл) . После обработки ультразвуком и последующего фильтрования твердое вещество промывают дополнительным дихлорметаном (1 мл)/диэтиловым эфиром (9 мл) и сушат, получая указанное в заглавии соединение (1,10 г, выход 97%).-8 014426 Пример получения 22. Рацемический трет-бутиловый эфир 3-(3-аминопропил)пиперидин-1 карбрновой кислоты Используя способ получения трет-бутилового эфира 4-(3-аминопропил)пиперидин-1-карбоновой кислоты, получают соединение в виде масла. Пример получения 23. (3- (4-Бензгидрил-2,6-цис-диметилпиперазин-1-ил)пропиламин Бензгидрилбромид (4,33 г, 17,5 ммоль) добавляют к перемешиваемому раствору 2,6-цисдиметилпиперазина (2,00 г, 17,5 ммоль) и диизопропилэтиламина (2,94 г, 22,8 ммоль) в безводном дихлорметане (50 мл) при 0 С. Полученную смесь оставляют перемешиваться в течение ночи. После концентрирования и последующей хроматографии на силикагеле, элюируя 2 M NH3/CH3OH в дихлорметане: 1-3%, бензгидрил-3,5-цис-диметилпиперазин получают в виде белого твердого вещества (3,0 г, выход 61%).N-(3-Бромпропил)фталимид (2,50 г, 9,33 ммоль) добавляют к перемешиваемому раствору бензгидрил-3,5-цис-диметилпиперазина (2,61 г, 9,33 ммоль) и диизопропилэтиламина (1,81 г, 14,0 ммоль) в N,Nдиметилацетамиде (25 мл). Полученную смесь нагревают при 120 С в течение 48 ч. После концентрирования и последующей хроматографии на силикагеле, элюируя 2 M NH3/CH3OH в дихлорметане: 0-1%, 2[3-(4-бензгидрил-2,6-цис-диметилпиперазин-1-ил)пропил]изоиндол-1,3-дион получают в виде коричневого масла (1,98 г, выход 45%). Гидразин (1,10 г, 34,2 ммоль) добавляют к перемешиваемому раствору 2-[3-(4-бензгидрил-2,6-цисдиметилпиперазин-1-ил)пропил]изоиндол-1,3-диона (1,98 г, 4,28 ммоль) в этаноле (70 мл). Смесь нагревают при 70 С в течение 12 ч, получая суспензию. Смесь фильтруют при комнатной температуре и фильтрат концентрируют, получая 3-(4-бензгидрил-2,6-цис-диметилпиперазин-1-ил)пропиламин (1,02 г,выход 71%) в виде масла. Пример получения 24. (3-(4-Метил-[1,4]диазепан-1-ил)пропиламин Используя способ получения 3-(4-изопропилпиперазин-1-ил)пропиламина,3-(4-метил[1,4]диазепан-1-ил)пропиламин синтезируют в виде масла из 1-метил-[1,4]диазепана. Пример получения 25. Циклопропиламид 2-(2-хлор-5-фторпиримидин-4-ил)-бензо[b]тиофен-4 карбоновой кислоты(А) Получение 2-(2-хлор-5-фторпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты Водный 2 N раствор Na2CO3 (36 мл) по каплям добавляют к перемешиваемому раствору (4 карбоксибензо[b]тиофен-2-ил)бороновой кислоты (3,63 г, 18,8 ммоль) и 2,4-дихлор-5-фторпиримидина(3,00 г, 18,0 ммоль) в диметиловом эфире этиленгликоля (50 мл) при комнатной температуре в атмосфере азота. После завершения добавления одной порцией добавляют дихлорбис(трифенилфосфин)палладий(II) (0,22 г, 3% моль), потом реакционную смесь нагревают при 100 С в течение ночи. Смесь охлаждают до 10 С, потом порциями добавляют 37% HCl (10 мл), получая суспензию. После фильтрования и промывания водой твердое вещество сушат в вакууме. Сухое твердое вещество суспендируют в 30 мл дихлорметана/этанола (10:1), обрабатывают ультразвуком, фильтруют и снова сушат, получая 2-(2-хлор-5-фторпиримидин-4-ил)бензо[b]тиофен-4-карбоновую кислоту (2,95 г, выход 48%).(В) Получение циклопропиламида 2-(2-хлор-5-фторпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты Используя способ получения циклопропиламида 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-4 карбоновой кислоты, циклопропиламид 2-(2-хлор-5-фторпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты синтезируют из 2- (2-хлор-5-фторпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты и циклопропиламина в виде твердого вещества (неочищенный выход 89%). Пример получения 26. Циклопропиламид 2-(2-хлор-5-метилпиримидин-4-ил)бензо[b]тиофен-4 карбоновой кислоты Используя способ получения циклопропиламида 2-(2-хлор-5-фторпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты,циклопропиламид 2-(2-хлор-5-метилпиримидин-4 ил)бензо[b]тиофен-4-карбоновой кислоты получают и выделяют в виде желто-коричневого твердого вещества. Пример получения 27. 2-(2,2,6,6-Тетраметилпиперидин-4-илиден)этиламин трет-Бутоксид калия (9,40 г, 83,7 ммоль) суспендируют в ТГФ (175 мл), потом охлаждают до 0 С. Диэтиловый эфир цианометилфосфоновой кислоты (16,0 г, 90,2 ммоль) добавляют в течение пяти минут. После перемешивания в течение 20 мин к реакционной смеси добавляют 2,2,6,6-тетраметилпиперидин-4 он (10,0 г, 64,4 ммоль), растворенный в ТГФ (50 мл), при -78 С. После завершения добавления охлаждающую баню удаляют. Реакционную смесь перемешивают в течение ночи, потом добавляют достаточное количество воды, чтобы растворить суспендированные соли. Органический слой отделяют, и водный слой экстрагируют EtOAc. Органические слои объединяют, концентрируют, потом остаток хроматографируют на силикагеле, элюируя 0-3% 2 М NH3/MeOH в дихлорметане, получая 3,77 г (2,2,6,6 тетраметилпиперидин-4-илиден)ацетонитрила (выход 33%). Полученный выше продукт (1,13 г, 6,34 ммоль) растворяют в безводном диэтиловом эфире (15 мл),охлажденном до 0 С, и к реакционной смеси медленно добавляют 1,0 М алюмогидрид лития в диэтило-9 014426 вом эфире. Охлаждающую баню удаляют, и реакционную смесь перемешивают в течение 18 ч. Реакционную смесь гасят МеОН, пока не прекращается выделение газа. Добавляют насыщенный виннокислый калий-натрий (45 мл), и реакционную смесь энергично перемешивают в течение 2 ч. Добавляют 4 эквивалента 5 N NaOH, и реакционную смесь перемешивают в течение часа. Добавляют диэтиловый эфир (45 мл) и два слоя разделяют. Водный слой повторно экстрагируют диэтиловым эфиром, потом органические слои объединяют, сушат над Na2SO4, фильтруют и концентрируют, получая 785 мг (выход 68%) 2(2,2,6,6-тетраметилпиперидин-4-илиден)этиламина. Пример получения 28. трет-Бутиловый эфир 4-(2-аминоэтил)-4-метилпиперидин-1-карбоновой кислоты(А) Получение 1-трет-бутилового эфира 4-метилового эфира 4-метилпиперидин-1,4-дикарбоновой кислоты 1-трет-Бутиловый эфир 4-метиловый эфир пиперидин-1,4-дикарбоновой кислоты (1,00 г, 4,11 ммоль) растворяют в ТГФ (10 мл) и охлаждают до -78 С. По каплям добавляют 2,0 М диизопропиламид лития в ТГФ, потом перемешивают в течение 1 ч. Добавляют йодометан (0,563 мл, 9,04 ммоль) и смесь перемешивают в течение 1 ч. Охлаждающую баню удаляют и реакционную смесь перемешивают в течение еще 0,5 ч. Реакционную смесь гасят насыщенным хлоридом аммония (3 мл), концентрируют, помещают в дихлорметан и хроматографируют на силикагеле, элюируя EtOAc в дихлорметане 0-5%, получая указанное в заглавии соединение в виде слегка желтого масла (680 мг, выход 64%).(В) Получение трет-бутилового эфира 4-гидроксиметил-4-метилпиперидин-1-карбоновой кислоты 1-трет-Бутиловый эфир 4-метиловый эфир 4-метилпиперидин-1,4-дикарбоновой кислоты (1,48 г,5,73 ммоль) растворяют в ТГФ (15 мл) и охлаждают до 0 С. По каплям добавляют 1,0 М алюмогидрид лития в ТГФ (6,30 мл, 6,30 ммоль). Через 1,25 ч реакционную смесь гасят МеОН, потом перемешивают с насыщенным виннокислым калием-натрием до образования двух слоев. Два слоя разделяют, и водный слой обрабатывают 5 N NaOH и экстрагируют диэтиловым эфиром. Органические слои объединяют,концентрируют и хроматорафируют, используя силикагель, элюируя EtOAc в гексанах 0-40%, получая указанное в заглавии соединение (1,27 г, выход 97%).(С) Получение трет-бутилового эфира 4-метансульфонилоксиметил-4-метилпиперидин-1 карбоновой кислоты К трет-бутиловому эфиру 4-гидроксиметил-4-метилпиперидин-1-карбоновой кислоты (1,25 г, 5,45 ммоль) и пиридину (0,661 мл, 8,18 ммоль) в дихлорметане (10 мл) при 0 С добавляют метансульфонилхлорид (0,593 мл, 7,63 ммоль). Через 3 ч добавляют дополнительный эквивалент метансульфонилхлорида и пиридина. Через 1 ч реакционную смесь концентрируют, потом добавляют EtOAc и воду. Органический слой концентрируют и хроматографируют на силикагеле, элюируя МеОН в дихлорметане 0-3%,получая указанное в заглавии соединение в виде желтого масла (1,60 г, выход 95%).(0,440 г, 1,43 ммоль), растворенному в ДМСО (3 мл), добавляют цианид калия (0,373 г, 5,73 ммоль). Смесь нагревают до 130 С в течение 18 ч. Реакционную смесь охлаждают и разбавляют EtOAc и водой. Органический слой концентрируют, помещают в МеОН и снова концентрируют, получая указанное в заглавии соединение в виде коричневого масла (263 мг, выход 77%).(Е) Получение трет-бутилового эфира 4-(2-аминоэтил)-4-метилпиперидин-1-карбоновой кислоты К 5% Rh/Al2O3 (0,600 г), суспендированному в воде (2 мл), добавляют этанол (5 мл), третбутиловый эфир 4-цианометил-4-метилпиперидин-1-карбоновой кислоты (0,258 г, 1,083 ммоль), растворенный в этаноле (10 мл), и 28% NH3 (водн.) (0,25 мл). Реакционную смесь обрабатывают водородом под давлением (газ) 50 фунт/дюйм 2 (344,8 КПа) и перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь фильтруют, чтобы удалить катализатор, потом фильтрат концентрируют и хроматографируют на силикагеле, элюируя 0-10% (2 M NH3 в МеОН) в дихлорметане, получая указанное в заглавии соединение (130 мг, выход 50%). Пример получения 29. 2-(2,2,6,6-Тетраметилпиперидин-4-ил)этиламин К 2-(2,2,6,6-тетраметилпиперидин-4-илиден)этиламину (0,480 г, 2,63 ммоль) в МеОН (5 мл) добавляют 10% Pd/C (48 мг) и 5 N HCl (2,63 мл, 13,2 ммоль). При давлении водорода (газ) 50 фунт/дюйм 2(344,8 КПа) при 50 С реакционную смесь перемешивают в течение 18 ч. Реакционную смесь фильтруют,чтобы удалить катализатор, и повторно подвергают реакционным условиям, используя RhClPPh3 (0,26 ммоль). Поскольку реакция не завершена, смесь разбавляют водой, концентрируют, чтобы удалить органический растворитель, фильтруют, чтобы удалить твердые вещества, и потом снова концентрируют. Остаток растворяют в уксусной кислоте и повторно подвергают гидрогенизации, используя 100 мг черного палладия и давление водорода (газ) 50 фунт/дюйм 2 (344,8 КПа) при 50 С в течение 18 ч. Смесь продуктов очищают с трудом, настолько, что неочищенную смесь обрабатывают ди-трет-бутилдикарбонатом в дихлорметане и потом очищают хроматографией на силикагеле, используя достаточно высокий процент 2 М NH3 в МеОН в дихлорметане, выделяя 240 мг трет-бутилового эфира [2- (2,2,6,6 тетраметил-пиперидин-4-ил)этил]карбаминовой кислоты. трет-Бутиловый эфир [2-(2,2,6,6-тетраметилпиперидин-4-ил)-этил]-карбаминовой кислоты (240 мг, 0,844 ммоль) растворяют в 2:1 Ме- 10014426 ОН:дихлорметан (10,5 мл) и HCl (г) барботируют в течение 5 мин. Через 1 ч реакционную смесь концентрируют, получая пену (219 мг). Пену растворяют в МеОН и загружают на колонку SCX 5 г смолы. Колонку промывают МеОН, потом продукт вымывают 7 М NH3 в МеОН. После концентрирования указанное в заглавии соединение получают и используют без дополнительного очищения (138 мг). Пример получения 30. трет-Бутиловый эфир 4-(3-аминопропил)-4-метилпиперидин-1-карбоновой кислоты(А) Получение трет-бутилового эфира 4-(2-цианоацетил)-4-метилпиперидин-1-карбоновой кислоты Ацетонитрил (3,07 мл, 58,4 ммоль) добавляют к ТГФ (75 мл). Медленно добавляют 1,6 М BuLi в гексанах при -78 С. Через 15 мин по каплям добавляют 1-трет-бутиловый эфир 4-метиловый эфир 4 метилпиперидин-1,4-дикарбоновой кислоты (6,83 г, 26,5 ммоль), растворенной в ТГФ (75 мл). Через 1 ч добавляют 2,2 эквиваленты 5 N HCl при -78 С. Реакционную смесь нагревают до комнатной температуры и концентрируют до объема приблизительно 50 мл. К смеси добавляют EtOAc (50 мл) и насыщенный водный хлорид натрия (25 мл). Органический слой отделяют, сушат над Na2SO4, концентрируют и хроматографируют на силикагеле, элюируя 0-20% EtOAc в дихлорметане, получая указанное в заглавии соединение (4,80 г, выход 68%).(В) Получение трет-бутилового эфира 4-(2-циано-1-гидроксиэтил)-4-метилпиперидин-1-карболовой кислоты К трет-бутиловому эфиру 4-(2-цианоацетил)-4-метилпиперидин-1-карбоновой кислоты (6,20 г, 23,3 ммоль), растворенному в сухом MeOH (95 мл), порциями добавляют боргидрид натрия (1,76 г, 46,6 ммоль) в течение 10 мин. Ледяную баню удаляют через 1 ч и перемешивание продолжают в течение 1 ч. Реакционную смесь концентрируют, потом растворяют в EtOAc (50 мл) и небольшом количестве МеОН. Смесь промывают 1 N HCl (25 мл). Добавляют насыщенный водный хлорид натрия (25 мл), и органический слой сушат над Na2SO4, потом концентрируют. Остаток растворяют в дихлорметане, загружают на колонку с силикагелем и хроматографируют. После объединения фракций и концентрирования смесь растворяют в МеОН и снова концентрируют, получая указанное в заглавии соединение в виде слегка желтого масла (5,89 г, выход 95%).(4,24 г, 15,8 ммоль) и пиридину (3,07 мл, 39,5 ммоль), растворенным в дихлорметане (45 мл) при 0 С,добавляют метансульфонилхлорид (3,45 мл, 42,6 ммоль). Через 1 ч реакция не завершена, и реакционную смесь нагревают при комнатной температуре. Через 18 ч при комнатной температуре добавляют 1 эквивалент пиридина и 1 эквивалент метансульфонилхлорида и перемешивают в течение 4 ч. Реакционную смесь разбавляют EtOAc и несколько раз промывают насыщенным NaHCO3. Органический слой сушат над Na2SO4, фильтруют и концентрируют, получая неочищенный трет-бутиловый эфир 4-(2-циано-1 метансульфонилоксиэтил)-4-метилпиперидин-1-карбоновой кислоты. Предположительный выход 100%,трет-бутиловый эфир 4-(2-циано-1-метансульфонилоксиэтил)-4-метилпиперидин-1-карбоновой кислоты(D) Получение трет-бутилового эфира 4-(3-аминопропил)-4-метилпиперидин-1-карбоновой кислоты трет-Бутиловый эфир цис/транс-4-(2-циановинил)-4-метилпиперидин-1-карбоновой кислоты (1,00 г,4,0 ммоль), 5%Rh/Al2O3 (0,500 г) и 28% водный NH3 (1,25 мл) нагревают при 35 С в этаноле (20 мл) при давлении водорода (газ) 50 фунт/дюйм 2 (344,8 КПа) в течение 18 ч. Реакционную смесь фильтруют через целит, концентрируют и хроматографируют 0-20% (2 М NH3 в МеОН) в дихлорметане, получая указанное в заглавии соединение в виде прозрачного масла (0,65 г, выход 63%). Пример получения 31. Рацемический трет-бутиловый эфир 4-(3-амино-1-гидроксипропил)-4 метилпиперидин-1-карбоновой кислоты Используя способ получения трет-бутилового эфира 4-(3-аминопропил)-4-метилпиперидин-1 карбоновой кислоты, трет-бутиловый эфир 4-(3-амино-1-гидроксипропил)-4-метилпиперидин-1 карбоновой кислоты получают из трет-бутилового эфира 4- (2-циано-1-гидроксиэтил)-4-метилпиперидин-1-карбоновой кислоты. Пример получения 32. 2-(2-Хлор-5-метилпиримидин-4-ил)бензо[b]тиофен-6-карбоновая кислота(А) Получение метилового эфира 2-(2-хлор-5-метилпиримидин-4-ил)бензо[b]тиофен-6-карбоновой кислоты Метиловый эфир бензо[b]тиофен-6-карбоновой кислоты (7,30 г, 38,0 ммоль) растворяют в ТГФ (100 мл) и охлаждают до -78 С. Последовательно добавляют триизопропилборат (9,5 мл) и раствор диизопропиламина лития (23 мл 2,0 М раствора), и реакционную смесь оставляют медленно нагреваться до комнатной температуры в течение 3 ч. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, в это время добавляют 2,4-дихлор-5-метилпиримидин (6,82 г, 41,8 ммоль), 1,1'- 11014426 бис(дифенилфосфино)ферроцен (1,05 г, 1,90 ммоль), ацетат палладия(II) (0,44 г, 1,9 ммоль) и карбонат натрия (57 мл 2,0 N раствора). Реакционную смесь нагревают при 70 С в течение 20 ч. После того как реакционный раствор охлаждается до комнатной температуры, добавляют воду (100 мл) и дихлорметан(100 мл). Полученный осадок фильтруют и промывают дихлорметаном, получая желто-коричневое твердое вещество (4,55 г). Объединенные органические слои сушат над безводным сульфатом натрия и концентрируют. Полученное твердое вещество хроматографируют на силикагеле, элюируя EtOAc/гексаны 550%, получая дополнительные 1,16 г указанного в заглавии соединения (в сумме 5,71 г, выход 47%). ES+(В) Получение метилового эфира 2-5-метил-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты Смесь метилового эфира 2-(2-хлор-5-метилпиримидин-4-ил)бензо[b]тиофен-6-карбоновой кислоты(2,08 г, 6,50 ммоль) и 1-(3-аминопропил)-4-метилпиперазина (3,00 г, 19,0 ммоль) в 1,4-диоксане (40 мл) нагревают при 90 С в течение 20 ч. Растворитель выпаривают и полученный остаток хроматографируют на силикагеле, элюируя 2 М NH3/CH3OH в дихлорметане 0-8%, получая указанное в заглавии соединение(С). Получение три-гидрохлорида 2-5-метил-2-[3-(4-метилпиперазин-1 ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты Метиловый эфир 2-5-метил-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты (1,31 г, 2,98 ммоль) растворяют в метаноле (30 мл), добавляют ТГФ (30 мл) и воду (10 мл), и раствор гидроксида лития (4,6 мл 2,0 М раствора). Раствор нагревают при 70 С в течение 4,5 ч, и одной порцией добавляют 5 N HCl (9 мл), одновременно продолжая нагревать раствор. Раствор охлаждают до комнатной температуры и полученное твердое вещество фильтруют и промывают метанолом. Твердое вещество сушат при 60 С в вакуумном сушильном шкафу в течение 4 ч,получая указанное в заглавии соединение (1,43 г, выход 97%). ES+ (m/z) 426 [М+Н]. Пример получения 33. Получение метиламида 2-(2-хлор-5-метилпиримидин-4-ил)бензо[b]тиофен-6 карбоновой кислоты Используя способ получения (А)-(D) три-гидрохлорида циклопропиламида 2-5-хлор-2-[3-(4 метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты, указанное в заглавии соединение синтезируют из 6-бромбензо[b]тиофена в виде желто-коричневого твердого вещества. Пример получения 34. Метиламид 2-[5-хлор-2-(3-пиперидин-4-илпропиламино)пиримидин-4 ил]бензо[b]тиофен-6-карбоновой кислоты(А) Получение метиламида 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-6-карбоновой кислоты Используя способ получения циклопропиламида 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-4 карбоновой кислоты, указанное в заглавии соединение синтезируют из 6-бромбензо[b]тиофена в виде желто-коричневого твердого вещества.(В) Получение метиламида 2-[5-хлор-2-(3-пиперидин-4-илпропиламино)пиримидин-4-ил]бензо[b]тиофен-6-карбоновой кислоты трет-Бутиловый эфир 4-(3-аминопропил)пиперидин-1-карбоновой кислоты (0,72 г, 3,0 ммоль) добавляют к перемешиваемой суспензии метиламида 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-6 карбоновой кислоты (0,40 г, 1,2 ммоль) и диизопропилэтиламина (0,38 г, 3,0 ммоль) в безводном 1,4 диоксане (15 мл) при комнатной температуре в атмосфере азота. Полученную смесь нагревают на масляной бане при 90 С в течение 12 ч. Смесь концентрируют при комнатной температуре и полученное твердое вещество промывают диэтиловым эфиром (20 мл), получая желтое твердое вещество. Твердое вещество суспендируют в дихлорметане (5 мл), потом добавляют триэтилсилан (0,7 мл) и TFA (4 мл). Полученный желтый раствор перемешивают в течение 2 ч. После концентрирования насухо неочищенный продукт растворяют в МеОН (20 мл)/дихлорметане (10 мл) и раствор обрабатывают порциями 2 N LiOH(4,2 мл), получая суспензию. После концентрирования и последующей хроматографии на силикагеле,элюируя 2,0 М NH3/MeOH в дихлорметане 0-10%, получают указанное в заглавии соединение в виде желтого твердого вещества (0,26 г, выход 49%). ES+ (m/z) 444 (35Cl) и 446 (37Cl) [М+Н] . Пример получения 35. [2-(2-Хлор-5-метилпиримидин-4-ил)-бензо[b]тиофен-6-ил]морфолин-4-илметанон Используя способ получения циклопропиламида 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-4 карбоновой кислоты, указанное в заглавии соединение синтезируют из 6-бромбензо[5]тиофена в виде желто-коричневого твердого вещества. Пример получения 36. [4-(6-Аминометил-бензо[5]тиофен-2-ил)пиримидин-2-ил]-[3-(4-метилпиперазин-1-ил)пропил]амин(А) Получение С-бензо[b]тиофен-6-илметиламина Бензо[b]тиофен-6-карбонитрил (9,70 г, 61,1 ммоль) растворяют в ТГФ (400 мл) и охлаждают до 05 С. По каплям добавляют алюмогидрид лития (183 мл 1,0 M раствора в ТГФ) в течение 30 мин, и реакционную смесь перемешивают в течение 20 ч, одновременно нагревая до 25 С. Реакционную смесь охлаждают на ледяной бане и медленно добавляют воду (6,94 мл), потом добавляют 15% гидроксид натрия(6,94 мл) и воду (20,83 мл) . Полученный осадок фильтруют и промывают диэтиловым эфиром. Фильтрат концентрируют, получая указанное в заглавии соединение в виде бесцветного масла (8,16 г, выход 82%).(В). Получение трет-бутилового эфира бензо[b]тиофен-6-илметилкарбаминовой кислоты Бензо[b]тиофен-6-ил-метиламин (7,80 г, 47,8 ммоль) растворяют в ТГФ (400 мл) и добавляют дитрет-бутилдикарбонат (13,9 г, 63,5 ммоль). После перемешивания в течение 20 ч растворитель удаляют. Полученный остаток растворяют в дихлорметане и растворитель выпаривают, получая бледно-желтое твердое вещество (8,0 г, выход 64%).[2-(2-хлорпиримидин-4-ил)бензо[b]тиофен-6 илметил]карбаминовой кислоты трет-Бутиловый эфир бензо[b]тиофен-6-илметилкарбаминовой кислоты (3,6 г, 13,8 ммоль) растворяют в ТГФ (100 мл) и охлаждают до -78 С. Добавляют триизопропилборат (8,5 мл), потом добавляют раствор диизопропиламина лития (27 мл 2,0 М раствора) и реакционную смесь оставляют медленно нагреваться до комнатной температуры в течение двух часов. Реакционную смесь перемешивают при комнатной температуре в течение двух часов, в это время добавляют 2,4-дихлорпиримидин (4,59 г, 30,8 ммоль), 1,1'-бис(дифенилфосфино)ферроцен (388 мг, 0,700 ммоль), ацетат палладия(II) (164 мг, 0,730 ммоль) и карбонат натрия (28 мл 2,0 N раствора). Реакционную смесь нагревают в течение 20 ч при 70 С. После охлаждения реакционной смеси до 25 С, добавляют воду (100 мл). Смесь экстрагируют дихлорметаном, и экстракты выпаривают. Полученное твердое вещество хроматографируют на силикагеле, элюируя EtOAc/гексаны 5-50%, получая указанное в заглавии соединение (1,47 г, выход 28%). ES+ (m/z) 376(D) Получение трет-бутилового эфира (2-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин 4-илбензо[b]тиофен-6-илметил)карбаминовой кислоты Смесь трет-бутилового эфира [2-(2-хлорпиримидин-4-ил)бензо[b]тиофен-6-илметил]карбаминовой кислоты (1,47 г, 3,90 ммоль) и 1-(3-аминопропил)-4-метилпиперазина (1,36 г, 8,60 ммоль) в диоксане (38 мл) кипятят с обратным холодильником в течение 3 ч. Растворитель удаляют и остаток хроматографируют на силикагеле, элюируя 2,0 М NH3/MeOH в CHCl3 0-10%, получая указанное в заглавии соединение(2-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-илметил)карбаминовой кислоты (1,36 г, 2,74 ммоль) растворяют в дихлорметане (20 мл) и добавляют TFA (3,2 мл). После перемешивания в течение 20 ч добавляют метанол и смесь пропускают через колонку SCX. После элюирования метанолом, чтобы удалить соли, используют 20% 2,0 MNH3/MeOH/EtOAC, чтобы элюировать продукт, который потом пропускают через колонку с силикагелем массой 15 г, используя такую же систему растворителей. Указанное в заглавии соединение получают в виде желтого твердого вещества (0,73 г, выход 68%). ES+ (m/z) 397 [М+Н]. Пример получения 37. [4-(6-Аминометилбензо[b]тиофен-2-ил)-5-хлорпиримидин-2-ил]-[3-(4 метилпиперазин-1-ил)пропил]амин(А) Получение 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-6-карбонитрила К охлажденному до -70 С раствору 6-цианобензотиофена (7,98 г, 50,1 ммоль) и триизопропилбората (10,4 г, 55,1 ммоль) в ТГФ (100 мл) по каплям добавляют диизопропиламид лития (27,6 мл, 2 М раствор в гептане/ТГФ/этилбензоле, 55,1 ммоль) в течение 10 мин. Смесь перемешивают в течение 3 ч и потом оставляют медленно нагреваться в течение 2 ч, до комнатной температуры. К смеси потом добавляют 2,4,5-трихлорпиримидин (9,19 г, 50,1 ммоль), 2 N Na2CO3 (50 мл, 100 ммоль), 1,1'бис(дифенилфосфино)ферроцен (1,39 г, 2,51 ммоль) и ацетат палладия(II) (563 мг, 2,51 ммоль), и полученную смесь нагревают до кипения с обратным холодильником в течение 18 ч. После охлаждения до комнатной температуры смесь концентрируют при пониженном давлении, экстрагируют из воды (100 мл) дихлорметаном (3200 мл). Объединенные органические экстракты концентрируют при пониженном давлении, получая бежевое твердое вещество (18,7 г). Неочищенное вещество обрабатывают ультразвуком в диэтиловом эфире (200 мл) и фильтруют, получая указанное в заглавии соединение в виде светло-бежевого твердого вещества (14,8 г, выход 97%).(В) Получение 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4 илбензо[b]тиофен-6-карбонитрила Используя способ получения трет-бутилового эфира (2-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-илметил)карбаминовой кислоты, указанное в заглавии соединение синтезируют из 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-6-карбонитрила и 1-(3 аминопропил)-4-метилпиперазина и выделяют в виде твердого вещества. ES+ (m/z) 427 (35Cl) и 429 (37Cl)[4-(6-аминометилбензо[b]тиофен-2-ил)-5-хлорпиримидин-2-ил]-[3-(4 метилпиперазин-1-ил)пропил]амина В колбу высокого давления помещают 2-(5-хлор-2-(3-(4-метилпиперазин-1-ил)пропил- 13014426 амино)пиримидин-4-ил)бензо[b]тиофен-6-карбонитрил (6,23 г, 14,6 ммоль), уксусную кислоту (25 мл),МеОН (500 мл) и никель Ренея (2,5 мл). Смесь гидрогенизируют при 60 фунт/дюйм 2 (413,8 КПа) в течение 12 ч, фильтруют и концентрируют при пониженном давлении. Полученную смолу растворяют в воде(200 мл) и экстрагируют диэтиловым эфиром (200 мл). Водный слой подщелачивают до рН=145 N NaOH и экстрагируют дихлорметаном (2200 мл). Органический слой концентрируют при пониженном давлении и очищают хроматографией на силикагеле, элюируя 7:2,5:0,5 EtOAc/MeOH/Et3N в дихлорметане: 0100%, получая неочищенное вещество в виде смеси продуктов (3,53 г). Это вещество подвергают очистке на смоле с обращенной фазой, 10-25% 0,1% TFA в CH3CN/0,1% TFA в воде на колонке С 18 Symmetry,получая желтое твердое вещество (2,55 г). Это твердое вещество растворяют в 2,5 N NaOH (100 мл) и экстрагируют дихлорметаном (3100 мл). Органические слои концентрируют, получая указанное в заглавии соединение в виде желтого твердого вещества (808 мг, выход 13%) . ES+ (m/z) 431 (35Cl) и 433(37Cl) [М+Н]. Пример получения 38. 4-(6-Бромбензо[b]тиофен-2-ил)-2,5-дихлорпиримидин Раствор 6-бромбензо[b]тиофена (5,00 г, 23,5 ммоль) в ТГФ (50 мл) охлаждают до -70 С. По каплям добавляют диизопропиламид лития (12,9 мл, 2 М раствор в гептане/ТТФ/этилбензоле, 25,8 ммоль) в течение 7 мин и смесь оставляли нагреваться до комнатной температуры в течение ночи. К смеси добавляют 2,4,5-трихлорпиримидин (4,31 г, 23,5 ммоль), 2 N Na2CO3 (23,6 мл, 47,2 ммоль), 1,1'бис(дифенилфосфино)ферроцен (651 мг, 1,17 ммоль) и ацетат палладия(II) (263 мг, 1,17 ммоль) и смесь нагревают до кипения с обратным холодильником в течение 21 ч. После охлаждения до комнатной температуры, смесь концентрируют при пониженном давлении, экстрагируют из воды (100 мл) дихлорметаном (3150 мл) и 10% МеОН/дихлорметан (2150 мл). Объединенные органические экстракты концентрируют при пониженном давлении, получая коричневое твердое вещество (9,15 г). Неочищенное вещество обрабатывают ультразвуком в диэтиловом эфире (200 мл) и фильтруют, получая указанное в заглавии соединение в виде светло-коричневого твердого вещества (6,66 г, выход 79%). Пример получения 39. [4-(6-Бромбензо[b]тиофен-2-ил)-пиримидин-2-ил]-[3-(4-метилпиперазин-1 ил)пропил]амин Используя способ получения 4-(6-бромбензо[b]тиофен-2-ил)-2,5-дихлорпиримидина, указанное в заглавии соединение синтезируют из 6-бромбензо[b]тиофена и выделяют в виде твердого вещества. Пример получения 40.(А) Получение бензо[b]тиофен-6-иламина Смесь 6-бромбензо[b]тиофена (16,0 г, 76,0 ммоль), бензофенон имина (16,6 г, 91,5 ммоль),трис(дибензилидинацетон)палладий(0) (0,72 г, 0,80 ммоль), 1,1'-бис(дифенилфосфино)ферроцена (1,3 г,2,3 ммоль) и трет-бутоксида натрия (10,8 г, 112 ммоль) в толуоле кипятят с обратным холодильником в течение 20 ч. Растворитель выпаривают и остаток хроматографируют на силикагеле, элюируя дихлорметаном, получая указанное в заглавии соединение (1,52 г, выход 11%).(В) Получение трет-бутилового эфира бензо[b]тиофен-6-илкарбаминовой кислоты Смесь бензо[b]тиофен-6-иламина (1,33 г, 8,93 ммоль), ди-трет-бутилдикарбоната (2,65 г, 12,1 ммоль) и диметиламинопиридина (0,35 г, 2,8 ммоль) в ТГФ (80 мл) перемешивают в течение 20 ч. Растворитель выпаривают и остаток хроматографируют на силикагеле, элюируя EtOAc в гексанах 0-40%,получая указанное в заглавии соединение в виде коричневого масла (1,51 г, выход 68%).(С) Получение трет-бутилового эфира [2-(2-хлор-5-метилпиримидин-4-ил)-бензо[b]тиофен-6-ил]карбаминовой кислоты трет-Бутиловый эфир бензо[b]тиофен-6-ил-карбаминовой кислоты (1,06 г, 4,30 ммоль) растворяют в ТГФ (40 мл) и охлаждают до -78 С. Добавляют раствор диизопропиламина лития (8,5 мл 2,0 М раствора) и триизопропилборат (6,0 мл, 26 ммоль). Реакционную смесь перемешивают при -78 С в течение 90 мин,потом охлаждающую баню удаляют. После перемешивания в течение трех часов добавляют 2,4-дихлор 5-метилпиримидин (0,74 г, 4,5 ммоль), 1,1'-бис(дифенилфосфино)ферроцен (120 мг, 0,220 ммоль), ацетат палладия(II) (50,4 мг, 0,220 ммоль) и карбонат натрия (9,5 мл 2,0 N раствора). Реакционную смесь нагревают при 70 С в течение 20 ч. Потом реакционный раствор охлаждают до 25 С, добавляют воду (100 мл). Смесь экстрагируют дихлорметаном, и экстракты выпаривают. Полученное твердое вещество хроматографируют на силикагеле, элюируя EtOAc в гексанах 5-50%, получая указанное в заглавии соединение в виде желтого твердого вещества (0,32 г, выход 20%).[2-(2-хлор-5-метилпиримидин-4-ил)-бензо[b]тиофен-6-ил]карбаминовой кислоты (0,32 г, 0,85 ммоль) и 1-(3-аминопропил)-4-метилпиперазина (0,41 г, 2,6 ммоль) в 1,4-диоксане (15 мл) кипятят с обратным холодильником в течение 48 ч. Растворитель удаляют, и остаток хроматографируют на силикагеле, элюируя 2,0 М NH3/МеОН в дихлорметане 0-10%, получая указанное в заглавии соединение в виде желтого твердого вещества (0,33 г, выход 78%). ES+ (m/z) 497(2-5-метил-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4 илбензо[b]тиофен-6-ил)карбаминовой кислоты (0,33 г, 0,66 ммоль) растворяют в дихлорметане (6 мл) и добавляют TFA (0,78 мл) . Раствор перемешивают в течение 20 ч, потом добавляют метанол. Смесь пропускают через колонку SCX. Потом, элюируя метанолом, используют 20% 2,0 М NH3/МеОН в EtOAc,чтобы элюировать продукт, который потом хроматографируют на силикагеле, элюируя 2,0 М NH3/МеОН в дихлорметане 0-15%, получая указанное в заглавии соединение в виде желтого масла (166 мг, выход 64%). ES+ (m/z) 397 [М+Н]. Пример получения 41. 3-[5-Хлор-4-(4-циклопропилкарбамоил-бензо[b]тиофен-2-ил)пиримидин-2 иламино]пропиламид пиперидин-4-карбоновой кислоты(А) Получение циклопропиламида 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты Суспензию 2-(2,5-дихлорпиримидин-4-ил)-бензо[b]тиофен-4-карбоновой кислоты (5,00 г, 15,4 ммоль) в дихлорметане (100 мл) обрабатывают при комнатной температуре циклопропиламином (1,20 мл, 17,3 ммоль) в присутствии N,N-диизопропилэтиламина (3,00 мл, 17,2 ммоль), гидрохлорида 1-(3 диэтиламинопропил)-3-этилкарбодиимида (3,34 г, 17,4 ммоль) и 1-гидроксибензотриазола (2,33 г, 17,2 ммоль) в течение 20 ч. Потом добавляют воду (20 мл) и после перемешивания в течение 20 мин смесь фильтруют и сушат. Полученное твердое вещество суспендируют в дихлорметане (50 мл), перемешивают в течение 2 ч, фильтруют и сушат, получая указанное в заглавии соединение (5,60 г, 99%).(В) Получение циклопропиламида 2-[2-(3-аминопропиламино)-5-хлорпиримидин-4-ил]бензо[b]тиофен-4-карбоновой кислоты Перемешиваемую суспензию циклопропиламида 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-4 карбоновой кислоты (5,59 г, 15,3 ммоль) в 1,4-диоксане (60 мл), трет-бутиловый эфир (3-аминопропил)карбаминовой кислоты (2,70 мл, 2,69 мг, 15,5 ммоль) в N,N-диизопропилэтиламине (5,20 мл, 3,86 г, 29,9 ммоль) нагревают при 97 С в течение 120 ч. Смесь потом охлаждают до комнатной температуры, разбавляют дихлорметаном (120 мл), фильтруют, промывают дихлорметаном (225 мл) и сушат, получая трет-бутиловый эфир 3-[5-хлор-4-(4-циклопропилкарбамоил-бензо[b]тиофен-2-ил)пиримидин-2 иламино]пропилкарбаминовой кислоты (5,00 г, 65%). Это промежуточное вещество (4,99 г, 9,94 ммоль) суспендируют в метаноле (120 мл) и обрабатывают 10% водной НС 1 (10 мл) и смесь нагревают при 100 С в течение 24 ч. Смесь потом охлаждают до комнатной температуры, гасят 2 N NaOH (20 мл),фильтруют, промывают Н 2 О (60 мл), дихлорметаном (60 мл) и диэтиловым эфиром (60 мл) и сушат, получая указанное в заглавии соединение (3,99 г, 99%).(С) Получение 3-[5-хлор-4-(4-циклопропилкарбамоил-бензо[b]тиофен-2-ил)пиримидин-2 иламино]пропиламида пиперидин-4-карбоновой кислоты Суспензию циклопропиламида 2-[2-(3-аминопропиламино)-5-хлорпиримидин-4-ил]бензо[b]тиофен-4-карбоновой кислоты (500 мг, 1,24 ммоль) в дихлорметане (30 мл) обрабатывают при комнатной температуре моно-трет-бутиловым эфиром пиперидин-1,4-дикарбоновой кислоты (340 мг,1,48 ммоль) в присутствии N,N-диизопропилэтиламина (0,220 мл, 163 мг, 1,26 ммоль), гидрохлорида 1(3-диэтиламинопропил)-3-этилкарбодиимида (240 мг, 1,25 ммоль) и 1-гидроксибензотриазола (171 мг,1,21 ммоль) в течение 24 ч. Смесь потом разбавляют дихлорметаном (30 мл), фильтруют, промывают Н 2 О (30 мл) и диэтиловым эфиром (30 мл) и сушат, получая трет-бутиловый эфир 4-3-[5-хлор-4-(4 циклопропилкарбамоил-бензо[b]тиофен-2-ил)-пиримидин-2-иламино]пропилкарбамоилпиперидин-1 карбоновой кислоты (700 мг, 92%). Перемешиваемую смесь этого промежуточного соединения (695 мг,1,13 ммоль) в дихлорметане (25 мл) обрабатывают при комнатной температуре TFA (2,5 мл) в течение 72 ч. Смесь потом концентрируют при пониженном давлении, и очищают хроматографией на силикагеле,элюируя 2 М NH3/МеОН в дихлорметане: 16-40%, получая указанное в заглавии соединение (492 мг, выход 85%). Пример получения 42. Циклопропиламид 2-(2,5-дихлорпиримидин-4-ил)-7-метоксибензо[b]тиофен 4-карбоновой кислоты(А) Получение 7-метоксибензо[b]тиофена К раствору 7-бромбензо[b]тиофена (10,0 г, 46,9 ммоль) в сухом DMF (234 мл) добавляют йодид меди (8,90 г, 46,9 ммоль), потом добавляют метоксид натрия (30% в МеОН, 176 мл, 938 ммоль) при комнатной температуре в атмосфере азота. Смесь нагревают при 100 С в течение 2 ч и охлаждают до комнатной температуры. Добавляют воду (400 мл) и смесь экстрагируют диэтиловым эфиром (4200 мл). Органические слои промывают охлажденной водой (3 х 75 мл), насыщенным водным хлоридом натрия(100 мл) , сушат (MgSO4) и концентрируют, получая указанное в заглавии соединение в виде желтого масла (7,58 г, выход 98%).(В) Получение 7-метоксибензо[b]тиофен-4-карбоновой кислоты Оксихлорид фосфора (7,1 мл, 76,7 ммоль) по каплям добавляют к охлажденному сухому DMF (13,2 мл, 170,4 ммоль) с такой скоростью, что температура не превышает 5 С. Через 30 мин при этой темпера- 15014426 туре по каплям добавляют раствор 7-метоксибензо[b]тиофена (7,00 г, 42,6 ммоль) в сухом DMF (2 мл). Перемешивание продолжают при 5 С в течение 30 мин и при комнатной температуре в течение 45 мин. Потом смесь нагревают до 117 С и потом при 90 С в течение 2 ч, охлаждают до 0 С и нейтрализируют раствором ацетата натрия (62 г) в воде (300 мл). Полученную смесь экстрагируют диэтиловым эфиром (5150 мл) и органические слои промывают охлажденной водой (5100 мл), насыщенным водным хлоридом натрия (100 мл), сушат (MgSO4) и концентрируют. Неочищенное вещество очищают на силикагеле(гексаны/EtOAc 9:1), получая 7-метоксибензо[b]тиофен-4-карбальдегид в виде желтого твердого вещества (5,5 г, выход 68%). К перемешиваемому раствору промежуточного соединения (14,9 г, 77,5 ммоль) в ацетоне (300 мл) медленно добавляют раствор перманганата калия (14,9 г, 94,3 ммоль) в воде (525 мл) при 0 С и смесь перемешивают в течение 75 мин. Потом добавляют изопропанол (100 мл) и смесь разделяют на две части. Каждую часть обрабатывают HCl (100 мл, 12%), разбавляют водой (300 мл) и экстрагируют EtOAc (3300 мл). Органические слои промывают водой (300 мл), насыщенным водным хлоридом натрия (300 мл), сушат (MgSO4) и концентрируют. Остаток собирают и разбавляют EtOAc (600 мл),и суспензию нагревают до 70 С и фильтруют, получая указанное в заглавии соединение в виде белого твердого вещества (10,3 г, выход 63%). При комнатной температуре, фильтрат образует суспензию. После фильтрования получают дополнительные 3,2 г. ES+ (m/z) 207 [М-Н].(С) Получение 2-(2,5-дихлорпиримидин-4-ил)-7-метоксибензо[b]тиофен-4-карбоновой кислоты К охлажденному до -78 С раствору диизопропиламина (2,9 мл, 20,9 ммоль) в сухом ТГФ (28 мл) добавляют раствор н-бутиллития (13,1 мл, 20,9 ммоль, 1,6 М в гексане) в атмосфере азота и смесь перемешивают в течение 30 мин. Смесь добавляют к суспензии 2-(2,5-дихлорпиримидин-4-ил)-7 метоксибензо[b]тиофен-4-карбоновой кислоты (1,36 г, 6,53 ммоль) в сухом ТГФ (40 мл) при -78 С. Полученную смесь нагревают до 0 С и перемешивание продолжают в течение 2 ч. Смесь охлаждают до -40 С и по каплям добавляют триизопропилборат (5,4 мл, 23,5 ммоль). Смесь нагревают до комнатной температуры,причем перемешивание продолжают в течение еще 2 ч. Раствор HCl (12%, 40 мл) добавляют при 0 С и смесь перемешивают при комнатной температуре в течение 30 мин. Добавляют воду (40 мл), и суспензию отфильтровывают. Твердое вещество промывают водой, получая 2-(2,5-дихлорпиримидин-4-ил)-7 метоксибензо[b]тиофен-4-карбоновая кислота-2-бороновую кислоту в виде белого твердого вещества(1,56 г, выход 95%). К раствору 2,4,5-трихлорпиримидина (1,24 г, 6,76 ммоль) в сухом диметоксиэтане (6 мл) последовательно добавляют дихлорбис(трифенилфосфин)палладий(II) (146 мг, 0,21 ммоль), карбонат натрия (2 N в воде, 12,2 мл, 24,6 ммоль) при комнатной температуре в атмосфере азота. Смесь нагревают до 45 С в течение 10 минут и добавляют суспензию 2-(2,5-дихлорпиримидин-4-ил)-7-метоксибензо[b]тиофен-4 карбоновая кислота-2-бороновой кислоты (1,55 г, 6,15 ммоль) в диметоксиэтане (24 мл) в течение 1 ч. Смесь перемешивают при 45 С в течение 1,5 ч, потом охлаждают до комнатной температуры. Смесь подкисляют до рН 2 раствором HCl (12%) и разбавляют водой (50 мл). Смесь отфильтровывают и твердое вещество промывают водой и диэтиловым эфиром, получая указанное в заглавии соединение в виде желтого твердого вещества (2,5 г), которое используют на следующей стадии без дополнительного очищения.(435 мг, 3,22 ммоль) при комнатной температуре в атмосфере азота. Смесь обрабатывают циклопропиламином (184 мг, 3,22 ммоль) и перемешивают при комнатной температуре в течение 1 дня. Смесь разбавляют дихлорметаном (60 мл) и промывают водой (330 мл). Суспензию в органической фазе отфильтровывают, получая желтое твердое вещество, которое промывают дихлорметаном и водой, получая указанное в заглавии соединение в виде желтого твердого вещества (880 мг, выход 72%). Пример получения 43. [5-Хлор-4-(6-триизопропилсиланилсульфанил-бензо[b]тиофен-2-ил)пиримидин-2-ил]-[3-(4-метилпиперазин-1-ил)пропил]амин К раствору [4-(6-бромбензо[b]тиофен-2-ил)-5-хлорпиримидин-2-ил]-[3-(4-метилпиперазин-1-ил)пропил]амина (600 мг, 1,24 ммоль) в толуоле (3 мл) добавляют тетракис(трифенилфосфин)палладий(0)(100 мг, 0,0870 ммоль) и соль триизопропилсилантиола калия (предварительно полученную из триизопропилсилантиола, используя, по существу, способ, описанный в Tetrahedron Lett., 35, (20), 3221-3224,(1994 (285 мг, 1,24 ммоль) при комнатной температуре в атмосфере азота. Смесь нагревают до 100 С в течение 2 ч, потом охлаждают до комнатной температуры. Добавляют воду (50 мл) и смесь экстрагируютEtOAc (320 мл). Органические слои сушат (MgSO4) и концентрируют, получая указанное в заглавии соединение в виде клейкого красного твердого вещества (660 мг).(А) Получение бензгидриламида бензо[b]тиофен-6-сульфоновой кислоты К суспензии магния (1,14 г, 46,9 ммоль) в сухом ТГФ (50 мл) добавляют йод (100 мг), потом медленно добавляют 6-бромбензо [b] тиофен (5,00 г, 23,5 ммоль) в сухом ТГФ (100 мл) при 64 С (внутренняя температура) в атмосфере азота. При добавлении к смеси добавляют сухой толуол (20 мл). После завершения добавления смесь нагревают при 68 С (внутренняя температура) в течение 3 ч, потом охлаждают до -60 С, причем поток диоксида серы пропускают через раствор в течение 10 мин. Смесь оставляют нагреваться до комнатной температуры, барботирование диоксида серы продолжают в течение дополнительных 5 мин и смесь перемешивают в течение 45 мин. После фильтрования и концентрирования получают красноватое твердое вещество (8,0 г), которое разбавляют дихлорметаном (235 мл), обрабатывают N-хлорсукцинимидом (3,45 г, 25,8 ммоль) при комнатной температуре, и перемешивают в течение 2 ч. После фильтрования и концентрирования получают красноватое твердое вещество (5,8 г), которое разбавляют дихлорметаном (234 мл), обрабатывают аминодифенилметаном (20,2 мл, 117 ммоль) при 0 С, и смесь перемешивают в течение 1 ч. Добавляют воду (200 мл) и смесь экстрагируют дихлорметаном (3200 мл). Органические слои сушат (MgSO4) и концентрируют. Неочищенный продукт суспендируют в дихлорметане/гексане, потом фильтруют, получая указанное в заглавии соединение в виде белого твердого вещества. Фильтрат концентрируют, и остаток хроматографируют на силикагеле (дихлорметан),получая вторую партию указанного в заглавии соединения (в сумме 2,52 г). ES+ (m/z) 378 [М-Н].(В) Получение бензгидриламида 2-(2-хлор-5-метилпиримидин-4-ил)бензо[b]тиофен-6-сульфоновой кислоты К раствору диизопропиламина (2,09 мл, 14,87 ммоль) в сухом ТГФ (10 мл) добавляют раствор нбутиллития (1,6 М в гексане, 9,14 мл, 14,62 ммоль) при -78 С в атмосфере азота, смесь перемешивают в течение 30 мин. Добавляют раствор бензгидриламида бензо[b]тиофен-6-сульфоновой кислоты (925 мг,2,44 ммоль) и триизопропилбората (2,87 мл, 12,43 ммоль) в сухом ТГФ (10 мл). Смесь медленно нагревают до 10 С в течение 1 ч и перемешивают при комнатной температуре в течение 30 мин. Добавляют раствор карбоната натрия (2M в воде, 3,78 мл), потом добавляют 2,4-дихлор-5-метилпиримидин (517 мг,3,17 ммоль) и хлорид (1,1'-бис(дифенилфосфино)ферроцен)палладия(II) (99,6 мг, 0,122 ммоль). Смесь нагревают при 60 С в течение 1,5 ч, потом охлаждают до комнатной температуры. Добавляют воду (40 мл) и смесь экстрагируют EtOAc (340 мл). Органические слои сушат (MgSO4) и концентрируют. Остаток хроматографируют на силикагеле, элюируя гексаны/EtOAc от 90:10 до 40:60, получая указанное в заглавии соединение в виде желтого твердого вещества (457 мг, выход 37%).(С) Получение бензгидрил-амида 2-5-метил-2-[3-(4-метилпиперазин-1 ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-сульфоновой кислоты К перемешиваемой суспензии бензгидриламида 2-(2-хлор-5-метилпиримидин-4-ил)бензо[b]тиофен-6-сульфоновой кислоты (457 мг, 0,903 ммоль) в сухом 1,4-диоксане (4,5 мл) добавляют диизопропилэтиламин (0,315 мл, 1,81 ммоль) и 1-(3-аминопропил)-4-метилпиперазин (213 мг, 1,35 ммоль). Смесь нагревают при 97 С в течение 1 дня. После концентрирования и последующего хроматографического очищения на силикагеле, элюируя 2 M NH3/MeOH в дихлорметане: 0-10%, получают указанное в заглавии соединение в виде желтого твердого вещества (317 мг, выход 57%). ES+ (m/z) 627(15 мл) перемешивают при 90 С в атмосфере азота в течение 6 ч. Реакционную смесь охлаждают до комнатной температуры, экстрагируют этилацетатом и насыщенным водным хлоридом натрия, промывают 2N водным раствором NaOH, насыщенным водным хлоридом натрия, сушат над Na2SO4, фильтруют и выпаривают. Остаток очищают хроматографией на силикагеле, элюируя этилацетатом:гексаны 3:7, получая указанный в заглавии продукт в виде красной жидкости (1,41 г), которую используют на следующей стадии без дополнительного очищения.(В) Получение 2,5-дихлор-4-(6-метилсульфанилбензо[b]тиофен-2-ил)пиримидина К перемешиваемому раствору 6-метилсульфанилбензо[b]тиофена (1,41 г, 7,82 ммоль) и триизопропилбората (1,80 мл, 7,82 ммоль) в ТГФ (20 мл) при -78 С в атмосфере азота добавляют диизопропиламин лития (4,3 мл, 2 М раствор). Реакционную смесь оставляют медленно нагреваться до комнатной температуры. Добавляют водный раствор Na2CO3 (2,50 г, 23,5 ммоль, в 11 мл воды), потом добавляют 2,4,5 трихлорпиримидин (1,58 г, 8,60 ммоль) и хлорид [1,1-бис(дифенилфосфено)ферроцен]палладия(II) (0,32 г, 0,39 ммоль). Реакционную смесь нагревают при 6 ОС в атмосфере азота в течение 1 ч. Потом охлаждают до комнатной температуры, суспензию фильтруют и твердое вещество промывают водой и этилацетатом, потом сушат под вакуумом. Неочищенный продукт очищают хроматографией на силикагеле,элюируя дихлорметаном:гексаны от 2:8 до 3:7, получая указанный в заглавии продукт в виде светложелтого твердого вещества (0,19 г).- 17014426 Пример получения 46. Амид 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты Диизопропилэтиламин (0,574 мл) добавляют к перемешиваемой суспензии 2-(2,5 дихлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты (1,02 г, 3,14 ммоль) в безводном дихлорметане (20 мл) при 0 С в атмосфере азота, получая прозрачный раствор. Раствор по каплям обрабатывают 7 М NH3/MeOH (0,493 мл, 3,45 ммоль), получая суспензию. К смеси добавляют порошкообразный гексафторфосфат 1H-бензотриазол-1-илокситрис(диметиламино)фосфония (1,46 г, 3,30 ммоль) и полученную смесь оставляют перемешиваться при 0 С в течение 2 ч и при комнатной температуре в течение 5 ч. К смеси малыми порциями добавляют диэтиловый эфир (15 мл). Смесь перемешивают в течение дополнительных 20 мин, потом фильтруют. После высушивания получают указанное в заглавии соединение в виде желто-коричневого твердого вещества, которое используют без дополнительного очищения(0,994 г). Пример получения 47. [Бис-(4-метоксифенил)метил]амид (2-(5-бром-2-хлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты Используя способ получения [бис-(4-метоксифенил)метил]амида 2-(2-хлор-5-метилпиримидин-4 ил)бензо[4]тиофен-4-карбоновой кислоты, указанное в заглавии соединение синтезируют из 2-(5-бром-2 хлорпиримидин-4-ил)бензо[4]тиофен-4-карбоновой кислоты в виде желто-коричневого твердого вещества. Пример получения 48. трет-Бутиловый эфир (R)-4-(3-аминопропил)-3-метилпиперазин-1 карбоновой кислотыN- (3-Бромпропил)фталимид (6,50 г, 24,2 ммоль) добавляют к перемешиваемому раствору третбутилового эфира (R)-3-метилпиперазин-1-карбоновой кислоты (4,85 г, 24,2 ммоль) и диизопропилэтиламина (4,70 г, 36,4 ммоль) в безводном 1,4-диоксане (50 мл). Полученную смесь нагревают на масляной бане при 90 С в течение 20 ч. После концентрирования смесь хроматографируют на силикагеле, элюируя 2 М NH3/CH3OH в дихлорметане 1-3%, получая промежуточный продукт (7,5 г, выход 79%). Промежуточный продукт (7,54 г, 19,5 ммоль) растворяют в безводном этаноле (250 мл), потом обрабатывают гидразином (3,75 г, 117 ммоль). Перемешиваемую смесь нагревают на масляной бане при 7 0 С в течение 16 ч, получая белую суспензию. Смесь фильтруют при комнатной температуре и фильтрат концентрируют, получая смесь твердого вещества и масла. Смесь суспендируют в этаноле (10 мл) и диэтиловом эфире (50 мл) . После фильтрования и концентрирования, получают указанное в заглавии соединение в виде желто-коричневого масла (4,72 г, выход 93%). Используя способ получения трет-бутилового эфира (R)-4-(3-аминопропил)-3-метилпиперазин-1 карбоновой кислоты, следующие соединения синтезируют из соответствующего трет-бутилового эфира метилпиперазин-1-карбоновой кислоты(А) Получение 1-трет-бутилового эфира 4-метилового эфира 4-этилпиперидин-1,4-дикарбоновой кислоты Используя способ получения 1-трет-бутилового эфира 4-метилового эфира 4-метилпиперидин-1,4 дикарбоновой кислоты, указанное в заглавии соединение синтезируют из 1-трет-бутилового эфира 4 метилового эфира пиперидин-1,4-дикарбоновой кислоты и выделяют в виде желто-коричневого масла.(В) Получение трет-бутилового эфира 4-(3-аминопропил)-4-этилпиперидин-1-карбоновой кислоты Используя способ получения трет-бутилового эфира 4-(3-аминопропил)-4-метилпиперидин-1 карбоновой кислоты, указанное в заглавии соединение синтезируют из 1-трет-бутилового эфира 4 метилового эфира 4-этилпиперидин-1,4-дикарбоновой кислоты и выделяют в виде прозрачного масла. Пример получения 53. Рацемический трет-бутиловый эфир 3-(3-аминопропил)пиперидин-1 карбоновой кислоты(А) Получение рацемического трет-бутилового эфира 3-(3-метансульфонилоксипропил)пиперидин 1-карбоновой кислоты Используя способ получения трет-бутилового эфира 4-(3-азидопропил)пиперидин-1-карбоновой- 18014426 кислоты, указанное в заглавии соединение синтезируют из рацемического 3-пиперидин-3-илпропан-1 ола и выделяют в виде масла.(В) Получение рацемического трет-бутилового эфира 3-(3-аминопропил)пиперидин-1-карбоновой кислоты Фталимид калия (7,79 г, 42,1 ммоль) добавляют к перемешиваемому раствору рацемического третбутилового эфира 3-(3-метансульфонилоксипропил)пиперидин-1-карбоновой кислоты (9,00 г, 28,0 ммоль) в DMF (60 мл). Смесь оставляют перемешиваться при 55 С в течение 16 ч. Смесь концентрируют при комнатной температуре, масло разбавляют в этилацетате (50 мл) и раствор промывают водой (50 мл). Органический слой концентрируют, и неочищенный продукт хроматографируют на силикагеле,элюируя этилацетатом в гексане 0-25%, получая трет-бутиловый эфир 3-[3-(1,3-диоксо-1,3 дигидроизоиндол-2-ил)-пропил]-пиперидин-1-карбоновой кислоты (9,84 г, выход 94%). Перемешиваемый раствор этого промежуточного соединения (9,00 г, 24,2 ммоль) в этаноле (400 мл) обрабатывают гидразином (4,65 г, 145 ммоль). Смесь нагревают при 50 С в течение 16 ч, получая белую суспензию. При комнатной температуре суспензию быстро фильтруют и фильтрат концентрируют, получая масло,которое содержит небольшое количество твердого вещества. Эту смесь разбавляют в этаноле (10 мл) и диэтиловом эфире (50 мл), фильтруют и концентрируют, получая указанное в заглавии соединение в виде масла (5,0 г, выход 85%). Пример получения 54. Рацемический трет-бутиловый эфир 4-(3-аминопропил)-3 изопропилпиперазин-1-карбоновой кислоты(А) Получение рацемического трет-бутилового эфира 3-изопропилпиперазин-1-карбоновой кислоты Ди-трет-бутил дикарбонат (7,37 г, 33,8 ммоль) добавляют к перемешиваемому раствору рацемического 2-изопропилпиперазина (4,80 г, 37,5 ммоль) в безводном дихлорметане (50 мл) при 0 С, потом смесь перемешивают при комнатной температуре в течение 16 ч. После концентрирования и последующего очищения с помощью хроматографии на силикагеле, элюируя 2 М NH3/MeOH в дихлорметане 13%, указанное в заглавии соединение выделяют в виде масла (5,3 г, выход 62%).(В) Получение рацемического трет-бутилового эфира 4- (3-аминопропил)-3-изопропилпиперазин-1 карбоновой кислоты Используя способ получения 3-(4-изопропилпиперазин-1-ил)пропиламина, указанное в заглавии соединение синтезируют из рацемического трет-бутилового эфира 3-изопропилпиперазин-1-карбоновой кислоты и выделяют в виде желто-коричневого масла. Пример получения 55.(А) Получение метилового эфира 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты Используя способ получения метилового эфира 2-(2-хлорпиримидин-4-ил)бензо[b]тиофен-4 карбоновой кислоты, указанное в заглавии соединение синтезируют из метилового эфира бензо[b]тиофен-4-карбоновой кислоты и 2,4,5-трихлорпиримидина и выделяют в виде твердого вещества.(В) Получение метилового эфира 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты Перемешиваемую суспензию метилового эфира 2-(2,5-дихлорпиримидин-4-ил)-бензо[b]тиофен-4 карбоновой кислоты (440 мг, 1,30 ммоль) в 1,4-диоксане (10 мл) обрабатывают 3-(4-метилпиперазин-1 ил)пропиламином (610 мг, 3,90 ммоль) и диизопропилэтиламином (500 мг, 3,90 ммоль), полученную смесь нагревают при 90 С в атмосфере азота в течение 16 ч. После концентрирования и последующего очищения с помощью хроматографии на силикагеле, элюируя 2 М NH3/MeOH в дихлорметане 1-10%,указанное в заглавии соединение выделяют в виде твердого вещества (310 мг, выход 51%).(С) Получение три-гидрохлорида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин 4-илбензо[b]тиофен-4-карбоновой кислоты Водный 2 N LiOH (1,1 мл, 2,2 ммоль) добавляют к перемешиваемому раствору метилового эфира 25-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]-пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты (280 мг, 0,610 ммоль) в воде (3 мл), МеОН (6 мл) и ТГФ (12 мл). Смесь нагревают при 70 С в течение 2 ч. Одновременно при 70 С к раствору добавляют 5 N HCl (1 мл), потом раствор оставляют охлаждаться до комнатной температуры. После концентрирования желтое твердое вещество суспендируют в ТГФ (20 мл), обрабатывают ультразвуком, фильтруют и сушат, получая указанное в заглавии соединение в виде твердого вещества (320 мг, выход 94%). Пример получения 56. Диметиламид 2-[5-метил-2-(2-пиперидин-4-илэтиламино)пиримидин-4 ил]бензо[b]тиофен-6-карбоновой кислоты Перемешиваемую смесь диметиламида 2- (2-хлор-5-метилпиримидин-4-ил)бензо[b]тиофен-6 карбоновой кислоты (473 мг, 1,43 ммоль), трет-бутилового эфира 4-(2-аминоэтил)пиперидин-1 карбоновой кислоты (814 мг, 3,56 ммоль) и диизопропилэтиламина (0,747 мл, 4,29 ммоль) в 1,4-диоксане(5 мл) нагревают при 97 С в атмосфере азота в течение 2 дней. При комнатной температуре смесь концентрируют и неочищенный продукт хроматографируют на силикагеле, элюируя МеОН в дихлорметане 0-2%,получая трет-бутиловый эфир 4-2-[4-(6-диметилкарбамоил-бензо[b]тиофен-2-ил)-5 метилпиримидин-2-иламино]этилпиперидин-1-карбоновой кислоты. Промежуточное вещество потом- 19014426 депротектируют, растворяя его в дихлорметане (20 мл) и обрабатывая триэтилсиланом (0,9 мл) и TFA (4 мл). Полученный желтый раствор перемешивают при комнатной температуре в течение 1 ч. После концентрирования и последующей хроматографии на силикагеле элюируя 2,0 М NH3/MeOH в дихлорметане 3-12%, фракции, содержащие желаемый продукт, собирают и концентрируют, получая желтую пену. Эту пену растворяют в МеОН (20 мл), обрабатывают 0,5 N LiOH (20 мл) потом концентрируют, получая неочищенный продукт указанного в заглавии соединения в виде желтой пены. Это вещество используют для последующего восстановительного метилирования без дополнительного очищения. Пример 1. Три-гидрохлорид [4-(бензо[b]тиофен-2-ил)пиримидин-2-ил]-[3-(4-метилпиперазин-1 ил)пропил]амина 1-(3-Аминопропил)-4-метилпиперазин (3,02 г, 19,2 ммоль) добавляют к перемешиваемой суспензии 4-(бензо[b]тиофен-2-ил)-2-хлор-пиримидина (2,06 г, 8,34 ммоль) в безводном 1,4-диоксане (25 мл) при температуре окружающей среды в атмосфере азота. Полученную смесь нагревают на масляной бане при 95 С в течение 28 ч. Смесь концентрируют при температуре окружающей среды и очищают хроматографией на силикагеле, элюируя 2 М NH3/CH3OH в дихлорметане 0-6%, получая свободное основание указанного в заглавии соединения в виде белого твердого вещества (2,83 г, выход 92%). Полученное выше свободное основание (1,42 г, 3,86 ммоль) растворяют в метаноле (10 мл)/дихлорметане (15 мл). Несильный поток безводного газообразного HCl медленно барботируют через перемешиваемый раствор в течение 2 мин, потом полученный желтый раствор концентрируют, получая желтое твердое вещество. Желтое твердое вещество повторно суспендируют в метаноле (5 мл) , одновременно обрабатывая ультразвуком, смесь разбавляют диэтиловым эфиром (25 мл). После фильтрования и высушивания получают указанное в заглавии соединение в виде желтого твердого вещества (1,85 г,выход 100%). ES+ (m/z) 368 [M+Н]. Используя способы, подобные способу получения три-гидрохлорида [4-(бензо[b]тиофен-2-ил)пиримидин-2-ил]-[3-(4-метилпиперазин-1-ил)пропил]амина, следующие соединения синтезируют и выделяют в виде свободного основания или соли HCl: Пример 17. [4-(Бензо[b]тиофен-2-ил)-5-метилпиримидин-2-ил]-[3-(пиперазин-1-ил)пропил]амин трет-Бутиловый эфир 4-(3-аминопропил)пиперазин-1-карбоновой кислоты (261 мг, 1,07 ммоль) добавляют к перемешиваемой суспензии 4-(бензо[b]тиофен-2-ил)-2-хлор-5-метилпиримидина (140 мг,0,537 ммоль) и диизопропилэтиламина (140 мкл, 0,805 ммоль) в безводном 1,4-диоксане (3,5 мл) при температуре окружающей среды в атмосфере азота. Полученную смесь нагревают на масляной бане при 95 С в течение 36 ч. Смесь концентрируют при температуре окружающей среды и хроматографируют на силикагеле, элюируя 2 М NH3/CH3OH в дихлорметане 0-6%, получая трет-бутиловый эфир 4-3-[4(бензо[b]тиофен-2-ил)-5-метилпиримидин-2-ил]аминопропилпиперазин-1-карбоновой кислоты в виде белого твердого вещества (178 мг, выход 70%).TFA (1 мл) добавляют к перемешиваемому раствору полученного выше продукта (168 мг, 0,359 ммоль) и триэтилсилана (0,172 мл, 1,08 ммоль) в безводном 1,2-дихлорэтане (3 мл) при температуре окружающей среды в атмосфере азота. Полученный раствор оставляют перемешиваться в течение 8 часов. После концентрирования неочищенный продукт суспендируют в СН 3 ОН (5 мл)/дихлорметане (3 мл),потом обрабатывают 2,5 N гидроксидом лития (LiOH) (0,43 мл), потом хроматографируют на силикагеле,элюируя 2 М NH3/CH3OH в дихлорметане 5-20%, получая указанное в заглавии соединение в виде желтоватого твердого вещества (132 мг, выход 100%). ES+ (m/z) 368 [М+Н]. Пример 18. Тригидрохлорид [4-(бензо[b]тиофен-2-ил)-5-бромпиримидин-2-ил]-(2-пиперазин-1-илэтил)амина Используя способ получения [4-(бензо[b]тиофен-2-ил)-5-метилпиримидин-2-ил]-[3-(пиперазин-1 ил)пропил]амина, свободное основание указанного в заглавии соединения синтезируют из 4(бензо[b]тиофен-2-ил)-5-бром-2-хлорпиримидина в виде белого твердого вещества. Это основание легко превращают в три-гидрохлоридную соль. ES+ (m/z) 418 (79Br) и 420 (81Br) [М+Н]. Пример 19. Тригидрохлорид циклопропиламида 2-[2-(3-пиперазин-1-илпропиламино)-пиримидин 4-ил]бензо[b]тиофен-4-карбоновой кислоты(А) Получение метилового эфира бензо[b]тиофен-4-карбоновой кислоты Смесь 4-бромбензо[b]тиофена (20,0 г, 93,8 ммоль), Pd(ОАс)2 (4,26 г, 19,0 ммоль), 1,1'бис(дифенилфосфино)ферроцена (15,4 г, 27,8 ммоль) и триэтиламина (72,0 мл, 520 ммоль) в МеОН (422 мл)/диметилсульфоксиде (ДМСО) (638 мл) помещают в реакционный сосуд высокого давления объемом на 1 л. В колбе создают давление монооксида углерода (СО) (газ) 100 фунт/дюйм 2 (689,6 КПа), потом смесь нагревают при 80 С в течение 24 ч. Темную реакционную смесь концентрируют, выпариваяMeOH, потом ее выливают в 2,4 л ледяной воды с перемешиванием, получая суспензию. После фильтрования твердое вещество помещают в дихлорметан, и фильтрат экстрагируют дихлорметаном.- 21014426 Объединенный дихлорметановый раствор концентрируют, получая темную смолу, ее растворяют в дихлорметане (50 мл) и хроматографируют на силикагеле, элюируя дихлорметаном в гексанах 50-100%,получая указанное в заглавии соединение в виде желто-коричневого масла (15,2 г, выход 84%).(В) Получение метилового эфира 2-(2-хлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты Диизопропиламид лития (5,70 мл, 2M В ТГФ) ПО каплям добавляют к перемешиваемому раствору метилового эфира бензо[b]тиофен-4-карбоновой кислоты (2,00 г, 10,4 ммоль) и триизопропилбората(2,63 мл, 11,4 ммоль) в безводном ТГФ (20 мл) при -78 С в атмосфере азота. После завершения добавления смесь оставляют медленно нагреваться: в течение 1 ч до температуры окружающей среды, причем ее перемешивают в течение еще 1 ч. К смеси добавляют водный раствор Na2CO3 (2 М, 15,6 мл), потом добавляют 1,1'-бис(дифенилфосфино)ферроцен (318 мг, 0,570 ммоль), ацетат палладия(II) (129 мг, 0,570 ммоль) и 2,4-дихлорпиримидин (1,46 г, 10,4 ммоль). Реакционную смесь нагревают до кипения с обратным холодильником в течение 16 ч. ТГФ выпаривают при температуре окружающей среды, водный слой экстрагируют CHCl3 (100 мл 2) и объединенные слои концентрируют, получая темное твердое вещество. Твердое вещество растворяют в дихлорметане и очищают хроматографией на силикагеле, элюируя дихлорметаном в гексанах 50-100%, получая указанное в заглавии соединение в виде желтоватого твердого вещества (1,60 г, выход 51%).(С) Получение трет-бутилового эфира 4-3-[4-(4-метоксикарбонилбензо[b]тиофен-2-ил)пиримидин 2-иламино]пропилпиперазин-1-карбоновой кислоты Используя способ получения три-гидрохлорида [4-(бензо[b]тиофен-2-ил)пиримидин-2-ил]-[3-(4 метилпиперазин-1-ил)пропил]амина, указанное в заглавии соединение синтезируют из метилового эфира 2-(2-хлор-пиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты в виде твердого вещества (выход 74%).(D) Получение дигидрохлорида трет-бутилового эфира 4-3-[4-(4-карбоксибензо[b]тиофен-2 ил)пиримидин-2-иламино]пропилпиперазин-1-карбоновой кислоты Водный раствор LiOH (2,5 N, 2,0 мл) добавляют к перемешиваемому раствору трет-бутилового эфира 4-3-[4-(4-метоксикарбонилбензо[b]тиофен-2-ил)пиримидин-2-иламино]пропилпиперазин-1 карбоновой кислоты: (700 мг, 1,49 ммоль) в ТГФ (7 мл)/МеОН (4 мл), полученную смесь перемешивают при 40 С в течение 4 ч. При 40 С к реакционной смеси одной порцией добавляют 5 N HCl (2,1 мл). В пределах 2 мин смесь превращается в суспензию. После фильтрования и высушивания получают указанное в заглавии соединение в виде желтого твердого вещества (950 мг, выход 99%).(Е) Получение тригидрохлорида циклопропиламида 2-[2-(3-пиперазин-1-илпропиламино)пиримидин-4-ил]бензо[b]тиофен-4-карбоновой кислоты Диизопропилэтиламин (0,578 мл, 3,33 ммоль) и циклопропиламин (0,231 мл, 3,33 ммоль) последовательно добавляют к перемешиваемой суспензии дигидрохлорида трет-бутилового эфира 4-3-[4-(4 карбоксибензо[b]тиофен-2-ил)пиримидин-2-иламино]пропилпиперазин-1-карбоновой кислоты (950 мг,1,66 ммоль) в безводном DMF (10 мл). К смеси добавляют порошкообразный гексафторфосфат 1Hбензотриазол-1-илокситрис(диметиламино)фосфония (884 мг, 2,00 ммоль), полученную смесь оставляют перемешиваться при 50 С в течение 14 ч. Смесь концентрируют и хроматографируют на силикагеле,элюируя 2 M NH3/CH3OH в дихлорметане 1-5%, получая N-циклопропилкарбоксамид в виде желтоватого твердого вещества. Полученный выше N-циклопропилкарбоксамид растворяют в МеОН (40 мл)/дихлорметан (20 мл) и через перемешиваемый раствор несильным потоком барботируют безводный газообразный HCl в течение 3 мин. Теплый раствор закрывают стеклянной пробкой и перемешивают при температуре окружающей среды в течение ночи, получая желтую суспензию. После фильтрования и высушивания получают указанное в заглавии соединение в виде желтого твердого вещества (480 мг, выход 53%). ES+ (m/z) 437(А) Получение бензо[b]тиофен-4-карбоновой кислоты Несколько кристаллов йода добавляют к перемешиваемой суспензии магния (Mg) (4,79 г, 197 ммоль) в безводном ТГФ (100 мл) в атмосфере азота, потом по каплям добавляют раствор 4-бром-бензотиофена (40,0 г, 188 ммоль) в безводном ТГФ (150 мл). Сначала добавляют только 5% общего количества(приблизительно 1 мл) для начала реакции, потом добавляют остальное количество с такой скоростью,чтобы температура реакции составляла около 50-55 С. Добавление длится приблизительно 30 мин и в конце реакционную смесь нагревают при 50 С в течение 1 ч. Когда израсходуется большая часть Mg,реакционную смесь охлаждают до 23 С и в раствор барботируют газообразный CO2 (полученный из сухого льда в колбе). Эта реакция является экзотермической и температуру удерживают при приблизительно 23 С с помощью ледяной бани. Барботирование продолжают в течение 15-20 мин, пока не появляется обильный осадок. Реакционную смесь осторожно гасят водной 10% HCl при 0 С. Добавляют водный хлорид натрия, и смесь экстрагируют EtOAc. Органическую фазу экстрагируют водным 2 М гидроксидом натрия (NaOH), и водную фазу потом подкисляют водной 37% HCl до рН 1, получая суспензию. После фильтрования и высушивания получают указанное в заглавии соединение в виде белого твердого(В) Получение (4-карбоксибензо[b]тиофен-2-ил)бороновой кислоты н-Бутиллитий (2,5 М, 94 мл) по каплям добавляют к перемешиваемому раствору диизопропиламина(33,0 мл, 235 ммоль) в безводном ТГФ (300 мл) при -78 С в атмосфере азота. Через 30 мин добавляют раствор бензо[b]тиофен-4-карбоновой кислоты (20,0 г, 112 ммоль) в безводном ТГФ (300 мл). После завершения добавления реакционную смесь оставляют нагреваться до 0 С, причем смесь перемешивают в течение еще 2 ч. Реакционную смесь охлаждают до -30 С, потом смесь обрабатывают триизопропилборатом (65,0 мл, 282 ммоль). Охлаждающую баню потом удаляют и реакционную смесь оставляют нагреваться до температуры окружающей среды, при этом смесь осторожно гасят концентрированной HCl(200 мл). После выпаривания ТГФ образуется суспензия, твердое вещество собирают фильтрованием,дважды промывают водой (150 мл 2) и сушат, получая указанное в заглавии соединение в виде белого твердого вещества (20,0 г, выход 80%).(С) Получение 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты Водный раствор Na2CO3 (2 М, 500 мл) по каплям добавляют к перемешиваемому раствору (4 карбоксибензо[b]тиофен-2-ил)бороновой кислоты (56 г, 0,25 моль) и 2,4,6-трихлорпиримидина (42,1 г,0,230 моль) в диметиловом эфире этиленгликоля (620 мл) при комнатной температуре в атмосфере азота. После завершения добавления одной порцией добавляют PdCl2(PPh3)2 (5,31 г, 3% моль), потом реакционную смесь нагревают при 100 С в течение ночи. Смесь охлаждают до 10 С, потом порциями добавляют 37% HCl (150 мл), получая суспензию. После фильтрования и промывания водой (300 мл 3) твердое вещество сушат под вакуумом. Потом твердое вещество суспендируют в 1 л дихлорметана/этанола (10:1) и перемешивают в течение ночи. После повторения цикла фильтрования и высушивания, получают первую порцию указанного в заглавии соединения (28,0 г, выход 38%). Маточный раствор концентрируют, и остаток суспендируют в ацетоне (1 мл) и перемешивают в течение ночи. После фильтрования, твердое вещество повторно суспендируют в 200 мл дихлорметана/этанола (этанол) (3:1) и перемешивают в течение 2 ч. Дополнительные 5 г указанного в заглавии соединения получают после фильтрования и высушивания. Общий выход составляет 44%.(40 мл) при 0 С в атмосфере азота, получая раствор, потом последовательно добавляют циклопропиламин (0,570 мл, 8,23 ммоль) и порошкообразный гексафторфосфат 1 Н-бензотриазол-1 илокситрис(диметиламино)фосфония (3,64 г, 8,23 ммоль). Полученную смесь оставляют перемешиваться при 0 С в течение 2 ч, потом при температуре окружающей среды в течение 3 ч. К смеси небольшими порциями добавляют диэтиловый эфир (35 мл) смесь перемешивают в течение дополнительных 20 мин,потом фильтруют. После высушивания получают указанное в заглавии неочищенное соединение (2,45 г) в виде желто-коричневого твердого вещества. Его используют без дополнительного очищения.(Е) Получение тригидрохлорида циклопропиламида 2-5-хлор-2-[3-(4-метилпиперазин-1 ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты 1-(3-Аминопропил)-4-метилпиперазин (2,27 г, 14,4 ммоль) добавляют к перемешиваемой суспензии неочищенного циклопропиламида 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты(2,10 г, 5,77 ммоль) в безводном 1,4-диоксане (40 мл) при температуре окружающей среды в атмосфере азота. Полученную смесь нагревают при 95 С в течение 6 ч. После концентрирования твердый остаток повторно суспендируют в дихлорметане (40 мл)/СН 3 ОН (16 мл), потом его обрабатывают 2 N LiOH (2,89 мл) . Смесь обрабатывают ультразвуком, потом разделяют на силикагеле, элюируя 2 М NH3/CH3OH в дихлорметане 0-8%. Фракции, содержащие желаемый продукт, собирают и медленно концентрируют в вакууме, пока не получают суспензию объемом 10 мл. К суспензии небольшими порциями добавляют диэтиловый эфир (40 мл) при обработке ультразвуком. После фильтрования и высушивания получают светло-желтое твердое вещество (1,89 г, выход 68%). Полученное выше свободное основание растворяют в дихлорметане (80 мл)/МеОН (80 мл), потом барботируют несильный поток безводного газообразного HCl в течение 3 мин. Желтый раствор медленно концентрируют, пока не получают суспензию объемом 15 мл. К суспензии небольшими порциями добавляют диэтиловый эфир (70 мл) при обработке ультразвуком. После фильтрования и высушивания указанное в заглавии соединение получают в виде желтого твердого вещества (2,17 г, выход 94%). ES+(m/z) 485 (35Cl) и 487 (37Cl) [М+Н] . Используя способ получения тригидрохлорида циклопропиламида 2-5-хлор-2-[3-(4 метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты, следующие соединения могут быть получены и выделены в виде свободного основания или гидрохлоридной соли: Пример 41. Дигидрохлорид циклопропиламида 2-5-метил-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты Соляную кислоту (1,0 М, 0,306 мл) добавляют к перемешиваемой суспензии циклопропиламида 2- 25014426 5-метил-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты (71,2 мг, 0,153 ммоль) в МеОН (5 мл). Полученный раствор концентрируют на ротационном испарителе при 45 С, получая твердое вещество. После высушивания в вакууме при 45 С в течение приблизительно 2 ч получают указанное в заглавии соединение в виде твердого вещества (80,0 мг; выход 97%).ES+ (m/z) 465 [М+Н]. Пример 42. Дигидрохлорид циклопропиламида 2-5-хлор-2-[3-(4-метилпиперазин-1 ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты Используя способ получения дигидрохлорида циклопропиламида 2-5-метил-2-[3-(4 метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты, указанное в заглавии соединение синтезируют из циклопропиламида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты и получают в виде твердого вещества. ES+ (m/z) 485 (35Cl) и 487 (37Cl) [М+Н] . Пример 43. Тригидрохлорид циклопропиламида 2-[5-хлор-2-(3-пиперазин-1 илпропиламино)пиримидин-4-ил]бензо[b]тиофен-4-карбоновой кислоты Используя способ получения тригидрохлорида [4-(бензо[b]тиофен-2-ил)пиримидин-2-ил]-[3-(4 метилпиперазин-1-ил)пропил]амина, указанное в заглавии соединение синтезируют из циклопропиламида 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты и трет-бутилового эфира 4-(3 аминопропил)пиперазин-1-карбоновой кислоты и выделяют в виде желтого твердого вещества (выход 43%). ES+ (m/z) 471 (35Cl) и 473 (37Cl) [М+Н] . Пример 44. Тригидрохлорид циклопропиламида 2-[5-метил-2-(3-пиперазин-1-ил-пропиламино)пиримидин-4-ил]бензо[b]тиофен-4-карбоновой кислоты Используя способ получения три-гидрохлорида циклопропиламида 2-[5-хлор-2-(3-пиперазин-1 илпропиламино)пиримидин-4-ил]бензо[b]тиофен-4-карбоновой кислоты, указанное в заглавии соединение синтезируют в виде желтого твердого вещества. ES+ (m/z) 451 [М+Н]. Используя способ получения тригидрохлорида циклопропиламида 2-5-хлор-2-[3-(4 метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты, следующие соединения синтезируют и выделяют в виде свободного основания или в виде гидрохлоридной соли: Используя способ синтеза тригидрохлорида циклопропиламида 2-[5-хлор-2-(3-пиперазин-1- 26014426 илпропиламино)пиримидин-4-ил]бензо[b]тиофен-4-карбоновой кислоты, указанное в заглавии соединение синтезируют из циклопропиламида 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты и трет-бутилового эфира 5-(2-аминоэтил)гексагидропирроло[3,4-с]пиррол-2-карбоновой кислоты и выделяют в виде желтого твердого вещества. ES+ (m/z) 483(35Cl) и 485 (37Cl) [М+Н] . Пример 51. Тригидрохлорид амида 2-5-хлор-2-[3-(4-метилпиперазин-1 ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты(А) Получение [бис-(4-метоксифенил)метил]амида 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-4 карбоновой кислоты Используя способ, получения, приведенный в примере получения D тригидрохлорида циклопропиламида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4 карбоновой кислоты, указанное в заглавии соединение получают из 2-(2,5-дихлорпиримидин-4 ил)бензо[b]тиофен-4-карбоновой кислоты и бис-(4-метоксифенил)метиламина в виде желто-коричневого твердого вещества.(В) Получение [бис-(4-метоксифенил)метил]амида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты Используя способ получения, приведенный в примере получения (Е) тригидрохлорида циклопропиламида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4 карбоновой кислоты, указанное в заглавии соединение получают из [бис-(4-метоксифенил)метил]амида 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты и 1-(3-аминопропил)-4 метилпиперазина в виде белого твердого вещества (выход 65%).(С) Получение тригидрохлорида амида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислотыTFA (3 мл) добавляют к перемешиваемому раствору полученного выше продукта (634 мг, 0,946 ммоль) и триэтилсилана (0,755 мл, 4,73 ммоль) в безводном дихлорметане (10 мл) при температуре окружающей среды в атмосфере азота. Полученный раствор оставляют перемешиваться в течение 4 ч. После концентрирования неочищенный продукт суспендируют в дихлорметане/МеОН (2:1), потом обрабатывают 2,5 N LiOH (1,42 мл), потом продукт хроматографируют на силикагеле, элюируя 2 М NH3/MeOH в дихлорметане 0-6%, получая свободное основание указанного в заглавии соединения в виде белого твердого вещества (420 мг). Полученное выше свободное основание растворяют в МеОН (35 мл)/дихлорметане (35 мл), и несильный поток безводного газообразного HCl барботируют через перемешиваемый раствор в течение 2 мин. Желтый раствор концентрируют до 5 мл суспензии, потом ее обрабатывают небольшими порциямиEtO2 (20 мл). После фильтрования и высушивания указанное в заглавии соединение получают в виде желтого твердого вещества (510 мг, выход 97%) . ES+ (m/z) 445 (35Cl) и 447 (37Cl) [М+Н]. Пример 52. Тригидрохлорид метиламида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты Используя способ получения тригидрохлорида циклопропиламида 2-5-хлор-2-[3-(4 метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты, указанное в заглавии соединение синтезируют и выделяют в виде желтого твердого вещества. ES+ (m/z) 459 (35Cl) и 461 (37Cl) [М+Н]. Используя способ получения, преведенный в примере получения (Е) тригидрохлорида циклопропиламида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4 карбоновой кислоты, следующие соединения синтезируют из циклопропиламида 2-(5-бром-2 хлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты и соответствующих 3-(пиперазин-1-ил)пропиламинов и выделяют в виде желтой гидрохлоридной соли: Используя способы получения три-гидрохлорида циклопропиламида 2-5-хлор-2-[3-(4 метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты и тригидрохлорида циклопропиламида 2-[5-хлор-2-(3-пиперазин-1-илпропиламино)пиримидин-4 ил]бензо[b]тиофен-4-карбоновой кислоты, следующие соединения синтезируют в виде ди- 27014426 гидрохлоридной соли из циклопропиламидов 2-(2-хлорпиримидин-4-ил)бензо[b]тиофен-4-карбоновой кислоты и соответствующих 3-пиперидин-4-ил-пропиламинов: Пример 58. Циклопропиламид 2-5-хлор-2-[2-(3(S)диметиламинопирролидин-1-ил)этиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты Используя способ получения тригидрохлорида циклопропиламида 2-5-хлор-2-[3-(4 метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты, указанное в заглавии соединение синтезируют и выделяют в виде белого твердого вещества. ES + (m/z) 485 (35Cl) и 487 (37Cl) [М+Н]. Пример 59. Тригидрохлорид циклопропиламида 2-5-хлор-2-[3-(4-метилпиперазин-1 ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты(А) Получение метилового эфира 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-6-карбоновой кислоты Используя способы получения, приведенные в примерах получения (А) и (В) тригидрохлорида циклопропиламида 2-[2-(3-пиперазин-1-илпропиламино)пиримидин-4-ил]бензо[b]тиофен-4-карбоновой кислоты, указанное в заглавии соединение синтезируют в две стадии из 6-бром-бензо[b]тиофена и 2,4,5 трихлорпиримидина, и его выделяют в виде белого твердого вещества.(В) Получение метилового эфира 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты Используя способ получения, приведенный в примере получения (Е) тригидрохлорида циклопропиламида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4 карбоновой кислоты, указанное в заглавии соединение синтезируют из метилового эфира 2-(2,5-дихлорпиримидин-4-ил)бензо[b]тиофен-6-карбоновой кислоты и выделяют в виде белого твердого вещества.(С) Получение три-гидрохлорида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты Водный раствор LiOH (2,0 M, 2,8 мл) добавляют к перемешиваемой суспензии метилового эфира 25-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты (0,840 г, 1,80 ммоль) в МеОН (20 мл)/ТГФ (20 мл)/Н 2 О (6 мл), полученную смесь нагревают при 70 С в течение 4,5 ч. Одновременно нагревая раствор, одной порцией добавляют 5,0 N HCl (3,4 мл), потом раствор оставляют охлаждаться до температуры окружающей среды, получая суспензию. После фильтрования твердое вещество сушат в вакуумном сушильном шкафу при 60 С в течение 4 ч, получая указанное в заглавии соединение (0,64 г, выход 67%) . ES+ (m/z) 446 (35Cl) и 448 (37Cl) [М+Н].(D) Получение тригидрохлорида циклопропиламида 2-5-хлор-2-[3-(4-метилпиперазин-1 ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты Диизопропилэтиламин (0,210 мл, 1,20 ммоль), циклопропиламин (0,090 мл, 1,3 ммоль) и гексафторфосфат (бензотриазол-1-илокси)трис(диметиламино)фосфония (205 мг, 0,460 ммоль) последовательно добавляют к перемешиваемой суспензии тригидрохлорида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты (195 мг, 0,400 ммоль) и LiCl (187 мг, 4,40 ммоль) в DMF (4 мл) при температуре окружающей среды в атмосфере азота, полученную смесь нагревают при 50 С в течение 20 ч. После охлаждения до температуры окружающей среды растворитель удаляют и остаток хроматографируют на силикагеле, элюируя 2 М NH3/MeOH в дихлорметане 0-8%,получая свободное основание указанного в заглавии соединения (97 мг). ES+ (m/z) 485 (35Cl) и 487 (37Cl)[М+Н]. Используя способ получения, приведенный в примере получения (Е) тригидрохлорида циклопропиламида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4 карбоновой кислоты, свободное основание превращают в три-гидрохлоридную соль в виде желтого твердого вещества. Используя способ получения тригидрохлорида циклопропиламида 2-5-хлор-2-[3-(4- 28014426 метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты, следующие соединения синтезируют из тригидрохлорида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты и аминов, и тригидрохлориды выделяют в виде желтых твердых веществ.(А) Получение [бис-(4-метоксифенил)метил]амида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты Используя способ получения, приведенный в примере получения D тригидрохлорида циклопропиламида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6 карбоновой кислоты, указанное в заглавии соединение синтезируют из три-гидрохлорида 2-5-хлор-2-[3(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты и бис-(4 метоксифенил)метиламина и выделяют в виде твердого вещества (выход 78%).(В) Получение тригидрохлорида амида 2-5-хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты Используя способ получения, приведенный в примере получения (С) три-гидрохлорида амида 2-5 хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карбоновой кислоты, указанное в заглавии соединение синтезируют из [бис-(4-метоксифенил)метил]амида 2-5-хлор-2-[3(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты и выделяют в виде желтого твердого вещества. ES+ (m/z) 445 (35Cl) и 447 (37Cl) [М+Н]. Пример 63. Тригидрохлорид амида 2-5-метил-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты(А) Получение тригидрохлорида 2-5-метил-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты Используя способы получения тригидрохлорида циклопропиламида 2-5-хлор-2-[3-(4 метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты, указанное в заглавии соединение синтезируют из метилового эфира бензо[b]тиофен-6-карбоновой кислоты и выделяют в виде твердого вещества. ES+ (m/z) 426 [М+Н].(В) Получение тригидрохлорида амида 2-5-метил-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты Используя способ получения, приведенный в примере получения (С) тригидрохлорида амида 2-5 хлор-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-4-карболовой кислоты, указанное в заглавии соединение синтезируют из тригидрохлорида 2-5-метил-2-[3-(4 метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты и выделяют в виде желтого твердого вещества. ES+ (m/z) 425 [М+Н]. Используя способ получения тригидрохлорида амида 2-5-метил-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4-илбензо[b]тиофен-6-карбоновой кислоты, следующие соединения синтезируют из тригидрохлорида 2-5-метил-2-[3-(4-метилпиперазин-1-ил)пропиламино]пиримидин-4 илбензо[b]тиофен-6-карбоновой кислоты и 2-аминогетероциклов и тригидрохлориды выделяют в виде желтых твердых веществ.
МПК / Метки
МПК: C07D 409/04, A61P 19/02, A61P 33/00, A61P 11/00, A61K 31/506
Метки: пиримидинил, соединения, бензотиофеновые
Код ссылки
<a href="https://eas.patents.su/30-14426-pirimidinil-benzotiofenovye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Пиримидинил бензотиофеновые соединения</a>
Предыдущий патент: Терапевтические соединения
Следующий патент: Соединение бициклического циннамида
Случайный патент: Способы получения мембранных везикул












