Новые пиперазиновые производные диалкилоксиндолов
Номер патента: 14236
Опубликовано: 29.10.2010
Авторы: Паллаги Каталин, Мезеи Тибор, Харсинг Ласло Габор, Левелеки Чилла, Мориц Кристина, Гиглер Габор, Гачальи Иштван, Капиллерне Дежёфи Рита, Сенаши Габор, Флориан Эндрене, Шимиг Дьюла, Вольк Балаж, Баркоци Йожеф, Эдьед Андраш, Сираи Нора, Леваи Дьёрдь
Формула / Реферат
1. Производные 3,3-диалкилиндол-2-она общей формулы (I)
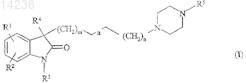
где R1обозначает водород, галоген, алкил, содержащий 1-7 атом(ов) углерода, или сульфонамидо;
R2 представляет собой водород или галоген;
R3 обозначает водород, алкил, содержащий 1-7 атом(ов) углерода, необязательно несущий бензильный или хлорфениловый заместитель, или бензил или хлорфенил, необязательно несущий один или два галогеновых заместителя;
R4 обозначает алкил, содержащий 1-7 атом(ов) углерода;
R5 обозначает группу общей формулы (IIa) или (IIb)
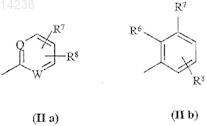
где Q и W, каждый, представляют собой азот или СН;
R6, R7и R8, каждый, обозначают водород, галоген, трифторметил, алкил или алкокси, содержащие 1-7 атом(ов) углерода; или
R6 и R7вместе представляют собой этилендиокси;
m обозначает 0, 1, или 2;
а представляет собой простую, двойную или тройную связь;
n обозначает 0, 1 или 2;
при условии, что, когда m обозначает 0, n отлично от 0;
и их фармацевтически приемлемые соли присоединения кислоты.
2. Производные 3,3-диалкилиндол-2-она общей формулы (I),
где R1обозначает водород, галоген, алкил, содержащий 1-7 атом(ов) углерода, или сульфонамидо;
R2 представляет собой водород или галоген;
R3 представляет собой водород;
R4 обозначает этил или 2-метилпропил;
R5 обозначает группу общей формулы (IIa) или (IIb), где Q обозначает азот, a W обозначает СН;
R6, R7и R8, каждый, обозначают водород, галоген или алкокси, содержащий 1-7 атом(ов) углерода; или
R6 и R7вместе представляют собой этилендиокси;
m обозначает 0 или 1;
а представляет собой простую связь;
n обозначает 1;
и их фармацевтически приемлемые соли присоединения кислоты.
3. Соединение по п.1, выбранное из
5-хлор-3-{3-[4-(3-хлорфенил)пиперазин-1-ил]пропил}-3-этил-1,3-дигидро-2H-индол-2-она,
3-{4-[4-(3-хлорфенил)пиперазин-1-ил]бутил}-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-она,
5,7-дихлор-3-{4-[4-(4-хлорфенил)пиперазин-1-ил]бутил}-3-этил-1,3-дигидро-2Н-индол-2-она,
3-{4-[4-(4-хлорфенил)пиперазин-1-ил]бутил}-3-этил-1,3-дигидро-2H-индол-2-она,
3-{4-[4-(4-хлорфенил)пиперазин-1-ил]бутил}-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-она,
3-{4-[4-(3-хлорфенил)пиперазин-1-ил]бутил}-3-этил-1,3-дигидро-2Н-индол-2-он-5-сульфонамида,
3-{4-[4-(2,3-дигидробензо[1,4]диоксин-5-ил)пиперазин-1-ил]бутил}-3-этил-1,3-дигидро-2Н-индол-2-она,
3-{4-[4-(2,3-дигидробензо[1,4]диоксин-5-ил)пиперазин-1-ил]бутил}-3-изобутил-1,3-дигидро-2Н-индол-2-она,
3-этил-3-{4-[4-(2-метоксифенил)пиперазин-1-ил]бутил}-1,3-дигидро-2Н-индол-2-она
и их фармацевтически приемлемых солей присоединения кислоты.
4. 5-Хлор-3-{3-[4-(3-хлорфенил)пиперазин-1-ил]пропил}-3-этил-1,3-дигидро-2Н-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты.
5. 3-{4-[4-(3-Хлорфенил)пиперазин-1-ил]бутил}-3-этил-5-фтор-1,3-дигидро-2H-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты.
6. 5,7-Дихлор-3-{4-[4-(4-хлорфенил)пиперазин-1-ил]бутил}-3-этил-1,3-дигидро-2H-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты.
7. 3-{4-[4-(4-Хлорфенил)пиперазин-1-ил]бутил}-3-этил-1,3-дигидро-2Н-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты.
8. 3-{4-[4-(4-Хлорфенил)пиперазин-1-ил]бутил}-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты.
9. 3-{4-[4-(3-Хлорфенил)пиперазин-1-ил]бутил}-3-этил-1,3-дигидро-2Н-индол-2-он-5-сульфонамид и его фармацевтически приемлемые соли присоединения кислоты.
10. 3-{4-[4-(2,3-Дигидробензо[1,4]диоксин-5-ил)пиперазин-1-ил]бутил}-3-этил-1,3-дигидро-2H-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты.
11. 3-{4-[4-(2,3-Дигидробензо[1,4]диоксин-5-ил)пиперазин-1-ил]бутил}-3-изобутил-1,3-дигидро-2H-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты.
12. 3-Этил-3-{4-[4-(2-метоксифенил)пиперазин-1-ил]бутил}-1,3-дигидро-2H-индол-2-он и его фармацевтически приемлемые соли присоединения кислоты.
13. Фармацевтические композиции, пригодные для лечения или профилактики расстройств центральной нервной системы, связанных с активностью 5-HT2C и a1 рецепторов, содержащие в качестве активного ингредиента, по меньшей мере, соединение общей формулы (I) по любому из пп.1-12 или его фармацевтически приемлемую соль присоединения кислоты в смеси с одним или более носителем(ями) или вспомогательным(и) агентом(ами).
14. Фармацевтические композиции по п.13, где расстройства центральной нервной системы выбраны из депрессии, шизофрении, аффективных расстройств, социальной фобии, мании, ухудшения умственных способностей, удара, деменции, разрушения клеток в некоторых отделах центральной нервной системы, болезни Альцгеймера, стресса, желудочно-кишечных заболеваний, сердечно-сосудистых заболеваний, почечной недостаточности, шума в ушах или тугоухости.
15. Фармацевтические композиции по п.13 или 14, включающие в качестве активного ингредиента 5-хлор-3-{3-[4-(3-хлорфенил)пиперазин-1-ил]пропил}-3-этил-1,3-дигидро-2Н-индол-2-он, 3-{4-[4-(3-хлорфенил)пиперазин-1-ил]бутил}-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-он, 5,7-дихлор-3-{4-[4-(4-хлорфенил)пиперазин-1-ил]бутил}-3-этил-1,3-дигидро-2Н-индол-2-он, 3-{4-[4-(4-хлорфенил)пиперазин-1-ил]бутил}-3-этил-1,3-дигидро-2H-индол-2-он, 3-{4-[4-(4-хлорфенил)пиперазин-1-ил]бутил}-3-этил-5-фтор-1,3-дигидро-2Н-индол-2-он, 3-{4-[4-(3-хлорфенил)пиперазин-1-ил]бутил}-3-этил-1,3-дигидро-2Н-индол-2-он-5-сульфонамид, 3-{4-[4-(2,3-дигидробензо[1,4]диоксин-5-ил)пиперазин-1-ил]бутил}-3-этил-1,3-дигидро-2H-индол-2-он, 3-{4-[4-(2,3-дигидробензо[1,4]диоксин-5-ил)пиперазин-1-ил]бутил}-3-изобутил-1,3-дигидро-2Н-индол-2-он, 3-этил-3-{4-[4-(2-метоксифенил)пиперазин-1-ил]бутил}-1,3-дигидро-2Н-индол-2-он или их фармацевтически приемлемые соли присоединения кислоты в смеси с одним или более носителем(ями) или вспомогательным агентом(ами).
16. Способ получения соединения по п.1, при котором соединение общей формулы (III)
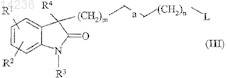
где R1, R2, R3, R4, m, n и а являются такими, как указано выше, a L обозначает уходящую группу, представляющую собой группу алкилсульфонилокси, в которой алкил представляет собой насыщенную углеводородную группу с прямой или разветвленной цепью, содержащую от 1 до 7 атомов углерода, или группу п-толуолсульфонилокси, или атом галогена, подвергают взаимодействию с пиперазиновым производным общей формулы (IV)
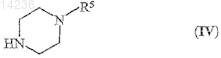
где R5 является таким, как указано выше, в присутствии агента, связывающего кислоту.
17. Способ по п.16, при котором продукт, полученный как определено в п.15, и в котором R2 является водородом, галогенируют, или высвобождают свободное основание продукта из его соли, или превращают его в фармацевтически приемлемую соль присоединения органической или неорганической кислоты.
18. Способ получения соединения по п.1, при котором соединение общей формулы (VI)
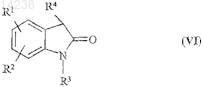
где R1, R2, R3и R4 являются такими, как указано выше, подвергают взаимодействию с соединением общей формулы (VII)
![]()
где m, n и а являются такими, как указано выше, а обозначает простую, двойную или тройную связь и L обозначает уходящую группу, представляющую собой группу алкилсульфонилокси, в которой алкил представляет собой насыщенную углеводородную группу с прямой или разветвленной цепью, содержащую от 1 до 7 атомов углерода, или группу п-толуолсульфонилокси, или атом галогена, в присутствии сильного основания.
19. Способ по п.18, при котором продукт, полученный как определено в п.17, и в котором R2является водородом, галогенируют, или высвобождают свободное основание продукта из его соли, или превращают его в фармацевтически приемлемую соль присоединения органической или неорганической кислоты.
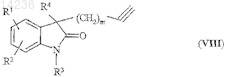
20. Способ получения соединения по п.1, при котором для получения соединений общей формулы (I), где n обозначает 1 и а обозначает тройную связь, осуществляют взаимодействие соединения общей формулы (VIII)
где R1, R2, R3, R4 и m являются такими, как указано выше, с формальдегидом, необязательно превращают полученное таким образом соединение общей формулы (III), где L обозначает гидрокси, в соединение общей формулы (III), L обозначает атом галогена или группу алкилсульфонилокси, в которой алкил представляет собой насыщенную углеводородную группу с прямой или разветвленной цепью, содержащую от 1 до 7 атомов углерода, или группу п-толуолсульфонилокси, и осуществляют взаимодействие полученного таким образом соединения общей формулы (III), где а обозначает тройную связь и n обозначает 1, с соединением общей формулы (IV) в присутствии сильного основания.
21. Способ по п.20, при котором продукт, полученный как определено в п.19, и который содержит R2, являющийся водородом, галогенируют, или высвобождают свободное основание продукта из его соли, или превращают его в фармацевтически приемлемую соль присоединения органической или неорганической кислоты.
22. Способ получения соединения по п.1, при котором для получения соединений общей формулы (I), где R1, R2, R3, R4, R5, m и n являются такими, как указано выше, и а обозначает простую или двойную связь, соответствующее соединение общей формулы (I), где а обозначает тройную связь, подвергают восстановлению.
23. Способ по п.22, при котором продукт, полученный как определено в п.21, и который содержит R2, являющийся водородом, галогенируют, или высвобождают свободное основание продукта из его соли, или превращают его в фармацевтически приемлемую соль присоединения органической или неорганической кислоты.
24. Способ получения соединения по п.1, при котором для получения соединений общей формулы (I), где R1, R2, R3, R4, R5, m и n являются такими, как указано выше, и а обозначает простую связь, соответствующее соединение общей формулы (I), где а обозначает двойную или тройную связь, подвергают восстановлению.
25. Способ по п.24, при котором продукт, полученный как определено в п.23, и который содержит R2, являющийся водородом, галогенируют, или высвобождают свободное основание продукта из его соли, или превращают его в фармацевтически приемлемую соль присоединения органической или неорганической кислоты.
26. Применение соединений общей формулы (I) по любому из пп.1-12 для изготовления лекарственного средства, пригодного для лечения или профилактики расстройств центральной нервной системы, связанных с активностью 5-HT2Cи a1рецепторов.
27. Применение по п.26, где расстройство центральной нервной системы выбрано из депрессии, шизофрении, аффективных расстройств, социальной фобии, мании, ухудшения умственных способностей, удара, деменции, разрушения клеток в некоторых отделах центральной нервной системы, болезни Альцгеймера, стресса, желудочно-кишечных заболеваний, сердечно-сосудистых заболеваний, почечной недостаточности, шума в ушах или тугоухости.
28. Способ производства фармацевтического препарата, подходящего для лечения или профилактики расстройств центральной нервной системы, связанных с активностью 5-HT2C и a1 рецепторов, при котором смешивают по меньшей мере одно соединение общей формулы (I) по любому из пп.1-12 или его фармацевтически приемлемую соль присоединения кислоты с фармацевтическим носителем и необязательно другим вспомогательным агентом и приводят смесь в галенову форму.
29. Способ по п.28, где расстройство центральной нервной системы, в частности депрессии, тревоги, шизофрении, аффективных расстройств, социальной фобии, мании, ухудшения умственных способностей, удара, деменции, болезни Альцгеймера, стресса, желудочно-кишечных расстройств, сердечно-сосудистых заболеваний, почечной недостаточности, шума в ушах или тугоухости.
30. Способ лечения или профилактики расстройств центральной нервной системы, связанных с активностью 5-HT2C и a1рецепторов, при котором пациенту, нуждающемуся в таком лечении, вводят эффективное количество фармацевтической композиции, содержащей по меньшей мере одно соединение общей формулы (I) или его фармацевтически приемлемую соль присоединения органической или неорганической кислоты.
31. Способ по п.30, где заболевание центральной нервной системы выбрано из депрессии, тревоги, шизофрении, аффективных расстройств, социальной фобии, мании, ухудшения умственных способностей, удара, деменции, гибели клеток в некоторых отделах центральной нервной системы, болезни Альцгеймера, стресса, желудочно-кишечных расстройств, сердечно-сосудистых заболеваний, почечной недостаточности, шума в ушах или тугоухости.
32. Соединения общей формулы (III),
где R1представляет собой водород, галоген, алкил, содержащий 1-7 атом(ов) углерода, или сульфонамидо;
R2 обозначает водород или галоген;
R3 обозначает водород, алкил, содержащий 1-7 атом(ов) углерода, необязательно несущий бензильный или хлорфениловый заместитель, или бензил или хлорфенил, необязательно несущий один или два галогеновых заместителя;
R4 обозначает алкил, содержащий 1-7 атом(ов) углерода;
L обозначает уходящую группу, представляющую собой группу алкилсульфонилокси, где алкил представляет собой насыщенную углеводородную группу с прямой или разветвленной цепью, содержащую от 1 до 7 атомов углерода, или группу п-толуолсульфонилокси, или атом галогена;
m и n обозначают 0, 1, или 2;
при условии, что, когда m обозначает 0, n отлично от 0;
а обозначает простую, двойную или тройную связь;
и их соли присоединения кислоты.
33. Способ получения соединений общей формулы (III), где заместители указаны выше, при котором осуществляют взаимодействие соединения общей формулы (V)
![]()
где L, a, m и n являются такими, как указано выше, и L' обозначает уходящую группу или группу, которая может быть превращена в уходящую группу, с соединением общей формулы (VI) в присутствии сильного основания.
Текст
НОВЫЕ ПИПЕРАЗИНОВЫЕ ПРОИЗВОДНЫЕ ДИАЛКИЛОКСИНДОЛОВ Настоящее изобретение относится к новым 3,3-двузамещенным производным индол-2-она общей формулы (I), пригодным для лечения или профилактики заболеваний центральной нервной системы, желудочно-кишечного тракта и сердечно-сосудистой системы. Вольк Балаж, Баркоци Йожеф, Шимиг Дьюла, Мезеи Тибор, Капиллерне Дежфи Рита, Флориан Эндрене, Гачальи Иштван,Паллаги Каталин, Гиглер Габор, Леваи Дьрдь, Мориц Кристина, Левелеки Чилла, Сираи Нора, Сенаши Габор, Эдьед Андраш, Харсинг Ласло Габор (HU) 014236 Область изобретения Изобретение относится к новым 3,3-двузамещенным производным индол-2-она, способу их получения, фармацевтическим композициям, содержащим указанные новые производные индол-2-она, и применению указанных соединений для лечения заболеваний. Конкретней настоящее изобретение относится к новым 3,3-двузамещенным производным индол-2 она общей формулы (I)R2 обозначает водород или галоген;R3 обозначает водород, алкил, содержащий 1-7 атом(ов) углерода, возможно несущий арильный заместитель или арил, возможно несущий один или два галогеновых заместителя;R5 обозначает группу общей формулы (IIa) или (IIb) где Q и W, каждый, обозначают азот или СН;m обозначает 0, 1, или 2; а обозначает простую, двойную или тройную связь;n обозначает 0, 1 или 2; при условии, что, когда m обозначает 0, n отлично от 0; и их фармацевтически приемлемым солям присоединения кислоты. Описание предшествующего уровня техники В патенте США 4452808 раскрыты производные 4-аминоалкилиндол-2-она, обладающие избирательной активностью в отношении D2 рецептора. Эти соединения могут быть использованы для лечения гипертензии. Одно из соединений, предложенных в этом патенте, а именно 4-[2-(ди-N-пропиламино)этил]-2(3 Н)индолон, применяют для клинического лечения болезни Паркинсона. В европейском патенте 281309 предложены производные индол-2-она, несущие арилпиперазинил-алкильный заместитель в положении 5, которые могут быть применены для лечения психотических состояний. Одно из соединений, описанных в этом патенте, а именно 5-[2-[4-(1,2-бензизотиазол-3-ил)-1 пиперазинил]этил]-6-хлор-1,3-дигидро-2 Н-индол-2-он, проявляет свою активность путем взаимодействия с D2, 5-HT1A и 5-НТ 2 рецепторами и применяются при клиническом лечении в качестве антипсихотического средства. В европейском патенте 376607 раскрыты производные индол-2-она, замещенные в положении 3 алкилпиперазинил-арильной группой, которые проявляют свою активность в отношении 5-НТ 1 А рецепторов и пригодны для лечения расстройств центральной нервной системы. В международной публикации WO 98/008816 раскрыты производные индол-2-она, содержащие замещенную алкилпиперазинильную, замещенную алкилпиперидинильную или алкилциклогексильную группу в положении 3. Эти соединения проявляют психотропное действие. Ускорение социально-технического развития в XX в. постоянно заставляет людей адаптироваться,что в отрицательных случаях может привести к возникновению адаптационных расстройств. Адаптационные расстройства составляют важный фактор риска при развитии заболеваний умственного или психосоматического происхождения, таких как анксиолитический синдром, стресс, депрессия, шизофрения,расстройства органов чувств, желудочно-кишечные заболевания, сердечно-сосудистые заболевания, почечные нарушения. Для лечения вышеуказанных клинических проявлений наиболее широко применяют фармацевтические средства, проявляющие свое действие в отношении бензодиазепиновой системы (например, диазе-1 014236 пам) или на 5-HT-1A рецепторы в центральной нервной системе (например, буспирон, зипразидон). В случае психосоматических заболеваний анксиолитическое лечение часто дополняют введением фармацевтических средств, проявляющих противогипертензивное (действующих на 1 или 2 рецепторы), или противоязвенное (антагонист H1-рецептора) действие. Нейролептики бензодиазепинового типа, тем не менее, имеют несколько неблагоприятных побочных эффектов. Они обладают сильным седативным действием, вызывают уменьшение способности концентрироваться и памяти и обладают эффектом мышечной релаксации. Указанные побочные эффекты негативно влияют на качество жизни пациента, уменьшая объем применения таких фармацевтических средств. Фармацевтические средства, действующие на 5-HT1A рецепторы, до настоящего времени применяемые при лечении, тем не менее, обладают несколькими недостатками и нежелательными побочными эффектами. Недостаток заключается в том, что нейролептическое действие может быть достигнуто только после лечения, которое длится по меньшей мере 10-14 суток. Кроме того, после исходного введения возникает нейролептическое действие. Относительно побочных эффектов часто наблюдают появление сонливости, дремоты, головокружения, галлюцинаций, головной боли, когнитивных расстройств или тошноты. Такие эффекты фармацевтических средств приводят к тому, что взаимодействие между лечащими врачами и пациентами существенно затрудняется, поскольку пациенты уверены, что ухудшение их симптомов является следствием введения лекарства. Помимо стресса, возникающего при адаптации к окружающей среде, еще одна существенная проблема современных сообществ заключается в быстром старении населения. Благодаря результатам современной медицинской науки ожидаемая продолжительность жизни увеличивается, и количество заболеваний, возникающих вследствие старения или развивающихся в преклонном возрасте, в частности множество умственных заболеваний, резко возрастает. Решение задачи лечения болезни Альцгеймера,сосудистых деменций и старческой деменции становится социальной проблемой. Еще одно следствие процессов старения заключается в значительном увеличении количества расстройств слуха. В соответствии со статистикой Всемирной организации здравоохранения (ВОЗ) в 2001 году 250 млн людей страдали от умеренной или тяжелой дисфункции слуха. Старческие нарушения слуха могут быть обнаружены у 10 и 25% населения в возрасте 45-55 лет и 65-75 лет соответственно. В результате перечисленных процессов существует значительная потребность в новых и эффективных фармацевтических средствах, обеспечивающих более эффективное лечение этих заболеваний по сравнению со средствами, существующими в настоящее время. Краткое изложение сущности изобретения Цель настоящего изобретения заключается в разработке фармацевтических ингредиентов, лишенных указанных выше недостатков и нежелательных побочных эффектов, характерных для активных агентов, связывающихся с 5-НТ 1 А рецепторами, и которые в то же самое время могут быть использованы для лечения расстройств центральной нервной системы. Изобретение основано на обнаружении того, что 3,3-диалкилзамещенные производные индол-2-она общей формулы (I) обладают значительным нейролептическим действием, но неожиданно, в отличие от соединений предшествующего уровня техники, содержащих похожую структуру, не связываются с 5-НТ 1 А рецепторами. В качестве благоприятного следствия соединения по изобретению лишены вышеперечисленных побочных эффекторов соединений, связывающихся с указанными рецепторами. Кроме того, неожиданно было обнаружено, что соединения общей формулы (I) по изобретению связываются также с 5-НТ 2 С и 1 рецепторами и вызывают высвобождение дофамина, что значительно расширяет объем терапевтического применения. Подробное описание изобретения В соответствии с одним из аспектов настоящего изобретения предложены новые 3,3-двузамещенные производные индол-2-она общей формулы (I),где R1 обозначает водород, галоген, алкил, содержащий 1-7 атом(ов) углерода, или сульфонамидо;R2 обозначает водород или галоген;R3 обозначает водород, алкил, содержащий 1-7 атом(ов) углерода, возможно содержащий арильный заместитель или арил, возможно содержащий один или два галогеновых заместителя;R5 обозначает группу общей формулы (IIa) или (IIb),где Q и W, каждый, обозначают азот или СН;m обозначает 0, 1, или 2; а обозначает простую, двойную или тройную связь;n обозначает 0, 1 или 2; при условии, что, когда m обозначает 0, n отлично от 0; и их фармацевтически приемлемые соли присоединения кислоты.-2 014236 Предполагается, что используемый в этом описании термин "алкил" обозначает насыщенные углеводородные группы с прямой или разветвленной цепью, содержащие от 1 до 7, предпочтительно от 1 до 4 атом(ов) углерода, (например, метил, этил, 1-пропил, 2-пропил, н-бутил, изобутил или трет-бутил и т.д.). Термин "галоген" охватывает атомы фтора, хлора, брома и йода и предпочтительно представляет собой хлор или бром. Уходящая группа может представлять собой группу алкилсульфонилокси или арилсульфонилокси,например группу метилсульфонилокси или п-толуолсульфонилокси; или атом галогена, предпочтительно бром или хлор. Термин "фармацевтически приемлемые соли присоединения кислоты" относится к нетоксичным солям соединений общей формулы (I), образованных с фармацевтически приемлемыми органическими или неорганическими кислотами. Неорганические кислоты, подходящие для образования соли, представляют собой, например, соляную, бромоводородную, ортофосфорную, серную или азотную кислоты. В качестве органических кислот могут быть использованы муравьиная, уксусная, пропионовая, малеиновая, фумаровая, янтарная, молочная, яблочная, винная, лимонная, аскорбиновая, малоновая, щавелевая,миндальная, гликолевая, фталевая, бензолсульфоновая, пара-толуолсульфоновая, нафтойная или метансульфоновая кислоты. Кроме того, карбонаты и гидрокарбонаты также рассматривают в качестве фармацевтически приемлемых солей. К подгруппе соединений общей формулы (I), обладающих ценными фармацевтическими свойствами, относятся соединения,где R1 обозначает водород, галоген, алкил, содержащий 1-7 атом(ов) углерода, или сульфонамидо;R2 обозначает водород или галоген;R5 обозначает группу общей формулы (IIa) или (IIb),где Q обозначает азот и W обозначает группу СН;R6 и R7 вместе образуют группу этилендиокси;n обозначает 1; и фармацевтически приемлемые соли присоединения кислоты соединениями общей формулы (I). К подгруппе соединений общей формулы (I), проявляющих особо предпочтительную активность,относятся производные,где R1 обозначает водород или галоген;R2 обозначает водород или галоген;R5 обозначает группу общей формулы (IIa),где Q обозначает азот и W обозначает группу СН;n обозначает 0 или 1; и фармацевтически приемлемые соли присоединения кислоты соединениями общей формулы (I). Еще одна подгруппа соединений общей формулы (I), проявляющих особо предпочтительную активность, включает производные,где R1 обозначает водород, галоген, алкил, содержащий 1-7 атом(ов) углерода, или сульфонамидо;R5 обозначает группу общей формулы (IIa);R6 и R7 вместе обозначают группу этилендиокси;n обозначает 1; и их фармацевтически приемлемым солям присоединения кислоты. В соответствии с еще одним аспектом настоящего изобретения предложен способ получения соединений общей формулы (I) и их фармацевтически приемлемых солей присоединения кислоты, при котором:(а) соединение общей формулы (III) где L обозначает уходящую группу, предпочтительно хлор или бром, m и n, каждый, обозначают 0,1 или 2 и а обозначает простую, двойную или тройную связь, подвергают взаимодействию с пиперазиновым производным общей формулы (IV)(б) соединение общей формулы (VI) где R1, R2, R3 и R4 являются такими, как указано выше, подвергают взаимодействию с соединением общей формулы (VII) где m и n, каждый, обозначают 0, 1 или 2, а обозначает простую, двойную или тройную связь и L обозначает уходящую группу, предпочтительно хлор или бром, в присутствии сильного основания; или(в) для получения соединений общей формулы (I), где n обозначает 1 и а обозначает тройную связь,соединение общей формулы (VIII) где R1, R2, R3, R4 и m являются такими, как указано выше, подвергают реакции с формальдегидом,возможно превращают полученное таким образом соединение общей формулы (III), где L обозначает гидроксильную группу, в соединение общей формулы (III), где L обозначает атом галогена или группу арилсульфонилокси или алкилсульфонилокси, и полученное таким образом соединение общей формулы(III), где а обозначает тройную связь и n обозначает 1, подвергают реакции с соединением общей формулы (IV) в присутствии сильного основания; или(г) для получения соединений общей формулы (I), где R1, R2, R3, R4, R5, m и n являются такими, как указано выше, и а обозначает простую или двойную связь, подвергают соответствующее соединение общей формулы (I), где а обозначает тройную связь, восстановлению; или(д) для получения соединений общей формулы (I), где R1, R2, R3, R4, R5, m и n являются такими, как указано выше, и а обозначает простую связь, подвергают соответствующее соединение общей формулы(I), где а обозначает двойную или тройную связь, восстановлению и, если желательно, галогенированию продукта, содержащего водород вместо R2, или высвобождению свободного основания из его соли или его превращению в фармацевтически приемлемую соль присоединения органической или неорганической кислоты. Соединения общей формулы (I), где R1-R5, a, m и n являются такими, как указано выше, могут быть получены путем реакции соединения общей формулы (III), где R1-R4, a, m и n являются такими, как указано выше, и L обозначает уходящую группу, с соединением общей формулы (IV), где R5 является таким,как указано выше, аналогично способам, известным по литературе [Houben-Weyl: Methoden der organischen Chemie, Georg Thieme Verlag, Stuttgart, 1992, 4th Edition, vol. E16d (D. Klamann); R.С. LarockComprehensive Organic Transformations, 2th Edition, John WileySons, New York, 1999, 789; D.A. Walsh,Y-H. Chen, J.B. Green, J.С. Nolan, J.M. Yanni J. Med. Chem., 1990, 33, 1823-1827]. При получении соединений общей формулы (III) получение заместителей может быть осуществле-4 014236 но в произвольной последовательности в соответствии со способами, известными из литературы. Целесообразно получать соединения общей формулы (III) путем реакции соединения общей формулы (V) где L, a, m и n являются такими, как указано выше, и L' обозначает уходящую группу или группу,которая может быть превращена в уходящую группу, с соединением общей формулы (VI), где R1-R4 являются такими, как указано выше, которое получено в соответствии со способами, известными из литературы [Houben-Weyl: Methoden der organischen Chemie, Georg Thieme Verlag, Stuttgart, 1977, 4th Edition,vol. V/2b; A.R. Katritzky, Ch.W. Rees-Comprehensive Heterocyclic Chemistry, 1th Edition, Pergamon, Oxford,1984, vol. 4. (ed.: С.W. Bird, G.W.H. Cheeseman), 98-150 и 339-366; G.М. Karp Org. Prep. Proc. Int., 1993,25, 481-513; B. Volk, T. Mezei, Gy. Simig Synthesis, 2002, 595-597]. Соединения общей формулы (I), где R1-R5, a, m и n являются такими, как указано выше, также могут быть получены путем реакции соединения общей формулы (VI), где R1-R4 являются такими, как указано выше, с соединением общей формулы (VII), где R5, а, m и n являются такими, как указано выше, и L обозначает уходящую группу, в соответствии со способами, известными из литературы [R.J. Sundberg:The chemistry of indoles, Academic Press, New York, 1970, chapter VII.; G.М. Karp Org. Prep. Proc. Int.,1993, 25, 481-513; A.S. Kende, J.C. Hodges Synth. Commun., 1982, 12, 1-10; W.W. Wilkerson, A.A. Kergaye,S.W. Tarn J. Med. Chem., 1993, 36, 2899-2907]. Соединения общей формулы (I), где R1-R5 и m являются такими, как указано выше, а представляет собой тройную связь и n обозначает 1, также могут быть получены путем реакции соединения общей формулы (VIII), где R1-R4 и m являются такими, как указано выше, в присутствии формальдегида с соединением общей формулы (IV), где R5 является таким, как указано выше, с использованием способов,известных из литературы [Houben-Weyl: Methoden der organischen Chemie, Georg Thieme Verlag, Stuttgart,1977, 4th Edition, vol. V/2a (ed.: E. Mller), 545-549; В.М. Trost, I. Fleming: Comprehensive Organic Syntheses, 1th Edition, Pergamon Press, Oxford, 1991, vol. 2 (ed.: C.H. Heathcock), 893-898; K. Ishizumi, A. Kojima,F. Antoku Chem. Pharm. Bull., 1991, 39, 2288-2300]. В определенных случаях эта реакция также может быть осуществлена в несколько стадий, а именно на первой стадии путем реакции соединения общей формулы (VIII), где R1-R4 и m являются такими, как указано выше, с формальдегидом, и получения соединения общей формулы (III), где R1-R4 и m являются такими, как указано выше, n обозначает 1, а обозначает тройную связь и L обозначает гидрокси. Полученное таким образом соединение затем подвергают реакции непосредственно с соединением общей формулы (IV) или группу L-OH сначала превращают в более подходящую уходящую группу с использованием способов, известных из литературы, и затем подвергают реакции с соединением общей формулы(IV) с получением соединения общей формулы (I), где R1-R5 и m являются такими, как указано выше, а обозначает тройную связь и n обозначает 1. Соединения общей формулы (I), где R1-R5, m и n являются такими, как указано выше, и а обозначает простую или двойную связь, также могут быть получены путем восстановления соединения общей формулы (I), где R1-R5, m и n являются такими, как указано выше, и а обозначает тройную связь, с использованием способов, известных из литературы [Houben-Weyl: Methoden der organischen Chemie, GeorgChemistry, Reactions, mechanisms и structure, 4th Edition, John WileySons, New York, 1992, 771-780]. Соединения общей формулы (I), где R1-R5, m и n являются такими, как указано выше, и а обозначает простую связь, также могут быть получены путем восстановления соединения общей формулы (I), гдеR1-R5, m и n являются такими, как указано выше, и а обозначает двойную связь, в соответствии со способами, известными из литературы [Houben-Weyl: Methoden der organischen Chemie, Georg Thieme Verlag,Stuttgart, 1980, 4th Edition, vol. IV/1c и IV/1d (ed.: H. Kropf); J. March: Advanced Organic Chemistry, Reactions, mechanisms and structure, 4th Edition, John WileySons, New York, 1992, 771-780]. Соединения общей формулы (I), где R1-R5, а, m и n являются такими, как указано выше, также могут быть получены путем образования заместителей R1-R8 в различной последовательности на последней стадии реакции. В этом случае соединение общей формулы (I) используют в качестве исходного вещества, где все заместители являются такими, как указано выше, за исключением одного образуемого. Введение и превращение заместителей осуществляют в соответствии со способами, известными из литературыvol. YIIb]. При введении заместителей может стать необходимо применение или удаление защитных групп. Такие способы указаны в Т.W. Greene, Protective groups in organic synthesis, John WileySons,1981. Соединения общих формул (IV), (V) и (VII) известны из литературы или могут быть получены при помощи аналогичных способов. Соединения общей формулы (VI), где R1-R4 являются такими, как указано выше, могут быть получены при помощи известных способов, получение заместителей осуществляют в произвольной последовательности в соответствии со способами, известными из литературы [A.R. Katritzky, Ch.W. Rees: Com-5 014236prehensive Heterocyclic Chemistry, 1th Edition Pergamon, Oxford, 1984, vol. 4 (ed.: С.W. Bird, G.W.H. Cheeseman), 98-150 и 339-366; С. Gautier, M. Aletru, Ph. Bovy, WO 99/62900; B. Volk, T. Mezei, Gy. Simig Synthesis, 2002, 595-597; G.M. Karp Org. Prep. Proc. Int., 1993, 25, 481-513; A.S. Kende, J.С. Hodges Synth. Commun., 1982, 12, 1-10]. При получении соединений общей формулы (VIII), где R1-R4 являются такими, как указано выше, иm обозначает 1, 2 или 3, введение заместителей R1-R4 и -(СН 2)m-ССН может быть осуществлено в произвольной последовательности в соответствии со способами, известными из литературы [A.R. Katritzky,Ch.W. Rees: Comprehensive Heterocyclic Chemistry, 1th Edition, Pergamon, Oxford, 1984, vol. 4 (ed.: С.W.Mezei, Gy. Simig Synthesis, 2002, 595- 597; G.M. Karp Org. Prep. Proc. Int., 1993, 25, 481-513; A.S. Kende, J. С. Hodges Synth. Commun., 1982, 12, 1-10]. Соединение общей формулы (VIII) предпочтительно получают путем алкилирования соединения общей формулы (VI), где R1-R4 являются такими, как указано выше, с соединением общей формулы (IX), где m обозначает 1, 2 или 3 и L обозначает уходящую группу, в соответствии со способами, известными из литературы. Соединения общей формулы (I), полученные с использованием способов по изобретению, могут быть высвобождены из их солей или превращены в фармацевтически приемлемые соли присоединения кислоты с использованием способов, известных из литературы. В соответствии с еще одним аспектом настоящего изобретения предложены фармацевтические композиции, включающие в качестве активного ингредиента соединение общей формулы (I) или его фармацевтически приемлемую соль присоединения кислоты в смеси с одним или более общепринятым носителем(ями) или вспомогательным агентом(ами). Фармацевтические композиции по настоящему изобретению, как правило, содержат 0,1-95 мас.%,предпочтительно 1-50 мас.%, в частности предпочтительно 5-30 мас.% активного ингредиента. Фармацевтические композиции по изобретению могут подходить для перорального (например, порошки, таблетки, таблетки в оболочке, капсулы, микрокапсулы, пилюли, растворы, суспензии или эмульсии), парентерального (например, инъецируемые растворы для внутривенного, внутримышечного, подкожного или внутриперитонеального применения), ректального (например, суппозитории), трансдермального (например, пластыри) или локального (например, мази или пластыри) введения или для применения в форме имплантатов. Твердые, мягкие или жидкие фармацевтические композиции по изобретению могут быть приготовлены с использованием способов, обычно применяемых в фармацевтической промышленности. Твердые фармацевтические композиции для перорального введения, содержащие соединения общей формулы (I) или их фармацевтически приемлемые соли присоединения кислоты, могут включать наполнители или носители (такие как лактоза, глюкоза, крахмал, фосфат калия, микрокристаллическая целлюлоза), связующие агенты (такие как желатин, сорбит, поливинилпирролидон), разрыхлители (такие как кроскармеллоза, Na-карбоксиметилцеллюлоза, кросповидон), вспомогательные агенты для таблетирования (такие как стеарат магния, тальк, полиэтиленгликоль, кремниевая кислота, диоксид кремния) и поверхностно-активные агенты (например, лаурилсульфат натрия). Жидкие композиции, подходящие для перорального введения, могут представлять собой растворы,суспензии или эмульсии. Такие композиции могут содержать суспендирующие агенты (например, желатин, карбоксиметилцеллюлоза), эмульгаторы (например, сорбитанмоноолеат), растворители (например,воду, масла, глицерин, пропиленгликоль, этанол), буферы (например, ацетатный, фосфатный, цитратный буферы) и консерванты (например, метил-4-гидроксибензоат и т.д.). Жидкие фармацевтические композиции, подходящие для парентерального введения, как правило,представляют собой стерильные изотонические растворы, возможно содержащие дополнительно к растворителю буферы и консерванты. Мягкие фармацевтические композиции, содержащие в качестве активного ингредиента соединение общей формулы (I) или его фармацевтически приемлемую соль присоединения кислоты, такие как суппозитории, содержат активный ингредиент, равномерно диспергируемый в основном материале суппозитория (например, в полиэтиленгликоле или масле какао). В соответствии с еще одним аспектом настоящего изобретения предложено применение производного индол-2-она общей формулы (I) или его фармацевтически приемлемой соли присоединения кислоты для получения фармацевтических композиций, подходящих для лечения или профилактики расстройств центральной нервной системы или психосоматических расстройств, включающих синдромы беспокойства, в частности общие тревожные расстройства, паническое расстройство, навязчивые состояния, социальную фобию, агорафобию, фобии, связанные с конкретными ситуациями, посттравматическое стрессовое расстройство, посттравматические нарушения памяти, когнитивные расстройства, сексуальную дисфункцию, связанную с нарушением в центральной нервной системе, депрессию, шизофрению, желудочно-кишечные заболевания и сердечно-сосудистые заболевания. Фармацевтические композиции по изобретению могут быть получены с использованием способов,известных в фармацевтической промышленности. Активный ингредиент смешивают с фармацевтически приемлемыми твердыми или жидкими носителями и/или вспомогательными агентами и смесь приводят в-6 014236 галенову форму. Носители и вспомогательные агенты вместе со способами, которые могут быть использованы в фармацевтической промышленности, раскрыты в литературе (Remington's Pharmaceutical Sciences, Edition 18, Mack Publishing Co., Easton, USA, 1990). Фармацевтические композиции по настоящему изобретению, как правило, имеют дозировку. Суточная доза соединения общей формулы (I) или его фармацевтически приемлемой соли присоединения кислоты для взрослых людей, как правило, может составлять 0,1-1000 мг/кг массы организма. Указанная суточная доза может быть введена в одной или более порции. Действительная суточная доза зависит от нескольких факторов и определяется лечащим врачом. В соответствии с еще одним аспектом настоящего изобретения предложено применение соединений общей формулы (I) или его фармацевтически приемлемых солей присоединения кислоты для лечения или профилактики расстройств центральной нервной системы и психосоматических расстройств,включающих синдром беспокойства, в частности общих тревожных расстройств, панического расстройства, навязчивых состояний, социальной фобии, агорафобии, фобий в связи с конкретными ситуациями,стрессового расстройства, посттравматического стрессового расстройства, посттравматических нарушений памяти, когнитивных расстройств, сексуальной дисфункции, связанной с нарушениями в центральной нервной системе, депрессии, шизофрении, ухудшения умственных способностей после гибели клеток мозжечка, болезни Альцгеймера, удара, деменций, кроме того, желудочно-кишечных заболеваний и сердечно-сосудистых заболеваний, в частности гипертензии. Соединения по изобретению также могут быть применены для лечения расстройств слухового органа, развивающихся вследствие терапии, лечения шума в ушах. Из заявки на европейский патент 376607 и из медицинской литературы (A. Dekeyne, J.M. Rivet,A. Gobert, M.J. Millan: Neuropharmacology 40 (7), p. 899-910 (2001); J.S. Sprouse et al. Neuropsychopharmacology, 21(5), p. 622-631 (1999); A. Newman-Tancredi et al. Eur. J. Pharmacol., 355 (2-3), p. 245-246(1998 известно, что соединения 1,3-дигидро-2 Н-индол-2-онового типа в соответствии с предшествующим уровнем техники избирательно связываются с 5-HT1A рецептором и таким образом влияют на центральную нервную систему. Соответственно, они могут применяться для лечения анксиолитических расстройств, депрессии, а также сердечно-сосудистых, желудочно-кишечных и почечных расстройств. Настоящее изобретение основано на неожиданном обнаружении того, что производные 3,3-диалкилиндол-2-она общей формулы (I) обладают нейролептическим действием, но не связываются 5-НТ 1 А рецепторами. Поэтому можно ожидать, что соединения по изобретению лишены вышеупомянутых отрицательных побочных эффектов, характерных для активных ингредиентов, связывающихся с 5-HT1 А рецепторами. Еще одно неожиданное обнаружение заключается в том, что соединения общей формулы (I),помимо нейролептического действия, которое может быть связано с их связыванием с 5-HT2C рецепторами, влияют на высвобождение дофамина в ухе и также связываются с 1 рецепторами. Связывания рецептора, за исключением связывания с 5-НТ 2 С рецептором, определяли путем использования препаратов мозговой области самцов крыс Wistar, содержащих массу 120-200 г. Для связывания с 5-НТ 1 А рецептором использовали препараты лобной доли коры головного мозга. Исследования связывания с 1 рецептором осуществляли в выделенных препаратах лобной доли коры головного мозга. Для экспериментов связывания с 5-НТ 2C рецептором использовали хориоидное сплетение свиньи. Содержание белка в мембранных препаратах определяли с использованием метода Лоури (1951). Связывание с 5-HT-1 А рецептором измеряли в соответствии со способом Перутка (Peroutka, S.J. J.Neurochem., 47, p. 529 (1986. Лиганд представлял собой тритированный 8-гидрокси-N,N-дипропил-2 аминотетралин (8-OH-DPAT). Для определения неспецифического связывания применяли 10 мкМ серотонин. Инкубируемый объем крови составлял 250 мкл. Инкубацию осуществляли при температуре 25 С в течение 30 мин. Реакцию останавливали путем добавления 9 мл ледяного 50 мМ буфера TRIS-HCl(рН 7,7) и быстрой вакуумной фильтрации с использованием фильтровальной бумаги из стекловолокнаWhatman GFEB. Радиоактивность на фильтрах измеряли путем жидкой люминесцентной спектрометрии. В экспериментах связывания с 5-НТ 2 С и 1 рецепторами лиганды представляли собой, соответственно, 3 Н-мезулергин (1,0 нМ) и 3 Н-празозин (0,3 нМ). Неспецифически связывающие лиганды представляли собой, соответственно, мианзерин (1 мкМ) и празозин (1 мкМ). Значение средней ингибирующей концентрации (IC50) представляет собой значение концентрации,при котором различие между общим и неспецифическим связыванием составляет 50% в присутствии определенной концентрации специфического лиганда. Соединения, содержащие значения IC50 меньше 100 нмоль, рассматривали в тесте как эффективные. Результаты приведены в табл. 1-3. Из результатов, раскрытых в табл. 1, можно видеть, что тестируемые соединения не связываются с 5-HT1A рецепторами. Таблица 2 Связывание с 5-НТ 2 С рецептором Таблица 3 Эксперимент по связыванию с 1 рецептором В соответствии с установленным из табл. 2 и 3 соединения по изобретению демонстрируют существенное связывание с 5-HT2C и 1 рецепторами. Нейролептическое действие соединений по изобретению исследовали на крысах в соответствии с конфликтным тестом Вогеля с питьевой депривацией и тестом с приподнятым крестообразным лабиринтом (S. Pelow, P. Chopin, S.E. File, J. Briley: Neurosci. Methods., 14, p. 149 (1985. Конфликтный тест Вогеля с питьевой депривацией Для эксперимента использовали самцов крыс Wistar, имеющих массу 160-180 г. Животных лишали питьевой воды в течение 48 ч и не кормили в течение 24 ч перед тестом. Тестируемые соединения или разбавитель вводили внутриперитонеально за 30 мин перед тестом. В тестируемой камере животные имели свободный доступ к питьевой воде. Через каждые 20 лизаний через питьевой носик в течение 5-мин периода теста применяли удар электрическим шоком (0,7 мА). Регистрировали количество лизаний с наказанием. Действие тестируемого соединения выражали в виде % увеличения количества ударов,к которым животное было толерантно. Минимальные эффективные дозы (МЭД) определяли для каждого-8 014236 соединения. Результаты приведены в табл. 4. Таблица 4 Конфликтный тест Вогеля с питьевой депривацией Тест для крыс с приподнятым крестообразным лабиринтом Для экспериментов использовали деревянный крестообразный приподнятый на 50 см над полом лабиринт, содержащий ширину 15 см с длиной рукавов 100 см. Стороны и концы двух противоположных рукавов креста оборудовали стенками высотой 40 см, тем не менее рукава были открыты в центральной области 1515 см (закрытые рукава). Два других противоположных рукава не были окружены стенками(открытые рукава). Для экспериментов использовали самцов крыс Sprague-Dawley, имеющих массу 200-220 г. Животных помещали в центральную область конструкции через 60 мин после обработки и в течение 5 мин теста наблюдали за следующими четырьмя параметрами: время, проводимое в открытых рукавах (с),время, проводимое в закрытых рукавах (с),количество входов в открытые рукава,количество входов в закрытые рукава. Действие выражено в виде процентного увеличения времени, проводимого в открытых рукавах, или количества входов в открытые рукава. МЭД (минимальные эффективные дозы) определяли для каждого соединения. Результаты представлены в табл. 5. Таблица 5 Приподнятый крестообразный лабиринт для крыс Из данных, представленных в вышеприведенных таблицах, можно видеть, что соединения общей формулы (I) обладают значительным нейролептическим действием. Исследование действия в отношении нарушения слуха и шума в ушах проводили на морских свинках, имеющих массу 145-375 г (Toxicoop, Hungary) в соответствии со способом Gaborjan et al. (GaborjanA., Lendvai В., Vizi E.S. Neuroscience 90, p. 131 (1999. Высвобождение дофамина во внутреннем ухе,коррелирующее с нарушением слуха, измеряли в образцах препаратов улитки (латеральные оливоулитковые эфференты) при помощи жидкостной хроматографии высокого давления (ЖХВД). Образцы собирали каждые 3 мин в течение 60 мин (20 фракций). Стимуляцию электрическим полем, как правило,применяли в течение 3-й и 13-й фракции (S1, S2, 2 Гц, 360 шоков, 60 В; Grass Medical Instruments). В соответствующих экспериментах ишемию (лишение кислорода и глюкозы, OGD) имитировали путем перфузии буфера, насыщенного 100% N2 и содержащего сахарозу вместо глюкозы. Результаты выражены в виде процента высвобождения дофамина на фракцию. Статистический анализ осуществляли путем анализа дисперсии (ANOVA) с последующим тестом Тьюки. Из полученных таким образом результатов показано действие соединения по примеру 76 на высвобождение дофамина во внутреннем ухе морской свинки (фиг. 1). Исходная стимуляция (ИС) вызывала существенное высвобождение дофамина. Это высвобождение уменьшается после второй стимуляции после лишения кислорода и глюкозы, но в присутствии соединения по примеру 76 высвобождение стабилизировалось на значительно более высоком уровне по сравнению со стабилизацией без лишения кислорода или глюкозы. Это действие может быть интерпретировано как ингибирование нарушения слуха. Нейропротективное действие соединений по изобретению продемонстрировано в модели общей ишемии головного мозга, вызванной двусторонней окклюзией сонной артерии. Самцов когтистых песчанок, имеющих массу 60-90 г, использовали в качестве тестируемых животных. Тестируемые соединения вводили внутриперитонеально в дозе 30 мг/кг через 45 мин после хирургического вмешательства. Тестируемые вещества суспендировали в 0,4%-ном метилцеллюлозном растворе. Под наркозом диэтиловым-9 014236 эфиром обнажали правую и левую сонные артерии через передний цервикальный разрез по средней линии и отделяли от блуждающих нервов и окружающих тканей. Полное прекращение кровотока через сонные артерии достигали путем затягивания клипсы для аневризмы в течение 3 мин. Во время хирургического вмешательства температуру тела животных поддерживали на индивидуальном уровне до операции (37,50,5 С) при помощи нагревающей пластинки и нагревающей лампы. Через 4 дня после хирургического вмешательства животных анестезировали 60 мг/кг в.п. нембутала(10 мл/кг) и перфузировали через сердце сначала физиологическим раствором, затем фиксирующим раствором, содержащим 0,1% глютаровый альдегид, 4% параформальдегид и 0,2% пикриновую кислоту в 0,1 М фосфатном буфере (рН 7,4) в течение 30 мин. Головной мозг извлекали из черепа и фиксировали в течение по меньшей мере одной недели при 4 С в том же самом фиксирующем растворе. Чередующиеся коронарные разрезы толщиной 60 мкм получали на различных уровнях дорсального гиппокампа при помощи микротома. Срезы неоднократно промывали в 0,1 М фосфатном буфере (рН 7,4) и окрашивали путем насыщения серебром. Срезы дважды держали в препарирующем растворе (раствор 2% гидроксид натрия и 0,875% гидроксида аммония) в течение 5 мин, насыщали в течение 10 мин в растворе 0,875% гидроксида аммония и 0,5% нитрата серебра и дважды на 2 мин и однократно на одну минуту помещали в промывающий раствор (0,5% карбонат натрия и 0,01% нитрат аммония, растворенные в 29,1% водном этанольном растворе). Срезы затем проявляли в 9,9% этанольном растворе, содержащем 1,5% формальдегид и 0,01% нитрат аммония, и трижды фиксировали на 3 мин в 0,5% растворе уксусной кислоты. Окрашенные срезы помещали в 0,1 М фосфатный буфер (рН 7,4) и на предметные стекла наносили хромовый желатин, дегидрировали и обрабатывали ксилолом. Покровные стекла фиксировали при помощи клея DPX (Fluka). Срезы исследовали под световым микроскопом и общее повреждение нейронов в субобласти СА 1 обоих гиппокампов оценивали по 6-точечной шкале: (0) неповрежденный,(1) 0-10%; (2) 10-30%; (3) 30-50%; (4) 50-70%; (5) 70-90%; (6) 90-100% гибель клеток. Различия между группами, обработанными лекарствами и разбавителем, статистически анализировали при помощи Результаты вышеприведенных экспериментов демонстрируют, что соединения по изобретению значительно уменьшают клеточную гибель в области СА 1 гиппокампа у животных, перенесших общую ишемию головного мозга. Эти результаты доказывают, что тестируемое соединение обладает значительным нейропротективным действием. На основе вышеприведенных экспериментов новые соединения по изобретению могут быть эффективны для лечения некоторых расстройств центральной нервной системы и сердечно-сосудистой системы. Такие расстройства центральной нервной системы включают различные формы тревоги (общее тревожное расстройство, компульсивное расстройство, паника, посттравматическое стрессовое расстройство, социальная фобия, депрессия, ухудшение умственных способностей после гибели клеток мозжечка(например, болезнь Альцгеймера, удар, деменции). Кроме того, соединения по изобретению подходят для лечения сердечно-сосудистых заболеваний, в частности гипертензии. Дополнительные действия соединений по изобретению включают нарушение слуха и шум в ушах, возникающие в качестве побочных эффектов терапии. Неожиданно, в отличие от соединений предшествующего уровня техники, содержащих похожую структуру, соединения по изобретению не действуют на 5-HT1A рецептора. Они демонстрируют значительное связывание с 5-НТ 2C рецепторами, которые, как полагают, играют роль в патологическом механизме беспокойства. Действие соединений по изобретению в отношении 1 рецептора свидетельствует о том, что они могут быть использованы для лечения сердечно-сосудистых заболеваний. Высвобождение дофамина, вызывающая активность во внутреннем ухе морской свинки указывают на то, что они полез- 10014236 ны для лечения нарушения слуха и шума в ушах. Дополнительные детали настоящего изобретения предложены в следующих примерах без ограничения объема изобретения до указанных примеров. Пример 1. 5-Хлор-3-этил-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают из 5-хлороксиндола в соответствии со способами, известными из литературы [В. Volk, T. Mezei, Gy. Simig Synthesis, 2002, 595]. 1,68 г (0,01 моль) 5-хлороксиндола растворяют в 20 мл этанола и к раствору добавляют 1,0 г ренеевского никеля. Смеси дают возможность вступать в реакцию в автоклаве при 110 С в течение 36 ч. Катализатор затем отфильтровывают, растворитель упаривают и остаток перекристаллизовывают из смеси гексана и этилацетата. Выход: 0,86 г белого порошка (44%). Т.пл.: 121-123 С (гексан-этилацетат). ИК (KBr): 3156, 1701 (С=О), 782 cм-1. 1 Н-ЯМР (CDCl3): 9,27 (br s, 1 Н, NH), 7,21 (1 Н, s, H-4), 7,19 (d, 1H, J=8,8 Гц, Н-6), 6,85 (d, 1H, J=8,1 Гц, Н-7), 3,47 (t, 1H, J=5,5 Гц, Н-3), 2,03 (m, 2H, СН 2), 0,92 (t, 3H, J=7,0 Гц, СН 3) млн-1. 13 С-ЯМР (CDCl3): 180,5, 140,4, 131,2, 127,8, 127,6, 124,5, 110,7, 47,5, 23,5, 9,9 млн-1. Анализ формулы C10H10ClNO (195,65): рассчитано С 61,39, Н 5,15, N 7,16, Cl 18,12%; Обнаружено: С 61,16, Н 5,10, N 6,93, Cl 18,11%. Пример 2. 5-Бром-3-этил-1,3-дигидро-2 Н-индол-2-он. 3-Этилоксиндол (16,1 г; 0,10 моль) растворяют в 350 мл ацетонитрила, раствор охлаждают до 0 С и к нему в течение 2 ч при той же самой температуре капают раствор N-бромсукцинимида (17,8 г; 0,10 моль) в 150 мл ацетонитрила. Реакционную смесь сначала перемешивают при 0 С в течение 1 ч и затем при комнатной температуре в течение 3 ч. Раствор упаривают, белое вещество, выделенное в кристаллической форме, экстрагируют дихлорметаном и 1 М раствором NaOH и органическую фазу вновь экстрагируют подщелоченной водой для удаления сукцинимида. Органическую фазу сушат над сульфатом натрия, фильтруют и выпаривают. Выделенное белое вещество перекристаллизовывают из смеси гептана и этилацетата. Выход: 15,24 г белого порошка (63%). Т.пл.: 125-127 С (гептан-этилацетат). ИК (KBr): 3154, 1700 (С=О), 812 см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 8,90 (1 Н, s), 7,36-7,32 (2 Н, m), 6,81 (1 Н, d, J=8,9 Гц), 3,43 (1 Н, t,J=5,8 Гц), 2,03 (2 Н, q, J=7,4 Гц), 0,92 (3 Н, t, J=7,4 Гц) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 180,3, 140,8, 131,6, 130,7, 127,2, 114,9, 111,2, 47,2, 23,4, 9,9 млн-1. Анализ формулы C10H10BrNO (240,10): рассчитано: С 50,03, Н 4,20, N 5,83, Br 33,28%; Обнаружено: С 50,16, Н 4,20, N 5,85, Br 32,70%. Пример 3. Дигидрохлорид 4-(4-пиримидин-2-ил-пиперазин-1-ил)бут-2-ин-1-ола. 2-(Пиперазин-1-ил)пиримидин (10,8 г; 66 ммоль) отмеряют в пропаргиловый спирт (3,9 мл; 66 ммоль), к нему добавляют моногидрат ацетата меди(II) (0,75 г; 3,8 ммоль) и в реакционную смесь при перемешивании капают с помощью пипетки 37% водный формалин (20 мл, 265 ммоль). Зеленую суспензию кипятят с обратным холодильником в течение 2 ч. Затем ее охлаждают, к ней добавляют воду и хлороформ и отфильтровывают бледно-зеленое вещество, нерастворимое в обеих фазах. Водную фазу дважды экстрагируют хлороформом, органические фазы объединяют, сушат над сульфатом натрия и упаривают. Оставшееся коричневое масло растворяют в этилацетате и к нему при перемешивании капают раствор 2-мольного эквивалента хлористого водорода в изопропаноле. Выделенную белую соль отфильтровывают, перемешивают в горячем изопропаноле, охлаждают и фильтруют. Выход: 12,7 г белого порошка (63%). Т.пл.: 187-188 С (метанол). ИК (KBr): 3295, 1625 см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц): 12,1 (br s, 1 Н), 8,54 (d, J=4,9 Гц, 2 Н), 7,12 (br s, 4 Н), 6,88 (t,J=4,9 Гц, 1 Н), 4,82 (br s, 2H), 4,23 (s, 2H), 4,17 (s, 2H), 3,62-3,48 (m, 4H), 3,20 (m, 2H) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 101 МГц): 159,1, 158,2, 111,5, 90,5, 73,1, 49,8, 49,2, 44,9, 40,9 млн-1.C12H18Cl2N4O (305,21). Пример 4. Дигидрохлорид 4-[4-(2-метоксифенил)пиперазин-1-ил]бут-2-ин-1-ола. 1-(2-Метоксифенил)пиперазин (12,7 г; 66 ммоль) отмеряют в пропаргиловый спирт (3,9 мл; 66 ммоль), к нему добавляют моногидрат ацетата меди(II) (0,75 г; 3,8 ммоль) и в реакционную смесь при перемешивании капают при помощи пипетки 37% водный формалин (20 мл, 265 ммоль). Зеленую суспензию кипятят с обратным холодильником в течение 2 ч. Затем ее охлаждают, к ней добавляют воду и хлороформ и отфильтровывают бледно-желтое вещество, нерастворимое в обеих фазах. Водную фазу дважды экстрагируют хлороформом, объединенные органические фазы сушат над сульфатом натрия и упаривают. Оставшееся коричневое масло растворяют в этилацетате и к нему при перемешивании капают раствор 2-мольного эквивалента хлористого водорода в изопропаноле. Выделенную белую соль от- 11014236 фильтровывают, горячей растворяют в изопропаноле, охлаждают и фильтруют. Выход: 16,3 г белого порошка (74%). Т.пл.: 179-181 С (этилацетат-этанол). ИК (KBr): 3324, 2853 см-1. 1 Н-ЯМР (D2O, дисукцинимидилсуберат (ДСС), 400 МГц): 7,45 (m, 2H), 7,25 (dd, J=8,8, 1,2 Гц, 1 Н),7,15 (dt, J=7,7, 1,2 Гц, 1 Н), 4,41 (t, J=1,7 Гц, 2 Н), 4,33 (t, J=1,7 Гц, 2 Н), 3,99 (s, 3 Н), 3,85 (br s, 8H) млн-1. 13 С-ЯМР (D2O, ДСС, 101 МГц): 154,3, 134,6, 124,1, 122,8, 115,5, 92,4, 75,0, 58,4, 52,1, 51,7, 48,8 млн 1C15H22Cl2N2O2 (333,26). Пример 5. Дигидрохлорид 4-[4-(3-хлорфенил)пиперазин-1-ил]бут-2-ин-1-ола. 1-(3-Хлорфенил)пиперазин (19,7 г; 0,10 моль) отмеряют пропаргиловый спирт (11,8 мл; 0,20 моль),к нему добавляют моногидрат ацетата меди(II) (1,0 г; 5,2 ммоль) и в реакционную смесь при перемешивании капают при помощи пипетки 37% водный формалин (50 мл). Зеленую суспензию кипятят с обратным холодильником в течение 2 ч. Затем ее охлаждают, к ней добавляют воду и хлороформ и отфильтровывают бледно-зеленое вещество, нерастворимое в обеих фазах. Водную фазу дважды экстрагируют хлороформом, объединенные органические фазы сушат над сульфатом натрия и упаривают. Оставшееся коричневое масло растворяют в этилацетате и к нему при перемешивании капают раствор 2-мольного эквивалента хлористого водорода в этилацетате. Выделенную белую соль отфильтровывают, горячей растворяют в изопропаноле, охлаждают и фильтруют. Выход: 26,6 г белого порошка (79%). Т.пл.: 171-173 С. 1 Н-ЯМР (ДМСО-d6, ТМС, 200 МГц): 8,6 (2 Н, br s), 7,28 (1 Н, t, J=8,0 Гц), 7,07 (1 Н, s), 6,95 (1 Н, d,J=2,0 Гц), 6,87 (1 Н, d, J=2,0 Гц), 4,23 (2 Н, s), 4,18 (2 Н, s), 3,95 (2 Н, br s), 3,55 (2 Н, br s), 3,22 (4 Н, br s) млн-1.C14H19Cl3N2O (337,68). Пример 6. Дигидрохлорид 4-(4-фенилпиперазин-1-ил)бут-2-ин-1-ола. 1-Фенилпиперазин (16,2 г; 0,10 моль) отмеряют в пропаргиловый спирт (11,8 мл; 0,20 моль), к нему добавляют моногидрат ацетата меди(II) (1,0 г; 5,2 ммоль) и в реакционную смесь при перемешивании капают при помощи пипетки 37% водный формалин (50 мл). Зеленую суспензию кипятят с обратным холодильником в течение 2 ч. Затем ее охлаждают, к ней добавляют воду и хлороформ и отфильтровывают бледно-зеленое вещество, нерастворимое в обеих фазах. Водную фазу дважды экстрагируют хлороформом, объединенные органические фазы сушат над сульфатом натрия и упаривают. Оставшееся коричневое масло растворяют в этилацетате и к нему при перемешивании капают раствор 2-мольного эквивалента хлористого водорода в этилацетате. Выделенную белую соль отфильтровывают, горячей растворяют в изопропаноле, охлаждают и фильтруют. Выход: 18,5 г белого порошка (61%). Т.пл.: 190-193 С. 1 Н-ЯМР (ДМСО-d6, ТМС, 200 МГц): 7,4 (2 Н, br s), 7,30 (2 Н, t, J=7,3 Гц), 7,15 (2 Н, t, J=8,3 Гц), 6,95C14H20Cl2N2O (303,23). Пример 7. Дигидрохлорид 2-[4-(4-хлорбут-2-инил)пиперазин-1-ил]пиримидина. К тионилхлориду (30 мл; 0,41 моль) шпателем при перемешивании небольшими порциями добавляют дигидрохлорид 4-(4-пиримидин-2-илпиперазин-1-ил)бут-2-ин-1-ола (9,61 г; 31,5 ммоль). По завершении добавления реакционную смесь нагревают до температуры дефлегмации. Можно наблюдать интенсивное газообразование, исходное вещество растворяется и продукт отделяют в форме соли. К реакционной смеси добавляют 15 мл толуола и ее перемешивают до прекращения газообразования (приблизительно полчаса). Смесь затем охлаждают, белоснежный порошок фильтруют, промывают этилацетатом и сушат. Выход: 8,77 г белого порошка (86%). Т.пл.: 178-179 С (этанол). ИК (KBr): 1622 см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц): 12,4 (s, 1 Н), 8,49 (d, J=4,9 Гц, 2 Н), 6,82 (t, J=4,8 Гц, 6,7 (br s,1H), 4,79 (s, 2H), 4,59 (s, 2H), 4,31 (s, 2H), 3,56 (m, 4H), 3,15 (m, 2H) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 101 МГц): 160,1, 158,3, 111,5, 85,5, 75,7, 49,9, 44,6, 40,5, 30,7 млн-1.C12H17Cl3N4 (323,65). Пример 8. Дигидрохлорид 1-(4-хлорбут-2-инил)-4-(2-метоксифенил)пиперазина. К тионилхлориду (40 мл; 0,55 моль) шпателем при перемешивании небольшими порциями добавляют дигидрохлорид 4-(4-(2-метоксифенил)пиперазин-1-ил)бут-2-ин-1-ола (13,3 г; 40 ммоль). По завершении добавления реакционную смесь нагревают до температуры дефлегмации. Можно наблюдать интенсивное газообразование, исходное вещество растворяется и продукт отделяют в форме соли. К реакционной смеси добавляют 30 мл толуола и ее перемешивают до прекращения газообразования. Смесь затем охлаждают, белый порошок фильтруют, промывают этилацетатом и сушат.C15H21Cl3N2O (351,70). Пример 9. 1-(2,6-Дихлорфенил)-3-изопропилиден-1,3-дигидро-2 Н-индол-2-он. 1-(2,6-Дихлорфенил)оксиндол (27,8 г; 0,10 моль) растворяют в 300 мл ацетона, пирролидин (10 мл; 0,12 моль) отмеряют в раствор и его нагревают до температуры дефлегмации. Реакционную смесь кипятят с обратным холодильником в течение 3 ч и раствор упаривают. Продукт, выделенный в кристаллической форме, растворяют в дихлорметане, дважды экстрагируют 10% хлористым водородом, органическую фазу сушат над сульфатом натрия, очищают сланцеватым углем, фильтруют и упаривают. Продукт используют для каталитического гидрирования без перекристаллизации. Аналитические образцы могут быть получены путем перекристаллизации из этилацетата. Выход: 31,82 г желтых кристаллов (97%). Т.пл.: 180-182 С (этилацетат). ИК (KBr): 1700 (С=О), 793 см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 2,46 (3 Н, s), 2,66 (3 Н, s), 6,40 (1 Н, dd, J=0,6, 7,8 Гц), 7,09 (1 Н, at,J=1,2, 7,6 Гц), 7,17 (1 Н, dt, J=1,0, 7,6 Гц), 7,35 (1 Н, dd, J=7,6, 8,7 Гц), 7,50 (2 Н, d, J=8,2 Гц), 7,64 (1 Н, d,J=7,5 Гц) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 23,4, 25,4, 108,5, 122,0, 122,3, 123,7, 123,8, 127,6, 128,9, 130,4,130,9, 135,9, 140,0, 156,1, 166,2 млн-1. Анализ формулы C17H13Cl2NO (318,21): рассчитано: С 64,17, Н 4,12, Cl 22,28, N 4,40%; обнаружено: С 64,02, Н 4,11, Cl 22,14, N 4,39%. Пример 10. 1-(2,6-Дихлорфенил)-3-изопропил-1,3-дигидро-2H-индол-2-он. Оксиндол 1-(2,6-дихлорфенил)-3-изопропилидена (23,7 г; 75 ммоль) растворяют в 170 мл метанола,к нему добавляют 5% палладий на сланцеватом угле (2,0 г) и реакционную смесь перемешивают в автоклаве в течение 3 ч при комнатной температуре при исходном давлении водорода 15105 Па (15 бар). Затем ее очищают сланцеватым углем, фильтруют и упаривают. Оставшееся желтое масло кристаллизуется при тритурации с гексаном. Продукт перемешивают в гексане, фильтруют, сушат и используют без дополнительной очистки. Выход: 19,6 г не совсем белого порошка (82%). Т.пл.: 138-140 С (этилацетат). ИК (KBr): 1720 (С=О), 752 см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 7,49 (d, J=8,5 Гц, 2 Н), 7,37 (d, J=7,3 Гц, 1 Н), 7,35 (t, J=8,2 Гц, 1 Н),7,19 (t, J=7,7 Гц, 1 Н), 7,09 (dt, J=0,9, 7,5 Гц, 1 Н), 6,38 (d, J=7,8 Гц, 1 Н), 3,64 (d, J=3,5 Гц, 1 Н), 2,63 (m, 1H),1,20 (d, J=7,0 Гц, 3 Н), 1,07 (d, J=7,0 Гц, 3 Н) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 175,8, 142,8, 135,5, 135,4, 130,6, 130,5, 129,0, 128,9, 127,7, 127,6,122,7, 121,7, 108,8, 51,7, 31,0, 20,1, 18,7 млн-1.C17H15Cl2NO (320,22). Пример 11. Моногидрохлорид 1-(2,6-дихлорфенил)-3-изопропил-3-[4-(4-пиримидин-2-илпиперазин-1-ил)бут-2-инил]-1,3-дигидро-2 Н-индол-2-она. Гидрид натрия (2,7 г; 55% суспензия; 62 ммоль) трижды промывают по 10 мл гексана для удаления суспендированного масла и суспендируют в 100 мл диметилформамида (ДМФ) при комнатной температуре. К нему небольшими порциями добавляют 1-(2,6-дихлорфенил)-3-изопропилоксиндол (5,0 г; 15,6 ммоль). После прекращения газообразования к нему небольшими порциями добавляют дигидрохлорид 2-[4-(4-хлорбут-2-инил)пиперазин-1-ил]пиримидина (4,88 г; 15,1 ммоль). Смеси дают возможность реагировать в течение 1 ч. Затем к ней добавляют 2 мл воды для разложения избытка гидрида натрия. Смесь экстрагируют водой и диэтиловым эфиром и водную фазу вновь экстрагируют простым эфиром. Объединенные органические фазы сушат над сульфатом натрия и упаривают. Полученное таким образом желтовато-коричневое масло очищают путем колоночной хроматографии с использованием в качестве элюента этилацетат. Чистое вещество растворяют в 100 мл диэтилового эфира и к раствору при перемешивании капают раствор 1-мольного эквивалента хлористого водорода. Выделенную соль гидрохлорид фильтруют, промывают небольшим количеством изопропилового спирта и гексаном и сушат в вакуумном пистолете. Выход: 3,02 г белого порошка (37%). Т.пл.: 171-173 С. ИК (KBr): 2364, 1722 (С=О) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 13,3 (1 Н, s), 8,35 (2 Н, d, J=4,7 Гц), 7,54-7,49 (2 Н, m), 7,40 (1 Н, t,- 13014236(1 Н, q, J=6,9 Гц), 1,03 (3 Н, d, J=6,9 Гц), 0,98 (3 Н, d, J=6,9 Гц) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 176,4, 157,7, 150,8, 142,2, 135,1, 135,0, 130,8, 130,1, 129,9, 129,3,129,2, 128,3, 124,0, 123,0, 111,2, 109,1, 88,8, 69,2, 54,8, 49,5, 46,4, 40,3, 34,9, 25,7, 17,4 млн-1. Анализ формулы C29H30Cl3N5O (570,95): рассчитано: С 61,01, Н 5,30, Cl 18,63, N 12,27%; обнаружено: С 59,81, Н 5,28, Cl 18,41, N 11,90%. Пример 12. (Е)-1-(2,6-Дихлорфенил)-3-(4-метилбензилиден)-1,3-дигидро-2H-индол-2-он. 1-(2,6-Дихлорфенил)оксиндол (22,24 г; 80 ммоль) и 4-метилбензальдегид (10,0 г; 84 ммоль) растворяют в 250 мл толуола, в раствор отмеряют пирролидин (4,0 мл; 0,30 моль) и смесь нагревают до температуры дефлегмации. Ее кипятят с обратным холодильником в течение 1 ч, дают возможность охлаждаться, дважды экстрагируют 10% хлоридом водорода, толуоловую фазу сушат над сульфатом натрия,очищают сланцеватым углем, фильтруют, промывают на фильтре толуолом и упаривают. Оставшееся оранжево-красное масло становится кристаллическим при тритурации с гексаном. Вещество перемешивают в гексане, фильтруют и промывают гексаном. Продукт используют для каталитического гидрирования без перекристаллизации. Выход: 18,59 г желтого кристалла (61%). Т.пл.: 201-202 С (этилацетат). ИК (KBr): 1716 (С=О), 791 см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 2,44 (3 Н, s), 6,41 (1 Н, d, J=7,9 Гц), 6,95 (1 Н, t, J=7,7 Гц), 7,18 (1 Н, t,J=7,7 Гц), 7,30 (2 Н, d, J=8,0 Гц), 7,37 (1 Н, t, J=7,7 Гц), 7,51 (1 Н, d, J=7,9 Гц), 7,64 (2 Н, d, J=8,0 Гц), 7,81(1 Н, d, J=7,7 Гц), 7,96 (1 Н, s) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 21,6, 109,2, 121,4, 122,4, 123,0, 125,5, 128,9, 129,3, 129,5, 129,6,130,5, 130,6, 131,8, 135,7, 138,8, 140,2, 142,1, 167,2 млн-1. Анализ формулы C22H15Cl2NO (380,28): рассчитано: С 69,49, Н 3,98, Cl 18,65, N 3,68%; обнаружено: С 69,53, Н 4,03, Cl 18,49, N 3,67%. Пример 13. 1-(2,6-Дихлорфенил)-3-(4-метилбензил)-1,3-дигидро-2 Н-индол-2-он. 1-(2,6-Дихлорфенил)-3-(4-метилбензилиден)оксиндол (12,0 г; 31,6 ммоль) растворяют в 170 мл этанола и насыщают в автоклаве с использованием катализатора 5% палладия на сланцеватом угле (2,0 г) при давлении водорода 10105 Па (10 бар). Реакция протекает в течение 2 ч. Катализатор затем отфильтровывают, смесь очищают сланцеватым углем и выпаривают. Продукт кристаллизуется в форме не совсем белого порошка. Выход: 10,21 г не совсем белого порошка (84%). Т.пл.: 123-124 С (гексан-этилацетат). ИК (KBr): 1718 (СО), 753 см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 7,47 (dd, J=1,4, 8,0 Гц, 1 Н), 7,45 (dd, J=1,4, 8,2 Гц, 1 Н), 7,33 (t,J=8,1 Гц, 1 Н), 7,14 (t, J=7,6 Гц, 1 Н), 7,11 (d, J=8,0 Гц, 2 Н), 7,07 (d, J=8,0 Гц, 2 Н), 6,97 (dt, J=0,9, 7,5 Гц,1 Н), 6,89 (d, J=7,4 Гц, 1 Н), 6,33 (d, J=7,8 Гц, 1 Н), 3,96 (dd, J=4,5, 9,2 Гц, 1 Н), 3,57 (dd, J=4,5, 13,7 Гц, 1 Н),3,03 (dd, J=9,2, 13,7 Гц, 1 Н), 2,31 (s, 3 Н) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 175,5, 142,4, 136,2, 135,5, 135,4, 134,5, 130,6, 130,1, 129,5, 129,0,128,9, 128,8, 127,9, 126,2, 125,0, 122,6, 108,9, 47,2, 36,5, 21,0 млн-1.C22H17Cl2NO (382,29). Пример 14. Диоксалат 1-(2,6-дихлорфенил)-3-4-[4-(2-метоксифенил)пиперазин-1-ил]бут-2-инил 3-(4-метилбензил)-1,3-дигидро-2 Н-индол-2-она. Гидрид натрия (2,0 г; 55% суспензия; 46 ммоль) трижды промывают по 10 мл гексана для удаления суспендированного масла и суспендируют в 50 мл ДМФ при комнатной температуре. К нему небольшими порциями добавляют 1-(2,6-дихлорфенил)-3-(4-метилбензил)оксиндол (5,0 г; 13 ммоль) и после прекращения газообразования небольшими порциями добавляют дигидрохлорид 1-(4-хлорбут-2-инил)-4-(2 метоксифенил)пиперазина (4,61 г; 13 ммоль). Через 1 ч к реакционной смеси добавляют 2 мл воды для разложения избытка гидрида натрия. Смесь экстрагируют водой и этилацетатом, органическую фазу подкисляют 10 об.% раствором хлористого водорода, кислую водную фазу вновь подщелачивают 25 об.% раствором аммиака и экстрагируют этилацетатом. Органическую фазу сушат над сульфатом натрия и упаривают. Оставшееся желтовато-коричневое масло (7,0 г; 11,2 ммоль) растворяют в 70 мл горячего этилацетата и в него капают раствор дигидрата щавелевой кислоты (2,82 г; 22,4 моль) в 30 мл горячего этилацетата. После охлаждения реакционной смеси соль диоксалат выделяют. Ее отфильтровывают и промывают этилацетатом и гексаном. Выход: 7,88 г белого порошка (75%). Т.пл.: 167-170 С.(21 Н, d, J=13,3 Гц), 3,09, 2,99 (21H, d, J=16,8 Гц), 3,4-3,0 (8 Н, br s), 2,18 (3 Н, s) млн-1. 13 С-ЯМР (CD3OD, TMC, 101 МГц): 178,5, 164,3, 154,0, 143,4, 140,5, 137,7, 133,0, 132,7, 131,7, 131,5,131,1, 130,8, 130,4, 130,3, 130,3, 129,8, 129,0, 126,2, 125,6, 124,7, 122,3, 120,8, 120,1, 113,1, 110,0, 88,5,72,6, 56,2, 54,0, 52,5, 48,9, 47,3, 42,8, 28,8, 21,2 млн-1. Анализ формулы C41H39Cl2N3O10 (804,69): рассчитано: С 61,20, Н 4,89, Cl 8,81, N 5,22%; обнаружено: С 61,12, Н 5,00, Cl 8,73, N 5,25%. Пример 15. 3-Этил-3-(проп-2-инил)-1,3-дигидро-2 Н-индол-2-он. В колбу, которую продули аргоном, отмеряют 2,5 М н-бутиллитий (60 мл; 0,15 моль). В нее добавляют 40 мл ТГФ и раствор охлаждают в ледяной бане с сухим ацетоном до -78 С. При этой температуре в нее при перемешивании капают раствор 3-этилоксиндола (9,66 г; 0,06 моль) в 50 мл ТГФ, перемешивают в течение еще 10 мин, в нее капают пропаргилбромид (4,7 мл; 0,063 моль) и раствору дают возможность нагреться до комнатной температуры. Затем его перемешивают в течение еще 3 ч, в него капают 20 мл этанола для разложения избытка бутиллития. Раствор дистиллировать при помощи роторного испарителя и оставшееся масло экстрагируют водой и этилацетатом. Органическую фазу сушат над сульфатом натрия. Оставшееся масло кристаллизуют путем тритурации с гексаном. Выделенные не совсем белые кристаллы перемешивают в 50 мл гексана для удаления избытка пропаргилбромида, фильтруют и промывают гексаном. Продукт используют для следующих реакций без перекристаллизации. Выход: 10,87 г белого порошка (91%). Т.пл.: 108-110 С (гексан-этилацетат). ИК (KBr): 3308, 3150, 1719 см-1. 1 Н-ЯМР (CDCl3, TMC, 200 МГц): 9,19 (br s, 1H, NH), 7,36 (dt, 1H, J=7,3, 0,7 Гц, Н-4), 7,24 (dt, 1H,J=7,7, 1,5 Гц, Н-6), 7,07 (dt, 1H, J=1,1, 1,1 Гц, Н-5), 6,96 (d, 1 Н, J=7,7 Гц, Н-7), 2,65 (dq, 2H, J=16,5, 2,6 Гц,СН 2 ССН), 2.10-1.88 (m, 2H, СН 2 СН 3), 1,94 (t, 1H, J=2,6 Гц, СН), 0,67 (t, 3H, J=13 Гц, СН 3) млн-1. 13 С-ЯМР (CDCl3, TMC, 50 МГц): 181,4, 141,2, 131,4, 128,1, 123,6, 122,4, 109,8, 79,5, 70,7, 52,3, 29,1,27,0, 8,6 млн-1. Анализ формулы C13H13NO (199,25): рассчитано: С 78,36, Н 6,58, N 7,03%; обнаружено: С 78,29, Н 6,55, N 6,99%. Пример 16. 3-Этил-1-метил-3-(проп-2-инил)-1,3-дигидро-2H-индол-2-он. Гидрид натрия (3,71 г; 55% суспензия; 85 ммоль) трижды промывают по 10 мл гексана и суспендируют в 70 мл ДМФ. Реакционную смесь охлаждают до 0-2 С и при этой температуре в нее капают раствор 3-этил-3-(проп-2-инил)оксиндола (15,0 г; 75 ммоль) в 60 мл ДМФ. По завершении выделения водорода в реакционную смесь капают метилйодид (5,3 мл; 85 ммоль), ее перемешивают в течение 3 ч, в нее капают 5 мл воды для разложения избытка гидрида натрия и экстрагируют водой и диэтиловым эфиром. Органическую фазу сушат над сульфатом натрия, очищают сланцеватым углем, фильтруют и упаривают. Оставшееся не совсем желтое масло кристаллизовали путем тритурации с гексаном. Выход: 12,21 г желтовато-белого порошка (76%). Т.пл.: 79-81 С (гексан-этилацетат). ИК (KBr): 2970, 2930, 1710 (С=О) см-1. 1 Н-ЯМР (CDCl3, ТМС, 200 МГц): 7,39 (d, J=7,3 Гц, 1 Н), 7,30 (dt, J=1,1, 7,7, 1 Н), 7,09 (dt, J=1,1,7,6 Гц, 1 Н), 3,22 (s, 3 Н), 2,71, 2,51 (dd, J=2,5, 16,5 Гц, 2 Н), 2,00 (q, J=7,3 Гц, 2 Н), 1,92 (t, J=2,8 Гц, 1 Н), 0,59(t, J=7,5 Гц, 3 Н) млн-1. 13 С-ЯМР (CDCl3, ТМС, 50 МГц): 178,5, 143,8, 130,9, 128,1, 123,2, 122,4, 107,7, 79,5, 70,4, 51,5, 29,0,26,9, 26,0, 8,5 млн-1. Анализ формулы C14H15NO (213,28): рассчитано: С 78,84, Н 7,09, N 6,57%; обнаружено: С 78,44, Н 7,08, N 6,52%. Пример 17. 1-Бензил-3-этил-3-(проп-2-инил)-1,3-дигидро-2 Н-индол-2-он. Гидрид натрия (3,71 г; 55% суспензия; 85 ммоль) трижды промывают по 10 мл гексана и суспендируют в 70 мл ДМФ. Реакционную смесь охлаждают до 0-2 С и при этой температуре к ней капают раствор 3-этил-3-(проп-2-инил)оксиндола (15,0 г; 75 ммоль) в 60 мл ДМФ. После завершения образования водорода в смесь капают бензилхлорид (9,5 мл; 75 ммоль). Ее перемешивают течение 2 ч, в нее капают 5 мл воды для разложения избытка гидрида натрия и экстрагируют водой и диэтиловым эфиром. Органическую фазу сушат над сульфатом натрия, очищают сланцеватым углем, фильтруют и выпаривают. Оставшееся бледно-желтое масло кристаллизуется при тритурации с гексаном. Выход: 18,71 г не совсем белого порошка (86%). 1- 15014236 Т.пл.: 79-80 С (гексан-этилацетат). ИК (KBr): 1703 (СО) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 7,38-7,20 (m, 6H), 7,17 (dt, J=1,2, 7,7 Гц, 1 Н), 7,05 (dt, J=1,0, 7,6 Гц,1 Н), 6,73 (d, J=7,8 Гц, 1 Н), 4,96, 4,90 (d, J=15,7 Гц, 2 Н), 2,75, 2,62 (dd, J=2,7, 16,5 Гц, 2 Н), 2,02 (q, J=7,4 Гц,2 Н), 1,87 (t, J=2,7 Гц, 1 Н), 0,64 (t, J=7,4 Гц, 3 Н) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 178,6, 143,1, 135,9, 130,9, 128,6, 128,0, 127,5, 127,3, 123,3, 122,5,108,9, 79,6, 70,6, 51,7, 43,7, 29,4, 27,2, 8,7 млн-1. Анализ формулы C20H19NO (289,38): рассчитано: С 83,01, Н 6,62, N 4,84%; обнаружено: С 82,91, Н 6,67, N 4,80%. Способ А (Реакция Манниха гидрогена ацетилена с пиперазинами). В смесь соответствующего N-замещенного 3-пропаргилоксиндола (50 ммоль), соответствующего пиперазина (50 ммоль), 1,0 г моногидрата ацетата меди(II) и 100 мл этанола капают 35% водный раствор формалина (50 мл; 0,63 моль) и раствор кипятят с обратным холодильником в течение 2 ч. Ее фильтруют на стеклянном фильтре G4 для удаления полимерного формальдегида, упаривают и экстрагируют водой и этилацетатом. Органическую фазу очищают сланцевым углем, сушат над сульфатом натрия и выпаривают. Оставшееся бледно-желтое масло очищают путем колоночной хроматографии с использованием в качестве элюента этилацетат. Способ очистки 1. Основный продукт растворяют в 200 мл простого эфира, небольшое количество плавающего осадка отфильтровывают и в чистый раствор при комнатной температуре в течение получаса при интенсивном перемешивании капают рассчитанное количество (1 или 2 мол.экв.) раствора хлористого водорода в простом эфире, разбавленным 50 мл диэтилового эфира. Выделенную белую соль отфильтровывают, промывают простым эфиром и гексаном и сушат в вакуумном пистолете при комнатной температуре в течение 3 ч. Если необходимо, соль гидрохлорид перекристаллизовывают. Способ очистки 2. Если основный продукт не кристаллизуется при добавлении диэтилового эфира и не приводит к получению хорошо фильтруемой соли с хлористым водородом, его растворяют в 200 мл горячего этилацетата и в него в течение 10 мин при перемешивании капают 1 мол.экв. раствора дигидрата щавелевой кислоты в 50 мл горячего этилацетата. Белую соль оксалат выделяют при охлаждении. Ее отфильтровывают при комнатной температуре, промывают этилацетатом и гексаном и сушат. Пример 18. Дигидрохлорид 3-этил-3-4-[4-(2-метоксифенил)пиперазин-1-ил]бут-2-инил-1-метил 1,3-дигидро-2H-индол-2-она. Указанное соединение получают в соответствии со способом А путем применения способа очистки 1 из 3-этил-1-метил-3-(проп-2-инил)-1,3-дигидро-2 Н-индол-2-она и 1-(2-метоксифенил)пиперазина. Т.пл.: 189-192 С. ИК (KBr): 2840, 1710 (С=О) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): kb. 13,7 (1 Н, br s), 8,17 (1 Н, d, J=7,6 Гц), 7,46 (1 Н, dt, J=1,5, 7,9 Гц),7,37 (1 Н, dd, J=0,6, 7,3 Гц), 7,25 (1 Н, dd, J=1,1, 7,7 Гц), 7,11-7,03 (3 Н, m), 6,91 (1 Н, d, J=7,8 Гц), 4,8 (2 Н,m), 4,10 (1 Н, m), 4,06 (3 Н, s), 4,01 (1 Н, m), 3,85 (2 Н, m), 3,50 (2 Н, m), 3,36 (1 Н, d, J=12,5 Гц), 3,29 (3 Н, s),3,21 (1 Н d, J=12,5 Гц), 2,85, 2,78 (2 Н, d, J=16,8 Гц), 2,05-1,83 (2 Н, m), 0,60 (3 Н, t, J=7,3 Гц) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 178,0, 152,4, 144,2, 131,4, 130,6, 128,6, 128,0, 123,7, 123,4, 122,4,121,6, 113,3, 108,0, 68,2, 55,9, 52,1, 48,5, 47,3, 47,1, 46,0, 29,6, 27,1, 26,2, 8,5 млн-1. Анализ формулы C26H33Cl2N3O2 (490,48): рассчитано: С 63,67, Н 6,78, Cl 14,46, N 8,57%; обнаружено: С 62,99, Н 6,84, Cl 13,84, N 8,65%. Пример 19. Монооксалат 3-этил-1-метил-3-[4-(4-пиримидин-2-илпиперазин-1-ил)бут-2-инил]-1,3 дигидро-2 Н-индол-2-она. Указанное соединение получают в соответствии со способом А путем применения способа очистки 2 из 3-этил-1-метил-3-(проп-2-инил)-1,3-дигидро-2 Н-индол-2-она и 2-(пиперазин-1-ил)пиримидина. Т.пл.: 119-121 С. ИК (KBr): 3452, 1702 (С=О) см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц): 8,5 (2 Н, br s), 8,44 (2 Н, d, J=4,8 Гц), 7,35 (1 Н, dd, J=1,8, 7,3 Гц),7,13 (1 Н, dt, J=1,3, 7,7 Гц), 7,00 (1 Н, dt, J=0,9, 7,5 Гц), 6,74 (1 Н, d, J=7,8 Гц), 3,70 (4 Н, s), 3,48, 3,36 (1+1 Н,d, J=16,6 Гц), 3,07 (3 Н, s), 2,79, 2,60 (1+1 Н, d, J=16,3 Гц), 2,34-2,27 (4H, m), 1,81-1,72 (2H, m), 0,46 (3 Н, t,J=7,4 Гц) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 101 МГц): 177,9, 162,5, 161,1, 158,2, 144,2, 130,8, 128,0, 123,2, 122,3,110,6, 108,1, 82,9, 74,2, 52,3, 50,0, 45,8, 42,1, 29,4, 26,5, 25,9, 8,7 млн-1. Анализ формулы C25H29N5O5 (479,54): рассчитано: С 62,62, Н 6,10, N 14,60%; обнаружено: С 62,62, Н 6,08, N 14,30%. Пример 20. Монооксалат 3-4-[4-(4-хлорфенил)пиперазин-1-ил]бут-2-инил-3-этил-1-метил-1,3 дигидро-2 Н-индол-2-она. Указанное соединение получают в соответствии со способом А путем применения способа очистки- 16014236 2, начиная с 3-этил-1-метил-3-(проп-2-инил)-1,3-дигидро-2 Н-индол-2-она и 1-(4-хлорфенил)пиперазина. Т.пл.: 69-72 С. ИК (KBr): 3453, 1710 (С=О) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 8,78 (3 Н, br s), 7,26-7,21 (4 Н, m), 7,08 (1 Н, dt, J=0,8, 7,5 Гц), 6,836,78 (3 Н, m), 3,7 (2 Н, br s), 3,26 (4 Н, br s), 3,20 (3 Н, s), 2,87 (4 Н, br s), 2,78 (1 Н, d, J=16,7 Гц), 2,71 (1H, d,J=16,7 Гц), 1,96-1,79 (2H, m), 0,58 (3 Н, t, J=7,3 Гц) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 178,2, 164,0, 148,3, 143,9, 130,6, 129,1, 128,1, 125,9, 122,9, 122,7,117,7, 107,9, 86,5, 70,0, 52,4, 49,6, 46,7, 45,7, 30,0, 26,9, 26,1, 8,5 млн-1. Анализ формулы C27H30ClN3O5 (512,01): рассчитано: С 63,34, Н 5,91, Cl 6,92, N 8,21%. обнаружено: С 63,43, Н 5,97, Cl 6,99, N 8,20%. Пример 21. Монооксалат 3-этил-1-метил-3-[4-(4-фенилпиперазин-1-ил)бут-2-инил]-1,3-дигидро-2Hиндол-2-она. Указанное соединение получают в соответствии со способом А путем применения способа очистки 2 из 3-этил-1-метил-3-(проп-2-инил)-1,3-дигидро-2H-индол-2-она и 1-фенилпиперазина. Т.пл.: 73-76 С. ИК (KBr): 3453, 1710 (С=О) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 9,71 (3 Н, br s), 7,32-7,22 (4 Н, m), 7,08 (1 Н, dt, J=0,8, 7,5 Гц), 6,94(4 Н, br s), 2,79 (1 Н, d, J=16,6 Гц), 2,71 (1H, d, J=16,6 Гц), 2,04-1,77 (2H, m), 0,58 (3 Н, t, J=7,4 Гц) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 178,1, 163,5, 149,4, 143,9, 130,5, 129,2, 128,1, 122,9, 122,7, 121,1,116,6, 108,0, 87,2, 69,2, 52,3, 49,7, 46,4, 45,6, 29,9, 26,8, 26,0, 8,4 млн-1. Анализ формулы C27H31N3O5 (477,57): рассчитано: С 67,91, Н 6,54, N 8,80%; обнаружено: С 67,20, Н 6,60, N 8,73%. Пример 22. Моногидрохлорид 1-бензил-3-этил-3-4-[4-(2-метоксифенил)пиперазин-1-ил]бут-2 инил-1,3-дигидро-2H-индол-2-она. Указанное соединение получают в соответствии со способом А путем применения способа очистки 1 из 3-этил-1-бензил-3-(проп-2-инил)-1,3-дигидро-2H-индол-2-она и 1-(2-метоксифенил)пиперазина. Т.пл.: 199-202 С. ИК (KBr): 2337, 1713 (С=О) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 7,4-7,2 (5 Н, m), 7,25 (1 Н, dd, J=1,0, 7,3 Гц), 7,14 (1 Н, dt, J=1,3,7,7 Гц), 7,10-7,04 (2 Н, m), 6,97-6,88 (3 Н, m), 6,81 (1 Н, d, J=7,7 Гц), 5,02, 4,92 (2 Н, d, J=15,4 Гц), 3,87 (3 Н,s), 3,64, 3,45 (2 Н, d, J=16,8 Гц), 3,35 (4 Н, br s), 2,88, 2,77 (2 Н, d, J=16,6 Гц), 3,00-2,60 (4 Н, s), 2,02, 1,91(2 Н, m), 0,66 (3 Н, t, J=7,3 Гц) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 178,2, 151,8, 143,2, 138,7, 135,9, 130,5, 128,7, 128,2, 127,9, 127,7,124,2, 123,1, 122,7, 121,2, 118,8, 111,3, 108,9, 88,0, 68,8, 55,2, 52,3, 50,0, 47,0, 45,8, 43,7, 29,9, 27,6, 8,8 млн-1. Анализ формулы C32H36ClN3O2 (530,12): рассчитано: С 72,50, Н 6,85, Cl 6,69, N 7,93%; обнаружено: С 72,16, Н 6,83, Cl 6,50, N 7,89%. Пример 23. Монооксалат 1-бензил-3-этил-3-[4-(4-пиримидин-2-илпиперазин-1-ил)бут-2-инил]-1,3 дигидро-2H-индол-2-она. Указанное соединение получают в соответствии со способом А путем применения способа очистки 2 из 3-этил-1-бензил-3-(проп-2-инил)-1,3-дигидро-2 Н-индол-2-она и 2-(пиперазин-1-ил)пиримидина. Т.пл.: 154-155 С. ИК (KBr): 1716 (С=О) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 10,83 (2 Н, br s), 8,39 (2 Н, d, J=4,8 Гц), 7,40-7,25 (5 Н, m), 7,15 (1 Н,d, J=7,3 Гц), 7,02 (1 Н, dt, J=1,1, 7,7 Гц), 6,87 (1 Н, t, J=7,2 Гц), 6,70 (1 Н, d, J=7,8 Гц), 6,64 (1 Н, t, J=4,8 Гц),4,95 (1 Н, d, J=15,3 Гц), 4,77 (1 Н, d, J=15,3 Гц), 3,90 (4 Н, s), 3,71 (1 Н, d, J=16,8 Гц), 3,41 (1 Н, dt, J=16,8,2,2 Гц), 2,88 (1 Н, d, J=16,6 Гц), 2,72 (1 Н, dt, J=16,6, 2,3 Гц), 2,50 (4 Н, br s), 1,96 (1 Н, m), 1,82 (1 Н, m), 0,63(3 Н, t, J=7,3 Гц) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 178,2, 163,1, 160,8, 157,8, 143,1, 136,0, 130,5, 128,8, 128,3, 128,0,127,9, 122,9, 122,7, 111,3, 108,7, 87,5, 69,1, 52,4, 49,6, 45,7, 43,8, 40,2, 30,2, 27,2, 8,7 млн-1. Анализ формулы C31H33N5O5 (555,64): рассчитано: С 67,01, Н 5,99, N 12,60%; обнаружено: С 66,44, Н 6,00, N 12,44%. Способ Б (каталитическое гидрирование тройной связи до простой связи). Соединение, содержащее тройную связь, (6 ммоль) растворяют в 20 мл метанола, отмеряют в автоклав объемом 70 мл, к ней добавляют 5% палладий на сланцеватом угле (0,30 г) и насыщение осуществляют при давлении водорода 10105 Па (10 бар). Через 2 ч раствор фильтруют и упаривают. Оставшийся продукт представляет собой желтое масло.- 17014236 Способ очистки 1. Масло растворяют в 200 мл простого эфира, небольшое количество плавающего осадка отфильтровывают и в чистый раствор при комнатной температуре в течение получаса при интенсивном перемешивании капают рассчитанное количество (1 мол.экв.) раствора хлористого водорода в 50 мл диэтилового эфира. Выделенную белую соль отфильтровывают, промывают простым эфиром и гексаном и сушат в вакуумном пистолете при комнатной температуре в течение 3 ч. Если необходимо,соль гидрохлорид перекристаллизовывают. Способ очистки 2. Если основный продукт не приводит к получению хорошо фильтруемой соли с хлористым водородом, его растворяют в 200 мл горячего этилацетата и в него в течение 10 мин при перемешивании капают 1 мол.экв. раствора дигидрата щавелевой кислоты в 50 мл горячего этилацетата. Белую соль оксалат выделяют при охлаждении. Ее отфильтровывают при комнатной температуре, промывают этилацетатом и гексаном и сушат. Пример 24. Монооксалат 1-бензил-3-этил-3-[4-(4-пиримидин-2-ил-пиперазин-1-ил)бутил]-1,3 дигидро-2 Н-индол-2-она. Указанное соединение получают в соответствии со способом Б путем применения способа очистки 2 из 1-бензил-3-этил-3-[4-(4-пиримидин-2-ил-пиперазин-1-ил)бут-2-инил]-1,3-дигидро-2 Н-индол-2-она. Т.пл.: 145-146 С. ИК (KBr): 1702 (С=О) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 10,0 (1 Н, br s), 7,30-7,20 (5 Н, m), 7,17 (1 Н t, J=7,6 Гц), 7,13 (1 Н, d,J=6,7 Гц), 7,05 (1 Н, t, J=7,4 Гц), 6,61 (1 Н, t, J=4,8 Гц), 4,98, 4,83 (2H, d, J=15,6 Гц), 4,13 (4 Н, br s), 3,10(4 Н, br s), 2,84 (2 Н, m), 1,95 (2 Н, m), 1,84-1,74 (2 Н, m), 1,60 (2 Н, m), 1,01-0,84 (2 Н, m), 0,59 (3 Н, t, J=7,3 Гц) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 179,7, 163,2, 160,8, 157,9, 143,1, 136,1, 131,4, 128,7, 127,8, 127,6,127,4, 122,8, 122,7, 111,4, 108,9, 57,1, 53,2, 51,8, 43,7, 40,8, 36,9, 31,2, 23,4, 21,6, 8,6 млн-1. Анализ формулы C31H37N5O5 (559,67): рассчитано: С 66,53, Н 6,66, N 12,51%; обнаружено: С 65,88, Н 6,65, N 12,45%. Пример 25. Монооксалат 1-бензил-3-этил-3-4-[4-(2-метоксифенил)пиперазин-1-ил]бутил-1,3 дигидро-2 Н-индол-2-она. Указанное соединение получают в соответствии со способом Б путем применения способа очистки 2 из 1-бензил-3-этил-3-4-[4-(2-метоксифенил)пиперазин-1-ил]бут-2-инил-1,3-дигидро-2 Н-индол-2-она. Т.пл.: 128-129 С. ИК (KBr): 3432, 1704 (С=О) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 7,32-7,21 (5 Н, m), 7,18 (1 Н, dt, J=1,3, 7,7 Гц), 7,13 (1 Н, d, J=6,5 Гц),7,06 (2 Н, m), 6,90 (3 Н, m), 6,77 (1 Н, d, J=7,7 Гц), 5,7 (2 Н, br s), 4,99, 4,84 (21 Н, d, J=15,4 Гц), 3,86 (3 Н, s),3,58 (2 Н, dd, J=11,6, 27,6), 3,46 (2 Н, m), 3,25 (2 Н, m), 2,97 (2 Н, t, J=10,6 Гц), 2,85 (2 Н, m), 1,96 (2 Н, m),1,81 (2 Н, m), 1,67 (2 Н, q, J=8,0 Гц), 0,95 (2 Н, m), 0,60 (3 Н, t, J=7,4 Гц) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 179,8, 163,0, 151,9, 143,1, 136,8, 136,1, 131,4, 129,6, 128,6, 127,8,127,6, 127,6, 127,4, 122,8, 122,7, 121,1, 118,7, 111,6, 108,9, 57,0, 55,4, 53,4, 52,4, 47,5, 43,7, 36,9, 31,1, 23,4,21,6, 8,6 млн-1. Анализ формулы C34H41N3O6 (587,72): рассчитано: С 69,49, Н 7,03, N 7,15%; обнаружено: С 69,08, Н 6,94, N 7,13%. Пример 26. Моногидрохлорид 3-этил-1-метил-3-[4-(4-фенилпиперазин-1-ил)бутил]-1,3-дигидро-2 Ниндол-2-она. Указанное соединение получают в соответствии со способом Б путем применения способа очистки 1 из 3-этил-1-метил-3-[4-(4-фенилпиперазин-1-ил)бут-2-инил]-1,3-дигидро-2 Н-индол-2-она. Т.пл.: 219-222 С. ИК (KBr): 2370, 1711 (С=О) см-1. 1 Н-ЯМР (COCl3, ТМС, 400 МГц): 12,8 (1 Н, brs), 7,4-7,35 (4 Н, m), 7,28 (1 Н, t, J=7,5 Гц), 7,18 (1 Н, m),7,13 (1 Н, d, J=6,7 Гц), 7,09 (1 Н, t, J=7,3 Гц), 6,85 (1 Н, d, J=7,8 Гц), 4,10 (2 Н, br s), 3,65-3,50 (6 Н, m), 3,21(3 Н, s), 2,97 (2 Н, br s), 2,03-1,70 (6 Н, m), 1,07-0,89 (2 Н, m), 0,54 (3 Н, t, J=7,3 Гц) млн-1. 13 С-ЯМР (CDCl3,TMC, 101 МГц): 179,3, 143,7, 131,1, 129,7, 127,7, 125,5, 122,4, 118,8, 107,7, 56,6,53,1, 50,1, 49,8, 48,4, 36,3, 30,7, 25,8, 23,2, 21,3, 8,2 млн-1. Анализ формулы C25H34ClN3O (428,02): рассчитано: Н 8,01, N 9,82%; обнаружено: Н 7,56, N 9,35%. Пример 27. Монооксалат 3-этил-1-метил-3-[4-(4-пиримидин-2-илпиперазин-1-ил)бутил]-1,3 дигидро-2 Н-индол-2-она. Указанное соединение получают в соответствии со способом Б путем применения способа очистки 2 из 3-этил-1-метил-3-[4-(4-пиримидин-2-илпиперазин-1-ил)бут-2-инил]-1,3-дигидро-2 Н-индол-2-она. Т.пл.: 150-152 С. ИК (KBr): 1706 (С=О)см-1.(1 Н, dd, J=1,5, 7,2 Гц), 7,09 (1 Н, t, J=7,3 Гц), 6,84 (1 Н, d, J=7,8 Гц), 6,60 (1H, t, J=4,8 Гц), 4,14 (4 Н, br s),3,20 (3 Н s), 3,15 (4 Н, br s), 2,88 (2H, m), 1,91 (1H, m), 1,88 (1H, m), 1,74 (2H, m), 1,62 (2H, m), 0,54 (3 Н, t,J=7,3 Гц) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 179,7, 163,2, 160,8, 157,8, 143,9, 131,3, 127,9, 122,7, 122,6, 111,3,107,9, 57,1, 53,3, 51,8, 40,7, 36,5, 31,0, 26,0, 23,4, 21,6, 8,4 млн-1. Анализ формулы C25H33N5O5 (483,57): рассчитано: С 62,10, Н 6,88, N 14,48%; обнаружено: С 61,99, Н 6,89, N 14,45%. Способ В (бромирование бутинольных соединений). Соответствующий замещенный дигидрохлорид пиперазин-1-илбут-2-ин-1-ола (20 ммоль) отмеряют в 50 мл трибромида фосфора и дают реагировать в течение 2 ч при 100 С. Ее охлаждают, к ней добавляют 20 мл дихлорметана, не совсем белое вещество фильтруют и используют для реакции связывания без дополнительной очистки. Пример 28. Дигидрохлорид 1-(4-бромбут-2-инил)-4-(2-метоксифенил)пиперазина. Указанное соединение получают в соответствии со способом В из дигидрохлорида 4-[4-(2 метоксифенил)пиперазин-1-ил]бут-2-ин-1-ола. Т.пл.: 185-190 С. 1 Н-ЯМР (ДМСО-d6, ТМС, 200 МГц): 9,8 (2 Н, br s), 7,14-6,88 (4 Н, m), 4,47 (2 Н, s), 4,42 (2 Н, s), 3,81(3 Н, s), 3,00-3,71 (8 Н, m) млн-1. Пример 29. Дигидрохлорид 2-[4-(4-бромбут-2-инил)пиперазин-1-ил]пиримидина. Указанное в заголовке соединение получают в соответствии со способом В из дигидрохлорида 4-(4 пиримидин-2-илпиперазин-1-ил)бут-2-ин-1-ола. Т.пл.: 148-151 С. 1 Н-ЯМР (ДМСО-d6, ТМС, 200 МГц): 8,56 (2 Н, m), 8,4 (2 Н, br s), 6,87 (1 Н, m), 4,66 (2 Н, s), 4,06 (2 Н,m), 3,8-3,1 (8 Н, m) млн-1. Пример 30. Дигидрохлорид 1-(4-бромбут-2-инил)-4-фенилпиперазина. Указанное соединение получают в соответствии со способом В из дигидрохлорида 4-(4 фенилпиперазин-1-ил)бут-2-ин-1-ола. Т.пл.: 195-200 С. 1 Н-ЯМР (ДМСО-d6, ТМС, 200 МГц): 9,5 (2 Н, m), 7,27 (2 Н, t, J=8,0 Гц), 7,02 (2 Н, d, J=7,9 Гц), 6,92(1 Н, t, J=7,0 Гц), 4,43 (2 Н, s), 4,41 (2 Н, s), 4,0-3,0 (8 Н, m) млн-1. Пример 31. Дигидрохлорид 1-(4-бромбут-2-инил)-4-(3-хлорфенил)пиперазина. Указанное соединение получают в соответствии со способом В из дигидрохлорида 4-[4-(3 хлорфенил)пиперазин-1-ил]бут-2-ин-1-ола. Т.пл.: 168-170 С. 1 Н-ЯМР (ДМСО-d6, ТМС, 200 МГц): 8,4 (2 Н, m), 7,28 (1 Н, t, J=8,0 Гц), 7,07 (1 Н, s), 6,98 (1 Н, d, J=8,4 Гц), 6,89 (1 Н, d, J=8,4 Гц), 4,41 (4 Н, br s), 4,0 (2 Н, br s), 3,6 (2 Н, br s), 3,2 (2H, br s) млн-1. Способ Г (связывание 3-этилоксиндола с бромбутинильными соединениями). Гидрид натрия (6,75 г; 50% суспензия; 0,14 моль) трижды промывают по 20 мл гексана и суспендируют в 50 мл ДМФ. Реакционную смесь охлаждают до -20 С и к ней при той же самой температуре капают раствор 3-этилоксиндола (6,45 г; 0,04 ммоль) в 25 мл ДМФ. Когда образование водорода прекращается, к ней при -20 С капают соль гидрохлорид соответствующего бромосоединения, содержащую тройную связь (0,04 моль), растворенную в 75 мл ДМФ. Реакционную смесь перемешивают в течение 3 ч, к ней капают 5 мл воды для разложения избытка гидрида натрия и смесь экстрагируют водой и диэтиловым эфиром. Органическую фазу сушат над сульфатом натрия, очищают сланцеватым углем, фильтруют и выпаривают. Оставшееся бледно-желтое масло очищают путем колоночной хроматографии с использованием в качестве элюента смеси 10:1 дихлорметана и метанола. Способ очистки 1. Если продукт, очищенный путем колоночной хроматографии, кристаллизуется при тритурации с диэтиловым эфиром, его отфильтровывают и перекристаллизуют из смеси гексана и этилацетата. Желаемые соединения получают в форме белых кристаллов. Способ очистки 2. Если основный продукт не кристаллизуется при добавлении диэтилового эфира,его растворяют в 100 мл горячего этилацетата и в него в течение 10 мин при перемешивании капают 1 мол.экв. раствора дигидрата щавелевой кислоты в 50 мл горячего этилацетата. Белую соль оксалат выделяют при охлаждении. Ее отфильтровывают при комнатной температуре, промывают этилацетатом и гексаном и сушат. Пример 32. Монооксалат 3-этил-3-[4-(4-фенилпиперазин-1-ил)бут-2-инил]-1,3-дигидро-2H-индол-2 она. Указанное соединение получают в соответствии со способом Г путем применения способа очистки 2 из дигидрохлорида 1-(4-бромбут-2-инил)-4-фенилпиперазина. Т.пл.: 94-95 С. ИК (KBr): 3210, 1715 (С=О) см-1. Н-ЯМР (CDCl3, ТМС, 400 МГц): 9,99 (1 Н, br s), 7,28-7,20 (2 Н, m), 7,12 (1 Н, d, J=7,3 Гц), 7,06 (1 Н, t,J=7,5 Гц), 6,99-6,86 (5 Н, m), 3,84, 3,67 (21 Н, d, J=16,5 Гц), 3,27 (4 Н, br s), 2,89 (4 Н, br s), 2,76, 2,62 (21 Н,d, J=16,4 Гц), 1,87 (2 Н, m), 0,63 (3 Н, t, J=7,3 Гц) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 180,7, 164,3, 149,6, 142,3, 131,1, 129,2, 127,9, 122,7, 122,1, 120,9,116,6, 110,7, 86,9, 69,5, 53,3, 49,9, 46,4, 45,6, 29,7, 27,2, 8,7 млн-1. Анализ формулы C26H29N3O5 (463,54): рассчитано: С 67,37, Н 6,31, N 9,07%; обнаружено: С 66,71, Н 6,18, N 8,90%. Пример 33. Монооксалат 3-этил-3-[4-(4-пиримидин-2-илпиперазин-1-ил)бут-2-инил]-1,3-дигидро 2 Н-индол-2-она. Указанное в заголовке соединение получают в соответствии со способом Г путем применения способа очистки 2 из дигидрохлорида 2-[(4-бромбут-2-инил)пиперазин-1-ил]пиримидина. Т.пл.: 147-149 С. ИК (KBr): 1714 (С=О), 1644, 1227, 754 см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц): 10,4 (1 Н, s), 9,8 (2 Н, br s), 8,36 (2 Н, d, J=4,8 Гц), 7,23(1 Н, d,J=7,1 Гц), 6,93 (1 Н, dt, J=1,2, 7,6 Гц), 6,84 (1 Н, dt, J=0,9, 7,4 Гц), 6,67 (1 Н, d, J=7,8 Гц), 6,64 (1 Н, t,J=4,8 Гц), 3,69 (4 Н, br s), 3,44 (2 Н, s), 2,70, 2,51 (21 Н, d, J=16,4 Гц), 2,44 (4 Н, m), 1,80-1,60 (2 Н, m), 0,45(3 Н, t, J=7,3 Гц) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 101 МГц): 179,8, 163,2, 142,7, 131,5, 127,3, 123,6, 121,7, 110,8, 109,4,109,4, 83,8, 73,4, 52,4, 50,0, 45,7, 41,7, 29,3, 26,7, 8,7 млн-1. Анализ формулы C24H27N5O5 (465,51): рассчитано: С 61,92, Н 5,85, N 15,04%; обнаружено: С 61,17, Н 5,84, N 14,86%. Пример 34. 3-Этил-3-4-[4-(2-метоксифенил)пиперазин-1-ил]бут-2-инил-1,3-дигидро-2 Н-индол-2 он. Указанное соединение получают в соответствии со способом Г путем применения способа очистки 1 из дигидрохлорида 1-(4-бромбут-2-инил)-4-(2-метоксифенил)пиперазина. Т.пл.: 161-163 С. ИК (KBr): 3077, 1715 (С=О) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 9,19 (1 Н, s), 7,21 (1 Н, d, J=6,9 Гц), 7,11 (1 Н, dt, J=1,2, 7,7 Гц), 7,086,90 (5 Н, m), 6,65 (1 Н, d, J=7,5 Гц), 3,96 (3 Н, s), 3,29 (1 Н, d, J=16,2 Гц), 3,17 (1 Н, dt, J=2,3, 16,7 Гц), 3,15(2 Н, br s), 2,91 (2 Н br s), 2,78 (1 Н, dt, J=2,3, 16,2 Гц), 2,65 (2H, d, J=16,7 Гц), 2,60 (2H, br s), 2,45 (2H, br s),2,00-1,80 (2H, m), 0,68 (3H, t, J=7,4 Гц) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 180,6, 152,0, 141,9, 141,3, 131,7, 127,7, 123,3, 123,0, 122,3, 121,2,118,7, 111,1, 109,7, 81,3, 75,6, 55,0, 53,4, 50,6, 50,2, 46,7, 29,7, 27,7, 8,7 млн-1. Анализ формулы C25H29N3O2 (403,53): рассчитано: С 74,41, Н 7,24, N 10,41%; обнаружено: С 73,43, Н 7,36, N 10,19%. Пример 35. Моногидрохлорид 3-4-[4-(3-хлорфенил)пиперазин-1-ил]бут-2-инил-3-этил-1,3-дигидро-2 Н-индол-2-она. Получение этил-(3-этил-2-оксо-2,3-дигидроиндол)-1-карбоксилата осуществляют в соответствии со способами, известными из литературы. Гидрид натрия (1,59 г; 50% суспензия; 33 ммоль) трижды промывают по 10 мл гексана и суспендируют в 30 мл ДМФ. Реакционную смесь охлаждают до -20 С и в нее при той же самой температуре капают раствор этил-(3-этил-2-оксо-2,3-дигидроиндол)-1-карбоксилата(2,32 г; 10 ммоль) в 10 мл ДМФ. После прекращения образования водорода к ней при -20 С капают раствор дигидрохлорида 1-(4-хлорбут-2-инил)-4-(3-хлорфенил)пиперазина (3,56 г; 10 ммоль) в 20 мл ДМФ. Смесь перемешивают в течение 5 ч, к ней капают 5 мл воды для разрушения избытка гидрида натрия и экстрагируют водой и диэтиловым эфиром. Органическую фазу сушат над сульфатом натрия, очищают сланцеватым углем, фильтруют и упаривают. Оставшееся бледно-желтое масло растворяют в 100 мл этилацетата и к ней при перемешивании капают 1 мол.экв. раствора хлорида водорода в 20 мл этилацетата. Выделенную не совсем белую соль фильтруют, промывают этилацетатом и гексаном и перекристаллизуют из изопропанола. Выход: 1,06 г белого порошка (24%). Т.пл.: 201-203 С. ИК (KBr): 3166, 1712 (С=О), 760 см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 9,96 (1 Н, s), 7,22 (1 Н, t, J=8,1 Гц), 7,16 (1 Н, d, J=7,0 Гц), 7,10-6,85- 20014236 рассчитано: С 64,87, Н 6,12, Cl 15,96, N 9,46%; обнаружено: С 64,82, Н 6,11, Cl 15,94, N 9,43%. Пример 36. Моногидрохлорид (Z)-3-4-[4-(3-хлорфенил)пиперазин-1-ил]бут-2-енил-3-этил-1,3 дигидро-2 Н-индол-2-она. Моногидрохлорид 3-4-[4-(3-хлорфенил)пиперазин-1-ил]бут-2-инил-3-этил-1,3-дигидро-2 Н-индол-2-она (7,15 г; 16 ммоль) суспендируют в 150 мл тетрагидрофурана (ТГФ) и к нему добавляют никель Ренея (1,0 г). Гидрирование осуществляют в течение 10 ч в автоклаве при исходном давлении 10 105 Па(10 бар) при температуре 90 С. Продукт затем растворяют в метаноле, катализатор отфильтровывают и фильтрат упаривают. Соль гидрохлорид соединения, имеющего (Z) конфигурацию, содержащего двойную связь, выделяют в форме не совсем белого вещества. Выход: 3,49 г не совсем белого порошка (49%). Т.пл.: 219-222 С. ИК (KBr): 3116, 2569, 1699 (С=О) см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц): 11,4 (1 Н, br s), 10,5 (1 Н, s), 7,29 (1 Н, d, J=47,9 Гц), 7,25 (1 Н, d,J=8,1 Гц), 7,18 (1 Н, t, J=7,4 Гц), 7,03 (1 Н, s), 6,99 (1 Н, t, J=7,4 Гц), 6,94 (1 Н, dd, J=1,8, 8,4 Гц), 6,86 (2 Н, d,J=7,5 Гц), 5,58 (1 Н, m), 5,43 (1 Н, m), 3,84 (2 Н, br s), 3,71 (2 Н, br s), 3,30 (2 Н, br s), 3,00 (2 Н, br s), 2,65, 2,55(21 Н, dd, J=7,3, 14,2 Гц), 1,80 (2H, m), 0,52 (3H, t, J=7,3 Гц) млн-1. 13 С-ЯМР (ДМСО-d6, TMC, 101 МГц): 180,2, 150,8, 142,4, 134,0, 133,1, 131,4, 130,7, 127,3, 123,5,121,5, 121,5, 120,9, 119,2, 115,3, 109,4, 52,9, 51,3, 49,7, 44,9, 34,6, 29,6, 8,5 млн-1. Анализ формулы C24H29Cl2N3O (446,42): рассчитано: С 64,57, Н 6,55, Cl 15,88, N 9,41%; обнаружено: С 64,11, Н 6,95, Cl 15,65, N 9,27%. Способ Д (получение -галогеноалкильного соединения). В колбу, которую продули аргоном, отмеряют 2,5 М н-бутиллитий (60 мл; 0,15 моль). В нее добавляют 200 мл ТГФ и раствор охлаждают в ледяной бане с сухим ацетоном до -78 С. При этой температуре в нее при перемешивании капают раствор 3-алкилоксиндола (0,20 моль) в 250 мл ТГФ. Смесь перемешивают в течение еще 10 мин, в нее капают дигалогеноалкан (1-бром-4-хлорбутан, 1-бром-3-хлорпропан,1,5-дибромпентан или 1,6-дибромгексан; 0,50 моль) и раствору дают возможность нагреться до комнатной температуры. Затем его перемешивают в течение еще 3 ч и в него капают 20 мл этанола для разложения избытка бутиллития. Раствор дистиллируют при помощи роторного испарителя и оставшееся масло экстрагируют водой и этилацетатом. Органическую фазу сушат над сульфатом натрия. Оставшееся масло кристаллизуют путем растирания с гексаном. Выделенные не совсем белые кристаллы перемешивают в 200 мл гексана для удаления избытка дигалогеноалкана, фильтруют и промывают гексаном. Продукт используют для следующих реакций без перекристаллизации. Аналитические образцы могут быть получены путем перекристаллизации из указанного растворителя. Пример 37. 3-(4-Хлорбутил)-3-этил-1,3-дигидро-2H-индол-2-он. Указанное соединение получают в соответствии со способом Д из 3-этил-1,3-дигидро-2H-индол-2 она и 1-бром-4-хлорбутана. Т.пл.: 104-105 С (гексан-этилацетат). ИК (KBr): 3181, 2941, 1700, 1306, 755 см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 8,57 (br s, 1H, NH), 7,21 (dt, 1H, J=7,6, 1,5 Гц, Н-6), 7,12 (d, 1H,J=7,4 Гц, Н-4), 7,06 (dt, 1H3, J=7,5, 1,0 Гц, Н-5), 6,92 (d, 1H, J=7,7 Гц, Н-7), 3,39 (t, 2H, J=6,7 Гц, CH2Cl),1,96-1,84 (m, 2H, СН 2), 1,83-1,74 (m, 2 Н, СН 2), 1,74-1,60 (m, 2 Н, СН 2), 1,24-1,18 (m, 1 Н), 1,08-1,03 (m, 1 Н),0,64 (t, 3 Н, J=7,4 Гц, СН 3) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 182,4, 141,2, 132,3, 127,7, 123,0, 122,5, 109,6, 54,1, 44,4, 36,8, 32,7,31,0, 21,8, 8,5 млн-1. Анализ формулы C14H18ClNO (251,76): рассчитано: С 66,79, Н 7,21, N 5,56, Cl 14,08%; обнаружено: С 66,89, Н 7,16, N 5,84, Cl 14,19%. Пример 38. 3-(4-Хлорбутил)-3-этил-5-фтор-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом Д из 3-этил-5-фтор-1,3-дигидро-2 Ниндол-2-она и 1-бром-4-хлорбутана. Т.пл.: 96-97 С (гексан-этилацетат). ИК (KBr): 3159, 1716, 817 см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 8,99 (br s, 1H, NH), 6,95-6,85 (m, 3H), 3,40 (t, 2 Н, J=6,7 Гц, CH2Cl),1,97-1,88 (m, 2 Н, СН 2), 1,83-1,75 (m, 2 Н, СН 2), 1,73-1,62 (m, 2 Н), 1,25-1,20 (m, 1 Н), 1,09-1,04 (m, 1 Н), 0,65- 21014236 обнаружено: С 62,49, Н 6,20, N 4,98, Cl 13,48%. Пример 39. 3-(4-Хлорбутил)-3-этил-6-фтор-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом Д из 3-этил-6-фтор-1,3-дигидро-2 Ниндол-2-она и 1-бром-4-хлорбутана. Т.пл.: 95-97 С (гексан-этилацетат). ИК (KBr): 3195, 1728, 1132 см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 9,34 (br s, 1H, NH), 7,05 (dd, 1H, J=8,1,5,3 Гц, Н-4), 6,75 (ddd, 1H,J=9,6, 8,1, 2,4 Гц, Н-5), 6,71 (dd, 1H, J=8,8, 2,4 Гц, Н-7), 3,44 (t, 2H, J=6,7 Гц, CH2Cl), 2,00-1,70 (m, 4H,2 СН 2), 1,70-1,60 (m, 2H, СН 2), 1,23-1,18 (m, 1 Н), 1,08-1,04 (m, 1 Н), 0,64 (t, 3 Н, J=7,4 Гц, СН 3) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 183,3, 162,5 (d, J=244,1 Гц), 142,5 (d, J=7,8 Гц), 127,5 (d, J=13,0 Гц), 123,8 (d, J=9,5 Гц), 108,8 (d, J=22,5 Гц), 98,5 (d, J=27,4 Гц), 53,8, 44,4, 36,8, 32,5, 31,0, 21,6, 8,4 млн-1. Анализ формулы C14H17ClFNO (269,75): рассчитано: С 62,34, Н 6,35, N 5,19, Cl 13,14%; обнаружено: С 62,09, Н 6,22, N 5,28, Cl 13,43%. Пример 40. 3-(4-Хлорбутил)-3-этил-5-метил-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом Д из 3-этил-5-метил-1,3-дигидро-2 Ниндол-2-она и 1-бром-4-хлорбутана. Т.пл.: 79-80 С (гексан). ИК (KBr) 3286, 1719 см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 8,70 (br s, 1H, NH), 7,00 (d, 1H, J=7,8 Гц, Н-6), 6,92 (s, 1H, Н-4),6,81 (d, 1H, J=7,9 Гц, Н-7), 3,39 (t, 2H, J=6,8 Гц, CH2Cl), 1,95-1,85 (m, 2 Н), 1,82-1,70 (m, 2H), 1,70-1,58 (m,2H), 1,30-1,12 (m, 1H), 1,10-0,98 (m, 1 Н), 0,63 (t, 3H, J=7,3 Гц, СН 3) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 182,5, 138,8, 132,4, 131,9, 128,0, 123,7, 109,3, 54,1, 44,4, 36,9, 32,7,31,0, 21,8, 8,4 млн-1. Анализ формулы C15H20ClNO (265,79): рассчитано: С 67,79, Н 7,58, N 5,27,Cl 13,34%; обнаружено: С 67,98, Н 7,43, N 5,11, Cl 13,09%. Пример 41. 3-(4-Хлорбутил)-3-этил-7-метил-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом Д из 3-этил-7-метил-1,3-дигидро-2Hиндол-2-она и 1-бром-4-хлорбутана. Т.пл.: 112-113 С (гексан-этилацетат). ИК (KBr): 3181, 1703 (С=О), 748 см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 0,63 (3 Н, t, J=7,4 Гц), 1,07-1,02 (1 Н, m), 1,25-1,17 (1 Н, m), 1,70-1,60(2 Н, m), 1,81-1,72 (2 Н, m), 1,96-1,86 (2 Н, m), 2,31 (3 Н, s), 3,36 (2 Н, t, J=6,8 Гц), 6,94 (1 Н, dd, J=1,7, 7,3 Гц),6,97 (1 Н, t, J=7,3 Гц), 7,03 (1 Н, dd, J=1,4, 7,2 Гц), 9,4 (1 Н, br s) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 8,5, 16,5, 21,8, 31,0, 32,7, 36,8, 44,4, 54,4, 119,1, 120,3, 122,4, 129,1,131,9, 140,1, 183,1 млн-1. Анализ формулы C15H20ClNO (265,79): рассчитано: С 67,79, Н 7,58, N 5,27, Cl 13,34%; обнаружено: С 67,56, Н 7,49, N 5,24, Cl 13,29%. Пример 42. 3-(3-Хлорпропил)-3-этил-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом Д из 3-этил-1,3-дигидро-2 Н-индол-2 она и 1-бром-3-хлорпропана. Т.пл.: 91-93 С (гексан). ИК (KBr): 3183, 1701, 751 см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 9,15 (br s, 1H, NH), 7,23 (dt, 1H, J=7,7, 1,3 Гц, Н-6), 7,14 (d, 1H,J=6,8 Гц, Н-4), 7,06 (dt, 1H, J=7,4, 0,9 Гц, Н-5), 6,95 (d, 1H, J=7,7 Гц, Н-7), 3,48-3,36 (m, 2 Н, CH2Cl),2,02-1,93 (m, 3 Н), 1,85-1,78 (m, 1 Н), 1,66-1,54 (m, 1 Н), 1,44-1,30 (m, 1 Н), 0,65 (t, 3H, J=7,4 Гц, СН 3) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 182,6, 141,3, 132,0, 127,9, 123,0, 122,6, 109,8, 53,7, 44,8, 34,8, 31,0,27,5, 8,5 млн-1. Анализ формулы C13H16ClNO (237,73): рассчитано: С 65,68, Н 6,78, N 5,89, Cl 14,91%; обнаружено: С 65,51, Н 6,70, N 5,82, Cl 14,68%. Пример 43. 3-(5-Бромпентил)-3-этил-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом Д из 3-этил-1,3-дигидро-2H-индол-2 она и 1,5-дибромпентана. Т.пл.: 77-78 С (гексан). ИК (KBr): 3290, 1718, 772 см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 9,11 (br s, 1 Н, NH), 7,20 (dt, 1H, J=7,6, 1,4 Гц, Н-6), 7,11 (d, 1H,J=7,3 Гц, Н-4), 7,05 (dt, 1H, J=7,4, 1,0 Гц, Н-5), 6,94 (d, 1H, J=7,4 Гц), 3,27 (t, 2 Н, J=6,9 Гц, CH2Br),1,98-1,86 (m, 2 Н, СН 2), 1,84-1,74 (m, 2 Н, СН 2), 1,71 (квинтет, 2 Н, J=7,2 Гц, СН 2), 1,38-1,24 (m, 2 Н), 1,181,04 (m, 1 Н), 0,96-0,84 (m, 1 Н), 0,63 (t, 3H, J=7,4 Гц, СН 3) млн-1. С-ЯМР (CDCl3, ТМС, 101 МГц): 182,9, 141,4, 132,5, 127,6, 122,9, 122,4, 109,7, 54,2, 37,4, 33,6, 32,4,31,0, 28,2, 23,4, 8,5 млн-1. Анализ формулы C15H20BrNO (310,24). Рассчитано: С 58,07, Н 6,50, N 4,51, Br 25,76%. Обнаружено: С 57,95, Н 6,42, N 4,67, Br 25,58%. Пример 44. 3-(4-Хлорбутил)-3-изобутил-1,3-дигидро-2H-индол-2-он. Указанное соединение получают в соответствии со способом Д из 3-изобутил-1,3-дигидро-2Hиндол-2-она и 1-бром-4-хлорбутана. Т.пл.: 124-125 С (гексан-этилацетат). ИК (KBr): 3208, 1713, 747 см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 9,02 (br s, 1H, NH), 7,21 (dt, 1H, ,7=7,5, 1,4 Гц, Н-6), 7,11 (td, 1H,J=7,4, 0,6 Гц, Н-4), 7,04 (dt, 1H, J=7,4, 1,0 Гц, Н-5), 6,95 (d, 1 Н, J=7,7 Гц, Н-7), 3,37 (t, 2H, J=6,7 Гц,CH2Cl), 1,95-1,70 (m, 4H, 2 СН 2), 1,70-1,58 (m, 2 Н, СН 2), 1,38-1,30 (m, 1 Н), 1,23-1,17 (m, 1 Н), 1,02-0,98(m, 1 Н), 0,73 (d, 3 Н, J=6,6 Гц, СН 3), 0,61 (d, 3H, J=6,6 Гц, СН 3) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 183,1, 141,1, 132,6, 127,7, 123,3, 122,3, 109,8, 53,0, 46,3, 44,4, 39,2,32,6, 25,3, 24,2, 23,6, 21,1 млн-1. Анализ формулы C16H22ClNO (279,81): рассчитано: С 68,68, Н 7,93, N 5,01, Cl 12,67%; обнаружено С 68,49, Н 7,89, N 4,92, Cl 12,89%. Пример 45. 3-(5-Бромпентил)-3-этил-5-фтор-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом Д из 3-этил-5-фтор-1,3-дигидро-2 Ниндол-2-она и 1,5-дибромпентана. Т.пл.: 82-83 С (гексан). ИК (KBr): 3293, 1720, 1690, 1175, 817 см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 7,96 (br s, 1 Н, NH), 6,92 (dt, 1H, J=8,8, 2,6 Гц, Н-6), 6,86 (dd, 1H,J=8,0, 2,6 Гц, Н-4), 6,82 (dd, 1H, J=8,4, 4,3 Гц, Н-7), 3,30 (t, 2 Н, J=6,9 Гц, CH2Br), 1,96-1,87 (m, 2 Н, СН 2),1,80-1,68 (m, 4 Н, 2 СН 2), 1,40-1,25 (m, 2 Н, СН 2), 1,18-1,04 (m, 1 Н), 0,96-0,84 (m, 1 Н), 0,64 (t, 3H, J=7,4 Гц,СН 3) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 181,8, 159,3 (d, J=240,7 Гц), 136,9, 134,4 (d, J=8,0 Гц), 114,0 (d,J=23,3 Гц), 111,0 (d, J=24,4 Гц), 109,9 (d, J=8,0 Гц), 54,7, 37,5, 33,6, 32,4, 31,1, 28,2, 23,5, 8,5 млн-1. Анализ формулы C15H19BrFNO (328,23): рассчитано: С 54,89, Н 5,83, N 4,27, Br 24,34%; обнаружено: С 54,68, Н 5,89, N 4,35, Br 24,16%. Пример 46. 3-(5-Бромпентил)-3-этил-5-метил-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом Д из 3-этил-5-метил-1,3-дигидро-2 Ниндол-2-она и 1,5-дибромпентана. Т.пл.: 72-73 С (гексан). ИК (KBr): 3262, 1726, 1694, 812 см-1. 1 Н-ЯМР(COCl3, ТМС, 400 МГц): 7,55 (brs, 1H, NH), 7,00 (d, 1H,J=7,9 Гц, Н-6), 6,92 (s, 1H, Н-4), 6,75(d, 1H,J=7,8 Гц, Н-7), 3,30 (t, 2H, J=6,8 Гц, CH2Br), 1,94-1,84 (m, 2 Н, СН 2), 1,79-1,68 (m, 4 Н, 2 СН 2), 1,351,24 (m, 2 Н, СН 2), 1,24-1,13 (m, 1 Н), 0,93-0,84 (m, 1 Н), 0,63 (t, 3H,J=7,4 Гц, СН 3) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 181,8, 159,3 (d, J=240,7 Гц), 136,9, 134,4 (d, J=8,0 Гц), 114,0 (d,J=23,3 Гц), 111,0 (d, J=24,4 Гц), 109,9 (d, J=8,0 Гц), 54,7, 37,5, 33,6, 32,4, 31,1, 28,2, 23,5, 8,5 млн-1. Анализ формулы C16H22BrNO (324,26): рассчитано: С 59,27, Н 6,84, N 4,32, Br 24,64%; обнаружено: С 59,18, Н 6,92, N 4,55, Br 24,51%. Пример 47. 3-(5-Бромпентил)-3-этил-6-фтор-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом Д из 3-этил-6-фтор-1,3-дигидро-2 Ниндол-2-она и 1,5-дибромпентана. Т.пл.: 95-96 С (гексан). ИК (KBr): 3300, 1722, 857 см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 9,24 (br s, 1H, NH), 7,01 (dd, 1H, J=8,1, 5,3 Гц, Н-5), 6,72 (ddd, 1H,J=9,6, 8,2, 2,3 Гц, Н-5), 6,68 (d, 1H, J=8,8, 2,3 Гц, Н-7), 3,26 (t, 2 Н, J=7,4 Гц, CH2Br), 1,92-1,83 (m, 2 Н,СН 2), 1,80-1,65 (m, 4 Н, 2 СН 2), 1,35-1,25 (m, 2 Н, СН 2), 1,09-1,00 (m, 1 Н), 0,92-0,84 (m, 1 Н), 0,60 (t, 3H,J=7,4 Гц, СН 3) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 183,3, 162,4 (d, J=244,1 Гц), 142,5 (d, J=11,8 Гц), 127,7 (d, J=3,1 Гц), 123,8 (d, J=9,9 Гц), 108,7 (d, J=22,1 Гц), 98,4 (d, J=27,1 Гц), 53,9, 37,4, 33,6, 32,3, 31,0, 28,2, 23,4, 8,4 млн-1. Анализ формулы C15H19BrFNO (328,23): рассчитано: С 54,89, Н 5,83, N 4,27, Br 24,34; обнаружено: С 54,69, Н 5,67, N 4,39, Br 24,19%.- 23014236 Способ Е (хлорирование -галогеналкильного соединения в положении 5). Галогеналкильное соединение (5 ммоль) растворяют в 15 мл ледяной уксусной кислоты, раствор охлаждают до начала отделения ледяной уксусной кислоты (14-16 С) и к нему капают раствор 0,5 мл(5,7 ммоль) сульфурилхлорида в 5 мл ледяной уксусной кислоты. Смесь перемешивают в течение 2 ч при той же самой температуре и затем капают с помощью пипетки в смесь лед-вода. Выделенное белое вещество фильтруют, промывают водой и гексаном, сушат и используют для реакции сочетания без очистки. Аналитические образцы могут быть получены путем перекристаллизации из указанного растворителя. Пример 48. 5-Хлор-3-(4-хлорбутил)-3-этил-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом Е из 3-(4-хлорбутил)-3-этил-1,3 дигидро-2H-индол-2-она. Т.пл.: 116-117 С (гексан-этилацетат). ИК (KBr): 3285, 1717, 818 см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 8,72 (br s, 1H, NH), 7,15 (dd, 1H, J=8,2, 2,1 Гц, Н-6), 7,12 (d, 1H,J=2,1 Гц, Н-4), 6,86 (d, 1H, J=8,2 Гц, Н-7), 3,41 (t, 2H, J=6,7 Гц, CH2Cl), 2,00-1,86 (m, 2 Н, СН 2), 1,84-1,74(m, 2 Н, СН 2), 1,74-1,60 (m, 2 Н), 1,29-1,15 (m, 1 Н), 1,12-0,95 (m, 1 Н), 0,65 (t, 3H, J=7,4 Гц, СН 3) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 182,0, 139,8, 134,2, 127,9, 127,8, 123,4, 110,7, 54,5, 44,4, 36,8, 32,5,31,0, 21,7, 8,5 млн-1. Анализ формулы C14H17Cl2NO (286,20): рассчитано: С 58,75, Н 5,99, N 4,89, Cl 24,77%; обнаружено: С 58,61, Н 5,96, N 4,80, Cl 24,66%. Пример 49. 5-Хлор-3-(3-хлорпропил)-3-этил-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом Е из 3-(3-хлорпропил)-3-этил-1,3 дигидро-2 Н-индол-2-она. Т.пл.: 105-107 С (гексан). ИК (KBr): 3221, 2963, 1700 (С=О), 1677, 1474 см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 9,15 (br s, 1 Н, NH), 7,21 (dd, 1H, J=8,2, 2,1 Гц, H-6), 7,12 (d, 1 Н,J=2,0 Гц, Н-4), 6,88 (d, 1H, J=8,2 Гц, Н-7), 3,43-3,39 (m, 2H, CH2Cl), 2,10-1,77 (m, 4 Н, 2 СН 2), 1,62-1,55 (m,1 Н), 1,42-1,38 (m, 1 Н), 0,66 (t, 3 Н, J=7,4 Гц, СН 3) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 182,1, 139,8, 133,9, 128,1, 128,0, 123,5, 110,8, 54,1, 44,6, 34,7, 30,9,27,5, 8,5 млн-1. Анализ формулы C13H15Cl2NO (272,18): рассчитано: С 57,37, Н 5,56, N 5,15, Cl 26,05%; обнаружено: С 57,19, Н 5,64, N 5,28, Cl 25,88%. Пример 50. 5-Хлор-3-(4-хлорбутил)-3-этил-6-фтор-1,3-дигидро-2H-индол-2-он. Указанное соединение получают в соответствии со способом Е из 6-фтор-3-(4-хлорбутил)-3-этил 1,3-дигидро-2 Н-индол-2-она. Т.пл.: 131-133 С (гексан-этилацетат). ИК (KBr): 3289, 1720, 1143 см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 8,90 (br s, 1 Н, NH), 7,12 (d, 1H, J=7,1, Н-4), 6,79 (d, 1H, J=8,8 Гц,Н-7), 3,42 (t, 2H, J=6,7 Гц, CH2Cl), 1,96-1,84 (m, 2H, СН 2), 1,80-1,63 (m, 4 Н, 2 СН 2), 1,30-1,20 (m, 1 Н),1,20-1,04 (m, 1 Н), 0,65 (t, 3 Н, J=7,4 Гц, СН 3) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 182,3, 157,6 (d, J=247,2 Гц), 140,9 (d, J=11,1 Гц), 128,8 (d,J=3,8 Гц), 124,8, 114,3 (d, J=18,3 Гц), 99,5 (d, J=26,7 Гц), 54,2, 44,3, 36,8, 32,4, 31,0, 21,6, 8,4 млн-1. Анализ формулы C14H16Cl2FNO (304,19): рассчитано: С 55,28, Н 5,30, N 4,60, Cl 23,31%; обнаружено: С 55,19, Н 5,27, N 4,58, Cl 23,34%. Способ Ж (5,7-дихлорирование -хлоралкильных соединений). Хлоралкильное соединение (40 ммоль) растворяют в 80 мл ледяной уксусной кислоты и к ней при комнатной температуре капают 9,6 мл (120 ммоль) сульфурилхлорида. Раствор оставляют при 60 С на 3 ч. Затем его охлаждают, выливают в лед и экстрагируют диэтиловым эфиром. Эфирную фазу дважды экстрагируют 10 об.% раствором NaOH, сушат над сульфатом натрия и упаривают. Полученное таким образом бледно-желтое масло тритурируют с гексаном, кристаллическое белое вещество перемешивают в гексане, фильтруют, промывают гексаном, сушат и используют для реакции сочетания без очистки. Аналитические образцы могут быть получены путем перекристаллизации из указанного растворителя. Пример 51. 5,7-Дихлор-3-(4-хлорбутил)-3-этил-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом Ж из 3-(4-хлорбутил)-3-этил-1,3 дигидро-2 Н-индол-2-она. Т.пл.: 65-67 С (гексан). ИК (KBr): 3165, 2964, 1713 (С=О), 1455 см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 8,38 (br s, 1H, NH), 7,20 (d, 1H, J=1,9 Гц, Н-6), 6,97 (d, 1H,- 24014236J=1,8 Гц, Н-4), 3,38 (t, 2H, J=6,7 Гц, CH2Cl), 1,95-1,84 (m, 2H, СН 2), 1,76-1,60 (m, 4 Н, 2 СН 2), 1,19-1,16 (m,1 Н), 1,04-0,96 (m, 1 Н), 0,62 (t, 3 Н, J=7,4 Гц, СН 3) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 180,5, 137,7, 135,1, 128,3, 127,6 121,9, 115,7, 55,7, 44,3, 36,8, 32,5,31,0, 21,7, 8,5 млн-1. Анализ формулы C14H16Cl3NO (320,65): рассчитано: С 52,44, Н 5,03, N 4,37, Cl 33,17%; обнаружено: С 52,37, Н 4,97, N 4,27, Cl 33,18%. Пример 52. 5,7-Дихлор-3-(4-хлорбутил)-3-изобутил-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом Ж из 3-(4-хлорбутил)-3-изобутил-1,3 дигидро-2 Н-индол-2-она. Т.пл.: 93-94 С (гексан). ИК (KBr): 3144, 1719, 1459 см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 8,49 (br s, 1H, NH), 7,24 (dt, 1H, J=1,9 Гц, Н-6), 7,01 (d, 1 Н,J=1,7 Гц, Н-4), 3,41 (t, 2H, J=6,7 Гц, CH2Cl), 1,91 (m, 2H, СН 2), 1,67 (m, 4 Н, 2 СН 2), 1,34 (m, 1 Н), 1,20 (m,1 Н), 1,01 (m, 1 Н), 0,74 (d, 3H, J=6,7 Гц, СН 3), 0,66 (d, 3H, J=6,7 Гц, СН 3) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 181,0, 137,5, 135,4, 128,2, 127,6, 122,2, 115,4, 54,5, 46,3, 44,3, 39,2,32,4, 25,3, 24,3, 23,1, 21,1 млн-1. Анализ формулы C16H20Cl3NO (348,70): рассчитано: С 55,11, Н 5,78, N 4,02, Cl 30,50%; обнаружено: С 55,29, Н 5,67, N 4,12, Cl 30,18%. Пример 53. 7-Хлор-3-(4-хлорбутил)-3-этил-5-фтор-1,3-дигидро-2 Н-индол-2-он. 3-(4-Хлорбутил)-3-этил-5-фтор-1,3-дигидро-2 Н-индол-2-он (5,40 г; 20 ммоль) растворяют в 40 мл ледяной уксусной кислоты и к раствору при комнатной температуре капают 3,2 мл (40 ммоль) сульфурилхлорида и оставляют при 60 С на 4 ч. Затем его охлаждают, выливают в лед и экстрагируют диэтиловым эфиром. Эфирную фазу дважды экстрагируют 10 об.% раствором NaOH, сушат над сульфатом натрия и упаривают. Полученное таким образом бледно-желтое масло тритурируют с гексаном, кристаллическое белое вещество перемешивают в гексане, фильтруют, промывают гексаном, сушат и используют для реакции сочетания без очистки. Аналитические образцы могут быть получены путем перекристаллизации из смеси гексана и этилацетата. Т.пл.: С (гексан-этилацетат). ИК (KBr): 3184, 1709, 1080, 853 см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 8,22 (br s, 1H, NH), 6,99 (dd, 1H, J=7,6, 2,3 Гц), 6,81 (dd, 1H, J=7,6,2,3 Гц), 3,42 (t, 2H, J=6,7 Гц, CH2Cl), 2,00-1,88 (m, 2H, СН 2), 1,82-1,60 (m, 4 Н, 2 СН 2), 1,30-1,16 (m, 1 Н),1,12-1,00 (m, 1 Н), 0,66 (t, 3 Н, J=7,4 Гц, СН 3). 13 С-ЯМР (CDCl3, TMC, 101 МГц): 180,6, 158,8 (d, J=244,5 Гц), 135,1 (d, J=2,3 Гц), 134,9 (d, J=8,4 Гц),114,8 (d, J=26,3 Гц), 114,8 (d, J=11,0 Гц), 109,7 (d, J=24,4 Гц), 55,8 (d, J=1,9 Гц), 44,3, 36,8, 32,5, 31,1, 21,7,8,5. Анализ формулы C14H16Cl2FNO (348,70): рассчитано: С 55,28, Н 5,30, N 4,60, Cl 23,31%; обнаружено: С 55,19, Н 5,28, N 4,65, Cl 23,19%. Пример 54. 5-Бром-3-(4-хлорбутил)-3-этил-1,3-дигидро-2 Н-индол-2-он. 3-(4-Хлорбутил)-3-этил-1,3-дигидро-2 Н-индол-2-он (12,59 г, 50 ммоль) растворяют в смеси 100 мл диоксана и 100 мл воды и смесь 2,84 мл брома (55 ммоль), 11,9 г KBr (100 ммоль) и 50 мл воды прикапывают к раствору при 80-90 С в течение 30 мин. Реакционную смесь хранят при этой температуре 30 мин,дают возможность охлаждаться и в нее капают 500 мл воды. Продукт выделяют в форме белого вещества. Выделенное вещество фильтруют, промывают водой и гексаном и используют для реакции сочетания без очистки. Аналитические образцы могут быть получены путем перекристаллизации из смеси гексана и этилацетата. Т.пл.: 117-118 С (гексан-этилацетат). ИК (KBr): 3286, 1717, 1198, 817 см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц):9,28 (br s, 1H, NH), 7,35 (dd, 1H, J=8,2, 2,0 Гц, Н-6), 7,24 (d, 1H,J=2,0 Гц, Н-4), 6,84 (d, 1H, J=8,2 Гц, Н-7), 3,41 (t, 2H, J=6,8 Гц, CH2Cl), 1,98-1,75 (m, 2H3, СН 2), 1,74-1,60(m, 4H, 2 СН 2), 1,27-1,16 (m, 1 Н), 1,11-1,01 (m, 1H), 0,64 (t, 3 Н, J=7,4 Гц, СН 3). 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 182,3, 140,4, 134,6, 130,7, 126,1, 115,3, 111,3, 54,5, 44,3, 36,7, 32,8,30,9, 21,7, 8,5. Анализ формулы C14H17BrClNO (330,65): рассчитано: С 50,86, Н 5,18, N 4,24%; обнаружено: С 50,79, Н 5,09, N 4,38%. Пример 55. 3-(4-Хлорбутил)-3-этил-2-оксоиндолин-5-сульфонилхлорид. 90 мл хлорсульфоновой кислоты охлаждают до 0 С и к ней порциями добавляют 3-(4-хлорбутил)-3 этилоксиндол (11,34 г; 45 ммоль) таким образом, что температура не превышает 2 С. Раствору затем да- 25014236 ют возможность нагреться до комнатной температуры при перемешивании и осторожно капают с помощью пипетки на лед в течение получаса. Выделенный белый осадок фильтруют, промывают водой и гексаном и используют для реакции сочетания без очистки. Аналитические образцы могут быть получены путем перекристаллизации из смеси гексана и этилацетата.T.пл.: C. ИК (KBr): 3197, 1729, 1371, 1176 см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 9,39 (br s, 1 Н, NH), 7,99 (dd, 1H, J=8,4, 1,9 Гц, Н-6), 7,80 (d, 1H,J=1,9 Гц, Н-4), 7,16 (d, 1H, J=8,4 Гц, Н-7), 3,46-3,41 (m, 2H, CH2Cl), 2,10-1,83 (m, 4 Н, 2 СН 2), 1,73-1,66 (m,2 Н), 1,32-1,18 (m, 1 Н), 1,14-1,00 (m, 1 Н), 0,68 (t, 3H, J=7,4 Гц, СН 3) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 182,4, 147,6, 138,4, 133,9, 128,8, 121,9, 110,1, 54,5, 44,2, 36,4, 32,2,30,9, 21,5, 8,5 млн-1. Анализ формулы C14H17Cl2NO3S (350,27): рассчитано: С 48,01, Н 4,89, N 4,00, Cl 20,24, S 9,15%; обнаружено: С 47,89, Н 4,76, N 4,18, Cl 20,01, S 9,38%. Пример 56. 5-Сульфонамид 3-(4-хлорбутил)-3-этил-2-оксоиндолина. 5-Сульфонилхлорид 3-(4-хлорбутил)-3-этил-2-оксоиндолина (9,96 г; 30 ммоль) растворяют в 450 мл этанола и в раствор при 0-2 С капают 25% водный раствор аммиака (9 мл, 120 ммоль). Смеси дают возможность нагреться до комнатной температуры. Ее перемешивают в течение еще 1 ч, упаривают, оставшееся белое вещество перемешивают в воде, фильтруют, промывают водой и гексаном и используют для реакции сочетания без очистки. Аналитические образцы могут быть получены путем перекристаллизации из смеси гексана и этилацетата. Т.пл.: 171-172C (этилацетат). ИК (KBr): 3343, 3265, 1725, 1327, 1169 см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц): 10,8 (br s, 1H, NH), 7,70 (dd, 1H, J=8,1, 1,8 Гц, Н-6), 7,65 (d, 1H,J=1,7 Гц, Н-4), 6,98 (d, 1H, J=8,1 Гц, Н-7), 3,54-3,49 (m, 2 Н, CH2Cl), 1,82-1,73 (m, 4 Н, 2 СН 2), 1,59 (квинтет, 2 Н, J=7,2 Гц, СН 2), 1,15-1,00 (m, 1H), 1,00-0,85 (m, 1H), 0,52 (t, 3H, J=7,4 Гц, СН 3) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 101 МГц): 181,0, 145,7, 137,6, 132,6, 126,6, 120,9, 109,1, 53,4, 45,1, 36,2,32,3, 30,3, 21,5, 8,5 млн-1. Анализ формулы C14H19ClN2O3S (330,84): рассчитано: С 50,83, Н 5,79, N 8,47, Cl 10,72, S 9,69%; обнаружено: С 50,79, Н 5,74, N 8,51, Cl 10,71, S 9,72%. Способ 3 (реакции сочетания -хлоралкильного соединения). В реакции сочетания соответствующее хлоралкильное соединение сочетают с вторичным амином. Расплав основания (12 ммоль) нагревают до 180 С при медленном перемешивании и к нему при той же самой температуре отмеряют хлоралкильное соединение (12 ммоль) и карбонат натрия (1,36 г; 12 ммоль). Смеси дают возможность вступать в реакцию в течение 1 ч. Затем расплаву дают возможность охладиться, к нему добавляют этилацетат и воду и фазы разделяют. Органическую фазу упаривают и оставшееся масло подвергают хроматографии на короткой колонке с использованием в качестве элюента этилацетата. Желаемые соединения получают в качестве основных продуктов колоночной хроматографии. Способ обработки 1. Если продукт, очищенный путем колоночной хроматографии, кристаллизуется при растирании с диэтиловым эфиром, его отфильтровывают и перекристаллизовывают из растворителя,для которого указано, что его температура плавления находится после температуры плавления данного вещества. Желаемые соединения получают в форме белых кристаллов. Способ обработки 2. Если основный продукт не кристаллизуется при добавлении диэтилового эфира, его растворяют в 200 мл простого эфира, небольшое количество плавающего осадка отфильтровывают и к чистому раствору при интенсивном перемешивании добавляют раствор рассчитанного количества(1 мол.экв.) хлорида водорода в 50 мл диэтилового эфира. Выделенную белую соль фильтруют, промывают простым эфиром и гексаном и сушат в вакуумном пистолете при комнатной температуре в течение 3 ч. Если необходимо, соль гидрохлорид перекристаллизовывают. Способ обработки 3. Если основный продукт не кристаллизуется при добавлении диэтилового эфира и не приводит к получению хорошо фильтруемой соли с хлоридом водорода, его растворяют в 100 мл горячего этилацетата и к нему в течение 10 мин при перемешивании капают 1 мол.экв. раствора дигидрата щавелевой кислоты в 50 мл горячего этилацетата. Белую соль оксалат выделяют при охлаждении. Его отфильтровывают при комнатной температуре, промывают этилацетатом и гексаном и сушат. Пример 57. 5-Хлор-3-3-[4-(3-хлорфенил)пиперазин-1-ил]пропил-3-этил-1,3-дигидро-2H-индол-2 он. Указанное соединение получают в соответствии со способом 3 путем применения способа обработки 1 из 5-хлор-3-(3-хлорпропил)-3-этил-1,3-дигидро-2 Н-индол-2-она и 2-хлор-6,7-дигидро-4 Н-тиено[3,2 с]пиридина. Т.пл.: 117-119 С (гексан-этилацетат).(2 Н, m), 2,00-1,89 (2 Н, m), 2,27 (2 Н, t, J=7,4 Гц), 2,41 (4 Н, t, J=5,0 Гц), 3,12 (4 Н, t, J=5,0 Гц), 6,73 (1 Н, dd,J=2,4, 8,4 Гц), 6,78 (1 Н, dd, J=1,7, 7,9 Гц), 6,82 (1 Н, t, J=2,2 Гц), 6,84 (1 Н, d, J=8,2 Гц), 7,10 (1 Н, d,J=2,0 Гц), 7,13 (1 Н, t, J=8,1 Гц), 7,19 (1 Н, dd, J=2,1, 8,2 Гц) 9,17 (1 Н, s) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 182,3, 152,2, 139,9, 134,9, 134,4, 129,9, 127,9, 127,7, 123,4, 119,2,115,6, 113,7, 110,6, 58,1, 54,5, 52,9, 48,5, 35,1, 31,0, 21,6, 8,5 млн-1. Анализ формулы C23H27Cl2N3O (432,40): рассчитано: С 63,89, Н 6,29, Cl 16,40, N 9,72%; обнаружено: С 63,50, Н 6,34, Cl 16,00, N 9,69%. Пример 58. 3-Этил-3-[3-(4-пиридин-2-илпиперазин-1-ил)пропил]-1,3-дигидро-2H-индол-2-он. Указанное соединение получают в соответствии со способом 3 путем применения способа обработки 1 из 3-(3-хлорпропил)-3-этил-1,3-дигидро-2 Н-индол-2-она и 2-(пиридин-1-ил)пиперазина. Т.пл.: 122-124 С (гексан-этилацетат). ИК (KBr): 3194, 1710 (С=О) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 0,64 (3 Н, t, J=7,4 Гц), 1,28-1,23 (1 Н, m), 1,38-1,32 (1 Н, m), 1,80-1,78(1 Н, dt, J=2,0, 7,9 Гц), 8,16 (1 Н, dd, J=1,9, 5,6 Гц), 9,02 (1 Н, s) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 182,6, 159,5, 147,8, 141,4, 137,3, 132,4, 127,6, 122,9, 122,3, 113,1,109,6, 106,9, 58,4, 54,0, 52,9, 45,0, 35,2, 31,0, 21,5, 8,5 млн-1. Анализ формулы C22H28N4O (364,49): рассчитано: С 72,50, Н 7,74, N 15,37%; обнаружено: С 72,23, Н 7,69, N 15,28%. Пример 59. 5-Бром-3-этил-3-[4-(4-пиридин-2-илпиперазин-1-ил)бутил]-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом 3 путем применения способа обработки 1 из 5-бром-3-(4-хлорбутил)-3-этил-1,3-дигидро-2 Н-индол-2-она и 2-(пиридин-1-ил)пиперазина. Т.пл.: 114-115 С (гексан-этилацетат). ИК (KBr): 3096, 1731 (С=О), 812 см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 9,15 (1 Н, br s), 8,17 (1 Н, dd, J=1,6, 5,3 Гц), 7,46 (1 Н, dt, J=2,0,7,8 Гц), 7,32 (1 Н, dd, J=1,9, 8,2 Гц), 7,22 (1 Н, d, J=1,9 Гц), 6,80 (1 Н, d, J=8,2 Гц), 6,64-6,60 (2 Н, m), 3,56(1 Н, m), 0,98-0,85 (1 Н, m), 0,63 (3 Н, t, J=7,4 Гц) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 182,9, 159,2, 149,5, 147,9, 139,5, 137,5, 134,8, 126,1, 115,1, 113,4,111,1, 107,1, 57,9, 54,5, 52,7, 44,7, 37,3, 31,0, 26,3, 22,1, 8,5 млн-1. Анализ формулы C23H29BrN4O (457,42): рассчитано: С 60,39, Н 6,39, Br 17,47, N 12,25%; обнаружено: С 59,90, Н 6,38, Br 17,24, N 11,98%. Пример 60. 3-4-[4-(3-Хлорфенил)пиперазин-1-ил]бутил-3-этил-1,3-дигидро-2 Н-индол-2-он-Н 2 ОHCl-изопропанол (1:1:1:1). Указанное соединение получают в соответствии со способом 3 путем применения способа обработки 2 из 3-(4-хлорбутил)-3-этил-1,3-дигидро-2 Н-индол-2-она и 1-(3-хлорфенил)пиперазина. Т.пл.: 109-111 С. ИК (KBr): 1701 (С=О), 1180 см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц): 11,14 (1 Н, br s), 10,44 (1 Н, s), 7,25 (1 Н, t, J=8,2 Гц), 7,22 (1 Н, d,J=7,9 Гц), 7,18 (1 Н, dt, J=1,2, 7,7 Гц), 7,03 (1 Н, t, J=2,1 Гц), 6,99 (1 Н, dt, J=0,9, 7,6 Гц), 6,94 (1 Н, dd,J=1,9, 8,3 Гц), 6,86 (1 Н, d, J=7,8 Гц), 6,86 (1 Н, d, J=7,9 Гц), 4,37 (1H, br s), 3,84 (2H, br s), 3,83-3,75 (1H, m),3,5-3,3 (4H, br s), 3,21 (2H, t), 3,10-2,85 (4H, br s), 1,85-1,65 (4H, m), 1,65-1,55 (2H, m), 1,04 (2H, d, J=6,1 Гц), 1,01-0,94 (1H, m),0,9-0,7 (1H, m), 0,51 (3H, t, J=7,3 Гц) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 101 МГц): 180,8, 151,0, 142,7, 134,1, 132,1, 130,8, 127,8, 123,2, 121,8,119,3, 115,4, 114,3, 109,4, 62,2, 55,1, 53,2, 50,3, 44,9, 36,6, 30,3, 25,7, 23,2, 21,4, 8,6 млн-1. Анализ формулы C27H41Cl2N3O3 (526,55): рассчитано: С 61,59, Н 7,85, Cl 13,47, N 7,98%; обнаружено: С 61,88, Н 7,58, Cl 13,68, N 8,05%. Пример 61. Монооксалат 5-бром-3-4-[4-(3-хлорфенил)пиперазин-1-ил]бутил-3-этил-1,3-дигидро 2 Н-индол-2-она. Указанное соединение получают в соответствии со способом 3 путем применения способа обработки 3 из 5-бром-3-(4-хлорбутил)-3-этил-1,3-дигидро-2 Н-индол-2-она и 1-(3-хлорфенил)пиперазина. Т.пл.: 200-202 С. ИК (KBr): 3200, 1706 (С=О) см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц): 10,5 (1 Н, s), kb. 7,8 (2 Н, br s), 7,45 (1 Н, d, J=2,0 Гц), 7,35 (1H,dd, J=1,8, 8,2 Гц), 7,23 (1H, t, J=8,1 Гц), 7,00 (1H, t, J=2,1 Гц), 6,92 (1H, dd, J=2,2, 8,0 Гц), 6,83 (1H, dd,1J=1,8, 8,2 Гц), 6,81 (1H, d, J=8,2 Гц), 3,36 (4H, br s), 3,04 (4H, br s), 2,80 (2H, t, J=8,1 Гц), 1,85-1,66 (4H, m),1,54-1,48 (2H, m), 0,97-0,89 (1H, m), 0,84-0,77 (1H, m), 0,50 (3H, t, J=7,3 Гц) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 101 МГц): 180,4, 164,2, 151,9, 142,0, 134,1, 134,0, 130,7, 130,5, 126,2,119,1, 115,2, 114,2, 113,7, 111,3, 55,0, 53,6, 50,9, 45,6, 36,5, 30,2, 23,9, 21,5, 8,5 млн-1. Анализ формулы C26H31BrClN3O5 (580,91): рассчитано: С 53,76, Н 5,38, N 7,23%; обнаружено: С 53,89, Н 5,60, N 7,11%. Пример 62. 3-Изобутил-3-[4-(4-пиридин-2-илпиперазин-1-ил)бутил]-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом 3 путем применения способа обработки 1 из 3-(4-хлорбутил)-3-этил-1,3-дигидро-2 Н-индол-2-она и 2-(пиридин-1-ил)пиперазина. Т.пл.: 158-159 С (гексан-этилацетат). ИК (KBr): 3192, 1719 (С=О) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 9,03 (1 Н, s), 8,17 (1 Н, ddd, J=1,0, 1,9, 4,8 Гц), 7,44 (1 Н, dt, J=2,0,7,9 Гц), 7,19 (1 Н, dt, J=1,3, 7,6 Гц), 7,10 (1 Н, d, J=6,8 Гц), 7,03 (1 Н, dt, J=0,9, 7,4 Гц), 6,90 (1 Н, d, J=7,7 Гц),6,60 (1 Н, dd, J=0,7, 7,4 Гц), 6,60 (dt, J=0,7, 7,0 Гц), 3,48 (4 Н, t, J=5,2 Гц), 2,44 (4 Н, t, J=5,1 Гц), 2,21 (2 Н, t,J=7,8 Гц), 1,86-1,82 (2 Н, m), 1,80-1,66 (2 Н, m), 1,50-1,28 (3 Н, m), 1,16-1,14 (1 Н, m), 0,92, 0,80 (1 Н, m), 0,69(3 Н, d, J=6,7 Гц), 0,58 (3 Н, d, J=6,7 Гц) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц); 183,2, 159,5, 147,9, 141,2, 137,3, 132,0, 127,5, 123,3, 122,2, 113,2,109,6, 107,0, 58,3, 53,1, 52,9, 46,3, 45,1, 39,9, 26,8, 25,3, 24,2, 23,1, 21,6 млн-1. Анализ формулы C25H34N4O (406,58): рассчитано: С 73,86, Н 8,43, N 13,78%; обнаружено: С 73,39, Н 8,34, N 13,50%. Пример 63. 3-4-[4-(2,3-Дигидробензо[1,4]диоксин-5-ил)пиперазин-1-ил]бутил-3-этил-1,3-дигидро-2 Н-индол-2-он. Указанное в заголовке соединение получают в соответствии со способом 3 путем применения способа обработки 1 из 3-(4-хлорбутил)-3-этил-1,3-дигидро-2 Н-индол-2-она и 4-(2,3-дигидробензо[1,4]диоксин-5-ил)пиперазина. Т.пл.: 169-170 С (гексан-этилацетат). ИК (KBr): 3025, 1710 (С=О) см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 0,63 (3 Н, t, J=7,3 Гц), 0,92-0,89 (1 Н, m), 1,13-1,09 (1 Н, m), 1,49-1,42(2 Н, m), 4,31-4,27 (4 Н, m), 6,50 (1 Н, dd, J=1,4, 8,0 Гц), 6,58 (1 Н, dd, J=1,4, 8,2 Гц), 6,75 (1 Н, 1 Н, t,J=8,1 Гц), 6,89 (1 Н, d, J=7,7 Гц), 7,04 (1 Н, dt, J=0,9, 7,4 Гц), 7,11 (1 Н, d, J=6,7 Гц), 7,19 (1 Н, dt, J=1,3, 7,6 Гц), 8,80 (1 Н, s) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 182,4, 144,0, 141,5, 141,4, 136,4, 132,5, 127,6, 123,0, 122,3, 120,6,111,9, 110,7, 109,5, 64,3, 63,9, 58,2, 54,1, 53,1, 50,3, 37,5, 31,0, 26,6, 22,2, 8,5 млн-1. Анализ формулы C26H33N3O3 (435,57): рассчитано: С 71,70, Н 7,64, N 9,65%; обнаружено: С 71,50, Н 7,60, N 9,60%. Пример 64. 3-4-[4-(2,3-Дигидробензо[1,4]диоксин-5-ил)пиперазин-1-ил]бутил-3-изобутил-1,3 дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом 3 путем применения способа обработки 1 из 3-(4-хлорбутил)-3-изобутил-1,3-дигидро-2 Н-индол-2-она и 4-(2,3-дигидробензо[1,4]диоксин-5 ил)пиперазина. Т.пл.: 152-154 С (гексан-этилацетат). ИК (KBr): 3331, 3081, 1706 (С=О) см-1. 1 Н-ЯМР (CDCl3, TMC, 400 МГц): 0,61 (3 Н, d, J=6,7 Гц), 0,72 (3 Н, d, J=6,7 Гц), 0,89-0,83 (1 Н, m),1,11-1,06 (1 Н, m), 1,33 (1 Н, m), 1,47-1,38 (2 Н, m), 1,79-1,67 (2 Н, m), 1,93-1,84 (2 Н, m), 2,29 (2 Н, t,J=7,9 Гц), 2,61 (4 Н, br s), 3,07 (4 Н, br s), 4,24-4,21 (2 Н, m), 4,31-4,27 (4 Н, m), 6,51 (1 Н, dd, J=1,4, 8,1 Гц),6,58 (1 Н, dd, J=1,4, 8,2 Гц), 6,75 (1 Н, 1 Н, t, J=8,2 Гц), 6,89 (1 Н, d, J=7,7 Гц), 7,03 (1 Н, dt, J=0,8, 7,4 Гц), 7,10(1 Н, d, J=6,9 Гц), 7,19 (1 Н, dt, J=1,3, 7,6 Гц), 8,88 (1 Н, s) млн-1. 13 С-ЯМР (CDCl3, TMC, 101 МГц): 182,9, 144,0, 141,5, 141,2, 136,4, 132,8, 127,5, 123,3, 122,2, 120,6,111,9, 110,7, 109,6, 64,3, 63,9, 58,2, 53,1, 53,0, 50,3, 46,3, 39,9, 26,6, 25,3, 24,2, 23,1, 21,6 млн-1. Анализ формулы C28H37N3O3 (463,63): рассчитано: С 72,54, Н 8,04, N 9,06%; обнаружено: С 72,53, Н 8,00, N 9,02%. Пример 65. 5,7-Дихлор-3-этил-3-[4-(4-пиридин-2-илпиперазин-1-ил)бутил]-1,3-дигидро-2 Н-индол 2-он. Указанное соединение получают в соответствии со способом 3 путем применения способа обработки 1 из 5,7-дихлор-3-(4-хлорбутил)-3-этил-1,3-дигидро-2 Н-индол-2-она и 2-(пиридин-1-ил)пиперазина. Т.пл.: 144-146 С (гексан-этилацетат). ИК (KBr): 3081, 1737 (С=О), 772 см-1.(1 Н, ddd, J=0,9, 1,9, 4,9 Гц), 8,79 (1 Н, s) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 180,8, 159,5, 147,9, 137,9, 137,3, 135,4, 128,0, 127,5, 121,9, 115,1,113,2, 107,0, 58,0, 55,6, 52,9, 45,0, 37,4, 31,0, 26,6, 22,2, 8,5 млн-1. Анализ формулы C23H28Cl2N4O (447,41): рассчитано: С 61,75, Н 6,31, Cl 15,85, N 12,52%; обнаружено: С 62,14, Н 6,34, Cl 15,74, N 12,21%. Пример 66. 5-Хлор-3-этил-3-[4-(4-пиридин-2-илпиперазин-1-ил)бутил]-1,3-дигидро-2 Н-индол-2-он. Указанное соединение получают в соответствии со способом 3 путем применения способа обработки 1 из 5-хлор-3-(4-хлорбутил)-3-этил-1,3-дигидро-2 Н-индол-2-она и 2-(пиридин-1-ил)пиперазина. Т.пл.: 154-156C (гексан-этилацетат). ИК (KBr): 3157, 1729 (С=О), 1597, 775 см-1. 1 Н-ЯМР (CDCl3, ТМС, 40 МГц): 0,63 (3 Н, t, J=7,4 Гц), 0,98-0,85 (1 Н, m), 1,18-1,04 (1 Н, m), 1,53-1,35(1 Н, dt, J=2,0, 7,9 Гц), 8,17 (1 Н, dm, J=4,7 Гц), 9,13 (1 Н, s) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 182,3, 159,5, 147,9, 140,0, 137,4, 134,5, 127,7, 127,6, 123,4, 113,2,110,5, 107,0, 58,1, 54,6, 52,9, 45,1, 37,4, 31,0, 26,8, 22,2, 8,5 млн-1. Анализ формулы C23H29ClN4O (412,97): рассчитано: С 66,90, Н 7,08, Cl 8,58, N 13,57%; обнаружено: С 66,22, Н 7,04, Cl 8,33, N 13,27%. Пример 67. 5-Хлор-3-4-[4-(3-хлорфенил)пиперазин-1-ил]бутил-3-этил-1,3-дигидро-2H-индол-2 он. Указанное соединение получают в соответствии со способом 3 путем применения способа обработки 1 из 5-хлор-3-(4-хлорбутил)-3-этил-1,3-дигидро-2 Н-индол-2-она и 6,7-дигидро-4 Н-тиено[3,2-с]пиридина. Т.пл.: 139-142 С (гексан-этилацетат). ИК (KBr): 3412, 1712 (С=О), 780 см-1. 1 Н-ЯМР (CDCl3, ТМС, 400 МГц): 0,64 (3 Н, t, J=7,4 Гц), 0,95-0,88 (1 Н, m), 1,13-1,07 (1 Н, m), 1,45-1,36(1 Н, t, J=2,1 Гц), 7,09 (1 Н, d, J=2,1 Гц), 7,13 (1 Н, t, J=8,2 Гц), 7,18 (1 Н, dd, J=2,1, 8,2 Гц) млн-1. 13 С-ЯМР (CDCl3, ТМС, 101 МГц): 182,4, 152,3, 140,0, 134,8, 134,5, 129 9, 127,8, 127,6, 123,4, 119,1,115,6, 113,7, 110,6, 57,9, 54,7, 52,9, 48,5, 37,4, 31,0, 26,8, 22,1, 8,5 млн-1. Анализ формулы C24H29Cl2N3O (446,42): рассчитано: С 64,57, Н 6,55, Cl 15,88, N 9,41%; обнаружено: С 64,55, Н 6,53, Cl 15,75, N 9,40%. Пример 68. Монооксалат 3-[4-(4-фенилпиперазин-1-ил)бутил]-3-этил-1,3-дигидро-2 Н-индол-2-она. Указанное соединение получают в соответствии со способом 3 путем применения способа обработки 3 из 3-(4-хлорбутил)-3-этил-1,3-дигидро-2 Н-индол-2-она и 1-фенилпиперазина. Т.пл.: 121-123 С. ИК (KBr): 3245, 1710, 1620 (С=О) см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц): 10,77 (2 Н, br s), 10,46 (1 Н, s), 7,30-7,16 (4 Н, m), 7,02-6,91 (3 Н,m), 6,89 (1 Н, d, J=7,7 Гц), 6,84 (1 Н, t, J=7,3 Гц), 3,37 (4 Н, br s), 3,20 (4 Н, br s), 2,93, 2,90 (2 Н, d, J=6,0 Гц),2,0-1,72 (4 Н, m), 1,56 (2 Н, m), 0,98 (1 Н, m), 0,83 (1 Н, m), 0,51 (3 Н, t, J=7,3 Гц) млн-1. 13 С-ЯМР (ДМСО-d6, ТМС, 101 МГц): 180,9, 149,9, 142,7, 132,2, 129,3, 127,6, 123,2, 121,8, 120,1,116,1, 109,4, 55,4, 53,2, 50,8, 45,7, 36,8, 30,4, 23,5, 21,5, 8,6 млн-1. Анализ формулы C26H33N3O5 (467,57): рассчитано: С 66,79, Н 7,11, N 8,99%; обнаружено: С 65,09, Н 7,21, N 8,73%. Пример 69. Монооксалат 3-этил-3-4-[4-(2-метоксифенил)пиперазин-1-ил]бутил-1,3-дигидро-2 Ниндол-2-она. Указанное соединение получают в соответствии со способом 3 путем применения способа обработки 3 из 3-(4-хлорбутил)-3-этил-1,3-дигидро-2 Н-индол-2-она и 1-(2-метоксифенил)пиперазина. Т.пл.: 180-183 С. ИК (KBr): 3201, 1707 (С=О) см-1. 1 Н-ЯМР (ДМСО-d6, ТМС, 400 МГц): 10,4 (1 Н, br s), 9,1 (2 Н, br s), 7,21 (1 Н, d, J=7,9 Гц), 7,18 (1 Н, dt,J=7,7, 1,1 Гц), 7,02-6,94 (3 Н, m), 6,91-6,87 (2 Н, m), 6,86 (1 Н, d, J=7,7 Гц), 3,78 (3 Н, s), 3,15 (8 Н, br s), 2,88
МПК / Метки
МПК: C07D 403/12, A61P 25/24, C07D 401/12, A61K 31/4458, A61K 31/4045, A61K 31/506, C07D 209/34
Метки: новые, диалкилоксиндолов, пиперазиновые, производные
Код ссылки
<a href="https://eas.patents.su/30-14236-novye-piperazinovye-proizvodnye-dialkiloksindolov.html" rel="bookmark" title="База патентов Евразийского Союза">Новые пиперазиновые производные диалкилоксиндолов</a>












