Соединения бензимидазолкарбоксамида в качестве агонистов рецепторов 5-нт4
Номер патента: 13240
Опубликовано: 30.04.2010
Авторы: Далзил Шон М., Дзян Лань, Фазери Пол Р., Маркесс Дэниэл, Физакерли Кирстен М., Чой Сеок-Ки, Маккиннелл Роберт Мюррей, Гендрон Роланд, Лонг Дэниэл Д.
Формула / Реферат
1. Соединение формулы (I)
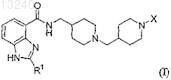
где R1 является С3-5алкилом, необязательно замещенным -ОН; и
X выбирают из:
(a) -С(О)OR2, где R2 представляет собой С1-4алкил или -(CH2)n-фенил, где n равно 0 или 1;
(b) -C(O)R3, где R3 выбирают из
фенила, необязательно замещенного 1, 2 или 3 заместителями, выбранными из С1-4алкила, галогена, С1-4 алкокси, -CF3, -OCF3, -OCHF2 и -CN,
С1-5алкила,
С4-5циклоалкила и
-(CH2)m-А, где m равно 0 или 1 и А выбирают из амино, фуранила, тиофенила, морфолинила, тетрагидрофуранила, пиридинила, нафталенила, пирролила, тиоморфолинила, пирролидинила, пиперидинила, оксоазетидинила, тиазолидинила, 1,1-диоксоизотиазолидинила и 2,4-диметилизоксазолила;
(c) -C(O)NR4R5, где R4 является водородом или C1-3алкилом и R5 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из С1-4алкила, галогена, С1-4алкокси, -CF3, -OCF3 и
-OCHF2;
(d) -С(O)С(R6R7)R8, где R6 является водородом или C1-3алкилом и R7 представляет собой водород, -ОН или C1-3алкил или R6 и R7, взятые вместе, образуют оксо или -(CH2)2- и
R8 является фенилом или циклогексилом, где фенил или циклогексил необязательно замещен 1, 2 или 3 заместителями, выбранными из С1-4алкила, галогена, С1-4алкокси, -CF3, -OCF3, -OCHF2 и -CN;
(e) -С(О)С(HR9)OR10, где R9 является водородом или C1-3алкилом и R10 является фенилом, необязательно замещенным 1, 2 или 3 заместителями, выбранными из С1-4алкила, галогена, C1-4алкокси, -CF3, -OCF3 и
-OCHF2; и
(f) -S(O)2R11, где R11 выбирают из C1-3алкила, -СН2-фенила, фуранила, тиофенила, морфолинила, тетрагидрофуранила, пиридинила, нафталенила, пирролила, тиоморфолинила, пирролидинила, пиперидинила, оксоазетидинила, тиазолидинила, 1,1-диоксоизотиазолидинила, 2,4-диметилизоксазолила и фенила, необязательно замещенных 1, 2 или 3 заместителями, выбранными из С1-4алкила, галогена, С1-4 алкокси, -CF3, -OCF3, -OCHF2 и -CN;
или его фармацевтически приемлемая соль, или сольват, или стереоизомер.
2. Соединение по п.1, где R1 является С3-5алкилом.
3. Соединение по п.2, где R1 является изопропилом или трет-бутилом.
4. Соединение по п.2, где X является -С(О)OR2.
5. Соединение по п.4 где R2 является C1-3алкилом или фенилом.
6. Соединение по п.2, где X является -C(O)R3.
7. Соединение по п.6, где R3 является фенилом, необязательно замещенным 1, 2 или 3 заместителями, выбранными из С1-4алкила, галогена, С1-4алкокси, -CF3, -OCF3 и - OCHF2.
8. Соединение по п.2, где X является -C(O)NR4R5.
9. Соединение по п.2, где
R1 представляет собой С3-4алкил и
X выбирают из:
(a) -С(О)OR2, где R2 является C1-3алкилом или фенилом;
(b) -C(O)R3, где R3 является фенилом, необязательно замещенным 1 или 2 заместителями, выбранными из С1-4алкила, галогена и -CF3; фуранилом или тиофенилом;
(c) -C(O)NR4R5, где R4 является водородом и R5 представляет собой фенил, необязательно замещенный 1 или 2 заместителями, выбранными из С1-4алкила и галогена;
(d) -С (O)C(R6R7)R8, где R6 является водородом и R7 представляет собой водород, -ОН или метил или R6 и R7, взятые вместе, образуют оксо или -(CH2)2- и R8 является фенилом или циклогексилом, где фенил или циклогексил необязательно замещен 1 или 2 заместителями, выбранными из С1-4алкила и галогена;
(e) -С(О)С(HR9)OR10, где R9 является водородом или метилом и R10 представляет собой фенил, необязательно замещенный 1 или 2 заместителями, выбранными из С1-4алкила и галогена; и
(f) -S(O)2R11, где R11 является метилом или фенилом, необязательно замещенным 1 или 2 заместителями, выбранными из C1-4алкила и галогена.
10. Соединение по п.9, где
R1 представляет собой изопропил или трет-бутил и
X выбирают из:
(a) -С(О)OR2, где R2 является метилом или фенилом;
(b) -C(O)R3, где R3 представляет собой фенил, необязательно замещенный 1 или 2 заместителями, выбранными из метила, хлора, фтора и -CF3; фуран-2-ил или тиофен-2-ил; и
(c) -C(O)NR4R5, где R4 является водородом и R5 является фенилом, необязательно замещенным 1 фтором или хлором.
11. Соединение по п.2, где соединение выбирают из группы, представляющей
метиловый эфир 4-(4-{[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метил}пиперидин-1-илметил) пиперидин-1-карбоновой кислоты;
фениловый эфир 4-(4-{[(2-изопропил-1H-бензоимидазол-4-карбонил)амино)метил}пиперидин-1-илметил) пиперидин-1-карбоновой кислоты;
{1-[1-(2-хлорбензоил)пиперидин-4-илметил]пиперидин-4-илметил}амид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты;
{1-[1-(2,4-дифторбензоил)пиперидин-4-илметил]пиперидин-4-илметил}амид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты;
{1-[1-(фуран-2-карбонил)пиперидин-4-илметил]пиперидин-4-илметил}амид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты;
{1-[1-(тиофен-2-карбонил)пиперидин-4-илметил]пиперидин-4-илметил}амид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты;
{1-[1-(2-фтор-5-трифторметилбензоилпиперидин-4-илметил]пиперидин-4-илметил}амид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты;
{1-[1-(2-фторфенилкарбамоил)пиперидин-4-илметил]пиперидин-4-илметил}амид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты;
метиловый эфир 4-(4-{[(2-трет-бутил-1H-бензоимидазол-4-карбонил)амино)метил}пиперидин-1-илметил)пиперидин-1-карбоновой кислоты;
{1-[1-(2-фторбензоил)пиперидин-4-илметил]пиперидин-4-илметил}амид 2-трет-бутил-1H-бензоимидазол-4-карбоновой кислоты;
{1-[1-(3-метилбензоил)пиперидин-4-илметил]пиперидин-4-илметил}амид 2-трет-бутил-1H-бензоимидазол-4-карбоновой кислоты;
{1-[1-(4-фторбензоил)пиперидин-4-илметил]пиперидин-4-илметил}амид 2-трет-бутил-1H-бензоимидазол-4-карбоновой кислоты и
их фармацевтически приемлемые соли, сольваты и стереоизомеры.
12. Соединение по п.2, где соединение выбирают из
метилового эфира 4-(4-{[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метил}пиперидин-1-илметил)пиперидин-1-карбоновой кислоты;
метилового эфира 4-(4-{[(2-трет-бутил-1H-бензоимидазол-4-карбонил)амино)метил}пиперидин-1-илметил)пиперидин-1-карбоновой кислоты;
{1-[1-(2-фторбензоил)пиперидин-4-илметил]пиперидин-4-илметил}амида 2-трет-бутил-1H-бензоимидазол-4-карбоновой кислоты и
его фармацевтически приемлемых солей, сольватов и стереоизомеров.
13. Кристаллический метиловый эфир 4-(4-{[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метил}пиперидин-1-илметил)пиперидин-1-карбоновой кислоты или его сольват.
14. Кристаллическое соединение по п.13, где кристаллическое соединение характеризуется порошковой рентгенограммой, имеющей два или несколько дифракционных пика при значениях 2q, выбранных из 15,08±0,20, 15,41±0,20, 19,00±0,20, 19,70±0,20 и 23,68±0,20.
15. Кристаллическое соединение по п.14, где кристаллическое соединение характеризуется профилем дифференциальной сканирующей калориметрии, показывающим максимум в эндотермическом тепловом потоке при температуре в диапазоне приблизительно от 146 до приблизительно 148°С.
16. Кристаллическое соединение по п.13, где кристаллическое соединение характеризуется профилем дифференциальной сканирующей калориметрии, показывающим максимум в эндотермическом тепловом потоке при температуре в диапазоне приблизительно от 143 до приблизительно 145°С.
17. Кристаллическое соединение по п.13, где кристаллическое соединение является моногидратом.
18. Кристаллическое соединение по п.17, где кристаллическое соединение характеризуется порошковой рентгенограммой, имеющей два или несколько дифракционных пика при значениях 2q, выбранных из 9,14±0,20, 12,41±0,20, 12,74±0,20, 17,75±0,20, 18,47±0,20, 20,63±0,20, 21,13±0,20 и 27,05±0,20.
19. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-18 и фармацевтически приемлемый носитель.
20. Применение соединения по любому из пп.1-18 для применения в терапии.
21. Применение соединения по любому из пп.1-18 для изготовления лекарственного средства.
22. Применение по п.21, где лекарственное средство предназначено для лечения клинического состояния у млекопитающего, связанного с активностью рецептора 5-HT4.
23. Применение по п.22, где заболеванием или состоянием являются сниженные моторики желудочно-кишечного тракта.
24. Способ получения соединения формулы (I)
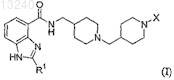
где R1 является С3-5алкилом, необязательно замещенным -ОН; и
X выбирают из:
a) -С(О)OR2, где R2 представляет собой С1-4алкил или -(CH2)n-фенил, где n равно 0 или 1;
b) -C(O)R3, где R3 выбирают из
фенила, необязательно замещенного 1, 2 или 3 заместителями, выбранными из С1-4алкила, галогена, С1-4 алкокси, -CF3, -OCF3, -OCHF2 и -CN,
С1-5алкила,
С4-5циклоалкила и
-(CH2)m-А, где m равно 0 или 1 и А выбирают из фуранила, тиофенила, морфолинила, тетрагидрофуранила, пиридинила, нафталенила, пирролила, тиоморфолинила, пирролидинила, пиперидинила, оксоазетидинила, тиазолидинила, 1,1-диоксоизотиазолидинила и 2,4-диметилизоксазолила;
c) -C(O)NR4R5, где R4 является водородом или C1-3алкилом и R5 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из С1-4алкила, галогена, С1-4алкокси, -CF3, -OCF3 и -OCHF2;
d) -С(О)С(R6R7)R8, где R6 является водородом или C1-3алкилом и R7 представляет собой водород, -ОН или C1-3алкил или R6 и R7, взятые вместе, образуют оксо или -(CH2)2- и R8 является фенилом или циклогексилом, где фенил или циклогексил необязательно замещен 1, 2 или 3 заместителями, выбранными из С1-4алкила, галогена, С1-4алкокси, -CF3, -OCF3, -OCHF2 и -CN;
(e) -С(О)С(HR9)OR10, где R9 является водородом или C1-3алкилом и R10 является фенилом, необязательно замещенным 1, 2 или 3 заместителями, выбранными из С1-4алкила, галогена, C1-4алкокси, -CF3, -OCF3 и
-OCHF2; и
(f) -S(O)2R11, где R11 выбирают из C1-3алкила, -СН2-фенила, фуранила, тиофенила, морфолинила, тетрагидрофуранила, пиридинила, нафталенила, пирролила, тиоморфолинила, пирролидинила, пиперидинила, оксоазетидинила, тиазолидинила, 1,1-диоксоизотиазолидинила, 2,4-диметилизоксазолила и фенила, необязательно замещенных 1, 2 или 3 заместителями, выбранными из С1-4алкила, галогена, С1-4 алкокси, -CF3, -OCF3, -OCHF2 и -CN;
или его фармацевтически приемлемой соли, или сольвата, или стереоизомера, включающий взаимодействие соединения формулы (II)
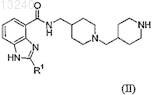
с соединением формулы (III)
![]()
где L является уходящей группой;
с получением соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или стереоизомера.
25. Способ получения соединения формулы (I)
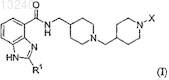
где R1 и X имеют значения, определенные в п.24, или его фармацевтически приемлемой соли, или сольвата, или стереоизомера, включающий взаимодействие соединения формулы (VIII)
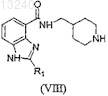
с соединением формулы (XIII)
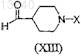
с получением соединения формулы (I), или его фармацевтически приемлемой соли, сольвата или стереоизомера.
26. Способ получения соединения формулы (I)
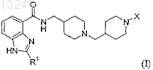
где R1 и X имеют значения, определенные в п.24, или его фармацевтически приемлемой соли, или сольвата, или стереоизомера, включающий
взаимодействие соединения формулы (VI)
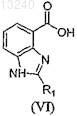
с соединением формулы (XIV)
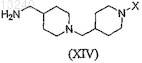
с получением соединения формулы (I), или его фармацевтически приемлемой соли, сольвата или стереоизомера.
27. Способ получения соединения формулы (I)
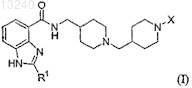
где R1 является С3-5алкилом и
X выбирают из:
b) -C(O)R3, где R3 выбирают из
фенила, необязательно замещенного 1, 2 или 3 заместителями, выбранными из:
С1-4алкила, галогена, С1-4алкокси, -CF3, -OCF3 и -OCHF2,
С1-5алкила,
С4-5циклоалкила и
-(CH2)m-A, где m равно 0 или 1 и А выбирают из фуранила, тиофенила, морфолинила, тетрагидрофуранила, пиридинила, нафталенила, пирролила, тиоморфолинила, пирролидинила, пиперидинила, оксоазетидинила, тиазолидинила, 1,1-диоксоизотиазолидинила и 2,4-диметилизоксазолила;
(d) -С(О)С(R6R7)R8, где R6 является водородом или C1-3алкилом и R7 представляет собой водород, -ОН или C1-3алкил или R6 и R7, взятые вместе, образуют оксо или -(CH2)2- и R8 является фенилом или циклогексилом, где фенил или циклогексил необязательно замещен 1, 2 или 3 заместителями, выбранными из С1-4алкила, галогена, С1-4алкокси, -CF3, -OCF3, -OCHF2 и -CN; и
(e) -С(О)С(HR9)OR10, где R9 является водородом или C1-3алкилом и R10 является фенилом, необязательно замещенным 1, 2 или 3 заместителями, выбранными из С1-4алкила, галогена, C1-4алкокси, -CF3, -OCF3 и
-OCHF2;
или его фармацевтически приемлемой соли, сольвата или стереоизомера, включающий
взаимодействие соединения формулы (II)
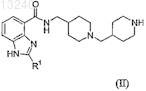
с соединением формулы (IV)
![]()
где X1 выбирают из R3, C(R6R7)R8 и C(HR9)OR10, с получением соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или стереоизомера.
28. Соединение формулы (II)
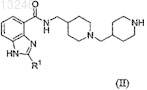
где R1представляет собой С3-5алкил или его соль, стереоизомер или его защищенное производное.
29. Способ получения кристаллического метилового эфира 4-(4-{[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метил}пиперидин-1-илметил)пиперидин-1-карбоновой кислоты, включающий:
(a) диспергирование метилового эфира 4-(4-{[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метил} пиперидин-1-илметил)пиперидин-1-карбоновой кислоты в инертном разбавителе, выбираемом из ацетонитрила, простого эфира, циклогексана и этилацетата в пропорции приблизительно от 15 до 25 мг метилового эфира 4-(4-{[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метил}пиперидин-1-илметил)пиперидин-1-карбоновой кислоты на 1 мл разбавителя с образованием смеси; и
(b) оставление смеси для выпаривания с получением кристаллического метилового эфира 4-(4-{[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метил}пиперидин-1-илметил)пиперидин-1-карбоновой кислоты.
30. Способ получения кристаллического метилового эфира 4-(4-{[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метил}пиперидин-1-илметил)пиперидин-1-карбоновой кислоты, включающий:
(a) взаимодействие (пиперидин-4-илметил)амида 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты с метиловым сложным эфиром 4-формилпиперидин-1-карбоновой кислоты в полярном апротонном разбавителе;
(b) добавление ацетонитрила при перегонке продукта стадии (а) для удаления полярного апротонного разбавителя из продукта стадии (а);
(c) получение смеси из остатка со стадии перегонки (b) в ацетонитриле при концентрации приблизительно от 50 до приблизительно 125 мг метилового эфира 4-(4-{[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метил}пиперидин-1-илметил)пиперидин-1-карбоновой кислоты на 1 мл ацетонитрила при температуре, достаточной для растворения остатка; и
(d) охлаждение смеси со стадии (с) до температуры не выше чем приблизительно 20°С с получением кристаллического метилового эфира 4-(4-{[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метил}пиперидин-1-илметил)пиперидин-1-карбоновой кислоты.
31. Способ лечения млекопитающего, имеющего клиническое состояние, обусловленное активностью рецепторов 5-HT4, включающий введение млекопитающему терапевтически эффективного количества фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение по любому из пп.1-18.
32. Способ по п.31, где клиническое состояние выбирают из синдрома раздраженного кишечника, хронического запора, функциональной диспепсии, задержки эвакуации содержимого желудка, гастроэзофагеальной рефлюксной болезни, гастропареза, послеоперационной непроходимости кишечника, кишечной псевдообструкции и медикаментозного замедления кишечного транзита.
33. Способ лечения заболевания со сниженной моторикой желудочно-кишечного тракта у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение по любому из пп.1-18.
34. Способ по п.33, где заболевание со сниженной моторикой выбирают из хронического запора, синдрома раздраженного кишечника с преобладанием запора, диабетического и идиопатического гастропареза и функциональной диспепсии.
Текст
013240 Настоящее изобретение относится к соединениям бензимидазолкарбоксамида, которые полезны в качестве агонистов рецепторов 5-HT4. Настоящее изобретение также относится к фармацевтическим композициям, содержащим такие соединения, способам применения таких соединений для лечения или предотвращения клинических состояний, обусловленных активностью рецепторов 5-HT4, и к способам и промежуточным продуктам, полезным для получения таких соединений. Серотонин (5-гидрокситриптамин, 5-HT) представляет собой нейромедиатор, широко распространенный в организме в целом, в центральной нервной системе и в периферических системах. Выделено по меньшей мере семь подтипов рецепторов серотонина, и взаимодействие серотонина с такими различными рецепторами связано с широким разнообразием физиологических функций. В этой связи разработка терапевтических средств, направленных на конкретные подтипы рецепторов 5-HT, вызывает значительный интерес. В частности, в последнее время активная работа нацелена на определение характеристик рецепторов 5-HT4 и выявление взаимодействующих с ними фармацевтических средств (см., например, обзорLanglois and Fischmeister, J. Med. Chem. 2003, 46, 319-344). Агонисты рецепторов 5-HT4 полезны для лечения заболеваний, выражающихся в сниженной моторике желудочно-кишечного тракта. Такие заболевания включают синдром раздраженного кишечника (СРК), хронический запор, функциональную диспепсию, задержку эвакуации содержимого желудка, гастроэзофагеальную рефлюксную болезнь (ГЭРБ),гастропарез, послеоперационную непроходимость кишечника, кишечную псевдообструкцию и медикаментозное замедление кишечного транзита. В дополнение, предполагалось, что некоторые соединения агонистов рецепторов 5-HT4 можно применять для лечения нарушений центральной нервной системы,включающих когнитивные нарушения, нарушения поведения, нарушения настроения и нарушения регуляции вегетативных функций. Несмотря на широкую полезность фармацевтических средств, модулирующих активность рецепторов 5-HT4, в настоящее время немногие соединения агонистов рецепторов 5-HT4 применяются в клинической практике. Таким образом, существует потребность в новых агонистах рецепторов 5-HT4, которые достигают своего желаемого действия с минимальными побочными эффектами. Наряду с другими свойствами предпочтительные средства могут обладать повышенной мощностью, улучшенной селективностью, фармакокинетическими свойствами и/или продолжительностью действия. Настоящее изобретение обеспечивает новые соединения, обладающие активностью агонистов рецепторов 5-HT4. Было обнаружено, что наряду с другими свойствами соединения настоящего изобретения являются мощными и селективными агонистами рецепторов 5-HT4. Дополнительно было обнаружено, что предпочтительные соединения настоящего изобретения проявляют благоприятные фармакокинетические свойства на модели животных, что является прогнозом хорошей биодоступности при пероральном введении. Соответственно, настоящее изобретение обеспечивает соединение формулы (I)(c) -C(O)NR4R5, где R4 является водородом или C1-3 алкилом, и R5 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из С 1-4 алкила, галогена, С 1-4 алкокси, -CF3,-OCF3 и -OCHF2;(d) -С(О)С(R6R7)R8, где R6 является водородом или C1-3 алкилом, и R7 представляет собой водород,-ОН или C1-3 алкил; или R6 и R7, взятые вместе, образуют оксо или -(CH2)2-; иR8 является фенилом или циклогексилом, где фенил или циклогексил необязательно замещен 1, 2 или 3 заместителями, выбранными из С 1-4 алкила, галогена, С 1-4 алкокси, -CF3, -OCF3, OCHF2 и -CN;(e) -С(О)С(HR9)OR10, где R9 является водородом или C1-3 алкилом, и R10 является фенилом, необязательно замещенным 1, 2 или 3 заместителями, выбранными из С 1-4 алкила, галогена, C1-4 алкокси, -CF3,-OCF3 и -OCHF2; и(f) -S(O)2R11, где R11 выбирают из C1-3 алкила, -СН 2-фенила, фуранила, тиофенила, морфолинила,тетрагидрофуранила, пиридинила, нафталенила, пирролила, тиоморфолинила, пирролидинила, пиперидинила, оксоазетидинила, тиазолидинила, 1,1-диоксоизотиазолидинила, 2,4-диметилизоксазолила и фенила, необязательно замещенных 1, 2 или 3 заместителями, выбранными из С 1-4 алкила, галогена,С 1-4 алкокси, -CF3, -OCF3, -OCHF2 и -CN; или его фармацевтически приемлемая соль, или сольват, или стереоизомер. Настоящее изобретение также обеспечивает фармацевтическую композицию, содержащую соединение настоящего изобретения и фармацевтически приемлемый носитель. В другом аспекте настоящее изобретение обеспечивает конкретное соединение формулы (I) в кристаллической форме свободного основания. Было обнаружено, что кристаллический метиловый эфир 4-(4-[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1-илметил)пиперидин-1 карбоновой кислоты имеет температуру плавления в диапазоне приблизительно от 145 до приблизительно 155 С, обычно приблизительно от 146 до приблизительно 148 С, температуру разложения выше чем приблизительно 240 С, и при воздействии относительной влажности в диапазоне приблизительно от 2 до приблизительно 90% при комнатной температуре показывает изменения массы менее чем приблизительно на 0,25%. Также дополнительные аспекты настоящего изобретения обеспечивают дополнительные кристаллические формы метилового эфира 4-(4-[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты. В аспекте способов настоящее изобретение обеспечивает способ лечения заболевания или состояния, связанного с активностью рецепторов 5-HT4, например нарушения, выражающегося в сниженной моторике желудочно-кишечного тракта, включающий введение млекопитающему терапевтически эффективного количества соединения настоящего изобретения. Дополнительно, настоящее изобретение обеспечивает способ лечения заболевания или состояния,связанного с активностью рецепторов 5-HT4 у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества фармацевтической композиции настоящего изобретения. Соединения настоящего изобретения также можно использовать в качестве средства исследования,то есть для изучения биологических систем или образцов, или для изучения действия других химических соединений. Соответственно, в других аспектах данного способа настоящее изобретение обеспечивает способ применения соединения формулы (I) или его фармацевтически приемлемой соли, или сольвата,или стереоизомера в качестве средства исследования для изучения биологической системы или образца,или для открытия новых агонистов рецепторов 5-HT4, включающий контактирование биологической системы или образца с соединением настоящего изобретения и определение эффектов, оказываемых данным соединением на биологическую систему или образец. В отдельных и отличительных аспектах настоящее изобретение также обеспечивает описанные в данном описании способы синтеза и промежуточные продукты, полезные для получения соединений настоящего изобретения. Настоящее изобретение также обеспечивает описанное в данном описании соединение настоящего изобретения для применения в медицинской практике, а также использование соединения настоящего изобретения для производства лекарственного препарата или лекарственного средства для лечения у млекопитающего заболевания или состояния, связанного с активностью рецепторов 5-HT4, например нарушения, выражающегося в снижении моторики желудочно-кишечного тракта. Различные аспекты настоящего изобретения показаны путем ссылки на прилагаемые чертежи. На фиг. 1 показана порошковая рентгенограмма (PXRD) кристаллического метилового эфира 4-(4[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты (форма I). На фиг. 2 показана кривая дифференциальной сканирующей калориметрии (DSC) (верхняя кривая,правая ось по вертикали) и кривая термического гравиметрического анализа (TGA) (нижняя кривая, левая ось по вертикали) для кристаллического метилового эфира 4-(4-[(2-изопропил-1H-бензоимидазол-4 карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты (форма I). На фиг. 3 показана изотерма динамической сорбции влажности (DMS) для кристаллического метилового эфира 4-(4-[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты (форма I). На фиг. 4 показана кривая дифференциальной сканирующей калориметрии (DSC) (верхняя кривая,правая ось по вертикали) и кривую термического гравиметрического анализа (TGA) (нижняя кривая, левая ось по вертикали) для кристаллического метилового эфира 4-(4-[(2-изопропил-1H-бензоимидазол-4 карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты (форма II). На фиг. 5 показана порошковая рентгенограмма (PXRD) кристаллического метилового эфира 4-(4[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты (форма III). На фиг. 6 показана кривая дифференциальной сканирующей калориметрии (DSC) (верхняя кривая,правая ось по вертикали) и кривую термического гравиметрического анализа (TGA) (нижняя кривая, ле-2 013240 вая ось по вертикали) для кристаллического метилового эфира 4-(4-[(2-изопропил-1H-бензоимидазол-4 карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты (форма III). Настоящее изобретение обеспечивает новые бензимидазолкарбоксамидные агонисты рецепторов 5-HT4 формулы (I) или их фармацевтически приемлемые соли, или сольваты, или стереоизомеры. Следующие заместители и значения предназначены для обеспечения типичных примеров различных аспектов настоящего изобретения. Указанные типичные значения предназначены для дополнительного определения таких аспектов и не предназначены для исключения других значений или ограничения объема настоящего изобретения. В конкретном аспекте настоящего изобретения R1 представляет собой С 3-5 алкил, необязательно замещенный -ОН. В другом конкретном аспекте R1 является С 3-5 алкилом. В других конкретных аспектах R1 представляет собой С 3-4 алкил или R1 представляет собой изопропил или трет-бутил. В другом конкретном аспекте R1 является изопропилом. Еще в одних конкретных аспектах R1 представляет собой 1-гидрокси-1-метилэтил или 2-гидрокси 1-метилэтил. В конкретном аспекте X является С(О)OR2, где R2 представляет собой С 1-4 алкил или -(CH2)n-фенил,где n равно 0 или 1. В другом конкретном аспекте X является -С(О)OR2, где R2 представляет собой C1-3 алкил или фенил. В других конкретных аспектах X является -С(О)OR2, где R2 представляет собой метил или фенил или где R2 является метилом. В конкретном аспекте X является -C(O)R3, где R3 выбирают из фенила, необязательно замещенного 1, 2 или 3 заместителями, выбранными из С 1-4 алкила, галогена, С 1-4 алкокси, -CF3, -OCF3, -OCHF2 и -CN; С 1-5 алкила; С 4-5 циклоалкила и -(CH2)m-А, где m равно 0 или 1, и А выбирают из амино, фуранила, тиофенила, морфолинила, тетрагидрофуранила, пиридинила, нафталенила, пирролила, тиоморфолинила, пирролидинила, пиперидинила, оксоазетидинила, тиазолидинила, 1,1-диоксоизотиазолидинила и 2,4-диметилизоксазолила. В другом конкретном аспекте X является -C(O)R3, где R3 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из С 1-4 алкила, галогена, С 1-4 алкокси, -CF3, -OCF3,-OCHF2 и -CN. В другом конкретном аспекте X является -C(O)R3, где R3 представляет собой С 1-5 алкил или С 4-5 циклоалкил. В другом конкретном аспекте X является -C(O)R3, где R3 представляет собой -(CH2)m-А, где m равно 0 или 1, и А выбирают из амино, фуранила, тиофенил, морфолинила, тетрагидрофуранила, пиридинила,нафталенила, пирролила, тиоморфолинила, пирролидинила, пиперидинила, оксоазетидинила, тиазолидинила, 1,1-диоксоизотиазолидинила и 2,4-диметилизоксазолила. В другом конкретном аспекте X является -C(O)R3, где R3 представляет собой фенил, необязательно замещенный 1 или 2 заместителями, выбранными из С 1-4 алкила, галогена и -CF3, фуранил или тиофенил. Еще в одних конкретных аспектах X является -C(O)R3, где R3 представляет собой фенил, необязательно замещенный 1 или 2 заместителями, выбранными из метила, хлора, фтора и -CF3, или R3 представляет собой фуран-2-ил или тиофен-2-ил. В конкретном аспекте X является -C(O)NR4R5, где R4 представляет водород или C1-3 алкил и R5 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из С 1-4 алкила,галогена, С 1-4 алкокси, -CF3, -OCF3 и -OCHF2. В другом конкретном аспекте X является -C(O)NR4R5, где R4 представляет собой водород. В другом конкретном аспекте X является -C(O)NR4R5, где R4 является водородом и R5 представляет собой фенил, необязательно замещенный 1 или 2 заместителями, выбранными из С 1-4 алкила и галогена. В других конкретных аспектах X является -C(O)NR4R5, где R4 представляет собой водород, и R5 представляет собой фенил, необязательно замещенный одним галогеном или одним фтором или хлором. В конкретном аспекте X является -С(О)С(R6R7)R8, где R6 представляет собой водород или С 1-3 алкил 7 и R представляет собой водород, -ОН или C1-3 алкил или R6 и R7, взятые вместе, образуют оксо или-(CH2)2- и R8 представляет собой фенил или циклогексил, где фенил или циклогексил необязательно замещены 1, 2 или 3 заместителями, выбранными из С 1-4 алкила, галогена, C1-4 алкокси, -CF3, -OCF3, -OCHF2 и -CN. В другом конкретном аспекте X представляет собой С(О)С(R6R7)R8, где R6 является водородом. В другом конкретном аспекте X является -С(О)С(R6R7)R8, где R8 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из С 1-4 алкила, галогена, -CF3, -OCF3,-OCHF2 и -CN. В другом конкретном аспекте X является -С(О)С(R6R7)R8, где R8 представляет собой циклогексил,необязательно замещенный 1, 2 или 3 заместителями, выбранными из С 1-4 алкила, галогена, C1-4 алкокси,-CF3, -OCF3, -OCHF2 и -CN. Еще в одних конкретных аспектах X является -С(О)С(R6R7)R8, где R6 является водородом и R7-3 013240 представляет собой водород, -ОН или метил или R6 и R7, взятые вместе, образуют оксо или -(CH2)2- и R8 представляет собой фенил или циклогексил, где фенил или циклогексил необязательно замещены 1 или 2 заместителями, выбранными из С 1-4 алкила и галогена; или R8 представляет собой фенил или циклогексил, где фенил или циклогексил необязательно замещены 1 или 2 заместителями, выбранными из метила,фтора и хлора. В конкретном аспекте X является -С(О)С(HR9)OR10, где R9 представляет собой водород илиC1-3 алкил и R10 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из С 1-4 алкила, галогена, С 1-4 алкокси, -CF3, -OCF3 и -OCHF2. В другом конкретном аспекте X является -С(О)С(HR9)OR10, где R9 представляет собой водород или метил. В других конкретных аспектах X является -С(О)С(HR9)OR10, где R9 представляет собой водород или метил и R10 является фенилом, необязательно замещенным 1 или 2 заместителями, выбранными из С 1-4 алкила и галогена, или фенилом, необязательно замещенным 1 или 2 заместителями, выбранными из метила, фтора и хлора. В конкретном аспекте X является -S(O)2R11, где R11 выбирают из C1-3 алкила, -СН 2-фенила, фуранила, тиофенила, морфолинила, тетрагидрофуранила, пиридинила, нафталенила, пирролила, тиоморфолинила, пирролидинила, пиперидинила, оксоазетидинила, тиазолидинила, 1,1-диоксоизотиазолидинила,2,4-диметилизоксазолила и фенила, необязательно замещенного 1, 2 или 3 заместителями, выбранными из С 1-4 алкила, галогена, C1-4 алкокси, -CF3, -OCF3, -OCHF2 и -CN. В другом конкретном аспекте X является -S(O)2R11, где R11 представляет собой С 1-3 алкил,2,4-диметилизоксазолил или фенил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из С 1-4 алкила, галогена, С 1-4 алкокси, -CF3, -OCF3, -OCHF2 и -CN. В других конкретных аспектах X является -S(O)2R11, где R11 является метилом или фенилом, необязательно замещенным 1 или 2 заместителями, выбранными из С 1-4 алкила и галогена; или 1 или 2 заместителями, выбранными из метила, фтора и хлора. В одном аспекте настоящее изобретение обеспечивает соединение формулы (I), где(d) -С(О)С(R6R7)R8, где R6 является водородом и R7 представляет собой водород, -ОН или метил или 6R и R7, взятые вместе, образуют оксо или -(CH2)2- и R8 представляет собой фенил или циклогексил, где фенил или циклогексил необязательно замещены 1 или 2 заместителями, выбранными из С 1-4 алкила и галогена;(e) -С(О)С(HR9)OR10, где R9 является водородом или метилом и R10 представляет собой фенил, необязательно замещенный 1 или 2 заместителями, выбранными из С 1-4 алкила и галогена; и(f) -S(O)2R11, где R11 является метилом или фенилом, необязательно замещенным 1 или 2 заместителями, выбранными из С 1-4 алкила и галогена. Настоящее изобретение дополнительно обеспечивает соединение формулы (I), гдеR1 представляет собой изопропил или трет-бутил и(a) -С(О)OR2, где R2 является метилом или фенилом;(c) -C(O)NR4R5, где R4 является водородом, и R5 представляет собой фенил, необязательно замещенный одним фтором или хлором. И еще в одних конкретных аспектах настоящее изобретение обеспечивает соединения, перечисленные в приведенных ниже примерах и табл. I-IX. Используемое в настоящем изобретении соглашение по химическому наименованию показано для соединения из примера 1 в соответствии с которым метиловый эфир 4-(4-[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты обозначен согласно программному обеспечению AutoNom, предоставленному компанией MDL Information Systems, GmbH(Франкфурт, Германия). Конденсированная кольцевая структура "бензоимидазол" иначе называется"бензимидазолом". Используемые в настоящем изобретении оба термина являются эквивалентными. Как показано на примере конкретных соединений, перечисленных в таблицах ниже, соединения настоящего изобретения могут содержать хиральный центр. Соответственно, если не указано иначе, настоящее изобретение включает рацемические смеси, чистые стереоизомеры и обогащенные стереоизомерами смеси таких изомеров. Если указан конкретный стереоизомер, специалистам в данной области будет понятно, что незначительное количество других стереоизомеров может присутствовать в соединениях настоящего изобретения, если не указано иначе, при условии, что наличие других таких изомеров не исключают какую-либо полезность композиции в целом. В одном аспекте настоящее изобретение обеспечивает соединение, выбранное из группы, представляющей метиловый эфир 4-(4-[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1 илметил)пиперидин-1-карбоновой кислоты; фениловый эфир 4-(4-[(2-изопропил-1H-бензоимидазол-4-карбонил)амино)метилпиперидин-1 илметил)пиперидин-1-карбоновой кислоты; 1-[1-(2-хлорбензоил)пиперидин-4-илметил]пиперидин-4-илметиламид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты; 1-[1-(2,4-дифторбензоил)пиперидин-4-илметил]пиперидин-4-илметиламид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты; 1-[1-(фуран-2-карбонил)пиперидин-4-илметил]пиперидин-4-илметиламид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты; 1-[1-(тиофен-2-карбонил)пиперидин-4-илметил]пиперидин-4-илметиламид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты; 1-[1-(2-фтор-5-трифторметилбензоилпиперидин-4-илметил]пиперидин-4-илметиламид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты; 1-[1-(2-фторфенилкарбамоил)пиперидин-4-илметил]пиперидин-4-илметиламид 2-изопропил-1Hбензоимидазол-4-карбоновой кислоты; метиловый эфир 4-(4-[(2-трет-бутил-1H-бензоимидазол-4-карбонил)амино)метилпиперидин-1 илметил)пиперидин-1-карбоновой кислоты; 1-[1-(2-фторбензоил)пиперидин-4-илметил]пиперидин-4-илметиламид 2-трет-бутил-1H-бензоимидазол-4-карбоновой кислоты; 1-[1-(3-метилбензоил)пиперидин-4-илметил]пиперидин-4-илметиламид 2-трет-бутил-1H-бензоимидазол-4-карбоновой кислоты; и 1-[1-(4-фторбензоил)пиперидин-4-илметил]пиперидин-4-илметиламид 2-трет-бутил-1H-бензоимидазол-4-карбоновой кислоты. Определения При описании соединений, композиций и способов настоящего изобретения, если не указано иначе,следующие термины имеют следующие значения. Термин "алкил" означает моновалентную насыщенную углеводородную группу, которая может быть линейной или разветвленной, или их комбинацией. Если не указано иначе, такие алкилированные группы обычно содержат от 1 до 10 атомов углерода. Представители алкильных групп включают в качестве примеров метил (Me), этил, н-пропил (n-Pr), изопропил (iPr), н-бутил (n-Bu), sec-бутил, изобутил,трет-бутил (tBu), н-пентил, н-гексил, н-гептил, н-октил, н-нонил, н-децил и т.п. Термин "алкокси" означает моновалентную группу -О-алкила, где алкил определен, как указано выше. Представители алкоксигруппы включают в качестве примера метокси, этокси, пропокси, бутокси и т.п. Термин "циклоалкил" означает моновалентную насыщенную карбоциклическую группу, которая может быть моноциклической или полициклической. Если не указано иначе, такие циклоалкильные группы обычно содержат от 3 до 10 атомов углерода. Представители циклоалкильной группы включают в качестве примера циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и т.п. Термин "галоген" означает фтор, хлор, бром или йод. Термин "оксо" означает атом кислорода с двойной связью (=O). Термин "соединение" означает соединение, которое получено путем синтеза или получено любым другим путем, таким как метаболизм. Термин "терапевтически эффективное количество" означает количество, достаточное для осуществления лечения при введении пациенту, нуждающемуся в таком лечении. Термин "лечение", используемый в данном описании, означает лечение заболевания, нарушения или клинического состояния у пациента, такого как млекопитающее (в частности, человек), которое включает:(a) предотвращение возникновения заболевания, нарушения или клинического состояния, то есть профилактическое лечение пациента;(b) улучшение заболевания, нарушения или клинического состояния, то есть устранение или обратное развитие заболевания, нарушения или клинического состояния у пациента;(c) подавление заболевания, нарушения или клинического состояния, то есть замедление или прекращение развития заболевания, нарушения или клинического состояния у пациента; или(d) облегчение симптомов заболевания, нарушения или клинического состояния у пациента. Термин "фармацевтически приемлемая соль" означает соль, полученную из кислоты или основания,которая подходит для введения пациенту, такому как млекопитающее. Такие соли можно получать из фармацевтически приемлемых неорганических или органических кислот и из фармацевтически приемлемых оснований. Обычно фармацевтически приемлемые соли соединений настоящего изобретения получают из кислот. Соли, полученные из фармацевтически приемлемых кислот, включают, но без ограничения, уксусную, адипиновую, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую,фумаровую, глюконовую, глютаминовую, бромисто-водородную, хлористо-водородную, молочную, малеиновую, яблочную, миндальную, метансульфоновую, муциновую, азотную, пантотеническую, фосфорическую, янтарную, серную, винно-каменную, п-толуолсульфоновую, ксинафоевую (1-гидрокси-2-нафтойная кислота), нафталин-1,5-дисульфоновую кислоту и т.п. Термин "сольват" означает комплекс или агрегат, образованный одной или несколькими молекулами растворенного вещества, то есть соединениями настоящего изобретения или его фармацевтически приемлемой соли, и одной или несколькими молекулами растворителя. Такие сольваты обычно представляют собой кристаллические твердые вещества, имеющие, по существу, фиксированное молярное отношение растворенного вещества и растворителя. Представители растворителей включают в качестве примера воду, метанол, этанол, изопропанол, уксусную кислоту и т.п. Если растворителем является вода,образованным сольватом является гидрат. Следует понимать, что термин или его фармацевтически приемлемая соль, или сольват его стереоизомера предполагает, что в него включены все перестановки в солях, сольватах и стереоизомерах, таких как сольват фармацевтически приемлемой соли стереоизомера соединения формулы (I). Термин "защитная аминогруппа" означает защитную группу, подходящую для предотвращения нежелательных реакций в аминоазоте. Представители защитных аминогрупп включают, но без ограничения, формил; ацильные группы, например алканоильные группы, такие как ацетил; алкоксикарбонильные группы, такие как трет-бутоксикарбонил (Boc); арилметоксикарбонильные группы, такие как бензилоскикарбонил (Cbz) и 9-флуоренилметоксикарбонил (Fmoc); арилметильные группы, такие как бензил(Bn), тритил (Tr) и 1,1-ди(4'-метоксифенил)метил; силильные группы, такие как триметилсилил (TMS) и трет-бутилдиметилсилил (TBDMS)/ и т.п. Общепринятые способы синтеза Соединения настоящего изобретения можно получить из легко доступных исходных соединений,используя следующие общепринятые способы и методики. Хотя конкретный аспект настоящего изобретения показан на приведенных ниже схемах специалистам в данной области будет понятно, что все аспекты настоящего изобретения можно получить с использованием способов, описанных в данном описании или с использованием других способов, реагентов и исходных соединений, известных специалистам в данной области. Также следует понимать, что если заданы обычные или предпочтительные условия способа (то есть параметры температуры реакции, времени, давления, молярные отношения реагентов,растворителей и т.д.), также можно использовать другие условия способа, если не указано иначе. Оптимальные условия реакции могут варьировать в зависимости от конкретных используемых реагентов или растворителя, но такие условия может определить специалист в данной области в соответствии с обычными алгоритмами оптимизации. Дополнительно, специалистам в данной области будет очевидно, что может быть необходимым наличие общепринятых защитных групп, препятствующих осуществлению нежелательных реакций с определенными функциональными группами. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящих условий для защиты и снятия защитных групп известен в данной области. Например, многочисленные защитные группы и их введение и удаление описаны в T.W.Greene and G.M. Wuts Protecting Groups in Organic Synthesis, Third Edition, Wiley, New York, 1999 и цитированных там ссылках. В одном способе синтеза соединения формулы (I) получают путем взаимодействия промежуточного продукта пиперидинилметилпиперидинилметила, имеющего формулу (II) где L является уходящей группой, например галогеном, таким как хлор, или ацилокси, сульфоновым сложным эфиром или оксисукцинимидом, и R1 и X определены согласно формуле (I). Взаимодействие обычно проводят путем контактирования промежуточного продукта (II) с приблизительно от 1 до приблизительно 1,5 экв. промежуточного продукта (III) в полярном апротонном разбавителе, таком как дихлорметан, в присутствии по меньшей мере одного эквивалента аминного основания, такого как N,N-диизопропилэтиламин. Подходящие инертные разбавители для данного способа, а также для описанных ниже способов включают N,N-диметилформамид, трихлорметан, 1,1,2,2-тетрахлорэтан, тетрагидрофуран и т.п. Подходящие аминные основания для способов настоящего изобретения также включают триэтиламин, пиридин и т.п. Реакцию обычно проводят при температуре в диапазоне приблизительно от 0 до приблизительно 30 С в течение приблизительно от четверти часа до приблизительно 2 ч или, по существу, до завершения реакции. Примеры реагентов L-X, где L представляет собой хлор, включают метилхлорформиат, фенилхлорформиат, хлорбензоилхлорид и метансульфонилхлорид. В альтернативном способе синтеза соединения формулы (I), где X выбирают из -C(O)R3,-С(О)С(R6R7)R8 и -С(О)С(HR9)OR10, можно получить реакцией сочетания амидов промежуточного продукта формулы (II) с карбоновой кислотой формулы (IV) В формуле (IV) X' представляет собой R3, C(R6R7)R8 или C(HR9)OR10 таким образом, что -С(О)Х' соответствует X, как определено выше для формулы (IV). В реакции сочетания амидов промежуточного продукта (II) сначала приблизительно от 1 до приблизительно 1,5 экв. карбоновой кислоты (IV) подвергают взаимодействию с приблизительно 1 до приблизительно 1,5 экв. агента сочетания, такого как гексафторфосфат О-(7-аксабензотризол-1-ил)-N,N,N',N'-тетраметилурония (HATU), в полярном апротонном растворителе, таком как диметилформамид или приведенные выше. Смесь кислот затем подвергают взаимодействию с промежуточным продуктом (II) в присутствии приблизительно от 2 до приблизительно 4 экв. аминного основания, например N,N-диизопропилэтиламина. Реакцию обычно проводят при температуре в диапазоне приблизительно от 0 до приблизительно 30 С в течение приблизительно от четверти часа до приблизительно 2 ч или, по существу, до завершения реакции. Подходящие альтернативные агенты сочетания включают гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC), 1,1'-карбонилдиимидазол (CDI), 1,3 дициклогексилкарбодиимид(DCC) и гексафторфосфат бензотриазол-1-илокситрипирролидинофосфония (РуВор). Агент сочетания можно объединять с активаторами, например 1-гидрокси-7-азабензотриазолом (HOAt), гидроксибензотриазолом (HOBt) или 1,4-диазабицикло[2,2,2]октаном (DABCO). Еще в одном альтернативном способе соединения формулы (I), в которых X представляет собойC(O)NHR5, можно получить путем взаимодействия промежуточного продукта формулы (II) с изоцианатом формулы Взаимодействие обычно проводят путем контактирования промежуточного продукта (II) с приблизительно от 1 до приблизительно 1,5 экв. промежуточного продукта (V) в полярном апротонном разбавителе в присутствии приблизительно от 2 до приблизительно 4 экв. аминного основания. Реакцию обычно осуществляют при температуре в диапазоне приблизительно от 0 до приблизительно 30 С в течение приблизительно от четверти часа до приблизительно 24 ч или, по существу, до завершения реакции. Продукт формулы (I) выделяют и очищают согласно общепринятым методам. Например, продукт можно выпаривать досуха при пониженном давлении, и остаток очищать высокоэффективной жидкостной хроматографией (ВЭЖХ). Промежуточные продукты пиперидинилметилпиперидинилметила формулы (II) получают из общедоступных исходных соединений согласно способу, показанному на схеме А. где Р 1 и Р 2 независимо представляют собой защитную аминогруппу, такую как трет-бутоксикарбонил (Boc). Сначала карбоновую кислоту формулы (VI) подвергают взаимодействию с защищенным аминометилпиперидином с образованием защищенного промежуточного продукта формулы (VII). Реакцию обычно проводят путем контактирования (VI) с приблизительно от 1 до приблизительно 2 экв. защищенного аминометилпиперидина в полярном апротонном разбавителе, в присутствии агента сочетания амидов, описанного выше, например гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) в комбинации с гидроксибензотриазолом (HOBt) или 1,1'-карбонилдиимидазола (CDI) в комбинации с 1,4-диазабицикло[2,2,2]октаном (DABCO). Реакцию обычно проводят при температуре в диапазоне приблизительно от 0 до приблизительно 60 С в течение периода времени приблизительно от 1 до приблизительно 24 ч или, по существу, до завершения реакции. Для получения промежуточного продукта (VIII) защитную группу Р 1 удаляют из промежуточного продукта (VII) общепринятым способом. Например, если в качестве защитной группы используют Boc,ее можно удалять обработкой кислотой, такой как трифторуксусная кислота или хлористо-водородная кислота. Затем получают промежуточный продукт формулы (IX) путем восстановительного аминирования промежуточного продукта (VIII) с защищенным пиперидинкарбоксальдегидом. Данную реакцию обычно осуществляют путем контактирования соединения (VIII) с приблизительно от 1 до приблизительно 2 экв. защищенного пиперидинкарбоксальдегида в инертном разбавителе в присутствии приблизительно от 1 до приблизительно 2 экв. восстановителя. Необязательно для ускорения реакции можно вводить в нее один эквивалент слабой кислоты, такой как уксусная кислота. Реакцию можно проводить при температуре приблизительно от 0 до приблизительно 30 С, обычно приблизительно от 20 до приблизительно 30 С,в течение приблизительно от 0,25 до приблизительно 2 ч или, по существу, до завершения реакции. Подходящие инертные разбавители включают дихлорметан, трихлорметан, 1,1,2,2-тетрахлорэтан и т.п. Обычные восстановители включают триацетоксиборангидрид натрия, борогидрид натрия и цианоборогидрид натрия. Продукт (IX) выделяют согласно стандартным методам. Если амин (VIII) получают в виде кислой соли, в реакцию включают приблизительно от 1 до приблизительно 3 экв. аминного основания, такого как N,N-диизопропилэтиламин. Наконец, защитную группу Р 2 удаляют из промежуточного продукта (IX) согласно общепринятым способам с получением промежуточного продукта (II), пиперидинилметилпиперидинилметила. Карбоновая кислота формулы (VI) может быть получена из диаминобензойной кислоты или сложного эфира способом, показанным на схеме В Схема В где R представляет собой метил или водород. Промежуточный продукт (XI) подвергают взаимодействию с карбоновой кислотой R1C(O)OH с образованием кислого промежуточного продукта (VI). Реакцию обычно проводят путем контактирования кислоты или сложного эфира (XI) с приблизительно от 2-8 013240 до приблизительно 4 экв. карбоновой кислоты R1C(O)OH в водном кислом растворе. Реакцию обычно проводят при температуре в диапазоне приблизительно от 80 до приблизительно 100 С в течение приблизительно от 12 до приблизительно 72 ч. Затем рН раствора повышают добавлением основания, такого как гидроксид натрия, и общепринятыми методами выделяют продукт. В общепринятом способе получения промежуточного продукта (XI) в виде метилового сложного эфира в качестве исходного соединения используют метиловый эфир 2-амино-3-нитробензойной кислоты (X) Обычно метиловый эфир 2-амино-3-нитробензойной кислоты (X) растворяют в полярном разбавителе и восстанавливают путем воздействия атмосферы водорода в присутствии катализатора из переходного металла с получением метилового эфира диаминобензойной кислоты (XI). Реакцию обычно проводят при температуре окружающей среды в течение приблизительно от 12 до приблизительно 72 ч. Когда заместитель R1 стерически объемен, как, например, когда R1 представляет собой трет-бутил,трет-бутилбензимидазолкарбоновую кислоту (VI') можно получить превращением метилового сложного эфира (XI') согласно двухстадийному способу, показанному, например, на схеме С Схема С Как подробно описано ниже в получении 3, метиловый сложный эфир (XI') сначала подвергают взаимодействию с 2,2-диметилпропионилхлоридом с получением промежуточного продукта (XII), который кипятят с обратным холодильником в растворе сильной кислоты, обычно в течение приблизительно от 12 до приблизительно 72 ч с получением трет-бутилбензимидазолкарбоновой кислоты (VI'). В альтернативных способах синтеза соединения формулы (I) можно получить согласно путям синтеза, проиллюстрированным на схеме D с использованием восстановительного аминирования и других реакций, описанных выше, и/или с использованием альтернативных реакций, хорошо известных специалистам в данной области. Схема D Как показано в пути синтеза (i), промежуточный продукт формулы (VIII) подвергают взаимодействию с промежуточным продуктом формулы (XIII) с получением соединения формулы (I). Реакцию обычно осуществляют в условиях, описанных выше для реакции амина (VIII) с защищенным пиперидинкарбоксальдегидом на схеме А. Промежуточный продукт (XIII) можно получить взаимодействием 4-гидроксиметилпиперидина с реагентом L-X формулы (III) с последующим окислением полученного промежуточного продукта. Например, для конкретного случая, когда X представляет собой С(О)ОСН 3, промежуточный продукт (XIII) можно получить, как показано на схеме Е. Сначала 4-гидроксиметилпиперидин подвергают взаимодействию с метилхлорформиатом с образованием промежуточного продукта гидроксиметилпиперидина (XV). Реакцию обычно проводят путем контактирования 4-гидроксиметилпиперидина в водном растворе с приблизительно от 3 до приблизительно 5 экв. метилхлорформиата в присутствии приблизительно от 3 до приблизительно 5 экв. основания. Реакцию обычно проводят при температуре в диапазоне приблизительно от 0 до приблизительно 30 С в течение приблизительно от 12 до приблизительно 72 ч или, по существу, до завершения реакции. Затем промежуточный продукт (XV) окисляют с образованием промежуточного продукта формилпиперидинила (XIII'). В реакции окисления обычно используют такой окислитель, как комбинация оксалилхлорида и диметилсульфоксида (окисление Сверна), хроматный реагент, такой как пиридинийхлорхромат, или такой окислитель, как гипохлорит натрия, вместе с катализатором, таким как свободный 2,2,6,6 тетраметил-1-пиперидинилоксирадикал (TEMPO). Получение соединения формулы (I) согласно пути синтеза (i) на схеме D с использованием промежуточного продукта (XIII') описано ниже в примерах 214 и 216. Соединение формулы (I) можно также получить путем взаимодействия карбоновой кислоты формулы (VI) с промежуточным продуктом формулы (XIV), как показано в пути синтеза (ii). Как показано на схеме F, промежуточный продукт (XIV) можно получить путем взаимодействия защищенного аминометилпиперидина с промежуточным продуктом (XIII) Схема F где Р является защитной аминогруппой с получением защищенного промежуточного продукта формулы (XVI), с последующей стадией снятия защитных групп. Получение соединений согласно пути синтеза (ii) описано ниже в получении 4 и в примерах 14 и 15. Реагенты L-X (III), Х 1 С(О)ОН (IV), O=C=N=R5 (V) и R1O(O) ОН являются коммерчески доступными или их легко получить стандартными способами из общепринятых исходных соединений. Дополнительные подробности, относящиеся к конкретным условиям реакции и другим примерам способов получения соединений настоящего изобретения или его промежуточных продуктов, описаны ниже в примерах. Соответственно, в аспекте способа настоящее изобретение обеспечивает способ получения соединения формулы (I), или его соли, или стереоизомера, включающий (а) взаимодействие соединения формулы (II) с соединением формулы (III); (b) взаимодействие соединения формулы (VIII) с соединением формулы (XIII) или (с) взаимодействие соединения формулы (VI) с соединением формулы (XIV), с получением соединения формулы (I), или его соли, или стереоизомера. В дополнительном аспекте способа настоящее изобретение обеспечивает способ получения соединения формулы (I), где X выбирают из -C(O)R3, -С(О)С(R6R7)R8 и -С(О)С(HR9)OR10, или их соли, или стереоизомера, включающий взаимодействие соединения формулы (II) с соединением формулы (IV), гдеX' представляет собой R3, C(R6R7)R8 или C(HR9)OR10, с получением соединения формулы (I), или его соли, или стереоизомера. Настоящее изобретение дополнительно обеспечивает соединение формулы (II), или его соль, или стереоизомер, или его защищенное производное, где R1 определен согласно формуле (I). Кристаллические формы В другом аспекте настоящее изобретение обеспечивает метиловый эфир 4-(4-[(2-изопропил-1Hбензоимидазол-4-карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты в кристаллической форме свободного основания или его сольвата. Обследовали три различимые формы кристаллического метилового эфира 4-(4-[(2-изопропил-1H-бензоимидазол-4-карбонил)амиино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты (далее указываемые, как соединение 1). Кристаллическая форма I настоящего изобретения является кристаллическим свободным основанием. Форма I характеризуется порошковой рентгенограммой (PXRD), имеющей два или несколько дифракционных пика при значении 29, выбранном из 15,080,20, 15,410,20, 19,000,20, 19,700,20 и 23,680,20. В частности, форма I характеризуется порошковой рентгенограммой, имеющей дифракционные пики при значении 2 19,000,20 и 19,700,20. Как хорошо известно, в области порошковой рентгеновской дифракции пиковые положения спектров PXRD, в отличие от относительной высоты пиков, являются относительно менее чувствительными- 10013240 к деталям эксперимента, таким как подробности приготовления образцов и расположение приборов. Таким образом, в одном аспекте кристаллическая форма I характеризуется порошковой рентгенограммой, в которой пиковые положения, по существу, соответствуют положениям, показанным на фиг. 1. Форма I дополнительно характеризуется рентгеноструктурным анализом кристаллической структуры, обеспечивающим следующие характеристики решетки: элементарная ячейка является ромбической со следующими параметрами: а=16,9053 , b=9,5172 , с=15,4659 ; пространственной группой является Pna21; вычисленная плотность составляет 1,22 г/см 3. Получаемая молекулярная структура подтверждает, что химическая композиция имеет структуру соединения 1 и что асимметричная единица не содержит молекулы воды или других растворителей. Пики порошковой рентгеновской дифракции, предполагаемые по полученным атомным положениям, отлично согласуются с наблюдаемыми результатами. Кристаллическая форма I настоящего изобретения также характеризуется высокой температурой термической устойчивости, о чем свидетельствует ее профиль дифференциальной сканирующей калориметрии (DSC), демонстрирующий пик эндотермического теплового потока в диапазоне приблизительно от 145 до приблизительно 155 С, обычно приблизительно от 146 до 148 С, как показано на фиг. 2, который можно определить как точку плавления. Кроме того, профиль термического гравиметрического анализа (TGA) не показывает случаев значимого изменения массы при температуре ниже начала распада,что составляет выше чем приблизительно 240 С. Еще в одном аспекте кристаллическая форма настоящего изобретения характеризуется своим спектром инфракрасного поглощения, который показывает выраженные полосы поглощения при длине приблизительно 766, 1097, 1251, 1413, 1449, 1579, 1609, 1640 и 1696 см-1. Было показано, что кристаллическая форма настоящего изобретения имеет обратимый профиль сорбции/десорбции с исключительно низким уровнем гигроскопичности (то есть меньше чем увеличение массы приблизительно на 0,25% в диапазоне влажности от 2% относительной влажности до 90% относительной влажности при комнатной температуре), как показано на фиг. 3. Дополнительно, было обнаружено, что кристаллическая форма I соединения 1 является устойчивой при воздействии повышенной температуры и влажности. При хранении в течение трех месяцев при температуре 40 С и относительной влажности 75% отсутствовали какие-либо поддающиеся определению изменения профилей DSC, TGA или PXRD, изменения химической чистоты, определяемые анализом ВЭЖХ, и какие-либо заметные визуальные изменения внешнего вида. Также отсутствовали какие-либо изменения, выявляемые DSC, TGA или PXRD, после измельчения частиц формы I от объемного среднего размера частиц, составляющего приблизительно 470 мкм до объемного среднего размера частиц приблизительно 15, приблизительно 22 или приблизительно 29 мкм. Кристаллическая форма II соединения 1 характеризуется профилями DSC и TGA, показанными на фиг. 4. Анализ TGA показывает начало потери массы в диапазоне температур приблизительно от 95 до приблизительно 105 С, обычно при приблизительно 100 С, со ступенчатым профилем, соответствующим потере воды или растворителя, тогда как профиль DSC показывает пик эндотермического теплового потока приблизительно от 143 до приблизительно 145 С, одновременно с явлением плавления. ДиаграммаPXRD формы II неотличима от аналогичной диаграммы формы I. Профиль TGA формы II согласуется с интерпретацией формы II в виде сольвата, тогда как положительная идентификация не проводилась. Третью кристаллическую форму настоящего изобретения идентифицировали как моногидрат. Форма III характеризуется порошковой рентгенограммой (PXRD), имеющей два или несколько дифракционных пика при значении 2 , выбранном из 9,140,20, 12,410,20, 12,740,20, 17,750,20, 18,470,20,20,630,20, 21,130,20 и 27,050,20, как показано на фиг. 5. В частности, форма III характеризуется порошковой рентгенограммой, имеющей дифракционные пики при значении 2 , составляющие 9,140,20 и 20,630,20. Профили DSC и TGA формы III, показанные на фиг. 6, показывают материал, претерпевающий ступенчатую потерю массы с началом температурного диапазона приблизительно от 65 до приблизительно 75 С, обычно при приблизительно 70 С, и пик эндотермического теплового потока при температуре приблизительно от 90 до приблизительно 100 С, соответствующий потере моногидрата воды и последующему плавлению. Форма III дополнительно характеризуется рентгеноструктурным анализом кристаллической структуры, обеспечивая следующие параметры кристаллической решетки: элементарная ячейка является моноклинной со следующими размерами: а=14,8101 , b=9,9985 , с=17,9222 ;=106,3020, пространственной группой является P21/n; расчетная плотность составляет 1,23 г/см 3. Полученная молекулярная структура свидетельствует о том, что структура имеет химический состав соединения 1 и что асимметрическая единица содержит единственную молекулу воды. Отдельные кристаллические формы настоящего изобретения можно повторяемо получать согласно следующим методикам. Кристаллическую форму I можно получить путем диспергирования соединения 1 в инертном разбавителе, выбранном из ацетонитрила, эфира, циклогексана и этилацетата в пропорции приблизительно от 15 до приблизительно 25 мг соединения 1 на 1 мл разбавителя, с образованием смеси,и оставляя смесь для выпаривания при температуре окружающей среды, что приводит к кристаллизации. Альтернативно, форму I можно получать способом замены растворителя из неочищенного соедине- 11013240 ния 1 в растворе, без выделения сначала аморфного соединения 1, как описано ниже в примере 216. Обычно реакцию получения соединения 1 проводят в полярном апротонном разбавителе, таком как дихлорметан, в котором соединение хорошо растворимо. Для получения кристаллической формы I добавляют ацетонитрил, в то время как вакуумной перегонкой неочищенного продукта реакции удаляют дихлорметан. Смесь, содержащую приблизительно от 1 до приблизительно 200 мг соединения 1 на 1 мл ацетонитрила, обычно приблизительно от 50 до приблизительно 125 мг соединения 1 на 1 мл ацетонитрила, получают из остатка, оставшегося после перегонки, и нагревают до температуры, достаточной для растворения остатка, например до температуры приблизительно 75 С. Затем смесь охлаждают до температуры не выше приблизительно 20 С, с получением кристаллической формы I, которую выделяют согласно общепринятым методам. Примером такого способа является охлаждение смеси до образования центров кристаллизации обычно при температуре приблизительно от 55 до приблизительно 65 С и выдерживание при этой температуре в течение приблизительно часа. Затем смесь охлаждают со скоростью приблизительно от 0,25 до приблизительно 0,4 С в минуту до температуры приблизительно 20 С. Для повышения выхода кристаллической формы I смесь можно дополнительно охлаждать со скоростью приблизительно от 0,5 до приблизительно 0,75 С в минуту до температуры приблизительно от 0 до приблизительно 5 С. Для получения формы II аморфное соединение 1 диспергируют в гексане при температуре окружающей среды до конечной концентрации приблизительно 10 мг/мл и полученную смесь подвергают обработке ультразвуком. Примерно через 24 ч при температуре окружающей среды получают кристаллические твердые вещества формы II. Форму III получали путем растворения аморфного соединения 1 в смеси этанол:водный растворитель в пропорции 1:1 при температуре окружающей среды до конечной концентрации приблизительно 20 мг/мл и обработки раствора ультразвуком в течение приблизительно 30 с. Раствор оставляли для частичного выпаривания в незакупоренной колбе. Спустя приблизительно 24 ч получают кристаллические твердые вещества формы III. Фармацевтические композиции Соединения бензимидазолкарбоксамида настоящего изобретения обычно вводят пациенту в виде фармацевтической композиции. Такие фармацевтические композиции можно вводить пациенту любым подходящим путем введения, включающим, но без ограничения, пероральный, ректальный, влагалищный, назальный, ингаляционный, местный (включая трансдермальный) и парентеральные способы введения. Соответственно, в одном из своих композиционных аспектов настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель или эксципиент и терапевтически эффективное количество соединения формулы (I), или его фармацевтически приемлемой соли, или сольвата. Необязательно такие фармацевтические композиции могут содержать другие терапевтические и/или входящие в состав агенты, если это желательно. Фармацевтические композиции настоящего изобретения обычно содержат терапевтически эффективное количество соединения настоящего изобретения или его фармацевтически приемлемой соли. Обычно такие фармацевтические композиции будут содержать приблизительно от 0,1 до приблизительно 95 мас.% активного вещества; включая приблизительно от 5 до приблизительно 70 мас.% и приблизительно от 10 до приблизительно 60 мас.% активного вещества. В фармацевтических композициях настоящего изобретения можно использовать любой общепринятый носитель или эксципиент. Выбор конкретного носителя или эксципиента или комбинаций носителей или эксципиентов будет зависеть от способа введения, применяемого для лечения конкретного пациента,или от типа клинического состояния или заболевания. В этом отношении получение подходящей фармацевтической композиции для конкретного способа введения входит в сферу деятельности, хорошо известную специалистам в фармацевтической области. Дополнительно, ингредиенты для таких композиций коммерчески доступны, например, от компании Sigma, P.O. Box 14508, St. Louis, MO 63178. Общепринятые технологии создания рецептур для дополнительной иллюстрации описаны в Remington: TheWhite, Baltimore, Maryland (1999). Типичные примеры материалов, которые могут служить фармацевтически приемлемыми носителями, включают, но без ограничения, следующее: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу, такую как микрокристаллическая целлюлоза и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; (4) порошковый трагакант; (5) солод; (6) желатин; (7) тальк; (8) эксципиенты, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло,сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли,такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферирующие вещества, такие как- 12013240 гидроксид магния и гидроксид алюминия; (15) альгиновая кислота; (16) апирогенная вода; (17) изотонический раствор; (18) раствор Рингера; (19) этиловый спирт; (20) фосфатно-буферные растворы и (21) другие нетоксичные совместимые вещества, применяемые в фармацевтических композициях. Фармацевтические композиции настоящего изобретения обычно получают путем основательного и тщательного перемешивания или перемешивания соединения настоящего изобретения с фармацевтически приемлемым носителем и с одним или несколькими необязательными ингредиентами. Затем, при необходимости или желании, полученную однородно перемешанную смесь можно формовать или помещать в таблетки, капсулы, пилюли и т.п., используя общепринятые способы и оборудование. Фармацевтические композиции настоящего изобретения предпочтительно упаковывают в виде единичной дозированной формы. Термин "единичная дозированная форма" относится к физически дискретной единице, подходящей для введения пациенту, то есть каждая единица содержит заданное количество активного вещества, рассчитанное таким образом, чтобы оказывать желаемый терапевтический эффект,или как таковой, или и в комбинации с одной или несколькими дополнительными единицами. Например,такие единичными дозированными формами могут являться капсулы, таблетки, пилюли и т.п. В предпочтительном варианте осуществления фармацевтические композиции настоящего изобретения подходят для перорального введения. Подходящие для перорального введения фармацевтические композиции могут быть в виде капсул, таблеток, пилюль, пастилок, саше, драже, порошков, гранул; или в виде раствора или суспензии в водной или неводной жидкости, или в виде жидкой эмульсии типа масло-в-воде или вода-в-масле; или в виде эликсира или сиропа и т.п.; каждое из которых в качестве активного ингредиента содержит заданное количество соединения настоящего изобретения. Если фармацевтические композиции настоящего изобретения предназначены для перорального введения в твердой лекарственной форме (то есть в виде капсул, таблеток, пилюль и т.п.), обычно в качестве активного ингредиента они будут содержать соединение настоящего изобретения и один или несколько фармацевтически приемлемых носителей, таких как цитрат натрия или дикальций фосфат. Необязательно или альтернативно, такие твердые лекарственные формы также могут содержать (1) эксципиенты или экстендеры, такие как крахмалы, микрокристаллическая целлюлоза, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; (2) связующие вещества, такие как карбоксиметилцеллюлоза,альгинаты, желатин, поливинилпирролидон, сахароза и/или камедь; (3) увлажняющие вещества, такие как глицерин; (4) дезинтегрирующие агенты, такие как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и/или карбонат натрия; (5) вещества, замедляющие растворение, такие как парафин; (6) катализаторы абсорбции, такие как соединения четвертичного аммония; (7) смачивающие вещества, такие как цетиловый спирт и/или глицеролмоностеарат;(8) абсорбенты, такие как каолин и/или бентонитовая глина; (9) лубриканты, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и/или их смеси; (10) красители и (11) буферирующие вещества. Также в фармацевтических композициях настоящего изобретения могут присутствовать агенты высвобождения, смачивающие вещества, вещества для покрытия, подсластители, ароматизаторы и отдушки, консерванты и антиоксиданты. Примеры фармацевтически приемлемых антиоксидантов включают(1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфат натрия, сульфит натрия и т.п.; (2) маслорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ),лецитин, пропилгаллат, альфа-токоферол и т.п.; и (3) металл-хелатирующие вещества, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, винно-каменная кислота, метафосфорная кислота и т.п. Покрывающие вещества для таблеток, капсул, пилюль и т.п. включают вещества,используемые для энтеросолюбильных покрытий, такие как ацетатфталат целлюлозы (САР), поливинилацетатфталат (PVAP), фталат гидроксипропилметилцеллюлозы, сополимеры эфира метакриловой кислоты-метакриловой кислоты, тримеллитат ацетатцеллюлозы (CAT), карбоксиметил этилцеллюлозы(СМЕС), сукцинат гидроксипропилметилацетат целлюлозы (HPMCAS) и т.п. Если желательно, можно также создавать рецептуру фармацевтических композиций настоящего изобретения, обеспечивающую медленное или регулируемое высвобождение активного ингредиента, с использованием, в качестве примера, гидроксипропилметилцеллюлозы в различных пропорциях или других полимерных матриц, липосом и/или микросфер. Дополнительно, фармацевтические композиции настоящего изобретения могут необязательно содержать рентгеноконтрастные вещества, и их рецептура может быть сделана таким образом, что они высвобождают только активный ингредиент или избирательно в определенной части желудочно-кишечного тракта необязательно путем отсроченного высвобождения. Примеры вставленных композиций, которые могут быть использованы, включают полимерные вещества и воски. Активный ингредиент также может находиться в микроинкапсулированной форме при необходимости с одним или несколькими описанными выше эксципиентами. Подходящие жидкие лекарственные формы для перорального введения включают, в качестве примера, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Такие жидкие лекарственные формы обычно содержат активный ингредиент и инертный разбави- 13013240 тель, такой как, например, вода или другие растворители, солюбилизирующие вещества и эмульгаторы,такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (например, хлопковое, арахисовое, кукурузное,оливковое, касторовое и кунжутное масло, масло пшеничных зародышей), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбита и их смеси. В дополнение к активному ингредиенту суспензии могут содержать суспендирующие вещества, такие как, например,этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакант, и их смеси. Альтернативно, фармацевтические композиции настоящего изобретения создают для ингаляционного введения. Подходящие фармацевтические композиции для введения путем ингаляции обычно получают в виде аэрозоля или порошка. Такие композиции, в общем, применяют с использованием общеизвестных устройств для доставки, таких как дозирующий ингалятор, порошковый ингалятор, распылитель или подобное устройство для доставки. Если фармацевтические композиции настоящего изобретения вводят путем ингаляции с использованием аэрозольного контейнера, обычно они будут содержать активный ингредиент и подходящий пропеллент, такой как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, углекислый газ или другой подходящий газ. Дополнительно, фармацевтическая композиция может быть в виде капсулы или картриджа (например, сделанного из желатина), содержащего соединение настоящего изобретения и порошок, подходящий для использования в порошковом ингаляторе. Подходящие порошковые основы включают, в качестве примера, лактозу или крахмал. Соединения настоящего изобретения можно также вводить чрескожно с использованием общеизвестных трансдермальных систем доставки и эксципиентов. Например, соединение настоящего изобретения можно смешивать с веществами, усиливающими проницаемость, такими как пропиленгликоль, монолаурат полиэтиленгликоля, азациклоалкан-2-оны и подобными, и включать в состав пластырей или в подобную систему доставки. Если желательно, в таких трансдермальных композициях можно использовать дополнительные эксципиенты, включающие желирующие вещества, эмульгаторы и буферирующие вещества. Следующие рецептуры показывают типичные фармацевтические композиции настоящего изобретения: Пример рецептуры А. Твердые желатиновые капсулы для перорального введения получают следующим образом: Пример методики: ингредиенты тщательно смешивают и затем помещают в твердую желатиновую капсулу (260 мг соединения на капсулу). Пример рецептуры В. Твердые желатиновые капсулы для перорального введения получают следующим образом: Пример методики: ингредиенты тщательно смешивают и затем пропускают через сито номер 45 США и помещают в твердую желатиновую капсулу (200 мг соединения на капсулу). Пример рецептуры С. Капсулы для перорального введения получают следующим образом: Пример методики: ингредиенты тщательно смешивают и затем помещают в твердую желатиновую капсулу (310 мг соединения на капсулу).- 14013240 Пример рецептуры D. Таблетки для перорального введения получают следующим образом: Пример методики: активные ингредиенты, крахмал и целлюлозу пропускают через сито номер 45 США и тщательно смешивают. Раствор поливинилпирролидона смешивают с полученными порошками и полученную смесь затем пропускают через сито номер 14 США. Полученные таким образом гранулы сушат при температуре 50-60 С и пропускают через сито номер 18 США. Затем к гранулам добавляют натрийкарбоксиметилкрахмал, стеарат магния и тальк (предварительно пропущенные через сито номер 60 США). После смешивания смесь прессуют на таблетирующей машине с получением таблетки массой 100 мг. Пример рецептуры Е. Таблетки для перорального введения получают следующим образом: Пример методики: ингредиенты тщательно смешивают и затем прессуют с образованием таблеток(440 мг композиции на таблетку). Пример рецептуры F. Таблетки с единственной насечкой для перорального введения получают следующим образом: Пример методики: ингредиенты тщательно смешивают и затем прессуют с образованием таблеток с одной насечкой (215 мг композиций на таблетку). Пример рецептуры G. Суспензию для перорального введения получают следующим образом: Пример методики: ингредиенты смешивают с образованием суспензии, содержащей 10 мг активного ингредиента на 10 мл суспензии.- 15013240 Пример рецептуры Н. Сухой порошок для ингаляционного введения получают следующим образом: Пример методики: активный ингредиент микронизируют и затем смешивают с лактозой. Эту смешанную массу затем загружают в желатиновый картридж для ингаляции. Содержимое картриджа вводят с использованием порошкового ингалятора. Пример рецептуры I. Сухой порошок для ингаляционного введения в дозирующем ингаляторе получают следующим образом: Пример методики: суспензию, содержащую 5% массы соединения настоящего изобретения и 0,1% лецитина, получают диспергированием 10 г активного соединения в виде микронизированных частиц со средним размером менее 10 мкм в растворе, образованном из 0,2 г лецитина, растворенного в 200 мл деминерализованной воды. Суспензию сушат распылением и полученный материал микронизируют до частиц, имеющих в среднем диаметр менее 1,5 мкм. Частицы помещают в картриджи со сжатым 1,1,1,2 тетрафторэтаном. Пример рецептуры J. Рецептуру для инъекций получают следующим образом: Пример методики: указанные выше ингредиенты смешивают и рН доводят до 40,5, используя 0,5 н.HCl или 0,5 н. NaOH. Пример рецептуры K. Капсулы для перорального введения получают следующим образом: Пример методики: ингредиенты тщательно смешивают и затем помещают в желатиновую капсулу(размер 1, белую, непрозрачную) (264 мг композиции на капсулу). Пример рецептуры L. Капсулы для перорального введения получают следующим образом: Пример методики: ингредиенты тщательно смешивают и затем помещают в желатиновую капсулу(размер 1, белую, непрозрачную) (148 мг композиции на капсулу). Следует понимать, что любые формы соединений настоящего изобретения (то есть свободное основание, фармацевтическая соль или сольват), которые являются подходящими для конкретного способа введения, можно использовать в описанных выше фармацевтических композициях. Соединения бензимидазолкарбоксамида настоящего изобретения представляют собой агонисты рецепторов 5-HT4 и поэтому предполагается, что они будут полезны для лечения клинических состояний,обусловленных рецепторами 5-HT4 или связанных с активностью рецепторов 5-HT4, то есть клинических состояний, которые улучшаются лечением агонистом рецепторов 5-HT4. Такие клинические состояния включают, но без ограничения, синдром раздраженного кишечника (СРК), хронический запор, функциональную диспепсию, задержку эвакуации содержимого желудка, гастроэзофагеальную рефлюксную болезнь (GERD), гастропарез, послеоперационную непроходимость кишечника, кишечную псевдообструкцию и медикаментозный замедленный кишечный транзит. Дополнительно, предполагается, что некоторые соединения агонистов рецепторов 5-HT4 можно применять при лечении нарушений центральной нервной системы, включающих когнитивные расстройства, нарушения поведения, нарушения настроения и нарушения регуляции вегетативных функций. В частности, соединения настоящего изобретения усиливают моторику желудочно-кишечного тракта (ЖКТ) и, таким образом, предполагается, что они будут полезны для лечения нарушений ЖК тракта,- 16013240 вызванного снижением моторики у млекопитающих, включая людей. Такие нарушения моторики ЖКТ включают, в качестве примера, хронический запор, синдром раздраженного кишечника с преобладанием запора (З-СРК), диабетический и идиопатический гастропарез и функциональную диспепсию. В этой связи в одном аспекте настоящее изобретение обеспечивает способ усиления моторики желудочно-кишечного тракта у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение настоящего изобретения. При использовании для лечения заболеваний со снижением моторики ЖК тракта или других состояний, обусловленных рецепторами 5-HT4, соединения настоящего изобретения обычно будут вводиться перорально в однократной суточной дозе или в виде многократного введения в день, вместе с тем можно применять другие формы введения. Количество вводимого активного вещества на одну дозу или общее количество, применяемое за сутки, обычно будет определять врач в свете соответствующих обстоятельств, включающих состояние, которое нужно лечить, выбранный путь введения, фактически применяемое соединение и его относительную активность, возраст, массу и индивидуальную реакцию пациента, тяжесть симптомов у пациента и т.п. Подходящие дозы для лечения заболеваний со сниженной моторикой ЖК тракта или других нарушений, обусловленных рецепторами 5-HT4, будут составлять диапазон приблизительно от 0,0007 до приблизительно 20 мг/кг/день активного вещества, включающего приблизительно от 0,0007 до приблизительно 1 мг/кг/день. Для среднего человека массой 70 кг это количество может составлять приблизительно от 0,05 до приблизительно 70 мг в день активного вещества. В одном аспекте настоящего изобретения соединения настоящего изобретения применяют для лечения хронического запора. Если соединения настоящего изобретение применяют для лечения хронического запора, их обычно будут вводить перорально в однократной суточной дозе или в виде многократного введения в день. Предпочтительная доза для лечения хронического запора будет составлять приблизительно от 0,05 до приблизительно 70 мг в день. В другом аспекте настоящего изобретения соединения настоящего изобретения применяют для лечения синдрома раздраженного кишечника. Если соединения настоящего изобретения применяют для лечения синдрома раздраженного кишечника с преобладанием запора, их обычно будут вводить перорально в однократной суточной дозе или в виде многократных доз в день. Предпочтительная доза для лечения синдрома раздраженного кишечника с преобладанием запора будет составлять диапазон приблизительно от 0,05 до приблизительно 70 мг в день. В другом аспекте настоящего изобретения соединения настоящего изобретения используют для лечения диабетического гастропареза. Если соединения настоящего изобретения применяют для лечения диабетического гастропареза, их обычно будут вводить перорально в однократной суточной дозе или в виде многократных доз в день. Предпочтительная доза для лечения диабетического гастропареза будет составлять диапазон приблизительно от 0,05 до приблизительно 70 мг в день. В еще одном аспекте настоящего изобретения соединения настоящего изобретения применяют для лечения функциональной диспепсии. Если соединения настоящего изобретения применяют для лечения функциональной диспепсии, их обычно будут вводить перорально в однократной суточной дозе или в виде многократных доз в день. Предпочтительная доза для лечения функциональной диспепсии будет составлять диапазон приблизительно от 0,05 до приблизительно 70 мг в день. Настоящее изобретение также обеспечивает способ лечения млекопитающего, имеющего заболевание или состояние, связанное с активностью рецепторов 5-HT4, включающий введение млекопитающему терапевтически эффективного количества соединения настоящего изобретения или фармацевтической композиции, содержащей соединение настоящего изобретения. Как описано выше, соединения настоящего изобретения представляют собой агонисты рецепторов 5-HT4. В этой связи настоящее изобретение дополнительно обеспечивает способ достижения у млекопитающего агонизма в отношении рецепторов 5-НТ 4, включающий введение млекопитающему соединения настоящего изобретения. Дополнительно, соединения настоящего изобретения также полезны в качестве инструментов исследования для изучения или исследования биологических систем или образцов, имеющих рецепторы 5-HT4, или для обнаружения новых агонистов рецепторов 5-HT4. Кроме того, такие соединения особенно полезны для изучения эффектов селективного агонизма рецепторов 5-HT4 в биологической системе или образце, поскольку соединения настоящего изобретения проявляют селективное связывание с рецепторами 5-HT4 по сравнению со связыванием с другими подтипами рецепторов 5-HT, в частности рецепторами с 5-HT3. В таких исследованиях, которые можно проводить как in vitro, так и invivo, можно использовать любую подходящую биологическую систему или образец, имеющий рецепторы 5-HT4. Примеры биологических систем или образцов, подходящих для таких исследований, включают, но не ограничены ими, клетки, клеточные экстракты, плазматические мембраны, образцы тканей,млекопитающих (таких как мыши, крысы, морские свинки, кролики, собаки, свиньи и т.д.) и т.п. В данном аспекте настоящего изобретения биологическая система или образец, содержащий рецептор 5-HT4, контактируют с соединением настоящего изобретения в количестве, оказывающем агонистический эффект в отношении рецепторов 5-HT4. Затем определяют агонистические эффекты рецепторов- 17013240 5-HT4, используя общепринятые методики и оборудование, такие как анализы радиолигандного связывания и функциональные анализы. Функциональные анализы включают лиганд-опосредованные изменения внутриклеточного циклического аденозинмонофосфата (цАМФ), лиганд-опосредованные изменения активности фермента аденилатциклазы (который синтезирует цАМФ), лиганд-опосредованные изменения во включении аналогов гуанозинтрифосфата (GTP)5, такие как [35S]GTPS (гуанозин 5'-O-(-тио)трифосфат) или GTP-Eu, в изолированные мембраны посредством катализируемого рецептором обмена аналогами GTP на аналоги GDP, лиганд-опосредованные изменения в свободных внутриклеточных ионах кальция (измеряемые, например, с помощью флуоресцентносвязанного отражающего планшет-ридераFLIPR от компании Molecular Devices, Inc.), и измерение активации митоген-активируемой протеинкиназы (МАРК). В любом из вышеперечисленных функциональных анализов или в анализах подобного характера соединение настоящего изобретения может являться агонистом или усиливать активацию рецепторов 5-HT4. Количество соединения настоящего изобретения, обладающее агонистическим эффектом в отношении рецепторов 5-HT4, обычно будет составлять диапазон приблизительно от 1 до приблизительно 500 нмоль. Дополнительно, соединения настоящего изобретения можно использовать в качестве инструментов исследования для обнаружения новых агонистов рецепторов 5-HT4. В этом варианте осуществления связывание рецепторов 5-HT4 или функциональные данные для тестируемого соединения или группы тестируемых соединений подвергают сравнению со связыванием рецепторов 5-HT4 или функциональными данными соединения настоящего изобретения, чтобы выявить среди тестируемых соединений соединения, которые обладают наиболее высоким связыванием или функциональной активностью, если таковые имеются. Данный аспект настоящего изобретения включает, как отдельные варианты осуществления, обе совокупности сравнительных данных (с использованием соответствующих анализов) и анализ данных испытаний для идентификации рассматриваемых тестируемых соединений. Наряду с другими свойствами было обнаружено, что соединения настоящего изобретения являются мощными агонистами рецепторов 5-HT4, и в анализе радиолигандного связывания проявляют значительную селективность для подтипа рецепторов 5-НТ 4 по сравнению с подтипом рецепторов 5-HT3. Дополнительно, соединения настоящего изобретения, которые были конкретно приведены, на модели крысы проявляли превосходные фармакокинетические свойства. Таким образом, предполагается, что такие соединения при пероральном введении будут обладать высокой биодоступностью. Дополнительно было обнаружено, что данные соединения не показывают недопустимого уровня ингибирования потока иона калия in vitro на модели фиксации напряжения с использованием изолированных цельных клеток сердечного калиевого канала, экспрессирующих hERG. Анализ фиксации напряжения является признанным способом доклинической оценки возможности фармацевтических средств изменять характеристики реполяризации миокарда, более конкретно, вызывать так называемую пролонгацию интервала QT, которую связывают с сердечной аритмией (Cavero et al. Opinion on Pharmacotherapy, 2000, 1, 947-73, Fermini et al.Nature Reviews Drug Discovery, 2003, 2, 439-447). Соответственно, предполагается, что фармацевтические композиции, содержащие соединения настоящего изобретения, будут обладать приемлемым кардиальным профилем. Указанные свойства, а также полезность соединений настоящего изобретения можно продемонстрировать, используя различные in vitro и in vivo анализы, известные специалистам в данной области. Примеры анализов описаны с дополнительными подробностями в следующих примерах. Примеры Следующие примеры синтеза и биологические примеры приводятся для иллюстрации настоящего изобретения, и в любом случае они не должны рассматриваться в качестве ограничения объема настоящего изобретения. В приведенных ниже примерах, если не обозначено иначе, следующие сокращения имеют следующие значения. Сокращения, не указанные ниже, имеют свои общепринятые значения. Вос=трет-бутоксикарбонил ДМСО=диметилсульфоксидRf=фактор удерживания Реагенты и растворители приобретали у коммерческих поставщиков (компании Aldrich, Fluka,Sigma и т.д.) и использовали без дополнительной очистки. Реакции осуществляли в атмосфере азота, если не указано иначе. Развитие реакционных смесей контролировали тонкослойной хроматографией(ТСХ), аналитической высокоэффективной жидкостной хроматографией (аналитическая ВЭЖХ) и массспектрометрией, подробное описание которых приведено ниже и отдельно в конкретных примерах реакций. Реакционные смеси обрабатывали, как описано конкретно в каждой реакции; обычно их очищали экстрагированием и другими методами очистки, такими как температурозависимая и растворительзависимая кристаллизация и осаждение. Дополнительно, реакционные смеси очищали обычным методом препаративной ВЭЖХ. Описание общей схемы приведено ниже. Определение характеристик продуктов реакции осуществляли обычно- 18013240 путем масс-спектрометрии и 1 Н-ЯМР-спектрометрии. Для измерения ЯМР образцы растворяли в дейтерированном растворителе (CD3OD, CDCl3 или ДМСО-d6) и в стандартных условиях наблюдения получали спектры 1 Н-ЯМР на оборудовании Varian Gemini 2000 (300 МГц). Масс-спектрометрическую идентификацию выполняли масс-спектрометрией с ионизацией электрораспылением (ESMS) на жидкостном хроматографе/масс-селективном детекторе (LC/MSD) Applied Biosystems (Foster City, CA) моделиa. Получение метилового эфира 2,3-диаминобензойной кислоты. К насыщенному азотом раствору метилового эфира 2-амино-3-нитробензойной кислоты (ChessGmbH, 50 г, 0,26 моль) в абсолютном этаноле (800 мл) добавляли гидроксид палладия (Degussa, 20% в массовом отношении (м/м) к углероду, 58,75% м/м к воде, 10 г). Суспензию дегазировали, затем энергично взбалтывали в атмосфере водорода (4 атм) при комнатной температуре в течение 48 ч. Катализатор отфильтровывали и фильтрат концентрировали в вакууме с получением метилового эфира 2,3-диаминобензойной кислоты в виде темно-оранжевого масла, которое затвердевало при стоянии (43 г, 0,26 моль,100%). (m/z): [М-ОСН 3]+, вычислено для C8H10N2O2: 135,05; найдено: 135,3. 1 Н ЯМР (300 МГц, ДМСО-d6):(м.д.) 3,74 (с, 3 Н), 4,80 (ушир.с, 1 Н), 6,20 (ушир.с, 1 Н), 6,38 (т, 1 Н),6,70 (д, 1 Н), 7,06 (д, 1 Н).b. Получение 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты. Суспензию метилового эфира 2,3-диаминобензойной кислоты (21,5 г, 0,3 моль) и изомасляной кислоты (36,2 мл, 0,39 моль) в водной хлористо-водородной кислоте (4 М, 210 мл) перемешивали при кипячении с обратным холодильником в течение 24 ч с получением гомогенного раствора. Раствор охлаждали до 10 С и рН повышали до 3,5, используя водный раствор гидроксида натрия (4 М, приблизительно 210 мл), одновременно поддерживая температуру ниже 30 С. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, охлаждали до 10 С и полученный осадок отфильтровывали. Твердый осадок на фильтре переносили в химический стакан и добавляли ацетонитрил (300 мл). Затем суспензию перемешивали при комнатной температуре в течение 1 ч и фильтровали с получением серого твердого вещества. Твердое вещество сушили в вакууме с получением указанного в заголовке промежуточного продукта (23 г, 0,11 моль, 87%). (m/z): [М+Н]+ вычислено для C11H12N2O2: 205,09; найдено: 205,3. 1 Н ЯМР (300 МГц, ДМСО-d6):(м.д.) 1,27 (д, 6 Н), 3,39 (м, 1 Н), 7,29 (т, 1 Н), 7,78 (м, 2 Н).N,N-диметилформамиде (100 мл) добавляли трет-бутиловый эфир 4-аминометилпиперидин-1 карбоновой кислоты (9,4 г, 44,1 ммоль) с последующим добавлением N,N-диизопропилэтиламина (16,9 мл, 97,0 ммоль). Раствор перемешивали в течение 15 мин при комнатной температуре перед добавлением гидроксибензотриазола (5,9 г, 44,1 ммоль), гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида (8,4 г, 44,1 ммоль) и дополнительно N,N-диметилформамида (50 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, разбавляли дихлорметаном (300 мл) и промывали последовательно 1 М водной метафосфорной кислотой, 1 М водным гидроксидом натрия и насыщенным раствором соли. Затем раствор сушили над сульфатом натрия и выпаривали в вакууме с получением коричневого масла, которое затвердевало после дополнения гексанов. Твердое вещество отфильтровывали с получением указанного в заголовке промежуточного продукта в виде бежевого твердого веществаd. Синтез (пиперидин-4-илметил)амида 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты. К раствору трет-бутилового эфира 4-[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1-карбоновой кислоты (10,8 г, 27,0 ммоль), растворенного в дихлорметане (50 мл), при 0 С медленно добавляли трифторуксусную кислоту (50 мл) порциями по 5 мл. Раствор оставляли нагреваться до комнатной температуры, перемешивали в течение дополнительных 20 мин, затем выпаривали в вакууме. Избыток трифторуксусной кислоты удаляли совместным выпариванием с толуолом. Затем остаток растворяли в минимальном объеме дихлорметана и медленно добавляли к диэтиловому эфиру (1 л) при 0 С. Полученную суспензию перемешивали в течение 2 ч при комнатной температуре, затем фильтровали с получением бис-трифторуксусной соли указанного в заголовке соединения в виде светло-коричневого твердого вещества (12,7 г, 24,0 ммоль, 89%). (m/z): [М+Н]+ вычислено для C17H24N4O: 301,21; найдено: 301,5. Время удерживания (аналитическая ВЭЖХ: 2-50% MeCN/H2O свыше 6 мин)=1,65 мин. 1 Н ЯМР (300 МГц, MeOD-d3):(м.д.) 1,59 (д, 6 Н), 1,60 (м, 1 Н), 2,03 (м, 2 Н), 2,04 (м, 1 Н), 3,00 (м,- 19013240 2 Н), 3,43 (м, 2 Н), 3,45 (м, 2 Н), 3,63 (септет, 1 Н), 7,63 (т, 1 Н), 7,90 (д, 1 Н), 7,96 (д, 1 Н), 9,04 (т, 1 Н). Получение 2. Синтез (1-пиперидин-4-илметилпиперидин-4-илметил)амида 2-изопропил-1 Н-бензоимидазол-4-карбоновой кислоты. Получение трет-бутилового эфира 4-(4-[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты. К суспензии бис-трифторацетата (пиперидин-4-илметил)амида 2-изопропил-1H-бензоимидазол-4 карбоновой кислоты (6,84 г, 12,95 ммоль) в дихлорметане (65 мл) при комнатной температуре в атмосфере азота добавляли последовательно N,N-диизопропилэтиламин (1,67 г, 2,25 мл), раствор 1-(третбутоксикарбонил)пиперидин-4-карбоксальдегида (3,16 г, 14,89 ммоль) в дихлорметане (5 мл) и триацетоксиборогидрид натрия (3,84 г, 18,13 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1,5 ч, затем подкисляли рН 1 до 1 М водной хлористо-водородной кислотой. Водный слой удаляли и экстрагировали органический слой 1 М водной хлористо-водородной кислотой до полного удаления продукта в органической фазе. Объединенные водные слои промывали охлажденным до 0 С дихлорметаном и повышали основность до рН 12 гранулами гидроксида натрия. Затем раствор экстрагировали дихлорметаном до полного удаления продукта из водной фазы и объединенные органические слои промывали насыщенным раствором соли, сушили над сульфатом натрия, фильтровали и концентрировали с получением желаемого продукта в виде коричневого масла (5,4 г, 10,8 ммоль, 84%), которое использовали без дополнительной очистки, (m/z): [M+H]+ вычислено для C28H43N5O3: 498,35; найдено: 498,5.b. Синтез (1-пиперидин-4-илметилпиперидин-4-илметил)амида 2-изопропил-1H-бензоимидазол-4 карбоновой кислоты. Продукт предыдущей стадии (5,4 г, 10,8 ммоль) растворяли в дихлорметане (40 мл) и охлаждали до 0 С. Добавляли трифторуксусную кислоту (30 мл) и перемешивали раствор при 0 С в течение дополнительных 0,5 ч. Затем смесь концентрировали и дважды совместно выпаривали в вакууме с дихлорметаном. Полученный остаток растворяли в дихлорметане (20 мл), охлаждали до 0 С и повышали основность с помощью водного гидроксида натрия (50 мл) в количестве 20% м/м. Раствор оставляли нагреваться до комнатной температуры в течение 10 мин, затем фильтровали. Твердое вещество промывали ацетонитрилом и сушили в вакууме с получением светло-серого порошка (3,09 г, 7,8 ммоль, 72%), который использовали без дополнительной очистки, (m/z): [M+H]+ вычислено для C23H35N5O: 398,29; найдено: 398,4. Получение 3. Синтез (1-пиперидин-4-илметилпиперидин-4-илметил) амида 2-трет-бутил-1-бензоимидазол-4-карбоновой кислоты. а. Получение метилового эфира 2-амино-3-(2,2-диметилпропиониламино)бензойной кислоты. К раствору метилового эфира 2,3-диаминобензойной кислоты (2,3 г, 13,8 ммоль) в пиридине (40 мл) при комнатной температуре добавляли 2,2-диметилпропионилхлорид (1,7 г, 14,0 ммоль). Раствор перемешивали в течение 16 ч, выпаривали и остаток распределяли между этилацетатом (100 мл) и 1 М водной хлористо-водородной кислотой (100 мл). Отделяли органическую фазу, промывали 1 М водной хлористоводородной кислотой (100 мл), сушили над сульфатом натрия и выпаривали с получением указанного в заголовке соединения в виде темного масла (2,7 г, 10,8 ммоль, 78%), которое использовали без дополнительной очистки, (m/z): [М+Н]+ вычислено для C13H18N2O3: 251,14; найдено: 250,8.b. Получение 2-трет-бутил-1H-бензоимидазол-4-карбоновой кислоты. Суспензию продукта предыдущей стадии (2,7 г, 10,8 ммоль) в водной 4 М хлористо-водородной кислоте (100 мл) перемешивали при кипячении с обратным холодильником в течение 24 ч с получением гомогенного раствора. Растворитель выпаривали с получением гидрохлоридной соли указанного в заголовке промежуточного продукта в виде красно-коричневого твердого вещества (2,5 г, 9,8 ммоль, 91%).c. Получение трет-бутилового эфира 4-[(2-трет-бутил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1-карбоновой кислоты. К раствору гидрохлорида 2-трет-бутил-1H-бензоимидазол-4-карбоновой кислоты (1,11 г,4,37 ммоль) в безводном N,N-диметилформамиде (5 мл) добавляли 1,1'-карбонилдиимидазол (0,77 г,4,75 ммоль). Раствор перемешивали при 50 С в течение 2 ч, затем добавляли трет-бутиловый эфир 4-аминометилпиперидин-1-карбоновой кислоты (0,94 г, 4,39 ммоль) с последующим добавлением 1,4-диазабицикло[2,2,2]октана (1,46 г, 13 ммоль). Раствор перемешивали при 50 С в течение 16 ч, оставляли для охлаждения и разбавляли водой (20 мл) и этилацетатом (60 мл). Водный слой удаляли, органический слой промывали водой (20 мл), сушили над сульфатом натрия и концентрировали в вакууме с получением указанного в заголовке промежуточного продукта (1,32 г, 3,18 ммоль, 73%), который использовали без дополнительной очистки, (m/z): [M+H]+ вычислено для C23H34N4O3: 415,27; найдено: 415,5.d. Получение (пиперидин-4-илметил)амида бутил 2-трет-1 Н-бензоимидазол-4-карбоновой кислоты. Трет-бутиловый эфир 4-[(2-трет-бутил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1- 20013240 карбоновой кислоты (13,5 г, 32,6 ммоль) растворяли в 4 N HCl в диоксане (200 мл) и перемешивали при комнатной температуре в течение 0,5 ч. Полученное твердое вещество отфильтровывали с получением бис-гидрохлоридной соли указанного в заголовке промежуточного продукта (11,3 г, 29,3 ммоль, 89%).e. Получение трет-бутилового эфира 4-(4-[(2-трет-бутил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты. К суспензии бис-HCl соли (пиперидин-4-илметил)амида 2-трет-бутил-1H-бензоимидазол-4-карбоновой кислоты (4,28 г, 11,06 ммоль) в дихлорметане (55 мл) при комнатной температуре последовательно добавляли N,N-диизопропилэтиламин (1,71 г, 2,31 мл), 1-(трет-бутоксикарбонил)пиперидин-4-карбоксальдегид (2,58 г, 12,17 ммоль) и триацетоксиборогидрид натрия (3,28 г, 15,48 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 ч, затем экстрагировали 1 М водной хлористо-водородной кислотой. В объединенных водных слоях повышали основность до рН 12 с помощью гранул гидроксида натрия, затем экстрагировали дихлорметаном. Объединенные органические слои сушили над сульфатом натрия, фильтровали и выпаривали. Полученный остаток сушили в глубоком вакууме с получением легкой коричневатой пены (4,9 г, 9,6 ммоль, 87%), которую использовали без дополнительной очистки, (m/z): [М+Н]+ вычислено для C29H45N5O3: 512,35, найдено: 512,4.f. Синтез (1-пиперидин-4-илметилпиперидин-4-илметил)амида 2-трет-бутил-1H-бензоимидазол-4 карбоновой кислоты. Неочищенный трет-бутиловый эфир 4-(4-[(2-трет-бутил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1-илметил)1-пиперидин-1-карбоновой кислоты, полученный на предыдущей стадии(5,1 г, 10 ммоль), обрабатывали смесью трифторуксусной кислоты (40 мл) и дихлорметана (40 мл) при комнатной температуре в течение 0,5 ч. Смесь выпаривали в вакууме, повторно растворяли в дихлорметане (25 мл) и повышали основность 1 М водным гидроксидом натрия (15 мл). Удаляли органический слой и водный слой повторно экстрагировали дихлорметаном. Объединенные органические фазы сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением желаемого продукта в виде коричневой пены (3,6 г, 8,8 ммоль, 88%). (m/z): [М+Н]+ вычислено для C24H37N5O: 412,31, найдено: 412,6. Получение 4. Синтез метилового эфира 4-(4-аминометилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты. а. Получение метилового эфира 4-[4-(трет-бутоксикарбониламинометил)пиперидин-1-илметил]пиперидин-1-карбоновой кислоты. К раствору 4-трет-бутоксикарбониламинометилпиперидина (3,62 г, 16,9 ммоль) в дихлорметане(100 мл) добавляли метиловый эфир 4-формилпиперидин-1-карбоновой кислоты (2,89 г, 16,9 ммоль) и уксусную кислоту (0,96 мл). Перед добавлением триацетоксиборогидрида натрия (5,4 г, 25,5 ммоль) смесь перемешивали при комнатной температуре в течение 10 мин. Конечную смесь перемешивали при комнатной температуре в течение 1 ч. Реакцию завершали добавлением насыщенного раствора бикарбоната натрия (50 мл). Смесь экстрагировали дихлорметаном (100 мл) и органический слой сушили надMgSO4. Выпаривание органического раствора приводило к получению бледно-желтого маслянистого остатка. Его очищали колоночной флэш-хроматографией на силикагеле (CH2Cl2 до 5% МеОН/CH2Cl2) и получали названный промежуточный продукт (4,4 г). (m/z): [М+Н]+ вычислено для C19H35N3O4: 370,27; найдено: 370,5.b. Синтез метилового эфира 4-(4-аминометилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты. К раствору метилового эфира 4-[4-(трет-бутоксикарбониламинометил)пиперидин-1-илметил]пиперидин-1-карбоновой кислоты (4,4 г, 10,8 ммоль) в дихлорметане (20 мл) добавляли трифторуксусную кислоту (20 мл). После перемешивания в течение 20 мин при комнатной температуре раствор концентрировали в вакууме, получая бис-трифторуксусную соль указанного в заголовке соединения в виде бледно-желтого масла, которое использовали без дополнительной обработки, (m/z): [М+Н] вычислено для C14H27N3O2: 270,22; найдено: 270,5. 1 Н-ЯМР (CD3OD):(м.д.) 4,0 (ушир.д, 2 Н), 3,6 (м, 5 Н), 2,9-2,7 (м, 6 Н), 2,1-1,9 (м, 2 Н), 1,7-1,5 (м,6 Н), 1,2-1,0 (м, 4 Н). Пример 1. Синтез метилового эфира 4-(4-[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты. К суспензии (1-пиперидин-4-илметилпиперидин-4-илметил)амида 2-изопропил-1H-бензоимидазол 4-карбоновой кислоты (2,9 г, 7,3 ммоль) в дихлорметане (50 мл) добавляли N,N-диизопропилэтиламин(1,05 мл, 7,3 ммоль). Полученный раствор охлаждали до 0 С и по каплям добавляли метилхлорформиат(576 мкл, 7,3 ммоль). Смесь перемешивали при 0 С в течение 1,5 ч, гасили уксусной кислотой (1 мл) и выпаривали в вакууме с получением бежевого твердого вещества (4,8 г), которое очищали препаративной ВЭЖХ с обращенной фазой [с градиентом 5-10-25% (5-10% в течение 10 мин; 10-25% в течение- 21013240 50 мин); скорость потока 15 мл/мин; обнаружение при 280 нм], с получением бис-трифторуксусной соли указанного в заголовке соединения в виде белого твердого вещества (3,5 г, 5,1 ммоль, 70%). (m/z):[M+H]+ вычислено для C25H37N5O3: 456,30; найдено: 456,3. Время удерживания (аналитическая ВЭЖХ: 2-50% MeCN/H2O в течение 6 мин)=3,06 мин. Пример 2. Синтез фенилового эфира 4-(4-[(2-изопропил-1H-бензоимидазол-4-карбонил)амино)метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты. К раствору (1-пиперидин-4-илметилпиперидин-4-илметил)амида 2-изопропил-1H-бензоимидазол-4 карбоновой кислоты (0,22 г, 0,55 ммоль) и N,N-диизопропилэтиламина (0,19 мл) в дихлорметане (5,0 мл) добавляли фенилхлорформиат (70 мкл). Смесь перемешивали при комнатной температуре в течение 10 мин, затем концентрировали в вакууме и очищали препаративной ВЭЖХ с обращенной фазой с получением бис-трифторуксусной соли указанного в заголовке соединения в виде белого твердого вещества(м, 2 Н), 1,92-2,06 (м, 4 Н), 2,82-2,97 (м, 6 Н), 3,32-3,38 (м, 2 Н), 3,43-3,50 (м, 1 Н), 3,52-3,69 (м, 2 Н),4,04-4,12 (м, 1 Н), 4,18-4,26 (м, 1 Н), 6,91-6,98 (м, 1 Н), 7,08-7,13 (м, 1 Н), 7,21-7,28 (м, 1 Н), 7,45-7,50 (м,1 Н), 7,73-7,77 (м, 1 Н), 7,81-7,87 (м, 1 Н), 9,02-9,32 (ушир.с, 1 Н). Пример 3. Синтез 1-[1-(2-хлорбензоил)пиперидин-4-илметил]пиперидин-4-илметиламида 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты. К суспензии (1-пиперидин-4-илметилпиперидин-4-илметил)амида 2-изопропил-1H-бензоимидазол 4-карбоновой кислоты (2,1 г, 5,29 ммоль) в тетрагидрофуране (26 мл) при комнатной температуре добавляли N,N-диизопропилэтиламин (2,05 г, 15,87 ммоль), дихлорметан (12 мл) и N,N-диметилформамид(5 мл). К полученной суспензии медленно добавляли о-хлорбензоилхлорид (1,02 г, 5,82 ммоль) и реакционную смесь перемешивали в течение 0,5 ч при комнатной температуре. Раствор концентрировали в вакууме, полученный остаток разбавляли уксусной кислотой (7,5 мл) и водой (0,5 мл) и продукт очищали препаративной ВЭЖХ с обращенной фазой. Очищенную соль распределяли между дихлорметаном и 1 М водным гидроксидом натрия, удаляли органический слой, повторно экстрагировали водный слой дихлорметаном и объединенные органические слои промывали насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме с получением указанного в заголовке соединения в виде белой пены (1,75 г, 3,26 ммоль, 62%). (m/z): [М+Н]+ вычислено для C30H38ClN5O2) 536,28; найдено: 536,3. 1H ЯМР (300 МГц, ДМСО-d6): 0,90 (ушир.м, 2 Н), 1,24 (д, 6 Н), 1,45 (ушир.м, 2 Н), 1,68 (ушир.м, 8 Н),1,96 (м, 1 Н), 2,72 (ушир.м, 5 Н), 3,08 (м, 2 Н), (3,20, м, 3 Н), 4,40 (ушир.м, 1 Н), 7,14 (т, 1 Н), 7,28 (м, 2 Н),7,39 (м, 1 Н), 7,49 (дд, 1 Н), 7,66 (дд, 1 Н). Примеры 4-6. Соединения примеров 4-6 получали, используя способы, аналогично примеру 3, за исключением замены о-хлорбензоилхлорида подходящим хлоридным реагентом. Пример 4. 1-[1-(2,4-Дифторбензоил)пиперидин-4-илметил]пиперидин-4-илметиламид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты; (m/z): [М+Н]+ вычислено для C30H37F2N5O2: 538,30; найдено: 538,2. Время удерживания (аналитическая ВЭЖХ: 2-60% MeCN/H2O в течение 4 мин)=2,12 мин. 1 Н ЯМР (300 МГц, ДМСО-d6): 0,92 (м, 2 Н), 1,30 (м, 2 Н), 1,38 (д, 6 Н), 1,53 (м, 2 Н), 1,60-1,90 (м, 6 Н),2,07 (д, 2 Н), 2,73-2,85 (ушир.м, 3 Н), 3,05 (т, 1 Н), 3,22 (септет, 1 Н), 3,38 (ушир.м, 3 Н), 4,44 (ушир.д, 1 Н),7,10-7,50 (м, 4 Н), 7,62 (д, 1 Н), 7,77 (д, 1 Н), 10,10 (ушир.с, 1 Н). Пример 5. 1-[1-(Фуран-2-карбонил)пиперидин-4-илметил]пиперидин-4-илметиламид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты; (m/z): [M+H]+ вычислено для C28H37N5O3: 492,30; найдено: 492,2. Время удерживания (аналитическая ВЭЖХ: 2-65% MeCN/Н 2 О в течение 4 мин)=1,68 мин. Пример 6. 1-[1-(Тиофен-2-карбонил)пиперидин-4-илметил]пиперидин-4-илметиламид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты; (m/z): [M+H]+ вычислено для C28H37N5O2S: 508,28; найдено: 508,2. Время удерживания (аналитическая ВЭЖХ: 2-65% MeCN/H2O в течение 4 мин)=1,94 мин. Пример 7. Синтез 1-[1-(2-фтор-5-трифторметилбензоилпиперидин-4-илметил]пиперидин-4 илметиламида 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты. К раствору 2-фтор-5-трифторметил бензойной кислоты (100 мг, 0,48 ммоль) в диметилформамиде(4 мл) при комнатной температуре добавляли гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'тетраметилурония (200 мг, 0,48 ммоль). Смесь перемешивали при комнатной температуре в течение 0,25 ч, затем добавляли (1-пиперидин-4-илметилпиперидин-4-илметил)амид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты (210 мг, 0,48 ммоль) и N,N-диизопропилэтиламин (0,184 мл, 0,96 ммоль) и продолжали перемешивание в течение дополнительных 0,5 ч. Раствор концентрировали в вакууме и неочищенный продукт очищали ВЭЖХ с обращенной фазой [градиент 5-10-25% (5-10% в течение 10 мин; 10-25% в течение 50 мин); скорость потока 15 мл/мин; обнаружение при 280 нм] с получением бис-трифторуксусной соли указанного в заголовке соединения в виде белого твердого вещества (70 мг,0,09 ммоль, 18%). (m/z): [M+H]+ вычислено для C31H37F4N5O2: 588,30; найдено: 588,2. Время удерживания (аналитическая ВЭЖХ: от 2 до 60% MeCN/H2O в течение 4 мин)=2,39 мин. Пример 8. Синтез 1-[1-(2-фторфенилкарбамоил)пиперидин-4-илметил]пиперидин-4-илметиламида 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты.- 22013240 В N,N-диметилформамиде (2,0 мл) при комнатной температуре растворяли (1-пиперидин-4 илметилпиперидин-4-илметил)амид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты (220 мг,0,55 ммоль). К полученному раствору добавляли N,N-диизопропилэтиламин (143,2 мг, 1,1 ммоль) с последующим добавлением о-фторфенилизоцианата (75,4 мг, 0,55 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи, концентрировали в вакууме и остаток очищали препаративной ВЭЖХ с обращенной фазой с получением бис-трифторуксусной соли указанного в заголовке соединения в виде белого твердого вещества (92,6 мг, 0,12 ммоль, 22%). (m/z): [М+Н]+ вычислено дляC30H39FN6O2: 535,32; найдено: 535,2. Время удерживания (аналитическая ВЭЖХ: 2-65% MeCN/H2O в течение 4 мин)=2,09 мин. Пример 9. Синтез [1-(1-метансульфонилпиперидин-4-илметил)пиперидин-4-илметил]амида 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты. В N,N-диметилформамиде (1,0 мл) при комнатной температуре растворяли (1-пиперидин-4 илметилпиперидин-4-илметил)амид 2-изопропил-1H-бензоимидазол-4-карбоновой кислоты (40 мг,0,1 ммоль). К полученному раствору добавляли N,N-диизопропилэтиламин (0,175 мл, 1 ммоль) с последующим добавлением метансульфонилхлорида (11,5 мг, 0,1 ммоль). Смесь перемешивали при комнатной температуре в течение 16 ч, затем концентрировали в вакууме и остаток очищали препаративной ВЭЖХ с обращенной фазой с получением бис-трифторуксусной соли указанного в заголовке соединения в виде белого твердого вещества (27,2 мг, 0,04 ммоль, 40%). (m/z): [M+H]+ вычислено для C24H37N5O3S: 476,27; найдено: 476,2. Время удерживания (аналитическая ВЭЖХ: 2-65% MeCN/H2O в течение 4 мин)=1,66 мин. Пример 10. Синтез метилового эфира 4-(4-[(2-трет-бутил-1H-бензоимидазол-4-карбонил]амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты. К неочищенному продукту из получения 3 (2,4 г, 5,8 ммоль) в дихлорметане (29 мл) при комнатной температуре добавляли N,N-диизопропилэтиламин (1,5 г, 11,6 ммоль). Полученную смесь охлаждали до температуры 0 С и по каплям добавляли метилхлорформиат (660 мг, 6,98 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение дополнительных 10 мин. Раствор концентрировали, повторно растворяли в 50%-й уксусной кислоте в воде, фильтровали и очищали препаративной ВЭЖХ с обращенной фазой. Полученное твердое вещество растворяли в дихлорметане и промывали 1 М водным гидроксидом натрия. Водный слой экстрагировали дважды дихлорметаном,объединенные органические слои промывали насыщенным раствором соли, сушили над сульфатом натрия, фильтровали и выпаривали с получением указанного в заголовке соединения в виде белой пены(1,3 г, 2,8 ммоль, 48%). (m/z): [M+H]+ вычислено для C26H39N5O3: 470,32, найдено: 470,6. 1 Н ЯМР (300 МГц, MeOD-d3):(м.д.) 1,02-1,16 (м, 2 Н), 1,49 (с, 9 Н), 1,47-1,7 (м, 4 Н), 1,82-2,03 (м,4 Н), 2,74-2,94 (м, 6 Н), 3,31-3,40 (м, 2 Н), 3,54-3,58 (м, 2 Н), 3,56 (с, 3 Н), 3,98-4,03 (м, 2 Н), 7,41-7,46 (м, 1 Н),7,71-7,74 (м, 1 Н), 7,79-7,82 (м, 1 Н), 9,35 (ушир.с, 1 Н). Примеры 11-13. Используя способы, аналогично примеру 10, за исключением замены метилхлорформиата подходящим хлоридным реагентом, получали соединения примеров 11-13. Пример 11. 1-[1-(2-Фторбензоил)пиперидин-4-илметил]пиперидин-4-илметиламид 2-трет-бутил 1H-бензоимидазол-4-карбоновой кислоты; (m/z): [М+Н]+ вычислено для C31H40FN5O2 534,33; найдено 534,4. Время удерживания (аналитическая ВЭЖХ: 2-65% MeCN/H2O в течение 4 мин)=2,09 мин. Пример 12. (1-[1-(3-Метилбензоил)пиперидин-4-илметил]пиперидин-4-илметиламид 2-трет-бутил 1H-бензоимидазол-4-карбоновой кислоты; (m/z): [M+H]+ вычислено для C32H43N5O2: 530,35; найдено: 530,42. Время удерживания (аналитическая ВЭЖХ: 2-65% MeCN/H2O в течение 4 мин)=2,22. Пример 13. 1-[1-(4-Фторбензоил)пиперидин-4-илметил]пиперидин-4-илметиламид 2-трет-бутил 1H-бензоимидазол-4-карбоновой кислоты; (m/z): [M+H]+ вычислено для C31H40FN5O2: 534,33; найдено: 534,4. Время удерживания (аналитическая ВЭЖХ: 2-65% MeCN/H2O в течение 4 мин)=2,17. Пример 14. Синтез метилового эфира 4-[4-([2-(1-гидрокси-1-метилэтил)-1 Н-бензоимидазол-4 карбонил]аминометил)пиперидин-1-илметил]пиперидин-1-карбоновой кислоты. а. Получение 2-(1-гидрокси-1-метилэтил)-1H-бензоимидазол-4-карбоновой кислоты. К раствору метилового эфира 2,3-диаминобензойной кислоты (1,5 г, 9,2 ммоль) в 4 М HCl (50 мл) добавляли 2-гидроксиизомасляную кислоту (2,87 г, 27,6 ммоль). Смесь перемешивали при температуре приблизительно 90 С в течение 24 ч. Нейтрализовали водным раствором гидроксида натрия до рН приблизительно 3 и концентрировали досуха. Остаток суспендировали в метаноле и фильтровали через фильтровальную бумагу. Фильтрат концентрировали и остаток промывали эфиром. Оставшийся твердый остаток растворяли в этилацетате и промывали насыщенным раствором соли. После сушки над MgSO4 органический раствор концентрировали в вакууме с выходом указанного в заголовке промежуточного продукта в виде бледно-желтого масла (приблизительно 800 мг). Неочищенный продукт использовали на следующей стадии без дополнительной очистки, (m/z): [М+Н]+ вычислено для C11H12N2O3: 221,09; найдено: 221,1. 1b. Синтез метилового эфира 4-[4-([2-(1-гидрокси-1-метилэтил)-1H-бензоимидазол-4-карбонил]ами- 23013240 нометил)пиперидин-1-илметил]пиперидин-1-карбоновой кислоты. К раствору продукта бензоимидазолкарбоновой кислоты предыдущей стадии (0,7 г, 3,18 ммоль),аминометилпиперидинового продукта из получения 4 в виде бис-ТФУК соли (1,2 г, 3,13 ммоль) и гидроксибензотриазола (HOBt) (0,43 г, 3,18 ммоль) в диметилформамиде (50 мл) добавляли триэтиламин(1,3 мл, 9,3 ммоль) и гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) (0,67 г,3,5 ммоль). Смесь перемешивали при комнатной температуре в течение 12 ч и концентрировали досуха в вакууме. Остаток распределяли между дихлорметаном (150 мл) и насыщенным бикарбонатом натрия. Органический слой сушили над MgSO4 и выпаривали досуха, получая на выходе бледно-желтый маслянистый остаток. Его очищали препаративной ВЭЖХ с получением бис-трифторуксусной соли указанного в заголовке соединения, (m/z): [M+H]+ вычислено для C25H37N5O4: 472,29; найдено: 472,5. Время удерживания (аналитическая ВЭЖХ: 5-30% MeCN/H2O в течение 6 мин)=3,67 мин. 1 Н-ЯМР (CD3OD):(м.д.) 7,9-7,8 (м, 2 Н), 7,6-7,5 (т, 1 Н), 4,0 (ушир.д, 2 Н), 3,6 (с, 5 Н), 2,9-2,75(ушир.м, 5 Н), 2,05-1,9 (ушир.д, 3 Н), 1,68 (м, 6 Н), 1,15 (м, 4 Н). Пример 15. Синтез метилового эфира 4-[4-([2-(2-гидрокси-1-метилэтил)-1H-бензоимидазол-4 карбонил]аминометил)пиперидин-1-илметил]пиперидин-1-карбоновой кислоты. а. Получение 2-(2-гидрокси-1-метилэтил)-1H-бензоимидазол-4-карбоновой кислоты. К раствору метилового эфира 2,3-диаминобензойной кислоты (2,1 г, 14,1 ммоль) в 4 М HCl (90 мл) добавляли метиловый эфир 2-метил-3-гидроксипропионовой кислоты (5 г, 42,3 ммоль). Смесь перемешивали при температуре приблизительно 90 С в течение 24 ч. Нейтрализовали водным раствором гидроксида натрия до рН приблизительно 3 и концентрировали досуха. Остаток суспендировали в метаноле и фильтровали через фильтровальную бумагу. После концентрирования фильтрата оставшийся твердый остаток растворяли в воде и промывали этилацетатом. Водный раствор концентрировали в вакууме с получением указанного в заголовке промежуточного продукта в виде бледно-желтого масла (приблизительно 800 мг). Неочищенный продукт использовали на следующей стадии без дополнительной очистки,(m/z): [М+Н]+ вычислено для C11H12N2O3: 221,09; найдено: 221,3. 1b. Синтез метилового эфира 4-[4-([2-(2-гидрокси-1-метилэтил)-1H-бензоимидазол-4-карбонил]аминометил)пиперидин-1-илметил]пиперидин-1-карбоновой кислоты. К раствору продукта бензоимидазолкарбоновой кислоты предыдущей стадии (0,45 г, 1,75 ммоль),аминометилпиперидинового продукта из получения 4 в виде бис-трифторуксусной соли (0,8 г,1,6 ммоль) и HOBt (0,237 г, 1,75 ммоль) в диметилформамиде (50 мл) добавляли триэтиламин (0,98 мл,7,0 ммоль) и EDC (0,353 г, 1,84 ммоль). Смесь перемешивали при комнатной температуре в течение 12 ч и концентрировали досуха при пониженном давлении. Остаток распределяли между дихлорметаном(150 мл) и насыщенным бикарбонатом натрия. Органический слой сушили над MgSO4 и выпаривали досуха, получая на выходе бледно-желтый маслянистый остаток. Его очищали препаративной ВЭЖХ, получая бис-трифторуксусную соль указанного в заголовке соединения (0,2 г). (m/z): [M+H]+ вычислено для C25H37N5O4: 472,29; найдено: 472,5. Время удерживания (аналитическая ВЭЖХ: 10-40% MeCN/H2O в течение 6 мин)=3,31 мин. 1(м, 4 Н). Дополнительные соединения настоящего изобретения Используя методики примеров 1-13 и их варианты, получали соединения, указанные в табл.I-IX, и характеризовали параметрами масс-спектрометрии. Незаполненные ячейки в приведенных ниже таблицах означают водород. Таблица I Пример 214. Альтернативный синтез метилового эфира 4-(4-[(2-изопропил-1 Н-бензоимидазол-4 карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты.a. Получение метилового эфира 4-гидроксиэтилпиперидин-1-карбоновой кислоты. 4-Гидроксиметилпиперидин (1,0 г, 8,6 ммоль) растворяли в воде (15 мл) и охлаждали до 0 С. К полученному раствору добавляли по каплям раствор калия карбоната (4,8 г, 34,7 ммоль) в воде (10 мл) с последующим добавлением метилхлорформиата (2,68 мл, 34,7 ммоль). Смесь энергично перемешивали и оставляли нагреваться до комнатной температуры в течение 2 ч. После перемешивания в течение ночи(16 ч) реакционную смесь подкисляли 6 М водной хлористо-водородной кислотой и экстрагировали дихлорметаном (360 мл). Экстракты объединяли, сушили над сульфатом натрия и фильтровали. Фильтрат выпаривали с получением указанного в заголовке промежуточного продукта (1,4 г, 8,1 ммоль, 93%) в виде бесцветного масла. (m/z): C8H15NO3, вычислено: 173,11; найдено: 156,2 [М-Н 2 О+Н]+. 1 Н ЯМР (300 МГц, ДМСО-d6):(м.д.) 0,98 (м, 2 Н), 1,52 (м, 1 Н), 1,63 (ушир.д, 2 Н), 2,72 (ушир.м,2 Н), 3,23 (д, 2 Н), 3,56 (с, 3 Н), 3,95 (ушир.д, 2 Н), 4,48 (ушир.с, 1 Н).b. Получение метилового эфира 4-формилпиперидин-1-карбоновой кислоты. К раствору оксалилхлорида (4,1 мл, 8,2 ммоль) в дихлорметане (4 мл) при температуре -78 С добавляли по каплям раствор диметилсульфоксида (1,2 мл, 16,4 ммоль) в дихлорметане (4 мл). После перемешивания в течение 5 мин добавляли раствор метилового эфира 4-гидроксиметилпиперидин-1 карбоновой кислоты (1,3 г, 7,5 ммоль) в дихлорметане (5 мл). Полученный раствор перемешивали в течение дополнительных 5 мин, затем добавляли триэтиламин (5,2 мл, 37,3 ммоль) и смесь оставляли нагреваться до -10 С. После перемешивания в течение 1 ч добавляли дихлорметан (100 мл) и органический- 29013240 слой промывали 1 М водной метафосфорной кислотой, 1 М водным гидроксидом натрия и насыщенным раствором соли. Раствор сушили над сульфатом натрия, затем выпаривали с получением указанного в заголовке промежуточного продукта в виде масла пшеничного цвета (1,0 г, 5,8 ммоль, 78%). 1 Н ЯМР (300 МГц, ДМСО-d6):(м.д.) 1,36 (м, 2 Н), 1,83 (м, 2 Н), 2,48 (ушир.м, 1 Н), 2,93 (ушир.т,2 Н), 3,56 (с, 3 Н), 3,80 (ушир.д, 2 Н), 9,56 (с, 1 Н). с. Синтез метилового эфира 4-(4-[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты.(0,72 мл, 4,0 ммоль). Когда суспензия становилась прозрачным раствором, добавляли уксусную кислоту(0,13 мл, 2,0 ммоль) с последующим добавлением раствора метилового эфира 4-формилпиперидин-1 карбоновой кислоты (0,54 г, 3,1 ммоль) в дихлорметане (20 мл). После перемешивания в течение 5 мин при комнатной температуре добавляли триацетоксиборогидрид натрия (0,628 г, 3,1 ммоль) и реакционную смесь перемешивали дополнительно в течение 1 ч. Затем водный слой делали щелочным 1 М водным гидроксидом натрия (35 мл) и экстрагировали дихлорметаном (220 мл). Объединенные органические слои промывали насыщенным раствором соли, сушили над сульфатом натрия и выпаривали с получением неочищенного продукта в виде коричневого твердого вещества (1,41 г). Неочищенный продукт очищали препаративной ВЭЖХ (с обращенной фазой) [градиент 5-10-25%: 5% MeCN/вода (0,1% ТФУ) к 10% MeCN, линейно в течение 10 мин; 10% MeCN к 25% MeCN, линейно в течение 50 мин; скорость потока=15 мл/мин; обнаружение при 280 нм] с получением указанного в заголовке соединения в виде бис-трифторуксусной соли, которую затем лиофилизировали. Смесь 1 М гидроксида натрия и дихлорметана (1:100 мл) добавляли к лиофилизированной бис-трифторуксусной соли. Органический слой сушили над сульфатом натрия, фильтровали, выпаривали и полученное твердое вещество лиофилизировали с получением указанного в заголовке соединения в виде белого твердого вещества (0,93 г, 2 ммоль, выход 98%, чистота 97,5%). (m/z): [M+H]+ вычислено для C25H37N5O3: 456,30; найдено: 456,3. Время удерживания (аналитическая ВЭЖХ: 2-50% MeCN/Н 2 О в течение 6 мин)=3,06 мин. 1 Н ЯМР (300 МГц, ДМСО-d6):(м.д.) 0,92 (м, 2 Н), 1,30 (м, 2 Н), 1,38 (д, 6 Н), 1,53 (м, 1 Н), 1,60-1,90(ушир.д, 2 Н), 7,23 (т, 1 Н), 7,62 (д, 2 Н), 7,77 (д, 1 Н), 10,10 (уш.с, 1 Н). Пример 215. Синтез кристаллического метилового эфира 4-(4-[(2-изопропил-1H-бензоимидазол-4 карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты (форма I). Метиловый эфир 4-(4-[(2-изопропил-1H-бензоимидазол-4-карбонил)амино]метилпиперидин-1 илметил)пиперидин-1-карбоновой кислоты в аморфной твердой форме, приготовленный согласно методике примера 214 (300 мг), растворяли в ацетонитриле (15 мл), смешивали до полного растворения и подвергали воздействию окружающей среды, что приводило к частичному испарению. Было отмечено образование ядер кристаллизации за период времени 2 ч. Химическую композицию кристаллов подтверждали 1 Н ЯМР, жидкостной хроматографией/масс-спектрометрией (ЖХ/МС) и рентгеноструктурным анализом. Кристаллическую природу твердого продукта подтверждали порошковой рентгеновской дифракцией, дифференциальной сканирующей калориметрией и рентгеноструктурным анализом. Пример 216. Синтез кристаллического метилового эфира 4-(4-[(2-изопропил-1H-бензоимидазол-4 карбонил)амино]метилпиперидин-1-илметил)пиперидин-1-карбоновой кислоты (форма I). а. Получение метилового эфира 4-гидроксиметилпиперидин-1-карбоновой кислоты. Колбу загружали 4-гидроксиметилпиперидином (47,6 г, 1,0 экв.) и водой (300 мл). Полученную смесь охлаждали до температуры 0-10 С. Карбонат калия (85,7 г, 1,5 экв.) растворяли в воде (150 мл) и добавляли метилхлорформиат (38,4 мл, 1,1 экв.), поддерживая температуру ниже 10 С. После завершения добавления реакционную смесь нагревали до температуры 20-30 С в течение 1 ч. После завершения реакции к реакционной смеси добавляли дихлорметан (500 мл). Органический слой собирали и промывали 1 М раствором метафосфорной кислоты (200 мл), насыщенным раствором бикарбоната натрия(200 мл) и насыщенным раствором хлорида натрия (200 мл). Органический слой сушили над сульфатом натрия (50 г, 1 м/м экв.) и затем перегоняли в вакууме с получением указанного в заголовке промежуточного продукта (67,0 г, выход 90%).b. Получение метилового эфира 4-формилпиперидин-1-карбоновой кислоты. Метиловый эфир 4-гидроксиметилпиперидин-1-карбоновой кислоты (34,7 г, 1,0 экв.) растворяли в дихлорметане и охлаждали до температуры 0-10 С. Добавляли раствор бикарбоната натрия (2,35 г,0,14 экв.) и бромида натрия (2,40 г, 0,10 экв.) в воде (100 мл) в течение 15 мин, поддерживая температуру 0-10 С. Свободный 2,2,6,6-тетраметил-1-пиперидинилоксирадикал (TEMPO) (0,32 г, 0,01 экв.) добавляли к смеси с последующим добавлением 10-13% мас./об. раствора гипохлорита натрия (135 мл, 1,1 экв.) в течение 1 ч при энергичном перемешивании, поддерживая температуру 0-10 С. После завершения реакции слои разделяли, органический слой промывали водой (150 мл) и сушили над сульфатом натрия (30 г,1 м/м экв.). Растворитель удаляли перегонкой с получением указанного в заголовке промежуточного про- 30
МПК / Метки
МПК: C07D 409/14, C07D 401/14, C07D 405/14, A61K 31/4545, A61P 1/00
Метки: соединения, агонистов, 5-нт4, рецепторов, качестве, бензимидазолкарбоксамида
Код ссылки
<a href="https://eas.patents.su/30-13240-soedineniya-benzimidazolkarboksamida-v-kachestve-agonistov-receptorov-5-nt4.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения бензимидазолкарбоксамида в качестве агонистов рецепторов 5-нт4</a>
Предыдущий патент: Новые соединения для лечения воспалительных заболеваний
Следующий патент: Способ и сырьевая смесь для приготовления неавтоклавного ячеистого бетона и способ возведения сооружений из неавтоклавного ячеистого бетона
Случайный патент: Способ ультразвукового контроля испытуемого объекта