Замещенные 2-карбониламино-6-пиперидинаминопиридины и замещенные 1-карбониламино-3-пиперидинаминобензолы как агонисты 5-ht1f
Номер патента: 11274
Опубликовано: 27.02.2009
Авторы: Чжан Дэи, Ин Бай-Пин, Худзиак Кевин Джон, Бланко-Пилладо Мария-Хесус, Виктор Франтц, Бенеш Дана Рае, Коэн Майкл Филип, Матес Брайан Майкл, Филла Сандра Энн, Сюй Яо-Чан, Кольман Дэниел Тимоти, Захерл Деанна Пиатт
Формула / Реферат
1. Соединение формулы
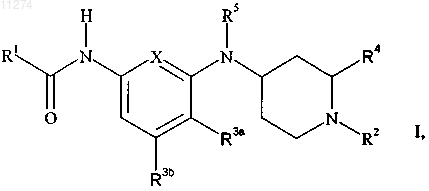
или его фармацевтически приемлемая соль присоединения кислоты,
где X обозначает -C(R3c)= или -N=;
R1 обозначает C2-C6алкил, замещенный C2-C6алкил, C3-C7циклоалкил, замещенный C3-C7циклоалкил, фенил, замещенный фенил, гетероцикл или замещенный гетероцикл, где "гетероцикл" обозначает насыщенное или ненасыщенное 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, причем указанное кольцо необязательно сконденсировано с бензольным; и где "замещенный фенил" и "замещенный гетероцикл" должны обозначать, что циклический фрагмент, в любом из этих случаев:
i) замещен галогеновыми заместителями в количестве от одного до трех; или
ii) замещен одним-двумя заместителями, независимо выбранными из группы, состоящей из галогена, C1-C4алкила, C1-C4алкоксигруппы, C1-C4алкилтиогруппы, цианогруппы и нитрогруппы, где каждый алкильный, алкоксильный и алкилтиозаместитель может быть далее независимо замещен C1-C2алкоксигруппой или от одной до пяти галогеновых групп, независимо выбранных из фтора и хлора; или
iii) замещен одним заместителем, выбранным из группы, состоящей из фенилоксигруппы, бензилоксигруппы, фенилтиогруппы, бензилтиогруппы и пиримидинилоксигруппы, где фенилокси-, бензилокси-, фенилтио-, бензилтио- или пиримидинилоксифрагмент может быть далее замещен одним-двумя заместителями, выбранными из группы, состоящей из галогена, C1-C2алкила и C1-C2алкоксигруппы, где каждая алкильная и алкоксигруппа может быть далее замещена 1-3 группами фтора; или
iv) замещен одним заместителем, выбранным из группы, состоящей из C1-C4ацила и C1-C4алкоксикарбонила, и далее необязательно замещен одним заместителем, выбранным из группы, состоящей из галогена, C1-C4алкила, C1-C4алкоксигруппы и C1-C4алкилтиогруппы, где каждая алкильная, алкокси- и алкилтиогруппа может быть далее замещена 1-3 группами фтора;
где замещенные алкил и циклоалкил обозначают группы, замещенные один или несколько раз независимо заместителем, выбранным из группы, состоящей из галогена, гидроксила и C1-C3алкоксигруппы;
R2 обозначает водород, н-C1-C3алкил, C3-C6циклоалкилC1-C3алкил или группу формулы
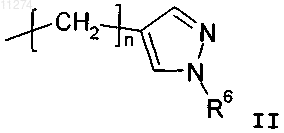
при условии, что, когда R1 обозначает C2-C6алкил или замещенный C2-C6алкил, R2 обозначает водород или метил;
R3a, R3b и, если X обозначает -C(R3c)=, R3c, каждый независимо, обозначают водород, фтор или метил при условии, что не более чем один из R3a, R3b и R3c может отличаться от водорода;
R4 обозначает водород или C1-C3алкил;
R5 обозначает водород, C1-C3алкил или C3-C6циклоалкилкарбонил при условии, что, когда R3a не является водородом, R5 обозначает водород;
R6 обозначает водород или C1-C6алкил и
n обозначает целое число от 1 до 6 включительно.
2. Соединение по п.1, в котором R4 обозначает водород.
3. Соединение по п.1 или 2, в котором R3a, R3b и, если X обозначает -C(R3c)=, R3c, каждый независимо, обозначают водород или фтор при условии, что не более чем один из R3a, R3b и R3c может отличаться от водорода.
4. Соединение по любому из пп.1-3, в котором R5 обозначает водород или метил.
5. Соединение по любому из пп.1-4, в котором R2 обозначает водород или метил.
6. Соединение по любому из пп.1-5, в котором R1 обозначает фенил, замещенный фенил, гетероцикл или замещенный гетероцикл, где "гетероцикл" обозначает насыщенное или ненасыщенное 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, причем указанное кольцо необязательно сконденсировано с бензольным; и где "замещенный фенил" и "замещенный гетероцикл" должны обозначать, что циклический фрагмент в любом из этих случаев:
i) замещен галогеновыми заместителями в количестве от одного до трех; или
ii) замещен одним-двумя заместителями, независимо выбранными из группы, состоящей из галогена, C1-C4алкила, C1-C4алкоксигруппы, C1-C4алкилтиогруппы, цианогруппы и нитрогруппы, где каждый алкильный, алкоксильный и алкилтиозаместитель может быть далее независимо замещен C1-C2алкоксигруппой или от одной до пяти галогеновых групп, независимо выбранных из фтора и хлора; или
iii) замещен одним заместителем, выбранным из группы, состоящей из фенилоксигруппы, бензилоксигруппы, фенилтиогруппы, бензилтиогруппы и пиримидинилоксигруппы, где фенилокси-, бензилокси-, фенилтио-, бензилтио- или пиримидинилоксифрагмент может быть далее замещен одним-двумя заместителями, выбранными из группы, состоящей из галогена, C1-C2алкила и C1-C2алкоксигруппы, где каждая алкильная и алкоксигруппа может быть далее замещена 1-3 группами фтора; или
iv) замещен одним заместителем, выбранным из группы, состоящей из C1-C4ацила и C1-C4алкоксикарбонила, и далее необязательно замещен одним заместителем, выбранным из группы, состоящей из галогена, C1-C4алкила, C1-C4алкоксигруппы и C1-C4алкилтиогруппы, где каждая алкильная, алкокси- и алкилтиогруппа может быть далее замещена 1-3 группами фтора.
7. Соединение по п.6, в котором R1 обозначает фенил, замещенный фенил, гетероцикл или замещенный гетероцикл, где гетероцикл выбирают из группы, состоящей из пиридинила, тиофена и фуранила; и где замещенный фенил обозначает кольцевой фрагмент, являющийся:
i) замещенным одним-тремя галогеновыми заместителями; или
ii) замещенным одним-двумя заместителями, независимо выбранными из группы, состоящей из галогена, метила, метоксигруппы, трифторметила, трифторметоксигруппы и цианогруппы;
где замещенный гетероцикл обозначает кольцевой фрагмент, монозамещенный галогеном.
8. Фармацевтическая композиция для лечения расстройства, ассоциированного с дисфункцией 5-HT1F рецепторов у млекопитающего, включающая терапевтически эффективное количество соединения по любому из пп.1-7 и фармацевтический носитель, разбавитель или эксципиент.
9. Способ активации 5-HT1F рецепторов у млекопитающего, который включает введение млекопитающему, нуждающемуся в такой активации, эффективного количества соединения формулы
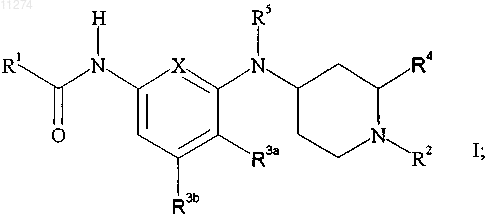
или его фармацевтически приемлемой соли присоединения кислоты,
где X обозначает -C(R3c)= или -N=;
R1 обозначает C2-C6алкил, замещенный C2-C6алкил, C3-C7циклоалкил, замещенный C3-C7циклоалкил, фенил, замещенный фенил, гетероцикл или замещенный гетероцикл, где "гетероцикл" обозначает насыщенное или ненасыщенное 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, причем указанное кольцо необязательно сконденсировано с бензольным; и где "замещенный фенил" и "замещенный гетероцикл" должны обозначать, что циклический фрагмент в любом из этих случаев:
i) замещен галогеновыми заместителями в количестве ют одного до трех; или
ii) замещен одним-двумя заместителями, независимо выбранными из группы, состоящей из галогена, C1-C4алкила, C1-C4алкоксигруппы, C1-C4алкилтиогруппы, цианогруппы и нитрогруппы, где каждый алкильный, алкоксильный и алкилтиозаместитель может быть далее независимо замещен C1-C2алкоксигруппой или от одной до пяти галогеновых групп, независимо выбранных из фтора и хлора; или
iii) замещен одним заместителем, выбранным из группы, состоящей из фенилоксигруппы, бензилоксигруппы, фенилтиогруппы, бензилтиогруппы и пиримидинилоксигруппы, где фенилокси-, бензилокси-, фенилтио-, бензилтио- или пиримидинилоксифрагмент может быть далее замещен одним-двумя заместителями, выбранными из группы, состоящей из галогена, C1-C2алкила и C1-C2алкоксигруппы, где каждая алкильная и алкоксигруппа может быть далее замещена 1-3 группами фтора; или
iv) замещен одним заместителем, выбранным из группы, состоящей из C1-C4ацила и C1-C4алкоксикарбонила, и далее необязательно замещен одним заместителем, выбранным из группы, состоящей из галогена, C1-C4алкила, C1-C4алкоксигруппы и C1-C4алкилтиогруппы, где каждая алкильная, алкокси- и алкилтиогруппа может быть далее замещена 1-3 группами фтора;
где замещенные алкил и циклоалкил обозначают группы, замещенные один или несколько раз независимо заместителем, выбранным из группы, состоящей из галогена, гидроксила и C1-C3алкоксигруппы;
R2 обозначает водород, н-C1-C3алкил, C3-C6циклоалкилC1-C3алкил или группу формулы
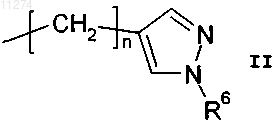
при условии, что, когда R1 обозначает C2-C6алкил или замещенный C2-C6алкил, R2 обозначает водород или метил;
R3a, R3b и, если X обозначает -C(R3c)=, R3c, каждый независимо, обозначают водород, фтор или метил при условии, что не более чем один из R3a, R3b и R3c может отличаться от водорода;
R4 обозначает водород или C1-C3алкил;
R5 обозначает водород, C1-C3алкил или C3-C6циклоалкилкарбонил при условии, что, когда R3a не является водородом, R5 обозначает водород;
R6 обозначает водород или C1-C6алкил и
n обозначает целое число от 1 до 6 включительно.
10. Способ по п.9, в котором млекопитающее является человеком.
11. Способ ингибирования экстравазации нейронных протеинов у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком ингибировании, эффективного количества соединения формулы
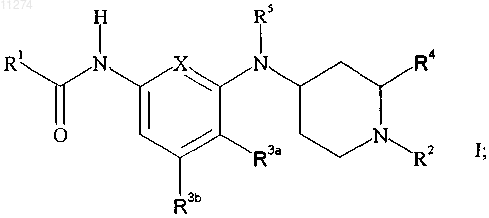
или его фармацевтически приемлемой соли присоединения кислоты,
где X обозначает -C(R3c)= или -N=;
R1 обозначает C2-C6алкил, замещенный C2-C6алкил, C3-C7циклоалкил, замещенный C3-C7циклоалкил, фенил, замещенный фенил, гетероцикл или замещенный гетероцикл, где "гетероцикл" обозначает насыщенное или ненасыщенное 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, причем указанное кольцо необязательно сконденсировано с бензольным; и где "замещенный фенил" и "замещенный гетероцикл" должны обозначать, что циклический фрагмент в любом из этих случаев:
i) замещен галогеновыми заместителями в количестве от одного до трех; или
ii) замещен одним-двумя заместителями, независимо выбранными из группы, состоящей из галогена, C1-C4алкила, C1-C4алкоксигруппы, C1-C4алкилтиогруппы, цианогруппы и нитрогруппы, где каждый алкильный, алкоксильный и алкилтиозаместитель может быть далее независимо замещен C1-C2алкоксигруппой или от одной до пяти галогеновых групп, независимо выбранных из фтора и хлора; или
iii) замещен одним заместителем, выбранным из группы, состоящей из фенилоксигруппы, бензилоксигруппы, фенилтиогруппы, бензилтиогруппы и пиримидинилоксигруппы, где фенилокси-, бензилокси-, фенилтио-, бензилтио- или пиримидинилоксифрагмент может быть далее замещен одним-двумя заместителями, выбранными из группы, состоящей из галогена, C1-C2алкила и C1-C2алкоксигруппы, где каждая алкильная и алкоксигруппа может быть далее замещена 1-3 группами фтора; или
iv) замещен одним заместителем, выбранным из группы, состоящей из C1-C4ацила и C1-C4алкоксикарбонила, и далее необязательно замещен одним заместителем, выбранным из группы, состоящей из галогена, C1-C4алкила, C1-C4алкоксигруппы и C1-C4алкилтиогруппы, где каждая алкильная, алкокси- и алкилтиогруппа может быть далее замещена 1-3 группами фтора;
где замещенные алкил и циклоалкил обозначают группы, замещенные один или несколько раз независимо заместителем, выбранным из группы, состоящей из галогена, гидроксила и C1-C3алкоксигруппы;
R2 обозначает водород, н-C1-C3алкил, C3-C6циклоалкилC1-C3алкил или группу формулы
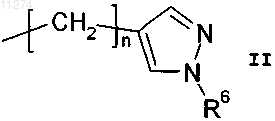
при условии, что, когда R1 обозначает C2-C6алкил или замещенный C2-C6алкил, R2 обозначает водород или метил;
R3a, R3b и, если X обозначает -C(R3c)=, R3c, каждый независимо, обозначают водород, фтор или метил при условии, что не более чем один из R3a, R3b и R3c может отличаться от водорода;
R4 обозначает водород или C1-C3алкил;
R5 обозначает водород, C1-C3алкил или C3-C6циклоалкилкарбонил при условии, что, когда R3a не является водородом, R5 обозначает водород;
R6 обозначает водород или C1-C6алкил и
n обозначает целое число от 1 до 6 включительно.
12. Способ по п.11, в котором млекопитающее является человеком.
13. Способ лечения или профилактики мигрени у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении или профилактике, эффективного количества соединения формулы
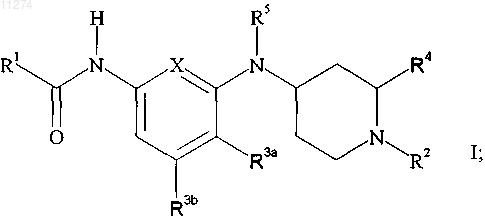
или его фармацевтически приемлемой соли присоединения кислоты,
где X обозначает -C(R3c)= или -N=;
R1 обозначает C2-C6алкил, замещенный C2-C6алкил, C3-C7циклоалкил, замещенный C3-C7циклоалкил, фенил, замещенный фенил, гетероцикл или замещенный гетероцикл, где "гетероцикл" обозначает насыщенное или ненасыщенное 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, причем указанное кольцо необязательно сконденсировано с бензольным; и где "замещенный фенил" и "замещенный гетероцикл" должны обозначать, что циклический фрагмент в любом из этих случаев:
i) замещен галогеновыми заместителями в количестве от одного до трех; или
ii) замещен одним-двумя заместителями, независимо выбранными из группы, состоящей из галогена, C1-C4алкила, C1-C4алкоксигруппы, C1-C4алкилтиогруппы, цианогруппы и нитрогруппы, где каждый алкильный, алкоксильный и алкилтиозаместитхыь может быть далее независимо замещен C1-C2алкоксигруппой или от одной до пяти галогеновых групп, независимо выбранных из фтора и хлора; или
iii) замещен одним заместителем, выбранным из группы, состоящей из фенилоксигруппы, бензилоксигруппы, фенилтиогруппы, бензилтиогруппы и пиримидинилоксигруппы, где фенилокси-, бензилокси-, фенилтио-, бензилтио- или пиримидинилоксифрагмент может быть далее замещен одним-двумя заместителями, выбранными из группы, состоящей из галогена, C1-C2алкила и C1-C2алкоксигруппы, где каждая алкильная и алкоксигруппа может быть далее замещена 1-3 группами фтора; или
iv) замещен одним заместителем, выбранным из группы, состоящей из C1-C4ацила и C1-C4алкоксикарбонила, и далее необязательно замещен одним заместителем, выбранным из группы, состоящей из галогена, C1-C4алкила, C1-C4алкоксигруппы и C1-C4алкилтиогруппы, где каждая алкильная, алкокси- и алкилтиогруппа может быть далее замещена 1-3 группами фтора;
где замещенные алкил и циклоалкил обозначают группы, замещенные один или несколько раз независимо заместителем, выбранным из группы, состоящей из галогена, гидроксила и C1-C3алкоксигруппы;
R2 обозначает водород, н-C1-C3алкил, C3-C6циклоалкилC1-C3алкил или группу формулы
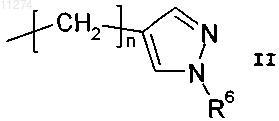
при условии, что, когда R1 обозначает C2-C6алкил или замещенный C2-C6алкил, R2 обозначает водород или метил;
R3a, R3b и, если X обозначает -C(R3c)=, R3c, каждый независимо, обозначают водород, фтор или метил при условии, что не более чем один из R3a, R3b и R3c может отличаться от водорода;
R4 обозначает водород или C1-C3алкил;
R5 обозначает водород, C1-C3алкил или C3-C6циклоалкилкарбонил при условии, что, когда R3a не является водородом, R5 обозначает водород;
R6 обозначает водород или C1-C6алкил и
n обозначает целое число от 1 до 6 включительно.
14. Способ по п.13, в котором млекопитающее является человеком.
15. Применение соединения по любому из пп.1-7 в качестве фармацевтического средства.
16. Применение соединения по любому из пп.1-7 для активации 5-HT1F рецепторов у млекопитающего.
17. Применение соединения по любому из пп.1-7 для ингибирования экстравазации нейронных протеинов у млекопитающего.
18. Применение соединения по любому из пп.1-7 для лечения или профилактики мигрени у млекопитающего.
19. Применение соединения по любому из пп.16-18, в котором млекопитающее является человеком.
20. Применение соединения по любому из пп.1-7 в производстве лекарственного препарата для активации 5-HT1f рецепторов у млекопитающего.
21. Применение соединения по любому из пп.1-7 в производстве лекарственного препарата для ингибирования экстравазации нейронных протеинов у млекопитающего.
22. Применение соединения по любому из пп.1-7 в производстве лекарственного препарата для лечения или профилактики мигрени у млекопитающего.
23. Применение соединения по любому из пп.1-7 в производстве лекарственного препарата для лечения расстройства, ассоциированного с дисфункцией 5-HT1F рецепторов у млекопитающего.
24. Применение по п.23, в котором 5-HT1F рецептор-ассоциированное расстройство является экстравазацией нейронных протеинов.
25. Применение по п.23, в котором 5-HT1F рецептор-ассоциированное расстройство является мигренью.
26. Применение по любому из пп.20-25, в котором млекопитающее является человеком.
27. Фармацевтическая композиция, адаптированная для лечения или профилактики мигрени, включающая соединение по любому из пп.1-7 в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами, носителями или разбавителями.
Текст
011274 Известный уровень техники До последнего времени среди теорий, касающихся патофизиологии мигрени, доминировала еще с 1938 г. работа Graham and Wolff (Arch. Neurol. Psychiatry, 39:737-63, 1938), в которой было предположено, что причиной мигреневой головной боли была вазодилатиция внечерепных сосудов. Эта точка зрения подтверждается тем фактом, что алкалоиды спорыньи и суматриптан, гидрофильный 5-HT1 агонист, не проникающий через гематоэнцефалический барьер, индуцируют сокращение гладких мышц головных сосудов и являются эффективными средствами лечения мигрени (Humphrey, et al., Ann. NY Acad. Sci.,600:587-600, 1990). Недавняя работа Moskowitz показала, однако, что возникновение мигреневых головных болей является независимым от изменений диаметра сосудов (Cephalalgia, 12:5-7, 1992).Moskowitz предположил, что неизвестные до настоящего времени триггеры боли стимулируют ганглии тройничного нерва, которые иннервируют сосудистую сеть внутри головных тканей, вызывая высвобождение вазоактивных нейропептидов из аксонов сосудистой сети. Эти высвобожденные нейропептиды потом активируют ряд событий, следствием которых является боль. Это нейрогенное воспаление блокируется суматриптаном и алкалоидами спорыньи по механизмам, включающим 5-HT рецепторы, которые считаются тесно связанными с субтипом 5-HT1D, расположенным на сосудистых волокнах тройничного нерва (Neurology, 43 (suppl. 3): S16-S20, 1993). Суматриптан фактически имеет высокое сродство к 5-HT1B и 5-HT1D рецепторам, Ki=10,3 и 5,1 нМ соответственно, что может быть признаком вазоконстрикторной активности. Суматриптан и подобные соединения, ранее предложенные для лечения мигрени, стремились выбирать на основании этой вазоконстрикторной активности в соответствии с предположениями известных моделей мигрени. Серотонин (5-HT) проявляет разные виды физиологичной активности, медиируемые по меньшей мере семью классами рецепторов, наиболее гетерогенным из которых является, по-видимому, 5-HT1. Ген человека, экспрессирующий один из этих субтипов 5-HT1 рецепторов, называемый 5-HT1F, был выделенKao и сотрудниками (Proc. Natl. Acad. Sci. USA, 90:408-412, 1993). Этот 5-HT1F рецептор обладает фармакологическим профилем, отличающимся от любого описаного до настоящего времени серотонинергического рецептора. Было обнаружено, что суматриптан, кроме вышеупомянутого сильного сродства к 5-HT1B и 5-HT1D рецепторам, обладает также сродством к субтипу 5-HT1F рецептора с величиной Ki примерно 23 нМ. Это позволяет предположить возможную роль рецептора 5-HT1F в мигрени. Позднее были получены разные агонисты рецепторов 5-HT1F, которые проявляют относительную селективность по отношению к субклассу рецепторов 5-HT1F, и было показано, что такая селективность,как правило, снижает показатели вазоконстрикторной активности других соединений, предложенных в качестве потенциальных агентов для лечения мигрени и ассоциированных расстройств. К этим агонистам рецепторов 5-HT1F относятся соединения, раскрытые в следующих источниках: патенты US5708187 и 5814653, которые описывают семейство 6-замещенных 3-амино(алкил)тетрагидрокарбазолов и 7-замещенных 4-амино(алкил)циклогепта[7,6-b]индолов;US5521196, US 5721252, US 5521197 и WO 96/29075, которые описывают разные семейства 5-замещенных пиперидин-3-илиндолов и 5-замещенных 1,2,3,6-тетрагидропиридин-3-илиндолов;WO 97/13512, который описывает семейство 5-замещенных 3-аминоэтилиндолов;WO 98/46570, который описывает семейство 5-замещенных индолов, пирроло[3,2-b]пиридинов,бензофуранов и бензотиофенов, замещенных в 3-положении октагидроиндолизинилом, октагидро-2Hхинолизинилом, декагидропиридо[1,2-а]азепинилом, 1,2,3,5,8,8 а-гексагидроиндолизинилом, 1,3,4,6,9,9 агексагидро-2H-хинолизинилом или 1,4,6,7,8,9,10,10 а-октагидропиридо[1,2-a]азепинилом;WO 98/20875 и WO 99/25348, которые описывают два семейства 5-замещенных пиперидин-3 илазаиндолов и 5-замещенных 1,2,3,6-тетрагидропиридин-3-илазаиндолов;WO 00/00487, который описывает семейство 5-замещенных (пиперидин-3-ил или 1,2,3,6 тетрагидропиридин-3-ил)индолов, азаиндолов, бензофуранов и бензотиофенов;WO 98/08502, который описывает семейство 8-замещенных 1,2,3,4-тетрагидро-2-дибензофуранаминов и 9-замещенных 2-аминоциклогепта[b]бензофуранов;WO 98/55115, который описывает семейство 3-амино-1,2,3,4-тетрагидро-9H-карбазол-6 карбоксамидов и 4-амино-10H-циклогепта[7,6-b]индол-7-карбоксамидов;WO 98/15545, который описывает избранное семейство 3,5-дизамещенных индолов и бензофуранов;WO 00/00490, который описывает семейство 5-аллилзамещенных (пиперидин-3-ил или 1,2,3,6 тетрагидропиридин-3-ил)индолов, азаиндолов, бензофуранов и бензотиофенов;WO 00/47559, который описывает семейство 4-(3-замещенный бензоил)пиперидинов;WO 00/50426, который описывает семейство 3,5-дизамещенных азабензофуранов; иWO 00/34266, который описывает семейство 3-гетероарил-5-(2-(арил или гетероарил)-2-оксоэтил)индолов. Продолжающиеся исследования неожиданно выявили новый класс неизвестных селективных агонистов 5-HT1F, обладающих отличными химическими свойствами и способностью к связыванию с рецептором, ингибирующим экстравазацию пептидов, в то же время не проявляющих значительной вазоконстрикторной активности и потому являющихся пригодными для лечения мигрени и других расстройств, ассоциированных с 5-HT1F рецепторами.-1 011274 Сущность изобретения Настоящее изобретение касается замещенных 2-карбониламино-6-пиперидинаминопиридиновых и замещенных 1-карбониламино-3-пиперидинаминобензольных соединений общей формулы или их фармацевтически приемлемых солей присоединения кислоты,где X обозначает -C(R3c)= или -N=;C3-C7 циклоалкил, фенил, замещенный фенил, гетероцикл или замещенный гетероцикл, где "гетероцикл" обозначает насыщенное или ненасыщенное 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов,выбранных из азота, кислорода и серы, причем указанное кольцо необязательно сконденсировано с бензольным; и где "замещенный фенил" и "замещенный гетероцикл" должны обозначать, что циклический фрагмент в любом из этих случаев:i) замещен галогеновыми заместителями в количестве от одного до трех; илиii) замещен одним-двумя заместителями, независимо выбранными из группы, состоящей из галогена, C1-C4 алкила, C1-C4 алкоксигруппы, C1-C4 алкилтиогруппы, цианогруппы и нитрогруппы, где каждый алкильный, алкоксильный и алкилтиозаместитель может быть далее независимо замещенC1-C2 алкоксигруппой или от одной до пяти галогеновых групп, независимо выбранных из фтора и хлора; илиiii) замещен одним заместителем, выбранным из группы, состоящей из фенилоксигруппы, бензилоксигруппы, фенилтиогруппы, бензилтиогруппы и пиримидинилоксигруппы, где фенилокси-, бензилокси-, фенилтио-, бензилтио- или пиримидинилоксифрагмент может быть далее замещен одним-двумя заместителями, выбранными из группы, состоящей из галогена, C1-C2 алкила и C1-C2 алкоксигруппы, где каждая алкильная и алкоксигруппа может быть далее замещена 1-3 группами фтора; илиC1-C4 алкоксикарбонила, и далее необязательно замещен одним заместителем, выбранным из группы,состоящей из галогена, C1-C4 алкила, C1-C4 алкоксигруппы и C1-C4 алкилтиогруппы, где каждая алкильная,алкокси и алкилтиогруппа может быть далее замещена 1-3 группами фтора; где замещенные алкил и циклоалкил обозначают группы, замещенные один или несколько раз независимо заместителем, выбранным из группы, состоящей из галогена, гидроксила и C1-C3 алкоксигруппы;R2 обозначает водород, H-C1-C3 алкил, C3-C6 циклоалкилC1-C3 алкил или группу формулы при условии, что, когда R1 обозначает C2-C6 алкил или замещенный C2-C6 алкил, R2 обозначает водород или метил;R3a, R3b и, если X обозначает -C(R3c)=, R3c, каждый независимо, обозначают водород, фтор или метил при условии, что не более чем один из R3a, R3b и R3c может отличаться от водорода;R4 обозначает водород или C1-C3 алкил;R6 обозначает водород или C1-C6 алкил иn обозначает целое число от 1 до 6 включительно. Настоящее изобретение также касается фармацевтических композиций для лечения расстройства,ассоциированного с дисфункцией 5-HT1F рецепторов у млекопитающего, которые включают соединение формулы I или его фармацевтически приемлемую соль присоединения кислоты и фармацевтически приемлемый носитель, разбавитель или эксципиент. Дополнительно, настоящее изобретение касается способа активации 5-HT1F рецепторов у млекопитающих, особенно людей, который включает введение млекопитающему, нуждающемуся в такой активации, эффективного количества соединения формулы I или его фармацевтически приемлемой соли присоединения кислоты. Кроме того, настоящее изобретение касается способа ингибирования экстравазации нейронных протеинов у млекопитающих, особенно людей, который включает введение млекопитающему, нуждающемуся в таком ингибировании, эффективного количества соединения формулы I или его фармацевтически приемлемой соли присоединения кислоты.-2 011274 Дополнительно, настоящее изобретение касается способа лечения или профилактики мигрени у млекопитающих, особенно людей, который включает введение млекопитающему, нуждающемуся в таком лечении или профилактике, эффективного количества соединения формулы I или его фармацевтически приемлемой соли присоединения кислоты. Другой аспект настоящего изобретения касается применения соединения формулы I в качестве фармацевтического средства, в частности, для активации 5-HT1F рецепторов, для ингибирования экстравазации нейронных протеинов и/или для лечения или профилактики мигрени у млекопитающих, особенно людей. Дополнительно, настоящее изобретение касается применения одного или нескольких соединений формулы I в производстве лекарственного препарата для активации 5-HT1F рецепторов, для ингибирования экстравазации нейронных протеинов и/или для лечения расстройства, ассоциированного с дисфункцией 5-HT1F рецепторов у млекопитающего, в частности для лечения или профилактики мигрени у млекопитающих, в частности у людей. Далее, настоящее изобретение предлагает фармацевтическую композицию, адаптированную для лечения или профилактики мигрени, включающую соединение формулы I в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами, носителями или разбавителями. Подробное описание изобретения Приведенное далее подробное описание предназначено, для того чтобы помочь специалистам в данной области в практическом осуществлении настоящего изобретения. Даже с учетом этого приведенное описание не должно рассматриваться как ненадлежащим образом ограничивающее настоящее изобретение вследствие того, что модификации и изменения в описанных здесь вариантах воплощения могут быть сделаны рядовыми специалистами в данной области без выхода за пределы сущности и объема данной изобретательской идеи. Такие модификации и изменения считаются входящими в объем изобретения. Одним вариантом воплощения настоящего изобретения является способ усиления активации 5-HT1F рецепторов, при этом одновременно избегается вазоконстрикторная активность, с целью лечения различных расстройств, которые были ассоциированы со снижением нейротрансмиссии серотонина у млекопитающих. К таким расстройствам относятся мигрень, общая боль, тригеминальная невралгия, зубная боль или дисфункционально-болевой синдром височно-нижнечелюстного сустава, тревожное состояние,расстройство генерализованной тревоги, паническое расстройство, депрессия, расстройства сна, синдром хронической усталости, предменструальный синдром или синдром поздней фазы лютеинизации, посттравматический синдром, потеря памяти, деменция, включая деменцию старения, социальные фобии,аутизм, расстройство дефицита внимания с гиперактивностью, расстройства с разрушительным поведением, расстройства импульсивных побуждений, расстройство с пограничным состоянием личности, обсессивно-компульсивное расстройство, преждевременная эякуляция, эректильная дисфункция, булимия,нервная анорексия, алкоголизм, табакокурение, немота и трихотиломания. Соединения по настоящему изобретению пригодны также для профилактического лечения мигрени. Любой из этих способов использует соединение формулы I. В предпочтительных вариантах воплощения млекопитающим, которое должно получать лечение путем введения соединений формулы I, является человек. Расстройства, которые можно лечить агонистами серотонина, являются известными по признанным и принятым классификациям; их классификацию можно найти в разных источниках. Например, в настоящее время диагностическим средством для идентификации многих из описанных здесь расстройств является 4-е изд. Диагностического и статистического справочника по умственным расстройствам (Diagnostic and Statistical Manual of Mental Disorders (DSM-IV), 1994, American Psychiatric Association, Washington, D.C.). Кроме того, классификацию многих из описанных расстройств дает Международная классификация болезней, 10-я ред. International Classification of Diseases, Tenth Revision (ICD-10). Квалифицированному специалисту понятно, что существуют альтернативные номенклатуры, нозологии и системы классификации описанных здесь расстройств, включая описанные в DSM-IV и ICD-10, и что терминология и системы классификации развиваются с прогрессом медицинской науки. Использование соединения формулы I для активации 5-HT1F рецепторов, для ингибирования экстравазации нейронного пептида, вообще или в частности, вследствие стимуляции ганглия тройничного нерва и/или для лечения любого из описанных выше расстройств является вариантами воплощения настоящего изобретения. В одном предпочтительном варианте воплощения изобретение предлагает способ лечения мигрени у млекопитающего, например человека, который включает в себя введение млекопитающему, нуждающемуся в таком лечении, фармацевтически эффективного количества соединения формулы I. В другом предпочтительном варианте воплощения изобретение предлагает способ профилактики мигрени у млекопитающего, например человека, который включает в себя введение млекопитающему,нуждающемуся в таком лечении, фармацевтически эффективного количества соединения формулы I. Аналогично, использование соединения формулы I или комбинации нескольких соединений формулы I в производстве лекарственного препарата для активации 5-HT1F рецепторов с целью ингибирования экстравазации нейронного пептида, вообще или в частности, посредством стимуляции ганглия трой-3 011274 ничного нерва и/или для лечения любого из описанных выше расстройств также является вариантом воплощения настоящего изобретения. Общие химические термины, используемые в описании, имеют свои обычные значения. Например, термин "алкил" касается разветвленной или неразветвленной насыщенной углеводородной группы. Термин "н-алкил" касается неразветвленной алкильной группы. В целях иллюстрации, но без ограничения, термин "C1-C2 алкил" относится к метилу и этилу. Термин "H-C1-C3 алкил" относится к метилу, этилу и н-пропилу. Термин "C1-C3 алкил" относится к метилу, этилу, н-пропилу и изопропилу. Термин "C1-C4 алкил" относится к метилу, этилу, н-пропилу, изопропилу, н-бутилу, изобутилу,втор-бутилу и трет-бутилу. Термин "C1-C6 алкил" относится ко всем разветвленным и неразветвленным алкильным группам,содержащим от одного до шести атомов углерода. Термин "C2-C6 алкил" относится ко всем разветвленным и неразветвленным алкильным группам,содержащим от двух до шести атомов углерода. Термин "C3-C6 циклоалкил" относится к циклопропилу, циклобутилу, циклопентилу и циклогексилу. Термин "C3-C7 циклоалкил" также включает циклогептил. Циклоалкилалкил касается циклоалкильного фрагмента, присоединенного через н-алкильную цепь,например, но без ограничения, "C3-C6 циклоалкилC1-C3 алкил" относится к C3-C6 циклоалкильному фрагменту, присоединенному через н-алкильную цепь с 1-3 атомами углерода. Каждая алкильная, циклоалкильная и циклоалкилалкильная группа может быть необязательно замещенной, как определено здесь. Среди соединений, в которых R1 обозначает циклоалкил, соединения, в которых X обозначает -N=, являются предпочтительными по сравнению с соединениями, в которых X обозначает -C(R3C)=. Термины "алкокси", "фенилокси", "бензилокси" и "пиримидинилокси" относятся к алкильной, фенильной, бензильной или пиримидинильной группе соответственно, каждая из которых необязательно замещена, как определено здесь, присоединенной через атом кислорода. Термины "алкилтио", "фенилтио" и "бензилтио" относятся к алкильной, фенильной или бензильной группе соответственно, каждая из которых необязательно замещена, как определено здесь, присоединенной через атом серы. Термин "C1-C4 ацил" касается формильной группы или C1-C3 алкильной группы, присоединенной через карбонильный фрагмент. Термин "C1-C4 алкоксикарбонил" касается C1-C4 алкоксигруппы, присоединенной через карбонильный фрагмент. Термин C3-C6 циклоалкилкарбонил касается C3-C6 циклоалкильной группы, присоединенной через карбонильный фрагмент. Термин "галоген" относится к фтору, хлору, брому или йоду. Предпочтительными группами галогенов являются фтор, хлор и бром. Еще более предпочтительными галогеновыми группами являются фтор и хлор. Термин "гетероцикл" обозначает насыщенное или ненасыщенное 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, причем указанное кольцо необязательно сконденсировано с бензольным. Примеры гетероциклов, в целях настоящего изобретения, включают фуранил, тиофенил, пирролил,пирролидинил, пиридинил, н-метилпирролил, оксазолил, изоксазолил, пиразолил, имидазолил, триазолил, оксадиазолил, тиадиазолил, тиазолил, тиазолидинил, нацетилтиазолидинил, пиримидинил, пиразинил, пиридазинил и т.п. Примеры бензоконденсированных гетероциклов, в целях настоящего изобретения, включают изохинолинил, бензоксазолил, бензодиоксолил, бензотиазолил, хинолинил, бензофуранил, бензотиофенил,индолил и т.п., которые все могут быть необязательно замещенными, что также включает необязательное замещение на бензольном кольце, если гетероцикл является бензоконденсированным. В одном варианте воплощения предпочтительные гетероциклы включают фуранил, тиофенил, пирролил, пиридинил, н-метилпирролил, пиримидинил, пиразинил, индолил, бензофуранил, бензотиофенил,бензодиоксолил и тиазолидинил, которые все могут быть необязательно замещенными. В еще одном варианте воплощения предпочтительные гетероциклы включают пиридинил, тиофенил и фуранил, которые все могут быть необязательно замещенными. Замещенные алкил, циклоалкил, циклоалкилалкил, алкоксигруппа или алкилтиогруппа обозначают алкильную, циклоалкильную, циклоалкилалкильную, алкоксильную или алкилтиогруппу соответственно, замещенные один или несколько раз независимо заместителем, выбранным из группы, состоящей из галогена, гидроксила и C1-C3 алкоксигруппы. Замещения на циклоалкилалкильных фрагментах могут находиться в кольцевой части или в алкильной цепи или в обеих частях. Предпочтительные замещения включают замещение 1-5 галогенами, каждый из которых выбирают независимо, или замещение 1-3 галогенами и, независимо, 1-2 группами, выбранными из гидроксила и C1-C3 алкоксигруппы, или замещение, независимо, 1-3 группами, выбранными из гидроксила и C1-C3 алкоксигруппы, при условии, что к-4 011274 одному атому углерода может быть присоединено не более одного гидроксильного и/или алкоксильного заместителя. Термины "замещенный фенил" и "замещенный гетероцикл" должны обозначать, что циклический фрагмент в любом из этих случаев замещен одним или несколькими галогеновыми заместителями, предпочтительно от одного до пяти, еще предпочтительнее от одного до трех, каждый из которых выбирают независимо; или замещен одним или несколькими заместителями, предпочтительно одним-двумя заместителями, независимо выбранными из группы, состоящей из галогена, C1-C4 алкила, C1-C4 алкоксигруппы,C1-C4 алкилтиогруппы, цианогруппы и нитрогруппы, где каждый алкильный, алкоксильный и алкилтиозаместитель может быть далее независимо замещен C1-C2 алкоксигруппой или от одной до пяти галогеновых групп, выбранных из фтора и хлора; или замещен одним заместителем, выбранным из группы, состоящей из фенилоксигруппы, бензилоксигруппы, фенилтиогруппы, бензилтиогруппы и пиримидинилоксигруппы, где фенилокси-, бензилокси-,фенилтио-, бензилтио- и пиримидинилоксифрагмент может быть далее замещен одним-двумя заместителями, выбранными из группы, состоящей из галогена, C1-C2 алкила и C1-C2 алкоксигруппы, где каждая алкильная и алкоксигруппа может быть далее замещена 1-3 группами фтора; или замещен одним заместителем, выбранным из группы, состоящей из C1-C4 ацила иC1-C4 алкоксикарбонила, и далее замещен 0-1 заместителями, выбранными из группы, состоящей из галогена, C1-C4 алкила,C1-C4 алкоксигруппы и C1-C4 алкилтиогруппы. Если заместитель является галогеном, предпочтительными галогеновыми группами являются фтор,хлор и бром. В другом варианте воплощения предпочтительные замещения для "замещенного фенила" и "замещенного гетероцикла" включают замещение одним или несколькими галогеновыми заместителями,предпочтительно от одного до пяти, еще предпочтительнее от одного до трех, каждый из которых выбирают независимо; или замещение одним или несколькими заместителями, предпочтительно одним-двумя заместителями, независимо выбранными из группы, состоящей из галогена, C1-C4 алкила,C1-C4 алкоксигруппы, цианогруппы и нитрогруппы, где каждый алкильный и алкоксильный заместитель может быть далее независимо замещен от одной до пяти галогеновыми группами, выбранными из фтора и хлора. В другом варианте воплощения предпочтительные замещения для "замещенного фенила" включают замещение одним или тремя независимо выбранными галогеновыми заместителями; или замещение одним-двумя заместителями, независимо выбранными из группы, состоящей из галогена, метила, метоксигруппы, трифторметила, трифторметоксигруппы и цианогруппы. Используемые в настоящем описании аббревиатуры имеют следующие значения:Pd(OAc)2 обозначает диацетат палладия; ТГФ обозначает тетрагидрофуран. Термин "аминозащитная группа" в используемом здесь значении относится к заместителю, обычно применяемому для блокирования или защиты аминной функциональной группы при проведении реакций других функциональных групп соединения. Примеры таких аминозащитных групп включают формильную группу, трифенилметильную группу, фталимидогруппу, ацетильную группу, трихлорацетильную группу, хлорацетильную, бромацетильную и йодацетильную группы, блокирующие группы уретанового типа, такие как бензилоксикарбонил, 9-флуоренилметоксикарбонил ("FMOC"), трет-бутоксикарбонил(t-BOC) и т.п., и подобные аминозащитные группы. Вид используемой аминозащитной группы не является критическим, если дериватизированная аминогруппа является стабильной в условиях последующих реакций в других положениях молекулы, и защитная группа может быть удалена в нужный момент времени без разрушения остальной части молекулы. Выбор и использование (введение и последующее удаление) аминозащитных групп хорошо известны рядовым специалистам. Дополнительные примеры групп, на которые имеются ссылки в приведенных выше терминах, описаны в работе T.W.Greene andP.G.M. Wuts, "Protective Groups in Organic Synthesis", 3rd ed., John WileySons, New York, NY, 1999, chapter 7, которая в дальнейшем обозначается "Greene". Термины "фармацевтический" или "фармацевтически приемлемый" при их использовании здесь в качестве определений указывают, по существу, на нетоксичный и, по существу, безвредный для реципиента характер."Фармацевтическая композиция" далее обозначает, что носитель, растворитель, эксципиенты и соль должны быть совместимыми с активным ингредиентом композиции (например, соединением формулыI). Специалистам в данной области техники понятно, что термины "лекарственное средство" и "фармацевтическая композиция" являются в общем взаимозаменяемыми и используются в таком значении в-5 011274 данном изобретении. Термин "соль присоединения кислоты" касается соли соединения, полученной путем проведения реакции соединения с минеральной или органической кислотой. Соединения по настоящему изобретению образуют фармацевтически приемлемые соли присоединения кислот с широким спектром органических и неорганических кислот и включают физиологично приемлемые соли, которые часто используются в фармацевтической химии. Такие соли также являются вариантами воплощения настоящего изобретения. "Фармацевтически приемлемая соль присоединения (кислоты)" образуется с фармацевтически приемлемой кислотой, как хорошо известно специалистам. Такие соли включают фармацевтически приемлемые соли, примеры которых приведены в Berge, S.M., Bighley, L.D. and Monkhouse, D.C., J. Pharm. Sci.,66:1, (1977) и хорошо известны специалистам в данной области. Неорганические кислоты, обычно используемые для образования таких солей, включают хлористо-водородную кислоту, бромисто-водородную кислоту, йодисто-водородную кислоту, серную кислоту, фосфорную кислоту и т.п. Органические кислоты, обычно используемые для образования таких солей, включают п-толуолсульфокислоту, метансульфоновую, щавелевую, п-бромфенилсульфоновую,угольную, янтарную, лимонную, бензойную, уксусную кислоты и т.п. примерами таких фармацевтически приемлемых солей являются, таким образом, сульфат, пиросульфат, бисульфат, сульфит, бисульфит,фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат,пропионат, деканоат, каприлат, акрилат, формиат, изобутират, капроат, гептаноат, пропиолат, оксалат,малонат, сукцинат, суберат, себакат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, -гидроксибутират, гликолат,тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и т.п. Хорошо известно, что такие соединения могут образовывать соли в разных молярных соотношениях с получением, например, полукислой, монокислой, двукислой соли и т.д. Термин "эффективное количество" обозначает количество соединения формулы I, способное активировать 5-HT1F рецепторы и/или ингибировать экстравазацию нейронных протеинов. Термин "пригодный растворитель" касается любого растворителя или смеси растворителей, инертного по отношению к протекающей реакции, который в достаточной степени солюбилизирует реагенты с образованием среды для протекания требуемой реакции. Считается, что соединения по настоящему изобретению могут существовать как стереоизомеры. По существу, все энантиомеры, диастереомеры и их смеси входят в объем настоящего изобретения. В тех случаях, когда в данном описании определена конкретная стереохимия, для описания конкретных изомеров и относительной стереохимии используются обозначения (R)- и (S)- в соответствии с правилами Кана-Прелога-Инголда и цис- и трансобозначения относительной стереохимии. Хотя считается, что все энантиомеры, диастереомеры и их смеси входят в объем настоящего изобретения, предпочтительными вариантами воплощения являются отдельные энантиомеры и отдельные диастереомеры. Хотя все соединения по настоящему изобретению пригодны для использования как 5-HT1F агонисты, определенные классы являются предпочтительными, как, например, соединения, удовлетворяющие любым из перечисленных далее условий выбора заместителей. Соединения, в которых: 1) R1 обозначает фенил, замещенный фенил, гетероцикл или замещенный гетероцикл; 2) R1 обозначает замещенный фенил; 3) R1 обозначает моно- или дизамещенный фенил, в котором заместители независимо выбирают из галогена, C1-C4 алкила, C1-C4 алкоксигруппы, трифторметила, трифторметоксигруппы, трифторэтоксигруппы, фенилоксигруппы, бензилоксигруппы, цианогруппы и нитрогруппы; 4) R1 обозначает моно- или дизамещенный фенил, в котором заместители независимо выбирают из галогена, C1-C2 алкоксигруппы, трифторметила, трифторметоксигруппы и трифторэтоксигруппы; 5) R1 обозначает моно- или дизамещенный фенил, в котором заместители независимо выбирают из галогена, трифторметила и трифторметоксигруппы; 6) R1 обозначает моно-, ди- или тригалогензамещенный фенил; 7) R1 обозначает гетероцикл или замещенный гетероцикл; 8) R1 обозначает гетероцикл или замещенный гетероцикл, где гетероцикл выбирают из группы, состоящей из фуранила, тиофенила, пирролила, пирролидинила, пиридинила, N-метилпирролила, оксазолила, изоксазолила, пиразолила, имидазолила, триазолила, оксадиазолила, тиадиазолила, тиазолила, тиазолидинила, N-ацетилтиазолидинила, пиримидинила, пиразинила, пиридазинила, изохинолинила, бензоксазолила, бензодиоксолила, бензотиазолила, хинолинила, бензофуранила, бензотиофенила и индолила; 9) R1 обозначает замещенный или незамещенный гетероцикл, где гетероцикл выбирают из группы,состоящей из пиридинила, индолила, фуранила, бензофуранила, тиофенила, бензодиоксолила и тиазолидинила; 10) R1 обозначает замещенный или незамещенный гетероцикл, где гетероцикл выбирают из группы,состоящей из пиридинила, тиофенила и фуранила; 11) R1 обозначает моно-, ди- или тригалогензамещенный гетероцикл, где каждую галогеновую-6 011274 группу выбирают независимо; 12) R1 обозначает моно- или дизамещенный гетероцикл, где один из заместителей выбирают из группы, состоящей из C1-C2 алкоксигруппы, феноксигруппы и фенилтиогруппы; 13) R1 обозначает монозамещенный гетероцикл, где заместителями являются галоген или нитрогруппа; 14) R1 обозначает моногалогензамещенный гетероцикл; 15) R1 обозначает незамещенный гетероцикл; 16) R1 обозначает C2-C6 алкил; 17) R1 обозначает C2-C6 алкил, замещенный от одного до пяти раз галогенами; 18) R1 обозначает C3-C7 циклоалкил; 19) R1 обозначает C3-C7 циклоалкил и X обозначает -N=; 20) R1 обозначает циклопропил; 21) R2 обозначает водород или н-C1-C3 алкил; 22) R2 обозначает водород или метил; 23) R2 обозначает пиразолилалкил или N-замещенный пиразолилалкил; 24) R2 обозначает пиразол-4-илэтил; 25) R2 обозначает 1-(C1-C3 алкил)пиразол-4-илэтил; 26) R2 обозначает циклопропилметил; 27) R3a, R3b и R3c, если они присутствуют, каждый, обозначают водород; 28) один из R3b или R3c, если они присутствуют, обозначает фтор; 29) R4 обозначает водород; 30) если X обозначает -C(R3c)=, то R4 обозначает метил; 31) R5 обозначает водород; 32) R5 обозначает метил; 33) R3a, R3b и R3c, если они присутствуют, обозначают водород или фтор при условии, что не более чем один из R3a, R3b и R3c может отличаться от водорода; 34) R3a, R3b и R3c, если они присутствуют, обозначают водород или фтор при условии, что не более чем один из R3a, R3b и R3c может отличаться от водорода и R4 обозначает водород; 35) R3a, R3b и R3c, если они присутствуют, обозначают водород или фтор при условии, что не более чем один из R3a, R3b и R3c может отличаться от водорода, R4 обозначает водород и R5 обозначает водород или метил; 36) R3b и R3c, если они присутствуют, обозначают водород или фтор при условии, что не более чем один из R3b и R3c может отличаться от водорода, R4 обозначает водород и R5 обозначает водород или метил; 37) R2 обозначает водород или метил, R3a, R3b и R3c, если они присутствуют, каждый, обозначают водород или фтор при условии, что не более чем один из R3a, R3b и R3c может отличаться от водорода, R4 обозначает водород и R5 обозначает водород или метил; 38) R1 обозначает моно-, ди- или тризамещенный фенил, в котором заместители независимо выбирают из галогена, C1-C2 алкоксигруппы, трифторметила, трифторметоксигруппы и трифторэтоксигруппы,R2 обозначает водород или метил, R3a, R3b и R3c, если они присутствуют, каждый, обозначают водород или фтор при условии, что не более чем один из R3a, R3b и R3c может отличаться от водорода, R4 обозначает водород и R5 обозначает водород или метил; 39) R1 обозначает моно-, ди- или тризамещенный фенил, в котором заместители независимо выбирают из галогена, R2 обозначает водород или метил, R3a, R3b и R3c, если они присутствуют, каждый, обозначают водород или фтор при условии, что не более чем один из R3a, R3b и R3c может отличаться от водорода, R4 обозначает водород и R5 обозначает водород или метил; 40) R1 обозначает замещенный или незамещенный гетероцикл, выбранный из группы, состоящей из пиридинила, индолила, бензофуранила, фуранила, тиофенила, бензодиоксолила и тиазолидинила, R2 обозначает водород или метил, R3a, R3b и R3c, если они присутствуют, каждый, обозначают водород или фтор при условии, что не более чем один из R3a, R3b и R3c может отличаться от водорода, R4 обозначает водород и R5 обозначает водород или метил; 41) R1 обозначает замещенный или незамещенный гетероцикл, выбранный из группы, состоящей из пиридинила, тиофенила и фуранила, R2 обозначает водород или метил, R3a, R3b и R3c, если они присутствуют, каждый, обозначают водород или фтор при условии, что не более чем один из R3a, R3b и R3c может отличаться от водорода, R4 обозначает водород и R5 обозначает водород или метил. Следует понимать, что указанные выше классы могут быть объединены с образованием дополнительных предпочтительных классов, таких как, например, комбинация предпочтительных вариантов выбора двух или более заместителей. Иллюстративными примерами комбинаций предпочтительных классов, образующих дополнительные предпочтительные классы, являются: 42) комбинация любого из предпочтительных классов по пп.1-20 с любым из предпочтительных классов по пп.21-26; 43) комбинация любого из предпочтительных классов по п.42 с предпочтительным классом по п.27-7 011274 или 28; 44) комбинация любого из предпочтительных классов по п.42 или 43 с предпочтительным классом по п.29 или 30; 45) комбинация любого из предпочтительных классов по пп.42, 43 или 44 с предпочтительным классом по п.31 или 32. Соединения по настоящему изобретению могут быть синтезированы рядом альтернативных путей. Схемы 1-7 относятся к синтезу соединений, в которых X обозначает -C(R3c)=. Схемы 8 и 9 относятся к синтезу соединений, в которых X обозначает -N=. Пригодные реакционные условия для стадий этих схем хорошо известны специалистам, а пригодная замена растворителей и реагентов доступна для специалистов. Аналогично, специалистам в данной области понятно, что промежуточные соединения синтеза могут быть выделены и/или очищены разными хорошо известными методами в зависимости от потребности или желания и что разные промежуточные соединения часто можно использовать непосредственно в следующих стадиях синтеза с незначительной очисткой или без нее. Все заместители, если не указано иное, имеют определенные выше значения и все реагенты хорошо известны специалистам. Схема 1 Соединения по настоящему изобретению, в которых X обозначает -CH=, могут быть синтезированы способами в соответствии со схемой 1, где R7 обозначает н-C1-C3 алкил, C3-C6 циклоалкилC1-C3 алкил либо группу формулы II или пригодную защитную группу азота. Схема включает в себя восстановительное аминирование необязательно R3-замещенного 3-аминонитробензола пригодным пиперидин-4-оновым реагентом, с последующим восстановлением нитрогруппы и, наконец, ацилирование первичного амина пригодным R1-ацилхлоридом. Необязательно впоследствии может быть проведено другое восстановительное аминирование для получения соединений, в которых R5 не является водородом. Если R7 обозначает защитную группу, то удаление защитной группы дает соединения по настоящему изобретению, в которых R2 обозначает водород. Дополнительные соединения, в которых R2 не является водородом, могут быть затем получены прямым способом путем алкилирования азота пиперидинила. Восстановительное аминирование 3-аминонитробензола пригодным пиперидин-4-оновым реагентом может быть осуществлено в инертном растворителе, таком как дихлорметан, ТГФ, толуол и т.п., при температуре типично в интервале примерно 0-40C в присутствии боргидрида, такого как боргидрид натрия, триацетоксиборгидрид натрия, цианоборгидрид натрия и т.п. Предпочтительно реакцию проводят в дихлорметане при температуре окружающей среды в присутствии триацетоксиборгидрида натрия. Восстановление нитрофункции каталитическим гидрированием в присутствии Pd/C осуществляют в пригодном растворителе, таком как метанол, этанол, изопропанол и т.п., при температуре типично в интервале примерно 20-40C. Предпочтительно гидрирование осуществляют в метаноле при температуре окружающей среды. Наконец, ацилирование первичного амина проводят с избытком хлорангидрида кислоты типично в интервале примерно 1,1-1,3 экв. в присутствии органического основания, такого как триэтиламин, основание Хюнига и т.п., в пригодном растворителе, таком как ТГФ, CH2Cl2, диэтиловый эфир,диизопропиловый эфир, метил-трет-бутиловый эфир, диоксан, ДМФ, толуол, этилацетат, ацетон и т.п.,при температуре типично в интервале примерно 0-40C. Предпочтительно ацилирование осуществляют в ТГФ, ацетоне или этилацетате с 1,1 экв. хлорангидрида кислоты при температуре окружающей среды в присутствии 2,2 экв. триэтиламина. Соединения, в которых R5 обозначает C1-C3 алкил, могут быть получены путем восстановительного аминирования пригодным альдегидом в присутствии органической кислоты и пригодного боргидрида. Предпочтительно это второе аминирование осуществляют в метаноле, с уксусной кислотой и цианоборгидридом натрия при температуре окружающей среды. Соединения, в которых R5 обозначаетC3-C6 циклоалкилкарбонил, могут быть получены путем проведения реакции с пригодным циклоалкилкарбонилхлоридным реагентом в условиях ацилирования, аналогичных описанным выше. Альтернативно, соединения по настоящему изобретению, в которых X обозначает -CH=, могут быть синтезированы способами в соответствии со схемой 2, где сначала проводят конденсацию необязательноR3-замещенного 3-аминонитробензола с пригодным R1-ацилхлоридом, с последующим восстановлением нитрогруппы и восстановительным аминированием пригодным пиперидин-4-оновым реагентом. Как и для схемы 1, соединения, в которых R5 не является водородом, могут быть получены с помощью другого восстановительного аминирования мостикового азота. Так же как и на схеме 1, если R7 обозначает защитную группу, удаление защитной группы дает соединения по настоящему изобретению, в которых R2 обозначает водород. Другие соединения, в которых R2 не является водородом, могут быть затем получены прямым способом с алкилированием азота пиперидинила. Типично, смешивают необязательно R3-замещенный 3-аминонитробензол с пригодным растворителем, таким как диоксан, пиридин, ТГФ, N,N-диметилацетамид и т.п. Обрабатывают смесь пригодным хлорангидридом кислоты (1,0-2,0 экв.). Перемешивают реакционную смесь на протяжении примерно 2-48 ч при температуре в интервале примерно 0-40C, например при комнатной температуре в течение примерно 16 ч. Переносят реакционную смесь в этилацетат или другой пригодный растворитель и промывают поочередно водной HCl (1 н.), водным NaOH (1 н.), насыщенным водным NaCl. Обычные процедуры обработки органического слоя дают бензамидное промежуточное соединение. Прибавляют бензамидное промежуточное соединение к теплому раствору (примерно 35-70C, например около 55C) SnCl22H2O в этаноле. Прибавляют концентрированную HCl, а потом перемешивают и нагревают смесь при температуре в интервале примерно 50-65C, например около 60C, на протяжении периода примерно 20-60 мин, например около 30 мин. Охлаждают реакционную смесь, а потом подщелачивают смесь до примерно pH 14 водным NaOH. Экстрагируют продукт пригодным растворителем,таким как этилацетат и т.п. Обычные процедуры обработки объединенных органических слоев дают аминобензамидное промежуточное соединение. Перемешивают смесь аминобензамидного промежуточного соединения, N-защищенного 4-пиперидона и порошкообразных молекулярных сит (4 ) в пригодном растворителе, таком как ТГФ,дихлорэтан, метиленхлорид и т.п., под инертной атмосферой. Прибавляют ледяную уксусную кислоту. Примерно через 1-8 ч, например приблизительно 1 ч, прибавляют NaBH(OC(O)CH3)3. Оставляют смесь для протекания реакции примерно на 8-24 ч примерно при 0-40C, например при комнатной температуре. Выливают реакционную смесь в пригодный растворитель, такой как метиленхлорид, этилацетат и т.п., и промывают водным NaOH. Обычные процедуры обработки органического слоя дают требуемый пиперидинилбензамид. Как и в схеме 1, мостиковый нитроген может необязательно быть замещенным, если желательно получить соединения, в которых R5 не является водородом. Соединения по настоящему изобретению, в которых X обозначает -CH=, могут быть также синтезированы способами в соответствии со схемой 3, которая включает защиту одной аминогруппы 1,3-диаминобензола, восстановительное аминирование пригодным пиперидин-4-оновым реагентом, удаление защиты и, наконец, ацилирование первичного амина пригодным R1-ацилхлоридом. Реакционные условия аналогичны схемам 1 и 2. Отметим также, что замещение мостикового азота может быть осуществлено до или после стадии ацилирования, по желанию. Схема 4 Соединения по настоящему изобретению, в которых R3c обозначает фтор, могут быть синтезированы, как показано на схеме 4. После начального восстановительного аминирования 3-амино-1-хлор-2 фторбензола, соответственно, замещенным 4-пиперидоном проводят превращение группы хлора на аминогруппу, а затем конденсацию с пригодным R1-ацилгалогенидным соединением. Реакционные условия аналогичны схемам 1-3. Отметим также, что замещение мостикового азота может быть осуществлено до или после стадии ацилирования, по желанию. Схема 5 Соединения, в которых R3c обозначает фтор и R5 обозначает C1-C3 алкил, могут быть синтезированы,как показано на схеме 5, на которой в качестве примера R5 - метил. После начальной конденсации 1-бром-2-фторбензола с соответственно замещенным 4-аминопиперидином проводят галогенирование бензильного кольца, превращение галогенидной группы в аминогруппу и последующую конденсацию с пригодным R1-ацилгалогенидным соединением. Соединения по настоящему изобретению, в которых R3b обозначает фтор и R5 обозначаетC1-C3 алкил, могут быть синтезированы, как показано на схеме 6, на которой в качестве примера R5 - метил. После начальной конденсации 1,3-дибром-5-фторбензола с соответственно замещенным 4 аминопиперидином проводят превращение оставшейся группы брома в аминогруппу и последующую конденсацию с пригодным R1-ацилгалогенидным соединением. Альтернативно, 1,3-дифтор-5 нитробензол может быть использован при начальной конденсации с соответственно замещенным 4 аминопиперидином с последующим восстановлением нитрогруппы до аминогруппы, а затем конденсацией с пригодным R1-ацилгалогенидным соединением. Типично, 1,3-дибром-5-фторбензол, растворенный в пригодном растворителе, таком как толуол,бензол и т.п., смешивают с метил(1-метилпиперидин-4-ил)амином, трет-бутоксидом натрия, Pd2dba3 иBINAP и нагревают, например, в интервале от 50 до 100C, например приблизительно 80C, на протяжении примерно 1-3 ч, например, приблизительно 2 ч. Реакцию гасят, например, прибавлением воды или другими пригодными средствами. (3-Бром-5-фторфенил)метил(1-метилпиперидин-4-ил)аминовое промежуточное соединение может быть обработано с использованием обычных процедур, например удаление растворителя, процедур экстракции и/или дополнительной очистки хроматографией и т.д.(3-Бром-5-фторфенил)метил(1-метилпиперидин-4-ил)аминовое промежуточное соединение потом аминируют в 3-положении бензольного кольца, например, путем проведения реакции промежуточного соединения с BINAP, Pd2(dba)3, бензгидрилиденамином и трет-бутоксидом натрия в пригодном растворителе, таком как толуол и т.п., под инертной атмосферой в течение примерно 1-3 ч, например приблизительно 2 ч, примерно при 50-100C, например около 80C. Полученное промежуточное соединение обрабатывают 1 М HCl и т.п. в пригодном растворителе, таком как ТГФ, при температуре от 0C до температуры окружающей среды, предпочтительно при температуре окружающей среды, в течение 1-2 ч, например приблизительно 1 ч. Полученное промежуточное соединение 5-фтор-N-метил-N-(1-метилпиперидин 4-ил)бензол-1,3-диамин можно потом выделить и очистить обычными процедурами, такими как, без ограничения, удаление растворителя, экстракция и/или хроматография и т.д. Конечные соединения могут быть затем синтезированы путем конденсации с R1-ацилхлоридом. Типично, 5-фтораминобензольное промежуточное соединение вводят в реакцию с пригоднымR1-ацилхлоридом, в пригодном растворителе, таком как диоксан, пиридин, ДМФ и т.п., при температуре от температуры окружающей среды до примерно 100C, предпочтительно в интервале примерно 50100C, до завершения реакции, например, в течение примерно 1-4 ч, например приблизительно 2 ч. Реакцию затем гасят прибавлением воды и конечный продукт очищают с помощью обычных процедур обработки. Альтернативно, промежуточное соединение 5-фтор-N-метил-N-(1-метилпиперидин-4-ил)бензол 1,3-диамин может быть синтезировано путем проведения реакции 1,3-дифтор-5-нитробензола с метил(1-метилпиперидин-4-ил)амином в присутствии ацетата натрия в пригодном растворителе, таком как этанол и т.п., на протяжении периода примерно 8-16 ч, например приблизительно 12 ч, при 80-120C,например приблизительно 100C, в закрытой пробирке. Реакцию потом гасят прибавлением воды и т.п. и промежуточное соединение (3-фтор-5-нитрофенил)метил(1-метилпиперидин-4-ил)амин очищают с помощью обычных процедур обработки. Нитрогруппу затем восстанавливают до аминогруппы, например,путем обработки железом и 1 М HCl в пригодном растворителе, таком как метанол и т.п., в течение времени примерно от 8 ч до периода с вечера до утра, например приблизительно 16 ч, при температуре в интервале примерно 80-100C, например приблизительно 100C. Промежуточное соединение 5-фтор-N-метил-N-(1-метилпиперидин-4-ил)бензол-1,3-диамин может быть затем выделено и очищено обычными процедурами. Соединения по настоящему изобретению, в которых R3b обозначает фтор и R5 обозначает водород,могут быть синтезированы, как показано на схеме 7, где 1,3-дибром-5-фторбензол превращают в 1,3-диаминосоединение, сконденсированное с пригодным R1-ацилгалогенидным соединением, с последующим восстановительным аминированием, соответственно, замещенным 4-аминопиперидином. Типично, 1,3-дибром-5-фторбензол, бензофенонимин, Pd2(dba)3, BINAP и трет-бутоксид натрия смешивают в пригодном растворителе, таком как толуол, ксилол, 1,4-диоксан и т.п., и нагревают, например, в интервале температур 60-130C в течение примерно 8-20 ч, например в течение около 15 ч. Реакцию гасят насыщенным раствором NaHCO3, экстрагируют несколько раз органическим растворителем,таким как этилацетат, метилендихлорид и т.п. Органические слои объединяют и растворитель удаляют. Остаток растворяют в пригодном растворителе, таком как ТГФ, эфир, метанол и т.п., и прибавляют водную HCl, например HCl с концентрацией в интервале 1-6 н., например, 5 н. HCl. Реакционную смесь перемешивают в течение примерно 1-3 ч при температуре в интервале примерно 0-60C, например примерно при температуре окружающей среды. Реакционную смесь потом разбавляют разбавленной воднойHCl и экстрагируют системой растворителей этилацетат/гексаны или эквивалентной. Органический слой промывают разбавленной водной HCl и водный слой потом подщелачивают NaOH и экстрагируют органическим растворителем, таким как метилендихлорид и т.п. Экстракт осушают, фильтруют, концентрируют и дополнительно очищают хроматографией, получая промежуточное диаминосоединение. Смесь промежуточного диаминосоединения и требуемого R1-ацилхлорида в пригодном растворителе, таком как диоксан, пиридин, ТГФ или ДМФ, с пригодным третичным амином, таким как триэтиламин, N-метилморфолин или диизопропилетиламин, перемешивают при температуре в интервале примерно 0-40C до завершения реакции, например в течение примерно 2-20 ч, например приблизительно 12 ч. Реакцию потом гасят прибавлением разбавленного водного NaOH. Обычные процедуры обработки и очистки дают амидное промежуточное соединение. Потом прибавляют триацетоксиборгидрид натрия к смеси амидного промежуточного соединения, соответственно 1-замещенного илиN-защищенного 4-пиперидона, уксусной кислоты и молекулярного сита (типично примерно 4 ), в пригодном растворителе, таком как ТГФ, дихлорэтан, метилендихлорид и т.п. Реакционную смесь перемешивают в течение примерно 8-20 ч, например приблизительно 12 ч, примерно при 0-40C, например при температуре окружающей среды. Реакцию потом гасят разбавленным водным NaOH, экстрагируют пригодным органическим растворителем, таким как метилендихлорид, этилацетат и т.п. Органический слой осушают, фильтруют, концентрируют и дополнительно очищают, например, хроматографией, получая требуемый продукт. Если R7 обозначает защитную группу, то используют пригодный способ удаления защиты для получения соединений, в которых R2 обозначает водород. Если требуется, незамещенный пиперидинильный фрагмент может быть впоследствии алкилирован обычными способами восстановительного алкилирования для получения соединений, в которых R2 не является водородом. Схема 8Br) алкилируют,соответственно,замещенным 4-(метиламино)пиперидином в присутствии основания, такого как карбонат калия, н-бутиллитий, гидрид натрия и т.д. в ДМФ, ацетонитриле, ТГФ и подобных растворителях. Альтернативно,2,6-дигалогенпиридин может быть обработан BINAP (или другим приемлемым лигандом), Pd(OAc)2, пиперидином и трет-бутоксидом натрия (или другим пригодным основанием) в толуоле (или подобном растворителе) с получением промежуточного соединения 1-метил-4-(N-(6-галогенпиридинил)метиламино)пиперидина. Галогенпиридин затем обрабатывают BINAP (или другим приемлемым лигандом),Pd(OAc)2, бензофенонимином (или другим эквивалентом амина) и трет-бутоксидом натрия (или другим- 12011274 пригодным основанием) в толуоле (или подобном растворителе), получая в качестве промежуточного соединения замещенный 4-(N-(6-аминопиридинил)метиламино)пиперидин. Этот амин затем ацилируют различными хлорангидридами кислот в пиридине, ТГФ, 1,4-диоксане или подобном растворителе, получая конечный продукт. Аналогично, соединения, в которых R5 обозначает этил или пропил, могут быть получены с использованием соответствующего 4-(этиламино)пиперидина или 4-(пропиламино)пиперидина. Схема 9 Типично, смесь R1-ацилхлорида и 2,6-диаминопиридина в пригодном растворителе, таком как диоксан, ТГФ, ДМФ и т.п., перемешивают при температуре в интервале от примерно температуры окружающей среды до примерно 100C на протяжении периода примерно 2-20 ч, например приблизительно 12 ч. Обычные процедуры обработки, такие как экстракция, фильтрация и/или хроматография, дают промежуточное соединение н-(6-аминопиридин-2-ил)амид. Триацетоксиборгидрид натрия потом прибавляют к смеси указанного выше промежуточного соединения с пригодным 1-замещенным 4-пиперидоном, уксусной кислотой и молекулярным ситом в пригодном растворителе, таком как ТГФ, дихлорэтан, метилендихлорид и т.п. Реакционную смесь перемешивают при температуре в интервале примерно 0-40C, например приблизительно при температуре окружающей среды, в течение примерно 8-20 ч, например около 12 ч. Типично прибавляют другую аликвоту пиперидонового реагента и триацетоксиборгидрид натрия и оставляют для протекания реакции с остатком N-(6-аминопиридин-2-ил)амидного промежуточного соединения. Реакцию потом гасят разбавленным водным NaOH. Обычные процедуры обработки и очистки дают N-(5-пиперидин-4 иламино)амидное соединение. Если R7 обозначает требуемый фрагмент R2, то обычные процедуры окончательной очистки используются для получения конечного продукта. Если R7 обозначает защитную группу, то защитную группу удаляют соответствующими процедурами, получая соединения, в которыхR2 обозначает водород. Эти соединения могут быть, при необходимости, впоследствии далее алкилированы хорошо известными способами для получения конечных продуктов, в которых R2 не является водородом. Следующие синтезы и примеры приведены для того, чтобы лучше пояснить практику настоящего изобретения и не должны каким-либо образом интерпретироваться как ограничивающие его объем. Смешивают 3-нитроанилин (3,0 г, 21,7 ммоль), дихлорметан (100 мл), пиридин (2,11 мл,26,0 ммоль) и 2-хлор-4-фторбензоилхлорид (3,07 мл, 23,9 ммоль). Перемешивают при комнатной температуре в течение ночи. Фильтруют белый осадок, промывают эфиром (210 мл) и высушивают в вакууме, получая 2-хлор-4-фтор-N-(3-нитрофенил)бензамид (4,92 г, 77%). Смешивают 2-хлор-4-фтор-N-(3 нитрофенил)бензамид (4,92 г, 16,7 ммоль) с этанолом (150 мл), SnCl22H2O (18,9 г, 83,6 ммоль) и концентрированной хлористо-водородной кислотой (8,24 мл, 83,6 ммоль). Перемешивают при кипении с обратным холодильником, в атмосфере азота в течение 2 ч. Нейтрализуют гидроксидом аммония (15 мл). Фильтруют через целит, промывают дихлорметаном (215 мл), отделяют фильтрат, экстрагируют дихлорметаном (280 мл) и осушают смешанные органические слои над сульфатом магния. Фильтруют и концентрируют досуха, получая названное в заголовке промежуточное соединение в виде беловатого твердого вещества (3,04 г, 69%); масс-спектр (ионное распыление): m/z=265,0 (М+1); 1 Способом, аналогичным синтезу 1, с использованием 2-хлор-6-фторбензоилхлорида (1,0 г,3,39 ммоль) получают названное в заголовке промежуточное соединение (820 мг, 91%); масс-спектр (ионное распыление): m/z=265,1 (М+1); 1 Способом, аналогичным синтезу 1, используя 2,6-дифторбензоилхлорид (1,0 г, 3,59 ммоль), получают названное в заголовке промежуточное соединение (723 мг, 81%); масс-спектр (ионное распыление): m/z=248,9 (М+1); 1 Способом, аналогичным синтезу 1, используя 2,4-дифторбензоилхлорид (1,0 г, 3,59 ммоль), получают названное в заголовке промежуточное соединение (664 мг, 74%); масс-спектр (ионное распыление): m/z=248,9 (М+1); 1 Способом, аналогичным синтезу 1, используя 2-бромбензоилхлорид (1,0 г, 3,11 ммоль), получают названное в заголовке промежуточное соединение (744 мг, 82%); масс-спектр (ионное распыление): m/z=293,0 (М+1); 1 Способом, аналогичным синтезу 1, используя 2-хлорбензоилхлорид (4,0 г, 14,5 ммоль), получают названное в заголовке промежуточное соединение (2,8 г, 78%); масс-спектр (ионное распыление): m/z=247,0 (М+1); 1 Способом, аналогичным синтезу 1, используя 2-трифторметоксибензоилхлорид (300 мг,1,01 ммоль), получают названное в заголовке промежуточное соединение (274 мг, 69%) в виде белой пены; масс-спектр (ионное распыление): m/z=394,2 (M+1); 1 Прибавляют раствор ди-трет-бутилдикарбоната (5,04 г, 23,11 ммоль) в хлороформе (100 мл+100 мл промывного раствора) к раствору 1,3-фенилендиамина (5,0 г, 46,23 ммоль) в хлороформе (100 мл). Перемешивают при комнатной температуре в течение ночи. Промывают гидроксидом натрия (1 н. водн.,200 мл) и отделяют органический слой. Очищают флэш-хроматографией (этилацетат/гексаны, от 1/4 до 1/1), получая трет-бутиловый сложный эфир (3-аминофенил)карбаминовой кислоты (4,17 г, 87%). Смешивают трет-бутиловый сложный эфир (3-аминофенил)карбаминовой кислоты (0,156 г,0,756 ммоль), 1-метилпиперидин-4-он (0,093 мл, 0,756 ммоль), триацетоксиборгидрид натрия (208 мг,0,982 ммоль), уксусную кислоту (0,043 мл, 0,756 ммоль) и дихлорметан (8 мл). Перемешивают при комнатной температуре в течение ночи. Разбавляют дихлорметаном (5 мл) и промывают дважды гидроксидом натрия (10 мл, 1 н. водн.). Объединяют органические слои и промывают насыщенным водным NaCl(10 мл). Осушают над сульфатом магния, фильтруют под разрежением и концентрируют досуха. Очищают флэш-хроматографией на картридже Biotage с диоксидом кремния, элюируя 20/1 смесью дихлорметана и 2 н. аммиака в метаноле, получая форму свободного основания названного в заголовке соединения. Растворяют остаток в диэтиловом эфире и обрабатывают эфирным раствором хлористого водорода. Растирают полученное смолистое вещество с эфиром, получая названное в заголовке соединение в виде белого твердого вещества; т.пл. 124-125C; масс-спектр (ионное распыление): m/z=306,2 (М+1); 1 Смешивают трет-бутиловый сложный эфир [3-(1-метилпиперидин-4-иламино)фенил]карбаминовой кислоты (синтез 9, 1,15 г, 3,77 ммоль), метанол (15 мл) и формальдегид (37% водн., 0,92 мл, 11,3 ммоль). Перемешивают при комнатной температуре в течение 45 мин. Охлаждают до 0C. Прибавляют уксусную кислоту (0,22 мл, 3,77 ммоль) и цианоборгидрид натрия (414 мг, 6,59 ммоль). Перемешивают при комнатной температуре в течение ночи. Концентрируют досуха. Растворяют остаток в 2/1 смеси этилацетата и гексанов (20 мл) и промывают гидроксидом натрия (1 н. водн., 220 мл). Отделяют органический слой и осушают над сульфатом магния. Фильтруют и концентрируют при пониженном давлении. Очищают флэш-хроматографией, элюируя 20/1 смесью дихлорметана и 2 М аммиака в метаноле, получая названное в заголовке соединение (990 мг, 82%); масс-спектр (ионное распыление): m/z=320,3 (М+1). Синтез 11. 1-Метил-4-[N-(3-аминофенил)-N-метиламино]пиперидина тригидрохлорид(2 мл). Перемешивают в течение ночи. Концентрируют при пониженном давлении. Растирают с диэтиловым эфиром (1 мл), получая названное в заголовке промежуточное соединение (671 мг, 66%); масс-спектр (свободное основание, ионное распыление): m/z=220,3 (М+1). Анализ: Вычислено для C13H24Cl3N3Cl3: C, 47,50; H, 7,36; N, 12,78. Найдено: C, 47,28; H, 7,28; N, 12,46. Синтез 12. 4-(2-Гидроксиэтил)-1-изопропил-1H-пиразол Смешивают 2,3-дигидрофуран (25 мл, 0,33 моль) и триэтилортоформиат (93,3 мл, 0,56 моль), а потом медленно прибавляют диэтилэфират трехфтористого бора (2,0 мл, 0,017 моль) при интенсивном перемешивании. Оставляют реакцию для протекания в течение 18 ч. Перегоняют реакционную смесь при 60C в вакууме 8 мм рт.ст. для удаления избытка 2,3-дигидрофурана и триэтилортоформиата. Нагревают часть остатка (10 г, 45 ммоль) до кипения с обратным холодильником в 1 н. HCl с изопропилгидразином(3,4 г, 45 ммоль). Через 2 ч температуру снижают до 80C и реакцию перемешивают в течение 18 ч. После охлаждения до комнатной температуры смесь подщелачивают 1 н. NaOH до pH12 и разбавляютCH2Cl2. Отделяют и экстрагируют водный слой CH2Cl2 (дважды), объединяют органические слои, осушают над MgSO4 и концентрируют. Хроматография на силикагеле с элюированием градиентом 0-10%(2 М NH3 в метаноле) в CH2Cl2 дает названное в заголовке промежуточное соединение в виде твердого вещества коричневого цвета (3,6 г, 52%). Масс-спектр (ионное распыление): m/z=155,2 (М+1); 1 Смешивают 4-фтор-3-нитроанилин (1,0 г, 6,4 ммоль) с диоксаном (20 мл). Обрабатывают смесь 2-хлор-4-фторбензоилхлоридом (1,6 г, 8,3 ммоль). Перемешивают реакционную смесь в течение ночи при комнатной температуре. Переносят реакционную смесь в этилацетат (220 мл), затем промывают поочередно водной HCl (1 н., 50 мл), водным NaOH (1 н., 50 мл), насыщенным водным NaCl (50 мл). Осушают органический слой над безводным сульфатом натрия, затем выпаривают растворитель при пониженном давлении. Далее очищают остаток хроматографией на силикагеле, используя градиент- 16011274 10-30% этилацетата в гексанах, получая названное в заголовке промежуточное соединение (1,7 г, выход 85%); масс-спектр (ионное распыление): m/z=313,0 (М+1). Синтез 14. N-(3-Амино-4-фторфенил)-2-хлор-4-фторбензамид(25 мл). Перемешивают и нагревают смесь при 60C в течение 30 мин. Охлаждают, а затем подщелачивают смесь до pH 14 водным NaOH. Экстрагируют продукт три раза этилацетатом (3150 мл). Объединяют органические слои и осушают над безводным сульфатом натрия. Выпаривают растворитель при пониженном давлении. Далее очищают остаток хроматографией на силикагеле, используя градиент 10-50% этилацетата в гексанах, получая названное в заголовке промежуточное соединение (800 мг, выход 89%); масс-спектр (ионное распыление): m/z=283,0 (М+1). Синтез 15. 2,4-Дифтор-N-(4-фтор-3-нитрофенил)бензамид(20 мл) и 2,4-дифторбензоилхлорид (1,46 г, 8,3 ммоль), получают названное в заголовке промежуточное соединение (1,6 г, выход 84%); масс-спектр (ионное распыление): m/z=297,0 (М+1). Синтез 16. 2,4-Дифтор-N-(3-амино-4-фторфенил)бензамид(25 мл), получают названное в заголовке промежуточное соединение (803 мг, выход 89%); масс-спектр (ионное распыление): m/z=267,0 (М+1). Синтез 17. 1-Метил-4-(3-нитрофениламино)пиперидин Смешивают 3-нитроанилин (25,0 г, 180,0 ммоль), 1-метил-4-пиперидон (40,9 мл, 360,0 ммоль) и уксусную кислоту (21,7 мл, 360,0 ммоль) в 350 мл дихлорэтана. Перемешивают при комнатной температуре в течение 0,5 ч. Прибавляют триацетоксиборгидрид натрия (76,4 г, 360,0 ммоль) несколькими порциями и перемешивают реакционную смесь при комнатной температуре в течение 2 дней. Гасят реакционную смесь прибавлением насыщенного водного NaHCO3 и разделяют между CH2Cl2 и водой. Доводят водную фазу примерно до pH 8 и экстрагируют 3 раза CH2Cl2. Смешивают органические фракции и промывают насыщенным водным NaCl, осушают над MgSO4 и концентрируют. Далее очищают хроматографией на силикагеле, элюируя градиентом 1-10% метанола в этилацетате, получая названное в заголовке промежуточное соединение (23,8 г, выход 56%); масс-спектр (ионное распыление): m/z=236,2 (М+1). Анализ: Вычислено для C12H17N3O20,3H2O: C, 59,88; H, 7,37; N, 17,45. Найдено: C, 60,07; H, 7,18; N, 17,09. Альтернативно, к раствору 3-нитроанилина (360 г, 2,6 моль) в дихлорметане (7,2 л) в атмосфере азота прибавляют триацетоксиборгидрид натрия (1,38 кг, 6,5 моль) порциями в течение 1 ч. После этого прибавляют уксусную кислоту (370 мл, 6,5 моль) с такой скоростью, чтобы Тмас не превышала 25C, а затем 1-метил-4-пиперидон (450 г, 3,98 моль), который прибавляют в течение 150 мин, поддерживая температуру ниже 25C. Перемешивают смесь при комнатной температуре в течение 3 ч. Прибавляют дополнительное количество триацетоксиборгидрида натрия (280 г, 1,32 моль), уксусной кислоты (74 мл,1,29 моль) и 1-метил-4-пиперидона (90 г, 0,8 моль) и перемешивают смесь в течение ночи при комнатной температуре. Гасят реакционную смесь водой (4 л) и доводят pH до значения в интервале 8-9 с помощью 30% гидроксида натрия. Экстрагируют органический слой и промывают водный слой дихлорметаном(2 л). Промывают объединенные органические слои водой (1 л), осушают над MgSO4 (100 г) и концентрируют (2). Фильтруют полученную суспензию, промывают дихлорметаном (500 мл) и концентрируют фильтраты при пониженном давлении (40C), получая сырой 1-метил-4-(3-нитрофениламино)пиперидин в виде твердого вещества оранжевого цвета (620 г). Суспендируют сырой 1-метил-4-(3 нитрофениламино)пиперидин (590 г) в смеси воды (5,9 л) и изопропанола (590 мл). Перемешивают смесь при комнатной температуре в течение 5 ч. Фильтруют полученные желтые кристаллы, промывают смесью воды (600 мл) и изопропанола (60 мл) и высушивают при пониженном давлении при комнатной температуре в течение ночи, получая 1-метил-4-(3-нитрофениламино)пиперидин (524 г, выход 94%). Синтез 18. 1-Метил-4-(3-аминофениламино)пиперидина триацетат Смешивают 1-метил-4-(3-нитрофениламино)пиперидин (синтез 17, 8,2 г, 34,8 ммоль), уксусную кислоту (6,3 г, 110 ммоль) и палладий на угле (10%, 2,1 г) в 300 мл этанола. Откачивают реакционную колбу, заполняют газообразным H2 (атмосферное давление) и перемешивают при комнатной температуре в течение 18 ч. Фильтруют через целит, промывают этилацетатом и концентрируют, получая 13,1 г названного в заголовке промежуточного соединения, которое обычно используют для последующих реакций без дополнительной очистки. Небольшой образец амина в форме свободного основания дополнительно очищают путем растворения триацетатной соли в метаноле, нанесения на колонку с 1 г сильного катионообменника (SCX) (mega bond elut, Varian) и промывают метанолом, элюируя 2 М NH3 в метаноле и концентрируя в вакууме: масс-спектр (ионное распыление);H ЯМР (CDCl3, м.д.) : 6,93 (т, J=7,9, 15,8 Гц, 1H), 6,03 (д, J=7,9 Гц, 2H), 5,94 (с, 1H), 3,46 (ушир.с,3H), 3,24 (ушир.с, 1H), 2,79 (м, 2H), 2,28 (с, 3H), 2,10 (м, 4H), 1,40 (м, 2H). Альтернативно, помещают в сосуд Парра на 2 л 1-метил-4-(3-нитрофениламино)пиперидин (100 г; 0,425 моль), 10% Pd/C (5 г) и метанол (1 л). Встряхивают смесь в течение ночи при начальном давлении водорода 4 атм, поддерживая температуру ниже 35C. Отделяют катализатор на фильтре и промывают метанолом (100 мл). Концентрируют фильтраты при пониженном давлении, получая 1-метил-4-(3 аминофениламино)пиперидин в виде маслянистой жидкости красного цвета (95,7 г, выход 100%), которая со временем кристаллизуется при комнатной температуре. Синтез 19. 1-Метил-4-(3-хлор-2-фторфениламино)пиперидин Смешивают 3-хлор-2-фторанилин (4,37 г, 30 ммоль), 1-метилпиперидин-4-он (3,39 г, 30 ммоль),триацетоксиборгидрид натрия (5,26 г, 33 ммоль) и уксусную кислоту (5,4 г, 90 ммоль) и перемешивают при комнатной температуре в течение ночи. Разделяют реакционную смесь между дихлорметаном и насыщенным водным NaCl, содержащим NH4OH, осушают над безводным сульфатом натрия, выпаривают и очищают на колонке с силикагелем (110 г), используя градиент дихлорметана-2 М NH3 в метаноле, получая 2,34 г названного в заголовке соединения (выход 32%); масс-спектр (ионное распыление): m/z=243 (М+1); 1 Смешивают 1-метил-4-(3-хлор-2-фторфениламино)пиперидин (синтез 19, 0,439 г, 1,8 ммоль), бензофенонимин (0,393 г), Pd2(dba)3 (4,1 мг), 2-(дициклогексилфосфино)бифенил (4,7 мг) и трет-бутоксид натрия (0,242 г) с толуолом (5 мл) и нагревают до кипения с обратным холодильником в течение ночи. Растворяют реакционную смесь в метаноле и фильтруют через колонку SCX (10 г), промывают метанолом, элюируют продукт 2 М NH3 в метаноле, выпаривают растворитель и далее очищают на колонке с силикагелем (35 г, используя градиент дихлорметана-2 М NH3 в метаноле), получая сырой 1-метил-4-(3 бензгидрилиденамино-2-фторфениламино)пиперидин (0,372 г). Прибавляют 1 н. HCl (2 мл) к раствору бензгидрилиденильного промежуточного соединения в ТГФ (10 мл) и перемешивают при комнатной температуре в течение 30 мин. Подщелачивают NH4OH, экстрагируют этилацетатом, осушают над безводным сульфатом натрия, выпаривают и очищают на колонке с силикагелем (10 г), используя градиент дихлорметана-2 М NH3 в метаноле, получая названное в заголовке промежуточное соединение (0,08 г); масс-спектр (ионное распыление): m/z=224 (М+1);(37%, 0,973 г), цианоборгидрид натрия (0,917 г) и уксусную кислоту (1,66 г) в метаноле (50 мл) и перемешивают при комнатной температуре в течение ночи. Прибавляют формальдегид (37%, 0,973 г), цианоборгидрид натрия (0,917 г) и уксусную кислоту (2 мл) и перемешивают при комнатной температуре в течение ночи. Разделяют реакционную смесь между дихлорметаном и насыщенным водным NaCl, осушают над безводным сульфатом натрия, выпаривают и очищают на колонке с силикагелем, используя градиент дихлорметана-2 М NH3 в метаноле, получая 1,06 г названного в заголовке промежуточного соединения. Синтез 22. 1-Метил-4-[N-(3-амино-2-фторфенил)метиламино]пиперидин(0,404 г) в толуоле (10 мл) в течение 44 ч. Разбавляют реакционную смесь метанолом, наносят на колонку SCX (10 г), промывают метанолом, элюируют продукт 2 М NH3 в метаноле, выпаривают и очищают на колонке с силикагелем (110 г), используя градиент дихлорметана-2 М NH3 в метаноле, получая 0,21 г 1-метил-4-[N-(3-бензгидрилидениламино-2-фторфенил)метиламино]пиперидина. Прибавляют 2 мл 1 н. HCl к раствору диамина (0,21 г) и перемешивают в течение 30 мин, подщелачивают NH4OH, экстрагируют этилацетатом, осушают над безводным сульфатом натрия, выпаривают и очищают на колонке с силикагелем (10 г), используя градиент дихлорметана-2 М NH3 в метаноле, получая 44 мг названного в заголовке промежуточного соединения. Синтез 23. 1-Метил-4-[N-(2-фторфенил)метиламино]пиперидин(0,366 г), рацемического BINAP (0,498 г) и трет-бутоксида натрия (2,70 г) в толуоле (40 мл) и нагревают до кипения с обратным холодильником в течение 2 дней. Фильтруют через слой целита, разделяют между дихлорметаном и насыщенным водным NaCl, осушают над безводным сульфатом натрия, выпаривают и очищают на колонке с силикагелем (35 г), используя градиент дихлорметана-2 М NH3 в метаноле, получая 1,1 г названного в заголовке промежуточного соединения. Синтез 24. 1-Метил-4-[N-(2-фтор-3-бромфенил)метиламино]пиперидин(0,97 г) в ТГФ (10 мл) при -78C и перемешивают в течение 30 мин. Прибавляют порциями раствор 1-метил-4-(N-(2-фторфенил)метиламино)пиперидина (синтез 23, 1,02 г) в ТГФ (10 мл) и перемешивают в течение 10 мин. Прибавляют по каплям 1,2-дибром-1,1,2,2-тетрахлорэтан (1,50 г) в ТГФ (10 мл) и перемешивают в течение 1 ч. Удаляют охлаждающую баню и перемешивают в течение 30 мин. Разделяют между этилацетатом и насыщенным водным NaCl, осушают над безводным сульфатом натрия, выпаривают и очищают на колонке с силикагелем (110 г), используя градиент дихлорметана-2 М NH3 в метаноле, получая 0,49 г названного в заголовке промежуточного соединения. Синтез 25. 1-Метил-4-[N-(2-фтор-3-аминофенил)метиламино]пиперидин Смешивают 1-метил-4-[N-(2-фтор-3-бромфенил)метиламино]пиперидин (синтез 24, 0,42 г), бензофенонимин (0,303 г), Pd2(dba)3 (25 мг), рацемический BINAP (35 мг) и трет-бутоксид натрия (0,187 г) в толуоле (10 мл) и нагревают до кипения с обратным холодильником в течение 3 ч. Разбавляют реакционную смесь метанолом (5 мл), наносят на колонку SCX (10 г), промывают метанолом, элюируют 2 М NH3 в метаноле, выпаривают и далее очищают на колонке с силикагелем (10 г), используя градиент дихлорметана-2 М NH3 в метаноле, получая 0,44 г названного в заголовке промежуточного соединения.(20 мл) и нагревают в закрытой пробирке при 80C в течение 3 дней. Наносят на колонку SCX (10 г),промывают метанолом, элюируют 2 М NH3 в метаноле, выпаривают и далее очищают на колонке с силикагелем (35 г), используя градиент дихлорметана-2 М NH3 в метаноле, получая 0,50 г названного в заголовке промежуточного соединения в виде бесцветной маслянистой жидкости; масс-спектр (электрораспыление) m/z=271 (М+1); 1(0,182 г) в толуоле (10 мл) и нагревают до кипения с обратным холодильником в течение 3 дней. Разбавляют метанолом (5 мл), через 30 мин прибавляют 2 мл 5 н. HCl, наносят на колонку SCX (10 г), промывают метанолом, элюируют продукт 2 М NH3 в метаноле, выпаривают и очищают на колонке с силикагелем (35 г), используя градиент дихлорметана-2 М NH3 в метаноле, получая 39 мг названного в заголовке соединения; масс-спектр (электрораспыление) m/z=252 (М+1). Синтез 28. 1-Метил-4-[N-(3-нитро-5-фторфенил)метиламино]пиперидин(2,74 мл, 18,85 ммоль), ацетат натрия (2,45 г, 29,8 ммоль) и абсолютный этанол (10 мл) в закрытой пробирке. Нагревают и перемешивают при 100C в течение 16 ч. Охлаждают реакционную смесь до температуры окружающей среды и выливают в воду (100 мл). Экстрагируют этилацетатом (2100 мл). Промывают объединенные органические слои насыщенным водным раствором NaCl (100 мл), осушают над сульфатом натрия, фильтруют и концентрируют. Очищают остаток флэш-хроматографией на силикагеле,элюируя 10% (2 М NH3 в метаноле) в CH2Cl2, получая 0,06 г (1,4%) названного в заголовке промежуточного соединения; 1 Смешивают 1-метил-4-[N-(3-нитро-5-фторфенил)метиламино]пиперидин (синтез 28, 0,06 г,0,22 ммоль), железную пыль (0,06 г, 1,12 ммоль), метанол (5 мл) и 1 М HCl (0,22 мл, 0,22 ммоль), перемешивают и нагревают до кипения с обратным холодильником в течение 18 ч. Охлаждают реакционную смесь до температуры окружающей среды, разбавляют этилацетатом (50 мл) и прибавляют раствор 1 н. гидроксида натрия до щелочной реакции (pH 9). Отделяют органический слой, промывают насыщенным водным раствором NaCl, осушают над сульфатом натрия, фильтруют и концентрируют, получая 0,036 г(2,58 мл, 17,7 ммоль), 2,2'-бис-(дифенилфосфино)-1,1'-бинафтил (0,49 г, 0,79 ммоль), трет-бутоксид на- 20011274 трия (2,57 г, 27,58 ммоль) и толуол (100 мл), перемешивают и нагревают при 80C. Через 10 мин прибавляют Pd2(dba)3 (0,49 г, 0,79 ммоль). Через 3 ч при 80C охлаждают до температуры окружающей среды. Разбавляют этилацетатом (100 мл) и промывают водой (50 мл). Осушают органический слой над сульфатом натрия, фильтруют и концентрируют до маслянистой жидкости. Очищают остаток флэшхроматографией на силикагеле, элюируя 10% (2 М NH3-метанол) в CH2Cl2, получая 2,95 г (55%) названного в заголовке промежуточного соединения; 1 Смешивают 1-метил-4-[N-(3-бром-5-фторфенил)метиламино]пиперидин (синтез 30, 2,90 г,9,63 ммоль), бензофенонимин (1,94 мл, 11,55 ммоль), 2,2'-бис-(дифенилфосфино)-1,1'-бинафтил (0,24 г,0,39 ммоль), трет-бутоксид натрия (1,26 г, 13,48 ммоль) и толуол (60 мл), перемешивают и нагревают до 80C. Через 10 мин прибавляют Pd2(dba)3 (0,17 г, 0,19 ммоль). Через 3 ч при 80C охлаждают до температуры окружающей среды. Разбавляют этилацетатом (100 мл) и промывают водой (50 мл). Отделяют органический слой, осушают над сульфатом натрия, фильтруют и концентрируют. Растворяют этот материал в тетрагидрофуране (120 мл) и обрабатывают раствором 1 М водной хлористо-водородной кислоты(40 мл). После перемешивания при температуре окружающей среды в течение 1 ч прибавляют раствор 2 М гидроксида натрия до щелочной реакции (21 мл). Экстрагируют этилацетатом (2100 мл). Промывают органический слой насыщенным водным раствором NaCl (75 мл), осушают над сульфатом натрия,фильтруют и концентрируют до маслянистой жидкости. Очищают остаток флэш-хроматографией на силикагеле, элюируя 10% (2 М NH3 в метаноле) в CH2Cl2, получая 1,96 г (86%) названного в заголовке соединения. Синтез 32. 1,3-Диамино-5-фторбензол Прибавляют 1,3-дибром-5-фторбензол (5,078 г, 20 ммоль), бензофенонимин (8,700 г, 48 ммоль),Pd2(dba)3 (366 мг, 0,4 ммоль), BINAP (747 мг, 1,2 ммоль) и трет-бутоксид натрия (4,998 г, 52 ммоль) к толуолу (100 мл). Нагревают реакционную смесь при 80C в течение 15 ч. Гасят реакцию насыщенным раствором NaHCO3. Экстрагируют смесь этилацетатом три раза. Промывают объединенные органические слои насыщенным раствором NaCl, осушают над Na2SO4, фильтруют и концентрируют, получая остаток. Растворяют остаток в ТГФ (80 мл), прибавляют 5 н. HCl (14 мл) и перемешивают в течение 2 ч. Разбавляют реакционную смесь 0,1 н. HCl и экстрагируют этилацетатом/гексанами (1:2) два раза. Промывают объединенные органические слои один раз 0,1 н. HCl, смешивают водные слои, доводят до pH11 с помощью 5 н. NaOH. Экстрагируют мутную смесь CH2Cl2 три раза. Объединяют органические слои, осушают над Na2SO4, фильтруют и концентрируют, получая маслянистую жидкость оранжевого цвета. Очищают хроматографией на силикагеле, элюируя 30-60% этилацетата в гексанах, получая названное в заголовке промежуточное соединение в виде маслянистой жидкости желтого цвета (1,955 г, 77%); масс-спектр (ионное распыление): m/z=127,1 (М+1); 1(2,56 мл, 17,6 ммоль), а затем трет-бутоксид натрия (2,37 г, 24,6 ммоль). Нагревают реакционную смесь до 80C в течение 40 ч. Охлаждают реакционную смесь до комнатной температуры и разделяют между этилацетатом и водой. Отделяют органический слой и экстрагируют водный слой дихлорметаном(250 мл). Смешивают органические экстракты, осушают над MgSO4, фильтруют и концентрируют в вакууме. Загружают остаток на колонку SCX и промывают метанолом. Элюируют 2 М аммиаком в метаноле и концентрируют в вакууме. Далее очищают продукт хроматографией на колонке с силикагелем,используя градиент 2-10% (2 М NH3 в метаноле) в CH2Cl2, получая названное в заголовке промежуточное соединение (632 мг, 13%); масс-спектр (ионное распыление): m/z=286,0 (М+1); 1 Смешивают 1-метил-4-[N-(6-бромпиридинил)метиламино]пиперидин (1,02 г, 3,59 ммоль) (синтез 33), -BINAP (224 мг, 0,36 ммоль) и Pd2(dba)3 (164 мг, 0,18 ммоль) в толуоле (20 мл). Прибавляют к реакции бензофенонимин (723 мкл, 4,31 ммоль) и трет-бутоксид натрия (483 мг, 5,03 ммоль) и нагревают до 80C в течение 19 ч. Охлаждают реакционную смесь до комнатной температуры и разделяют между этилацетатом и водой. Отделяют органический слой и экстрагируют водный слой дихлорметаном(250 мл). Смешивают органические экстракты, осушают (MgSO4), фильтруют и концентрируют в вакууме. Растворяют остаток в 50 мл 1:1 ТГФ/H2O и обрабатывают 50 мл водной 1 н. HCl в течение 2 ч. Загружают раствор на колонку SCX и промывают поочередно 1:1 ТГФ/H2O, метанолом и, наконец, 2 М аммиаком в метаноле. Концентрируют основные промывные жидкости в вакууме и очищают остаток хроматографией на колонке с силикагелем, используя градиент 2-10% (2 NH3 в метаноле) в CH2Cl2, получая названное в заголовке промежуточное соединение (459 мг, 58%); масс-спектр (ионное распыление): m/z=221,2 (М+1). Анализ: Вычислено для C12H20N40,1CH2Cl2: C, 63,51; H, 8,90; N, 24,49. Найдено: C, 63,42; H, 8,56; N, 24,25. Синтез 35. 1-Метил-4-[N-(6-хлорпиридин-2-ил)метиламино]пиперидин Растворяют 1-метил-4-(метиламино)пиперидин (10 мл, 68,8 ммоль) в тетрагидрофуране (50 мл) и охлаждают до -78C. Медленно прибавляют к реакционной смеси н-бутиллитий (1,6 н. в гексане, 43 мл,68,8 ммоль) и перемешивают при -78C в течение 30 мин. Подогревают реакционную смесь до комнатной температуры и перемешивают в течение 30 мин. Затем охлаждают реакционную смесь до -78C и прибавляют 2,6-дихлорпиридин (11,2 г, 75,7 ммоль) в тетрагидрофуране (50 мл). Перемешивают реакционную смесь при -78C в течение 15 мин, подогревают до комнатной температуры, а затем нагревают до 60C в течение 19 ч. Охлаждают реакционную смесь до комнатной температуры и разделяют между этилацетатом и водой. Отделяют органический слой и экстрагируют водный слой дихлорметаном(250 мл). Объединяют органические экстракты, осушают (MgSO4), фильтруют и концентрируют в вакууме. Очищают остаток хроматографией на колонке с силикагелем, используя градиент 2-10% (2 М NH3 в метаноле) в CH2Cl2, получая названное в заголовке промежуточное соединение (11,91 г, 72%); масс-спектр (ионное распыление): m/z=240,1 (М+1); 1 Помещают 1-метил-4-[N-(6-хлорпиридин-2-ил)метиламино]пиперидин (синтез 35, 1,62 г,6,76 ммоль), -BINAP (420 мг, 0,68 ммоль) и Pd2(dba)3 (310 мг, 0,34 ммоль) в толуол (15 мл). Прибавляют к реакции бензофенонимин (1,36 мл, 8,11 ммоль) и трет-бутоксид натрия (910 мг, 9,46 ммоль) и нагревают до 80C в течение 20 ч. Охлаждают реакцию до комнатной температуры и разделяют между этилацетатом и водой. Отделяют органический слой и экстрагируют водный слой дихлорметаном(250 мл). Смешивают органические экстракты, осушают над MgSO4, фильтруют и концентрируют в вакууме. Загружают остаток на колонку SCX, промывают метанолом, элюируют 2 М аммиаком в метаноле и концентрируют в вакууме. Растворяют остаток в 50 мл 1:1 ТГФ/H2O и обрабатывают 50 мл 1 н.HCl в течение 2 ч. Загружают раствор на колонку SCX и промывают поочередно 1:1 ТГФ/H2O, метанолом и, наконец, 2 М аммиаком в метаноле. Концентрируют щелочные промывные жидкости в вакууме и очищают остаток хроматографией на колонке с силикагелем, используя градиент 2-10% (2 М NH3 в метаноле) в CH2Cl2, получая названное в заголовке промежуточное соединение (1,38 г, 93%); масс-спектр (ионное распыление): m/z=221,1 (М+1); 1 Смешивают триэтиламин (15,8 мл, 111,0 ммоль) и 2,6-диаминопиридин (6,5 г, 59,6 ммоль) в диоксане (200 мл). Прибавляют малыми порциями 4-фторбензоилхлорид (5,46 мл, 44,7 ммоль). После завершения прибавления перемешивают при комнатной температуре в течение 18 ч. Выливают в воду и разбавляют этилацетатом и водой. Отделяют и дважды экстрагируют водный слой CH2Cl2, объединяют органические фракции, осушают над MgSO4 и концентрируют. Хроматографируют на силикагеле, элюируя градиентом 0-10% (2 М NH3 в метаноле) в CH2Cl2, получая названное в заголовке промежуточное соединение (8,91 г, 86,3%); масс-спектр (ионное распыление): m/z=232,3 (М+1). Анализ: Вычислено для C12H10N3OF0,1H2O: C, 61,85; H, 4,41; N, 18,03. Найдено: C, 61,75; H, 4,08; N, 17,66. Синтез 38. N-(6-Аминопиридин-2-ил)-2-хлор-4-фторбензамид По способу, аналогичному синтезу 37, используя 2-хлор-4-фторбензоилхлорид, получают названное в заголовке промежуточное соединение в виде твердого вещества желтовато-коричневого цвета; масс-спектр (ионное распыление): m/z=266,2 (М+1). Анализ: Вычислено для C12H9N3OClF: C, 54,25; H, 3,41; N, 15,82. Найдено: C, 53,98; H, 3,23; N, 15,54. Синтез 39. трет-Бутиловый сложный эфир 4-[6-(4-фторбензоиламино)пиридин-2-иламино]пиперидин-1-карбоновой кислоты Помещают N-(6-аминопиридин-2-ил)-4-фторбензамид (синтез 37, 2 г, 8,3 ммоль) и 1-boc-4-пиперидон (15,0 г, 83 ммоль) в 1,2-дихлорэтан (20 мл). Перемешивают в течение 1 ч, затем прибавляют триацетоксиборгидрид натрия (4,38 г, 20,8 ммоль). После перемешивания в течение 36 ч гасят 1 н. NaOH и разбавляют CH2Cl2. Отделяют и экстрагируют водный слой дважды CH2Cl2, объединяют органические слои, осушают над MgSO4 и концентрируют. Разбавляют остаток в CH2Cl2 и наносят на две 10 г колонки SCX. Промывают колонку поочередно CH2Cl2, а затем метанолом. Элюируют продукт 2 МNH3 в метаноле) в CH2Cl2, получая названное в заголовке промежуточное соединение 3,11 г (90%); масс-спектр (ионное распыление): m/z=415,4 (М+1); т.пл. 82,7C. Синтез 40. трет-Бутиловый сложный эфир 4-[6-(2-хлор-4-фторбензоиламино)пиридин-2 иламино]пиперидин-1-карбоновой кислоты(синтез 38, 2,0 г, 7,5 ммоль), получают названное в заголовке промежуточное соединение в виде белого твердого вещества; масс-спектр (ионное распыление): m/z=449,4 (М+1); т.пл. 82,0C.(2,3 г, 37,0 ммоль) и перемешивают в течение 2 ч. Гасят реакцию 1 н. NaOH и разбавляют CH2Cl2. Отделяют и экстрагируют водный слой дважды CH2Cl2 и один раз смесью 3:1 CHCl3:изопропанол. Объединяют органические фракции, осушают над MgSO4 и концентрируют. Хроматографируют на силикагеле,элюируя градиентом 0-10% (2 М NH3 в метаноле) в CH2Cl2, получая названное в заголовке промежуточное соединение (0,97 г, 30,6%); масс-спектр (ионное распыление): m/z=429,4 (М+1); т.пл. 77,7C. Синтез 42. трет-Бутиловый сложный эфир 4-[6-(2-хлор-4-фторбензоиламино)пиридин-2 ил]метиламинопиперидин-1-карбоновой кислоты По способу, аналогичному синтезу 41, используя трет-бутиловый сложный эфир 4-[6-(2-хлор-4 фторбензоиламино)пиридин-2-иламино]пиперидин-1-карбоновой кислоты (синтез 40, 2,11 г, 4,6 ммоль),получают названное в заголовке промежуточное соединение в виде белого твердого вещества; масс-спектр (ионное распыление): m/z=463,3 (М+1); т.пл. 79,1C. Синтез 43. N-(6-Аминопиридин-2-ил)-2,4,6-трифторбензамид Смешивают 2,4,6-трифторбензоилхлорид (3,891 г, 20 ммоль), 2,6-диаминопиридин (6,548 г,60 ммоль) и диоксан (25 мл) и перемешивают в течение 1 ч при комнатной температуре с последующим нагреванием при 40C в течение ночи. Разбавляют реакционную смесь CH2Cl2 (100 мл) и промывают 0,1 н. раствором NaOH. Экстрагируют водный слой три раза CH2Cl2. Объединяют органические слои,осушают над Na2SO4, фильтруют и концентрируют до остатка. Хроматографируют на силикагеле, элюируя градиентом 40-50% этилацетата в гексанах, получая названное в заголовке промежуточное соединение (3,95 г, 74%); масс-спектр (ионное распыление): m/z=267,9 (М+1); 1 Растворяют 2,6-диаминопиридин (9,822 г, 90 ммоль) в диоксане (100 мл) и охлаждают до 0C. Медленно прибавляют ацетилхлорид (2,355 г, 2,1 мл, 30 ммоль) и перемешивают в течение 1 ч при 0C. Удаляют ледяную баню и перемешивают при комнатной температуре в течение ночи. Гасят реакционную смесь насыщенным раствором NaHCO3, экстрагируют три раза этилацетатом. Объединяют органические слои, осушают над Na2SO4, фильтруют и концентрируют, получая твердое вещество. Хроматография на силикагеле с элюированием градиентом 60-70% этилацетата в гексанах дает названное в заголовке промежуточное соединение (3,45 г, 76%); масс-спектр (ионное распыление): m/z=152,1 (М+1); 1 По способу, аналогичному синтезу 44, используя 2-хлорбензоилхлорид (875 мг, 5,0 ммоль), получают названное в заголовке промежуточное соединение в виде белого твердого вещества (1,172 г, 95%); масс-спектр (ионное распыление) m/z=247,9 (М+1); 1 По способу, аналогичному синтезу 44, используя 2-бромбензоилхлорид (1,097 г, 5,0 ммоль), получают названное в заголовке промежуточное соединение в виде белого твердого вещества (1,445 г, 99%); масс-спектр (ионное распыление): m/z=291,9 (М+1); 1 По способу, аналогичному синтезу 44, используя циклогексанкарбонилхлорид (733 мг, 5,0 ммоль),получают названное в заголовке промежуточное соединение в виде белого твердого вещества (1,137 г,100%); масс-спектр (ионное распыление): m/z=242,0 (M+Na); 1 Растворяют 2,6-диаминопиридин (1,3 г, 12 ммоль) в диоксане (30 мл). Прибавляют 2-хлор-6 фторбензоилхлорид (768 мг, 4 ммоль). Перемешивают в атмосфере азота (40C, 64 ч). Переносят реакционную смесь в этилацетат (150 мл). Промывают насыщенным раствором бикарбоната натрия (80 мл). Осушают над безводным сульфатом натрия. Удаляют растворитель при пониженном давлении и очищают хроматографией (силикагель, 10% этилацетат/гексаны), получая названное в заголовке промежуточное соединение (820 мг, выход 78%); масс-спектр (ионное распыление): m/z=266,0 (М+1). Синтез 49. N-(6-Аминопиридин-2-ил)-3-хлор-2,6-дифторбензамид По способу, аналогичному синтезу 48, используя 3-хлор-2,6-дифторбензоилхлорид (840 мг,4 ммоль), получают названное в заголовке промежуточное соединение (761 мг, выход 67%); масс-спектр (ионное распыление): m/z=284,0 (М+1). Синтез 50. N-(6-Аминопиридин-2-ил)-2,6-дифтор-3-метилбензамид По способу, аналогичному синтезу 48, используя 2,6-дифтор-3-метилбензоилхлорид (760 мг,4 ммоль), получают названное в заголовке промежуточное соединение (669 мг, выход 64%); масс-спектр (ионное распыление): m/z=264,1 (М+1). Синтез 51. N-(6-Аминопиридин-2-ил)-2,4-дифторбензамид(75 мл) и 2,6-дихлорбензоилхлорид (1,68 г, 8 ммоль, перемешивают при 25C в течение 16 ч), получают названное в заголовке промежуточное соединение (1,5 г, выход 66%); масс-спектр (ионное распыление): m/z=282,0 (М+1). Синтез 53. N-(6-Аминопиридин-2-ил)-2,6-дифторбензамид(75 мл) и 2,6-дифторбензоилхлорид (1,4 г, 8 ммоль) (перемешивают при 25C в течение 16 ч), получают названное в заголовке промежуточное соединение (1,5 г, выход 75%); масс-спектр (ионное распыление): m/z=250,1 (М+1). Синтез 54. N-(6-Аминопиридин-2-ил)-2,4-дихлорбензамид(80 мл) и 2,4,6-трихлорбензоилхлорид (1,95 г, 8 ммоль, перемешивают при 0-25C в течение 16 ч), получают названное в заголовке промежуточное соединение (1,0 г, выход 39%); масс-спектр (ионное распыление): m/z=316,0 (М+1). Примеры Пример 1. 2-Хлор-4-фтор-N-[3-(1-метилпиперидин-4-иламино)фенил]бензамида дигидрохлорид Смешивают 2-хлор-4-фтор-N-(3-аминофенил)бензамид (синтез 1, 200 мг, 0,756 ммоль),1-метилпиперидин-4-он (0,093 мл, 0,756 ммоль), триацетоксиборгидрид натрия (208 мг, 0,982 ммоль),уксусную кислоту (0,043 мл, 0,756 ммоль) и дихлорметан (8 мл). Перемешивают при комнатной температуре в течение ночи. Разбавляют дихлорметаном (5 мл) и промывают дважды гидроксидом натрия(10 мл, 1 н., водн.). Объединяют органические слои и промывают насыщенным водным NaCl (10 мл). Осушают над сульфатом магния, фильтруют под разрежением и концентрируют досуха. Очищают флэшхроматографией на картридж Biotage с двуокисью кремния, элюируя смесью 20/1 дихлорметана и 2 н. аммиака в метаноле, получая форму свободного основания названного в заголовке соединения (239 мг,87%). Растворяют остаток в диэтиловом эфире и обрабатывают эфирным раствором хлористого водорода. Растирают полученное смолистое вещество с эфиром, получая названное в заголовке соединение в виде белого твердого вещества (31 мг); т.пл. 180C; масс-спектр (свободное основание, ионное распыление): m/z=362,1 (М+1); 1- 26011274 Анализ: Вычислено для C19H23Cl3FN3O: C, 51,95; H, 5,39; N, 9,57. Найдено: C, 52,03; H, 5,46; N, 9,17. Альтернативно, к раствору 1-метил-4-(3-аминофениламино)пиперидина (92 г, 17 ммоль) и триэтиламина (156 мл, 39 ммоль) в сухом ТГФ (1 л) прибавляют по каплям 2-хлор-4-фторбензоилхлорид (3,6 г,18,6 ммоль) в атмосфере азота в течение 1 ч, поддерживая Тмас между 20 и 26C. Перемешивают суспензию при комнатной температуре в течение 1 ч. Гасят реакционную смесь водой (100 мл) и 30% NaOH(40 мл), получая двухфазный раствор (pH 8-9). Экстрагируют метил-трет-бутиловым эфиром (500 мл),промывают органический слой водой (100 мл), осушают над MgSO4 и концентрируют при пониженном давлении, получая 2-хлор-4-фтор-N-[3-(1-метилпиперидин-4-иламино)фенил]бензамид в виде аморфного твердого вещества. Суспендируют твердое вещество в метил-трет-бутиловом эфире (400 мл) и кипятят смесь с обратным холодильником в течение 2 ч. Охлаждают смесь до комнатной температуры, прибавляют циклогексан (100 мл) и метил-трет-бутиловый эфир (250 мл). Фильтруют полученные кристаллы,промывают метил-трет-бутиловым эфиром (160 мл) и высушивают при пониженном давлении при 50C в течение ночи, получая 2-хлор-4-фтор-N-(3-(1-метилпиперидин-4-иламино)фенил)бензамид в виде белого порошка (123 г, выход 76%). Пример 1A. 2-Хлор-4-фтор-N-[3-(1-метилпиперидин-4-иламино)фенил]бензамид, соль фумаровой кислоты. Фумаровую кислоту (170 мг; 1,46 ммоль) прибавляют к суспензии 2-хлор-4-фтор-N-[3-(1 метилпиперидин-4-иламино)фенил]бензамида (свободное основание по примеру 1, 500 мг, 1,38 ммоль) в изопропаноле (5 мл) при комнатной температуре. Суспензию нагревают при температуре кипения с обратным холодильником в течение 1 ч, охлаждают до комнатной температуры и продолжают перемешивать в течение 2 ч. Кристаллы фильтруют, промывают изопропанолом (20,5 мл) и высушивают при пониженном давлении при 40C, получая белое твердое вещество (665 мг, выход 100%). Эти кристаллы(100 мг; 0,21 ммоль) ресуспендируют в воде (1 мл) и перемешивают при комнатной температуре. Примерно через 5 мин после перемешивания суспензия превращается в гомогенный раствор оранжевого цвета, после чего появляются мелкие кристаллы (примерно через 10 мин). Смесь оставляют при перемешивании на ночь. Суспензию затем фильтруют, твердое вещество промывают водой (0,1 мл) и высушивают при пониженном давлении, получая названное в заголовке соединение в виде твердого вещества чисто белого цвета (76 мг, выход 76%). Пример 2. 2-Хлор-4-фтор-N-3-[N-циклопропилкарбонил-N-(1-метилпиперидин-4-ил)амино]фенилбензамида гидрохлорид(пример 1, 48 мг, 0,134 ммоль), диоксан (1 мл) и циклопропилкарбонилхлорид (0,013 мл, 0,148 ммоль). Встряхивают и нагревают (106C) в устройстве J-Kem Reaction Block в течение 2 ч. Загружают на колонку SCX (Varian) и элюируют 2 М аммиаком в метаноле, получая форму свободного основания названного в заголовке соединения (54 мг, 93%). После получения соли по методике, аналогичной описанной в примере 1, получают названное в заголовке соединение в виде белого твердого вещества (47 мг); т.пл. 133-136C; масс-спектр (свободное основание, ионное распыление): m/z=430,1 (М+1); 1 По способу, аналогичному примеру 2, используя циклобутилкарбонилхлорид (0,017 мл,0,148 ммоль), получают названное в заголовке соединение в виде белого твердого вещества (свободное По способу, аналогичному примеру 1, используя 2-хлор-6-фтор-N-(3-аминофенил)бензамид (синтез 2, 300 мг, 1,133 ммоль), получают названное в заголовке соединение в виде белого твердого вещества По способу, аналогичному примеру 1, используя 2,6-дифтор-N-(3-аминофенил)бензамид (синтез 3,300 мг, 1,208 ммоль), получают названное в заголовке соединение в виде белого твердого вещества (свободное основание, 355 мг, 85%; дигидрохлорид 411 мг); т.пл. 198 С (разл.); масс-спектр (свободное основание, ионное распыление): m/z=346,0 (М+1); 1 По способу, аналогичному примеру 1, используя 2,4-дифтор-N-(3-аминофенил)бензамид (синтез 4,307 мг, 1,236 ммоль), получают названное в заголовке соединение в виде белого твердого вещества (свободное основание 394 мг, 92%; дигидрохлорид 394 мг); т.пл. 262C (разл.); масс-спектр (свободное основание, ионное распыление): m/z=346,0 (М+1); 1- 28011274 По способу, аналогичному примеру 1, используя 2,4,6-трифтор-N-(3-аминофенил)бензамид (синтез 5, 290 мг, 1,089 ммоль), получают названное в заголовке соединение в виде белого твердого вещества По способу, аналогичному примеру 1, используя 2-бром-N-(3-аминофенил)бензамид (синтез 6,304 мг, 1,044 ммоль), получают названное в заголовке соединение в виде белого твердого вещества (свободное основание 377 мг, 93%; дигидрохлорид 395 мг); т.пл. 192-193C; масс-спектр (свободное основание, ионное распыление): m/z=388,1 (М+1); 1 По способу, аналогичному примеру 1, используя 2-хлор-N-(3-аминофенил)бензамид (синтез 7,300 мг, 1,216 ммоль), получают названное в заголовке соединение в виде белого твердого вещества (свободное основание 331 мг, 79%; дигидрохлорид 333 мг); т.пл. 206-208C; масс-спектр (свободное основание, ионное распыление): m/z=344,0 (М+1); 1(синтез 8, 300 мг, 1,013 ммоль), получают названное в заголовке соединение в виде белого твердого вещества (свободное основание 274 мг, 69%; дигидрохлорид 325 мг); т.пл. 159-162C; масс-спектр (свободное основание, ионное распыление): m/z=394,2 (М+1); 1 Смешивают 1-метил-4-[N-(3-аминофенил)-N-метиламино]пиперидин (синтез 11, 101 мг,0,307 ммоль), дихлорметан (6 мл) и пиридин (0,125 мл, 1,535 ммоль) при 0C. Прибавляют неразбавленный 2,6-дифторбензоилхлорид (0,048 мл, 0,384 ммоль) и продолжают перемешивание в течение 1 ч. Разбавляют дихлорметаном (5 мл) и промывают гидроксидом натрия (1 н., водн., 28 мл). Объединяют органические слои, осушают над сульфатом магния, фильтруют под разрежением и концентрируют досуха. Очищают флэш-хроматографией, элюируя смесью 20/1 дихлорметана/(2 н. аммиака в метаноле), получая форму свободного основания названного в заголовке соединения (88 мг, 80%). После приготовления соли по способу, аналогичному описанному в примере 1, получают названное в заголовке соединение в виде твердого вещества желтого цвета (89 мг); масс-спектр (свободное основание, ионное распыление): m/z=360,1 (М+1); 1(2,0 М в метаноле), получая соответствующее свободное основание. Концентрируют досуха. Растворяют полученную бурую маслянистую жидкость в диоксане (2 мл) и делят раствор на две аликвоты (21 мл). К одной из аликвот прибавляют диоксан (1 мл). Прибавляют неразбавленный 2,4,6-трифторбензоилхлорид(0,052 мл, 0,401 ммоль). Встряхивают и нагревают при 106,5C в течение 2 ч. Охлаждают до температуры окружающей среды и загружают в колонку SCX (картридж 1 г, Varian). Элюируют аммиаком (2,0 М в метаноле). Очищают далее методом флэш-хроматографии, используя смесь 20/1 дихлорметана и 2,0 М аммиака в метаноле, получая форму свободного основания названного в заголовке соединения (86 мг,62%). Используя способ образования соли, аналогичный примеру 1, получают названное в заголовке соединение в виде белого твердого вещества (99 мг); т.пл. 199-200C; масс-спектр (свободное основание, ионное распыление): m/z=378,2 (М+1); 1
МПК / Метки
МПК: A61K 31/4436, C07D 211/58, C07D 401/06, C07D 401/14, C07D 401/12, A61K 31/4409, A61P 25/06, A61K 31/4439, A61K 31/444
Метки: замещенные, 2-карбониламино-6-пиперидинаминопиридины, агонисты, 1-карбониламино-3-пиперидинаминобензолы, 5-ht1f
Код ссылки
<a href="https://eas.patents.su/30-11274-zameshhennye-2-karbonilamino-6-piperidinaminopiridiny-i-zameshhennye-1-karbonilamino-3-piperidinaminobenzoly-kak-agonisty-5-ht1f.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные 2-карбониламино-6-пиперидинаминопиридины и замещенные 1-карбониламино-3-пиперидинаминобензолы как агонисты 5-ht1f</a>
Следующий патент: Суточная дозированная единица комплекса этинилэстрадиол- циклодекстрин
Случайный патент: Замещенные производные морфолина и тиоморфолина












