Пиридиноилпиперидины как агонисты 5-нт1f
Номер патента: 7966
Опубликовано: 27.02.2007
Авторы: Лян Сидни Си, Виктор Франтц, Захерл Деанна Пиатт, Сюй Яо-Чан, Ин Бай-Пин, Кохен Майкл Филип, Манкюзо Венсан, Кольман Дэниел Тимоти, Чжан Дэи
Формула / Реферат
1. Соединение формулы I
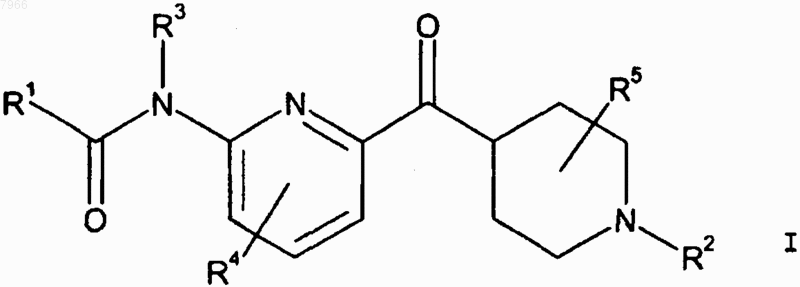
или его фармацевтически приемлемая аддитивная соль кислоты,
где R1 означает С1-С6алкил, замещенный С1-С6алкил, С3-С7циклоалкил, замещенный С3-С7циклоалкил, С3-С7циклоалкилС1-С3алкил, замещенный С3-С7циклоалкилС1-С3алкил, фенил, замещенный фенил, гетероцикл или замещенный гетероцикл;
R2 означает водород, С1-С3алкил, С3-С6циклоалкилС1-С3алкил или группу формулы II
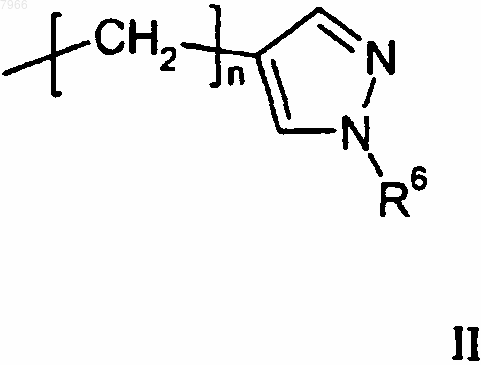
R3 означает водород или С1-С3алкил;
R4 означает водород, галоген или С1-С3алкил;
R5 означает водород или С1-С3алкил;
R6 означает водород или С1-С6алкил, и
n равно целому числу от 1 до 6 включительно.
2. Соединение по п.1, в котором R5 означает водород и R4 означает водород или галоген.
3. Соединение по п.2, в котором R4 означает водород.
4. Соединение по любому из пп.1-3, в котором R2 означает водород или C1-С3алкил.
5. Соединение по любому из пп.1-4, в котором R1 означает фенил, замещенный фенил, гетероцикл или замещенный гетероцикл.
6. Соединение по любому из пп.1-5, в котором R1 означает фенил, замещенный фенил, гетероцикл или замещенный гетероцикл, при этом гетероциклический фрагмент выбран из группы, состоящей из фуранила, тиофенила, пирролила, пирролидинила, пиридинила, N-метилпирролила, оксазолила, изоксазолила, пиразолила, имидазолила, триазолила, оксадиазолила, тиадиазолила, тиазолила, тиазолидинила, N-ацетилтиазолидинила, пиримидинила, пиразинила, пиридазинила, изохинолинила, бензоксазолила, бензодиоксолила, бензотиазолила, хинолинила, бензофуранила, бензотиофенила и индолила, и где термин "замещенный", в контексте циклического фрагмента, означает замещенный одним-тремя галогеновыми заместителями; или замещенный одним-двумя заместителями, независимо выбранными из группы, состоящей из галогена, С1-С4алкила, С1-С4алкокси и С1-С4алкилтио, где каждый из указанных алкильного, алкокси и алкилтио заместителей может быть далее независимо замещен С1-С2алкокси или одной-пятью галогеновыми группами, каждая из которых независимо выбрана из атомов фтора и атома хлора; или замещенный одним заместителем, выбранным из группы, состоящей из фенилокси, бензилокси, фенилтио, бензилтио и пиримидинилокси, где фенилокси, бензилокси, фенилтио, бензилтио или пиримидинилокси фрагмент может быть далее замещен одним-двумя заместителями, выбранными из группы, состоящей из галогена, С1-С2алкила и С1-С2алкокси; или замещенный одним заместителем, выбранным из группы, состоящей из С1-С4ацила и С1-С4алкоксикарбонила, и далее замещенным заместителем в количестве от нуля до одного, выбранным из группы, состоящей из галогена, С1-С4алкила, С1-С4алкокси и С1-С4алкилтио.
7. Соединение по п.6, в котором R1 означает фенил, замещенный фенил, гетероцикл или замещенный гетероцикл, где указанный гетероциклический фрагмент выбран из группы, состоящей из пиридинила, индолила, бензофуранила, фуранила, тиофенила, бензодиоксолила и тиазолидинила, и где термин "замещенный", в контексте циклического фрагмента, означает замещенный одним-тремя галогеновыми заместителями; или замещенный одним-двумя заместителями, независимо выбранными из группы, состоящей из галогена, С1-С4алкила, С1-С4алкокси и С1-С4алкилтио, где каждый алкильный, алкокси и алкилтио заместитель может быть далее замещен независимо С1-С2алкокси или одной-пятью галогеновыми группами, каждая из которых независимо выбрана из атома фтора и атома хлора; или замещенный одним заместителем, выбранным из группы, состоящей из фенилокси, бензилокси, фенилтио, бензилтио и пиримидинилокси, где указанный фенилокси, бензилокси, фенилтио, бензилтио и пиримидинилокси фрагмент может быть далее замещен одним-двумя заместителями, выбранными из группы, состоящей из галогена, С1-С2алкила и С1-С2алкокси; или замещенный одним заместителем, выбранным из группы, состоящей из С1-С4ацила и С1-С4алкоксикарбонила, и замещенным далее заместителем в количестве от нуля до одного, выбранным из группы, состоящей из галогена, С1-С4алкила, С1-С4алкокси и С1-С4алкилтио.
8. 2,4,6-Трифтор-N-[6-(1-метилпиперидин-4-илкарбонил)пиридин-2-ил]бензамид, его фармацевтически приемлемая аддитивная соль кислоты.
9. Полусукцинатная соль 2,4,6-трифтор-N-[6-(1-метилпиперидин-4-илкарбонил)пиридин-2-ил]бензамида.
10. Гидрохлоридная соль 2,4,6-трифтор-N-[6-(1-метилпиперидин-4-илкарбонил)пиридин-2-ил]бензамида.
11. Фармацевтическая композиция, включающая соединение по любому из пп.1-10 и фармацевтический носитель, разбавитель или эксципиент.
12. Применение соединения по любому из пп.1-10 при производстве лекарственного средства, применяемого для активации 5-HT1F рецепторов у млекопитающего.
13. Применение соединения по любому из пп.1-10 при производстве лекарственного средства, применяемого для ингибирования экстравазации нейронного белка у млекопитающего.
14. Применение соединения по любому из пп.1-10 при производстве лекарственного средства, применяемого при лечении и профилактике мигрени у млекопитающего.
15. Применение соединения по любому из пп.1-10 при производстве лекарственного средства, применяемого при лечении расстройства, связанного с дисфункцией 5-HT1F рецепторов у млекопитающего.
16. Применение по п.15, отличающееся тем, что связанное с 5-HT1F рецептором расстройство представляет собой экстравазацию нейронного белка.
17. Применение по п.15, отличающееся тем, что связанное с 5-HT1F рецептором расстройство представляет собой мигрень.
18. Применение по любому из пп.12-17, отличающееся тем, что указанным млекопитающим является человек.
19. Способ получения 2-галоген-6-(пиперидин-4-карбонил)пиридинового соединения формулы III
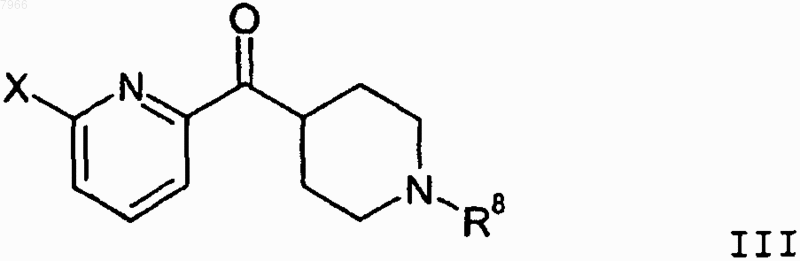
где X означает атом брома или хлора;
R8 означает защитную группу для аминогруппы, С1-С6алкил, С3-С6циклоалкилС1-С3алкил или группу формулы II
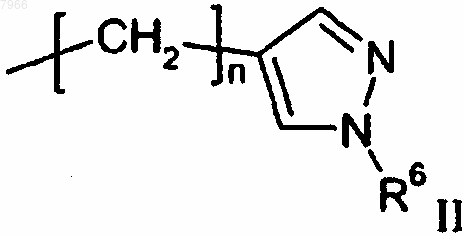
R6 означает водород или С1-С6алкил, и
n равно целому числу от 1 до 6 включительно,
включающий
1) взаимодействие 2,6-дигалогенпиридина, выбранного из 2,6-дибромпиридина и 2,6-дихлорпиридина, с н-бутиллитием с получением 2-галоген-6-литийпиридина, и затем
2) взаимодействие 2-галоген-6-литийпиридина с замещенным аминокарбонилпиперидиновым соединением формулы IV
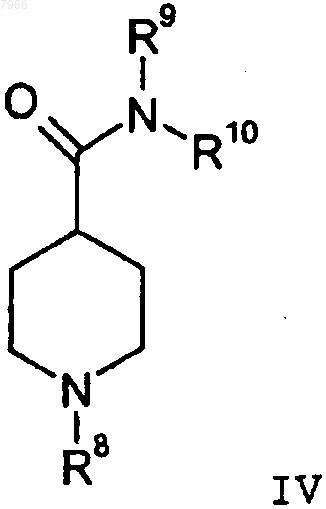
где R9 и R10 каждый означает метил или R9 и R10 вместе с атомом азота, к которому они присоединены, объединены с образованием азетидинила, пирролидинила или пиперидинила.
20. Способ по п.19, отличающийся тем, что X означает бром и 2,6-дигалогенпиридином является 2,6-дибромпиридин.
21. Способ по любому из пп.19 или 20, отличающийся тем, что R9 и R10 каждый означает метшы.
22. Способ по любому из пп.19 или 20, отличающийся тем, что R9 и R10 вместе с атомом азота, к которому они присоединены, объединены с образованием пирролидинила.
23. Способ по любому из пп.19-22, отличающийся тем, что растворитель на стадии 2) представляет собой метил-трет-бутиловый эфир.
24. Способ по любому из пп.19-23, отличающийся тем, что растворитель на стадии 2) представляет собой толуол.
25. Способ получения 2-бром-6-(пиперидин-4-карбонил)пиридинового соединения формулы III
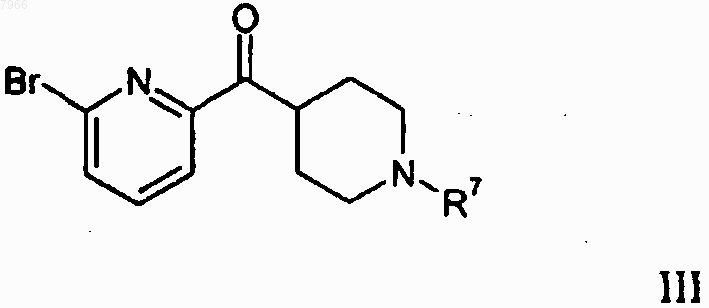
где R7 означает С1-С3 н-алкил или защитную группу для аминогруппы,
включающий взаимодействие 2,6-дибромпиридина с н-бутиллитием с образованием 2-бром-6-литийпиридина и с последующим взаимодействием 2-бром-6-литийпиридина с 4-(N,N'-диметиламино)карбонилпиперидиновым соединением формулы IV
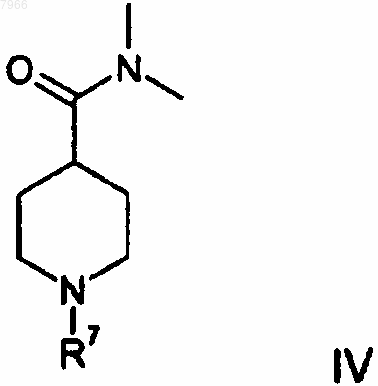
в метил-трет-бутиловом эфире в качестве растворителя.
Текст
007966 Предпосылки создания изобретения До последнего времени теории, касающиеся патофизиологии мигрени, начиная с 1938 года, в основном, базировались на работе Грэхема и Вольффа (Graham and Wolff. Arch. Neurol. Psychiatry, 39:73763, 1938). Указанные авторы предположили, что причиной головной боли по типу мигрени является вазодилатация внечерепных сосудов. Данная точка зрения поддерживалась тем, что алкалоиды спорыньи и суматриптан, гидрофильный агонист 5-HT1, которые не проходят через гематоэнцефалический барьер,индуцируют сокращение гладких мышц сосудов головы и эффективны при лечении мигрени (Humphrey,et al., Ann. NY Acad. Sci., 600:587-600, 1990). Однако последние работы Московитца показали, что развитие головной боли по типу мигрени не зависит от изменений диаметра сосудов (Moskowitz, Cephalalgia,12:5-7, 1992). Московитц предположил, что неизвестные в настоящее время запускатели боли стимулируют ганглии тройничного нерва, которые иннервируют кровеносную сеть в ткани головы, приводя к высвобождению вазоактивных нейропептидов из аксонов сосудистой сети. Указанные высвобождаемые нейропептиды затем активируют цепь событий, следствием которых является боль. Такое нейрогенное воспаление блокируется суматриптаном и алкалоидами спорыньи через механизмы, включающие участие 5-НТ рецепторов, которые, как считается, тесно связаны с подтипом рецепторов 5-HT1D, расположенных на волокнах сосудов в области тройничного нерва (Neurology, 43 (suppl. 3):S16-S20 1993). Суматрипан фактически обладает активностью в отношении рецепторов 5-HT1B и 5-HT1D, со значениями Ki=10,3 нМ и 5,1 нМ, соответственно, причем указанная активность может быть показателем сосудосуживающей активности. Суматрипан и родственные соединения, которые раньше предполагалось использовать для лечения мигрени, были выбраны на основе такой сосудосуживающей активности, которая соответствовала доминировавшим на достигнутом уровне техники моделям развития мигрени. Серотонин (5-НТ) демонстрирует разнообразную физиологическую активность, опосредованную по меньшей мере семью классами рецепторов, наиболее гетерогенным из которых является, по-видимому,5-HT1. Человеческий ген, который экспрессирует один из таких подтипов 5-HT1 рецепторов, названный 5-HT1F, был выделен Као с соавт. (Као and coworkers. Proc. Natl. Acad. Sci. USA, 90:408-412, 1993). Данный рецептор 5-HT1F демонстрирует фармакологический профиль, отличающийся от профиля любого описанного ранее серотонергического рецептора. Было обнаружено, что суматриптан в дополнение к указанной выше выраженной афинности в отношении 5-HT1B и 5-НТ 1D рецепторам, также обладает афинностью в отношении данного подтипа рецептора со значением Ki, равным примерно 23 нМ. Такая картина предполагает возможную роль рецептора 5-HT1F в развитии мигрени. Впоследствии было разработано множество агонистов рецептора 5-HT1F, которые, как было показано, характеризуются относительной селективностью в отношении 5-HT1F подкласса рецептора, и было показано, что такая селективность позволяет, в основном, снижать сосудосуживающую активность, характерную для других соединений, рассматриваемых в контексте возможного использования в качестве средств для лечения мигрени и связанных с нею расстройств. В число указанных агонистов 5-HT1F рецептора входят соединения, описанные в приведенных ниже документах: патенты США 5708187 и 5814653, описывающие семейство 6-замещенных-3-амино(алкил)тетрагидрокарбазолов и 7-замещенных-4-амино(алкил)циклогепта[7,6-b]индолов; патенты США 5521196, 5721252, 5521197 и WO 96/29075, описывающие различные семейства 5 замещенных пиперидин-3-илиндолов и 5-замещенных 1,2,3,6-тетрагидропиридин-3-илиндолов;WO 98/20875 и WO 99/25348, описывающие два семейства 5-замещенных пиперидин-3 илазаиндолов и 5-замещенных 1,2,3,6-тетрагидропиридин-3-илазаиндолов;WO 98/15545, описывающий выбранное семейство 3,5-дизамещенных индолов и бензофуранов;WO 00/34266, описывающий семейство 3-гетероарил-5-[2-(арил или гетероарил)-2-оксоэтил]индолов. Последующее изучение неожиданно привело к открытию нового и неожиданного класса селектив-1 007966 ных агонистов 5-HT1F, обладающих особыми химическими свойствами и способностью к связыванию с рецептором, которые ингибируют экстравазацию пептидов, что позволяет избежать развития существенной сосудосуживающей активности, и в этой связи, полезных для лечения мигреней и других расстройств, связанных с 5-HT1F рецептором. Кроме того, соединения по настоящему изобретению обладают лучшей растворимостью, что делает их более приемлемыми для применения в предпочтительных композициях, таких как сублингвальные, трансбуккальные и/или назальные композиции. Краткое описание изобретения Настоящее изобретение относится к пиридиноилпиперидиновым соединениям общей формулы I и их фармацевтически приемлемым аддитивным солям кислоты, гдеR1 означает C1-С 6 алкил, замещенный С 1-С 6 алкил, С 3-С 7 циклоалкил, замещенный С 3-С 7 циклоалкил,С 3-С 7 циклоалкилС 1-С 3 алкил, замещенный С 3-С 7 циклоалкилС 1-С 3 алкил, фенил, замещенный фенил, гетероцикл или замещенный гетероцикл;R2 означает C1-С 3 алкил, C3-С 6 циклоалкилC1-С 3 алкил или группу формулы IIR3 означает водород или C1-С 3 алкил;R5 означает водород или C1-С 3 алкил;R6 означает водород или C1-С 6 алкил; иn равно целому числу от 1 до 6 включительно. В одном предпочтительном варианте настоящее изобретение относится к пиридиноилпиперидиновым соединениям общей формулы I и их фармацевтически приемлемым аддитивным солям кислоты, гдеR1 означает фенил, замещенный фенил, гетероцикл или замещенный гетероцикл;R2 означает водород или С 1-С 2 алкил;R3 означает водород или метил, иR4 и R5 означают оба водород. Другими предпочтительными соединениями являются такие соединения формулы I, в которой R3 означает водород. Настоящее изобретение относится также к фармацевтическим композициям, включающим соединения формулы I или его фармацевтически приемлемую аддитивную соль кислоты и фармацевтический носитель, разбавитель или эксципиент. В предпочтительных вариантах осуществления данного аспекта изобретения предлагаются фармацевтические композиции, содержащие соединения формулы I или его фармацевтически приемлемую соль, адаптированные для активации 5-HT1F рецепторов для ингибирования экстравазации нейронного белка при лечении или профилактике мигрени и/или лечения или профилактике тревожного состояния у млекопитающих, в частности у человека. Кроме того, настоящее изобретение относится к способу активации 5-HT1F рецепторов у млекопитающих, в частности у человека, включающему введение млекопитающему, при необходимости такой активации, эффективного количества соединения формулы I или его фармацевтически приемлемой аддитивной соли кислоты. Кроме того, настоящее изобретение относится к способу, в частности у человека, включающему введение млекопитающему, при необходимости такого ингибирования, эффективного количества соединения формулы I или его фармацевтически приемлемой аддитивной соли кислоты. Дополнительно настоящее изобретение относится к способу лечения или профилактики мигрени у млекопитающих, в частности у человека, включающему введение млекопитающему, при необходимости такого лечения или такой профилактики, эффективного количества соединения формулы I или его фар-2 007966 мацевтически приемлемой аддитивной соли кислоты. Дополнительно настоящее изобретение относится к способу лечения тревожного состояния у млекопитающих, в частности у человека, включающему введение млекопитающему, при необходимости такого лечения или такой профилактики, эффективного количества соединения формулы I или его фармацевтически приемлемой аддитивной соли кислоты. В другом аспекте настоящее изобретение относится к соединению формулы I или его фармацевтически приемлемой аддитивной соли кислоты, предназначенных для активации рецептора 5-HT1F в процессе ингибирования экстравазации нейронного белка при лечении или профилактике мигрени и/или при лечении тревожного состояния у млекопитающих, в частности у человека. Таким образом, настоящее изобретение относится к применению соединения формулы I в качестве лекарственного средства для активации 5-HT1F рецептора для ингибирования экстравазации нейронного белка при лечении или профилактике мигрени и/или лечения тревожного состояния у млекопитающих, в частности у человека. Дополнительно настоящее изобретение относится к применению одного или более соединений формулы I при производстве лекарственного средства, предназначенного для активации 5-HT1F рецептора в процессе ингибирования экстравазации нейронного белка при лечении или профилактике мигрени и/или при лечении тревожного состояния у млекопитающих, в частности у человека. Кроме того, настоящее изобретение относится к способам лечения заболеваний, опосредованных 5HT1F, включающим введение млекопитающим, при необходимости такого лечения, в частности человеку, эффективного количества соединения формулы I или его фармацевтически приемлемой аддитивной соли кислоты. В другом аспекте настоящего изобретения предлагается способ синтеза соединений формулы I и новых промежуточных соединений, образуемых в процессе данного синтеза. В одном варианте настоящего изобретения предлагается способ получения 2-галоген-5-(пиперидин-4-карбонил)пиридинового соединения формулы III где X означает бром или хлор;R8 означает защитную группу для амино, C1-С 3 алкил, С 3-С 6 циклоалкилС 1-С 3 алкил или группу формулы IIR6 означает водород или С 1-С 6 алкил, иn равно целому числу от 1 до 6 включительно; включающий: 1) взаимодействие 2,6-дигалогенпиридина, выбранного из группы, состоящей из 2,6-дибромпиридина и 2,6-дихлорпиридина, с н-бутиллитием с образованием 2-галоген-6-литийпиридина и затем 2) взаимодействие 2-галоген-6-литийпиридина с замещенным аминокарбонилпиперидиновым соединением формулы IV где R9 и R10 каждый означает метил или R9 и R10 вместе с атомом азота, к которому они присоединены,образуют азетидинил, пирролидинил или пиперидинил. В конкретном варианте осуществления данного аспекта настоящего изобретения предлагается способ получения 2-бром-6-(пиперидин-4-карбонил)пиридинового соединения формулы III где R7 означает С 1-С 3 н-алкил или защитную группу для амино; в метил-трет-бутиловом эфире в качестве растворителя. Подробное описание изобретения Один вариант настоящего изобретения относится к способу повышения активации 5-HT1F рецепторов при устранении сосудосуживающей активности для лечения множества заболеваний, которые связаны со снижением нейротрансмиссии серотонина у млекопитающих. К числу указанных расстройств относятся мигрень, общий болевой синдром, невралгия тройничного нерва, зубная боль или боль при дисфункции сустава нижней челюсти, тревога, генерализованное тревожное расстройство, паническое расстройство, депрессия, расстройство сна, синдром хронической усталости, предменструальный синдром или синдром поздней лютеиновой фазы, посттравматический синдром, потеря памяти, деменция, включая возрастную деменцию, социальные фобии, аутизм, дефицит внимания, гиперактивные расстройства, расстройства разрушительного поведения, расстройства импульсивного контроля, пограничное личностное расстройство, навязчиво-компульсивное расстройство,ускоренная эоякуляция, эректильная дисфункция, булимия, нервно-психическая анорексия, алкоголизм,злоупотребление табаком, мутизм и трихориптомания. Соединения по настоящему изобретению также полезны для профилактического лечения мигрени. Любой из указанных способов включает применения соединения формулы I. Те заболевания, для которых установлено и зафиксировано в классификациях, что они могут подвергаться лечению агонистами серотонина, могут быть выявлены с помощью соответствующих систем классификации заболеваний, опубликованных в различных источниках. Так, например, четвертое издание руководства по диагностике и статистике ментальных расстройств, изданное Американской Психиатрической Ассоциацией (DSM-IV) (1994, American Psychiatric Association, Washington, D.C.) предлагает диагностическое средство для идентификации многих расстройств из числа, описанных в настоящем изобретении. Кроме того, в Международной Классификации Заболеваний (десятое переработанное издание (ICD-10 дается классификация многих описанных в настоящем изобретении расстройств. Для специалиста в данной области очевидно, что имеются альтернативные номенклатуры, нозологии и системы классификации приведенных заболеваний и расстройств, включая таковые, описанные в DSM-IV и ICD-10,и что терминология и системы классификации эволюционируют вместе с прогрессом медицинской науки. Все случаи применения соединения формулы I для активации 5-HT1F рецептора в процессе ингибирования экстравазации нейронного пептида, в общем случае или конкретно, благодаря стимуляции тройничного нерва и/или при лечении любого расстройства из числа описанных выше, являются вариантами осуществления настоящего изобретения. Аналогично, все виды применения соединения формулы I или сочетания, включающего более одного соединения формулы I, при производстве лекарственного средства для активации 5-HT1F рецептора в процессе ингибирования экстравазации нейронного пептида, в общем случае или конкретно, благодаря стимуляции тройничного нерва и/или для лечения любого расстройства из числа описанных выше, также являются вариантами осуществления настоящего изобретения. Основные химические термины, используемые в описании, имеют их обычные значения. Так, например, термин алкил относится к разветвленной или неразветвленной насыщенной углеводородной группе. Термин н-алкил относится к неразветвленной алкильной группе. Термин Сх-Суалкил относится к алкильной группе, имеющей от х до у атомов углерода, включительно, в составе разветвленной или неразветвленной углеводородной группы. В качестве иллюстрации, но без ограничения, следует отметить, что термин С 1-С 4 алкил относится к линейному или разветвленному углеводородному фрагменту, содержащему от 1 до 4 атомов углерода, включая метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Термин С 1-С 4 н-алкил относится к линейным углеводородным фрагментам, содержащим от 1 до 4 атомов углерода, включая метил, этил, н-пропил и н-бутил. Термин С 3 С 6 циклоалкил относится к циклопропилу, циклобутилу, циклопентилу и циклогексилу. Термин С 3 С 7 циклоалкил также включает циклогептил. Циклоалкилалкил относится к циклоалкильным фрагментам, соединенным через алкильную связующую цепь, таким как, например, но без ограничения, циклопропилметил, циклопропилэтил, циклопропилпропил, циклопропилбутил, циклобутилметил, циклобутилэтил, циклобутилпропил, циклопентилметил, циклопентилэтил, циклопентилпропил, циклогексилметил, циклогексилэтил и циклогексипропил. Каждая из алкильной, циклоалкильной и циклоалкилалкиль-4 007966 ной групп может быть необязательно замещена, как указано в настоящем описании. Термины алкокси, фенилокси, бензокси и пиримидинилокси относятся к алькильной группе, фенильной группе, бензильной группе или пиримидинильной группе, соответственно, каждая из которых может быть необязательно замещена, причем каждая присоединена через атом кислорода. Термины алкилтио, фенилтио и бензилтио относятся к алкильной группе, фенильной группе,бензильной группе, соответственно, каждая из которых может быть необязательно замещена, и каждая присоединена через атом серы. Термин C1-С 6 ацил относится к формильной группе или C1-С 3 алкильной группе, соединенной с карбонильным фрагментом. Термин С 1-С 4 алкоксикарбонил относится к С 1-С 4 алкоксигруппе, соединенной с карбонильным фрагментом. Термин галоген относится к атому фтора, хлора, брома или иода. Предпочтительными галогеновыми группами являются атомы фтора, хлора и брома. Более предпочтительными галогеновыми группами являются атомы фтора и хлора. Термин гетероцикл в контексте настоящего описания означает насыщенное или ненасыщенное 5 или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из атома азота, кислорода и серы,причем указанное кольцо может быть необязательно конденсировано с бензолом. Примеры гетероциклов, приемлемых для достижения целей настоящего изобретения, включают фуранил, тиофенил (тиенил), пирролил, пирролидинил, пиридинил, N-метилпирролил, оксазолил, изоксазолил, пиразолил, имидазолил, триазолил, оксадиазолил, тиадиазолил, тиазолил, тиазолидинил, N-ацетилтиазолидинил, пиримидинил, пиразинил, пиридазинил и т.п. Конденсированные с бензолом гетероциклические кольца включают изохинолинил, бензоксазолил, бензодиоксолил, бензотиазалил, хинолинил, бензофуранил,бензотиофенил, индолил и т.п., причем все они могут быть необязательно замещены, и указанное замещение включает также необязательное замещение в бензольном кольце, в том случае, когда гетероцикл конденсирован с бензольным кольцом. Предпочтительные гетероциклы включают пиридинил, индолил, фуранил, бензофуранил, тиофенил, бензодиоксолил и тиазолидинил, все из которых могут быть необязательно замещены. Термины замещенные алкил, циклоалкил, циклоалкилалкил, алкокси или алкилтио означают алкильную, циклоалкильную, циклоалкилалкильную, алкокси или алкилтиогруппу, соответственно, замещенную независимо один или несколько раз заместителем, выбранным из группы, состоящей из галогена, гидрокси и C1-С 3 алкокси. В качестве иллюстрации, но без ограничения, можно указать примеры, включающие трифторметил, пентафторэтил, 5-фтор-2-бромпентил, 3-гидроксипропилокси, 4 гидроксициклогексилокси, 2-бромэтилтио, 3-этоксипропилокси, 3-этокси-4-хлорциклогексил и т.п. Предпочтительные замещения включают замещение 1-5 раз галогеном, при независимом выборе каждого, или замещение 1-3 раза галогеном и 1-2 раза независимо группой, выбранной из гидрокси и C1-С 3 алкокси, или замещение 1-3 раза независимо группой, выбранной из гидрокси и C1-С 3 алкокси, при условии, что не более чем один гидрокси и/или алкоксизаместитель может быть присоединен к одному и тому же атому углерода. Термины замещенный фенил и замещенный гетероцикл в контексте настоящего описания означают циклический фрагмент, который в каждом случае замещен одним или более галогеновыми заместителями, предпочтительно от одного до пяти, каждый из которых выбран независимо; или замещен одним или более заместителями, предпочтительно одним или двумя заместителями, независимо выбранными из группы, состоящей из галогена, С 1-С 4 алкила, С 1-С 4 алкокси и С 1-С 4 алкилтио, причем каждый из указанных алкильных, алкокси и алкилтиозаместителей могут быть далее замещены независимоC1-С 2 алкокси или одной-пятью галогеновыми группами, выбранными из фтора и хлора; или замещен одним заместителем, выбранным из группы, состоящей из фенилокси, бензилокси, фенилтио, бензилтио и пиримидинилокси, причем указанные фенилокси, бензилокси, фенилтио, бензилтио и пиримидинилокси фрагменты могут быть далее замещены одним или двумя заместителями, выбранными из группы, состоящей из галогена, C1-С 2 алкила и C1-С 2 алкокси; или замещен одним заместителем, выбранным из группы, состоящей из C1-С 4 ацила и С 1-С 4 алкоксикарбонила, и далее замещен заместителем в количестве от нуля до одного, выбранным из группы, состоящей из галогена, С 1-С 4 алкила, С 1-С 4 алкокси и С 1-С 4 алкилтио. В том случае, когда заместителем является галоген, предпочтительными галогеновыми группами являются атомы фтора, хлора и брома.APCI MS означает масс-спектр с химической ионизацией при атмосферном давлении. Термин защитная группа для аминогруппы используется в контексте настоящего описания для обозначения заместителей, обычно используемых для блокирования или защиты аминогруппы, в то вре-5 007966 мя как другие функциональные группы соединения доступны для взаимодействия. Примеры таких защитных групп для аминогруппы включают формильную группу, тритильную группу, фталимидогруппу,ацетильную группу, трихлорацетильную группу, хлорацетильную группу, бромацетильную группу и йодацетильную группу, блокирующие группы уретанового типа, такие как бензилоксикарбонил, 9 флуоренилметоксикарбонил (FMOC) и т.п., и аналогичные защитные группы для аминогруппы. Вид используемой защитной группы для аминогруппы не является решающим фактором, главное, чтобы такое функциональное производное аминогруппы было стабильно в условиях последующих реакций, осуществляемых по другим положениям молекулы, и могли бы быть удалены на соответствующей стадии без разрушения оставшейся части молекулы. Другие примеры групп, охватываемых указанными выше терминами, описаны у T.W. Greene, Protective Groups in Organic Synthesis, John Wiley and Sons, NewYork, N.Y., 1991, Chapter 7, далее цитируемой как руководство Грина. Термин фармацевтический или фармацевтически приемлемый, используемый в настоящем описании в качестве прилагательного, означает, по существу, нетоксичный и, по существу. безвредный для реципиента. Термин фармацевтическая композиция также означает, что носитель, растворитель, эксципиент и соль должны быть совместимы с активным ингредиентом композиции (например, с соединением формулы I). Специалист в данной области понимает, что термины фармацевтическая рецептура и фармацевтическая композиция являются в целом взаимозаменяемыми и используются в целях настоящего изобретения. Термин аддитивная соль кислоты относится к соли соединения формулы I, получаемой в результате реакции соединения формулы I с минеральной или органической кислотой. Примеры фармацевтически приемлемых аддитивных солей кислоты приведены у Berge, S.M., Bighley, L.D., and Monkhouse,D.C., J. Pharm. Sci., 66:1, 1977. Поскольку соединения по настоящему изобретению относятся к аминам,они имеют основную природу и, соответственно, взаимодействуют с любым числом неорганических и органических кислот с образованием фармацевтически приемлемых аддитивных солей кислоты. Поскольку некоторые из свободных аминов соединений по настоящему изобретению обычно представляют собой масла при комнатной температуре, предпочтительно осуществлять преобразование свободных аминов в их фармацевтически приемлемые аддитивные соли кислоты для легкости работы с ними и последующего введения, поскольку последние, в основном, являются твердыми веществами при комнатной температуре. Фармацевтически приемлемые аддитивные соли кислоты по настоящему изобретению обычно образуются в результате взаимодействия соединения формулы I с эквимолярным или избыточным количеством кислоты. Альтернативно, полусоли могут быть образованы в реакции соединения формулы I с желательной кислотой, при соотношении соединения к кислоте, равном 2:1. Обычно реагенты объединяют в общем для них растворителе, таком как диэтиловый эфир, тетрагидрофуран, метанол, этанол, изопропанол, бензол и т.п. Соли осаждаются из раствора в течение времени от примерно 1 ч до примерно 10 дней и далее могут быть выделены фильтрованием или другими общепринятыми методами. Неорганические кислоты, обычно используемые для образования таких солей, включают хлористоводородную кислоту, бромисто-водородную кислоту, йодисто-водородную кислоту, серную кислоту,фосфорную кислоту и т.п. Органические кислоты, обычно используемые для образования таких солей,включают п-толуолсульфоновую кислоту, метансульфоновую кислоту, щавелевую кислоту, п-бромфенилсульфоновую кислоту, угольную кислоту, янтарную кислоту, лимонную кислоту, бензойную кислоту, уксусную кислоту и т.п. Таким образом, примеры указанных фармацевтически приемлемых солей включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат, гемисукцинат, суберат, себакат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат,динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксилолсульфонат, фенилацетат,фенилпропионат, фенилбутират, цитрат, лактат, -гидроксибутират, гликолят, тартрат, метансульфонат,пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и т.п. Предпочтительными фармацевтически приемлемыми солям являются такие соли, образованные при взаимодействии с хлористо-водородной кислотой и янтарной кислотой. Термин эффективное количество означает количество соединения формулы I, которое способно активировать рецепторы 5-HT1F и/или ингибировать экстравазацию нейронного белка. Термин приемлемый растворитель относится к любому растворителю или смеси растворителей,который характеризуется инертностью в отношении осуществляемой реакции, способностью в достаточной мере солюбилизировать реагенты с образованием среды, в которой осуществляется желаемая реакция. Все энантиомеры, диастереомеры и их смеси входят в объем настоящего изобретения. Так, например, соединения формулы I, в которых R5 отличен от водорода, содержат два хиральных центра, один - в положении 4 пиперидинового кольца и один - в том положении, где R5 присоединяется к пиперидиновому кольцу. В качестве иллюстрации, но без какого-либо ограничения, ниже указываются четыре стереоизомера N-[6-(1,2-диметилпиперидин-4-карбонил)пиридин-2-ил]изоникотинамида, в которых хиральные-6 007966 центры обозначены символами , и определения R и S, как указано выше. Несмотря на то, что все энантиомеры, диастереомеры и их смеси полезны в качестве агонистов 5HT1F, предпочтительны однотипные энантиомеры и однотипные диастереомеры. Кроме того, несмотря на то, что все соединения по настоящему изобретению полезны в качестве агонистов 5-HT1F, некоторые классы являются предпочтительными. В приведенных ниже абзацах описаны такие предпочтительные классы. 1) R1 означает фенил, замещенный фенил, гетероцикл или замещенный гетероцикл; 2) R1 означает замещенный фенил; 3) R1 означает моно- или дизамещенный фенил, причем заместители выбраны независимо из галогена, С 1-С 4 алкила, С 1-С 4 алкокси, трифторметила, трифторметокси, трифторэтокси, фенокси и бензилокси; 4) R1 означает моно- или дизамещенный фенил, причем заместители выбраны независимо из галогена, C1-С 2 алкокси, трифторметила, трифторметокси и трифторэтокси; 5) R1 означает ди- или тригалогензамещенный фенил; 6) R1 означает гетероцикл или замещенный гетероцикл; 7) R1 означает замещенный или незамещенный гетероцикл, выбранный из группы, состоящей из фуранила, тиофенила, пирролила, пирролидинила, пиридинила, N-метилпирролила, оксазолила, изоксазолила, пиразолила, имидазолила, триазолила, оксадиазолила, тиадиазолила, тиазолила, тиазолидинила,N-ацетилтиазолидинила, пиримидинила, пиразинила, пиридазинила, изохинолинила, бензоксазолила,бензодиоксолила, бензотиазалила, хинолинила, бензофуранила, бензотиофенила, индолила; 8) R1 означает замещенный или незамещенный гетероцикл, выбранный из группы, состоящей из пиридинила, индолила, бензофуранила, фуранила, тиофенила, бензодиоксолила и тиазолидинила; 9) R1 означает замещенный или незамещенный гетероцикл, выбранный из группы, состоящей из пиридинила, фуранила, тиофенила; 10) R1 означает моно-, ди- или тригалогензамещенный гетероцикл, причем каждая галогеновая группы выбрана независимо; 11) R1 означает моно- или дизамещенный гетероцикл, причем один из заместителей выбраны из группы, состоящей из С 1-С 2 алкокси, фенокси и фенилтио; 12) R2 означает водород или C1-С 3 алкил; 13) R2 означает водород или метил; 14) R2 означает С 3-С 6 циклоалкилС 1-С 3 алкил; 15) R2 означает пиразолилалкил или N-замещенный пиразолилалкил; 16) R2 означает пиразолил-4-ил-этил; 17) R2 означает 1-(C1-С 3 алкил)пиразолил-4-илэтил; 18) R3 означает водород; 19) R3 означает метил; 20) R3 означает этил; 21) R4 означает водород; 22) R4 означает галоген; 23) R4 означает фтор или хлор; 24) R4 означает C1-С 3 алкил; 25) R4 означает метил; 26) R5 означает водород; 27) R5 означает C1-С 3 алкил; 28) R5 означает метил; 29) R2 означает водород или метил, и R3, R4 и R5 все означают водород; 30) R2 означает водород или метил, R3 означает метил, a R4 и R5 оба означают водород; 31) R1 означает моно- или дизамещенный фенил, причем заместители выбраны независимо из галогена, С 1-С 2 алкокси, трифторметила, трифторметокси и трифторэтокси, R2 означает водород или метил,R3, R4 и R5 означают водород; 32) R1 означает замещенный или незамещенный гетероцикл, выбранный из группы, состоящей из-7 007966 пиридинила, индолила, бензофуранила, фуранила, тиофенила, бензодиоксолила и тиазолидинила; R2 означает водород или метил, и R3 R4 и R5 означают водород; 33) R1 означает замещенный фенил, R2 означает водород или метил, и R3 R4 и R5 все означают водород; 34) R1 означает замещенный фенил, R2 означает водород или метил, R3 означает метил, и R4 и R5 оба означают водород; 35) R1 означает моно- или дизамещенный фенил, и заместители выбраны из галогена, С 1-С 2 алкокси,трифторметила, трифторметокси и трифторэтокси, R2 означает водород или метил, R3 означает метил, иR4 и R5 означают водород; 36) R1 означает ди- или тригалогензамещенный фенил, R2 означает водород или метил, R3, R4 и R5 все означают водород; 37) R1 означает ди- или тригалогензамещенный фенил, R2 означает водород или метил, R3 означает метил, и R4 и R5 оба означают водород; 38) R1 означает замещенный или незамещенный гетероцикл, выбранный из группы, состоящей из пиридинила, индолила, бензофуранила, фуранила, тиофенила, бензодиоксолила и тиазолидинила, R2 означает водород или метил, R3 означает метил, и R4 и R5 означают водород; 39) любое соединение, приведенное в качестве примера; 40) соединение представляет собой аддитивную соль кислоты; 41) соединение представляет собой гидрохлоридную соль; 42) соединение представляет собой дигидрохлоридную соль; 43) соединение представляет собой гемисукцинатную соль; 44) соединение представляет собой сукцинатную соль, и 45) соединение представляет собой дисукцинатную соль. Следует понимать, что указанные выше классы могут объединяться с образованием дополнительных предпочтительных классов, как, например, в случае сочетания предпочтительных вариантов выбора двух или более заместителей. Примеры сочетаний предпочтительных классов, образующих дополнительные предпочтительные классы, проиллюстрированы ниже: 46) сочетание любого из предпочтительных классов 1), 2), 8) или 9) с предпочтительными классами 21) и 26); 47) сочетание любого из предпочтительных классов 1), 2), 8) или 9) с предпочтительными классами 21) и 27); 48) сочетание любого из предпочтительных классов 1), 2), 8) или 9) с предпочтительными классами 21) и 28); 49) сочетание любого из предпочтительных классов 1), 2), 8) или 9) с предпочтительными классами 23) и 26); 50) сочетание любого из предпочтительных классов 1), 2), 8) или 9) с предпочтительными классами 23) и 28); 51) сочетание любого из предпочтительных классов 1), 2), 8) или 9) с предпочтительными классами 25) и 26); 52) сочетание любого из предпочтительных классов 1), 2), 8) или 9) с предпочтительными классами 25) и 28); 53) сочетание любого из предпочтительных классов 46)-52) с предпочтительными классами 12) и 18); 54) сочетание любого из предпочтительных классов 46)-52) с предпочтительными классами 12) и 19); 55) сочетание любого из предпочтительных классов 46)-52) с предпочтительными классами 13) и 18); 56) сочетание любого из предпочтительных классов 46)-52) с предпочтительными классами 13) и 19); 57) сочетание любого из предпочтительных классов 46)-52) с предпочтительными классами 14) и 18); 58) сочетание любого из предпочтительных классов 46)-52) с предпочтительными классами 14) и 19); 59) сочетание любого из предпочтительных классов 46)-52) с предпочтительными классами 15) и 18), и 60) сочетание любого из предпочтительных классов 46)-52) с предпочтительными классами 15) и 19). В дополнение к соединениям, приведенных в примерах, ниже приведены соединения, которые также иллюстрируют область настоящего изобретения: 1) 4-фтор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 2) 2,4-дифтор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 3) N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 4) 2-xлop-4-фтop-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 5) 2-хлор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 6) 2,4,6-трифтор-N-[6-(пиперидин-4-карбонил)пиридин-2-ил]бензамид; 7) [6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]амид 1 Н-5-трифторметилиндол-3-карбоновой кислоты; 8) N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]-2-трифторметоксибензамид; 9) [6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]амид 3-бромтиофен-2-карбоновой кислоты;-8 007966 10) 4-фтор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]-2-трифторметилбензамид; 11) 2,4,6-трифтор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 12) 2-хлор-6-фтор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 13) 2,4,6-трифтор-N-метил-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 14) 2,4,6-трифтор-N-метил-N-[6-(пиперидин-4-карбонил)пиридин-2-ил]бензамид; 15) 2,4,6-трифтор-N-метил-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 16) 2,4,6-трифтор-N-этил-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 17) 2-хлор-4-фтор-N-[6-(пиперидин-4-карбонил)пиридин-2-ил]бензамид; 18) 2-хлор-4-фтор-N-метил-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 19) [6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]амид 1 Н-5-фториндол-3-карбоновой кислоты; 20) [6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]амид циклопропанкарбоновой кислоты; 21) 3-метил-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бутанамид; 22) [6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]амид тиофен-2-карбоновой кислоты; 23) [6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]амид фуран-2-карбоновой кислоты; 24) 2-хлор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 25) [6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]амид фуран-3-карбоновой кислоты; 26) 3,4-дифтор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 27) N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]изоникотинамид; 28) 2-метил-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 29) 2-6poм-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 30) [6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]амид тиофен-3-карбоновой кислоты; 31) 2-фтор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]изоникотинамид; 32) 4-хлор-2-метокси-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 33) 2-этокси-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 34) N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]-2-феноксибензамид; 35) 5-хлор-2-метокси-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 36) 2-метокси-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]-4-метилсульфанилбензамид; 37) [6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]амид 2,3-дигидробензофуран-7-карбоновой кислоты; 38) 2-бензилокси-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 39) N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]-2-пропоксибензамид; 40) [6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]амид 2,2-дифторбензо[1,3]диоксол-4-карбоновой кислоты; 41) 4-метокси-2-(2-метоксиэтокси)-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 42) 5-бром-2-метокси-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 43) 2-(4,6-диметоксипиримидин-2-илокси)-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 44) N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бутанамид; 45) [6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]амид циклогексанкарбоновой кислоты; 46) N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]-3-фенилпропионамид; 47) 2,6-дифтор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 48) 2-этокси-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]никотинамид; 49) N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]-2-феноксиникотинамид; 50) [6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]амид 3-ацетилтиазолидин-4-карбоновой кислоты; 51) N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]-2-фенилсульфанилникотинамид; 52) 5-метокси-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]-2-(2,2,2-трофторэтокси)бензамид; 53) 2-метокси-6-метил-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 54) метиловый эфир N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]терефталамовой кислоты; 55) [6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]амид циклобутанкарбоновой кислоты; 56) 2-(2-хлор-1,1,2-трифторэтокси)-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 57) 2-хлор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 58) 2,5-дифтор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 59) 3,4-дифтор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 60) 4-фтор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]-2-трифторметилбензамид; 61) 2-фтор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]-6-трифторметилбензамид; 62) 2,3,4-трифтор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 63) 2,4,5-трифтор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 64) [6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]амид 3-хлортиофен-2-карбоновой кислоты; 65) 2,6-дихлор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]бензамид; 66) 2-фтор-N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]-4-трифторметилбензамид; 67) [6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]амид циклопентакарбоновой кислоты; 68) N-[6-(1-метилпиперидин-4-карбонил)пиридин-2-ил]никотинамид. Предпочтительно, млекопитающим, подлежащим лечению путем введения соединений по настоящему изобретению, является человек.-9 007966 Соединения по настоящему изобретению могут быть синтезированы конденсацией 6-литиевого аниона 2-хлорпиридина с 1-замещенным или N-защищенным метоксиметиламидом пиперидин-4-карбоновой кислоты, с последующими преобразованием 2-галогеновой группы в аминогруппу и конденсацией с соответствующим R1-ацилгалогенидным соединением (см. cхему 1). Схема 1 Подходящие условия реакции на стадиях указанной схемы известны из уровня техники, и соответствующие замены растворителей и реактивов также известны специалистам в данной области. См., например, условия исходной конденсации J.C.S. Perkin Т.(24), 3597-3600 (1997). Обычно 2-хлорпиридин активируют проведением реакции со смесью н-бутиллития и 2-диметиламиноэтанола в подходящем растворителе, таком как гексан, при -78 С. Реакция, в основном, завершается примерно в течение часа. Далее добавляют метоксиметиламид 1-R7 замещенной-пиперидин-4 карбоновой кислоты в органическом растворителе, таком как гексан, и смесь перемешивают до образования промежуточного 2-хлорпиридиноилпиперидина. Реакция, в основном, завершается примерно в течение часа. В том случае, когда желательный конечный R2 заместитель представляет водород, пиперидинильный азот сначала защищают с помощью защитной группы для аминогруппы, введение и последующее удаление которой осуществляют по стандартным, известным в данной области методикам. Обычно первую реакцию конденсации гасят добавлением воды и смесь многократно экстрагируют соответствующим растворителем, таким как этилацетат. 2-Хлорпиридиноилпиперидиновое промежуточное соединение может быть высушено, например, над безводным сульфатом натрия, подвергнуто выпариванию и затем частично очищено, например, хроматографией на колонке с силикагелем. Далее 2-хлорпиридиноилпиперидиновое промежуточное соединение подвергают взаимодействию с бензофенонимином в присутствии трис(дибензилиденацетон)дипалладия(0), Рd2(dbа)3, в качестве катализатора и с 2,2'-бис(дифенилфосфино)-1,1'-бинафтилом (BINAP) и трет-бутоксидом натрия в подходящем растворителе, таком как толуол, при кипячении с обратным холодильником для замещения галогеновой группы бензофенониминовой группой. После соответствующей обработки промежуточное соединение подвергают обычно взаимодействию с хлористо-водородной кислотой в растворителе, таком как тетрагидрофуран, и затем очищают с получением соответствующего 2-аминопиридиноилпиперидинового промежуточного соединения. На конечной стадии приведенной cхемы 1 образования амидной связи вводят фрагмент R1 взаимодействием 2-аминопиридиноилпиперидинового промежуточного соединения с желаемым R1-ацилгалогенидом. Обычно смешивают примерно при комнатной температуре смесь 2-аминопиридиноилпиперидинового промежуточного соединения, желаемого R1-ацилгалогенида, связывающего протон соединения,такого как триэтиламин, диизопропилэтиламин и т.п., в соответствующем растворителе, таком как дихлорметан, ТГФ, МТБЭ и т.п., до завершения реакции примерно в течение 4 ч. Может быть добавлено сильное основание, такое как гидроксид натрия, для нейтрализации реакционной смеси, и готовый продукт очищают обычными методами обработки. Если азот пиперидинила защищен защитной группой для аминогрупп, то указанную группу удаляют после проведения реакции конденсации с ацилгалогенидом. Пиперидинильный азот может оставаться в молекуле в виде вторичного амина в том случае, когда в соединении по настоящему изобретению R2- 10007966 означает водород, или он может быть подвергнут алкилированию с использованием известных методик в случае тех соединений по настоящему изобретению, в которых R2 означает C1-С 3 алкил, С 3-С 6 циклоалкилС 1-С 3 алкил или группу формулы II Несмотря на то, что в данной области известны разные альтернативные способы алкилирования, одна типичная реакция алкилирования осуществляется путем восстановительного алкилирования вторичного амина с соответствующим альдегидом, органической кислотой, такой как ледяная уксусная кислота или трифторуксусная кислота, и восстановителем, таким как цианборгидрид натрия или триацетоксиборгидрид натрия, в подходящем растворителе, таком как метанол или дихлорметан, где подходящий альдегид представляет собой альдегид, способный взаимодействовать с образованием желаемого R2 заместителя (Michael В. Smith and Jerry March, March's Advanced Organic Chemistry: Reactions, mechanisms andStructure, 5th ed., pgs. 1185-1187 (sec. 16-12), John WileySons., Inc., New York, 2001). В качестве иллюстрации можно указать, что для синтеза соединений, в которых R2 - мeтил, желаемым альдегидом будет формальдегид, тогда как в случае синтеза соединений, в которых R2 - 3-циклопентилпропил, желаемым альдегидом будет 3-циклопентилпропанал. Соединения по настоящему изобретению, в которых R3 означает метил или этил, могут быть синтезированы в соответствии со cхемой 2. Схема 2R3-Аминокарбонил-R1-реагенты могут быть легко получены взаимодействием соответствующего R1 ацилгалогенида с желаемым амином (метиламином, этиламином, пропиламином или изопропиламином,например, в 2 М их растворе) в соответствующем растворителе, таком как, например, метанол. Такая методика является простой и известной в данной области. 2-Бромпиридиноилпиперидиновое промежуточное соединение синтезируют проведением первой реакции 2,6-дибромпиридина в подходящем органическом растворителе, таком как дихлорметан, предпочтительно в атмосфере азота, с 1,1 эквивалента н-бутиллития в подходящем растворителе, таком как гексаны, предпочтительно при низкой температуре, такой как -78 С. Затем к реакционной смеси добавляют подходящий 1-R7-замещенный-N-метокси-N-метилпиперидин-4-карбоксамид. Впоследствии реакцию гасят добавлением основания, например, водного раствора NaOH. Полученное промежуточное соединение может быть далее очищено по стандартной методике обработки, такой как экстракция с последующими удалением растворителя и хроматографией. 2-Бромпиридиноилпиперидиновое промежуточное соединение подвергают взаимодействию в атмосфере N2 в смеси с желаемым метиламинокарбонил-R1, этиламинокарбонил-R1 или пропиламинокарбонил-R1, соответственно, а также с трис(дибензилиденацетон)дипалладием(0) (Рd2(dba)3), 2,2'-бис(дифенилфосфино)-1,1'-бинафтилом (BINAP) и трет-бутоксидом натрия в подходящем растворителе, таком как, соответственно, безводный толуол. Реакционную смесь обычно нагревают в течение нескольких часов, например при температуре 85 С в течение 16 ч. Может быть добавлено дополнительное количество С 1-С 2 алкиламинокарбонил-R1,трис(дибензилиденацетон)дипалладия(0)(Рd2(dba)3),2,2'бис(дифенилфосфино)-1,1'-бинафтила (BINAP) и трет-бутоксида натрия и реакция продолжена еще в течение того же периода времени для повышения выхода реакции. Готовый продукт далее очищают с использованием обычных методов. Соединения по настоящему изобретению, в которых R4 и R5 отличаются от водорода, могут быть синтезированы по указанным выше схемам с использованием соответствующим образом замещенных 2-галогенпиридина и замещенных пиперидинильных исходных реагентов. В предпочтительном варианте используют новую реакцию конденсации для синтеза 2-бром- 11007966 пиридиноилпиперидинового промежуточного соединения с достижением как высокоселективного моноприсоединения, так и высоких выходов желаемого промежуточного соединения со сниженным содержанием примесей. В другом предпочтительном варианте используют более удобную реакцию для превращения 2-бромпиридиноилпиперидинового промежуточного соединения в 2-аминопиридиноилпиперидиновое промежуточное соединение в ходе получения для проведения реакции конечной конденсации (см. cхему 3). Схема 3 Новое N,N-диметиламинокарбонилпиперидиновое промежуточное соединение получают с высоким выходом из производного R7-изонипекотиновой кислоты взаимодействием кислоты с оксалилхлоридом в присутствии каталитического количества диметилформамида (ДМФА) в подходящем растворителе, таком как дихлорметан, тетрагидрофуран, дихлорэтан, диэтиловый эфир и т.п., и последующем концентрировании с получением производного изонипекотилхлорида. Далее его ресуспендируют в подходящем растворителе, таком как тетрагидрофуран, дихлорметан, дихлорэтан, диэтиловый эфир и т.п., и подвергают взаимодействию с диметиламином в присутствии соединения, связывающего протон, такого как,например, ненуклеофильное органическое основание, такое как триэтиламин, диизопропилэтиламин и т.п., и далее очищают с получением N,N-диметиламинокарбонилпиперидинового промежуточного соединения.N,N-Диметиламинокарбонилпиперидиновые промежуточные соединения по настоящему изобретению имеют вполне очевидные преимущества по сравнению с N-защищенными реагентами на основе метоксиметиламида пиперидин-4-карбоновой кислоты (реагентов Вайнреба), известного уровня техники, за счет того, что они не гигроскопичны и обеспечивают неожиданно существенное повышение хемоселективности и выхода в последующей реакции конденсации по сравнению с реакцией конденсации, проводимой с использованием соответствующего реагента Вайнреба. Указанное преимущество особенно существенно в том случае, когда, как в предпочтительном варианте, в качестве растворителя используют толуол или метил-трет-бутиловый эфир (МТБЭ). В еще более предпочтительном варианте осуществления изобретения в качестве растворителя используют МТБЭ. Далее 2,6-дибромпиридин активируют взаимодействием с н-бутиллитием в холодном МТБЭ или толуоле, предпочтительно в МТБЭ, с образованием бромлитийпиридинового промежуточного соединения. Впоследствии добавляют N,N-диметиламинокарбонилпиперидиновое промежуточное соединение и смесь перемешивают в течение примерно 1 ч при температуре от примерно -100 до примерно -60 С,предпочтительно примерно при -75 С. В предпочтительном варианте проводят реакцию сочетания при соотношении 2,6-дибропиридина к N,N-диметиламинокарбонилпиперидиновому промежуточному соединению, составляющему от примерно 1,0 до примерно 2,0, более предпочтительно при соотношении от примерно 1,3 до примерно 1,7 и наиболее предпочтительно при соотношении, равном примерно 1,5. Далее реакцию гасят добавлением насыщенного раствора хлорида аммония при температуре от пример- 12007966 но -20 до примерно 10 С и затем проводят нейтрализацию хлористо-водородной кислотой и дополнительно добавляют воду. Продукт может быть далее выделен с использованием обычных методов обработки, например, но, не ограничиваясь ими, экстракцией водной фазы дихлорметаном, промывкой органических фракций подкисленной водой (например, до рН 2), нейтрализацией водного экстракта гидроксидом натрия с последующей экстракцией этилацетатом, сушкой органической фазы, например, сульфатом магния, и концентрированием, например, выпариванием, в том числе выпариванием на роторном испарителе и т.п. В другом предпочтительном варианте заменяют 4-(N,N'-диметиламино)карбонилпиперидиновое соединение, показанное на cхеме 3, замещенным аминокарбонилпиперидиновым соединением формулы IV где R8, R9 и R10 определены выше. Предпочтительные соединения формулы IV включают такие соединения, где R9 и R10 каждый означает метил, или где R9 и R10 вместе с азотом, к которому они присоединены, объединены с образованием пирролидинила. Особенно предпочтительными являются такие соединения, где R9 и R10 вместе с атомом азота, к которому они присоединены, объединены с образованием пирролидинила. Соединения, где R9 и R10 вместе с атомом азота, к которому они присоединены, объединены с образованием азетидинила, пирролидинила или пиперидинила, могут быть синтезированы с помощью тех же способов, что и в случае получения N,N'-диметиловых аналогов, путем замены описанного выше диметиламинного реагента азетидином, пирролидином или пиперидином, соответственно. 4-(Пирролидинилкарбонил)пиперидиновые реагенты обладают дополнительным преимуществом в сравнении с 4-(N,N'-диметиламино)карбонилпиперидиновыми реагентами за счет того, что они менее гигроскопичны и дают более стабильные кристаллы, улучшая тем самым те свойства соединений, которые облегчают работу с ними. Как и в случае 4-(N,N'-диметиламино)карбонилпиперидиновых реагентов,4-(пирролидинилкарбонил)пиперидиновые реагенты демонстрируют неожиданно усиленную хемоселективность и выход в последующей реакции конденсации по сравнению с реакциями, проводимыми с использованием соответствующих реагентов Вайнреба. В качестве иллюстраций, но без ограничения, можно указать на 1-метил-4-(N,N'-диметиламино)карбонилпиперидин, который представляет собой твердое вещество с низкой температурой плавления, который легко кристаллизуется и обладает относительно низкой гигроскопичностью, особенно в сравнении с соответствующим реагентом Вайнреба. Однако в том случае, когда кристаллическая форма поглощает воду, она превращается в масло. В сравнении с такой ситуацией, 1-метил-4-(пирролидинилкарбонил)пиперидин также является твердым веществом с низкой температурой плавления, которое также легко кристаллизуется, но является еще менее гигроскопичным, чем 1-метил-4-(N,N'-диметиламино)карбонилпиперидин и дает более стабильные кристаллы, так что они могут сохранять свою кристаллическую форму даже в случае поглощения некоторого количества воды. При этом 1-метил-4-(пиперидин-1-ил) карбонилпиперидин, в основном, остается в виде масла. В другом варианте осуществления способа изобретения можно использовать 2,6-дихлорпиридин вместо 2,6-дибромпиридина, показанного выше на схеме 3, в аналогичных условиях реакции, с получением соответствующего 2-хлорпиридиноилпиперидинового промежуточного соединения. В еще одном предпочтительном варианте осуществления нового способа синтеза в качестве растворителя используют МТБЭ или толуол с достижением еще большей хемоселективности в реакции конденсации. При этом МТБЭ более предпочтителен в качестве растворителя. В еще одном варианте осуществления способа данного изобретения следующая стадия синтеза позволяет провести замену аминогруппы галогеновой группой реакцией 2-бром-6-(пиперидинилкарбонил) пиперидинового промежуточного соединения, указанного выше, с аммиаком и этиленгликолем в присутствии оксида меди(I) в качестве катализатора. В предпочтительном варианте реакцию проводят в автоклаве, в котором поддерживаются обычные условия, включая температуру от примерно 80 до примерно 110 С, предпочтительно примерно 100 С, и давление от примерно 45 до примерно 60 фунт/дюйм 2 (примерно от 310 до примерно 414 кПа), обычно при давлении примерно 50 фунт/дюйм 2 (примерно 345 кПа). Затем аммиак откачивают из органической фазы. Далее добавляют водный раствор гидроксида натрия и смесь экстрагируют подходящим органическим растворителем, таким как, например, метил-третбутиловый эфир или дихлорметан, и затем сушат, например, над сульфатом магния. В предпочтительном варианте неочищенное 2-амино-6-(1-R7-пиперидин-4-илкарбонил)пиридиновое промежуточное соединение далее очищают кристаллизацией из хлористо-водородной кислоты с последующими нейтрализацией соли гидроксидом натрия, экстракцией органическим растворителем и- 13007966 удалением растворителя. Реакция конечной конденсации описана на cхеме 1. Приведенные ниже получения и соответствующие примеры являются иллюстративными и не должны интерпретироваться каким-либо образом в плане ограничения объема настоящего изобретения. Получения Добавляют 2-хлорпиридин (1 г, 8,8 ммоль) к смеси н-бутиллития (1,6 М в гексане) (22 мл, 35,2 ммоль) и 2-диметиламиноэтанол (1,56 г, 17,6 ммоль) в гексане (20 мл при -78 С) и перемешивают в течение 1 ч. Затем добавляют метоксиметиламид 1-метилпиперидин-4-карбоновой кислоты (3,2 г, 17,6 ммоль) в гексане (5 мл) и смесь перемешивают в течение 1 ч. Гасят реакцию добавлением воды и дважды экстрагируют этилацетатом, сушат органический слой над безводным сульфатом натрия, выпаривают растворитель и очищают оставшийся продукт хроматографией на колонке с силикагелем с получением примерно 1 г указанного в заголовке продукта. 2. 2-Амино-6-(1-метилпиперидин-4-илкарбонил)пиридин. Нагревают смесь 2-хлор-6-(1-метилпиперидин-4-илкарбонил)пиридина (800 мг, 3,35 ммоль), бензофенонимина (729 мг, 4,02 ммоль), трис(дибензилиденацетон)дипалладия(0) (61 мг, 0,067 ммоль), рацемического 2,2'-бис(дифенилфосфино)-1,1'-бинафтила (83 мг, 0,134 ммоль) и трет-бутоксида натрия (451 мг, 4,69 ммоль) в толуоле (100 мл) при температуре кипения с обратным холодильником в течение 2 ч. Выпаривают растворитель и остаток растворяют в этилацетате, промывают водой, сушат безводным сульфатом натрия, выпаривают и очищают хроматографией на колонке с силикагелем, получая примерно 1 г бензофенониминного промежуточного соединения. Добавляют 1N HCl (12 мл) в раствор продукта в ТГФ (50 мл) и перемешивают при комнатной температуре в течение 2 ч. Затем добавляют 25 мл 1N HCl и дважды экстрагируют смесью гексан:этилацетат (2:1). Подщелачивают водный слой, экстрагируют дихлорметаном, сушат безводным сульфатом натрия, выпаривают растворитель и очищают оставшийся продукт хроматографией на колонке с силикагелем (этилацетат:2 М NH3 в метаноле, 90:10) с получением примерно 600 мг указанного в заголовке продукта. Перемешивают смесь 2-амино-6-(1-метилпиперидин-4-илкарбонил)пиридина (0,150 г), 4-фторбензоилхлорида (0,218 г), триэтиламина (0,192 мл) и дихлорметана при комнатной температуре в течение 4 ч. Добавляют 1N водный раствор NaOH для подщелачивания реакционной смеси. Экстрагируют смесь дихлорметаном, сушат органическую фазу безводным сульфатом натрия, выпаривают растворитель и очищают оставшееся вещество методом ВЭЖХ с получением указанного в заголовке соединения в виде свободного основания. Растворяют свободное основание в диэтиловом эфире, добавляют избыток 1N По методике, аналогично приведенной выше в примере 1, с использованием 2,4-дифторбензоилхлорида получают указанное в заголовке соединение. Т.пл. 108-110 С; масс-спектр (электрораспыление) По методике, аналогично приведенной выше в примере 1, с использованием 2-хлор-4-фторбензоилхлорида получают указанное в заголовке соединение. Свободное основание: Т.пл. 53-55 С; HRMC: 376,1233 (найдено) (вычислено 376,1228). Ди-НСl соль: Т.пл. 243-245 С; HRMC: 376,1238 (найдено) (вычислено 376,1228). 4. Моногидрохлоридная соль 2-хлор-6-фтор-N-[6-(1-метилпиперидин-4-илкарбонил)пиридин-2-ил] бензамида. Объединяют 2-амино-6-(1-метилпиперидин-4-илкарбонил)пиридин (0,18 г, 0,85 ммоль), 2-хлор-6 фторбензоилхлорид (0,318 г, 1,65 ммоль) и 1,4-диоксан (10 мл). Перемешивают и нагревают смесь при температуре кипения с обратным холодильником. Через 2 ч охлаждают реакционную смесь до температуры окружающей среды и концентрируют. Вносят смесь на колонку SCX (10 г), промывают метанолом и элюируют смесью 2 М аммиак/метанол. Концентрируют элюент с получением свободного основания указанного в заголовке соединения (0,30 г, 94%) в виде масла. Растворяют масло в метаноле (5 мл) и обрабатывают хлоридом аммония (0,045 г, 0,85 ммоль). Смесь концентрируют и сушат в вакууме с получением указанного в заголовке соединения. HRMC: Найдено: m/z 376,1237; Вычислено: m/z 376,1218; Т.пл. 155 С (разлож.) 5. Гидрохлоридная соль 2-бром-N-[6-(1-метилпиперидин-4-илкарбонил)пиридин-2-ил]бензамида. По методике, аналогично приведенной выше в примере 1, с использованием 2-бромбензоилхлорида получают свободное основание указанного в заголовке соединения. Растворяют чистое вещество (104,8 г) в метаноле и добавляют эквивалентное количество (13,9 мг) NH4Cl. Реакционную смесь обрабатывают ультразвуком при комнатной температуре в течение 15 мин, затем смесь концентрируют и сушат с получением указанного в заголовке соединения в виде белого твердого вещества. Масс-спектр (ионное рас- 15007966 пыление): m/z=402,1 (М+1); 1 Н ЯМР(d6-ДМСO, м.д.), 1,15 (1 Н, с), 8,37 (1 Н, ушир.с), 8,07 (1 Н, т, J=7,69,8,05, 15,74 Гц), 7,74 (2 Н, м), 7,58 (3 Н, м), 3,70 (1 Н, ушир.с), 2,87 (2 Н, м), 2,65 (3 Н, с), 2,12 (3 Н, м), 1,82(0,175 г) в 1,4-диоксане (10 мл) и нагревают при температуре кипения с обратным холодильником в течение 1 ч. Разбавляют метанолом (10 мл) и вносят на колонку с SCX (10 г). Промывают колонку метанолом, элюируют продукт 2 М NН 3 в метаноле, выпаривают и очищают продукт на колонке с силикагелем(электрораспыление): m/z=358 (М+1) и 360 (М+2+1); 1 Н ЯМР (CDCl3): 8,60 (ушир.с, 1 Н), 8,54 (д, 1 Н),7,90 (дд, 1 Н), 7,81 (д, 1 Н), 7,76 (дд, 1 Н), 7,45 (м, 3 Н), 3,63 (м, 1 Н), 2,90 (м, 2 Н), 2,29 (с, 3 Н), 2,07 (м, 2 Н),1,85 (м, 4 Н). Растворяют свободное основание в дихлорметане и добавляют 1N HCl в диэтиловом эфире (0,85 мл),выпаривают и сушат в вакууме с получением моногидрохлоридной соли (0,354 г). 7. Гидрохлорид N-[6-(1-метилпиперидин-4-илкарбонил)пиридин-2-ил]бензамида. По методике, аналогично приведенной выше в примере 1, с использованием бензоилхлорида получают свободное основание указанного в заголовке соединения. Растворяют свободное основание в диэтиловом эфире и добавляют 1 М НСl в молярном соотношении 1:1. Выпаривают растворитель и сушат остаток в вакууме с получением указанного в заголовке соединения. HRMC: 324,1697 (найдено) (вычислено 324,1712). 8. Моногидрохлоридная соль 2,4,6-трифтор-N-[6-(1-метилпиперидин-4-илкарбонил)пиридин-2-ил] бензамида. Объединяют 2-амино-6-(1-метилпиперидин-4-илкарбонил)пиридин (0,20 г, 0,92 ммоль), 2,4,6-трифторбензоилхлорид (0,357 г, 1,84 ммоль) и 1,4-диоксан (10 мл) и смесь перемешивают при нагревании при температуре кипения с обратным холодильником. Через 3 ч реакционную смесь охлаждают до температуры окружающей среды и концентрируют. Вносят концентрированную смесь на колонку SCX (10 г),промывают метанолом и элюируют 2 М аммиаком в метаноле. Концентрируют элюент с получением свободного основания указанного в заголовке соединения в виде масла (0,365 г (100%. Растворяют масло в метаноле (5 мл) и обрабатывают хлоридом аммония (0,05 г, 0,92 ммоль). Смесь концентрируют и сушат в вакууме с получением указанного в заголовке соединения. HRMC: Найдено: 378,1435, Вычислено: m/z 378,1429; Т.пл. 255 С (разлож). 9. Моногидрохлоридная соль 2-трифторметил-4-фтор-N-[6-(1-метилпиперидин-4-илкарбонил)пиридин-2-ил]бензамида. Объединяют 2-амино-6-(1-метилпиперидин-4-илкарбонил)пиридин (0,19 г, 0,87 ммоль), 2-трифторметил-4-фторбензоилхлорид (0,395 г, 1,74 ммоль) и 1,4-диоксан (10 мл). Перемешивают и нагревают смесь при температуре кипения с обратным холодильником. Через 3 ч реакционную смесь охлаждают до температуры окружающей среды и концентрируют. Вносят смесь на колонку SCX (10 г), промывают метанолом и элюируют смесью 2 М аммиак/метанол. Концентрируют элюент с получением свободного основания указанного в заголовке соединения в виде масла (0,241 г, 68%). Растворяют масло в метаноле(5 мл) и обрабатывают хлоридом аммония (0,031 г, 0,59 ммоль). Смесь концентрируют и сушат в вакууме с получением указанного в заголовке соединения. HRMC: Найдено: 410,1490, Вычислено: m/z 410,1491; Т.пл. 145-150 С. Объединяют 2-амино-6-(1-метилпиперидин-4-илкарбонил)пиридин (0,18 г, 0,84 ммоль), 2-трифторметоксибензоилхлорид (0,23 г, 1,0 ммоль) и 1,4-диоксан (5 мл). Смесь перемешивают и нагревают при температуре кипения с обратным холодильником. Через 3 ч реакционную смесь охлаждают до температуры окружающей среды. Вносят смесь на колонку SCX (10 г), промывают метанолом и элюируют смесью 2 М аммиак/метанол. Концентрируют элюент с получением свободного основания указанного в заголовке соединения в виде масла (0,26 г, 16%). Масло растворяют в метаноле (10 мл) и обрабатывают хлоридом аммония (0,032 г). Концентрируют и сушат в вакууме с получением указанного в заголовке соединения. HRMC: Найдено: 408,1517, Вычислено: m/z 408,1535; Т.пл. 155-160 С. 11. Моногидрохлоридная соль 3-бром-N-[6-(1-метилпиперидин-4-илкарбонил)пиридин-2-ил]тиофен-2-карбоксамида. Объединяют 2-амино-6-(1-метилпиперидин-4-илкарбонил)пиридин (0,104 г, 0,48 ммоль), 3-бромтиофен-2-карбонилхлорид (0,215 г, 0,95 ммоль) и 1,4-диоксан (10 мл). Смесь перемешивают и нагревают при температуре кипения с обратным холодильником. Через 2 ч реакционную смесь охлаждают до температуры окружающей среды и концентрируют. Вносят смесь на колонку SCX (10 г), промывают метанолом и элюируют смесью 2 М аммиак/метанол. Концентрируют элюент с получением свободного основания указанного в заголовке соединения в виде масла (0,152 г, 78%). Масло растворяют в дихлорметане Добавляют по каплям оксалилхлорид (0,18 мл, 2,1 ммоль) к раствору 1-бензилиндол-3-карбоновой кислоты (0,48 г, 1,9 ммоль) в пиридине и СН 3 СN (5 мл каждой), охлажденному на ледяной бане. Перемешивают реакционную смесь в течение 2,25 ч и затем добавляют суспензию 2-амино-6-(1-метилпиперидин-4-илкарбонил) пиридина (0,56 г, 1,9 ммоль) в CH3CN (5 мл) и пиридине (12 мл). В течение ночи нагревают реакционную смесь до комнатной температуры. Гасят реакцию добавлением холодной Н 2 О(20 мл) и разбавляют СНСl3. Доводят рН до 11 с помощью Na2CO3 и разделяют слои. Экстрагируют водный слой СНСl3 (2x30 мл). Органические фракции объединяют, сушат безводным MgSO4, фильтруют и концентрируют смесь в вакууме. Очищают продукт хроматографией на колонке с силикагелем, элюируя смесью метанол/СН 2 Сl2 (5:95) и затем смесью метанол/СН 2 Сl2 (10:90) с получением указанного в заголовке промежуточного соединения (0,44 г, 51%). 1 Н ЯМР (CD3OD)8,45 (д, J=8 Гц, 1 Н), 8,32 (с, 1 Н),8,26 (м, 1 Н), 7,95 (т, J=8 Гц, 1 Н), 7,72 (д, J=8 Гц, 1 Н), 7,45 (м, 1 Н), 7,22-7,37 (м, 7 Н), 5,51 (с, 2 Н), 3,90 (м,1 Н), 2,93-3,01 (м, 2 Н), 2,33 (с, 3 Н), 2,21-2,31 (м, 2 Н), 3,92-1,99 (м, 2 Н), 1,71-1,84 (м, 2 Н); CIMS (метан) Трихлорид алюминия (106 мг, 0,795 ммоль) добавляют к суспензии 1-бензилиндол-3-ил-N-[6-(1-метилпиперидин-4-илкарбонил)пиридин-2-ил]карбоксамида (180 мг, 0,398 ммоль) в бензоле (6 мл) и смесь нагревают при температуре кипения с обратным холодильником в течение 1,25 ч. Затем добавляют еще 2 эквивалента трихлорида алюминия (108 мг) и продолжают нагревание при температуре кипения с обратным холодильником в течение еще 5,5 ч. Охлаждают реакционную смесь до комнатной температуры. Затем выливают реакционную смесь в охлажденную Н 2O (50 мл) и далее разбавляют этилацетатом. Доводят рН раствора до 11 насыщенным Nа 2 СO3, разделяют слои и водный слой экстрагируют этилацетатом (3x50 мл). Объединяют органические фракции, сушат Na2SO4, фильтруют и концентрируют в вакууме. Промежуточное соединение очищают флэш-хроматографией на колонке с силикагелем, элюируя смесью СНСl3/метанол/NH4 ОН (93:7:1) с получением указанного в заголовке промежуточного соединения (96 мг, 67%). 1 Н ЯМР (CD3OD)8,45 (д, J=8 Гц, 1 Н), 8,25 (с, 1 Н), 8,21 (м, 1 Н), 7,96 (т, J=8 Гц, 1 Н), 7,72 2,0 М НСl в диэтиловом эфире (0,46 мл, 0,93 ммоль) добавляют к суспензии 1 Н-индол-3-ил-N-[6-(1 метилпиперидин-4-илкарбонил)пиридин-2-ил]карбоксамида (свободное основание) (0,16 г, 0,44 ммоль) в диэтиловом эфире (10 мл). Через 2 ч фильтруют реакционную смесь и промывают твердое вещество диэтиловым эфиром с получением указанного в заголовке соединения в виде желтого твердого вещества. Rf 0,29 (93:7:1, СНСl3/метанол/NH4 ОН); Т.пл. 200-218 С; 1 Н ЯМР (CD3OD, комплексная смесь ротамеров)8,38 и 8,49 (с, 1 Н), 8,46 (м, 1 Н), 8,08-8,10 и 8,18-8,29 (м, 2 Н), 7,61 и 7,72 (д, J=8 Гц, 1 Н), 7,52 (м, 1 Н), 7,267,32 (м, 2 Н), 4,01 (м, 1 Н), 3,19-3,68 (м, 3 Н), 2,97 (м, 1 Н), 2,82 и 2,94 (с, 3 Н), 2,28-2,32 (м, 2 Н), 1,68-2,02 (м,2 Н); CIMS (метан) m/z 363 [C21H22N4O2+H]+; ВЭЖХ (метод А) 96,7%, время удерживания 16,4 мин; элементный анализ для С 21 Н 22N4O22,1 НСl1,5 Н 2O: Вычислено (в %) С-54,12; Н-5,86; N-12,02; Сl-15,98. Найдено (в %) С-54,13; Н-6,03; N-12,37; Сl-15,71. 13. Дигидрохлоридная соль циклопропил[6-(1-метилпиперидин-4-илкарбонил)пиридин-2-ил]карбоксамида. Добавляют по каплям циклопропилкарбонилхлорид (0,08 мл, 0,83 ммоль) к раствору 2-амино(6-пиридил)-1-метил(4-пиперидил)кетона (221 мг, 0,76 ммоль) и триэтиламина (0,32 мл, 2,3 ммоль) в CH2Cl2 (5 мл), охлажденному на ледяной бане. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 3 ч. Экстрагируют реакционную смесь CH2Cl2 и Н 2 О и доводят рН водного слоя до 11 с использованием Nа 2 СO3. Разделяют слои и экстрагируют водный слой СН 2 Сl2 (2x50 мл). Объединяют органические фракции, сушат Na2SO4, фильтруют и концентрируют смесь в вакууме. Очищают полученный концентрат хроматографией на колонке с силикагелем, элюируя градиентом смеси СНСl3/метанол (от 95:5 до 90:10) с получением указанного в заголовке соединения в виде свободного основания- 18007966 мин; Элементный анализ для C16H21N3O22,3 НСl2,3 Н 2O: Вычислено (в %): С-46,57; Н-6,81; N-10,18; Сl19,76. Найдено (в %) С-46,43; Н-6,55; N-10,00; Cl-19,62. 14. Дигидрохлоридная соль 2-метилпроп-1-ил-N-[6-(1-метилпиперидин-4-илкарбонил)пиридин-2 ил]карбоксамида.(i) Свободное основание: 3-метилбутаноилхлорид (0,11 мл, 0,90 ммоль) по каплям добавляют к раствору 2-амино-6-(1-метилпиперидин-4-илкарбонил)пиридина (132 мг, 0,45 ммоль) и триэтиламина (0,19 мл, 1,4 ммоль) в СН 2 Сl2 (5 мл), охлажденному на ледяной бане. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 3 ч. Разбавляют реакционную смесь СН 2 Сl2 и промывают насыщенным раствором NaHCO3 (50 мл). Экстрагируют водный слой СН 2 Сl2 (2x25 мл). Органические фракции объединяют, сушат Na2SO4, фильтруют и концентрируют смесь в вакууме. Продукт очищают хроматографией на колонке с силикагелем, элюируя смесью СН 2 Сl2/метанол (95:5), с получением указанного в заголовке соединения в виде свободного основания (88 мг, 64%). 1 Н ЯМР (CDCl3)8,44 (д,J=8,0 Гц, 1 Н), 7,81-7,86 (м, 1 Н), 7,73 (д, J=7,1 Гц, 1 Н), 3,50 (м, 1 Н), 3,00-3,18 (м, 2 Н), 2,18-2,46 (м, 7 Н),1,92-2,01 (м, 2 Н), 1,52-1,71 (м, 3 Н), 1,05 (д, J=6,6 Гц, 6 Н); CIMS (метан) m/z 304 [C17H25N3O2+H]+.(ii) Дигидрохлоридная соль: добавляют 2,0 М НСl в диэтиловом эфире (0,36 мл, 0,73 ммоль) к раствору свободного основания (88 мг, 0,29 ммоль) в диэтиловом эфире (5 мл) и метаноле (2 мл). Через 2 ч реакционную смесь концентрируют в вакууме, получая указанное в заголовке соединения в виде коричневого твердого вещества. Rf 0,58 (93:7:1, СНСl3/метанол/NН 4 ОН); Т.пл. 93-95 С. 1 Н ЯМР (CD3OD, комплексная смесь ротамеров)8,35 (м, 1 Н), 7,95 (м, 1 Н), 7,77 (м, 1 Н), 4,06 и 4,25 (м, 1 Н), 3,43-3,52 и 3,613,65 (м, 2 Н), 3,18-3,28 (м, 2 Н), 2,81-2,94 (м, 3 Н), 2,21-2,37 (м, 5 Н), 1,90-2,02 (м, 2 Н), 1,03-1,05 (м, 6 Н);Corporation, Milford, Massachusetts) (4,6x250 мм); Элементный анализ для C17H25N3O21,9 НСl1,2 Н 2O: Вычислено (в %): С-51,79; Н-7,49; N-10,66; Сl-17,08. Найдено (в %) С-51,78; Н-7,64; N-10,35; Сl-17,07. 15. Гидрохлоридная соль 2,4,6-трифтор-N-метил-N-[6-(1-метилпиперидин-4-илкарбонил)пиридин 2-ил]бензамида. Растворяют 2,6-дибромпиридин (3,6 г, 15,3 ммоль) в безводном дихлорметане (90 мл) в атмосфере азота. Охлаждают реакционную смесь до -78 С. Очень медленно с помощью шприца добавляют раствор н-бутиллития в гексане (1,6 М, 10,5 мл, 16,9 ммоль). После завершения добавления перемешивают реакционную смесь при температуре -78 С в течение 1 ч. К реакционной смеси добавляют по каплям раствор трет-бутилового эфира 4-(метоксиметиламинокарбонил)пиперидин-1-карбоновой кислоты (2 г, 7,3 ммоль) в безводном дихлорметане (10 мл). Перемешивают реакционную смесь при -78 С в течение 2 ч и затем дают постепенно нагреться до комнатной температуры в течение ночи. Гасят реакцию добавлением 0,1N водного раствора NaOH. Разбавляют раствор дихлорметаном (100 мл), переносят в делительную воронку и встряхивают с 0,1N NaOH (60 мл). Отделяют органический слой и сушат над безводным сульфатом натрия. Выпаривают растворитель при пониженном давлении. Далее очищают остаток хроматографией на колонке с силикагелем (10-30% этилацетат/гексан) с получением 2-бром-6-(1-трет-бутоксикарбонилпиперидин-4-илкарбонил)пиридина (2,7 г, количественный выход). Масс-спектр (ионное распыление):(12,4 мг, 0,02 ммоль), трет-бутоксида натрия (55 мг, 0,57 ммоль) в безводном толуоле (10 мл) при 85 С в течение 16 ч. Охлаждают реакционную смесь до комнатной температуры и добавляют другую аликвотуN-метил-2,4,6-трифторбензамида, Рd2(dbа)3, BINAP и трет-бутоксид натрия в том же количестве. Снова нагревают смесь при температуре 85 С еще в течение 16 ч. Экстрагируют реакционную смесь этилацетатом и водным NaOH (0,1N). Отделяют и сушат органические слои. Неочищенный продукт концентрируют и очищают хроматографией (силикагель, 10-30% этилацетат/гексан) с получением 2,4,6-трифтор-N-метилN-[6-(1-трет-бутоксикарбонилпиперидин-4-илкарбонил)пиридин-2-ил]бензамида (86 мг, 44% выход). Растворяют 2,4,6-трифтор-N-метил-N-[6-(1-трет-бутоксикарбонилпиперидин-4-илкарбонил)пиридин 2-ил]бензамид в 50% смеси трифторуксусная кислота/СН 2 Сl2 (24 мл) и перемешивают в течение 45 мин. Удаляют летучие продукты при пониженном давлении и экстрагируют этилацетатом и водным NaOH(2M). Органические слои объединяют и сушат над сульфатом натрия. Остаток концентрируют и очищают хроматографией (силикагель, 6% (2 М NH3 в метаноле)/CH2Cl2 с получением 2,4,6-трифтор-N-метилN-[6-(пиперидин-4-илкарбонил)пиридин-2-ил]бензамида (77 мг, 85% выход). Растворяют 2,4,6-трифтор-N-метил-N-[6-(пиперидин-4-илкарбонил)пиридин-2-ил]бензамид (77 мг,- 19007966 0,20 ммоль) в метаноле (10 мл), добавляют 37% водный формальдегид (0,16 мл, 2,0 ммоль), ледяную уксусную кислоту (0,34 мл, 6,0 ммоль) и NаВН 3 СN (21,9 мг, 0,35 ммоль). Перемешивают реакционную смесь при комнатной температуре. Смесь экстрагируют этилацетатом и водным NaOH (2M) с получением 2,4,6-трифтор-N-метил-N-[6-(-гидрокси-(1-метилпиперидин-4-илкарбонил)метил)пиридин-2-ил]бензамида. Растворяют 2,4,6-трифтор-N-метил-N-[6-(-гидрокси-(1-метилпиперидин-4-илкарбонил)метил)пиридин 2-ил]бензамид в безводном CH2Cl2 (12 мл) и обрабатывают в атмосфере N2 реактивом Десс-Мартена (127 мг,0,30 ммоль) в течение 1 ч. Экстрагируют этилацетатом и водным NaOH (2M). Органические слои собирают и сушат. Остаток концентрируют и очищают хроматографией (силикагель, 6% (2 М NH3 в метаноле)/CH2Cl2) с получением указанного в заголовке соединения в виде свободного амина (60,2 мг, 77% выход). Растворяют свободное основание в метаноле (10 мл) и обрабатывают хлоридом аммония (0,032 г). Концентрируют и сушат в вакууме с получением указанного в заголовке соединения. Масс-спектр (ионное распыление): m/z=392,0 (М+1); 1 Н ЯМР (метанол-d4): 7,85 (м, 2 Н), 7,50 (м, 1 Н), 6,80 (м, 2 Н), 3,75 (м,1 Н), 3,52 (д, 2 Н), 3,47 (с, 3 Н), 3,20 (т, 2 Н), 2,94 (с, 3 Н), 2,03 (д, 2 Н), 1,83 (м, 2 Н). 16. Гидрохлоридная соль 2,4,6-трифтор-N-этил-N-[6-(1-метилпиперидин-4-илкарбонил)пиридин-2 ил]бензамида. Растворяют 2,6-дибромпиридин (5,5 г, 23,2 ммоль) в безводном дихлорметане (140 мл) в атмосфере азота. Охлаждают реакционную смесь до температуры -78 С. Очень медленно с помощью шприца добавляют раствор н-бутиллития в гексане (1,6 М, 15,8 мл, 25,3 ммоль). После завершения добавления перемешивают реакционную смесь при температуре -78 С в течение 1 ч. К реакционной смеси добавляют по каплям раствор 1-метил-N-метил-метоксипиперидин-4-карбоксамида (2 г, 11 ммоль) в безводном дихлорметане (10 мл). Перемешивают реакционную смесь при -78 С в течение 2 ч и затем дают постепенно нагреться до комнатной температуры в течение ночи. Гасят реакцию добавлением 0,1N водного раствораNaOH. Разбавляют раствор дихлорметаном (100 мл), переносят в делительную воронку и встряхивают с 2N NaOH (50 мл). Органический слой отделяют, сушат над безводным сульфатом натрия и затем выпаривают растворитель при пониженном давлении. Далее очищают остаток хроматографией на колонке с силикагелем (6%, 2 М NH3 в метаноле/СН 2 Сl2) с получением 2-бром-6-(1-метилпиперидин-4-илкарбонил) пиридина (2,3 г, 74% выход). Масс-спектр (ионное распыление) m/z 283 (М+1). Объединяют смесь 2-бром-6-(1-метилпиперидин-4-илкарбонил)пиридина (189 мг, 0,67 ммоль), Nэтил-2,4,6-трифторбензамида (162 мг, 0,80 ммоль), Pd2(dba)3 (14,6 мг, 0,016 ммоль), BINAP (19,9 мг,0,032 ммоль), трет-бутоксида натрия (90,2 мг, 0,94 ммоль) и безводного толуола (10 мл) и нагревают смесь при температуре при 85 С в течение 16 ч в атмосфере азота. Охлаждают реакционную смесь до комнатной температуры и добавляют дополнительное количество N-этил-2,4,6-трифторбензамид,Pd2(dba)3, BINAP и трет-бутоксида натрия в том же количестве. Снова нагревают смесь при температуре 85 С еще в течение 16 ч. Экстрагируют реакционную смесь этилацетатом и водным NaOH (0,1N). Отделяют и сушат органические слои. Неочищенный продукт концентрируют и очищают хроматографией(силикагель, 10-30% этилацетат/гексаны) с получением указанного в заголовке соединения в виде свободного основания (100 мг, выход 37%). Растворяют свободное основание в метаноле (10 мл) и обрабатывают хлоридом аммония (0,032 г). Концентрируют и сушат в вакууме с получением указанного в заголовке соединения. Масс-спектр (ионное распыление) m/z 406,1 (М+1). 1 Н ЯМР (метанол-d4): 7,94 (м, 2 Н),7,54 (м, 1 Н), 6,88 (м, 2 Н), 4,12 (кв., 2 Н), 3,86 (м, 1 Н), 3,77 (д, 2 Н), 3,18 (т, 2 Н), 2,94 (с, 3 Н), 2,15 (д, 2 Н),1,92 (м, 2 Н). 17. 2,4,6-Трифтор-N-[6-(пиперидин-4-илкарбонил)пиридин-2-ил]бензамид. Добавляют 1-хлорэтилхлорформиат (0,8 г) в раствор 2,4,6-трифтор-N-[6-(1-метилпиперидин-4-илкарбонил)пиридин-2-ил]бензамида (0,216 г) в дихлорэтане (10 мл) и нагревают при температуре кипения с обратным холодильником в течение 1 ч. Затем добавляют еще порцию 1-хлорэтилхлорформиата (1 мл) и нагревают при температуре кипения с обратным холодильником в течение ночи. К реакционной смеси добавляют метанол (10 мл), концентрируют до небольшого объема, разбавляют снова метанолом, наносят на колонку SCX (10 г), промывают метанолом, элюируют смесью 2 М NH3/метанол, выпаривают и очищают на колонке с силикагелем (СН 2 Сl2, в смеси 2 М NH3 в метаноле), получая указанное в заголовке соединение (61 мг). Масс-спектр (электрораспыление) m/z 364 (М+1). 1 Н ЯМР (CDCl3): 8,55 (д, J=8,1 Гц,1 Н), 7,92 (дд, J=8,0, 8,0 Гц 1 Н), 7,84 (1 Н, J=8,0 Гц, 1 Н), 6,81 (м, 3 Н), 3,89 (м, 1 Н), 3,12 (ушир.д, 2 Н), 2,81(м, 2 Н), 1,85 (м, 2 Н), 1,74 (ушир., 2 Н), 1,61 (м, 2 Н). В раствор свободного основания в смеси метиленхлорид/метанол добавляют 0,17 мл 1N HCl в эфи- 20007966 ре, выпаривают растворитель и сушат в вакууме с получением моногидрохлоридной соли. 18. 2,4,6-Трифтор-N-[6-(1-этилпиперидин-4-илкарбонил)пиридин-2-ил]бензамид. Смешивают 2,4,6-трифтор-N-[6-(пиперидин-4-илкарбонил)пиридин-2-ил]бензамид (26 мг), ацетальдегид (42 мг), цианборгидрид натрия (10 мг) и трифторуксусную кислоту (16,4 мг) в метаноле (2 мл) в запаянной пробирке и нагревают на масляной бане при температуре 90 С в течение ночи. Разбавляют смесь метанолом и наносят на колонку SCX (10 г), промывают метанолом, элюируют продукт смесью 2 М смесью NH3/метанол, выпаривают и очищают на колонке с силикагелем (4 г, растворитель: градиент смеси дихлорметан/2 М NH3 в метаноле), получая указанное в заголовке соединение (8,4 мг). Масс-спектр(электрораспыление) m/z 392 (М+1). 1 Н ЯМР (CDCl3): 8,51 (д, 1 Н), 8,42 (ушир., 1 Н), 7,92 (т, 1 Н), 7,82 (дд,1 Н), 6,84 (м, 2 Н), 3,63 (м, 1 Н), 3,02 (м, 2 Н), 2,44 (м, 2 Н), 2,04 (м, 2 Н), 1,87 (м, 4 Н), 1,60 (м, 5 Н), 1,11 (т,J=6,8 Гц, 3 Н). Растворяют свободное основание (8,4 мг) в смеси дихлорметан/метанол и добавляют 0,02 мл 1N Смешивают 2,4,6-трифтор-N-[6-(пиперидин-4-илкарбонил)пиридин-2-ил]бензамид (50 мг), пропионовый альдегид (80 мг), триацетоксиборгидрид натрия (38 мг) и уксусную кислоту (21 мг) с дихлорметаном (5 мл) и перемешивают в течение 1,5 ч. Разбавляют метанолом и наносят на колонку SCX (10 г),промывают метанолом и элюируют продукт смесью 2 М NH3/мeтaнoл. Очищают продукт на колонке с силикагелем (10 г, градиент смеси дихлорметан/2 М NH3 в метаноле), получая указанное в заголовке соединение в виде свободного основания (26 мг). Масс-спектр (электрораспыление) m/z 406 (М+1). 1 Н ЯМР (CDCl3): 8,52 (д, 1 Н), 8,38 (ушир., 1 Н), 7,92 (т, 1 Н), 7,82 (дд, 1 Н), 6,82 (м, 2 Н), 3,61 (ушир., 1 Н), 3,00(м, 2 Н), 2,34 (м, 2 Н), 2,11 (м, 2 Н), 1,87 (м, 3 Н), 1,60 (м, 5 Н), 0,90 (т, J=7,3 Гц, 3 Н). Растворяют свободное основание (26 мг) в смеси дихлорметан/метанол и добавляют 0,064 мл 1N Объединяют 2,4,6-трифтор-N-[6-(пиперидин-4-илкарбонил)пиридин-2-ил]бензамид (0,05 г, 0,138 ммоль),циклопропилметаналь (0,10 г, 1,38 ммоль) и дихлорметан (5 мл) и перемешивают при температуре окружающей среды. Через 15 мин добавляют при перемешивании ледяную уксусную кислоту (0,02 мл, 0,35 ммоль) и затем триацетоксиборгидрид натрия (0,038 г, 0,18 ммоль). Через 3 ч реакционную смесь разбавляют метанолом (5 мл) и наносят на колонку SCX (10 г). Промывают метанолом, элюируют продукт смесью 2 М аммиак/метанол и концентрируют элюат. Очищают остаток флэш-хроматографией, элюируя смесью 10% аммиак/метанол в дихлорметане, с получением указанного в заголовке соединения в виде свободного основания (0,045 г, 77%). Растворяют свободное основание в дихлорметане (5 мл), обрабатывают 1 М хлористым водородом в диэтиловом эфире (0,25 мл) и концентрируют смесь с получением гидрохлоридной соли. Т.пл.=140 С; HRMC: Найдено: m/z 418,1743; Вычислено: m/z 418,1742. 1 Н ЯМР (CDCl3): 11,51 В реактор из нержавеющей стали для проведения гидрирования вносят изонипекотиновую кислоту- 21007966 катализатор Pd/C (10%, 55% паста, 100 г). Создают в реакторе давление водорода (3 бар) и перемешивают реакционную смесь в течение ночи со скоростью 200-300 об./мин при 16-25 С. Останавливают реакцию и отфильтровывают катализатор. Промывают фильтрат водой (500 мл) и концентрируют в вакууме. Отгоняют оставшуюся воду из остатка с использованием этанола (2x1 л). Сушат твердое вещество в течение ночи в вакууме при 50 С с получением указанного в заголовке продукта в виде не совсем белого твердого вещества (1087 г, 98,1% выход). 4. Гидрохлорид N-метилизонипекотилхлорида. Суспендируют N-метилизонипекотиновую кислоту (365 г, 2,55 моль) в CH2Cl2 (3500 мл) и добавляют каталитическое количество ДМФА (2 мл). К реакционной смеси добавляют оксалилхлорид (435 г,3,42 моль, 1,35 экв.), поддерживая температуру около 20 С. Нагревают суспензию при температуре кипения с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают и концентрируют на роторном испарителе. Повторно суспендируют остаток в толуоле (1000 мл), выпаривают и сушат в вакууме с получением указанного в заголовке продукта (489 г, выход 96%) в виде не совсем белого твердого остатка, который используют без дальнейшей очистки на следующей стадии реакции. 5. N,N'-Диметил-N-метилизонипекотинамид. Повторно суспендируют гидрохлорид N-метилизонипекотилхлорида (489 г, 2,54 моль) в безводном ТГФ (5000 мл) и охлаждают суспензию до температуры 0-5 С. К реакционной смеси добавляют по каплям раствор диметиламина в ТГФ (2 М, 2500 мл, 2 экв.) и триэтиламин (775 г, 3 экв.), поддерживая температуру ниже 7 С. Перемешивают суспензию в течение 3 ч при данной температуре, затем дают суспензии нагреться до 20 С в течение ночи. Затем охлаждают реакционную смесь до 5 С и добавляют 30%NaOH (600 мл) и СН 2 Сl2 (2 л). Отделяют образовавшийся органический слой от вязкого твердого вещества и растворяют твердое вещество в воде (2 л). Экстрагируют раствор CH2Cl2 (2 л). Органические фракции объединяют, концентрируют примерно до 3500 мл и промывают дважды водой (500 мл). Органический слой сушат Na2SO4, фильтруют и концентрируют досуха. Красное масло сушат в вакууме при комнатной температуре с получением указанного в заголовке продукта (378,7 г, выход 90%). Обрабатывают эфиром и выпаривают досуха с получением продукта в виде твердого вещества. 6. 2-Бром-6-(1-метилпиперид-4-илкарбонил)пиридин. Охлаждают метил-трет-бутиловый эфир (МТБЭ) (50 мл) (Тмасс=-75 С) в атмосфере азота и добавляют н-бутиллитий (2,5 М в н-гексане, 35 мл, 0,875 моль) с получением белой суспензии. Добавляют по каплям к суспензии 2,6-дибромпиридин (20,9 г, 0,088 моль) в МТБЭ (210 мл) со скоростью, позволяющей поддерживать Тмасс ниже -65 С (40 мин). Перемешивают полученный желтый гетерогенный раствор при температуре -70 С в течение 20 мин с получением зеленого гомогенного раствора. Затем добавляютN',N-диметил-N-метилизонипекотамид (10 г, 0,0587 моль) в МТБЭ (100 мл) по каплям со скоростью, позволяющей поддерживать Тмасс ниже -65 С (20 мин). После завершения добавления перемешивают смесь при -75 С в течение 1 ч. Гасят реакцию добавлением при температуре 0-10 С насыщенного раствора хлорида аммония (30 мл). Нейтрализуют реакционную смесь (рН 7) 37% НСl (15 мл) и добавляют дополнительное количество воды (50 мл). Декантируют водную фазу и экстрагируют порциями CH2Cl2 (3x500 мл). Органические слои объединяют и промывают подкисленной водой (рН 2) (3x500 мл). Затем подщелачивают водную фазу 30% NaOH (pH 12) и экстрагируют смесь этилацетатом. (2x500 мл). Органические слои объединяют, сушат с использованием MgSO4, концентрируют при пониженном давлении и далее сушат в вакууме при комнатной температуре с получением указанного в заголовке продукта в виде масла Вносят 2-бром-6-(1-метилпиперидин-4-илкарбонил)пиперидин (20 г, 70,67 ммоль, 1 экв.) в 73,6 мл смеси 7 М NН 3/этиленгликоль (530 ммоль, 7,5 экв.) в автоклав объемом 130 мл, работающий под давлением, и добавляют в качестве катализатора Cu2O (101 мг, 0,706 ммоль, 0,01 экв.). Закрывают автоклав и нагревают реакционную смесь до 85 С при давлении примерно 50 фунт/дюйм 2 (345 кПа) в течение 20 ч. Охлаждают реакционную смесь до комнатной температуры, переносят органический слой в колбу на 250 мл и затем помещают колбу в условия пониженного давления для удаления аммиака. Добавляют воду (70 мл) и 30% NaOH (38 мл) и затем экстрагируют смесь метил-трет-бутиловым эфиром (МТБЭ) (5x100 мл). Органические слои объединяют и затем сушат MgSO4, фильтруют и концентрируют при пониженном давлении с получением неочищенного 2-амино-6-(1-метилпиперид-4-илкарбонил)пиридина (18,5 г). Повторно суспендируют неочищенный 2-амино-6-(1-метилпиперид-4-илкарбонил)пиридин (14,5 г,66,2 ммоль) в этаноле (30 мл), добавляют 2,5 М НСl/этанол (100 мл), перемешивают смесь в течение 30 мин и затем удаляют растворитель при пониженном давлении. Повторно суспендируют полученное твердое вещество в 125 мл изопропанола и нагревают при температуре кипения с обратным холодильником в течение 30 мин. Охлаждают реакционную смесь при комнатной температуре, отфильтровывают осадок,промывают 20 мл изопропанола и сушат в вакууме при 50 С с получением 2-амино-6-(1-метилпиперидин-4-илкарбонил)пиридина 2 НСl (11 г, выход 63%, скорректированный по данным ВЭЖХ, мас.%). Повторно суспендируют 2-амино-6-(1-метилпиперид-4-илкарбонил)пиридин 2 НСl (129,5 г) в этилацетате (100 мл) и добавляют 10 М NaOH (50 мл) и воду (50 мл) для нейтрализации суспензии. Отделяют органический слой и экстрагируют водную фазу этилацетатом (2x150 мл). Органические слои объединяют, сушат MgSO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке продукта (21 г). Примеры 21. 2,4,6-Трифтор-N-[6-(1-метилпиперидин-4-илкарбонил)пиридин-2-ил]бензамид. В атмосфере азота добавляют триэтиламин (10,67 мл, 76,60 ммоль, 2,4 экв.) к раствору 2-амино-6(1-метилпиперидин-4-илкарбонил)пиперидина (7 г, 31,96 ммоль, 1 экв.) в безводном ТТФ (100 мл). Добавляют по каплям при комнатной температуре 2,4,6-трифторбензоилхлорид (7,46 г, 5 мл, 38,35 ммоль,1,20 экв.). Через 2 ч в реакционную смесь добавляют дополнительное количество 2,4,6-трифторбензоилхлорида (0,75 мл, 0,15 экв.) и триэтиламина (1,32 мл, 0,3 экв.) и перемешивают полученную смесь еще в течение 3 ч. Гасят реакцию добавлением дистиллированной воды (10 мл) и 30% NaOH (15 мл). Перемешивают полученную двухфазную систему в течение 1 ч и затем разделяют фазы. Экстрагируют органическую фракцию добавлением Н 2O (75 мл) и уксусной кислоты (12 мл) и затем циклогексана (70 мл). Промывают органическую фракцию Н 2O (50 мл), содержащей уксусную кислоту (1 мл). Объединяют все водные фракции и промывные воды и нейтрализуют смесь 30% NaOH (15 мл). Экстрагируют метил-третбутиловым эфиром (МТБЭ) (3x50 мл). Объединяют органические фракции и сушат MgSO4, фильтруют,концентрируют при пониженном давлении и сушат в вакууме при комнатной температуре с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (11,031 г, 91% выход). Масс-спектр (электрораспыление) m/z=378 (М+1); 1 Н ЯМР (250 МГц, хлороформ-D) м.д. 1,54 (м, 2 Н), 2,02- 23007966 свободного основания (5 г, 23,26 ммоль) в изопропаноле (50 мл) при комнатной температуре и добавляют 3,3 М раствор диэтиловый эфир/НСl (8 мл). Нагревают реакционную смесь при температуре кипения с обратным холодильником в течение 30 мин. Охлаждают реакционную смесь до комнатной температуры и перемешивают в течение 2 ч. Отфильтровывают полученный белый осадок и промывают его изопропанолом (5 мл). Сушат остаток твердого вещества при пониженном давлении и при температуре 40 С в течение ночи с получением указанного в заголовке соединения (5,12 г, выход 93%). Т.пл. 223-223 С Добавляют янтарную кислоту (0,25 г, 2,148 ммоль, 0,5 экв.) к раствору 2,4,6-трифтор-N-[6-(1-метилпиперидин-4-илкарбонил)пиперидин-2-ил]бензамида в виде свободного основания (1,62 г, 4,297 ммоль, 1 экв.) в ацетоне (16,2 мл) при комнатной температуре. Нагревают раствор при температуре кипения с обратным холодильником в течение 30 мин. Охлаждают реакционную смесь до комнатной температуры и отфильтровывают полученный белый осадок. Промывают осадок ацетоном (0,2 мл) и сушат в вакууме при 50 С в течение 16 ч с получением указанного в заголовке соединения (1,5 г, выход 80%). Т.пл. 198,5 С. Масс-спектр (электрораспыление) m/z=495,45. Приведенные ниже примеры описывают получение соединений методами комбинаторной химии следующим образом. Примеры 24-54. Объединяют R-кислоту (300 мкл 0,5 М раствора в диметилформамиде (ДМФА, HATU (57 г, 0,15 ммоль),коллидин (19 мкл, 0,15 ммоль), 2-амино-6-(1-метилпиперидин-4-илкарбонил)пиридин и ДМФА (1,5 мл) и перемешивают в течение 48 ч. Разбавляют реакционную смесь 10% уксусной кислотой в метаноле (0,5 мл). Наносят реакционную смесь на колонку с 2 г SCX. Тщательно промывают колонку метанолом и затем элюируют 1 М аммиаком в метаноле. Концентрируют элюент и далее очищают продукт высокопроизводительной хроматографией. Указанную методику повторяют параллельно в примерах 24-54. Примеры 55-58. Нагревают R-хлорангидрид (300 мкл 0,5 М раствора в пиридине) до 55 С, добавляют 2-амино-6-(1 метилпиперидин-4-илкарбонил)пиридин (200 мкл 0,5 раствора в пиридине) и продолжают нагревание реакционной смеси в течение 24 ч. Концентрируют реакционную смесь и затем разбавляют 10% уксусной кислотой в метаноле (0,5 мл) и метанолом (5 мл). Наносят полученную реакционную смесь непосредственно на колонку с 2 г SCX. Тщательно промывают колонку метанолом и затем элюируют колонки 1 М аммиаком в метаноле. Концентрируют элюент и затем очищают продукт высокопроизводительной хроматографией. Указанную методику повторяют параллельно в примерах 55-58. Примеры 59-71. Нагревают 2-амино-6-(1-метилпиперидин-4-илкарбонил)пиридин (200 мкл 0,5 М раствора в пиридине) до 55 С, затем добавляют R-хлорангидрид (0,10 ммоль) и нагревают в течение 2 ч. Концентрируют реакционную смесь и затем разбавляют 10% уксусной кислотой в метаноле (0,5 мл) и метанолом (5 мл). Наносят полученную реакционную смесь непосредственно на колонку с 2 г SCX. Тщательно промывают колонку метанолом и затем элюируют колонку 1 М аммиаком в метаноле. Концентрируют элюат и затем очищают продукт высокопроизводительной хроматографией. Указанную методику повторяют парал- 24007966 лельно в примерах 59-71. Полученные методами рекомбинантной химии соединения описывают далее с использованием для анализа жидкостной хроматографии/масс-спектроскопии на спектрометре Shimadzu QP8000. В примерах 24-45 и 55-58 используют методы, выполняемые на колонке Metachem C18 (монохром 3 мкм,2,5x25 см) с использованием 10-90% градиента растворителя В в течение 4,5 мин, где растворитель А представляет собой 0,1% трифторуксусную кислоту в воде и растворитель В представляет собой 0,1% трифторуксусную кислоту в ацетонитриле. В примерах 46-54 и 59-71 используют методы, выполняемые на колонке Metachem C18 (монохром 5 мкм, 4,6x50 см) с использованием 10-80% градиента растворителя В в течение 9 мин, где растворитель А представляет собой 0,1% трифторуксусную кислоту в воде и растворитель В представляет собой 0,08% трифторуксусную кислоту в ацетонитриле.
МПК / Метки
МПК: C07D 409/14, C07D 401/06, A61P 25/06, C07D 401/14, A61K 31/44
Метки: агонисты, пиридиноилпиперидины, 5-нт1f
Код ссылки
<a href="https://eas.patents.su/30-7966-piridinoilpiperidiny-kak-agonisty-5-nt1f.html" rel="bookmark" title="База патентов Евразийского Союза">Пиридиноилпиперидины как агонисты 5-нт1f</a>
Предыдущий патент: Способ получения комбретастатинов
Следующий патент: Защита, восстановление и усиление эритропоэтинреактивных клеток, тканей и органов
Случайный патент: Электроимпедансный компьютерный маммограф












