Агонисты ppar&alpha и их применение
Номер патента: 8947
Опубликовано: 26.10.2007
Авторы: Мадхаван Гуррам Ранга, Дас Сайбал Кумар, Бхуния Дебназ, Чакрабарти Ранджан, Викрамадитян Риба Каннимел, Икбал Джавед
Формула / Реферат
1. Соединение формулы (I)
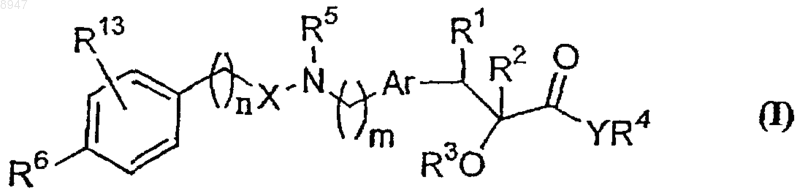
где R1 обозначает водород, гидроксигруппу;
R2 обозначает водород,
R3 обозначает водород или замещенные или незамещенные группы, представленные линейными или разветвленными (С1-С12)алкильными группами;
R4 обозначает водород или замещенные или незамещенные группы, представленные линейными или разветвленными (С1-С12)алкильными группами;
Y обозначает кислород,
R5 обозначает водород или замещенную или незамещенную группу, представленную алкилом, или ароил,
Аr обозначает замещенный или незамещенный двухвалентный фенилен,
X обозначает -С(=O)-, -C(=S)-, -C(=S)-O, -C(=O)-O-, -C(=O)-S-, -C(=S)-O-, -O-(CH2)d-, -NH-(CH2)d-, где d обозначает целое число в интервале 1-4, -O-С(=O)-, -C(O)CH2-, -CRa=CRb-CH2-, где Ra и Rb могут быть одинаковыми или разными и обозначают водород или (С1-С6)алкил, или X обозначает связь,
R6 обозначает замещенную или незамещенную группу, выбранную из -OSO2R8 или -NR8COR9, где R8 обозначает водород, или замещенный или незамещенный алкил или арил, арилалкил, алкоксикарбонил или арилалкоксикарбонил, a R9 обозначает водород, или замещенный или незамещенный алкил, при условии, что R6 обозначает водород, когда R13 находится в третьей позиции фенильного кольца и не обозначает водород,
R13 обозначает водород, -OSO2алкил; и
n обозначает целое число в интервале от 0 до 6 и
m обозначает целое число в интервале от 0 до 6;
и стереоизомеры, таутомерные формы, фармацевтически приемлемые соли, фармацевтически приемлемые сольваты соединения с общей формулой (I).
2. Соединение формулы (I) по п.1, в котором
R1 обозначает водород;
R2 обозначает водород;
R3 обозначает водород, линейный или разветвленный (С1-С12)алкил;
R4 обозначает водород, линейный или разветвленный (С1-С12)алкил;
R5 обозначает водород, (С1-С12)алкил или ароил;
R6 обозначает -OSO2R8 или -NR8SO2R9;
R8 обозначает водород, линейный или разветвленный (С1-С6)алкил или замещенный или незамещенный арил;
R9 обозначает водород, линейный или разветвленный (С1-С6)алкил;
R13 обозначает водород или -OSO2R8;
X обозначает O-С(=O)-, -O(CH2)d, -CH=CH-CH2- или X обозначает связь;
Y обозначает кислород;
m обозначает целое число от 0 до 1; и
n обозначает целое число от 0 до 2.
3. Соединение формулы (I) по п.2, в котором
R1 обозначает водород;
R2 обозначает водород;
R3 обозначает водород или линейный или разветвленный (С1-С12)алкил;
R4 обозначает водород или линейный или разветвленный (С1-С12)алкил;
R5 обозначает водород, или (С1-С12)алкил, или ароил;
R6 обозначает -OSO2R8 или -NR8SO2R9,
R8 обозначает линейный или разветвленный (С1-С6)алкил или замещенную арильную группу, в которой заместителем является линейный или разветвленный (С1-С6)алкил;
R9 обозначает линейный или разветвленный (С1-С6)алкил;
R13 обозначает водород или -OSO2R8 и
X обозначает связь.
4. Соединение по пп.1-3, выбранное из
этил-2-метокси-3-[4-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионата или его солей в форме отдельных энантиомеров или рацемата,
этил-2-этокси-3-[4-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионата или его солей в форме отдельных энантиомеров или рацемата,
этил-2-этокси-3-[4-{3-(4-метансульфонилоксифенил)пропилоксикарбониламино}фенил]пропионата или его солей в форме отдельных энантиомеров или рацемата,
этил-2-этокси-3-[4-{3-(3-метансульфонилоксифенил)пропиламино}фенил]пропионата или его солей в форме отдельных энантиомеров или рацемата,
этил-2-этокси-3-[4-{3-(4-(толуол-4-сульфонилокси)фенил)пропиламино}фенил]пропионата или его солей в форме отдельных энантиомеров или рацемата,
этил-2-этокси-3-[3-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионата или его солей в форме отдельных энантиомеров или рацемата,
этил-2-изопропокси-3-[4-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионата или его солей в форме отдельных энантиомеров или рацемата,
этил-2-этокси-3-[4-(4-метилсульфонилоксифенетиламино)фенил]пропионата или его солей в форме отдельных энантиомеров или рацемата,
этил-2-этокси-3-{4-[(Е)-3-(4-метилсульфонилоксифенил)-2-пропениламино]фенил}пропионата или его солей в форме отдельных энантиомеров или рацемата,
метил-2-этокси-3-[4-(4-метансульфонилоксибензиламино)фенил]пропионата или его солей в форме отдельных энантиомеров или рацемата,
2-метокси-3-[4-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата,
2-этокси-3-[4-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата,
2-этокси-3-[4-{3-(4-метансульфонилоксифенил)пропилоксикарбониламино}фенил]пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата,
2-этокси-3-[4-{3-(3-метансульфонилоксифенил)пропиламино}фенил]пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата,
2-этокси-3-[4-{3-(4-(толуол-4-сульфонилокси)фенил)пропиламино}фенил]пропионата или его солей в форме отдельных энантиомеров или рацемата,
2-этокси-3-[3-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата,
2-изопропокси-3-[4-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата,
2-этокси-3-[4-(4-метансульфонилоксибензиламино)фенил]пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата,
2-этокси-3-[4-(4-метилсульфонилоксифенетиламино)фенил]пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата,
2-этокси-3-{4-[(E)-3-(4-метилсульфонилоксифенил)-2-пропениламино]фенил}пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата,
этил-2-этокси-3-[4-(4-метилсульфонилоксибензилкарбоксамидо)фенил]пропионата или его солей в форме отдельных энантиомеров или рацемата,
2-этокси-3-[4-(4-метилсульфонилоксибензилкарбоксамидо)фенил]пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата,
этил-2-этокси-3-[4-{3-(4-метилсульфонамидофенил)пропиламино}фенил]пропионата или его солей в форме отдельных энантиомеров или рацемата,
2-этокси-3-[4-{3-(4-метилсульфонамидофенил)пропиламино}фенил]пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата,
этил-2-этокси-3-{4-[(E)-2-(4-метилсульфонилоксифенил)-1-этенилкарбоксамидо]фенил}пропионата или его солей в форме отдельных энантиомеров или рацемата,
2-этокси-3-(4-[(E)-2-(4-метилсульфонилоксифенил)-1-этенилкарбоксамидо]фенил}пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата,
этил-2-этокси-3-[4-(4-метилсульфонилоксифенетилкарбоксамидо)фенил]пропионата или его солей в форме отдельных энантиомеров или рацемата,
2-этокси-3-[4-(4-метилсульфонилоксифенетенилкарбоксамидо)фенил]пропионотющ кислоты или ее солей в форме отдельных энантиомеров или рацемата,
этил-2-метокси-3-[4-{(E)-3-(4-метилсульфонилоксифенил)-2-пропениламино}фенил]пропионата или его солей в форме отдельных энантиомеров или рацемата,
2-метокси-3-[4-{(E)-3-(4-метилсульфонилоксифенил)-2-пропениламино}фенил]пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата,
этил-2-метокси-3-[4-{3-(3-метансульфонилоксифенил)пропиламино}фенил]пропионата или его солей в форме отдельных энантиомеров или рацемата,
2-метокси-3-[4-{3-(3-метансульфонилоксифенил)пропиламино}фенил]пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата,
этил-2-этокси-3-{4-[(E)-3-(4-метилсульфонилоксифенил)-2-пропенил(фенил)карбоксамидо]фенил}пропионата или его солей в форме отдельных энантиомеров или рацемата,
2-этокси-3-{4-[(E)-3-(4-метилсульфонилоксифенил)-2-пропенил(фенил)карбоксамидо]фенил}пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата,
метил-2-метокси-3-{4-[(E)-3-(4-метилсульфонилоксифенил)-2-пропенил(фенил)карбоксамидо]фенил}пропионата или его солей в форме отдельных энантиомеров или рацемата,
2-метокси-3-{4-[(Е)-3-(4-метилсульфонилоксифенил)-2-пропенил(фенил)карбоксамидо]фенил}пропионовой кислоты или ее солей в форме отдельных энантиомеров или рацемата.
5. Соединение по п.1, в котором фармацевтически приемлемая соль выбрана из группы, состоящей из солей Li, Na, K, Са, Mg, Fe, Cu, Zn, Al, Mn, N,N'-диацетилэтилендиамина, бетаина, кофеина, 2-диэтиламиноэтанола, 2-диметиламиноэтанола, н-этилморфолина, н-этилпиперидина, глюкамина, глюкозамина, гидрабамина, изопропиламина, метилглюкамина, морфолина, пиперазина, пиперидина, прокаина, теобромина, валинола, диэтиламина, триэтиламина, триметиламина, трипропиламина, трометамина, адамантиламина, диэтаноламина, меглумина, этилендиамина, N,N'-дифенилэтилендиамина, N,N'-дибензилэтилендиамина, N-бензилфенилэтиламина, холина, холина гидроксида, дициклогексиламина, метформина, бензиламина, фенилэтиламина, диалкиламина, триалкиламина, тиамина, аминопиримидина, аминопиридина, пурина, пиримидина, спермидина, алкилфениламина, этаноламина, фенилэтаноламина, глицина, аланина, валина, лейцина, изолейцина, норлейцина, тирозина, цистина, цистеина, метионина, пролина, гидроксипролина, гистидина, орнитина, лизина, аргинина, серина, треонина, фенилаланина, аминокислот, таких как D-изомеры или незамещенные аминокислоты, D-изомеров или замещенных аминокислот, солей кислых аминокислот, выбранных из аспарагиновой кислоты или глутаминовой кислоты, гуанидина, замещенного гуанидина, в котором заместители выбраны из нитрогруппы, аминогруппы, алкила, алкенила или алкинила, аммония, замещенных аммониевых солей, сульфатов, нитратов, фосфатов, перхлоратов, боратов, гидрогалогенидов (HCl, HBr, Hl), ацетатов, тартратов, малеатов, цитратов, сукцинатов, пальмоатов, метансульфонатов, бензоатов, салицилатов, гидроксинафтоатов, бензолсульфонатов, аскорбатов, глицерофосфатов или кетоглутаратной соли.
6. Способ получения соединения формулы (I) по п.1

его таутомерных форм, его стереоизомеров или его фармацевтически приемлемых солей, его фармацевтически приемлемых сольватов, в которой все символы имеют указанные выше значения, включающий проведение реакции соединения формулы (IIIg)
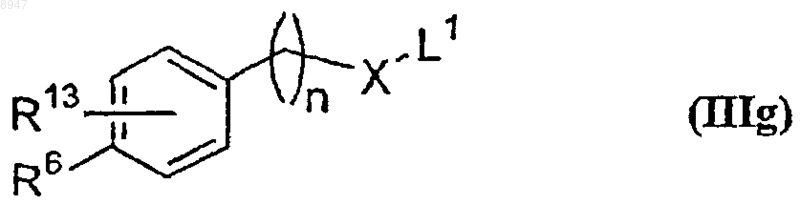
где R6, R13, X и n имеют значения, указанные в п.1, и L1 обозначает уходящую группу, с соединением формулы (IIIf)
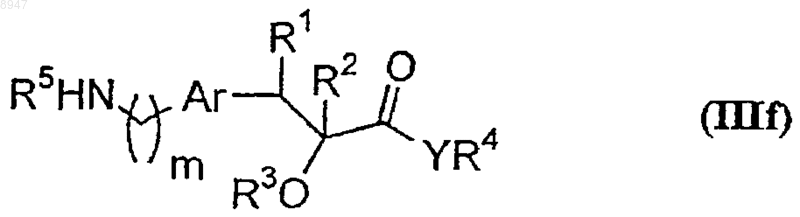
где R1 и R2 вместе обозначают связь, а все другие символы имеют указанные выше значения, с образованием соединения формулы (I).
7. Способ получения соединения формулы (I) по п.1
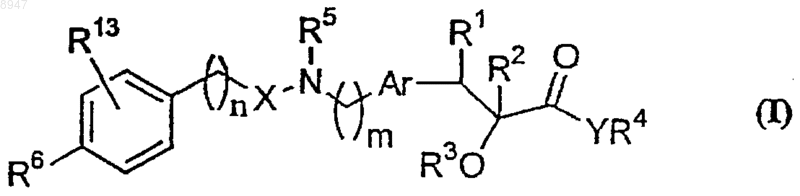
его таутомерных форм, его стереоизомеров или его фармацевтически приемлемых солей, его фармацевтически приемлемых сольватов, в которой все символы имеют указанные выше значения, включающий проведение реакции соединения формулы (IVg)
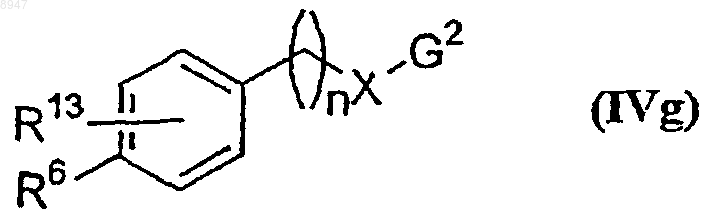
где G2 обозначает NH2 или -СНО, а все другие символы имеют указанные выше значения, с соединением формулы (IVf)
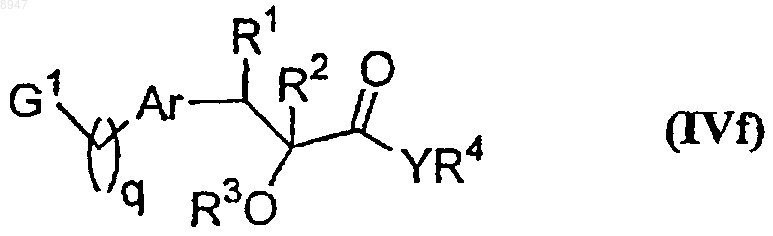
где G1 обозначает NH2, если G2 обозначает -СНО, или G1 обозначает -СНО, если G2 обозначает NH2, q имеет значение от 0 до 6, а все другие символы имеют указанные выше значения, с образованием соединения формулы (I), где R5 обозначает водород, а все другие символы имеют указанные выше значения.
8. Промежуточное соединение формулы (IIIa)
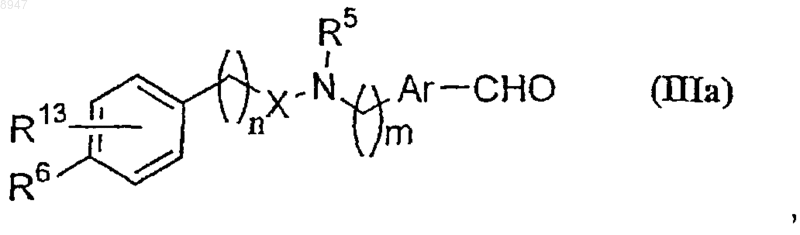
его стереоизомеры, таутомерные формы, фармацевтически приемлемые соли, фармацевтически приемлемые сольваты, где R5 обозначает водород или замещенную или незамещенную группу, представленную алкилом, или ароил, n и m являются целыми числами в интервале 0-6, Ar обозначает замещенный или незамещенный двухвалентный фенилен, X обозначает С=O, C=S, -C(O)CH2-, -СН=СН-СН2-, или X обозначает связь, R6 обозначает замещенную или незамещенную группу, выбранную из -OSO2R8 или
-NR8COR9, где R8 обозначает водород или замещенный или незамещенный алкил или арил, арилалкил, алкоксикарбонил или арилалкоксикарбонил, a R9 обозначает водород или замещенный или незамещенный алкил, при условии, что R6 обозначает водород, когда R13 находится в третьей позиции фенильного кольца и не обозначает водород, R13 обозначает водород, -OSO2алкил.
9. Способ получения соединения формулы (IIIa)
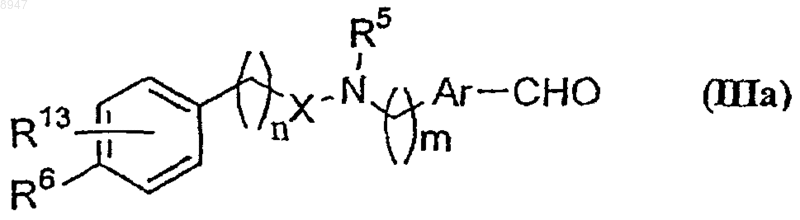
его таутомерных форм, его стереоизомеров, как определено в п.8, включающий:
i) проведение реакции соединения формулы (IIIk)
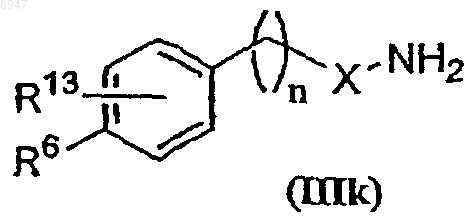
где X обозначает С(O)СН2-, -СН=СН-СН2- или X обозначает связь и R6 и R13 имеют значения, указанные в п.6, с соединением формулы (IIIl)
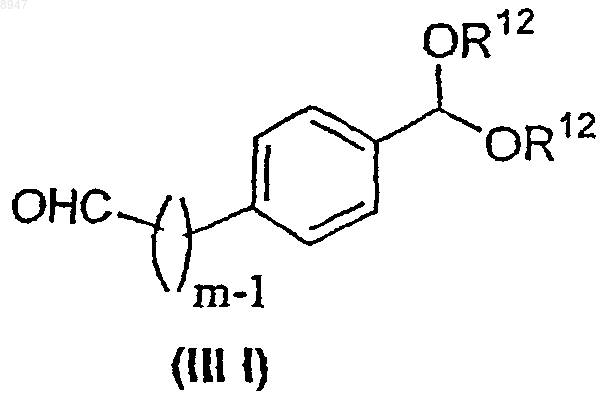
где R12 обозначает водород или (С1-С6)алкильную группу и m имеет значения в интервале от 1 до 6, с образованием соединения формулы (IIIm)
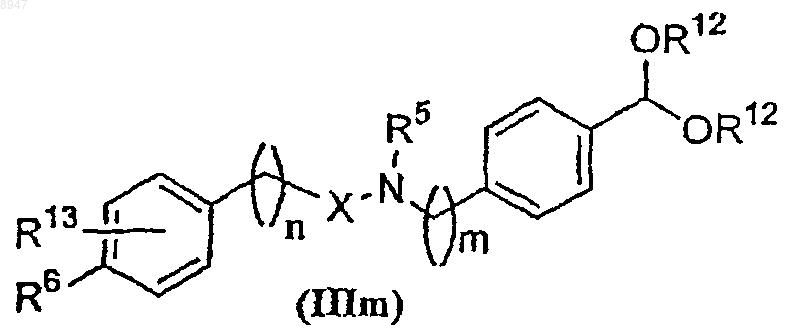
где все символы имеют указанные выше значения, и
ii) превращение соединения формулы (IIIm) в соединение формулы (IIIа) в присутствии кислоты или основания, где R5 обозначает водород, X обозначает С(O)СН2-, -СН=СН-СН2- или X обозначает связь, m равняется 0, Ar обозначает фенил, а все другие символы имеют указанные выше значения.
10. Способ получения соединения формулы (IIIa)
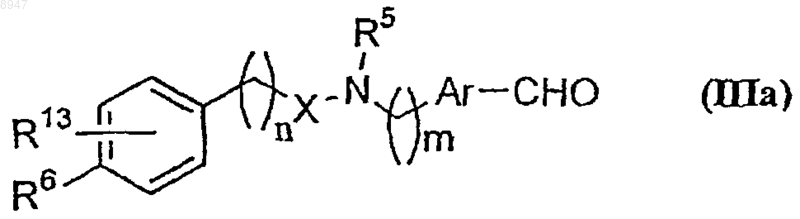
его таутомерных форм, его стереоизомеров, как определено в п.8, включающий проведение реакции соединения формулы (IIIg)
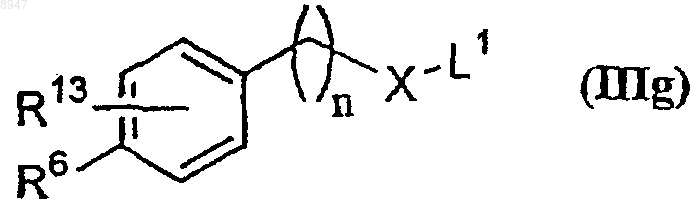
где все символы имеют указанные выше значения, с соединением формулы (IIIn)
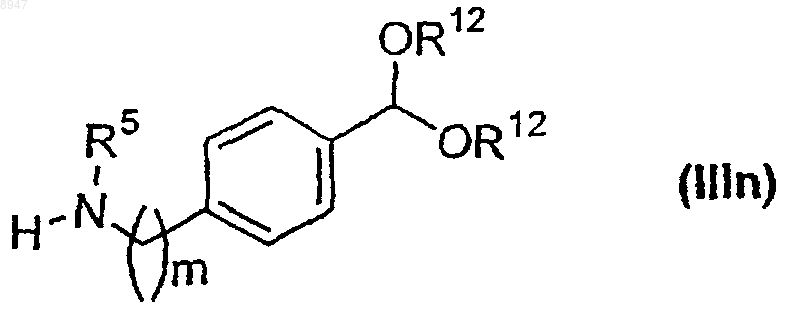
где R12 обозначает водород или алкильную группу, m обозначает целое число в интервале 0-6 и R5 имеет указанные выше значения, с образованием соединения формулы (IIIa), где R5 обозначает водород или алкильную группу, m равняется 0 или 1, а все другие символы имеют указанные выше значения.
11. Композиция, включающая соединение формулы (I)

определенной в любом из пп.1-5, и фармацевтически приемлемый носитель, разбавитель, эксципиент или сольват.
12. Композиция, включающая соединение формулы (I), определенной в пп.1-5, ингибитор HMG СоА-редуктазы, ингибитор всасывания холестерина, средство для борьбы с ожирением, средство для лечения липопротеидных расстройств, гипогликемический агент, инсулин, бигуанид, сульфонилмочевину, тиазолидиндион, двойной агонист PPARa и g или их смесь и фармацевтически приемлемый носитель, разбавитель, эксципиент или сольват.
13. Фармацевтическая композиция по п.11 или 12 в форме таблетки, капсулы, порошка, сиропа, раствора или суспензии.
14. Способ лечения или профилактики диабета, вызванного инсулинорезистентностью или нарушенной толерантностью к глюкозе, включающий введение соединения формулы (I), определенной в пп.1-5, или фармацевтической композиции по п.11 или 12 нуждающемуся в этом пациенту.
15. Способ лечения или профилактики диабета, вызванного инсулинорезистентностью или нарушенной толерантностью к глюкозе, или осложнений диабета, в котором осложнение является дислипидемией, инсультом, гиперлипидемией, гиперхолестеринемией, гипергликемией, остеопорозом, атеросклерозом, лептинорезистентностью, гипертензией, ожирением, ишемической болезнью сердца, сердечно-сосудистыми расстройствами, болезнью почек, гломерулонефритом, гломерулосклерозом, нефротическим синдромом, гипертензивным нефросклерозом, нефропатией, ретинопатией, расстройствами, связанными с активацией эндотелиальных клеток, псориазом, синдромом поликистозных яичников (PCOS), деменцией, воспалительными болезнями кишечника, миотонической дистрофией, панкреатитом, артериосклерозом, ксантомой, расстройствами питания, раком или остеопорозом, или использование в качестве ингибитора альдозоредуктазы или как противовоспалительного агента, включающий введение соединения формулы (I), определенной в пп.1-5, или фармацевтической композиция по п.11 или 12 нуждающемуся в этом пациенту.
16. Способ лечения или профилактики гиперлипидемии, гиперхолестеринемии, гипергликемии, остеопороза, ожирения, нарушенной толерантности к глюкозе, атеросклероза, лептинорезистентности, инсулинорезистентности или болезней, в которых инсулинорезистентность является базовым патофизиологическим механизмом, включающий введение соединения формулы (I), определенной в пп.1-5, или фармацевтической композиции по п.11 или 12 нуждающемуся в этом пациенту.
17. Способ лечения или профилактики расстройств, связанных с синдромом X, включающий введение агониста PPAR формулы (I) по пп.1-5 или фармацевтической композиции по п.11 или 12 нуждающемуся в этом пациенту.
18. Способ по п.17, в котором расстройство является гипертензией, ожирением, инсулинорезистентностью, атеросклерозом, ишемической болезнью сердца или сердечно-сосудистым расстройством.
19. Способ снижения общего холестерина, веса тела, глюкозы плазмы крови, инсулина, Hb1C, триглицеридов, LDL, VLDL или свободных жирных кислот или повышения HDL в плазме, включающий введение соединения формулы (I), определенной в пп.1-5, или фармацевтической композиции по п.11 или 12 нуждающемуся в этом пациенту.
20. Способ лечения или профилактики гиперлипидемии, гиперхолестеринемии, гипергликемии, остеопороза, ожирения, нарушенной толерантности к глюкозе, атеросклероза, лептинорезистентности, инсулинорезистентности или болезней, в которых инсулинорезистентность является базовым патофизиологическим механизмом, включающий введение нуждающемуся в этом пациенту эффективного количества соединения формулы (I), определенной в пп.1-5, или фармацевтической композиции по п.11 или 12, в комбинации/совместно с ингибитором HMG СоА-редуктазы, ингибитором всасывания холестерина, средством для борьбы с ожирением, средством для лечения липопротеидных расстройств, гипогликемическим агентом: инсулином, бигуанидом, сульфонилмочевиной, тиазолидиндионом, двойным агонистом PPARa и g, или их смесью, или их комбинацией в течение периода времени, позволяющего обеспечить их синергическое и/или аддитивное действие.
21. Способ лечения или профилактики диабета, вызванного инсулинорезистентностью или нарушенной толерантностью к глюкозе, или осложнения диабета, в котором осложнение является дислипидемией, инсультом, гиперлипидемией, гиперхолестеринемией, гипергликемией, остеопорозом, атеросклерозом, лептинорезистентностью, гипертензией, ожирением, ишемической болезнью сердца, сердечно-сосудистыми расстройствами, болезнью почек, гломерулонефритом, гломерулосклерозом, нефротическим синдромом, гипертензивным нефросклерозом, нефропатией, ретинопатией, расстройствами, связанными с активацией эндотелиальных клеток, псориазом, синдромом поликистозных яичников (PCOS), деменцией, воспалительными болезнями кишечника, миотонической дистрофией, панкреатитом, артериосклерозом, ксантомой, расстройствами питания, раком или остеопорозом, или использование в качестве ингибитора альдозоредуктазы или как противовоспалительного агента, включающий введение соединения формулы (I), определенной в пп.1-5, или фармацевтической композиции по п.11 или 12 нуждающемуся в этом пациенту, в комбинации/совместно с ингибитором HMG СоА-редуктазы, ингибитором всасывания холестерина, средством для борьбы с ожирением, средством для лечения липопротеидных расстройств, гипогликемическим агентом: инсулином, бигуанидом, сульфонилмочевиной, тиазолидиндионом, двойным агонистом PPARa и g, или их смесью, или их комбинацией в течение периода времени, позволяющего обеспечить их синергическое и/или аддитивное действие.
22. Способ лечения или профилактики расстройств, связанных с синдромом X, включающий введение нуждающемуся в этом пациенту агониста PPAR формулы (I) по пп.1-5 или фармацевтической композиции по п.11 или 12 и ингибитора HMG СоА-редуктазы, ингибитора всасывания холестерина, средства для борьбы с ожирением, средства для лечения липопротеидных расстройств, гипогликемического агента: инсулина, бигуанида, сульфонилмочевины, тиазолидиндиона, двойного агониста PPARa и g, или их смеси, или их комбинации в течение периода времени, позволяющего обеспечить их синергическое и/или аддитивное действие.
23. Способ по п.22, в котором расстройство является гипертензией, ожирением, инсулинорезистентностью, атеросклерозом, ишемической болезнью сердца или сердечно-сосудистым расстройством.
24. Способ снижения общего холестерина, веса тела, глюкозы плазмы крови, инсулина, Hb1c, триглицеридов, LDL, VLDL или свободных жирных кислот или повышения HDL в плазме, включающий введение соединения формулы (I) по пп.1-5 или фармацевтической композиции по п.9 или 10, в комбинации/совместно с ингибитором HMG СоА-редуктазы, ингибитором всасывания холестерина, средством для борьбы с ожирением, средством для лечения липопротеидных расстройств, гипогликемическими агентами: инсулином, бигуанидом, сульфонилмочевиной, тиазолидиндионом, двойным агонистом PPARa и g или их смесью, которые могут быть введены вместе с ними или в течение периода времени, позволяющего обеспечить их синергическое и/или аддитивное действие, нуждающемуся в этом пациенту.
25. Применение соединения формулы (I) по любому из пп.1-5 или фармацевтической композиции по п.11 или 12 для изготовления лекарственного средства для лечения и/или профилактики диабета, вызванного инсулинорезистентностью или нарушенной толерантностью к глюкозе.
26. Применение соединения формулы (I) по любому из пп.1-5 или фармацевтической композиции по п.11 или 12 для изготовления лекарственного средства для лечения и/или профилактики диабета, вызванного инсулинорезистентностью или нарушенной толерантностью к глюкозе, или осложнения диабета, в котором осложнение является дислипидемией, инсультом, гиперлипидемией, гиперхолестеринемией, гипергликемшхщ, остеопорозом, атеросклерозом, лептинорезистентностью, гипертензией, ожирением, ишемической болезнью сердца, сердечно-сосудистыми расстройствами, болезнью почек, гломерулонефритом, гломерулосклерозом, нефротическим синдромом, гипертензивным нефросклерозом, нефропатией, ретинопатией, расстройствами, связанными с активацией эндотелиальных клеток, псориазом, синдромом поликистозных яичников (PCOS), деменцией, воспалительными болезнями кишечника, миотонической дистрофией, панкреатитом, артериосклерозом, ксантомой, расстройствами питания, раком или остеопорозом, или в качестве ингибитора альдозоредуктазы или противовоспалительного агента.
27. Применение соединения формулы (I) по любому из пп.1-5 или фармацевтической композиции по п.11 или 12 для изготовления лекарственного средства для лечения и/или профилактики гиперлипидемии, гиперхолестеринемии, гипергликемии, остеопороза, ожирения, нарушенной толерантности к глюкозе, атеросклероза, лептинорезистентности, инсулинорезистентности или болезней, в которых инсулинорезистентность является базовым патофизиологическим механизмом.
28. Применение соединения формулы (I) по любому из пп.1-5 или фармацевтической композиции по п.11 или 12 для изготовления лекарственного средства для лечения и/или профилактики расстройств, связанных с синдромом X, включающее введение агониста PPARa и/или PPARg.
29. Применение соединения по п.28, в котором расстройство является гипертензией, ожирением, инсулинорезистентностью, атеросклерозом, ишемической болезнью сердца или сердечно-сосудистым расстройством.
30. Применение соединения формулы (I) по любому из пп.1-5 или фармацевтической композиции по п.11 или 12 для изготовления лекарственного средства для снижения общего холестерина, веса тела, глюкозы плазмы крови, инсулина, Hb1c, триглицеридов, LDL, VLDL или свободных жирных кислот или повышения HDL в плазме.
31. Применение соединения формулы (1) по любому из пп.1-5 или фармацевтической композиции по п.11 или 12 в комбинации/совместно с ингибитором HMG СоА-редуктазы, ингибитором всасывания холестерина, средством для борьбы с ожирением, средством для лечения липопротеидных расстройств, гипогликемическим агентом: инсулином, бигуанидом, сульфонилмочевиной, тиазолидиндионом или двойным агонистом PPARa и g или их комбинацией для изготовления лекарственного средства для лечения и/или профилактики гиперлипидемии, гиперхолестеринемии, гипергликемии, остеопороза, ожирения, нарушенной толерантности к глюкозе, атеросклероза, лептинорезистентности, инсулинорезистентности или болезней, в которых инсулинорезистентность является базовым патофизиологическим механизмом.
32. Применение соединения формулы (I) по любому из пп.1-5 или фармацевтической композиции по п.11 или 12 в комбинации с ингибитором HMG СоА-редуктазы, ингибитором всасывания холестерина, средством для борьбы с ожирением, средством для лечения липопротеидных расстройств, гипогликемическим агентом: инсулином, бигуанидом, сульфонилмочевиной, тиазолидиндионом или двойным агонистом PPARa и g, или их смесью, или их комбинацией, для изготовления лекарственного средства для лечения и/или профилактики диабета, вызванного инсулинорезистентностью или нарушенной толерантностью к глюкозе, или осложнения диабета, в котором осложнение является дислипидемией, инсультом, гиперлипидемией, гиперхолестеринемией, гипергликемией, остеопорозом, атеросклерозом, лептинорезистентностью, гипертензией, ожирением, ишемической болезнью сердца, сердечно-сосудистыми расстройствами, болезнью почек, гломерулонефритом, гломерулосклерозом, нефротическим синдромом, гипертензивным нефросклерозом, нефропатией, ретинопатией, расстройствами, связанными с активацией эндотелиальных клеток, псориазом, синдромом поликистозных яичников (PCOS), деменцией, воспалительными болезнями кишечника, миотонической дистрофией, панкреатитом, артериосклерозом, ксантомой, расстройствами питания, раком или остеопорозом, или в качестве ингибитора альдозоредуктазы или как противовоспалительного агента.
33. Применение соединения формулы (I) по любому из пп.1-5 или фармацевтической композиции по п.11 или 12 в комбинации с ингибитором HMG СоА-редуктазы, ингибитором всасывания холестерина, средством для борьбы с ожирением, средством для лечения липопротеидных расстройств, гипогликемическим агентом: инсулином, бигуанидом, сульфонилмочевинами, тиазолидиндионом или двойным агонистом PPARa и g или их комбинацией для изготовления лекарственного средства для лечения и/или профилактики расстройств, связанных с синдромом X.
34. Применение соединения по п.33, в котором расстройство является гипертензией, ожирением, инсулинорезистентностью, атеросклерозом, ишемической болезнью сердца или сердечно-сосудистым расстройством.
35. Применение соединения формулы (I) по любому из пп.1-5 или фармацевтической композиции по п.11 или 12 в комбинации с ингибитором HMG СоА-редуктазы, ингибитором всасывания холестерина, средствами для борьбы с ожирением, средством для лечения липопротеидных расстройств, гипогликемическим агентом: инсулином, бигуанидом, сульфонилмочевиной, тиазолидиндионом, двойным агонистом PPARa и g или их смесью для изготовления лекарственного средства для снижения общего холестерина, веса тела, глюкозы плазмы крови, инсулина, Hb1c, триглицеридов, LDL, VLDL или свободных жирных кислот или повышения HDL в плазме.
36. (S)-Этил 2-метокси-3-[4-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионат.
37. Этил 2-этокси-3-[4-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионат.
38. (S)-Этил 2-этокси-3-[4-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионат.
39. Этил 2-этокси-3-[4-{3-(3-метансульфонилоксифенил)пропиламино}фенил]пропионат.
40. (S)-Этил 2-этокси-3-[4-(4-метилсульфонилоксифенетиламино)фенил]пропионат.
41. (S)-2-Метокси-3-[4-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионовая кислота.
42. 2-Этокси-3-[4-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионовая кислота.
43. (S)-2-Этокси-3-[4-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионовая кислота.
44. 2-Этокси-3-[3-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионовая кислота.
45. 2-Этокси-3-[4-(4-метилсульфонилоксифенетиламино)фенил]пропионовая кислота.
46. (S)-2-Этокси-3-[4-(4-метилсульфонилоксифенетиламино)фенил]пропионовая кислота.
47. 2-Этокси-3-[4-{3-(4-трет-бутокси-4-метилсульфонамидофенил)пропиламино}фенил]пропионовая кислота.
48. Аргининовая соль 2-этокси-3-[4-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионовой кислоты.
49. Аргининовая соль 2-этокси-3-[3-{3-(4-метансульфонилоксифенил)пропиламино}фенил]пропионовой кислоты.
Текст
008947 Область изобретения Изобретение касается новых антидиабетических, гиполипидемических, гипохолестеринемических соединений и средств против ожирения формулы (I), их таутомерных форм, их стереоизомеров, их полиморфов, их фармацевтически приемлемых солей, их фармацевтически приемлемых сольватов и содержащих их фармацевтически приемлемых композиций. Конкретнее, данное изобретение касается соединений общей формулы (I), являющихся преимущественно агонистами PPAR, их таутомерных форм, стереоизомеров, их полиморфов, их фармацевтически приемлемых солей, фармацевтически приемлемых сольватов и содержащих их фармацевтически приемлемых композицийR2 обозначает водород,R3 обозначает водород или замещенные или незамещенные группы, представленные линейными или разветвленными (С 1-С 12)алкильными группами;R4 обозначает водород или замещенные или незамещенные группы, представленные линейными или разветвленными (С 1-С 12)алкильными группами;Y обозначает кислород,R5 обозначает водород или замещенную или незамещенную группу, представленную алкилом, или ароил,Ar обозначает замещенный или незамещенный двухвалентный фенилен,X обозначает -С(=O)-, -C(=S)-, -C(=S)-O, -C(=O)-O-, -C(=O)-S-, -C(=S)-O-, -O-(CH2)d-, -NH-(CH2)d-,где d обозначает целое число в интервале 1-4, -O-С(=O)-, -C(O)CH2-, -CRa=CRb-CH2-, где Ra и Rb могут быть одинаковыми или разными и обозначают водород или (С 1-С 6)алкил, или X обозначает связь,R6 обозначает замещенную или незамещенную группу, выбранную из -OSO2R8 или -NR8COR9, где 8R обозначает водород, или замещенный или незамещенный алкил или арил, арилалкил, алкоксикарбонил или арилалкоксикарбонил, a R9 обозначает водород, или замещенный или незамещенный алкил, при условии, что R6 обозначает водород, когда R13 находится в третьей позиции фенильного кольца и не обозначает водород,R13 обозначает водород, -OSO2 алкил иn обозначает целое число в интервале от 0 до 6 иm обозначает целое число в интервале от 0 до 6. Изобретение также относится к способу получения указанных выше соединений, их таутомерных форм, полиморфов, стереоизомеров, фармацевтически приемлемых солей, фармацевтически приемлемых сольватов и содержащих их фармацевтических композиций. Изобретение также относится к новым промежуточным соединениям, способам их получения, их использованию в синтезе соединений формулы (I) и их использованию в качестве антидиабетических,гиполипидемических, гипохолестеринемических соединений и средств против ожирения. Соединения по настоящему изобретению понижают глюкозу, триглицериды, инсулин плазмы, снижают общий холестерин (ТС) и повышают липопротеиды высокой плотности (HDL) и снижают липопротеиды низкой плотности (LDL), что дает полезный эффект при ишемической болезни сердца и атеросклерозе. Соединения по настоящему изобретению являются полезными при снижении веса тела и при лечении и/или профилактике болезней, таких как атеросклероз, инсульт, периферические сосудистые болезни и родственные расстройства. Эти соединения пригодны для лечения гиперлипидемии, гипергликемии,гиперхолестеринемии, снижения атерогенных липопротеидов, VLDL (липопротеиды очень низкой плотности) и LDL. Соединения по настоящему изобретению могут быть использованы для лечения почечных болезней, включая гломерулонефрит, гломерулосклероз, нефротический синдром, гипертензивный нефросклероз и нефропатию. Соединения общей формулы (I) являются также пригодными для лечения и/или профилактики лептинорезистентности, нарушенной толерантности к глюкозе, расстройств, родственных с синдромом X, таких как гипертензия, ожирение, инсулинорезистентность, ишемическая болезнь сердца и другие сердечно-сосудистые расстройства. Эти соединения могут также быть полезными как ингибиторы альдозоредуктазы, для улучшения познавательных функций при деменции, лечения диабетических осложнений, расстройств, связанных с активацией эндотелиальных клеток, псориаза, синдрома поликистозных яичников (PCOS), воспалительных болезней кишечника, остеопороза, миотонической дистрофии, панкреатита, артериосклероза, ретинопатии, ксантомы, расстройств питания, воспаления и для лечения рака. Соединения по настоящему изобретению являются также полезными при лечении и/или профилактике вышеупомянутых болезней в комбинации совместно с одним или несколькими ингибиторами HMG-1 008947 СоА-редуктазы, ингибитором всасывания холестерина, средством против ожирения, средством для лечения липопротеидных расстройств, гипогликемическим агентом, инсулином, бигуанидом, сульфонилмочевиной, тиазолидиндионом, двойным агонистом PPAR иили их смесью. Предпосылки создания изобретения Атеросклероз и другие периферические сосудистые болезни влияют на качество жизни миллионов людей. Поэтому значительное внимание уделяется изучению этиологии гиперхолестеринемии и гиперлипидемии и разработке эффективных терапевтических стратегий. Гиперхолестеринемия определяется как уровень холестерина в плазме, превышающий значение,произвольно названное "нормальным" уровнем. Недавно было признано, что "идеальные" уровни холестерина в плазме являются значительно более низкими, чем "нормальный" уровень холестерина в общей популяции, и что риск болезни коронарных артерий (CAD) возрастает при повышении уровня холестерина выше "оптимального" (или "идеального") значения. Существует несомненная причинноследственная связь между гиперхолестеринемией и CAD, особенно для лиц с многочисленными факторами риска. Большая часть холестерина находится в этерифицированных формах с разными липопротеидами, такими как липопротеиды низкой плотности (LDL), липопротеиды промежуточной плотности(IDL), липопротеиды высокой плотности (HDL) и, частично, липопротеиды очень низкой плотности(VLDL). Исследования четко указывают на наличие обратного соотношения между CAD и атеросклерозом и концентрациями HDL-холестерина в сыворотке (Stampfer et al., N. Engl. J. Med., 325 (1991), 373381). Риск CAD возрастает с повышением уровней LDL и VLDL. При CAD обычно наблюдаются "жировые полоски" в сонной, коронарной и мозговой артериях, которые состоят преимущественно из свободного и этерифицированного холестерина. Miller et al. (Br. Med.J., 282 (1981), 1741-1744) показали, что увеличение количества частиц HDL может уменьшить количество участков стеноза в коронарных артериях человека, а высокий уровень HDL-холестерина может предотвращать развитие атеросклероза. Picardo et al., Arteriosclerosis 6 (1986) 434-441, показали в экспериментах in vitro, что HDL способен удалять холестерин из клеток. Они предположили, что HDL может очищать ткани от избытка свободного холестерина и переносить его к печени, что известно как обратный транспорт холестерина (Macikinnon et al., J. Biol. Chem. 261 (1986), 2548-2552). Таким образом, агенты, повышающие уровень холестерина HDL, будут иметь терапевтическую значимость для лечения гиперхолестеринемии и ишемической болезни сердца (CHD). Ожирение - болезнь, очень распространенная в обществах высокого благосостояния и в развивающихся странах и является важной причиной заболеваемости и смертности. Оно представляет собой состояние накопления в организме избыточного жира. Причины ожирения точно неизвестны. Считается,что оно имеет генетическую природу или стимулируется взаимодействием между генотипом и окружающей средой. Независимо от причины, результатом является отложение жира вследствие дисбаланса между потреблением энергии и расходованием энергии. Частью курса лечения ожирения являются диета,физические упражнения и угнетение аппетита. Существует потребность в эффективной терапии для борьбы с этой болезнью, поскольку она может служить причиной ишемической болезни сердца, диабета,инсульта, гиперлипидемии, подагры, остеоартрита, снижения способности приносить потомство и многих других психологических и социальных проблем. Диабет и инсулинорезистентность являются другим заболеванием, сильно влияющим на качество жизни большого числа людей во всем мире. Инсулинорезистентность является пониженной способностью инсулина проявлять свое биологическое действие в широком интервале концентраций. При инсулинорезистентности организм секретирует аномально высокое количество инсулина для компенсации этого дефекта; при невозможности достичь этого, концентрация глюкозы в плазме неминуемо повышается и приводит к развитию диабета. В развивающихся странах сахарный диабет является очень распространенной проблемой; он ассоциирован с разными аномалиями, включая ожирение, гипертензию, гиперлипидемию (J. Clin. Invest., 75 (1985) 809-817; N. Engl. J. Med., 317 (1987) 350-357; J. Clin. Endocrinol.Metab., 66 (1988) 580-583; J. Clin. Invest., 68 (1975) 957-969) и другие почечные осложнения (патентная публикацияWO 95/21608). Сейчас все большее признание приобретают представления о том, что инсулинорезистентность и относительная гиперинсулинемия играют определенную роль в ожирении, гипертензии, атеросклерозе и сахарном диабете типа II. Связь инсулинорезистентности с ожирением, гипертензией и стенокардией была описана как синдром, центральным патогенным звеном которого является инсулинорезистентность - синдром X. Гиперлипидемия является главной причиной сердечно-сосудистых заболеваний (CVD) и других болезней периферических сосудов. Высокий риск CVD связан с повышенными значениями LDL (липопротеиды низкой плотности) и VLDL (липопротеиды очень низкой плотности), что наблюдается при гиперлипидемии. Пациенты с непереносимостью к глюкозе/инсулинорезистентностью, в дополнение к гиперлипидемии имеют повышенный риск CVD. Многочисленные исследования в прошлом показали, что снижение триглицеридов плазмы и общего холестерина, в частности LDL и VLDL, и повышение холестерина HDL помогает предотвращению сердечно-сосудистых заболеваний. Рецепторы, активируемые пролифератором пероксисом (PPAR), являются сиротскими рецепторами, принадлежащими к надсемейству стероидных/ретиноидных рецепторов лиганд-активируемых фак-2 008947 торов транскрипции (Wilson Т.М. and Wahli W., Curr. Opin. Chem. Biol., 1997, Vol. 1, 235-241). Были выделены три рецептора, которые активируются пролифератором пероксисом (PPAR), названные PPAR-,PPAR- и PPAR-. Эти PPAR регулируют экспрессию целевых генов путем связывания с элементами последовательностей ДНК. Было признано, что некоторые соединения, активирующие или иначе взаимодействующие с одним или несколькими PPAR, принимают участие в регулировании уровней триглицеридов и холестерина в животных моделях (патенты США 5847008, 5859051 и публикации РСТ WO 97/28149, WO 99/04815). Имеется огромное количество информации о влиянии агонистов PPAR- на профиль сердечнососудистого риска, например соединения класса фибратов, являющиеся слабыми агонистами PPAR-,корректируют атерогенную дислипопротеинемию. Несколько испытаний ангиографического вмешательства продемонстрировали полезное действие этого лекарственного средства на развитие атеросклеротических поражений, а результаты испытаний первичной и вторичной профилактики выявили снижение частоты сердечно-сосудистых явлений (Ricote M. and Glass С.K.; Trends in Pharmacological Sciences; 2001; 22(9); 441-443). Несмотря на то, что фибраты, являющиеся слабыми активаторами PPAR-, снижают уровни триглицеридов плазмы и одновременно повышают уровни HDL-C, они не являются предпочтительными лекарственными средствами из-за низкой эффективности, требующей использования больших доз, возможности возникновения миозита и наличия противопоказаний для пациентов с нарушениями почечной и печеночной функций и для беременных и кормящих женщин. Однако происходил быстрый прогресс в понимании роли PPAR- при разных патофизиологических состояниях, в дополнение к хорошо документированным благоприятным эффектам на липидный профиль. Воспалительная активация гладких клеток мышц аорты, являющаяся характерным признаком атеросклероза, по-видимому, ингибируется действием PPAR- (Vamecq J. and Latruffe N.; Lancet; 1999; 354; 141-148). Полученные недавно данные позволяют предположить участие рецепторов PPAR- в улучшении чувствительности к инсулину. Было продемонстрировано, что за счет снижения липидов в кровообращении и мышцах в инсулинорезистентных моделях грызунов, таких как крысы Zucker с ожирением, мыши,получающие корм с высоким содержимым жира, и крысы, которых кормят сахарозой-лярдом, лигандыPPAR- улучшают чувствительность к инсулину и состояние при ожирении. Кроме того, было выявлено взаимодействие липидпонижающей активности статинов с рецепторами PPAR- в дополнение к ограниченной доступности холестерина. Некоторые клинические испытания выявили улучшение показателей чувствительности к инсулину при применении фибратов (Guerre-Millo M., Rounalt С, and Poulain P.; Diabetes; 2001; 50; 2809-2814, Muoio D.M., Way J.M. and Tanner С.J.; Diabetes; 2002; 51; 901-909, Ye J., DoyleP.J. and Iglesias M.A.; Diabetes; 2001; 50; 411-417, and Roglans N., Sanguino E. and Peris C; JPET; 2002; 302; 232-239). Таким образом, существуют интересные свидетельства того, что агонисты PPAR- могут быть использованы для контроля липидов и, по последним данным, даже для улучшения чувствительности к инсулину. Ограничения существующих сейчас средств лекарственной терапии вместе с возрастающим распространением липидных аномалий во всем мире требуют создания более сильнодействующих и безопасных агонистов PPAR-. В продолжение наших исследований агонистов PPAR (патенты США 5885997, 6054453, 6265401; заявка PCT/IB 02/04275) с целью удовлетворения этих потребностей был синтезирован ряд соединений, которые раскрыты в данном изобретении. Известный уровень техники Было описано несколько алкилкарбоновых кислот, их производных и их аналогов, пригодных для использования в лечении гипергликемии и гиперхолестеринемии. Некоторые из таких соединений, описанных в известном уровне техники, указаны ниже:i). Патент США 5306726 и WO 91/19702 раскрывают несколько производных 3-арил-2-оксипропионовой кислоты общих формул (IIа) и (IIb) в качестве гиполипидемических и гипогликемических агентов. Примеры этих соединений представлены формулами (IIc) и (IId)ii). Международные публикацииWO 95/03038 и WO 96/04260 раскрывают соединения формулы (IIе) Пример этих соединений представлен формулой (IIf)iii). Международные публикацииWO 94/13650, WO 94/01420 и WO 95/17394 раскрывают соединения общей формулы (IIg) Пример этих соединений представлен формулой (IIh)iv). Международная публикацияWO 00/49005 раскрывает соединения общей формулы (IIi) Пример этих соединений представлен формулой (IIj)v). Международная публикацияWO 94/12181 раскрывает соединения общей формулы (IIk) Пример этих соединений представлен формулой (IIl)vi). Международная публикацияWO 93/16697 и патент США 5227490 раскрывают соединения общей формулы (IIm) Пример этих соединений представлен формулой (IIn)vii). Международная публикацияWO 99/62871 раскрывает соединения общей формулы (IIо) Пример этих соединений представлен формулой (IIp)viii). Международная публикацияWO 00/64888 раскрывает соединения общей формулы (IIq) Пример этих соединений представлен формулой (IIr)ix). Международная публикацияWO 99/62872 раскрывает соединения формулы (IIs) х). Международная публикацияWO 00/63153 раскрывает соединения формулы (IIt) Пример этих соединений представлен формулой (IIu)xi). Международная публикацияWO 01/55085 раскрывает соединения формулы (IIv) Пример этих соединений представлен формулой (IIw) Были описаны несколько производных -фенилгидроксизамещенной пропионовой кислоты, которые использовались в качестве промежуточных соединений для синтеза целевых молекул. Некоторые из таких соединений, описанных в известном уровне техники, указаны ниже.i). Европейская патентная заявка ЕРО 816316 раскрывает соединение формулы (Va) Эти 1,2-этандиольные производные являются полезными промежуточными соединениями для фармацевтических и сельскохозяйственных химикатов.ii). Патентная заявка Японии JP 10017540 раскрывает соединение формулы (Vc) Сущность изобретения Целью данного изобретения являются создание соединений общей формулы (I), проявляющих преимущественно PPAR-агонистическую активность при существенно сниженной токсичности, ассоциированной с PPAR-активацией, пригодных для снижения глюкозы крови, уровней липидов, снижения холестерина и уменьшения веса тела с полезными эффектами при лечении и/или профилактике болезней,связанных с повышенными уровнями липидов, атеросклероза, заболеваний коронарной артерии, синдрома X, нарушенной толерантности к глюкозе, инсулинорезистентности, инсулинорезистентности, приводящей к диабету типа 2 и его диабетическим осложнениям, для лечения болезней, патофизиологическим механизмом которых является инсулинорезистентность, и для лечения гипертензии, с лучшей эффективностью, действенностью и меньшей токсичностью, для чего мы сосредоточили наши исследования на разработке новых соединений, эффективных для лечения вышеупомянутых болезней. Усилия в этом направлении привели к созданию соединений, имеющих общую формулу (I). Таким образом, главным аспектом данного изобретения является создание алкилкарбоновых кислот общей формулы (I), их таутомерных форм, стереоизомеров, полиморфов, фармацевтически приемлемых солей, фармацевтически приемлемых сольватов и содержащих их фармацевтических композиций или их смесей. Другим аспектом данного изобретения является создание алкилкарбоновых кислот, их таутомерных форм, стереоизомеров, полиморфов, фармацевтически приемлемых солей, фармацевтически приемлемых сольватов и содержащих их фармацевтических композиций, или их смесей, которые могут иметь агонистическую активность по отношению к PPAR и/или PPAR и, необязательно, ингибировать HMG СоАредуктазу, в дополнение к наличию агонистической активности по отношению к PPAR и/или PPAR. Еще одним аспектом данного изобретения является создание способа получения алкилкарбоновых кислот формулы (I), их таутомерных форм, стереоизомеров, полиморфов, фармацевтически приемлемых солей и их фармацевтически приемлемых сольватов. Еще одним аспектом данного изобретения является создание фармацевтических композиций, которые содержат соединения общей формулы (I), их таутомеры, стереоизомеры, полиморфы, соли, сольваты или их смеси в комбинации с пригодными носителями, растворителями, разбавителями и другими средами, обычно используемыми для изготовления таких композиций. Другим аспектом данного изобретения является создание новых промежуточных соединений, способа их получения и использование промежуточных соединений в способах получения алкилкарбоновых кислот формулы (I), их таутомеров, стереоизомеров и их использование в качестве антидиабетических,гиполипидемических, гипохолестеринемических соединений и средств против ожирения. Детальное описание изобретения Новые -арилоксизамещенные пропионовые кислоты общей формулы (I) их таутомерные формы, их стереоизомеры, их полиморфы, их фармацевтически приемлемые соли, их фармацевтически приемлемые сольваты,где R1 обозначает водород, гидроксигруппу;R2 обозначает водород,R3 обозначает водород или замещенные или незамещенные группы, представленные линейными или разветвленными (С 1-С 12)алкильными группами;R4 обозначает водород или замещенные или незамещенные группы, представленные линейными или разветвленными (С 1-С 12)алкильными группами;Y обозначает кислород,R5 обозначает водород или замещенную или незамещенную группу, представленную алкилом, или ароил,Ar обозначает замещенный или незамещенный двухвалентный фенилен,X обозначает -С(=O)-, -C(=S)-, -C(=S)-O, -C(=O)-O-, -C(=O)-S-, -C(=S)-O-, -O-(CH2)d-, -NH-(CH2)d-,где d обозначает целое число в интервале 1-4, -O-С(=O)-, -С(O)СН 2-, -CRa=CRb-CH2-, где Ra и Rb могут быть одинаковыми или разными и обозначают водород или (С 1-С 6)алкил, или X обозначает связь,R6 обозначает замещенную или незамещенную группу, выбранную из -OSO2R8 или -NR8COR9, где 8R обозначает водород, или замещенный или незамещенный алкил или арил, арилалкил, алкоксикарбонил или арилалкоксикарбонил, a R9 обозначает водород, или замещенный или незамещенный алкил, при условии, что R6 обозначает водород, когда R13 находится в третьей позиции фенильного кольца и не обозначает водород,R13 обозначает водород, -OSO2 алкил;n обозначает целое число в интервале от 0 до 6 иm обозначает целое число в интервале от 0 до 6. Пригодные группы, представленные R1, могут быть выбраны из водорода, гидроксигруппы. Пригодные группы, представленные R2 означают водород. Пригодные группы, представленные R3, могут быть выбраны из водорода, замещенной или незамещенной, линейной или разветвленной (С 1-С 12)алкильной группы. Пригодные группы, представленные R4, могут быть выбраны из водорода, замещенной или незамещенной, линейной или разветвленной (С 1-С 12)алкильной группы. Пригодные группы, представленные R5, могут быть выбраны из водорода или замещенной или незамещенной алкильной группы или ароила. Пригодные группы, представленные R6, могут быть выбраны из замещенной или незамещенной группы, выбранной из -OSO2R8 или -NR8COR9, где R8 обозначает водород или замещенный или незамещенный алкил или арил, арилалкил, алкоксикарбонил или арилалкоксикарбонил, a R9 обозначает водород или замещенный или незамещенный алкил, при условии, что R6 обозначает водород, когда R13 находится в третьей позиции фенильного кольца и не обозначает водород. Пригодные группы, представленные R13, могут быть выбраны из водород или -OSO2 алкила. Пригодные группы, представленные Ar, могут быть выбраны из замещенной или незамещенной двухвалентной фениленовой группы. Пригодные n и m являются целыми числами в интервале значений 0-6. Пригодные X обозначают -С(=O)-, -C(=S)-, -C(=S)-O, -C(=O)-O-, -C(=O)-S-, -C(=S)-O-, -O-(CH2)d-,-NH-(CH2)d- (где d обозначает целое число в интервале 1-4), -O-С(=O)-, -C(O)CH2-, -CRa=CRb-CH2-, где Ra и Rb могут быть одинаковыми или разными и обозначают водород или (С 1-С 6)алкил, или X обозначает связь. Предпочтительными соединениями по настоящему изобретению являются такие соединения формулы (I), в которыхR1 обозначает водород или гидроксигруппу.R3 обозначает водород или замещенные или незамещенные группы, представленные линейными или разветвленными (С 1-С 12)алкильными группами.R4 обозначает водород водород или замещенные или незамещенные группы, представленные линейными или разветвленными (С 1-С 12)алкильными группами.R5 обозначает водород или замещенную или незамещенную группу, представленную алкилом, или ароил.R6 обозначает замещенную или незамещенную группу, выбранную из -OSO2R8 или -NR8COR9, R8 обозначает водород, или замещенный или незамещенный алкил или арил, арилалкил, алкоксикарбонил или арилалкоксикарбонил, a R9 обозначает водород или замещенный или незамещенный алкил, при условии, что R6 обозначает водород, когда R13 находится в третьей позиции фенильного кольца и не обозначает водород.R8 обозначает водород или замещенный или незамещенный алкил или арил, арилалкил, алкоксикарбонил или арилалкоксикарбонил.R9 обозначает водород или замещенный или незамещенный алкил.R13 обозначает водород или -OSO2 алкил.X обозначает -С(=O)-, -C(=S)-, -C(=S)-O, -C(=O)-O-, -C(=O)-S-, -C(=S)-O-, -O-(CH2)d-, -NH-(СН 2)d-,где d обозначает целое число в интервале 1-4, или X обозначает связь.m обозначает целое число от 0 до 1.n обозначает целое число от 0 до 2. Еще более предпочтительными соединениями по настоящему изобретению являются такие соединения формулы (I), в которыхR3 обозначает водород, линейную или разветвленную (С 1-С 12)алкильную группу.R4 обозначает водород, линейную или разветвленную (С 1-С 12)алкильную группу.R8 обозначает линейный или разветвленный (С 1-С 6)алкил или замещенную арильную группу, в которой заместитель является линейной или разветвленной (С 1-С 6)алкильной группой.R9 обозначает линейный или разветвленный (С 1-С 6)алкил, т-бутилоксикарбонильную или бензилоксикарбонильную группу.R13 обозначает водород или -OSO2 алкил.Y обозначает кислород. Фармацевтически приемлемые соли, составляющие часть данного изобретения, включают соли, образованные неорганическими основаниями, такими как Li, Na, K, Са, Mg, Fe, Cu, Zn, Al, Mn; соли органических оснований, таких как N,N'-диацетилэтилендиамин, бетаин, кофеин, 2-диэтиламиноэтанол, 2 диметиламиноэтанол, н-этилморфолин, н-этилпиперидин, глюкамин, глюкозамин, гидрабамин, изопропиламин, метилглюкамин, морфолин, пиперазин, пиперидин, прокаин, теобромин, валинол, диэтиламин,триэтиламин, триметиламин, трипропиламин, трометамин, адамантиламин, диэтаноламин, меглумин,этилендиамин, N,N'-дифенилэтилендиамин, N,N'-дибензилэтилендиамин, н-бензилфенилэтиламин, холин, холина гидроксид, дициклогексиламин, метформин, бензиламин, фенилэтиламин, диалкиламин,триалкиламин, тиамин, аминопиримидин, аминопиридин, пурин, пиримидин, спермидин и т.п.; хиральных оснований, таких как алкилфениламин, этаноламин, фенилэтаноламин и т.п., соли природных аминокислот, таких как глицин, аланин, валин, лейцин, изолейцин, норлейцин, тирозин, цистин, цистеин,метионин, пролин, гидроксипролин, гистидин, орнитин, лизин, аргинин, серин, треонин, фенилаланин; неприродных аминокислот, таких как D-изомеры или замещенные аминокислоты; соли кислотных аминокислот, таких как аспарагиновая кислота, глутаминовая кислота; гуанидина, замещенного гуанидина,где заместители выбраны из нитрогруппы, аминогруппы, алкила, алкенила, алкинила, аммониевых или замещенных аммониевых солей. Соли могут включать в надлежащих случаях кислотно-аддитивные соли, которые могут быть сульфатами, нитратами, фосфатами, перхлоратами, боратами, гидрогалогенидами (HCl, HBr, HI), ацетатами, тартратами, малеатами, цитратами, сукцинатами, пальмоатами, метансульфонатами, бензоатами, салицилатами, гидроксинафтоатами, бензолсульфонатами, аскорбатами, глицерофосфатами, кетоглутаратами и т.п. Фармацевтически приемлемые сольваты могут быть гидратами или включать другие растворители кристаллизации, такие как спирты. Особенно полезные соединения по настоящему изобретению включают этил-2-метокси-3-[4-3-(4-метансульфонилоксифенил)пропиламинофенил]пропионат или его соли в форме отдельных энантиомеров или рацемата,этил-2-этокси-3-[4-3-(4-метансульфонилоксифенил)пропиламинофенил]пропионат или его соли в форме отдельных энантиомеров или рацемата,этил-2-этокси-3-[4-3-(4-этансульфонилоксифенил)пропилоксикарбониламинофенил]пропионат или его соли в форме отдельных энантиомеров или рацемата,этил-2-этокси-3-[4-3-(3-метансульфонилоксифенил)пропиламинофенил]пропионат или его соли в форме отдельных энантиомеров или рацемата,этил-2-этокси-3-[4-3-(4-(толуол-4-сульфонилокси)фенил)пропиламинофенил]пропионат или его соли в форме отдельных энантиомеров или рацемата,этил-2-этокси-3-[3-3-(4-метансульфонилоксифенил)пропиламинофенил]пропионат или его соли в форме отдельных энантиомеров или рацемата,этил-2-изопропокси-3-[4-3-(4-метансульфонилоксифенил)пропиламинофенил]пропионат или его соли в форме отдельных энантиомеров или рацемата,этил-2-этокси-3-[4-(4-метилсульфонилоксифенетиламино)фенил]пропионат или его соли в форме отдельных энантиомеров или рацемата,этил-2-этокси-3-4-[(Е)-3-(4-метилсульфонилоксифенил)-2-пропениламино]фенилпропионат или его соли в форме отдельных энантиомеров или рацемата,метил-2-этокси-3-[4-(4-метансульфонилоксибензиламино)фенил]пропионат или его соли в форме отдельных энантиомеров или рацемата,2-метокси-3-[4-3-(4-этансульфонилоксифенил)пропиламинофенил]пропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,-8 008947 2-этокси-3-[4-3-(4-метансульфонилоксифенил)пропиламинофенил]пропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,2-этокси-3-[4-3-(4-метансульфонилоксифенил)пропилоксикарбониламинофенил]пропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,2-этокси-3-[4-3-(3-метансульфонилоксифенил)пропиламинофенил]пропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,2-этокси-3-[4-3-(4-(толуол-4-сульфонилокси)фенил)пропиламинофенил]пропионат или его соли в форме отдельных энантиомеров или рацемата,2-этокси-3-[3-3-(4-метансульфонилоксифенил)пропиламинофенил]пропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,2-изопропокси-3-[4-3-(4-метансульфонилоксифенил)пропиламинофенил]пропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,2-этокси-3-[4-(4-метансульфонилоксибензиламино)фенил]пропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,2-этокси-3-[4-(4-метилсульфонилоксифенетиламино)фенил]пропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,2-этокси-3-4-[(Е)-3-(4-метилсульфонилоксифенил)-2-пропениламино]фенилпропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,этил-2-этокси-3-[4-(4-метилсульфонилоксибензилкарбоксамидо)фенил]пропионат или его соли в форме отдельных энантиомеров или рацемата,2-этокси-3-[4-(4-метилсульфонилоксибензилкарбоксамидо)фенил]пропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,этил-2-этокси-3-[4-3-(4-метилсульфонамидофенил)пропиламинофенил]пропионат или его соли в форме отдельных энантиомеров или рацемата,2-этокси-3-[4-3-(4-метилсульфонамидофенил)пропиламинофенил]пропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,этил-2-этокси-3-(4-[(Е)-2-(4-метилсульфонилоксифенил)-1-этенилкарбоксамидо]фенилпропионат или его соли в форме отдельных энантиомеров или рацемата,2-этокси-3-4-[(Е)-2-(4-метилсульфонилоксифенил)-1-этенилкарбоксамидо]фенилпропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,этил-2-этокси-3-[4-(4-метилсульфонилоксифенетилкарбоксамидо)фенил]пропионат или его соли в форме отдельных энантиомеров или рацемата,2-этокси-3-[4-(4-метилсульфонилоксифенетенилкарбоксамидо)фенил]пропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,этил-2-метокси-3-[4-(E)-3-(4-метилсульфонилоксифенил)-2-пропениламинофенил]пропионат или его соли в форме отдельных энантиомеров или рацемата,2-метокси-3-[4-(Е)-3-(4-метилсульфонилоксифенил)-2-пропениламинофенил]пропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,этил-2-метокси-3-[4-3-(3-метансульфонилоксифенил)пропиламинофенил]пропионат или его соли в форме отдельных энантиомеров или рацемата,2-метокси-3-[4-3-(3-метансульфонилоксифенил)пропиламинофенил]пропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,этил-2-этокси-3-4-[(E)-3-(4-метилсульфонилоксифенил)-2-пропенил(фенил)карбоксамидо]фенил пропионат или его соли в форме отдельных энантиомеров или рацемата,2-этокси-3-4-[(E)-3-(4-метилсульфонилоксифенил)-2-пропенил(фенил)карбоксамидо]фенил] пропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата,метил-2-метокси-3-4-[(Е)-3-(4-метилсульфонилоксифенил)-2-пропенил(фенил)карбоксамидо] фенилпропионат или его соли в форме отдельных энантиомеров или рацемата,2-метокси-3-4-[(Е)-3-(4-метилсульфонилоксифенил)-2-пропенил(фенил)карбоксамидо]фенил пропионовую кислоту или ее соли в форме отдельных энантиомеров или рацемата. Согласно данному изобретению соединение общей формулы (I), где R1, R2, R3, R4, R5, R6, R13, X, Y,n, m и Ar имеют указанные выше значения, может быть получено любым из путей, изображенных на Путь (1). Реакция соединения общей формулы (IIIa), в которой все символы имеют указанные выше значения, с соединением формулы (IIIb), в которой Y имеет указанные выше значения, за исключениемNH, R11 обозначает линейный или разветвленный (С 1-С 6)алкил, а все другие символы имеют указанные выше значения, с образованием соединения общей формулы (I), где Y имеет указанные выше значения,за исключением NH, а все другие символы имеют указанные выше значения, может быть проведена в присутствии основания, такого как гидриды щелочных металлов, такие как NaH или KН; литийорганические соединения, такие как СН 3Li, BuLi, LDA, TMEDA и т.п.; алкоксиды, такие как NaOMe, NaOEt,K+Bu- и т.п. или их смеси. Реакция может быть проведена в присутствии растворителей, таких как диэтиловий эфир, ТГФ, диоксан, ДМФ, ДМСО, DME (диметиловый эфир этиленгликоля), толуол, бензол и т.п. или их смеси. В качестве сорастворителя может быть использован НМРА (гексаметилфосфорамид). Температура реакции может изменяться в интервале от -78 до 50 С, предпочтительнее в интервале температур от -10 до 30 С. Реакция протекает более эффективно в безводных условиях. Соединение общей формулы (IIIb) может быть получено по реакции Арбузова (Annalen Chemie, 1996, 53, 699). В другом варианте исполнения соединение формулы (I) может быть получено путем проведения реакции соединения формулы (IIIa), в которой все символы имеют указанные выше значения, с реагентами Виттига, такими как Hal-Ph3P+CH-(OR3)CO2R4, в реакционных условиях, аналогичных описанным выше, где R3 и R4 имеют указанные выше значения. Путь (2). Реакция соединения формулы (IIId), где R6 имеет указанные выше значения, NR8R9, Y имеет указанные выше значения, за исключением NH, а все другие символы имеют указанные выше значения, с соединением формулы (IIIс), где R3 имеет указанные выше значения, за исключением водорода,и L1 обозначает уходящую группу, такую как атом галогена, п-толуолсульфонат, метансульфонат, трифторметансульфонат и т.п., с образованием соединения формулы (I), может быть проведена в присутствии растворителей, таких как диэтиловый эфир, ТГФ, ДМФ, ДМСО, DME, толуол, бензол и т.п. Может поддерживаться инертная атмосфера путем использования инертных газов, таких как N2, Ar, He и т.п. Реакция может быть проведена в присутствии основания, такого как KОН, NaOH, NaOMe, t-BuO-K+, NaH,KH, LDA, NaHMDS, K2CO3, Na2CO3 и т.п. Может быть использован катализатор фазового переноса, такой как галогениды или гидроксиды или бисульфаты тетраалкиламмония. Температура реакции может изменяться в интервале от -20 до 200 С, предпочтительнее в интервале температур от 0 до 150 С. Продолжительность реакции может меняться от 1 до 72 ч, предпочтительнее от 1 до 12 ч. Реакция может также быть проведена с использованием алкилирующих агентов, таких как диалкилсульфаты, например диэтилсульфат или диметилсульфат; алкилгалогенидов, например метилйодида, метилбромида, этилйодида, этилбромида и т.п. Путь (3). Реакция соединения общей формулы (IIIa), в которой все символы имеют указанные выше значения, с соединением формулы (IIIе), где R2 обозначает атом водорода, Y имеет указанные выше значения, за исключением NH, а все другие символы имеют указанные выше значения, может быть проведена в присутствии основания. Природа основания не является критической. Может быть использовано любое основание, обычно применяемое для реакции альдольной конденсации; могут быть использованы такие основания, как гидрид металла, например NaH, KH, алкоксиды металлов, такие как NaOMe, т-BuO- 10008947K+, NaOEt, амиды металлов, такие как LiNH2, Li(iPr)2. Могут быть использованы апротонные растворители, такие как ТГФ, диэтиловый эфир, диоксан. Реакция может быть проведена в инертной атмосфере,которая может поддерживаться путем использования инертных газов, таких как N2, Ar или Не, причем реакция протекает более эффективно в безводных условиях. Может быть использована температура в интервале от -80 до 35 С. Полученный сначала -гидроксилированный продукт может быть дегидратирован при обычных условиях дегидратации, таких как обработка п-TSA в растворителях, таких как бензол или толуол. Природа растворителя и агента дегидратации не являются критическими. Может быть использована температура в интервале от 20 С до температуры кипения с обратным холодильником использованного растворителя, предпочтительнее температура кипения растворителя с обратным холодильником, при непрерывном удалении воды с помощью водного сепаратора Дина-Старка. Путь (4). Реакция соединения формулы (IIIg), где R6, R13, X, n имеют указанные выше значения, и 1L обозначает уходящую группу, такую как атом галогена, например хлор, или бром, или йод, птолуолсульфонат, метансульфонат, трифторметансульфонат и т.п., предпочтительнее атом галогена, с соединением формулы (IIIf), где R1 и R2 вместе обозначают связь, а все другие символы имеют указанные выше значения, с образованием соединения формулы (I), определенной выше, может быть проведена в присутствии апротонных растворителей, таких как диэтиловый эфир, ТГФ, ДМФ, ДМСО, DME, толуол, бензол, ацетон, ацетонитрил и т.п. или их смеси. Реакция может быть проведена в инертной атмосфере, которая может поддерживаться путем использования инертных газов, таких как N2, Ar, He и т.п. Реакция может быть проведена в присутствии основания, такого как K2CO3, Na2CO3 или NaH или их смеси. Температура реакции может изменяться в интервале (-20)-120 С, предпочтительнее в интервале температур 0-120 С. Продолжительность реакции может изменяться от 1 до 48 ч. Может быть использован катализатор фазового переноса, такой как галогениды, или гидроксиды, или бисульфаты тетраалкиламмония. Путь (5). Реакция соединения общей формулы (IIIh), где R6, R13, X, n имеют указанные выше значения, с соединением общей формулы (IIIi), где R1 и R2 вместе обозначают связь, R5 обозначает водород, а все другие символы имеют указанные выше значения, может быть проведена с использованием пригодных агентов сочетания, таких как изобутилхлорформиат или этилхлорформиат/Et3N, пивалоилхлорид/Et3N, дициклогексилмочевина, триарилфосфин/диалкилазадикарбоксилат, например PPh3/DEAD и т.п. Реакция может быть проведена в присутствии растворителей, таких как ТГФ, DME, СН 2Cl2, СНCl3,толуол, ацетонитрил, четыреххлористый углерод и т.п. Может поддерживаться инертная атмосфера путем использования инертных газов, таких как N2, Ar, He и т.п. Реакция может быть проведена в присутствии DMAP (диметиламинопиридин), HOBt (гидрат 1-гидроксибензотриазола), которые могут быть использованы в количестве от 0,05 до 2 экв., предпочтительнее от 0,25 до 1 экв. Температура реакции может находиться в интервале от 0 до 100 С, предпочтительнее в интервале от 20 до 80 С. Продолжительность реакции может изменяться от 0,5 до 48 ч, предпочтительнее от 03 до 24 ч. Путь 6. Реакция соединения формулы (IIIi), в которой все символы имеют указанные выше значения, с соединением формулы (IIIj), где Y обозначает кислород, R3=R4 и имеют указанные выше значения,за исключением водорода, с образованием соединения формулы (I), где R1 и R2 вместе обозначают связь,Y обозначает атом кислорода, может быть проведена без разведения в присутствии основания, такого как гидриды щелочных металлов, например NaH, KH, или литийорганические реагенты, например СН 3Li,BuLi и т.п., или алкоксиды, такие как NaOMe, NaOEt, т-BuO-K+ и т.п., или их смеси. Реакция может быть проведена в присутствии апротонных растворителей, таких как ТГФ, диоксан, ДМФ, ДМСО, DME и т.п. или их смеси. В качестве сорастворителя может быть использован НМРА. Температура реакции может изменяться в интервале от -78 до 100 С, предпочтительнее в интервале от -10 до 50 С. Продолжительность реакции может изменяться от 1 до 48 ч. В еще одном варианте воплощения данного изобретения соединение общей формулы (I), где R1 обозначает атом водорода, гидроксильную группу, алкоксигруппу, галоген, низший алкил, замещенную или незамещенную арилалкильную группу; R2 обозначает водород, галоген, низший алкил, алканоил,ароил, арилалканоил, замещенный или незамещенный арилалкил; R3, R4, R5, R6, R13, X, Y, Ar, m и n имеют указанные выше значения, может быть получено одним или несколькими способами, изображенными на схеме II ниже. Путь 7. Восстановление соединения формулы (IVa), которая обозначает соединение формулы (I),где R1 и R2 вместе обозначают связь, Y представляет собой атом кислорода, а все другие символы имеют указанные выше значения, полученного, как описано выше (схема I), с образованием соединения общей формулы (I), где R1 и R2 обозначают каждый атом водорода, и все символы имеют указанные выше значения, может быть проведено в присутствии газообразного водорода и катализатора, такого как Pd/C,Rh/C, Pt/C и т.п. Могут быть использованы смеси катализаторов. Реакция может также быть проведена в присутствии растворителей, таких как диоксан, уксусная кислота, этилацетат, спирт, такой как метанол,этанол и т.п. Может быть использовано давление от атмосферного давления до 276-552 кПа (40-80 psi). Катализатором может быть предпочтительнее 5-10% Pd/C, а количество использованного катализатора может находиться в интервале 5-100% мас./мас. Реакция может также быть проведена путем восстановления металлом в растворителе, например магнием или самарием в спирте или амальгамой натрия в спирте, предпочтительнее метаноле. Гидрирование может быть проведено в присутствии металлических катализаторов, содержащих хиральные лиганды, для получения соединения формулы (I) в оптически активной форме. Металлический катализатор может содержать родий, рутений, индий и т.п. Хиральные лиганды могут предпочтительнее быть хиральными фосфинами, такими как оптически чистые энантиомеры 2,3-бис(дифенилфосфино)бутана, 2,3-изопропилиден-2,3-дигидрокси-1,4-бис(дифенилфосфино) бутана и т.п. Может быть использован любой пригодный хиральный катализатор, обеспечивающий желательную оптическую чистоту продукта (I) (см.: Principles of Asymmetric Synthesis, Tetrahedron Series,Vol. 14, pp.311-316, Ed. Baldwin J. E.). Путь 8. Реакция соединения формулы (IVb), где R6 имеет указанные выше значения; R4 имеет указанные выше значения, за исключением водорода, а все другие символы имеют указанные выше значения и L1 обозначает уходящую группу, такую как атом галогена, например, хлор, бром или йод; метансульфонат, п-толуолсульфонат, трифторметансульфонат, со спиртом общей формулы (IVc), где R3 имеет указанные выше значения, за исключением водорода, с образованием соединения формулы (I), определенной выше, может быть проведена в присутствии растворителей, таких как диэтиловый эфир, ТГФ,ДМФ, ДМСО, DME, диэтиловый эфир, толуол, бензол и т.п. или их смеси. Реакция может быть проведена в инертной атмосфере, которая может поддерживаться путем использования инертных газов, таких как N2, Ar, He и т.п. Реакция может быть проведена в присутствии основания, такого как KОН, NaOH,NaOMe, NaOEt, т-BuO-K+, NaH, KH или их смеси. Могут быть использованы катализаторы фазового переноса, такие как галогениды, бисульфаты или гидроксиды тетраалкиламмония. Температура реакции может находиться в интервале от -20 до 120 С, предпочтительнее в интервале от 0 до 100 С. Продолжительность реакции может изменяться от 1 до 48 ч, предпочтительнее от 1 до 24 ч. Путь 9. Реакция соединения формулы (IIIg), определенной раньше, с соединением формулы (IIIf), в которой все символы имеют указанные выше значения, с образованием соединения формулы (I), определенной выше, может быть проведена в присутствии растворителей, таких как диэтиловый эфир, ТГФ,ДМФ, ДМСО, DME, толуол, бензол, ацетон, ацетонитрил и т.п. или их смеси.- 12008947 Реакция может быть проведена в инертной атмосфере, которую поддерживают путем использования инертных газов, таких как N2, Ar, Не и т.п. Реакция может быть проведена в присутствии основания,такого как K2 СО 3, Na2CO3, NaH и т.п. или их смеси. Температура реакции может изменяться в интервале от -20 до 120 С, предпочтительнее в интервале температур 0-120 С. Продолжительность реакции может изменяться от 1 до 48 ч, предпочтительнее от 1 до 24 ч. Может быть использован катализатор фазового переноса, такой как галогениды или гидроксиды тетраалкиламмония. Путь 10. Реакция соединения общей формулы (IIIh), определенной раньше, с соединением общей формулы (IIIf), где все символы имеют указанные выше значения, может быть проведена с использованием пригодных агентов сочетания, таких как изобутилхлорформиат, этилхлорформиат/Et3N или пивалоилхлорид/Et3N,дициклогексилмочевина,триарилфосфин/диалкилазадикарбоксилат,напримерPPh3/DEAD и т.п. Реакция может быть проведена в присутствии растворителей, таких как ТГФ, DME,СН 2Cl2, СНCl3, толуол, ацетонитрил, четыреххлористый углерод и т.п. Может поддерживаться инертная атмосфера путем использования инертных газов, таких как N2, Ar, Не и т.п. Реакция может быть проведена в присутствии DMAP, HOBt, которые могут быть использованы в количестве от 0,05 до 2 экв., предпочтительнее от 0,25 до 1 экв. Температура реакции может находиться в интервале от 0 до 100 С, предпочтительнее в интервале от 20 до 80 С. Продолжительность реакции может изменяться от 0,5 до 48 ч,предпочтительнее от 6 до 24 ч. Путь 11. Реакция соединения формулы (IIId), которая обозначает соединение формулы (I), где все символы имеют указанные выше значения, с соединением формулы (IIIс), где R3 имеет указанные выше значения, за исключением водорода, и L1 обозначает уходящую группу, такую как атом галогена, например хлор, бром или йод; метансульфонат, п-толуолсульфонат, трифторметансульфонат и т.п., может быть проведена в присутствии растворителей, таких как диэтиловый эфир, ТГФ, ДМФ, ДМСО, DME,толуол, бензол, ацетон, ацетонитрил и т.п. Может поддерживаться инертная атмосфера путем использования инертных газов, таких как N2, Ar, Не и т.п. Реакция может быть проведена в присутствии основания, такого как KОН, NaOH, NaOMe, t-BuO-K+, NaH, KH, LDA, NaHMDS, K2CO3, Na2CO3 и т.п. Может быть использован катализатор фазового переноса, такой как галогениды, или гидроксиды, или бисульфаты тетраалкиламмония. Температура реакции может изменяться в интервале от -20 до 200 С, предпочтительнее в интервале от 0 до 150 С. Продолжительность реакции может изменяться от 1 до 72 ч, предпочтительнее от 1 до 12 ч. Реакция может также быть проведена с использованием алкилирующих агентов,таких как диалкилсульфаты, например диэтилсульфат или диметилсульфат; алкилгалогениды, например метилйодид, метилбромид, этилйодид, этилбромид и т.п. Путь 12. Реакция соединения общей формулы (IIIa), определенной ранее, с соединением формулы(IIIе), где R2 обозначает атом водорода, Y имеет указанные выше значения, за исключением NH, а все другие символы имеют указанные выше значения, может быть проведена в обычных условиях. Может быть использовано любое основание, обычно применяемое для реакции альдольной конденсации, например гидрид металла, такой как NaH или KН; алкоксиды металлов, такие как NaOMe, T-BUO-K+ илиNaOEt; амиды металлов, такие как LiNH2, Li(iPr)2. Могут быть использованы апротонные растворители,такие как ТГФ, ДМФ или диэтиловый эфир. Может быть использована инертная атмосфера, такая как аргон, причем реакция протекает более эффективно в безводных условиях. Может быть использована температура в интервале от -80 до 25 С. -Гидроксилированный альдольный продукт может быть дегидроксилирован обычными методами, удобно, с использованием метода ионного гидрирования, такого как путем обработки триалкилсиланом в присутствии кислоты, такой как трифторуксусная кислота. Может быть использован растворитель, такой как CH2Cl2. Предпочтительнее реакция проводится при 25 С. Если реакция протекает медленно, то может быть использована повышенная температура. Дегидроксилирование может также быть проведено с использованием процедуры деоксигенирования по Бартону (Barton)(см.: D.H.R. Barton et al., J. Chem. Soc, Perkin Trans. I, 1975, 1574; F.S. Martin et al., Tetrahedron Lett, 1992,33, 1839). Путь 13. Превращение соединения формулы (IVd), в которой все символы имеют указанные выше значения, в соединение формулы (I), где Y обозначает атом кислорода и все другие символы имеют указанные выше значения, может быть проведено в присутствии основания или кислоты, причем выбор основания или кислоты не является критическим. Может быть использовано любое основание, обычно применяемое для гидролиза нитрила до кислоты, например гидроксиды металлов, такие как NaOH илиKОН, в водном растворителе, или может быть использована любая кислота, обычно используемая для гидролиза нитрила до сложного эфира, такая как HCl, в избытке спирта, такого как метанол, этанол, пропанол и т.д. Реакция может быть проведена в интервале температур от 0 С до температуры кипения с обратным холодильником использованного растворителя, предпочтительнее, в интервале температур от 25 С до температуры кипения с обратным холодильником использованного растворителя. Продолжительность реакции может изменяться от 0,25 до 48 ч. Путь 14. Реакция соединения формулы (IVe), где R4 имеет указанные выше значения, за исключением водорода, и все символы имеют указанные выше значения, с соединением формулы (IVc), где R3 имеет указанные выше значения, за исключением водорода, с образованием соединения формулы (I) (по- 13008947 реакции внедрения, медиируемой карбеноидом родия) может быть проведена в присутствии солей родия(II), таких как ацетат родия(II). Реакция может быть проведена в присутствии растворителей, таких как бензол, толуол, диоксан, диэтиловый эфир, ТГФ и т.п. или их комбинация или, если это возможно, в присутствии R3OH в качестве растворителя при любой температуре, обеспечивающей приемлемую скорость образования желательного продукта, в общем, при повышенной температуре, например, при температуре кипения растворителя с обратным холодильником. Может поддерживаться инертная атмосфера путем использования инертных газов, таких как N2, Ar, Не и т.п. Продолжительность реакции может изменяться от 0,5 до 24 ч, предпочтительнее от 0,5 до 6 ч. Путь 15. Реакция соединения формулы (IVg) с соединением формулы (IVf), где G1 и G2 являются разными и независимо обозначают NH2 или СНО, q обозначает целое число в интервале 0-6, а все другие символы имеют указанные выше значения, с образованием соединения формулы (I), где R5 обозначает водород, а все другие символы имеют указанные выше значения, может быть проведена в две стадии,первой из которых является образование имина, с последующим восстановлением. Образование имина может быть проведено в растворителях, таких как МеОН, EtOH, i-PrOH и т.п. Реакция может быть проведена в присутствии основания, такого как NaOAc, KOAc и т.п. или их смеси. Температура реакции может изменяться в интервале от комнатной температуры до температуры кипения с обратным холодильником использованного растворителя. Время реакции может составлять от 2 до 24 ч, предпочтительнее от 2 до 12 ч. Имин может быть также получен по реакции соединения общей формулы (IVg) с соединением формулы (IVf), где G1 и G2 являются разными и независимо обозначают NH2 или СНО, q обозначает целое число в интервале 0-6, а все другие символы имеют указанные выше значения, с использованием растворителей, таких как CH2Cl2, СНCl3, хлорбензол, бензол, ТГФ, в присутствии катализатора, такого как п-толуолсульфоновая кислота, метансульфоновая кислота, TFA, TfOH, BF3-OEt2 и т.п. Реакция может также быть проведена в присутствии активированных молекулярных сит. Температура реакции может изменяться в интервале от 10 до 100 С, предпочтительнее в интервале от 10 до 60 С. Время реакции может составлять от 1 до 48 ч. Полученный, как описано выше, иминовый продукт может быть восстановлен с помощьюNa(CN)BH3-HCl (см.: Hutchins, R.О. et al. J. Org. Chem. 1983, 48, 3433), NaBH4, H2-Pd/C, H2-Pt/C, H2-Rh/C и т.п. в растворителях, таких как метанол, этанол и т.п. Соединение формулы (I), где R5 обозначает водород, может быть также получено с помощью одностадийной процедуры с использованием соединения формулы (IVg) и (IVf), где все символы имеют указанные выше значения, путем восстановительного аминирования с использованием водорода в качестве восстановителя. Соединения формул (IVg) и (IVf) при конденсации под давлением в присутствии водорода могут образовывать соединение формулы (I). Давление может изменяться в интервале от 69 до 620 кПа (10-90 psi), предпочтительнее от 138 до 414 кПа (20-60 psi). В качестве растворителя может быть выбран один из МеОН, EtOH, EtOAc, диоксана, толуола и т.п. Температура может изменяться в интервале от комнатной температуры до 50 С, предпочтительнее в интервале от комнатной температуры до 40 С. Может быть использован катализатор, такой как Pd/C, Rh/C, Pt/C и т.п. Соединение общей формулы (I), где R4 обозначает атом водорода, может быть получено путем гидролиза, с использованием обычных методов, соединения формулы (I), где R4 обозначает все определенные прежде группы, за исключением водорода. Гидролиз может быть проведен в присутствии основания,такого как Na2CO3, K2CO3, NaOH, KОН, LiOH и т.п., и пригодного растворителя, такого как метанол,этанол, вода и т.п. или их смеси. Реакция может быть проведена в интервале температур 20-120 С. Время реакции может составлять от 2 до 48 ч, предпочтительнее, от 2 до 12 ч. Соединение общей формулы (I), где Y обозначает кислород и R4 обозначает водород или низшую алкильную группу, может быть превращено в соединение формулы (I), где Y обозначает NR7, путем реакции с соответствующими аминами формулы NHR4R7, где R4 и R7 имеют указанные выше значения, с образованием соединения формулы (I), где Y обозначает NR7, a все другие символы имеют указаны выше значение. По другому варианту исполнения, соединение формулы (I), где YR4 обозначает ОН, может быть превращено в галоидангидрид кислоты, предпочтительнее YR4 = Cl, путем проведения реакции с соответствующими реагентами, такими как оксалилхлорид, тионилхлорид и т.п., с последующей обработкой аминами формулы NHR4R7, где R4 и R7 имеют указанные выше значения. По другому варианту исполнения смешанные ангидриды могут быть получены из соединения формулы (I), где YR4 обозначает ОН, а все другие символы имеют указанные выше значения, путем обработки галоидангидридами кислот, такими как ацетилхлорид, ацетилбромид, пивалоилхлорид, дихлорбензоилхлорид и т.п. Реакция может быть проведена в присутствии пиридина, триэтиламина, диизопропилэтиламина и т.п. Для активации кислоты могут быть также использованы агенты сочетания, такие как DCC/DMAP, DCC/HOBt,EDCI/HOBT, этилхлорформиат, изобутилхлорформиат. Могут быть использованы растворители, такие как галогенированные углеводороды, например, CHCl3 или CH2Cl2; углеводороды, такие как бензол, толуол, ксилол и т.п. Реакция может быть проведена в интервале температур от -40 до 40 С, предпочтительнее при температуре в интервале от 0 до 20 С. Галоидангидрид кислоты или смешанный ангидрид- 14008947 или активированная кислота, полученные с помощью агентов сочетания, как описано выше, могут быть обработаны далее соответствующими аминами формулы NHR4R7, где R4 и R7 имеют указанные выше значения, с образованием соединения формулы (I), где Y обозначает NR7, а все другие символы имеют указанные выше значения. Еще один вариант исполнения данного изобретения предусматривает новое промежуточное соединение формулы (IIIa) его таутомерные формы, его стереоизомеры, его соли, его сольваты,R5 обозначает водород или замещенную или незамещенную группу, представленную алкилом, или ароил, n и m являются целыми числами в интервале 0-6, Ar обозначает замещенный или незамещенный двухвалентный фенилен, X обозначает С=O, C=S, -C(O)CH2-, -СН=СН-СН 2- или X обозначает связь,R6 обозначает замещенную или незамещенную группу, выбранную из -OSO2R8 или -NR8COR9, где 8R обозначает водород, или замещенный или незамещенный алкил, или арил, арилалкил, алкоксикарбонил или арилалкоксикарбонил, a R9 обозначает водород, или замещенный или незамещенный алкил, при условии, что R6 обозначает водород, когда R13 находится в третьей позиции фенильного кольца и не обозначает водород, иR13 обозначает водород, -OSO2 алкил. Заместители групп, представленных Ar, R5, R6, R8 и R13, имеют значения, указанные для соединения формулы (I), m обозначает целое число от 0 до 6 и n обозначает целое число от 0 до 6. По еще одному варианту воплощения данного изобретения соединение формулы (IIIa), где R5 обозначает водород; X обозначает С(O)СН 2-, -СН=СН-СН 2- или X обозначает связь; m имеет значения в интервале от 1 до 6, Ar обозначает фенил, а все другие символы имеют указанные выше значения, может быть получено способом, описанным на cхеме III ниже. Схема III Реакция соединения формулы (IIIk), где все символы определены выше, с соединением формулы(III l), где R12 обозначает водород или (С 1-С 6)-алкильную группу, с образованием соединения формулы(IIIm), в которой все символы имеют указанные выше значения, может быть проведена в две стадии первой стадией является образование имина, с последующим восстановлением. Образование имина может быть проведено в растворителях, таких как МеОН, EtOH i-PrOH и т.п. Реакция может быть проведена в присутствии промотора, такого как NaOAc, KOAc и т.п. или их смесей. Температура реакции может изменяться в интервале от комнатной температуры до температуры кипения с обратным холодильником использованного растворителя. Время реакции может составлять от 2 до 24 ч, предпочтительнее от 2 до 12 ч. Имин может быть также получен по реакции соединения общей формулы (IIIk) с соединением формулы (III l) с использованием растворителей, таких как СН 2 С 12, СНСl3, хлорбензол, бензол, ТГФ, в присутствии катализатора, такого как п-толуолсульфоновая кислота, метансульфоновая кислота, TFA,TfOH, BF3-OEt2 и т.п. Реакция может также быть проведена в присутствии активированных молекулярных сит. Температура реакции может изменяться в интервале от 10 до 100 С, предпочтительнее в интервале от 10 до 60 С. Время реакции может составлять от 1 до 48 ч. Иминовый продукт, полученный, как описано выше, может быть восстановлен с помощьюNa(CN)BH3-HCl (см.: Hutchins, R.О. et al., J. Org. Chem. 1983, 48, 3433), NaBH4, H2-Pd/C, H2-Pt/C, H2-Rh/C и т.п. в растворителях, таких как метанол, этанол и т.п. Гидролиз соединения формулы (IIIm), в которой все символы имеют указанные выше значения, с образованием соединения формулы (IIIa), может быть проведен в присутствии основания или кислоты,причем выбор основания или кислоты не является критическим. Могут быть использованы такие осно- 15008947 вания, как гидроксиды металлов, например, NaOH или KОН, в водном растворителе или кислотах, таких как водная HCl или TFA в растворителях, таких как CH2Cl2, ТГФ, ацетон, метанол, этанол, пропанол,вода и т.д. Реакция может быть проведена в интервале температур от 0 С до температуры кипения с обратным холодильником использованного растворителя, предпочтительнее в интервале температур от 0 С до температуры кипения с обратным холодильником использованного растворителя. Продолжительность реакции может изменяться от 0,25 до 48 ч. По еще одному варианту исполнения данного изобретения соединение формулы (IIIa), где R5 обозначает водород или алкильную группу; m равняется 0, а все другие символы имеют указанные выше значения, может быть получено способом, включающим проведение реакции соединения формулы (IIIg) где все символы имеют указанные выше значения, с соединением формулы (IIIn) где R12 обозначает водород или алкильную группу, и R5 имеет указанные выше значения, m обозначает целое число в интервале 0-6. Реакция соединения формулы (IIIg) с соединением формулы (IIIn) может быть проведена в присутствии растворителей, таких как ТГФ, ДМФ, ДМСО, DME, толуол, бензол, ацетон, ацетонитрил и т.п. или их смесей. Реакция может быть проведена в инертной атмосфере, которую поддерживают путем использования инертных газов, таких как N2, Ar, Не и т.п. Реакция может быть проведена в присутствии основания, такого как K2 СО 3, Na2 СО 3, NaH и т.п. или их смесей. Температура реакции может изменяться в интервале от 20 до 120 С, предпочтительнее в интервале 30-80 С. Продолжительность реакции может меняться от 1 до 24 ч, предпочтительнее от 1 до 12 ч. Промежуточное соединение (IIIf) по настоящему изобретению и способ его получения являются предметом нашей заявки РСТPCT/IB 02/04274. Предполагается, что в любой из указанных выше реакций, любая реакционноспособная группа в молекуле субстрата может быть защищена в соответствии с обычной химической практикой. Пригодными защитными группами в любой из упомянутых выше реакций являются трет-бутилдиметилсилил, метоксиметил, трифенилметил, бензилоксикарбонил, ТНР и т.д. для защиты гидроксильной или фенольной гидроксильной группы; N-Boc, N-Cbz, N-Fmoc, бензофенонимин и т.д. для защиты аминогруппы или анилиногруппы, ацетальная защита для альдегида, кетальная защита для кетона и т.п. Способы образования и удаления таких защитных групп являются обычными способами, зависящими от молекулы, нуждающейся в защите. Фармацевтически приемлемые соли получают путем проведения реакции соединения формулы (I) с 1-4 экв. основания, такого как гидроксид натрия, метоксид натрия, гидрид натрия, гидроксид калия, тбутоксид калия, гидроксид кальция, гидроксид магния и т.п., в растворителях, таких как диэтиловый эфир, ТГФ, метанол, т-бутанол, диоксан, изопропанол, этанол и т.д. Могут быть использованы смеси растворителей. Могут быть использованы также органические основания, такие как лизин, аргинин, диэтаноламин, холин, гуанидин, трометамин и их производные и т.д. По другому варианту, в соответствующих случаях получают кислотно-аддитивные соли путем обработки кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, п-толуолсульфоновая кислота, метансульфоновая кислота, уксусная кислота, лимонная кислота,малеиновая кислота, фумаровая кислота, салициловая кислота, оксинафтойная кислота, аскорбиновая кислота, пальмитиновая кислота, янтарная кислота, бензойная кислота, бензолсульфоновая кислота, винная кислота и т.п., в растворителях, таких как этилацетат, диэтиловый эфир, спирты, ацетон, ТГФ, диоксан и т.д. Могут быть использованы также смеси растворителей. Стереоизомеры соединений, составляющие часть данного изобретения, могут быть получены путем использования в способе, если это возможно, реагентов в форме отдельных энантиомеров, или путем проведения реакции в присутствии реагентов или катализаторов в форме их отдельных энантиомеров, или путем разделения смеси стереоизомеров обычными методами. Некоторые из лучших методов включают использование микробного разделения, разделение диастереомерных солей, образованных с хиральными кислотами, такими как миндальная кислота, камфорсульфоновая кислота, винная кислота, молочная кислота и т.п., если это возможно,или с хиральными основаниями, такими как бруцин, алкалоиды хинного дерева и их производные и т.п. Обычно используемые методы описаны Jaques et al. в книге "Enantiomers, Racemates and Resolution"(Wiley Interscience, 1981). Конкретнее, соединение формулы (I), где YR10 обозначает ОН, может быть превращено в 1:1 смесь диастереомерных амидов путем обработки хиральными аминами, аминокислотами, аминоспиртами, производными от аминокислот; для превращения кислоты в амид могут быть ис- 16008947 пользованы обычные условия реакции; диастереомеры могут быть разделены с помощью фракционной кристаллизации или хроматографии, и стереоизомеры соединения формулы (I) могут быть получены путем гидролиза чистого диастереомерного амида. Разные полиморфы соединения общей формулы (I), образующие часть данного изобретения, могут быть получены путем кристаллизации соединения формулы (I) в разных условиях. Например, используют для перекристаллизации обычно используемые растворители или их смеси; проводят кристаллизацию при разных температурах; используют разные режимы охлаждения, от очень быстрого до очень медленного охлаждения во время кристаллизации. Полиморфы могут быть получены также путем нагревания или плавления соединения с последующим постепенным или быстрым охлаждением. Присутствие полиморфов может быть определено методами твердофазной ЯМР-спектроскопии, ИК-спектроскопии, дифференциальной сканирующей калориметрии, порошковой рентгеновской дифракции или другими подобными методами. Данное изобретение предлагает фармацевтическую композицию, содержащую соединения общей формулы (I), определенной выше, их производные, их аналоги, их таутомерные формы, их стереоизомеры, их полиморфы, их фармацевтически приемлемые соли или их фармацевтически приемлемые сольваты в комбинации с обычными фармацевтически применимыми носителями, разбавителями и т.п., пригодную для лечения и/или профилактики болезней, таких как гипертензия, ишемическая болезнь сердца,атеросклероз, инсульт, периферические сосудистые заболевания и родственные расстройства. Эти соединения пригодны для лечения семейной гиперхолестеринемии, гипертриглицеридемии, снижения атерогенных липопротеидов, VLDL и LDL. Соединения по настоящему изобретению могут быть использованы для лечения некоторых почечных заболеваний, включая гломерулонефрит, гломерулосклероз, нефротический синдром, гипертензивный нефросклероз, нефропатию. Соединения общей формулы (I) являются также пригодными для лечения/профилактики инсулинорезистентности (диабет типа II), нарушенной толерантности к глюкозе, лептинорезистентности, дислипидемии, расстройств, связанных с синдромом X, таких как гипертензия,ожирение, инсулинорезистентность, ишемическая болезнь сердца и других сердечно-сосудистых расстройств. Соединения по настоящему изобретению могут также быть полезны как ингибиторы альдозоредуктазы, для улучшения познавательных функций при деменции, как воспалительные агенты, для лечения диабетических осложнений, расстройств, связанных с активацией эндотелиальных клеток, псориаза,синдрома поликистозных яичников (PCOS), воспалительных болезней кишечника, остеопороза, миотонической дистрофии, панкреатита, ретинопатии, артериосклероза, ксантомы и для лечения рака. Соединения по настоящему изобретению являются пригодными для лечения и/или профилактики указанных выше болезней в комбинации/совместно с одним или несколькими ингибиторами HMG СоАредуктазы; ингибиторами всасывания холестерина; средствами для лечения ожирения; средствами для лечения липопротеидных расстройств; гипогликемическими агентами: инсулином; бигуанидом; сульфонилмочевиной; тиазолидиндионом; двойными агонистами PPAR иили их смесью. Соединения по настоящему изобретению в комбинации с ингибиторами HMG СоА-редуктазы, ингибиторами всасывания холестерина, средствами для лечения ожирения, гипогликемическими агентами могут вводиться одновременно или на протяжении такого периода времени, чтобы обеспечить их синергическое действие. Данное изобретение предлагает также фармацевтическую композицию, содержащую соединения общей формулы (I), определенной выше, их производные, их аналоги, их таутомерные формы, их стереоизомеры, их полиморфы, их фармацевтически приемлемые соли или их фармацевтически приемлемые сольваты и один или несколько ингибиторов HMG СоА-редуктазы; ингибиторов всасывания холестерина; средств против ожирения; средств для лечения липопротеидных расстройств; гипогликемических агентов; инсулин; бигуанид; сульфонилмочевину; тиазолидиндион; двойные PPAR иили их смесь в комбинации с обычными фармацевтически применимыми носителями, разбавителями и т.п. Фармацевтическая композиция может находиться в обычно применяемых формах, таких как таблетки, капсулы, порошки, сиропы, растворы, суспензии и т.п., может содержать вкусовые агенты, подсластители и т.д. в пригодных твердых или жидких носителях или разбавителях, или в пригодной стерильной среде для образования растворов или суспензий для инъекций. Такие композиции типично содержат от 1 до 20%, предпочтительнее от 1 до 10 мас.%, активного соединения, а остаток композиции состоит из фармацевтически приемлемых носителей, разбавителей или растворителей. Пригодные фармацевтически приемлемые носители включают твердые наполнители или разбавители и стерильные водные или органические растворы. Активный ингредиент входит в состав таких фармацевтических композиций в количестве, достаточном для обеспечения желательной дозы в указанном выше интервале значений. Так, для орального введения, соединение формулы (I) может быть объединено с пригодным твердым или жидким носителем или разбавителем с образованием капсул, таблеток,порошков, сиропов, растворов, суспензий и т.п. Фармацевтические композиции могут при необходимости содержать дополнительные компоненты, такие как вкусовые агенты, подсластители, эксципиенты и т.п. Для парентерального введения соединения могут быть объединены со стерильной водной или орга- 17008947 нической средой для получения растворов или суспензий для инъекций. Например, могут быть использованы растворы в кунжутном или арахисовом масле, водном пропиленгликоле и т.п., а также водные растворы водорастворимых фармацевтически приемлемых кислотно-аддитивных солей или солей основных форм соединений. В растворах для инъекций могут также быть использованы водные растворы с активным ингредиентом, растворенным в полигидроксилированном касторовом масле. Растворы для инъекций, изготовленные таким образом, могут быть потом введены внутривенно, внутрибрюшинно,подкожно или внутримышечно, причем предпочтительным для людей является внутримышечное введение. Для назального введения препарат может содержать соединения по настоящему изобретению, растворенные или суспендированные в жидком носителе, в частности в водном носителе, для аэрозольного применения. Носитель может содержать добавки, такие как солюбилизаторы, например пропиленгликоль, поверхностно-активные вещества, средства, усиливающие всасывание, такие как лецитин (фосфатидилхолин), или циклодекстрин, или консерванты, такие как парабены. Особенно пригодными для любого орального применения являются таблетки, драже или капсулы,содержащие связующий носитель на основе талька и/или углевода и т.п. Предпочтительно носители для таблеток, драже или капсул включают лактозу, кукурузный крахмал и/или картофельный крахмал. В тех случаях, когда может быть применен подслащенный носитель, могут быть использованы сироп или эликсир. Соединение (соединения) формулы (I), определенной выше, клинически вводят млекопитающим,включая человека, оральным или парентеральным путями. Предпочтительным является введение оральным путем, как более удобное и позволяющее избегнуть боли и раздражения, возможных при инъекции. Однако если пациент не может проглотить лекарственное средство или при нарушенном всасывании после орального введения, например, вследствие болезни или другой аномалии, лекарственное средство должно быть введено парентерально. При любом пути введения, дозу, находящуюся в интервале от примерно 0,01 до примерно 100 мг/кг веса тела субъекта в сутки или предпочтительнее от примерно 0,01 до примерно 50 мг/кг веса тела в сутки, вводят в виде разовой или кратных доз. Однако оптимальную схему дозирования для каждого субъекта, получающего лечение, определяет лицо, ответственное за лечение,причем обычно сначала вводят меньшие дозы, которые потом постепенно увеличивают для определения наиболее пригодной дозы. Соединения по настоящему изобретению снижают уровень сахара крови в произвольный момент времени, триглицериды, общий холестерин, LDL, VLDL и повышают HDL по агонистическому механизму. Это можно продемонстрировать экспериментами на животных как in vitro, так и in vivo. Изобретение поясняется детальнее в приведенных ниже примерах, которые даются только для иллюстрации и потому не должны истолковываться как ограничивающие объем изобретения. Синтез 1. 4-(3-Метансульфонилоксипропил)фенилметансульфонат. Стадия (i). К суспензии LAH (22,1 г, 2,5 экв., 583 ммоль) в сухом ТГФ (1,0 л), прибавляют по каплям раствор метил-3-(4-гидроксифенил)пропионата (21 г, 1,0 экв., 116 ммоль) в ТГФ (50 мл) при комнатной температуре. Реакционную смесь нагревают докипения с обратным холодильником в течение 4-5 ч. Ее дорабатывают путем гашения избытком этилацетата с последующим добавлением воды (23 мл), 15%-го водн.NaOH (23 мл) и воды (70 мл) при контролируемом перемешивании и поддержании комнатной температуры. К доработанной смеси прибавляют конц. HCl для доведения рН до 7,0. Потом ее фильтруют через целит и промывают этилацетатом. Объединенный фильтрат осушают (Na2SO4) и конденсируют. Полученный остаток подвергают хроматографии (этилацетат/гексаны), получая 3-(4-гидроксифенил)пропанол(17 г, 100%) в виде белого твердого вещества. Т. пл.: 52-54 С. 1 Н ЯМР (CDCl3, 200 МГц) : 1,78-1,86 (м, 2 Н); 2,63 (т, J = 7,9 Гц, 2 Н); 3,67 (т, J = 6,3 Гц, 2 Н); 6,74 (д,J = 8,8 Гц, 2 Н); 7,05 (д, J = 8,8 Гц, 2 Н). ИК (чистое вещество) см-1: 3485, 3029, 2940, 1505. Масса m/z (Cl) (химическая ионизация): 152 [М+1]. Стадия (ii). К раствору 3-(4-гидроксифенил)пропанола (17 г, 1,0 экв., 111,8 ммоль), полученного на стадии (i), и триэтиламина (93,3 мл, 6,0 экв., 670,8 ммоль) в ДХМ (550 мл) прибавляют по каплям метансульфонилхлорид (26 мл, 3,0 экв., 335,4 ммоль) при 0 С. Реакционную смесь перемешивают при комнатной температуре в течение 16 ч, после чего ее дорабатывают путем разведения избытком ДХМ и промывания органического слоя разв. HCl, водой и рассолом. Органический слой осушают (Na2SO4) и концентрируют. Требуемый продукт очищают из сырьевой массы перекристаллизацией из диизопропилового эфира. Остаток маточного раствора конденсируют и подвергают хроматографии (этилацетат/гексаны), получая- 18008947 дополнительное количество требуемого соединения (общий выход 20,8 г, 61%) в виде белого твердого вещества. Т. пл.: 60-62 С. 1 Н ЯМР (CDCl3, 200 МГц):2,00-2,18 (м, 2 Н); 2,77 (т, J = 7,8 Гц, 2 Н); 3,00 (с, 3 Н); 3,13 (с, 3 Н); 4,23 Получают в соответствии с типичной процедурой синтеза 1. Стадия (i). Из метил-3-гидроксифенилпропионата получают 3-(3-гидроксифенил)пропанол в виде жидкой массы (100%). 1 Н ЯМР (CDCl3, 200 МГц):1,80-1,88 (м, 2 Н); 2,64 (т, J = 7,9 Гц, 2 Н); 3,49 (шир.с, -ОН); 3,67 (т, J = 6,5 Гц, 2 Н); 6,65-6,76 (ароматическое ядро, 3 Н); 7,09-7,17 (ароматическое ядро, 1 Н). ИК (чистое вещество) см-1: 3353, 2932, 2859, 1590. Масса m/z (Cl): 152 [М+1]. Стадия (ii). Из 3-(3-гидроксифенил)пропанола (900 мг, 1,0 экв., 5,92 ммоль), полученного на стадии (i), получают 3-(3-метансульфонилоксипропил)фенилметансульфонат (52%) в виде белого твердого вещества. Т. пл.: 60-62 С. 1 Н ЯМР (CDCl3, 200 МГц):2,00-2,18 (м, 2 Н); 2,79 (т, J = 7,8 Гц, 2 Н); 3,00 (с, 3 Н); 3,15 (с, 3 Н); 4,22 К раствору 3-(4-гидроксифенил)пропанола (2,5 г, 1,0 экв., 16,44 ммоль), полученного на стадии (i) синтеза 1 в ДХМ (82 мл) и триэтиламине (11,4 мл, 5,0 экв., 82,2 ммоль), прибавляют по каплям толуол-4 сульфонилхлорид (9,4 г, 3,0 экв., 49,3 ммоль) при 0 С. Реакционную смесь перемешивают при комнатной температуре в течение 16 ч, после чего ее дорабатывают путем разведения избытком ДХМ и промывания органического слоя водой и рассолом. Сырьевый остаток, полученный после высушивания (Na2SO4) и конденсирования, подвергают хроматографии (этилацетат/гексаны), получая требуемое соединение (5,1 г, 67,7%) в виде вязкой жидкости. 1 Н ЯМР (CDCl3, 200 МГц):1,90 (квинтет, J = 7,9 Гц, 2 Н); 2,44 (с, 6 Н); 2,61 (т, J = 6,8 Гц, 2 Н); 3,98 Смесь 4-нитрофенола (1,0 г, 1,0 экв., 7,19 ммоль), 1,2-дибромэтана (3,85 мл, 6,0 экв., 43,1 ммоль) и безводного K2 СO3 (3,0 г, 3 экв., 21,5 ммоль) в сухом ацетоне (36 мл) перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь фильтруют и фильтрат конденсируют. Конденсированную массу снова растворяют в этилацетате и промывают водн. раствором бикарбоната натрия. Органический слой осушают (Na2SO4), конденсируют и остаток подвергают хроматографии с использованием этилацетата и гексанов, получая названное в заголовке соединение в виде твердого вещества (540 мг, 32%). Т. пл.: 168 С. 1 Н ЯМР (CDCl3, 200 МГц):3,67 (т, J = 6,1 Гц, 2 Н); 4,38 (т, J = 6,1 Гц, 2 Н); 6,97 (д, J = 8,7 Гц, 2 Н); 8,20 (д, J = 8,7 Гц, 2 Н). ИК (чистое вещество) см-1: 2925, 1592, 1511, 1330. Масса m/z (Cl): 245 [M(79Br)], 246 [M(79Br)+1], 247 [М(81 Вr)], 248 [M(81Br)+1]. Синтез 5. Этил-2-этокси-3-(4-аминофенил)пропионат. Стадия (i). Готовят соль Виттига из триэтил-2-этоксифосфоноацетата (26,5 г, 1,5 экв., 99,3 ммоль) и NaH (50% в масле) (5,3 г, 2 экв., 132,4 ммоль) в ТГФ (350 мл) при 0 С. Прибавляют к ней порциями твердый 4 нитробензальдегид (10 г, 1 экв., 66,2 ммоль) при 0 С и полученный раствор перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь разводят этилацетатом и промывают водным NH4Cl. Сырьевый продукт содержит этил-п-нитро-2-этоксициннамат в форме Z- и Е-стереоизомеров (11 г). Стадия (ii). Этил-п-нитро-2-этоксициннамат, полученный на стадии (i), гидрируют с использованием 10%Pd-C-Н 2 (414 кПа) (60 psi) (11 г) в этилацетате (150 мл) при комнатной температуре и подвергают хроматографии с использованием этилацетата/гексана, получая названное в заголовке соединение в виде вязкой маслянистой жидкости (9,41 г, 60%). 1 Н ЯМР (CDCl3, 200 МГц):1,16 (т, J = 7,0 Гц, 3 Н), 1,22 (т, J = 7,0 Гц, 3 Н), 2,90 (д, J = 6,3 Гц, 2 Н),3,30 (шир.с, 2 Н, NH2), 3,35 (м, 1 Н), 3,55 (м, 1 Н), 3,94 (т, J = 6,3 Гц, 1 Н), 4,15 (кв, J = 7,0 Гц, 2 Н), 6,62 (д, J= 8,3 Гц, 2 Н), 7,03 (д, J = 8,0 Гц, 2 Н). ИК (чистое вещество) см-1: 3372, 1738. Масса m/z (Cl): 238 (М+1), 192 (М-ОС 2 Н 5). Синтез 6. Метил-2-этокси-3-(4-аминофенил)пропионат. Стадия (i). Готовят соль Виттига из триэтил-2-этоксифосфоноацетата (34,3 мл, 2 экв., 132 ммоль) и NaH (50% в масле) (6,28 г, 2 экв., 132 ммоль) в ТГФ (350 мл) при 0 С. Прибавляют к ней твердый пнитробензальдегид (10 г, 1 экв., 66 ммоль) порциями при 0 С. Полученный раствор перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь разводят этилацетатом и промывают воднымNH4Cl. Сырьевый продукт содержит этил-п-нитро-2-этоксициннамат в форме Z- и Е-стереоизомеров (15 г, 86%). Стадия (ii). Сырьевое соединение (15 г, 1 экв., 56,6 ммоль), полученное на стадии (i), растворяют в метаноле(250 мл). Прибавляют к нему формиат аммония (35,6 г, 10 экв., 566 ммоль) и 10% Pd-C (40 г) и реакционную смесь перемешивают при комнатной температуре в течение 16 ч. Катализатор отделяют на фильтре и фильтрат конденсируют на вращающемся испарителе. Остаток разводят этилацетатом и промывают водой и рассолом. Сырьевую массу подвергают хроматографии, получая этил-2-этокси-п-аминоциннамат в форме (Е)- и (Z)-изомеров (10 г, 75%). Стадия (iii). Этил-2-этокси-п-аминоциннамат (10 г, 1 экв., 42,5 ммоль), полученный на стадии (ii), обрабатывают магнием (20,4 г, 20 экв., 850 ммоль) и сухим метанолом (500 мл). Реакционную смесь нагревают до кипения с обратным холодильником в течение 2-3 ч и оставляют при перемешивании при комнатной температуре в течение 16 ч. Реакционную смесь разводят этилацетатом и гасят холодным водным хлоридом аммония. Органический слой промывают водой и рассолом. Остаток подвергают хроматографии с использованием этилацетата и гексана, получая названное в заголовке соединение в виде вязкой жидкости Начиная с 3-нитробензальдегида и используя типичную процедуру синтеза 5, получают названное в заголовке соединение в виде вязкой маслянистой жидкости (60% для двух стадий). 1 Н ЯМР (200 МГц, CDCl3):1,17 (т, J = 7 Гц, 3 Н); 1,22 (т, J = 7 Гц, 3 Н); 2,91 (д, J = 6,7 Гц, 2 Н); 3,303,48 (м, 1 Н); 3,48-3,62 (м, 1 Н); 4,00 (т, J = 6,7 Гц, 1 Н); 4,17 (кв, J = 7 Гц, 2 Н); 6,50-6,70 (ароматическое ядро, 3 Н); 7,06 (т, J = 7,5 Гц, 1 Н). ИК (чистое вещество) см-1: 3374, 2978, 1738, 1606. Масса m/z (Cl): 238 [М+1]. Синтез 8. Этил-2-изопропокси-3-(4-нитрофенил)пропионат.(50 мл) и тионилхлорида (5 мл) при -5 С. Смесь перемешивают при этой температуре в течение еще одного часа, а потом перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь конденсируют на вращающемся испарителе, подвергают азеотропной перегонке с толуолом, а потом высушивают с помощью высоковакуумного насоса, получая хлористо-водородную соль этилового сложного эфира 4-нитрофенилаланина в виде белого твердого вещества (количественный выход). Стадия (ii). Хлористо-водородную соль этилового сложного эфира 4-нитрофенилаланина (2 г, 1,0 экв., 7,28 ммоль), полученную на стадии (i), растворяют в этилацетате (150 мл). Прибавляют к ней Na2CO3 (386 мг,0,5 экв., 3,64 ммоль) и перемешивают в течение 15 мин. Реакционную смесь промывают водн. NaHCO3. Органический слой осушают (Na2SO4) и конденсируют, получая этиловый сложный эфир 4-нитрофенилаланина в виде вязкой маслянистой жидкости (1,55 г, 89%). Стадия (iii). Этиловый сложный эфир 4-нитрофенилаланина (1,55 г, 1,0 экв., 6,51 ммоль), полученный на стадии(ii) выше, растворяют в хлороформе (33 мл). Прибавляют к нему ледяную уксусную кислоту (20 мкл,0,05 экв., 0,33 ммоль) и изоамилнитрит (958 мкл, 1,1 экв., 7,16 ммоль) и реакционную смесь нагревают до кипения с обратным холодильником в течение 30 мин. Реакционную смесь разводят хлороформом и промывают водн. NaHCO3. Органический слой осушают (Na2SO4) и конденсируют (осторожно) до желтоватой жидкости. Стадия (iv). Жидкость (1,54 г, 1,0 экв., 6,18 ммоль), полученную, как описано на стадии (iii), растворяют в сухом изопропаноле (31 мл), прибавляют к ней каталитическое количество Rh2(OAc)42H2O (38 мг, 0,02 экв.,0,12 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 16 ч. Изопропанол конденсируют и реакционую смесь разводят этилацетатом. Органический слой промывают водой и рассолом, осушают (Na2SO4) и концентрируют. Хроматография на колонке с использованием этилацетата и гексанов дает требуемое соединение этил-2-изопропокси-3-(4-нитрофенил)пропионат (1,25 г, общий выход 61%). 1 Н ЯМР (200 МГц, CDCl3) : 0,92 (д, J = 5,8 Гц, 3 Н), 1,16 (д, J = 5,8 Гц, 3 Н), 1,27 (т, J = 7,4 Гц, 3 Н),3,00-3,10 (м, 2 Н), 3,52 (квинтет, 1 Н), 4,08 (дд, J = 8,7 и 4,8 Гц, 1 Н), 4,21 (кв, J = 7,4 Гц, 2 Н), 7,43 (д, J = 8,7 Гц, 2 Н), 8,16 (д, J = 8,7 Гц, 2 Н). ИК (чистое вещество) см-1: 2975, 1747, 1602, 1522, 1347. Масса m/z (Cl): 282 [М+1]. Синтез 9. Этил-2-изопропокси-3-(4-аминофенил)пропионат. Этил-2-изопропокси-3-(4-нитрофенил)пропионат (1,52 г, 5,4 ммоль), полученный в синтезе 8, гидрируют при давлении молекулярного водорода 69 кПа (10 psi) с использованием в качестве катализатора 10% Pd/C (700 мг) в этилацетате (200 мл) при комнатной температуре в течение 3-4 ч. Требуемый продукт выделяют после фильтрации реакционной смеси и концентрирования фильтрата при пониженном давлении. Хроматография на колонке сырьевой массы с использованием этилацетата и гексанов дает требуемое соединение этил-2-изопропокси-3-(4-аминофенил)пропионат (1,16 г, общий выход 86%). 1 Н ЯМР (200 МГц, CDCl3) : 0,97 (д, J = 5,8 Гц, 3 Н), 1,15 (д, J = 5,8 Гц, 3 Н), 1,23 (т, J = 7,0 Гц, 3 Н),2,80-2,95 (м, 2 Н), 3,49 (квинтет, 1 Н), 3,98 (дд, J = 8,1 и 5,7 Гц, 1 Н), 4,16 (кв, J = 7,0 Гц, 2 Н), 6,61 (д, J = 8,3 Гц, 2 Н), 7,03 (д, J = 8,3 Гц, 2 Н). ИК (чистое вещество) см-1: 3455, 3371, 2975, 2929, 1737, 1626, 1519. Масса m/z (Cl): 252 [М+1]. Синтез 10. 4-Метансульфонилоксибензальдегид. Смесь 4-гидроксибензальдегида (5,0 г, 1,0 экв., 40,98 ммоль), безводного K2 СO3 (17 г, 3 экв., 123 ммоль) и метансульфонилхлорида (4,76 мл, 1,5 экв., 61,37 ммоль) в сухом ДМФ (200 мл) перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь разводят этилацетатом (200 мл) и промывают водой и рассолом. Органический слой осушают (Na2SO4), конденсируют и полученный остаток- 21008947 подвергают хроматографии с использованием этилацетата и гексанов, получая названное в заголовке соединение в виде белого твердого вещества (2,0 г, 25%). Т. пл.: 60-62 С. 1 Н ЯМР (CDCl3, 200 МГц) : 3,21 (с, 3 Н); 7,45 (д, J = 8,8 Гц, 2 Н); 7,95 (д, J = 8,8 Гц, 2 Н); 10,01 (с,1 Н). ИК (чистое вещество) см-1: 3024, 2932, 1701, 1591, 1502. Масса m/z (Cl): 201 [М+1]. Синтез 11. 2-(4-Гидроксифенил)-1-этанол. Раствор метил-2-(4-гидроксифенил)ацетата (3,0 г, 18,07 ммоль) в ТГФ (20 мл) прибавляют к перемешиваемой суспензии LAH (0,89 г, 23,49 ммоль) в ТГФ (20 мл) при 0 С. Перемешивание продолжают при комнатной температуре в течение 4 ч. Излишек LAH гасят насыщенным раствором Na2SO4 и образующийся осадок собирают на фильтре. Фильтрат экстрагируют этилацетатом и органический экстракт промывают рассолом, осушают (Na2SO4) и упаривают до сухого остатка. Очистка на колонке с использованием 50% этилацетата-петролейного эфира дает названное в заголовке соединение (1,1 г, 44%) в виде белого твердого вещества. Т. пл.: 88-92 С. 1 Н ЯМР (200 МГц, CDCl3 + ДМСО-d6):2,75 (т, J = 7,1 Гц, 2 Н); 3,75 (т, J = 6,3 Гц, 2 Н); 6,75 (д, J = 8,3 Гц, 2 Н); 7,03 (д, J = 8,3 Гц, 2 Н). Масса m/z (Cl): 138 [М]. Синтез 12. 4-(2-Метилсульфонилоксиэтил)фенилметансульфонат. Названное в заголовке соединение (2 г, 94%) получают из 2-(4-гидроксифенил)-1-этанола (1,0 г,7,25 ммоль), полученного в синтезе 11, в ДХМ (20 мл) с использованием триэтиламина (2,52 мл, 16,1 ммоль) и метансульфонилхлорида (0,83 мл, 15,9 ммоль) при комнатной температуре в течение 2 ч в соответствии с процедурой, аналогичной описанной в синтезе 1, стадия (ii). 1 Н ЯМР (200 МГц, CDCl3):2,91 (с, 3 Н); 3,08 (т, J = 6,8 Гц, 2 Н); 3,15 (с, 3 Н); 4,42 (т, J = 6,8 Гц, 2 Н); 7,20-7,34 (м, 4 Н). Масса m/z (Cl): 199 [М-OSO2Me]. Синтез 13. Метил-2-(4-метилсульфонилоксифенил)ацетат. Названное в заголовке соединение (1,7 г, 77%) получают из метил-2-(4-гидроксифенил)ацетата (1,5 г, 9,04 ммоль) в ДХМ (20 мл) с использованием триэтиламина (3,14 мл, 22,59 ммоль) и метансульфонилхлорида (0,84 мл, 10,84 ммоль) при комнатной температуре в течение 2 ч в соответствии с процедурой,аналогичной описанной в синтезе 1, стадия (ii). 1 Н ЯМР (200 МГц, CDCl3):3,14 (с, 3 Н); 3,64 (с, 2 Н); 3,71 (с, 3 Н); 7,24 (д, J = 8,8 Гц, 2 Н); 7,34 (д, J= 8,8 Гц, 2 Н). Масса m/z: 244 [М]. Синтез 14. 2-(4-Метилсульфонилоксифенил)уксусная кислота. К раствору метил-2-(4-метилсульфонилоксифенил)ацетата (0,95 г, 3,89 ммоль), полученного в синтезе 13, в метаноле (10 мл) прибавляют Na2CO3 (2,06 г, 19,48 ммоль) в воде (5 мл) и реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Метанол упаривают и остаток разводят в воде и промывают этилацетатом для удаления из него примесей, если они есть. Водный слой подкисляют до рН 2, после чего выделяют названное в заголовке соединение (0,55 г, 61,4%) в виде белого твердого вещества. Т. пл.: 158-162 С. 1 Н ЯМР (200 МГц, ДМСО-d6):3,32 (с, 3 Н); 3,62 (с, 2 Н); 7,28 (д, J = 8,9 Гц, 2 Н); 7,37 (д, J = 8,6 Гц,2 Н). Масса m/z (Cl): 231 [М+1]; 230 [М]. Синтез 15. Метил-4-нитроциннамат. Раствор 4-нитрокоричной кислоты (3 г, 15,54 ммоль) в метаноле (50 мл) охлаждают до 10 С, медленно прибавляют конц. H2SO4 (1 мл), а потом нагревают до кипения с обратным холодильником в течение 30 ч. Метанол упаривают при пониженном давлении. Прибавляют к остатку этилацетат (150 мл) и раствор промывают водой, насыщ. раствором NaHCO3, водой и рассолом соответственно. Органический слой осушают (Na2SO4) и упаривают, получая названное в заголовке соединение (3 г, 93%) в виде беловатого твердого вещества. Т. пл.: 158-160 С. 1 Н ЯМР (200 МГц, CDCl3):3,84 (с, 3 Н); 6,56 (д, J = 15,9 Гц, 1 Н); 7,64-7,78 (м, 3 Н); 8,25 (д, J = 8,9 Гц, 2 Н). Масса m/z (Cl): 208 [М+1]; 194 [М-СН 3]. Синтез 16. Метил-3-(4-аминофенил)пропионат. К раствору 4-метилнитроциннамата, полученного в синтезе 15 (1,5 г, 7,25 ммоль), в диоксане (25 мл) прибавляют 10% Pd-C (0,6 г) и гидрируют при комнатной температуре при 414 кПа (60 psi) в течение 20 ч. Реакционную смесь фильтруют через целит и концентрируют при пониженном давлении. Сырьевой остаток очищают хроматографией на колонке с использованием 50% EtOAc-петролейного эфира, получая чистое названное в заголовке соединение (1,07 г, 82,5%) в виде беловатого твердого вещества. Т. пл.: 142-144 С. 1 Н ЯМР (200 МГц, CDCl3):2,57 (т, J = 7,5 Гц, 2 Н); 2,85 (т, J = 7,8 Гц, 2 Н); 3,66 (с, 3 Н); 6,64 (д, J = 8,3 Гц, 2 Н); 7,00 (д, J = 8,3 Гц, 2 Н). Масса m/z (Cl): 180 [М+1]. Синтез 17. 3-(4-Аминофенил)-1-пропанол. Холодный раствор метил-3-(4-аминофенил)пропионата (0,48 г, 2,7 ммоль), полученного в синтезе 16, в ТГФ (10 мл) медленно прибавляют по каплям к суспензии LAH (132 мг, 3,49 ммоль) в ТГФ (10 мл) при 0 С и перемешивают в течение ночи при комнатной температуре. Непрореагировавший LAH гасят насыщ. раствором Na2SO4 и фильтруют через целит, а слой фильтрующего материала тщательно промывают этилацетатом. Фильтрат и промывную жидкость объединяют и органический слой осушают(Na2SO4) и упаривают. Остаток дает после очистки названное в заголовке соединение (0,27 г, 66,7%) в виде твердого вещества желтого цвета. Т. пл.: 54-56 С. 1 Н ЯМР (200 МГц, CDCl3):1,88-1,92 (м, 2 Н); 2,60 (т, J = 7,5 Гц, 2 Н); 3,66 (т, J = 6,3 Гц, 2 Н); 6,63 (д,J = 8,1 Гц, 2 Н); 6,99 (д, J = 8,1 Гц, 2 Н). Масса m/z (Cl): 152 [М+1]. Синтез 18. 3-(4-трет-Бутоксикарбониламинофенил)-1-пропанол. К охлажденному (0 С) раствору 3-(4-аминофенил)-1-пропанола, полученного в синтезе 17 (0,5 г, 3,3 ммоль), в дихлорметане (15 мл) прибавляют Et3N (1,4 мл), а потом Вос-ангидрид (0,84 мл, 3,64 ммоль) и смесь перемешивают в течение 72 ч при комнатной температуре. Реакционную смесь разводят ДХМ (50 мл) и органический слой промывают водой и рассолом, осушают (Na2SO4) и упаривают до сухого остатка. Хроматография остатка на колонке дает названное в заголовке соединение (0,4 г, 48%) в виде бесцветной маслянистой жидкости. 1 Н ЯМР (200 МГц, CDCl3):1,44-1,53 (м, 9 Н); 1,78-1,93 (м, 2 Н); 2,64 (т, J = 7,6 Гц, 2 Н); 3,64 (т, J = 6,6 Гц, 2 Н); 6,41 (шир.с, 1 Н, D2O-обменный); 7,10 (д, J = 8,3 Гц, 2 Н); 7,25 (д, J = 8,3 Гц, 2 Н). Масса m/z (Cl): 252 [М+1]; 152 [М-Воc]. Синтез 19. 3-(4N-трет-Бутоксикарбонил-4-метилсульфонамидофенил)пропилметансульфонат.(0,27 мл, 3,5 ммоль) и смесь перемешивают в течение 4 ч при комнатной температуре. Реакционную смесь разводят ДХМ (50 мл) и органический слой промывают водой и рассолом, осушают (Na2SO4) и упаривают до сухого остатка, получая названное в заголовке соединение (0,61 г, 94%). 1 Н ЯМР (200 МГц, CDCl3):1,50 (с, 9 Н); 1,95-2,10 (м, 2 Н); 2,68 (т, J = 7,5 Гц, 2 Н); 2,97 (с, 3 Н); 3,13 Названное в заголовке соединение получают в виде твердого вещества коричневого цвета из 4 оксикоричной кислоты (2 г, 12,18 ммоль) с использованием метанола (25 мл) и конц. H2SO4 (0,8 мл) в течение 20 ч по такой же процедуре, как описано в синтезе 15. Т. пл.: 144-146 С. 1 Н ЯМР (200 МГц, CDCl3):3,80 (с, 3 Н); 5,69 (шир.с, D2O обменный); 6,30 (д, J = 15,8 Гц, 1 Н); 6,85 Раствор метил-4-гидроксициннамата, полученного в синтезе 20 (1,5 г, 8,43 ммоль), в ТГФ (15 мл) прибавляют по каплям к суспензии LAH (416 мг) в сухом ТГФ (10 мл) при 0 С и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Излишек LAH гасят насыщ. раствором Na2SO4. Смесь фильтруют через слой целита и фильтрат осушают (Na2SO4) и упаривают до сухого остатка. Остаток очищают хроматографией на колонке, используя 20% ЕtOАс в петролейном эфире, получая названное в заголовке соединение (0,4 г, 31,6%) в виде беловатого твердого вещества. Т. пл.: 116-118 С. 1 Н ЯМР (200 МГц, CD3OD) : 4,17 (д, J = 5,9 Гц, 2 Н); 6,15 (тд, J = 5,9 и 15,8 Гц, 1 Н); 6,50 (д, J = 5,9 Гц, 1 Н); 6,71 (д, J = 8,3 Гц, 2 Н); 7,23 (д, J = 8,6 Гц, 2 Н). Масса m/z (Cl): 151 [М+1]. Синтез 22. 4-[(Е)-3-Хлор-1-пропенил]фенилметансульфонат. Названное в заголовке соединение получают (0,47 г, 64%) из (E)-3-(4-гидроксифенил)-2-пропен-1 ола, полученного в синтезе 21 (0,36 г, 2,4 ммоль), ДХМ (10 мл), Et3N (0,83 мл) и метансульфонилхлорида Названное в заголовке соединение получают (0,53 г, 36%) из (E)-4-оксикоричной кислоты (1,0 г, 6,1 ммоль), ДХМ (20 мл), Et3N (2,12 мл, 15,24 ммоль) и метансульфонилхлорида (0,57 мл, 7,32 ммоль) таким же образом, как описано в синтезе 19. 1 Н ЯМР (200 МГц, CDCl3):3,20 (с, 3 Н); 6,51 (д, J = 15,8 Гц, 1 Н); 7,36 (д, J = 8,6 Гц, 2 Н); 7,64 (д, J = 8,3 Гц, 2 Н); 7,81 (д, J = 15,8 Гц, 1 Н). Масса m/z (Cl): 243 [M+1]. Синтез 24. 3-(4-Метилсульфонилоксифенил)пропионовая кислота. Названное в заголовке соединение получают (1,02 г, 69,4%) из 3-(4-гидроксифенил)пропионовой кислоты (1,0 г, 6,02 ммоль), ДХМ (15 мл), Et3N (2,1 мл, 15,06 ммоль) и метансульфонилхлорида (0,56 мл,7,23 ммоль) таким же образом, как описано в синтезе 19. 1 Н ЯМР (200 МГц, CDCl3):2,74 (т, J = 7,4 Гц, 2 Н); 3,00-3,09 (м, 2 Н); 3,14 (с, 3 Н); 7,14-7,37 (м, 4 Н). Масса m/z (Cl): 245 [M+1]. Синтез 25. Этил-(2S)-3-(4-аминофенил)-2-этоксипропионат и этил-(2R)-3-(4-аминофенил)-2 этоксипропионат. К охлажденному раствору этил-2-этокси-3-(4-аминофенил)пропионата (2,0 г, 8,44 ммоль), полученного в синтезе 5, в сухом ДМФ (30 мл) прибавляют Na2CO3 (2,68 г, 25,3 ммоль) и перемешивают в течение 15 мин. Потом к раствору прибавляют по каплям бензилбромид (2,0 мл, 16,88 ммоль) и реакционную смесь перемешивают в течение 16 ч при комнатной температуре. Реакционную смесь разводят водой (50 мл) и экстрагируют этилацетатом (350 мл). Объединенные органические слои промывают рассолом,осушают (Na2SO4) и упаривают до сухого остатка, получая названное в заголовке соединение в виде желтой маслянистой жидкости (3,42 г, 97%), которую используют на следующей стадии без очистки. 1 Н ЯМР (200 МГц, CDCl3):1,06-1,32 (м, 6 Н); 2,89 (д, J = 6,4 Гц, 2 Н); 3,28-3,48 (м, 1 Н); 3,52-3,70 (м,1 Н); 3,95 (т, J = 6,6 Гц, 1 Н); 4,12 (кв, J = 7,0 Гц, 2 Н); 4,63 (с, 4 Н); 6,67 (д, J = 7,0 Гц, 2 Н); 7,03 (д, J = 8,3 Гц, 2 Н); 7,15-7,43 (м, 10 Н). Масса m/z (Cl): 418 [М+1]. Стадия (ii). 3-(4-Дибензиламинофенил)-2-этоксипропионовая кислота. К раствору соединения, полученного на стадии (i) (0,5 г, 1,2 ммоль), в метаноле (10 мл) прибавляютNa2CO3 (380 мг, 3,6 ммоль) в воде (2 мл) и реакционную смесь перемешивают в течение 3 дней при комнатной температуре. Потом метанол удаляют и реакционную смесь разводят водой (10 мл). Водный слой экстрагируют этилацетатом для удаления любых нежелательных неполярных примесей. Потом водный слой подкисляют с помощью 2 Н раствора HCl до рН 4 и экстрагируют этилацетатом. Объединенные этилацетатные слои промывают рассолом (310 мл), осушают (Na2SO4) и концентрируют, получая названное в заголовке соединение (0,340 г, 74%). 1 Н ЯМР (200 МГц, CDCl3):1,17 (т, J = 7,1 Гц, 3 Н); 2,82-3,05 (м, 2 Н); 3,29-3,67 (м, 2 Н); 3,97-4,09 (м,1 Н); 4,63 (с, 4 Н); 6,67 (д, J = 8,8 Гц, 2 Н); 7,03 (д, J = 8,3 Гц, 2 Н); 7,13-7,42 (м, 10 Н). Масса m/z (Cl): 390 [М+1]. Стадия (iii). N1-[(1S)-1-Фенилпропил]-(2S)-3-(4-дибензиламинофенил)-2-этоксипропанамид (iiia) и К охлажденному раствору соединения, полученного на стадии (ii) (1,0 г, 2,57 ммоль), в сухом ДХМ прибавляют 5-гидроксибензотриазол (172 мг, 1,286 ммоль) и 1-(3-(диметиламино)пропил)-3-этилкарбодиимид (EDCl) (592 мг, 3,08 ммоль) и реакционную смесь перемешивают при 0 С в течение 30 мин (пока она не станет прозрачным раствором). Прибавляют к раствору 2-L-фенилэтаноламин (0,37 г, 2,69 ммоль)- 25008947 и перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь разводят ДХМ (25 мл),промывают водой (325 мл), осушают (Na2SO4) и концентрируют. Диастереомеры разделяют на колонке с силикагелем, используя 10-45% этилацетата в петролейном эфире. Выход iiia: 420 мг (32%); белое твердое вещество, т. пл.: 110-112 С. Выход iiib: 380 мг (29%). К раствору соединения iiia (410 мг, 0,8 ммоль) в диоксане (6 мл) прибавляют 1 М H2SO4 (4 мл) и реакционную смесь нагревают до кипения с обратным холодильником в течение 24 ч. Диоксан удаляют при пониженном давлении и остаток разводят водой (10 мл). Водный слой экстрагируют этилацетатом(325 мл) и объединенные органические слои промывают рассолом, осушают (Na2SO4) и упаривают до сухого остатка. Сырьевую массу очищают на силикагеле, используя 40% этилацетата в петролейном эфире, получая названное в заголовке соединение (180 мг, 58%).(5 мл) в диоксане при кипячении с обратным холодильником в течение 24 ч с использованием такой же процедуры, как описано для синтеза соединения iva. 1 Н ЯМР (200 МГц, CDCl3):1,18 (т, J = 7,0 Гц, 3 Н); 2,83-3,05 (м, 2 Н); 3,40-3,67 (м, 2 Н); 4,03 (дд, J = 7,3 и 4,3 Гц, 1 Н); 4,63 (с, 4 Н); 6,67 (д, J = 8,6 Гц, 2 Н); 7,03 (д, J = 8,6 Гц, 2 Н); 7,15-7,40 (м, 10 Н). Масса m/z (Cl): 390 [М+1]. Стадия (V). Этил-(2S)-3-(4-дибензиламинофенил)-2-этоксипропионат (va). К охлажденному раствору соединения iva (1,2 г, 3,08 ммоль) в сухом ДМФ (30 мл) прибавляютK2 СO3 (1,277 г, 9,25 ммоль) и перемешивают в течение 15 мин при низкой температуре. Прибавляют этилйодид (0,75 мл, 9,25 ммоль) и реакционную смесь оставляют при перемешивании на 3 ч при комнатной темепратуре. Прибавляют воду и реакционную смесь экстрагируют этилацетатом (330 мл). Объединенные органические слои промывают (рассол), осушают (Na2SO4) и концентрируют, получая названное в заголовке соединение (1,1 г, 85%). 1 Н ЯМР (200 3 МГц, CDCl3):1,09-1,30 (м, 6 Н); 2,90 (д, J = 6,5 Гц, 2 Н); 3,27-3,67 (м, 2 Н); 3,96 (т, J = 6,7 Гц, 1 Н); 4,14 (кв, J = 7,3 Гц, 2 Н); 4,63 (с, 4 Н); 6,65 (д, J = 8,6 Гц, 2 Н); 7,03 (д, J = 8,3 Гц, 2 Н); 7,15-7,42 Соединение vb (120 мг, 74%) получают из соединения ivb (150 мг, 0,39 ммоль), K2 СO3 (156 мг, 1,17 ммоль), этилйодида (0,09 мл, 1,17 ммоль) в сухом ДМФ с использованием такой же процедуры, как описано для синтеза va. 1 Н ЯМР (200 МГц, CDCl3):1,08-1,30 (м, 6 Н); 2,89 (д, J = 6,4 Гц, 2 Н); 3,28-3,67 (м, 2 Н); 3,95 (т, J = 10 Гц, 1 Н); 4,13 (кв, J = 7,0 Гц, 2 Н); 4,62 (с, 4 Н); 6,64 (д, J = 8,6 Гц, 2 Н); 7,02 (д, J = 8,6 Гц, 2 Н); 7,19-7,40 К раствору va (1,0 г, 2,4 ммоль) в метаноле (20 мл) прибавляют 10% Pd-C (0,2 г, 20% мас./мас.) и смесь гидрируют в гидрогенизаторе Parr при 414 кПа (60 psi) в течение 24 ч при комнатной температуре. Реакционную смесь фильтруют через целит и промывают фильтрующий слой метанолом. Объединенные слои упаривают до сухого остатка и остаток очищают на силикагеле с использованием 20% ЕtOАс в петролейном эфире, получая названное в заголовке соединение (300 мг, 53%). 1 Н ЯМР (200 МГц, CDCl3):1,17 (т, J = 6,8 Гц, 3 Н); 1,23 (т, J = 7,0 Гц, 3 Н); 2,91 (д, J = 6,8 Гц, 2 Н); 3,25-3,79 (м, 2 Н); 3,95 (т, J = 6,8 Гц, 1 Н); 4,13 (кв, J = 7,6 Гц, 2 Н); 6,62 (д, J = 8,3 Гц, 2 Н); 7,03 (д, J = 8,3 Гц, 2 Н). Масса m/z (Cl): 238 [М+1]. Этил-(2R)-3-(4-аминофенил)-2-этоксипропионат (vib).(0,32 г, 20% мас./мас.) в метаноле (20 мл) в течение 24 ч с использованием такой же процедуры, как описано для синтеза соединения via. 1 Н ЯМР (200 МГц, CDCl3):1,17 (т, J = 7,0 Гц, 3 Н); 1,23 (т, J = 7,0 Гц, 3 Н); 2,90 (д, J = 6,7 Гц, 2 Н); 3,25-3,80 (м, 2 Н); 3,94 (т, J = 6,7 Гц, 1 Н); 4,16 (кв, J = 7,1 Гц, 2 Н); 6,61 (д, J = 8,3 Гц, 2 Н); 7,03 (д, J = 8,1 Гц, 2 Н). Масса m/z (Cl): 238 [М+1]. Синтез 26. (S)-Этил-2-этокси-3-(4-аминофенил)пропионат. Стадия (i). К раствору (S)-(4-нитрофенил)глицина (10 г, 47,6 ммоль) в смеси воды (50 мл), H2SO4 (1M, 60 мл) и ацетона (150 мл) при -5 С прибавляют по каплям при перемешивании раствор нитрита натрия (9,85 г,142,8 ммоль) в воде (40 мл) в течение 30 мин. Реакционную смесь перемешивают при температуре от -5 до 0 С в течение еще 1,5 ч, а потом перемешивают при комнатной температуре в течение 16 ч. Ацетон удаляют, а реакционную смесь разводят 500 мл этилацетата. Органический слой промывают рассолом,осушают над безводным Na2SO4 и концентрируют. Сырьевую массу очищают кристаллизацией из изопропилацетата (9,0 г, 96%). Т. пл.: 134-136 С.(S)-Окси-3-(4-нитрофенил)пропионовую кислоту (9,0 г, 42,6 ммоль), полученную на стадии (i) выше, растворяют в сухом ЕtOH (300 мл). К этому раствору прибавляют конц. H2SO4 (326 мкл, 5,9 ммоль) и кипятят с обратным холодильником в течение 5-6 ч. Реакционную смесь нейтрализуют водным бикарбонатом натрия. Этанол конденсируют на вращающемся испарителе и остаток растворяют в этилацетате. Органический слой промывают водным бикарбонатом натрия, водой, рассолом, а потом осушают над- 27008947 безводным Na2SO4 и концентрируют. Требуемый продукт получают из сырьевой массы кристаллизацией из диизопропилового эфира (8,0 г, 78,5%). Т. пл.: 74-76 С.[]D: -13(c 1,0, MeOH). 1 Н ЯМР (CDCl3):1,30 (т, J = 7 Гц, 3 Н), 3,06 (дд, J = 14 и 7 Гц, 1 Н), 3,25 (дд, J = 14 и 4,3 Гц, 1 Н),4,25 (кв, J = 7 Гц, 2 Н), 4,25 (дд, J = 7 и 4,3 Гц, 1 Н), 7,42 (д, J = 8,7 Гц, 2 Н), 8,16 (д, J = 8,7 Гц, 2 Н). ИК (чистое вещество) см-1: 3432, 2924, 1736, 1518, 1347. Масса m/z (Cl): 240 (М+1). Стадия (iii). К смеси (S)-этил-2-гидрокси-3-(4-нитрофенил)пропионата (4,77 г, 19,95 ммоль), полученного на стадии (ii) выше, молекулярных сит (4) (5,0 г) и порошкообразного Ag2O (13,8 г, 59,8 ммоль) в сухом ацетонитриле (100 мл) прибавляют при комнатной температуре этилйодид (6,4 мл, 79,8 ммоль). Реакционную смесь нагревают при 60 С в течение 16 ч. Реакционную смесь фильтруют через целит и концентрируют. Сырьевую массу подвергают хроматографии с использованием этилацетата и гексанов, получая требуемый продукт в виде вязкой жидкости (3,5 г, выход отдельной стадии 67%). Извлекают непрореагировавший исходный материал (900 мг), который может быть использован повторно.(S)-Этил-2-этокси-3-(4-нитрофенил)пропионат (6,0, 25,3 ммоль), полученный на стадии (iii) выше,растворяют в сухом метаноле (100 мл). К этому раствору прибавляют 10% Pd/C (2,0 г) и гидрируют с использованием газообразного водорода (138 кПа, 20 psi) в течение 3-4 ч. Реакционную смесь фильтруют через целит и фильтрат концентрируют, получая сиропообразную массу. Продукт получают с количественным выходом. Стадия (i). К смеси (S)-этил-2-гидрокси-3-(4-нитрофенил)пропионата (12,5 г, 52,3 ммоль), полученного на стадии (ii) синтеза 26, и порошкообразного Ag2O (36,3 г, 157 ммоль) в сухом ацетонитриле (260 мл) прибавляют метилйодид (13 мл, 209,2 ммоль) при комнатной температуре. Прибавляют активированные молекулярные сита (4) (12,5 г), а потом реакционную смесь перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь фильтруют через целит и концентрируют. Сырьевую массу подвергают хроматографии с использованием этилацетата и гексанов, получая требуемый продукт в виде вязкой жидкости (10,0 г, 75%).(S)-Этил-2-метокси-3-(4-нитрофенил)пропионат (8,0, 31,6 ммоль), полученный на стадии (i) выше,растворяют в сухом метаноле (200 мл). К этому раствору прибавляют 10% Pd/C (2,5 г) и гидрируют с использованием газообразного водорода (138 кПа, 20 psi) в течение 3-4 ч. Реакционную смесь фильтруют через целит и концентрируют до сиропообразной массы. После хроматографии на колонке с использованием этилацетата/гексанов выделяют требуемый продукт в виде вязкой жидкости (7,0 г, количественный выход).(S)-Этил-2-гидрокси-3-(4-нитрофенил)пропионат (9,6 г, 40,1 ммоль), полученный на стадии (ii) синтеза 26, растворяют в этилацетате (250 мл). К этому раствору прибавляют 10% Pd/C (7,0 г) и гидрируют с использованием газообразного водорода (138 кПа, 20 psi) в течение 3-4 ч. Реакционную смесь фильтруют через целит и концентрируют, получая сиропообразную массу. После хроматографии на колонке с использованием этилацетата/гексанов выделяют требуемый продукт в виде вязкой жидкости (6,1 г, 72%).(100 мл) перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь разводят этилацетатом (300 мл), промывают 10%-й водной лимонной кислотой, осушают над безводным Na2SO4 и концентрируют. После хроматографии на колонке с использованием этилацетата/гексанов выделяют требуемый продукт в виде вязкой жидкости (4,5 г, 61%).(S)-Этил-2-гидрокси-3-(4-дибензиламинофенил)пропионат (4,5 г, 1,0 экв., 11,57 ммоль), полученный на стадии (ii) выше, гидролизуют в МеОН-ТГФ-воде с помощью LiOHH2O (972 мг, 2 экв., 23,1 ммоль) при комнатной температуре. Реакционную смесь концентруют и доводят до рН 3. Требуемая кислота выпадает в осадок, который потом собирают на фильтре (4,0 г, выход 96%). Т. пл.: 114-116 С. 1 Н ЯМР (CDCl3):2,83 (дд, J = 14, 7 Гц, 1 Н); 3,09 (дд, J = 14, 3,5 Гц, 1 Н), 4,35-4,44 (м, 1 Н), 4,62 (с,4 Н); 6,68 (д, J = 8,3 Гц, 2 Н), 7,03 (д, J = 8,3 Гц, 2 Н); 7,21-7,35 (ароматическое ядро, 10H). ИК (чистое вещество) см-1: 3450, 3028, 2923, 1725, 1615, 1521. Масса m/z (Cl): 362 [М+1]. Стадия (iv). К раствору (S)-окси-3-(4-дибензиламинофенил)пропионовой кислоты (4,0 г, 11,1 ммоль), полученной на стадии (iii), в сухом ДМФ (56 мл) прибавляют порциями NaH (60% в масле, 886 мг, 22,2 ммоль) при комнатной температуре. Полученную смесь перемешивают при 50 С в течение 2 ч. Реакционную смесь снова охлаждают до комнатной температуры и прибавляют этилйодид (2,67 мл, 33,3 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь разводят этилацетатом и промывают водой и рассолом. Органический слой осушают над безводным Na2SO4 и концентрируют. Остаток очищают хроматографией на колонке с использованием этилацетата/гексанов,получая требуемый продукт в виде вязкой жидкости (2,65 г, выход 57%).(S)-Этил-2-этокси-3-(4-дибензиламинофенил)пропионат, полученный на стадии (iv) выше, гидрируют с помощью Pd/C (10%) и газообразного водорода (138-207 кПа, 20-30 psi) в этилацетатном растворителе в течение 3-4 ч. Требуемый продукт получают из реакционной смеси концентрированием фильтрата сразу после отделения катализатора фильтрацией. Смесь 4-(3-метансульфонилоксипропил)фенилметансульфоната (5,5 г, 1,0 экв., 17,9 ммоль), полученного в синтезе 1, (S)-этил-2-метокси-3-(4-аминофенил)пропионата (4,0 г, 1,0 экв., 17,9 ммоль), полученного в синтезе 27, тетрабутиламмонийбромида (2,8 г, 0,5 экв., 9,0 ммоль) и безводного K2 СO3 (7,4 г,3,0 экв., 53,7 ммоль) в сухом толуоле (90 мл) нагревают при перемешивании до 90 С в течение 7-9 ч. Реакционную смесь разводят этилацетатом (300 мл) и промывают водой и рассолом. Органический слой осушают (Na2SO4), конденсируют и остаток подвергают хроматографии с использованием этилацетата и гексанов, получая названное в заголовке соединение в виде вязкой жидкости (3,4 г, 44%). Начиная с 4-(3-метансульфонилоксипропил)фенилметансульфоната, полученного в синтезе 1, и этил-2-этокси-3-(4-аминофенил)пропионата, полученного в синтезе 5, получают названное в заголовке соединение в виде вязкой жидкости (выход 40%) по процедуре примера 1. 1 Н ЯМР (CDCl3, 200 МГц):1,16 (т, J = 5,8 Гц, 3 Н); 1,21 (т, J = 5,8 Гц, 3 Н): 1,91 (квинтет, J = 7,2 Гц,2 Н); 2,72 (т, J = 7,3 Гц, 2 Н); 2,88 (д, J = 6,3 Гц, 2 Н); 3,02-3,18 (м, 5 Н); 3,22-3,42 (м, 1 Н); 3,42-3,62 (м, 1 Н); 3,93 (т, J = 6,5 Гц, 1 Н); 4,15 (кв, J = 7,3 Гц, 2 Н); 6,51 (д, J = 8,3 Гц, 2 Н); 7,10 (д, J = 8,3 Гц, 2 Н); 7,15-7,24 Из 4-(3-метансульфонилоксипропил)фенилметансульфоната, полученного в синтезе 1, и (S)-этил-2 этокси-3-(4-аминофенил)пропионата, полученного в синтезе 26, получают названное в заголовке соединение по процедуре примера 1.
МПК / Метки
МПК: A61K 31/27, C07C 309/73, A61K 31/167, C07C 311/55, C07C 309/66, A61K 31/145, A61P 3/10
Метки: применение, ppar&alpha, агонисты
Код ссылки
<a href="https://eas.patents.su/30-8947-agonisty-pparalpha-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Агонисты ppar&alpha и их применение</a>
Предыдущий патент: Применение ингибиторов аланиламинопептидаз и содержащие их фармацевтические композиции
Следующий патент: Новые сульфонамиды в качестве средств защиты растений
Случайный патент: Смесь производных фурфураля и 5-алкоксиметилфурфураля из сахаров и спиртов












