5-замещенные-3-(1,2,3,6-тетрагидропиридин-4-ил)- и 3-(пиперидин-4-ил)-1н-индолы и их фармацевтически приемлемые соли и сольваты, фармацевтическая композиция на их основе, способ активации рецепторов 5-нт1 и способ ингибирования нейронной белковой транссудации.
Номер патента: 1113
Опубликовано: 30.10.2000
Авторы: Дрессман Брюс Энтони, Томпсон Деннис Чарльз, Дрост Джеймс Джозеф, Кох Дэниел Джеймс, Одиа Джеймс Эдмунд, Рокко Винсент Патрик, Шос Джон Мехнет, Фриц Джеймс Эрвин, Кэлдор Стефен Уоррен, Ниссен Джеффри Скотт
Формула / Реферат
1. 5-Замещенные -3-(1,2,3,6-тетрагидропиридин-4-ил)-3-(пиперидин-4-ил)индолы общей формулы I
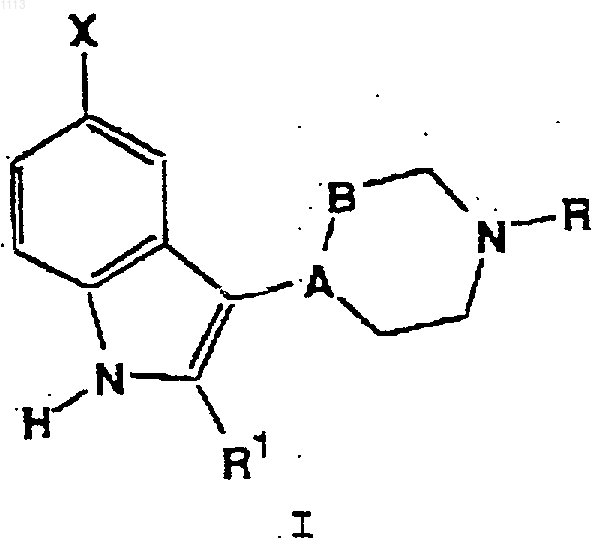
в которой А-В представляет -CH-CH2- или -С=СН-;
R представляет Н или C1-C6-алкил;
R1 представляет Н или С1-С4-алкил;
Х представляет -C(О)NR4R15, -NR5R6, -NR7SO2R8, -NHC(Q)NR10R11, -NHC(O)OR12 или NR13C(O)R14;
где Q представляет О или S;
R4 представляет гетероарил, замещенный гетероарил, гетероарил(C1-C4 алкил) или замещенный гетероарил(C1-C4 алкил);
R4 и R15, взятые вместе с атомом азота, образуют пирролидиновое, пиперидиновое; замещенное гидрокси, гидроксиметилом или N,N-ди(C1-C4 алкил)карбоксамидогруппой пиперидиновое; пиперазиновое; замещенное C1-C6 алкилом, C1-C4 алкокси, замещенной C1-C6 алкилом, фенилом, фенил(C1-C4 алкенилом), гетероарилом или гетероарил(C1-C4 алкенилом) в положении 4 пиперазиновое, морфолиновое или тиоморфолиновое кольцо;
R5 и R6 оба представляют трифторметансульфонил;
R7 представляет Н или C1-C4 алкил;
R8 представляет фенил, замещенный одним заместителем, выбранным из группы, состоящей из галогена, C1-C4 алкила, C1-C8 алкокси, C1-C4 алкилтио, нитро, циано, ди(C1-C4 алкил)амино, трифторметила, трифторметокси, фенила, C1-C4 ацила, бензоила или (C1-C4-алкил)сульфонила, или двумя или тремя заместителями, независимо выбранными из галогена, нитро, C1-C4 алкила или C1-C4 алкоксифенил или ди(C1-C4 алкил)амино;
R10 и R11 независимо выбраны из группы, состоящей из C1-C6 алкила, С3-С6 алкенила; С3-C8 циклоалкила; фенила, замещенного галогеном, C1-C4 алкилом, C1-C8 алкокси, C1-C4 алкилтио, нитро, циано, ди(C1-C4 алкил)амино, трифторметилом, трифторметокси, фенилом, C1-C4 ацилом, бензоилом или (C1-C4 алкил)сульфонилом или двумя или тремя заместителями, независимо выбранными из галогена, нитро, C1-C4 алкила или C1-C4 алкоксифенила; фенил(C1-C4 алкилена); фенил(C1-C4 алкилена), замещенного в фенильном кольце; ((C1-C4 алкил или C1-C4 алкоксикарбонилзамещенного)C1-C4-алкил)фенила; C1-C4 алкила, a-замещенного C1-C4 алкоксикарбонилом; или
R10 и R11, взятые вместе с атомом азота, образуют пирролидиновое, пиперидиновое, пиперазиновое, замещенное C1-С6 алкилом, C1-C4 алкокси, замещенной C1-C6 алкилом, фенилом, фенил(C1-C4 алкиленом), гетероарилом или гетероарил(C1-C4 алкиленом) в положении 4 пиперазиновое, морфолиновое или тиоморфолиновое кольцо;
R12 представляет C1-C6 алкил, С3-С6 алкенил, фенил, замещенный галогеном, C1-C4 алкилом, C1-C8 алкокси, C1-C4 алкилтио, нитро, циано, ди(C1-C4 алкил)амино, трифторметилом, трифторметокси, фенилом, C1-C4 ацилом, бензоилом или (C1-C4 алкил)сульфонилом, или двумя или тремя заместителями, независимо выбранными из галогена, нитро, C1-C4 алкила или C1-С4 алкоксифенилa; С3-С8 циклоалкил; C1-C4 алкил, w-замещенный C1-C4 алкоксигруппой;
R13 представляет Н или C1-C4 алкил;
R14 представляет C1-C10 алкил, замещенный заместителями в количестве вплоть до трех, выбранными из группы, состоящей из гидрокси, C1-C4 алкокси, галогена, арилокси, C1-C4 алкоксикарбонила и гетероарилокси; С2-С10 алкенил; С2-С10 алкинил; С3-C8 циклоалкил; фенил; замещенный галогеном, C1-C4 алкилом, C1-C8 алкокси, C1-C4 алкилтио, нитро, циано, ди(C1-C4 алкил)амино, трифторметилом, трифторметокси, фенилом, C1-C4 ацилом, бензоилом или (C1-C4 алкил)сульфонилом, или двумя или тремя заместителями, независимо выбранными из галогена, нитро, C1-C4 алкила или C1-C4 алкокси фенилa; нафтил; фенил(C1-C4 алкилен); фенил(C1-C4 алкилен), замещенный в фенильном кольце; 2-фенилэтилен-1-ил; дифенилметил; бензосконденсированный C4-C8 циклоалкил; C1-C4 алкилен, w-замещенный С3-С6 циклоалкилом, или гетероцикл;
R15 представляет Н или C1-C6 алкил; и их фармацевтически приемлемые соли c кислотами и сольваты.
2. Соединение по п.1, в котором А-В представляет -С=СН-.
3. Соединение по п.1, в котором А-В представляет -СН-СН2-.
4. Соединение по п.1, в котором R1 представляет Н.
5. Соединение по п.1, в котором Х представляет -NR13C(О)R14.
6. Соединение по п.5, которое представляет собой 5-(4-фторбензоил)амино-3-(1-метилпиперидин-4-ил)-1H-индол или его фармацевтически приемлемую соль с кислотой или сольват.
7. Соединение по п.6, которое представляет собой 5-(4-фторбензоил)амино-3-(1-метилпиперидин-4-ил)-1H-индолгидрохлорид.
8. Фармацевтическая композиция, содержащая активный ингредиент в сочетании с фармацевтически приемлемым носителем, разбавителем или наполнителем, отличающаяся тем, что в качестве активного ингредиента содержит эффективное количество соединения формулы I по п.1.
9. Фармацевтическая композиция по п.8, отличающаяся тем, что содержит соединение формулы I, где А-В представляет -С=СН-.
10. Фармацевтическая композиция по п.8, отличающаяся тем, что содержит соединение формулы I, в которой А-В представляет -СН-СН2.
11. Фармацевтическая композиция по п.8, отличающаяся тем, что содержит соединение формулы I, в которой R представляет Н.
12. Фармацевтическая композиция по п.8, отличающаяся тем, что содержит соединение формулы I, в которой Х представляет -NR13C(О)R14.
13. Фармацевтическая композиция по п.12, отличающаяся тем, что она содержит соединение, представляющее собой 5-(4-фторбензоил) амино-3-(1-метилпиперидин-4-ил)-1H-индол или его фармацевтически приемлемую кислотно-аддитивную соль или сольват.
14. Фармацевтическая композиция по п.13, отличающаяся тем, что она содержит соединение, представляющее собой 5-(4-фторбензоил) амино-3-(1-метилпиперидин-4-ил)-1H-индол-гидрохлорид.
15. Способ активации серотониновых рецепторов 5-HT1F у млекопитающих, отличающийся тем, что млекопитающему, нуждающемуся в такой активации, вводят эффективное количество соединения по п.1.
16. Способ по п.15, отличающийся тем, что млекопитающим является человек.
17. Споёюс ингибирования нейронной белковой транссудации, отличающийся тем, что вводят нуждающемуся в этом млекопитающему эффективное количество соединения по п.1.
18. Способ по п.17, отличающийся тем, что млекопитающим является человек.
19. Способ по п.15 лечения и/или предупреждения мигрени, отличающийся тем, что вводят млекопитающему, нуждающемуся в таком лечении, эффективное количество соединения по п.1.
20. Способ по п.19, отличающийся тем, что млекопитающим является человек.
Текст
1 С 1938 г. доминировали теории патофизиологии мигрени, разработанные Graham and(1938. Они предполагали, что причиной мигрени было расширение (вазодилатация) внечерепных сосудов. Этот взгляд подтверждался тем, что алкалоиды спорыньи и суматриптан,гидрофильный агонист серотонинового рецептора 5-HT1, который не преодолевает гематоэнцефалический барьер, сокращают гладкую мышцу головного кровеносного сосуда и эффективны в лечении мигрени. (Humphrey et al.,Ann.NY Acad.Sci., 600, 587-600 (1990. Недавняя работа Московица (Moskowitz) показала,что появление мигренозных головных болей не зависит от изменений диаметра кровеносных сосудов. (Cephalalgia 12, 5-7 (1992. Московиц предположил, что неизвестные в настоящее время пусковые механизмы боли стимулируют ганглии тройничного нерва, которые иннервируют кровеносную сеть в головной ткани, вызывая высвобождение вазоактивных нейропептидов из аксонов кровеносной сети. Эти высвобожденные нейропептиды активируют затем серию событий, следствием которых является боль. Суматриптан и алкалоиды спорыньи блокируют это нейрогенное воспаление посредством механизмов, включающих в себя рецепторы 5-НТ (по-видимому, близко родственные подтипу 5-НТ 1D), расположенные на тригеминоваскулярных волокнах (Neurology, 43,(прилож.3), S16-S20 (1993. Серотонин (5-НТ) проявляет разнообразную активность через посредство, по крайней мере, семи классов рецепторов, наиболее гетерогенным из которых, видимо, является 5-НT1. Человеческий ген, который выражает один из подтипов этих 5-HT1 рецепторов, а именно 5HT1F, был выделен Као (Као) с сотрудниками(Proc. Natl. Acad. Sci. USA, 90, 408-412 (1993. Этот рецептор 5-HT1F имеет фармакологическую характеристику, отличную от любого, уже описанного серотонергического рецептора. Высокий аффинитет суматриптана к этому подтипу(К = 23 нМ) говорит о роли рецептора 5-HT1F в мигрени. Настоящее изобретение дает новые агонисты рецептора 5-HT1F, которые ингибируют транссудацию пептидов вследствие стимуляции ганглий тройничного нерва и, следовательно,полезны для лечения мигрени и связанных с ней расстройств. В соответствии с настоящим изобретение предлагаются новые 5-замещенные-3-(1,2,3,6 тетрагидропиридин-4-ил)-1 Н-индолы и 5 замещенные-3-(пиперидин-4-ил)-1 Н-индолы формулы I:R4 представляет гетероарил, замещенный гетероарил, гетероарил-(С 1-С 4-алкил) или замещенный гетероарил (С 1-С 4-алкил);R4 и R15, взятые вместе с атомом азота, образуют пирролидиновое, пиперидиновое, замещенное пиперидиновое, пиперазиновое, 4 замещенное пиперазиновое, морфолиновое или триморфолиновое кольцо;R8 представляет C1-C4-алкил, фенил, замещенный фенил или ди-(C1-C4-алкил)амино;R10 и R11 независимо выбраны из группы,состоящей из C1-C6-алкила, C3-C6-алкенила, С 3 С 8-циклоалкила, фенила, замещенного фенила,фенил(C1-C4-алкилена), фенил(C1-C4-алкилена),замещенного в фенильном кольце, C1-C4 алкил- или C1-C4-алкоксикарбонилзамещенного)R15 представляет Н или C1-C6-алкил; при условии, что когда R7 представляет Н,8 то R не является C1-C4-алкилом; и их фармацевтически приемлемые кислотно-аддитивные соли и сольваты. В соответствии с настоящим изобретением предлагается также фармацевтическая композиция, которая содержит соединение формулы I в сочетании с фармацевтически приемлемым носителем, разбавителем или наполнителем. Еще одним видом осуществления настоящего изобретения является способ активации рецептора 5-HT1F для лечения самых разнообразных расстройств, связанных с уменьшением нейротрансмиссии серотонина у млекопитающих. К этим расстройствам относятся депрессия, мигренозная боль, булимия, предменструальный синдром или синдром поздней лютеиновой фазы, алкоголизм, злоупотребление табаком, паническое расстройство, страх, обычная боль, посттравматический синдром, потеря(снижение) памяти, возрастное слабоумие, социальная фобия, гиперфункциональное расстройство с дефицитом внимания, деструктивные поведенческие расстройства, расстройства импульсивного контроля, пограничное личностное расстройство, обсессивно-компульсивное расстройство (навязчивое состояние), синдром хронической усталости, преждевременное семяизвержение, затруднение с эрекцией, нервнопсихическая анорексия, расстройства сна, аутизм, мутизм, трихотилломания, невралгия тройничного нерва, зубная боль или боль от дисфункции височно-нижнечелюстного сустава. Соединения по настоящему изобретению полезны также для профилактического лечения мигрени. В любом из этих способов используют соединение формулы I. Применение соединения формулы I для активации рецептора 5-HT1F, для ингибирования транссудации пептидов вообще или вследствие стимуляции ганглий тройничного нерва в частности и для лечения любого из описанных выше расстройств - все это виды осуществления настоящего изобретения. Общие химические термины, использованные в приведенных выше формулах, имеют обычные значения. Например, термины "алкил,алкокси и алкилтио" включают такие группы,как метил, этил, н-пропил, изопропил, н-бутил,изобутил, втор-бутил, трет-бутил, пентил, 2 пентил, 3-пентил, нео-пентил, гексил, гептил,октил и тому подобное. Термин "алкенил" включает винил, аллил, 1-бутен-4-ил, 2-бутен-4 ил, 1-пентен-5-ил, 2-пентен-5-ил, 3-пентен-5-ил, 001113"(C1-C4 алкил)сульфонил" включает метансульфонил,этансульфонил, пропансульфонил, изопропансульфонил, бутансульфонил и тому подобное. Термин "галоген" включает фтор, хлор, бром и иод. Принято, что термин "замещенный фенил" или "фенил(C1-C4-алкилен), замещенный в фенильном кольце" означает, что фенильная часть может быть замещена одним заместителем, выбранным из группы, состоящей из галогена, C1C4-алкила, C1-C8-алкокси, C1-C4-алкилтио, нитро, циано, ди-(C1-C4-алкил)амино, трифторметила, трифторометокси, фенила, C1-C4-ацила,бензоила или (C1-C4-алкил)сульфонила, или двумя-тремя заместителями, независимо выбранными из группы, состоящей из галогена,нитро, C1-С 4-алкила или C1-C4-алкокси. Принято, что термин "гетероцикл" означает устойчивые ароматические и неароматические 5- и 6-членные кольца, содержащие от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, причем указанные кольца необязательно сконденсированы с бензольным кольцом. Все указанные кольца могут иметь до трех заместителей, независимо выбранных из группы, состоящей из галогена,C1-C4-алкокси, C1-C4-алкила, циано, нитро, гидрокси, -S(O)n-(C1-C4-аклкила) и -S(O)n-фенила,где n составляет 0, 1 или 2. Неароматические кольца включают, например, пирролидинил,пиперидинил, пиперазинил, тетрагидрофурил,оксазолидинил, диоксанил, пиранил и тому подобное. Неароматические кольца, сконденсированные с бензольным кольцом, включают индолинил, 1,2,3,4-тетрагидрохинолинил, 1,2,3,4 тетрагидроизохинолинил и тому подобное. Ароматические кольца включают фурил, тиенил, пиридинил, пирролил, N-метилпирролил,оксазолил, изоксазолил, пиразолил, имидазолил,триазолил, оксадиазолил, тиадиазолил, тиазолил, пиримидинил, пиразинил, пиридазинил и тому подобное. Ароматические кольца, сконденсированные с бензольным кольцом, включают изохинолинил, бензоксазолил, бензтиазолил, хинолинил, бензофуранил, тионафтил, индолил и тому подобное. Принято, что термин "гетероарил" означает ароматический или сконденсированный с бензольным кольцом ароматический гетеро 5 цикл, как определенный в предшествующем абзаце. Принято, что термин "замещенный гетероарил" означает ароматический или сконденсированный с бензольным кольцом ароматический гетероцикл, как определенный в предшествующем абзаце, который имеет до трех заместителей, независимо выбранных из группы, состоящей из галогена, C1-C4-алкокси, C1-C4 алкила, циано, нитро, гидрокси, -S(O)n-(C1-C4 алкила) и -S(O)n-фенила, где n составляет 0, 1 или 2. Термин "гетероарил(C1-C4-алкил)" означает разветвленную или неразветвленную алкильную цепь с 1-4 углеродными атомами, замещенную в каком-нибудь месте ароматическим или сконденсированным с бензольным кольцом ароматическим гетероциклическим фрагментом. Термин "замещенный гетероарил(C1-C4-алкил)" означает разветвленную или неразветвленную алкильную цепь с 1-4 углеродными атомами, замещенную в каком-нибудь месте ароматическим или сконденсированным с бензольным кольцом ароматическим гетероциклическим фрагментом, который имеет до трех заместителей, независимо выбранных из группы, состоящей из галогена, C1-C4-алкокси, C1C4-алкила, циано, нитро, гидрокси, -S(O)n-(C1C4-алкила) и -S(O)n-фенила, где n составляет 0, 1 или 2. Термин "гетероарилокси" означает такую,как определенная в предшествующем абзаце,гетероарильную или замещенную гетероарильную группу, связанную с атомом кислорода. Термин "арилокси" означает фенильную или замещенную фенильную группу, связанную с атомом кислорода. Термин "4-замещенный пиперазин" означает пиперазиновое кольцо, замещенное в положении 4 заместителем, выбранным из группы,состоящей из C1-C6-алкила, C1-C4-алкоксизамещенного C1-C6-алкила, фенила, замещенного фенила, фенил(C1-C4-алкилена), фенил(C1-C4 алкилена), замещенного в фенильном кольце,гетероарила и гетероарил(C1-C4-алкилена). Принято, что термин "замещенный пиперидин" означает пиперидиновое кольцо, необязательно замещенное заместителем, выбранным из группы, состоящей из гидрокси, гидроксиметила и N,N-ди(C1-C4-алкил)карбоксамидо. Термин "С 4-С 8-циклоалкил, сконденсированный с бензольным кольцом" означает С 4-С 8 циклоалкильную группу, сконденсированную с фенильным кольцом. Примеры этих групп включают бензоциклобутил, инданил, 1,2,3,4 тетрагидронафтил и тому подобное. Хотя полезны в качестве агонистов 5-HT1F все соединения по настоящему изобретению, но некоторые классы являются предпочтительными. В следующих абзацах описаны такие предпочтительные классы.bd) R4 представляет гетероарил или замещенный гетероарил;ex) R4 и R15, взятые вместе в азотом, образуют замещенное пиперидиновое кольцо; еу) R4 и R15, взятые вместе в азотом, образуют пиперазиновое кольцо;fc) соединение представляет свободное основание;fe) соединение представляет соль гидрохлорид;ff) соединение представляет соль фумарат;fg) соединение представляет соль оксалат. Следует понимать, что все указанные выше классы можно объединять для образования дополнительных предпочтительных классов. Соединения по настоящему изобретению полезны в способе активации рецептора 5-HT1F для лечения самых разнообразных расстройств,связанных с пониженной нейротрансмиссией серотонина у млекопитающих. Является предпочтительным, чтобы млекопитающим, которое должно быть подвержено лечению путем введе 9 ния соединения по настоящему изобретению,был человек. Поскольку соединения по настоящему соединению являются аминами, то они основны по своей природе и, следовательно, взаимодействуют с любой из многих неорганических и органических кислот с образованием фармацевтически приемлемых кислотно-аддитивных солей. Так как некоторые свободные амины из числа соединений по настоящему изобретению обычно являются маслами при комнатной температуре, то является предпочтительным преобразовывать свободные амины в их фармацевтически приемлемые кислотно-аддитивные соли,чтобы облегчить обращение с ними и их введение, поскольку соли при комнатной температуре обычно являются твердыми веществами. Кислотами, обычно используемыми для образования таких солей, являются неорганические кислоты,такие как хлороводородная кислота, бромоводородная кислота, иодоводородная кислота,серная кислота, фосфорная кислота и тому подобное, и органические кислоты, такие как птолуолсульфоновая кислота, метансульфоновая кислота, щавелевая кислота, п-бромфенилсульфоновая кислота, угольная кислота, янтарная кислота, лимонная кислота, бензойная кислота,уксусная кислота и тому подобное. Примерами таких фармацевтически приемлемых солей являются, таким образом, сульфат, пиросульфат,бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, иодид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат,изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, себацат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6 диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат,лактат, b-гидроксибутират, гликоллат, тартрат,метансульфонат, пропансульфонат, нафталин-1 сульфонат, нафталин-2-сульфонат, манделат и тому подобное. Предпочтительными фармацевтически приемлемыми солями являются соли,образованные с хлороводородной, щавелевой или фумаровой кислотой. Следующая группа иллюстрирует соединения, входящие в объем настоящего изобретения: 5-(4-фторфенил)тио-3-(1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индол,5-(3-хлорфенил)тио-3-(1-(пент-2-ил)-1,2,3,6-тетрагидропиридин-4-ил)-2-метил-1 Н-индол,5-(2-бромфенил)тио-3-(1-пентил-1,2,3,6 тетрагидропиридин-4-ил)-1 Н-индол,5-(2-иодфенил)тио-3-(1-изобутил-1,2,3,6 тетрагидропиридин-4-ил)-1 Н-индол,5-(3-метоксифенил)тио-3-(-1-(втор-бутил)1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индол, 001113 32 5-(3-тиеноил)амино-3-(1-изопропилпиперидин-4-ил)-1 Н-индол,5-(3-тиеноил)амино-3-(1-бутилпиперидин 4-ил)-1 Н-индол,5-(3-тиеноил)амино-3-(1-изобутилпиперидин-4-ил)-1 Н-индол,5-(3-тиеноил)амино-3-(1-(втор-бутил)пиперидин-4-ил)-1 Н-индол,5-(3-тиеноил)амино-3-(1-(трет-бутил)пиперидин-4-ил)-1 Н-индол,5-(3-тиеноил)амино-3-(1-пентилпиперидин-4-ил)-1 Н-индол,5-(3-тиеноил)амино-3-(1-(2-пентил)пиперидин-4-ил)-1 Н-индол,5-(3-тиеноил)амино-3-(1-(3-пентил)пиперидин-4-ил)-1 Н-индол,5-(3-тиеноил)амино-3-(1-неопентилпиперидин-4-ил)-1 Н-индол,5-(3-тиеноил)амино-3-(1-гексилпиперидин 4-ил)-1 Н-индол,5-(2-фуроил)амино-3-(1-этилпиперидин-4 ил)-1 Н-индол,5-(2-фуроил)амино-3-(1-пропилпиперидин 4-ил)-1 Н-индол,5-(2-фуроил)амино-3-(1-изопропилпиперидин-4-ил)-1 Н-индол,5-(2-фуроил)амино-3-(1-бутилпиперидин 4-ил)-1 Н-индол,5-(2-фуроил)амино-3-(1-изобутилпиперидин-4-ил)-1 Н-индол,5-(2-фуроил)амино-3-(1-(втор-бутил)пиперидин-4-ил)-1 Н-индол,5-(2-фуроил)амино-3-(1-(трет-бутил)пиперидин-4-ил)-1 Н-индол,5-(2-фуроил)амино-3-(1-пентилпиперидин 4-ил)-1 Н-индол,5-(2-фуроил)амино-3-(1-(2-пентил)пиперидин-4-ил)-1 Н-индол,5-(2-фуроил)амино-3-(1-(3-пентил)пиперидин-4-ил)-1 Н-индол,5-(2-фуроил)амино-3-(1-неопентилпиперидин-4-ил)-1 Н-индол,5-(2-фуроил)амино-3-(1-гексилпиперидин 4-ил)-1 Н-индол,5-(3-фуроил)амино-3-(1-этилпиперидин-4 ил)-1 Н-индол,5-(3-фуроил)амино-3-(1-пропилпиперидин 4-ил)-1 Н-индол,5-(3-фуроил)амино-3-(1-изопропилпиперидин-4-ил)-1 Н-индол,5-(3-фуроил)амино-3-(1-бутилпиперидин 4-ил)-1 Н-индол,5-(3-фуроил)амино-3-(1-изобутилпиперидин-4-ил)-1 Н-индол,5-(3-фуроил)амино-3-(1-(втор-бутил)пиперидин-4-ил)-1 Н-индол,5-(3-фуроил)амино-3-(1-(трет-бутил )пиперидин-4-ил)-1 Н-индол,5-(3-фуроил)амино-3-(1-пентилпиперидин 4-ил)-1 Н-индол,5-(3-фуроил)амино-3-(1-(2-пентил)пиперидин-4-ил)-1 Н-индол, 33 5-(3-фуроил)амино-3-(1-(3-пентил)пиперидин-4-ил)-1 Н-индол,5-(3-фуроил)амино-3-(1-неопентилпиперидин-4-ил)-1 Н-индол,5-(3-фуроил)амино-3-(1-гексилпиперидин 4-ил)-1 Н-индол,N-[пиридин-2-ил]-5-карбоксамидо-3-(1 метил-1,2,5,6-тетрагидропиридин-4-ил)-1 Ниндол,N-[фур-3-ил]-5-карбоксамидо-3-(1-метил 1,2,5,6-тетрагидропиридин-4-ил)-1 Н-индол,N-[пиразол-3-ил]-5-карбоксамидо-3-(1 метил-1,2,5,6-тетрагидропиридин-4-ил)-1 Ниндол,N-[тиазол-2-ил]-5-карбоксамидо-3-(1 метил-1,2,5,6-тетрагидропиридин-4-ил)-1 Ниндол,N-[хинолин-4-ил]-5-карбоксамидо-3-(1 метил-1,2,5,6-тетрагидропиридин-4-ил)-1 Ниндол,N-[имидиазол-4-ил]-5-карбоксамидо-3-(1 метилпиперидин-4-ил)-1 Н-индол,N-[фур-3-ил]-5-карбоксамидо-3-(1-метил 1,2,5,6-тетрагидропиридин-4-ил)-1 Н-индол,N-[пиримидин-5-ил]-5-карбоксамидо-3-(1 метилпиперидин-4-ил)-1 Н-индол,N-[индол-2-ил]-5-карбоксамидо-3-(1 метилпиперидин-4-ил)-1 Н-индол,N-[изоксазол-5-ил]-5-карбоксамидо-3-(1 метилпиперидин-4-ил)-1 Н-индол. Соединения по настоящему изобретению получают способами, хорошо известными специалистам в данной области техники, такими,как в общем описанные в патенте США 4443451, который включен в данное описание путем ссылки. Хотя простые индолы, необходимые для получения соединений по настоящему изобретению, в сущности коммерчески доступны, их получение описано у Robinson, Theand Procedures International, 17. 391 (1985). Соединения по настоящему изобретению,где Х представляет -NR7SO2R8, можно получить путем первоначального модифицирования соответствующего 5-аминоиндола. Когда R7 представляет водород, 5-аминоиндол подвергают взаимодействию с подходящим сульфонилгалогенидом или -ангидридом для получения соответствующего сульфонамида. Но когда R7 представляет низший алкил, 5-аминоиндол сначала ацилируют и затем восстанавливают подходящим гидридным восстановителем. В соответствии с другим вариантом 5-аминоиндол может быть подвергнут гидроалкилированию подходящим альдегидом или кетоном в присутствии подходящего гидридного восстановителя с получением соответственно замещенного индола. Эти замещенные индолы затем подвергают взаимодействию с сульфонилгалогенидом или ангидридом с получением соответствующего 34 сульфонамида. Эти химические процессы показаны на схеме I синтеза, где М представляет метокси, этокси, метил, этил, пропил или изопропил, LG представляет хлор или бром и R1, R7 и R8 - такие, как определенные выше. Схема I синтеза Когда R7 должен быть водородом, раствор 5-аминоиндола в подходящем растворителе,таком как тетрагидрофуран, диоксан, диэтиловый эфир или диметилформамид, при температуре от примерно температуры окружающей среды до примерно 0 С подвергают взаимодействию с коммерчески доступным R8-сульфонилгалогенидом или R8-сульфоновым ангидридом в присутствии подходящего основания, такого как пиридин или триэтиламин. Полученный сульфонамид может быть выделен путем разбавления реакционной смеси водой, регулирования рН и экстрагирования несмешивающимся с водой растворителем, таким как дихлорметан. Продукт можно использовать для дальнейшего взаимодействия, как он извлечен, или очищенным путем хроматографии или путем перекристаллизации из подходящего растворителя. Когда R7 должен быть низшим алкилом,раствор 5-аминоиндола в подходящем растворителе, таком как тетрагидрофуран, диоксан или диэтиловый эфир, при температуре от примерно температуры окружающей среды до примерно 0 С подвергают взаимодействию с соединением структуры М-С(O)-галоген в присутствии подходящего основания, такого как пиридин или триэтиламин. Полученное соединение выделяют путем разбавления реакционной смеси водой и экстрагирования несмешивающимся с водой растворителем, таким как дихлорметан. Этот ацилированный продукт может быть либо очищен путем хроматографии, либо непосредст 35 венно использован на последующей стадии. Ацилированный продукт затем растворяют в подходящем растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре от примерно температуры окружающей среды до примерно 0 С и обрабатывают подходящим гидридным восстановителем, таким как диборан или литийалюминийгидрид. Реакционную смесь перемешивают в течение 1-24 ч и затем обрабатывают водным раствором сульфата натрия. Полученную суспензию фильтруют и фильтрат концентрируют при пониженном давлении. Продукт можно использовать для дальнейшей реакции как он есть, очищенным путем хроматографии или перекристаллизованным из подходящего растворителя. В соответствии с другим вариантом раствор 5-аминоиндола в растворителе, подходящем для азеотропного удаления воды, таком как толуол, бензол или циклогексан, подвергают взаимодействию при нагревании с обратным холодильником с подходящим альдегидом или кетоном, таким как формальдегид, ацетальдегид, пропаналь, бутаналь или ацетон, в присутствии 0,1-10%-ного источника протонов, такого как п-толуолсульфоновая кислота. По завершении реакции удаляют при пониженном давлении летучие вещества и остаток вновь растворяют в алканоле, таком как метанол или этанол. Затем этот раствор подвергают воздействию условий гидрирования или обрабатывают подходящим гидридным восстановителем, таким как борогидрид натрия или, предпочтительно,цианборогидрид натрия, в присутствии безводной кислоты, такой как хлороводород. Реакционную смесь затем разбавляют водой, обрабатывают основанием и экстрагируют несмешивающимся с водой растворителем, таким как дихлорметан. Продукт можно использовать для дальнейшей реакции как он есть, очищенным путем хроматографии или перекристаллизованным из подходящего растворителя. Этот продукт далее обрабатывают коммерчески доступнымR8 сульфоновым ангидридом так, как описано выше, с получением целевых сульфонамидов. Соединения по настоящему изобретению,где Х представляет -S-R2, -C(O)R3 или-C(O)NR4R15, получают путем первоначального преобразования 5-броминдола в 5-бром-3(1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индол или 5-бром-3-(1-пиперидин-4-ил)-1 Н-индол. Соединения по настоящему изобретению, где Х представляет-NHC(O)OR или -NR C(O)R , получают путем первоначального преобразования 5-нитроили 5-аминоиндола в 5-нитро- или 5-амино-3(1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индол или в соответствующий 5-нитро- или 5-амино-(1 пиперидин-4-ил)-1 Н-индол. Соединения по настоящему изобретению, где Х представляет-NR7SO2R8 или -NR13C(O)R14, могут быть полу 001113 36 чены путем преобразования подходящим образом замещенного индола в соответствии 3(1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индол или 3-(1-пиперидин-4-ил)-1 Н-индол. Эти химические процессы показаны на схеме II синтеза, где 5-Замещенный индол конденсируют с 4 пиперидоном в присутствии подходящего основания с получением соответствующего 5 замещеннного-3-(1,2,3,6-тетрагидропиридин-4 ил)-1 Н-индола. Реакцию осуществляют путем первоначального растворения избыточного количества основания, обычно гидроксида натрия или калия, в низшем алканоле, обычно метаноле или этаноле. Затем добавляют индол и два эквивалента 4-пиперидона и реакционную смесь нагревают с обратным холодильником в течение 8-72 ч. Полученные 5-замещенные-3-(1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индолы могут быть выделены из реакционной смеси путем добавления воды. Соединения, выпавшие в осадок,можно извлекать непосредственно путем фильтрования, а другие можно экстрагировать путем регулирования рН раствора и экстрагирования несмешивающимся с водой растворителем, таким как этилацетат или дихлорметан. Извлеченные соединения можно использовать непосредственно на последующих стадиях или сначала очистив путем хроматографии на силикагеле или перекристаллизации из подходящего растворителя. 5-Замещенные-3-(1-замещенные-1,2,3,6 тетрагидропиридин-4-ил)-1 Н-индолы можно использовать для получения других соединений по настоящему изобретению или, если требуется, гидрировать над катализатором на основе благородного металла, таким как палладий на угле, с получением соответствующих 5 замещенных-3-(пиперидин-4-ил)-1 Н-индолов. Когда Y представляет бром, используют такой 37 катализатор гидрирования, как сульфидированная платина на угле, оксид платины или смешанная каталитическая система, состоящая из сульфидированной платины на угле и оксида платины, чтобы предотвратить гидрогенолиз 5 бром-заместителя во время восстановления тетрагидропиридильной двойной связи. Растворитель для гидрирования может состоять из низшего алканола, такого как метанол или этанол,тетрагидрофурана или смешанной растворительной системы из тетрагидрофурана и этилацетата. Гидрирование можно осуществлять при начальном давлении водорода 20-80 фунтов на кв.дюйм (1,4-5,6 кг/см 2), предпочтительно 50-60 фунтов на кв.дюйм (3,5-4,2 кг/см 2), при 0-60 С,предпочтительно при температуре от температуры окружающей среды до 40 С, в течение времени от 1 ч до 3 дней. В зависимости от конкретного субстрата для доведения реакции до завершения могут потребоваться дополнительные порции водорода. Полученные описанным образом 5-замещенные-3-(пиперидин-4-ил)-1 Ниндолы выделяют путем удаления катализатора фильтрованием с последующей концентрацией растворителя реакционной смеси при пониженном давлении. Извлеченный продукт можно использовать непосредственно на последующих стадиях или дополнительно очищенным путем хроматографии или путем перекристаллизации из подходящего растворителя. В качестве альтернативы гидрированию 5 замещенные-3-(1,2,3,6-тетрагидро-4-пиридинил)-1 Н-индолы можно преобразовать при желании в соответствующие 5-замещенные-3(пиперидин-4-ил)-1 Н-индолы путем обработки трифторуксусной кислотой и триэтилсиланом,5-замещенный-3-(1-замещенный-1,2,3,6-тетрагидро-4-пиридинил)-1 Н-индол растворяют в трифторуксусной кислоте, к которой добавляют избыточное количество (1,1-10,0 эквивалентов) триэтилсилана. Реакционную смесь перемешивают примерно при температуре окружающей среды в течение от примерно 1 до примерно 48 ч, после чего реакционную смесь концентрируют при пониженном давлении. Затем остаток обрабатывают 2 Н гидроксидом натрия или калия и смесь экстрагируют несмешивающимся с водой растворителем, таким как дихлорметан или диэтиловый эфир. Полученный 5-замещенный-3-(пиперидин-4-ил)-1 Н-индол при необходимости очищают путем колоночной хроматографии. Для специалиста в данной области техники понятно, что 5-нитро-заместитель может быть восстановлен до или после конденсации подходящим 4-пиперидоном. Кроме того, при необходимости нитрогруппу и 1,2,3,6-тетрагидропиридинильную двойную связь можно гидрировать одновременно. Соединения по настоящему изобретению,где Х представляет -S-R2, получают из соответствующих 5-бром-3-(1,2,3,6-тетрагидропири 001113 38 дин-4-ил)-1H-индолов или 5-бром-3-(пиперидин-4-ил)-1 Н-индолов так, как показано на схеме III синтеза, где А, В, R1 и R2 - такие, как определенные выше, и R представляет С 1-С 4 алкил. Схема III синтеза 5-Бром-3-(1,2,3,6-тетрагидропиридин-4 ил)-1 Н-индолы или 5-бром-3-(пиперидин-4-ил)1 Н-индолы в подходящемапротонном растворителе, таком как диэтиловый эфир или тетрагидрофуран, охлаждают до примерно 0 С и обрабатывают гидридом калия, чтобы депротонировать индольное ядро в положении 1. Для этого депротонирования пригодны и другие гидриды, но полученная соль калия более растворима в типичных растворителях для этой реакции. Затем реакционную смесь охлаждают до примерно -78 С и осуществляют металлогалогенный обмен путем добавления двух эквивалентов трет-бутиллития. К этому дианионному раствору добавляют затем подходящий дисульфид и дают реакционной смеси согреться до температуры окружающей среды. Соединение по настоящему изобретению выделяют путем обработки реакционной смеси водным основанием,таким как гидроксид натрия или калия, и затем экстрагирования несмешивающимся с водой растворителем, таким как диэтиловый эфир или дихлорметан. Затем продукт реакции очищают путем колоночной хроматографии. Соединения по настоящему изобретению,где Х представляет -C(О)R3 или C(О)NR4R15,получают из соответствующих 5-бром-3(1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индолов или 5-бром-3-(пиперидин-4-ил)-1 Н-индолов так,как показано на схеме IV синтеза, где А, В, R1,R3, R4 и R15 такие, как определенные выше, и R представляет С 1-С 4-алкил. Схема IV синтезаN-метил-N-метокси-5-карбоксамидо 1 Н-индол выделяют путем обработки реакционной смеси водным основанием, таким как гидроксид натрия или калия, и затем экстрагированием несмешивающимся с водой растворителем, таким как диэтиловый эфир или дихлорметан. Затем продукт реакции очищают путем колоночной хроматографии. Соединение по настоящему изобретению,где Х представляет -С(О)-R3, получают путем осуществления взаимодействия раствора Nметил-N-метокси-5-карбоксиамидо-3-(1,2,3,6 тетрагидропиридин-4-ил)-1 Н-индола или Nметил-N-метокси-5-карбоксамидо-3-(пиперидин-4-ил)-1 Н-индола в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран, при примерно 0 С с подходящим реагентом, таким как арил- или алкиллитий или алкиловый или ариловый реагент Гриньяра. Указанные реагенты либо коммерчески доступны, либо могут быть получены способами, хорошо известными специалисту в данной области техники. Арил- или алкиллитиевые реагенты целесообразно получать путем обработки подходящего арил- или алкилгалогенида н-бутиллитием. Ариловые или алкиловые реагенты Гриньяра могут быть получены путем обработки подходящего арил-или алкилгалогенида магнием. Представляющие интерес соединения могут быть выделены путем обработки водой с последующим экстрагированием несмешивающимся с водой растворителем, таким как диэтиловый эфир или дихлорметан, и затем очищением путем хроматографии или путем перекристаллизации из подходящего растворителя. Специалисту в данной области техники будет понятно, что соединения по настоящему изобретению, где Х представляет -C(О)R3, можно также получить путем осуществления взаимодействия дианиона 5-бром-3-(1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола или 5-бром-3(пиперидин-4-ил)-1 Н-индола с подходящим ариловым или алкиловым N-метил-N-метоксикарбоксамидом. Эти карбоксамиды получают из соответствующих карболовых кислот и Nметил-N-метоксиамина при стандартных условиях образования пептидной связи с использованием N,N'-дициклогексилкарбодиимида. Соединения по настоящему изобретению,где Х представляет -C(О)NR4R15, получают путем осуществления взаимодействия раствора Nметил-N-метокси-5-карбоксамидо-3-(1,2,3,6 тетрагидропиридин-4-ил)-1 Н-индола или Nметил-N-метокси-5-карбоксамидо-3-(пиперидин-4-ил)-1 Н-индола в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран, при примерно 0 С с анионом подходящего амина. Эти анионы получают обработкой подходящего амина н-бутиллитием. Представляющие интерес соединения могут быть выде 001113 40 лены путем обработки водой с последующим экстрагированием несмешивающимся с водой растворителем, таким как диэтиловый эфир или дихлорметан, и затем очищением путем хроматографии или путем перекристаллизации из подходящего растворителя. В соответствии с другим вариантом соединения по настоящему изобретению, где Х представляет -C(O)NR4R15, получают, подвергая подходящую индол-5-карбоновую кислоту и подходящий амин воздействию стандартных условий образования пептидной связи. Индол-5 карбоновая кислота в подходящем растворителе может быть обработана оксалилхлоридом, тионилхлоридом или фосфористым трибромидом в подходящем растворителе (например, толуоле) с получением соответствующего галогенангидрида кислоты. Галогенангидрид в подходящем растворителе (например, тетрагидрофуране или диметилформамиде) может быть обработан амином формулы: HNR4R14 в присутствии подходящего основания, такого как триэтиламин, пиридин или диметиламинопиридин,с получением целевого соединения. Продукт может быть выделен путем обработки водой с последующим экстрагированием несмешивающимся с водой растворителем, таким как диэтиловый эфир, этилацетат или дихлорметан, и затем очищением путем хроматографии или путем перекристаллизации из подходящего растворителя. В соответствии с предпочтительным вариантом соединения по настоящему изобретению,где Х представляет -C(O)NR4R15, получают путем осуществления взаимодействия подходящей индол-5-карбоновой кислоты с подходящим амином в присутствии типичных реагентов для образования пептидной связи, таких как N,N'карбонилдиимидазол(EDC). Соединения по настоящему изобретению,где Х представляет -NR5R6, -NHC(Q)NR10R11,-NHC(O)OR12 или -NR13C(O)R14, получают путем осуществления взаимодействия подходящего 5-амино-3-(1,2,3,6-тетрагидропиридин-4-ил)1 Н-индола или 5-амино-3-(пиперидин-4-ил)-1 Ниндола с подходящим электрофилом. Эти реакции показаны на схеме V синтеза, где А, В, R1,R5, R6, R10, R11, R12, R13 и R14 - такие как описанные выше, и R представляет С 1-С 4-алкил. Соединения по настоящему изобретению,где Х представляет -NR4R5, получают путем обработки раствора 5-амино-3-(1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола или 5-амино-3(пиперидин-4-ил)-1 Н-индола в подходящем растворителе, таком как дихлорметан, тетрагидрофуран, ацетонитрил или диметилформамид,подходящим электрофилом, таким как трифторметансульфоновый ангидрид или N-карбэтоксифталимид, в присутствии подходящего основания, такого как пиридин или триэтиламин. Продукт реакции выделяют путем выпаривания растворителя реакционной смеси при пониженном давлении. Продукт может быть очищен путем хроматографии или путем кристаллизации из подходящего растворителя. Соединения по настоящему изобретению,где Х представляет -NHC(Q)NR10R11, получают путем обработки раствора 5-амино-3-(1,2,3,6 тетрагидропиридин-4-ил)-1 Н-индола или 5-амино-3-(пиперидин-4-ил)-1 Н-индола в подходящем растворителе, таком как хлороформ или дихлорметан, подходящим изоцианатом, изотиоицианатом, карбамоилхлоридом или карбамоилбромидом. Подходящие карбамоилхлориды можно получить путем обработки амина формулы: HNR10R11 фосгеном. При использовании карбамоилхлорида или карбамоилбромида реакции проводят в присутствии подходящего основания. Подходящие основания включают амины, обычно используемые в качестве акцепторов кислот, такие как пиридин или триэтиламин, или коммерчески доступные полимерные основания, такие как поливинилпиридин. При необходимости используют избыточное количество изоцианата, изотиоцианата, карбамоилхлорида или карбамоилбромида, чтобы обеспечить полное реагирование исходного амина. Реакции проводят при температуре от примерно температуры окружающей среды до примерно 80 С в 42 течение времени от примерно трех часов до примерно трех дней. Обычно продукт можно выделить путем промывки реакционной смеси водой и концентрирования оставшейся органики при пониженном давлении. Но при использовании избыточного количества изоцианата, изотиоцианата, карбамоилхлорида или карбамоилбромида может оказаться целесообразным добавление полимерного первичного или вторичного амина, такого как аминометилированный полистирол, для реагирования с избыточным реагентом. Выделение продуктов реакций, в которых бы использован полимерный реагент,значительно упрощается и требует лишь фильтрования реакционной смеси и затем концентрирования фильтрата при пониженном давлении. Продукт этих реакций может быть при необходимости очищен путем хроматографии или перекристаллизации из подходящего растворителя. Специалисту в данной области техники будет понятно, что соединения по настоящему изобретению, которые являются мочевинами,могут быть преобразованы в соответствующую тиомочевину путем обработки реагентом Лоессона (Lawesson) [2,4-бис(4-метоксифенил)-1,3 дитиа-2,4-дифосфетан-2,4-дисульфид] или пентасульфидом фосфора. Соединения по настоящему изобретению,где Х представляет -NHC(О)OR12, получают путем осуществления взаимодействия 5-амино 3-(1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола или 5-амино-3-(пиперидин-4-ил)-1 Н-индола с подходящим образом замещенным хлорформиатом в присутствии подходящего амина при условиях, описанных в предшествующем абзаце. Аналогичным образом, соединения по настоящему соединению, где Х представляет-NR13C(О)R14, получают путем осуществления взаимодействия 5-амино-3-(1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола или 5-амино-3-(пиперидин-4-ил)-1 Н-индола с подходящим хлоридом, бромидом или ангидридом карбоновой кислоты, необязательно, в присутствии катализатора ацилирования, такого как диметиламинопиридин, в присутствии подходящего основания, такого как те, что описаны выше. В соответствии с другим вариантом соединения по настоящему изобретению, где Х представляет -NR13C(О)R14, получают путем осуществления взаимодействия 5-амино-3-(1,2,3,6 тетрагидропиридин-4-ил)-1 Н-индола или 5 амино-3-(пиперидин-4-ил)-1 Н-индола с подходящим галогенидом карбоновой кислоты, ангидридом карбоновой кислоты или карбоновой кислотой в присутствии обычных реагентов для образования пептидной связи, таких как N,N'карбонилдиимидазол (CDI), N,N'-дициклогексилкарбодиимид (DCC) и 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (EDC). Нанесенная на полимер форма EDC уже описана (Tetrahedron Letters, 34 (48), 7685 (1993 и очень полезна для получения соединений по 43 настоящему изобретению. Продукт этих реакций выделяют и очищают так, как описано выше. Специалисту в данной области техники будет понятно, что порядок выполнения стадий получения соединений по настоящему изобретению во многих случаях не важен. Например,соединения, где Х представляет -NR7-SO2R8,можно получить, подвергая 5-амино-3-(1,2,3,6 тетрагидропиридин-4-ил)-1 Н-индолы или 5 амино-3-(пиперидин-4-ил)-1 Н-индолы воздействию условий, показанных на схеме I. Аналогичным образом, 5-аминоиндол может быть подвергнут последовательности реакций, показанной на схеме V, до реакции с 4-пиперидоном,показанной на схеме II. Специалисту будет также понятно, что соединения, где R представляет Н, могут быть получены путем конденсирования 4-пиперидона с подходящим образом замещенным индолом с получением соответствующих 3-(1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индолов, которые при необходимости могут быть затем гидрированы. В соответствии с другим вариантом подходящим образом замещенный 4 пиперидон может быть в любой момент процесса синтеза заменен 1-бензил-4-пиперидоном. Бензильная группа может быть затем удалена при стандартных условиях гидрирования, после того, как закончатся реакции, с которыми вторичный амин был бы несовместим. Можно также 3-(1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индолы восстановить в соответствующие 3-(пиперидин-4-ил)-1 Н-индолы в любом удобном месте последовательности реакций синтеза. Указанные варианты ясно показаны в следующих далее получениях и примерах. Получение I. 5-Бром-3-(1-метилпиперидин-4-ил)-1 Н-индол. Получение 5-бром-3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола. К раствору 56,11 г (306 ммоль) гидроксида калия в 300 мл метанола добавляли 38 мл (306 ммоль) 1-метил-4-пиперидона, а затем 30,0 г(153 ммоль) 5-бром-1 Н-индола. Реакционную смесь перемешивали при нагревании с обратным холодильником в течение 18 ч. Затем реакционную смесь охлаждали до температуры окружающей среды и разбавляли 1,5 л воды. Полученное белое твердое вещество отфильтровывали, промывали последовательно водой и диэтиловым эфиром и затем высушивали в вакууме с получением 44,6 г (100%) 5-бром-3-(1 метил-1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола. Каталитическое гидрирование. К раствору 44,6 г (153 ммоль) 5-бром-3-(1 метил-1,2,3,6-тетрагидропиридин-4-ил)-1 Ниндола в 1,95 л тетрагидрофурана добавляли 9,0 г оксида платины. Реакционную смесь гидрировали при начальном давлении водорода 60 фунтов на кв.дюйм (4,2 кг/см 2) и температуре окружающей среды в течение 24 ч. Реакционную 44 смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток перекристаллизовывали из ацетонитрила, получив в результате 32,6 г (73,7%) указанного в заголовке соединения в виде белого твердого вещества. МС (m/e): 293(М+) Вычислено для C14H17N2Br: Теория: С 57,32; Н 5,96; N 9,69. Найдено: С 57,35; Н 5,84; N 9,55. Получение II. N-Метил-N-метокси-5-карбоксамидо-3-(1-метилпиперидин-4-ил)-1 Н-индол. К суспензии 0,72 г (3,58 ммоль) гидрида калия в 16,0 мл тетрагидрофурана при 0 С добавляли раствор 1,0 г (3,41 ммоль) 5-бром-3-(1 метил-пиперидин-4-ил)-1 Н-индола в 16,0 мл тетрагидрофурана и перемешивали раствор в течение примерно 30 мин. Полученную смесь охлаждали до примерно -78 С и добавляли к ней через канюлю 4,4 мл (7,5 ммоль) третбутиллития, который был предварительно охлажден до -78 С. Спустя примерно 15 мин добавляли 0,66 г (3,41 ммоль) N,N'-диметил-N,N'диметоксимочевины и давали реакционной смеси постепенно согреться до температуры окружающей среды. Затем реакционную смесь обрабатывали 5 Н гидроксидом натрия и экстрагировали диэтиловым эфиром. Эфирные экстракты объединяли, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали при пониженном давлении. Очистка путем флэш-хроматографии(элюирование смесью этилацетат:метанол:толуол = 4,5:0,5:0,2) дала 0,61 г (60%) указанного в заголовке соединения. МС (m/е): 301(M+). ИК: 1632 см-1. Вычислено для С 17 Н 23N3O2 0,25 Н 2 О: Теория: С 66,75; Н 7,74; N 13,73. Найдено: С 66,47; Н 7,72; N 13,69. Получение III. 2-Метил-2-амино-1 Н-индол. К раствору 2,0 г (11,4 ммоль) 2-метил-5 нитро-1 Н-индола в 100 мл смеси этанол:тетрагидрофуран (1:1) добавляли 0,25 г 5%-ного палладия на угле. Суспензию гидрировали при температуре окружающей среды при начальном давлении водорода 60 фунтов на кв.дюйм (4,2 кг/см 2). Через 5 ч реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении, получив в результате 1,5 г темно-коричневого твердого вещества. Твердое вещество очищали путем флэш-хроматографии(71,7%) указанного в заголовке соединения в виде светло-коричневых пластинок. Т.пл. = 154-156 С. МС (m/е): 147(М+1). Вычислено для C9H10N2: Теория: С 73,94; Н 6,89; N 19,16. Найдено: С 74,15; Н 6,93; N 19,27. Многие 5-(С 1-С 4-алкил)амино-1 Н-индолы,необходимые для получения соединений по на 45 стоящему соединению, можно получить способом, описанным в получении IV. Получение IV. 5-Метиламино-1 Н-индол. А. Получение N-этоксикарбонил-5-амино 1 Н-индол. К раствору 4,27 г (32,3 ммоль) 5-амино-1 Ниндола в 50 мл тетрагидрофурана добавляли 5,4 мл (38,8 ммоль) триэтиламина, после чего реакционную смесь охлаждали до 0 С. Затем к этому раствору добавляли по каплям 3,4 мл (35,5 ммоль) этилхлорформиата. Через 4 ч реакционную смесь разбавляли 1 Н НСl и затем экстрагировали этилацетатом. Органическую фазу промывали последовательно 1 Н НСl, водой и насыщенным водным раствором хлорида натрия. Оставшуюся органику сушили над сульфатом натрия и концентрировали при пониженном давлении с получением 7,4 г темного масла. Это масло очищали путем флэш-хроматографии(элюирование градиентом дихлорметана, содержавшего 0-2,5% метанола) с получением 4,95 г (75%) указанного в заголовке соединения в виде рыжевато-коричневого вещества. Т.пл. = 113-114 С. МС (m/е): 204(М+). Вычислено для C11H12N2O2: Теория: С 64,69; Н 5,92; N 13,72. Найдено: С 64,76; Н 5,92; N 13,76. В. Восстановление N-этоксикарбонил-5 амино-1 Н-индола. К суспензии 6,3 г (164,5 ммоль) литийалюминийгидрида в 50 мл тетрагидрофурана добавляли по каплям раствор 4,8 г (23,5 ммоль) Nэтоксикарбонил-5-амино-1 Н-индола в 40 мл тетрагидрофурана. Реакционную смесь нагревали с обратным холодильником до тех, пока не был израсходован исходный материал, что было определено путем тонкослойной хроматографии. Затем реакционную смесь охлаждали до температуры окружающей среды и обрабатывали насыщенным водным раствором сульфата натрия для разложения лишнего литийалюминийгидрида. Полученную суспензию фильтровали и фильтрат концентрировали при пониженном давлении, получив в результате 3,6 г темного твердого вещества. Твердое вещество подвергали флэш-хроматографии (элюирование градиентом дихлорметана, содержавшего 0-2% метанола) с получением 3,3 г (97,1%) указанного в заголовке соединения в виде рыжеватокоричневого твердого вещества. МС (m/e): 146(М+). Вычислено для С 9 Н 10N2: Теория: С 73,94; Н 6,90; N 19,16. Найдено: С 73,78; Н 6,94; N 19,04. Все 5-сульфонамидо-1 Н-индолы, необходимые для получения соединений по настоящему соединению, можно получить путем обработки 5-амино-1H-индола подходящим сульфонилхлоридом так, как описано в получении V. Получение V. 5-Метансульфонамидо-1 Ниндол. 46 К раствору 2 г (15,1 ммоль) 5-амино-1Hиндола в 25 мл тетрагидрофурана добавляли 2,4 мл (17,2 ммоль) триэтиламина. При охлаждении реакционной смеси в ледяной бане добавляли к ней по каплям 1,23 мл (15,6 ммоль) метансульфонилхлорида. Через 3,5 ч реакционную смесь распределяли между 1 Н раствором гидроксида натрия и этилацетатом. Органическую фазу экстрагировали два раза 1 Н раствором гидроксида натрия. Все натрийгидроксидные фазы объединяли, регулировали кислотой до рН 5 и хорошо экстрагировали этилацетатом. Эти органические фазы объединяли, промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали при пониженном давлении, получив в результате 3,0 г твердого вещества пурпурного цвета. Это твердое вещество кристаллизовали из смеси циклогексан-этил-ацетат с получением 2,5 г (78,6%) указанного в заголовке соединения в виде кристаллов светлопурпурного цвета. Т.пл. = 133-135 С. МС (m/е): 210(M+). Вычислено для C9H13N2O2S: Теория: С 51,41; Н 4,79; N 13,32. Найдено: С 51,16; Н 4,93; N 13,27. Получение VI. 5-Амино-3-(1-метилпиперидин-4-ил)-1 Н-индол. А. Из 5-нитро-1 Н-индола. К раствору 10,38 г (185 ммоль) гидроксида калия в 200 мл метанола добавляли 10,0 г (61,7 ммоль) 5-нитро-1 Н-индола, а затем 13,96 г (123 ммоль) 1-метил-4-пиперидона. Смесь нагревали с обратным холодильником в течение 4 дней в атмосфере азота. Затем реакционной смеси давали остыть до температуры окружающей среды и образовавшееся твердое вещество отфильтровывали и промывали метанолом. Это твердое вещество высушивали в вакууме при 50 С. Объединенные фильтраты концентрировали при пониженном давлении и остаток подвергали флэш-хроматографии (элюирование смесью дихлорметан:метанол=92,5:7,5). Содержавшие продукт фракции объединяли и концентрировали при пониженном давлении. Объединив это твердое вещество с тем, что было выделено непосредственно из реакционной смеси, получили 13,79 г (87%) 5-нитро-3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола. К раствору 38,2 г (145 ммоль) 5-нитро-3(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1 Ниндола в 1,9 л этанола и 30 мл 5 Н НСl добавляли 10,0 г 5%-ного палладия на угле. Реакционную смесь гидрировали при температуре окружающей среды в течение 18 ч при начальном давлении водорода 60 фунтов на кв.дюйм (4,2 кг/см 2). Далее реакционную смесь фильтровали и концентрировали при пониженном давлении. Остаток растворяли в метаноле и раствор фильтровали. Фильтрат концентрировали при пониженном давлении и остаток вновь раство 47 ряли в этаноле. Раствор концентрировали до примерно 500 мл и давали продукту возможность кристаллизоваться. Отфильтровав кристаллы, получили 48,9 г (95%) указанного в заголовке соединения в виде этанолового сольвата дихлороводородной соли. Т.пл. = 310-320 С (разлож.). МС (m/е): 229(M+). Вычислено для C14H19N32HClC2H6O: Теория: С 55,17; Н 7,81; N 12,06. Найдено: С 55,23; Н 7,61; N 12,30. В. Через 5-амино-1H-индол. К раствору 1,29 г (20 ммоль) гидроксида калия в 10 мл метанола добавляли 1,32 г (10 ммоль) 5-амино-1 Н-индола, а затем 2,46 мл (20 ммоль) 1-метил-4-пиперидона. Далее реакционную смесь нагревали с обратным холодильником в течение 18 ч. Затем реакционную смесь охлаждали до температуры окружающей среды,разбавляли 20 мл воды и отфильтровывали осадок. Твердое вещество перекристаллизовывали из смеси этилацетат-метанол с получением 1,11 г (48,9%) 5-амино-3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола в виде рыжеватокоричневого твердого вещества (т.пл. 200203 С). Рыжевато-коричневое твердое вещество подвергали флэш-хроматографии (элюирование смесью дихлорметан:метанол:гидроксид аммония=100:20:0,5), получив в результате 0,99 г 5 амино-3-(1-метил-1,2,3,6-тетрагидропиридин-4 ил)-1 Н-индола в виде твердого вещества кремового цвета (т.пл. 212-215 С (этилацетатметанол. МС (m/е): 227(M+). Вычислено для С 14 Н 17N3: Теория: С 73,98; Н 7,54; N 18,49. Найдено: С 73,76; Н 7,48; N 18,22. К раствору 11,3 г (50 ммоль) 5-амино-3-(1 метил-1,2,3,6-тетрагидропиридин-4-ил)-1 Ниндола в 250 мл метанола добавляли 3,0 г 5%ного палладия на угле. Смесь гидрировали при комнатной температуре и начальном давлении водорода 60 фунтов на кв.дюйм (4,2 кг/см 2) в течение 18 ч. Далее реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении, получив в результате темную смолу, которую суспендировали в гексане с получением указанного в заголовке соединения в виде коричневого твердого вещества. МС (m/е): 229(M+). Получение VII. 4-Хлор-N-метил-N-метоксибензамид. К раствору 11,38 г (116,7 ммоль) Nметокси-N-метиламингидрохлорида в 700 мл 1 Н гидроксида натрия добавляли раствор 18,56 г(106,04 ммоль) 4-хлорбензоилхлорида в 200 мл дихлорметана и смесь перемешивали при температуре окружающей среды. Через 18 ч разделяли фазы и оставшуюся водную фазу экстрагировали дихлорметаном. Все органические фазы объединяли, сушили над сульфатом натрия и концентрировали при пониженном давлении, 001113 48 получив в результате 27,9 г (95%) указанного в заголовке соединения в виде светлого масла. МС (m/е): 165(М+). ИК: 3011, 2974, 2938, 1634 см-1. Получение VIII. 5-Карбокси-3-(1-метил 1,2,5,6-тетрагидропиридин-4-ил)-1 Н-индол. К раствору 5,8 г (90 ммоль) гидроксида калия в 50 мл метанола добавляли 4,83 г (30 ммоль) индол-5-карбоновой кислоты, а затем 7,4 мл (60 ммоль) 1-метил-4-пиперидона, и полученный раствор нагревали с обратным холодильником в течение 18 часов. Далее реакционную смесь концентрировали при пониженном давлении и полученное масло растворяли в 200 мл воды. Раствор постепенно нейтрализовали добавлением 18 мл 5 Н хлороводородной кислоты. Образовавшийся осадок отфильтровывали,промывали водой и высушивали, получив в результате 6,09 г твердого вещества. Это твердое вещество растворяли в 100 мл 0,5 Н гидроксида натрия, раствор фильтровали и фильтрат обрабатывали 50 мл 1 Н хлороводородной кислоты. Образовавшееся твердое вещество отфильтровывали и сушили при пониженном давлении,получив в результате 5,46 г (71%) указанного в заголовке соединения. Т.пл. = 249 С. МС (m/е): 256(M+). Вычислено для C15H16N2O2: Теория: С 70,29; Н 6,29; N 10,93. Найдено: С 70,02; Н 6,39; N 11,02. Получение IX. 5-Карбокси-3-(1-метилпиперидин-4-ил)-1 Н-индол. 5-Этоксикарбонил-3-(1-метил-1,2,5,6 тетрагидропиридин-4-ил)-1 Н-индол. Раствор 0,513 г (2 ммоль) 5-карбокси-3-(1 метил-1,2,5,6-тетрагидропиридин-4-ил)-1 Ниндола в 5,1 мл этанола охлаждали в ледяной бане, добавляя при этом по каплям 0,51 мл серной кислоты. Полученную смесь нагревали с обратным холодильником в течение 5 ч. Уже громогенный раствор выливали в 50 мл холодной воды и затем подщелачивали его насыщенным гидроксидом аммония. Светло-желтый осадок собирали путем фильтрования и перекристаллизовывали из этанола с получением 0,24 г (42%) целевого соединения в виде светложелтых кристаллов. Т.пл. = 249 С. МС (m/е): 284(M+). Вычислено для C17H20N2O2: Теория: С 71,81; Н 7,09; N 9,85. Найдено: С 71,97; Н 7,25; N 9,71. 5-Этоксикарбонил-3-(1-метилпиперидин-4 ил)-1 Н-индол. К раствору 3,24 г (11,3 ммоль) 5 этоксикарбонил-3-(1-метил-1,2,5,6-тетрагидропиридин-4-ил)-1 Н-индола в 100 мл этанола добавляли 0,8 г 5%-ного палладия на угле и реакционную смесь гидрировали при комнатной температуре в течение 18 ч при начальном давлении водорода 60 фунтов на кв.дюйм (4,2 49 кг/см 2). Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаточное масло, которое, постояв при комнатной температуре, кристаллизовалось,перекристаллизовывали из 30 мл ацетонитрила с получением 1,79 г (55%) целевого соединения в виде бесцветных кристаллов. Т.пл. = 155-157 С. МС (m/е): 286(М+). Вычислено для C17H22N2O2: Теория: С 71,30; Н 7,74; N 9,78. Найдено: С 71,07; Н 7,88; N 9,73. Омыление и протонирование. Смесь 0,859 г (3 ммоль) 5-этоксикарбонил 3-(1-метилпиперидин-4-ил)-1 Н-индола, 6,0 мл этанола и 6 мл 2 Н гидроксида натрия нагревали с обратным холодильником в течение 2 ч. Отгоняли из полученного раствора этанол и оставшийся водный раствор нейтрализовали 2,4 мл 5 Н хлороводородной кислоты. Полученное масло, суспендированное в воде, обрабатывали небольшим количеством дихлорметана и охлаждали. Полученное твердое вещество отфильтровывали, промывали водой и ацетоном и затем перекристаллизовывали из 15 мл воды с получением 0,308 г (40%) указанного в заголовке соединения в виде бесцветных кристаллов. Т.пл.280 С. МС (m/е): 258(M+). Вычислено для C15H18N2O2: Теория: С 69,74; Н 7,02; N 10,84. Найдено: С 69,66; Н 7,03; N 10,92. Получение Х. Получение полистиролизоцианатной смолы. К перемешанной суспензии 50 г (61 ммоль) аминометилированного полистирола(1,22 ммоль/г) в 800 мл толуола добавляли 193 мл (366 ммоль) 1,9 М фосгена в толуоле. После перемешивания реакционной смеси в течение 10 мин добавляли 67 мл (482 ммоль) триэтиламина и реакционную смесь перемешивали 18 ч при комнатной температуре. Смесь фильтровали и извлеченное твердое вещество промывали 10 раз дихлорметаном. В результате получили светло-розовую смолу, смешанную с белым твердым веществом. Эту твердую смесь вновь суспендировали в 700 мл дихлорметана, перемешивали 10 мин и затем фильтровали и хорошо промывали дихлорметаном. Полученное твердое вещество опять суспендировали, перемешивали и промывали дихлорметаном, получив в результате целевую смолу. ИК (КВr): 2252 см-1 (характерный пик для N=С=O). Пример 1. 5-Фенилтио-3-(1-метилпиперидин-4-ил)-1 Н-индол. К суспензии 0,21 г (1,05 ммоль) гидрида калия в 5,0 мл тетрагидрофурана при 0 С добавляли раствор 0,3 г (1,0 ммоль) 5-бром-3-(1 метилпиперидин-4-ил)-1 Н-индола в 5 мл тетрагидрофурана и полученный раствор перемешивали примерно 30 мин. Полученную смесь ох 001113 50 лаждали до примерно -78 С и добавляли к ней через канюлю 1,47 мл (2,3 ммоль) трет-бутиллития, предварительно охлажденного до-78 С. Спустя примерно 15 мин, добавляли 0,43 г (2 ммоль) дифенилдисульфида и давали реакционной смеси постепенно согреться до температуры окружающей среды. Затем реакционную смесь обрабатывали 5 Н гидроксидом натрия и экстрагировали диэтиловым эфиром. Эфирные экстракты объединяли, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали при пониженном давлении. Очистка путем флэшхроматографии (элюирование смесью этилацетат:метанол:толуол=4,5:0,5:0,2) с последующей перекристаллизацией из смеси гександиэтиловый эфир дали 0,28 г (85,1%) указанного в заголовке соединения в виде белого твердого вещества. Т.пл. = 147-150 С. МС (m/е): 322(М+). Вычислено для C20H22N2S: Теория: С 74,49; Н 6,89; N 8,69. Найдено: С 74,27; Н 6,96; N 8,77. Способом, подробно описанным в примере 1, получали соединения примеров 2-5. Пример 2. 5-(4-Метоксифенил)тио-3-(1 метилпиперидин-4-ил)-1 Н-индол. Из 0,3 г (1,0 ммоль) 5-бром-3-(1-метилпиперидин-4-ил)-1 Н-индола и 0,55 г (1,99 ммоль) ди(4-метоксифенил)дисульфида получили 0,28 г (64,0%) указанного в заголовке соединения в виде бесцветного твердого вещества. Т.пл. = 160-162 С МС(m/е): 352(М+). Вычислено для C21H24H4OS: Теория: С 71,55; Н 6,86; N 7,95. Найдено: С 71,67; Н 6,89; N 8,24. Пример 3. 5-Бензилтио-3-(1-метилпиперидин-4-ил)-1 Н-индол. Из 0,325 г (1,11 ммоль) 5-бром-3-(1 метилпиперидин-4-ил)-1 Н-индола и 0,55 г (2,22 ммоль) дибензилдисульфида получили 0,065 г(17,0%) указанного в заголовке соединения в виде бесцветного твердого вещества. Т.пл = 138-141 С. МС (m/e): 336(M+). Вычислено для C21H24N2S: Теория: С 74,96; Н 7,19; N 8,33 Найдено: С 75,55; Н 7,32; N 7,95. Пример 4. 5-(Пиридин-2-ил)тио-3-(1-метилпиперидин-4-ил)-1 Н-индол. Из 0,3 г (1,0 ммоль) 5-бром-3-(1-метилпиперидин-4-ил)-1 Н-индола и 0,44 г (1,99 ммоль) ди(пиридин-2-ил)дисульфида получили 0,12 г(37,0%) указанного в заголовке соединения в виде не совсем белого твердого вещества. Т.пл = 83 С. МС (m/е): 323(M+). Вычислено для C19H21N3S. Теория: С 70,55; Н 6,54; N 12,99. Найдено: С 70,25; Н 6,60; N 12,80. 51 Пример 5. 5-(4-Хлорфенил)тио-3-(1-метилпиперидин-4-ил)-1 Н-индол. Из 0,4 г (1,36 ммоль) 5-бром-3-(1-метилпиперидин-4-ил)-1 Н-индола и 0,78 г (2,73 ммоль) ди(4-хлорофенил)дисульфида получили 0,39 г (79,6%) указанного в заголовке соединения в виде бесцветного твердого вещества. Т.пл = 148-150 С. МС (m/e):356(M+). Вычислено для C20H21N2SCl: Теория: С 67,30; Н 5,93; N 7,85. Найдено: С 67,47; Н 6,10; N 7,84. Пример 6. 5-Бензоил-3-(1-метилпиперидин-4-ил)-1 Н-индол. К раствору 0,41 мл (0,73 ммоль) фениллития в 4,0 мл тетрагидрофурана при 0 С добавляли 0,10 г (0,33 ммоль) N-метил-N-метокси-5 карбоксамидо-3-(1-метилпиперидин-4-ил)-1 Ниндола (получение II) в 2,0 мл тетрагидрофурана. Через 1 ч реакционную смесь быстро охлаждали добавлением 2 Н гидроксида натрия и полученную смесь хорошо экстрагировали диэтиловым эфиром. Далее эфирные экстракты промывали насыщенным водным хлоридом натрия,сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали путем радиальной хроматографии (диоксид кремния 2 мм, элюирование смесью дихлорметан:метанол=10:1) с получением 0,096 г(91%) указанного в заголовке соединения в виде светло-желтого твердого вещества. Т.пл. = 101 С. МС (m/е): 319(M+). ИК: 1644 см-1. Вычислено для C21H22N2OH2O: Теория: С 74,48; Н 7,19; N 8,33. Найдено: С 74,85; Н 7,00; N 8,67. Способом, подробно описанным в примере 6, получали соединения примеров 7-9. Пример 7. Моногидрат 5-ацетил-3-(1 метилпиперидин-4-ил)-1 Н-индолгидрохлорида. Из 0,30 г (1,0 ммоль) N-метил-N-метокси 5-карбоксамидо-3-(1-метилпиперидин-4-ил)-1 Ниндола (получение II) и 3,56 мл (4,98 ммоль) метиллития получили 5-ацетил-3-(1-метилпиперидин-4-ил)-1 Н-индол, который преобразовали в его хлороводородную соль. В результате получили 0,153 г (60%) указанного в заголовке соединения. Т.пл = 65 С. МС (m/е): 256(M+). 52 разовали в его хлороводородную соль. В результате получили 0,124 г (63%) указанного в заголовке соединения в виде рыжеватокоричневого твердого вещества, которое кристаллизовали из смеси этанол-диэтиловый эфир. Т.пл. = 242-245 С. МС (m/е): 299(M+). Вычислено для C19H26N2OHCl: Теория: С 68,15; Н 8,13; N 8,37. Найдено: С 67,89; Н 8,05; N 8,64. Пример 9. 5-Фенилацетил-3-(1-метилпиперидин-4-ил)-1 Н-индол. Из 0,30 г (1,0 ммоль) N-метил-N-метокси 5-карбоксамидо-3-(1-метилпиперидин-4-ил)-1 Ниндола (получение II) и 2,5 мл (5,0 ммоль) бензилмагнийхлорида получили 0,22 г (66%) указанного в заголовке соединения в виде не совсем белого твердого вещества. Т.пл = 69 С. МС (m/e): 333(M+). ИК: 1662 см-1. Вычислено для C22H24N2O: Теория: С 79,48; Н 7,28; N 8,43. Найдено: С 79,68; Н 7,47; N 8,61. Пример 10. 5-(4-Метоксибензоил)-3-(1-метилпиперидин-4-ил)-1 Н-индол. К раствору 0,35 мл (2,82 ммоль) 4-метокси 1-бромбензола в 3,0 мл тетрагидрофурана при-78 С добавляли 1,83 г (2,93 ммоль) нбутиллития и реакционную смесь перемешивали 30 мин при -78 С. К этому раствору добавляли 0,17 г (0,56 ммоль) N-метил-N-метокси-5 карбоксамидо-3-(1-метилпиперидин-4-ил)-1 Ниндола (получение II) в 2,0 мл тетрагидрофурана. Давали реакционной смеси постепенно согреться до температуры окружающей среды и затем быстро охлаждали добавлением 2 Н гидроксида натрия. Полученную смесь хорошо экстрагировали диэтиловым эфиром. Далее эфирные экстракты промывали насыщенным водным хлоридом натрия, сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали путем радиальной хроматографии (диоксид кремния 2 мм, элюирование смесью дихлорметан:метанол=10:1) с получением 0,135 г (72%) указанного в заголовке соединения в виде светло-желтого твердого вещества. МС (m/е): 349(M+). Вычислено для C22H24N2O2: Теория: С 75,84; Н 6,94; N 8,04. Найдено: С 75,85; Н 7,11; N 8,06. Способом, подробно описанным в примере 10, получали соединения примеров 11-19. Пример 11. 5-(4-Фторбензоил)-3-(1-метилпиперидин-4-ил)-1 Н-индол. Из 0,20 г (0,66 ммоль) N-метил-N-метокси 5-карбоксамидо-3-(1-метилпиперидин-4-ил)-1 Ниндола (получение II) и 0,36 мл (4,98 ммоль) 4 фтор-1-бромбензола получили 0,158 г (71%) указанного в заголовке соединения в виде не совсем белого твердого вещества. Т.пл. = 89 С. 53 МС (m/е): 336(M+). Пример 12. 5-(4-Метилбензоил)-3-(1-метилпиперидин-4-ил)-1 Н-индол. Из 0,20 г (0,66 ммоль) N-метил-N-метокси 5-карбоксамидо-3-(1-метилпиперидин-4-ил)-1 Ниндола (получение II) и 0,41 мл (3,32 ммоль) 4 метил-1-бромбензола получили 0,180 г (79%) указанного в заголовке соединения в виде желтого твердого вещества. Т.пл. = 92 С. МС (m/е): 332(М+). Вычислено для C22H24N2O: Теория: С 79,48; Н 7,28; N 8,43. Найдено: С 79,60; Н 7,40; N 8,54. Пример 13. 5-(4-Трифторметилбензоил)-3(1-метилпиперидин-4-ил)-1 Н-индол. Из 0,15 г (0,50 ммоль) N-метил-N-метокси 5-карбоксамидо-3-(1-метилпиперидин-4-ил)-1 Ниндола (получение II) и 0,35 мл (2,49 ммоль) 4 трифторметил-1-бромбензола получили 0,122 г(64%) указанного в заголовке соединения в виде желтого твердого вещества. Т.пл. = 160-162 С. МС (m/е): 386(M+). Вычислено для С 22 Н 21N2 ОF3: Теория: С 68,38; Н 5,48; N 7,25. Найдено: С 68,54; Н 5,72; N 7,47. Пример 14. 5-(4-Трифторметоксибензоил)3-(1-метилпиперидин-4-ил)-1 Н-индол. Из 0,17 г (0,56 ммоль) N-метил-N-метокси 5-карбоксамидо-3-(1-метилпиперидин-4-ил)-1 Ниндола (получение II) и 0,49 мл (3,32 ммоль) 4 трифторметокси-1-бромбензола получили 0,157 г (69%) указанного в заголовке соединения в виде светло-желтого твердого вещества. Т.пл. = 172-175 С. МС (m/е): 402(М+). Вычислено для С 22 Н 21N2 О 2F3: Теория: С 65,66; Н 5,26; N 6,96. Найдено: С 65,86; Н 5,45; N 7,20. Пример 15. 5-(4-Диметиламинобензоил)-3(1-метилпиперидин-4-ил)-1 Н-индол. Из 0,20 г (0,66 ммоль) N-метил-N-метокси 5-карбоксамидо-3-(1-метилпиперидин-4-ил)-1 Ниндола (получение II) и 0,80 мл (3,98 ммоль) 4 диметиламино-1-бромбензола получили 0,159 г(66%) указанного в заголовке соединения в виде светло-желтого твердого вещества. Т.пл. = 103-104 С. МС (m/e): 361(M+). Вычислено для C23H27N3O0,5H2O: Теория: С 74,56; Н 7,62; N 11,34. Найдено: С 74,46; Н 7,53; N 11,04. Пример 16. 5-(2-Нафтоил)-3-(1-метилпиперидин-4-ил)-1 Н-индол. Из 0,20 г (0,66 ммоль) N-метил-N-метокси 5-карбоксамидо-3-(1-метилпиперидин-4-ил)-1 Ниндола (получение II) и 0,60 мл (3,32 ммоль) 2 бромнафталина получили 0,178 г (73%) указанного в заголовке соединения в виде светложелтого твердого вещества. Т.пл. = 92 С. 54 МС (m/е): 368(M+). Пример 17. 5-(2-Пиридинкарбонил)-3-(1 метилпиперидин-4-ил)-1 Н-индол. Из 0,20 г (0,66 ммоль) N-метил-N-метокси 5-карбоксамидо-3-(1-метилпиперидин-4-ил)-1 Ниндола (получение II) и 0,32 мл (3,32 ммоль) 2 бромпиридина получили 0,089 г (42%) указанного в заголовке соединения в виде светложелтого твердого вещества. Т.пл. = 90 С. МС (m/е): 319(М+). Пример 18. 5-(N-Фенилкарбоксамидо)-3(1-метилпиперидин-4-ил)-1 Н-индол. Из 0,20 г (0,66 ммоль) N-метил-N-метокси 5-карбоксамидо-3-(1-метилпиперидин-4-ил)-1 Ниндола (получение II) и 0,30 мл (3,32 ммоль) анилина получили 0,118 г (53%) указанного в заголовке соединения в виде светло-рыжеватокоричневого твердого вещества. Т.пл. = 97 С. МС (m/e): 333(M+). Вычислено для C21H23N3O0,25H2O: Теория: С 74,64; Н 7,01; N 12,43. Найдено: С 74,29; Н 7,06; N 12,51. Пример 19. 5-(N-Бензилкарбоксамидо)-3(1-метилпиперидин-4-ил)-1 Н-индол. Из 1,2 г (4,0 ммоль) N-метил-N-метокси-5 карбоксамидо-3-(1-метилпиперидин-4-ил)-1 Ниндола (получение II) и 2,2 мл (20,0 ммоль) бензиламина получили 0,788 г (57%) указанного в заголовке соединения в виде белого твердого вещества. Т.пл. = 87 С. МС (m/е): 347(M+). Вычислено для C22H25N3O: Теория: С 76,05; Н 7,25; N 12,09. Найдено: С 76,06; Н 7,51; N 12,35 Пример 20. 5-(4-Хлорбензоил)-3-(1-метилпиперидин-4-ил)-1 Н-индол. К суспензии 0,21 г (1,05 ммоль) гидрида калия в 5,0 мл тетрагидрофурана при 0 С добавляли раствор 0,3 г (1,0 ммоль) 5-бром-3-(1 метилпиперидина-4-ил)-1 Н-индола в 5 мл тетрагидрофурана и полученный раствор перемешивали примерно 30 мин. Полученную смесь охлаждали до примерно -78 С и добавляли к ней через канюлю 1,47 мл (2,3 ммоль) трет-бутил лития, предварительно охлажденного до -78 С. Спустя примерно 15 мин, добавляли раствор 1,0 г (5,0 ммоль) N-метил-N-метокси-4-хлорбензамида (получение VII) в 3,0 мл тетрагидрофурана. Давали реакционной смеси постепенно согреться до температуры окружающей среды и затем быстро охлаждали добавлением 2 Н гидроксида натрия. Смесь хорошо экстрагировали диэтиловым эфиром и эфирные экстракты промывали насыщенным водным хлоридом натрия,сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали путем радиальной хроматографии (диоксид кремния 2 мм, элюирование смесью этилацетат: метанол=95:5) с получением указанного 55 в заголовке соединения в виде светло-желтого твердого вещества. Т.пл. = 133 С. МС (m/е): 352(M+). Вычислено для C21H21N2OCl0,5H2O: Теория С 69,70; Н 6,13; N 7,74. Найдено: С 70,02; Н 6,20; N 7,93. Пример 21. 5-Метансульфониламино-3-(1 метил-1,2,3,6-тетрагидропиридин-4-ил)-1 Ниндол. К раствору 1,2 г (21,4 ммоль) гидроксида калия в 12 мл метанола добавляли 1,0 г (4,76 ммоль) 5-метансульфониламино-1 Н-индола, а затем 0,76 мл (6,2 ммоль) 1-метил-4-пиперидона. Гомогенный раствор нагревали с обратным холодильником в течение 18 ч под азотом. Затем реакционную смесь охлаждали и концентрировали при пониженном давлении. Остаток растворяли в воде и доводили рН раствора от 14 до 8-9 добавлением кислоты. Образовавшийся осадок отфильтровывали, промывали водой и высушивали в вакууме, получив в результате 1,3 г (89,6%) указанного в заголовке соединения в виде рыжевато-коричневого твердого вещества. Т.пл. = 210-214 С. МС (m/е): 305(M+). Вычислено для C15H19N3O2S: Теория С 58,99; Н 6,27; N 13,76. Найдено: С 59,00; Н 6,20; N 13,74. Способом, подробно описанным в примере 21, получали соединения примеров 22-29. Пример 22. N-Метил-5-метансульфониламино-3-(1-метил-1,2,3,6-тетрагидропиридин-4 ил)-1 Н-индол. Из 1,23 г (5,5 ммоль) N-метил-5 метансульфониламино-1 Н-индола и 0,88 мл (7,1 ммоль) 1-метил-4-пиперидона получили 1,4 г(80%) указанного в заголовке соединения в виде кристаллического порошка рыжевато-коричневого цвета. Т.пл. = 198-202 С. МС (m/е): 319(М+). Вычислено для С 16 Н 21N3 О 2S: Теория С 60,16; Н 6,63; N 13,16. Найдено: С 60,30; Н 6,76; N 12,97. Пример 23. 2-Метил-5-метансульфониламино-3-(1-метил-1,2,3,6-тетрагидропиридин-4 ил)-1 Н-индол. Из 1,37 г (6,1 ммоль) 2-метил-5 метансульфониламино-1 Н-индола и 0,98 мл (7,9 ммоль) 1-метил-4-пиперидона получили 0,65 г(33,3%) указанного в заголовке соединения в виде желтого твердого вещества. Т.пл. = 176-184 С. МС (m/е): 320(М+1). Вычислено для C16H21N3O2S: Теория С 60,16; Н 6,63; N 13,16. Найдено: С 60,39; Н 6,48; N 13,10. Пример 24. 5-Этансульфониламино-3-(1 метил-1,2,3,6-тетрагидропиридин-4-ил)-1 Ниндол.(72,6%) указанного в заголовке соединения в виде бледно-желтого порошка. Т.пл. = 207-208 С. МС (m/e): 334(M+). Вычислено для С 16H22N4O2S: Теория: С 57,46; Н 6,63; N 16,75. Найдено: С 57,69; Н 6,71; N 16,60. Пример 26. 5-Метансульфониламино-3-(1 этил-1,2,3,6-тетрагидропиридин-4-ил)-1 Ниндол. Из 1,50 г (7,1 ммоль) 5-метансульфониламино-1 Н-индола и 1,25 мл (9,3 ммоль) 1-этил 4-пиперидона получили 1,34 г (58,8%) указанного в заголовке соединения в виде бледножелтого кристаллического порошка. Т.пл. = 218-219 С (разлож.). МС (m/е): 320(М+1). Вычислено для C16H21N3O2S: Теория: С 60,16; Н 6,63; N 13,16. Найдено: С 59,89; Н 6,39; N 13,24. Пример 27. 5-Метансульфониламино-3-(1 пропил-1,2,3,6-тетрагидропиридин-4-ил)-1 Ниндол. Из 1,50 г (7,1 ммоль) 5-метансульфониламино-1H-индола и 1,4 мл (9,3 ммоль) 1-пропил 4-пиперидона получили 2,1 г (88,2%) указанного в заголовке соединения в виде желтого порошка. Т.пл. = 217-218,5 С (разлож.). МС(m/е): 334(М+1). Вычислено для C17H23N3O2S: Теория: С 61,23; Н 6,95; N 12,60. Найдено: С 61,51; Н 7,23; N 12,30. Пример 28. 5-Метансульфониламино-3-(1 изопропил-1,2,3,6-тетрагидропиридин-4-ил)-1 Ниндол. Из 1,0 г (4,76 ммоль) 5-метансульфониламино-1H-индола и 0,873 мл (6,2 ммоль) 1 изопропил-4-пиперидона получили 1,02 г 57 Пример 29. 5-Метансульфониламино-3-(1 бутил-1,2,3,6-тетрагидропиридин-4-ил)-1 Ниндол. Из 1,0 г (4,7 ммоль) 5-метансульфониламино-1H-индола и 0,96 мл (6,2 ммоль) 1-бутил 4-пиперидона получили 1,4 г (84,8%) указанного в заголовке соединения в виде желтого порошка. Т.пл. = 202-204 С. МС (m/e): 347(M+). Вычислено для C18H25N3O2S: Теория: С 62,22; Н 7,25; N 12,09. Найдено: С 62,10; Н 7,11; N 12,28. Пример 30. 5-Метансульфониламино-3-(1 метилпиперидин-4-ил)-1 Н-индолоксалат. К раствору 0,815 г (2,67 ммоль) 5 метансульфониламино-3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола в 125 мл метанола добавляли 0,815 г 5%-ного палладия на угле. Смесь гидрировали при температуре окружающей среды в течение 18 ч при начальном давлении водорода 60 фунтов на кв.дюйм (4,2 кг/см 2). Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаточное масло очищали путем флэш-хроматографии (элюирование смесью дихлорметан:метанол=90:10). Содержавшие продукт фракции объединяли и концентрировали при пониженном давлении. Остаток растворяли в метаноле и добавляли к нему щавелевую кислоту. Суспензию фильтровали с получением 0,261 г (25%) указанного в заголовке соединения. Т.пл. = 119,1 С. МС (m/е): 307(M+). Пример 31. 5-(N-Метил)метансульфониламино-3-(1-метилпиперидин-4-ил)-1 Н-индол. Следуя процедуре, подробно описанной в примере 30, гидрировали 0,807 г (2,53 ммоль) 5(N-метил)метансульфониламино-3-(1-метил 1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола(пример 22) с получением 0,075 г (9,3%) указанного в заголовке соединения в виде рыжеватокоричневого пенообразного вещества. МС (m/е): 322 (М+1). Вычислено для C16H23N3O2S: Теория: С 59,79; Н 7,21; N 13,07. Найдено: С 59,62; Н 7,33; N 12,82. Пример 32. 2-Метил-5-метансульфониламино-3-(1-метилпиперидин-4-ил)-1 Н-индол. К раствору 0,45 г (1,41 ммоль) 2-метил-5 метансульфониламино-3-(1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола (пример 23) в 125 мл метанола добавляли 0,11 г 5%-ного палладия на угле и реакционную смесь гидрировали при температуре окружающей среды и начальном давлении водорода 60 фунтов на кв.дюйм (4,2 кг/см 2). Через 18 ч реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением желтого масла. Масло очищали путем радиальной хроматографии (силикагель 2 мм, элюирование смесью=100:5:0,5), получив в результате 0,21 г желтого пенообразного вещества, которое затем осаждали из смеси этилацетат-гексаны с получением 0,18 г (39,7%) указанного в заголовке соединения в виде белого порошка. Т.пл. = 124-128 С. МС (m/е): 321 (М+). Вычислено для C16H23N3O2S: Теория: С 59,79; Н 7,21; N 13,07. Найдено: С 59,88; Н 7,24; N 13,33. Способом, подробно описанным в примере 32, получали соединения примеров 33-38. Пример 33. 5-Этансульфониламино-3-(1 металпиперидин-4-ил)-1 Н-индол. Гидрировали 0,70 г (2,2 ммоль) 5-этансульфониламино-3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола (пример 24) с получением 0,545 г (77,4%) указанного в заголовке соединения в виде белого порошка. Т.пл. = 176-178 С. МС (m/е): 322(М+1). Вычислено для C16H23N3O2S: Теория: С 59,79; Н 7,21; N 13,07. Найдено: С 60,07; Н 7,22; N 12,79. Пример 34. 5-(N,N-диметиламино)сульфониламино-3-(1-метилпиперидин-4-ил)-1 Н-индол. Гидрировали 0,66 г (2,0 ммоль) 5-(N,Nдиметиламино)сульфониламино-3-(1-метил 1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола(пример 25) с получением 0,333 г (50,2%) указанного в заголовке соединения в виде не совсем белого порошка. Т.пл. = 179-181 С (разлож.). МС (m/е): 336(M+). Вычислено для C16H24N4O2S: Теория С 57,12; Н 7,19; N 16,65. Найдено: С 57,38; Н 7,27; N 16,87. Пример 35. 5-Метансульфониламино-3-(1 этилпиперидин-4-ил)-1 Н-индол. Гидрировали 0,96 г (3,0 ммоль) 5 метансульфониламино-3-(1-этил-1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола (пример 26) с получением 0,531 г (55,0%) указанного в заголовке соединения в виде не совсем белого порошка. Т.пл. = 179-181 С. МС (m/е): 321 (M+). Вычислено для C16H23N3O2S: Теория: С 59,79; Н 7,21; N 13,07. Найдено: С 59,50; Н 7,11; N 12,81. Пример 36. 5-Метансульфониламино-3-(1 пропилпиперидин-4-ил)-1 Н-индол. Гидрировали 1,0 г (3,0 ммоль) 5-метансульфониламино-3-(1-пропил-1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола (пример 27) с получением 0,376 г (37,2%) указанного в заголовке соединения в виде не совсем белого порошка. Т.пл. = 87-90 С. МС (m/e): 335(М+). Вычислено для C17H25N3O2S: Теория: С 60,87; Н 7,51; N 12,53.(пример 28) с получением 0,310 г (41,1%) указанного в заголовке соединения в виде белого порошка. Т.пл. = 104-108 С. МС (m/е): 335(M+). Вычислено для C17H25N3O2SC2H2O4: Теория: С 53,63; Н 6,40; N 9,87. Найдено: С 53,38; Н 6,34; N 9,66. Пример 38. 5-Метансульфониламино-3-(1 бутилпиперидин-4-ил)-1 Н-индол. Гидрировали 1,05 г (3,02 ммоль) 5 метансульфониламино-3-(1-бутил-1,2,3,6-тетрагидропиридин-4-ил)-1 Н-индола (пример 29) с получением 0,255 г (24,0%) указанного в заголовке соединения в виде рыжевато-коричневого пенообразного вещества. Т.пл. = 78 С. МС (m/e): 349(М+). Вычислено для C18H27N3O2S: Теория С 61,86; Н 7,79; N 12,02. Найдено: С 61,66; Н 7,74; N 11,87. Пример 39. 5-Бензолсульфониламино-3-(1 метилпиперидин-4-ил)-1 Н-индол. К раствору 2,00 г (5,74 ммоль) 5-амино-3(1-метилпиперидин-4-ил)-1H-индола в 50,0 мл дихлорметана добавляли 1,63 г (20,7 ммоль) пиридина и раствор охлаждали до 0 С. Далее к этому охлажденному раствору добавляли по каплям раствор 2,23 г (12,6 ммоль) бензолсульфонилхлорида в 50 мл дихлорметана. Давали реакционной смеси постепенно согреться до температуры окружающей среды. Через 24 ч реакционную смесь промывали 100 мл воды и оставшуюся органику концентрировали при пониженном давлении. Остаток суспендировали в воде и доводили рН до 14 добавлением гидроксида натрия. Затем водную фазу хорошо экстрагировали дихлорметаном. Органическую фазу промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали при пониженном давлении. Водные фазы объединяли, доводили рН до 10 путем добавления кислоты и опять экстрагировали смесью хлороформ:изопропанол=3:1. Эти органические экстракты объединяли и концентрировали при пониженном давлении. Объединенные остатки подвергали флэш-хроматографии (элюирование градиентной системой дихлорметан:метанол: аммонийгидроксид=100:10:0,5 до 100:11:0,5) с получением 0,83 г (39,1%) указанного в заголовке соединения в виде белого порошка. Т.пл. = 246-249 С. МС (m/е): 370(М+1). Вычислено для C20H23N3O2S: Теория:С 65,02; Н 6,27; N 11,37. Найдено: С 64,78; Н 6,09; N 11,44. 60 Пример 40. 5-(4-Иодбензолсульфонил) амино-3-(1-метилпиперидин-4-ил)-1 Н-индол. Следуя процедуре, подробно описанной в примере 39, использовали 0,791 г (3,45 ммоль) 5-амино-3-(1-метилпиперидин-4-ил)-1 Н-индола и 1,1 г (3,62 ммоль) 4-иодбензолсульфонилхлорида с получением 0,809 г (47,3%) указанного в заголовке соединения в виде белого порошка. Т.пл. =250 С. МС (m/е): 495(M+). Вычислено для C20H22IN3O2S: Теория С 48,49; Н 4,48; N 8,48. Найдено: С 48,68; Н 4,47; N 8,26. Пример 41. 5-(Ди(трифторметансульфониламино-3-(1-метилпиперидин-4-мл)-1 Ниндолгидрохлорид. К суспензии 1,00 г (2,87 ммоль) 5-амино-3(1-метилпиперидин-4-мл)-1H-индолдигидрохлорида в 100 мл дихлорметана добавляли 2,5 мл(14,3 ммоль) диизопропилэтиламина, а затем 1,06 мл (6,3 ммоль) трифторметансульфонового ангидрида. Через 20 мин реакционную смесь промывали водой, сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали путем флэшхроматографии (элюирование дихлорметаном,содержавшим 15% метанола) с получением 5(ди(трифторметансульфониламино-3-(1-метилпиперидин-4-мл)-1 Н-индола. Это вещество преобразовывали в его хлороводородную соль и кристаллизовали из ацетонитрила, получив в результате 0,34 г (22,3%) указанного в заголовке соединения. Т.пл. = 175-185 С (разлож.). МС (m/е): 493(M+). Вычислено для С 16 Н 17N3O4S2F6HCl: Теория: С 36,27; Н 3,23; N 7,93. Найдено: С 36,48; Н 3,58; N 7,85. Пример 42. 5-(Метоксикарбонил)амино-3(1-метилпиперидин-4-ил)-1 Н-индол. К смеси 10 мг (0,0437 ммоль) 5-амино-3(1-метилпиперидин-4-мл)-1H-индола и 15,0 мг(0,131 ммоль) поливинилпиридина в 3,0 мл дихлорметана добавляли 4,3 мг (0,0458 ммоль) метилхлорформиата. Реакционную смесь перемешивали 18 ч при температуре окружающей среды. Затем к этой смеси добавляли 170 мг(0,137 ммоль) аминометилированного полистирола и реакционную смесь перемешивали еще 18 ч. Далее, реакционную смесь фильтровали и выпаривали летучие вещества, получив в результате 10,2 мг (81%) указанного в заголовке соединения. МС (m/e): 287(М+). Соединения примеров 43-50 получали способом, подробно описанным в примере 42. Пример 43. 5-(Этоксикарбонил)амино-3(1-метилпиперидин-4-ил)-1 Н-индол. Из 10 мг (0,0437 ммоль) 5-амино-3-(1 метилпиперидин-4-мл)-1 Н-индола и 4,97 мг
МПК / Метки
МПК: A61K 31/4439, C07D 401/04
Метки: соли, транссудации, фармацевтическая, активации, композиция, приемлемые, способ, 5-замещенные-3-(1,2,3,6-тетрагидропиридин-4-ил, рецепторов, фармацевтически, сольваты, нейронной, ингибирования, белковой, 3-(пиперидин-4-ил)-1н-индолы, 5-нт1, основе
Код ссылки
<a href="https://eas.patents.su/30-1113-5-zameshhennye-3-1236-tetragidropiridin-4-il-i-3-piperidin-4-il-1n-indoly-i-ih-farmacevticheski-priemlemye-soli-i-solvaty-farmacevticheskaya-kompoziciya-na-ih-osnove-sposob-aktivac.html" rel="bookmark" title="База патентов Евразийского Союза">5-замещенные-3-(1,2,3,6-тетрагидропиридин-4-ил)- и 3-(пиперидин-4-ил)-1н-индолы и их фармацевтически приемлемые соли и сольваты, фармацевтическая композиция на их основе, способ активации рецепторов 5-нт1 и способ ингибирования нейронной белковой транссудации.</a>
Предыдущий патент: Быстродействующий химический стерилизующий агент
Следующий патент: Способ конверсии углеводородов и устройство для конверсии углеводородов
Случайный патент: Шина, снабженная средством для изменения направления вытесняемой воды


































