Производные 1н-тиено [2,3-c] пиразола, предназначенные для использования в качестве ингибиторов киназы
Номер патента: 11032
Опубликовано: 30.12.2008
Авторы: Виольо Серджо, Тезеи Даниа, Бинди Симона, Вианелло Паола, Фанчелли Даниеле, Варази Марио
Формула / Реферат
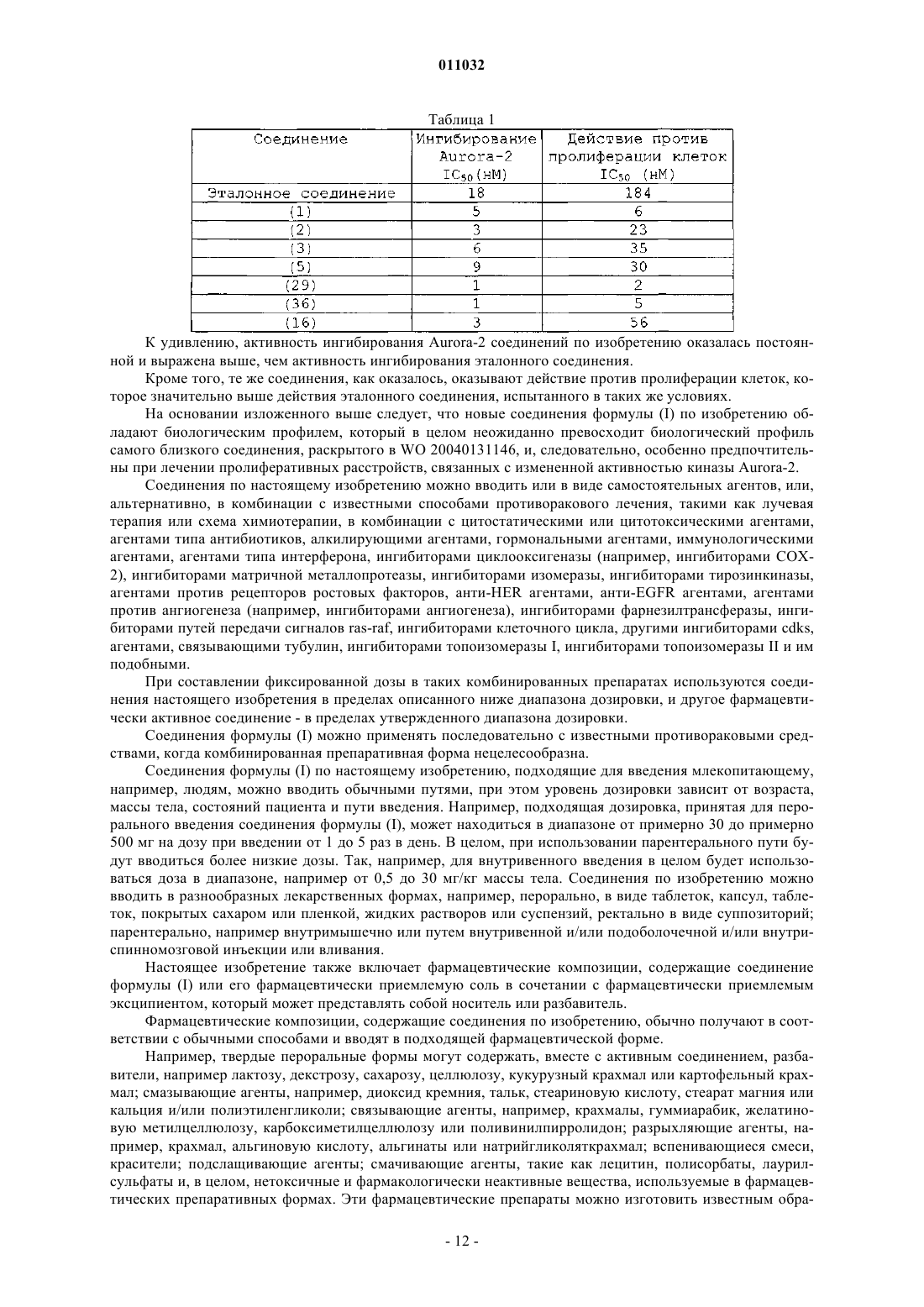
1. Способ лечения клеточных пролиферативных расстройств, вызванных и/или связанных с измененной активностью протеинкиназы, включающий введение нуждающемуся в нем млекопитающему эффективного количества производного 1Н-тиено[2,3-c]пиразола формулы (I)
где R представляет собой фенил или 5- или 6-членную гетероарильную группу, содержащую 1 или 2 гетероатома, выбранных из N, S или О, где R необязательно замещен в любом из его свободных положений 1-6 группами, выбранными из галогена, нитро, карбокси, циано, алкила, полифторированного алкила, алкенила, алкинила, циклоалкила, циклоалкенила; арильной, гетероциклильной, алкилгетероциклильной, гетероциклилалкильной, аминоалкильной, аминогрупп и их производных, таких как алкиламино, диалкиламино, ариламино, диариламино, уреидо, алкилуреидо или арилуреидо; карбониламиногрупп и их производных, таких как формиламино, алкилкарбониламино, алкенилкарбониламино, арилкарбониламино, алкоксикарбониламино; гидроксигрупп и их производных, таких как алкокси, полифторированный алкокси, арилокси, гетероциклилокси, алкикарбонилокси, арилкарбонилокси, циклоалкенилокси или алкилиденаминокси; карбонильных групп и их производных, таких как алкилкарбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, циклоалкилоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил; сульфированных производных, таких как алкилтио, арилтио, алкилсульфонил, арилсульфонил, алкилсульфинил, арилсульфинил, арилсульфонилокси, аминосульфонил, алкиламиносульфонил или диалкиламиносульфонил;
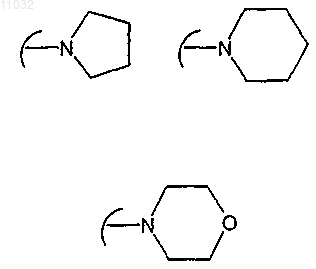
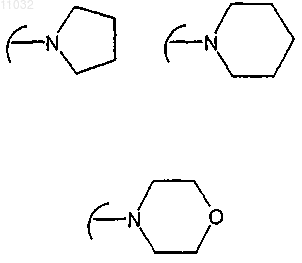
R1 и R2, одинаковые или различные, независимо друг от друга представляют собой атом водорода, прямой или разветвленный C1-С3алкил или группу -CH2NR' R'', или взятые вместе с атомом углерода, с которым они связаны, R1 и R2 могут образовывать С3-С6циклоалкильную группу; при условии, что по меньшей мере один из R1 и R2 не представляет собой атом водорода; R' и R'', взятые вместе с атомом азота, с которым они связаны, могут образовывать гетероциклическое кольцо формулы
где R3 представляет собой атом водорода, галогена или прямой или разветвленный C1-С3алкокси;
или его изомеры, таутомеры и фармацевтически приемлемые соли.
2. Способ по п.1, предназначенный для лечения клеточных пролиферативных расстройств, вызванных и/или связанных с измененной активностью киназ Aurora.
3. Способ по п.2, где киназа Aurora представляет собой Aurora 2.
4. Способ по п.1, где клеточное пролиферативное расстройство выбрано из группы, состоящей из рака, болезни Альцгеймера, вирусных инфекций, аутоиммунных заболеваний и нейродегенеративных расстройств.
5. Способ по п.4, где рак выбран из группы, состоящей из карциномы, плоскоклеточной карциномы, гематопоэтических опухолей миелоидной или лимфоидной линии дифференцировки, опухолей мезенхимального происхождения, опухолей центральной и периферической нервной системы, меланомы, семиномы, тератокарциномы, остеосаркомы, пигментозной ксеродермии, кератоксантомы, фолликулярного рака щитовидной железы и саркомы Капоши.
6. Способ по п.1, где клеточное пролиферативное расстройство выбрано из группы, состоящей из доброкачественной гиперплазии предстательной железы, наследственного аденоматоза, полипоза, нейрофиброматоза, псориаза, связанной с атеросклерозом пролиферации гладкомышечных клеток сосудов, пневмосклероза, артрита, гломерулонефрита и послеоперационного стеноза и рестеноза.
7. Способ по п.1, дополнительно включающий воздействие на нуждающегося в нем млекопитающего лучевой терапии или химиотерапии в комбинации по меньшей мере с одним цитостатическим или цитотоксическим средством.
8. Способ по п.1, где млекопитающее представляет собой человека.
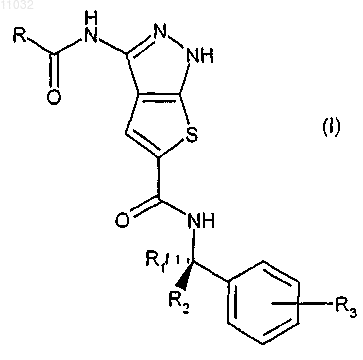
9. Производное 1Н-тиено[2,3-c]пиразола формулы (I)
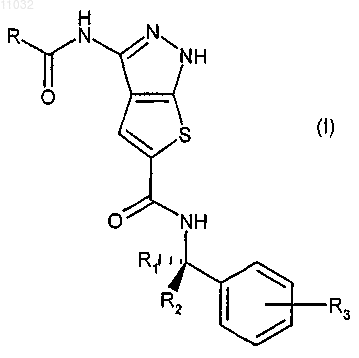
где R представляет собой фенил или 5- или 6-членную гетероарильную группу, содержащую 1 или 2 гетероатома, выбранных из N, S или О, где R необязательно замещен в любом из его свободных положений 1-6 группами, выбранными из галогена, нитро, карбокси, циано, алкила, полифторированного алкила, алкенила, алкинила, циклоалкила, циклоалкенила; арильной, гетероциклильной, алкилгетероциклильной, гетероциклилалкильной, аминоалкильной, аминогрупп и их производных, таких как алкиламино, диалкиламино, ариламино, диариламино, уреидо, алкилуреидо или арилуреидо; карбониламиногрупп и их производных, таких как формиламино, алкилкарбониламино, алкенилкарбониламино, арилкарбониламино, алкоксикарбониламино; гидроксигрупп и их производных, таких как алкокси, полифторированный алкокси, арилокси, гетероциклилокси, алкикарбонилокси, арилкарбонилокси, циклоалкенилокси или алкилиденаминокси; карбонильных групп и их производных, таких как алкилкарбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, циклоалкилоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил; сульфированных производных, таких как алкилтио, арилтио, алкилсульфонил, арилсульфонил, алкилсульфинил, арилсульфинил, арилсульфонилокси, аминосульфонил, алкиламиносульфонил или диалкиламиносульфонил;
R1 и R2, одинаковые или различные, независимо друг от друга представляют собой атом водорода, прямой или разветвленный C1-С3алкил или группу -CH2NR'R'', или взятые вместе с атомом углерода, с которым они связаны, R1 и R2 могут образовывать С3-С6циклоалкильную группу; при условии, что по меньшей мере один из R1 и R2 не представляет собой атом водорода; R' и R'', взятые вместе с атомом азота, с которым они связаны, могут образовывать гетероциклическое кольцо формулы
R3 представляет собой атом водорода, галогена или прямой или разветвленный C1-С3алкокси;
или его изомеры, таутомеры и фармацевтически приемлемые соли.
10. Способ ингибирования активности киназы Aurora 2, который включает контактирование указанной киназы с эффективным количеством соединения по п.9.
11. Соединение формулы (I) по п.9, где R представляет собой группу, выбранную из тиенила, фурила, пирролила и фенила, необязательно, дополнительно замещенную другой вышеуказанной группой.
12. Соединение формулы (I) по п.11, где R представляет собой тиенил, фурил, пирролил, N-метилпирролил, фенил и фенил, замещенный атомами галогенов, гетероциклическими, гетероциклилокси или гетероциклилакильными группами.
13. Соединение формулы (I) по п.12, где R выбран из 2-тиенила, 2-фурила, 1-метилпирролил-2-ила, фенила, 4-фторфенила, 4-(1-метилпиперидил-4-илокси)фенила, 4-(1-метилпиперазинил-4-ил)фенила, 4-(1-метилпиперазинил-4-илметил)фенила, 4-(пирролидин-1-ил)метилфенила, 4-(пиперидин-1-ил)метилфенила, 4-(1-метилпиперазин-4-ил)метилфенила, 4-(морфолино-1-ил)метилфенила, 4-(алкиламино)метилфенила, 4-(диалкиламино)метилфенила или 4-(морфолино-4-ил)фенила.
14. Соединение формулы (I) по п.9, где один из R1 или R2 представляет собой атом водорода или метильную группу, и остающийся один из R1 или R2 представляет собой метил, этил или группу
-CH2NR'R", в которой R' и R'' имеют вышеуказанные значения.
15. Соединение формулы (I) по п.9, где R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют С3-С6циклоалкильную группу.
16. Соединение формулы (I) по п.15, где R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют циклопропильную или циклопентильную группу.
17. Соединение формулы (I), в котором R, R1 и R2 имеют значения, указанные в п.9, и R3 представляет атом водорода, фтора или хлюЁр или метоксигруппу.
18. Соединение формулы (I) по п.9, необязательно в форме его фармацевтически приемлемой соли, выбранной из группы, состоящей из
1) N-(1-метил-1-фенилэтил)-3-[(4-морфолин-4-илбензоил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
2) 3-[(4-морфолин-4-илбензоил)амино]-N-(1-фенилциклопропил)-1Н-тиено[2,3-c]пиразол-1-карбоксамид;
3) N-[(1R)-1-(4-фторфенил)этил]-3-[(4-морфолин-4-илбензоил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
4) 3-[(4-морфолин-4-илбензоил)амино]-N-[(1R)-1-фенилпропил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
5) 3-[(4-морфолин-4-илбензоил)амино]-N-[(1S)-1-фенил-2-пирролидин-1-илэтил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
6) 3-[(4-морфолин-4-илбензоил)амино]-N-[(1S)-2-морфолин-4-ил-1-фенилэтил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
7) 3-[(4-фторбензоил)амино]-N-[(1-фенилциклопропил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
8) 3-[(4-фторбензоил)амино]-N-[(1-метил-1-фенилэтил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
9) 3-[(4-фторбензоил)амино]-N-[(1R)-1-фенилпропил)-1Н-тиено[2,3-с]пиразол-5-карбоксамид;
10) 3-[(4-фторбензоил)амино]-N-[(1S)-1-фенил-2-пирролидин-1-илэтил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
11) 3-[(4-фторбензоил)амино]-N-[(1R)-1-(4-фторфенил)этил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
12) 3-[(4-фторбензоил)амино]-N-[(1S))-2-морфолин-1-ил-1-фенилэтил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
13) N-(1-этил-1-фенилпропил)-3-[(4-фторбензоил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
14) 3-[(4-фторбензоил)амино]-N-[(1-фенилциклопентил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
15) N-[(1S)-2-морфолин-4-ил-1-фенилэтил)-3-[(тиен-2-илкарбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
16) N-(1-метил-1-фенилэтил)-3-[(тиен-2-илкарбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
17) N-[(1R)-1-(4-фторфенил)этил)-3-[(тиен-2-илкарбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
18) N-(1-фенилциклопропил)-3-[(тиен-2-илкарбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
19) N-[(1S)-1-фенил-2-пирролидин-1-илэтил)-3-[(тиен-2-илкарбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
20) N-[(1R)-1-фенилпропил]-3-[(тиен-2-илкарбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
21) N-(1-метил-2-фенилэтил)-3-{[(1-метил-1Н-пиррол-2-ил)карбонил]амино}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
22) 3-{[(1-метил-1Н-пиррол-2-ил)карбонил]амино}-N-(1-фенилциклопропил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
23) 3-(2-фуроиламино)-N-(1-фенилциклопропил)-1Н-тиено[2,3-с]пиразол-5-карбоксамид;
24) 3-(2-фуроиламино)-N-(1-метил-1-фенилэтил)-1Н-тиено[2,3-с]пиразол-5-карбоксамид;
25) N-(1-метил-1-фенилэтил)-3-({4-[(1-метилпиперидин-4-ил)окси]бензоил}амино)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
26) 3-({4-[(1-метилпиперидин-4-ил)окси]бензоил}амино)-N-(1-фенилциклопропил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
27) N-(1-метил-1-фенилэтил)-3-({4-[(4-метилпиперазин-1-ил)метил]бензоил}амино)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
28) 3-({4-[(4-метилпиперазин-1-ил)метил]бензоил}амино)-N-(1-фенилциклопропил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
29) N-(1-метил-1-фенилэтил)-3-{[4-(4-метилпиперазин-1-ил)бензоил]амино}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
30) 3-{[4-(4-метилпиперазин-1-ил)бензоил]амино}-N-[(1R)-фенилпропил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
31) 3-{[4-(4-метилпиперазин-1-ил)бензоил]амино}-N-[(1S)-2-морфолин-4-ил-1-фенилэтил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
32) 3-{[4-(4-метилпиперазин-1-ил)бензоил]амино}-N-[(1S)-1-фенил-2-пирролидин-1-илэтил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
33) N-(1-этил-1-фенилпропил)-3-{[4-(4-метилпиперазин-1-ил)бензоил]амино}-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
34) 3-{[4-(4-метилпиперазин-1-ил)бензоил]амино}-N-(1-фенилциклопентил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
35) 3-{[4-(4-метилпиперазин-1-ил)бензоил]амино}-N-(1-фенилциклопропил)-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
36) 3-{[4-(4-метилпиперазин-1-ил)бензоил]амино}-N-[(1R)-1-фенилэтил]-1Н-тиено[2,3-c]пиразол-5-карбоксамид;
37) (1-метил-1-фенилэтил)амид 3-(4-пирролидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
38) (1-метил-1-фенилэтил)амид 3-[(4-морфолин-4-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
39) (1-метил-1-фенилэтил)амид 3-(4-пиперидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
40) (1-метил-1-фенилэтил)амид 3-[4-(изопропиламинометил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
41) (1-метил-1-фенилэтил)амид 3-[4-(1,1-диоксо-1-тиоморфолин-4-илметил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
42) [1-(3-фторфенил)-1-метилэтил]амид 3-(4-морфолин-4-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
43) [1-(2-фторфенил)-1-метилэтил]амид 3-(4-морфолин-4-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
44) [1-(4-фторфенил)-1-метилэтил]амид 3-(4-морфолин-4-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
45) сложный трет-бутиловый эфир 4-{4-[5-(1-метил-1-фенилэтилкарбамоил)-1Н-тиено[2,3-c]пиразол-3-илкарбамоил]бензил}пиперазин-1-карбоновой кислоты;
46) (1-метил-1-фенилэтил)амид 3-[4-(4-фторпиперидин-1-илметил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
47) (1-метил-1-фенилэтил)амид 3-(4-пиперазин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
48) (1-метил-1-фенилэтил)амид 3-(4-имидазол-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
49) (1-метил-1-фенилэтил)амид 3-(4-тиазолидин-3-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
50) [1-(3-фторфенил)-1-метилэтил]амид 3-(4-пирролидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
51) [1-(3-фторфенил)-1-метилэтил]амид 3-(4-пиперидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
52) [1-(2-фторфенил)-1-метилэтил]амид 3-(4-пиперидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
53) (1-метил-1-фенилэтил)амид 3-(4-азетидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
54) [1-(2-фторфенил)-1-метилэтил]амид 3-(4-азетидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
55) [1-(3-фторфенил)-1-метилэтил]амид 3-(4-азетидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
56) [1-(4-фторфенил)-1-метилэтил]амид 3-(4-азетидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
57) (1-метил-1-фенилэтил)амид 3-[4-(4-трет-бутилпиперазин-1-илметил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
58) [1-(4-фторфенил)-1-метилэтил]амид 3-(4-пирролидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
59) [1-(4-фторфенил)-1-метилэтил]амид 3-(4-пиперидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
60) (1-метил-1-фенилэтил)амид 3-фенилацетиламино-1Н-тиено[2,3-с]пиразол-5-карбоновой кислоты;
61) (1-метил-1-фенилэтил)амид 3-(4-диметиламинометилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
62) (1-метил-1-фенилэтил)амид 3-(4-циклопропиламинометилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
63) (1-метил-1-фенилэтил)амид 3-(4-циклобутиламинометилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
64) (1-метил-1-фенилэтил)амид 3-{4-[(изопропилметиламино)метил]бензоиламино}-1Н-тиено[2,3-с]пиразол-5-карбоновой кислоты;
65) (1-метил-1-фенилэтил)амид 3-(4-циклопентиламинометилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
66) (1-метил-1-фенилэтил)амид 3-{4-[(диизопропиламино)метил]бензоиламино}-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
67) (1-метил-1-фенилэтил)амид 3-(4-аминометилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
68) [1-(2-фторфенил)-1-метилэтил]амид 3-(4-пирролидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
69) [1-(2-метоксифенил)-1-метилэтил]аьшф 3-(4-пирролидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
70) [1-(3-метоксифенил)-1-метилэтил]амид 3-(4-пирролидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
71) [1-(4-метоксифенил)-1-метилэтил]амид 3-(4-пирролидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
72) [1-(4-метоксифенил)-1-метилэтил]амид 3-(4-пиперидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
73) [1-(3-метоксифенил)-1-метилэтил]амид 3-(4-пиперидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
74) [1-(2-метоксифенил)-1-метилэтил]амид 3-(4-пиперидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
75) [1-(2-метоксифенил)-1-метилэтил]амид 3-(4-азетидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
76) [1-(3-метоксифенил)-1-метилэтил]амид 3-(4-азетидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
77) [1-(4-метоксифенил)-1-метилэтил]амид 3-(4-азетидин-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
78) [1-(4-метоксифенил)-1-метилэтил]амид 3-(4-морфолин-4-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
79) [1-(3-метоксифенил)-1-метилэтил]амид 3-(4-морфолин-4-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
80) [1-(2-метоксифенил)-1-метилэтил]амид 3-(4-морфолин-4-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
81) [1-метил-1-(2-метоксифенил)этил]амид 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
82) [1-метил-1-(3-метоксифенил)этил]амид 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
83) [1-метил-1-(4-метоксифенил)этил]амид 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
84) [1-метил-1-(2-фторфенил)этил]амид 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
85) [1-метил-1-(3-фторфенил)этил]амид 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
86) [1-метил-1-(4-фторфенил)этил]амид 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
87) [1-метил-1-(2-фторфенил)этил]амид 3-({4-[(1-метилпиперидин-4-ил)окси]бензоил}амино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
88) [1-метил-1-(3-фторфенил)этил]амид 3-({4-[(1-метилпиперидин-4-ил)окси]бензоил}амино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
89) [1-метил-1-(4-фторфенил)этил]амид 3-({4-[(1-метилпиперидин-4-ил)окси]бензоил}амино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
90) [1-метил-1-(4-метоксифенил)этил]амид 3-({4-[(1-метилпиперидин-4-ил)окси]бензоил}амино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
91) [1-метил-1-(3-метоксифенил)этил]амид 3-({4-[(1-метилпиперидин-4-ил)окси]бензоил}амино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
92) [1-метил-1-(2-метоксифенил)этил]амид 3-({4-[(1-метилпиперидин-4-ил)окси]бензоил}амино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
93) [1-(2-фторфенил)-1-метилэтил]амид 3-(4-циклопропиламинометилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
94) [1-(2-метоксифенил)-1-метилэтил]амид 3-(4-циклопропиламинометилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
95) [1-(2-фторфенил)-1-метилэтил]амид 3-[4-(изопропиламинометил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
96) [1-(2-метоксифенил)-1-метилэтил]амид 3-[4-(изопропиламинометил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
97) (1-метил-1-фенилэтил)амид 3-(4-азепан-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
98) [1-(2-фторфенил)-1-метилэтил]амид 3-(4-азепан-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
99) (1-метил-1-фенилэтил)амид 3-(4-пиразол-1-илметилбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
100) (1-метил-1-фенилэтил)амид 3-(4-метоксибензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
101) (1-метил-1-фенилэтил)амид 3-(3-метоксибензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
102) (1-метил-1-фенилэтил)амид 3-(2-метоксибензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
103) (1-метил-1-фенилэтил)амид 3-(3-морфолин-4-илбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
104) (1-метил-1-фенилэтил)амид 3-[4-(4-метилпиперазин-1-ил)бензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
105) (1-метил-1-фенилэтил)амид 3-(4-диметиламинобензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
106) (1-метил-1-фенилэтил)амид 3-[(фуран-3-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
107) (1-метил-1-фенилэтил)амид 3-[(тиофен-3-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
108) (1-метил-1-фенилэтил)амид 3-[(1-метил-1Н-пиррол-3-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
109) (1-метил-1-фенилэтил)амид 3-[(1-метил-1Н-пиразол-3-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
110) (1-метил-1-фенилэтил)амид 3-[(1-метил-1Н-пиразол-5-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
111) (1-метил-1-фенилэтил)амид 3-[(пиридин-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
112) (1-метил-1-фенилэтил)амид 3-[(пиридин-3-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
113) (1-метил-1-фенилэтил)амид 3-[(пиридин-4-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
114) (1-метил-1-фенилэтил)амид 3-(4-хлорбензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
115) (1-метил-1-фенилэтил)амид 3-(4-феноксибензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
116) [1-(2-метоксифенил)-1-метилэтил]амид 3-(4-морфолин-4-илбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
117) [1-(4-метоксифенил)-1-метилэтил]амид 3-(4-морфолин-4-илбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
118) [1-(2-метоксифенил)-1-метилэтил]амид 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
119) [1-(3-метоксифенил)-1-метилэтил]амид 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
120) [1-(4-метоксифенил)-1-метилэтил]амид 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
121) (1-этил-1-фенилпропил)амид 3-[(тиофен-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
122) (1-фенилциклопентил)амид 3-[(тиофен-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
123) [1-(2-фторфенил)-1-метилэтил]амид 3-[(тиофен-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
124) [1-(3-фторфенил)-1-метилэтил]амид 3-[(тиофен-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
125) ((S)-2-морфолин-4-ил-1-фенилэтил)амид 3-(4-трифторметоксибензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
126) [1-(2-фторфенил)-1-метилэтил]амид 3-[4-(2-диметиламиноэтокси)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
127) (1-метил-1-фенилэтил)амид 3-[4-(2-диметиламиноэтокси)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
128) ((S)-1-фенил-2-пиперидин-1-илэтил)амид 3-(4-фторбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
129) (1-этил-1-фенилпропил)амид 3-(4-морфолин-4-илбензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
130) ((S)-1-фенил-2-пиперидин-1-илэтил)амид 3-[(тиофен-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
131) (1-фенилциклопентил)амид 3-(4-морфолин-4-илбензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
132) [1-(3-хлорфенил)-1-метилэтил]амид 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
133) [1-(3-хлорфенил)-1-метилэтил]амид 3-(4-фторбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
134) (1-фенилциклопропил)амид 3-(4-метоксибензоиламино)-1Н-тиеню[2,3-c]пиразол-5-карбоновой кислоты;
135) (1-фенилциклопропил)амид 3-(4-трифторметоксибензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
136) (1-метил-1-фенилэтил)амид 3-[(6-морфолин-4-ил-пиридин-3-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
137) ((S)-1-метил-2-морфолин-4-ил-1-фенилэтил)амид 3-(4-морфолин-4-илбензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
138) (1-метил-1-пиридин-4-илэтил)амид 3-(4-морфолин-4-илбензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
139) [1-(4-фторфенил)-1-метилэтил]амид 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
140) [1-(3-метоксифенил-1-метилэтил]амид 3-(4-морфолин-4-илбензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
141) [1-(2-фторфенил)-1-метилэтил]амид 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
142) [1-(3-фторфенил)-1-метилэтил]амид 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
143) (1-метил-1-фенилэтил)амид 3-(4-метансульфонилбензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
144) (1-метил-1-фенилэтил)амид 3-[4-(1,1-диоксотиоморфолин-4-ил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
145) [1-метил-1-(3-пирролидин-1-илфенил)этил]амид 3-(4-морфолин-4-илбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
146) [1-метил-1-(3-пирролидин-1-илфенил)этил]амид 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
147) [1-(3-метансульфонилфенил)-1-метилэтил]амид 3-(4-морфолин-4-илбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
148) [1-(2-фторфенил)-1-метилэтил]амид 3-(4-морфолин-4-илбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
149) [1-(3-фторфенил)-1-метилэтил]амид 3-(4-морфолин-4-илбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
150) [1-(4-фторфенил)-1-метилэтил]амид 3-(4-морфолин-4-илбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
151) [1-(4-фторфенил)-1-метилэтил]амид 3-[(тиофен-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
152) [1-(2-метоксифенил)-1-метилэтил]амид 3-[(тиофен-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
153) [1-(3-метоксифенил)-1-метилэтил]амид 3-[(тиофен-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
154) [1-(4-метоксифенил)-1-метилэтил]амид 3-[(тиофен-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
155) [1-(2-фторфенил)-1-метилэтил]амид 3-[(фуран-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
156) [1-(3-фторфенил)-1-метилэтил]амид 3-[(фуран-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
157) [1-(4-фторфенил)-1-метилэтил]амид 3-[(фуран-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
158) [1-(2-метоксифенил)-1-метилэтил]амид 3-[(фуран-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
159) [1-(2-фторфенил)-1-метилэтил]амид 3-[(1-метил-1Н-пиразол-5-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
160) [1-(2-метоксифенил)-1-метилэтил]амид 3-[(1-метил-1Н-пиразол-5-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
161) [1-(4-фторфенил)-1-метилэтил]амид 3-[(1-метил-1Н-пиразол-5-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
162) [1-(2-фторфенил)-1-метилэтил]амид 3-[(1-метил-1Н-пиразол-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
163) [1-(2-фторфенил)-1-метилэтил]амид 3-[(1-метил-1Н-пиразол-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
164) [1-(2-метоксифенил)-1-метилэтил]амид 3-[(1-метил-1Н-пиразол-2-карбонил)амино]-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
165) ((R)-1-фенилэтил)амид 3-(4-морфолин-4-илбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
166) ((S)-1-фенилэтил)амид 3-(4-морфолин-4-илбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
167) (1-метил-1-фенилэтил)амид (3-бензоиламино)-1Н-тиено[2,3-с]пиразол-5-карбоновой кислоты;
168) (1-метил-1-фенилэтил)амид 3-(3-фторбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты;
169) (1-метил-1-фенилэтил)амид 3-(2-фторбензоиламино)-1Н-тиено[2,3-c]пиразол-5-карбоновой кислоты.
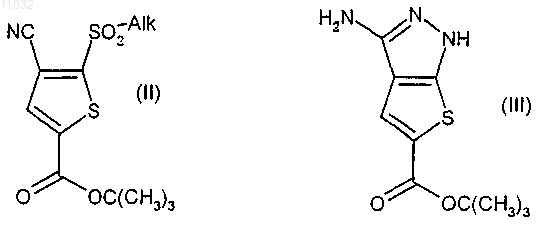
19. Способ получения производных 1Н-тиено[2,3-c]пиразола формулы (I) и их фармацевтически приемлемых солей по п.9, включающий:
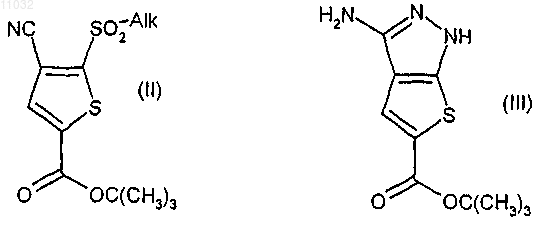
а) взаимодействие соединения формулы (II), где Alk означает низшую алкильную группу, с гидразином или солью гидразина и взаимодействие полученного таким путем промежуточного соединения в кислотных условиях с получением соединения формулы (III)
(b) взаимодействие соединения формулы (III) с любым подходящим агентом, защищающим пиразольный атом азота, с получением соединения формулы (IV) в любой из его таутомерных форм (IVa) или (IVb)
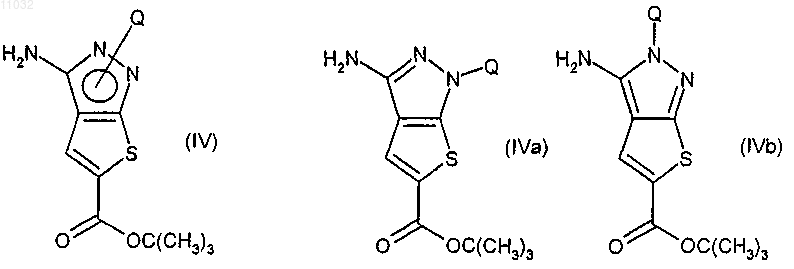
и где Q представляет указанную защитную группу;
с) ацилирование соединения формулы (IV) соединением формулы (V), где R представляет собой определенную в п.9 группу и Z представляет подходящую уходящую группу, с получением соединения формулы (VI)

d) селективный гидролиз трет-бутил-кабоксиэфирной группы с получением соединения формулы (VII)
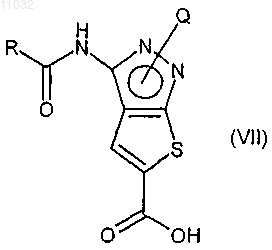
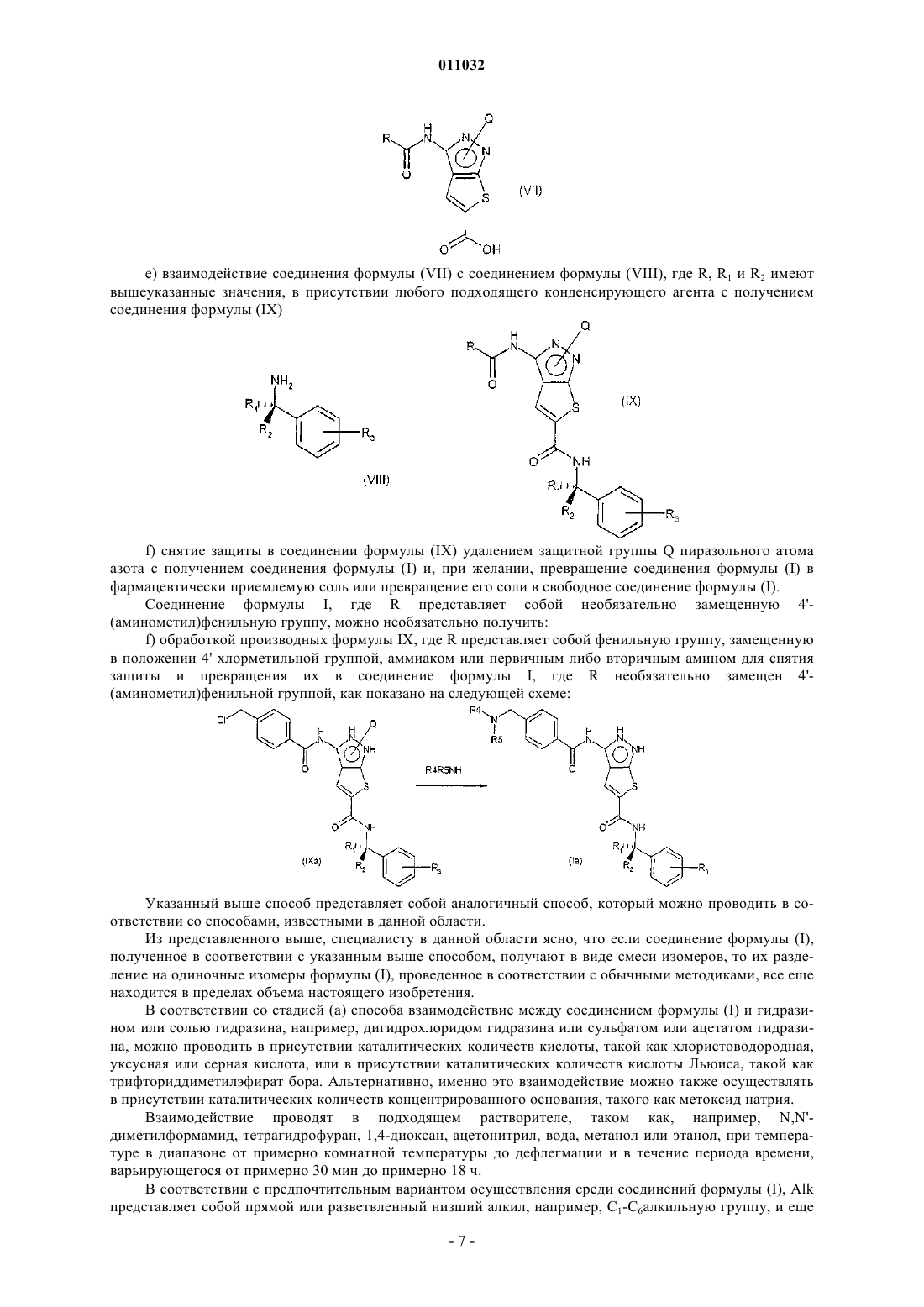
е) взаимодействие соединения формулы (VII) с соединением формулы (VIII), где R1, R2 и R3 имеют значения, указанные в п.9, в присутствии любого подходящего конденсирующего агента с получением соединения формулы (IX)
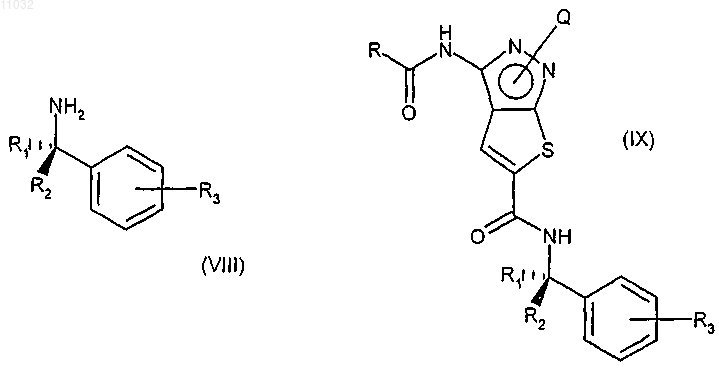
f) снятие защиты в соединении формулы (IX) удалением защитной группы Q пиразольного атома азота с получением соединения формулы (I) и, при желании, превращение соединения формулы (I) в фармацевтически приемлемую соль или превращение его соли в свободное соединение формулы (I).
20. Способ по п.19, где в соединении формулы (II) Alk представляет этил.
21. Способ по п.19, где в соединении формулы (IV) Q представляет этоксикарбонильную группу (-COOEt).
22. Способ получения производных 1Н-тиено[2,3-c]пиразола формулы (I) и их фармацевтически приемлемых солей по п.9, включающий:
а') взаимодействие соединения формулы (III), полученного на стадии (а) п.19, с избытком соединения формулы (V), где R имеет значения, определенные в п.9, и Z представляет подходящую уходящую группу, с получением соединения формулы (X)

b') снятие защиты в соединении формулы (X) у пиразольного атома азота в соответствии со стадией (f) способа и дополнительное взаимодействие полученного соединения в соответствии с остальными стадиями (d) и (е) по п.19.
23. Способ по любому из пп.19 или 22, где в соединениях формулы (V) Z представляет атом хлора или брома.
24. Способ получения производных 1Н-тиено[2,3-c]пиразола формулы (I) и их фармацевтически приемлемых солей по п.9, включающий:
а) взаимодействие соединения формулы (II), где Alk означает низшую алкильную группу, с гидразином или солью гидразина и взаимодействие полученного таким путем промежуточного соединения в кислотных условиях с получением соединения формулы (III)
(b) взаимодействие соединения формулы (III) с любым подходящим агентом, защищающим пиразольный атом азота, с получением соединения формулы (IV) в любой из его таутомерных форм (IVa) или (IVb)
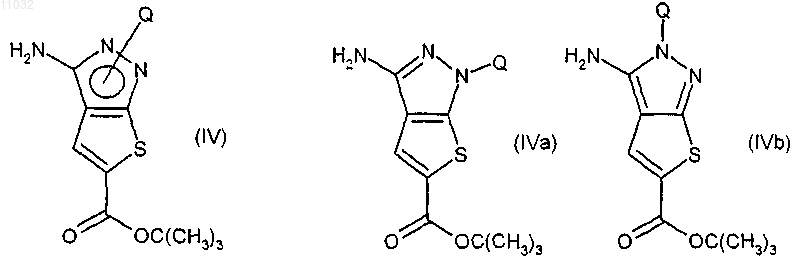
и где Q представляет указанную защитную группу;
с) ацилирование соединения формулы (IV) соединением формулы (V), где R представляет собой группу, определенную в п.9, и Z представляет подходящую уходящую группу, с получением соединения формулы (VI)
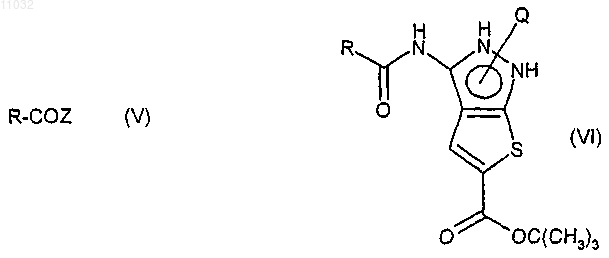
d) селективный гидролиз трет-бутилкарбоксиэфирной группы с получением соединения формулы (VII)
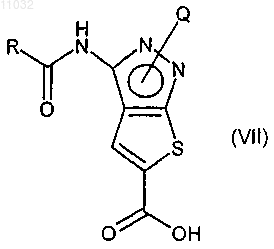
е) взаимодействие соединения формулы (VII) с соединением формулы (VIII), где R1, R2 и R3 имеют значения, указанные в п.9, в присутствии любого подходящего конденсирующего агента с получением соединения формулы (IX)
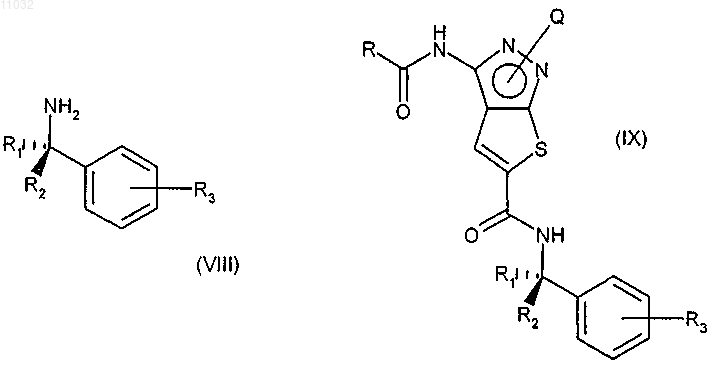
f) обработку соединения формулы IX, где R представляет собой фенильную группу, замещенную в положении 4' хлорметильной группой, аммиаком или первичным или вторичным амином для снятия защиты и превращения их в соединение формулы (I), где R представляет собой необязательно замещенную 4'-(аминометил)фенильную группу
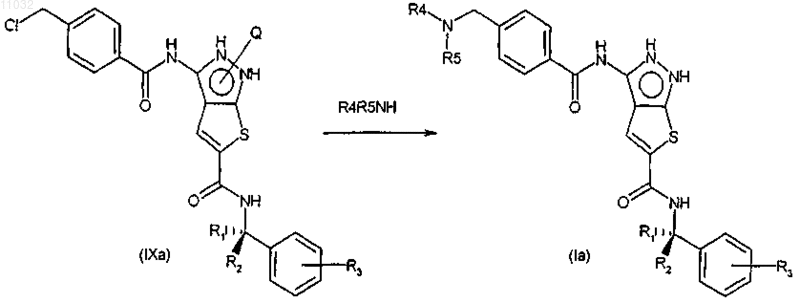
25. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли по п.9 и по меньшей мере один фармацевтически приемлемый эксципиент, носитель и/или разбавитель.
26. Фармацевтическая композиция по п.25, дополнительно содержащая одно или более химиотерапевтических средств.
27. Применение соединения формулы (I) или его фармацевтически приемлемой соли по п.9 в качестве лекарственного средства.
28. Применение соединения формулы (I) или его фармацевтически приемлемой соли по п.9 при изготовлении лекарственного средства с противоопухолевой активностью.
Текст
011032 Область изобретения Настоящее изобретение относится к производным тиенопиразола, к способу их получения, к фармацевтическим композициям, включающим их и к их применению в качестве терапевтических средств, в частности, при лечении рака и клеточных пролиферативных расстройств. Обсуждение предшествующего уровня техники Нарушение функции протеинкиназ (РК) является отличительной чертой многочисленных заболеваний. Большое количество онкогенов и прото-онкогенов, участвующих в развитии различных видов рака у людей, кодируют РК. С повышением активности РК также связаны многие незлокачественные заболевания, такие как доброкачественная гиперплазия предстательной железы, наследственный аденоматоз,полипоз, нейрофиброматоз, псориаз, связанная с атеросклерозом пролиферация гладкомышечных клеток сосудов, пневмосклероз, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз. РК также участвуют в воспалительных состояниях и в размножении вирусов и паразитов. РК могут также играть важную роль в патогенезе и развитии нейродегенеративных расстройств. Обзор нарушения функции или нарушения регуляции РК можно найти, например, в публикацииCurrent Option in Chemical Biology, 1999, 3, 459-465. Среди нескольких протеинкиназ, которые, как известно в данной области, участвуют в росте раковых клеток, имеются киназы Aurora, в частности, Aurora-2. Было обнаружено, что Aurora-2 избыточно экспрессирована в ряде различных типов опухолей. Ее генный локус картируется у 20ql3, область хромосомы, часто амплифицированной при многих видах рака, включая рак молочной железы [Cancer Res. 1999, 59(9), 2041-4] и толстой кишки. Амплификация 20q13 коррелируется с неблагоприятным прогнозом у пациентов, страдающих раком молочной железы без поражения лимфоузлов, и увеличенная экспрессия Aurora-2 является показателем неблагоприятного прогноза и уменьшает время выживания у пациентов, страдающих раком мочевого пузыря [J. Natl. Cancer Inst., 2002, 94(17), 1320-9]. Обзор роли Aurora-2 в нарушенной функции центросомы при раке можно также найти в публикациях Molecular Cancer Therapeutics, 2003, 2, 589-595 и Curr.Opin. Genet.Dev. 2004, 14(1), 29-36. Краткое описание сущности изобретения Предметом настоящего изобретения являются соединения, которые можно использовать при лечении в качестве средств против заболеваний хозяина, вызванных и/или связанных с нарушением регуляции активности протеинкиназ, конкретнее, активности киназ Aurora. Еще одним предметом настоящего изобретения являются соединения, которые обладают ингибирующей активностью в отношении протеинкиназы, конкретнее, ингибирующим действием в отношении киназ Aurora. Изобретатели в настоящее время обнаружили, что некоторые соединения тиенопиразола и их производные обладают ингибирующей активностью в отношении протеинкиназы, например, ингибирующей активностью в отношении киназ Aurora. Конкретнее, соединения по настоящему изобретению можно использовать при лечении разнообразных форм рака, включая, но не ограничиваясь, карциному, такую как карцинома мочевого пузыря, молочной железы, толстой кишки, почки, печени, легкого, включая мелкоклеточный рак легкого, пищевода, желчного пузыря, яичника, поджелудочной железы, желудка, шейки матки, щитовидной железы,предстательной железы и кожи, включая плоскоклеточную карциному; гемопоэтические опухоли лимфоидной линии дифференцировки, включая лейкоз, острый лимфолейкоз, острый лимфобластический лейкоз, В-клеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому,ретикулоэндотелиозную лимфому и лимфому Буркетта; гематопэтические опухоли миелоидной линии дифференцировки, включая острые и хронические миелогенные лейкозы, миелодиспластический сидром и промиелоцитарный лейкоз; опухоли мезенхимального происхождения, включая фибросаркому и рабдомиосаркому; опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому и шванномы; другие опухоли, включая меланому, семиному, тератокарциному, остеосаркому, пигментозную ксеродермию, кертаноксантому, фолликулярный рак щитовидной железы и саркому Капоши. Ввиду ключевой роли РК и киназ Aurora в регуляции клеточной пролиферации, эти производные тиенопиразола можно также использовать при лечении разнообразных клеточных пролиферативных расстройств, таких как, например, доброкачественная гиперплазия предстательной железы, наследственный аденоматоз, полипоз, нейрофиброматоз, псориаз, связанная с атеросклерозом пролиферация гладкомышечных клеток сосудов, пневмосклероз, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз. Соответственно, в первом аспекте осуществления, настоящее изобретение представляет собой способ лечения клеточных пролиферативных расстройств, вызванных и/или связанных с измененной активностью протеинкиназ, который включает введение нуждающемуся в нем млекопитающему эффективного количества соединения формулы (I)R представляет собой необязательно замещенную арильную или гетероарильную группу;R1 и R2 одинаковые или различные, независимо друг от друга представляют собой атом водорода,прямой или разветвленный C1-С 3 алкил или группу -CONH2 или -CH2NR'R или, взятые вместе с атомом углерода, с которым они связаны, R1 и R2 могут образовывать С 3-С 6 циклоалкильную группу; при условии, что, по меньшей мере, один из R1 и R2 не представляет собой атом водорода; R' и R одинаковые или различные, независимо друг от друга представляют собой атом водорода, прямую или разветвленную C1 С 3 алкильную группу или, взятые вместе с атомом азота, с которым они связаны, R' и R могут образовывать гетероциклическое кольцо формулы где R представляет собой атом водорода или прямую или разветвленную C1-С 3 алкильную группу;R3 представляет собой галоген или атом галогена или группу, выбранную из гидрокси, циано, прямого или разветвленного C1-С 3 алкила или C1-С 3 алкокси; или его изомеров, таутомеров, носителей, метаболитов, пролекарств и фармацевтически приемлемых солей. Описанный выше способ обеспечивает возможность лечения клеточных пролиферативных расстройств, вызванных и/или связанных с измененной активностью киназ Aurora. В предпочтительном варианте осуществления описанного выше способа, клеточное пролиферативное расстройство представляет собой рак. Определенные типы рака, которые можно лечить, включают карциному, плоскоклеточную карциному, гематопоэтические опухоли миелоидной или лимфоидной линии дифференцировки, опухоли мезенхимального происхождения, опухоли центральной и периферической нервной системы, меланому,семиному, тератокарциному, остеосаркому, пигментозную ксеродермию, кертаксантому, фолликулярный рак щитовидной железы и саркому Капоши. Предметом настоящего изобретения также является соединение формулы (I)R представляет собой необязательно замещенную арильную или гетероарильную группу;R1 и R2 одинаковые или различные, независимо друг от друга представляют собой атом водорода,прямой или разветвленный C1-С 3 алкил или группу -CONH2 или -CH2NR'R или, взятые вместе с атомом углерода, с которым они связаны, R1 и R2 могут образовывать С 3-С 6 циклоалкильную группу при условии, что по меньшей мере один из R1 и R2 не представляет собой атом водорода; R' и R одинаковые или различные, независимо друг от друга представляют собой атом водорода, прямую или разветвленную C1-2 011032 С 3 алкильную группу или, взятые вместе с атомом азота, с которым они связаны, R' и R могут образовывать гетероциклическое кольцо формулы где R представляет собой атом водорода или прямую или разветвленную C1-С 3 алкильную группуR3 представляет собой атом водорода или галогена или группу, выбранную из гидрокси, циано, прямого или разветвленного C1-С 3 алкила или C1-С 3 алкокси; или его изомеры, таутомеры, носители, метаболиты, пролекарства и фармацевтически приемлемые соли. Настоящее изобретение также включает способы синтеза тиенопиразольных соединений формулы(I) и их фармацевтически приемлемых солей, а также содержащие их фармацевтические композиции. Более полная оценка изобретения и многих преимуществ, связанных с ним, станет возможной после лучшего его понимания при прочтении следующего подробного описания. Подробное описание изобретения Из предшествующего уровня техники известны несколько гетероциклических соединений в качестве ингибиторов протеинкиназы. В качестве примера, производные 2-карбоксамидопиразола и 2 уреидопиразола были раскрыты в качестве ингибиторов протеинкиназы в международных патентных заявках WO 01/12189, WO 01/12188, WO 02/48114 и WO 02/70515, все на имя самого заявителя. Конденсированные бициклические соединения, включающие пиразольные фрагменты, и обладающие ингибирующей активностью в отношении киназы, были также раскрыты в заявках WO 00/69846, WO 02/12242,WO 03/028720, WO 03/097610, а также в WO 2004007504 и WO 2004013146 (соответственно претендующих на приоритет заявки US 60/396174 от 17 июля 2002 г и заявки US 60/398121 от 25 июля 2002 г.), все на имя самого заявителя. Кроме того, производные 5-фенилсульфонилтиено[2,3-с]пиразола также известны в данной области в качестве синтетических промежуточных соединений с получением более сложных гетероциклических структур, по сообщению в публикации Monatshefte fur Chemie 128, 687-696 (1997). Соединения по настоящему изобретению подпадают под объем общей формулы указанной выше заявки WO2004013146, но конкретно в ней не проиллюстрированы. Соединения формулы (I) по изобретению имеют асимметричные атомы углерода и могут поэтому существовать в виде отдельных оптических изомеров, в виде рацемических смесей или в виде любой другой смеси, в составе которой преобладает один из двух оптических изомеров, предназначенных для включения в пределы объема настоящего изобретения. Аналогичным образом, применение в качестве противоопухолевого средства всех возможных изомеров и их смесей и обоих метаболитов и фармацевтически приемлемых биологических предшественников (иначе именуемых пролекарствами) соединений формулы (I) также находится в пределах объема настоящего изобретения. Пролекарства представляют собой любые ковалентно связанные соединения, которые in vivo высвобождают активный материнский препарат в соответствии с формулой (I). В случаях, когда соединения могут существовать в таутомерных формах, предусмотрено, что каждая форма соединения, существующего или в равновесии, или преимущественно в одной форме, включена в пределы этого изобретения. Таким образом, при отсутствии других указаний, когда указана только одна из следующих таутомерных форм формулы (Ia) или (Ib), остающаяся форма все же предназначена для включения в пределы объема изобретения:-3 011032 В контексте настоящего изобретения, при отсутствии других определений, под термином арильная группа подразумевают любую ароматическую карбоциклическую кольцевую систему, содержащую 1 или 2 кольцевых фрагмента, или конденсированных, или связанных друг с другом посредством простой связи, например, включающую фенильную, - или -нафтильную или бифенильную группы. Под термином гетероарил заявители подразумевают любое ароматическое гетероциклическое кольцо, которое может включать необязательно бензоконденсированный 5- или 6-членный гетероцикл с 1-3 гетероатомами, выбранными среди N, О или S. Таким образом, не ограничивающие примеры гетероарильных групп в соответствии с изобретением могут включать, например, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, имидазолил, тиазолил, изотиазолил, пирролил, фенилпирролил, фурил, фенилфурил, оксазолил, изоксазолил, пиразолил,тиенил, бензотиенил, изоиндолинил, бензоимидазолил, хинолинил, изохинолинил, 1,2,3-тиазолил, 1 фенил-1,2,3-тиазолил и им подобные. Под термином прямой или разветвленный C1-С 3 алкил или C1-С 3 алкокси подразумевают любую из групп, таких как метил, этил, н-пропил, изопропил, метокси, этокси, н-пропокси и изопропокси. Под термином атом галогена подразумевают атом фтора, хлора, брома и иода. Под термином С 3 С 6 циклоалкил подразумевают любую группу, такую как циклопропил, циклобутил, циклопентил или циклогексил. Ясно, что, поскольку одинаковые циклоалкильные группы могут образовываться, когда R1 и R2 взяты вместе с атомом углерода, к которому они присоединены, то, таким образом, можно получить циклические спиро-соединения. Только в качестве примера, когда R1 и R2 вместе образуют циклопентильную группу, рассматривают производные, имеющие следующую общую формулу: При рассмотрении производных формулы (I), где R1 или R2 представляет группу -CH2NR' R, и R' иR связаны вместе с атомом азота, к которому они присоединены, таким образом, могут быть образованы гетероциклические фрагменты в соответствии с общей формулой. Только в качестве примера, рассматривая R1 в качестве водорода, и R2 в качестве группы -CH2NR'R, при R' и R, связанных вместе с образованием пирролидинил-1-ильной группы, рассматривают соединения, имеющие следующую общую формулу: Из всего сказанного выше, специалисту в данной области ясно, что соединения формулы (I) по изобретению характеризуются присутствием фрагмента, далее просто именуемого бензиламиновым остатком, где метиленовая группа обязательно замещена по меньшей мере одной из двух групп R1 или R2, не представляющей собой водород. В соответствии со значениями, представленными для R, любая из представленных выше арильной или гетероарильной групп может быть необязательно, кроме того, замещена в любом из их свободных положений одной или более группами, например, 1-6 группами, выбранными из: галогена, нитро, карбокси, циано, алкила, полифторированного алкила, алкенила, алкинила, циклоалкинила, циклоалкенила,арила, гетероциклила, алкилгетероциклила, гетероциклилалкила, аминоалкила, аминогрупп и их производных, таких как, например, алкиламино, диалкиламино, ариламино, диариламино, уреидо, алкилуреидо или арилуреидо; карбониламиногрупп и их производных, таких как, например, формиламино, алкилкарбониламино, алкенилкарбониламино, арилкарбониламино, алкоксикарбониламино; гидроксигруппа-4 011032 ми и их производными, такими как, например, алкокси, полифторированной алкокси, арилокси, гетероциклилокси, алкикарбонилокси, арилкарбонилокси, циклоалкенилокси или алкилиденаминокси; карбонильными группами и их производных, таких как, например, алкилкарбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, циклоалкилоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил; сульфированными производными, такими как, например, алкилтио, арилтио, алкилсульфонил, арилсульфонил, алкилсульфонил, арилсульфинил, арилсульфонилокси, аминосульфонил, алкиламиносульфонил или диалкиламиносульфонил. В свою очередь, когда это целесообразно, каждый из указанных выше заместителей может быть,кроме того, замещен одной или более из указанных выше групп. Под термином алкильная или алкокси группа при отсутствии других определений подразумевают любую прямую или разветвленную С 1-С 6 алкильную или алкокси группу, следовательно, охватывающие указанные выше C1-С 3 алкильную или алкокси группы, а также включающие н-бутил, изобутил, вторбутил, трет-бутил, н-пентил, н-гексил, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентилокси,н-гексилокси и им подобные. Под термином алкенильная или алкинильная группа при отсутствии других определений подразумевают любую ненасыщенную прямую или разветвленную С 2-С 6 алкенильную или алкинильную группу, такую как, например, винил, аллил, 1-пропенил, изопропенил, 1-, 2- или 3-бутенил, пентенил, гексенил, этинил, 1- или 2-пропинил, бутинил, пентинил, гексинил и им подобные. Под термином полифторированный алкил или алкокси подразумевают любую прямую или разветвленную C1-С 6 алкильную или алкокси группу, как определено выше, где более чем один атом водорода замещен атомами фтора, такую как, например, трифторметил, трифторметокси, 2,2,2-трифторэтил,2,2,2-трифторэтокси, 1,2-дифторэтил, 1,1,1,3,3,3-гексафторпропил-2-ил и им подобные. Под термином гетероцикл, гетероциклил или гетероциклическая группа также подразумевают необязательно бензоконденсированный 4-7-членный гетероцикл, следовательно, охватывающий ароматические гетероциклические группы, также известные как гетероарильные группы, или насыщенные, или частично ненасыщенные, с 1-3 гетероатомами, выбранными среди N, О и S. Примерами этих 4-7-членных гетероциклических групп являются, например, 1,3-диоксолан, пиран,пирролидин, пирролин, имидазолин, имидазолидин, пиразолидин, пиразолин, пиперидин, пиперазин,морфолин, тетрагидрофуран, гексаметиленимин,1,4-гексагидродиазепин, азетидин и им подобные. Под термином циклоалкенил подразумевают любую из указанных выше С 3-С 6 циклоалкильных групп, кроме того, включающих двойную связь, таких как, например, 2-циклопентен-1-ил, 3 циклопентен-1-ил, 1-циклогексен-1-ил, 2-циклогексен-1-ил, 3-циклогексен-1-ил и им подобные. Из всего сказанного выше специалисту в данной области ясно, что любая группа, название которой было идентифицировано как составное название, такая, например, как циклоалкилалкил, арилалкил, гетероциклоалкил, алкилтио, арилокси, арилалкилокси, алкилкарбонилокси и им подобные, следует рассматривать как обычно идентифицируемые по частям, из которых они получены. Так, в качестве примера, под термином алкоксигетероциклиларил подразумевается прямая или разветвленная алкильная группа, замещенная гетероциклилом, кроме того, замещенным алкокси, где алкил, гетероциклил и алкокси представляют собой группы, определенные выше. Аналогичным образом, под термином алкилгетероциклилокси подразумевается гетероциклилокси группа, кроме того, замещенная алкилом. Термин фармацевтически приемлемые соли охватывает соли, обычно используемые для образования солей щелочных металлов и для образования аддитивных солей свободных кислот или свободных оснований. Природа соли не имеет решающего значения, при условии, что она фармацевтически приемлема. Подходящие фармацевтически приемлемые кислотно-аддитивные соли соединений по настоящему изобретению можно получить из неорганической и органической кислоты. Примерами таких неорганических кислот являются хлористо-водородная, бромисто-водородная, иодисто-водородная, азотная,угольная, серная и фосфорная кислота. Соответствующие органические кислоты можно выбрать из алифатических, циклоалифатических, ароматических, арилалифатических, гетероциклических, карбоновых и сульфоновых органических кислот, примерами которых являются муравьиная, уксусная, трифторуксуная, пропионовая, янтарная, гликолевая, глюконовая, молочная, яблочная, винная, лимонная, аскорбиновая, глюкуроновая, малеиновая, фумаровая, пировиноградная, аспарагиновая, глутаминовая, бензойная,антраниловая, мезиловая, салициловая, п-гидроксибензойная, фенилуксуная, миндальная, эмбоновая (памоевая), метансульфоновая, этансульфоновая, бензолсульфоновая, пантотеновая, толуолсульфоновая, 2 гидроксиэтансульфоновая, сульфанильная, стеариновая, циклогексиламиносульфоновая, альгеовая, гидроксимасляная, галактаровая и галактуроновая кислоты. Подходящие фармацевтически приемлемые соли присоединения оснований соединений по настоящему изобретению включают соли металлов, полученные из алюминия, кальция, лития, магния, калия, натрия и цинка, или органические соли, полученные из N,N'-дибензилэтилендиамина, хлорпрокаина, холина, диэтаноламина, этилендиамина, меглумина (Nметилглюкамина) и прокаина. Все эти соли можно получить обычными средствами из соответствующих соединений по настоящему изобретению, например, взаимодействием их с соответствующей кислотой или основанием. Предпочтительный класс соединений по изобретению представлен производными формулы (I), гдеR представляет собой группу, выбранную из тиенила, фурила, пирролила и фенила, необязательно дополнительно замещенную. Предпочтительнее в пределах указанного выше класса имеются производные формулы (I), где R представляет собой тиенил, фурил, N-метилпирролил, фенил и фенил, замещенный атомами галогена,гетероциклилами, аминоалкильными группами, гетероциклилокси или гетероциклилакильными группами. Еще предпочтительнее, в пределах указанного выше класса соединений формулы (I), R выбран из 2 тиенила, 2-фурила, 1-метилпирролил-2-ила, фенила, 4-фторфенила, 4-(1-метилпиперидил-4 илокси)фенила, 4-(1-метилпиперазинил-4-ил)фенила, 4-(1-метилпиперазинил-4-илметил)фенила, 4(пирролидин-1-ил)метилфенила,4-(пиперидин-1-ил)метилфенила,4-(1-метилпиперазин-4 ил)метилфенила,4-(морфолино-1-ил)метилфенила,4-(алкиламино)метилфенила,4(диалкиламино)метилфенила или 4-(морфолино-4-ил)фенила. Другой предпочтительный класс соединений по изобретению представлен производными формулы(I), где один из R1 или R2 представляет собой атом водорода или метильную группу, и остающийся один из R1 или R2 представляет собой метил, этил или группу -CH2NR'R, в которой R' и R представляют собой, как указано выше. Другой предпочтительный класс соединений по изобретению представлен производными формулы(I), где R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют С 3-С 6 циклоалкильную группу и, еще предпочтительнее, циклопропил или циклопентил. Другой предпочтительный класс соединений по изобретению представлен производными формулы(I), где R, R1 и R2 представляют собой указанные выше значения, и R3 представляет атом водорода, фтора или хлора или группу, выбранную из гидрокси, метокси или циано. Любое определенное соединение формулы (I) по изобретению, необязательно в форме фармацевтически приемлемой соли, представлено в следующем экспериментальном разделе. Как указано выше, еще одним предметом настоящего изобретения является способ получения соединений формулы (I) и их фармацевтически приемлемых солей, причем способ включает: а) взаимодействие соединения формулы (II), где Alk означает низший алкил, с гидразином или солью гидразина и взаимодействие полученного таким путем промежуточного соединения в кислотных условиях с получением соединения формулы (III)(b) взаимодействие соединения формулы (III) с любым подходящим агентом, защищающим атом азота, с получением соединения формулы (IV) в любой из его таутомерных форм (IVa) или (IVb) и где Q представляет указанную защитную группу; с) ацилирование соединения формулы (IV) соединением формулы (V), где R имеет вышеуказанные значения и Z представляет подходящую уходящую группу, с получением соединения формулы (VI)d) селективный гидролиз группы сложного трет-бутилового эфира с получением соединения формулы (VII) е) взаимодействие соединения формулы (VII) с соединением формулы (VIII), где R, R1 и R2 имеют вышеуказанные значения, в присутствии любого подходящего конденсирующего агента с получением соединения формулы (IX)f) снятие защиты в соединении формулы (IX) удалением защитной группы Q пиразольного атома азота с получением соединения формулы (I) и, при желании, превращение соединения формулы (I) в фармацевтически приемлемую соль или превращение его соли в свободное соединение формулы (I). Соединение формулы I, где R представляет собой необязательно замещенную 4'(аминометил)фенильную группу, можно необязательно получить:f) обработкой производных формулы IX, где R представляет собой фенильную группу, замещенную в положении 4' хлорметильной группой, аммиаком или первичным либо вторичным амином для снятия защиты и превращения их в соединение формулы I, где R необязательно замещен 4'(аминометил)фенильной группой, как показано на следующей схеме: Указанный выше способ представляет собой аналогичный способ, который можно проводить в соответствии со способами, известными в данной области. Из представленного выше, специалисту в данной области ясно, что если соединение формулы (I),полученное в соответствии с указанным выше способом, получают в виде смеси изомеров, то их разделение на одиночные изомеры формулы (I), проведенное в соответствии с обычными методиками, все еще находится в пределах объема настоящего изобретения. В соответствии со стадией (а) способа взаимодействие между соединением формулы (I) и гидразином или солью гидразина, например, дигидрохлоридом гидразина или сульфатом или ацетатом гидразина, можно проводить в присутствии каталитических количеств кислоты, такой как хлористоводородная,уксусная или серная кислота, или в присутствии каталитических количеств кислоты Льюиса, такой как трифториддиметилэфират бора. Альтернативно, именно это взаимодействие можно также осуществлять в присутствии каталитических количеств концентрированного основания, такого как метоксид натрия. Взаимодействие проводят в подходящем растворителе, таком как, например, N,N'диметилформамид, тетрагидрофуран, 1,4-диоксан, ацетонитрил, вода, метанол или этанол, при температуре в диапазоне от примерно комнатной температуры до дефлегмации и в течение периода времени,варьирующегося от примерно 30 мин до примерно 18 ч. В соответствии с предпочтительным вариантом осуществления среди соединений формулы (I), Alk представляет собой прямой или разветвленный низший алкил, например, C1-С 6 алкильную группу, и еще-7 011032 предпочтительнее С 1-С 4 алкильную группу. Предпочтительно стадию (а) проводят взаимодействием соединения формулы (II) с гидразингидратом в метаноле, этаноле или тетрагидрофуране при температуре в диапазоне от комнатной температуры до температуры дефлегмации. Полученное промежуточное соединение трет-бутил-4-циано-5 гидразинтиофен-2-карбоксилат можно или отделить от реакционной среды и далее переработать в соответствии с рабочими примерами, или, альтернативно, непосредственно переработать посредством циклизации с получением соединения формулы (III). Циклизацию проводят при температуре в диапазоне от примерно 15 до примерно 50 С в метаноле или этаноле и в присутствии каталитических количеств минеральной кислоты, такой как хлористо-водородная или серная кислота. В соответствии со стадией (b) способа полученное таким путем тиенопиразольное производное формулы (III) затем защищают, в соответствии с хорошо известными способами, у пиразольного атома азота. В качестве примера указанная выше защита может осуществляться алкилхлоркарбонатом в подходящем растворителе, таком как тетрагидрофуран, дихлорметан, хлороформ, ацетонитрил, толуол или их смеси, при температуре в диапазоне от примерно -5 до примерно 35 С и в течение периода времени,варьирующегося от примерно 30 мин до примерно 72 ч, в присутствии оппортунистического акцептора нейтронов, такого как триэтиламин или диизопропилэтиламин. В соответствии со стадией (с) способа, соединение формулы (IV) затем взаимодействует с любым подходящим ацилирующим агентом формулы (V) с получением соединения формулы (VI), обработкой в соответствии с хорошо известными в данной области способами получения карбоксамидных производных. Обычно в соединении формулы (V) Z предпочтительнее представляет атом брома или хлора. Взаимодействие проводят в подходящем растворителе, таком как, например, тетрагидрофуран, диметилформамид, дихлорметан, хлороформ, ацетонитрил, толуол или их смеси в диапазоне от примерно -10 С до примерно температуры дефлегмации и в течение периода времени, варьирующегося от примерно 30 мин до примерно 96 ч, в присутствии подходящего акцептора протонов, такого как триэтиламин, N,Nдиизопропилэтиламин или пиридин. Из изложенного выше, специалисту в данной области ясно, что указанная выше защита у пиразольного атома азота на стадии (b) имеет особое преимущество, поскольку она предотвращает ацилирование соединением формулы (IV) на стадии (с) у пиразольного атома азота. В соответствии со стадией (d) способа карбоксиэфирная функциональная группа соединения формулы (VII) селективно гидролизуется с тем, чтобы дать соответствующую карбоксигруппу. Взаимодействие проводят в кислотных условиях, предпочтительно в присутствии хлористоводородной кислоты в диоксане, работой при комнатной температуре и в течение подходящего периода времени, например, до 72 ч. В соответствии со стадией (е) способа соединение формулы (VII) затем подвергают взаимодействию с любым подходящим аминопроизводным формулы (VIII) с тем, чтобы привести к получению соответствующего соединения формулы (IX). Из изложенного выше, специалисту в данной области ясно, что взаимодействие можно осуществить различными путями и рабочими условиями, которые широко известны в области получения карбоксамидов. В качестве примера, взаимодействие между соединениями формулы (VII) и (VIII) можно проводить в присутствии агента реакции сочетания, такого как, например, тетрафторборат 2-(1 Н-бензотриазол-1 ил)-1,1, 3,3-тетраметилурония (TBTU), 1,3-дициклогексилкарбодиимид, 1,3-диизопропилкарбодиимид, 1(3-диметиламинопропил)-3-этилкарбодиимид,N-циклогексилкарбодиимид-N'-пропилоксиметилполистирол или N-циклогексилкарбодиимид-N'-метилполистирол, в подходящем растворителе, таком как,например, дихлорметан, хлороформ, тетрагидрофуран, диэтиловый эфир, 1,4-диоксан, ацетонитрил, толуол или N,N-диметилформамид, при температуре в диапазоне от примерно -10 С до температуры дефлегмации и в течение подходящего периода времени, например, от примерно 30 мин до примерно 96 ч. Указанное взаимодействие необязательно проводят в присутствии подходящего катализатора, например,4-диметиламинопиридина, или в присутствии еще одного реагента соединения, такого как Nгидроксибензотриазол. Альтернативно, такое же взаимодействие можно также проводить, например, посредством методики смешанного ангидрида путем использования алкилхлорформиата, такого как этил, изобутил или изопропилхлорформиат, в присутствии третичного основания, такого как триэтиламин, N,Nдиизопропилэтиламин или пиридин, в подходящем растворителе, таком как, например, толуол, дихлорметан, хлороформ, тетрагидрофуран, ацетонитрил, диэтиловый эфир, 1,4-диоксан или N,Nдиметилформамид, при температуре в диапазоне от примерно -30 С до комнатной температуры. В соответствии со стадией (f) способа защиту соединения формулы (IX) снимают у пиразольного атома азота в основных условиях и доработкой в соответствии с обычными методиками, например, обработкой водным гидроксидом натрия или калия в присутствии подходящего совместного растворителя,такого как метанол, этанол, диметилформамид, 1,4-диоксан, или обработкой третичным амином, таким как триэтиламин или N,N-диизопропилэтиламин и использованием спирта, подобного метанолу или этанолу, в качестве растворителя. Снятие защиты может происходить при температуре в диапазоне от при-8 011032 мерно 18 С до температуры дефлегмации растворителя, в течение периода времени, варьирующегося от примерно 30 мин до примерно 72 ч. Наконец, в соответствии со стадией (f) способа, бензильный атом хлора соединения формулы (IXa) замещают обработкой аммиаком или первичным или вторичным амином в подходящем растворителе,подобном метанолу, этанолу, тетрагидрофурану, диметилформамиду при температуре в диапазоне от 0 С до температуры дефлегмации растворителя. В этих условиях также происходит одновременное удаление защитной группы у пиразольного атома азота. При желании, в соответствии со способами, хорошо известными в данной области, можно легко провести образование соли соединения формулы (I) или превращение его соответствующей соли в свободное соединение (I), в соответствии со стадией (f) способа. Как будет понятно специалисту в данной области, при получении соединений формулы (I), являющихся предметом изобретения, необходимо в соответствии с обычными методиками соответствующим образом защитить необязательно присутствующие функциональные группы как в исходных, так и в промежуточных соединениях, которые могут вызвать нежелательные побочные реакции. Аналогичным образом, в соответствии с известными процедурами удаления защиты, можно провести превращение этих последних указанных соединений в свободные соединения. Так, когда тиенопиразольное производное способа, защищенное у пиразольного атома азота, соответствующим образом функционализировано посредством образования карбоксамидной группы на стадиях (с) и (е) способа, то последующее снятие защиты может происходить в нежестких рабочих условиях, обеспечивающих, следовательно, возможность получения желаемого соединения формулы (I). По желанию, в соответствии с альтернативным вариантом осуществления изобретения, соединение формулы (III) стадии (а) может быть подвергнуто взаимодействию с избытком соединения формулы (V) обработкой, как указано на стадии (с), с тем, чтобы получить желательную функционализацию аминогруппы и, тем самым, защитить пиразольный атом азота. Поэтому еще одним предметом изобретения является способ получения соединений формулы (I) и их фармацевтически приемлемых солей, включающий: а) взаимодействие соединения формулы (III), полученного на стадии (а) способа, с избытком соединения формулы (V), где R имеет вышеуказанные значения и Z представляет подходящую уходящую группу, с получением соединения формулы (X)b) снятие защиты соединения формулы (X) у пиразольного атома азота, в соответствии со стадией(f) способа, и далее взаимодействие полученного соединения, в соответствии с оставшимися стадиями(d) и (е). Все соединения формул (II), (V) и (VIII) известны или их можно получить, в соответствии с известными способами. В качестве примера исходное соединение формулы (II), где Alk означает метил, можно легко получить следующим образом, исходя из коммерчески доступного этил-4-циано-5-(метилтио)тиофен-2 карбоксилата Гидролиз этоксикарбонильной группы проводят в соответствии с хорошо известными способами,например, в присутствии водных щелочных растворов, таких как водный гидроксид натрия. Аналогичным образом, этерификацию проводят, в соответствии с хорошо известными рабочими условиями, в присутствии алкилирующего агента, подобного трет-бутилбромиду или ди-трет-9 011032 бутилдикарбонату, в подходящем растворителе, таком как диметилформамид или тетрагидрофуран. Наконец, превращение алкилтиогруппы в алкилсульфонил можно провести в присутствии любого подходящего окисляющего агента, такого как, например, перекись водорода, 3-хлорпероксибензойная кислота или оксон, в подходящем растворителе, таком как, например, дихлорметан, ДМФА, ацетон, толуол, ацетонитрил, метанол, этанол, вода, уксусная кислота, при температуре в диапазоне от примерно-10 С до температуры дефлегмации и в течение периода времени, варьирующегося от примерно 30 мин до примерно 4 дней. Обзор способов получения соединений формулы (II) можно найти, например, в публикации J. Bioorg. Med. Chem. Lett. 11(2001), 915-918; EP-A-234622; а также в следующем экспериментальном разделе. Фармакология Соединения формулы (I) активны в качестве ингибиторов протеинкиназы, конкретнее, в качестве ингибиторов киназ Aurora, и поэтому их можно применять, например, для ограничения нерегулируемой пролиферации опухолевых клеток. В терапии их можно использовать при лечении различных опухолей, таких как указанные выше опухоли, а также при лечении других клеточных пролиферативных расстройств, таких как псориаз, пролиферация гладкомышечных клеток сосудов, связанная с атеросклерозом, и послеоперационный стеноз и рестеноз. Ингибирующую активность и эффективность отобранных соединений определяют посредством методики анализа, основанного на использовании технологии SPA (полиакрилата натрия) (Amersham Pharmacia Biotech). Анализ состоит в переносе меченой радиоактивной меткой фосфатной части киназой на биотинилированный субстрат. Полученному, меченому ЗЗР биотинилированному продукту дают возможность связаться с покрытыми стрептавидином шариками из SPA (способность связывания биотина 130 пкмоль/мг), и излучаемый свет измеряют в сцинтилляционном счетчике. Анализ ингибирования активности Aurora-2 Реакция киназы: 8 мкМ биотинилированного пептида (4 повтора LRRWSLG), 10 мкМ АТФ (0,5 мКи Р 33-АТФ), 7,5 нг ингибитора Aurora=2 в конечном объеме 30 мкл буфера (HEPES 50 мМ рН 7,0,MgCl2 10 мМ, 1 мМ DTT (дитиотрейтола), 0,2 мг/мл BSA (бычьего сывороточного альбумина), 3 мкМ ортованадата) добавляют в каждую лунку 96-луночного планшета с U-образным дном. Через 60 мин инкубации при комнатной температуре реакцию останавливают и биотинилированный пептид захватывают добавлением 100 мкл суспензии шариков. Стратификация: 100 мкл CSCl2 5M добавляют в каждую лунку и дают стоять 4 ч перед подсчетом радиоактивности на приборе Top-Count. Определение IC50: ингибиторы испытывают при различных концентрациях в диапазоне от 0,0015 до 10 мкМ. Экспериментальные данные анализируют компьютерной программой GraphPad Prizm с использованием четырехпараметрического логистического уравнения: У=дно+(верх-дно)/(1+10logC50-x)наклон,где х представляет собой логарифм концентрации ингибитора, у представляет собой реакцию; у начинается на дне и идет кверху в сигмовидной форме. Расчет Ki: Экспериментальный метод: Реакцию проводят в буфере (10 мМ Tris, рН 7,5, 10 мМ MgCl2, 0,2 мг/мл BSA, 7,5 мМ DTT), содержащем 3,7 нМ фермента, гистон и АТФ (постоянное отношение холодной/меченой АТФ 1/3000). Реакцию останавливают EDTA (этилендиаминтетрауксусной кислотой) и субстрат захватывают на фосфомембране (9 б-луночные планшеты Multiscreen от Millipore). После обильного промывания планшеты Multiscreen считывают на счетчике верхней части лунок. Измеряют контроль(нулевое время) для каждой величины концентрации АТФ и гистона. Структура эксперимента: Величины скорости реакции измеряют при четырех концентрациях АТФ,субстрата (гистона) и ингибитора. 80-точечную матрицу концентрации конструируют вокруг соответствующих величин АТФ и Km субстрата и получают величины IC50 ингибитора (величины Km, умноженные на 0,3, 1, 3, и 9, или IC50). Предварительный динамический эксперимент в отсутствие ингибитора и при различных концентрациях АТФ и субстрата обеспечивает возможность отбора одной конечной точки времени (10 мин) в линейном диапазоне реакции для эксперимента по определению Ki. Показатели кинетических параметров: кинетические параметры оценивают одновременной не линейной минимально-квадратической регрессией с использованием [уравнения 1] (конкурентный ингибитор в отношении АТФ, случайный механизм), используя полный набор данных (80 точек):- 10011032 субстратом и связыванием АТФ и субстратом и связыванием ингибитора. Соединения по изобретению далее испытывают in vitro для оценки антипролиферативного воздействия на культуры клеток. Анализ пролиферации клеток in vitro Линию клеток рака толстой кишки человека НСТ-116 высевают в концентрации 5000 клеток/см 2 в 24-луночный планшет (Costar), используя среду F12 (Gibco) с добавлением 10% FCS (EuroClone, Italy), 2 мМ L-глутаминовой кислоты, смеси 1% пенициллин/стрептомицин, и поддерживают при 37 С, 5% СО 2 и относительной влажности 96%. На следующий день планшеты обрабатывают в двух повторах 5 мл соответствующего разведения соединений, начиная с 10 мМ маточного раствора в ДМСО (диметилсульфоксид). В каждый планшет включают 2 необработанные контрольные лунки. После 72 ч обработки среду удаляют и клетки отделяют от каждой лунки, используя 0,5 мл 0,05% (мас./об.) трипсина, 0,02%(мас./об.) EDTA (Gibco). Образцы разбавляют 9,5 мл Isoton (Coulter) и подсчитывают, используя счетчик клеток Multisizer 3 (Beckman Coulter). Данные оценивают в виде процентной доли от контрольных лунок:% CTR=(Обработанные-необработанные)/(контрольные-необработанные). Величины IC50 рассчитывают LSW/анализом данных, используя подгонку сигмовидной кривой программы Microsoft Excel. В результате использования указанных выше анализов установлено, что соединения формулы (I) по изобретению обладают выраженной ингибирующей активностью в отношении протеинкиназы, например, ингибирующей активностью в отношении Aurora-2 (см., например, следующую табл. I, где представлены экспериментальные данные некоторых репрезентативных соединений по изобретению, испытанных в качестве ингибиторов Aurora-2 (IC50 в нМ) и для выявления их эффекта против пролиферации клеток (IC50 в нМ). Интересно, что эти же производные были испытаны в сравнении со структурно очень близким соединением, обозначенным, как эталонное соединение, которое специально раскрыто в указанной выше патентной заявке РСТ/ЕРОЗ/07531 - см. соединение 421 примера 6. К удивлению, активность ингибирования Aurora-2 соединений по изобретению оказалась постоянной и выражена выше, чем активность ингибирования эталонного соединения. Кроме того, те же соединения, как оказалось, оказывают действие против пролиферации клеток, которое значительно выше действия эталонного соединения, испытанного в таких же условиях. На основании изложенного выше следует, что новые соединения формулы (I) по изобретению обладают биологическим профилем, который в целом неожиданно превосходит биологический профиль самого близкого соединения, раскрытого в WO 20040131146, и, следовательно, особенно предпочтительны при лечении пролиферативных расстройств, связанных с измененной активностью киназы Aurora-2. Соединения по настоящему изобретению можно вводить или в виде самостоятельных агентов, или,альтернативно, в комбинации с известными способами противоракового лечения, такими как лучевая терапия или схема химиотерапии, в комбинации с цитостатическими или цитотоксическими агентами,агентами типа антибиотиков, алкилирующими агентами, гормональными агентами, иммунологическими агентами, агентами типа интерферона, ингибиторами циклооксигеназы (например, ингибиторами СОХ 2), ингибиторами матричной металлопротеазы, ингибиторами изомеразы, ингибиторами тирозинкиназы,агентами против рецепторов ростовых факторов, анти-HER агентами, анти-EGFR агентами, агентами против ангиогенеза (например, ингибиторами ангиогенеза), ингибиторами фарнезилтрансферазы, ингибиторами путей передачи сигналов ras-raf, ингибиторами клеточного цикла, другими ингибиторами cdks,агентами, связывающими тубулин, ингибиторами топоизомеразы I, ингибиторами топоизомеразы II и им подобными. При составлении фиксированной дозы в таких комбинированных препаратах используются соединения настоящего изобретения в пределах описанного ниже диапазона дозировки, и другое фармацевтически активное соединение - в пределах утвержденного диапазона дозировки. Соединения формулы (I) можно применять последовательно с известными противораковыми средствами, когда комбинированная препаративная форма нецелесообразна. Соединения формулы (I) по настоящему изобретению, подходящие для введения млекопитающему,например, людям, можно вводить обычными путями, при этом уровень дозировки зависит от возраста,массы тела, состояний пациента и пути введения. Например, подходящая дозировка, принятая для перорального введения соединения формулы (I), может находиться в диапазоне от примерно 30 до примерно 500 мг на дозу при введении от 1 до 5 раз в день. В целом, при использовании парентерального пути будут вводиться более низкие дозы. Так, например, для внутривенного введения в целом будет использоваться доза в диапазоне, например от 0,5 до 30 мг/кг массы тела. Соединения по изобретению можно вводить в разнообразных лекарственных формах, например, перорально, в виде таблеток, капсул, таблеток, покрытых сахаром или пленкой, жидких растворов или суспензий, ректально в виде суппозиторий; парентерально, например внутримышечно или путем внутривенной и/или подоболочечной и/или внутриспинномозговой инъекции или вливания. Настоящее изобретение также включает фармацевтические композиции, содержащие соединение формулы (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым эксципиентом, который может представлять собой носитель или разбавитель. Фармацевтические композиции, содержащие соединения по изобретению, обычно получают в соответствии с обычными способами и вводят в подходящей фармацевтической форме. Например, твердые пероральные формы могут содержать, вместе с активным соединением, разбавители, например лактозу, декстрозу, сахарозу, целлюлозу, кукурузный крахмал или картофельный крахмал; смазывающие агенты, например, диоксид кремния, тальк, стеариновую кислоту, стеарат магния или кальция и/или полиэтиленгликоли; связывающие агенты, например, крахмалы, гуммиарабик, желатиновую метилцеллюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; разрыхляющие агенты, например, крахмал, альгиновую кислоту, альгинаты или натрийгликоляткрахмал; вспенивающиеся смеси,красители; подслащивающие агенты; смачивающие агенты, такие как лецитин, полисорбаты, лаурилсульфаты и, в целом, нетоксичные и фармакологически неактивные вещества, используемые в фармацевтических препаративных формах. Эти фармацевтические препараты можно изготовить известным обра- 12011032 зом, например, посредством способов смешивания, гранулирования, таблетирования, покрытия сахаром или пленкой. Жидкие дисперсии для перорального введения могут представлять собой, например, сиропы,эмульсии и суспензии. В качестве примера сироп может содержать в качестве носителя сахарозу или сахарозу с глицерином и/или маннитом и сорбитом. Суспензии и эмульсии могут содержать, в качестве примеров носителей, натуральную смолу, альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензия или растворы для внутримышечных инъекций могут содержать, вместе с активным соединением, фармацевтически приемлемый носитель, например, стерильную воду, оливковое масло, этилолеат, гликоли, например, пропиленгликоль и, при желании, подходящее количество гидрохлорида лидокаина. Растворы для внутривенных инъекций или вливаний могут содержать, в качестве носителя, стерильную воду или, предпочтительно, они могут быть в форме стерильных, водных, солевых растворов,или они могут содержать в качестве носителя пропиленгликоль. Суппозитории могут содержать, вместе с активным соединением, фармацевтически приемлемый носитель, например, масло какао, полиэтиленгликоль, поверхностно-активный сложный эфир жирной кислоты полиоксиэтиленсорбитана или лецитин. С целью лучшей иллюстрации настоящего изобретения, без установления каких-либо его ограничений, теперь ниже приводятся следующие примеры. Экспериментальный раздел Следующий метод ВЭЖХ использовали при анализе соединений, как указано в изложенных ниже синтетических примерах. Используемый здесь термин "Rt" относится к времени удерживания (мин) для соединения при использовании указанного ниже метода ВЭЖХ. Метод ЖХ-МС (ЖХ-МС, жидкостной хроматомасс-спектрометрии) ВЭЖХ/МС выполняли на колонке Waters X Terra RP 18 (4,650 мм, 3,5 мкм), используя систему ВЭЖХ Waters 2790 с детектором 996 Waters PDA и одиночного квадрупольного масс-спектрометра Micromass mod. ZQ, оборудованного электрораспылительным (ESI) источником ионов. Подвижная фаза А представляла собой 5 мМ буфер ацетата аммония (рН 5,5 с уксусной кислотой/ацетонитрилом 95:5), и подвижная фаза В представляла собой воду/ацетонитрил (5:95). Градиент от 10 до 90% В через 8 мин,удержание 90% В 2 мин. УФ выявление при 220 нм и 254 нм. Скорость потока 1 мл/мин. Объем инжекции 10 мкл. Полное сканирование, диапазон массы от 100 до 800 amu (атомных единиц массы). Капиллярное напряжение составляло 2,5 кВ; температура источника была 120 С; диффузор был 10 В. Величины времени удерживания (ЖХ-МС Rt) представлены в минутах при 220 или 254 нм. Величины массы даны в виде отношения m/z. Пример 1. 4-Циано-5-(метилтио)тиофен-2-карбоновая кислота Водный гидроксид натрия (20% мас./мас, раствор, 9 мл) добавляют к раствору этил-4-циано-5(метилтио)тиофен-2-карбоксилата (10 г, 44 ммоль) в 1,4-диоксане (100 мл) при 5 С. После перемешивания в течение 4 ч при комнатной температуре к реакционной смеси добавляют воду (500 мл) и рН доводят примерно до 2,5 добавлением 2 н раствора водной хлористо-водородной кислоты. Белое твердое вещество отделяют фильтрованием, промывают водой и сушат в вакууме с получением 8,5 г указанного в заголовке соединения. ЖХ-МС: Rt 2,4; [М+Н]+ 200. Пример 2. трет-Бутил-4-циано-5-(метилтио)тиофен-2-карбоксилат Смесь 4-циано-5(метилтио)тиофен-2-карбоновой кислоты (2,0 г, 10 ммоль), бензилтриметиламмонийхлорида (2,25 г, 10 ммоль), трет-бутилбромида (54 мл, 480 ммоль) и безводного карбоната калия (36 г, 260 ммоль) в диметилацетамиде (100 мл) перемешивают при 60 С в течение 6 ч. После охлаждения смесь разбавляют этилацетатом (400 мл) и промывают водой. Органический слой сушат и выпаривают при пониженном давлении с получением остатка, который очищают хроматографией (элюент этилацетат/н-гексан 3:1), получая 1,5 г указанного в заголовке соединения. ЖХ-МС: Rt 7,4; [M+Н]+ 256. Пример 3. трет-Бутил-4-циано-5-(метилсульфонил)тиофен-2-карбоксилат Смесь трет-бутил-4-циано-5(метилтио) тиофен-2-карбоксилата (1,4 г, 21,5 ммоль) в диметилформамиде (100 мл) перемешивают при комнатной температуре в течение 16 ч. Затем реакционную смесь выливают в смесь лед/вода (400 мл) и экстрагируют этилацетатом. Органический слой промывают водой,сушат над безводным сульфатом натрия и выпаривают досуха с получением 1,5 г указанного в заголовке соединения. ЖХ-МС: Rt 6,2; [М+Н]+ 288. Пример 4. трет-Бутил-4-циано-5-гидразинтиофен-2-карбоксилат Смесь трет-бутил-4-циано-5(метилсульфонил)тиофен-2-карбоксилата (2,0 г, 7,0 ммоль) и гидразингидрата (1,7 мл) в метиловом спирте (30 мл) перемешивают при 60 С в течение 2 ч. Реакционную смесь- 13011032 разбавляют этилацетатом (100 мл) и промывают водой. Органический слой отделяют, сушат над безводным сульфатом натрия и выпаривают. Посредством хроматографической очистки (н-гексан/этилацетат 3:2) получают 1 г указанного в заголовке соединения. ЖХ-МС: Rt 5,6; [М+Н]+ 240. Пример 5. трет-Бутил-3-амино-1 Н-тиено[2,3-e]пиразол-5-карбоксилат Смесь трет-бутил-4-циано-5-гидразинтиофен-2-карбоксилата (1,0 г, 4,2 ммоль) и хлористоводородной кислоты (0,7 мл 37% раствора) в метиловом спирте (15 мл) перемешивают при комнатной температуре в течение 14 ч. Реакционную смесь разбавляют этилацетатом (50 мл) и промывают водным раствором бикарбоната натрия. Органический слой отделяют, сушат над безводным сульфатом натрия и выпаривают с получением 0,9 г указанного в заголовке соединения. ЖХ-МС: Rt 4,5; [М+Н]+ 240. Пример 6. 5-трет-Бутил-1-этил-3-амино-1 Н-тиено[2,3-е]пиразол-1,5-дикарбоксилат Раствор этилхлоркарбоната (4,90 мл, 51,7 ммоль) в тетрагидрофуране (THF, 60 мл) медленно добавляют к смеси трет-бутил-3-амино-1 Н-тиено[2,3-e]пиразол-5-карбоксилата (12,0 г, 50,2 ммоль) и диизопропилэтиламина (DIEA, 51,5 мл 301 ммоль) в THF (300 мл), поддерживая температуру от -5 до -10 С. Реакционную смесь выдерживают при такой же температуре в течение 5 мин, затем дают возможность достичь комнатной температуры. Полученную смесь выпаривают досуха в вакууме и остаток экстрагируют этилацетатом (AcOEt) и водой. Органический слой отделяют, сушат над сульфатом натрия и выпаривают досуха. Полученный неочищенный продукт растирают с диэтиловым эфиром с получением 13,7 г указанного в заголовке соединения в виде белого твердого вещества. ЖХ-МС: Rt 5,6; [М+Н]+ 312. Пример 7. 5-трет-Бутил-1-этил-3-[(4-морфолин-4-илбензоил)амино]-1 Н-тиено[2,3-е]пиразол-1,5 дикарбоксилат Оксалилхлорид (20,2 мл, 231 ммоль) добавляют к суспензии 4-морфолин-4-илбензойной кислоты(7,98 г, 38,5 ммоль) в сухом дихлорметане (DCM, 210 мл) и диметилформамиде (ДМФА, 0,04 мл). После кипячения смеси с обратным холодильником в течение 6,5 ч летучие вещества тщательно удаляют при пониженном давлении (трижды собирая остаток толуолом). Полученный гидрохлорид 4-морфолин-4 илбензоилхлорид добавляют порциями (примерно через 0,5 ч) к суспензии 5-трет-бутил-1-этил-3-амино 1 Н-тиено[2,3-с]пиразол-1,5-дикарбоксилата (6,0 г, 19,3 ммоль) в сухом DCM (200 мл) и пиридине (23,2 мл, 289 ммоль) при перемешивании при 5 С. Полученную суспензию перемешивают в течение 20 ч при комнатной температуре. Затем к реакционной смеси добавляют 300 мл DCM и 100 мл водного бикарбоната натрия; органический слой отделяют, промывают рассолом, сушат над сульфатом натрия и выпаривают. Очистка хроматографией (DCM/этилацетат 7:3) дает 4,05 г указанного в заголовке соединения. ЖХ-МС: Rt 7,2; [М+Н]+ 501. Следуя методике, описанной выше, и подвергая взаимодействию 5-трет-бутил-1-этил-3-амино-1 Нтиено[2,3-с]пиразол-1,5-дикарбоксилазу с соответствующим производным ацилхлорида, получают следующие соединения: 5-трет-бутил-1-этил-3-[4-метилпиперазин-1-ил)бензоил]амино-1 Н-тиено[2,3-c]пиразол-1,5 дикарбоксилат; 5-трет-бутил-1-этил-3-[4-фторбензоил]амино-1 Н-тиено[2,3-с]пиразол-1,5-дикарбоксилат; 5-трет-бутил-1-этил-3-[тиен-2-илкарбонил)амино-1H-тиено[2,3-c]пиразол-1,5-дикарбоксилат; 5-трет-бутил-1-этил-3-[(1-метил-1 Н-пиррол-2-ил)карбонил]амино-1 Н-тиено[2,3-c]пиразол-1,5 дикарбоксилат; 5-трет-бутил-1-этил-3-(2-фуроиламино)-1 Н-тиено[2,3-с]пиразол-1,5-дикарбоксилат; 5-трет-бутил-1-этил-3-(4-[(1-метилпиперидин-4-ил)окси]бензоиламино)-1 Н-тиено[2,3-c]пиразол 1,5-дикарбоксилат; 5-трет-бутил-1-этил-3-(4-[(4-метилпиперазин-1-ил)метил]бензоиламино)-1 Н-тиено[2,3-c]пиразол 1,5-дикарбоксилат. Пример 8. Гидрохлорид 1-(этоксикарбонил)-3-[(4-морфолин 4-илбензоил)амино]-1 Н-тиено[2,3-c]пиразол-1,5 карбоновой кислоты 5-трет-бутил-1-этил-3-[(4-морфолин-4-илбензоил)амино]-1 Н-тиено[2,3-c]пиразол-1,5-дикарбоксилат (4,05 г) добавляют к раствору хлористо-водородной кислоты в диоксане (88 мл, 4 н раствор). Полученную смесь перемешивают при комнатной температуре в течение 72 ч. Затем летучие вещества удаляют выпариванием при пониженном давлении, остаток растирают с диэтиловым эфиром и сушат в вакууме при 40 С с получением 3,4 г указанного в заголовке соединения, используемого на следующей стадии без дальнейшей очистки. ЖХ-МС: Rt 3,1; [М+Н]+ 445. Следуя методике, описанной выше, и исходя из соответствующего промежуточного соединения,получают следующие соединения: гидрохлорид 1-(этоксикарбонил)-3-[4(4-метилпиперазин-1-ил)бензоил]амино-1 Н-тиено[2,3 е]пиразол-5-карбоновой кислоты;- 14011032 1-(этоксикарбонил)-3-[(4-фторбензоил)амино]-1 Н-тиено[2,3-с]пиразол-5-карбоновую кислоту; 1-(этоксикарбонил)-3-[(тиен-2-илкарбонил)амино]-1 Н-тиено[2,3-е]пиразол-5-карбоновую кислоту; 1-(этоксикарбонил)-3-[(1-метил-1 Н-пиррол-2-ил)карбонил]амино-1 Н-тиено[2,3-c]пиразол-5 карбоновую кислоту; 1-(этоксикарбонил)-3-(2-фуроиламино)-1 Н-тиено[2,3-с]пиразол-5-карбоновую кислоту; гидрохлорид 1-(этоксикарбонил)-3-(4-[(1-метилпиперидин-4-ил)окси]бензоиламино-1 Нтиено[2,3-c]пиразол-5-карбоновой кислоты; гидрохлорид 1-(этоксикарбонил)-3-(4-[(4-метилпиперазин-1-ил)метил]бензоиламино-1 Нтиено[2,3-c]пиразол-5-карбоновой кислоты. Пример 9. Этил-5-[(1-метил-1-фенилэтил)амино]карбонил-3-[(4-морфолин-4-илбензоил)амино]1 Н-тиено[2,3-c]пиразол-1-карбоксилат Смесь кумиламина (1,43 г, 10,6 ммоль), тетрафторбората 2-(1 Н-бензотриазол-1-ил)-1,1,3,3 тетраметилурония (TBTU, 3,40 г, 10,6 ммоль), гидрохлорида 1-(этоксикарбонил)-3-[(4-морфолин-4 илбензоил)амино]-1 Н-имено[2,3-c]пиразол-5-карбоновой кислоты (3,40 мг, 7,07 ммоль) и N,N'диизопропилэтиламина (12,1 мл, 7,07 ммоль) в 80 мл диметилформамида перемешивают при комнатной температуре в течение 20 ч. Затем реакционную смесь разбавляют водой и экстрагируют дихлорметаном. Летучие вещества удаляют выпариванием при пониженном давлении, остаток растирают с этилацетатом,фильтруют и обильно промывают диэтиловым эфиром в вакууме при 40 С с получением 3,7 г указанного в заголовке соединения, используемого на следующей стадии без дальнейшей очистки. ЖХ-МС: Rt 6,8; [М+Н]+ 562. Следуя методике, описанной выше, и исходя из соответствующего промежуточного производного,получают следующие соединения: этил-3-[(4-морфолин-4-илбензоил)амино]-5-[(1-фенилциклопропил)амино]карбонил-1 Нтиено[2,3-c] пиразол-1-карбоксилат; этил-5-([(1R)-1-(4-фторфенил)этил]аминокарбонил)-3-[(4-морфолин-4-илбензоил)амино]-1 Нтиено [2,3-c]пиразол-1-карбоксилат; этил-3-[(4-морфолин-4-илбензоил)амино]-5-([(1R)-1-фенилпропил]аминокарбонил)-1 Н-тиено[2,3c]пиразол-1-карбоксилат; этил-3-[(4-морфолин-4-илбензоил)амино]-5-([(1S)-1-фенил-2-пирролидин-1-илэтил]аминокарбонил)-1 Н-тиено[2,3-c]пиразол-1-карбоксилат; этил-3-[(4-морфолин-4-илбензоил)амино]-5-([(1S)-2-морфолин-4-ил-1-фенилэтил]аминокарбонил)-1 Н-тиено[2,3-с]пиразол-1-карбоксилат; этил-3-[(4-фторбензоил)амино]-5-[(1-фенилциклопропил)амино]карбонил)-1 Н-тиено[2,3-c]пиразол-1-карбоксилат; этил-3-[(4-фторбензоил)амино]-5-[(1-метил-1-фенилэтил)амино]карбонил)-1H-тиено[2,3-c]пиразол-1-карбоксилат; этил-3-[(4-фторбензоил)амино]-5-([(1R)-1-фенилпропил]аминокарбонил)-1 Н-тиено[2,3-c]пиразол 1-карбоксилат; этил-3-[(4-фторбензоил)амино]-5-([(1R)-1-фенил-2-пирролидин-1-илэтил]аминокарбонил)-1 Нтиено[2,3-c]пиразол-1-карбоксилат; этил-3-[(4-фторбензоил)амино]-5-([(1R)-1-(4-фторфенил)этил]аминокарбонил)-1 Н-тиено[2,3c]пиразол-1-карбоксилат; этил-3-[(4-фторбензоил)амино]-5-([(1S)-2-морфолин-4-ил-1-фенилэтил]аминокарбонил)-1 Н-тиено[2,3-е]пиразол-1-карбоксилат; этил-5-[(1-этил-1-фенилпропил]аминокарбонил)-3-[(4-фторбензоил)амино]-1 Н-тиено[2,3-е]пиразол-1-карбоксилат; этил-3-[(4-фторбензоил)амино]-5-[(1-фенилциклопентил]карбонил-1 Н-тиено[2,3-c]пиразол-1 карбоксилат; этил-5-([(1S)-2-морфолин-4-ил-1-фенилэтилил]амино-3-[(тиен-2-илкарбонил)амино]-1 Н-тиено[2,3-c]пиразол-1-карбоксилат; этил-5-[(1-метил-1-фенилэтил)амино]карбонил-3-[(тиен-2-илкарбонил)амино]-1 Н-тиено[2,3c]пиразол-1-карбоксилат; этил-5-([(1R)-1-(4-фторфенил)этил]аминокарбонил)-3-[(тиен-2-илкарбонил)амино]-1 Н-тиено[2,3 е] пиразол-1-карбоксилат; этил-5-[(1-фенилциклопропил)амино]карбонил-3-[(тиен-2-илкарбонил)амино]-1 Н-тиено[2,3-c]пиразол-1-карбоксилат; гидрохлорид 1-(этоксикарбонил)-3-(4-[(4-метилпиперазин-1-ил)метил]бензоиламино)-1 Нтиено[2,3-с]пиразол-5-карбоновой кислоты; этил-5-([(1R)-1-фенилпропил]аминокарбонил)-3-[(тиен-2-илкарбонил)амино]-1 Н-тиено[2,3-c]пиразол-1-карбоксилат; этил-5-[(1-метил-1-фенилэтил)амино]карбонил-3-[(1-метил-1 Н-пиррол-2-ил)карбонил]амино 1 Н-тиено[2,3-c]пиразол-1-карбоксилат;(TEA, 7 мл) перемешивают при 70 С в течение 5 ч. После выпаривания растворителя при пониженном давлении остаток собирают DCM и промывают водой. Органический слой отделяют, сушат над сульфатом натрия и выпаривают. Очистка хроматографией (DCM/MeOH 47:3) дает 2,8 г указанного в заголовке соединения. ЖХ-МС: Rt 5,70; [М+Н]+ 490. Следуя методике, описанной выше, и исходя из соответствующего промежуточного производного,получают следующие соединения: 2) 3-[(4-морфолин-4-илбензоил)амино]-N-(1-фенилциклопропил)-1 Н-тиено[2,3-е]пиразол-1 карбоксамид; ЖХ-МС: Rt 5, 5; [М+Н]+ 488; 3)Rt 5,35; [М+Н]+ 395; 25) N-(1-метил-1-фенилэтил)-3-(4-[(1-метилпиперидин-4-ил)окси]бензоиламино)-1 Н-тиено[2,3c]пиразол-5-карбоксамид; ЖХ-МС: Rt 3,76; [М+Н]+ 518; 26) 3-(4-[(1-метилпиперидин-4-ил)окси]бензоиламино)-N-(1-фенилциклопропил)-1 Н-тиено[2,3c]пиразол-5-карбоксамид; ЖХ-МС: Rt 3,75; [М+Н]+ 516; 27) N-(1-метил-1-фенилэтил)-3-(4-[(4-метилпиперазин-1-ил)метил]бензоиламино)-1 Н-тиено[2,3c]пиразол-5-карбоксамид; ЖХ-МС: Rt 3,8; [М+Н]+ 517; 28) 3-(4-[(4-метилпиперазин-1-ил)метил]бензоиламино)-N-(1-фенилциклопропил)-1 Н-тиено[2,3c]пиразол-5-карбоксамид; ЖХ-МС: Rt 3,58; [М+Н]+ 515. Пример 11. трет-Бутил-1-[4-(4-метилпиперазин-1-ил)бензоил]-3-[4-(4-метилпиперазин-1-ил)бензоил]амино 1 Н-тиено[2,3-c]пиразол-5-карбоксилат Оксалилхлорид (11 мл, 127 ммоль) добавляют к суспензии 4-(4-метилпиперазин-1-ил)бензойной кислоты (4,62 г, 21 ммоль) в DCM (150 мл) и ДМФА (0,15 мл). После кипячения смеси с обратным холодильником в течение 6,5 ч летучие вещества тщательно удаляют при пониженном давлении (собирая остаток 3 раза толуолом). Полученный гидрохлорид 4-(4-метилпиперазин-1-ил)бензоилхлорида добавляют порциями (примерно через 6 ч) к суспензии трет-бутил-3-амино-1 Н-тиено[2,3-c]пиразол-5-карбоксилата (0,62 г, 2,6 ммоль) в сухом DCM (80 мл) и пиридина (3,1 мл, 3 9 ммоль) при перемешивании при 5 С. Полученную суспензию перемешивают в течение 72 ч при комнатной температуре. 300 мл водного бикарбоната натрия затем добавляют к реакционной смеси и органический слой отделяют, промывают рассолом, сушат над сульфатом натрия и выпаривают. Остаток (6,2 г), смесь указанного в заголовке соединения 4-(4 метилпиперазин-1-ил)бензойной кислоты и 4-(4-метилпиперазин-1-ил)бензойного ангидрида, используют в следующем примере без очистки. Пример 12. трет-Бутил-3-[4-(4-метилпиперазин-1-ил)бензоил]амино-1 Н-тиено[2,3-c]пиразол-5 карбоксилат Смесь, полученную, как описано в примере 11 (6,2 г), обрабатывают МеОН (45 мл) и TEA (5 мл) и перемешивают при комнатной температуре в течение 16 ч. Затем раствор выпаривают и остаток очищают флэш-хроматографией на силикагеле (OCM/MeOH/7 н раствор аммиака в метиловом спирте 94:5:1) с получением указанного в заголовке соединение в виде твердого вещества (0,500 г). ЖХ-МС: Rt 4,72; [M+Н]+ 442. Пример 13. Гидрохлорид 3-[4-(4-метилпиперазин-1-ил)бензоил]амино-1 Н-тиено[2,3-c]пиразол-5-карбоновой кислоты Смесь трет-бутил-3-[4-(4-метилпиперазин-1-ил)бензоил]амино-1 Н-тиено[2,3-с]пиразол-5-карбоксилата (0,50 г, 1,1 ммоль) в хлористоводородной кислоте 4 М в диоксане (15 мл) перемешивают в течение 16 ч при комнатной температуре. Затем летучие вещества удаляют выпариванием при пониженном давлении и остаток растирают с диэтиловым эфиром с получением 0,496 г указанного в заголовке соединения в виде белого твердого вещества. ЖХ-МС: Rt 1,85; [М+Н]+ 386. Пример 14. N-(1-Метил-1-фенилэтил)-3-[4-(4-метилпиперазин-1-ил)бензоил]амино-1 Н-тиено[2,3c]пиразол-5-карбоксамид (29) К охлажденной льдом суспензии 3-[4-(4-метилпиперазин-1-ил)бензоил]амино-1 Н-тиено[2,3c]пиразол-5-карбоновой кислоты (113 мг, 0,27 ммоль) и N,N'-диизопропилэтиламина (2,1 ммоль, 0,38 мл) в 3 мл N, N-диметилформамида добавляют по каплям 0,154 мл этилхлорформиата (1,6 ммоль). Через 20 мин к полученному раствору добавляют 1-метил-1-фенилэталамин (0,302 мл, 2,1 ммоль) и реакционной смеси дают возможность нагреться до комнатной температуры. Через 16 ч реакционную смесь разбавляют дихлорметаном и промывают водным раствором бикарбоната натрия. После выпаривания растворителя остаток собирают метиловым спиртом (9 мл) и триэтиламином (1 мл) и перемешивают при 40 С в течение 2 ч. Затем реакционную смесь выпаривают досуха с получением масла, которое очищают флэшхроматографией на силикагеле, используя в качестве элюента дихлорметан/7 н раствор аммиака в метиловом спирте (93:6:1), с получением указанного в заголовке соединения в виде белого твердого вещества- 17011032 ЖХ-МС: Rt 4,14; [М+Н]+ 489. Следуя методике, описанной выше, и исходя из соответствующего промежуточного производного,получают следующие соединения: 30) 3-[4-метилпиперазин-1-ил)бензоил]амино-N-[(1R)-фенилпропил]-1 Н-тиено[2,3-c]пиразол-5 карбоксамид; ЖХ-МС: Rt 4,54; [М+Н]+ 503; 31) 3-[4-метилпиперазин-1-ил)бензоил]амино-N-[(1S)-2-морфолин-4-ил-1-фенилэтил]-1 Н-тиено[2,3-c]пиразол-5-карбоксамид; ЖХ-МС: Rt 3,14; [М+Н]+ 574; 32) 3-[4-метилпиперазин-1-ил)бензоил]амино-N-[(1S)-1-фенил-2-пирролидин-1-илэтил]-1 Н-тиено[2,3-c]пиразол-5-карбоксамид; ЖХ-МС: Rt 2,56; [M+Н]+ 558; 33) N-(1-этил-1-фенилпропил)-3-[4-метилпиперазин-1-ил)бензоил]амино-1 Н-тиено[2,3-c]пиразол 5-карбоксамид; ЖХ-МС: Rt 4,4; [М+Н]+ 531; 34) 3-[4-метилпиперазин-1-ил)бензоил]амино-N-фенилциклопентил)-1 Н-тиено[2,3-c]пиразол-5 карбоксамид; ЖХ-МС: Rt 5,75; [М+Н]+ 529; 35) 3-[4-метилпиперазин-1-ил)бензоил]амино-N-фенилциклоппропил)-1 Н-тиено[2,3-c]пиразол-5 карбоксамид; ЖХ-МС: Rt 3,47; [М+Н]+ 501; 36) 3-[4-метилпиперазин-1-ил)бензоил]амино-N-[(1R)-1-фенилэтил]-1 Н-тиено[2,3-c]пиразол-5 карбоксамид; ЖХ-МС: Rt 4,54; [М+Н]+ 489. Пример 15. 5-трет-Бутил-1-этил-3-[(4-хлорметилбензоил)амино]-1 Н-тиено[2,3-с]пиразол-1,5 дикарбоксилат 4-Хлорметилбензоилхлорид (5,42 г, 28,7 ммоль) добавляют к суспензии трет-бутил-3-амино-1 Нтиено[2,3-c]пиразол-5-карбоксилата (5,94 г, 19,1 ммоль) в сухом DCM (150 мл) и 2,4,6-колидине (6,94 г,57,3 ммоль) при перемешивании при 20 С. Полученную суспензию перемешивают в течение 3 ч при комнатной температуре. Затем 300 мл водного карбоната натрия добавляют к реакционной смеси, органический слой отделяют, промывают рассолом, сушат над сульфатом натрия и выпаривают. Осадок растирают с гексаном, фильтруют и сушат при 40 С в вакууме с получением 3 г указанного в заголовке соединения. ЖХ-МС: Rt, [M+H]+ 4 64. Следуя методике, описанной выше, и исходя из соответствующего промежуточного производного,получают следующее соединение: этил-3-[(4-хлорметилбензоил)амино]-5-[(1-фенилциклопропил)амино]карбонил-1 Н-тиено[2,3c]пиразол-1-карбоксилат Пример 16. 1-(Этоксикарбонил)-3-[(4-хлорметилбензоил)амино]-1 Н-тиено[2,3-с]пиразол-5 карбоновая кислота 5-трет-Бутил-1-этил-3-[(4-хлорметилбензоил)амино]-1 Н-тиено[2,3-c]пиразол-1,5-дикарбоксилат (8,2 г) добавляют к раствору хлористо-водородной кислоты в диоксане (88 мл, 4 н раствор). Полученную смесь перемешивают при 50 С в течение 2 ч при комнатной температуре. Затем летучие вещества удаляют выпариванием при пониженном давлении, осадок растирают с диэтиловым эфиром, фильтруют,обильно промывают диэтиловым эфиром и сушат в вакууме при 40 С с получением 5,7 г указанного в заголовке соединения, используемого на следующей стадии без дальнейшей очистки. ЖХ-МС: Rt, [M+H]+ 408. Пример 17. Этил-5-[(1-метил-1-фенилэтил)амино]карбонил-3-[(4-хлорметилбензоил)амино]-1 Н-тиено[2,3c]пиразол-1-карбоксилат Смесь кумиламина (1,43 г, 10,6 ммоль), тетрафторбората 2-(1 Н-бензотриазол-1-ил)-1,1,3,3 тетраметилурония (TBTU, 3,40 г, 10,6 ммоль), 1-(этоксикарбонил)-3-[(4-хлорметилбензоил)амино]-1 Нтиено[2,3-c]пиразол-5-карбоновой кислоты (2,88 мг, 7,07 ммоль) и N,N'-диизопропилэтиламина (18,2 мл,10,6 ммоль) в 150 мл дихлорметана перемешивают при комнатной температуре в течение 20 ч. Затем реакционную смесь промывают 2 н водной хлористо-водородной кислотой и рассолом и сушат над сульфатом натрия. Летучие вещества удаляют выпариванием при пониженном давлении, осадок растирают с диэтиловым эфиром, фильтруют, обильно промывают диэтиловым эфиром и сушат в вакууме при 40 С с получением 3,3 г указанного в заголовке соединения, используемого на следующей стадии без дальнейшей очистки. ЖХ-МС: Rt, [M+H]+ 408. Пример 18.(3,80 мг, 7,25 ммоль) в 100 мл сухого этанола. Полученную смесь перемешивают при 79 С в течение 1 ч. Затем летучие вещества удаляют выпариванием при пониженном давлении и осадок очищают хроматографией над силикагелем (элюент дихлорметан/метиловый спирт/водный аммиак 92:8:01) с получением 1,2 г указанного в заголовке соединения. ЖХ-МС: Rt 3,8, [М+Н]+ 488.- 18011032 Следуя методике, описанной выше, и исходя из соответствующего промежуточного производного,получают следующие соединения: 38) (1-метил-1-фенилэтил)амид 3-[(4-морфолин-4-илметилбензоиламино)-1 Н-тиено[2,3-c]пиразол 5-карбоновой кислоты; ЖХ-МС: Rt 4,4, [М+Н]+ 504; 39) (1-метил-1-фенилэтил)амид 3-(4-пиперидин-1-илметилбензоиламино)-1 Н-тиено[2,3-c]пиразол 5-карбоновой кислоты; ЖХ-МС: Rt 4,9, [М+Н]+ 502; 40)- 20011032 99) (1-метил-1-фенилэтил)амид 3-(4-пиразол-1-илметилбензоиламино)-1 Н-тиено[2,3-c]пиразол-5 карбоновой кислоты; Rt 5,0; [M+Н]+ 485. Пример 19. Следуя методике, аналогично описанной выше в примере 10, получают следующие соединения, исходя из подходящих промежуточных производных: 100) (1-метил-1-фенилэтил)амид 3-(4-метоксибензоиламино)-1 Н-тиено[2,3-c]пиразол-5-карбоновой кислоты; [М+Н]+ 435; 101) (1-метил-1-фенилэтил)амид 3-(3-метоксибензоиламино)-1 Н-тиено[2,3-c]пиразол-5-карбоновой кислоты; [М+Н]+ 435; 102) (1-метил-1-фенилэтил)амид 3-(2-метоксибензоиламино)-1 Н-тиено[2,3-c]пиразол-5-карбоновой кислоты; [М+Н]+ 435; 103) (1-метил-1-фенилэтил)амид 3-(3-морфолин-4-илбензоиламино)-1 Н-тиено[2,3-c]пиразол-5 карбоновой кислоты; [М+Н]+ 490; 104)[М+Н]+ 405; 168) (1-метил-1-фенилэтил)амид 3-(3-фторбензоиламино)-1 Н-тиено[2,3-е]пиразол-5-карбоновой кислоты; [М+Н]+ 423; 169) (1-метил-1-фенилэтил)амид 3-(2-фторбензоиламино)-1 Н-тиено[2,3-c]пиразол-5-карбоновой кислоты; [М+Н]+ 423. Пример биологического испытания Было показано, что все следующие соединения в соответствии со способами, описанными в приведенном выше фармакологическом разделе, имеют величины IC50 для ингибирования Aurora-2 не ниже 20 нМ: Соединения: 1; 2; 3; 4; 5; 6; 7; 8; 9; 11; 15; 16; 17; 18; 19; 20; 21; 22; 23; 24; 25; 27; 29; 30; 31; 32; 33; 34; 35, 36; 37; 38; 39; 40; 41; 42; 46; 47; 48; 49; 50; 51; 53; 57; 58; 59; 62; 63; 64; 65; 122; 123; 124; 126; 131; 132; 134; 136; 137; 138; 139; 140; 141; 142; 143; 144; 147; 148; 149; 150 и 151. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения клеточных пролиферативных расстройств, вызванных и/или связанных с измененной активностью протеинкиназы, включающий введение нуждающемуся в нем млекопитающему эффективного количества производного 1 Н-тиено[2,3-c]пиразола формулы (I) где R представляет собой фенил или 5- или 6-членную гетероарильную группу, содержащую 1 или 2 гетероатома, выбранных из N, S или О, где R необязательно замещен в любом из его свободных положений 1-6 группами, выбранными из галогена, нитро, карбокси, циано, алкила, полифторированного алкила,алкенила, алкинила, циклоалкила, циклоалкенила; арильной, гетероциклильной, алкилгетероциклильной,гетероциклилалкильной, аминоалкильной, аминогрупп и их производных, таких как алкиламино, диалкиламино, ариламино, диариламино, уреидо, алкилуреидо или арилуреидо; карбониламиногрупп и их производных, таких как формиламино, алкилкарбониламино, алкенилкарбониламино, арилкарбониламино, алкоксикарбониламино; гидроксигрупп и их производных, таких как алкокси, полифторированный алкокси, арилокси, гетероциклилокси, алкикарбонилокси, арилкарбонилокси, циклоалкенилокси или алкилиденаминокси; карбонильных групп и их производных, таких как алкилкарбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, циклоалкилоксикарбонил, аминокарбонил, алкиламинокарбонил,диалкиламинокарбонил; сульфированных производных, таких как алкилтио, арилтио, алкилсульфонил,арилсульфонил, алкилсульфинил, арилсульфинил, арилсульфонилокси, аминосульфонил, алкиламино- 23011032 сульфонил или диалкиламиносульфонил;R1 и R2, одинаковые или различные, независимо друг от друга представляют собой атом водорода,прямой или разветвленный C1-С 3 алкил или группу -CH2NR' R, или взятые вместе с атомом углерода, с которым они связаны, R1 и R2 могут образовывать С 3-С 6 циклоалкильную группу; при условии, что по меньшей мере один из R1 и R2 не представляет собой атом водорода; R' и R, взятые вместе с атомом азота, с которым они связаны, могут образовывать гетероциклическое кольцо формулы где R3 представляет собой атом водорода, галогена или прямой или разветвленный C1-С 3 алкокси; или его изомеры, таутомеры и фармацевтически приемлемые соли. 2. Способ по п.1, предназначенный для лечения клеточных пролиферативных расстройств, вызванных и/или связанных с измененной активностью киназ Aurora. 3. Способ по п.2, где киназа Aurora представляет собой Aurora 2. 4. Способ по п.1, где клеточное пролиферативное расстройство выбрано из группы, состоящей из рака, болезни Альцгеймера, вирусных инфекций, аутоиммунных заболеваний и нейродегенеративных расстройств. 5. Способ по п.4, где рак выбран из группы, состоящей из карциномы, плоскоклеточной карциномы,гематопоэтических опухолей миелоидной или лимфоидной линии дифференцировки, опухолей мезенхимального происхождения, опухолей центральной и периферической нервной системы, меланомы, семиномы, тератокарциномы, остеосаркомы, пигментозной ксеродермии, кератоксантомы, фолликулярного рака щитовидной железы и саркомы Капоши. 6. Способ по п.1, где клеточное пролиферативное расстройство выбрано из группы, состоящей из доброкачественной гиперплазии предстательной железы, наследственного аденоматоза, полипоза, нейрофиброматоза, псориаза, связанной с атеросклерозом пролиферации гладкомышечных клеток сосудов,пневмосклероза, артрита, гломерулонефрита и послеоперационного стеноза и рестеноза. 7. Способ по п.1, дополнительно включающий воздействие на нуждающегося в нем млекопитающего лучевой терапии или химиотерапии в комбинации по меньшей мере с одним цитостатическим или цитотоксическим средством. 8. Способ по п.1, где млекопитающее представляет собой человека. 9. Производное 1 Н-тиено[2,3-c]пиразола формулы (I) где R представляет собой фенил или 5- или 6-членную гетероарильную группу, содержащую 1 или 2 гетероатома, выбранных из N, S или О, где R необязательно замещен в любом из его свободных положений 1-6 группами, выбранными из галогена, нитро, карбокси, циано, алкила, полифторированного алкила,алкенила, алкинила, циклоалкила, циклоалкенила; арильной, гетероциклильной, алкилгетероциклильной,гетероциклилалкильной, аминоалкильной, аминогрупп и их производных, таких как алкиламино, диалкиламино, ариламино, диариламино, уреидо, алкилуреидо или арилуреидо; карбониламиногрупп и их производных, таких как формиламино, алкилкарбониламино, алкенилкарбониламино, арилкарбониламино, алкоксикарбониламино; гидроксигрупп и их производных, таких как алкокси, полифторированный алкокси, арилокси, гетероциклилокси, алкикарбонилокси, арилкарбонилокси, циклоалкенилокси или алкилиденаминокси; карбонильных групп и их производных, таких как алкилкарбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, циклоалкилоксикарбонил, аминокарбонил, алкиламинокарбонил,диалкиламинокарбонил; сульфированных производных, таких как алкилтио, арилтио, алкилсульфонил,арилсульфонил, алкилсульфинил, арилсульфинил, арилсульфонилокси, аминосульфонил, алкиламино- 24011032 сульфонил или диалкиламиносульфонил;R1 и R2, одинаковые или различные, независимо друг от друга представляют собой атом водорода,прямой или разветвленный C1-С 3 алкил или группу -CH2NR'R, или взятые вместе с атомом углерода, с которым они связаны, R1 и R2 могут образовывать С 3-С 6 циклоалкильную группу; при условии, что по меньшей мере один из R1 и R2 не представляет собой атом водорода; R' и R, взятые вместе с атомом азота, с которым они связаны, могут образовывать гетероциклическое кольцо формулыR3 представляет собой атом водорода, галогена или прямой или разветвленный C1-С 3 алкокси; или его изомеры, таутомеры и фармацевтически приемлемые соли. 10. Способ ингибирования активности киназы Aurora 2, который включает контактирование указанной киназы с эффективным количеством соединения по п.9. 11. Соединение формулы (I) по п.9, где R представляет собой группу, выбранную из тиенила, фурила, пирролила и фенила, необязательно, дополнительно замещенную другой вышеуказанной группой. 12. Соединение формулы (I) по п.11, где R представляет собой тиенил, фурил, пирролил, Nметилпирролил, фенил и фенил, замещенный атомами галогенов, гетероциклическими, гетероциклилокси или гетероциклилакильными группами. 13. Соединение формулы (I) по п.12, где R выбран из 2-тиенила, 2-фурила, 1-метилпирролил-2-ила,фенила, 4-фторфенила, 4-(1-метилпиперидил-4-илокси)фенила, 4-(1-метилпиперазинил-4-ил)фенила, 4(1-метилпиперазинил-4-илметил)фенила,4-(пирролидин-1-ил)метилфенила,4-(пиперидин-1 ил)метилфенила,4-(1-метилпиперазин-4-ил)метилфенила,4-(морфолино-1-ил)метилфенила,4(алкиламино)метилфенила, 4-(диалкиламино)метилфенила или 4-(морфолино-4-ил)фенила. 14. Соединение формулы (I) по п.9, где один из R1 или R2 представляет собой атом водорода или метильную группу, и остающийся один из R1 или R2 представляет собой метил, этил или группу-CH2NR'R", в которой R' и R имеют вышеуказанные значения. 15. Соединение формулы (I) по п.9, где R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют С 3-С 6 циклоалкильную группу. 16. Соединение формулы (I) по п.15, где R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют циклопропильную или циклопентильную группу. 17. Соединение формулы (I), в котором R, R1 и R2 имеют значения, указанные в п.9, и R3 представляет атом водорода, фтора или хлора или метоксигруппу. 18. Соединение формулы (I) по п.9, необязательно в форме его фармацевтически приемлемой соли,выбранной из группы, состоящей из 1)S)-1-фенилэтил)амид 3-(4-морфолин-4-илбензоиламино)-1 Н-тиено[2,3-c]пиразол-5 карбоновой кислоты; 167) (1-метил-1-фенилэтил)амид (3-бензоиламино)-1 Н-тиено[2,3-с]пиразол-5-карбоновой кислоты; 168) (1-метил-1-фенилэтил)амид 3-(3-фторбензоиламино)-1 Н-тиено[2,3-c]пиразол-5-карбоновой кислоты; 169) (1-метил-1-фенилэтил)амид 3-(2-фторбензоиламино)-1 Н-тиено[2,3-c]пиразол-5-карбоновой кислоты. 19. Способ получения производных 1 Н-тиено[2,3-c]пиразола формулы (I) и их фармацевтически приемлемых солей по п.9, включающий: а) взаимодействие соединения формулы (II), где Alk означает низшую алкильную группу, с гидразином или солью гидразина и взаимодействие полученного таким путем промежуточного соединения в кислотных условиях с получением соединения формулы (III)
МПК / Метки
МПК: A61P 25/28, A61P 17/06, A61P 9/10, A61P 35/00, A61K 31/4162, A61P 19/02, A61P 31/12
Метки: использования, 2,3-c, качестве, пиразола, предназначенные, 1н-тиено, киназы, производные, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-11032-proizvodnye-1n-tieno-23-c-pirazola-prednaznachennye-dlya-ispolzovaniya-v-kachestve-ingibitorov-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1н-тиено [2,3-c] пиразола, предназначенные для использования в качестве ингибиторов киназы</a>
Предыдущий патент: Новая кристаллическая форма iii агомелатина, способ её получения и фармацевтические композиции, которые её содержат
Следующий патент: 3-замещенные-2(арилалкил)-1-азабициклоалканы и способы их применения
Случайный патент: Штапельные волокна из политриметилентерефталата и способ их получения