Производные 1-фенил-2-пиридинилалкиловых спиртов в качестве ингибиторов фосфодиэстераз
Номер патента: 17530
Опубликовано: 30.01.2013
Авторы: Армани Элисабета, Дельканале Маурицио, Амари Габриеле
Формула / Реферат
1. Соединение общей формулы (I)
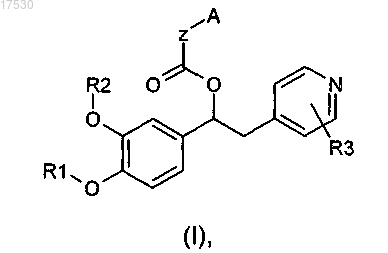
где Z выбран из группы, состоящей из (CH2)m, где m = 0 или 1; и
CR4R5, где
R4 независимо выбран из H и
R5 независимо выбран из группы, состоящей из
линейного или разветвленного (C1-C4)алкила;
NH2 и
HNCOOR', где R' представляет собой линейный или разветвленный (C1-C4)алкил, или R4 и R5 образуют с атомом углерода, с которым они соединены, кольцо, имеющее 3, 4, 5 или 6 углеродных атомов;
R1 и R2 являются разными или одинаковыми и независимо выбраны из группы, состоящей из
линейного или разветвленного (С1-С6)алкила, возможно замещенного одним или более заместителями, выбранными из (C3-C7)циклоалкила или фтора;
(С3-С7)циклоалкила;
R3 представляет собой один или более заместителей, независимо выбранных из группы, состоящей из атомов галогенов;
А выбран из группы, состоящей из фенила, нафтила, пиридила, имидазолила, бензимидазолила, дигидробензооксазинила, тетрагидропуринила, дигидробензоимидазолила, дигидробензодиоксинила, хинолинила, тиазолидинила, бициклогептанила и индолила, в которых могут присутствовать один или более возможных заместителей Rx, которые могут быть одинаковыми или разными и независимо выбранными из группы, состоящей из
линейного или разветвленного (C1-C6)алкила, возможно замещенного одним или более (С3-С7)циклоалкилами;
фенила;
(С3-С7)гетероциклоалкила;
OR7, где R7 выбран из группы, состоящей из
(C1-C10)алкила, возможно замещенного одним или более (С3-C7)циклоалкилами или атомами фтора;
(C3-C7)циклоалкила;
группы (C1-C4)алкилен-(C3-C7)гетероциклоалкил;
группы СО(С1-С6)алкил;
фенила;
бензила;
(C1-C10)алкил-NR8R9, где R8 и R9 независимо выбраны из группы, состоящей из H, линейного или разветвленного (С1-С6)алкила, и они образуют с атомом азота, с которым они соединены, насыщенное, частично насыщенное или ненасыщенное кольцо, где это кольцо возможно замещено (C1-C4)алкилом; и
атомов галогенов;
CN;
NO2;
NR10R11, где R10 и R11 являются разными или одинаковыми и независимо выбраны из группы, состоящей из
Н;
линейного или разветвленного (C1-C6)алкила, возможно замещенного фенилом или (С3-С7)циклоалкилом;
оксо;
HNSO2R13, где R13 представляет собой (C1-C4)алкил;
COOR17, где R17 представляет собой Н,
и его фармацевтически приемлемые соли и N-оксиды по пиридиновому кольцу.
2. Соединение по п.1, где А представляет собой фенил, возможно замещенный одной или более группами Rx.
3. Соединение по п.1, где А представляет собой имидазолил или пиридил.
4. Соединение по любому из пп.1-3, где R3 представляет собой хлор.
5. Соединение по п.4, имеющее общую формулу (II)
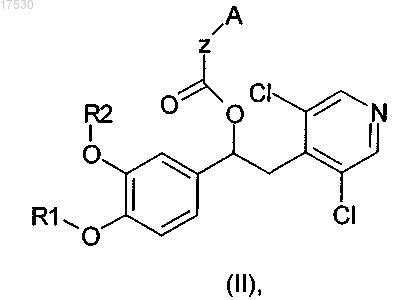
где R1, R2, Z и А такие, как определено выше.
6. Соединение по п.5, где Z представляет собой (CH2)m и m равно 0.
7. Соединение по п.6, представляющее собой 1-(3-циклопропилметокси-4-дифторметоксифенил)-2-(3,5-дихлор-1-оксипиридин-4-ил)этиловый эфир 3-циклопропилметокси-4-дифторметоксибензойной кислоты.
8. Соединение по п.6, представляющее собой 1-(3-циклопропилметокси-4-дифторметоксифенил)-2-(3,5-дихлорпиридин-4-ил)этиловый эфир 3-циклопропилметокси-4-дифторметоксибензойной кислоты.
9. Соединение по п.5, где Z представляет собой CHR5, где R5 представляет собой линейный или разветвленный (C1-C4)алкил.
10. Соединение по п.5, где Z представляет собой CR4R5, где R4 и R5 образуют с атомом углерода, с которым они соединены, кольцо, имеющее 3, 4, 5 или 6 углеродных атомов.
11. Соединение по п.10, где R4 и R5 образуют с атомом углерода, с которым они соединены, кольцо, имеющее 3 углеродных атома.
12. Соединение по п.1, где R' представляет собой трет-бутил.
13. Соединение по п.1 или 9, где R5 представляет собой метил.
14. Соединение по п.1, где NR8R9 соединен с (С1-С10)алкилом, образуя насыщенные, частично насыщенные или ненасыщенные пиперидиновые, оксазиновые, имидазольные кольца.
15. Способ получения соединения по любому из пп.1-14, включающий стадию добавления кислоты формулы AZCOOH, или хлорангидрида формулы AZCOCl, или изоцианата формулы AZNCO, где А и Z такие, как определено выше, к раствору производного спирта общей формулы (2)
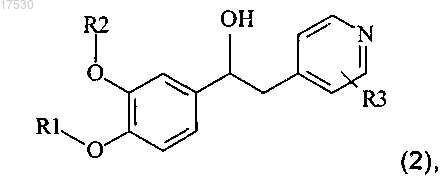
где R1, R2 и R3 такие, как определено выше.
16. Соединение общей формулы (2)
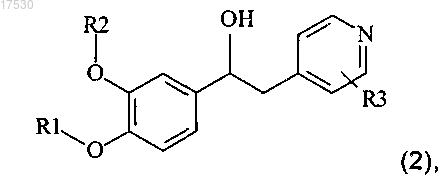
где R1, R2 и R3 такие, как определено в п.1,
и его N-оксиды по пиридиновому кольцу при условии, что указанное соединение не представляет собой 1-(3-циклопентилокси-4-метоксифенил)-2-(3,5-дихлорпирид-4-ил)этанол и 1-(3-циклопентилокси-4-дифторметоксифенил)-2-(3,5-дихлорпирид-4-ил)этанол.
17. Фармацевтическая композиция, содержащая соединение по любому из пп.1-14 в качестве активного ингредиента в смеси с одним или более фармацевтически приемлемыми носителями и/или эксципиентами.
18. Фармацевтическая композиция по п.17, пригодная для ингаляционного введения.
19. Применение соединения по любому из пп.1-14 в качестве лекарственного средства для предупреждения и/или лечения заболевания, характеризующегося повышенной активностью фосфодиэстеразы 4 (PDE4), и/или при котором желательным является ингибирование активности PDE4.
20. Применение соединения по любому из пп.1-14 для изготовления лекарственного средства, имеющего ингибирующую активность в отношении фермента PDE4.
21. Применение соединения по любому из пп.1-14 для изготовления лекарственного средства для предупреждения и/или лечения заболевания, характеризующегося повышенной активностью фосфодиэстеразы 4 (PDE4), и/или при котором желательным является ингибирование активности PDE4.
22. Применение по п.21, где заболевание является заболеванием дыхательных путей, характеризующимся их обструкцией.
23. Применение по п.22, где заболевание выбрано из группы, состоящей из астмы, хронического бронхита или хронического обструктивного заболевания легких.
24. Способ лечения воспалительного заболевания, расстройства или состояния, характеризующегося или ассоциированного с нежелательной воспалительной иммунной реакцией либо индуцированного избыточной секрецией TNF-α и PDE4 или ассоциированного с ней, который включает введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения по любому из пп.1-14.
Текст
Изобретение относится к ингибиторам фермента фосфодиэстеразы 4(PDE4). Конкретнее, изобретение относится к соединениям, являющимся производными 1-фенил-2 пиридинилалкиловых спиртов, способам получения таких соединений, содержащим их композициям и их терапевтическому применению. 017530 Область изобретения Настоящее изобретение относится к ингибиторам фермента фосфодиэстеразы 4 (PDE4). Конкретнее, изобретение относится к соединениям, являющимся производными 1-фенил-2-пиридинилалкиловых спиртов, способам получения таких соединений, содержащим их композициям и их терапевтическому применению. Предпосылки изобретения Ряд серьезных респираторных заболеваний, включая астму и хроническое обструктивное заболевание лгких (COPD), характеризуется обструкцией дыхательных путей. Причины обструкции дыхательных путей включают отек стенок дыхательных путей, повышенное образование слизи и воспаление. В настоящее время лекарственные средства для лечения таких респираторных заболеваний как астма и COPD вводят посредством ингаляции. Одним из преимуществ ингаляционного способа введения перед системным является возможность доставки лекарственного средства непосредственно к сайту его действия, избегая любых системных побочных эффектов и тем самым обеспечивая более быструю клиническую реакцию и более высокий терапевтический индекс. Ингалируемые кортикостероиды являются на данный момент средствами выбора для поддерживающей терапии астмы, а вместе с бронходилататорными бета-2-агонистами - для облегчения острых симптомов. Они составляют основу современной терапии данного заболевания. В настоящее время лечение COPD является в основном симптоматическим с помощью бронходилатационной терапии ингалируемыми антихолинергическими средствами и ингалируемыми агонистами бета-2-адренорецепторов. Однако при COPD, в отличие от астмы, кортикостероиды не снижают воспалительную реакцию. Другой класс терапевтических средств, которые вследствие их противовоспалительного действия были исследованы для лечения таких воспалительных респираторных заболеваний как астма и COPD,представлен ингибиторами ферментов фосфодиэстераз (PDE), в частности фосфодиэстеразы 4-го типа(далее - PDE4). В уровне техники раскрыты разнообразные соединения, действующие как ингибиторы PDE4. Однако применимость различных ингибиторов PDE4 первого поколения, таких как ролипрам и пикламиласт,ограничена вследствие их нежелательных побочных эффектов. Указанные эффекты включают тошноту и рвоту из-за их воздействия на PDE4 центральной нервной системы, а также секрецию желудочного сока в результате действия на PDE4 париетальных клеток пищеварительного тракта. Причины побочных эффектов широко изучены. Обнаружено, что PDE4 существует в двух отличных формах, представляющих собой различные конформации, которые были обозначены как высокоаффинный сайт связывания ролипрама, или HPDE4,главным образом присутствующий в центральной нервной системе и в париетальных клетках, и как низкоаффинный сайт связывания ролипрама, или LPDE4, которые находятся в иммунных и воспалительных клетках (Jacobitz S. et al., Mol. Pharmacol, 1996, 50, 891-899). По-видимому, несмотря на то, что обе формы проявляют каталитическую активность, они отличаются в отношении своей чувствительности к ингибиторам. В частности, оказывается, что соединения с более высокой аффинностью к LPDE4 менее склонны вызывать такие побочные эффекты как тошнота, рвота и повышенная секреция желудочного сока. Направленные на LPDE4 усилия привели к небольшому улучшению в избирательности ингибиторов PDE4 второго поколения, таких как циломиласт и рофлумиласт. Однако даже эти соединения не обладают хорошей избирательностью в отношении LPDE4. В уровне техники также раскрыты и другие классы соединений, действующих как ингибиторыPDE4. Например, в EP 1634606 описаны, среди прочего, такие производные кетонов как производные бензофурана или 1,3-бензодиоксола. В WO 9402465 описаны, среди прочего, производные кетонов общей формулы где R1 представляет собой низший алкил, a R2 может быть алкилом, алкенилом, циклоалкилом, циклоалкенилом, циклотиоалкилом или циклотиоалкенилом. В WO 9535281 (Celltech Therapeutics) описаны тризамещенные производные фенила. Обе заявки обходят молчанием проблему побочных эффектов, связанных с ингибированием HPDE4 и не сообщают данных об аффинности к HPDE4 и LPDE4. Таким образом, несмотря на то, что к настоящему времени раскрыты различные ингибиторы PDE4,все еще существует необходимость в более действенных и лучше переносимых соединениях. В частности, было бы очень полезно предоставить соединения с большей избирательностью, на-1 017530 пример, обладающие более высокой аффинностью к LPDE4, чем к HPDE4, для того, чтобы смягчить или избежать побочных эффектов, связанных с ее ингибированием. Настоящее изобретение решает эти проблемы, предоставляя ингибиторы PDE4, имеющие улучшенную избирательность к LPDE4. По существу, теперь обнаружено, что наличие у ингибитора PDE4 дополнительной группировки,взаимодействующей с активным сайтом PDE4, улучшает избирательность ингибиторов к LPDE4. Ингибиторы PDE4 по настоящему изобретению эффективно действуют при ингаляционном введении и могут быть охарактеризованы хорошей стойкостью в легких и кратковременным системным воздействием. Краткое изложение сущности изобретения Изобретение направлено на соединения, действующие как ингибиторы фермента фосфодиэстеразы 4 (PDE4), способы получения указанных соединений, содержащие их композиции и их терапевтическое применение. В частности, изобретение направлено на производные 1-фенил-2-пиридинилалкиловых спиртов общей формулы (I)R4 независимо выбран из H; иR5 независимо выбран из группы, состоящей из линейного или разветвленного (C1-C4)алкила;HNCOOR', где R' представляет собой линейный или разветвленный (C1-C4)алкил, или R4 и R5 образуют с атомом углерода, с которым они соединены, кольцо, имеющее 3, 4, 5 или 6 углеродных атомов;R1 и R2 являются разными или одинаковыми и независимо выбраны из группы, состоящей из линейного или разветвленного (C1-C6)алкила, возможно замещенного одним или более заместителями, выбранными из (C3-C7)циклоалкила или фтора;R3 представляет собой один или более заместителей, независимо выбранных из группы, состоящей из атомов галогенов,А выбран из группы, состоящей из фенила, нафтила, пиридила, имидазолила, бензимидазолила, дигидробензооксазинила, тетрагидропуринила, дигидробензоимидазолила, дигидробензодиоксинила, хинолинила, тиазолидинила, бициклогептанила и индолила, в которых могут присутствовать один или более возможных заместителей Rx, которые могут быть одинаковыми или разными и независимо выбранными из группы, состоящей из линейного или разветвленного (C1-C6)алкила, возможно замещенного одним или более (C3C7)циклоалкилами; фенила;OR7, где R7 выбран из группы, состоящей из (C1-C10)алкила, возможно замещенного одним или более (C3-С 7)циклоалкилами или атомами фтора;(C1-C10)алкил-NR8R9, где R8 и R9 независимо выбраны из группы, состоящей из H, линейного или разветвленного (C1-C6)алкила, и они образуют с атомом азота, с которым они соединены, насыщенное,частично насыщенное или ненасыщенное кольцо, где это кольцо возможно замещено (С 1-С 4)алкилом; и атомов галогенов;NR10R11, где R10 и R11 являются разными или одинаковыми и независимо выбраны из группы, состоящей из-2 017530 Н; линейного или разветвленного (C1-C6)алкила, возможно замещенного фенилом или (C3C7)циклоалкилом; оксо;HNSO2R13, где R13 представляет собой (C1-C4)алкил; COOR17, где R17 представляет собой Н, и их фармацевтически приемлемые соли и N-оксиды по пиридиновому кольцу. Предпочтительно А представляет собой фенил, возможно замещенный одной или более группами Rx. Предпочтительно А представляет собой имидазолил или пиридил. Предпочтительно R3 представляет собой хлор. Соединение по изобретению может иметь общую формулу (II) где R1, R2, Z и А такие, как определено выше. Предпочтительно Z представляет собой (CH2)m, и m равно 0. Соединение по изобретению может представлять собой 1-(3-циклопропилметокси-4 дифторметоксифенил)-2-(3,5-дихлор-1-оксипиридин-4-ил)этиловый эфир 3-циклопропилметокси-4 дифторметоксибензойной кислоты. Соединение по изобретению также может представлять собой 1-(3-циклопропилметокси-4 дифторметоксифенил)-2-(3,5-дихлорпиридин-4-ил)этиловый эфир 3-циклопропилметокси-4 дифторметоксибензойной кислоты. Предпочтительно Z представляет собой CHR5, где R5 представляет собой линейный или разветвленный (C1-C4)алкил. Предпочтительно Z представляет собой CR4R5, где R4 и R5 образуют с атомом углерода, с которым они соединены, кольцо, имеющее 3, 4, 5 или 6 углеродных атомов. Предпочтительно R4 и R5 образуют с атомом углерода, с которым они соединены, кольцо, имеющее 3 углеродных атома. В соединении по изобретению R' может представлять собой трет-бутил. В соединении по изобретению R5 может представлять собой метил. Предпочтительно в соединении по изобретению NR8R9 соединен с (C1-С 10)алкилом, образуя насыщенные, частично насыщенные или ненасыщенные пиперидиновые, оксазиновые, имидазольные кольца. Согласно данному изобретению также предложен способ получения вышеуказанного соединения,включающий стадию добавления кислоты формулы AZCOOH, или хлорангидрида формулы AZCOCl,или изоцианата формулы AZNCO, где А и Z такие, как определено выше, к раствору производного спирта общей формулы (2) где R1, R2 и R3 такие, как определено выше. Кроме того, данное изобретение относится к соединению общей формулы (2) где R1, R2 и R3 такие, как определено выше, и его N-оксидам по пиридиновому кольцу, при условии,что указанное соединение не представляет собой 1-(3-циклопентилокси-4-метоксифенил)-2-(3,5 дихлорпирид-4-ил)этанол или 1-(3-циклопентилокси-4-дифторметоксифенил)-2-(3,5-дихлорпирид-4 ил)этанол. Согласно данному изобретению также предложена фармацевтическая композиция, содержащая вышеуказанное соединение в качестве активного ингредиента в смеси с одним или более фармацевтически приемлемыми носителями и/или эксципиентами. Предпочтительно фармацевтическая композиция пригодна для ингаляционного введения. Данное изобретение также относится к применению вышеуказанного соединения в качестве лекарственного средства для предупреждения и/или лечения заболевания, характеризующегося повышенной-3 017530 активностью фосфодиэстеразы 4 (PDE4), и/или при котором желательным является ингибирование активности PDE4. Кроме того, данное изобретение относится к применению вышеуказанного соединения для изготовления лекарственного средства, имеющего ингибирующую активность в отношении фермента PDE4. Согласно данному изобретению также предложено применение вышеуказанного соединения для изготовления лекарственного средства для предупреждения и/или лечения заболевания, характеризующегося повышенной активностью фосфодиэстеразы 4 (PDE4), и/или при котором желательным является ингибирование активности PDE4. Предпочтительно заболевание является заболеванием дыхательных путей, характеризующимся их обструкцией. Более предпочтительно заболевание выбрано из группы, состоящей из астмы, хронического бронхита или хронического обструктивного заболевания легких. Согласно данному изобретению также предложен способ лечения воспалительного заболевания,расстройства или состояния, характеризующегося или ассоциированного с нежелательной воспалительной иммунной реакцией, либо индуцированного избыточной секрецией TNF- и PDE4 или ассоциированного с ней, который включает введение нуждающемуся в этом субъекту терапевтически эффективного количества вышеуказанного соединения. Определения Используемый здесь термин атомы галогенов включает фтор, хлор, бром и йод, предпочтительно хлор. Используемое здесь выражение линейный или разветвленный (C1-Cx)алкил, где x является целым числом больше 1, относится к алкильным группам с прямой или разветвленной цепью, где количество составляющих атомов углерода находится в диапазоне от 1 до x. В частности, алкильными группами являются метил, этил, н-пропил, изопропил и трет-бутил. Возможно в указанных группах один или более атомов водорода могут быть заменены атомами галогенов, предпочтительно хлором или фтором. Производные выражения (С 2-С 6)алкенил и (С 2-С 6)алкинил истолковываются аналогичным образом. Используемое здесь выражение (С 3-Cx)циклоалкил, где x является целым числом больше 3, относится к циклическим неароматическим углеводородным группам, содержащим от 3 до x углеродных атомов в кольце. Примеры включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Возможно в указанных группах один или более атомов водорода могут быть заменены атомами галогенов, предпочтительно хлором или фтором. Используемое здесь выражение (C3-C7)гетероциклоалкил относится к циклическим неароматическим углеводородным группам, содержащим один или более гетероатомов (например, N, S или О), возможно замещенным одним или более (C1-C4)алкилами. Производное выражение (С 3-Сх)циклоалкоксил истолковывается аналогичным образом. Производное выражение (С 5-Сх)циклоалкенил, где x является целым числом больше 5, истолковывается аналогичным образом. Используемое здесь выражение кольцевая система относится к моно- или бициклическим кольцевым системам, которые могут быть насыщенными, частично ненасыщенными или ненасыщенными, таким как арил, (C3-C8)циклоалкил или гетероарил, имеющим от 5 до 10 атомов в кольце, где по меньшей мере один кольцевой атом является гетероатомом (например N, S или O). Примеры соответствующих моноциклических систем включают фенил, пиридил, пиперазинил, пиперидинил, морфолинил, циклопентил, циклогексил, циклогексенил, циклогептил, диоксан, имидазол и имидазолидин. Примеры соответствующих бициклических систем включают нафтил, хинолинил, изохинолинил,инденил, флуорен, бензимидазол, бензимидазолидин, ксантин, а также их частично или полностью гидрированные производные. Подробное описание изобретения Изобретение направлено на класс соединений, действующих как ингибиторы фермента фосфодиэстераза 4 (PDE4). Указанный класс соединений ингибирует превращение циклических нуклеотидов, в частности циклического аденозинмонофосфата (сАМР), в их неактивные 5'-мононуклеотидные формы. В дыхательных путях физиологические реакции на повышенные внутриклеточные уровни циклических нуклеотидов, в частности сАМР, приводят к подавлению активности иммунных и провоспалительных клеток, таких как мастоциты, макрофаги, Т-лимфоциты, эозинофилы и нейтрофилы,приводя к уменьшению высвобождения воспалительных медиаторов, которые включают такие цитокины как IL-1 (интерлейкин), SL-3 и фактор некроза опухоли-альфа (TNF-). Это также приводит к расслаблению гладкой мускулатуры дыхательных путей и уменьшению оте-4 017530 ка. Ранее был идентифицирован каталитический сайт PDE4: он в основном состоит из гидрофобной области, в которой присутствуют два субкармана, S0 и S1, и гидрофильной области, содержащей ионы металлов Zn2+ and Mg2+, которая в свою очередь состоит из субкармана S2, располагающегося вокруг ионов металлов, и субкармана S3, который отходит от центра гидрофобного кармана под углом примерно 90. Большинство соединений из уровня техники имеют группировку, способную взаимодействовать с субкарманами S0 и S1 гидрофобной области, такую как замещенная катехинная группа, а также другую группировку, способную косвенно взаимодействовать с ионами металлов субкармана S2, например гетероцикл, такой как пиридин или пирролидон. Настоящее изобретение направлено на соединения, которые были сконструированы таким образом,чтобы они могли поддерживать взаимодействия с субкарманами S0 и S1 посредством замещенной катехинной группировки и взаимодействие с областью ионов металлов с помощью пиридинового кольца подобно другим известным ингибиторам PDE4, но отличались бы присутствием дополнительной группы,способной устанавливать дополнительное взаимодествие с субкарманом S3. В частности, настоящее изобретение относится к производным 1-фенил-2-пиридинилалкиловых спиртов общей формулы (I) Фармацевтически приемлемые соли включают соли, полученные взаимодействием исходного соединения, действующего в качестве основания, с неорганической или органической кислотой с образованием соли, например солей соляной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, камфорсульфоновой кислоты, щавелевой кислоты, малеиновой кислоты, янтарной кислоты и лимонной кислоты. Специалисту в данной области очевидно, что соединения общей формулы (I) могут содержать асимметрические центры. Таким образом, изобретение также включает оптические стереоизомеры и их смеси. В том случае, если соединения по изобретению имеют по меньшей мере один асимметрический центр, они, соответственно, могут существовать в виде энантиомеров. В том случае, если соединения по изобретению обладают двумя или более асимметрическими центрами, они могут дополнительно существовать в виде диастереоизомеров. Понятно, что все такие изомеры и их смеси в любом соотношении охватываются объемом настоящего изобретения. Было обнаружено, что соединения общей формулы (I) показывают in vitro ингибирующую активность в отношении фермента PDE4 в наномолярной области и что они, оказывается, обладают хорошей активностью в легких при внутритрахеальном введении в животных моделях COPD. Также в некоторых случаях они демонстрируют длительные пульмонарные уровни в легких, при этом не демонстрируя обнаружимых уровней в плазме, что является признаком кратковременного системного воздействия. Одно из возможных объяснений неожиданно высокой избирательности этих соединений к LPDE4 по сравнению с HPDE4 заключается в том, что все они имеют группировку, которая благодаря заместителю А может в точности соответствовать субкарману S3 каталитического сайта фермента PDE4. Более того, как это видно из результатов, представленных в примере 13, было обнаружено, что представитель соединения по данному изобретению в 1319 раз более избирателен к LPDE4 по сравнению с HPDE4. Предпочтительной группой соединений общей формулы (I) являются такие соединения, в которых 2-пиридинильное кольцо замещено в положениях 3 и 5 двумя атомами хлора в соответствии с общей формулой (II)-5 017530 Первая группа более предпочтительных соединений общей формулы (II) представляет собой группу, в которойZ представляет собой (CH2)m, где m равно 0; и А такой, как определено выше. Вторая группа более предпочтительных соединений общей формулы (II) представляет собой группу, в которой:Z представляет собой CHR5, где R5 представляет собой линейный или разветвленный (C1-C4)алкил,предпочтительно метил; и А такой, как определено выше. Третья группа более предпочтительных соединений общей формулы (II) представляет собой группу, в которой:Z представляет собой CR4R5, где оба R4 и R5 образуют кольцо с атомом углерода, с которым они связаны, имеющее 3, 4, 5 или 6 атомов углерода, предпочтительно имеющее 3 атома углерода; и А является таким, как определено выше. В одном из предпочтительных воплощений А является замещенным, и Rx выбран из группы, состоящей из линейного или разветвленного (C1-C6)алкила или OR7, где R7 является таким, как определено выше. В другом предпочтительном воплощении А является замещенным, и Rx представляет собой группу,способную улучшить растворимость в воде молекулы в целом, такую как NR10R11 или HNSO2R13, где R10,R11 и R13 являются такими, как определено выше. В конкретном воплощении изобретения А выбран из группы, состоящей из пиридина или имидазола и наиболее предпочтительно пиридина. Согласно предпочтительному воплощению настоящее изобретение представляет следующие соединения, перечисленные ниже: Согласно определению IC50 соединения по изобретению преимущественно характеризуются более высокой избирательностью к LPDE4, чем к HPDE4. В случае LPDE4 IC50 представляет собой молярную концентрацию тестируемого соединения, обеспечивающую 50%-ное ингибирование исчезновения сАМР при оценке согласно методике, приведенной вCortijo J. et al., Br J Pharmacol 1993, 108: 562-568, тогда как в случае HPDE4 IC50 представляет собой молярную концентрацию испытываемого соединения, обеспечивающую 50%-ное ингибирование связывания [H3] ролипрама, при оценке согласно методике, приведенной в Duplantier AJ et al., J Med Chem 1996; 39: 120-125. Преимущественно отношение HPDE4/LPDE4 IC50 для соединений по изобретению выше 5, предпочтительнее выше 10, более предпочтительно выше 20 и еще более предпочтительно выше 100. Соединения общей формулы (I) могут быть получены согласно методам, раскрытым в уровне техники. Некоторые способы, которые могут быть использованы, описаны ниже и представлены на схеме,но они не должны рассматриваться как ограничение области методов синтеза, доступных для получения соединений по изобретению. Например, в соответствии с частным воплощением настоящего изобретения (см. схему), соединения общей формулы (I) могут быть получены согласно способу, включающему следующие стадии: 1-ая стадия - восстановление производного этанона общей формулы (1) с получением производного спирта общей формулы (2) (путь А). Взаимодействие может быть осуществлено с использованием боргидрида натрия (NaBH4) в таком растворителе как метанол, при комнатной температуре в атмосфере азота. 2-ая стадия - добавление подходящей кислоты формулы AZCOOH к раствору производного спирта общей формулы (2) с получением соединения общей формулы (I). Взаимодействие осуществляется в присутствии подходящего сильного основания, например диизопропиламида лития (LDA), NaH, диметиламинопиридина (DMAP), и в присутствии конденсирующего агента, например гидрохлорида 1-этил-3-[3-диметиламинопропил]карбодиимида (EDC) и Nгидроксибензотриазола (НОВТ), в таком растворителе как дихлорметан, в атмосфере азота. Могут быть использованы другие растворители, например диметилформамид (DMF), тетрагидрофуран (THF), хлороформ, диоксан или любой другой апротонный растворитель, известный специалисту в соответствии с современным уровнем техники. В частном воплощении взаимодействие может быть осуществлено без растворителя. В случае карбоновой кислоты, A-Z-COOH несет такие активные группы как гидроксильная, карбоксильная, тио- или аминогруппа, и они могут потребовать защиты такими защитными группами как третбутоксикарбонил, бензил, бензилоксикарбонил, метил, триметилсилил и пр., и, на определенном этапе синтеза, снятия защиты для получения снова свободных активных групп; после этого освобожденная группа может вступать в реакцию с подходящими реагентами, такими как алкилирующие, ацилирующие,сульфонирующие и тому подобные агенты. Введение и снятие защиты функциональных групп описана в "Protective Groups in Organic Chemistry" 3rd edition, T.W. Greene and P.G.M. Wuts, Wiley-Interscience (1999) и "Protecting Groups", P. J. Kocienski, Georg Thieme Verlag (1994). Соединения общей формулы (I) могут быть также получены добавлением подходящего хлорангидрида общей формулы A-Z-COCl или подходящего изоцианата общей формулы A-Z-NCO к раствору производного спирта общей формулы (2) с подходящим основанием в стехиометрическом или каталитическом количестве по методикам, хорошо известным специалистам. Альтернативно, производное спирта общей формулы (2) может быть получено взаимодействием производного бензальдегида формулы (3) с производным метилпиридина формулы (4) (путь В), используя бис-(триметилсилил)амид лития (LiHMDS) или сходные сильные основания и растворитель, такой как тетрагидрофуран (THF) или любые другие апротонные растворители. Промежуточные соединения общих формул (3) и (4) доступны на рынке или могут быть получены по методикам, описанным в литературе и хорошо известным специалистам.N-оксиды по 2-пиридинильному кольцу соединений общей формулы (I) могут быть получены по методикам, описанным в литературе и хорошо известным специалистам. Например, они могут быть получены растворением соединения общей формулы (I) в CH2Cl2 или CHCl3 с последующим добавлением к полученному раствору окисляющего агента, например м-хлорпербензойной кислоты (mCPBA). Могут быть использованы другие окисляющие агенты, такие как перекись водорода, пербензойная кислота и- 15017530 перуксусная кислота. Для тех соединений, в которых А является кольцом, замещенным функциональной группой, чувствительной к окислению, соответствующие N-оксиды получают альтернативным путем, проводя стадию окисления перед 2-ой стадией пути А. Настоящее изобретение также предлагает фармацевтические композиции соединений общей формулы (I) в смеси с один или более фармацевтически приемлемых носителей, например тех, которые описаны в Remington's Pharmaceutical Sciences Handbook, XVII Ed., Mack Pub., N.Y., USA. Введение соединений по настоящему изобретению может выполняться так, как это необходимо пациенту, например перорально, назально, парентерально (подкожно, внутривенно, внутримышечно, интрастернально и инфузией), ингаляционно, ректально, вагинально, местно, локально, трансдермально или путем введения в глаз. Для введения соединений по настоящему изобретению могут быть использованы различные твердые лекарственные формы для перорального применения, например таблетки, капсулы, желатиновые капсулы, таблетки в оболочке, гранулы, леденцы или порошки. Соединения по настоящему изобретению могут вводиться в чистом виде или в комбинации с различными фармацевтически приемлемыми носителями, разбавителями (например, сахарозой, маннитом, лактозой, крахмалами) и эксципиентами, известными в уровне техники, включая, но не ограничиваясь ими, суспендирующие агенты, вещества, повышающие растворимость, буферные агенты, связующие вещества, разрыхлители,консерванты, красители, ароматизаторы, смазывающие агенты и другие подобные компоненты. Кроме того, при введении соединений по настоящему изобретению преимущество имеют капсулы, таблетки и гели с контролируемым высвобождением. Также для введения соединений по изобретению могут быть использованы различные жидкие лекарственные формы для перорального применения, включая водные и неводные растворы, эмульсии,суспензии, сиропы и эликсиры. Такие лекарственные формы тоже могут содержать подходящие инертные разбавители, известные в области техники, к которой относится данное изобретение, например воду,и подходящие эксципиенты, также известные в данной области, например консерванты, смачивающие агенты, подсластители, ароматизаторы, а также агенты для эмульгирования и/или суспендирования соединений по изобретению. Соединения по настоящему изобретению могут быть введены, например,внутривенно в форме изотонического стерильного раствора. Другие препараты также возможны. Суппозитории для ректального введения соединений по настоящему изобретению могут быть изготовлены смешиванием соединения с подходящим эксципиентом, например маслом какао, салицилатами или полиэтиленгликолями. Композиции для вагинального введения могут иметь форму крема, геля, пасты, пены или аэрозоля,содержащего, в дополнение к активному ингредиенту, известные в этой области техники подходящие носители. Для местного введения фармацевтические композиции могут иметь форму кремов, мазей, линиментов, лосьонов, эмульсий, суспензий, гелей, растворов, паст, порошков, аэрозолей и капель, подходящих для применения на коже, глазах, ушах и носу. Местное применение может также включать трансдермальное введение с помощью трансдермальных пластырей. Для лечения заболеваний дыхательных путей соединения по изобретению предпочтительно вводят ингаляционным способом. Ингаляционные препараты включают ингалируемые порошки, пропеллентсодержащие дозированные аэрозоли или не содержащие пропеллентов ингаляционные композиции. Для применения в виде сухих порошков могут быть использованы известные в данной области однодозовые и мультидозовые ингаляторы. В этом случае порошком могут быть наполнены желатиновые,пластиковые или другие капсулы, картриджи или блистерные упаковки, или резервуар. Разбавитель или носитель, обычно нетоксичный и химически инертный к соединениям по изобретению, например лактоза или любая другая добавка, подходящая для улучшения вдыхаемой фракции,может быть добавлена к порошкообразному соединению по изобретению. Ингаляционные аэрозоли, содержащие пропелленты, например, гидрофторалканы, могут содержать соединения по изобретению либо в виде раствора, либо в дисперсной форме. Пропеллентсодержащие составы могут также содержать другие компоненты, например сорастворители, стабилизаторы и возможно прочие эксципиенты. Не содержащие пропелленты ингаляционные составы, содержащие соединения по изобретению,могут иметь форму растворов или суспензий в водной, спиртовой или водно-спиртовой среде и могут применяться с помощью известных на практике струйных или ультразвуковых небулайзеров или жидкостных дозированных небулайзеров типа Respimat. Соединения по изобретению могут вводиться как единственный активный агент, так и в комбинации с другими фармацевтически активными ингредиентами, включая используемые в настоящее время для лечения респираторных заболеваний, например бета 2-агонисты, кортикостероиды и антихолинергические и антимускариновые агенты. Дозировка соединений по настоящему изобретению зависит от различных факторов, включая конкретное заболевание, подлежащее лечению, серьезность симптомов, способ введения, частоту примене- 16017530 ния, конкретное используемое соединение, эффективность, токсикологический и фармакокинетический профиль соединения. Преимущественно, соединения общей формулы (I) могут вводиться, например, дозами от 0,001 до 1000 мг в сутки, предпочтительно от 0,1 до 500 мг в сутки. При введении ингаляционным способом дозировка соединений общей формулы (I) преимущественно составляет от 0,01 до 20 мг в сутки, предпочтительно от 0,1 до 10 мг в сутки. Преимущественно, соединения общей формулы (I) в чистом виде или в комбинации другими активными компонентами могут вводиться для предупреждения и/или лечения любых обструктивных респираторных заболеваний, например астмы, хронических бронхитов и хронического обструктивного заболевания лгких (COPD). Однако соединения общей формулы (I) могут вводиться для предупреждения и/или лечения любых заболеваний, требующих ингибирования PDE4. Указанные заболевания включают болезненные аллергические состояния, например атопические дерматиты, крапивницу, аллергические риниты, аллергические конъюнктивиты, весенние конъюнктивиты, эозинофильные гранулемы, псориаз, воспалительные артриты, ревматоидные артриты, септический шок, язвенные колиты, болезнь Крона, реперфузионное повреждение миокарда и мозга, хронический гломерулонефрит, эндотоксический шок, кистозный фиброз, артериальный рестеноз, атеросклероз, кератоз, ревматоидный спондилит, остеоартрит, пирез, сахарный диабет, пневмокониоз, токсическую и аллергическую контактную экзему, атопическую экзему, себорейную экзему, лихеноидный зудящий дерматит, солнечный ожог, зуд в анально-половой области, очаговую алопецию, гипертрофические рубцы, дискоидную красную волчанку, системную красную волчанку,фолликулярную и обширную пиодермию, эндогенную и экзогенную угревую сыпь, розовые угри, болезнь Бехчета, анафилактоидную пурпуру, нефриты, воспалительное заболевание кишечника, лейкемию,рассеянный склероз, желудочно-кишечные заболевания, аутоиммунные заболевания и т.п. Они также включают неврологические и психиатрические расстройства, такие как болезнь Альцгеймера, рассеянный склероз, амиотрофический латеральный склероз (ALS), множественная системная атрофия (MSA), шизофрения, болезнь Паркинсона, болезнь Хантингтона, болезнь Пика, депрессия, инсульт, повреждения спинного мозга. Далее настоящее изобретение будет описано в виде нижеследующих неисключительных примеров. Примеры Пример 1. Получение 3,5-дихлор-4-метилпиридина (Промежуточное соединение (4) на схеме). Диизопропиламин (70 мл, 500 ммоль) растворяли в сухом тетрагидрофуране (THF) (500 мл), раствор охлаждали до -10C и при помешивании по каплям добавляли бутиллитий (2,5 н. в гексане, 210 мл,525 ммоль). Через 30 мин раствор охлаждали до -20C и добавляли по каплям раствор 3,5 дихлорпиридина (66,6 г, 450 ммоль) в тетрагидрофуране (200 мл). Раствор перемешивали при -10C в течение 30 мин, затем охлаждали до -70C и по каплям добавляли раствор йодметана (50 мл, 1,6 моль) в тетрагидрофуране (100 мл). Реакционной смеси давали нагреться до комнатной температуры, гасили водой (100 мл) и экстрагировали диэтиловым эфиром (3100 мл); объединенные органические слои сушили над сульфатом натрия (5 г) и выпаривали досуха. Неочищенный продукт дважды кристаллизовали из водного этанола и затем из гексана с получением 3,5-дихлор-4-метилпиридина (49,9 г, 306 ммоль, выход 68%) в виде белого твердого вещества.MS/ESI+ (масс-спектрометрия с электрораспылительной ионизацией) 162-164-166 m/z[MH]+. Пример 2. Получение 2-(3,5-дихлорпиридин-4-ил)-1-(3,4-диметоксифенил)этанона (Промежуточное соединение (1) на схеме). Раствор 3,5-дихлор-4-метилпиридина (2,06 г, 12,7 ммоль) в сухом тетрагидрофуране (30 мл) охлаждали до -78 C, затем при помешивании по каплям добавляли 1,8 М раствор диизопропиламида лития в тетрагидрофуране (7,4 мл, 13,3 ммоль), поддерживая температуру ниже -70C. Поучившийся раствор перемешивали 30 мин, затем добавляли по каплям раствор 3,4-диметоксибензоилхлорида (2,55 г, 12,7 ммоль) в сухом тетрагидрофуране (20 мл), поддерживая температуру ниже -70C. После перемешивания в течение 15 мин добавляли лед (20 г) и затем еще 500 мл воды. Смесь экстрагировали этилацетатом (2 50 мл), объединенные органические слои сушили над сульфатом натрия и выпаривали под пониженным давлением с получением масла, которое очищали флэш-хроматографией (элюент: смесь этилацетат/петролейный эфир от 10/90 до 30/70 об./об.). Было получено 2,1 г (6,4 ммоль, выход 52%) указанного в заголовке соединения в виде белого твердого вещества.MS/ESI+ 326-328-330 m/z [MH]+; 1 Н ЯМР (CDCl3 калиброванный по 7,26 м.д.) 3,91 и 3,95 (2s, 6H), 4,62 (s, 2H), 6,91-6,95 (d, 1H), 7,537,54 (d, 1H), 7,67-7,75 (dd, 1H), 8,49 (s, 2H). Используя соответствующие растворители, при помощи вышеуказанного способа были получены следующие промежуточные соединения. Пример 3. Получение 2-(3,5-дихлорпиридин-4-ил)-1-(3,4-диметоксифенил)этанола (Промежуточное соединение (2) на схеме). Способ А. Боргидрид натрия NaBH4 (45,2 мг, 2,5 экв.) добавляли к суспензии 2-(3,5-дихлорпиридин-4-ил)-1(3,4-диметоксифенил)этанона (150 мг, 1 экв.) в CH3OH (5 мл) при комнатной температуре в атмосфере азота. Смесь перемешивали при комнатной температуре в течение ночи, затем реакцию гасили водой и экстрагировали этилацетатом (EtOAc). Органический слой сушили над Na2SO4 и выпаривали растворитель. Сырое вещество очищали флэш-хроматографией на силикагеле в градиенте элюции от смеси петролейный эфир/EtOAc 9/1 об./об. до смеси петролейный эфир/EtOAc 7/3 об./об., в результате чего получали 75 мг указанного в заголовке соединения (выход 50%).MS/ESI+328-330-332[МН]+ Используя соответствующие растворители, при помощи вышеуказанного способа были получены следующие промежуточные соединения. Таблица 2 Пример 4. Получение 2-(3,5-дихлорпиридин-4-ил)-1-(3,4-диметоксифенил)этанола (Промежуточное соединение (2) на схеме). Путь В. 3,5-Дихлор-4-метилпиридин (500 мг, 1 экв.) растворяли в сухом THF (2 мл) в атмосфере азота при -60C.LiN(TMS)2 (1,0 моль в THF, 3,38 мл, 1,1 экв.) добавляли по каплям с помощью шприца, поддерживая температуру ниже -55C. Пожелтевшую смесь перемешивали при -60C примерно 30 мин. Затем с помощью шприца добавляли по каплям раствор 3,4-диметоксибензальдегида (513 мг, 1 экв.) в сухом THF (2 мл), поддерживая- 18017530 температуру ниже -55C. После этого смесь медленно нагревали до комнатной температуры и перемешивали при комнатной температуре примерно 2 ч. Затем ее гасили водой и экстрагировали EtOAc. Органический слой сушили над Na2SO4 и выпаривали растворитель. Неочищенный продукт растирали с Et2O и фильтровали с получением 741 мг указанного в заголовке соединения в виде белого твердого вещества (выход 73%).MS/ESI+ 328-330-332 [МН]+. Пример 5. Получение 2-(3,5-дихлорпиридин-4-ил)-1-(3,4-диметоксифенил)этилового эфира (3)-2-(4 изобутил-фенил)пропионовой кислоты (соединение 1). Гидрохлорид 1-этил-3-[3-диметиламинопропил]карбодиимида (EDC.HCl) (345 мг, 3 экв.) добавляли к раствору 2-(3,5-дихлорпиридин-4-ил)-1-(3,4-диметоксифенил)этанола (200 мг, 1 экв.), (S)-2-(4 изобутилфенил)пропионовой кислоты (148 мг, 1,2 экв.) и 4-диметиламинопиридина (DMAP) (37 мг, 0,5 экв.) в сухом CH2Cl2 (8 мл) при комнатной температуре в атмосфере азота. Смесь перемешивали при комнатной температуре в течение ночи, затем обрабатывали насыщенным раствором NH4Cl (20 мл) и экстрагировали EtOAc (2 20 мл). Объединенный органический слой сушили над Na2SO4 и выпаривали растворитель. После очистки неочищенного продукта флэш-хроматографией на силикагеле в градиенте элюции (петролейный эфир/EtOAc от 9/1 до 7/3 об./об.) получали 259 мг чистого соединения. Используя соответствующие реагенты, при помощи вышеуказанного пути были получены следующие соединения. Таблица 3(S)-2-(4-изобутилфенил)пропионовой кислота (соединение 13). Соединение 1 (51,5 мг, 0,1 ммоль) растворяли в дихлорметане CH2Cl2 (1 мл). Затем добавляли мхлорпербензойную кислоту (mCPBA, 15 мг, 0,12 ммоль) и получившийся раствор перемешивали при- 21017530 комнатной температуре 2 ч. После этого смесь разбавляли CH2Cl2 (5 мл) и экстрагировали 1 н. NaOH (5 мл). Органическую фазу сушили над Na2SO4 и выпаривали растворитель. После очистки неочищенного продукта посредством препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) получали 37 мг указанного в заголовке соединения. Используя соответствующие реагенты, при помощи того же самого пути были получены следующие соединения. Таблица 4 Соединения 26-101 были получены аналогично методам, описанным выше в примерах, и согласно ранее изложенной общей схеме синтеза с использованием соответствующих реагентов. Пример 7. Получение 2-(3,5-дихлорпиридин-4-ил)-1-(3,4-диметоксифенил)этилового эфира 2-(4 аминофенил)пропионовой кислоты (соединение 16). Соединение 10 (50 мг, 0,1 ммоль) растворяли в диметилформамиде (DMF) (3 мл). Добавляли хлорид олова (SnCl2 2 Н 2 О, 113 мг, 0,5 ммоль) и получившуюся смесь перемешивали при комнатной температуре 17 ч. Затем смесь разбавляли водой (15 мл) и экстрагировали Et2O (230 мл). Органическую фазу обезвоживали Na2SO4 и выпаривали растворитель. После очистки неочищенного продукта посредством препаративной ВЭЖХ получали 10 мг указанного в заголовке соединения. Пример 8. Получение 2-(3,5-дихлорпиридин-4-ил)-1-(3,4-диметоксифенил)этилового эфира 2-(4 метансульфониламинофенил)пропионовой кислоты (соединение 17) Соединение 16 (26 мг, 0,05 ммоль) растворяли в сухом CH2Cl2 (10 мл) в атмосфере азота. Раствор охлаждали до 0C и добавляли триэтиламин (0,009 мл, 0,066 ммоль) и метансульфонилхлорид (0,0052 мл,0,06 ммоль). Затем смеси давали прореагировать при комнатной температуре в течение 17 ч. После этого реакционную смесь разбавляли водой (15 мл) и экстрагировали AcOEt (230 мл). Органическую фазу сушили над Na2SO4 и выпаривали растворитель. После очистки неочищенного продукта посредством препаративной ВЭЖХ получали 10 мг указанного в заголовке соединения в виде смеси диастереоизомеров. Таблица 6 Пример 9. Получение 1-(3-циклопропилметокси-4-дифторметоксифенил)-2-(3,5-дихлор-1 оксипиридин-4-ил)-этанола (соединение 18) Промежуточное соединение 2b (100 мг, 0,25 ммоль) растворяли в CHCl3 (3 мл). К полученному раствору добавляли м-хлорпербензойную кислоту (mCPBA, 80 мг, 0,46 ммоль) и выдерживали при 0C в течение ночи. Затем смесь разбавляли CHCl3 (5 мл) и промывали 1 н. NaOH (5 мл). Органическую фазу сушили над Na2SO4 и выпаривали растворитель. Неочищенный продукт очищали кристаллизацией из этанола. После фильтрации белого твердого вещества и промывки петролейным эфиром получали 70 мг указанного в заголовке соединения. Используя соответствующие реагенты, при помощи того же самого пути были получены следующие соединения. Пример 10. Получение гидрохлорида 1-(3-циклопропилметокси-4-дифторметоксифенил)-2-(3,5 дихлор-1-оксипиридин-4-ил)этилового эфира 4-(2-пиперидин-1-ил-этокси)бензойной кислоты (соединение 25). Гидрохлорид 1-этил-3-[3-диметиламинопропил]карбодиимида (EDC.HCl) (55 мг, экв.) добавляли к раствору соединения 18 (60 мг, 0,14 ммоль), 4-(2-пиперидин-1-ил-этокси)бензойной кислоты (81 мг, 0,28 экв.) и 4-диметиламинопиридина (DMAP) (37 мг, 0,5 экв.) в сухом DMF (4 мл) при комнатной температуре в атмосфере азота. Смесь перемешивали при комнатной температуре в течение ночи, затем обрабатывали насыщенным раствором NH4Cl (20 мл) и экстрагировали EtOAc (220 мл). Объединенные органические слои сушили над Na2SO4 и выпаривали растворитель. Неочищенный продукт очищали посредством препаративной ВЭЖХ. Маслянистый остоток растворяли в этилацетате (2 мл) и добавляли с небольшим избытком 1 М раствор сухого HCl в этилацетате. После выпаривания растворителя и кристаллизации осадка из смеси метанола и диэтилового эфира получали 14 мг гидрохлорида. Таблица 8ESI = электрораспыление Фармакологическая активность соединений по изобретению. Пример 11. Определение PDE4 ингибирующей активности in vitro в бесклеточном тесте В качестве источника фермента PDE4 использовали человеческую моноцитарную клеточную линию U937. Клетки культивировали, собирали и приготавливали надосадочную фракцию главным образом так, как описано в Torphy TJ et al., J. Pharmacol. Exp. Ther. 1992; 263:1195-1205. Активность PDE4 в клеточных супернатантах определяли, анализируя исчезновение сАМР из инкубационных смесей. 50 мкл клеточного супернатанта инкубировали при 30C в течение 30 мин в конечном объеме 200 мкл в присутствии 1,6 мкмоль сАМР, как вместе с тестируемым соединением (50 мкл),так и без него. Концентрация тестируемых соединений находилась в пределах от 10-12 до 10-6 М. Реакции останавливали, инактивируя нагреванием (2,5 мин при 100C), и остаточный сАМР измеряли с помощью электрохемилюминесцентного (ECL) иммунологического анализа. Результаты, выраженные как среднее 95%-ные доверительные интервалы молярной концентрации тестируемого соединения, дающей 50% ингибирования исчезновения сАМР (IC50), представлены в табл. 9 в примере 12. Процент ингибирования активности PDE4 рассчитывали, принимая исчезновение сАМР в отсутствие ингибиторов за 100%, а исчезновение сАМР в образцах, инактивированных нагреванием, за 0%. Все значения IC50 тестируемых соединений, типичных для изобретения, были меньше чем 0,2 мкмоль. Пример 12. Определение PDE4 ингибирующей активности in vitro в тесте на мононуклеарных клетках периферической крови (РВМС). Тест, который основывается на известной ингибиторной активности проявляемой ингибиторамиPDE4 в отношении индуцированного липополисахаридами (LPS) факторе некроза опухолей-альфа (высвобождение TNF- в мононуклеарных клетках периферической крови (РВМС), выполняли по методу,ранее описанному в Hatzelmann A et al., J. Pharmacol. Exp. Ther. 2001; 297:267-279; Draheim R et al., J.Pharmacol. Exp. Ther. 2004; 308:555-563. Криоконсервированные человеческие РВМС, (100 мкл на лунку) инкубировали в 96-луночном планшете (105 клеток на лунку) в течение 30 мин в присутствии (50 мкл) и в отсутствие тестируемых соединений, концентрации которых находились в пределах от 10-12 до 10-6 М. Затем добавляли LPS (3 нг/мл). После 18 ч инкубирования при 37C в увлажняемом инкубаторе в атмосфере из 95% воздуха и 5%CO2 культуральную среду собирали и измеряли уровень TNF- с помощью твердофазного иммуноферментного анализа (ELISA). Результаты, выраженные как среднее 95%-ные доверительные интервалы молярной концентрации тестируемого соединения, дающей 50% ингибирования LPS-индуцированного высвобождения TNF(IC50), представлены в табл. 9. Влияние тестируемых соединений рассчитывали как процент ингибирования высвобождения TNF, принимая LPS-индуцированную продукцию TNF- в отсутствие ингибиторного соединения за 100%, а базисную продукцию TNF- в PBMCs в отсутствие LPS за 0%. Таблица 9. Активность типичных соединений по изобретению по ингибированию PDE4 in vitro. Пример 13. Оценка способности ингибировать низкоаффинный LPDE4 против способности конкурировать за высокоаффинный HPDE4. Аффинность к LPDE4 и HPDE4 оценивали согласно описанию в Cortijo J. et al., BrJ Pharmacol 1993,108: 562-568; и Duplantier AJ et al., J. Med Chem 1996; 39: 120-125, соответственно. Концентрация тестируемых соединений находилась в пределах от 10-12 до 10-5 М. Результаты в виде IC50 представлены в табл. 10. В случае LPDE4, IC50 представляет собой молярную концентрацию тестируемого соединения, дающую 50% ингибирования исчезновения сАМР, тогда как в случае HPDE4, IC50 представляет собой молярную концентрацию тестируемого соединения, дающую 50% ингибирования связывания [H3] ролипрама. Результаты показывают, что соединения по изобретению ингибировали LPDE4 с субнаномолярной аффинностью и были существенно более избирательными к LPDE4 по сравнению с HPDE4. Таблица 10. Профиль активности типичных соединений по изобретению ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I)R4 независимо выбран из H иR5 независимо выбран из группы, состоящей из линейного или разветвленного (C1-C4)алкила;HNCOOR', где R' представляет собой линейный или разветвленный (C1-C4)алкил, или R4 и R5 образуют с атомом углерода, с которым они соединены, кольцо, имеющее 3, 4, 5 или 6 углеродных атомов;R1 и R2 являются разными или одинаковыми и независимо выбраны из группы, состоящей из линейного или разветвленного (С 1-С 6)алкила, возможно замещенного одним или более заместителями, выбранными из (C3-C7)циклоалкила или фтора;R3 представляет собой один или более заместителей, независимо выбранных из группы, состоящей из атомов галогенов; А выбран из группы, состоящей из фенила, нафтила, пиридила, имидазолила, бензимидазолила, дигидробензооксазинила, тетрагидропуринила, дигидробензоимидазолила, дигидробензодиоксинила, хинолинила, тиазолидинила, бициклогептанила и индолила, в которых могут присутствовать один или более возможных заместителей Rx, которые могут быть одинаковыми или разными и независимо выбранными из группы, состоящей из линейного или разветвленного (C1-C6)алкила, возможно замещенного одним или более (С 3- 26017530 С 7)циклоалкилами; фенила;(C1-C10)алкила, возможно замещенного одним или более (С 3-C7)циклоалкилами или атомами фтора;(C1-C10)алкил-NR8R9, где R8 и R9 независимо выбраны из группы, состоящей из H, линейного или разветвленного (С 1-С 6)алкила, и они образуют с атомом азота, с которым они соединены, насыщенное,частично насыщенное или ненасыщенное кольцо, где это кольцо возможно замещено (C1-C4)алкилом; и атомов галогенов;NR10R11, где R10 и R11 являются разными или одинаковыми и независимо выбраны из группы, состоящей из Н; линейного или разветвленного (C1-C6)алкила, возможно замещенного фенилом или (С 3 С 7)циклоалкилом; оксо;COOR17, где R17 представляет собой Н,и его фармацевтически приемлемые соли и N-оксиды по пиридиновому кольцу. 2. Соединение по п.1, где А представляет собой фенил, возможно замещенный одной или более группами Rx. 3. Соединение по п.1, где А представляет собой имидазолил или пиридил. 4. Соединение по любому из пп.1-3, где R3 представляет собой хлор. 5. Соединение по п.4, имеющее общую формулу (II) где R1, R2, Z и А такие, как определено выше. 6. Соединение по п.5, где Z представляет собой (CH2)m и m равно 0. 7. Соединение по п.6, представляющее собой 1-(3-циклопропилметокси-4-дифторметоксифенил)-2(3,5-дихлор-1-оксипиридин-4-ил)этиловый эфир 3-циклопропилметокси-4-дифторметоксибензойной кислоты. 8. Соединение по п.6, представляющее собой 1-(3-циклопропилметокси-4-дифторметоксифенил)-2(3,5-дихлорпиридин-4-ил)этиловый эфир 3-циклопропилметокси-4-дифторметоксибензойной кислоты. 9. Соединение по п.5, где Z представляет собой CHR5, где R5 представляет собой линейный или разветвленный (C1-C4)алкил. 10. Соединение по п.5, где Z представляет собой CR4R5, где R4 и R5 образуют с атомом углерода, с которым они соединены, кольцо, имеющее 3, 4, 5 или 6 углеродных атомов. 11. Соединение по п.10, где R4 и R5 образуют с атомом углерода, с которым они соединены, кольцо,имеющее 3 углеродных атома. 12. Соединение по п.1, где R' представляет собой трет-бутил. 13. Соединение по п.1 или 9, где R5 представляет собой метил. 14. Соединение по п.1, где NR8R9 соединен с (С 1-С 10)алкилом, образуя насыщенные, частично насыщенные или ненасыщенные пиперидиновые, оксазиновые, имидазольные кольца. 15. Способ получения соединения по любому из пп.1-14, включающий стадию добавления кислоты формулы AZCOOH, или хлорангидрида формулы AZCOCl, или изоцианата формулы AZNCO, где А и Z такие, как определено выше, к раствору производного спирта общей формулы (2) где R1, R2 и R3 такие, как определено выше. 16. Соединение общей формулы (2) где R1, R2 и R3 такие, как определено в п.1,и его N-оксиды по пиридиновому кольцу при условии, что указанное соединение не представляет собой 1-(3-циклопентилокси-4-метоксифенил)-2-(3,5-дихлорпирид-4-ил)этанол и 1-(3-циклопентилокси 4-дифторметоксифенил)-2-(3,5-дихлорпирид-4-ил)этанол. 17. Фармацевтическая композиция, содержащая соединение по любому из пп.1-14 в качестве активного ингредиента в смеси с одним или более фармацевтически приемлемыми носителями и/или эксципиентами. 18. Фармацевтическая композиция по п.17, пригодная для ингаляционного введения. 19. Применение соединения по любому из пп.1-14 в качестве лекарственного средства для предупреждения и/или лечения заболевания, характеризующегося повышенной активностью фосфодиэстеразы 4 (PDE4), и/или при котором желательным является ингибирование активности PDE4. 20. Применение соединения по любому из пп.1-14 для изготовления лекарственного средства,имеющего ингибирующую активность в отношении фермента PDE4. 21. Применение соединения по любому из пп.1-14 для изготовления лекарственного средства для предупреждения и/или лечения заболевания, характеризующегося повышенной активностью фосфодиэстеразы 4 (PDE4), и/или при котором желательным является ингибирование активности PDE4. 22. Применение по п.21, где заболевание является заболеванием дыхательных путей, характеризующимся их обструкцией. 23. Применение по п.22, где заболевание выбрано из группы, состоящей из астмы, хронического бронхита или хронического обструктивного заболевания легких. 24. Способ лечения воспалительного заболевания, расстройства или состояния, характеризующегося или ассоциированного с нежелательной воспалительной иммунной реакцией либо индуцированного избыточной секрецией TNF- и PDE4 или ассоциированного с ней, который включает введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения по любому из пп.1-14.
МПК / Метки
МПК: A61P 11/00, A61K 31/44, C07D 213/61
Метки: спиртов, 1-фенил-2-пиридинилалкиловых, фосфодиэстераз, качестве, ингибиторов, производные
Код ссылки
<a href="https://eas.patents.su/29-17530-proizvodnye-1-fenil-2-piridinilalkilovyh-spirtov-v-kachestve-ingibitorov-fosfodiesteraz.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1-фенил-2-пиридинилалкиловых спиртов в качестве ингибиторов фосфодиэстераз</a>
Предыдущий патент: Генетические маркеры для предотвращения риска аритмии сердца
Следующий патент: Лавинозащитная галерея-трамплин
Случайный патент: Механизм для преобразования возвратно-вращательного движения в одностороннее вращательное












