N-(гетероциклил)бензол- или пиридинсульфонамиды в качестве антитромботических агентов и антикоагулянтов
Номер патента: 4986
Опубликовано: 28.10.2004
Авторы: Кремер Жерар, Матругюи Мостафа, Альтенбюрже Жан-Мишель, Лассалль Жильбер
Формула / Реферат
1. Соединения формулы [I]
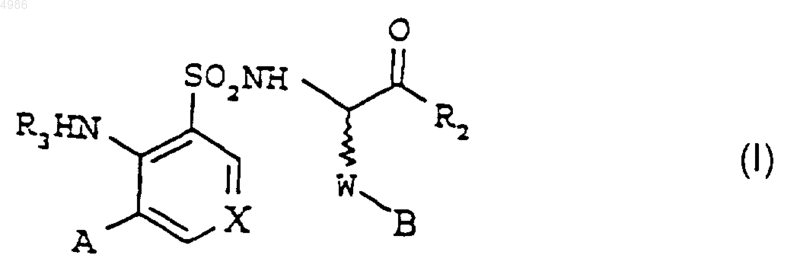
в которых
X представляет собой либо группу =CR4-, либо атом азота,
W представляет собой группу -(CH2)2-, -(CH2)3-, -CH2-Cу C- (тройная связь) или -CH2-CH=CH- (двойная связь в цис- или транс-конфигурации),
R2 представляет собой
либо группу пиперидил, которая возможно замещена
одной или двумя группами, выбранными из групп гидроксил, (C1-C4)алкил, гидрокси(C1-C4)алкил, (C1-C4)алкокси(C1-C4)алкил, (C1-C4)алкокси, (C1-C4)алкилтио, монофторметил, дифторметил, трифторметил и (C3-C6)циклоалкил,
группой =CYZ [причем Y и Z независимо друг от друга выбраны из атомов водорода, атомов галогена и групп (C1-C4)алкил (возможно замещенных атомами галогена в количестве от 1 до 3)],
группой

(r = от 1 до 3) или
группой спиро[(C3-C6)циклоалкан],
либо группу 1,2,3,6-тетрагидропиридил, возможно замещенную группой (C1-C4)алкил (причем эта группа (C1-C4)алкил возможно замещена атомами галогена в количестве от 1 до 3) или группой (C3-C6)циклоалкил,
либо группу гексагидро-1H-азепинил, возможно замещенную в положении 4 группой трифторметил или дифторметилен,
либо группу гептагидроазоцин-1-ил,
либо группу октагидро-1H-азонин-1-ил,
либо группу
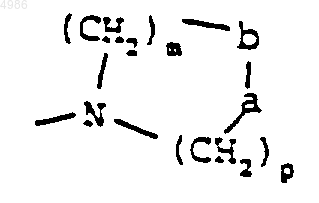
(причем a-b представляют собой группу -CONR'-, m = 1-2, p = 1-2 и R' представляет собой атом водорода или группу (C1-C4)алкил),
либо группу
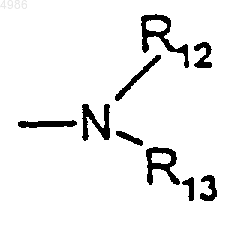
в которой
либо R12 представляет собой группу (C1-C4)алкил, группу карбокси(C1-C4)алкил или группу (C1-C4)алкоксикарбонил(C1-C4)алкил, а R13 представляет собой группу (C1-C4)алкокси или (C1-C4)алкил,
либо R12 представляет собой группу (C1-C4)алкил или -CH2CF3, а R13 представляет собой группу

(причем Q представляет собой атом углерода или азота и r = от 1 до 3),
либо группу пиперазинил, возможно замещенную группой (C1-C4)алкил или группой (C1-C4)алкилсульфонил,
либо группу морфолинил,
R4 представляет собой
либо атом галогена,
либо атом водорода,
R3 представляет собой
либо группу (C1-C5)алкил,
либо группу -COR1, в которой R1 представляет собой либо атом водорода, либо группу (C1-C4)алкил, -(CH2)nOCH3, -CH2O(C2H4O)nCH3, -(CH2)nCF3 или -(CH2)nOH (n = от 1 до 4),
либо группу -SO2R5,
либо группу -CONHR5,
либо группу -SO2N(R5)2, в которой R5 представляет собой группу (C1-C4)алкил,
A представляет собой
либо группу фенил, возможно замещенную заместителями в количестве от 1 до 3, выбранными из
атома галогена и
групп (C1-C4)алкил, (C1-C4)алкокси, трифторметил, трифторметокси, -CH2OR10, -CH2OCOR10, -CH2OCONR10R11, -COOR10, -CONR10R11, нитро, -NR10R11, -NHCOR10 и -NH(CH2)qOR10, в которых R10 и R11 независимо друг от друга представляют собой атом водорода или группу (C1-C4)алкил, а q равен числу от 0 до 6,
либо гетероцикл, выбранный из групп пиридил, тиенил, фурил, пиримидинил и тиазолил, причем указанные группы возможно замещены аналогично определенной выше группе фенил,
либо группу (C5-C8)циклоалкил, а
B представляет собой
либо группу пиридил, возможно замещенную 1 или 2 заместителями, выбранными из группы (C1-C4)алкил, группы гидроксил и группы (C1-C4)алкокси,
либо группу аминопиразинил,
либо группу аминопиридазинил,
либо группу пиримидинил, возможно замещенную аминогруппой,
либо группу пиперидил,
либо группу аминопиридил, возможно замещенную по пиридину группой (C1-C4)алкил или (C1-C4)алкокси, либо атомом галогена, причем аминогруппа возможно также замещена группой (C1-C4)алкил,
либо группу аминофенил, причем аминогруппа возможно также замещена группой (C1-C4)алкил, а группа фенил возможно замещена группой (C1-C4)алкилили атомом галогена,
в форме рацематов или чистых энантиомеров либо смесей энантиомеров, или альтернативно в форме кислот или свободных оснований либо солей присоединения с фармацевтически приемлемыми кислотами.
2. Соединения по п.1, отличающиеся тем, что
X, W, R4, A и B являются такими, как определено в п.1,
R2 представляет собой
либо группу пиперидил, которая возможно замещена
одной или двумя группами, выбранными из групп гидроксил, (C1-C4)алкил, гидрокси(C1-C4)алкил, (C1-C4)алкокси(C1-C4)алкил, (C1-C4)алкокси, (C1-C4)алкилтио, монофторметил, дифторметил, трифторметил и (C3-C6)циклоалкил,
группой =CYZ [причем Y и Z независимо друг от друга выбраны из атомов водорода, атомов галогена и групп (C1-C4)алкил (возможно замещенных атомами галогена в количестве от 1 до 3)],
либо группу 1,2,3,6-тетрагидропиридил, возможно замещенную группой (C1-C4)алкил (причем эта группа (C1-C4)алкил возможно замещена атомами галогена в количестве от 1 до 3) или группой (C3-C6)циклоалкил,
либо группу гексагидро-1H-азепинил, возможно замещенную в положении 4 группой трифторметил или дифторметилен,
либо группу
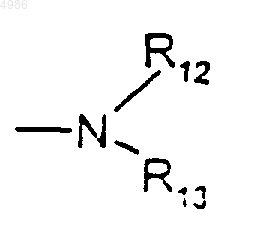
в которой
R12 представляет собой группу (C1-C4)алкил, группу карбокси(C1-C4)алкил или группу (C1-C4)алкоксикарбонил(C1-C4)алкил, а
R13 представляет собой группу (C1-C4)алкокси или (C1-C4)алкил,
либо группу пиперазинил, возможно замещенную группой (C1-C4)алкил или группой (C1-C4)алкилсульфонил,
либо группу морфолинил,
R3 представляет собой
либо группу (C1-C5)алкил,
либо группу -COR1, в которой R1 представляет собой либо атом водорода, либо группу (C1-C4)алкил, -(CH2)nOCH3, -CH2O(C2H4O)nCH3, -(CH2)nCF3 или -(CH2)nOH (n = от 1 до 4),
в форме рацематов или чистых энантиомеров либо смесей энантиомеров, или альтернативно в форме кислот или свободных оснований либо солей присоединения с фармацевтически приемлемыми кислотами.
3. Соединения по любому из пп.1 и 2, отличающиеся тем, что
X, R4 и В являются такими, как определено в п.1,
W представляет собой группу -(CH2)3- или -CH2-CH=CH- (двойная связь в цис- или транс-конфигурации),
R2 представляет собой
либо группу пиперидил, которая возможно замещена
одной или двумя группами, выбранными из групп гидроксил, (C1-C4)алкил, гидрокси(C1-C4)алкил, (C1-C4)алкокси(C1-C4)алкил, (C1-C4)алкокси, (C1-C4)алкилтио, монофторметил, дифторметил и трифторметил,
группой =CYZ [причем Y и Z независимо друг от друга выбраны из атомов водорода, атомов галогена и групп (C1-C4)алкил (возможно замещенных атомами галогена в количестве от 1 до 3)],
либо группу 1,2,3,6-тетрагидропиридил, возможно замещенную группой (C1-C4)алкил (причем эта группа (C1-C4)алкил возможно замещена атомами галогена в количестве от 1 до 3),
либо группу гексагидро-1H-азепинил,
либо группу пиперазинил, возможно замещенную группой (C1-C4)алкилсульфонил,
либо группу морфолинил,
R3 представляет собой группу -COR1, в которой R1 представляет собой группу (C1-C4)алкил, -(CH2)nOCH3 или -(CH2)nCF3 (n = от 1 до 4),
A представляет собой
либо группу фенил, возможно замещенную заместителями в количестве от 1 до 3, выбранными из
атома галогена и
групп (C1-C4)алкил и (C1-C4)алкокси,
либо гетероцикл, выбранный из групп пиридил и тиенил,
либо группу (C5-C8)циклоалкил,
в форме рацематов или чистых энантиомеров либо смесей энантиомеров, или альтернативно в форме кислот или свободных оснований либо солей присоединения с фармацевтически приемлемыми кислотами.
4. Соединения по любому из пп.1-3, отличающиеся тем, что они выбраны из
N-[2-[[[(1S)-4-(5-амино-3-метилпирид-2-ил)-1-[[4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил]-6-тиен-2-илфенил]пропанамида,
N-[2-[[[(1S)-4-(6-амино-4-этилпирид-3-ил)-1-[[4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил]-6-циклопентилфенил]ацетамида,
N-[3-[[[(1S)-4-(5-аминопирид-2-ил)-1-[[4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил]-3'-фтор[1,1'-дифенил]-2-ил]пропанамида,
N-[3-[[[(1S)-4-(5-аминопирид-2-ил)-1-[[4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил]-3'-фтор[1,1'-дифенил]-2-ил]ацетамида,
N-[2-[[[(1S)-4-(5-аминопирид-2-ил)-1-[(4-этилпиперид-1-ил)карбонил]бутил]амино]сульфонил]-6-тиен-2-илфенил]пропанамида,
N-[2-[[[(1S)-4-(6-аминопирид-3-ил)-1-[пиперид-1-илкарбонил]бутил]амино]сульфонил]-6-циклопентилфенил]пропанамида,
N-[2-[[[(1S)-4-(5-аминопирид-2-ил)-1-[[4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил]-6-циклопентилфенил]пропанамида,
N-[3-[[[(1S)-4-(5-аминопирид-2-ил)-1-[[4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил][1,1'-дифенил]-2-ил]ацетамида,
N-[2-[[[(1S)-4-(6-аминопирид-3-ил)-1-[[4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил]-6-тиен-2-илфенил]ацетамида,
N-[2-[[[(1S)-4-(6-амино-4-метилпирид-3-ил)-1-[[4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил]-6-тиен-2-илфенил]пропанамида,
N-[2-[[[(1S)-4-(6-аминопирид-3-ил)-1-[[4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил]-6-циклопентилфенил]ацетамида,
N-[2-[[[(1S)-4-(аминопирид-3-ил)-1-[[4-(трифторметил)-1,2,3,6-тетрагидропирид-1-ил]карбонил]бутил]амино]сульфонил]-6-тиен-2-илфенил]пропанамида,
N-[2-[[[(1S)-4-(6-аминопирид-3-ил)-1-[[4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил]-6-циклопентилфенил]пропанамида,
N-[3-[[[(1S)-4-(5-аминопирид-2-ил)-1-[[4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил][1,1'-дифенил]-2-ил]пропанамида,
N-[2-[[[(1S)-4-(6-амино-4-метилпирид-3-ил)-1-[[4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил]-6-циклопентилфенил]пропанамида,
N-[3-[[[(1S)-4-(6-аминопирид-3-ил)-1-[[4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил]-3'-фтор[1,1'-дифенил]-2-ил]пропанамида,
N-[2-[[[(1S)-4-(5-аминопирид-2-ил)-1-[(4-метилпиперид-1-ил)карбонил]бутил]амино]сульфонил]-6-тиен-2-илфенил]ацетамида,
N-[2-[[[(1S)-4-(6-аминопирид-3-ил)-1-[(4-этилпиперид-1-ил)карбонил]бутил]амино]сульфонил]-6-тиен-2-илфенил]пропанамида,
N-[2-[[[(1S)-4-(6-аминопирид-3-ил)-1-[(4-метилпиперид-1-ил)карбонил]бутил]амино]сульфонил]-6-циклопентилфенил]ацетамида,
N-[3-[[[(1S)-4-(5-аминопирид-2-ил)-1-[(4-метилпиперид-1-ил)карбонил]бутил]амино]сульфонил]-3'-метил[1,1'-дифенил]-2-ил]ацетамида,
N-[3-[[[(1S)-4-(6-амино-4-метоксипирид-3-ил)-1-[[4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил][1,1'-дифенил]-2-ил]пропанамида,
N-[3-[[[(1S)-4-(5-аминопирид-2-ил)-1-[(4-метилпиперид-1-ил)карбонил]бутил]амино]сульфонил]-3'-метил[1,1'-дифенил]-2-ил]пропанамида,
N-[3-[[[(1S)-4-(5-аминопирид-2-ил)-1-[(4-метилпиперид-1-ил)карбонил]бутил]амино]сульфонил]-3'-фтор[1,1'-дифенил]-2-ил]ацетамида,
N-[3-[[[(1S)-4-(5-аминопирид-2-ил)-1-[(4-метилпиперид-1-ил)карбонил]бутил]амино]сульфонил]-3'-метокси[1,1'-дифенил]-2-ил]пропанамида,
N-[(1S)-4-(5-амино-2-пиридил)-1-[[4-(дифторметилен)-1-пиперидил]карбонил]бутил]-2-(формиламино)-3'-метил[1,1'-дифенил]-3-сульфонамида,
N-[3-[[[(1S,3Z)-4-(5-амино-2-пиридил)-1-[[4-(дифторметилен)-1-пиперидил]карбонил]-3-бутенил]амино]сульфонил][1,1'-дифенил]-2-ил]ацетамида,
N-[3-[[[(1S,3Z)-4-(5-амино-2-пиридил)-1-[(4-метил-1-пиперидил)карбонил]-3-бутенил]амино]сульфонил][1,1'-дифенил]-2-ил]ацетамида,
в форме рацематов или чистых энантиомеров либо смесей энантиомеров, или альтернативно в форме кислот или свободных оснований либо солей присоединения с фармацевтически приемлемыми кислотами.
5. Соединения по любому из пп.1-4, отличающиеся тем, что предпочтительной конфигурацией центральной аминокислотной части
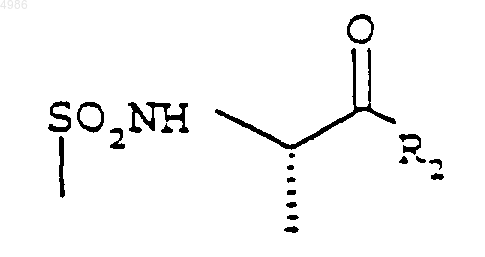
является [S].
6. Способ получения соединений формулы [I] по п.1, в которых X представляет собой группу =CR4-, где R4 является таким, как определено в п.1, отличающийся тем, что соединение формулы [V]
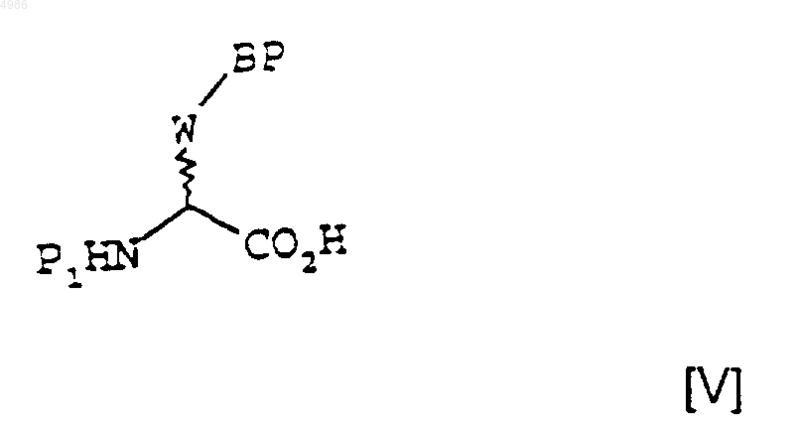
в котором P1 представляет собой защитную группу для аминной функции, В и W являются такими, как определено в п.1, а P представляет собой защитную группу или атом водорода, подвергают на стадии (i) взаимодействию с соединением формулы [VI]
R2H [VI],
в котором R2 является таким, как определено в п.1, с получением соединения формулы [IV]
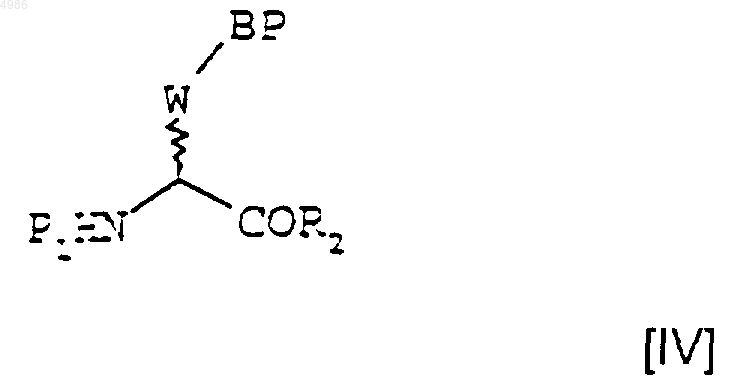
которое затем на стадии (ii) обрабатывают хлористым водородом с получением соединения формулы [III]
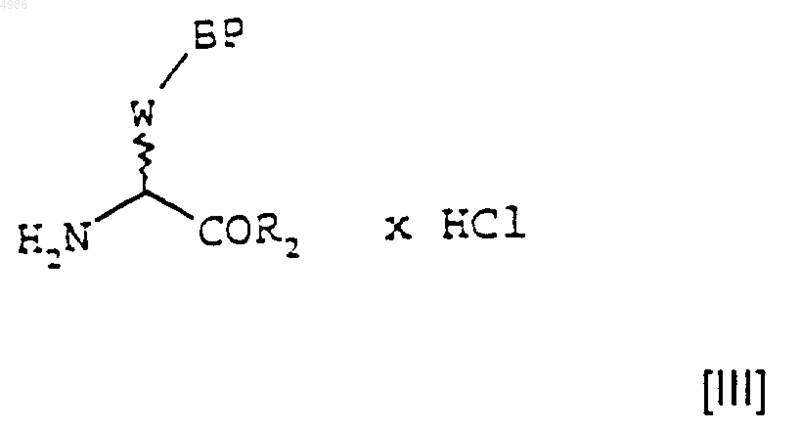
которое на стадии (iii) конденсируют с соединением формулы [II]
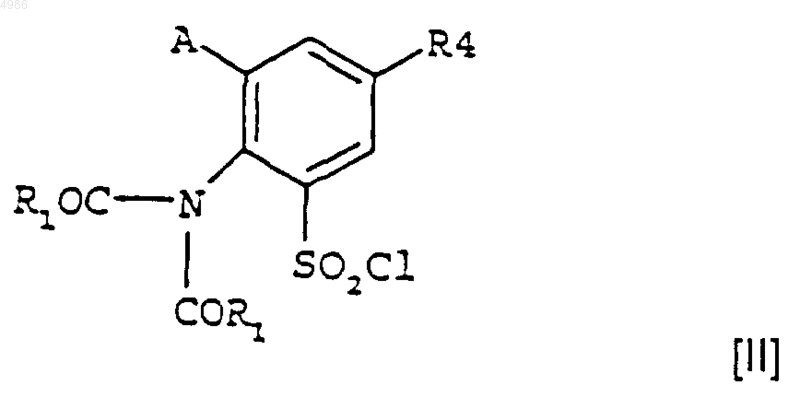
в котором R1, R4 и A являются такими, как определено в п.1, с последующим гидрогенолизом на стадии (iv), когда это является желательным, с получением соединения формулы [I], в котором R4 представляет собой атом водорода.
7. Способ получения соединений формулы [I] по п.1, в которых X представляет собой группу =CR4-, где R4 является таким, как определено в п.1, отличающийся тем, что соединение формуыы [III], полученное на стадии (ii) способа по п.6, в котором P представляет собой атом водорода

на стадии (i) подвергают взаимодействию с соединением формулы [IIa]
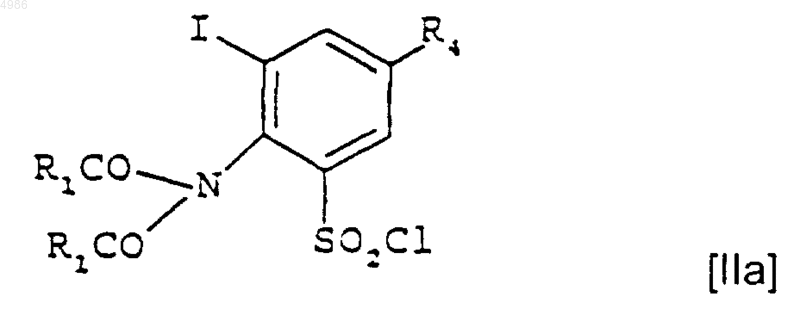
в котором R4 и R1 являются такими, как определено в п.1, с получением соединения формулы [Ia]
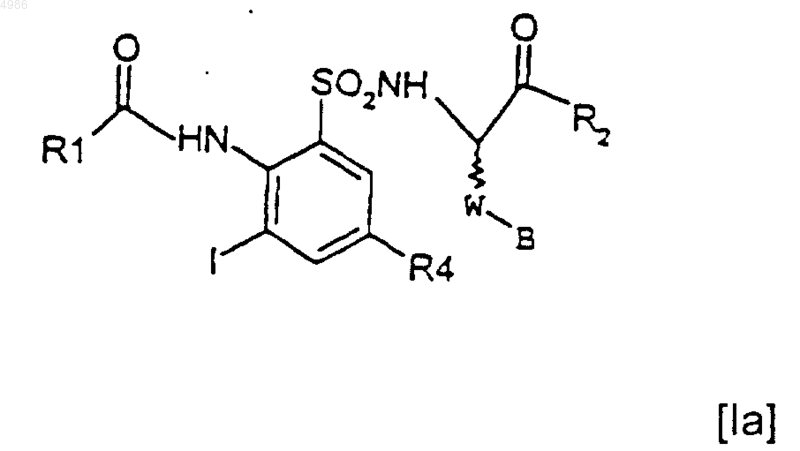
которое сочетают с соединением формулы [VII]
A-Sn(R5)3 [VII],
в котором A является таким, как определено в п.1, и R5 представляет собой группу (C1-C4)алкил, с последующим гидрогенолизом на стадии (iii), когда это является желательным, с получением соединения формулы [I], в котором R4 представляет собой атом водорода.
8. Способ получения соединений формулы [I] по п.1, в которых X представляет собой атом азота, отличающийся тем, что он включает в себя стадию сочетания соединения формулы [III], как оно определено в п.6 или 7, с соединением формулы [XV]
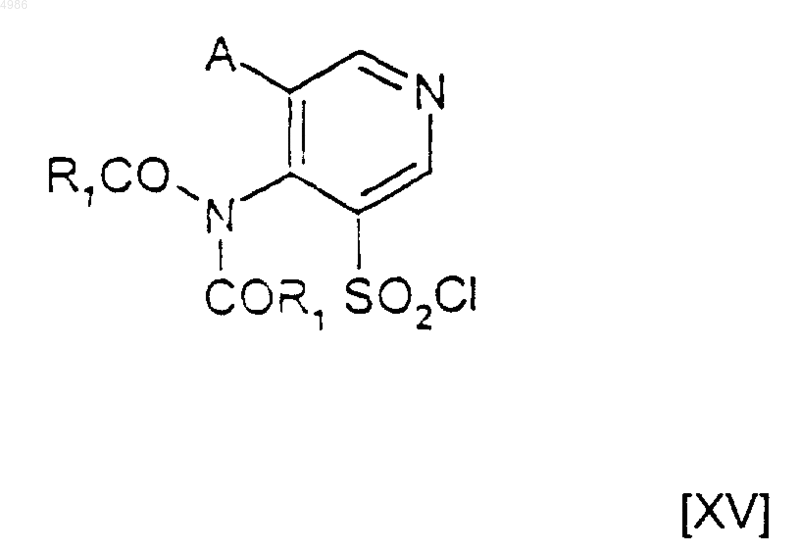
9. Соединения формулы [III]

в которых В и R2 являются такими, как определено в п.1, а P представляет собой защитную группу для аминной функции или атом водорода, которые полезны в качестве промежуточных соединений в синтезе соединений формулы [I] по п.1.
10. Соединения формулы [XV]
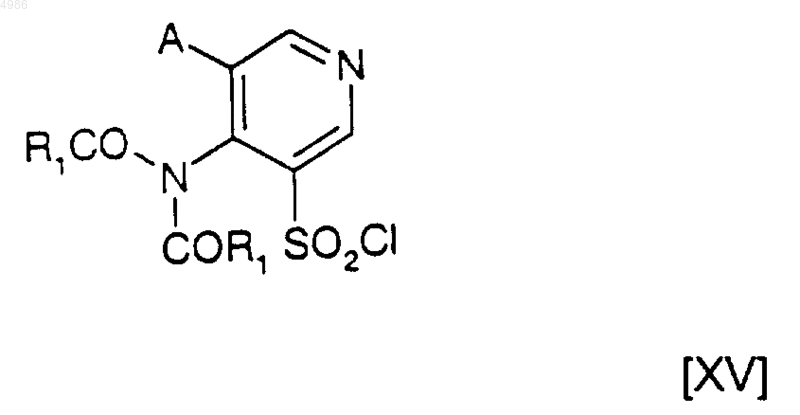
в которых A и R1 являются такими, как определено в п.1, которые полезны в качестве промежуточных соединений в синтезе соединений формулы [I] по п.1.
11. Лекарственный препарат, отличающийся тем, что он содержит по меньшей мере одно соединение по любому из пп.1-5.
12. Фармацевтическая композиция, отличающаяся тем, что она содержит по меньшей мере одно соединение по любому из пп.1-5, а также по меньшей мере один фармацевтически приемлемый эксципиент.
Текст
1 Настоящее изобретение относится к производным N-(гетероциклил)бензол- или пиридинсульфонамидов, к их получению и к их терапевтическому применению. Соединения по настоящему изобретению соответствуют формуле (I)X представляет собой группу =CR4- или атом азота, W представляет собой группу-(СН 2)2-, -(СН 2)3-, -(СН 2)-СС- (тройная связь) или -CH2-CH=CH- (двойная связь в цис- или транс-конфигурации), R2 представляет собой либо группу пиперидил, которая возможно замещена одной или двумя группами, выбранными из групп гидроксил, (С 1-С 4)алкил, гидрокси(С 1 С 4)алкил, (С 1-С 4)алкокси(С 1-С 4)алкил, (С 1-С 4) алкокси, (C1-С 4)алкилтио, монофторметил, дифторметил, трифторметил и (С 3-С 6)циклоалкил,группой =CYZ [причем Y и Z независимо друг от друга выбраны из атомов водорода, атомов галогена и групп (С 1-С 4)алкил (возможно замещенных атомами галогена в количестве от 1 до 3)],группой(причем эта группа (С 1-С 4)алкил возможно замещена атомами галогена в количестве от 1 до 3) или группой (С 3-С 6)циклоалкил,либо группу гексагидро-1 Н-азепинил, возможно замещенную в положении 4 группой трифторметил или дифторметилен,либо группу гептагидроазоцин-1-ил,либо группу октагидро-1 Н-азонин-1-ил,либо группу-CONR'-, m = 1-2, р = 1-2 и R' представляет собой атом водорода или группу (С 1-С 4 алкил),либо группу в которой либо R12 представляет собой группу (С 1 С 4)алкил, группу карбокси(С 1-С 4)алкил или группу (С 1-С 4)алкоксикарбонил(C1-С 4)алкил, aR13 представляет собой группу (С 1-С 4)алкокси или (С 1-С 4)алкил,либо R12 представляет собой группу (С 1 С 4)алкил или -CH2CF3, a R13 представляет собой группу(причем Q представляет собой атом углерода или азота и r = от 1 до 3),либо группу пиперазинил, возможно замещенную группой (С 1-С 4)алкил или группой(С 1-С 4)алкилсульфонил,либо группу морфолинил,R4 представляет собой либо атом галогена,либо атом водорода,R3 представляет собой либо группу (С 1-С 5)алкил,либо группу -COR1, в которой R1 представляет собой либо атом водорода, либо группу(С 1-С 4)алкил, -(СН 2)nOСН 3, -СН 2 О(С 2 Н 4 О)nСН 3,-(CH2)nCF3 или -(СН 2)nОН (n = от 1 до 4),либо группу -SO2R5,либо группу -CONHR5,либо группу -SO2N(R5)2, в которой R5 представляет собой группу (С 1-С 4)алкил,А представляет собой либо группу фенил, возможно замещенную заместителями в количестве от 1 до 3, выбранными из атома галогена и групп (С 1-С 4)алкил,(С 1-С 4)алкокси, трифторметил, трифторметокси,-CH2OR10,-CH2OCOR10,-CH2OCONR10R11,-COOR10,-CONR10R11,нитро,-NR10R11,-NHCOR10 и -NH(CH2)qOR10, в которых R10 и R11 независимо друг от друга представляют собой атом водорода или группу (С 1-С 4)алкил, a q равен числу от 0 до 6,либо гетероцикл, выбранный из групп пиридил, тиенил, фурил, пиримидинил и тиазолил,причем указанные группы возможно замещены аналогично определенной выше группе фенил,либо группу (С 5-С 6)циклоалкил, а В представляет собой либо группу пиридил, возможно замещенную 1 или 2 заместителями, выбранными из группы (С 1-С 4)алкил, группы гидроксил и группы (С 1-С 4)алкокси,либо группу аминопиразинил,либо группу аминопиридазинил,либо группу пиримидинил, возможно замещенную аминогруппой,либо группу пиперидил,либо группу аминопиридил, возможно замещенную по пиридину группой (С 1-С 4)алкил или группой (С 1-С 4)алкокси, или атомом галогена, причем аминогруппа возможно также замещена группой (С 1-С 4)алкил,либо группу аминофенил, причем аминогруппа возможно также замещена группой (С 1 3 С 4)алкил, а группа фенил возможно замещена группой (С 1-С 4)алкил или атомом галогена. В контексте изобретения приведенные ниже термины имеют следующие значения: группа (С 1-С 4)алкил представляет собой нормальную или разветвленную насыщенную углеводородную цепь, содержащую от 1 до 4 атомов углерода,группа (Сх-Су)циклоалкил представляет собой циклическую углеводородную цепь, содержащую атомы углерода в количестве от х до у,группа (С 1-С 4)алкокси представляет собой кислородный радикал, замещенный группой(С 1-С 4)алкил, определенной выше,атом галогена представляет собой атом хлора, брома, йода или фтора. В контексте изобретения атомы галогена предпочтительно представляют собой атомы хлора, фтора и брома. В зависимости от природы группы W соединения формулы (I) в соответствии с изобретением могут быть представлены приведенными ниже формулами (I1), (I2), (I3) и (I4) Соединения, которые являются предпочтительными согласно изобретению, представляют собой соединения формулы (I), в которых X, W,R4, А и В являются такими, как определено выше, R2 представляет собой либо группу пиперидил, которая возможно замещена одной группой или двумя группами, выбранными из групп гидроксил, (С 1-С 4)алкил,гидрокси(С 1-С 4)алкил,(С 1-С 4)алкокси(С 1-С 4) алкил, (С 1-С 4)алкокси, (С 1-С 4)алкилтио, монофторметил, дифторметил, трифторметил и (С 3 С 6)циклоалкил,группой =CYZ [причем Y и Z независимо друг от друга выбраны из атомов водорода, атомов галогена и групп (С 1-С 4)алкил (возможно замещенных атомами галогена в количестве от 1 до 3)],либо группу 1,2,3,6-тетрагидропиридил,возможно замещенную группой (С 1-С 4)алкил(причем эта группа (С 1-С 4)алкил возможно замещена атомами галогена в количестве от 1 до 3) или группой (С 3-С 6)циклоалкил, 004986 4 либо группу гексагидро-1 Н-азепинил, возможно замещенную по положению 4 группой трифторметил или дифторметилен,либо группуR12 представляет собой группу (С 1 С 4)алкил, группу карбокси(С 1-С 4)алкил или группу (С 1-С 4)алкоксикарбонил(С 1-С 4)алкил, aR13 представляет собой группу (С 1 С 4)алкокси или (С 1-С 4)алкил,либо группу пиперазинил, возможно замещенную группой (С 1-С 4)алкил или группой(С 1-С 4)алкилсульфонил,либо группу морфолинил,R3 представляет собой либо группу (С 1-С 5)алкил,либо группу -COR1, в которой R1 представляет собой либо атом водорода, либо группу(С 1-С 4)алкил, -(CH2)nOCH3, -CH2O(C2H4O)nCH3,-(CH2)nCF3 или -(СН 2)nОН (n равен от 1 до 4). Среди предпочтительных соединений, определенных выше, соединения, которые являются особенно предпочтительными, представляют собой соединения формулы (I), в которыхX, R4 и В являются такими, как определено выше,W представляет собой группу -(СН 2)3- или-СН 2-СН=СН- (двойная связь в цис- или трансконфигурации),R2 представляет собой либо группу пиперидил, которая возможно замещена одной или двумя группами, выбранными из групп гидроксил, (С 1-С 4)алкил, гидрокси(С 1 С 4)алкил,(С 1-С 4)алкокси(С 1-С 4)алкил,(С 1 С 4)алкокси, (C1-С 4)алкилтио, монофторметил,дифторметил и трифторметил,группой =CYZ [причем Y и Z независимо друг от друга выбраны из атомов водорода, атомов галогена и групп (С 1-С 4)алкил (возможно замещенных атомами галогена в количестве от 1 до 3)],либо группу 1,2,3,6-тетрагидропиридил,возможно замещенную группой (С 1-С 4)алкил(причем эта группа (С 1-С 4)алкил возможно замещена атомами галогена в количестве от 1 до 3),либо группу гексагидро-1 Н-азепинил,либо группу пиперазинил, возможно замещенную группой (С 1-С 4)алкилсульфонил,либо группу морфолинил,R3 представляет собой группу -COR1, в которой R1 представляет собой группу (С 1 С 4)алкил, -(СН 2)nОСН 3 или -(CH2)nCF3 (n равно от 1 до 4),А представляет собой 5 либо группу фенил, возможно замещенную заместителями в количестве от 1 до 3, выбранными из атома галогена и групп (С 1-С 4)алкил и(С 1-С 4)алкокси,либо гетероцикл, выбранный из групп пиридил и тиенил,либо группу (С 5-С 8)циклоалкил. Предпочтительной конфигурацией центральной аминокислотной части соединений в соответствии с настоящим изобретением является [S]. Соединения формулы [I] в соответствии с изобретением могут существовать в форме рацематов или чистых энантиомеров, либо смесей энантиомеров. Они также могут существовать в форме кислот или свободных оснований, либо солей присоединения с фармацевтически приемлемыми кислотами, например, в форме гидрохлорида или метансульфоната. В частности, можно упомянуть следующие соединения в форме рацематов или чистых энантиомеров, либо смесей энантиомеров, или альтернативно в форме кислот или свободных оснований, гидрохлорида или любой другой фармацевтически приемлемой соли, которые составляют часть изобретенияN-[(1S)-4-(5-амино-2-пиридил)-1-4(дифторметилен)-1-пиперидил]карбонил] бутил]-2-(формиламино)-3'-метил[1,1'-дифенил]-3-сульфонамид,N-[3-(1S,3Z)-4-(5-амино-2-пиридил)-14-(дифторметилен)-1-пиперидил]карбонил]-3 бутенил]амино]сульфонил][1,1'-дифенил]-2 ил]ацетамид,N-[3-(1S,3Z)-4-(5-амино-2-пиридил)-1[(4-метил-1-пиперидил)карбонил]-3-бутенил] амино]сульфонил][1,1'-дифенил]-2-ил]ацетамид. Объектом изобретения также является лекарственный продукт, отличающийся тем, что он содержит по меньшей мере одно соединение формулы (I), как оно определено выше. Объектом изобретения также является фармацевтическая композиция, отличающаяся тем, что она содержит по меньшей мере одно соединение формулы (I), как оно определено выше, а также по меньшей мере один фармацевтически приемлемый эксципиент. Согласно схеме 1 с целью получения соединений формулы [I] в соответствии с настоящим изобретением, в которых X представляет собой группу =CR4-, соединение формулы [V], в котором P1 представляет собой защитную группу для аминной функции, в частности, группу трет-бутоксикарбонил (Воc), В и W являются такими, как определено выше, и Р представляет собой либо защитную группу, такую как фенилметоксикарбонил, либо атом водорода, подвергают на стадии (i) взаимодействию с соединением формулы [VI], в котором R2 является таким, как определено выше. Таким образом получают соединение формулы [IV], которое на стадии (ii) обрабатывают хлористым водородом с получением соединения формулы [III]. Схема 1 На стадии (iii) соединение формулы [III] сочетают в присутствии триэтиламина с соединением формулы [II], в котором R1, R4 и А являются такими, как определено выше, с получением после обработки аммиаком соединения 8 формулы [I]. Модификацию группы -NHCOR1 в группу -NHR3, как определено выше в отношении формулы [I], осуществляют в соответствии с методиками органической химии, которые известны специалистам в данной области техники. Когда желательным является получение соединения формулы [I], в котором R4 представляет собой атом водорода, затем проводят гидрогенолиз соединения [I] на стадии (iv) с получением соединения формулы [Ib]. Согласно одному предпочтительному воплощению способа получения соединений формулы (I) по настоящему изобретению упомянутую выше стадию (i) можно проводить в присутствии N,N-диизопропилэтиламина (ДИЭА) в дихлорметане или в диметилформамиде путем добавления в атмосфере азота О-(1-бензотриазолил)-N,N,N',N'-тетраметилурония гексафторфосфата (ГБТУ),стадию (ii) можно проводить в дихлорметане в присутствии газообразного хлористого водорода,стадию (iii) можно проводить сначала в дихлорметане и триэтиламине (ТЭА), а затем путем растворения полученного продукта в тетрагидрофуране (ТГФ), а затем пропускания через него потока аммиака с последующей обработкой 0,1 н. хлористым водородом в изопропаноле или бромистым водородом в уксусной кислоте,стадию (iv) можно проводить путем растворения соединения формулы [I] в 0,1 н. растворе хлористого водорода и в изопропаноле. Согласно одному варианту способа в соответствии с настоящим изобретением соединения формулы [I], в которых X представляет собой группу =CR4-, также получают в соответствии со схемой 2. Согласно схеме 2 эти соединения можно получить взаимодействием на стадии (i) соединения формулы [III], которое получено на стадии (ii) способа по изобретению, описанного выше (схема 1) [где Р = атом водорода] с соединением формулы [IIa], в котором R4 представляет собой атом галогена, a R1 является таким, как определено выше. Таким образом получают соединение формулы [la], которое сочетают с соединением формулы [VII], в котором А является таким, как определено выше, a R6 представляет собой группу (С 1-С 4)алкил, с получением соединения формулы [I]. Когда желательным является получение соединения формулы[I], в котором R4 представляет собой атом водорода, затем проводят гидрогенолиз соединения[I] на стадии (iii) с получением соединения формулы [Ib]. Согласно одному предпочтительному воплощению этого варианта способа получения соединений формулы [I] по настоящему изобретению, в которых X представляет собой группу=CR4-, упомянутую выше стадию (i) можно проводить сначала в дихлорметане в присутст 9 вии триэтиламина, а затем последующим поглощением полученного продукта в потоке аммиака. Схема 2Cтадию (ii) можно проводить в смеси йодида меди и трифениларсина (Ph3As) в безводном диметилформамиде (ДМФ) и путем добавления бисдибензилиденацетонпалладия (0)[Pd(dba)2],стадию (iii) можно проводить в присутствии активированного палладия на угле (Pd-c) и формиата аммония в метаноле,стадию (iv) можно проводить путем растворения соединения формулы [I] в 0,1 н. растворе хлористого водорода и в изопропаноле. Соединения формулы [V] по настоящему изобретению, как представлено на схеме 1, получают согласно схемам 3 и 4. На схемах 3 и 4 проиллюстрировано получение различных типов соединений формулы[V], а именно соединение формулы [Ve], которое полезно в качестве промежуточного соединения для получения соединений формулы (I), в которыхW = СН 2-СН=СН- (причем двойная связь находится в цис-конфигурации),соединение формулы [Vg], которое полезно в качестве промежуточного соединения для получения соединений формулы (I), в которыхW = -СН 2-СН=СН- (причем двойная связь находится в транс-конфигурации),соединение формулы [Vh], которое полезно в качестве промежуточного соединения для получения соединений формулы (I), в которыхW = -(СН 2)3-,соединение формулы [Vc], которое полезно в качестве промежуточного соединения для получения соединений формулы (I), в которыхW = СН 2-СС-,соединение формулы [Vi], которое полезно в качестве промежуточного соединения для получения соединений формулы (I), в которых W= Чтобы получить соединение формулы(cхема 3) на стадии (i) и по аналогии с синтезом,раскрытым в патентной заявке WO 97/40052,соединение формулы [Va], в котором P1 является таким, как определено выше, подвергают взаимодействию с соединением формулы [Vb],в котором B1 представляет собой ароматическое основание, несущее защищенную или незащищенную первичную или вторичную аминную функцию, либо предшественника аминной функции, такого как нитрогруппа, а X представляет собой атом галогена, с получением соединения формулы [Vc]. Чтобы превратить соединение формулы[Vc] в соединение формулы [V], которое можно использовать непосредственно в способе, представленном на схеме 1, проводят омыление эфирной группы, и, когда B1 несет предшественника аминной функции, этого предшественника превращают в аминную группу, возможно 11 защищенную группой Р, с помощью методик органической химии, которые известны специалистам в данной области техники. Чтобы получить соединение формулы[Vc] подвергают либо общему гидрогенированию как тройной связи, так и азотсодержащего гетероцикла, возможно с последующей традиционной ортогональной защитой неароматического вторичного амина, который может быть образован группой Р, такой как фенилметоксикарбонил, либо избирательному гидрогенированию тройной связи с последующим омылением,с получением соединения формулы [Vh]. Чтобы получить соединение формулы(схема 3): на стадии (iii) соединение [Vc] подвергают контролируемому гидрогенированию тройной связи возможно с последующей традиционной ортогональной защитой группой Р,такой как трет-бутоксикарбонил (Вос), вторичного амина для амина, образованного группой В. На стадии (iv) проводят омыление сложноэфирной группы соединения [Vd] с получением соединения [Ve]. Чтобы получить соединение формулы(схема 3): на стадии (v) соединение [Va] подвергают сначала гидростаннированию тройной связи с последующим катализируемым сочетанием через палладиевый комплекс с соединением [Vb],в котором B1 представляет собой ароматическое основание, несущее либо защищенную, либо незащищенную первичную или вторичную аминную функцию, либо предшественника аминной функции, такого как нитрогруппа, а X представляет собой атом галогена, с получением соединений формулы [Vf],на стадии (vi) сложно-эфирную группу соединения [Vf] подвергают гидролизу с получением соединения формулы [Vg]. Согласно одному предпочтительному воплощению способа получения соединений формулы [V] по настоящему изобретению, как проиллюстрировано на схеме 3, упомянутую выше стадию (i) можно проводить в диметилформамиде в присутствии катализатора на основе палладия, такого как комплекс дихлорбис(трифенилфосфин)палладий/йодид меди(I), в щелочной среде, например, с бикарбонатом калия, и в безводном диметилформамиде,упомянутую выше стадию (ii) можно проводить с молекулярным водородом или формиатом аммония в метаноле в присутствии катализатора на основе палладия, такого как активированный палладий на угле, и путем омыления гидроксидом лития в смеси метанол/вода,упомянутую выше стадию (iii) можно проводить в присутствии палладия на сульфате бария в этилацетате. Когда B1 несет функцию нит 004986 12 ро, желательно предварительно восстановить ее,предпочтительно железом в смеси этанол/уксусная кислота,стадию (iv), приводящую к соединениям[Ve], можно проводить с гидроксидом лития в смеси метанол/вода,стадию (v) можно проводить с соединением [Va], несущим защитную группу P1, такую как тритил,чтобы улучшить региоизбирательность реакции гидростаннирования. Реакцию проводят с гидридом трибутилолова в тетрагидрофуране в присутствии тетракис(трифенилфосфин)палладия (0). Сочетание с электрофильным реагентом [Vb] проводят в безводном диоксане в присутствии тетракис(трифенилфосфин)палладия (0),когда группа P1 соединения формулы [Vf] представляет собой тритил, стадия (vi) заключается в превращении группы P1 типа тритила в группу трет-бутилоксикарбонил в присутствии водного гидроксида натрия при использовании бис(ди-трет-бутил)карбоната. При данной операции метиловый эфир подвергают гидролизу до карбоновой кислоты, получая таким образом соединение формулы [Vg]. По схеме 4 можно получить промежуточные соединения формулы [Vi], делая таким образом возможным получение соединений формулы [I], в которых W представляет собой группу -(СН 2)2-, следующим образом: на стадии (i) соединение формулы [VII],которое представляет собой производное глутаминовой кислоты, в котором P1 является таким,как определено выше, a Ph представляет собой группу фенил, подвергают реакции Хунсдиккера (Hunsdiecker) с получением соединения формулы [VIII],на стадии (ii) соединение формулы [VIII] превращают в соответствующее цинкорганическое производное, которое сочетают in situ посредством катализа палладием с соединением формулы [Vb], в котором B1 является таким, как определено выше, а X представляет собой атом галогена, с получением соединений формулы[IX],на стадии (iii) соединение формулы [IX] подвергают гидрогенированию на палладиевом катализаторе с получением соединения формулы [Vi], несущее свободную функцию карбоновой кислоты. Согласно одному предпочтительному воплощению данного способа получения соединений формулы [Vi] по настоящему изобретению упомянутую выше стадию (i) можно проводить в четыреххлористом углероде в атмосфере аргона в присутствии ди(ацетилокси) йодбензола и молекулярного йода. Данную стадию, соответственно, проводят при облучении УФ,упомянутую выше стадию (ii) можно проводить в диметилформамиде в атмосфере аргона в присутствии порошка цинка, активированного 13 добавлением триметилсилилхлорида и 1,2 дибромэтана. Цинкорганическое производное,полученное таким образом, затем обрабатывают электрофилом B1X, например, в присутствии трис(дибензилиденацетон)дипалладия и триорто-толилфосфина при комнатной температуре,упомянутую выше стадию (iii) можно проводить в смеси метанол/вода в присутствии активного катализатора 10% палладий на угле и при давлении водорода 344,738 кПа (50 фунт/кв.дюйм). По схеме 5, чтобы получить соединения формулы [XV], которые полезны в качестве промежуточных соединений для получения соединений формулы [I] в соответствии с изобретением, в которых X = N, проводят следующие стадии: на стадии (i) 4-аминопиридиновое соединение формулы [X], в котором аминная функция защищена защитной группой P1, как определено выше, превращают в производное формулы[XI], несущее два атома брома, введенных заранее для включения желаемых групп,на стадии (ii) соединение формулы [XI] сочетают с производным бороновой кислоты формулы АВ(ОН)2, в котором А представляет собой фенильное ядро или гетероцикл, который является возможно замещенным, в присутствии палладиевого катализатора с получением соединения формулы [XII]. Схема 5 На стадии (iii) атом серы, который является предшественником группы сульфонилхлорид, вводят посредством катализируемой палладием реакции сочетания между соединением формулы [XII] и оловоорганическим производным, полученным предварительно из бензолметантиола,на стадии (iv) защитную группу P1 удаляют обработкой кислотой в традиционных условиях с получением соединения формулы [XIV],на стадии (v) соединение формулы [XIV] превращают в смешанный имид обработкой ангидридом, и затем группу бензилтиол непо 004986 14 средственно окисляют до хлорсульфонильного производного формулы [XV] сульфонилхлоридом в присутствии уксусной кислоты и воды. Согласно одному предпочтительному воплощению данного способа получения соединений формулы [XV] упомянутую выше стадию (i) можно проводить в ацетонитриле с N-бромсукцинимидом,упомянутую выше стадию (ii) можно проводить в смеси диоксан/вода в присутствии карбоната натрия и тетракис(трифенилфосфин) палладия (0),упомянутую выше стадию (iii) можно проводить в безводном диоксане в присутствии тетракис(трифенилфосфин)палладия (0) с трибутил[(фенилметил)тио]станнаном, полученным предварительно,упомянутую выше стадию (iv) можно проводить традиционно в метаноле в присутствии потока хлористого водорода,упомянутую выше стадию (v) можно проводить путем нагревания в чистом ангидриде,таком как пропионовый ангидрид. После выпаривания избытка реагента обработкой в смеси уксусной кислоты и воды сульфирилхлоридом получают ожидаемое хлорсульфонильное соединение формулы [XV] непосредственно. Полученное таким образом соединение формулы [XV] затем можно использовать для получения соединений формулы [I] в соответствии с изобретением, в которых X = N, путем выполнения протокола, описанного на стадии(iii) схемы 1, т.е. сочетанием соединения формулы [XV] с соединением формулы [III], как определено выше. Исходные соединения, такие как соединение формулы [Vb], являются коммерчески доступными или описаны в литературе, либо альтернативно их можно получить согласно способам, которые описаны здесь или известны специалистам в данной области техники. Следующие далее примеры иллюстрируют получение некоторых соединений в соответствии с изобретением. Микроанализы и спектры ИК и ЯМР подтверждают структуру полученных соединений. Номера проиллюстрированных соединений относятся к тем соединениям в приведенных далее таблицах, которые иллюстрируют химические структуры и физические свойства ряда соединений согласно изобретению. Отношение (х : у) представляет собой отношение(S)-N-[2-4-(6-аминопирид-3-ил)-1-[(4 этилпиперид-3-ил)карбонил]бутил]амино] сульфонил]-6-тиен-2-илфенил]пропанамида гидрохлорид. 1.1. N-(5-Бромпирид-2-ил)-2,2,2-трифторацетамид. 68,0 мл (0,477 моль) раствора трифторуксусного ангидрида в 250 мл дихлорметана до 15 бавляли по каплям при 0 С в атмосфере азота к раствору 75,0 г (0,433 моль) 5-бром-2 пиридинамина и 41,25 мл (0,519 моль) пиридина в 250 мл дихлорметана. Этой смеси давали осторожно нагреться до комнатной температуры и перемешивание продолжали в течение 18 ч. Эту реакционную смесь разбавляли 300 мл дихлорметана, а затем промывали водой (2400 мл), а затем насыщенным раствором хлорида натрия(2200 мл), после чего ее высушивали над сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке геля, элюируя под давлением смесью дихлорметан/пентан (1:1). Получили 100 г N-(5-бромпирид-2-ил)-2,2,2 трифторацетамида в форме белого твердого вещества. Выход (%) = 86; т. пл. (С) = 73. 1.2. Метил-(S)-2-(1,1-диметилэтокси) карбонил]амино]-5-[6-[(трифторацетил)амино] пирид-3-ил]пент-4-иноат. 1,7 г (2,4 ммоль) дихлорбис(трифенилфосфин)палладия добавляли при комнатной температуре в атмосфере аргона к смеси 13,0 гN-(5-бромпирид-2-ил)-2,2,2 трифторацетамида, 16,0 г (70,5 ммоль) метил(S)-2-(1,1-диметилэтокси)карбонил]амино] пент-4-иноата, 0,46 г (2,4 ммоль) йодида меди и 13,35 г (96,6 ммоль) карбоната калия в 25 мл безводного диметилформамида (ДМФ). Эту смесь нагревали в течение 5 ч при 65 С. Эту смесь растворяли в эфире (800 мл), а затем промывали водой (2600 мл), а затем насыщенным раствором хлорида натрия (300 мл) и высушивали над сульфатом натрия. Полученный продукт фильтровали, а затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке силикагеля, элюируя под давлением градиентом этилацетат/циклогексан от 0 до 20% этилацетата. Таким образом получили 10 г метил-(S)-2-(1,1 диметилэтокси)карбонил]амино]-5-[6-[(трифторацетил)амино]пирид-3-ил]пент-4-иноата в форме масла. Выход (%) = 52. 1.3. (S)-6-Амино(1,1-диметилэтокси) карбонил]амино]пиридин-3-пентановая кислота. Смесь 8,04 г метил-(S)-2-(1,1-диметилэтокси)карбонил]амино]-5-[6-[(трифторацетил) амино]пирид-3-ил]пент-4-иноата (20 ммоль) и активированного 10% палладия на угле (0,8 г) в метаноле (80 мл), а также уксусной кислоты(1,32 мл; 22 ммоль) перемешивали в течение 7 ч при давлении водорода 344,738 кПа (50 фунт/кв.дюйм) при комнатной температуре. Эту смесь фильтровали, а затем концентрировали при пониженном давлении. Полученный остаток переносили в этилацетат (400 мл), а затем промывали насыщенным раствором гидрокарбоната натрия (200 мл) и насыщенным раствором хлорида натрия (200 мл), фильтровали и 16 высушивали над сульфатом натрия, а затем концентрировали при пониженном давлении. К раствору этого остатка, полученного таким образом, в метаноле (50 мл) и воде (15 мл) добавляли гидроксида лития моногидрат (1,1 г; 26 ммоль) при 0 С. Этой смеси давали нагреться до комнатной температуры и перемешивание продолжали в течение 18 ч. Эту реакционную смесь охлаждали до 0 С, нейтрализовали 1 н. раствором соляной кислоты, а затем концентрировали при пониженном давлении. Получили 7 г (S)-6 амино(1,1-диметилэтокси)карбонил]амино] пиридин-3-пентановой кислоты (хлорида лития) в форме вязкого масла, которые использовали в следующей стадии без дальнейшей очистки. Выход (%) = 88. 1.4. 1,1-Диметилэтил-(S)-[4-(6-аминопирид-3-ил-1-([4-этилпиперид-3-ил)карбонил] бутил]карбамат. 2,1 г (5,5 ммоль) О-(бензотриазол-1-ил)N,N,N',N'-тетраметилурония гексафторфосфата(ГБТУ) добавляли порциями при перемешивании при 0 С в атмосфере азота к смеси 2,0 г (S)6-амино(1,1-диметилэтокси)карбонил] амино]пиридин-3-пентановой кислоты (5,5 ммоль), 1,14 г (7,5 ммоль) 4-этилпиперидина гидрохлорида,N,N-диизопропилэтиламина(ДМФ). Этой смеси давали нагреться до комнатной температуры и перемешивание продолжали в течение 18 ч. Эту реакционную смесь переносили в 250 мл этилацетата и промывали 50 мл 0,1 н. раствора соляной кислоты, 50 мл насыщенного раствора гидрокарбоната натрия и 50 мл насыщенного раствора хлорида натрия. Затем полученный продукт высушивали над сульфатом натрия, а затем фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке силикагеля, элюируя под давлением этилацетатом. Получили 1,48 г 1,1-диметилэтил(S)-[4-(6-аминопирид-3-ил-1-([4-этилпиперид-3 ил)карбонил]бутил]карбамата в форме вязкого масла. Выход (%) = 74. 1.5.(S)-1-[2-Амино-5-(6-аминопирид-3 ил)-1-оксопентил]-4-этилпиперидина гидрохлорид (2:1). Раствор 1,48 г (3,6 ммоль) 1,1 диметилэтил-(S)-[4-(6-аминопирид-3-ил)-1-([4 этилпиперид-3-ил)карбонил]бутил]карбамата в 40 мл дихлорметана обрабатывали в течение 1 мин при 0 С потоком хлористого водорода. Через один час при 0 С этой реакционной смеси давали нагреться до комнатной температуры, а затем концентрировали ее при пониженном давлении. Получили 1,4 г (S)-1-[2-амино-5-(6 аминопирид-3-ил)-1-оксопентил]-4-этилпиперидина гидрохлорида (2:1) в форме белого твер 17 дого вещества, которое использовали в следующей стадии без дальнейшей очистки. Выход (%) = 100; т. пл. (С) = 65. 1.6. (S)-N-[2-4-(6-аминопирид-3-ил)-1[(4-этилпиперид-3-ил)карбонил]бутил]амино] сульфонил]-6-тиен-2-илфенил]пропанамида гидрохлорид. 1,84 мл (13,2 ммоль) триэтиламина (ТЭА) добавляли при 0 С к раствору 1,5 г (4 ммоль)(S)-1-[2-амино-5-(6-аминопирид-3-ил)-1-оксопентил]-4-этилпиперидина гидрохлорида (2:1) в 20 мл дихлорметана с последующим добавлением порциями 1,54 г (4 ммоль) 2-[бис(1 оксопропил)амино]-3-тиен-2-илбензолсульфонилхлорида. Через 4 ч при 0 С добавляли 200 мл этилацетата, а затем эту смесь промывали 100 мл насыщенного раствора гидрокарбоната натрия и 100 мл насыщенного раствора хлорида натрия. Полученный продукт высушивали над сульфатом натрия и концентрировали при пониженном давлении. Полученный таким образом остаток переносили в 100 мл тетрагидрофурана (ТГФ), а затем охлаждали до 0 С и обрабатывали в течение 5 мин потоком аммиака. Этой реакционной смеси давали нагреться до комнатной температуры, а затем через 4 ч концентрировали при пониженном давлении. Полученный остаток переносили в 50 мл 0,1 н. раствора хлористого водорода в изопропаноле (5 ммоль),а затем концентрировали при пониженном давлении и очищали хроматографией на колонке(S)-N-[2-4-(6-аминопирид-3-ил)-1-[(4 этилпиперид-3-ил)карбонил]бутил]амино] сульфонил]-4-пирид-2-илфенил]пропанамида гидрохлорид (2:1). 2.1. (S)-N-[2-4-(6-аминопирид-3-ил)-1[(4-этилпиперид-3-ил)карбонил]бутил]амино] сульфонил]-4-бром-6-йодфенил]пропанамид. Использовали ту же методику, как в примере 1.6, за исключением обработки 0,1 н. раствором хлористого водорода в изопропаноле и очистки хроматографией на колонке RP 18. Таким образом, начиная с 1,4 г (3,6 ммоль) (S)-1[2-амино-5-(6-аминопирид-3-ил)-1-оксопентил]4-этилпиперидина гидрохлорида (2:1) и 1,88 г 18 сульфонил]-4-бром-6-пирид-2-илфенил]пропанамид. 0,08 г (0,14 ммоль) бис(дибензилиденацетон)палладия(0) добавляли при комнатной температуре к смеси 1,8 г (2,76 ммоль) (S)-N-[24-(6-аминопирид-3-ил)-1-[(4-этилпиперид-3 ил)карбонил]бутил]амино]сульфонил]-4-бром 6-йодфенил]пропанамида, 1,22 г (3,32 ммоль) 2(трибутилстаннил)пиридина, 0,052 г (0,28 ммоль) йодида меди и 0,17 г (0,56 ммоль) трифениларсина в 6 мл безводного диметилформамида (ДМФ). Эту реакционную смесь нагревали при 80 С в течение 7 ч, а затем переносили в 200 мл этилацетата. Затем эту смесь промывали дважды 200 мл водного 10%-ного раствора аммиака, а затем 100 мл воды и 100 мл насыщенного раствора хлорида натрия. Полученный в результате раствор высушивали над сульфатом натрия и фильтровали, а полученный в результате продукт концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на колонке силикагеля, элюируя под давлением смесью 94/6 дихлорметан/метанол. Получили 0,54 г (S)-N-[24-(6-аминопирид-3-ил)-1-[(4-этилпиперид-3 ил)карбонил]бутил]амино]сульфонил]-4-бром 6-пирид-2-илфенил]пропанамида в форме масла. Выход (%) = 30. 2.3. (S)-N-[2-4-(6-аминопирид-3-ил)-1[(4-этилпиперид-3-ил)карбонил]бутил]амино] сульфонил]-6-пирид-2-илфенил]пропанамида гидрохлорид (2:1). Смесь 0,2 г (0,3 ммоль) (S)-N-[2-4-(6 аминопирид-3-ил)-1-[(4-этилпиперид-3-ил)карбонил]бутил]амино]сульфонил]-4-бром-6 пирид-2-илфенил]пропанамида, 0,02 г активированного 10% палладия на угле и 0,2 г формиата аммония (3,0 ммоль) в 10 мл метанола кипятили с обратным холодильником в течение 2 ч. Эту реакционную смесь фильтровали, а затем переносили в 100 мл дихлорметана, промывали 50 мл насыщенного раствора гидрокарбоната натрия и 50 мл насыщенного раствора хлорида натрия. Полученный в результате раствор высушивали над сульфатом натрия, а затем фильтровали и полученный в результате продукт концентрировали. Полученный таким образом остаток растворяли в 40 мл 0,1 н. раствора хлористого водорода в изопропаноле, а затем концентрировали и очищали хроматографией на колонке RP 18, элюируя градиентом ацетонитрил/вода от 5/95 до 30/70. Получили 0,135 г (S)N-[2-4-(6-аминопирид-3-ил)-1-[(4-этилпиперид-3-ил)карбонил]бутил]амино]сульфонил]-6 пирид-2-илфенил]пропанамида гидрохлорида(S)-N-[2-1-[(4-Этилпиперид-3-ил)карбонил]-4-пиперид-3-илбутил]амино]сульфонил]-6 тиен-2-илфенил]пропанамида гидрохлорид. 3.1. Метил-(S)(1,1-диметилэтокси) карбонил]амино]-1-[(фенилметокси)карбонил] пиперидин-4-пентаноат. Смесь 2,8 г (10,0 ммоль) метил-(S)-2-(1,1 диметилэтокси)карбонил]амино]-5-пирид-4 илпент-4-иноата и 0,28 г активированного 10% палладия на угле в 20 мл этанола перемешивали в течение 3 ч при комнатной температуре и давлении водорода 413,686 кПа (60 фунт/кв.дюйм). Эту реакционную смесь фильтровали и концентрировали при пониженном давлении. Полученный остаток переносили в 20 мл уксусной кислоты и перемешивали в течение 14 ч в присутствии 0,05 г оксида платины при давлении водорода 413,686 кПа (60 фунт/кв.дюйм). Эту реакционную смесь фильтровали, а затем концентрировали при пониженном давлении. Полученный остаток переносили в 10 мл тетрагидрофурана (ТГФ) и 5 мл воды. Этот раствор охлаждали до 0 С с последующим добавлением раствора 3,4 г (40,0 ммоль) гидрокарбоната натрия в 40 мл воды, и добавляли по каплям 1,63 мл (12,0 ммоль) бензилхлорформиата. Этой смеси давали нагреться до комнатной температуры и реакцию продолжали в течение 4 ч. Эту реакционную смесь переносили в 200 мл этилацетата и дважды промывали 100 мл 1 н. раствора соляной кислоты, а затем 100 мл насыщенного раствора гидрокарбоната натрия и 100 мл насыщенного раствора хлорида натрия. Полученный в результате раствор высушивали над сульфатом натрия. Полученный в результате продукт фильтровали и концентрировали. Полученный остаток очищали хроматографией на колонке силикагеля,элюируя под давлением градиентом циклогексан/этилацетат от 95/5 до 80/20. Получили 3,55 г метил(S)(1,1-диметилэтокси)карбонил] амино]-1-[(фенилметокси)карбонил]пиперидин 4-пентаноата в форме вязкого масла. Выход (%) = 79; т. пл. (С) = 110. 3.2. (S)(1,1-Диметилэтокси)карбонил] амино]-1-[(фенилметокси)карбонил]пиперидин 4-пентановая кислота. Смесь 3,55 г (8,0 ммоль) метил-(S)-(1,1-диметилэтокси)карбонил]амино]-1[(фенилметокси)карбонил]пиперидин-4-пентаноата и 0,40 г (9,6 ммоль) гидроксида лития моногидрата в 15 мл метанола и 5 мл воды перемешивали в течение 18 ч при комнатной температуре. Метанол выпаривали при пониженном давлении, а затем эту смесь охлаждали до 0 С и подкисляли до рН 2 водным 1 н. раствором соляной кислоты, а затем дважды экстрагировали 150 мл этилацетата. Полученный в результате экстракт промывали 100 мл насыщенного раствора хлорида натрия, а затем высушивали над сульфатом натрия и фильтровали и полученный 20 остаток концентрировали. Получили 3 г (S)-(1,1-диметилэтокси)карбонил]амино]-1[(фенилметокси)карбонил]пиперидин-4-пентановой кислоты в форме белого порошка, который использовали в следующей стадии без дальнейшей очистки. Выход (%) = 86. 3.3. Фенилметил-(S)-4-[4-(1,1-диметилэтокси)карбонил]амино]-5-(4-этилпиперид-1 ил)-5-оксопентил]пиперидин-1-карбоксилат. 1,7 г (4,4 ммоль) О-(бензотриазол-1-ил)N,N,N',N'-тетраметилурония гексафторфосфата(ГБТУ) добавляли порциями при 0 С в атмосфере азота к раствору 1,73 г (4,0 ммоль) (S)-(1,1-диметилэтокси)карбонил]амино]-1[(фенилметокси)карбонил]пиперидин-4-пентановой кислоты, 0,66 г (4,4 ммоль) 4 этилпиперидина гидрохлорида и 1,8 мл (10,4 ммоль) N,N-диизопропилэтиламина (ДИЭА) в дихлорметане. Этой реакционной смеси давали медленно нагреться до комнатной температуры и реакцию продолжали в течение 18 ч. Затем эту реакционную смесь переносили в 200 мл этилацетата и промывали 100 мл 1 н. раствора соляной кислоты, а затем 100 мл насыщенного раствора гидрокарбоната натрия и 100 мл насыщенного раствора хлорида натрия. Полученный в результате продукт высушивали над сульфатом натрия и фильтровали, а затем концентрировали. Полученный остаток очищали хроматографией на колонке силикагеля, элюируя под давлением смесью 4/6 этилацетат/циклогексан. Получили 2 г фенилметил-(S)-4-[4-(1,1 диметилэтокси)карбонил]амино]-5-(4-этилпиперид-1-ил)-5-оксопентил]пиперидин-1-карбоксилата в форме вязкого масла. Выход (%) = 95. 3.4. Фенилметил-(S)-4-[4-амино-5-(4 этилпиперид-1-ил)-5-оксопентил]пиперидин-1 карбоксилата гидрохлорид. Раствор 1,54 г (3,0 ммоль) фенилметил-(S)4-[4-(1,1-диметилэтокси)карбонил]амино]-5(4-этилпиперид-1-ил)-5-оксопентил]пиперидин 1-карбоксилата в 60 мл дихлорметана обрабатывали в течение 5 мин при 0 С потоком хлористого водорода. После 3 ч при 0 С эту смесь концентрировали при пониженном давлении. Полученный в результате продукт использовали в следующей стадии без дальнейшей очистки. Таким образом получили 1,35 г фенилметил-(S)4-[4-амино-5-(4-этилпиперид-1-ил)-5-оксопентил]пиперидин-1-карбоксилата гидрохлорида в форме вязкого масла. Выход (%) = 100. 3.5.(S)-N-[2-1-[(4-Этилпиперид-3-ил) карбонил]-4-пиперид-4-илбутил]амино]сульфонил]-6-тиен-2-илфенил]пропанамида гидрохлорид. 1,27 г (3,3 ммоль) 2-[бис(1-оксопропил) амино]-3-тиен-2-илбензолсульфонилхлорида добавляли порциями при 0 С к раствору 1,35 г(3,0 ммоль) фенилметил-(S)-4-[4-амино-5-(4 этилпиперид-1-ил)-5-оксопентил]пиперидин-1 карбоксилата гидрохлорида и 0,96 мл (6,9 ммоль) триэтиламина (ТЭА) в 15 мл дихлорметана. Этой смеси давали медленно нагреться до комнатной температуры, и реакцию продолжали в течение 18 ч. Эту реакционную смесь переносили в 250 мл этилацетата и промывали 100 мл 1 н. раствора соляной кислоты, 100 мл насыщенного раствора гидрокарбоната натрия и 100 мл насыщенного раствора хлорида натрия. Полученный в результате продукт высушивали над сульфатом натрия и фильтровали, а затем концентрировали при пониженном давлении. Полученный остаток переносили в 100 мл тетрагидрофурана (ТГФ) и охлаждали до 0 С, а затем обрабатывали в течение 5 мин потоком аммиака. Этой реакционной смеси давали нагреться до комнатной температуры. После 4 ч эту реакционную смесь концентрировали при пониженном давлении. Полученный остаток переносили в 250 мл этилацетата, промывали 50 мл 1 н. раствора соляной кислоты, а затем 50 мл насыщенного раствора гидрокарбоната натрия и 50 мл насыщенного раствора хлорида натрия. Полученный в результате продукт высушивали над сульфатом натрия и фильтровали, а затем концентрировали при пониженном давлении. Полученный остаток переносили в 1,2 мл уксусной кислоты, охлаждали до 0 С, а затем обрабатывали 5 н. раствором бромистого водорода в 1,2 мл уксусной кислоты, добавляя по каплям. Этой смеси давали нагреться до комнатной температуры. Через 4 ч эту реакционную смесь концентрировали при пониженном давлении. Полученный остаток переносили в 250 мл этилацетата и промывали 50 мл насыщенного раствора гидрокарбоната натрия, а затем 50 мл насыщенного раствора хлорида натрия. Полученный в результате продукт высушивали над сульфатом натрия и фильтровали, а затем концентрировали после добавления 0,1 н. раствора хлористого водорода в 40 мл изопропанола. Полученный остаток очищали хроматографией на колонке RP 18,элюируя градиентом ацетонитрил/вода от 5/95 до 30/70. Получили 0,36 г (S)-N-[2-1-[(4 этилпиперид-3-ил)карбонил]-4-пиперид-4-илбутил]амино]сульфонил]-6-тиен-2-илфенил]пропанамида гидрохлорида. Выход (%) = 22; т. пл. (С) = 134-138;(ДМФ) нагревали в течение 4 ч при 60 С в атмосфере аргона. Эту реакционную смесь переносили в 800 мл этилацетата, промывали 2x400 мл воды, 400 мл насыщенного раствора гидрокарбоната натрия и 400 мл рассола, высушивали над сульфатом натрия, фильтровали, а затем концентрировали при пониженном давлении. Полученный остаток очищали на колонке силикагеля, элюируя градиентом циклогексан/ этилацетат от 0 до 20% этилацетата. Выделили 11 г метил-(S)-2-(1,1-диметилэтокси)карбонил]амино]-5-(5-нитропирид-2-ил)пент-4 иноата. Выход (%) = 65. 4.2. Метил-(S)-5-амино(1,1-диметилэтокси)карбонил]амино]пиридин-2-пентаноат. Смесь метил-(S)-2-(1,1-диметилэтокси) карбонил]амино]-5-(5-нитропирид-2-ил)пент-4 иноата (10,5 г; 30,0 ммоль), формиата аммония(19,0 г; 300,0 ммоль) и активированного 10% палладия на угле (1,1 г) в 100 мл метанола кипятили с обратным холодильником в течение 3 ч в атмосфере аргона. Эту реакционную смесь фильтровали, а затем концентрировали при пониженном давлении. Полученный остаток переносили в 400 мл этилацетата, промывали 100 мл рассола, высушивали над сульфатом натрия,фильтровали, а затем концентрировали при пониженном давлении. Остаток очищали на колонке силикагеля, элюируя смесью дихлорметан/метанол (96/4). Выделили 6,5 г метил-(S)-5 амино(1,1-диметилэтокси)карбонил]амино] пиридин-2-пентаноата в форме вязкого масла. Выход (%) = 62. 4.3. (S)-5-Амино(1,1-диметилэтокси) карбонил]амино]пиридин-2-пентановая кислота. Гидроксида лития моногидрат (0,9 г; 21,1 ммоль) добавляли при 0 С к смеси метил-(S)-5 амино(1,1-диметилэтокси)карбонил]амино] пиридин-2-пентаноата (6,2 г; 17,6 ммоль) в 45 мл метанола и 15 мл воды. Этой смеси давали медленно нагреться до комнатной температуры и перемешивание продолжали в течение 18 ч. Эту реакционную смесь охлаждали до 0 С, нейтрализовали 1 н. соляной кислотой (22,0 мл; 22,0 ммоль), а затем концентрировали при пониженном давлении. Выделили 7,0 г (S)-5-амино-(1,1-диметилэтокси)карбонил]амино]пиридин 2-пентановой кислоты в форме аморфного порошка. Выход (%) = 100. 4.4. 1,1-Диметилэтил-(S)-[4-(5-аминопирид-2-ил)-1-4-(дифторметилен)пиперид-1-ил] карбонил]бутил]карбамат. Использовали такую же методику, как в примере 1.4, за исключением очистки на колонке силикагеля, которую проводили градиентом(1,63 г, 9,6 ммоль), выделили 2,45 г 1,1 диметилэтил-(S)-[4-(5-аминопирид-2-ил)-1-4(дифторметилен)пиперид-1-ил]карбонил]бутил] карбамата в форме белого твердого вещества. Выход (%) = 72; т. пл. (С) = 142. 4.5.(S)-1-[2-Амино-5-(5-аминопирид-2 ил)-1-оксопентил]-4-(дифторметилен)пиперидина гидрохлорид. Использовали такую же методику, как в примере 1.5. Таким образом, начиная с 1,1 диметилэтил-(S)-[4-(5-аминопирид-2-ил)-1-4(дифторметилен)пиперид-1-ил]карбонил]бутил] карбамата (2,4 г; 5,6 ммоль), получили 2,25 г(S)-1-[2-амино-5-(5-аминопирид-2-ил)-1-оксопентил]-4-(дифторметилен)пиперидина гидрохлорида в форме гигроскопичного аморфного порошка, который использовали в следующей стадии без дальнейшей очистки. Выход (%) = 100. 4.6. (S)-N-[3-4-(5-Аминопирид-2-ил)-14-(дифторметилен)пиперид-1-ил]карбонил] бутил]амино]сульфонил]-3'-фтор[1,1'-дифенил]2-ил]пропанамида гидрохлорид. Использовали такую же методику, как в примере 1.6, за исключением очистки на колонке RP 18, которую проводили, используя градиент ацетонитрил/вода от 0 до 40% ацетонитрила. Таким образом, начиная с (S)-1-[2-амино-5-(5 аминопирид-2-ил)-1-оксопентил]-4-(дифторметилен)пиперидина гидрохлорида (0,65 г; 1,6 ммоль) и 2-бис(1-оксопропил)амино]-3'-фтор[1,1'-дифенил]-3-ил]сульфонилхлорида (0,69 г; 1,6 ммоль), выделили 0,69 г (S)-N-[3-4-(5 аминопирид-2-ил)-1-4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил]-3'фтор[1,1'-дифенил]-2-ил]пропанамида гидрохлорида. Выход (%) = 65; т. пл. (С) = 136-140;(S)-N-[2-4-(5-Амино-2-пиразинил)-1-4(дифторметилен)пиперид-1-ил]карбонил]бутил] амино]сульфонил]-6-циклопентилфенил]пропанамида гидрохлорид. 5.1. 5-Бром-2-пиразинамин. 28,2 г N-бромсукцинимида (0,158 моль) добавляли порциями при 0 С к раствору 2 аминопиразина (15,0 г; 0,158 моль) в 900 мл дихлорметана. Через 3 ч эту реакционную смесь фильтровали через агломерационную воронку,промывали насыщенным карбонатом натрия(2400 мл), водой (400 мл) и рассолом (200 мл),высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали на колонке силикагеля, элюируя под давлением градиентом 24 циклогексан/этилацетат от (9/1) до (1/1). Получили 18,0 г 5-бром-2-пиразинамина в форме желтоватого порошка. Выход (%) = 66; т. пл. (С) = 144. 5.2. Метил-(S)-5-(5-амино-2-пиразинил)-2(1,1-диметилэтокси)карбонил]амино]пент-4 иноат. Данный процесс осуществляли тем же путем, как в примере 1.2, и начиная с 7,5 г (43,0 ммоль) 5-бром-2-пиразинамина и 11,71 г (51,6 ммоль) метил-(S)-2-(1,1-диметилэтокси) карбонил]амино]пент-4-иноата, получили через 7 ч при комнатной температуре 10,6 г метил-(S)5-(5-амино-2-пиразинил)-2-(1,1-диметилэтокси)карбонил]амино]пент-4-иноата в форме вязкого масла. Выход (%) = 77. 5.3. Метил-(S)-5-(5-амино-2-пиразинил)-2(1,1-диметилэтокси)карбонил]амино]пентаноат. Смесь метил-(S)-5-(5-амино-2-пиразинил)2-(1,1-диметилэтокси)карбонил]амино]пент-4 иноата (10,0 г; 31,2 ммоль), формиата аммония(29,7 г; 468,0 ммоль) и активированного 10% палладия на угле (1,2 г) в метаноле (100 мл) кипятили с обратным холодильником в течение 3 ч. Эту реакционную смесь фильтровали, а затем концентрировали при пониженном давлении. Полученный остаток переносили в этилацетат(300 мл), промывали рассолом (2200 мл), высушивали над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали на колонке силикагеля, элюируя под давлением смесью дихлорметан/метанол (96/4). Выделили 7,9 г метил-(S)5-(5-амино-2-пиразинил)-2-(1,1-диметилэтокси)карбонил]амино]пентаноата в форме вязкого масла. Выход (%) = 79. 5.4. (S)-5-(5-Амино-2-пиразинил)-2-(1,1 диметилэтокси)карбонил]амино]пентановая кислота. Гидроксид лития (1,2 г; 28,6 ммоль) добавляли при 0 С к раствору метил-(S)-5-(5-амино 2-пиразинил)-2-(1,1-диметилэтокси)карбонил] амино]пентаноата (7,75 г; 23,9 ммоль) в метаноле (60 мл) и воде (20 мл). Этой смеси давали нагреться до комнатной температуры и перемешивание продолжали в течение 18 ч. Метанол выпаривали при пониженном давлении и полученный остаток охлаждали до 0 С, подкисляли до рН 3-4 1 н. соляной кислотой (30 мл), экстрагировали этилацетатом (2200 мл), промывали рассолом (50 мл), высушивали над сульфатом натрия,фильтровали и концентрировали при пониженном давлении. Получили 7,17 г (S)-5-(5-амино-2-пиразинил)-2-(1,1 диметилэтокси)карбонил]амино]пентановой кислоты в форме белого порошка, который использовали в следующей стадии без дальнейшей очистки. 25 Выход (%) = 97; т. пл. (С) = 76. 5.5. 1,1-Диметилэтил-(S)-[4-(5-амино-2 пиразинил)-1-4-(дифторметилен)пиперид-1 ил]карбонил]бутил]карбамат. Этот процесс осуществляли тем же путем,как в примере 1.4, и, начиная с 2,32 г (7,5 ммоль)(S)-5-(5-амино-2-пиразинил)-2-(1,1 диметилэтокси)карбонил]амино]пентановой кислоты и 1,9 г (11,25 ммоль) 4-(дифторметилен)пиперидина гидрохлорида, получили 2,61 г 1,1-диметилэтил-(S)-[4-(5-амино-2-пиразинил)-1-4-(дифторметилен)пиперид-1-ил]карбонил]бутил]карбамата в форме аморфного порошка. Выход (%) = 82; т. пл. (С) = 133. 5.6. (S)-1-[2-Амино-5-(5-амино-2-пиразинил)-1-оксопентил]-4-(дифторметилен)пиперидина гидрохлорид (2:1). Этот процесс осуществляли тем же путем,как в примере 1.5, и, начиная с 2,6 г (6,1 ммоль) 1,1-диметилэтил-(S)-[4-(5-амино-2-пиразинил)1-4-(дифторметилен)пиперид-1-ил]карбонил] бутил]карбамата, получили 2,45 г (S)-1-[2 амино-5-(5-амино-2-пиразинил)-1-оксопентил]4-(дифторметилен)пиперидина гидрохлорида(2:1) в форме вязкого масла. Выход (%) = 100. 5.7. (S)-N-[2-4-(5-Амино-2-пиразинил)-14-(дифторметилен)пиперид-1-ил]карбонил] бутил]амино]сульфонил]-6-циклопентилфенил] пропанамида гидрохлорид. Этот процесс осуществляли тем же путем,как в примере 1.6, и начиная с 1,11 г (3,0 ммоль) 2-[бис(1-оксопропил)амино]-3-циклопентилбензолсульфонилхлорида и 1,21 г (3,0 ммоль) (S)-1[2-амино-5-(5-амино-2-пиразинил)-1-оксопентил]-4-(дифторметилен)пиперидина гидрохлорида (2:1), получили 1,3 г (S)-N-[2-4-(5 амино-2-пиразинил)-1-4-(дифторметилен) пиперид-1-ил]карбонил]бутил]амино]сульфонил]-6-циклопентилфенил]пропанамида. Выход (%) = 68; т. пл. (С) = 136-140;(31,2 г; 89,0 ммоль) в уксусном ангидриде (93,0 мл) кипятили с обратным холодильником в течение 4 ч. Эту реакционную смесь концентрировали при пониженном давлении. Полученный остаток переносили в дихлорметан (250,0 мл) и охлаждали до 0 С с последующим добавлением пентахлорида фосфора (37,40 г; 178,0 ммоль). После 6 ч при 0 С эту реакционную смесь концентрировали при пониженном давлении. Полученный остаток переносили в эфир (500 мл), 004986 26 промывали рассолом (100 мл), высушивали над сульфатом натрия, фильтровали, а затем концентрировали. Остаток подвергали хроматографии на колонке Florisil, элюируя градиентом н-гексан/эфир от 0 до 60% эфира. Выделили 14,1 г 2-(диацетиламино)[1,1'-дифенил]-3 сульфонилхлорида в форме аморфного белого твердого вещества. Выход (%) = 45,0. 6.2. 1,1-Диметилэтил-(S)-[4-(5-аминопирид-2-ил)-1-[(4-метилпиперид-1-ил)карбонил] бутил]карбамат. Использовали такую же методику, как в примере 1.4, за исключением очистки на колонке силикагеля, которую проводили градиентом этилацетат/метанол от 0 до 10% метанола. Таким образом, начиная с (S)-5-амино(1,1 диметилэтокси)карбонил]амино]пиридин-2 пентановой кислоты (11,0 г; 31,0 ммоль) и 4 метилпиперидина (5,5 мл; 46,0 ммоль), выделили 1,1-диметилэтил-(S)-[4-(5-аминопирид-2-ил)1-[(4-метилпиперид-1-ил)карбонил]бутил]карбамат. Выход (%) = 86. 6.3. 1-[(2S)-2-Амино-5-(5-аминопирид-2 ил)-1-оксопентил]-4-метилпиперидина гидрохлорид. Использовали такую же методику, как в примере 1.5. Таким образом, начиная с 1,1 диметилэтил-(S)-[4-(5-аминопирид-2-ил)-1-[(4 метилпиперид-1-ил)карбонил]бутил]карбамата(10,2 г; 26,0 ммоль), получили 9,5 г 1-[(2S)-2 амино-5-(5-аминопирид-2-ил)-1-оксопентил]-4 метилпиперидина гидрохлорида в форме гигроскопичного аморфного порошка, который использовали в следующей стадии без дальнейшей очистки. Выход (%) = 100. 6.4. N-[3-(1S)-4-(5-Аминопирид-2-ил)-1[(4-метилпиперид-1-ил)карбонил]бутил]амино] сульфонил][1,1'-дифенил]-2-ил]ацетамид. Этот процесс осуществляли тем же путем,как в примере 1.6. Таким образом, начиная с 2(диацетиламино)[1,1'-дифенил]-3-сульфонилхлорида (4,57 г; 13,0 ммоль) и 1-[(2S)-2-амино 5-(5-аминопирид-2-ил)-1-оксопентил]-4-метилпиперидина гидрохлорида, получили 5,2 г N-[3(1S)-4-(5-аминопирид-2-ил)-1-[(4-метилпиперид-1-ил)карбонил]бутил]амино]сульфонил]N-3-[(1S)-4-(5-Аминопирид-2-ил)-1-4(дифторметилен)пиперид-1-ил)карбонил]бутил] амино]сульфонил][1,1'-дифенил]-2-ил]ацетамида гидрохлорид. Этот процесс осуществляли тем же путем,как в примере 1.6. Таким образом, начиная с 3,52 г (10,0 ммоль) 2-(диацетиламино)[1,1'дифенил]-3-сульфонилхлорида и 4,2 г (10,5N-[3-(1S)-4-(6-Аминопирид-3-ил)-1-[(4 метилпиперид-1-ил)карбонил]бутил]амино] сульфонил]-5-фенилпирид-4-ил]пропанамида гидрохлорид. 8.1. 1,1-Диметилэтил-(3,5-дибромпирид-4 ил)карбамат. Смесь 1,1-диметилэтил-4-пиридинкарбамата (11,0 г; 57,0 ммоль) и N-бромсукцинимида (25,6 г; 142,0 ммоль) в ацетонитриле (50 мл) нагревали в течение 12 ч при 55 С. Эту реакционную смесь концентрировали при пониженном давлении. Полученный остаток переносили в эфир (400 мл), промывали насыщенным водным раствором бикарбоната калия(2200 мл), высушивали над сульфатом натрия,фильтровали, а затем концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке силикагеля, элюируя градиентом этилацетат/циклогексан от 0 до 10% этилацетата. Выделили 8,2 г 1,1-диметилэтил(3,5-дибромпирид-4-ил)карбамата в форме белого твердого вещества. Выход (%) = 41. 8.2. 1,1-Диметилэтил-(3-бром-5-фенилпирид-4-ил)карбамат. Смесь 1,1-диметилэтил-(3,5-дибром-4 пиридил)карбамата (4,2 г; 12,0 ммоль), фенилбороновой кислоты (1,76 г; 14,4 ммоль), карбоната натрия (3,1 г; 29,2 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,416 г; 0,36 ммоль) в диоксане (24 мл) и воде (12 мл) нагревали при 70 С в атмосфере аргона в течение 8 ч. Эту реакционную смесь концентрировали при пониженном давлении. Полученный остаток переносили в этилацетат (200 мл), промывали водой (2100 мл) и рассолом (100 мл), высушивали над сульфатом натрия, фильтровали, а затем концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке силикагеля, элюируя градиентом этилацетат/циклогексан от 0 до 5%. Выделили 2,3 г 1,1 диметилэтил-(3-бром-5-фенилпирид-4-ил)карбамата в форме белого твердого вещества. Выход (%) = 55. 8.3. Трибутил[(фенилметил)тио]станнан. 1,8-Диазабицикло[5.4.0]ундец-7-ен (ДБУ) добавляли по каплям при 20 С в атмосфере аргона к раствору бензолметантиола (11,72 мл; 100,0 ммоль) в безводном ДМФ (20,0 мл). После 0,5 ч при 20 С эту реакционную смесь охлаждали до 0 С и добавляли по каплям хлорид трибутилолова. Этой смеси давали нагреться до ком 004986 28 натной температуры и перемешивание продолжали в течение 5 ч. Эту реакционную смесь переносили в пентан (400 мл), промывали водой(3x300 мл) и рассолом (100 мл), высушивали над сульфатом натрия, фильтровали, а затем концентрировали при пониженном давлении. Получили 39,0 г трибутил[(фенилметил) тио]станнана в форме бесцветного масла, которое использовали в следующей стадии без дальнейшей очистки. Выход (%) = 95. 8.4. 1,1-Диметилэтил-[3-фенил-5-[(фенилметил)тио]пирид-4-ил]карбамат. Смесь 1,1-диметилэтил-(3-бром-5-фенилпирид-4-ил)карбамата (2,30 г; 6,6 ммоль), трибутил[(фенилметил)тио]станнана (2,44 мл; 7,3 ммоль) и тетракис(трифенилфосфин)палладия (0) (0,30 г; 0,26 ммоль) в безводном диоксане (4,0 мл) нагревали в течение 10 ч в атмосфере аргона при 90 С. Через 4 и через 6 ч добавляли тетракис(трифенилфосфин)палладий(0) (0,30 и 0,15 г соответственно). Эту реакционную смесь переносили в эфир (100 мл), обрабатывали в течение 0,5 ч водным 5%-ным раствором фторида калия (50 мл), а затем фильтровали через агломерационную воронку. Фильтрат промывали рассолом (50 мл), высушивали над сульфатом натрия, фильтровали, а затем концентрировали без пониженного давления. Полученный остаток подвергали хроматографии на колонке силикагеля, элюируя градиентом этилацетат/циклогексан от 0 до 20% этилацетата. Выделили 1,0 г 1,1-диметилэтил-[3-фенил 5-[(фенилметил)тио]пирид-4-ил]карбамата в форме белого твердого вещества. Выход (%) = 45. 8.5. 3-Фенил-5-[(фенилметил)тио]пирид-4 амин. Раствор 1,1-диметилэтил-[3-фенил-5[(фенилметил)тио]пирид-4-ил]карбамата (0,9 г; 2,7 ммоль) в метаноле (50 мл) обрабатывали в течение 5 мин при 0 С потоком хлористого водорода. Этой смеси давали нагреться до комнатной температуры и перемешивание продолжали в течение 6 ч. Эту реакционную смесь концентрировали при пониженном давлении. Полученный остаток переносили в этилацетат(150 мл), обрабатывали насыщенным водным раствором карбоната калия (20 мл), высушивали над сульфатом натрия, фильтровали, а затем концентрировали при пониженном давлении. Получили 0,8 г 3-фенил-5-[(фенилметил) тио]пирид-4-амина в форме вязкого масла, которое использовали в следующей стадии без дальнейшей очистки. Выход (%) = 100. 8.6. 4-[бис(1-Оксопропил)амино]-5-фенилпирид-3-сульфонилхлорид. Раствор 3-фенил-5-[(фенилметил)тио] пирид-4-амина (0,8 г; 2,74 ммоль) в пропионовом ангидриде нагревали при 150 С в течение 6 ч. Эту реакционную смесь концентрировали при 29 пониженном давлении и использовали в следующей стадии без дальнейшей очистки. Добавляли по каплям сульфонилхлорид (0,75 мл; 9,4 ммоль) при 5 С к смеси сырого продукта,полученного выше, в уксусной кислоте (3 мл) и воды (0,2 мл). После 0,5 ч при 5 С эту реакционную смесь концентрировали при пониженном давлении. Полученный остаток переносили в эфир (150 мл), промывали водой (50 мл) и рассолом (50 мл), высушивали над сульфатом натрия, фильтровали, а затем концентрировали при пониженном давлении. Получили 1,1 г 4[бис(1-оксопропил)амино]-5-фенилпирид-3 сульфонилхлорида в форме вязкого масла, которое использовали в следующей стадии без дальнейшей очистки. Выход (%) = 100. 8.7. N-[3-(1S)-4-(6-Аминопирид-3-ил)-1[(4-метилпиперид-1-ил)карбонил]бутил]амино] сульфонил]-5-фенилпирид-4-ил]пропанамида гидрохлорид. Раствор 4-[бис(1-оксопропил)амино]-5 фенилпирид-3-сульфонилхлорида (0,5 г; 1,0 ммоль) в дихлорметане (3 мл) добавляли по каплям при 0 С к смеси 1-[(2S)-2-амино-5-(6 аминопирид-3-ил)-1-оксопентил]-4-метилпиперидина (0,35 г; 1,1 ммоль) и триэтиламина (0,45 мл; 3,3 ммоль) в дихлорметане (3 мл). После 6 ч при 0 С эту реакционную смесь переносили в этилацетат (100 мл), промывали рассолом (50 мл), высушивали над сульфатом натрия, фильтровали, а затем концентрировали при пониженном давлении. Полученный остаток переносили в тетрагидрофуран (20,0 мл), охлаждали до 0 С,а затем обрабатывали в течение 5 мин потоком газообразного аммиака. После 4 ч при комнатной температуре эту реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке силикагеля, элюируя градиентом дихлорметан/метанол от 0 до 5% метанола. Выделили 0,45 г основания (выход (%) = 77), которое переносили в 2 мл 0,1 н. раствора хлористого водорода в изопропаноле и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке силикагеля RP 18,элюируя смесью 3/7 ацетонитрил/вода. Выделили 0,42 г N-[3-(1S)-4-(6-аминопирид-3-ил)-1[(4-метилпиперид-1-ил)карбонил]бутил]амино] сульфонил]-5-фенилпирид-4-ил]пропанамида гидрохлорида. Выход (%) = 66; т. пл. (С) = 180-184;(дифторметилен)-1-пиперидил]карбонил] бутил]-3'-метил. 0,74 мл триэтиламина (5,31 ммоль) добавляли по каплям к перемешанному раствору 0,64 г (1,77 ммоль) (1S)-5-амино 4-(дифторметилен)-1-пиперидил]карбонил]-2-пиридинбутанамина дигидрохлорида в 10 мл дихлорметана с последующим добавлением по каплям при 0 С раствора 2-амино-3'-метил-[1,1'дифенил]-3-сульфонилхлорида (0,50 г; 1,77 ммоль) в 2 мл дихлорметана. После перемешивания в течение 16 ч при комнатной температуре реакционную среду выпаривали при пониженном давлении. Остаток переносили в 100 мл этилацетата и промывали 25 мл насыщенного раствора бикарбоната натрия, а затем 25 мл насыщенного раствора хлорида натрия и, наконец,высушивали над Na2SO4. Растворитель выпаривали при пониженном давлении, и остаток подвергали хроматографии на силикагеле в смеси дихлорметан/метанол от 0 до 10% метанола с получением 0,6 г чистого продукта. Выход (%) = 60. 9.2. N-[(1S)-4-(5-Амино-2-пиридил)-1-4(дифторметилен)-1-пиперидил]карбонил] бутил]-2-(формиламино)-3'-метил-[1,1'-дифенил]-3-сульфонамида гидрохлорид. Раствор 0,55 г N-[(1S)-4-(5-амино-2 пиридил)-1-4-(дифторметилен)-1-пиперидил] карбонил]бутил]-2-(формиламино)-3'-метил-2N-амино-[1,1'-дифенил]-3-сульфонамида(1 ммоль) в 3 мл этилортоформиата нагревали при 125 С при перемешивании и в атмосфере аргона в течение 7 ч. Затем эту реакционную смесь наливали в раствор 50 мл уксусной кислоты и 50 мл воды и нагревали при 100 С в течение 1 ч. После выпаривания при пониженном давлении остаток переносили в 100 мл этилацетата, промывали 50 мл насыщенного раствора хлорида натрия и высушивали над Na2SO4. Растворитель выпаривали при пониженном давлении и остаток переносили в 10 мл 0,1 н. раствора хлористого водорода в изопропаноле и выпаривали при пониженном давлении. Затем этот продукт подвергали хроматографии на силикагеле RP18 в смеси N/100 соляная кислота/ацетонитрил от 0 до 100% ацетонитрила. Таким образом получили 0,22 г делаемого продукта. Выход (%) = 37; т. пл. (С) = 168; 31 амино]-4-пентиноата и 10 г (63,1 ммоль) 2-хлор 5-нитропиридина в 100 мл дихлорметана с последующим добавлением 380 мг (2,6 ммоль) бромида меди. Эту смесь дегазировали барботированием через нее аргона в течение 15 мин. К этой реакционной смеси добавляли 740 мг (1,05 ммоль) тетракис(трифенилфосфин)палладия(0) в атмосфере аргона, а затем ее кипятили с обратным холодильником (температура = 40 С) в течение 4 ч. Эта смесь становилась черной. Дихлорметан выпаривали, а затем остаток переносили в 500 мл этилацетата. Органическую фазу промывали насыщенным раствором хлорида натрия, высушивали над безводным сульфатом натрия, а затем выпаривали до сухости. Остаток после выпаривания очищали на силикагеле смесью циклогексан/этилацетат (85/15). Получили 16,6 г коричневого порошка. Выход (%) = 90. 10.2. Метил-(2S)-5-(5-амино-2-пиридил)-2[(2,2-диметил-1-оксопропокси)амино]-4-пентиноат. Смесь 11,6 г (33,2 ммоль) метил-(2S)-2[2,2-диметил-1-оксопропокси)амино]-5-нитро-2 пиридил)-4-пентиноата, 6,5 г (116,2 ммоль) железа, 100 мл воды, 200 мл этанола и 20 мл уксусной кислоты кипятили с обратным холодильником в течение 5 ч. Этанол выпаривали и затем эту смесь фильтровали через целит. Продукт экстрагировали дихлорметаном. Органическую фазу высушивали над безводным сульфатом магния, а затем выпаривали до сухости. Остаток после выпаривания очищали на диоксиде кремния смесью дихлорметан/метанол (97/3). Получили 8 г коричневого масла. Выход (%) = 80. 10.3. Метил-(2S,4Z)-5-(5-амино-2-пиридил)-2-[(2,2-диметил-1-оксопропокси)амино]-4 пентеноат. 4 г (12,5 ммоль) метил-(2S,4Z)-5-(5-амино 2-пиридил)-2-[(2,2-диметил-1-оксопропокси) амино]-4-пентиноата, растворенного в 100 мл этилацетата, помещали в аппарат Парра и гидрогенировали при комнатной температуре при давлении 55,158 кПа (8 фунт/кв.дюйм) в течение 4 ч. Эту смесь фильтровали через бумагу Ватман и фильтрат выпаривали. Сырой остаток очищали на силикагеле смесью циклогексан/этилацетат (1/1). Получили 1,8 г светлокоричневого порошка. Выход (%) = 45. 10.4.(2S,4Z)-5-(5-амино-2-пиридил)-2[(2,2-диметил-1-оксопропокси)амино]-4-пентеновая кислота. 260 мг гидроксида лития (6,16 ммоль) добавляли к раствору метил-(2S,4Z)-5-(5-амино-2 пиридил)-2-[(2,2-диметил-1-оксопропокси) амино]-4-пентеноата (1,8 г, то есть 5,6 ммоль) в смеси метанол/вода (45/15). Эту смесь оставляли перемешиваться в течение ночи при комнатной температуре. Эту смесь выпаривали до сухости азеотропной дистилляцией толуола. К 32 этой смеси добавляли 1,6 мл 4 н. хлористого водорода в диоксане и 30 мл дихлорметана. Полученную в результате смесь снова выпаривали до сухости. Ожидаемое соединение получили количественно в форме оранжевой смолы. 10.5. 6-(1Z,4S)-5-[4-(Дифторметилен)-1 пиперидил]-4-[(2,2-диметил-1-оксопропокси) амино]-5-оксо-1-пентенил-3-пиридинамин. 2,82 мл (16,1 ммоль) диизопропилэтиламина добавляли в атмосфере аргона к раствору 1,07 г (6,2 ммоль) 4-дифторметиленпиперидина в смеси дихлорметан/диметилформамид (8/2). Эту смесь охлаждали до 0 С. При этой температуре добавляли 2,2 г (6,2 ммоль) (2S,4Z)-5-(5 амино-2-пиридил)-2-[(2,2-диметил-1-оксопропокси)амино]-4-пентеновой кислоты и 2,2 г(6,93 ммоль) ТБТУ. Этой смеси давали нагреться до комнатной температуры при перемешивании в течение ночи. Эту смесь выпаривали до сухости и остаток переносили в этилацетат и промывали насыщенным раствором карбоната натрия. Органическую фазу высушивали над безводным сульфатом натрия и выпаривали до сухости. Остаток после выпаривания очищали на диоксиде кремния смесью циклогексан/этилацетат/метанол (45/45/10). Выход (%) = 75. 10.6.N-[2-(1S,3Z)-4-(5-амино-2-пиридил)-1-4-(дифторметилен)-1-пиперидил]карбонил]-3-бутенил]амино]сульфонил]-6-(2-тиенил) фенил]ацетамида гидрохлорид. 46 ммоль (11,5 мл) 4 н. хлористого водорода в диоксане добавляли к раствору 1,95 г (4,6 ммоль) 6-(1Z,4S)-5-[4-(дифторметилен)-1 пиперидил]-4-[(2,2-диметил-1-оксопропокси) амино]-5-оксо-1-пентенил-3-пиридинамина в 40 мл дихлорметана. Эту смесь оставляли перемешиваться в течение ночи при комнатной температуре. Эту смесь выпаривали до сухости. 351 мг (0,98 ммоль) остатка переносили в 3 мл дихлорметана и добавляли к нему 401 мкл (2,94 ммоль) триэтиламина. Эту смесь охлаждали до 0 С. При этой температуре добавляли 350 мг(0,98 ммоль) 2-[(диацетиламино)-1,1'-дифенил]3-сульфонилхлорида. Этой смеси давали нагреться до комнатной температуры при перемешивании в течение 1 ч. Эту смесь промывали водным раствором хлорида натрия, а затем выпаривали до сухости. Остаток переносили в 5 мл тетрагидрофурана. Через эту смесь, охлажденную до 0 С, барботировали аммиак в течение 45 мин. Тетрагидрофуран выпаривали, а затем продукт очищали на диоксиде кремния смесью циклогексан/этилацетат (3/7), а затем на обращенной фазе, используя градиент N/100 соляная кислота/ацетонитрил от 0 до 100% ацетонитрила. Выход (%) = 20; т. пл. (С) = 170;N-[3-(1S,3 Е)-4-(5-амино-2-пиридил)-14-(дифторметилен)-1-пиперидил]карбонил]-3 33 бутенил]амино]сульфонил][1,1'-дифенил]-2-илацетамида гидрохлорид. 11.1. Метил-(2S)-2-[(трифенилметил)амино]-4-пентиноат. 22 мл (88 ммоль) 4 н. хлористого водорода в диоксане добавляли к раствору 2 г (8,8 ммоль) метил-(S)-2-1,1-диметилэтокси)карбокси] амино]пент-4-иноата в 5 мл дихлорметана. Эту смесь оставляли перемешиваться в течение 2 ч при комнатной температуре. Эту смесь выпаривали до сухости, а затем переносили в 8 мл дихлорметана. К ней добавляли 1,8 мл (13,2 ммоль) триэтиламина. Эту смесь охлаждали до 0 С. При этой температуре к ней добавляли 2,6 г(0,65 ммоль) тритилхлорида. Этой смеси давали нагреться до комнатной температуры при перемешивании в течение ночи. Эту смесь промывали водой, высушивали над безводным сульфатом натрия, а затем выпаривали до сухости. Остаток после выпаривания очищали на диоксиде кремния смесью циклогексан/этилацетат (9/1). Получили 3 г вязкого белого твердого вещества. Выход (%) = 92. 11.2. Метил-(2S)-5-(трибутилстаннил)-2[(трифенилметил)амино]-4-пентеноат. Аргон барботировали через раствор 200 мг(0,54 ммоль) метил-(2S)-2-[(трифенилметил) амино]-4-пентиноата в 2 мл безводного тетрагидрофурана в течение 10 мин. Добавляли 5% тетракис(трифенилфосфин)палладия (0) (3 мг; 2,710-3 ммоль). Когда смесь становилась однородной, ее охлаждали до 0 С. 173 мкл (0,65 ммоль) гидрида трибутилолова добавляли по каплям при 0 С в атмосфере аргона. Эта смесь становилась мутно-желтой. Этой смеси давали нагреться до комнатной температуры при перемешивании в течение 2 ч. Эту смесь выпаривали до сухости, а затем очищали на Florisil, элюируя чистым циклогексаном. Получили прозрачную вязкую жидкость. 11.3. Метил-(2S,4 Е)-5-(5-нитро-2-пиридил)-2-[(трифенилметил)амино]-4-пентеноат. Аргон барботировали через раствор 80 мг(0,19 ммоль) 2-бром-5-нитропиридина в 1 мл безводного диоксана в течение 10 мин. Затем добавляли 11,4 мг (0,0125 ммоль) тетракис(трифенилфосфин)палладия (0). Эту смесь поддерживали при 110 С в течение 24 ч в атмосфере аргона. Эту смесь промывали насыщенным раствором фторида калия, а затем экстрагировали этилацетатом. Органическую фазу высушивали над безводным сульфатом натрия,а затем концентрировали при пониженном давлении. Остаток после выпаривания очищали на диоксиде кремния, элюируя смесью циклогексан/этилацетат 98/2, а затем 95/5. Получили 20 мг желтого масла. Выход (%) = 31. 11.4. Метил-(2S,4 Е)-5-(5-амино-2-пиридил)-2-[(трифенилметил)амино]-4-пентеноат. 34 Смесь 1,2 г (2,43 ммоль) метил-(2S,4 Е)-5(5-нитро-2-пиридил)-2-[(трифенилметил)амино]-4-пентеноата, 477 мг (8,5 ммоль) железа, 3,6 мл воды, 7,2 мл этанола и 720 мкл уксусной кислоты поддерживали при 110 С в течение 40 мин. Эту смесь фильтровали через целит. Этанол выпаривали при пониженном давлении. Сырой остаток экстрагировали смесью дихлорметан/изопропанол (75/25). Органическую фазу высушивали над безводным сульфатом натрия,а затем концентрировали при пониженном давлении. Остаток после выпаривания очищали на диоксиде кремния смесью циклогексан/ этилацетат (6/4). Получили 500 мг желтого масла. Выход (%) = 41,6. 11.5. Метил-(2S,4 Е)-2-[(2,2-диметил-1 оксопропокси)амино]-5-[5-[(2,2-диметил-1-оксопропил)амино]-2-пиридил]-4-пентеноат. Раствор 500 мг (1,08 ммоль) метил-(2S,4 Е)5-(5-амино-2-пиридил)-2-[(трифенилметил)амино]-4-пентеноата в 3,24 мл соляной кислоты и 2 мл тетрагидрофурана кипятили с обратным холодильником при 65 С в течение 1 ч 30 мин. Этой смеси давали охладиться. 1 н. гидроксид натрия добавляли к этой смеси до тех пор, пока рН не становился щелочным. К ней добавляли 2,35 г (10,8 ммоль) ди-трет-бутилкарбоната. Эту смесь оставляли перемешиваться при комнатной температуре в течение 24 ч. Эту смесь промывали диэтиловым эфиром, а затем снова подкисляли лимонной кислотой и сырой продукт экстрагировали дихлорметаном. Органическую фазу высушивали над безводным сульфатом натрия, а затем выпаривали до сухости. Получили 300 мг желтого масла. Выход (%) = 60. 11.6. N-(1S,3E)-1-4-(дифторметилен)-1 пиперидил]карбонил]-4-[5-[(2,2-диметил-1 оксопропил)амино]-2-пиридил]-3-бутенил]-2,2 диметилпропанамид. 300 мг (0,73 ммоль) метил-(2S,4 Е)-2-[(2,2 диметил-1-оксопропил)амино]-5-[5-[(2,2-диметил-1-оксопропил)амино]-2-пиридил]-4-пентеноата добавляли к раствору, охлажденному до 0 С, 120 мг (0,73 ммоль) 4-дифторметилпиперидина в 8 мл дихлорметана и 509 мкл диизопропилэтиламина с последующим добавлением 257 мг (0,80 ммоль) ТБТУ. Эту смесь оставляли перемешиваться при 0 С в течение 2 ч 30 мин. Дихлорметан выпаривали. Остаток переносили в этилацетат, промывали насыщенным раствором карбоната натрия, а затем водой, и высушивали над безводным сульфатом натрия. Органическую фазу концентрировали в вакууме. Остаток после выпаривания очищали на диоксиде кремния смесью дихлорметан/метанолN-(1S,3 Е)-1-4-(дифторметилен)-1 пиперидил]карбонил]-4-[5-[(2,2-диметил-1 оксопропил)амино]-2-пиридил]-3-бутенил]-2,2 диметилпропанамида в 4 мл дихлорметана. Эту смесь перемешивали при комнатной температуре в течение 2 ч. Эту смесь выпаривали до сухости. Остаток после выпаривания растворяли в 3 мл дихлорметана. К нему добавляли 315 мкл(2,31 ммоль) триэтиламина. Эту смесь охлаждали до 0 С. При этой температуре добавляли 232 мг (0,66 ммоль) 2-(диацетиламино)-[1,1'дифенил]-3-сульфонилхлорида. Этой смеси давали нагреться до комнатной температуры при перемешивании в течение 2 ч. Эту смесь промывали насыщенным раствором хлорида натрия. Органическую фазу высушивали над безводным сульфатом натрия, а затем выпаривали до сухости. Остаток переносили в 4 мл тетрагидрофурана и охлаждали до 0 С. Аммиак барботировали через эту смесь в течение 45 мин при 0 С. Эту смесь выпаривали до сухости. Остаток после выпаривания очищали на диоксиде кремния смесью циклогексан/этилацетат (2/8), а затем на обращенной фазе, используя N/100 градиент соляная кислота/ацетонитрил от 0 до 100% ацетонитрила. Получили 150 мг ожидаемого соединения. Выход (%) = 38; т. пл. (С) = 175;(S)-N-[3-3-(5-амино-2-пиридил)-1-4(дифторметилен)-1-пиперидил]карбонил] пропил]амино]сульфонил][1,1'-дифенил]-2 ил]ацетамида гидрохлорид. 12.1. Фенилметил-(S)-4-йод-2-(фенилметокси)карбонил]амино]бутаноат. 14 г (43 ммоль) ди(ацетилокси)йодбензола и 10,5 г (41 ммоль) йода добавляли к раствору 30 г (80 ммоль) 1-фенилметил-(L)-(N)[(фенилметокси)карбонил]глутамата в 800 мл тетрахлорида углерода в атмосфере аргона. Эту смесь кипятили с обратным холодильником при облучении УФ. Через 1 ч 30 мин добавляли дополнительно 14 г (43 ммоль) ди(ацетилокси) йодбензола и 10,5 г йода. После облучения УФ в течение 2 ч эту смесь промывали 10%-ным раствором гидросульфита натрия (2300 мл), затем 200 мл насыщенного раствора гидрокарбоната натрия, а затем 200 мл воды. Эту смесь высушивали над сульфатом натрия, концентрировали при пониженном давлении и очищали фильтрованием через колонку силикагеля, элюируя смесью циклогексан/этилацетат 95/5. Получили 12,8 г фенилметил-(S)-4-йод-2-(фенилметокси) карбонил]амино]бутаноата в форме масла. Выход (%) = 35. 36 12.2. Фенилметил-(S)-5-нитро(фенилметокси)карбонил]амино]-2-пиридинбутаноат. Суспензию 6 г (92 ммоль) цинкового порошка и 0,4 мл (4,7 ммоль) 1,2-дибромэтана в 7 мл безводного N,N-диметилформамида нагревали при 60 С при перемешивании и в атмосфере аргона в течение 45 мин. Затем добавляли 0,126 мл (1 ммоль) триметилсилилхлорида, и эту смесь энергично перемешивали при комнатной температуре в течение 30 мин. Затем добавляли раствор 7 г (15,4 ммоль) фенилметил-(S)-4-йод 2-(фенилметокси)карбонил]амино]бутаноата в 1 мл безводного N,N-диметилформамида. После 30 мин при комнатной температуре добавляли 0,28 г (0,31 ммоль) трис(дибензилиденацетон) дипалладия (0), 0,38 г (1,24 ммоль) три-ортотолилфосфина, 3,78 г (18,5 ммоль) 2-бром-5 нитропиридина и 1 мл безводного N,Nдиметилформамида при комнатной температуре, и эту смесь перемешивали в течение 3 ч при комнатной температуре. Эту реакционную смесь переносили в 200 мл этилацетата и добавляли 5 г активированного угля, а затем фильтровали через брикет целита. Брикет промывали 2100 мл этилацетата и органические фазы объединяли, промывали 5100 мл воды, высушивали над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали фильтрованием на колонке силикагеля, элюируя градиентом циклогексан/этилацетат от 0 до 20% этилацетата. Таким образом получили 5,16 г фенилметил-(S)-5-нитро(фенилметокси) карбонил]амино]-2-пиридинбутаноата в форме желтой пены. Выход (%) = 74. 12.3. (S)-,5-диамино-2-пиридинбутановая кислота. Смесь 5,16 г (11,5 ммоль) фенилметил-(S)5-нитро(фенилметокси)карбонил]амино]-2 пиридинбутаноата, 2 г активированного угля и 0,77 г активированного палладия на угле в 100 мл метанола и 100 мл воды перемешивали в течение 4 суток при 344,738 кПа (50 фунт/кв.дюйм) водорода при комнатной температуре. Эту реакционную смесь фильтровали через брикет целита и этот брикет промывали 350 мл кипящей воды. Водные фазы объединяли и концентрировали при пониженном давлении. Таким образом получили 2,05 г (S)-,5 диамино-2-пиридинбутановой кислоты в форме белого твердого вещества. Выход (%) = 92; т. пл. (С)260. 12.4.(S)-,5-бис(1,1-диметилэтокси) карбонил]амино]-2-пиридинбутановая кислота. 1,05 мл (9,19 ммоль) водного 35%-ного раствора гидроксида натрия и 2 г (9,17 ммоль) бис(1,1-диметилэтил)дикарбоната добавляли к раствору 0,85 г (4,36 ммоль) (S)-,5-диамино-2 пиридинбутановой кислоты в 50 мл воды и 50 мл 1,1-диметилэтанола. Этот раствор перемешивали в течение 2 ч при комнатной температу 37 ре и добавляли дополнительно 2 г (9,17 ммоль) бис(1,1-диметилэтил)дикарбоната и 1 мл водного 35%-ного раствора гидроксида натрия. После перемешивания в течение 15 ч при комнатной температуре эту реакционную смесь разбавляли 100 мл водного 1 н. раствора гидроксида натрия и 50 мл насыщенного раствора хлорида натрия,а затем промывали 2300 мл эфира. Водную фазу подкисляли лимонной кислотой до рН = 45, а затем экстрагировали смесью дихлорметан/изопропанол 75/25 (2100 мл). Органические фазы объединяли и концентрировали при пониженном давлении. Остаток переносили в 100 мл толуола и снова концентрировали при пониженном давлении. Получили 1,18 г (S)-,5-бис(1,1-диметилэтокси)карбонил]амино]-2-пиридинбутановой кислоты в форме вязкого масла. Выход (%) = 69. 12.5. 1,1-Диметилэтил-(S)-1-4-(дифторметилен)-1-пиперидил]карбонил]-3-5-(1,1 диметилэтокси)карбонил]амино]-2-пиридил] пропил]карбамат. 1,16 г (3,6 ммоль) О-(1-бензотриазол)N,N,N',N'-тетраметилурония тетрафторбората(ТБТУ) добавляли в атмосфере аргона и при перемешивании при 0 С к смеси 1,18 г (3 ммоль) (S)-,5-биc(1,1-диметилэтокси)карбонил]амино]-2-пиридинбутановой кислоты, 1,15 мл (6,6 ммоль) N,N-диизопропилэтиламина и 0,56 г (3,3 ммоль) 4-дифторметилен-1 пиперидина гидрохлорида в 30 мл дихлорметана. Этой смеси давали нагреться до комнатной температуры и перемешивание продолжали в течение 2 ч. Эту реакционную смесь разбавляли 50 мл дихлорметана и промывали 50 мл воды, а затем 50 мл насыщенного раствора гидрокарбоната натрия и снова 250 мл воды. Органическую фазу высушивали над сульфатом натрия и концентрировали при пониженном давлении, и остаток очищали хроматографией на колонке силикагеля,элюируя смесью циклогексан/этилацетат 1/1. Получили 1,62 г 1,1 диметилэтил-(S)-1-4-(дифторметилен)-1-пиперидил]карбонил]-3-5-(1,1-диметилэтокси) карбонил]амино]-2-пиридил]пропил]карбамата в форме вязкого масла. Выход (%) = 100. 12.6. (S)-5-амино 4-(дифторметилен)-1 пиперидил]карбонил]-2-пиридинпропанамина гидрохлорид. Раствор 1,62 г (3,18 ммоль) 1,1 диметилэтил-(S)-1-4-(дифторметилен)-1 пиперидил]карбонил]-3-5-(1,1-диметилэтокси)карбонил]амино]-2-пиридил]пропил]карбамата в 50 мл дихлорметана обрабатывали в течение 5 мин при 0 С потоком хлористого водорода. Этому раствору давали нагреться до комнатной температуры и перемешивание продолжали в течение 3 ч. Полученный белый осадок затем отфильтровывали и промывали 10 мл ди 004986 38 хлорметана. Таким образом получили 1 г высокогигроскопичного (S)-5-амино 4-(дифторметилен)-1-пиперидил]карбонил]-2-пиридинпропанамина гидрохлорида (2:1), и его использовали в следующей стадии без дальнейшей очистки. Выход (%) = 88; т. пл. (С) = 70. 12.7. (S)-N-[3-3-(5-амино-2-пиридил)-14-(дифторметилен)-1-пиперидил]карбонил] пропил]амино]сульфонил][1,1'-дифенил]-2 ил]ацетамида гидрохлорид. 0,8 мл (5,7 ммоль) триэтиламина добавляли к раствору 0,7 г (1,83 ммоль) (S)-5-амино-4-(дифторметилен)-1-пиперидил]карбонил]-2 пиридинпропанамина гидрохлорида (2:1) в 20 мл дихлорметана, и полученный в результате раствор охлаждали до 0 С при перемешивании. Затем добавляли порциями 0,58 г (1,64 ммоль) 2-(диацетиламино)-[1,1'-дифенил]-3-сульфонилхлорида. Через 2 ч при 0 С добавляли 50 мл дихлорметана, и этот раствор промывали последовательно 220 мл воды, 50 мл насыщенного раствора гидрокарбоната натрия и 210 мл воды. Органическую фазу высушивали над сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток переносили в 20 мл тетрагидрофурана, а затем охлаждали до 0 С и обрабатывали в течение 5 мин потоком аммиака. Этой реакционной смеси давали нагреться до комнатной температуры, а затем через 4 ч концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке силикагеля, элюируя под давлением смесью дихлорметан/метанол 99/1. После концентрирования при пониженном давлении остаток затем растворяли в 1,8 мл 1 М раствора хлористого водорода в метаноле (1,8 ммоль) и снова концентрировали при пониженном давлении, а затем очищали хроматографией на колонке RP 18, элюируя градиентом ацетонитрил/N/1000 соляная кислота от 5/95 до 100/0 в течение 60 мин. После лиофилизации получили 0,61 г (S)-N-[3-3-(5-амино-2-пиридил)-14-(дифторметилен)-1-пиперидил]карбонил] пропил]амино]сульфонил][1,1'-дифенил]-2 ил]ацетамида гидрохлорида в форме белого порошка. Выход (%) = 60; т. пл. (С) = 184-186;[]20D= +118 (с = 0,23; метанол) Ключ к таблицам, которые следуют далее: в колонке соль HCl соответствует гидрохлориду, и отношение в скобках представляет собой отношение (кислота : основание),в колонке []20D с = 0,2; метанол за исключением соединений 9 и 11 (с = 0,4; метанол). Соединения по изобретению прошли фармакологические исследования, в которых продемонстрированы их антитромботические и антикоагулянтные свойства и их значение в качестве терапевтически активных веществ. 1. Определение констант ингибирования(Ki) в отношении тромбина (in vitro). 25 мкл раствора тестируемого соединения(исследовали 7 концентраций), 50 мкл раствора хромогенного субстрата (исследовали 2 концентрации; S2238 Chromogenix), растворенных в Трис-буфере при рН 7,5 (50 мМ Трис, 100 мМNaCl и 0,1% БСА) и, наконец, 25 мкл раствора тромбина 0,24 ед./мл помещали в каждую лунку 96-луночного микропланшета. Мониторинг высвобождения 4-нитроанилина проводили при 405 нм, используя считывающее устройство для планшетов. Кi определяли способом Диксона (Dixon). Соединения по изобретению ингибируют человеческий тромбин, и их Ki находятся между 0,001 и 100 мкМ. 2. Антикоагулянтная активность в плазме крыс (ex vivo). Самцов крыс CD массой от 200 до 250 г обрабатывали тестируемым соединением или его носителем перорально. Затем этих животных анестезировали с помощью Nembutal (60 мг/кг; 0,1 мл/кг), кровь собирали над 3,8% тринатрия цитрата (1 об./9 об. крови) из заглазничного синуса и плазму получали центрифугированием при 3000xg в течение 15 мин при комнатной температуре. Затем 200 мкл плазмы инкубировали при 37 С с 200 мкл раствора тромбина, причем конечная концентрация тромбина 45 составляла 0,75 ед. NIH (единица тромбина Национального института здравоохранения(США/мл, и отмечали время свертывания. Антикоагулянтный эффект выражали в виде процента повышения тромбинового времени в плазме, собранной через 30 и 90 мин после введения 20 мг/кг п.о.; оно находится между 100 и 2000%. 3. Антитромботическая активность у крыс в модели смешанного артерио-венозного тромбоза (in vivo). Образования тромба у крыс добивались путем размещения шунта между левой яремной веной и правой сонной артерией; в этот шунт вводили хлопковую нить, пропитанную тромбопластином (тканевой фактор или ТФ). Соединение вводили перорально в нескольких дозах за 30 или 60 мин до установки шунта. Через 5 мин после установки шунта тромб, образованный на контакте с нитью + ТФ,извлекали и быстро взвешивали. Антитромботическую активность оценивали по снижению свежей массы тромба (мг) у животных, обработанных соединением, по сравнению с контрольными животными, обработанными его носителем. Антитромботическую активность выражали в виде AD50, дозы, которая снижает массу свежего тромба на 50%. Эта доза находится между 0,1 и 50 мг/кг. 4. Проницаемость мембраны in vitro. Соединения по изобретению оценивают в модели проницаемости мембраны на клеточной линии Сасо-2, полученной из человеческой аденокарциномы. Эта клеточная линия составляет модель выбора для исследования поглощения ксенобиотиков [P. Artusson, Therapeutics DrugCarrier System (1991), 8 (4), pp 305-330]. Прохождение соединений по изобретению выражают в виде функции количества продукта, которое пересекло клеточный барьер за 2 ч. Эти значения находились между 0 и 50%. Соединения по изобретению могут быть полезными при любом клиническом симптоме,связанном с тромбозом, или при симптоме, при котором могут встречаться тромботические осложнения. С этой целью их можно производить в любой форме, которая является подходящей для перорального, парентерального или внутривенного введения, такой как плоские таблетки, таблетки, покрытые оболочкой, гелевые капсулы,капсулы-облатки, питьевые и инъекционные суспензии или растворы и т.д., в сочетании с подходящими эксципиентами. Все эти формы дозируют таким образом, чтобы обеспечить возможность введения от 1 до 1000 мг в сутки и на пациента, в одной или более чем одной дозе.X представляет собой либо группу =CR4-,либо атом азота,W представляет собой группу -(СН 2)2-,-(СН 2)3-, -СН 2-СС- (тройная связь) или -СН 2 СН=СН- (двойная связь в цис- или трансконфигурации),R2 представляет собой либо группу пиперидил, которая возможно замещена одной или двумя группами, выбранными из групп гидроксил, (С 1-С 4)алкил, гидрокси(С 1 С 4)алкил, (С 1-С 4)алкокси(С 1-С 4)алкил, (С 1-С 4) алкокси, (C1-С 4)алкилтио, монофторметил, дифторметил, трифторметил и (С 3-С 6)циклоалкил,группой =CYZ [причем Y и Z независимо друг от друга выбраны из атомов водорода, атомов галогена и групп (С 1-С 4)алкил (возможно замещенных атомами галогена в количестве от 1 до 3)],группой(причем эта группа (С 1-С 4)алкил возможно замещена атомами галогена в количестве от 1 до 3) или группой (С 3-С 6)циклоалкил,либо группу гексагидро-1H-азепинил, возможно замещенную в положении 4 группой трифторметил или дифторметилен,либо группу гептагидроазоцин-1-ил,либо группу октагидро-1 Н-азонин-1-ил,либо группу-CONR'-, m = 1-2, р = 1-2 и R' представляет собой атом водорода или группу (С 1-С 4)алкил),либо группу в которой либо R12 представляет собой группу (С 1 С 4)алкил, группу карбокси(С 1-С 4)алкил или группу (С 1-С 4)алкоксикарбонил(С 1-С 4)алкил, aR13 представляет собой группу (С 1-С 4)алкокси или (С 1-С 4)алкил, 47 либо R12 представляет собой группу (С 1 С 4)алкил или -CH2CF3, a R13 представляет собой группу(причем Q представляет собой атом углерода или азота и r = от 1 до 3),либо группу пиперазинил, возможно замещенную группой (С 1-С 4)алкил или группой(С 1-С 4)алкилсульфонил,либо группу морфолинил,R4 представляет собой либо атом галогена,либо атом водорода,R3 представляет собой либо группу (С 1-С 5)алкил,либо группу -COR1, в которой R1 представляет собой либо атом водорода, либо группу(С 1-С 4)алкил, -(СН 2)nОСН 3, -СН 2 О(С 2 Н 4 О)nСН 3,-(CH2)nCF3 или -(СН 2)nОН (n = от 1 до 4),либо группу -SO2R5,либо группу -CONHR5,либо группу -SO2N(R5)2, в которой R5 представляет собой группу (С 1-С 4)алкил,А представляет собой либо группу фенил, возможно замещенную заместителями в количестве от 1 до 3, выбранными из атома галогена и групп (С 1-С 4)алкил, (С 1-С 4)алкокси, трифторметил,трифторметокси,-CH2OR10,-CH2OCOR10,-CH2OCONR10R11,-COOR10,-CONR10R11, нитро, -NR10R11, -NHCOR10 и-NH(CH2)qOR10, в которых R10 и R11 независимо друг от друга представляют собой атом водорода или группу (С 1-С 4)алкил, a q равен числу от 0 до 6,либо гетероцикл, выбранный из групп пиридил, тиенил, фурил, пиримидинил и тиазолил,причем указанные группы возможно замещены аналогично определенной выше группе фенил,либо группу (С 5-С 8)циклоалкил, а В представляет собой либо группу пиридил, возможно замещенную 1 или 2 заместителями, выбранными из группы (С 1-С 4)алкил, группы гидроксил и группы (С 1-С 4)алкокси,либо группу аминопиразинил,либо группу аминопиридазинил,либо группу пиримидинил, возможно замещенную аминогруппой,либо группу пиперидил,либо группу аминопиридил, возможно замещенную по пиридину группой (С 1-С 4)алкил или (С 1-С 4)алкокси, либо атомом галогена, причем аминогруппа возможно также замещена группой (С 1-С 4)алкил,либо группу аминофенил, причем аминогруппа возможно также замещена группой (С 1 004986 48 С 4)алкил, а группа фенил возможно замещена группой (С 1-С 4)алкил или атомом галогена,в форме рацематов или чистых энантиомеров либо смесей энантиомеров, или альтернативно в форме кислот или свободных оснований либо солей присоединения с фармацевтически приемлемыми кислотами. 2. Соединения по п.1, отличающиеся тем,чтоX, W, R4, А и В являются такими, как определено в п.1,R2 представляет собой либо группу пиперидил, которая возможно замещена одной или двумя группами, выбранными из групп гидроксил, (C1-С 4)алкил, гидрокси(С 1 С 4)алкил, (С 1-С 4)алкокси(С 1-С 4)алкил, (С 1-С 4) алкокси, (С 1-С 4)алкилтио, монофторметил, дифторметил, трифторметил и (С 3-С 6)циклоалкил,группой =CYZ [причем Y и Z независимо друг от друга выбраны из атомов водорода, атомов галогена и групп (С 1-С 4)алкил (возможно замещенных атомами галогена в количестве от 1 до 3)],либо группу 1,2,3,6-тетрагидропиридил,возможно замещенную группой (С 1-С 4)алкил(причем эта группа (С 1-С 4)алкил возможно замещена атомами галогена в количестве от 1 до 3) или группой (С 3-С 6)циклоалкил,либо группу гексагидро-1 Н-азепинил, возможно замещенную в положении 4 группой трифторметил или дифторметилен,либо группуR12 представляет собой группу (С 1-С 4) алкил, группу карбокси(С 1-С 4)алкил или группуR13 представляет собой группу (С 1 С 4)алкокси или (С 1-С 4)алкил,либо группу пиперазинил, возможно замещенную группой (С 1-С 4)алкил или группой(С 1-С 4)алкилсульфонил,либо группу морфолинил,R3 представляет собой либо группу (С 1-С 5)алкил,либо группу -COR1, в которой R1 представляет собой либо атом водорода, либо группу(С 1-С 4)алкил, -(СН 2)nOСН 3, -СН 2 О(С 2 Н 4 О)nСН 3,-(CH2)nCF3 или -(СН 2)nОН (n = от 1 до 4),в форме рацематов или чистых энантиомеров либо смесей энантиомеров, или альтернативно в форме кислот или свободных оснований либо солей присоединения с фармацевтически приемлемыми кислотами. 3. Соединения по любому из пп.1 и 2, отличающиеся тем, чтоW представляет собой группу -(СН 2)3- или-СН 2-СН=СН- (двойная связь в цис- или трансконфигурации),R2 представляет собой либо группу пиперидил, которая возможно замещена одной или двумя группами, выбранными из групп гидроксил, (C1-С 4)алкил, гидрокси(С 1 С 4)алкил,(С 1-С 4)алкокси(С 1-С 4)алкил,(С 1 С 4)алкокси, (С 1-С 4)алкилтио, монофторметил,дифторметил и трифторметил,группой =CYZ [причем Y и Z независимо друг от друга выбраны из атомов водорода, атомов галогена и групп (С 1-С 4)алкил (возможно замещенных атомами галогена в количестве от 1 до 3)],либо группу 1,2,3,6-тетрагидропиридил,возможно замещенную группой (С 1-С 4)алкил(причем эта группа (С 1-С 4)алкил возможно замещена атомами галогена в количестве от 1 до 3),либо группу гексагидро-1 Н-азепинил,либо группу пиперазинил, возможно замещенную группой (С 1-С 4)алкилсульфонил,либо группу морфолинил,R3 представляет собой группу -COR1, в которой R1 представляет собой группу (С 1 С 4)алкил, -(СН 2)nОСН 3 или -(CH2)nCF3 (n = от 1 до 4),А представляет собой либо группу фенил, возможно замещенную заместителями в количестве от 1 до 3, выбранными из атома галогена и групп (С 1-С 4)алкил и (С 1-С 4)алкокси,либо гетероцикл, выбранный из групп пиридил и тиенил,либо группу (С 5-С 8)циклоалкил,в форме рацематов или чистых энантиомеров либо смесей энантиомеров, или альтернативно в форме кислот или свободных оснований либо солей присоединения с фармацевтически приемлемыми кислотами. 4. Соединения по любому из пп.1-3, отличающиеся тем, что они выбраны изN-[2-(1S)-4-(5-аминопирид-2-ил)-1-[(4 этилпиперид-1-ил)карбонил]бутил]амино] сульфонил]-6-тиен-2-илфенил]пропанамида,N-[2-(1S)-4-(6-аминопирид-3-ил)-1(пиперид-1-илкарбонил)бутил]амино]сульфонил]-6-циклопентилфенил]пропанамида,N-[2-(1S)-4-(5-аминопирид-2-ил)-1-4(дифторметилен)пиперид-1-ил]карбонил]бутил] амино]сульфонил]-6-циклопентилфенил] пропанамида,N-[3-(1S)-4-(5-аминопирид-2-ил)-1-4(дифторметилен)пиперид-1-ил]карбонил]бутил] амино]сульфонил][1,1'-дифенил]-2-ил]ацетамида,N-[2-(1S)-4-(6-аминопирид-3-ил)-1-4(дифторметилен)пиперид-1-ил]карбонил]бутил] амино]сульфонил]-6-тиен-2-илфенил]ацетамида,N-[2-(1S)-4-(6-амино-4-метилпирид-3 ил)-1-4-(дифторметилен)пиперид-1-ил]карбонил]бутил]амино]сульфонил]-6-тиен-2-илфенил]пропанамида,N-[2-(1S)-4-(6-аминопирид-3-ил)-1-4(дифторметилен)пиперид-1-ил]карбонил] бутил]амино]сульфонил]-6-циклопентилфенил] ацетамида,N-[2-(1S)-4-(аминопирид-3-ил)-1-4(трифторметил)-1,2,3,6-тетрагидропирид-1 ил]карбонил]бутил]амино]сульфонил]-6-тиен-2 илфенил]пропанамида,N-[2-(1S)-4-(6-аминопирид-3-ил)-1-4(дифторметилен)пиперид-1-ил]карбонил]бутил] амино]сульфонил]-6-циклопентилфенил] пропанамида,N-[3-(1S)-4-(5-аминопирид-2-ил)-1-4(дифторметилен)пиперид-1-ил]карбонил]бутил] амино]сульфонил][1,1'-дифенил]-2-ил]пропанамида,N-[2-(1S)-4-(6-амино-4-метилпирид-3 ил)-1-4-(дифторметилен)пиперид-1-ил] карбонил]бутил]амино]сульфонил]-6-циклопентилфенил]пропанамида,N-[3-(1S)-4-(6-аминопирид-3-ил)-1-4(дифторметилен)пиперид-1-ил]карбонил]бутил] амино]сульфонил]-3'-фтор[1,1'-дифенил]-2-ил] пропанамида,N-[2-(1S)-4-(5-аминопирид-2-ил)-1-[(4 метилпиперид-1-ил)карбонил]бутил]амино] сульфонил]-6-тиен-2-илфенил]ацетамида,N-[2-(1S)-4-(6-аминопирид-3-ил)-1-[(4 этилпиперид-1-ил)карбонил]бутил]амино] сульфонил]-6-тиен-2-илфенил]пропанамида,N-[2-(1S)-4-(6-аминопирид-3-ил)-1-[(4 метилпиперид-1-ил)карбонил]бутил]амино] сульфонил]-6-циклопентилфенил]ацетамида,N-[3-(1S)-4-(5-аминопирид-2-ил)-1-[(4 метилпиперид-1-ил)карбонил]бутил]амино] сульфонил]-3'-метил[1,1'-дифенил]-2-ил]ацетамида,N-[3-(1S)-4-(6-амино-4-метоксипирид-3 ил)-1-4-(дифторметилен)пиперид-1-ил]карбо 51 нил]бутил]амино]сульфонил][1,1'-дифенил]-2 ил]пропанамида,N-[3-(1S)-4-(5-аминопирид-2-ил)-1-[(4 метилпиперид-1-ил)карбонил]бутил]амино] сульфонил]-3'-метил[1,1'-дифенил]-2-ил]пропанамида,N-[3-(1S)-4-(5-аминопирид-2-ил)-1-[(4 метилпиперид-1-ил)карбонил]бутил]амино] сульфонил]-3'-фтор[1,1'-дифенил]-2-ил]ацетамида,N-[3-(1S)-4-(5-аминопирид-2-ил)-1-[(4 метилпиперид-1-ил)карбонил]бутил]амино] сульфонил]-3'-метокси[1,1'-дифенил]-2-ил]пропанамида,N-[(1S)-4-(5-амино-2-пиридил)-1-4(дифторметилен)-1-пиперидил]карбонил] бутил]-2-(формиламино)-3'-метил[1,1'-дифенил]-3-сульфонамида,N-[3-(1S,3Z)-4-(5-aмино-2-пиридил)-14-(дифторметилен)-1-пиперидил]карбонил]-3 бутенил]амино]сульфонил][1,1'-дифенил]-2 ил]ацетамида,N-[3-(1S,3Z)-4-(5-амино-2-пиридил)-1[(4-метил-1-пиперидил)карбонил]-3-бутенил] амино]сульфонил][1,1'-дифенил]-2-ил]ацетамида,в форме рацематов или чистых энантиомеров либо смесей энантиомеров, или альтернативно в форме кислот или свободных оснований либо солей присоединения с фармацевтически приемлемыми кислотами. 5. Соединения по любому из пп.1-4, отличающиеся тем, что предпочтительной конфигурацией центральной аминокислотной части является [S]. 6. Способ получения соединений формулы[I] по п.1, в которых X представляет собой группу =CR4-, где R4 является таким, как определено в п.1, отличающийся тем, что соединение формулы [V] которое затем на стадии (ii) обрабатывают хлористым водородом с получением соединения формулы [III] которое на стадии (iii) конденсируют с соединением формулы [II] в котором R1, R4 и А являются такими, как определено в п.1, с последующим гидрогенолизом на стадии (iv), когда это является желательным,с получением соединения формулы [I], в котором R4 представляет собой атом водорода. 7. Способ получения соединений формулы[I] по п.1, в которых X представляет собой группу =CR4-, где R4 является таким, как определено в п.1, отличающийся тем, что соединение формулы [III], полученное на стадии (ii) способа по п.6, в котором Р представляет собой атом водорода[Ia] в котором P1 представляет собой защитную группу для аминной функции, В и W являются такими, как определено в п.1, а Р представляет собой защитную группу или атом водорода,подвергают на стадии (i) взаимодействию с соединением формулы [VI][VI] в котором R2 является таким, как определено в п.1, с получением соединения формулы [IV][VII] в котором А является таким, как определено в п.1, и R5 представляет собой группу (С 1 53 С 4)алкил, с последующим гидрогенолизом на стадии (iii), когда это является желательным, с получением соединения формулы [I], в которомR4 представляет собой атом водорода. 8. Способ получения соединений формулы[I] по п.1, в которых X представляет собой атом азота, отличающийся тем, что он включает в себя стадию сочетания соединения формулы[III], как оно определено в п.6 или 7, с соединением формулы [XV] 54 группу для аминной функции или атом водорода, которые полезны в качестве промежуточных соединений в синтезе соединений формулы [I] по п.1. 10. Соединения формулы [XV] в которых А и R1 являются такими, как определено в п.1, которые полезны в качестве промежуточных соединений в синтезе соединений формулы [I] по п.1. 11. Лекарственный препарат, отличающийся тем, что он содержит по меньшей мере одно соединение по любому из пп.1-5. 12. Фармацевтическая композиция, отличающаяся тем, что она содержит по меньшей мере одно соединение по любому из пп.1-5, а также по меньшей мере один фармацевтически приемлемый эксципиент.
МПК / Метки
МПК: A61P 7/02, A61K 31/506, C07D 401/14
Метки: качестве, пиридинсульфонамиды, агентов, n-(гетероциклил)бензол, антикоагулянтов, антитромботических
Код ссылки
<a href="https://eas.patents.su/28-4986-n-geterociklilbenzol-ili-piridinsulfonamidy-v-kachestve-antitromboticheskih-agentov-i-antikoagulyantov.html" rel="bookmark" title="База патентов Евразийского Союза">N-(гетероциклил)бензол- или пиридинсульфонамиды в качестве антитромботических агентов и антикоагулянтов</a>
Предыдущий патент: Производные пурина
Следующий патент: Производные пурина
Случайный патент: Пылевсасывающее устройство с самоочищением фильтров












