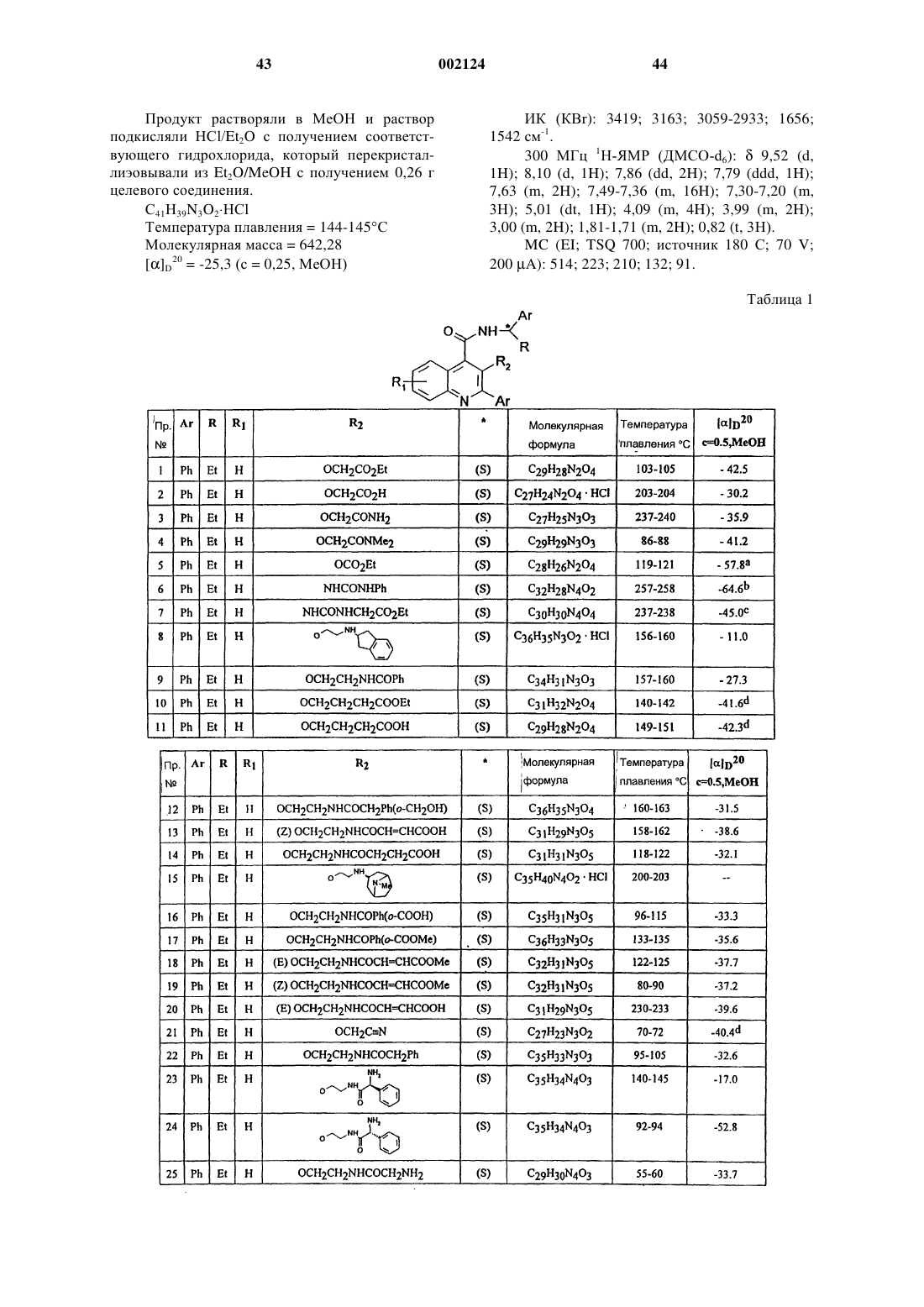
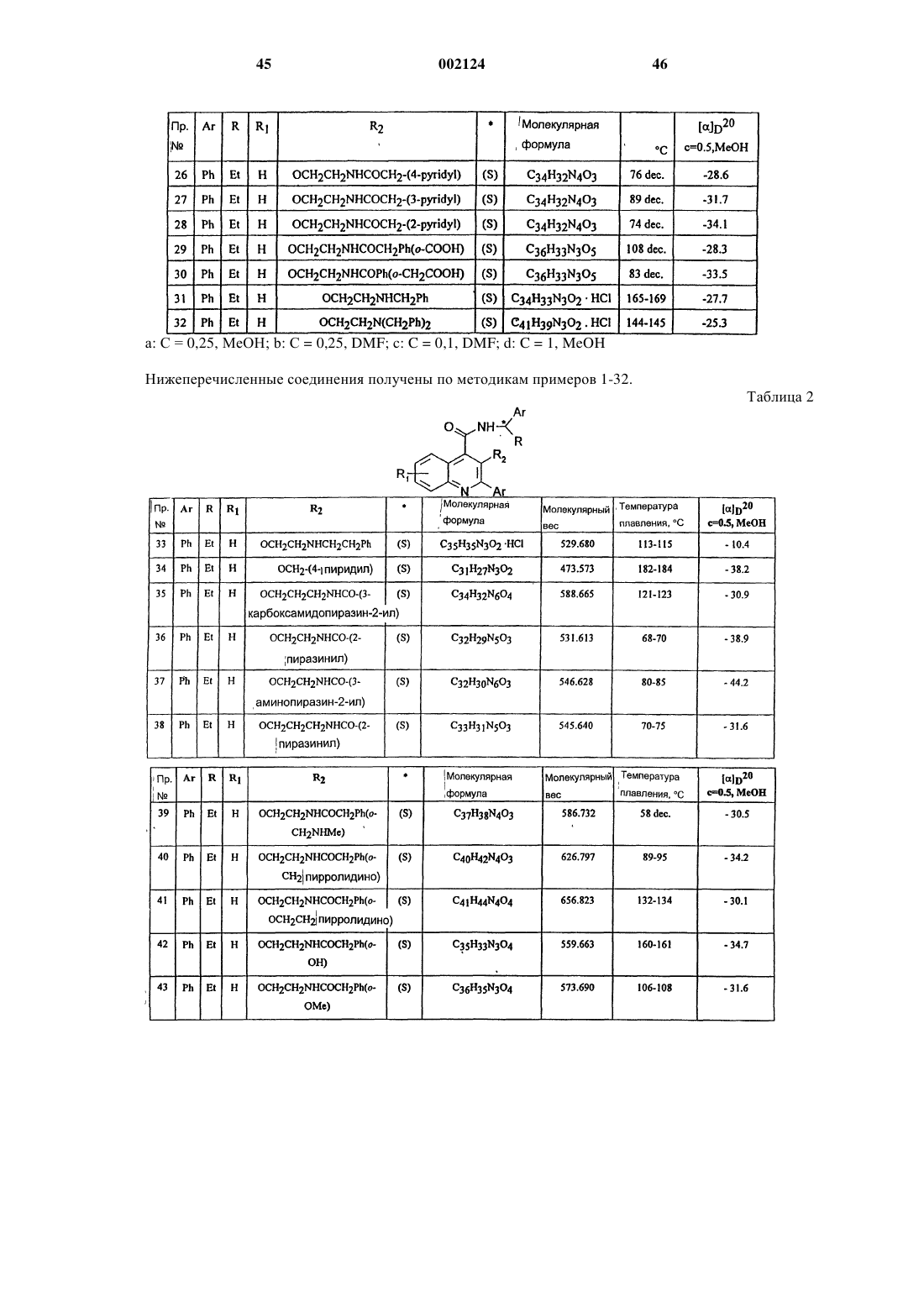
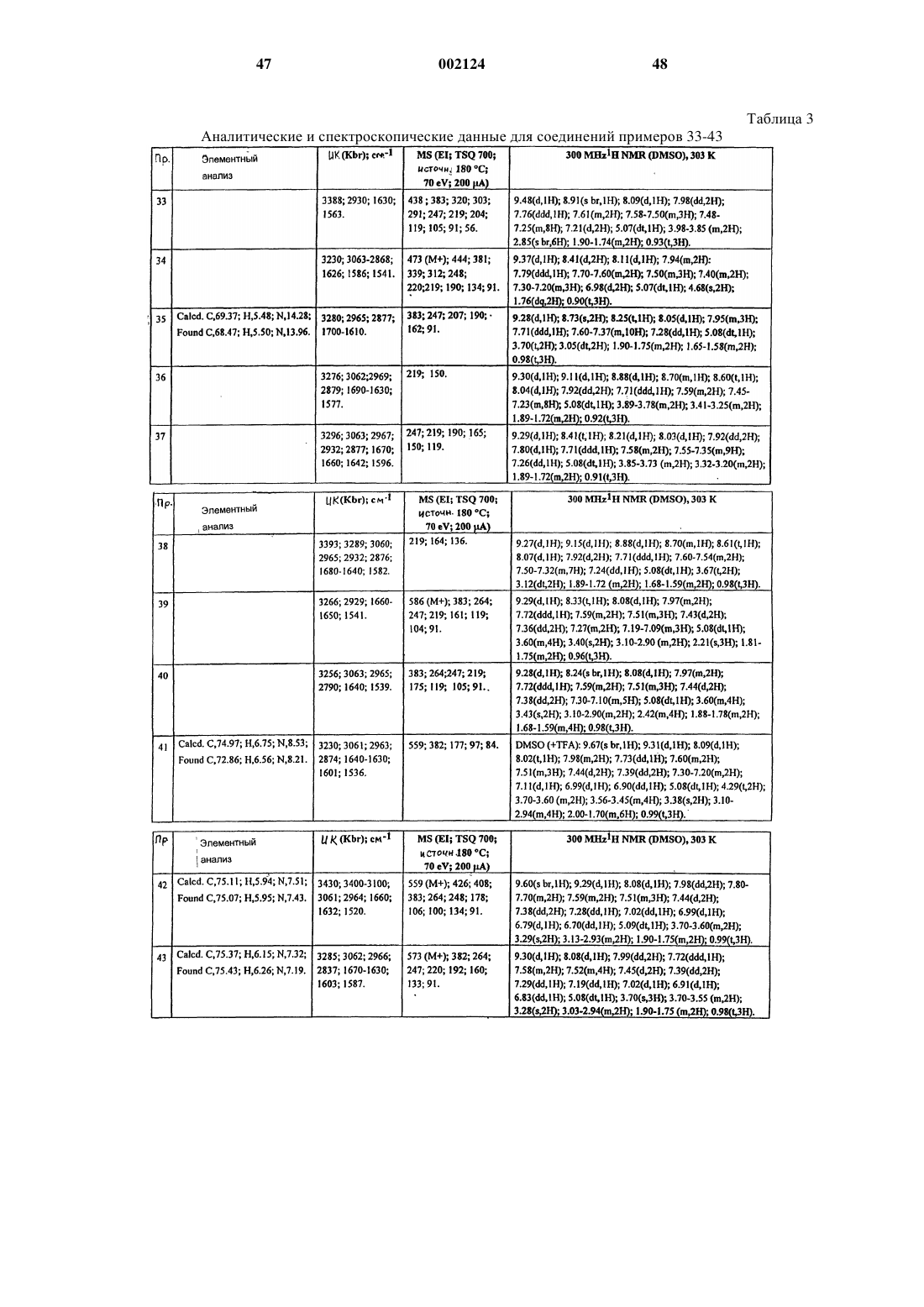
Производные хинолина
Номер патента: 2124
Опубликовано: 24.12.2001
Авторы: Груни Марио, Фарино Карло, Гьярдина Джузеппе Арнальдо Мариа, Равелиа Лука Франческо
Формула / Реферат
1. Соединение формулы (I)
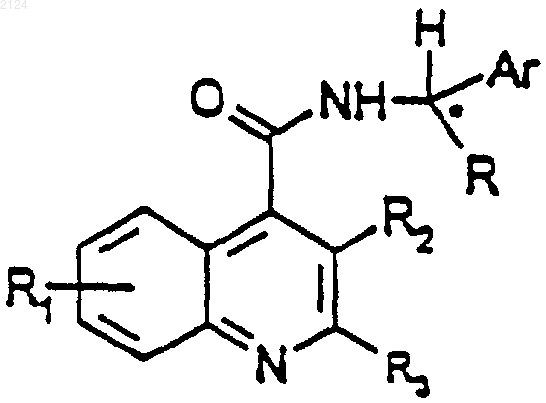
или его соль, или его сольват,
где Аr представляет собой фенил;
R представляет собой C1-C6 алкил;
R1 представляет собой водород;
R2 представляет собой группу -O-(СН2)n-Х, где Х представляет собой C1-С6 алкил, необязательно замещенный одной или двумя группами, выбранными из гидрокси и амино; карбокси, циано, C1-6 алкоксикарбонила, аминокарбонила, моно- или ди-С1-6 алкиламинокарбонила, амино-С1-6 алкиламинокарбонила или моно- или ди-С1-6 алкиламино-C1-6 алкиламинокарбонила; или Х представляет собой группу -NX1X2, где X1 и Х2, каждый независимо, представляет собой водород, карбокси-С1-С6 алкилкарбонил, С1-С6 алкоксикарбонил-С1-С6 алкилкарбонил, С1-С6 алкилкарбонил, фенилкарбонил, фенил-С1-С6 алкилкарбонил, гетероарилкарбонил, гетероарил-С1-С6 алкилкарбонил, где гетероарильная группа включает ароматическое гетероциклическое кольцо, содержащее 5 или 6 атомов и включающее вплоть до четырех гетероатомов в кольце, выбранных из S, О и N; аминокарбонил, моно- или бис-С1-6 алкиламинокарбонил, амино-С1-С6-алкилкарбонил, моно- или бис-С1-6 алкиламино-С1-6 алкилкарбонил, группу формулы -CO-T-CO-T1 или циклоалкильную группу с 5-9- членным единичным или конденсированным кольцом, необязательно содержащую 1 или 2 атома азота и необязательно 1 или 2 дополнительных гетероатома, выбранных из О или N, и где один или два атома кольца необязательно замещены С1-С6 алкилом, причем указанное кольцо необязательно конденсировано с бензольным кольцом, где вышеуказанные фенильная или гетероарильная группы необязательно замещены до двух групп, которые выбирают из гидрокси, C1-6 алкокси, гидрокси-С1-С6 алкил, амино-С1-6 алкил, моно- или бис-С1-6 алкиламино, моно- или бис-С1-6 алкиламино-С1-6 алкил, амино-C1-6 алкокси, моно- или бис-С1-6 алкиламино-С1-6 алкокси, карбокси, C1-6 алкилкарбонил, C1-6 алкоксикарбонил, карбокси-С1-6 алкил, карбокси-C1-6 алкокси и С1-6 алкилкарбонил-С1-6 алкокси; и где алкильная часть любой гетероарил-С1-6 алкильной или фенил-С1-6 алкильной группы необязательна замещена амино, моно-С1-6 алкиламино или бис-С1-6 алкиламиногруппой; или Х представляет собой С-присоединенную гетероциклическую, группу с единичным или конденсированным кольцом, причем любое кольцо может быть насыщенным или ненасыщенным и имеет от 5 до 6 атомов в кольце, причем указанные атомы кольца включают 1 или 2 атома азота и необязательно 1 или 2 дополнительных гетероатома, выбранных из О или N, и где один или два атома кольца необязательно замещены C1-6 алкилом, гидрокси, амино, моно- или бис-С1-6 алкиламино или оксозаместителями; а n равно нулю или представляет собой целое число от 1 до 7, при условии, что, когда Х представляет собой группу -NX1X2, n представляет собой только целое число от 2 до 7, и при условии, что X1 и Х2 не являются одновременно водородом; R2 представляет собой группу -NH-CO-NHY, где Y представляет собой С1-6 алкил, фенил, фенил-С1-3 алкил, группу -(CH2)p-X3, где р представляет собой целое число от 1 до 4, а Х3 представляет собой карбокси, С1-6 алкоксикарбонил или группу -CO-NH-(CH2)q-NX4X5, где q представляет собой целое число от 2 до 4, а Х4 и Х5, каждый независимо, представляет собой водород, C1-6 алкил или С1-6 алкилкарбонил;
R3 представляет собой фенил;
Т представляет собой C1-6 алкиленовую или С2-6 алкиленовую группу;
T1 представляет собой гидрокси или C1-6 алкокси.
2. Соединение по п.1, в котором R2 представляет собой группу -О-(СН2)n-Х, где X представляет собой карбокси или C1-6-алкоксикарбонил, или С-связанную гетероциклическую группу с единичным или конденсированным кольцом, как указано в формуле (I).
3. Соединение по п.1, в котором R2 представляет собой группу -О-(СН2)n-X, где n является целым числом 2 или 3, а Х представляет собой группу -NX1X2, где X1 представляет собой водород, а Х2 представляет собой группу вышеуказанной формулы -СО-Т-СО-T1, замещенный фенил-С1-6 алкилкарбонил или гетероарилкарбонил.
4. Соединение по п.1, в котором Аr представляет собой фенил, R представляет собой этил, R1 представляет собой водород и R2 представляет собой группу -O-(СН2)n-Х, где либо n равно 1, 2 или 3, а X представляет собой карбокси, C1-6 алкоксикарбонил, например этоксикарбонил, или С-связанную гетероциклическую группу с единичным или конденсированным кольцом, определенную в формуле (I), например пиридил; или n равно 2 или 3, а Х представляет собой группу NX1X2, где X1 представляет собой водород, a X2 представляет собой группу вышеуказанной формулы -CO-T-CO-T1, например, где Т представляет собой этилен, a T1 представляет собой ОH, или Х2 представляет собой замещенный фенил-С1-6 алкилкарбонил, например (2-карбокси)бензилкарбонил и (2-пирролидинометил)-бензилкарбонил или гетероарилкарбонил, например 2-пиразинилкарбонил.
5. Соединение формулы I по п.1, или его соль, или его сольват, где радикалы Ar, R, R1, R2 и R3 принимают значения, предстaвленные ниже
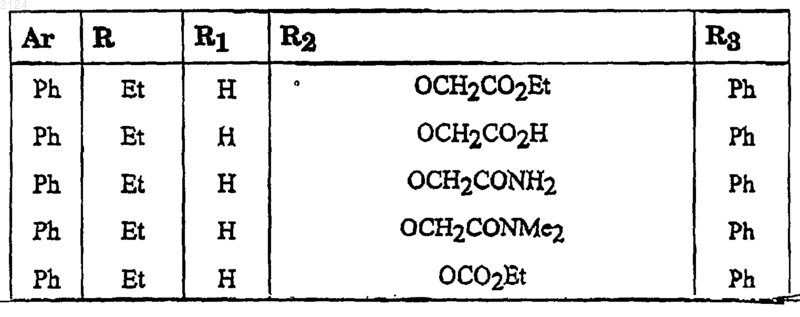
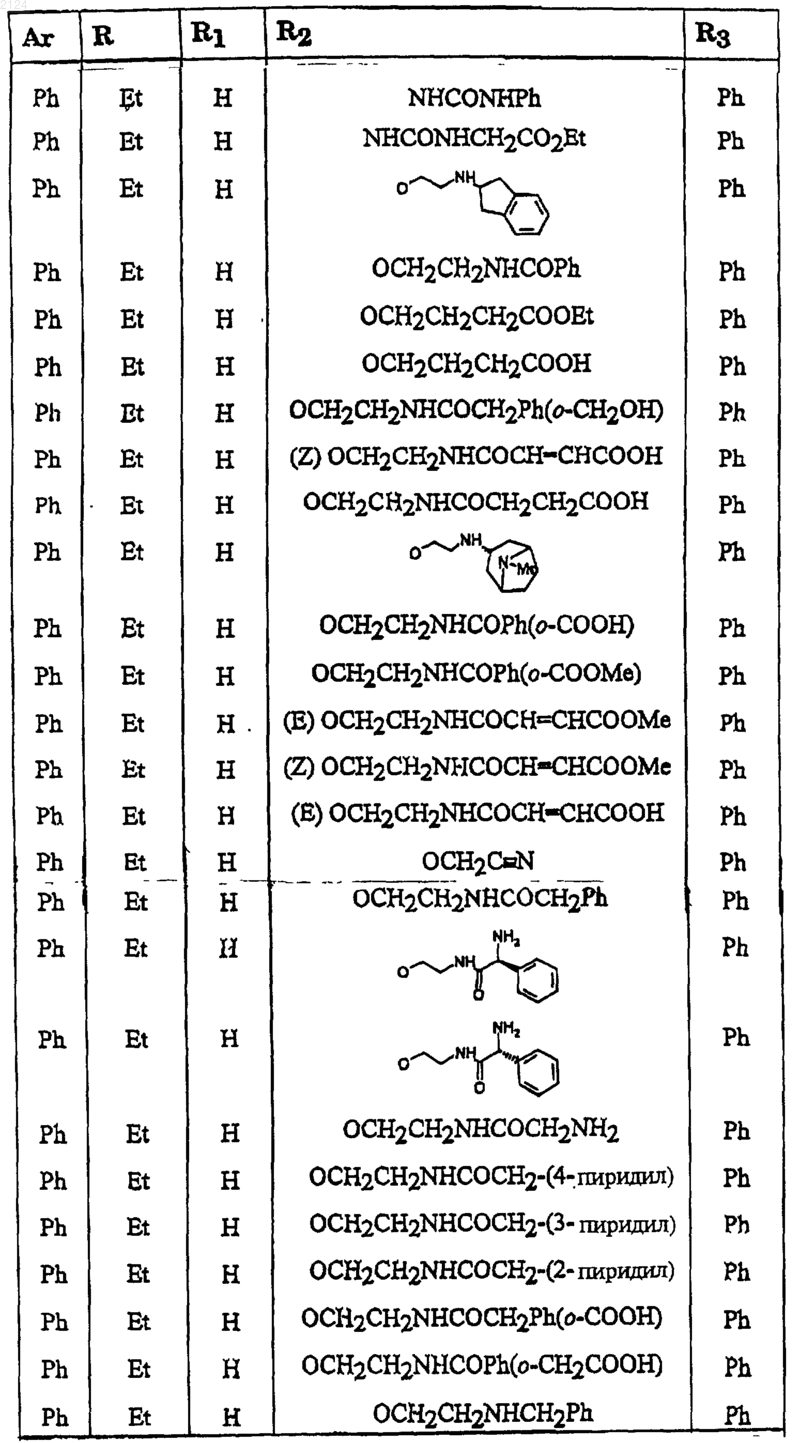

6. Соединение формулы I по п.1, или его соль, или его сольват, где радикалы Ar, R, R1, R2 и R3 принимают значения, предстaвленные ниже

7. Способ получения соединения формулы (I), или его соли, и/или сольвата, который включает взаимодействие соединения формулы (III)

где R' и Ar' имеют те же значения, чтo R и Аr в формуле (I), или представляет собой группу или атом, превращаемые в R и Ar соответственно с соединением формулы (II) или его активным производным
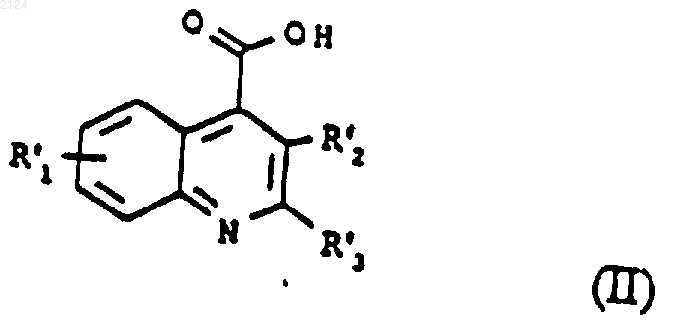
где R'1, R'2 и R'3 имеют те же значения, что R1, R2, R3 соответственно, как указано в формуле (I), или представляют собой группу, превращаемую в R1, R2, R3 с получением соединения формулы (Ib)
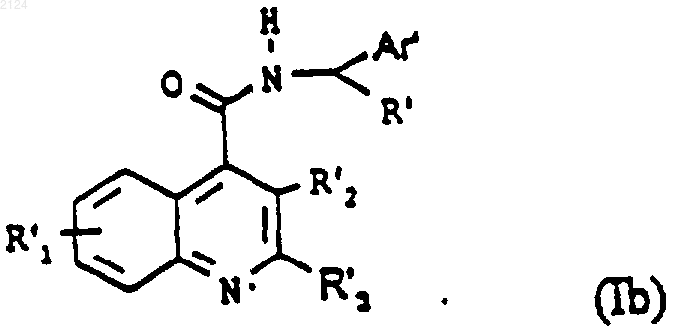
где Аr', R', R'1, R'2 и R'3 имеют вышеуказанные значения, и необязательно дополнительно проведение одной или нескольких следующих стадий:
(i) превращение любого из Ar', R', R'1, R'2 и R'3 в Ar, R, R1, R2 и R3 соответственно с получением соединения формулы (I);
(ii) превращение соединения формулы (I) в другое соединение формулы (I); и
(iii) получение соли соединения формулы (I) и/или его сольвата.
8. Фармацевтическая композиция, включающая соединение формулы (I), или его фармацевтически приемлемую соль, или его фармацевтически приемлемый сольват, и фармацевтически приемлемый носитель.
9. Способ лечения и/или профилактики состояний, которые характеризуются чрезмерной стимуляцией рецепторов NK3 и NK2 тахикинина и заболеваний центральной нервной системы у млекопитающих, который включает введение млекопитающему, нуждающемуся в таком лечении и/или профилактике, эффективного нетоксичного количества соединения формулы (I), или его фармацевтически приемлемой соли, или фармацевтически приемлемого сольвата.
10. Применение соединения формулы (I), или его фармацевтически приемлемой соли, или его фармацевтически приемлемого сольвата в качестве активного терапевтического вещества.
11. Применение соединения формулы (I), или его фармацевтически приемлемой соли, или его фармацевтически приемлемого сольвата для лечения и/или профилактики состояний, которые характеризуются чрезмерной стимуляцией рецепторов NK3 и NK2 тахикинина и заболеваний центральной нервной системы.
12. Применение соединения формулы (I), или его фармацевтически приемлемой соли, или его фармацевтически приемлемого сольвата для производства медикамента для лечения состояний, которые характеризуются чрезмерной стимуляцией рецепторов NK2 и NK3 тахикинина и заболеваний центральной нервной системы.
13. Применение соединения формулы (I) по п.1 или его фармацевтически приемлемой соли, или его фармацевтически приемлемого сольвата в качестве комбинированного антагониста NK-2/NK-3.
14. Применение по п.13, где соединение формулы (I) имеет соотношение сродства к связыванию NK-2/NK-3 в диапазоне от 0,05 до 20.
15. Применение по п.13, где соединение формулы (I) имеет соотношение сродства к связыванию NK-2/NK-3 в диапазоне от 0,1 до 10.
16. Применение по п.13, где соединение формулы (I) имеет, по существу, равное сродство к связыванию для рецепторов NK-2 и NK-3.
17. Способ лечения и/или профилактики респираторных заболеваний у млекопитающих, включающий введение эффективного нетоксичного фармацевтически приемлемого количества комбинированного антагониста NK-2/NK-3 соединения формулы (I) по п.1.
Текст
1 Настоящее изобретение относится к новым соединениям, в частности, к новым производным хинолина, к способам получения таких соединений, к фармацевтическим композициям,содержащим такие соединения, и к использованию таких соединений в медицине. Пептид млекопитающего "нейрокинин Б"(NKB) принадлежит к семейству пептидов "Тахикинины" (ТК), которое включает также "вещество Р" (SP) и "нейрокинин A" (NКА). Фармакологические и молекулярно-биологические исследования показали, что существует три подтипа рецептора ТК (NK1, NК 2 и NК 3) и NKB связывается, в первую очередь, с рецепторомNК 3, хотя он распознается также двумя другими рецепторами с более низким сродством (см. работу Maggi et al., 1993, J. Auton. Pharmacol., 13,23-93). Известны селективные пептидные антагонисты рецептора NК 3 (см. работу Drapeau, 1990Regul. Pept., 31, 125-135), и исследования пептидных агонистов рецептора NК 3 позволяют предположить, что NКВ, активируя рецепторNК 3, играет ключевую роль в модуляции нервного сигнала в дыхательных путях, коже, спинном мозге и нигро-стритатальных путях (см. работы Myers and Undem, 1993, J. Physiol., 470,665-679; Counture et al., 1993, Regul. Peptides, 46,426-429; Mccarson and Krause, 1994, J. Nеurosci.,14(2), 712-720; Arenas et. al., 1991, J. Neurosci.,11, 2332-8). Однако пептидоподобная природа известных антагонистов делает их слишком лабильными с точки зрения метаболизма, чтобы они на практике могли служить терапевтическими агентами. Обнаружен новый класс непептидных агонистов NК 3, которые гораздо более стабильны с точки зрения метаболизма, чем известные пептидные антагонисты рецептора NК 3 и поэтому потенциально могут использоваться в качестве терапевтических агентов. Эти соединения также обладают активностью в качестве антагонистовNК 2, и поэтому считается, что их можно будет использовать для предотвращения и лечения широкого круга клинических состояний, которые характеризуются чрезмерной стимуляцией рецепторов тахикинина, в частности NК 3 и NК 2. Указанные состояния включают заболевания органов дыхания, такие как хроническая обструкция легкого, астма, гиперреактивность дыхательных путей, кашель; воспалительные заболевания, такие как воспаление кишечника,псориаз, фиброз, остеоартрит, ревматоидный артрит и боли воспалительного характера; нейрогенное воспаление или периферическую нейропатию аллергии, такие как экзема и ринит; офтальмологические заболевания, такие как глазные воспаления, конъюнктивит, весенний конъюнктивит и т.п.; кожные болезни, нарушения, такие как чесотка, например волдыри и покраснения, контактный дерматит, атопический дерматит, крапивница и другие экземопо 002124 2 добные дерматиты; вредные иммунологические реакции, такие как отторжение имплантированных тканей и нарушения, связанные с повышением иммунитета или подавлением иммунитета,такие как системная волчанка; желудочнокишечные расстройства и заболевания желудочно-кишечного тракта, такие как расстройства, связанные с контролированием внутренних органов нервной системой, такие как неспецифический язвенный колит, болезнь Крона и недержание мочи; заболевания почек и мочевого пузыря (здесь и далее именуемые "первичными состояниями"). Помимо этого, определенные соединения по настоящему изобретению продемонстрировали активность преимущественно по отношению к периферической нервной системе, а не к центральной нервной системе. Поэтому такие соединения считаются особенно полезными при лечении таких компонентов "первичных состояний", которые требуют селективного воздействия на периферическую нервную систему. Определенные соединения по настоящему изобретению продемонстрировали также активность в отношении центральной нервной системы и поэтому они лучше всего подходят для лечения нарушений центральной нервной системы, таких как беспокойство, депрессия, психоз и шизофрения; заболевания, связанные с дегенерацией нервной системы, такие как деменция, связанная со СПИДом, сенильная деменция типа болезни Альцгеймера, болезньAльцгеймера, синдром Дауна, болезнь Хантингтона, болезнь Паркинсона, двигательные нарушения и конвульсии (например, эпилепсия); заболевания, связанные с демиелинезацией, такие как рассеянный склероз и боковой амиотрофический склероз и другие патологии нервной системы, такие как диабетическая невропатия,заболевания нервной системы, связанные со СПИДом, невропатия, вызванная химиотерапией, и невралгия; такие нарушения, как алкоголизм; соматические расстройства, связанные со стрессом; дегенерация симпатической нервной системы, например синдром плечо рука; дистимия; нарушения питания (такие как нарушение усваивания пищи); заболевания, связанные с фиброзом и коллагенозом, такие как склеродермия и эозинофильный фасциолиаз; нарушения кровотока, вызванные вазодилатацией и спастическими заболеваниями, такими как ангина,мигрень и болезнь Рейно, а также боли или болезни болевых рецепторов, например связанные или вызванные одним из вышеуказанных состояний, особенно передача боли при мигрени(здесь и далее называемых "вторичные состояния"). Отдельные соединения являются селективными антагонистами рецептора NK-3 относительно рецептора NK-2. В альтернативном варианте настоящего изобретения определенные соединения являют 3 ся комбинированными антагонистами NK-2/NK3 и поэтому они считаются наиболее подходящими для лечения и/или профилактики респираторных заболеваний, таких как хроническая обструкция легких, астма, гиперреактивность дыхательных путей и кашель. Эти соединения считаются пригодными также в качестве инструментов диагностики для оценки того, в какой степени активность рецептора нейроликина-3 (активность может быть нормальной, повышенной или пониженной) вовлечена в симптомы пациента. В соответствии с настоящим изобретением предложено соединение формулы (I)R2 представляет собой группу -O-(СН 2)n-Х,где Х представляет собой C1-С 6 алкил, необязательно замещенный одной или двумя группами,выбираемыми из гидрокси и амино; карбокси,циано, C1-6 алкоксикарбонил, аминокарбонил-,моно- или ди-С 1-6 алкиламинокарбонил, аминоС 1-6 акиламинокарбонил или моно- или ди-С 1-6 алкиламино-С 1-6 алкиламинокарбонил; или Х представляет собой группу -NX1X2, где X1 и Х 2,каждый независимо, представляет собой водород, карбокси C1-С 6 алкилкарбонил, C1-С 6 алкоксикарбонил C1-С 6 алкилкарбонил, C1-С 6 алкилкарбонил, фенилкарбонил, гетероарилкарбонил, фенил-C1-6 алкилкарбонил, гетероарил C1-6 алкилкарбонил, где гетероарильная группа включает ароматическое гетероциклическое кольцо, содержащее 5 или 6 атомов и включающее вплоть до четырех гетероатомов в кольце, выбранных из S, О и N; аминокарбонил,моно- или бис-С 1-6 алкиламинокарбонил, аминоC1-6 алкилкарбонил, моно- или бис-C1-6 алкиламино C1-6 алкилкарбонил, группу формулы -СОT-CO-T1, или циклоалкильную группу с 5-9 членным единичным или конденсированным кольцом, необязательно содержащую 1 или 2 атома азота и, необязательно, 1 или 2 дополнительных гетероатома, выбираемых из О или N, и где один или два атома кольца необязательно замещены C1-6 алкилом, причем указанное кольцо, необязательно, является конденсированным с бензольным кольцом, где вышеуказанные фенильная и гетероарильная группы необязательно замещены максимум двумя группами, которые выбирают из гидрокси, C1-6 алкокси, гидрокси-С 1-6 алкил-, амино-С 1-6 алкил, моно- или бис-С 1-6 алкиламино, моно- или бис-С 1-6 алкиламино-C1-6 алкил, амино-С 1-6 алкокси, моно- или 4 бис-C1-6 алкиламино-С 1-6 алкокси, карбокси, C1-6 алкилкарбонил, C1-6 алкоксикарбонил, карбоксиC1-6 алкил, карбокси-С 1-6 алкокси и C1-6 алкилкарбонил-С 1-6 алкокси; также где алкильная часть любой гетероарил-С 1-6 алкильной или фенил-C1-6 алкильной группы является необязательно замещенной амино, моно-C1-6 алкиламино или бис-С 1-6 алкиламиногруппой; или Х представляет собой гетероциклическую группу,присоединенную к С и имеющую единичное или конденсированное кольцо, причем любое кольцо может быть насыщенным или ненасыщенным и состоит от 5 до 6 атомов, причем указанные атомы кольца содержат 1 или 2 атома азота и, необязательно, 1 или 2 дополнительных гетероатома, выбранных из О или N, и где один или два атома кольца необязательно замещеныC1-6 алкилом, гидрокси, амино, моно- или бисC1-6 алкиламино, или оксогруппами; а n равно нулю или представляет собой целое число от 1 до 7, при условии, что когда Х представляет собой группу -NX1X2, n представляет собой только целое число от 2 до 7, и при условии, чтоX1 и X2 не одновременно являются водородом;R2 представляет собой группу -NH-CO-NHY,где Y представляет собой C1-6 алкил, фенил, фенил C1-3 алкил, группу -(СН 2)р-Х 3, где р представляет собой целое число в диапазоне от 1 до 4, а Х 3 представляет собой карбокси, C1-6 алкоксикарбонил или группу -CO-NH-(CH2)q-NX4X5,где q представляет собой целое число в диапазоне от 2 до 4, а Х 4 и Х 5, каждый независимо,представляет собой водород, C1-6 алкил или C1-6 алкилкарбонил;T1 представляет собой гидрокси или C1-6 алкокси. Когда R2 представляет собой группу -О(СН 2)n-Х, где n представляет собой целое число в пределах от 1 до 7, такое как 1, 2 и 3, соответственно значения Х будут включать карбокси,C1-6 алкоксикарбонил, аминокарбонил, моноили ди-С 1-6 алкиламинокарбонил, или Х представляет собой гетероциклическую группу, присоединенную к С и имеющую единичное или конденсированное кольцо, как описано в отношении n в формуле (I); предпочтительно, чтобыX представлял собой карбокси, C1-6 алкоксикарбонил, например, этоксикарбонил, или указанную гетероциклическую группу, присоединенную к С и имеющую единичное или конденсированное кольцо, например пиридил; предпочтительно, n равно 1 или 3. В предпочтительном варианте изобретенияR2 представляет собой группу -О-(СН 2)n-Х, где Х представляет собой карбокси или C1-6 алкоксикарбонил. В еще одном предпочтительном варианте изобретения R2 представляет собой группу -O(СН 2)n-Х, где Х представляет собой присоеди 5 ненную к С гетероциклическую группу с единичным или конденсированным кольцом, как описано в отношении формулы (I). Когда R2 представляет собой группу -O(СН 2)n-Х, где n представляет собой целое число в пределах от 2 до 7, такое как 2 или 3, соответственно значения Х будут включать группу-NX1X2, где X1 и X2, каждый независимо, представляет собой водород, C1-C6 алкилкарбонил,гетероарилкарбонил, фенилкарбонил, аминокарбонил, моно- или ди-С 1-6 алкиламинокарбонил, группу вышеуказанной формулы -СО-ТСО-Т 1, или 5- или 6-членную циклоалкильную группу, причем указанная группа необязательно конденсирована с бензольным кольцом, при условии, что X1 и Х 2 не являются одновременно водородом; предпочтительно, один из X1 и Х 2 представляет собой водород, а второй выбирают из числа гетероарилкарбонила, арилкарбонила или группы вышеуказанной формулы -CO-TCO-T1. Примеры Х включают карбокси, циано,этоксикарбонил, аминокарбонил, диметиламинокарбонил, (2-инданил)амино и бензоиламино. Конкретным значением R2 является -O(СН 2)n-Х, где n представляет собой 1, 2 или 3, аn представляет собой 1, 2 или 3, а X представляет собой пиридил. Конкретным значением R2 является -O(СН 2)n-Х, где n представляет собой 2 или 3, а Х представляет собой группу -NX1X2, где X1 представляет собой водород, а Х 2 представляет собой от 5- до 9-членную циклоалкильную группу конденсированную с бензольным кольцом, например, 2-инданиламиногруппу, или N-метил-8 азабицикло[3,2,1]окт-3-ил группу. Конкретным значением R2 является -O(СН 2)n-Х, где n представляет собой 2 или 3, а Х представляет собой группу -NX1X2, где X1 представляет собой водород, а Х 2 представляет собой амино-C1-6 алкилкарбонил или моно- или бис-C1-6 алкиламино C1-6 алкилкарбонил, например, 2-аминоацетил. Конкретным значением R2 является -O(СН 2)n-Х, где n представляет собой 2 или 3, а Х представляет собой группу -NX1X2, где X1 представляет собой водород, а Х 2 представляет собой группу формулы -CO-T-CO-T1, где Т представляет собой C1-6 алкилен, например -СН 2 СН 2-,a T1 представляет собой гидрокси или C1-6 алкокси, особенно гидрокси. Конкретным значением R2 является -O(СН 2)n-Х, где n представляет собой 2 или 3, а Х представляет собой группу -NX1X2, где X1 представляет собой водород, а Х 2 представляет собой необязательно замещенный гетероарилкар 002124 6 бонил, такой как 2-пиразинилкарбонил и 3 амино-2-пиразинилкарбонил. Конкретным значением R2 является -О(СН 2)n-Х, где n представляет собой 2 или 3, а Х представляет собой группу -NX1X2, где X1 представляет собой водород, а Х 2 представляет собой необязательно замещенную фенил-C1-6 алкилкарбонильную группу, такую как 2(метиламинометил)бензилкарбонил, 2-(пирролидинометил)бензилкарбонил, 2-(пирролидиноэтокси)бензилкарбонил и (2-карбокси)бензилкарбонил. Конкретным значением R2 является -О(СН 2)n-Х, где n представляет собой 2 или 3, а Х представляет собой группу -NX1 Х 2, где X1 представляет собой водород, а Х 2 представляет собой группу вышеуказанной формулы -CO-TCO-T1, например, где Т представляет собой этилен, a T1 представляет собой ОН. Конкретным значением R2 является -O(СН 2)n-Х, где n представляет собой 2 или 3, а Х представляет собой группу -NX1 Х 2, где X1 представляет собой водород, а Х 2 представляет собой замещенный фенил-C1-6 алкилкарбонил,например, (2-карбокси)бензилкарбонил и (2 пирролидинометил)бензилкарбонил. Конкретным значением R2 является -О(СН 2)n-Х, где n представляет собой 2 или 3, а Х представляет собой группу -NX1X2, где X1 представляет собой водород, а Х 2 представляет собой гетероарилкарбонил, например, 2-пиразинилкарбонил. Когда R2 представляет собой группу -О(СН 2)n-Х, где n равно нулю, то, соответственно,значения Х будут включать карбокси, C1-6 алкоксикарбонил, например этоксикарбонил.Y, соответственно, представляет собой фенил или группу -(СН 2)р-Х 3. Когда Y представляет собой -(CH2)p-Х 3, р предпочтительно равно 1. Когда Y представляет собой -(СН 2)р-Х 3, Х 3, соответственно, представляет собой С 1-6 алкоксикарбонил, например этоксикарбонил. Предпочитаемыми соединениями формулы(I) являются соединения, где Ar представляет собой фенил, R - этил, R1 - водород, a R2 представляет собой группу -O-(СН 2)n-Х, где либоn равно 1, 2 или 3, а X представляет собой карбокси, C1-6 алкоксикарбонил, например этоксикарбонил, или связанную с С гетероциклическую группу с единичным или конденсированным кольцом, как описано в отношении формулы (I), например пиридил; илиn равно 2 или 3, а Х представляет собой группу -NX1X2, где X1 представляет собой водород, a X2 представляет собой группу вышеуказанной формулы -CO-T-CO-T1, например, где Т представляет собой этилен, a T1 представляет собой ОН, или X2 представляет собой замещенный фенил-С 1-6 алкилкарбонил, например (2 карбокси)бензилкарбонил и (2-пирролидинометил)бензилкарбонил, или гетероарилкарбонил, например 2-пиразинилкарбонил. 7 В частности, следует упомянуть соединения по примерам 2, 11, 14, 29, 34, 36, 38, 39 и 40,особенно 2, 11 и 40. Следует также указать, что соединения 2 и 11, особенно 14 и 29, являются особенно активными в отношении периферической нервной системы, и поэтому считается, что они обладают особенно селективным действием при лечении тех "первичных состояний", которые требуют селективного воздействия на периферическую нервную систему, как говорилось выше. Соединения 34, 36 и 38 обладают селективным действием в отношении рецептора NK-3 по сравнению с рецептором NК-2. Как указывалось выше, определенные соединения формулы (I) являются комбинированными антагонистами NK-2/NK-3 и считаются наиболее подходящими для лечения и/или профилактики респираторных заболеваний, таких как хроническая обструкция легких, астма, гиперреактивность дыхательных путей и кашель. Соответственно, настоящее изобретение включает также комбинированный антагонист NK2/NK-3, особенно предназначенный для лечения и/или профилактики респираторных заболеваний. Настоящее изобретение включает также способ лечения и/или профилактики респираторных заболеваний у млекопитающих, таких как человек, который включает введение эффективного нетоксичного фармацевтически приемлемого количества комбинированного антагониста NK-2/NK-3. Подходящим комбинированным антагонистом NK-2/NK-3 является антагонист, имеющий соотношение сродства связывания с NK-2/NK-3 в диапазоне 0,05-20, желательно 0,1-10, предпочтительно 1-7 и наиболее предпочтительно 15; такие предпочтительные соединения считаются, по существу, обладающими в основном эквипотенциальными антагонистами рецепторов NK-2 и NK-3. Соединения 39 и 40 являются наиболее подходящими комбинированными антагонистами NK-2/NK-3 и, таким образом, они лучше всего подходят для лечения и/или профилактики респираторных заболеваний, таких как хроническая обструкция легких, астма, гиперреактивность дыхательных путей и кашель. Соединения формулы (I) могут иметь, по меньшей мере, один асимметричный центр, например атом углерода, отмеченный звездочкой в соединении формулы (I) - и поэтому может существовать в стереоизомерических формах. Настоящее изобретение охватывает все такие стереоизомерические формы и их смеси, включая рацемические. В частности, настоящее изобретение включает соединения, в которых отмеченный звездочкой атом углерода в формуле где Аr, R, R1, R2 и R3 имеют значения указанные выше в формуле (I). Соединения формулы (I) или их соли или сольваты предпочтительно должны находиться в фармацевтически приемлемой форме или, по существу, в чистом виде. Фармацевтически приемлемая форма означает, в числе прочего,форму с фармацевтически приемлемым уровнем чистоты, за исключением обычных фармацевтических добавок, таких как разбавители и носители, не содержащую материалы, которые считаются токсичными на уровне обычных доз. По существу, чистая форма обычно содержит, по меньшей мере, 50% соединения формулы (I) (исключая обычные фармацевтические добавки), предпочтительно 75%, более предпочтительно 90%, а еще более предпочтительно 95% соединения формулы (I), или его соли, или сольвата. Одной из предпочитаемых фармацевтически приемлемых форм является кристаллическая форма, которую включают в фармацевтическую композицию. В случае использования солей и сольватов, дополнительные ионные формы и сольватные части тоже должны быть нетоксичными. Подходящими солями являются фармацевтически приемлемые соли. Подходящие фармацевтически приемлемые соли включают кислотно-аддитивные соли с обычной фармацевтической кислотой, например малеиновой,соляной,бромистоводородной, фосфорной, уксусной, фумаровой,салициловой, лимонной, молочной, миндальной, винной, янтарной, бензойной, аскорбиновой и метасульфоновой. Подходящие фармацевтически приемлемые соли включают соли кислотных частей соединений формулы (I), когда они присутствуют,например, соли карбоксильных групп или фенольных гидроксильных групп. Подходящие соли кислотных частей включают соли металлов, таких как алюминий, соли щелочных металлов, таких как литий, натрий или калий, щелочно-земельных металлов, таких как кальций или магний и аммоний, или соли замещенного аммония, например соли с низшими алкиламинами, такими как триэтиламин,гидроксиалкиламинами, такими как 2-гидроксиэтиламин, бис-(2-гидроксиэтил)амин, или три(2-гидроксиэтил)амин,циклоалкиламинами,такими как бициклогексиламин или с прокаином,дибензилпиперидином,N-бензил-фенэтиламином, дегидроабиэтиламином, N,N'бисдегидроабиэтиламином, глюкамином, Nметилглюкамином или основаниями пиридино 9 вого типа, такими как пиридин, коллидин, хинин, или хинолин. Подходящими сольватами являются фармацевтически приемлемые сольваты. Подходящие фармацевтически приемлемые сольваты включают гидраты. Термин "алкил", используемый отдельно или образующий часть другой группы (такой как "алкокси") включает алкильные группы с прямой или разветвленной цепью, содержащие от 1 до 6 атомов углерода, примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутильную группы. Термин "циклоалкил" включает группы,имеющие 3-12, желательно 4-6 атомов углерода в кольце. Термин "арил" включает фенил и нафтил,предпочтительно фенил, который за исключением особо оговоренных случаев может содержать до пяти, предпочтительно до трех заместителей, выбираемых из галогена, алкила, фенила,алкокси, галоалкила, гидроксиалкила, гидрокси,амино, нитро, циано, карбокси, алкоксикарбонила, алкоксикарбонилалкила, алкилкарбонилокси или алкилкарбонила. Термин "ароматическая гетероциклическая группа" или "гетероарил" включает группы,содержащие ароматические гетероциклические кольца с от 5 до 12 атомами в кольце, желательно с 5 или 6 атомами, и содержащие до четырех гетероатомов в каждом кольце, выбранных из S,О или N. За исключением особо оговоренных случаев, подходящие заместители для любой гетероциклической группы включают до 4 заместителей, выбираемых из следующих групп: алкил, алкокси, арил и галоген, или любые два заместителя на соседних атомах углерода, вместе с атомами углерода, к которым они присоединены, могут образовывать арильную группу,предпочтительно бензольное кольцо, и где атомы углерода арильной группы, представленные указанными двумя заместителями, могут сами быть замещенными или незамещенными. В настоящем тексте термин "галоген" относится к фтору, хлору, брому и йоду, предпочтительно фтору и хлору. В настоящем тексте термин "ацил" включает остатки кислот, в частности остаток карбоновой кислоты, такой как алкил- или арилкарбонильная группа. Настоящее изобретение включает также способ получения соединения формулы (I) или его соли и/или сольвата, включающей взаимодействие соединения формулы (III) где R' и Аr' имеют те же значения, что R и Аr в вышеописанной формуле (I), или представляют собой группу или атом, которые можно превра 002124(II) или его активным производным где R'1, R'2 и R'3 имеют те же значения, что R1,R2 и R3, соответственно, в формуле (I), или представляет собой группу, которую можно превратить в R1, R2 и R3 с образованием соединения формулы (Ib) где Аr', R', R'1, R'2, R'3 имеют вышеуказанные значения, и далее необязательно осуществляют одну или несколько из описанных ниже стадий:(i) превращение любого из Ar', R', R'1, R'2,R'3 в Аr, R, R1, R2, R3, соответственно, как требуется, с получением соединения формулы (I);(ii) превращение соединения формулы (I) в другое соединение формулы (I);(iii) получение соли соединения формулы(I) и/или его сольвата. Подходящие группы, которые можно превратить в другие группы, включают защищенные формы указанных групп. Соответственно, Аr', R', R'1 или R'3 каждый представляет Аr, R, R1 или R3, соответственно,или их защищенную форму. Соответственно, R'2 представляет группу,отличную от защищенной формы, которую можно превратить в R2 обычными способами. Желательно, чтобы соединение формулы(II) присутствовало в виде активного производного. Подходящим активным производным соединения формулы (II) является переходная активированная форма соединения формулы (II) или производное, где карбоксильная группа соединения формулы (II) замещена другой группой или атомом, например, карбоксильным галогенангидридом,предпочтительно хлорангидридом, или азидом, или ангидридом карбоновой кислоты. Другие подходящие активные производные включают: смешанные ангидридные формы, образованные карбоксильной частью соединения формулы (II) и алкилхлороформиатом; активированный сложный эфир, такой как цианометиловый эфир, тиофениловый эфир, п-нитрофениловый эфир, п-нитротиофениловый эфир, 2,4,6 трихлорфениловый эфир, пентахлорфениловый эфир, пентафторфениловый эфир, N-гидроксифталимидный эфир, N-гидроксипиперидиновый эфир, N-гидроксисукцинимидный эфир, Nгидроксибензотриазоловый эфир; в альтернативном варианте карбоксильную группу соеди 11 нения формулы (II) можно активировать при помощи карбодиимида или N,N'-карбонилдиимидазола. Взаимодействие между соединением формулы (II) или его активным производным и соединением формулы (III) осуществляют в обычных условиях, соответствующих конкретным выбранным соединениям. Обычно, когда соединение формулы (II) присутствует в виде активного производного, взаимодействие осуществляют при использовании того же растворителя и в тех же условиях, которые используют для получения активированного производного, предпочтительно активированное производное получают in situ перед получением соединения формулы (Ib) и после этого получают соединение формулы (I), или его соль, и/или сольват. Например, взаимодействие между активным производным соединения формулы (I) и соединением формулы (III) можно осуществить следующим образом: а) сначала получают хлорангидрид кислоты и затем сочетают этот хлорангидрид с соединением формулы (III) в присутствии неорганического или органического основания в подходящем апротонном растворителе, таком как диметилформамид при температуре в пределах от-70 до 50 С (предпочтительно в пределах от -10 до 20 С); или б) обрабатывают соединение формулы (II) соединением формулы (III) в присутствии подходящего конденсирующего агента, такого как,например, N,N'-карбонилдиимидазол, или карбодиимида, такого как дициклогексилкарбодиимид,илиN-диметиламинопропил-N'этилкарбодиимид, предпочтительно в присутствии N-гидроксибензотриазола, что позволяет получить максимальный выход продукта и избежать рацемизации (см. Synthesis, 453, 1972), в апротонном растворителе, таком как смесь ацетонитрила (MeCN) и тетрагидрофурана, например, смесь с объемным соотношением от 1:9 до 7:3 (MeCN:THF) при температуре в диапазоне от -70 до 50 С (предпочтительно в диапазоне от-10 до 25 С). Предпочитаемая схема реакции приведена ниже на схеме 1 Схема 1 зуются в качестве промежуточных соединений для получения других соединений по настоящему изобретению. Соответственно, настоящее изобретение также включает способ получения соединения формулы (I), или его соли, и/или сольвата,включающий превращение соединения вышеуказанной формулы (Ib), где, по меньшей мере,один из Ar', R', R'1, R'2, R'3 не является Ar, R, R1,R2, R3 соответственно, с получением соединения формулы (I); и далее, если требуется, осуществление одной или нескольких следующих необязательных стадий:(i) превращение соединения формулы (I) в другое соединение формулы (I);(ii) получение соли соединения формулы(Ib) переменные Ar', R', R'1, R'3 представляют собой Ar, R, R1, R3, соответственно, или же их защищенные формы, а R'2 представляет собой группу или атом, который можно превратить вR2 с помощью одной или нескольких стадий. Желательно, чтобы R'2 представлял собой ОН или NH2. Превращение любой группы Ar', R', R'1 илиR'3 в Ar, R, R1 или R3, которые, как указывалось выше, обычно являются защищенными формами Ar, R, R1 или R3 можно осуществить при использовании соответствующих обычных условий, таких как соответствующая методика удаления защитных групп. Превращение любой группы R'2 в R2 можно осуществить при использовании соответствующих обычных реагентов и условий. Например, когда R'2 является ОН, соединения формулы (Ib) можно превратить в соединения формулы (I), как описано на схеме 2 Схема 2(Ib) можно было превратить в соединение формулы (I) или одно соединение формулы (I) можно было превратить в другое соединение формулы (I) путем взаимопревращения подходящих заместителей. Таким образом, определенные соединения формулы (I) и (Ib) исполь где Ar', R', R'1, R'2, R'3 и Х имеют значения, указанные в формуле (I), n имеет значение, как указано в формуле (I) или как конкретно указано в схеме 2, a L1 представляет собой уходящую группу или атом, такой как атом галогена, например атом хлора или брома. На схеме 2 Х является COOEt. В частности, когда R'2 является ОН, этот радикал можно алкилировать алкилгалоформиа 13 том или -галоалкиловым сложным эфиром или-галоалкилнитрилом; например, когда его алкилируют этилбромацетатом и К 2 СО 3 в ТГФ, то получают 3-этоксикарбонилметокси производное. Полученная эфирная часть может быть затем гидролизована при нагревании с обратным холодильником в концентрированной НСl, или переамидирована аммиаком, первичным или вторичным амином в этаноле в качестве растворителя, при температуре от 20 до 120 С, возможно в присутствии каталитического количества NaCN (см. J. Оrg. Сhеm., 1987, 52, 2033). На схеме 3 R'2=ОН превращают в аминоалкокси группу взаимодействием с бромоалкилфталимидом и К 2 СО 3 в кипящем ТГФ с получением фталимидоалкоксильного производного, которое, в свою очередь, гидролизуют гидразингидратом. Аминную функциональную группу полученного -аминоалкоксильного заместителя можно затем ацилировать фенил(алкил)хлорангидридом кислоты, таким как бензоилхлорид, и триэтаноламин в CH2Cl2 или можно подвергнуть восстановительному аминированию с бензконденсированным циклическим кетоном, например 2-инданоном, и NaCNBH3 в метаноле при комнатной температуре (см. J. где Ar', R', R'1, R'2, R'3 имеют вышеуказанные значения, X'1 представляет собой X1, как описано выше в формуле (I), или защищенную форму этого радикала, (циклический СО) представляет собой 5-9-членную циклоалкильную группу с единичным или конденсированным кольцом,где один или два атома кольца необязательно замещены C1-6 алкилом, причем указанное кольцо необязательно конденсировано с получением бензольного кольца и указанное кольцо также содержит оксогруппу. Когда R'2 представляет собой NН 2, соединения (Ib) можно превратить в другие соединения формулы (I) или (Ib), как описано на схеме 4. где Аr', R', R'1, R'2, R'3 и n имеют вышеуказанные значения, Y' соответствует Y, значения которого указаны в формуле (I), или представляет собой защищенную его форму, Х'3 имеет те же значения, что Х 3, как указано в формуле (I), или представляет собой защищенную форму этого радикала, a q имеет те же значения, указанные в формуле (I). В частности, когда R'2 представляет собой NH2, фенил(алкил)уреидопроизводное получают взаимодействием с фенил(алкил) изоцианатом в СН 2 Сl2/ТГФ/СН 3 СN при 40 С. Аналогичным образом синтезируют этоксикарбонилалкилуреидопроизводные из соответствующих этоксикарбонилалкилизоцианатов в ТГФ/ДМФ при 60 С. Далее, промежуточный первичный амин, описанный в схеме 3 (где R2 представляет собой -О-(CH2)n-NX1X2, где X1 и Х 2 оба представляют собой водород) может быть превращен в соединение формулы (I), где один или оба X1 и X2 представляют собой арилС 1-6-алкил, гетероарил-С 1-6-алкил или часть -COT-CO-T1, где Т и T1 имеют значения, указанные выше в формуле (I), используя реакции, приведенные на схеме 5 Схема 5 где Аr', R', R'1, R'3 имеют вьшеуказанные значения. Соответствующие превращения одного соединения формулы (I) в другое соединение формулы (I) включают превращения, в результате которых одну группу R, R1, R2 или R3 превращают в другую группу R, R1, R2 или R3, соответственно, причем указанные превращения удобно осуществлять через соответствующие группы Ar', R', R'1, R'2, R'3 с использованием обычной методики, например способов, описанных на схемах 2, 3 и 4 выше. 15 Как упоминалось ранее, соединения формулы (I) могут существовать в виде нескольких стереоизомеров, и способ по изобретению позволяет получать рацематы, а также энантиомерночистые формы. Соответственно, чистый энантиомер соединения формулы (I) получают взаимодействием соединения вышеуказанной формулы (I) с соответствующим энантиомерночистым первичным амином формулы (IIIa) или где R' и Аr' имеют вышеуказанные значения, с получением соединения формулы (I'а) или (I'с) где Аr', R', R'1, R'2, R'3 имеют вышеуказанные значения. Соединения формулы (I'а) или (I'с) можно затем превратить в соединения формул (Iа) или где Аr, R, R1, R2, R3 имеют вышеуказанные значения, способами превращения, описанными выше. Соединения формулы (II), где R2 представляет собой ОН или NH2 и защищенные формы таких соединений являются либо известными соединениями, либо их получают способами,используемыми для получения известных соединений, например, 3-гидрокси-2-фенил-4 хинолинкарбоновую кислоту (R2 представляет собой ОН, CAS=[485-89-2]) получают способами, описанными в патенте США 2,776,290Chemical Abstract 77:61769u (см. Хим. Гетероцикл. Соедин. (1972), 4, 525-6). Желательно, чтобы в ходе любой из вышеуказанных реакций любая реакционноспособная группа в молекуле вещества могла быть защищена в соответствии с обычной химической практикой. Подходящими защитными группами в любой вышеуказанной реакции являются группы,обычно применяемые в подобной практике. Например, подходящие гидроксильные защитные группы включают бензил или триалкилсилильную группу. Аминогруппу обычно защищают 16 Способы образования и удаления таких защитных групп являются обычными способами, соответствующими тем молекулам, которые предстоит защищать. Например, бензилоксильную группу мoжно получить обработкой соответствующего соединения бензилгалогенидом,таким как бензилбромид, а после этого, если требуется, бензильную группу можно удалить,используя каталитическое гидрирование, или же при помощи слабого эфирного отщепляющего реагента, такого как триметилсилилиодид или трибромид бора. ФМОКаминогруппу получают взаимодействием аминного соединения с хлорангидридом ФМОК в растворителе, таком как метиленхлорид, предпочтительно в присутствии триэтиламина, и обычно при температуре от низкой до температуры окружающей среды,например, от 0 С до температуры окружающей среды. Группу ФМОК удаляют обработкой органическим основанием, таким как диэтиламин. Как указано выше, соединения формулы(I) обладают полезными фармацевтическими свойствами, соответственно настоящее изобретение предлагает способ применения соединения формулы (I) или фармацевтически приемлемой соли или сольвата этого соединения, в качестве активного терапевтического вещества. Далее, настоящее изобретение предлагает фармацевтическую композицию, содержащую соединение формулы (I), или фармацевтически приемлемую соль или сольват этого соединения, и фармацевтически приемлемый носитель. Настоящее изобретение также предлагает применение соединения формулы (I) или фармацевтически приемлемой соли или сольвата этого соединения для производства медикаментов для лечения состояний, которые характеризуются чрезмерной стимуляцией рецепторовNK2 и NK3 тахикинина и заболеваний центральной нервной системы. Помимо вышеуказанного, отдельные соединения по изобретению обладают селективным действием в отношении периферической нервной системы. Эти соединения характеризуются тем, что они обладают достаточной гидрофильностью, так что, по существу, они не проходят через барьер кровь/головной мозг: их гидрофильность легко измерить при помощи обычных физико-химических способов, таких как измерение коэффициента разделения (lоgР иLоgР) и легко проверить in vivo, например, при помощи оценки относительных уровней соединения в плазме по сравнению с мозгом после введения дозы животному. Коэффициенты разделения определяют обычными способами, такими как способы, раскрытые в работах A. Leo et al., in Chem. Rev. 1971, 71, 525, R.C. Young et al., in J. Med. Chem. 1988, 31, 656 или Р. Seiler in Eur. J. Med. Chem. 1974, 9, 473. Такой медикамент и композицию по изобретению можно получить смешиванием соеди 17 нения по изобретению с соответствующим носителем. Он может содержать разбавитель, модифицирующую добавку, наполнитель, разрыхляющий агент, ароматизатор, краситель, смазывающее вещество или консервант. Эти обычные добавки можно применять,например, для получения композиций с известными агентами для лечения указанных состояний. Предпочтительно, чтобы фармацевтическая композиция по изобретению находилась в единичной дозированной форме и в форме, пригодной для использования в медицине или ветеринарии. Например, такие препараты могут быть в упакованном виде с письменными или печатными инструкциями по использованию в качестве агента для лечения указанных состояний. Подходящий диапазон доз для соединений по настоящему изобретению зависит от используемого соединения и от состояния пациента. Он будет зависеть также, помимо прочего, от соотношения между активностью и способностью к абсорбции и от частоты и пути введения. Соединение или композиция по изобретению может быть приготовлено для введения любым способом, предпочтительно в единичной дозированной форме или в такой форме, что пациент может сам ввести одну дозу. Желательно, чтобы композиция была пригодна для перорального, ректального, местного, парентерального, внутривенного или внутримышечного введения. Препараты могут быть изготовлены таким образом, что обеспечивается замедленное высвобождение активного ингредиента. Композиции могут быть, например, в форме таблеток, капсул, саше, ампул, порошков,гранул, лепешек, восстановимых порошков или жидких композиций, например растворов или суспензий, или свечей. Композиции, например композиции, пригодные для перорального введения, могут содержать обычные добавки, такие как модифицирующие добавки, например сироп, камедь,желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактозу, сахар,кукурузный крахмал, фосфат кальция, сорбит или глицин; вещества, делающие таблетки скользкими, например стеарат магния; разрыхляющие агенты, например крахмал, поливинилпирролидон, натрий крахмал гликолят или микрокристаллическая целлюлоза; или фармацевтически приемлемые добавки, такие как лаурилсульфат натрия. Твердые композиции можно получить при помощи обычных способов смешивания, наполнения, таблетирования и т.п. Повторное перемешивание можно использовать для того, чтобы активный реагент распределился в тех композициях, где используется большое количество наполнителей. Когда композиция находится в форме таблеток, порошка или лепешки, может 18 применяться любой носитель, пригодный для получения твердых фармацевтических композиций, примерами являются стеарат магния,крахмал, глюкоза, лактоза, сахароза, рисовая мука и мел. Таблетки можно покрыть оболочками при помощи известных способов, обычно применяемых в фармацевтической практике, в частности энтеросолюбильными оболочками. Композиция может быть также в форме перевариваемой в желудке капсулы, например, из желатина, содержащей соединение, при желании с носителем или другими добавками. Композиции для перорального введения в виде жидкостей могут быть в форме, например,эмульсий, сиропов, или эликсиров, или могут представлять собой сухой продукт, подлежащий растворению в воде или в другом подходящем растворителе перед его использованием. Такие жидкие композиции могут содержать обычные добавки, такие как суспендирующие агенты,например, сорбит, сироп, метилцеллюлозу, желатин,гидроксиэтилцеллюлозу,карбоксиметилцеллюлозу, стеарат алюминия в гелеобразной форме, гидрированные съедобные жиры; эмульгаторы, например лецитин, сорбитанмоноолеат или камедь; водные или безводные носители, которые включают съедобные масла,например миндальное масло, фракционированное кокосовое масло, маслянистые сложные эфиры, например глицерин, или пропиленгликоль, или этиловый спирт, глицерин, воду, или физиологический раствор; консерванты, например метил или пропил п-гидроксибензоат или сорбитановую кислоту; а также, при желании,обычные ароматизаторы или красители. Соединения по настоящему изобретению можно вводить также непероральными способами. В соответствии с обычными фармацевтическими процедурами композиции можно изготавливать, например, для ректального введения в виде свечей. Композиции также можно изготовить в виде водных или безводных растворов,суспензий или эмульсий для инъекций с применением любой фармацевтически приемлемой жидкости, например стерильной беспирогенной воды, или масла или смеси жидкостей, приемлемых для парентерального введения. Жидкость может содержать бактериостатические агенты,антиокислители и другие консерванты, буферы или растворенные вещества, которые делают раствор изотоническим крови, загустители, суспендирующие агенты или другие фармацевтически приемлемые добавки. Такие лекарственные препараты изготавливают в виде отдельных доз, например, в ампулах или в одноразовых приспособлениях для инъекций, или в форме нескольких доз, например, в бутылках, из которых можно извлечь нужное количество, или в форме концентрата в твердой форме, который можно использовать для приготовления препарата для инъекций. 19 Соединения по изобретению можно вводить также путем ингаляций через нос или рот. Такое введение осуществляют, используя препаративные формы в виде спреев, содержащих соединение по изобретению и подходящий носитель, необязательно суспендированные, например, в углеводородном пропелленте. Предпочтительные препаративные формы в виде спрея включают измельченные до размеров в несколько микрон частицы соединения в сочетании с поверхностно-активным веществом,растворителем или диспергирующим агентом для предотвращения осаждения суспендированных частиц. Предпочтительно размер частиц соединения должен составлять от около 2 до 10 микрон. Еще один способ введения соединений по изобретению включает чрескожное введение при использовании препаративных форм в виде пластыря. Предпочтительная препаративная форма содержит соединение по изобретению, диспергированное в адгезиве, чувствительном к давлению, который обладает адгезией к коже, таким образом позволяя соединению диффундировать из адгезива через кожу, поставляя активный агент в организм пациента. Для того чтобы чрескожная абсорбция проходила с постоянной скоростью, можно использовать адгезивы, чувствительные к давлению, такие как природный каучук или силикон. Как упоминалось выше, эффективная доза соединения зависит от того, какое соединение конкретно применяется, от состояния пациента и от частоты и способа введения. Единичная доза обычно содержит от 20 до 1000 мг, предпочтительно 30-500 мг, в частности, 50, 100,150, 200, 250, 300, 350, 400, 450 или 500 мг. Композицию можно вводить один или несколько раз в сутки, например 2, 3 или 4 раза в сутки,и суммарная суточная доза для взрослого весом 70 кг обычно находится в диапазоне от 100 до 3000 мг. Альтернативно, единичная доза будет содержать от 2 до 20 мг активного ингредиента и ее вводят многократно, если необходимо, для введения вышеуказанной суточной дозы. Никаких нежелательных токсикологических действий соединений по изобретению не ожидается, при введении их в соответствии с изобретением. Настоящее изобретение также раскрывает способ лечения и/или профилактики первичных или вторичных состояний у млекопитающих, в частности, человека, который включает введение млекопитающему, нуждающемуся в подобном лечении, и/или профилактике, эффективного количества соединения формулы (I) или фармацевтически приемлемой соли или сольвата этого соединения. Активность соединений по настоящему изобретению в качестве лигандов NК 3, определяют по их способности подавлять связываниеal., 1994, Biochem. Biophys. Res. Commun.,198(3), 967-972). Исследования связывания позволяют определить концентрацию индивидуального соединения, требуемую для того, чтобы на 50% снизить специфическое связывание [125I]-[MePhe7]-NKB и [3 Н]-Senktide с рецептором NК 3 в равновесных условиях (IС 50). Исследования связывания позволяют получить для каждого тестируемого соединения среднее значение IC50 из 2-5 отдельных экспериментов, проведенных с двойными или тройными параллельными определениями. Наиболее активные соединения по настоящему изобретению имеют значения IС 50 в пределах 0,1-1000 нМ. Активность соединений по изобретению в качестве антагониста NК 3 определяют по их способности ингибировать вызванное сенктидом сокращение подвздошной кишки морской свинки (см. работу Maggi et al., 1990, Br. J.Pharmacol., 101, 996-1000) и мышцы сфинктера радужной оболочки кролика (см. работу Hall etvitro на морских свинках и кроликах позволяют получить для каждого тестируемого соединения среднее значение КB из 3-8 экспериментов, где КB является концентрацией индивидуального соединения, требуемой для получения двукратного сдвига вправо в кривой зависимости концентрация/ответ для сенктида. Функциональные исследования человеческого рецептора позволяют определить концентрацию индивидуального соединения, требуемую для того, чтобы на 50% (значения IС 50) снизить мобилизацию Са,вызванную агонистом NKB. В этом тесте соединения по настоящему изобретению ведут себя как антагонисты. Терапевтический потенциал соединений по изобретению для лечения указанных состояний можно оценить при использовании моделей заболеваний на грызунах. Как указывалось выше, считается, что соединения формулы (I) можно использовать в качестве диагностического инструмента. Соответственно, изобретение включает соединения формулы (I), полезные в качестве диагностических инструментов для оценки степени влияния активности рецептора нейрокинина-3 (такая активность может быть нормальной, повышенной или недостаточной) на симптомы пациента. Такое применение включает использование соединения формулы (I) в качестве антагониста указанной активности, например, включая, но не ограничиваясь этим, обмен инозитолфосфата, 21 вызванный агонистом тахикинина, или электрофизиологическую активацию, образцов клеток, взятых у пациента. Сравнение такой активности в присутствии и в отсутствие соединения формулы (I) показывает степень включения рецептора NK-3 в медиирование действий агониста в данной ткани. Приведенные ниже примеры получения иллюстрируют получение промежуточных соединений, в то время как примеры иллюстрируют получение соединений по настоящему изобретению. Соединения примеров сведены в табл. 1-3 ниже. В приведенном ниже описании примеров получения и примеров использована следующая аббревиатура:s br - широкий синглет. Пример получения 1. (S)-N-(-Этилбензил)-3-гидрокси-2-фенилхинолин-4-карбоксамид. 2,49 г (9,4 ммоль) 3-гидрокси-2-фенилхинолин-4-карбоновой кислоты (CAS[485-89-2]) суспендировали в 150 мл смеси 7/3 ТГФ/ СН 3 СN; добавили 1,40 г (10,3 ммоль) 1 гидроксибензотриазола (ГОБТ) и 1,27 г (9,4 ммоль) (S)этилбензиламина, растворенного в 20 мл CH2Cl2, и реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Затем по каплям добавляли 2,13 г (10,3 ммоль) дициклогексилкарбодиимида (ДЦК),растворенного в 20 мл CH2Cl2. Реакционную смесь оставляли при комнатной температуре на ночь, останавливали реакцию при помощи 20 мл Н 2 О, реакционную смесь выпаривали в вакууме досуха и растворяли в EtOAc. Выпавшую в осадок дициклогексилмочевину отфильтровывали и органический слой промывали Н 2 О, 20% лимонной кислотой, насыщенным растворомNa2SO4 и выпаривали в вакууме досуха; остаток очищали, используя колоночную хроматографию на силикагеле 60-240 меш, используя смесь гексан/EtOAc 9:1 в качестве исходного элюента и смеси гексан/EtOAc 7:3 в качестве конечного элюента. Неочищенный продукт перекристаллизовывали из изо-РrОН с получением 1,75 г целевого соединения в виде белого твердого вещества.[]D20 = -28,5 (с = 0,5, МеОН) Элементный анализ: рассчитано: С, 78,51; Н, 5,80; N, 7,33; найдено: С, 78,49; Н, 5,84; N, 7,26; ИК (КВr): 3370; 1625; 1525 см-1. 300 МГц 1 Н-ЯМР (ДМСО-d6):9,80 (s,1H); 9,11 (d, 1H); 8,00-7,94 (m, 3 Н); 7,61-7,42 (m,8H); 7,38 (dd, 2H); 7,28 (dd, 1H); 5,06 (dt, 1H); 1,82 (ddq, 2H); 0,97 (t, 3 Н). МС (EI; TSQ 700; источник 200 С; 70 V; 200 А): 382 (М+); 264; 247; 219. Пример получения 2. (S)-N-(-Этилбензил)-3-амино-2-фенилхинолин-4-карбоксамид. 1,5 г (5,7 ммоль) 3-амино-2-фенилхинолин 4-карбоновой кислоты (CAS[36735-26-9]) растворяли в 140 мл смеси 7/3 ТГФ/СН 3 СN; добавляли по капле 1,5 г (11,11 ммоль) 1-гидроксибензотриазола (ГОБТ) и 1,15 г (8,5 ммоль) (S)-этилбензиламина, растворенного в 10 млCH2Cl2. После охлаждения реакционной смеси до 0 С, по каплям добавляли 1,4 г (6,7 ммоль) дициклогексилкарбодиимида (ДЦК), растворенного в 10 мл СН 2 Сl2. Реакционную смесь оставляли при температуре 0 С на 30 мин, а затем при комнатной температуре на ночь. Реакционную смесь выпаривали в вакууме досуха и растворяли в СН 2 Сl2, раствор фильтровали, промывали Н 2 О, 20% лимонной кислотой, насыщенным раствором NаНСО 3, насыщенным раствором NaCl. Органический слой отделяли, сушили над Na2SO4 и выпаривали в вакууме досуха с получением 2,4 г неочищенного продукта. Продукт растирали в порошок с изо-Pr2O, затем перекристаллизовывали из смеси 10:1 изоРr2O/изо-РrОН с получением 1,7 г целевого соединения. С 25 Н 22N3 О Температура плавления = 153-155 С Молекулярная масса = 381,48(продукт из примера получения 1) растворяли в 20 мл ТГФ. Добавляли 3,80 г (14,9 ммоль) N-(2 бромэтил)фталимида, растворенного в 15 мл ТГФ, 2,00 г (14,5 ммоль) К 2 СО 3 и 0,25 г KI и суспензию перемешивали при комнатной температуре в течение 2,5 ч, а затем кипятили с 23 обратным холодильником в течение 2 ч. Добавляли еще 1,90 г (7,4 ммоль) N-(2 бромэтил)фталимида и каталитическое количество KI, затем реакционную смесь кипятили с обратным холодильником в течение 3,5 ч; после этого добавляли еще 0,50 г (2,0 ммоль) N-(2 бромэтил)фталимида и каталитическое количество KI, затем реакционную смесь кипятили с обратным холодильником в течение 5 ч. Неорганические соли отфильтровывали и реакционную смесь выпаривали в вакууме досуха, растворяли в СН 2 Сl2 и промывали водой; органический слой отделяли, сушили над Na2SO4 и выпаривали в вакууме досуха. Остаток очищали колоночной флэш-хроматографией на силикагеле 230-400 меш, элюируя сначала смесью гексан/этилацетат 8:2, содержащей 0,5% NH4OH(28%), а затем смесью гексан/этилацетат 3:2,содержащей 0,5% NH4 ОН (28%). Полученное очищенное твердое вещество (2,60 г) растирали в порошок с изо-Рr2 ОН, фильтровали, промывали и сушили досуха с получением 2,5 г целевого соединения.(S)-N-(Этилбензил)-3-(2-аминоэтокси)-2-фенилхинолин-4-карбоксамид. 2,2 г (3,9 ммоль) (S)-N-(-этилбензил)-2 фенил-3-(2-фталимидоэтокси)хинолин-4 карбоксамид (соединение примера получения 3) растворяли в 150 мл 96% EtOH; раствор кипятили с обратным холодильником; добавляли 0,38 мл (7,8 ммоль) гидразингидрата и кипятили реакционную смесь с обратным холодильником в течение 4 ч. Каждые 12 ч добавляли дополнительные 0,4 мл (8,2 ммоля), 0,2 мл (4,1 ммоля), 0,2 мл(4,1 ммоля), 0,4 мл (8,2 ммоля), 0,4 мл (8,2 ммоля) гидразингидрата при кипячении реакционной смеси с обратным холодильником. Затем смесь выпаривали в вакууме досуха и добавляли 20 мл Н 2 О; смесь охлаждали на ледяной бане и добавляли 10 мл концентрированной НСl. Реакционную смесь кипятили с обратным холодильником в течение 1 ч, затем после охлаждения отфильтровывали фталгидразид. Полученный водный фильтрат промывали EtOAc,подщелачивали 2N NaOH и экстрагировалиEtOAc. Органический слой промывали насыщенным раствором NaCl, высушивали надNa2SO4 и выпаривали в вакууме досуха. Остаток очищали колоночной флэш-хроматографией на силикагеле 230-400 меш, элюируя смесью(S)-N-(-Этилбензил)-3(этоксикарбонилметокси)-2-фенилхинолин-4 карбоксамид. 2,0 г (5,2 ммоль) (S)-N-(-этилбензил)-3 гидрокси-2-фенилхинолин-4-карбоксамида (соединения примера получения 1) растворяли в 20 мл ТГФ в атмосфере азота при перемешивании магнитной мешалкой. Затем добавляли 2,0 г(14,5 ммоль) К 2 СО 3, 0,87 мл (7,8 ммоль) этилбромоацетата и небольшое количество KI и реакционную смесь оставляли при комнатной температуре и перемешивании магнитной мешалкой на 2,5 ч. Осадок отфильтровывали и раствор выпаривали в вакууме досуха; остаток растворяли в воде и экстрагировали EtOAc; органическую фазу отделяли, сушили над Na2SO4 и выпаривали в вакууме досуха с получением 3,3 г густого желтого масла. Масло очищали флэш-хроматографией на силикагеле 230-400 меш, элюируя смесью гексан/EtOAc 70:30, содержащей 0,5% 28%NH4OH; и очищенный продукт растирали в порошок с изо-Рr2O/изо-РrОН с получением 2,1 г целевого соединения в виде белого твердого вещества.MC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 468 (М+); 439; 334; 306; 278. Пример 2. (S)-N-(-Этилбензил)-3-(карбоксиметокси)-2-фенилхинолин-4-карбоксамида гидрохлорид. 0,35 г (0,7 ммоль) (S)-N-(-этилбензил)-3-(этоксикарбонилметокси)-2-фенилхинолин-4-карбоксамида (соединения примера 1) растворяли в 20 мл 37% НСl и реакционную смесь кипятили с обратным холодильником при перемешивании магнитной мешалкой в течение 20 мин. Раствор выпаривали в вакууме досуха и неочищенный продукт растирали с теплымEtOAc/изо-РrОН с получением 0,17 г целевого соединения в виде белого твердого вещества. С 27 Н 24N2O4 НСl Температура плавления = 203-204 С Молекулярная масса = 476,96MC (EI; TSQ 700; источник 180 С; 70 V; 200 A): 440 (М+); 411; 396; 306; 278. Пример 3. (S)-N-(-этилбензил)-3-(аминокарбонилметокси)-2-фенилхинолин-4-карбоксамид. 0,5 г (1,3 ммоль) (S)-N-(-этилбензил)-3 гидрокси-2-фенилхинолин-4-карбоксамида (соединения примера получения 1) растворяли в 5 мл ТГФ в атмосфере азота при перемешивании магнитной мешалкой; затем добавляли 0,5 г (3,6 ммоль) К 2 СО 3, 0,27 мл (1,9 ммоль) 2 бромоацетамида и небольшое количество KI. Реакционную смесь оставляли при комнатной температуре и при перемешивании магнитной мешалкой на ночь; осадок отфильтровывали и остаток растворяли в Н 2O и экстрагировали EtOAc; органический слой промывали насыщенным раствором NaCl, сушили над Nа 2SO4 и выпаривали в вакууме досуха. Неочищенный продукт растирали с гексаном и затем перекристаллизовывали из EtOH с получением 0,29 г целевого соединения в виде белого твердого вещества.MC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 439 (М+); 410; 305; 277; 248. Пример 4. (S)-N-(-Этилбензил)-3-(диметиламинокарбонилметокси)-2-фенилхинолин-4 карбоксамид. 0,6 г (1,3 ммоль) (S)-N-(-этилбензил)-3(этоксикарбонилметокси)-2-фенилхинолин-4 карбоксамида (соединения примера 1) растворяли в 30 мл Me2NH/EtOH (28%); добавили небольшое количество NaCN и реакционную смесь нагревали в аппарате Парра до 100 С (наружная температура) в течение 2 ч, затем до 120 С в течение 12 ч. Реакционную смесь выпаривали в вакууме досуха, остаток растворяли вEtOAc и промывали Н 2O, 20% лимонной кислотой, насыщенным раствором NaHCO3 и насыщенным раствором NaCl. Органический слой высушивали над Na2SO4 и выпаривали в вакууме досуха с получением 0,45 г остатка, который подвергли флэш-хроматографии на 230-400 меш силикагеле, элюируя смесью гексан/EtOAc 50:50, содержащей 0,5% 28% NH4OH. Неочищенный продукт растирали с теплым Et2O,фильтровали, промывали и высушивали с получением 80 мг целевого соединения в виде белого твердого вещества.MC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 467 (М+); 438; 333; 305; 262. Пример 5. (S)-N-(-Этилбензил)-3-(этоксикарбонилокси)-2-фенилхинолин-4-карбоксамид. 0,5 г (1,3 ммоль) (S)-N-(-этилбензил)-3 гидрокси-2-фенилхинолин-4-карбоксамида (соединение примера получения 1) растворяли в 10 мл пиридина; затем по каплям добавляли 0,5 мл(5,2 ммоль) этилхлорформиата и раствор кипятили с обратным холодильником при перемешивании магнитной мешалкой в течение 8 ч. Реакционной смеси позволяли достичь комнатной температуры и оставляли на ночь. Затем добавили 1,0 мл (10,4 ммоль) этилхлорформиата и раствор кипятили с обратным холодильником в течение 4 ч. Пиридин выпаривали с толуолом; остаток растворяли в СН 2 Сl2, промывали Н 2O и органический слой высушивали над Na2SO4 и 27 выпаривали в вакууме досуха. Неочищенный продукт растирали с теплым изо-Рr2 О с получением 0,25 г целевого соединения в виде желтого твердого вещества.MC (EI; TSQ 700; источник 180 С; 70 V; 200 A): 454 (М+.); 425; 382; 320; 247; 219. Пример 6. (S)-N-(-Этилбензил)-3-(3 фенилуреидо)-2-фенилхинолин-4-карбоксамид. 1,5 г (3,9 ммоль) (S)-N-(-этилбензил)-3 амино-2-фенилхинолин-4-карбоксамида (соединение примера получения 2) растворяли в 30 мл сухого СН 2 Сl2, 10 мл сухого ТГФ и 10 мл сухогоCH3CN. Затем добавляли 0,47 мл (4,3 ммоль) фенилизоцианата, растворенного в 10 мл СН 2 Сl2 и реакционную смесь нагревали до 40 С в течение 4 ч. После охлаждения реакционной смеси осадок собирали фильтрацией и промывали СН 2 Сl2 с получением 0,9 г целевого соединения. С 32 Н 28N4O2 Температура плавления = 257-258 С Молекулярная масса = 500,61(МН+). Пример 7. (S)-N-(-Этилбензил)-3-(3 этоксикарбонилметилуреидо)-2-фенилхинолин 4-карбоксамид. 2,0 г (5,2 ммоль) (S)-N-(-этилбензил)-3 амино-2-фенилхинолин-4-карбоксамида (соединение примера получения 2) растворяли в 10 мл ТГФ и 5 мл сухого ДМФ. Затем добавляли 1,71 мл (15,2 ммоль) фенилизоцианата и реакционную смесь нагревали до 60 С в течение 3 дней; затем еще раз добавляли 1,0 мл (10,3 ммоль) чистого фенилизоцианата и реакционную смесь перемешивали при 60 С еще в течение 2 дней. После охлаждения реакционной смеси осадок собирали фильтрованием и промывалиCH2Cl2 с получением 0,8 г белого порошка. Остаток перекристаллизовывали из толуола, содержащего следовые количества EtOH, а затем 28 из EtOH, содержащего следовые количества Н 2 О, с получением 0,45 г целевого соединения. С 30 Н 30N4O4 Температура плавления = 237-238 С Молекулярная масса = 510,60MS (EI; TSQ 700; источник 180 C; 70V; 200 А): 510 (М+); 407; 290. Пример 8. (S)-N-(-этилбензил)-3[2-(2 инданиламино)этокси]-2-фенилхинолин-4 карбоксамида гидрохлорид. 1,0 г (2,3 ммоль) ди(S)-N-(-этилбензил)-3(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида (соединения примера получения 4) растворяли в 15 мл МеОН в атмосфере азота и при перемешивании магнитной мешалкой; затем добавляли 0,47 г (3,5 ммоль) 2-инданона и небольшое количество растертых молекулярных сит и смесь перемешивали при комнатной температуре в течение 30 мин. Затем порциями добавляли 0,15 г (2,3 ммоль) NаСNВН 3, добавление производили в течение 30 мин, после чего смесь оставляли при перемешивании и комнатной температуре на ночь. Реакцию останавливали, добавляя 20 мл 2N NaOH и, после перемешивания при комнатной температуре в течение 20 мин, выпаривали в вакууме досуха. Остаток растворяли в 2N NaOH и экстрагировали СН 2 Сl2; органический слой промывали насыщенным раствором NaCl и экстрагировали 20% лимонной кислотой. Водный слой кислоты подщелачивали концентрированным NaOH и экстрагировали EtOAc; органический слой несколько раз промывали насыщенным растворомHCl/Et2O с получением 0,84 г соответствующего гидрохлорида, который перекристаллизовывали из смеси ацетон/EtOH с получением 0,49 г целевого соединения в виде белого порошка. С 36 Н 35N3O2 НСl Температура плавления = 156-160 С Молекулярная масса = 578,16FAB газообразный Хе; 8 кВ; источник 50 С): 542 (МН+). Пример 9. (S)-N-(-Этилбензил)-3-(2-бензоиламиноэтокси)-2-фенилхинолин-4-карбоксамид. 0,95 г (2,2 ммоль) (S)-N-(-этилбензил)-3(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида (соединение примера получения 4) растворяли в 12 мл сухого CH2Cl2 в атмосфере азота и при перемешивании магнитной мешалкой; добавляли 0,37 мл (2,6 ммоль) триэтаноламина,раствор охлаждали до 0 С и по каплям добавляли 0,3 мл (2,6 ммоль) бензоилхлорида, растворенного в 3 мл сухого CH2Cl2. Реакционную смесь оставляли на 30 мин при 0 С, затем позволяли ей достичь комнатной температуры и оставляли на ночь. Смесь выпарили в вакууме досуха, остаток растворили в СН 2 Сl2 и промыли Н 2 О, 20% лимонной кислотой, насыщенным раствором NаНСО 3, насыщенным раствором NaCl; органический слой высушивали над Nа 2SO4 и выпаривали в вакууме досуха. Остаток растирали с горячим изоРr2 О/изо-РrОН с получением 0,8 г целевого соединения в виде белого твердого вещества. С 34 Н 31N3 О 3 Температура плавления = 157-160 С Молекулярная масса = 529,64MC (EI; TSQ 700; источник 180 С; 70 V; 200 А) : 529 (М+); 382; 148. Пример получения 5. Метил 3-хлоркарбонилпропеноат. 5,0 г (51,0 ммоль) малеинового ангидрида нагревали до 100 С в 2,2 мл МеОН в течение 1 ч(см. J. Chem. Soc., 1964, 526-528). Реакционную смесь охлаждали до комнатной температуры и по каплям добавляли 37 мл (50,7 ммоль) SOCl2. Реакционную смесь кипятили с обратным холодильником в течение 1,5 ч, затем перегоняли,собирая фракции, кипящие при 42-44 С/2 мбар с получением 5,3 г целевого соединения, необязательно в виде смеси Е и Z диастереоизомеров. Это соединение использовали без дальнейшей очистки в последующей реакции получения соединений примеров 18 и 19. Пример 10. (S)-N-(-Этилбензил)-3-[3(этоксикарбонил)пропокси]-2-фенилхинолин-4 карбоксамид.(7,84 ммоль) этил-4-бромбутирата суспендировали в 50 мл ТГФ и реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Твердое вещество отфильтровывали, а растворитель выпаривали в вакууме досуха. Остаток растворяли в СН 2 Сl2 и органическую фазу промывали Н 2 О, отделяли, высушивали надNa2SO4 и выпаривали досуха в вакууме. Неочищенный продукт растирали с горячим изо-Рr2O с получением 2,10 г целевого соединения в виде белого порошка.(S)-N-(-Этилбензил)-3(карбоксипропокси)-2-фенилхинолин-4-карбоксамид. 0,6 г (1,21 ммоль) (S)-N-(-этилбензил)-3[3-(этоксикарбонил)пропокси]-2-фенилхинолин-4-карбоксамида (соединение примера 10) растворяли в 30 мл 6N НСl и раствор кипятили с обратным холодильником в течение 4 ч. Реакционную смесь выпаривали в вакууме досуха и неочищенное соединение перекристаллизовывали из толуола, содержащего следовые количества ТГФ, с получением 0,5 г целевого соединения в виде желтого твердого вещества. 31 0,7 г (4,7 ммоль) изохроманона растворяли в 25 мл абсолютного EtOH; добавляли 2,0 г (4,7 ммоль) (S)-N-(-этилбензил)-3-(2-аминоэтокси)2-фенилхинолин-4-карбоксамида (соединения примера получения 4) и реакционную смесь кипятили с обратным холодильником в течение 12 ч. Затем добавляли еще 0,3 г (2,0 ммоль) изохроманона и реакционную смесь кипятили с обратным холодильником 5 ч; затем добавляли еще 0,5 г (3,4 ммоль) изохроманона и реакционную смесь кипятили с обратным холодильником еще 10 ч. После охлаждения смесь выпаривали в вакууме досуха и остаток очищали с применением градиентной колоночной флэшхроматографии на силикагеле 230-400 меш, используя смесь гексан/EtOAc 50:50, содержащую 0,5% NHl4OH (28%), в качестве исходного элюента, и смесь гексан/EtOAc 20:80, содержащую 0,5% NH4OH (28%), в качестве конечного элюента. Неочищенный продукт, полученный таким образом, растирали с изо-Рr2O/изо-РrОН с получением 1,8 г целевого соединения.MC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 555; 438; 411; 382; 247; 218; 192; 174; 119. Пример 13. (SZ)-N-(-Этилбензил)-3-[2-(3 карбоксипропеноил)-аминоэтокси]-2-фенилхинолин-4-карбоксамид. 2,0 г (4,7 ммоль) (S)-N-(-этилбензил)-3(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида (соединения примера получения 4) и 0,61 г (6,2 ммоль) малеинового ангидрида растворяли в 50 мл толуола. Добавляли молекулярные сита и реакционную смесь кипятили с обратным холодильником в течение 5 ч. После охлаждения реакционную смесь выпаривали в вакууме досуха, растворяли в СН 2 Сl2 и промывали насыщенным раствором NaCl, 20% лимонной кислотой, насыщенным раствором NaCl. Органический слой высушивали над Na2SO4 и выпаривали в вакууме досуха. Неочищенный продукт очищали с применением колоночной флэшхроматографии на силикагеле 230-400 меш,элюируя смесью изо-Рr2 О/EtOAc 70:30, содер 002124(6,2 ммоль) ангидрида янтарной кислоты растворяли в 50 мл толуола; добавляли растертые молекулярные сита и реакционную смесь кипятили с обратным холодильником в аппаратеDean Stark в течение 4 ч. Реакционную смесь досуха выпаривали в вакууме, растворяли в 100 мл CH2Cl2 и промывали насыщенным растворомNaCl, 20% лимонной кислотой, насыщенным раствором NaCl. Органический слой высушивали над Nа 2SO4 и выпаривали в вакууме досуха с получением 2,3 г неочищенного продукта, который очищали колоночной флэш-хроматографией на силикагеле 230-400 меш, элюируяCH2Cl2/MeOH 9:1, а затем смесью CH2Cl2/MeOH 8:2. Полученный неочищенный твердый продукт растирали с изо-Рr2 О/изо-РrОН, фильтровали, промывали и высушивали с получением 1,4 г целевого соединения. С 31 Н 31 Н 3O5 Температура плавления = 118-122 С Молекулярная масса = 525,60(МН+); 383; 291. Пример 15. (S)-N-(-Этилбензил)-3-[2-(Nметил-8-азабицикло[3.2.1]-окт-3-ил)-аминоэток 33 си]-2-фенилхинолин-4-карбоксамида гидрохлорид. 1,5 г (3,53 ммоль) (S)-N-(-этилбензил)-3(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида (соединение примера получения 4) и 0,98 г (7,06 ммоль) тропинона растворяли в 30 мл МеОН и 100 мл толуола; порциями добавляли 0,22 г (3,53 ммоль) NaCNBH3 и реакционную смесь кипятили с обратным холодильником в течение 24 ч в аппарате Dean Stark. Реакцию останавливали при помощи 5 мл 2 Н NaOH и,после перемешивания при комнатной температуре в течение 20 мин, реакционную смесь выпаривали досуха в вакууме. Остаток растворяли в 20% лимонной кислоте и дважды экстрагировали EtOAc; водный слой подщелачивали твердым К 2 СО 3 и экстрагировали CH2Cl2. Органический слой высушивали над Na2SO4 и выпаривали в вакууме досуха с получением 1,8 г желтого твердого вещества, которое очищали колоночной флэш-хроматографией на силикагеле 230400 меш, элюируя EtOAc/MeOH 80:20, содержащей 2% 28% NH4OH. Неочищенный продукт(0,17 г) растворяли в МеОН и раствор подкисляли HCl/Et2O с получением соответствующего гидрохлорида, который перекристаллизовывали из смеси EtOAc/абсолютный EtOH с получением 0,10 г целевого соединения в виде коричневатого порошка. С 35 Н 40N4O2 НСl Температура плавления = 200-203 С Молекулярная масса = 585,19 ИК (КВr): 3403; 2966-2760; 1637; 1558 см-1. 300 МГц 1H-ЯМР (ДМСО-d6):9,29 и 9,26MC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 548 (М+); 386; 305; 166; 124; 82. Пример 16. (S)-N-(-Этилбензил)-3-[2-(2'кapбoкcибeнзoил)-аминоэтокси]-2-фенилхинолин-4-карбоксамид. 0,85 г (2,0 ммоль) (S)-N-(-этилбензил)-3[2-[2'-метоксикарбонилбензоил)-аминоэтокси]2-фенилхинолин-4-карбоксамида (соединение примера 17) растворяли в 25 мл 10% NaOH и 5 мл 1,4-диоксана. Раствор нагревали до 60 С в течение 15 мин, затем экстрагировали СН 2 Сl2,промывали 10% лимонной кислотой и насыщенным раствором NaCl, высушивали надNa2SO4 и выпаривали в вакууме досуха. Остаток очищали градиентной колоночной флэшхроматографией на силикагеле 230-400 меш,используя смесь изо-Pr2O/EtOAc/HCOOHMC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 555; 526; 422; 382; 262; 247; 219; 174; 119; 91. Пример 17. (S)-N-(-Этилбензил)-3-[2-(2'метоксикарбонилбензоил)-аминоэтокси]-2 фенилхинолин-4-карбоксамид. 2,4 г (5,7 ммоль) (S)-N-(-этилбензил)-3(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида (соединение примера получения 4) растворяли в 50 мл сухого СН 2 Сl2 в атмосфере азота; добавляли 0,88 мл (6,2 ммоль) TEA и раствор охлаждали до 0 С. Затем по каплям добавляли 1,1 г (5,8 ммоль) метил-2-хлоркарбонилбензоата(полученного обработкой соответствующего сложного моноэфира монокислоты оксалилхлоридом), растворенный в 50 мл CH2Cl2 при 0 С,затем раствор перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь промывали Н 2 О, 20% лимонной кислотой, насыщенным раствором NаНСО 3, насыщенным раствором NaCl, высушивали над Na2SO4 и выпаривали в вакууме досуха. Полученные 1,0 г остатка очищали колоночной флэш-хроматографией на силикагеле 230-400 меш, при использовании смеси гексан/EtOAc 1:1 в качестве элюента, а затем растирали с изо-Рr2 О с получением 0,9 г целевого соединения. С 36 Н 33N3 О 5 Температура плавления = 133-135 С Молекулярная масса = 587,68 1,4 г (3,3 ммоль) (S)-N-(-этилбензил)-3(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида (соединение примера получения 4) растворяли в 35 мл сухого CH2Cl2 в атмосфере азота. Добавляли 0,77 (5,5 ммоль) TEA и раствор охлаждали до 0 С. Затем по каплям добавляли 0,4 г (3,4 ммоль) метил-3-хлорокарбонилпропеноата (соединение примера получения 5),растворенный в 25 мл CH2Cl2 при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 2 дней, затем промывали Н 2 О, 20% лимонной кислотой, насыщенным раствором NаНСО 3, насыщенным растворомNaCl, высушивали над Na2SO4 и выпаривали в вакууме досуха. Полученный остаток очищали градиентной колоночной флэш-хроматографией на силикагеле 230-400 меш, при использовании смеси гексан/EtOAc 8:2 в качестве исходного элюента, и смеси гексан/EtOAc 7:2 в качестве конечного элюента. Полученный неочищенный продукт подвергали дальнейшей очистке методом препаративной ВЭЖХ с получением 0,30 г целевого соединения. С 32 Н 31N3O5 Температура плавления = 122-125 С Молекулярная масса = 537,62MS (EI; TSQ 700; источник 180 С; 70 V; 200 А): 537 (М+); 507; 404; 382; 301; 249; 156. Пример 19. (S,Z)-N-(-Этилбензил)-3-[2(3-метоксикарбонилпропеноил)-аминоэтокси]-2 фенилхинолин-4-карбоксамид. Продолжая элюирование колоночной флэш-хроматографией примера 18, выделяли 0,31 г целевого соединения. С 32 Н 31N3O5 Температура плавления = 80-90 С Молекулярная масса = 537,62MC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 537 (М+); 476; 371; 247; 156; 124. Пример 20. (S,E)-N-(-Этилбензил)-3-[2(3-карбоксипропеноил)-аминоэтокси]-2-фенилхинолин-4-карбоксамид. 0,2 г (0,4 ммоль) (SE)-N-(-этилбензил)-3[2-(3-метоксикарбонилпропеноил)-аминоэтокси]-2-фенилхинолин-4-карбоксамида (соединение примера 18) растворяли в 25 мл 10% NaOH и 5 мл 1,4-диоксана и нагревали до 60 С в течение 15 мин. После охлаждения реакционную смесь экстрагировали СН 2 Сl2 и промывали 10% лимонной кислотой и насыщенным растворомNaCl. Органический слой высушивали над(S)-N-(-Этилбензил)-3(цианометокси)-2-фенилхинолин-4-карбоксамид. 2,0 г (5,23 ммоль) (S)-N-(-этилбензил)-3 гидрокси-2-фенилхинолин-4-карбоксамида (соединение примера получения 1), 2,21 г К 2 СО 3,0,26 г (1,57 ммоль) KI и 0,52 мл (7,85 ммоль) бромоацетонитрила перемешивали в 30 мл сухого ТГФ в течение 5 ч. Неорганические соли отфильтровывали и фильтрат выпаривали в вакууме досуха. Остаток растворяли в СН 2 Сl2 и органическую фазу промывали Н 2 О, насыщенным раствором NаНСО 3, насыщенным раствором NaCl, разделяли, высушивали над Na2SO4 и выпаривали в вакууме досуха с получением 2,10 г коричневого масла, которое подвергли флэшхроматографии на силикагеле 230-400 меш,элюируя смесью гексан/EtOAc 70:30. Неочищенный продукт растирали с гексаном, фильтровали, промывали и высушивали с получением 0,75 г целевого соединения в виде белого твердого вещества. С 27 Н 23N3O2 Температура плавления = 70-72 С Молекулярная масса = 421,50MC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 421 (М+); 392; 381; 287; 247; 219; 190; 134. Пример 22. (S)-N-(-Этилбензил)-3-(2 фенилацетиламиноэтокси)-2-фенилхинолин-4 карбоксамид. 1,0 г (2,3 ммоль) (S)-N-(-этилбензил)-3(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида (соединение примера получения 4) растворяли в 20 мл сухого CH2Cl2; добавляли 0,37 мл (2,6 ммоль) TEA и реакционную смесь охлаждали до 0 С. Затем по каплям добавляли 0,4 г(2,6 ммоль) фенилацетилхлорида, растворенного в 20 мл СН 2 Сl2 и реакционную смесь перемешивали при комнатной температуре в течение 4 ч,затем промывали 20% лимонной кислотой, насыщенным раствором NаНСО 3 и солевым раствором. Органический слой высушивали надMC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 543 (М+); 410; 382; 162. Пример 23. (S)-N-(-Этилбензил)-3-[2-S)-аминофенилацетил)аминоэтокси]-2-фенилхинолин-4-карбоксамид. Реакцию получения ФМОК-защищенного целевого соединения проводили способом, который описан в примере 25, используя в качестве исходных материалов 2,8 г (6,7 ммоль) (S)-N(-этилбензил)-3-(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида (соединение примера получения 4), 1,1 мл (8,0 ммоль) TEA и 3,1 г (8,0 ммоль) (S)-ФМОК-фенилглицинилхлорида. Реакционную смесь перемешивали при комнатной температуре в течение 20 ч и обрабатывали так,как описано в примере 25, с получением 4,5 г ФМОК-защищенного целевого соединения, у которого удаляли защитные группы путем перемешивания при комнатной температуре в течение 30 мин с 90 мл 10% раствора диэтиламина в ДМФ. Затем реакционную смесь выпаривали в вакууме и очищали градиентной колоночной 38 флэш-хроматографией на силикагеле 230-400 меш, используя EtOAc в качестве исходного элюента и смесь EtOAc/MeOH 9:1 в качестве конечного элюента с получением, после растирания с изо-Рr2 О, 1,4 г целевого соединения. С 35 Н 34N4O3 Температура плавления = 140-145 С Молекулярная масса = 558,68MC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 541; 453; 382; 292; 291; 247; 219; 106. Пример 24. (S)-N-(-Этилбензил)-3-[2R)аминофенилацетил)аминоэтокси]-2 фенилхинолин-4-карбоксамид. Реакцию осуществляли точно по методике примера 23, используя (R)-ФМОК-фенилглицинилхлорид вместо (S). Использовали те же количества всех реагентов. Было получено 0,8 г целевого соединения. С 35 Н 34N4O3 Температура плавления = 92-94 С Молекулярная масса = 558,68MC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 541; 453; 382; 292; 291; 247; 219; 106. Пример 25. (S)-N-(-Этилбензил)-3-(2 аминоацетиламиноэтокси)-2-фенилхинолин-4 карбоксамид. 3,0 г (7,1 ммоль) (S)-N-(-этилбензил)-3(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида (соединение примера получения 4) растворяли в 60 мл СН 2 Сl2 в атмосфере азота и добавляли 1,2 мл (8,5 ммоль) TEA; раствор охлаждали до 0 С и по каплям добавляли 2,7 г (8,5 ммоль) (9-фторенилметоксикарбонил)глицинилхлорида (ФМОК-глицинилхлорида), растворенного в 60 мл CH2Cl2. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч и затем промывали насыщенным растворомNaCl, высушивали над Nа 2SO4 и выпаривали в вакууме досуха. Неочищенный продукт очищали градиентной колоночной флэшхроматографией на силикагеле 230-400 меш,используя смесь гексан/EtOAc 1:1 в качестве исходного элюента, и смесь EtOAc/MeOH 9:1 в качестве конечного элюента. Продукт (5,0 г) растворяли в 100 мл 10% раствора диэтиламина в ДМФ и перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь затем выпаривали в вакууме и очищали градиентной колоночной флэш-хроматографией на силикагеле 230-400 меш, используя смесьMC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 482 (М+); 382; 291; 264; 247; 219; 190; 141; 119; 101; 91. Пример 26. (S)-N-(-Этилбензил)-3-[2-(4 пиридилацетил)аминоэтокси]-2-фенилхинолин 4-карбоксамид. 0,41 г (2,4 ммоль) гидрохлорида 4 пиридилуксусной кислоты суспендировали в 80 мл СН 2 Сl2; суспензию охлаждали до 0 С и добавляли 0,33 мл (2,4 ммоль) TEA, 0,64 г (4,7 ммоль) ГОБТ и 1,0 г (2,4 ммоль) (S)-N-(этилбензил)-3-(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида (соединение примера получения 4). Затем по каплям добавляли 0,58 г (2,8 ммоль) ДЦК, растворенного в 10 мл СН 2 Сl2, и реакционную смесь перемешивали при 0 С в течение 1 ч, а затем при комнатной температуре в течение ночи. Выпавшую в осадок дициклогексилмочевину отфильтровывали и фильтрат промывали 20% лимонной кислотой, насыщенным раствором NaCl, насыщенным раствором соли, высушивали над Na2SO4 и выпаривали в вакууме досуха. Неочищенный продукт очищали градиентной колоночной флэшхроматографией на силикагеле 230-240 меш,элюируя смесью CH2Cl2/MeOH 95:5, содержащей 0,5% NH4OH (28%) с получением, послеMC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 544 (М+); 411; 382; 163. Пример 27. (S)-N-(-Этилбензил)-3-[2-(3 пиридилацетил)аминоэтокси]-2-фенилхинолин 4-карбоксамид. Получен способом, описанным в примере 26 из 0,41 г (2,4 ммоль) гидрохлорида 3 пиридилуксусной кислоты, 1,0 г (2,4 ммоль) (S)N-(-этилбензил)-3-(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида (соединение примера получения 4), 0,33 мл (2,4 ммоль) TEA, 0,64 (4,7 ммоль) ГОБТ и 0,58 (2,8 ммоль) ДЦК. Обработку и очистку реакционной смеси проводили по методике, описанной в примере 26. После растирания с изо-Рr2 О получали 0,76 г целевого соединения. С 34 Н 32N4O3 Температура плавления = 89 С разл. Молекулярная масса = 544,65MC (EI; TSQ 700; источник 180 С; 70 V; 200 A): 544 (М+); 515; 411; 382; 353; 264; 247; 163. Пример 28. (S)-N-(-Этилбензил)-3-[2-(2 пиридилацетил)аминоэтокси]-2-фенилхинолин 4-карбоксамид. Получен способом, описанном в примере 26 из 0,41 г (2,4 ммоль) гидрохлорида 2 пиридилуксусной кислоты, 1,0 г (2,4 ммоль) (S)N-(-этилбензил)-3-(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида (соединение примера получения 4), 0,33 мл (2,4 ммоль) TEA, 0,64 (4,7 ммоль) ГОБТ и 0,58 (2,8 ммоль) ДЦК. Обработку и очистку реакционной смеси проводили по методике, описанной в примере(2,8 ммоль) гомофталиевой кислоты и реакционную смесь кипятили с обратным холодильником в течение 3,5 ч. После охлаждения растворитель выпаривали в вакууме досуха и остаток растворяли в СН 2 Сl2 и промывали солевым раствором. Органический слой высушивали надNa2SO4 и выпаривали в вакууме досуха. Остаток очищали градиентной колоночной флэшхроматографией на силикагеле 230-400 меш,используя смесь гексан/EtOAc 7:3, содержащую 0,5% NH4OH (28%) в качестве исходного элюента, и смесь EtOAc/MeOH 8:2, содержащую 2%(соединения 30). 0,4 г этой смеси очищали препаративной ВЭЖХ с получением 0,17 г целевого соединения. С 36 Н 33N3 О 5 Температура плавления = 108 С разл. Молекулярная масса = 587,67MC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 569; 425; 407; 396; 383; 291; 277; 262; 247; 219; 188; 165; 118; 91. Пример 30. (S)-N-(-Этилбензил)-3-[2-(2'карбоксиметилбензоил)-аминоэтокси]-2-фенилхинолин-4-карбоксамид. Продолжая препаративную ВЭЖХ примера 29, получали 0,063 г целевого соединения.MC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 569; 425; 407; 396; 383; 291; 277; 262; 247; 219; 188; 165; 118; 91. Пример 31. (S)-N-(-Этилбензил)-3-(2 бензиламиноэтокси)-2-фенилхинолин-4-карбоксамида гидрохлорид. 1,5 г (3,52 ммоль) (S)-N-(-этилбензил)-3(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида (соединение примера получения 4) и 0,71 мл (7,04 ммоль) бензальдегида растворяли в 40 мл МеОН; после охлаждения до 10 С порциями добавляли 2,21 г (3,52 ммоль) NаСNВН 3 в атмосфере азота, и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакцию останавливали при помощи 50 мл 2N NaOH и экстрагировали эфиром; органический слой отделяли, высушивали над Na2SO4 и выпаривали в вакууме досуха. Неочищенный продукт очищали градиентной колоночной флэш-хроматографией на силикагеле 230-400 меш, элюируя смесью гексан/EtOAc (от 20 до 30%). Неочищенный продукт (0,64 г) растворяли в МеОН и раствор подкисляли HCl/Et2O с получением соответствующего гидрохлорида, который перекристаллизовывали из изо-Рr2 О/изоРrОН до 0,50 г целевого соединения в виде бледно-желтого порошка. С 34 Н 33N3 О 2 НСl Температура плавления = 165-169 С Молекулярная масса = 552,110MC (EI; TSQ 700; источник 180 С; 70 V; 200 А): 408; 273; 380. Пример 32. (S)-N-(-Этилбензил)-3-(2 дибензиламиноэтокси)-2-фенилхинолин-4 карбоксамида гидрохлорид. Продолжая элюирование хроматографической колонны примера 31, получали 0,40 г неочищенного целевого соединения. 43 Продукт растворяли в МеОН и раствор подкисляли НСl/Et2O с получением соответствующего гидрохлорида, который перекристаллиэовывали из Et2O/MeOH с получением 0,26 г целевого соединения. С 41 Н 39N3O2 НСl Температура плавления = 144-145 С Молекулярная масса = 642,28 а: С = 0,25, МеОН; b: С = 0,25, DMF; c: C = 0,1, DMF; d: C = 1, MeOH Нижеперечисленные соединения получены по методикам примеров 1-32. Таблица 2 Аналитические и спектроскопические данные для соединений примеров 33-43R2 представляет собой группу -O-(СН 2)n-Х,где Х представляет собой C1-С 6 алкил, необязательно замещенный одной или двумя группами,выбранными из гидрокси и амино; карбокси,циано, C1-6 алкоксикарбонила, аминокарбонила,моно- или ди-С 1-6 алкиламинокарбонила, аминоС 1-6 алкиламинокарбонила или моно- или ди-С 1-6 алкиламино-C1-6 алкиламинокарбонила; или Х представляет собой группу -NX1X2, где X1 и Х 2,каждый независимо, представляет собой водород, карбокси-С 1-С 6 алкилкарбонил, С 1-С 6 алкоксикарбонил-С 1-С 6 алкилкарбонил, С 1-С 6 алкилкарбонил, фенилкарбонил, фенил-С 1-С 6 алкилкарбонил, гетероарилкарбонил, гетероарил-С 1-С 6 алкилкарбонил, где гетероарильная группа включает ароматическое гетероциклическое кольцо, содержащее 5 или 6 атомов и включающее вплоть до четырех гетероатомов в кольце, выбранных из S, О и N; аминокарбонил,моно- или бис-С 1-6 алкиламинокарбонил, аминоС 1-С 6-алкилкарбонил, моно- или бис-С 1-6 алкиламино-С 1-6 алкилкарбонил, группу формулы-CO-T-CO-T1 или циклоалкильную группу с 5-9 членным единичным или конденсированным кольцом, необязательно содержащую 1 или 2 атома азота и необязательно 1 или 2 дополнительных гетероатома, выбранных из О или N, и где один или два атома кольца необязательно 50 замещены С 1-С 6 алкилом, причем указанное кольцо необязательно конденсировано с бензольным кольцом, где вышеуказанные фенильная или гетероарильная группы необязательно замещены до двух групп, которые выбирают из гидрокси, C1-6 алкокси, гидрокси-С 1-С 6 алкил,амино-С 1-6 алкил, моно- или бис-С 1-6 алкиламино, моно- или бис-С 1-6 алкиламино-С 1-6 алкил,амино-C1-6 алкокси, моно- или бис-С 1-6 алкиламино-С 1-6 алкокси, карбокси, C1-6 алкилкарбонил, C1-6 алкоксикарбонил, карбокси-С 1-6 алкил, карбокси-C1-6 алкокси и С 1-6 алкилкарбонил-С 1-6 алкокси; и где алкильная часть любой гетероарил-С 1-6 алкильной или фенил-С 1-6 алкильной группы необязательна замещена амино,моно-С 1-6 алкиламино или бис-С 1-6 алкиламиногруппой; или Х представляет собой Сприсоединенную гетероциклическую, группу с единичным или конденсированным кольцом,причем любое кольцо может быть насыщенным или ненасыщенным и имеет от 5 до 6 атомов в кольце, причем указанные атомы кольца включают 1 или 2 атома азота и необязательно 1 или 2 дополнительных гетероатома, выбранных из О или N, и где один или два атома кольца необязательно замещены C1-6 алкилом, гидрокси, амино, моно- или бис-С 1-6 алкиламино или оксозаместителями; а n равно нулю или представляет собой целое число от 1 до 7, при условии, что,когда Х представляет собой группу -NX1X2, n представляет собой только целое число от 2 до 7, и при условии, что X1 и Х 2 не являются одновременно водородом; R2 представляет собой группу -NH-CO-NHY, где Y представляет собой С 1-6 алкил, фенил, фенил-С 1-3 алкил, группу-(CH2)p-X3, где р представляет собой целое число от 1 до 4, а Х 3 представляет собой карбокси,С 1-6 алкоксикарбонил или группу -CO-NH(CH2)q-NX4X5, где q представляет собой целое число от 2 до 4, а Х 4 и Х 5, каждый независимо,представляет собой водород, C1-6 алкил или С 1-6 алкилкарбонил;T1 представляет собой гидрокси или C1-6 алкокси. 2. Соединение по п.1, в котором R2 представляет собой группу -О-(СН 2)n-Х, где X представляет собой карбокси или C1-6-алкоксикарбонил, или С-связанную гетероциклическую группу с единичным или конденсированным кольцом, как указано в формуле (I). 3. Соединение по п.1, в котором R2 представляет собой группу -О-(СН 2)n-X, где n является целым числом 2 или 3, а Х представляет собой группу -NX1X2, где X1 представляет собой водород, а Х 2 представляет собой группу вышеуказанной формулы -СО-Т-СО-T1, замещенный фенил-С 1-6 алкилкарбонил или гетероарилкарбонил. 51 4. Соединение по п.1, в котором Аr представляет собой фенил, R представляет собой этил, R1 представляет собой водород и R2 представляет собой группу -O-(СН 2)n-Х, где либо n равно 1, 2 или 3, а X представляет собой карбокси, C1-6 алкоксикарбонил, например этоксикарбонил, или С-связанную гетероциклическую группу с единичным или конденсированным кольцом, определенную в формуле (I), например пиридил; или n равно 2 или 3, а Х представляет собой группу NX1X2, где X1 представляет собой водород, a X2 представляет собой группу вышеуказанной формулы -CO-T-CO-T1, например,где Т представляет собой этилен, a T1 представляет собой OH, или Х 2 представляет собой замещенный фенил-С 1-6 алкилкарбонил, например 7. Способ получения соединения формулы(I), или его соли, и/или сольвата, который включает взаимодействие соединения формулы (III) где R' и Ar' имеют те же значения, чтo R и Аr в формуле (I), или представляет собой группу или атом, превращаемые в R и Ar соответственно с соединением формулы (II) или его активным производным где R'1, R'2 и R'3 имеют те же значения, что R1,R2, R3 соответственно, как указано в формуле(I), или представляют собой группу, превращаемую в R1, R2, R3 с получением соединения формулы (Ib) где Аr', R', R'1, R'2 и R'3 имеют вышеуказанные значения, и необязательно дополнительно проведение одной или нескольких следующих стадий:(i) превращение любого из Ar', R', R'1, R'2 иR'3 в Ar, R, R1, R2 и R3 соответственно с получением соединения формулы (I);(ii) превращение соединения формулы (I) в другое соединение формулы (I); и(iii) получение соли соединения формулы(I) и/или его сольвата. 8. Фармацевтическая композиция, включающая соединение формулы (I), или его фармацевтически приемлемую соль, или его фармацевтически приемлемый сольват, и фармацевтически приемлемый носитель. 9. Способ лечения и/или профилактики состояний, которые характеризуются чрезмерной стимуляцией рецепторов NK3 и NK2 тахикинина и заболеваний центральной нервной системы у млекопитающих, который включает введение млекопитающему, нуждающемуся в таком лечении и/или профилактике, эффективного нетоксичного количества соединения формулы (I),или его фармацевтически приемлемой соли, или фармацевтически приемлемого сольвата. 10. Применение соединения формулы (I),или его фармацевтически приемлемой соли, или его фармацевтически приемлемого сольвата в качестве активного терапевтического вещества. 11. Применение соединения формулы (I),или его фармацевтически приемлемой соли, или его фармацевтически приемлемого сольвата для лечения и/или профилактики состояний, кото 54 рые характеризуются чрезмерной стимуляцией рецепторов NK3 и NK2 тахикинина и заболеваний центральной нервной системы. 12. Применение соединения формулы (I),или его фармацевтически приемлемой соли, или его фармацевтически приемлемого сольвата для производства медикамента для лечения состояний, которые характеризуются чрезмерной стимуляцией рецепторов NK2 и NK3 тахикинина и заболеваний центральной нервной системы. 13. Применение соединения формулы (I) по п.1 или его фармацевтически приемлемой соли, или его фармацевтически приемлемого сольвата в качестве комбинированного антагониста NK-2/NK-3. 14. Применение по п.13, где соединение формулы (I) имеет соотношение сродства к связыванию NK-2/NK-3 в диапазоне от 0,05 до 20. 15. Применение по п.13, где соединение формулы (I) имеет соотношение сродства к связыванию NK-2/NK-3 в диапазоне от 0,1 до 10. 16. Применение по п.13, где соединение формулы (I) имеет, по существу, равное сродство к связыванию для рецепторов NK-2 и NK-3. 17. Способ лечения и/или профилактики респираторных заболеваний у млекопитающих,включающий введение эффективного нетоксичного фармацевтически приемлемого количества комбинированного антагониста NK-2/NK-3 соединения формулы (I) по п.1.
МПК / Метки
МПК: A61P 25/00, A61K 31/47, C07D 215/52
Метки: производные, хинолина
Код ссылки
<a href="https://eas.patents.su/28-2124-proizvodnye-hinolina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хинолина</a>
Предыдущий патент: Соединения, усиливающие активность ретиноидов.
Следующий патент: Способ производства азотной кислоты и ее рекуперации.
Случайный патент: Фенилфенантридины с ингибирующей фдэ-4 активностью