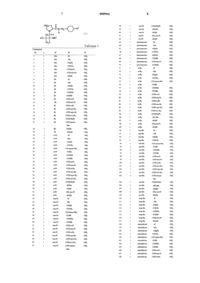
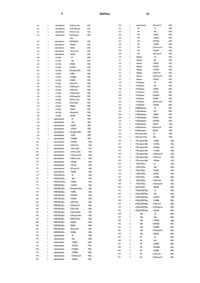
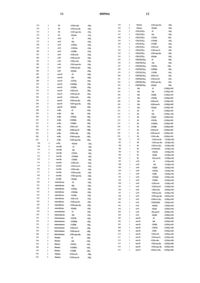
Производные пеницилламинамида.
Номер патента: 966
Опубликовано: 28.08.2000
Авторы: Ивазе Норимити, Осима Масахиро, Сугавара Коити, Инакоси Наото, Окицу Мисао
Формула / Реферат
1. Соединение, представленное следующей общей формулой (I), или его соль, или его гидрат и его сольват
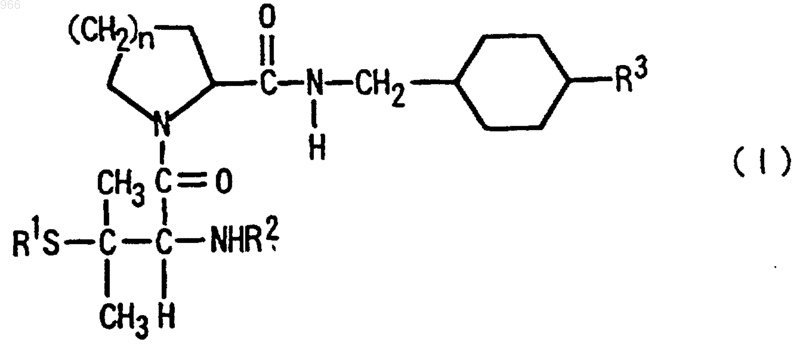
где n равно 1 или 2;
R1 обозначает C1-С10-алкильную группу, которая может быть замещена С3-С10-циклоалкильной группой или карбоксильной группой, С6-С10-арильную группу, которая может быть замещенной, С3-С10-циклоалкильную группу, которая может быть замещенной, или С7-С12-аралкильную группу, которая может быть замещенной;
R2 обозначает атом водорода, C1-С10-алкильную группу, С7-С12-аралкильную группу, которая может быть замещенной, -COR4 (где R4 обозначает атом водорода, C1-С10-алкильную группу, C1-C10-алкоксигруппу, С6-С10-арильную группу, которая может быть замещенной, С6-С10-арилоксигруппу, которая может быть замещенной, С3-С10-циклоалкильную группу, которая может быть замещенной, С3-С10-циклоалкилоксигруппу, которая может быть замещенной, С7-С12-аралкильную группу, которая может быть замещенной, или С7-С12-аралкилоксигруппу), или -SO2R5 (где R5 обозначает C1-С10-алкильную группу, С6-С10-арильную группу, которая может быть замещенной, С3-С10-циклоалкильную группу, которая может быть замещенной, или С7-С12-аралкильную группу, которая может быть замещенной), и
R3 обозначает аминогруппу или амидиногруппу, при условии, что исключены следующие соединения:
соединение, где R1 обозначает метильную группу, R2 обозначает этоксикарбонильную группу, R3 обозначает аминогруппу и n равно 1;
соединение, где R1 обозначает метильную группу, R2 обозначает метилсульфонильную группу, R3 обозначает аминогруппу и n равно 1;
соединение, где R1 обозначает этильную группу, R2 обозначает метилсульфонильную группу, R3 обозначает аминогруппу и n равно 1;
соединение, где R1 обозначает изопропильную группу, R2 обозначает этоксикарбонильную группу, R3 обозначает амидиногруппу и n равно 1.
2. Соединение, или его соль, или его гидрат, или сольват по п.1, где функциональная группа, которая может быть заместителем на вышеуказанных группах, выбрана из группы, состоящей из C1-С6-алкильной группы, C1-C6-галогеналкильной группы, C1-C6-алкоксигруппы, гидроксильной группы, карбоксильной группы, С2-С7-карбоксиалкильной группы, С2-С7-карбоксиалкилоксигруппы, С2-С7-ацильной группы, С2-С7-ацилоксигруппы, С2-С7-алкоксикарбонильной группы, С2-С7-алкоксикарбонилоксигруппы, С8-С10-аралкилоксикарбонильной группы, С7-С9-алкоксикарбонилалкоксигруппы и атома галогена.
3. Соединение, или его соль, или его гидрат, или сольват по п.1, где R1 обозначает С4-С10-алкильную группу, С6-С10-арильную группу, которая может быть замещенной, С3-С10-циклоалкильную группу, которая может быть замещенной, или С7-С12-аралкильную группу, которая может быть замещенной, и R3 обозначает амидиногруппу.
4. Соединение, или его соль, или его гидрат, или сольват по п.1, где R3 обозначает аминогруппу.
5. Соединение, или его соль, или его гидрат, или сольват по п.1, где R2 обозначает атом водорода, C1-С10-алкильную группу, С7-С12-аралкильную группу, которая может быть замещенной, или -COR4, где R4 имеет указанные выше значения.
6. Соединение, или его соль, или его гидрат, или сольват по п.1, где R2 обозначает -COR4, где R4 обозначает C1-C10-алкильную группу, C1-С10-алкоксигруппу, С6-С10-арильную группу, которая может быть замещенной, С6-С10-арилоксигруппу, которая может быть замещенной, С3-С10-циклоалкильную группу, которая может быть замещенной, С3-С10-циклоалкилоксигруппу, которая может быть замещенной, С7-С12-аралкильную группу, которая может быть замещенной, или С7-С12-аралкилоксигруппу, которая может быть замещенной.
7. Соединение по п.1, представляющее собой транс-4-амино-[(S)-N-[(S)-2-пропоксикарбониламино-3-изопропилтио-3-метилбутаноил] пролил]аминометилциклогексан, или его соль, или гидрат, или сольват.
8. Соединение по п.1, представляющее собой транс-4-амино-[(S)-N-[(S)-2-этоксикарбониламино-3-изопропилтио-3-метилбутаноил] пролил]аминометилциклогексан, или его соль, или гидрат, или сольват.
9. Фармацевтическая композиция, содержащая эффективное количество соединения по любому из пп.1-8, или его соли, или гидрата, или сольвата, вместе с фармацевтически приемлемой добавкой.
10. Применение фармацевтической композиции по п.10 в качестве антикоагулянта.
11. Применение производного пеницилламинамида, представленного следующей общей формулой (I), или его соли, или гидрата, или сольвата
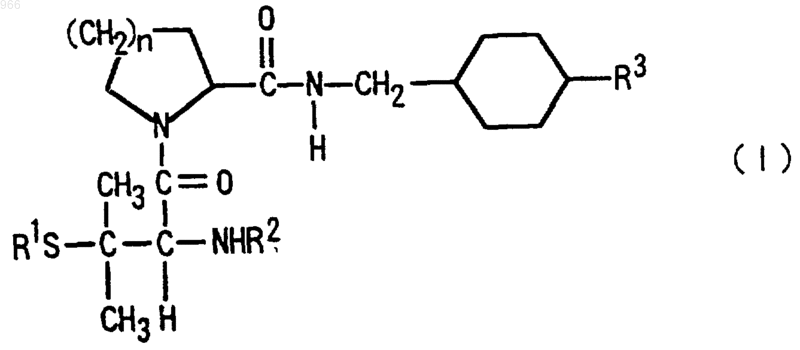
где n обозначает 1 или 2;
R1 обозначает C1-С10-алкильную группу, которая может замещена С3-С10-циклоалкильной группой или карбоксильной группой, С6-С10-арильную группу, которая может быть замещенной, С3-С10-циклоалкильную группу, которая может быть замещенной, или С7-С12-аралкильную группу, которая может быть замещенной;
R2 обозначает атом водорода, C1-С10-алкильную группу, С7-С12-аралкильную группу, которая может быть замещенной, -COR4 (где R4 обозначает атом водорода, C1-С10-алкильную группу, C1-С10-алкоксигруппу, С6-С10-арильную группу, которая может быть замещенной, C6-C10-арилоксигруппу, которая может быть замещенной, С3-С10-циклоалкильную группу, которая может быть замещенной, С3-С10-циклоалкилоксигруппу, которая может быть замещенной, С7-С12-аралкильную группу, которая может быть замещенной, или С7-С12-аралкилоксигруппу), или -SO2R5 (где R5 обозначает C1-С10алкильную группу, С6-С10-арильную группу, которая может быть замещенной, С3-С10-циклоалкильную группу, которая может быть замещенной, или С7-С12-аралкильную группу, которая может быть замещенной), и
R3 обозначает аминогруппу или амидиногруппу, при условии, что исключены следующие соединения:
соединение, в котором R1 обозначает метильную группу, R2 обозначает этоксикарбонильную группу, R3 обозначает аминогруппу и n обозначает 1;
соединение, в котором R1 обозначает метильную группу, R2 обозначает метилсульфонильную группу, R3 обозначает аминогруппу и n обозначает 1;
соединение, в котором R1 обозначает этильную группу, R2 обозначает метилсульфонильную группу, R3 обозначает аминогруппу и n обозначает 1;
соединение, в котоЁюь R1 обозначает изопропильную группу, R2 обозначает этоксикарбонильную группу, R3 обозначает амидиногруппу и n обозначает 1, в качестве ингибитора протеазы.
12. Применение по п.11 в качестве антикоагулянта.
13. Применение по п.11 для ингибирования тромбина.
Текст
1 Область техники Настоящее изобретение относится к новым производным пеницилламинамида. Более конкретно, настоящее изобретение относится к производным пеницилламинамида и их солям,которые обладают ингибирующей активностью против протеаз, в частности антитромботической активностью. Настоящее изобретение относится также к ингибиторам протеаз, содержащим указанные вещества в качестве активных ингредиентов. Предпосылки изобретения Хорошо известно, что в живых организмах присутствуют различные типы протеаз. Например, известно существование класса сериновых протеаз, таких как тромбин, фактор Ха, факторIХа, фактор VIIa, трипсин, плазмин, тканевый активатор плазминогена, калликреин, фермент С 1 в комплементе, С 3/С 5-конвертаза и триптаза. Известно также, что различные типы заболеваний обусловлены атипичной активацией этих протеаз по некоторым причинам. Поэтому,можно ожидать, что вещества, обладающие ингибирующей активностью против этих протеаз,являются применимыми в качестве лекарственных средств. Например, известно, что антитромботические агенты эффективны в качестве терапевтических лекарственных средств для тромбоза, и по этой причине развивались разработки ингибиторов протеаз, обладающих антитромботической активностью. Однако, эти ингибиторы предоставляют некоторые проблемы, например,проблемы недостаточной стабильности in vivo или отсутствия избирательности в отношении сериновых протеаз, иных, чем тромбин, или снижения антитромботической активности при пероральном введении. Таким образом, эти ингибиторы неудовлетворительны для практических применений. Некоторые трипептидные производные,содержащие часть производного аргинина, также известны в качестве ингибиторов протеаз. Например,D-фенилаланил-L-пролил-L-аргиналь известен в качестве ингибитора тромбина(например, Folia Haemotol. 109, 22 (1982. Однако это соединение является относительно нестабильным в живом организме (J. Med. Chem.,33, 1729 (1990. Имеется также несколько сообщений о производных аргиналя (the Japanese(1980, производных аргининкетоамида (WO 9408941), производных соединений бора (например, J. Biol. Chem., 265, 18289 (1990), theJapanese Patent Unexamined Publication Nos. Hei 4-330094/1992 и (Hei)6-298795/1994 и WO 9425049). Однако эти производные предоставляют проблему, заключающуюся в том, что они имеют низкую ферментативную избирательность среди сериновых протеаз, принадлежащих(Hei)6-25195/1994) и тетразамещенные производные циклогексиламина (WO 942505) сообщались в качестве тромбин-специфических ингибиторов, однако не может ожидаться их эффективность при пероральном введении. Описание изобретения С учетом описанных выше обстоятельств заявитель данного изобретения провел многочисленные исследования для нахождения веществ, которые обладают удовлетворительными для практики ферментативной селективностью,пероральной доступностью и стабильностью invivo и являются структурно новыми. В результате было обнаружено, что производные пеницилламинамида, представленные ниже, обладают желательными свойствами, и, таким образом, была достигнута цель данного изобретения. Данное изобретение относится к производным пеницилламинамида, представленным следующей общей формулой (I), и их солям,гидратам и сольватам:R1 обозначает C1-С 10-алкильную группу,которая может быть замещена С 3-С 10 циклоалкильной группой или карбоксильной группой, С 6-С 10-арильную группу, которая может быть замещенной, С 3-С 10-циклоалкильную группу, которая может быть замещенной, или С 7-С 12-аралкильную группу, которая может быть замещенной;R2 обозначает атом водорода, C1-С 10 алкильную группу, С 7-С 12-аралкильную группу,которая может быть замещенной, -COR4 (где R4 обозначает атом водорода, C1-С 10-алкильную группу, C1-С 10-алкоксигруппу, С 6-С 10-арильную группу, которая может быть замещенной, С 6 С 10-арилоксигруппу, которая может быть замещенной, С 3-С 10-циклоалкильную группу, которая может быть замещенной,С 3-С 10 циклоалкилоксигруппу, которая может быть замещенной, С 7-С 12-аралкильную группу, которая может быть замещенной, или С 7-С 12 аралкилоксигруппу), или -SO2R5 (где R5 обозначает C1-С 10-алкильную группу, С 6-С 10-арильную группу, которая может быть замещенной, С 3 С 10-циклоалкильную группу, которая может быть замещенной, или С 7-С 12-аралкильную группу, которая может быть замещенной), иR3 обозначает аминогруппу или амидиногруппу, при условии, что исключены соединения, в которыхR1 обозначает изопропильную группу, R2 обозначает этоксикарбонильную группу, R3 обозначает амидиногруппу и n равно 1. Согласно другим аспектам данного изобретения предложено лекарственное средство,содержащее вещество, выбранное из группы,состоящей из вышеуказанных производных пеницилламинамида и их солей, гидратов и сольватов; и фармацевтические композиции, содержащие вещество, выбранное из группы, состоящей из вышеуказанных производных пеницилламинамида и их солей, гидратов и сольватов в качестве активного ингредиента, вместе с фармацевтически приемлемым носителем. Вышеуказанные лекарственные средства и фармацевтические композиции могут использоваться для профилактики и/или лечения заболеваний, вызываемых гиперфункцией протеазной активности, например, они могут использоваться в качестве антитромботических средств, т.е. перорально доступных антикоагулянтов. Ингибиторы протеаз, содержащие вещество, выбранное из группы, состоящей из вышеуказанных производных пеницилламинамида и их солей, гидратов и сольватов, также предложены согласно следующему аспекту данного изобретения. Согласно еще одному аспекту данного изобретения предложено применение вещества,выбранного из группы, состоящей из вышеуказанных производных пеницилламинамида и их солей, гидратов и сольватов, для приготовления вышеописанных фармацевтических композиций; и способ терапевтического лечения заболевания, вызываемого гиперфункцией протеазной активности, предусматривающий стадию введения пациенту терапевтически и/или профилактически эффективного количества вещества,выбранного из группы, состоящей из вышеуказанных производных пеницилламинамида и их солей, гидратов и сольватов. Наилучший способ осуществления данного изобретения Производные пеницилламинамида по данному изобретению представлены формулой (I),приведенной выше. Примеры C1-С 10-алкильной группы в приведенном выше определении включают, например, метильную группу, этильную группу, нпропильную группу, изопропильную группу, нбутильную группу, втор-бутильную группу,изобутильную группу, трет-бутильную группу,н-пентильную группу, 1,1-диметилпропильную группу, неопентильную группу, н-гексильную 4 группу, 1-метил-1-этилпропильную группу, нгептильную группу, 1,1-диэтилпропильную группу, н-октильную группу, н-нонильную группу и н-децильную группу. Примеры С 6-С 10-арильной группы включают, например, фенильную группу, толильную группу и нафтильную группу. Примеры С 3-С 10-циклоалкильной группы включают, например, циклопропильную группу,циклобутильную группу, циклопентильную группу, циклогексильную группу, циклогептильную группу, циклооктильную группу, циклононильную группу и циклодецильную группу. Примеры C1-С 10-алкоксигруппы включают,например, метоксигруппу, этоксигруппу, нпропоксигруппу,изопропокси-группу,нбутоксигруппу, втор-бутоксигруппу, изобутоксигруппу, трет-бутоксигруппу, н-пентилоксигруппу, неопентилоксигруппу, н-гексилоксигруппу,н-гептилоксигруппу,н-октилоксигруппу, н-нонилоксигруппу и н-децилоксигруппу. Примеры С 3-С 10-циклоалкилоксигруппы включают, например, циклопропилоксигруппу,циклобутилоксигруппу, циклопентилоксигруппу, циклогексилоксигруппу и циклогептилоксигруппу. Примеры С 7-С 12-аралкилоксигруппы включают, например, бензилоксигруппу, фенилэтилоксигруппу, фенилпропилоксигруппу и нафтилметилоксигруппу, и примеры С 6-С 10 арилоксигруппы включают, например, фенилоксигруппу, толилоксигруппу и нафтилоксигруппу. Примеры С 7-С 12-аралкильной группы включают, например, бензильную группу, фенилэтильную группу, фенилпропильную группу и нафтилметильную группу. Когда определения функциональных групп приведенной выше общей формулы включают выражение "которые могут быть замещенными", примеры этих заместителей включают, например, C1-С 6-алкильную группу, такую как метильная группа, этильная группа, нпропильная группа, изопропильная группа, нбутильная группа, втор-бутильная группа, изобутильная группа, трет-бутильная группа, нпентильная группа и н-гексильная группа; C1C6-галогеналкильную группу, такую как хлорметильная группа, бромметильная группа, дихлорметильная группа, 1-хлорэтильная группа,2-хлорэтильная группа, 3-хлорпропильная группа, 4-хлорбутильная группа, 5-хлорпентильная группа, 6-хлоргексильная группа, дифторметильная группа и трифторметильная группа; C1 С 6-алкоксигруппу, такую как метоксигруппа,этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, втор-бутоксигруппа,изобутилоксигруппа, трет-бутилоксигруппа, нпентилоксигруппа и н-гексилоксигруппа; гидроксильную группу; карбоксильную группу; С 2 С 7-карбоксиалкильную группу, такую как карбоксиметильная группа, 2-карбоксиэтильная группа, 3-карбоксипропильная группа, 4-карбо 5 ксибутильная группа, 5-карбоксипентильная группа и 6-карбоксигексильная группа; С 2-С 7 карбоксиалкилоксигруппу, такую как карбоксиметоксигруппа, 2-карбоксиэтоксигруппа, 3 карбоксипропоксигруппа, 4-карбоксибутилоксигруппа, 5-карбоксипентилоксигруппа и 6 карбоксигексилоксигруппа; С 2-С 7-ацильную группу, такую как ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа, валерильная группа, изовалерильная группа, пивалоильная группа, гексаноильная группа и гептаноильная группа; С 2-С 7 ацилоксигруппу, такую как ацетилоксигруппа,пропионилоксигруппа, бутирилоксигруппа, изобутирилоксигруппа, валерилоксигруппа, изовалерилоксигруппа, пивалоилоксигруппа, гексаноилоксигруппа и гептаноилоксигруппа; С 2-С 7 алкоксикарбонильную группу, такую как метоксикарбонильная группа, этоксикарбонильная группа, н-пропоксикарбонильная группа, изопропоксикарбонильная группа, н-бутилоксикарбонильная группа, втор-бутилоксикарбонильная группа, изобутилоксикарбонильная группа, трет-бутилоксикарбонильная группа, нпентилоксикарбонильная группа и н-гексилоксикарбонильная группа; С 2-С 7-алкоксикарбонилоксигруппу, такую как метоксикарбонилоксигруппа,этоксикарбонилоксигруппа,нпропоксикарбонилоксигруппа, изопропоксикарбонилоксигруппа,н-бутилоксикарбонилоксигруппа,втор-бутилоксикарбонилоксигруппа,изобутилоксикарбонилоксигруппа, трет-бутилоксикарбонилоксигруппа,н-пентилоксикарбонилоксигруппа и н-гексилоксикарбонилоксигруппа; С 8-С 10-аралкилоксикарбонильную группу, такую как бензилоксикарбонильная группа,фенилэтилоксикарбонильная группа и фенилпропилоксикарбонильная группа; С 3-С 9-алкоксикарбонилалкоксигруппу, такую как метоксикарбонилметоксигруппа, этоксикарбонилметоксигруппа, пропоксикарбонилметоксигруппа, метоксикарбонилэтоксигруппа, этоксикарбонилэтоксигруппа и пропоксикарбонилэтоксигруппа; атом галогена, такой как атом фтора, атом хлора и атом брома. Примеры предпочтительных соединений данного изобретения включают соединения общей формулы (I), где R1 обозначает C4-C10 алкильную группу, С 6-С 10-арильную группу,которая может быть замещенной, С 3-С 10 циклоалкильную группу, которая может быть замещенной, или С 7-С 12-аралкильную группу,которая может быть замещенной, и R3 обозначает амидиногруппу. Соединения, в которых R3 обозначает аминогруппу, также являются предпочтительными. Примеры более предпочтительных соединений включают соединения общей формулы(I), где R2 обозначает атом водорода, C1-С 10 алкильную группу, С 7-С 12-аралкильную группу,которая может быть замещенной, или -COR4,где R4 имеет указанное выше значение. 6 Примеры наиболее предпочтительных соединений включают соединения общей формулы (I), где R2 обозначает -COR4, где R4 обозначаетC1-С 10-алкильную группу,C1-С 10 алкоксигруппу, С 6-С 10-арильную группу, которая может быть замещенной, С 6-С 10-арилоксигруппу, которая может быть замещенной,С 3-С 10-циклоалкильную группу, которая может быть замещенной,С 3-С 10-циклоалкилоксигруппу, которая может быть замещенной, С 7 С 12-аралкилоксигруппу, которая может быть замещенной, или С 7-С 12-аралкилоксигруппу,которая может быть замещенной. Производные пеницилламинамида, представленные приведенной выше общей формулой(I), могут иметь разные стереоструктуры. Например, ввиду асимметричного атома углерода в качестве асимметричного центра их абсолютная конфигурация может быть (S)- или (R)конфигурацией. Они могут также существовать в виде рацематов. Оптические изомеры или диастереомеры в чистом виде или любые смеси этих изомеров или рацематы также находятся в сфере действия данного изобретения. Примеры солей, образуемых соединениями данного изобретения, представленными приведенной выше общей формулой (I), включают,например, соли неорганических кислот, такие как гидрохлорид, гидробромид, гидройодид,сульфат, нитрат и фосфат, и соли органических кислот, такие как сукцинат, оксалат, фумарат,малеат, лактат, тартрат, цитрат, ацетат, гликолат, метансульфонат и толуолсульфонат. Когда производные пеницилламинамида общей формулы (I) имеют свободную карбоксильную группу, они могут образовывать соли с фармацевтически приемлемыми основаниями. Примеры таких солей включают, например, соли щелочных металлов, соли щелочно-земельных металлов, соли аммония и соли алкиламмония. Производные пеницилламинамида, представленные общей формулой (I), и их соли могут образовать гидраты или могут образовать сольваты с метанолом, этанолом, изопропанолом, ацетоном, этилацетатом, метиленхлоридом или т.п. Эти вещества также находятся в сфере действия данного изобретения. Ниже приведены характерные примеры данного изобретения. В таблице Me обозначает метильную группу, Et обозначает этильную группу, Ph обозначает фенильную группу, н-Рr обозначает н-пропильную группу, изо-Рr обозначает изопропильную группу, Вu обозначает бутильную группу, н-Вu обозначает нбутильную группу, изо-Вu обозначает изобутильную группу, втор-Вu обозначает вторбутильную группу, циклоНех обозначает циклогексильную группу, 4-F-бензил обозначает 4 фторбензильную группу и 4-ОМе-бензил обозначает 4-метоксибензильную группу. Далее представлены способы получения соединений по данному изобретению. Соединения по данному изобретению могут быть получены сочетанием реакций, пригодных для получения соответствующих желаемых соединений. Типичные реакционные схемы приведены в качестве примера ниже, однако,способы не ограничиваются только описанными ниже способами. В приведенных выше схемах R1, R2 и n имеют указанные выше значения, и Р и Q обозначают защитную группу для аминогруппы,такую как бензилоксикарбонильную группу и трет-бутилоксикарбонильную группу. В приведенных выше схемах может быть использован известный способ синтеза амидов для получений соединений формул (IV), (VII),(IX) и (XI). Примеры приемлемых способов включают, например, способы с использовани 000966 18 ем агента дегидратации-конденсации, такого как дициклогексилкарбодиимид, 1-этил-3-(диметиламинопропил)карбодиимид и карбонилдиимидазол, способы на основе азидов, способы на основе галогенангидридов кислот, способы на основе ангидридов карбоновых кислот, способы на основе активированных сложных эфиров и т.п. (см., например, "Jikken Kagaku Koza", 4th(1992), Ed. by the Chemical Society of Japan, Maruzen). Реакции могут проводиться в инертном растворителе, таком как тетрагидрофуран, диэтиловый эфир и дихлорметан при охлаждении,при комнатной температуре или при нагревании общепринятыми способами. В приведенных выше реакционных схемах соединения формулы(V), соединения формулы (I) в реакционной схеме 1 и соединения формулы (X) могут быть синтезированы проведением реакции удаления защитных групп согласно способу, известному в области химии пептидов (см., например, Nobuo,Izumiya et al., "Fundamentals and Experiments ofPeptide Syntheses'", Maruzen). Соединение формулы (I) в Реакционной схеме 2 может быть получено взаимодействием имидатного соединения, полученного обработкой соединения формулы (XI) спиртом и неорганической кислотой, такой как хлористоводородная кислота, с аммиаком или солью аммония или, альтернативно, взаимодействием тиоамидного соединения, полученного обработкой соединения формулы (XI) сероводородом в присутствии органического основания, такого как триэтиламин или пиридин, с (низший алкил)галогенидом, таким как метилйодид, и затем взаимодействием полученного тиоимидатного соединения с аммиаком или солью аммония. Каждое из соединений, полученных, как описано выше, можно выделить и очистить общепринятыми химическими способами, например, такими как экстракция, кристаллизация,перекристаллизация или различные хроматографические способы. В случае использования соединения данного изобретения в качестве лекарственных средств можно использовать соединение per se. Однако как правило, предпочтительно использовать это соединение в форме фармацевтической композиции, содержащей соединение данного изобретения в виде активного ингредиента,вместе с фармацевтически приемлемой добавкой (носителем). Отношение активного ингредиента к фармацевтически приемлемой добавке может меняться в диапазоне, например, от 1 до 90 мас.%. Например, в качестве фармацевтических композиций, содержащих соединение данного изобретения, могут быть введены композиции для перорального введения, такие как гранулы, мелкие гранулы, порошки, таблетки,твердые капсулы, мягкие капсулы, сиропы,эмульсии, суспензии и жидкие лекарственные средства, или альтернативно, могут быть ис 19 пользованы внутривенные, внутримышечные или подкожные инъекции. Композиции могут также использоваться в виде суппозиториев. Композиции могут быть приготовлены в виде порошков для инъекций и использоваться в виде инъекционных растворов, получаемых перед использованием. В качестве фармацевтически приемлемых добавок могут использоваться твердые или жидкие и органические или неорганические носители и разбавители для фармацевтических препаратов, пригодные для перорального, энтерального или парентерального введения. В качестве наполнителей, используемых для приготовления твердых фармацевтических композиций, можно использовать, например, лактозу,сахарозу, крахмал, тальк, целлюлозу, декстрин,каолин, карбонат кальция и т.п. Жидкие композиции для перорального введения, такие как эмульсии, сиропы, суспензии или растворы,могут содержать общепринятые инертные разбавители, такие как вода или растительные масла. Эти жидкие композиции могут содержать,кроме инертных разбавителей, например, вспомогательные средства, такие как смачивающие агенты, способствующие суспендированию вспомогательные агенты, подслащивающие вещества, улучшающие вкус и запах агенты, красители и консерванты. Приготовленные таким образом жидкие композиции могут быть инкапсулированы в капсулы, изготовленные из абсорбируемого материала, такого как желатин. Примеры растворителей или суспензионных сред,используемых для приготовления фармацевтических композиций для парентерального введения, таких как инъекционные формы, суппозитории и т.п., включают, например, воду, пропиленгликоль, полиэтиленгликоль, бензиловый спирт, этилолеат и лецитин. Материалы-основы,используемые для суппозиториев, включают,например, какао-масло, эмульгированное какаомасло, лауриновый липид и Witepsol. Эти фармацевтические композиции могут быть приготовлены общепринятыми способами. Клиническая доза для перорального введения может обычно составлять 0,01-1000 мг,предпочтительно 10-1000 мг в день на массу взрослого соединения данного изобретения. Однако предпочтительно увеличивать или уменьшать эту дозу соответствующим образом в зависимости от возраста, состояния и симптомов пациента. Суточную дозу лекарственного средства данного изобретения можно вводить один раз в день или, альтернативно, два или три раза в день с подходящими интервалами в виде разделенных доз. Эту дозу можно вводить с перерывами. При использовании этих лекарственных средств в виде инъекций желательно вводить разовую дозу 0,001-100 мг на взрослого (в виде веса соединения данного изобретения) непрерывно или с перерывами. 20 Примеры. Теперь данное изобретение будет объяснено более конкретно с помощью примеров. Однако объем данного изобретения не ограничен следующими далее примерами. В приведенных ниже примерах используются следующие обычные аббревиатуры: ТГФ - тетрагидрофуран; ДМФ - N,N-диметилформамид; ДМСО - диметилсульфоксид; КДИ - карбонилимидазол; ДФФА - дифенилфосфорилазид;Z - бензилоксикарбонил и Воc: трет-бутилоксикарбонил. В физико-химических данных ЯМР обозначает ядерный магнитный резонанс, где величины представлены в виде(дельта)-величин в м.д., которые обычно используются для указания химических смещений. ТМС (тетраметилсилан) использовали в качестве внутреннего стандарта. Числа в скобках после дельтавеличин указывают количества атомов углерода и, что касается символов после чисел в скобках,"с" обозначает синглет, "д" обозначает дублет,"т" обозначает триплет, "кв" обозначает квартет,"м" обозначает мультиплет и "шир." обозначает широкий абсорбционный пик. ИК обозначает спектр инфракрасного поглощения, который измеряли с таблеткой бромида калия, если нет других указаний. Цифровые величины указаны в качестве волновых чисел в см-1. Указаны только основные пики поглощения. Символ "т.пл." обозначает точку плавления, и некорректированные величины показаны в виде С. Пример 1. Синтез гидрохлорида транс-4 амино-[(S)-N-[(S)-2-пропоксикарбониламино-3 изопропилтио-3-метилбутаноил]пролил]аминометилциклогексана (соединения 51 в таблице 1). а) Транс-4-трет-бутоксикарбониламинобензилоксикарбониламинометилциклогексан. К раствору транс-4-аминометилциклогексанкарбоновой кислоты (15, 7 г, 100 ммоль) и гидроксида натрия (4,0 г, 100 ммоль) в воде (30 мл) добавляли одновременно и медленно по каплям бензилоксикарбонилхлорид (15,6 мл,110 ммоль) и раствор гидроксида натрия (4,4 г,110 ммоль) в воде (30 мл) при 0 С. После перемешивания в течение 4 ч смесь экстрагировали один раз эфиром и добавляли 1 н. соляную кислоту к водному слою для доведения рН до 2. Выпавший белый твердый продукт собирали фильтрованием и сушили. Триэтиламин (8,3 мл, 60 ммоль) и ДФФА(13,7 г, 50 ммоль) добавляли к раствору полученного соединения (12,8 г, 50 ммоль) в третбутаноле (150 мл) и смесь нагревали с обратным холодильником в течение 8 ч. После выпаривания растворителя к остатку добавляли воду и затем смесь экстрагировали хлороформом. Органический слой промывали один раз 5% вод 21 ным карбонатом натрия, один раз 5% водным сульфатом калия, дважды водой и затем один раз насыщенным солевым раствором. После высушивания над сульфатом натрия растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле(гексан/этилацетат) с получением соединения заголовка а) (8,6 г, выход 47%). ЯМР (СDСl3,): 0,85-1,37 (м, 14 Н), 1,60-1,85b) Транс-4-трет-бутоксикарбониламино[(S)-N-бензилоксикарбонилпролил]аминометилциклогексан. Соединение, полученное в а) (4,4 г, 12 ммоль), растворяли в метаноле (200 мл) и раствор подвергали каталитическому восстановлению в присутствии палладия черного (палладия на угле) (0,4 г) при температуре окружающей среды при атмосферном давлении. После завершения реакции катализатор удаляли фильтрованием и растворитель выпаривали. КДИ (2,0 г, 12 ммоль) добавляли к раствору (S)-Z-пролина (3,0 г, 12 ммоль) в ТГФ (30 мл) при 0 С. После перемешивания в течение 3 ч к смеси добавляли раствор полученного соединения в ТГФ (150 мл) при 0 С. После перемешивания в течение 6 ч растворитель выпаривали и к остатку добавляли воду (50 мл). Смесь экстрагировали хлороформом и органический слой промывали три раза водой и один раз насыщенным солевым раствором. После высушивания этого слоя сульфатом натрия растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением соединения заголовка b) (4,2 г, выход 77%). ЯМР (CDCl3): 0,85-1,06 (м, 4 Н), 1,44 (с,9 Н), 1,60-2,35 (м, 9 Н), 2,94-3,20 (м, 2 Н), 3,203,55 (м, 3 Н), 4,31 (шир., 1 Н), 4,47 (шир., 1 Н),5,14 (с, 2 Н), 6,90 (шир., 1 Н), 7,15-7,40 (м, 5 Н). с) Транс-4-трет-бутоксикарбониламино[(S)-N-[(S)-2-пропоксикарбониламино-3-изопропилтио-3-метилбутаноил]пролил]аминометилциклогексан. Соединение, полученное в b) (3,6 г, 7,9 ммоль), растворяли в метаноле (50 мл) и раствор подвергали каталитическому восстановлению в присутствии палладия черного (0,3 г) при температуре окружающей среды при атмосферном давлении. После завершения реакции катализатор удаляли фильтрованием и затем растворитель выпаривали. Полученный маслянистый продукт (S)-2 пропоксикарбонил-амино-3-изопропилтио-3 метилбутановую кислоту (2,4 г, 8,7 ммоль) и триэтиламин (1,58 г, 15,6 ммоль) растворяли в дихлорметане (55 мл) и к раствору добавляли по каплям диэтилфосфорцианидат (DEPC, 1,4 г, 8,7 ммоль) в дихлорметане (10 мл) при 0 С. После повышения температуры до комнатной температуры смесь перемешивали еще в течение 24 ч 22 и затем добавляли воду. Смесь экстрагировали дважды дихлорметаном и органический слой сушили над сульфатом натрия. После выпаривания растворителя полученный остаток очищали колоночной хроматографией (хлороформ/метанол) с получением соединения заголовка с) (3,9 г, выход 85%). ЯМР (СDСl3): 7,18 (т, 1 Н), 5,59 (д, 1 Н),4,61 (д, 1 Н), 4,34 (д, 2 Н), 4,20-3,85 (м, 3 Н), 3,72(3,9 г, 6,7 ммоль), в хлороформе (5 мл) добавляли по каплям 4 н. раствор хлористоводородной кислоты в этилацетате (37 мл) при 0 С. После перемешивания смеси в течение 1 ч растворитель выпаривали. Полученный остаток суспендировали и промывали эфиром и затем собирали фильтрованием с получением соединения заголовка d) (3,1 г, выход 90%). ЯМР (СDСl3): 8,34 (шир., 3 Н) 7,21 (т, 1 Н),5,61 (д, 1 Н), 4,59 (д, 1 Н), 4,31 (д, 1 Н), 4,07-3,92(м, 3 Н), 3,74 (м, 1 Н), 3,20-2,90 (м, 2 Н), 2,36 (м,1 Н), 2,20-1,40 (м, 12 Н), 1,47 (с, 3 Н), 1,41 (с, 3 Н),1,29 (дд, 6 Н), 0,95 (т, 3 Н), 1,10-0,90 (м, 2 Н). ИК: 3344, 2974, 2876, 1689, 1637, 1527,1448, 1313, 1240, 1060. Подобно описанному выше, получали соединения примеров 2-39, приведенных ниже. Пример 2. Гидрохлорид транс-4-амино[(S)-N-[(S)-2-этоксикарбониламино-3-изопропилтио-3-метилбутаноил]пролил]аминометилциклогексана (соединения 50 в таблице 1). ЯМР (CDCl3): 8,32 (шир., 3 Н), 7,22 (т, 1 Н),5,60 (д, 1 Н), 4,59 (м, 1 Н), 4,30 (д, 1 Н), 4,20-3,90(м, 4 Н), 1,70 (м, 4 Н), 1,62-1,46 (м, 2 Н), 1,48 (с,3 Н), 1,41 (с, 3 Н), 1,32 (д, 3 Н), 1,26 (д, 3 Н), 1,101,00 (м, 2 Н), 0,92 (т, 3 Н). ИК: 3428, 3347, 2957, 2934, 1690, 1640,1524, 1449, 1240, 1055. Пример 40. Гидрохлорид транс-4-амидино[(S)-N-[(S)-2-пропокси-карбониламино-3 изопропилтио-3-метилбутаноил]пролил]аминометилциклогексана (Соединения 410 в таблице 1). а) Транс-4-N-бензилоксикарбониламинометилциклогексилнитрил. К раствору транс-4-аминометилциклогексанкарбоновой кислоты (25 г, 159 ммоль) и карбоната натрия (20 г, 191 ммоль) в воде (300 мл) добавляли бензилоксикарбонилхлорид (27 мл,190 ммоль) при 0 С. После перемешивания в течение 6 ч к смеси добавляли 1 н. соляную кислоту для доведения рН до 2 и выпавший белый твердый продукт собирали фильтрованием и промывали водой и затем сушили. Полученное белое твердое вещество растворяли в ТГФ (300 мл) и к раствору добавляли КДИ (21 г, 130 ммоль) при 0 С. После перемешивания в течение 3 ч реакционную смесь добавляли по каплям к смеси концентрированного водного аммиака (50 мл) и ТГФ (150 мл) при 0 С. После перемешивания в течение 5 ч растворитель выпаривали и к остатку добавляли воду (500 мл). Выпавший белый твердый продукт собирали фильтрованием и промывали водой и затем сушили. К раствору полученного соединения в 1,2 дихлорэтане (500 мл) добавляли тионилхлорид(19 мл, 260 ммоль) и затем смесь нагревали при внутренней температуре смеси 70 С. После продолжения перемешивания в течение 5 ч реакционную смесь выливали в охлажденную льдом воду и смесь нейтрализовали 1 н. водным гидроксидом натрия. Смесь экстрагировали хлороформом и органический слой промывали дважды водой и один раз насыщенным солевым раствором и затем сушили над сульфатом натрия. После выпаривания растворителя полученный неочищенный продукт перекристаллизовывали (гексан/этилацетат) с получением соединения заголовка а) (22,8 г, выход 53%). Т.пл. 90-92 С.b) Транс-4-(S)-пролиламинометилциклогексилнитрил. Соединение, полученное в а), растворяли в этаноле (250 мл) и раствор подвергали каталитическому восстановлению в присутствии палладия черного (1 г) при температуре окружающей среды при атмосферном давлении. После завершения реакции катализатор удаляли фильтрованием и затем растворитель выпаривали. 31 К раствору (S)-N-бензилоксикарбонилпролина (20,7 г, 83 ммоль) в ТГФ (150 мл) добавляли КДИ (13,5 г, 83 ммоль) при 0 С. После перемешивания в течение 3 ч к смеси добавляли раствор соединения, полученного восстановлением, как описано выше, в ТГФ (200 мл) при 0 С. После перемешивания смеси в течение 12 ч растворитель выпаривали и к полученному остатку добавляли хлороформ (400 мл). Органический слой промывали три раза водой и один раз насыщенным солевым раствором и затем сушили над сульфатом натрия. Растворитель выпаривали и полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол). Полученное соединение растворяли в этаноле (250 мл) и раствор подвергали каталитическому восстановлению в присутствии палладия черного (1 г) при температуре окружающей среды при атмосферном давлении. После завершения реакции катализатор удаляли фильтрованием и затем растворитель выпаривали с получением соединения заголовка b) (18,8 г, выход 95%). ЯМР (ДМСО-d6): 0,88-1,06 (м, 2 Н), 1,381,52 (м, 3 Н), 1,68-2,03 (м, 7 Н), 2,20-2, 40 (м, 1 Н),2,52-2,67 (м, 1 Н), 2,80-3,20 (м, 4 Н), 4,03-4,10 (м,1 Н), 7,53 (шир., 1 Н), 8,65-8,70 (м, 1 Н).(1,04 г, 4,4 ммоль), (S)-2-пропоксикарбониламино-3-изопропилтио-3-метилбутановой кислоты (1,20 г, 4,3 ммоль) и триэтиламина (1,5 г, 14,8 ммоль) в дихлорметане (35 мл) добавляли по каплям при 0 С раствор диэтилфосфорцианидата (DEPC, 0,85 г, 5,3 ммоль) в дихлорметане (5 мл). Температуру смеси повышали до комнатной температуры и перемешивание продолжали в течение 24 ч. К реакционной смеси добавляли воду и смесь экстрагировали дважды дихлорметаном и затем органический слой сушили над сульфатом натрия. Растворитель выпаривали и остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением соединения заголовка с) (1,77 г,выход 83%). ЯМР (CDCl3): 7,18 (т, 1 Н), 5,58 (д, 1 Н),4,61 (д, 1 Н), 4,33 (д, 1 Н), 4,20-3,85 (м, 3 Н), 3,73(0,70 г, 1,42 ммоль), в хлороформе (2 мл) добавляли насыщенный раствор хлористого водорода в этаноле (10 мл) при 0 С и затем смесь оставляли стоять при 0 С в течение 48 ч. Раствори 000966 32 тель реакционной смеси выпаривали и полученный остаток растворяли в метаноле (15 мл) и затем к раствору добавляли карбонат аммония(1,0 г, 10,4 ммоль) при 0 С. Температура смеси повышалась до комнатной температуры и перемешивание продолжали в течение 6 ч, после чего растворитель выпаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол) с получением соединения заголовка d) (0,71 г, выход 92%). ЯМР (CDCl3): 8,87 (шир., 2 Н), 8,57 (шир.,2 Н), 7,48 (т, 1 Н), 6,00 (д, 1 Н), 4,59 (д, 1 Н), 4,34(м, 2 Н). ИК: 3325, 3084, 2930, 2874, 1693, 1637,1521, 1446, 1240, 1062. Подобно описанному выше, получали соединения примеров 40-76, приведенных ниже. Пример 41. Гидрохлорид транс-4-амидино[(S)-N-[(S)-2-этоксикарбониламино-3-(1'этилпропилтио)-3-метилбутаноил]пролил]аминометилциклогексана (cоединения 514 в таблице 1). ЯМР (СDСl3): 8,83 (шир., 2 Н), 8,72 (шир.,2 Н), 7,52 (т, 1 Н), 5,98 (д, 1 Н), 4,61 (д, 1 Н), 4,304,15 (м, 3 Н), 4,00 (м, 1 Н), 3,71 (м, 1 Н), 3,18 (м,1 Н), 2,89 (м, 1 Н) , 2,70-2,50 (м, 2 Н), 2,24 (м, 1 Н),2,10-1,40 (м, 17 Н), 1,45 (с, 3 Н), 1,37 (с, 3 Н), 1,28i) Способ измерения ингибирования гидролиза синтезированного субстрата (S-2238).S-2238 (Kabi) растворяли в Трис-НСlбуфере (рН 8,3) для получения раствора S-2238 при концентрации 80 мкМ в 0,4 М Трис-НСl. К 175 мкл этого раствора добавляли 515 мкл водного раствора соединения данного изобретения и смесь инкубировали при 37 С в течение 1 мин и затем к смеси добавляли 10 мкл раствора 4,4 Е/мл бычьего тромбина (Mochida). Скорость реакции гидролиза определяли детектированием изменения поглощения при 405 нм при 37 С. Концентрацию ингибитора (соединения данного изобретения), которая давала 1/2 величины поглощения пробы без ингибитора, определяли как I50 (мкМ).ii) Способ измерения ингибирования коагуляции плазмы крыс. Соединение данного изобретения растворяли в воде или физиологическом солевом растворе в общем объеме 0,1 мл и затем к раствору добавляли 0,1 мл плазмы крысы и смесь инкубировали при 37 С в течение 30 с. К реакционной смеси добавляли 0,1 мл раствора 8 Е/мл бычьего тромбина (Mochida) и время коагуляции измеряли при 37 С. Концентрацию ингибитора (соединения данного изобретения), которая удваивала время свертывания (коагуляции) пробы без ингибитора, определяли как I50 (мкМ).iii) Способ измерения антитромботической активности в плазме крысы после перорального введения. 30 мг/кг соединения данного изобретения вводили перорально в виде водного раствора или суспензии крысам, голодавшим в течение ночи, при помощи ротовой трубки. После 1 и 3 ч брали 2 мл крови из брюшной большой вены и антитромботическую активность в плазме измеряли по способу, описанному выше в ii). Величины сравнивали с результатом, полученным с использованием крови крысы, которой не вводили ингибитор (соединение данного изобретения), и пролонгирующие действия на время свертывания были представлены как относительные величины, представляющие скорости пролонгирования тромбинового времени в расчете на контроль, взятый за 1. Тест-пример 2. Измерение антитрипсиновой активности.i) Способ измерения ингибирования гидролиза синтезированного субстрата (S-2222).S-2222 (Kabi) растворяли в Трис-НСlбуфере (рН 8,3) для получения раствора S-2222 при концентрации 400 мкМ в 0,4 М Трис-HCl. К 175 мкл этого раствора добавляли 515 мкл водного раствора соединения данного изобретения и смесь инкубировали при 37 С в течение 1 мин. Затем к смеси добавляли 10 мкл раствора 1 или 2 мг/мл бычьего трипсина (Sigma). Скорость реакции гидролиза субстрата определяли детектированием изменения поглощения при 405 нм при 37 С. Концентрацию ингибитора(соединения данного изобретения), которая давала 1,2 величины поглощения пробы без ингибитора, определяли как I50 (мкМ). Таблица 2 Тромбиновое время коэффициент пролонгирования при пероральном введении 43 Промышленная применимость Производные пеницилламинамида данного изобретения и их соли обладают сильной ингибирующей активностью против тромбина и превосходной пероральной доступностью (всасываемостью). Таким образом, они применимы в качестве перорально доступных антитромботических средств, то есть, антикоагулянтов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представленное следующей общей формулой (I), или его соль, или его гидрат и его сольват:R1 обозначает C1-С 10-алкильную группу,которая может быть замещена С 3-С 10 циклоалкильной группой или карбоксильной группой, С 6-С 10-арильную группу, которая может быть замещенной, С 3-С 10-циклоалкильную группу, которая может быть замещенной, или С 7-С 12-аралкильную группу, которая может быть замещенной;R2 обозначает атом водорода, C1-С 10 алкильную группу, С 7-С 12-аралкильную группу,которая может быть замещенной, -COR4 (где R4 обозначает атом водорода, C1-С 10-алкильную группу, C1-C10-алкоксигруппу, С 6-С 10-арильную группу, которая может быть замещенной, С 6 С 10-арилоксигруппу, которая может быть замещенной, С 3-С 10-циклоалкильную группу, которая может быть замещенной, С 3-С 10-циклоалкилоксигруппу, которая может быть замещенной, С 7-С 12-аралкильную группу, которая может быть замещенной,или С 7-С 12 аралкилоксигруппу), или -SO2R5 (где R5 обозначает C1-С 10-алкильную группу, С 6-С 10-арильную группу, которая может быть замещенной, С 3 С 10-циклоалкильную группу, которая может быть замещенной, или С 7-С 12-аралкильную группу, которая может быть замещенной), иR3 обозначает аминогруппу или амидиногруппу, при условии, что исключены следующие соединения: соединение, где R1 обозначает метильную группу, R2 обозначает этоксикарбонильную группу, R3 обозначает аминогруппу и n равно 1; соединение, где R1 обозначает метильную группу, R2 обозначает метилсульфонильную группу, R3 обозначает аминогруппу и n равно 1; соединение, где R1 обозначает этильную группу, R2 обозначает метилсульфонильную группу, R3 обозначает аминогруппу и n равно 1; соединение, где R1 обозначает изопропильную группу, R2 обозначает этоксикарбо 000966 44 нильную группу, R3 обозначает амидиногруппу и n равно 1. 2. Соединение, или его соль, или его гидрат, или сольват по п.1, где функциональная группа, которая может быть заместителем на вышеуказанных группах, выбрана из группы,состоящей из C1-С 6-алкильной группы, C1-C6 галогеналкильной группы, C1-C6-алкоксигруппы, гидроксильной группы, карбоксильной группы, С 2-С 7-карбоксиалкильной группы, С 2 С 7-карбоксиалкилоксигруппы, С 2-С 7-ацильной группы, С 2-С 7-ацилоксигруппы, С 2-С 7-алкоксикарбонильной группы, С 2-С 7-алкоксикарбонилоксигруппы, С 8-С 10-аралкилоксикарбонильной группы, С 7-С 9-алкоксикарбонилалкоксигруппы и атома галогена. 3. Соединение, или его соль, или его гидрат, или сольват по п.1, где R1 обозначает С 4 С 10-алкильную группу, С 6-С 10-арильную группу,которая может быть замещенной, С 3-С 10 циклоалкильную группу, которая может быть замещенной, или С 7-С 12-аралкильную группу,которая может быть замещенной, и R3 обозначает амидиногруппу. 4. Соединение, или его соль, или его гидрат, или сольват по п.1, где R3 обозначает аминогруппу. 5. Соединение, или его соль, или его гидрат, или сольват по п.1, где R2 обозначает атом водорода, C1-С 10-алкильную группу, С 7-С 12 аралкильную группу, которая может быть замещенной, или -COR4, где R4 имеет указанные выше значения. 6. Соединение, или его соль, или его гидрат, или сольват по п.1, где R2 обозначает-COR4, где R4 обозначает C1-C10-алкильную группу, C1-С 10-алкоксигруппу, С 6-С 10-арильную группу, которая может быть замещенной, С 6 С 10-арилоксигруппу, которая может быть замещенной, С 3-С 10-циклоалкильную группу, которая может быть замещенной,С 3-С 10 циклоалкилоксигруппу, которая может быть замещенной, С 7-С 12-аралкильную группу, которая может быть замещенной, или С 7-С 12 аралкилоксигруппу, которая может быть замещенной. 7. Соединение по п.1, представляющее собой транс-4-амино-[(S)-N-[(S)-2-пропоксикарбониламино-3-изопропилтио-3-метилбутаноил] пролил]аминометилциклогексан, или его соль,или гидрат, или сольват. 8. Соединение по п.1, представляющее собой транс-4-амино-[(S)-N-[(S)-2-этоксикарбониламино-3-изопропилтио-3-метилбутаноил] пролил]аминометилциклогексан, или его соль,или гидрат, или сольват. 9. Фармацевтическая композиция, содержащая эффективное количество соединения по любому из пп.1-8, или его соли, или гидрата,или сольвата, вместе с фармацевтически приемлемой добавкой. 10. Применение фармацевтической композиции по п.10 в качестве антикоагулянта. 11. Применение производного пеницилламинамида, представленного следующей общей формулой (I), или его соли, или гидрата, или сольватаR1 обозначает C1-С 10-алкильную группу,которая может замещена С 3-С 10 циклоалкильной группой или карбоксильной группой, С 6-С 10-арильную группу, которая может быть замещенной, С 3-С 10-циклоалкильную группу, которая может быть замещенной, или С 7-С 12-аралкильную группу, которая может быть замещенной;R2 обозначает атом водорода, C1-С 10 алкильную группу, С 7-С 12-аралкильную группу,которая может быть замещенной, -COR4 (где R4 обозначает атом водорода, C1-С 10-алкильную группу, C1-С 10-алкоксигруппу, С 6-С 10-арильную группу, которая может быть замещенной, C6C10-арилоксигруппу, которая может быть замещенной, С 3-С 10-циклоалкильную группу, которая может быть замещенной,С 3-С 10 циклоалкилоксигруппу, которая может быть 46 замещенной, С 7-С 12-аралкильную группу, которая может быть замещенной, или С 7-С 12 аралкилоксигруппу), или -SO2R5 (где R5 обозначает C1-С 10 алкильную группу, С 6-С 10-арильную группу, которая может быть замещенной, С 3 С 10-циклоалкильную группу, которая может быть замещенной, или С 7-С 12-аралкильную группу, которая может быть замещенной), иR3 обозначает аминогруппу или амидиногруппу, при условии, что исключены следующие соединения: соединение, в котором R1 обозначает метильную группу, R2 обозначает этоксикарбонильную группу, R3 обозначает аминогруппу и n обозначает 1; соединение, в котором R1 обозначает метильную группу, R2 обозначает метилсульфонильную группу, R3 обозначает аминогруппу и n обозначает 1; соединение, в котором R1 обозначает этильную группу, R2 обозначает метилсульфонильную группу, R3 обозначает аминогруппу и n обозначает 1; соединение, в котором R1 обозначает изопропильную группу, R2 обозначает этоксикарбонильную группу, R3 обозначает амидиногруппу и n обозначает 1, в качестве ингибитора протеазы. 12. Применение по п.11 в качестве антикоагулянта. 13. Применение по п.11 для ингибирования тромбина.
МПК / Метки
МПК: A61P 7/02, A61K 31/401, C07D 207/16
Метки: производные, пеницилламинамида
Код ссылки
<a href="https://eas.patents.su/24-966-proizvodnye-penicillaminamida.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пеницилламинамида.</a>
Предыдущий патент: Новые норпрегнаны для стимуляции гипоталамических эффектов.
Следующий патент: Ингибитор протеинкиназы с.
Случайный патент: Способ удаления целевого газа из смеси газов с помощью адсорбции за счет термического перепада