Соединения, усиливающие активность ретиноидов.
Формула / Реферат
1. Соединение, представленное следующей общей формулой (I)
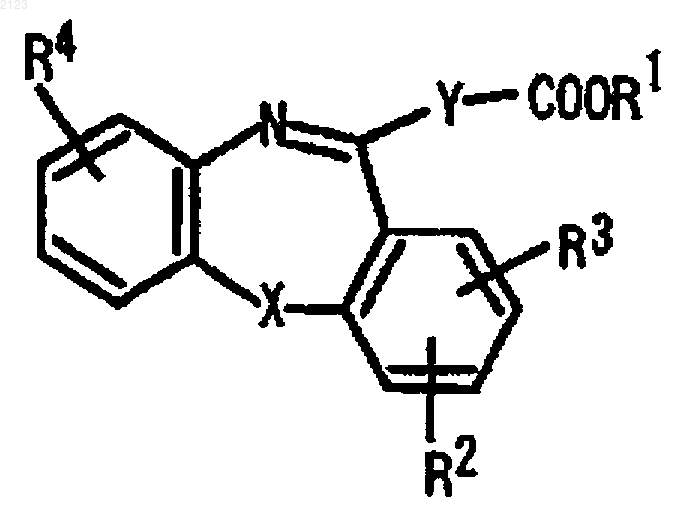
или его соли;
где R1 представляет атом водорода или C1-6 алкильную группу; R2 и R3 независимо представляют атом водорода или C1-6 алкильную группу, или R2 и R3 могут быть объединены вместе с углеродными атомами фенильного кольца, к которым R2 и R3 присоединены, с образованием 5- или 6-членной циклоалкильной группы, которая может быть необязательно замещена одной или несколькими C1-4 алкильными группами; R4 представляет атом водорода, C1-6 алкильную группу, C1-6 алкоксигруппу, гидроксильную группу, нитрогруппу или атом галогена; Х представляет -NR7-, -О-, -CHR7- или -S-, где R7 представляет атом водорода, C1-6 алкильную группу или арилзамещенную C1-6 алкильную группу; и Y представляет фениленовую группу или пиридиндиильную группу.
2. Соединение по п.1, которое выбрано из группы, состоящей из следующих соединений, или его соль:
4-[5Н-2,3-(2,5-диметил-2,5-гексано)-5-метилдибензо[b,е]-[1,4]диазепин-11-ил]бензойная кислота (НХ600);
4-[5Н-2,3-диизопропил-5-метилдибензо[b,е][1,4]диазепин-11-ил]бензойная кислота (НХ610);
4-[5Н-2-трет-бутил-5-метилдибензо[b,е][1,4]-диазепин-11-ил]бензойная кислота (НХ511);
4-[5Н-3,4-(1,4-бутано)-5-метилдибензо[b,е][1,4]диазепин-11-ил]бензойная кислота (НХ545);
4-[5Н-2,3-(2,5-диметил-2,5-гексано)-5-метил-8-нитродибензо-[b,е][1,4]диазепин-11-ил]бензойная кислота (НХ531);
4-[2,3-(2,5-диметил-2,5-гексано)дибензо[b,f][1,4]оксазепин-11-ил]бензойная кислота (НХ620);
4-[2,3-(2,5-диметил-2,5-гексано)дибензо[b,f][1,4]тиазепин-11-ил]бензойная кислота (НХ630);
5-[5Н-2,3-(2,5-диметил-2,5-гексано)-5-метилдибензо[b,е]-[1,4]диазепин-11-ил]-2-пиридинкарбоновая кислота;
6-[5Н-2,3-(2,5-диметил-2,5-гексано)-5-метилдибензо[b,е]-[1,4]диазепин-11-ил]-3-пиридинкарбоновая кислота и
4-[2,3-(2,5-диметил-2,5-гексано)дибензо[b,е]азепин-11-ил]бензойная кислота (НХ640).
3. Лекарственное средство, содержащее соединение или его физиологически приемлемую соль по п. 1.
4. Лекарственное средство по п.3, где указанное лекарственное средство находится в виде фармацевтической композиции, содержащей соединение или его физиологически приемлемую соль по п.1 вместе с одной или несколькими фармацевтическими добавками.
5. Лекарственное средство по п.3, обладающее способностью усиливать активность физиологически активного вещества, оказывающего влияние на физиологическую активность путем связывания с внутриядерным рецептором, принадлежащим надсемейству внутриядерных рецепторов.
6. Лекарственное средство по п.5, где физиологически активным веществом является ретиноидное соединение.
7. Фармацевтическая композиция, содержащая соединение по п.1 или его физиологически приемлемую соль вместе с ретиноидным соединением.
8. Способ усиления активности физиологически активного вещества, оказывающего влияние на физиологическую активность путем связывания с внутриядерным рецептором, принадлежащим надсемейству внутриядерных рецепторов, который включает стадию введения соединения по п.1 или его физиологически приемлемой соли млекопитающему.
9. Способ по п.8, где физиологически активным веществом является ретиноидное соединение.
10. Способ по п.8, где физиологически активным веществом является ретиноевая кислота, изначально присутствующая в живом организме указанного млекопитающего.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениям, которые усиливают физиологическую активность лигандов по отношению к внутриядерным рецепторам и типичными примерами которых являются ретиноевая кислота и соединения (ретиноиды), обладающие активностями, подобными тем, которыми обладает ретиноевая кислота. Предпосылки создания изобретения Ретиноевая кислота (кислотная форма витамина А), активный метаболит витамина А,имеет очень важные физиологические функции,например, индуцирования дифференцировки незрелых клеток в процессе развития до зрелых клеток, имеющих специфические функции, усиления роста клеток и обеспечения жизнедеятельности. Уже известно, что различные производные витамина А, синтезированные до настоящего времени, также обладают аналогичными физиологическими функциями, например,производные бензойной кислоты, раскрытые в нерассмотренной японской патентной публикации (KOKAI)(Sho)61-22047/1986 и(Sho)61-76440/1986, и соединения, описанные в Журнале медицинской химии (Journal of Medicinal Chemistry), 1988, том 31,11, стр. 2182."Ретиноиды" - общий термин для ретиноевой кислоты и вышеупомянутых соединений, обладающих биологическими активностями, подобными тем, которыми обладает ретиноевая кислота. Например, доказано, что полностью трансретиноевая кислота связывается в виде лиганда к присутствующему в ядрах клеток рецептору ретиноевой кислоты (RAR), который относится к надсемейству внутриядерных рецепторов (Evans, P.M., Science, 240, стр. 889, 1988), и регулирует рост и дифференцировку клеток животных или гибель клеток (Petkovich, М., et al., Nature,330, страницы 444-450, 1987). Была также высказана мысль, что вышеуказанные соединения,обладающие биологическими активностями,подобными тем, которыми обладает ретиноевая кислота,например,4-[(5,6,7,8-тетрагидро 5,5,8,8-тетраметил-2-нафталинил)карбамоил]бензойная кислота, Аm80, также связываются сRAR подобно ретиноевой кислоте, проявляя физиологические действия (см. Hashimoto, Y.,Cell Struct. Funct., 16, стр. 113-123, 1991; Hashimoto, Y., et al., Biochem. Biophys. Res. Commun.,166, стр. 1300-1307, 1990). Клинически было установлено, что эти соединения полезны для терапевтического и профилактического лечения заболевания, связанного с недостаточностью витамина А, гиперкератоза эпителиальной ткани, ревматизма, аллергической реакции замедленного типа, заболевания костей, лейкоза и некоторых типов рака. Известны соединения, которые являются антагонистами указанных ретиноидов и ослаб 002123 2 ляют первичное действие ретиноида (Eyrolles,L., et al., Journal of Medicinal Chemistry, 37(10),стр. 1508-1517, 1994). Однако не известно никакое соединение, отличное от раскрытых в ЕР 694301 A1, которое бы усиливало действие ретиноидов, таких как ретиноевая кислота, хотя само по себе не обладало ретиноидным действием или его ретиноидное действие было бы незначительным. В данном описании предложена идея, что лигандное соединение, специфическое к RXR-рецептору, обладает усиливающей активностью по отношению к Am80, т.е. лигандному соединению, специфическому к RAR-рецептору. Описание сущности изобретения Задачей настоящего изобретения является создание соединений, обладающих усиливающими активностями по отношению к действиям ретиноидов, таких как ретиноевая кислота. В частности, целью настоящего изобретения является разработка соединений, которые могли бы заметно усиливать действие ретиноидов, таких как ретиноевая кислота, но сами по себе не обладали бы ретиноидным действием или их ретиноидное действие было бы очень слабым. Для решения указанной задачи данные изобретатели провели различные исследования и в результате нашли, что соединения, представленные общей формулой, приведенной ниже, усиливают действие ретиноидов, таких как ретиноевая кислота. На основе этих обнаружений и было создано настоящее изобретение. Таким образом, в соответствии с настоящим изобретением предлагаются соединения,представленные следующей общей формулой (I) или их соли где R1 представляет атом водорода или C1-6 алкильную группу;R2 и R3 независимо представляют атом водорода или C1-6 алкильную группу, или R2 и R3 могут быть объединены вместе с углеродными атомами фенильного кольца, к которым R2 и R3 присоединены, с образованием 5- или 6-членной циклоалкильной группы, которая может быть необязательно замещена одной или несколькими C1-4 алкильными группами; R4 представляет атом водорода, C1-6 алкильную группу, C1-6 алкоксигруппу, гидроксильную группу, нитрогруппу или атом галогена; Х представляет -NR7-, -О-, -CHR7- или -S-,где R7 представляет атом водорода, C1-6 алкильную группу или арилзaмещенную C1-6 алкильную группу; и Y представляет фениленовую группу или пиридиндиильную группу. 3 Кроме того, в соответствии с другими вариантами осуществления настоящего изобретения предлагаются лекарственное средство, содержащее указанные соединения, и средство,усиливающее действия ретиноида, и средство,усиливающее действия лигандов к внутриядерным рецепторам, причем указанные средства содержат вышеуказанные соединения. Наиболее предпочтительные варианты осуществления изобретения В приведенной выше общей формуле (I) R1 представляет атом водорода или неразветвленную или разветвленную C1-6 (т.е. имеющую 1-6 углеродных атомов) алкильную группу. Примеры алкильной группы включают, например, метильную группу, этильную группу, нпропильную группу, изопропильную группу, нбутильную группу, втор-бутильную группу и трет-бутильную группу, причем предпочтительно используют метильную группу.R2 и R3 независимо представляют атом водорода или неразветвленную или разветвленную C1-6 алкильную группу. Что касается алкильной группы, то можно использовать алкильные группы, указанные выше, причем предпочтительно используют этильную группу,изопропильную группу, трет-бутильную группу или тому подобное. Положения замещения R2 иR3 особо не ограничиваются и каждый из них может независимо замещать по любому положению. Однако является предпочтительным,чтобы R2 и R3 находились, соответственно, в пара-положении и мета-положении или в метаположении и орто-положении по отношению кR2 и R3 могут быть объединены с образованием 5- или 6-членной циклоалкильной группы вместе с углеродными атомами фенильного кольца, к которым R2 и R3, соответственно, присоединены. Циклоалкильное кольцо может иметь одну или несколько C1-4 алкильных групп. Например, кольцо может иметь от двух до четырех метильных групп, предпочтительно четыре метильные группы. Является предпочтительным, чтобы, например, R2 и R3 вместе с фенильным кольцом, замещенным группами R2 иR4 представляет атом водорода, C1-6 алкильную группу, C1-6 алкоксигруппу, гидроксильную группу, нитрогруппу или атом галогена. В качество C1-6 алкильной группы можно использовать группы, указанные в качестве примера выше. В качестве С 1-6 алкоксигруппы можно использовать, например, метоксигруппу, этоксигруппу,н-пропоксигруппу,изопропоксигруппу,нбутоксигруппу, втор-бутоксигруппу или третбутоксигруппу, предпочтительно метоксигруппу. В качестве атома галогена можно использо 002123 4 вать любой из атомов фтора, хлора, брома или йода. Положение радикала R4 особенно не ограничивается, и он может быть заместителем в любом положении на фенильном кольце.R5 представляет атом водорода, C1-6 алкильную группу или арилзaмещенную C1-6 алкильную группу. C1-6 алкильная группа может быть неразветвленной или разветвленной и в качестве нее можно предпочтительно использовать алкильные группы, указанные выше. Примеры арильного фрагмента арилзамещенной C1-6 алкильной группы включают, например, фенильную, нафтильную или пиридильную группу, а C1-6 алкильный фрагмент может быть неразветвленным или разветвленным. Например,можно использовать фенилзамещенную C1-6 алкильную группу, такую как бензильная группа или фенетильная группа, нафтилзaмещеннуюC1-6 алкильную группу, такую как нафтилметильная группа, пиридилзaмещенную C1-6 алкильную группу, такую как пиридилметильная группа, и тому подобное. Арильная группа, являющаяся частью указанных арилзамещенных C1-6 алкильных групп,может иметь один или несколько заместителей. Например, в качестве заместителя можно использовать атом галогена, такой как атом фтора или атом хлора, C1-6 алкильную группу, такую как метильная группа или этильная группа, неразветвленную или разветвленную C1-6 алкоксигруппу, такую как метоксигруппа или этоксигруппа, нитрогруппу, неразветвленную или разветвленную галогенированную C1-6 алкильную группу, такую как трифторметильная группа,гидроксильную группу, карбоксильную группу,C1-6 алкоксикарбонильную группу, такую как метоксикарбонильная группа или этоксикарбонильная группа, или тому подобное. R6 представляет атом водорода или C1-6 алкильную группу. C1-6 алкильная группа может быть неразветвленной или разветвленной и в качестве таковой можно предпочтительно использовать алкильные группы, описанные выше. Особенно предпочтительными соединениями являются соединения, в которых и R5, и R6 представляют атомы водорода, и соединения, в которых R5 представляет C1-6 алкильную группу или арилзaмещенную C1-6 алкильную группу, и R6 представляет атом водорода. Х представляет атом азота, замещенный радикалом R7(-NR7-), атом кислорода (-O-), метиленовую группу , замещенную радикалом R7(CHR7-), или атом серы (-S-). R7 представляет атом водорода, C1-6 алкильную группу или арилзaмещенную C1-6 алкильную группу. C1-6 алкильная группа может быть неразветвленной или разветвленной и в качестве нее можно использовать алкильные группы, приведенные в качестве примера выше, например, метильную группу. В качестве арилзaмещенной C1-6 алкильной группы можно использовать группы, описанные в качестве примера выше, предпочтительно бен 5 зильную группу. Атом азота и атом серы могут находиться в форме N-оксида и сульфоксида,соответственно. Из них Х предпочтительно представляет атом азота, замещенный R7(NR7), а наиболее предпочтительно - атом азота, замещенный метильной группой, этильной группой,н-пропильной группой, изо-пропильной группой или бензильной группой.Y представляет фениленовую группу или пиридиндиильную группу. Например, можно использовать любую из фениленовых или пиридиндиильных групп, таких как п-фениленовая группа, м-фениленовая группа, о-фениленовая группа, пиридин-2,4-диильная группа, пиридин 2,5-диильная группа или пиридин-3,5-диильная группа. Предпочтительно можно использовать п-фениленовую группу, м-фениленовую группу или пиридин-2,5-диильную группу. При использовании пиридин-2,5-диильной группы группа COOR1 может быть заместителем либо в положении 2, либо в положении 5 пиридинового кольца. В ряд соединений по настоящему изобретению входят кислотно-аддитивные и основноаддитивные соли. Примеры кислотноаддитивных солей включают соли минеральных кислот, такие как гидрохлорид или гидробромид, соли органических кислот, такие как птолуолсульфонат, метансульфонат, оксалат или тартрат. Основно-аддитивные соли могут быть образованы в случае, когда R1 представляет атом водорода. Могут быть, например, использованы соли металлов, такие как, например, натриевая, калиевая, магниевая или кальциевая соли, аммонийные соли или соли органическиx аминов, такие как, например, соль триэтиламина или соль этаноламина. Кроме того, соединения формулы (I) по настоящему изобретению могут иметь один или несколько дополнительных асимметрических углеродных атомов, зависящих от типов Х и других заместителей. Всякие оптические изомеры на основе асимметрического(их) углеродного(ых) атома(ов), всякая смесь оптических изомеров, рацематы, диастереомеры на основе двух или нескольких асимметрических атомов углерода, смеси диастереомеров и тому подобное находятся в объеме настоящего изобретения. Следует также понимать, что любые гидраты или сольваты соединений в свободных формах или гидраты или сольваты соединений в форме солей также входят в объем настоящего изобретения. Ниже представлены схемы примерных способов получения соединений НХ 600, НХ 610,НХ 511, НХ 531 и НХ 545, являющихся предпочтительными соединениями формулы (I) по настоящему изобретению. Однако соединения по настоящему изобретению и способы их получения не ограничиваются теми, что показаны на схемах. Способы получения соединений по настоящему изобре 002123 6 тению в соответствии с показанными ниже схемами дополнительно подробно проиллюстрированы представленными в описании примерами. Таким образом, можно легко понять, что любые соединения, входящие в объем настоящего изобретения, могут быть получены путем соответствующего изменения исходных материалов,реагентов, условий реакции и тому подобного,которые раскрыты в указанных примерных способах. Соединения по настоящему изобретению сами по себе, по существу, не обладают такой,как у ретиноидов, активностью или обладают незначительной или умеренной такой активностью. Однако, когда соединения по настоящему изобретению получают возможность сосуществовать с ретиноидом, таким как ретиноевая кислота, физиологические активности ретиноида(типичные примеры включают активность в отношении дифференцировки клеток, активность в отношении усиления роста клеток, активность по поддержанию жизнедеятельности и тому подобное) заметно усиливаются. Хотя это и не связано ни с какой конкретной теорией, соединения по настоящему изобретению, обладающие ретиноидным действием, обеспечивают синергическое действие. Таким образом, при введении ретиноевой кислоты или вышеуказанных соединений, обладающих биологическими активностями, как у ретиноевой кислоты (например, 4-[(5,6,7,8-тетрагидро 5,5,8,8-тетраметил-2-нафталинил)карбамоил]бензойной кислоты: Am80), в качестве лекарственных средств для профилактического или терапевтического лечения заболевания, связанного с недостаточностью витамина А, гиперкератоза эпителиальной ткани, псориаза, аллергических заболеваний, иммунологических заболеваний, таких как ревматизм, заболеваний костей,лейкоза или злокачественных опухолей, соединения по настоящему изобретению могут быть использованы в качестве средств, усиливающих активности ретиноидов. В случае, когда ретиноиды не вводят для профилактического или терапевтического лечения вышеуказанных заболеваний, соединения по настоящему изобретению могут усиливать активности ретиноевой кислоты, врожднно присутствующей в живых организмах, и потому соединения по настоящему изобретению сами по себе могут быть введены с целью профилактического и терапевтического лечения вышеуказанных заболеваний. Кроме того, соединения по настоящему изобретению можно использовать не только для усиления действия ретиноидов, но и для усиления активностей физиологически активных веществ, таких как, например,стероидные соединения, соединения витаминаD, такие как витамин D3, тироксин и тому подобное, которые связываются с рецепторами,принадлежащие к надсемейству внутриядерных рецепторов, существующих в ядрах клеток для оказания влияния на физиологические активности (Evans, H.M., Science, 240, стр. 889, 1988). Соединения по настоящему изобретению,как таковые, могут быть введены в виде содержащих их лекарственных средств. Однако является предпочтительным пероральное или парентеральное введение фармацевтических композиций, которые могут быть получены способами, хорошо известными специалистам в данной области техники. Соединения могут быть добавлены к лекарственным средствам, содержащим ретиноид, такой как ретиноевая кислота, в качестве активного компонента, и использованы как фармацевтические композиции в форме так называемых комбинированных препаратов. Примеры фармацевтических композиций, пригодных для перорального введения, включают,например, таблетки, капсулы, порошки, мелкозернистые гранулы, гранулы, жидкости, сиропы и тому подобное. Примеры фармацевтических композиций, пригодных для парентерального введения, включают, например, растворы для инъекций, суппозитории, лекарственные формы для ингаляции, глазные капли, капли в нос, мази, кремы, пластыри и тому подобное. Указанные фармацевтические композиции могут быть приготовлены путем введения фармакологически и фармацевтически приемлемых добавок. Примеры фармакологически и фармацевтически приемлемых добавок включают,например, наполнители, разрыхлители и вспомогательные разрыхляющие вещества, связывающие вещества, смазывающие вещества, вещества для покрытия, красители, разбавители,основы, растворяющие вещества и вспомогательные растворяющие вещества, изотонические вещества, модификаторы рН, стабилизаторы, газы-вытеснители, клеющие вещества и тому подобное. Дозы лекарственного средства по настоящему изобретению особо не ограничивают и можно легко подобрать подходящие дозы для всяких типов введения, например, когда усиливают действия ретиноида путем использования лекарственного средства по настоящему изобретению в сочетании с лекарственным средством, содержащим ретиноид, такой как ретиноевая кислота, в качестве активного компонента, или когда лекарственное средство по настоящему изобретению вводят для усиления действий ретиноевой кислоты, врожднно присутствующей в живом организме, без использования в сочетании с ним лекарственного средства, содержащего ретиноид. Например, для перорального введения лекарственное средство можно использовать при дозе 0,01-1000 мг в сутки для взрослой особи. При использовании лекарственного средства по настоящему изобретению в сочетании с лекарственным средством, 9 содержащим ретиноид в качестве активного компонента, лекарственное средство по настоящему изобретению можно вводить в любые периоды времени, т.е. во время введения ретиноида или до или после его введения. Примеры Более конкретное пояснение настоящего изобретения проводится на следующих далее примерах. Но эти примеры не ограничивают объем настоящего изобретения. Номера соединений в примерах соответствуют номерам соединений в показанных выше схемах. Пример 1. Получение 4-[5 Н-2,3-(2,5 диметил-2,5-гексано)-5-метилдибензо[b,е][1,4]диазепин-11-ил]бензойной кислоты (НХ 600). К 6-бром-1,2,3,4-тетрагидро-1,1,4,4-тетраметилнафталину (2,30 г, 8,61 ммоль), онитроанилину (4,30 г, 31,2 ммоль), К 2 СО 3 (4,30 г, 31,2 ммоль) и CuI (347 мг) прибавляли ксилол(40 мл) и смесь нагревали с обратным холодильником в течение 24 ч. Выпаривали при пониженном давлении ксилол и остаток очищали путем колоночной хроматографии на силикагеле (AcOEt:H-гексан=1:50). Продукт перекристаллизовывали из гексана с получением соединения 1 (2,33 г, 84%). 1H-ЯМР CDCl3: 9,49 (с, 1 Н), 8,20 (дд, 1 Н,8,4 Гц, 1,5 Гц), 7,33 (д, 2 Н, 8,4 Гц), 7,20 (дд, 1 Н,8,8 Гц, 1,1 Гц), 7,18 (д, 1 Н, 2,2 Гц), 7,04 (дд, 1 Н,8,4 Гц, 2,2 Гц), 6,73 (м, 1 Н), 1,71 (с, 4 Н), 1,30 (с,6 Н), 1,28 (с, 6 Н) Основание NaH (60% в масле, 246 мг, 6,16 ммоль, 1,5 экв) промывали н-гексаном и сушили. Прибавляли к основанию соединение 1 (1,33 г, 4,10 ммоль), растворенное в ДМФ (30 мл) и смесь перемешивали при комнатной температуре в течение 30 мин. К этой смеси прибавляли СН 3I (0,51 мл, 8,20 ммоль) и перемешивали ее 3 ч. Реакционную смесь вливали в ледяную воду и экстрагировали дихлорметаном, после чего органический слой промывали водой и насыщенным рассолом и сушили. Выпаривали при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (AcOEt:н-гексан=1:40) с получением соединения 2 (1,39 г, 100%). 1H-ЯМР CDCl3: 7,81 (дд, 1 Н, 8,1 Гц, 1,5 Гц), 7,53 (м, 1 Н), 7,34 (дд, 1 Н, 8,1 Гц, 1,5 Гц),7,19 (м, 1 Н), 7,14 (д, 1 Н, 8,4 Гц), 6,67 (д, 1 Н, 2,6 Гц), 6,61 (дд, 1 Н, 8,4 Гц, 2,6 Гц), 3,29 (с, 3 Н),1,63 (с, 4 Н), 1,23 (с, 6 Н), 1,18 (с, 6 Н) Соединение 2 (1,41 г, 4,17 ммоль) суспендировали в воде (20 мл) и этаноле (40 мл) и к суспензии прибавляли концентрированную хлороводородную кислоту (6,0 мл). К смеси прибавляли железный порошок (2,2 г) и нагревали ее с обратным холодильником в течение 30 мин. Реакционную смесь фильтровали для удаления твердого железного порошка и фильтрат экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и затем сушили. Выпаривали при пониженном(м, 2 Н), 6,81 (дд, 1 Н, 8,1 Гц, 1,5 Гц), 6,75 (м,1 Н), 6,61 (д, 1 Н, 2,6 Гц), 6,44 (дд, 1 Н, 8,4 Гц, 2,6 Гц), 3,82 (шир.с, 2 Н) , 3,18 (с, 3 Н), 1,65 (с, 4 Н),1,23 (с, 6 Н), 1,23 (с, 6 Н) Соединение 3 (1,25 г, 4,06 ммоль) растворяли в высушенном бензоле (25 мл) и к раствору прибавляли пиридин (0,5 мл). К смеси прибавляли хлорид монометилового эфира терефталевой кислоты (966 мг, 4,87 ммоль) и перемешивали при комнатной температуре в течение 18 ч. К реакционной смеси прибавляли ледяную воду и разбавленную хлороводородную кислоту и экстрагировали смесь этилацетатом. Органический слой сушили и выпаривали при пониженном давлении растворитель с получением неочищенного продукта (2,10 г). Продукт очищали путем колоночной хроматографииH-ЯМР CDCl3: 8,57 (дд, 1 Н, 8,1 Гц, 1,5 Гц),8,45 (с, 1 Н), 7,99 (д, 2 Н, 8,8 Гц), 7,45 (д, 2 Н, 8,8 Гц), 7,32 (м, 1 Н), 7,18-7,26 (м, 2 Н), 6,68 (д, 1 Н,2,6 Гц), 6,60 (дд, 1 Н, 8,4 Гц, 2,6 Гц), 3,93 (с, 3 Н),3,31 (с, 3 Н), 1,62 (с, 4 Н), 1,24 (с, 6 Н), 1,16 (с, 6 Н) Соединение 4 (1,72 г, 3,65 ммоль) прибавляли к полифосфорной кислоте (15,8 г) и смесь перемешивали при 110 С в течение 2 ч 40 мин. Добавляли к реакционной смеси воду и экстрагировали ее дихлорметаном, после чего органический слой промывали насыщенным рассолом. Выпаривали при пониженном давлении растворитель и полученный остаток сушили и затем очищали путем колоночной хроматографии на силикагеле (AcOEt:н-гексан=1:30) с получением соединения по настоящему изобретению (соединение 5: метил 4-[5 Н-5-метил-7,8-(2,5 диметил-2,5-гексано)-дибензо[b,е]диазепин-10 ил]бензоат) (1,41 г, 86%). Т.пл. 238 С. 1(с, 3 Н), 1,04 (с, 3 Н) Анал. выч. для C30H32N2O2 C:79,61, H:7,13,N:6,19; найдено С:79,56, Н:7,27, N:6,12 Соединение 5 (43 мг, 0,095 ммоль) суспендировали в этаноле (4 мл) и 2 н. NaOH (1,5 мл) и полученную суспензию перемешивали при комнатной температуре в течение 1 ч 10 мин. Реакционную смесь доводили до рН 2, используя 2 н. НСl, и затем экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом и сушили, после чего выпаривали при пониженном давлении растворитель. Полученный остаток высушивали с получением соединения по настоящему изобретению: НХ 600 (соединение 6, 37,1 мг, 89%). Т.пл. 282 С.(с, 3 Н) МС М+ 438 Анал. выч. для С 29H30N2 О 2 С:79,42, Н:6,89,N:6,39; найдено С:79,12, Н:7,15, N:6,25 Пример 2. Получение 4-[5 Н-2,3-диизопропил-5-метилдибензо-[b,е][1,4]диазепин-11 ил]бензойной кислоты (НХ 610). К 3,4-диизопропиланилину (107 мг, 0,60 ммоль), о-йоднитробензолу (180 мг, 0,72 ммоль), К 2 СО 3 (83 мг, 0,60 ммоль) и CuI (34 мг) прибавляли ксилол (5 мл) и смесь нагревали с обратным холодильником в течение 18 ч. Выпаривали при пониженном давлении ксилол и остаток очищали путем колоночной хроматографии на силикагеле (AcOEt:н-гексан=1:50) с получением соединения 7 (59 мг, 33%). 1H-ЯМР CDCl3: 9,50 (с, 1 Н), 8,20 (дд, 1 Н,8,4 Гц, 1,5 Гц), 7,40 (м, 1 Н), 7,29 (д, 1 Н, 8,1 Гц),7,20 (дд, 1 Н, 8,8 Гц, 1,1 Гц), 7,13 (д, 1 Н, 2,2 Гц),7,08 (дд, 1 Н, 8,4 Гц, 2,2 Гц), 6,73 (м, 1 Н), 3,27 (м,2 Н), 1,25 (м, 12 Н) Основание NaH (60% в масле, 16 мг, 0,40 ммоль, 2 экв) промывали н-гексаном и сушили. Прибавляли к основанию соединение 7 (58 мг,0,20 ммоль), растворенное в ДМФ (5 мл), и смесь перемешивали при комнатной температуре в течение 30 мин. К этой смеси прибавляли СН 3I (0,04 мл, 0,60 ммоль) и перемешивали ее 3 ч. Реакционную смесь вливали в ледяную воду и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом. После сушки выпаривали при пониженном давлении растворитель с получением соединения 8 (57 мг, 93%). 1H-ЯМР CDCl3: 7,81 (дд, 1 Н, 8,1 Гц, 1,5 Гц), 7,53 (м, 1 Н), 7,34 (дд, 1 Н, 8,1 Гц, 1,5 Гц),7,18 (м, 1 Н), 7,10 (д, 1 Н, 9,2 Гц), 6,62 (м, 2 Н),3,31 (с, 3 Н), 3,17 (септет, 2 Н), 1,19 (д, 6 Н, 7,0 Гц), 1,14 (д, 6 Н, 7,0 Гц). Соединение 8 (52,5 мг, 0,17 ммоль) суспендировали в воде (2 мл) и этаноле (4 мл) и к суспензии прибавляли концентрированную хлороводородную кислоту (0,5 мл). К смеси прибавляли железный порошок (200 мг) и нагревали ее с обратным холодильником в течение 30 мин. Реакционную смесь фильтровали для удаления твердого железного порошка и фильтрат экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и сушили. Затем выпаривали при пониженном давлении растворитель с получением соединения 9 (40,0 мг, 84%). 1 12 Соединение 9 (39 мг, 0,14 ммоль) растворяли в сухом бензоле (5 мл) и к раствору прибавляли пиридин (0,1 мл). К смеси прибавляли хлорид монометилового эфира терефталевой кислоты (36 мг, 0,18 ммоль) и перемешивали при комнатной температуре в течение 3 ч. К реакционной смеси прибавляли ледяную воду и разбавленную хлороводородную кислоту и экстрагировали смесь этилацетатом. Органический слой сушили и выпаривали при пониженном давлении растворитель с получением неочищенного продукта (67,3 мг). Продукт очищали путем колоночной хроматографии (AcOEt:нгексан=1:20) с получением соединения 10 (44,4 мг, 71%). 1(д, 6 Н, 6,6 Гц), 1,13 (д, 6 Н, 7,0 Гц) Соединение 10 (44 мг, 0,10 ммоль) прибавляли к полифосфорной кислоте (1,2 г) и смесь перемешивали при 120 С в течение 1 ч. Добавляли к реакционной смеси воду и экстрагировали ее дихлорметаном. Органический слой промывали насыщенным рассолом и сушили, после чего выпаривали при пониженном давлении растворитель. Полученный остаток сушили и затем очищали путем колоночной хроматографии на силикагеле (AcOEt:н-гексан=1:30) с получением соединения по настоящему изобретению (соединение 11: метил 4-[5 Н-5-метил-7,8 диизопропилдибензо[b,е]диазепин-10-ил]бензоат) (19,2 мг, 45%). 1(с, 1 Н), 3,95 (с, 3 Н), 3,27 (с, 3 Н), 3,23 (м, 1 Н),3,13 (м, 1 Н), 1,28 (д, 3 Н, 6,6 Гц), 1,26 (д, 3 Н, 7,0 Гц), 1,08 (д, 3 Н, 7,0 Гц), 1,01 (д, 3 Н, 7,0 Гц) Соединение 11 (18 мг, 0,043 ммоль) суспендировали в этаноле (2 мл) и 2 н. NaOH (1 мл) и полученную суспензию перемешивали при комнатной температуре в течение 40 мин. Реакционную смесь доводили до рН 2, используя 2 н. НСl, и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом, после чего выпаривали при пониженном давлении растворитель. Полученный остаток высушивали с получением соединения по настоящему изобретению: НХ 610 (соединение 12, 15,6 мг, 88%). Продукт перекристаллизовывали из смеси этанол-вода с получением очищенного соединения (10,5 мг), т.пл. 263 С. 1 13 Гц) Анал. выч. для C27H28N2O2 С: 78, 61, Н:6,84,N:6,79; найдено С:78,36, Н:6,92, N:6,67 Пример 3. Получение 4-[5 Н-2-трет-бутил 5-метилдибензо[b,e]-[1,4]диазепин-11-ил]бензойной кислоты (НХ 511). К о-йоднитробензолу (1,25 г, 5,0 ммоль) прибавляли 4-трет-бутиланилин (761 мг, 5,1 ммоль), К 2 СО 3 (697 мг, 5,1 ммоль), CuI (95 мг) и о-ксилол (10 мл) и смесь перемешивали при 150 С в течение 11 ч. Реакционную смесь очищали путем колоночной хроматографии на силикагеле (АсОЕt:н-гексан=1:40) с получением соединения 13 (529,1 мг, 39%). 1H-ЯМР CDCl3: 9,48 (с, 1 Н), 8,20 (дд, 1 Н,8,4 Гц, 1,5 Гц), 7,43 (д, 2 Н, 8,8 Гц), 7,35 (м, 1 Н),7,22 (м, 3 Н), 6,76 (м, 1 Н), 1,35 (с, 9 Н) Основание NaH (60% в масле, 73 мг, 1,82 ммоль) промывали гексаном и сушили. К NaH прибавляли ДМФ (1 мл) и к полученной суспензии прибавляли соединение 13 (241,7 мг, 0,895 ммоль), растворенное в ДМФ (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 мин, прибавляли метилиодид (0,18 мл, 2,78 ммоль, 3 экв) и перемешивали смесь 3 ч. Реакционную смесь вливали в ледяную воду и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом и сушили, после чего концентрировали при пониженном давлении с получением соединения 14 (245,3 мг, 97%). 1H-ЯМР CDCl3: 7,83 (дд, 1 Н, 8,1 Гц, 1,5 Гц), 7,57 (м, 1 Н), 7,36 (дд, 1 Н, 8,1 Гц, 1,5 Гц),7,22 (д, 2 Н, 8,8 Гц), 6,70 (д, 2 Н, 9,2 Гц), 3,29 (с,3 Н), 1,27 (с, 9 Н) К соединению 14 (240 мг, 0,845 ммоль) прибавляли воду (4 мл), этанол (8 мл), железный порошок (406 мг) и затем концентрированную хлороводородную кислоту (1,0 мл), после чего смесь нагревали с обратным холодильником в течение 20 мин. К реакционной смеси прибавляли этилацетат и фильтровали ее. Фильтрат промывали водой и насыщенным рассолом. Органический слой сушили и концентрировали при пониженном давлении с получением соединения 15 (184,6 мг, 86%). 1(м, 1 Н), 7,04 (дд, 1 Н, 8,1 Гц, 1,5 Гц), 6,82 (дд, 1 Н,7,7 Гц, 1,5 Гц), 6,77 (м, 1 Н), 6,61 (д, 2 Н, 8,8 Гц),3,83 (шир.с, 2 Н), 3,20 (с, 3 Н), 1,28 (с, 9 Н) Соединение 15 (174 мг, 0,685 ммоль) растворяли в сухом бензоле (7 мл) и к раствору прибавляли пиридин (0,1 мл, 1,25 ммоль). К смеси прибавляли хлорид монометилового эфира терефталевой кислоты (163 мг, 0,823 ммоль) и перемешивали при комнатной температуре в течение 2 ч 15 мин. К реакционной смеси прибавляли ледяную воду и разбавленную хлороводородную кислоту и экстрагировали смесь этилацетатом. Органический слой сушили и выпаривали при пониженном давлении растворитель с получением неочищенного продукта (320,1 мг). Продукт очищали путем колоночной хромато 002123(м, 1 Н), 7,28 (д, 2 Н, 8,8 Гц), 7,21 (м, 2 Н), 6,72 (д,2 Н, 8,8 Гц), 3,93 (с, 3 Н), 3,28 (с, 3 Н), 1,29 (с, 9 Н) Соединение 16 (202,6 мг, 0,487 ммоль) прибавляли к полифосфорной кислоте (2,5 г) и смесь перемешивали при 130 С в течение 2 ч. Прибавляли дополнительную полифосфорную кислоту (2,0 г) и продолжали перемешивание в течение 1 ч. К реакционной смеси прибавляли воду и экстрагировали смесь дихлорметаном. Органический слой концентрировали и сушили с получением неочищенного продукта (164,9 мг). Этот неочищенный продукт очищали путем колоночной хроматографии на силикагеле(AcOEt:н-гексан=1:401:20) и полученный очищенный продукт дополнительно очищали путем колоночной хроматографии на силикагеле (АсОЕt:н-гексан=1:20) с получением соединения 17 (22,0 мг, 11%). 1(с, 9 Н) К соединению 17 (20,1 мг, 0,05 ммоль) прибавляли 2 н. NaOH (1,0 мл) и этанол (2,0 мл) и смесь перемешивали в точение 3 ч 15 мин. Реакционную смесь подкисляли путем добавления 2 н. хлороводородной кислоты, и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом и сушили, после чего выпаривали при пониженном давлении растворитель. Полученный неочищенный продукт очищали путем колоночной хроматографии на силикагеле (дихлорметан:метанол=20:1) с получением соединения по настоящему изобретению: НХ 511 (соединение 18, 16,5 мг, 85%). Продукт перекристаллизовывали из смеси этанол-вода с получением очищенного соединения, т.пл. 249 С. 1(НХ 531). Соединение 5 (сложный метиловый эфир соединения НХ 600, 102 мг, 0,226 ммоль) растворяли в концентрированной серной кислоте (5 мл) и к раствору прибавляли КNО 3 (36,5 мг, 0,36 ммоль) при охлаждении льдом. Через 1 ч реакционную смесь вливали в ледяную воду и экстрагировали дихлорметаном. Органический слой промывали последовательно насыщенным водным раствором гидрокарбоната натрия, водой и 15 рассолом и сушили, после чего выпаривали при пониженном давлении растворитель с получением неочищенного продукта (102 мг). Этот неочищенный продукт очищали путем колоночной хроматографии на силикагеле (AcOEt:нгексан=1:20) с получением соединения 19 (19,3 мг, 17%). 1(с, 3 Н), 1,14 (с, 3 Н), 1,07 (с, 3 Н) К соединению 19 (17,3 мг, 0,035 ммоль) прибавляли 2 н. NaOH (1,0 мл) и этанол (2,0 мл) и смесь перемешивали при комнатной температуре в течение 90 мин. Реакционную смесь подкисляли путем добавления 2 н. НСl и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом и сушили, после чего выпаривали при пониженном давлении растворитель с получением соединения по настоящему изобретению: НХ 531(соединение 20, 15,0 мг, 89%). Продукт перекристаллизовывали из смеси этанол-вода с получением очищенного соединения, т.пл. 300 С. 1(217 мг) прибавляли ксилол (40 мл) и смесь нагревали с обратным холодильником в течение 18 ч. Выпаривали при пониженном давлении ксилол и полученный остаток очищали путем колоночной хроматографии на силикагелеH-ЯМР CDCl3: 9,30 (с, 1 Н), 8,20 (дд, 1 Н,8,8 Гц, 1,5 Гц), 7,32 (м, 1 Н), 7,15 (м, 2 Н), 7,04 (д,1 Н, 7,3 Гц), 6,90 (дд, 1 Н, 8,4 Гц, 1,1 Гц), 6,72 (м,1 Н), 2,83 (м, 2 Н), 2,64 (м, 2 Н), 1,79 (м, 4 Н) Основание NaH (60% в масле, 114 мг, 2,84 ммоль, 2 экв) промывали гексаном и сушили. Прибавляли к основанию соединение 21 (381 мг, 1,42 ммоль), растворенное в ДМФ (8 мл) и смесь перемешивали при комнатной температуре в течение 15 мин. К этой смеси прибавляли метилйодид (0,37 мл, 5,68 ммоль) и перемешивали ее 3 ч 30 мин. Реакционную смесь вливали в ледяную воду и экстрагировали дихлорметаном. Органический слой сушили, после чего выпаривали при пониженном давлении растворитель с получением неочищенного продукта. Этот неочищенный продукт очищали путем ко 002123 16 лоночной хроматографии на силикагеле(AcOEt:н-гексан=1:100) и полученное соединение промывали водой и насыщенным рассолом. После сушки выпаривали растворитель с получением соединения 22 (293 мг, 73%). 1H-ЯМР CDCl3: 7,67 (дд, 1 Н, 8,1 Гц, 1,8 Гц), 7,34 (м, 1 Н), 7,08 (т, 1 Н, 7,7 Гц), 6,97 (д, 1 Н,7,3 Гц), 6,86 (м, 3 Н), 3,16 (с, 3 Н), 2,81 (м, 2 Н),2,57 (м, 2 Н), 1,76 (м, 4 Н) Соединение 22 (101,6 мг, 0,36 ммоль) суспендировали в смеси воды (2 мл) и этанола (6 мл) и к суспензии прибавляли концентрированную хлороводородную кислоту (0,5 мл). К смеси прибавляли железный порошок (201 мг) и нагревали ее с обратным холодильником в течение 10 мин. Реакционную смесь фильтровали для удаления твердых материалов и фильтрат экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и сушили, после чего выпаривали при пониженном давлении растворитель с получением соединения 23 (81,1 мг, 89%). 1(шир.с, 2 Н), 3,05 (с, 3 Н), 2,76 (м, 2 Н), 2,15 (м,2 Н), 1,65 (м, 4 Н) Соединение 23 (81 мг, 0,32 ммоль) растворяли в сухом бензоле (5 мл) и к раствору прибавляли пиридин (0,1 мл). К смеси прибавляли хлорид монометилового эфира терефталевой кислоты (79,6 мг, 0,40 ммоль) и перемешивали при комнатной температуре в течение 16 ч. К реакционной смеси прибавляли ледяную воду и разбавленную хлороводородную кислоту и затем экстрагировали смесь этилацетатом. Органический слой сушили и выпаривали при пониженном давлении растворитель. Полученный остаток очищали путем колоночной хроматографии (AcOEt:н-гексан=1:20 1:10) с получением соединения 24 (113,9 мг, 86%). 1(м, 2 Н) К соединению 24 (113 мг, 0,273 ммоль) прибавляли полифосфорную кислоту (1,83 г) и смесь перемешивали при 130 С в течение 1 ч. Добавляли к реакционной смеси воду и экстрагировали ее дихлорметаном, после чего органический слой промывали насыщенным рассолом. После сушки выпаривали при пониженном давлении растворитель и полученный остаток очищали путем колоночной хроматографии на силикагеле (AcOEt:н-гексан=1:401:20) с получением соединения 25 (67,9 мг, 63%). 1(м, 2 Н) К соединению 25 (66,3 мг, 0,167 ммоль) прибавляли 2 н. NаОН (2,0 мл) и этанол (5,0 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 ч 15 мин. Реакционную смесь подкисляли, используя 2 н. НСl, и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом и сушили, после чего выпаривали при пониженном давлении растворитель с получением соединения по настоящему изобретению: НХ 545(соединение 26, 60,7 мг, 95%). Продукт перекристаллизовывали из смеси этанол-вода с получением очищенного соединения, т.пл. 273 С. 1(97 мг,0,475 ммоль),охлорнитробензолу (77 мг, 0,48 ммоль) и гидроксиду калия (27 мг, 0,48 ммоль) прибавляли ДМСО (5 мл) и смесь перемешивали при 90 С в течение 17 ч 30 мин. К реакционной смеси прибавляли воду, дихлорметан и концентрированную хлороводородную кислоту (1 мл) и органический слой промывали разбавленной хлороводородной кислотой и рассолом. После сушки выпаривали при пониженном давлении растворитель с получением неочищенного продукта(139,7 мг). Этот неочищенный продукт очищали путем колоночной хроматографии на силикагеле (AcOEt:H-гексан=1:30) с получением о(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталинил)-2-нитрофенола (соединение 27, 103,1 мг,67%, бесцветное масло). 1H-ЯМР CDCl3: 7,93 (дд, 1 Н, 8,1 Гц, 1,5 Гц), 7,46 (м, 1 Н), 7,29 (д, 1 Н, 8,8 Гц), 7,14 (м,1 Н), 7,01(д, 1 Н, 2,6 Гц), 6,99 (дд, 1 Н, 8,4 Гц, 1,1 Гц), 6,80 (дд, 1 Н, 8,4 Гц, 2,6 Гц), 1,69 (с, 4 Н),1,28 (с, 6 Н), 1,25 (с, 6 Н) Соединение 27 суспендировали в воде (2 мл) и этаноле (6 мл) и к суспензии прибавляли концентрированную хлороводородную кислоту(0,5 мл). К смеси прибавляли железный порошок (220 мг) и нагревали ее с обратным холодильником в течение 30 мин. Реакционную смесь фильтровали для удаления твердых материалов и фильтрат экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом. После сушки выпаривали при пониженном давлении растворитель с получением о-(5,6,7,8-тетрагидро-5,5,8,8-тетра 002123(с, 6 Н) Соединение 28 (80,5 мг, 0,264 ммоль) растворяли в сухом бензоле (5 мл) и к раствору прибавляли пиридин (0,1 мл, 1,25 ммоль). К этому раствору прибавляли хлорид монометилового эфира терефталевой кислоты (63 мг,0,317 ммоль) и перемешивали при комнатной температуре в течение 16 ч 30 мин. К реакционной смеси прибавляли ледяную воду и разбавленную хлороводородную кислоту и затем экстрагировали смесь этилацетатом. После сушки выпаривали при пониженном давлении растворитель с получением неочищенного продукта(133 мг). Этот неочищенный продукт очищали путем колоночной хроматографии на силикагеле (АсОЕt:н-гексан=1:201:2) с получением метил 4-[2-(о-(5,6,7,8-тетрагидро-5,5,8,8-тетраметилнафталинил)амино)карбамоил]бензоата(д, 2 Н, 8,4 Гц), 7,30 (д, 1 Н, 8,8 Гц), 7,16 (м, 1 Н),7,07 (дд, 1 Н, 8,1 Гц, 1,5 Гц), 7,04 (д, 1 Н, 2,6 Гц),6,90 (дд, 1 Н, 8,1 Гц, 1,5 Гц), 6,81 (дд, 1 Н, 8,4 Гц,2,6 Гц), 3,95 (с, 3 Н), 1,70 (с, 4 Н), 1,28 (с, 6 Н),1,25 (с, 6 Н) К соединению 29 (111 мг, 0,238 ммоль) прибавляли полифосфорную кислоту (2,2 г) и смесь перемешивали при 100 С в течение 1 ч 30 мин, добавляли к реакционной смеси воду и экстрагировали ее дихлорметаном. После этого органический слой сушили, выпаривали при пониженном давлении растворитель и полученный остаток очищали путем колоночной хроматографии на силикагеле (AcOEt:н-гексан=1:40) с получением метил 4-[2,3-(2,5-диметил-2,5 гексано)дибензо[b,f][1,4]оксазепин-11-ил]-бензоата (соединение 30, 33,4 мг, 31%). 1(с, 6 Н) Соединение 30 (30,0 мг, 0,067 ммоль) суспендировали в этаноле (5 мл) и 2 н гидроксиде натрия (1 мл) и полученную суспензию перемешивали при комнатной температуре в течение 40 мин. Реакционную смесь подкисляли 2 н. хлороводородной кислотой и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом. После сушки выпаривали при пониженном давлении растворитель с получением соединения по настоящему изобретению: 4-[2,3-(2,5-диметил-2,5-гексано)дибензо[b,f][1,4]оксазепин-11-ил]бензойной кислоты (НХ 620: соединение 31, 29,0 мг, 100%),т.пл. 289 С.(с, 6 Н) Пример 7. Получение 4-[2,3-(2,5-диметил 2,5-гексано)дибензо-[b,f][1,4]тиазепин-11-ил] бензойной кислоты (НХ 630). К хлорсульфоновой кислоте (10 мл) при 0 С прибавляли 1,2,3,4-тетрагидро-1,1,4,4 тетраметилнафталин (6,0 г, 32,0 ммоль) и смесь перемешивали в течение 1 ч. Реакционную смесь вливали в ледяную воду и экстрагировали этилацетатом. Органический слой промывали насыщенным рассолом и после сушки выпаривали при пониженном давлении растворитель. К остатку прибавляли цинковый порошок (10 г,15,2 ммоль) и этанол (20 мл), после чего прибавляли концентрированную хлороводородную кислоту (40 мл) в течение 5 мин и смесь нагревали с обратным холодильником в течение 1 ч 25 мин. Реакционную смесь экстрагировали путем добавления ледяной воды и этилацетата и органический слой промывали насыщенным рассолом. После сушки выпаривали растворитель при пониженном давлении с получением неочищенного продукта 6,82 г). 1H-ЯМР CDCl3: 3,37 (с, 1 Н, -SH) К полученному, как описано выше, тиофенольному соединению (290 мг, 1,3 ммоль), охлорнитробензолу (212 мг, 1,3 ммоль) и гидроксиду калия (71,5 мг, 1,3 ммоль) прибавляли ДМСО (8 мл) и смесь перемешивали при 100 С в течение 15 ч 40 мин. К реакционной смеси прибавляли воду, дихлорметан и затем концентрированную хлороводородную кислоту (1 мл). Органический слой промывали разбавленной хлороводородной кислотой и рассолом и после сушки выпаривали при пониженном давлении растворитель. Полученный остаток очищали путем колоночной хроматографии на силикагеле (АсОЕt:н-гексан=1:40) с получением s(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталинил)-2-нитрофенилтиофенола (соединение 32,112,3 мг, 25%). 1(м, 1 Н), 7,29 (дд, 1 Н, 8,1 Гц, 1,8 Гц), 7,20 (м,1 Н), 6,90 (дд, 1 Н, 8,1 Гц, 1,1 Гц), 1,72 (с, 4 Н),1,32 (с, 6 Н), 1,27 (с, 6 Н) Соединение 32 (275,3 мг, 0,807 ммоль) суспендировали в воде (5 мл) и этаноле (10 мл) и к суспензии прибавляли концентрированную хлороводородную кислоту (0,5 мл). К этой смеси прибавляли железный порошок (210 мг) и нагревали ее с обратным холодильником в течение 5 мин. Реакционную смесь фильтровали для удаления твердых материалов и фильтрат экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и после сутки концентрировали при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагелеH-ЯМР CDCl3: 7,43 (дд, 1 Н, 7,7 Гц, 1,5 Гц), 7,21 (м, 1 Н), 7,14 (д, 1 Н, 8,4 Гц), 7,10 (д, 1 Н,2,2 Гц), 6,77 (м, 3 Н), 4,30 (шир.с, 2 Н), 1,64 (с,4 Н), 1,22 (с, 6 Н), 1,20 (с, 6 Н) Соединение 33 (91,4 мг, 0,294 ммоль) растворяли в сухом бензоле (5 мл) и к раствору прибавляли пиридин (0,2 мл, 2,5 ммоль). К этому раствору прибавляли хлорид монометилового эфира терефталевой кислоты (76 мг, 0,38 ммоль) и перемешивали при комнатной температуре в течение 18 ч. К реакционной смеси прибавляли ледяную воду и разбавленную хлороводородную кислоту и затем экстрагировали смесь этилацетатом. Органический слой сушили и выпаривали растворитель с получением неочищенного продукта (146,8 мг). Этот неочищенный продукт очищали путем колоночной хроматографии на силикагеле (АсОЕt:нгексан=1:20 1:10) с получением метил 4-[2-(s(5,6,7,8-тетрагидро-5,5,8,8-тетраметилнафталинил)амино)карбамоил]бензоата (соединение 34,123,7 мг, 89%). 1(м, 3 Н), 7,10 (д, 1 Н, 1,8 Гц), 6,83 (дд, 1 Н, 8,4 Гц,2,2 Гц), 3,95 (с, 3 Н), 1,61 (с, 4 Н), 1,20 (с, 6 Н),1,13 (с, 6 Н) К соединению 34 (46,8 мг, 0,099 ммоль) прибавляли полифосфорную кислоту (1,48 г) и смесь перемешивали при 120 С в течение 45 мин. Добавляли к реакционной смеси воду и экстрагировали ее дихлорметаном. После этого органический слой сушили и выпаривали при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (АсОЕt:н-гексан=1:40) с получением метил 4-[2,3-(2,5-диметил-2,5-гексано)дибензо[b,f][1,4]тиазепин-11-ил]бензоата (соединение 35, 27,3 мг, 61%). 1(с, 3 Н), 1,28 (с, 3 Н), 1,13 (с, 3 Н), 1,06 (с, 3 Н) Соединение 35 (26,4 мг, 0,058 ммоль) суспендировали в этаноле (5 мл) и гидроксиде натрия (1 мл) и полученную суспензию перемешивали при комнатной температуре в течение 40 мин. Реакционную смесь подкисляли 2 н. хлороводородной кислотой и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом и после сушки концентрировали при пониженном давлении растворитель с получением соединения по настоящему изобретению: 4-[2,3-(2,5-диметил-2,5 гексано)-дибензо[b,f][1,4]тиазепин-11-ил]бензойной кислоты (НХ 630, соединение 36, 24,9 мг, 21 97%). Продукт перекристаллизовывали в смеси этанол-вода с получением очищенного соединения, т.пл. 299 С. 1(м, 4 Н), 1,31 (с, 3 Н), 1,28 (с, 3 Н), 1,15 (с, 3 Н),1,07 (с, 3 Н) Пример 8. Получение 4-[2,3-(2,5-диметил 2,5-гексано)дибензо-[b,е]азепин-11-ил]бензойной кислоты (НХ 640). 5,6,7,8-Тетрагидро-5,5,8,8-тетраметилнафталин (10,0 г, 53,2 ммоль) и хлорангидрид онитробензойной кислоты (9,4 г, 50,5 ммоль) растворяли в дихлорметане (50 мл) и к раствору прибавляли порциями АlСl3 (14,3 г), после чего реакционную смесь нагревали с обратным холодильником в течение 1 ч 30 мин. Реакционную смесь вливали в воду и экстрагировали дихлорметаном. После сушки выпаривали растворитель с получением неочищенного продукта(21,59 г). Продукт очищали путем колоночной хроматографии на силикагеле (АсОЕt:нгексан=1:10) с получением (5,5,8,8-тетраметил 5,6,7,8-тетрагидро-2-нафтил)-карбонил-2-нитробензола (соединение 37, 7,5 г, 42%). Этот продукт затем перекристаллизовывали из н-гексана. 1(дд, 1 Н, 7,7 Гц, 1,5 Гц), 7,34 (м, 2 Н), 1,69 (с, 4 Н),1,28 (с, 6 Н), 1,26 (с, 6 Н) Соединение 37 (262,1 мг, 0,78 ммоль) растворяли в этаноле (10 мл), прибавляли к нему железный порошок (313 мг) и затем концентрированную хлороводородную кислоту (2,0 мл) и полученную реакционную смесь нагревали с обратным холодильником в течение 15 мин. Реакционную смесь фильтровали и фильтрат экстрагировали этилацетатом. После сушки выпаривали растворитель с получением (5,5,8,8 тетраметил-5,6,7,8-тетрагидро-2-нафтил)карбонил-2-анилина (соединение 38, 242,9 мг, 100%). 1LiAlH4 (41,3 мг, 1,09 ммоль, суспендированный в 8 мл диэтилового эфира) и смесь нагревали с обратным холодильником в течение 19 ч. Реакционную смесь обрабатывали обычным образом и полученный неочищенный продукт очищали путем колоночной хроматографии на силикагеле (AcOEt:н-гексан=1:40-1:20) с получением 2(5,6,7,8-тетрагидро-5,5,8,8-тетраметилнафтилметил)анилина (соединение 39, 34,9 мг, 54%). 1(с, 6 Н), 1,24 (с, 6 Н) Соединение 39 (88,5 мг, 0,30 ммоль) растворяли в сухом бензоле (4 мл) и к раствору прибавляли пиридин (0,2 мл, 2,5 ммоль). К этому раствору прибавляли хлорид монометилового эфира терефталевой кислоты (73,7 мг, 0,37 ммоль) и перемешивали при комнатной температуре в течение 1 ч 30 мин. К реакционной смеси прибавляли ледяную воду и 2 н. НСl и экстрагировали смесь этилацетатом. После сушки выпаривали растворитель и остаток очищали путем колоночной хроматографии на силикагеле с получением метил 4-[2-(2-(5,6,7,8 тетрагидро-5,5,8,8-тетра-метилнафтилметил)амино)карбонил]бензоата (соединение 40, 115,1 мг,84%). 1H-ЯМР CDCl3: 8,13 (д, 1 Н, 8 Гц), 7,99 (д,1 Н, 8,4 Гц), 7,62 (шир.с, 1 Н), 7,38 (д, 2 Н, 8,4 Гц),7,30 (м, 3 Н), 7,21 (т, 1 Н, 7,7 Гц), 7,11 (д, 1 Н),6,90 (дд, 1 Н, 8,1 Гц), 4,04 (с, 2 Н), 3,95 (с, 3 Н),1,68 (м, 4 Н), 1,29 (с, 6 Н), 1,15 (с, 6 Н) К соединению 40 (103,4 мг, 0,227 ммоль) прибавляли полифосфорную кислоту (1,56 г) и смесь перемешивали при 110 С в течение 45 мин. Добавляли к реакционной смеси воду и экстрагировали ее дихлорметаном. После этого органический слой сушили и выпаривали растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (АсОЕt:нгексан=1:20) с получением метил 4-[2,3-(2,5 диметил-2,5-гексано)дибензо-[b,е]азепин-11 ил]бензоата (соединение 41, 78,3 мг, 79%). 1NaOH (2 мл) и полученную суспензию перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь подкисляли 2 н. НСl и экстрагировали дихлорметаном. Органический слой сушили и выпаривали растворитель с получением 4-[2,3-(2,5-диметил 2,5-гексано)дибензо[b,e]азепин-11-ил]бензойной кислоты(НХ 640, соединение 42, 73,6 мг, 97%). Продукт перекристаллизовывали из смеси этанол-вода с получением очищенного соединения, т.пл. 300 С. 1 1,2,3,4-Тетрагидро-1,1,4,4-тетраметилнафталин (10,0 г, 53,2 ммоль) и хлорид монометилового эфира терефталевой кислоты (10,0 г, 50,5 ммоль) растворяли в дихлорметане (50 мл) и к раствору добавляли АlСl3 (14,3 г, 107,5 ммоль) в течение 10 мин при охлаждении льдом. После нагревания с обратным холодильником в течение 1 ч реакционную смесь вливали в ледяную воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным рассолом и после сушки концентрировали с получением метил 4-[5,5,8,8-тетраметил-5,6,7,8 тетрагидро-2-нафтил)карбонил]бензоата(соединение 43, 18,5 г, 99%). Часть этого продукта перекристаллизовывали из этилацетата. 1(с, 4 Н), 1,32 (с, 6 Н), 1,29 (с, 6 Н) Соединение 43 (693 мг, 1,98 ммоль) растворяли в концентрированной Н 2SO4 (5 мл) и к раствору прибавляли КNО 3 (240 мг, 2,37 ммоль) при охлаждении льдом. Через 1 ч реакционную смесь вливали в ледяную воду и экстрагировали дихлорметаном. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным рассолом, сушили и затем концентрировали. Остаток перекристаллизовывали из этилацетата с получением метил 4-[3-нитро-5,5,8,8-тетраметил-5,6,7,8 тетрагидро-2-нафтилкарбонил]бензоата в виде бесцветных игольчатых кристаллов (соединение 44) 414 мг, 53%). 1H-ЯМР CDCl3: 8,16 (с, 1 Н), 8,11 (д, 2 Н, 8,4 Гц), 7,81 (д, 2 Н, 8,4 Гц), 7,38 (с, 1 Н), 3,94 (с, 3 Н),1,77 (с, 4 Н), 1,39 (с, 6 Н), 1,31 (с, 6 Н) Соединение 45 (318,5 мг, 0,806 ммоль) суспендировали в воде (5 мл) и этаноле (10 мл) и к суспензии прибавляли концентрированную хлороводородную кислоту (1,0 мл). К этой смеси прибавляли железный порошок (317 мг) и нагревали ее с обратным холодильником в течение 50 мин. Реакционную смесь затем фильтровали для удаления твердых материалов. Фильтрат экстрагировали этилацетатом и органический слой промывали водой и насыщенным рассолом. После сушки органический слой концентрировали с получением метил 4-[3-амино 5,5,8,8-тетраметил-5,6,7,8-тетрагидро-2-нафтилкарбонил]бензоата в виде желтых кристаллов(шир.с, 2 Н), 3,97 (с, 3 Н), 1,65 (м, 4 Н), 1,28 (с,6 Н), 1,11 (с, 6 Н) К соединению 46 (70 мг, 0,19 ммоль) и гидрохлориду метилового эфира глицина (38,3 мг, 0,31 ммоль) прибавляли пиридин (5 мл) и смесь нагревали с обратным холодильником в течение 16 ч. Добавляли к реакционной смеси разбавленную хлороводородную кислоту и экстрагировали дихлорметаном. Органический 24 слой промывали водой и насыщенным рассолом, сушили и затем концентрировали с получением остатка (72,3 мг). Остаток очищали путем колоночной хроматографии на силикагеле(AcOEt:н-гексан=1:4) с получением метил 4[1,3-дигидро-7,8-(2,5-диметил-2,5-гексано)-2 оксо-2 Н-1,4-бензодиазепин-5-ил]бензоата (соединение 47, 34,7 мг, 45%). Был извлечен также исходный материал (23,1 мг, 33%). 1(с, 6 Н) Соединение 47 (32,6 мг, 0,08 ммоль) суспендировали в этаноле (5 мл) и 2 н. NaOH (1 мл) и полученную суспензию перемешивали при комнатной температуре в течение 20 мин. Реакционную смесь подкисляли 2 н. хлороводородной кислотой и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом, сушили и затем концентрировали с получением 4-[1,3-дигидро-7,8-(2,5 диметил-2,5-гексано)-2-оксо-2 Н-1,4-бензодиазепин-5-ил]бензойной кислоты (НХ 800, соединение 48, 26,0 мг, 83%). Часть продукта перекристаллизовывали из смеси метанол-гексан с получением очищенного соединения, т.пл.300 С. МС М+ 390 1(НХ 801). Основание NаН (60% в масле, 7,1 мг, 0,18 ммоль, 2 экв) промывали гексаном и сушили,после чего прибавляли к основанию полученный в примере 9 метил 4-[1,3-дигидро-7,8-(2,5 диметил-2,5-гексано)-2-оксо-2 Н-1,4-бензодиазепин-5-ил]бензоат (36 мг, 0,089 ммоль), растворенный в ДМФ (4 мл). Смесь перемешивали при комнатной температуре в течение 10 мин и прибавляли к ней СН 3I (0,02 мл, 0,36 ммоль, 4 экв),после чего перемешивали ее еще 2 ч 30 мин. Реакционную смесь вливали в ледяную воду и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом, сушили и затем концентрировали. Остаток очищали путем колоночной хроматографии на силикагеле (АсОЕt:н-гексан=1:1) с получением метил 4-[1,3-дигидро-7,8-(2,5-диметил-2,5-гексано)-1-метил-2-оксо-2 Н-1,4-бензодиазепин-5 ил]бензоата (соединение 49, 21,8 мг, 59%). 1 25 полученную суспензию перемешивали при комнатной температуре в течение 40 мин. Реакционную смесь подкисляли 2 н. хлороводородной кислотой и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом, сушили и затем концентрировали с получением 4-[1,3-дигидро-7,8-(2,5 диметил-2,5-гексано)-1-метил-2-оксо-2 Н-1,4 бензодиазепин-5-ил]бензойной кислоты(НХ 801), соединение 50, 23,5 мг, 83%). Часть продукта перекристаллизовывали из смеси этилацетат-гексан с получением очищенного соединения, т.пл. 300 С. 1(188 мг, 0,515 ммоль), полученному в примере 9, и гидрохлориду этилового эфира L-аланина(177 мг, 0,77 ммоль, 1,5 экв) прибавляли пиридин (5 мл) и смесь нагревали с обратным холодильником в течение 16 ч. Добавляли к реакционной смеси разбавленную хлороводородную кислоту и затем экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом, сушили и затем концентрировали. Остаток очищали путем колоночной хроматографии на силикагеле (AcOEt:нгексан=1:3) с получением метил 4-[3(S)-метил 1,3-дигидро-7,8-(2,5-диметил-2,5-гексано)-2 оксо-2 Н-1,4-бензодиазепин-5-ил]бензоата (соединение 51, 25,6 мг, 12%). 1H-ЯМР CDCl3: 8,06 (д, 2 Н, 8,4 Гц), 7,67 (д,2 Н, 8,4 Гц), 7,17 (с, 1 Н), 6,97 (с, 1 Н), 3,94 (с,3 Н), 3,84 (кв., 1 Н, 6,6 Гц), 1,74 (д, 3 Н, 6,6 Гц),1,71 (м, 4 Н), 1,34 (с, 3 Н), 1,31 (с, 3 Н), 1,19 (с,3 Н), 1,12 (с, 3 Н) Соединение 51 (15,1 мг, 0,036 ммоль) суспендировали в этаноле (3 мл) и 2 н. NaOH (1 мл) и полученную суспензию перемешивали при комнатной температуре в течение 40 мин. Реакционную смесь подкисляли 2 н. НСl и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом, сушили и затем концентрировали с получением 4[3(S)-метил-1,3-дигидро-7,8-(2,5-диметил-2,5 гексано)-2-оксо-2 Н-1,4-бензодиазепин-5 ил]бензойной кислоты (НХ 810, соединение 52,14,9 мг, 100%). Часть продукта перекристаллизовывали из смеси этилацетат-гексан с получением очищенного соединения, т.пл. 300 С. 1(НХ 803). Основание NaH (60% в масле, 4,7 мг, 0,12 ммоль, 2 экв) промывали гексаном и сушили,после чего прибавляли к основанию полученный в примере 9 метил 4-[1,3-дигидро-7,8-(2,5 диметил-2,5-гексано)-2-оксо-2 Н-1,4-бензодиазепин-5-ил]бензоат (24 мг, 0,059 ммоль), растворенный в ДМФ (6 мл). Смесь перемешивали при комнатной температуре в течение 15 мин и прибавляли к ней 2-йодпропан (0,02 мл, 0,24 ммоль,4 экв), после чего перемешивали ее еще 4 ч. Реакционную смесь вливали в ледяную воду и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом, сушили и затем концентрировали. Остаток очищали путем колоночной хроматографии на силикагеле (АсОЕt:н-гексан=1:5) с получением метил 4-[1,3-дигидро-7,8-(2,5-диметил-2,5 гексано)-1-изопролил-2-оксо-2 Н-1,4-бензодиазепин-5-ил]бензоата (соединение 53, 6,4 мг, 24%). 1(д, 3 Н, 7,0 Гц), 1,13 (с, 3 Н) Соединение 53 (6,4 мг, 0,014 ммоль) суспендировали в этаноле (4 мл) и 2 н. NaOH (0,5 мл) и полученную суспензию перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь подкисляли 2 н. НСl и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом, сушили и затем концентрировали с получением 4[1,3-дигидро-7,8-(2,5-диметил-2,5-гексано)-1 изопропил-2-оксо-2 Н-1,4-бензодиазепин-5 ил]бензойной кислоты (НХ 803, соединение 54,6,2 мг, 100%). Часть продукта перекристаллизовывали из смеси этилацетат-гексан с получением очищенного соединения, т.пл. 275 С. 1(НХ 805). Основание NaH (60% в масле, 6,1 мг, 0,15 ммоль, 2 экв) промывали гексаном и сушили,после чего прибавляли к основанию полученный в примере 9 метил 4-[1,3-дигидро-7,8-(2,5 27 диметил-2,5-гексано)-2-оксо-2 Н-1,4-бензодиазепин-5-ил]бензоат (31,9 мг, 0,076 ммоль), растворенный в ДМФ (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 мин и прибавляли к ней бензилбромид(0,035 мл, 0,30 ммоль, 4 экв), после чего перемешивали ее еще 1 ч. Реакционную смесь вливали в ледяную воду и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом, сушили и затем концентрировали. Остаток перекристаллизовывали из смеси этилацетатдихлорметан с получением метил 4-[1-бензил-1,3-дигидро-7,8-(2,5-диметил 2,5-гексано)-2-оксо-2 Н-1,4-бензодиазепин-5 ил]бензоата (соединение 55, 23,3 мг, 60%). 1H-ЯМР CDCl3: 8,03 (д, 2 Н, 8,4 Гц), 7,51 (д,2 Н, 8,4 Гц), 7,25 (с, 1 Н), 7,16 (м, 3 Н), 7,06 (м,2 Н), 4,89 (д, 1 Н, 10,3 Гц), 4,87 (д, 1 Н, 15,4 Гц),3,97 (д, 1 Н, 10,3 Гц), 3,95 (с, 3 Н), 1,66 (с, 4 Н),1,23 (с, 3 Н), 1,20 (с, 3 Н), 1,11 (с, 3 Н), 1,08 (с, 3 Н) Соединение 55 (19,1 мг, 0,035 ммоль) суспендировали в этаноле (6 мл) и 2 н NaOH (1 мл) и полученную суспензию перемешивали при 70 С в течение 2 ч. Реакционную смесь подкисляли 2 н. НСl и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом, сушили и затем концентрировали с получением 4-[1-бензил-1,3-дигидро 7,8-(2,5-диметил-2,5-гексано)-2-оксо-2 Н-1,4 бензодиазепин-5-ил]бензойной кислоты(НХ 805, соединение 56, 12,5 мг, 72%). Часть продукта перекристаллизовывали из смеси этилацетат-дихлорметан с получением очищенного соединения, т.пл.300 С. 1(НХ 850). К Fmoc-(L)фенилаланину (272 мг, 0,70 ммоль) прибавляли SОСl2 (4 мл) и смесь нагревали с обратным холодильником в течение 30 мин. Выпаривали при пониженном давленииSOCl2 и реакционную смесь в достаточной степени сушили. К остатку прибавляли метил 4-[3 амино-5,5,8,8-тетраметил-5,6,7,8-тетра-гидро-2 нафтилкарбонил]бензоат (89 мг, 0,244 ммоль) иDMAP (12 мг), а затем безводный бензол (10 мл) и пиридин (0,5 мл). Эту смесь перемешивали при комнатной температуре в течение 50 мин,подкисляли 2 н. НСl и затем экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным рассолом, сушили надNа 2SO4 и затем концентрировали. Остаток очищали путем колоночной хроматографии на си 002123(с, 6 Н) Смесь соединения 57 (82,3 мг, 0,11 ммоль),дихлорметана (4 мл) и пиперидина (1 мл) перемешивали при комнатной температуре в течение 40 мин. Выпаривали при пониженном давлении растворитель досуха и к остатку прибавляли бутанол (10 мл) и уксусную кислоту (0,5 мл),после чего смесь перемешивали при 80 С в течение 2 ч. Добавляли к реакционной смеси водный раствор гидрокарбоната натрия и экстрагировали ее дихлорметаном. Экстракт очищали путем колоночной хроматографии на силикагеле (AcOEt:н-гексан=1:10) с получением метил 4[3(S)-бензил-1,3-дигидро-7,8-(2,5-диметил-2,5 гексано)-2-оксо-2 Н-1,4-бензодиазепин-5-ил]бензоата (соединение 58, 48,4 мг, 92%). 1(с, 1 Н), 7,00 (с, 1 Н), 3,93 (с, 3 Н), 3,87 (м, 1 Н),3,63 (м, 2 Н), 1,68 (м, 4 Н), 1,34 (с, 3 Н), 1,31 (с,3 Н), 1,16 (с, 3 Н), 1,10 (с, 3 Н) Соединение 58 (28,6 мг, 0,06 ммоль) суспендировали в этаноле (5 мл) и 1 н. КОН (2 мл) и полученную суспензию перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь подкисляли 2 н. НСl и экстрагировали дихлорметаном. Органический слой сушили и концентрировали с получением 4-[3(S)бензил-1,3-дигидро-7,8-(2,5-диметил-2,5-гексано)-2-оксо-2 Н-1,4-бензодиазепин-5-ил]бензойной кислоты (НХ 850, соединение 59, 24,8 мг,89%). Часть продукта перекристаллизовывали из смеси дихлорметан-гексан. 1(с, 3 Н) Пример 15. Пример испытания. Проверяли эффекты соединений из описанных выше примеров 1 и 8 на активность ретиноидов в отношении индуцирования дифференцировки клеток. В качестве ретиноидов(агонистов рецептора полностью трансретиноевой кислоты) использовали ретиноевую кислоту и Аm80 (4-[(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафталинил)карбамоил]бензойная кислота). Способность вышеуказанных ретиноидов индуцировать дифференцировку клеток определяли для линии HL-60 клеток промиелоидного лейкоза в присутствии и в отсутствие соединений примеров 1 и 2 в соответствии с методом, описанным в нерассмотренной публикации патента Японии (KOKAI)(Sho)6176440/1986. Степень дифференцировки в гранулоцитные клетки определяли путем наблюдения ядерной морфологии и измерения способности снижать нитросиний тетразолий (NBT). Этот метод хорошо известен в данной области как испытание, способное надлежащим образом отображать активность ретиноидов в отношении индуцирования дифференцировки клеток. Результаты показаны в данной ниже табл. 1 (в этой таблице NTB положительное отношение представляет процентное содержание дифференцированных клеток относительно живых клеток). Ретиноид (М) Ретиноевая кисл. Когда соединения по настоящему изобретению получали возможность сосуществовать с ретиноевой кислотой или Am80, отношения дифференцированных клеток были заметно увеличенными. Таким образом, очевидно, что соединения по настоящему изобретению усиливали активность ретиноевой кислоты или Am80 в отношении индуцирования клеточной дифференцировки. Соединение LE135, использованное в качестве контрольного, известно как антагонист ретиноида (соединение 16 в Eyrolles, L.,et al., J. Med. Chem., 37, стр. 1508-1517, 1994: 4(5 Н-7,8,9,10-тетрагидро-5,7,7,10,10-пентаметилбензо[е]нафто[2,3-b][1,4]диазепин-13-ил)бензойная кислота) и соответствует структурному изомеру соединения НХ 600 по настоящему изобретению. Когда была обеспечена возможность сосуществования этого соединения с Аm80, индуцирующая клеточную дифференцировку активность Аm80 была заметно подавленной. Пример 16. Пример испытания. Проверяли эффекты соединения примера 10 (НХ 801) на активность ретиноида в отношении индуцирования клеточной дифференцировки. В качестве ретиноида использовали Аm80 и индуцирующую клеточную дифференцировку активность указанного ретиноида по отношению к линии LH-60 клеток промиелоидного лейкоза определяли в присутствии или в отсутствие соединения НХ 801 в соответствии с тем же методом, что и в примере 15. Результаты представлены в следующей далее табл. 2 (в этой таблице "-" показывает на отсутствие лекарственного средства). Когда была обеспечена возможность сосуществования соединения с Аm80,отношение дифференцированных клеток было заметно увеличенным. Эти результаты ясно показывают, что соединения по настоящему изобретению усилили активность Аm80 в отношении индуцирования клеточной дифференцировки. Промышленная применимость Соединения по настоящему изобретению усиливают действие ретиноидов, таких как ретиноевая кислота, и потому полезны как лекарственные средства для усиления активности ретиноида. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представленное следующей общей формулой (I) или его соли; где R1 представляет атом водорода или C1-6 алкильную группу; R2 и R3 независимо представляют атом водорода или C1-6 алкильную группу, или R2 и R3 могут быть объединены вместе с углеродными атомами фенильного кольца, к которым R2 и R3 присоединены, с образованием 5- или 6-членной циклоалкильной группы, которая может быть необязательно замещена одной или несколькими C1-4 алкильными группами; R4 представляет атом водорода,C1-6 алкильную группу, C1-6 алкоксигруппу, гидроксильную группу, нитрогруппу или атом галогена; Х представляет -NR7-, -О-, -CHR7- или-S-, где R7 представляет атом водорода, C1-6 алкильную группу или арилзамещенную C1-6 алкильную группу; и Y представляет фениленовую группу или пиридиндиильную группу. 2. Соединение по п.1, которое выбрано из группы, состоящей из следующих соединений,или его соль: 4-[5 Н-2,3-(2,5-диметил-2,5-гексано)-5 метилдибензо[b,е]-[1,4]диазепин-11-ил]бензойная кислота (НХ 600); 4-[5 Н-2,3-диизопропил-5-метилдибензо[b,е][1,4]диазепин-11-ил]бензойная кислота[b,е]азепин-11-ил]бензойная кислота (НХ 640). 3. Лекарственное средство, содержащее соединение или его физиологически приемлемую соль по п. 1. 4. Лекарственное средство по п.3, где указанное лекарственное средство находится в виде фармацевтической композиции, содержащей соединение или его физиологически приемлемую соль по п.1 вместе с одной или несколькими фармацевтическими добавками. 5. Лекарственное средство по п.3, обладающее способностью усиливать активность физиологически активного вещества, оказывающего влияние на физиологическую активность путем связывания с внутриядерным рецептором, принадлежащим надсемейству внутриядерных рецепторов. 6. Лекарственное средство по п.5, где физиологически активным веществом является ретиноидное соединение. 7. Фармацевтическая композиция, содержащая соединение по п.1 или его физиологически приемлемую соль вместе с ретиноидным соединением. 8. Способ усиления активности физиологически активного вещества, оказывающего влияние на физиологическую активность путем связывания с внутриядерным рецептором, принадлежащим надсемейству внутриядерных рецепторов, который включает стадию введения соединения по п.1 или его физиологически приемлемой соли млекопитающему. 9. Способ по п.8, где физиологически активным веществом является ретиноидное соединение. 10. Способ по п.8, где физиологически активным веществом является ретиноевая кислота, изначально присутствующая в живом организме указанного млекопитающего.
МПК / Метки
МПК: A61K 31/5513, C07D 243/10, A61P 19/08
Метки: соединения, ретиноидов, активность, усиливающие
Код ссылки
<a href="https://eas.patents.su/17-2123-soedineniya-usilivayushhie-aktivnost-retinoidov.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, усиливающие активность ретиноидов.</a>
Предыдущий патент: Сушильная камера
Следующий патент: Производные хинолина
Случайный патент: Подставка для новогодней елки












