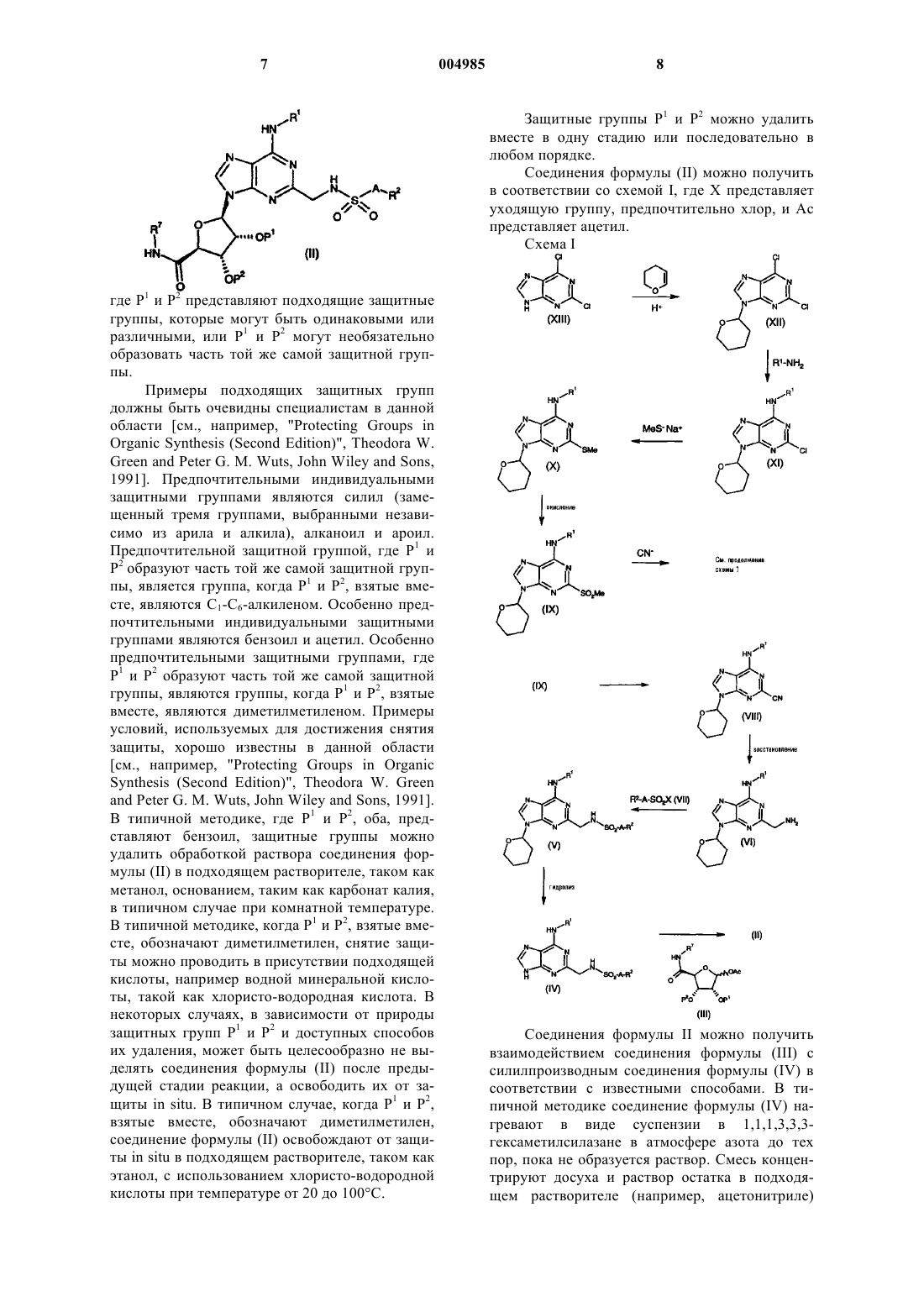
Производные пурина
Формула / Реферат
1. Соединение формулы
или его фармацевтически приемлемая соль или сольват, где
R1 представляет водород или C1-C6-алкил, необязательно замещенный 1 или 2 заместителями, каждый из которых, независимо, выбран из фенила и нафтила, причем указанный фенил и нафтил, необязательно, замещен C1-C6-алкилом, C1-C6-алкокси, галогеном или циано;
A представляет связь или C1-C3-алкилен;
R2 представляет
(i) водород, C1-C6-алкил, C3-C7-циклоалкил, фенил или нафтил, причем указанный C3-C7-циклоалкил, фенил или нафтил, необязательно, замещен C1-C6-алкилом, фенилом, C1-C6-алкокси-(C1-C6)-алкилом, R3R3N-(C1-C6)-алкилом, фтор-(C1-C6)-алкилом, фтор-(C1-C6)-алкокси, C2-C5-алканоилом, галогеном, -OR3, циано, -COOR3, C3-C7-циклоалкилом, -S(O)mR4, -NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 или -NR3SO2R4, с условием, что R2 не является водородом, когда A представляет связь, или
(ii) когда A представляет C2-C3-алкилен, -NR8R9, -OR3, -COOR3, -OCOR4, -SO2R4 -CN, -SO2NR3R3, -NR3COR4 или -CONR3R3, или
(iii) C-связанный 4-11-членный моно- или бициклический гетероцикл, имеющий либо от 1 до 4 атомов азота в кольце либо 1 или 2 атома азота и 1 атом кислорода или 1 атом серы в кольце, и необязательно C-замещенный оксо, C1-C6-алкокси-(C1-C6)-алкилом, R3R3N-(C1-C6)-алкилом, фтор-(C1-C6)-алкилом, фтор-(C1-C6)-алкокси, фтор-(C2-C5)-алканоилом, галогеном, циано -OR5, R6, -COR5, -NR5R5, -COOR5, -S(O)mR6, -SO2NR5R5, -CONR5R5, -NR5SO2R6 или -NR5COR6, и необязательно N-замещенный C1-C6-алкокси-(C1-C6)-алкилом, R3R3N-(C2-C6)-алкилом, фтор-(C1-C6)-алкилом, фтор-(C2-C5)-алканоилом, R6, -COR5, -COOR5, -S(O)mR6, -SO2NR5R5 или CONR5R5;
R3 представляет H, C1-C6-алкил, C3-C7-циклоалкил или фенил; R4 представляет C1-C6-алкил, C3-C7-циклоалкил или фенил; R5 представляет H, C1-C6-алкил, C3-C7-циклоалкил, фенил, нафтил или het;
R6 представляет C1-C6-алкил, C3-C7-циклоалкил, фенил, нафтил или het;
m равно 0, 1 или 2;
het, используемый в определениях R5 и R6, означает C-связанный пирролил, имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил, пиримидинил, пиридазинил, пиразинил, хинолинил, изохинолинил, бензимидазолил, хиназолинил, фталазинил, бензоксазолил или хиноксалинил, каждый из которых необязательно замещен C1-C6-алкилом, C1-C6-алкокси, циано или галогеном;
R7 представляет метил, этил или циклопропилметил; и
либо R8 и R9, взятые вместе с атомом азота, с которым они связаны, представляют азетидинил, пирролидинил, пиперидинил, морфолинил, пиперазинил, гомопиперидинил, гомопиперазинил или тетрагидроизохинолинил, каждый из которых необязательно замещен у атома углерода кольца C1-C6-алкилом, C3-C8-циклоалкилом, фенилом, C1-C6-алкокси- (C1-C6)-алкилом, R3R3N-(C1-C6)-алкилом, фтор-(C1-C6)-алкилом, -CONR3R3, -COOR3 или (C2-C5)-алканоилом и необязательно замещен у атома углерода кольца, не являющегося соседним с атомом азота, фтор-(C1-C6)-алкокси, галогеном, -OR3, циано, -S(O)mR4, -NR3R3, -SO2NR3R3, -NR3COR4 или -NR3SO2R4, и указанный пиперазин-1-ил и гомопиперазин-1-ил необязательно замещен у атома азота, не связанного с A, C1-C6-алкилом, фенилом, C1-C6-алкокси-(C2-C6)-алкилом, R3R3N-(C2-C6)-алкилом, фтор-(C1-C6)-алкилом, C2-C5-алканоилом, -COOR4, C3-C8-циклоалкилом, -SO2R4, -SO2NR3R3 или -CONR3R3,
либо R8 представляет H, C1-C6-алкил, C3-C8-циклоалкил, фенил или бензил и R9 представляет H, C1-C6-алкил, C3-C8-циклоалкил, фенил, бензил, фтор-(C1-C6)-алкил, -CONR3R3, -COOR4, C2-C5-алканоил или -SO2NR3R3.
2. Соединение по п.1, где
R1 представляет водород или C1-C6-алкил, необязательно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанный фенил и нафтил необязательно замещен C1-C6-алкилом, C1-C6-алкокси, галогеном или циано;
A представляет связь или C1-C6-алкилен;
R2 представляет
(i) водород, C1-C6-алкил, C3-C7-циклоалкил, фенил или нафтил, причем указанный C3-C7-циклоалкил, фенил или нафтил необязательно замещен C1-C6-алкилом, фенилом, C1-C6-алкокси-(C1-C6)-алкилом, амино-(C1-C6)-алкилом, фтор-(C1-C6)-алкилом, фтор-(C1-C6)-алкокси, C2-C5-алканоилом, галогеном, -OR3, циано, -COOR3, C3-C7-циклоалкилом, -S(O)mR4, -NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 или -NR3SO2R4, с условием, что R2 не является водородом, когда A представляет связь, или
(ii) когда A представляет C2-C3-алкилен, -NR3R3, -OR3, -COOR3, -OCOR4, -SO2R4, -CN, -SO2NR3R3, -NR3COR4 или -CONR3R3, или
(iii) C-связанный, 4-11-членный, моно- или бициклический гетероцикл, имеющий либо от 1 до 4 атомов азота в кольце либо 1 или 2 атома азота и 1 атом кислорода или 1 атом серы в кольце, необязательно C-замещенный оксо, C1-C6-алкокси-(C1-C6)-алкилом, амино-(C1-C6)-алкилюь, фтор-(C1-C6)-алкилом, фтор-(C1-C6)-алкокси, фтор-(C2-C5)-алканоилом, галогеном, циано -OR5, R6, -COR5, -NR5R5, -COOR5, -S(O)mR6, -SO2NR5R5, -CONR5R5, -NR5SO2R6 или -NR5COR6, и необязательно N-замещенный C1-C6-алкокси-(C1-C6)-алкилом, амино-(C2-C6)-алкилом, фтор-(C1-C6)-алкилом, фтор-(C2-C5)-алканоилом, R6, -COR5, -COOR5, -S(O)mR6, -SO2NR5R5 или CONR5R5; или
(iv) когда A представляет C2-C3-алкилен, N-связанный азетидинил, пирролидинил, пиперидинил или пиперазинил, причем каждый необязательно C-замещен C1-C6-алкилом, фенилом, C1-C6-алкокси-(C1-C6)-алкилом, амино-(C1-C6)-алкилом, фтор-(C1-C6)-алкилом, фтор-(C1-C6)-алкокси, C2-C5-алканоилом, галогеном, -OR3, циано, -COOR3, C3-C7-циклоалкилом, -S(O)mR4, -NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 или -NR3SO2R4, и необязательно N-замещен C1-C6-алкилом, фенилом, C1-C6-алкокси-(C1-C6)-алкилом, амино-(C2-C6)-алкилом, фтор-(C1-C6)-алкилом, C2-C5-алканоилом, -COOR3, C3-C7-циклоалкилом, -S(O)mR4, -SO2NR3R3 или -CONR3R3;
R3 представляет H, C1-C6-алкил или фенил;
R4 представляет C1-C6-алкил или фенил;
R5 представляет H, C1-C6-алкил, C3-C7-циклоалкил, фенил, нафтил или het;
R6 представляет C1-C6-алкил, C3-C7-циклоалкил, фенил, нафтил или het;
m равно 0, 1 или 2;
het, используемый в определениях R5 и R6, означает C-связанный пирролил, имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил, пиримидинил, пиридазинил, пиразинил, хинолинил, изохинолинил, бензимидазолил, хиназолинил, фталазинил, бензоксазолил или хиноксалинил, каждый из которых необязательно замещен C1-C6-алкилом, C1-C6-алкокси, циано или галогеном; и
R7 представляет метил, этил или циклопропилметил.
3. Соединение по п.1 или 2, где A представляет связь.
4. Соединение по п.1 или 2, где A представляет C1-C3-алкилен.
5. Соединение по п.1, где A представляет C2-C3-алкилен.
6. Соединение по п.5, где A представляет -CH2CH2-.
7. Соединение по любому одному из предыдущих пунктов, где R2 представляет C1-C6-алкил, фенил или нафтил, причем указанный фенил необязательно замещен фенилом.
8. Соединение по п.7, где R2 представляет метил, н-пропил, изопропил, 2-метилпроп-1-ил, фенил, 4-фенилфенил, 1-нафтил или 2-нафтил.
9. Соединение по п.5 или 6, где R2 представляет -NR8R9, причем R8 и R9 имеют значения, указанные в п.1.
10. Соединение по п.9, где R8 и R9, взятые вместе с атомом азота, с которым они связаны, представляют пиперидинил.
11. Соединение по п.1, где -A-R2 представляет метил, н-пропил, изопропил, 2-метилпроп-1-ил, фенил, 4-фенилфенил, фенилметил, 1-нафтил, 2-нафтил или 2-(пиперидин-1-ил)этил.
12. Соединение по любому предыдущему пункту, где R1 представляет C1-C6-алкил, замещенный 1 или 2 фенильными группами, причем фенильная группа(ы), необязательно, замещена C1-C6-алкокси.
13. Соединение по п.12, где R1 представляет 2,2-дифенилэтил или (4-метоксифенил)метил.
14. Соединение по п.1, которое выбрано из группы, состоящей из
(2S,3S,4R,5R)-5-{2-{[(бензилсульфонил)амино]метил}-6-[(2,2-дифенилэтил)амино]-9H-пурин-9-ил}-N-этил-3,4-дигидрокситетрагидро-2-фуранкарбоксамид;
(2S,3S,4R,5R)-5-(6-[(2,2-дифенилэтил)амино]-2-{[(пропилсульфонил)амино]метил}-9H-пурин-9-ил)-N-этил-3,4-дигидрокситетрагидро-2-фуранкарбоксамид;
(2S,3S,4R,5R)-5-(6-[(2,2-дифенилэтил)амино]-2-{[(изопропилсульфонил)амино]метил}-9H-пурин-9-ил)-N-этил-3,4-дигидрокситетрагидро-2-фуранкарбоксамид;
(2S,3S,4R,5R)-5-(6-[(2,2-дифенилэтил)амино]-2-{[(фенилсульфонил)амино]метил}-9H-пурин-9-ил)-N-этил-3,4-дигидрокситетрагидро-2-фуранкарбоксамид;
(2S,3S,4R,5R)-5-{2-{[([1,1'-бифенил]-4-илсульфонил)амино]метил}-6-[(2,2-дифенилэтил)амино]-9H-пурин-9-ил}-N-этил-3,4-дигидрокситетрагидро-2-фуранкарбоксамид;
(2S,3S,4R,5R)-5-(6-[(2,2-дифенилэтил)амино]-2-{[(1-нафтилсульфонил)амино]метил}-9H-пурин-9-ил)-N-этил-3,4-дигидрокситетрагидро-2-фуранкарбоксамид;
(2S,3S,4R,5R)-5-(6-[(2,2-дифенилэтил)амино]-2-{[(2-нафтилсульфонил)амино]метил}-9H-пурин-9-ил)-N-этил-3,4-дигидрокситетрагидро-2-фуранкарбоксамид;
(2S,3S,4R,5R)-5-(6-[(2,2-дифенилэтил)амино]-2-{[(метилсульфонил)амино]метил}-9H-пурин-9-ил)-N-этил-3,4-дигидрокситетрагидро-2-фуранкарбоксамид;
(2S,3S,4R,5R)-5-(6-[(2,2-дифенилэтил)амино]-2-{[(изобутилсульфонил)амино]метил}-9H-пурин-9-ил)-N-этил-3,4-дигидрокситетрагидро-2-фуранкарбоксамид;
(2S,3S,4R,5R)-N-этил-3,4-дигидрокси-5-{2-{[(изобутилсульфонил)амино]метил}-6-[(4-метоксибензил)амино]-9H-пурин-9-ил}тетрагидро-2-фуранкарбоксамид и
(2S,3S,4R,5R)-5-{6-[(2,2-дифенилэтил)амино]-2-[({[2-(1-пиперидинил)этил]сульфонил}амино)метил]-9H-пурин-9-ил}-N-этил-3,4-дигидрокситетрагидро-2-фуранкарбоксамид
и их фармацевтически приемлемые соли и сольваты.
15. Фармацевтическая композиция, включающая соединение формулы (I) или его фармацевтически приемлемую соль или сольват по любому одному из предыдущих пунктов вместе с фармацевтически приемлемым наполнителем, разбавителем или носителем.
16. Применение соединения формулы (I) или его фармацевтически приемлемой соли, сольвата по любому одному из пп.1-14, соответственно, для приготовления лекарственного средства для лечения заболевания, для которого показан агонист рецептора A2a.
17. Применение соединения формулы (I) или его фармацевтически приемлемой соли, сольвата по любому одному из пп.1-14, соответственно, для приготовления противовоспалительного агента.
18. Применение соединения формулы (I) или его фармацевтически приемлемой соли, сольвата по любому одному из пп.1-14, соответственно, для приготовления лекарственного средства для лечения респираторного заболевания.
19. Применение по п.18, где заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых (ARDS), бронхита, хронического бронхита, хронического закупоривающего легочного заболевания, муковисцидоза, астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита.
20. Применение соединения формулы (I) или его фармацевтически приемлемой соли, сольвата по любому одному из пп.1-14, соответственно, для приготовления лекарственного средства для лечения септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии, церебральной ишемии, периферического васкулярного заболевания, послеишемического повреждения при реперфузии, диабета, ревматоидного артрита, рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Кроэр, воспалительного заболевания кишечника, гастрита, вызванного Heliobacter pylori, гастрита, вызванного не Heliobacter pylori, повреждения желудочно-кишечного тракта, вызванного нестероидным противовоспалительным лекарственным средством, или психотического нарушения или для заживления ран.
21. Способ лечения заболевания млекопитающего, включая человека, для которого показан агонист рецептора A2a, включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции по любому одному из пп.1-14 и 15, соответственно.
22. Способ лечения воспалительного заболевания млекопитающего, втом числе человека, включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции по любому одному из пп.1-14 и 15, соответственно.
23. Способ лечения респираторного заболевания млекопитающего, в том числе человека, включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции по любому одному из пп.1-14 и 15, соответственно.
24. Способ по п.23, отличающийся тем, что заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых (ARDS), бронхита, хронического бронхита, хронического закупоривающего легочного заболевания, муковисцидоза, астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита.
25. Способ лечения млекопитающего, включая человека, для терапии септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии, церебральной ишемии, периферического васкулярного заболевания, послеишемического повреждения при реперфузии, диабета, ревматоидного артрита, рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита, вызванного Heliobacter pylori, гастрита, вызванного не Heliobacter pylori, повреждения желудочно-кишечного тракта, вызванного нестероидным противовоспалительным лекарственным средством, или психотического нарушения или для заживления ран, включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции по любому одному из пп.1-14 и 15, соответственно.
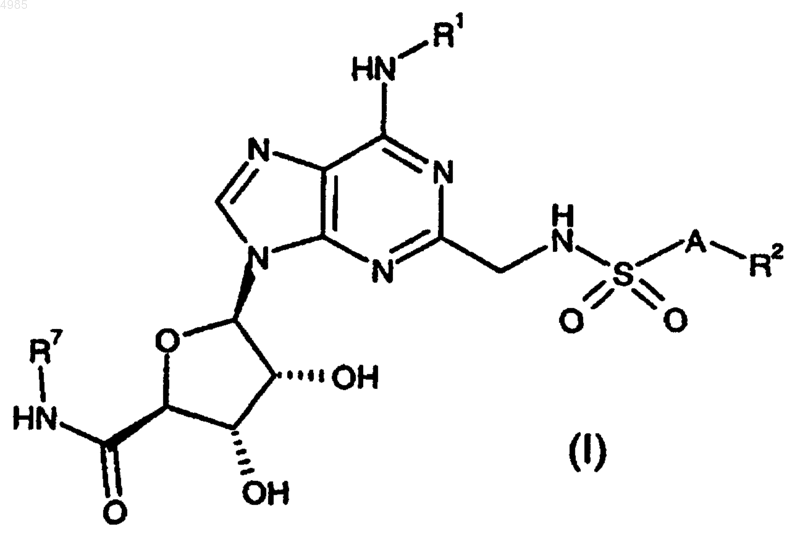
26. Способ получения соединения формулы (I) по п.1 или 2 или его фармацевтически приемлемой соли или сольвата, который включает
снятие защиты у соединения формулы (II)
где R1, R2, R7 и A имеют значения, указанные в п.1 или 2, и
либо P1 и P2, когда взяты по отдельности, представляют защитные группы, либо P1 и P2, когда взяты вместе, представляют защитную группу, причем защитные группы P1 и P2, когда они взяты по отдельности, удаляют либо вместе, либо последовательно; и необязательно следует превращение соединения формулы (I) в его фармацевтически приемлемую соль.
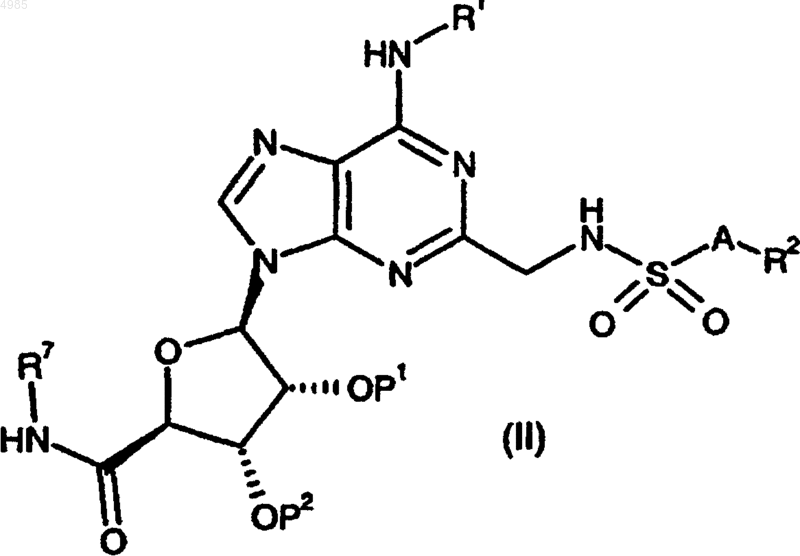
27. Способ получения соединения формулы (I) по п.1 или 2, или его фармацевтически приемлемой соли или сольвата, который включает
сульфонилирование соединения формулы
где R1 и R7 имеют значения, указанные в п.1 или 2, соединением формулы
R2-A-SO2X (VII),
где X представляет уходящую группу, предпочтительно хлор, и R2 и A имеют значения, указанные в п.1 или 2; и
необязательно следует превращение соединения формулы (I) в его фармацевтически приемлемую соль.
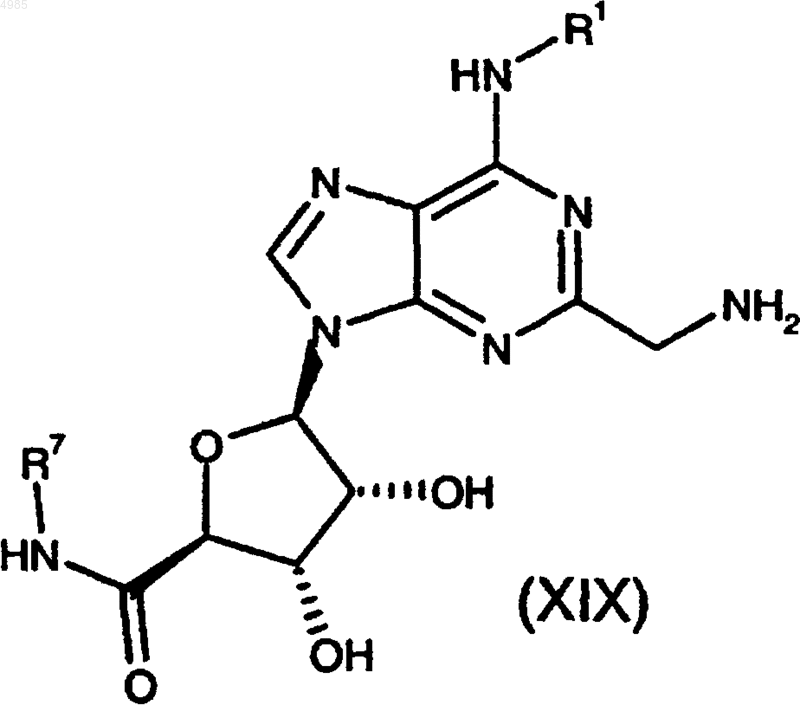
28. Способ получения соединения формулы (I) по п.1, в которой A представляет -CH2CH2- и R2 представляет NR7R8, или его фармацевтически приемлемой соли, или сольвата, который включает взаимодействие соединения формулы
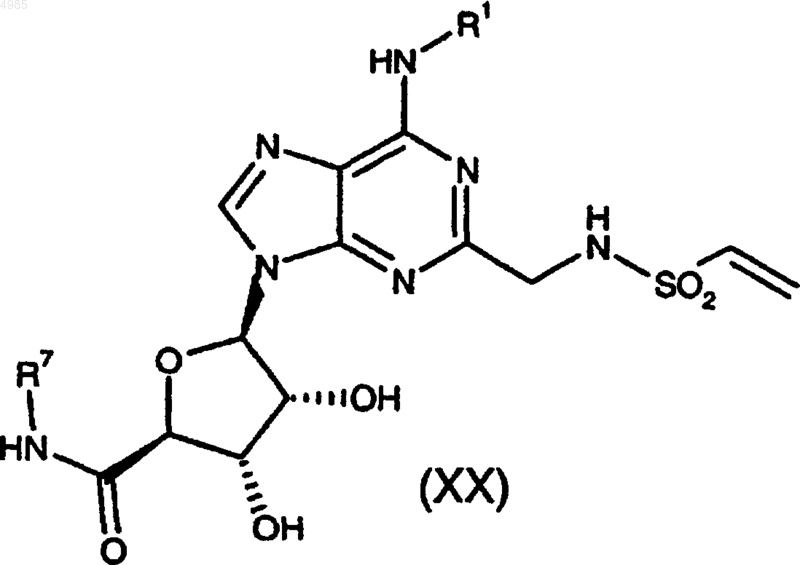
где R1 и R7 имеют значения, указанные в п.1, с соединением формулы
R8R9NH (XXI),
где R8 и R9 имеют значения, указанные в п.1;
причем за указанным способом, необязательно, следует превращение соединения формулы (I) в его фармацевтически приемлемую соль.
29. Соединение формулы
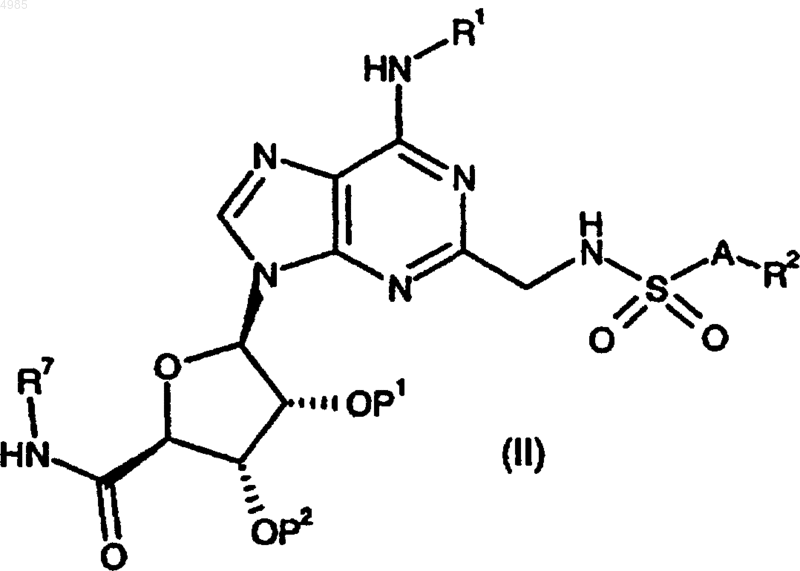
где P1 и P2, когда они взяты по отдельности, представляют защитные группы, или, когда они взяты вместе, представляют защитную группу.
30. Соединение формулы
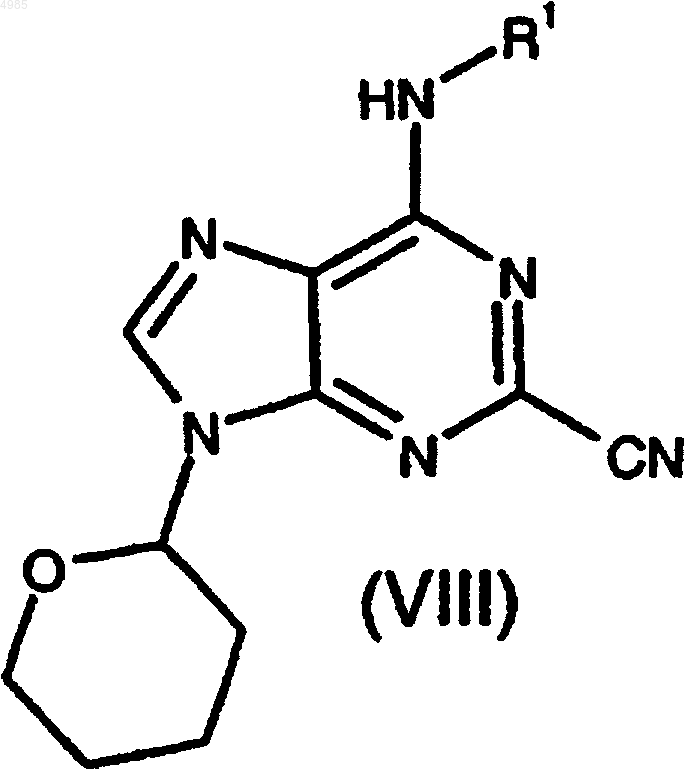
причем группа R1 представляет C1-C6-алкил, необязательно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанный фенил и нафтил необязательно замещен C1-C6-алкилом, C1-C6-алкокси, галогеном или циано.
31. Соединение формулы
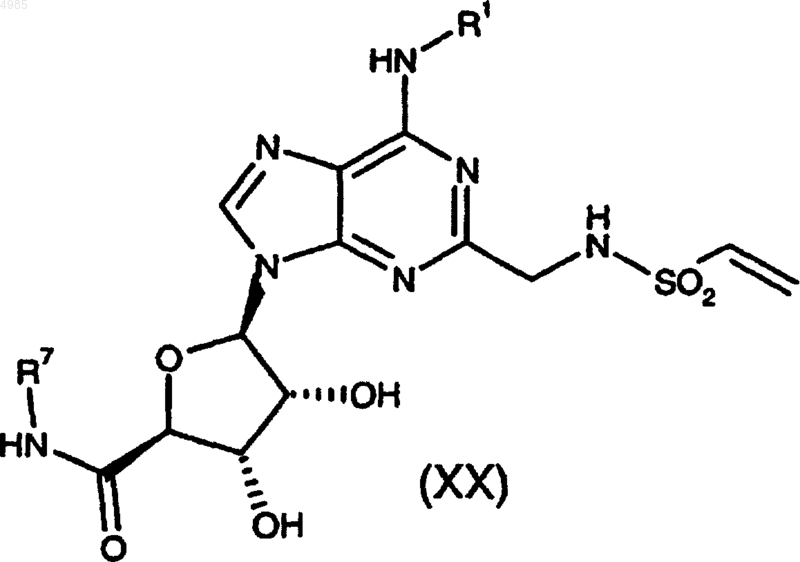
причем группы R1 и R2 имеют значения, указанные в п.1.
Текст
1 Данное изобретение относится к производным пурина. Более конкретно, данное изобретение относится к производным N-[(пурин 2-ил)метил]сульфонамида и способам получения промежуточных продуктов, используемых при получении таких производных, композициям, содержащим такие производные, и применению таких производных. Данные производные являются селективными, функциональными агонистами рецептора аденозина А 2 а человека, их можно использовать в качестве противовоспалительных агентов при лечении, inter alia, заболеваний дыхательных путей. Аденозин является молекулой, играющей центральную роль в промежуточном метаболизме млекопитающих. Независимо от этого,аденозин действует на множественные поверхностные рецепторы с продуцированием различных ответных реакций. Классификация рецепторов аденозина показала присутствие по меньшей мере четырех подтипов: A1, A2a, A2b и A3. Было описано, что стимуляция рецепторов аденозина А 2 на поверхности нейтрофилов человека ингибирует в значительной степени ряд функций нейтрофилов. Среди других медиаторов воспаления активированные нейтрофилы могут повреждать ткань легких посредством высвобождения реакционноспособных кислородных радикалов, например супероксидных анионных радикалов (O2-), и гранулярных продуктов, например эластазы нейтрофилов человека (HNE). Кроме того, активированные нейтрофилы осуществляют как синтез de novo, так и высвобождение арахидонатных продуктов,таких как лейкотриен В 4 (LTB4). LTB4 является сильнодействующим хемоаттрактантом, который индуцирует рекрутинг дополнительных нейтрофилов к очагу воспаления, тогда как высвобожденные О 2- и HNE неблагоприятно действуют на легочную внеклеточную матрицу. Подтип рецептора А 2, опосредующий многие из этих ответных реакций (высвобождение O2 иLTB4/HNE и клеточную адгезию), определяют как А 2 а. Остается установить подтип А 2 (А 2 а или А 2b) , опосредующий другие эффекты. Патент США 5877180 раскрывает агонисты рецепторов аденозина А 2 а, которыми являются соединения общей формулы 1, охарактеризованной в описании. Данные соединения очень близки по структуре к соединениям настоящего изобретения, но имеют 6-NH2 и 2-замещение и могут быть 5'-ОН или O-prot. Указанные соединения могут быть использованы при лечении воспалительных заболеваний дыхательных путей, таких как респираторный дистресс-синдром взрослых (ARDS),бронхит и многие другие. Предпочтительно для лечения указанных заболеваний вводить эффективное количество соединения формулы 1 совместно с ингибитором фосфодиэстеразы. Кроме того, известны производные аденина,которые являются селективными, функциональными агонистами рецептора аденозина А 2 а чело 004985 2 века, их можно использовать в качестве противовоспалительных агентов при лечении, inter alia,заболеваний дыхательных путей (WO 00/023457). Установлено, что активность селективного агониста в отношении А 2 а-рецептора оказывает более сильное терапевтическое действие, чем использование неселективных агонистов рецептора аденозина вследствие того, что взаимодействие с другими подтипами ассоциируется с вредными действиями в легких в исследованиях на моделях животных и тканях человека. Например, истинные астматики характеризуются сужением бронхов при антигенной стимуляции введенным ингаляцией аденозином. Данная ответная реакция, по меньшей мере, частично обусловлена активацией подтипа рецептора А 1. Активация рецепторов А 1 также стимулирует хемотаксис нейтрофилов и адгезию с эндотелиальными клетками, таким образом, стимулируя повреждение легких. Кроме того, многим пациентам с респираторным заболеванием могут быть совместно прописаны 2 агонисты, и в исследованиях на животных было показано негативное взаимодействие между рецепторами изопреналина и аденозина, негативно связанных с аденилатциклазой. Дегрануляцию тучных клеток человека стимулируют активацией рецепторов аденозина А 2b, таким образом, селективность по сравнению с рецептором А 2b также является выгодной. Нами теперь неожиданно установлено, что данные производные пурина ингибируют функцию нейтрофилов и являются селективными агонистами рецептора аденозина А 2 а. Они могут иметь также антагонистическую активность в отношении рецептора аденозина A3. Настоящие соединения можно использовать для лечения любого заболевания, для которого показан агонист рецептора аденозина А 2 а. Их можно использовать для лечения заболевания, в которое включается индуцированное лейкоцитом (например, нейтрофилом, эозинофилом, базофилом, лимфоцитом,макрофагом) повреждение ткани. Их можно использовать в качестве противовоспалительных агентов при лечении заболеваний дыхательных путей, таких как респираторный дистресссиндром взрослых (ARDS), бронхит, хронический бронхит, хроническое закупоривающее легочное заболевание, муковисцидоз, астма, эмфизема,бронхоэктаз, хронический синусит и ринит. Настоящие соединения можно также использовать при лечении септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии, церебральной ишемии, периферического васкулярного заболевания, послеишемического повреждения при реперфузии, диабета, ревматоидного артрита, рассеянного склероза, псориаза,дерматита, аллергического дерматита, экземы,неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника,гастрита, вызванного Heliobacter pylori, гастрита,вызванного не Heliobacter pylori, повреждения желудочно-кишечного тракта, вызванного несте 3 роидным противовоспалительным лекарственным средством, или психотического нарушения или для заживления ран. В соответствии с этим, настоящее изобретение предлагает соединение формулы или его фармацевтически приемлемую соль или сольват,где R1 представляет водород или C1-С 6 алкил, необязательно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанный фенил и нафтил, необязательно, замещен C1-С 6 алкилом, C1-С 6-алкокси, галогеном или циано; А представляет связь или C1-С 3-алкилен;(iii) С-связанный, 4-11-членный, моно- или бициклический гетероцикл, имеющий либо от 1 до 4 атомов азота в кольце, либо 1 или 2 атома азота и 1 атом кислорода или 1 атом серы в кольце, и необязательно С-замещенный оксо,C1-С 6-алкокси-(C1-С 6)-алкилом, R3R3N-(C1-С 6)алкилом, фтор-(C1-С 6)-алкилом, фтор-(C1-С 6)алкокси, фтор-(С 2-С 5)-алканоилом, галогеном,циано -OR5, R6, -COR5, -NR5R5, -COOR5,-S(O)mR6, -SO2NR5R5, -CONR5R5, -NR5SO2R6 илиR7 представляет метил, этил или циклопропилметил и либо R8 и R9, взятые вместе с атомом азота, к которому они присоединены,представляют азетидинил, пирролидинил, пиперидинил, морфолинил, пиперазинил, гомопиперидинил, гомопиперазинил или тетрагидроизохинолинил, каждый из которых, необязательно, замещен у атома углерода кольца C1-С 6 алкилом, C3-С 8-циклоалкилом, фенилом, C1-С 6 алкокси-(C1-С 6)-алкилом, R3R3N-(C1-С 6)-алкилом,фтор-(C1-С 6)-алкилом, -CONR3R3, -COOR3 или(С 2-С 5)-алканоилом и необязательно замещен у атома углерода кольца, не являющегося соседним с атомом азота кольца, фтор-(C1-С 6)алкокси, галогеном, -OR3, циано, -S(O)mR4,-NR3R3, -SO2NR3R3, -NR3COR4 или -NR3SO2R4, и указанный пиперазин-1-ил и гомопиперазин-1 ил необязательно замещен у атома азота кольца,не связанного с А, C1-С 6-алкилом, фенилом, C1 С 6-алкокси-(С 2-С 6)-алкилом,R3R3N-(С 2-С 6)алкилом, фтор-(C1-С 6)-алкилом, С 2-С 5-алканоилом, -COOR4, С 3-С 8-циклоалкилом, -SO2R4,-SO2NR3R3 или -CONR3R3,либо R8 представляет Н, C1-С 6-алкил, С 3 С 8-циклоалкил, фенил или бензил и R9 представляет Н, C1-С 6-алкил, C3-С 8-циклоалкил, фенил, бензил, фтор-(C1-С 6)-алкил, -CONR3R3,-COOR4, С 2-С 5-алканоил или -SO2NR3R3. В вышеуказанных определениях галоген означает фтор, хлор, бром или иод и алкильные,алкиленовые, алканоильные и алкоксигруппы,содержащие требуемое число атомов углерода,могут быть неразветвленной или разветвленной цепью. Гетероцикл, как определено выше в R2,часть (iii), может быть ароматическим или полностью или частично насыщенным. Выражение С-связанный, используемое в определении R2 иhet, означает, что группа связана с соседним атомом углерода кольца. Примеры алкила включают метил, этил, н-пропил, изопропил, нбутил, изобутил, втор-бутил и трет-бутил. Примеры алкокси включают метокси, этокси, нпропокси, изопропокси, н-бутокси, изобутокси,втор-бутокси и трет-бутокси. Примеры алкилена включают метилен, 1,1-этилен, 1,2-этилен, 1,3 пропилен и 1,2-пропилен. Примеры циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. 5 Фармацевтически приемлемые соли соединений формулы (I) включают их кислотноаддитивные соли и соли оснований. Подходящие кислотно-аддитивные соли образуют из кислот, образующих нетоксичные соли, и примерами их являются гидрохлоридная, гидробромидная, гидроиодидная, сульфатная, бисульфатная, нитратная, фосфатная, гидрофосфатная, ацетатная, малеатная, фумаратная,лактатная, тартратная, цитратная, глюконатная,сукцинатная, сахаратная, бензооатная, метансульфонатная, этансульфонатная, бензолсульфонатная, п-толуолсульфонатная и памоатная соли. Подходящие соли оснований образуют из оснований, образующих нетоксичные соли, и примерами их являются соли натрия, калия,алюминия, кальция, магния, цинка и диэтаноламина. Для обзора подходящих солей см. Berge etal., J. Pharm. Sci., 1977, 66, 1-19. Фармацевтически приемлемые сольваты соединений формулы (I) включают их гидраты. В настоящий объем соединений формулы I включаются также их полиморфы. Соединение формулы (I) может содержать один или несколько дополнительных асимметричных атомов углерода и поэтому существует в двух или более стереоизомерных формах. Настоящее изобретение включает индивидуальные стереоизомеры соединений формулы (I) вместе с их смесями. Разделение диастереоизомеров можно достичь общепринятыми методиками, например фракционной кристаллизацией, хроматографией или ВЭЖХ стереоизомерной смеси соединения формулы (I) или его подходящей соли или производного. Индивидуальный энантиомер соединения формулы (I) можно также получить из соответствующего оптически чистого промежуточного продукта или разделением, например ВЭЖХ, соответствующего рацемата с использованием подходящей хиральной основы, или фракционной кристаллизацией диастереоизомерных солей, образованных взаимодействием соответствующего рацемата с подходящей оптически активной кислотой или основанием, что необходимо. Предпочтительно, R1 представляет C1-С 6 алкил, необязательно замещенный 1 или 2 фенильными группами, причем указанная фенильная группа(ы) необязательно замещена C1-С 6 алкокси. Предпочтительно R1 представляет C1-С 6 алкил, замещенный 1 или 2 фенильными группами, причем указанная фенильная группа(ы) необязательно замещена C1-С 6-алкокси. Предпочтительно R1 представляет C1-С 4 алкил, замещенный 1 или 2 фенильными группами, причем указанная фенильная группа(ы) необязательно замещена С 1-С 4-алкокси. 6 Предпочтительно R1 представляет C1-С 2 алкил, замещенный 1 или 2 фенильными группами, причем указанная фенильная группа(ы) необязательно замещена C1-С 4-алкокси. Предпочтительно R1 представляет дифенилэтил или (метоксифенил)метил. Предпочтительно R1 представляет 2,2-дифенилэтил или (4-метоксифенил)метил. Предпочтительно R1 представляет 2,2-дифенилэтил. Предпочтительно А представляет связь. Предпочтительно А представляет C1-С 3 алкилен. Предпочтительно А представляет C2-С 3 алкилен. Предпочтительно А представляет С 2-алкилен. Предпочтительно А представляет -СН 2 СН 2-. Предпочтительно R2 представляет C1-С 6 алкил, фенил, нафтил или -NR8R9, причем-NR8R9 предпочтительно представляет пиперидин-1-ил и указанный фенил необязательно замещен фенилом. Предпочтительно R2 представляет С 1-С 4 алкил, фенил, нафтил или пиперидин-1-ил, причем указанный фенил необязательно замещен фенилом. Предпочтительно R2 представляет метил,н-пропил, изопропил, 2-метилпроп-1-ил, фенил,нафтил или пиперидин-1-ил, причем указанный фенил необязательно замещен фенилом. Предпочтительно R2 представляет метил,н-пропил, изопропил, 2-метилпроп-1-ил, фенил,4-фенилфенил, 1-нафтил, 2-нафтил или пиперидин-1-ил. Предпочтительно -A-R2 представляет метил, н-пропил, изопропил, 2-метилпроп-1-ил,фенил, 4-фенилфенил, фенилметил, 1-нафтил, 2 нафтил или 2-(пиперидин-1-ил)этил. Предпочтительно R7 представляет этил. Предпочтительные примеры соединений формулы (I) включают соединения приведенных ниже примеров, включая любые их фармацевтически приемлемые соли. Все соединения формулы (I) можно получить общепринятыми путями, например методиками, описанными в общих способах, представленных ниже, или конкретными способами,описанными в примерах, или подобными им способами. Настоящее изобретение включает также, кроме любых новых промежуточных продуктов, использованных здесь, любой один или несколько этих способов для получения соединений формулы (I). В общих описанных способах R1, R2, R7 и А имеют ранее указанные значения, если не оговорено особо. Все соединения формулы (I) можно получить снятием защиты у соединения формулы 8 Защитные группы Р 1 и Р 2 можно удалить вместе в одну стадию или последовательно в любом порядке. Соединения формулы (II) можно получить в соответствии со схемой I, где X представляет уходящую группу, предпочтительно хлор, и Ас представляет ацетил. Схема I где Р 1 и Р 2 представляют подходящие защитные группы, которые могут быть одинаковыми или различными, или Р 1 и Р 2 могут необязательно образовать часть той же самой защитной группы. Примеры подходящих защитных групп должны быть очевидны специалистам в данной области [см., например, "Protecting Groups inGreen and Peter G. M. Wuts, John Wiley and Sons,1991]. Предпочтительными индивидуальными защитными группами являются силил (замещенный тремя группами, выбранными независимо из арила и алкила), алканоил и ароил. Предпочтительной защитной группой, где Р 1 и Р 2 образуют часть той же самой защитной группы, является группа, когда Р 1 и Р 2, взятые вместе, являются C1-С 6-алкиленом. Особенно предпочтительными индивидуальными защитными группами являются бензоил и ацетил. Особенно предпочтительными защитными группами, где Р 1 и Р 2 образуют часть той же самой защитной группы, являются группы, когда Р 1 и Р 2, взятые вместе, являются диметилметиленом. Примеры условий, используемых для достижения снятия защиты, хорошо известны в данной областиand Peter G. M. Wuts, John Wiley and Sons, 1991]. В типичной методике, где Р 1 и Р 2, оба, представляют бензоил, защитные группы можно удалить обработкой раствора соединения формулы (II) в подходящем растворителе, таком как метанол, основанием, таким как карбонат калия,в типичном случае при комнатной температуре. В типичной методике, когда Р 1 и Р 2, взятые вместе, обозначают диметилметилен, снятие защиты можно проводить в присутствии подходящей кислоты, например водной минеральной кислоты, такой как хлористо-водородная кислота. В некоторых случаях, в зависимости от природы защитных групп Р 1 и Р 2 и доступных способов их удаления, может быть целесообразно не выделять соединения формулы (II) после предыдущей стадии реакции, а освободить их от защиты in situ. В типичном случае, когда Р 1 и Р 2,взятые вместе, обозначают диметилметилен,соединение формулы (II) освобождают от защиты in situ в подходящем растворителе, таком как этанол, с использованием хлористо-водородной кислоты при температуре от 20 до 100 С. Соединения формулы II можно получить взаимодействием соединения формулы (III) с силилпроизводным соединения формулы (IV) в соответствии с известными способами. В типичной методике соединение формулы (IV) нагревают в виде суспензии в 1,1,1,3,3,3 гексаметилсилазане в атмосфере азота до тех пор, пока не образуется раствор. Смесь концентрируют досуха и раствор остатка в подходящем растворителе (например, ацетонитриле) 9 обрабатывают соединением формулы (III) и триметилсилил-трифторметансульфонатом, получая при этом соединение формулы (II). Соединения формулы (IV) можно получить гидролизом соединения формулы (V). В типичном случае соединение формулы (V) растворяют в подходящем растворителе, таком как этанол, и обрабатывают кислотой, такой как хлористоводородная кислота. Взаимодействие можно проводить при температуре от 0 до 100 С, предпочтительно при температуре от 20 до 50 С. Соединения формулы (V) можно получить сульфонилированием соединения формулы (VI) соединением формулы (VII). В типичной методике раствор соединения формулы (VI) в подходящем инертном растворителе, таком как дихлорметан, обрабатывают сульфонилирующим агентом. Можно, необязательно, добавить акцептор кислоты, такой как триэтиламин. Соединения формулы (VI) можно получить восстановлением соединения формулы (VIII). Восстановление можно проводить любым подходящим гидридным восстанавливающим агентом или гидрированием. В типичной методике раствор соединения формулы (VIII) в подходящем растворителе, таком как этанол, насыщают газообразличным аммиаком, обрабатывают подходящим катализатором гидрирования, таким как катализатор Pearlmann's, и создают повышенное давление водорода, предпочтительно, до 414 кПа (60 фунтов/кв. дюйм). Соединения формулы (VIII) можно получить взаимодействием соединения формулы (IX) с источником цианиданиона, таким как цианид калия. Взаимодействие в типичном случае проводят в растворителе,таком как N,N-диметилформамид, при повышенной температуре. Соединения формулы (IX) можно получить окислением соединения формулы (X). В типичной методике водный раствор пероксимоносульфата калия добавляют к раствору соединения формулы (X) и гидрокарбоната натрия в подходящем растворителе, таком как смесь воды и ацетона. Соединения формулы(X) можно получить заменой хлорида в соединении формулы (XI) тиометоксидом. В типичном случае взаимодействие проводят в полярном растворителе, таком как N,N-диметилформамид, при повышенных температурах и в атмосфере азота. Тиометоксид можно использовать в форме соли щелочного металла, такой как тиометоксид натрия. Соединения формулы (XI) можно получить взаимодействием соединения формулы (XII) с подходящим первичным амином. В типичном случае раствор дихлорпурина(XII) в подходящем растворителе, таком как изопропиловый спирт, обрабатывают таким амином и нагревают предпочтительно при кипячении с обратным холодильником. Можно,необязательно, добавить акцептор кислоты, такой как N-этил-N-изопропил-2-пропанамин. Соединение (XII) можно получить взаимодействием 2,6-дихлор-9 Н-пурина (XIII) с 2,3-дигид 004985 10 ропираном в подходящем растворителе, таком как этилацетат, и в присутствии кислотного катализатора, такого как 4-толуол-сульфоновая кислота, обычно при повышенной температуре. Соединения формулы (II) можно получить также взаимодействием амина формулы (XIV) с сульфонилирующим агентом формулы (VII),как показано на схеме 2, где X представляет уходящую группу, предпочтительно, хлор, Ас представляет ацетил и Р 1 и Р 2 имеют значения,указанные выше. Схема 2 В типичной методике раствор соединения формулы (XIV) в подходящем инертном растворителе, таком как дихлорметан, обрабатывают соединением формулы (VII). Необязательно можно добавить акцептор кислоты, такой как триэтиламин. Соединения формулы (XIV), где Р 1 и Р 2, взятые вместе, представляют диметилметилен, например, можно получить восстановлением соединения формулы (XV). Восстановление можно проводить любым подходящим гидридным восстанавливающим агентом или гидрированием. В типичной методике, где Р 1 и Р 2, взятые вместе, представляют диметилметилен, раствор соединения формулы (XV) в подходящем растворителе, таком как этанол, насыщают газообразным аммиаком, обрабатывают подходящим катализатором гидрирования, таким как 5% мас./мас. палладий на угле, и создают повышенное давление водорода предпочтительно приблизительно до 1034 кПа (150 фунтов/кв. дюйм). Соединения формулы (XV) можно получить взаимодействием соединения формулы (III) с соединением формулы (XVI) известными способами. В типичной методике смесь соединения формулы (XVI), соединения формулы (III) и иода нагревают приблизительно при 150 С при пониженном давлении. Что касается условий, которые используют в последних стадиях, они могут быть подходящими для за 11 мены защитных групп Р 1 и Р 2 в соединениях формулы (XV). Альтернативные подходящие защитные группы хорошо известны специалисту в данной области [например, "ProtectingWiley and Sons, 1991] . В типичном случае, если Р 1 и P2 в соединении формулы (XV) оба представляют бензоил, то эти защитные группы могут быть восприимчивыми к условиям восстановления, используемым в следующей стадии. В данном случае раствор соединения формулы(XV), где Р 1 и Р 2, оба представляют бензоил, в подходящем растворителе, таком как этанол,можно насытить аммиаком с получением соединения формулы (XV), где Р 1 и Р 2 заменены на Н, который можно затем снова заменить более подходящей функциональной группой. Например, соединение формулы (XV), где Р 1 и Р 2 заменены на Н, можно растворить в ацетоне и образовавшийся раствор обработать 2,2-диметоксипропаном и 10-камфорасульфоновой кислотой с получением соединения формулы(XV), где Р 1 и Р 2, взятые вместе, представляют диметилметилен. Соединения формулы (XVI) можно получить гидролизом соединения формулы (VIII). В типичном случае соединение формулы (VIII) растворяют в подходящем растворителе, таком как этанол, и обрабатывают кислотой, такой как хлористо-водородная кислота. Соединения формулы (III), используемые в схемах 1 и 2, можно получить, как показано на схеме 3, где Ас представляет ацетил и Р 1 и Р 2 имеют указанные выше значения. Схема 3 Соединения формулы (III) можно получить обработкой соединения формулы (XVII) смесью уксусной кислоты, уксусного ангидрида и сильной кислоты, такой как хлористо-водородная кислота, предпочтительно с охлаждением (в типичном случае до -10 С). Соединения формулы (XVII) можно получить из кислоты формулы(XVIII) активацией кислоты, например превращением в хлорангидрид кислоты и обработкой активированного промежуточного продукта подходящим первичным амином. В типичной методике соединение формулы (XVIII) растворяют в подходящем инертном растворителе (на 004985N,N-диметилформамида. После удаления избыточного растворителя и реагента упариванием при пониженном давлении остаток растворяют в подходящем растворителе, таком как безводный дихлорметан, и обрабатывают подходящим первичным амином. Что касается условий, используемых в последних стадиях, они могут быть подходящими для изменений защитных групп Р 1 и Р 2 в соединениях формулы (XVII). Альтернативные подходящие защитные группы хорошо известны специалисту в данной области [например, "Protecting Groups in Organic SynthesisG. M. Wuts, John Wiley and Sons, 1991]. В типичном случае раствор соединения формулы(XVII), где Р 1 и Р 2, взятые вместе, представляют диметилметилен, в подходящем растворителе,таком как метанол, можно обработать кислотой,такой как паратолуолсульфонат пиридиния с получением соединения формулы (XVII), где Р 1 и Р 2 оба заменяют на Н, который можно затем снова заменить другой функциональной группой. Например, соединение формулы (XVII), где Р 1 и Р 2 оба заменены на Н, можно растворить в подходящем растворителе, таком как дихлорметан, и образовавшийся раствор можно обработать акцептором кислоты, таким как пиридин и бензоилхлорид, с получением соединения формулы (XVII), где Р 1 и Р 2, каждый, представляют бензоин. Соединения формулы (XVIII) являются известными в данной области (см., например,в J. Amer. Chem. Soc, 1958, 80, 5168). Все соединения формулы (I) можно также получить сульфонилированием соединения формулы (XIX) соединением формулы (VII), как показано на схеме 4, где X представляет уходящую группу, предпочтительно Сl, и Р 1 и Р 2 имеют значения, указанные ранее. Схема 4 По типичной методике раствор соединения формулы (XIX) в подходящем инертном растворителе, таком как дихлорметан, обрабатывают сульфонилирующим агентом формулы (VII). Может быть добавлен, необязательно, акцептор кислоты, такой как триэтиламин. Соединения формулы (XIX) можно получить снятием защиты у соединения формулы (XIV). Примеры условий, используемых для достижения снятия защиты, хорошо известны в данной областиand Peter G. M. Wuts, John Wiley and Sons, 1991]. По типичной методике, когда Р 1 и Р 2 оба представляют бензоил, защитные группы можно удалить обработкой раствором соединения формулы(II) в подходящем растворителе, таком как метанол, основанием, таким как карбонат калия, обычно при комнатной температуре. По типичной методике, когда Р 1 и Р 2, взятые вместе, представляют диметилметилен, снятие защиты можно проводить в присутствии подходящей кислоты, например водной минеральной кислоты, такой как хлористоводородная кислота. Соединения формулы (I), в которой А представляет -СН 2 СН 2- и R2 представляет-NR8R9, можно также получить взаимодействием соединения формулы (XIX) с 2-хлорэтансульфонилхлоридом с получением промежуточного продукта формулы Промежуточный продукт формулы (XX) затем обрабатывают соединением формулы(XXI) в которой R8 и R9 имеют значения, указанные выше, получая при этом соединение формулы (I). Две стадии можно проводить с выделением или без выделения промежуточного продукта формулы (XX). По типичной методике, где промежуточный продукт формулы (XX) не выделяют, раствор соединения формулы(XIX) в подходящем растворителе, таком как ацетонитрил, обрабатывают хлорэтансульфонилхлоридом и основанием, таким как пиридин. Когда взаимодействие по существу завершится(что оценивают тонкослойной хроматографией),добавляют соединение формулы (XXI) и реакционную смесь нагревают предпочтительно при кипячении с обратным холодильником. Соединения формулы (XXI) являются либо коммерчески доступными, либо их легко получают методиками, хорошо известными специалисту в данной области. Соединения формулы (I) можно также подвергать взаимному превращению с использованием общепринятых методик взаимного превращения функциональных групп. Во всех взаимодействиях и получениях новых исходных материалов, используемых в предыдущих способах, используют общепринятые и подходящие реагенты и условия реакций,а также методики выделения целевых продуктов, которые должны быть хорошо известны 14 специалистам в данной области со ссылкой на литературные источники и приведенные ниже примеры и получения. Фармацевтически приемлемую соль соединения формулы (I) можно легко получить смешиванием вместе растворов соединения формулы (I) и требуемой кислоты или основания, что необходимо. Соль можно осадить из раствора и собрать фильтрованием или можно выделить выпариванием растворителя. Противовоспалительные свойства соединений формулы (I) демонстрируют посредством их способности ингибировать нейтрофильную функцию, которая означает активность агониста рецептора А 2 а. Ее оценивают определением профиля соединения в анализе, где продуцирование супероксида измеряют по нейтрофилам,активированным fMLP. Нейтрофилы выделяют из периферической крови человека с использованием декстрановой седиментации с последующим центрифугированием при помощи раствора Ficoll-Hypaque. Любые загрязняющие эритроциты в гранулоцитном осадке центрифугирования удаляют лизисом охлажденной льдом дистиллированной водой. Продуцирование супероксида из нейтрофилов индуцировали fMLP в присутствии примирующей концентрации цитохалазина В. В анализ включали аденозиндеаминазу для удаления любого эндогенно продуцированного аденозина, который может подавить продуцирование супероксида. Мониторинг влияния соединения на fMLP-индуцированную ответную реакцию проводили колориметрическим способом по уменьшению цитохрома С в буфере для анализа. Активность соединений оценивали концентрацией, дающей 50% ингибирование (IС 50) по сравнению с контрольной ответной реакцией на fMLP. Соединения формулы (I) можно вводить взятыми по отдельности, но обычно их вводят в смеси с подходящим фармацевтическим наполнителем, разбавителем или носителем, выбранным в зависимости от предполагаемого пути введения и стандартной фармацевтической практики. Соединения формулы (I) можно вводить,например, перорально, трансбуккально или сублингвально в форме таблеток, капсул, овулей,эликсиров, растворов или суспензий, которые могут содержать корригенты и красящие агенты, для применений с немедленным, замедленным, длительным, импульсным или регулируемым высвобождением. Такие таблетки могут содержать наполнители, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция,гидрофосфат кальция и глицин, дезинтеграторы,такие как крахмал (предпочтительно, крахмал кукурузы, картофеля и тапиоки), натриевая соль гликолята крахмала, натрийкросскармеллоза и некоторые комплексные силикаты, и связующие для грануляции, такие как поливинилпирроли 15 дон, гидроксипропилметилцеллюлоза (НРМС),гидроксипропилцеллюлоза (НРС), сахароза,желатин и аравийская камедь. Кроме того, можно включить смазывающие агенты, такие как стеарат магния, стеариновая кислота, глицерилбегенат и тальк. Твердые композиции подобного типа можно также использовать в качестве наполнителей в желатиновые капсулы. Предпочтительные наполнители в этом отношении включают лактозу, крахмал, целлюлозу, молочный сахар или полиэтиленгликоль с высокой молекулярной массой. Для водных суспензий и/или эликсиров соединения формулы (I) можно сочетать с различными подслащивающими агентами или корригентами, красящим веществом или красителями, с эмульгирующими и/или суспендирующими агентами и с разбавителями, такими как вода, этанол, пропиленгликоль или глицерин, и их комбинациями. Соединения формулы (I) можно также вводить парентеральным, например внутривенным, внутриартериальным, внутрибрюшинным,внутриоболочечным,внутрижелудочковым,внутригрудинным, внутричерепным, внутримышечным или подкожным способом, или их можно вводить способами инфузии. Их лучше всего используют в форме стерильного водного раствора, который может содержать другие вещества, например соли или глюкозу, в количестве, достаточном для того, чтобы сделать раствор изотоничным с кровью. Водные растворы,если необходимо, должны быть подходящим способом забуферены (предпочтительно, до рН от 3 до 9). Получение подходящих парентеральных готовых препаративных форм в стерильных условиях легко выполняют стандартными фармацевтическими способами, хорошо известными специалистам в данной области. Для перорального и парентерального введения пациентам-людям уровень суточной дозы соединений формулы (I) обычно составляет от 0,01 до 100 мг/кг, предпочтительно от 0,1 до 100 мг/кг (в виде одной или разделенных доз). Таким образом, таблетки или капсулы соединения формулы (I) могут содержать от 5 до 500 мг активного соединения для введения однократно или два или более раз, как необходимо. Штатный врач больницы в любом случае может определить действительную дозу, которая будет очень подходящей для любого отдельного пациента и будет изменяться в зависимости от возраста, массы и реакции конкретного пациента. Вышеуказанные дозы являются примером среднего случая. Могут быть, конечно, отдельные случаи, когда необходимы диапазоны более высоких и более низких доз, и они находятся в объеме данного изобретения. Соединения формулы (I) можно также вводить интраназально или посредством ингаляции, в подходящем случае их доставляют в форме ингалятора с сухим порошком или аэро 004985 16 зольного спрея, подаваемого из находящегося под давлением контейнера, насоса, спрея, пульверизатора или распылителя с использованием или без использования подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан (HFA 134A) [товарный знак] или 1,1,1,2,3,3,3 гептафторпропак (HFA 227EA) [товарный знак],диоксида углерода или другого подходящего газа. 3 случае распыляемого аэрозоля дозированную единицу можно определить при помощи клапана для поставки измеренного количества. Контейнер под давлением, насос, спрей, пульверизатор или распылитель может содержать раствор или суспензию активного соединения, в которой используют, например, смесь этанола и пропеллента в качестве растворителя, который может дополнительно содержать смазывающее вещество, например, триолеат сорбитана. Можно изготовить капсулы и картриджи (сделанные,например, из желатина) для использования в ингаляторе или инсуффляторе, которые содержат порошкообразную смесь соединения формулы (I) и подходящей порошкообразной основы, такой как лактоза или крахмал. Готовые препаративные формы в виде аэрозоля или сухого порошка предпочтительно изготовляют так, чтобы каждая измеренная доза или "пуфф" содержал от 20 до 4000 мкг соединения формулы (I) для доставки пациенту. Суммарная суточная доза с аэрозолем находится в диапазоне от 20 мкг до 20 мг, которые можно ввести в виде одинарной дозы или, что наиболее обычно, в виде разделенных доз на всем протяжении дня. В альтернативном случае соединения формулы (I) можно ввести в форме суппозитория или пессария или их можно наносить локально в форме лосьона, раствора, крема, мази или пылящего порошка. Соединения формулы (I) можно также вводить чрескожно, например, с использованием кожного пластыря. Для применения посредством наружного нанесения на кожу соединения формулы (I) можно изготовить в виде подходящей мази, содержащей активное соединение, суспендированное или растворенное, например, в смеси с одним или несколькими следующими компонентами: минеральным маслом, вазелиновым маслом, белым вазелином, пропиленгликолем,соединением полиоксиэтилен-полиоксипропилена, эмульгирующим воском и водой. В альтернативном случае их можно изготовить в виде подходящего лосьона или крема, суспендированного или растворенного, например, в смеси с одним или несколькими следующими компонентами: минеральным маслом, моностеаратом сорбитана, полиэтиленгликолем, жидким парафином, полисорбатом 60, воском в виде цетиловых эфиров, цетеариловым спиртом, 2 17 октилдодеканолом, бензиловым спиртом и водой. Соединения формулы (I) можно также использовать в комбинации с циклодекстрином. Известно, что циклодекстрины образуют комплексы включения и невключения с молекулами лекарственного средства. Образование комплекса лекарственное средство - циклодекстрин может модифицировать растворимость, скорость растворения, биологическую доступность и/или стабильность молекулы лекарственного средства. Комплексы лекарственное средство - циклодекстрин обычно пригодны для большинства лекарственных форм и путей введения. В качестве альтернативы для непосредственного образования комплекса с лекарственным средством циклодекстрин можно использовать в качестве вспомогательной добавки, например носителя,разбавителя или солюбилизатора. Чаще всего используют альфа-,бетаи гаммациклодекстрины и подходящие примеры их описываются в WO-A-91/11172, WO-A-94/02518 и WO-A-98/55148. Следует учесть, что все ссылки здесь на лечение включают терапевтическое, паллиативное и профилактическое лечение. Таким образом, изобретение предлагает:(i) соединение формулы (I) или его фармацевтически приемлемую соль или сольват;(ii) способ получения соединения формулы(I) или его фармацевтически приемлемой соли или сольвата;(iii) фармацевтическую композицию,включающую соединение формулы (I) или его фармацевтически приемлемую соль или сольват вместе с фармацевтически приемлемым наполнителем, разбавителем или носителем;(iv) соединение формулы (I) или его фармацевтически приемлемую соль или сольват для использования в качестве лекарственного средства;(v) применение соединения формулы (I) или его фармацевтически приемлемой соли,сольвата или композиции для приготовления лекарственного средства для лечения заболевания, для которого показан агонист рецептора А 2 а;(vi) применение соединения формулы (I) или его фармацевтически приемлемой соли,сольвата или композиции для приготовления противовоспалительного агента;(vii) применение соединения формулы (I) или его фармацевтически приемлемой соли,сольвата или композиции для приготовления лекарственного средства для лечения респираторного заболевания;(viii) применение, как в (vii), где заболевание выбрано из группы, включающей респираторный дистресс-синдром взрослых (ARDS),бронхит, хронический бронхит, хроническое закупоривающее легочное заболевание, муко 004985(ix) применение соединения формулы (I) или его фармацевтически приемлемой соли,сольвата или композиции для приготовления лекарственного средства для лечения септического шока, мужской эректильной дисфункции,гипертензии, удара, эпилепсии, церебральной ишемии, периферического васкулярного заболевания, послеишемического повреждения при реперфузии, диабета, ревматоидного артрита,рассеянного склероза, псориаза, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита, вызванного Heliobacter pylori, гастрита, вызванного не Heliobacterpylori,повреждении желудочнокишечного тракта, вызванного нестероидным противовоспалительным лекарственном средством, или психотического нарушения или для заживления ран;(х) способ лечения млекопитающего, в том числе человека, для терапии заболевания, для которого показан агонист рецептора А 2 а, включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции;(xi) способ лечения млекопитающего, в том числе человека, для терапии воспалительного заболевания, включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции;(xii) способ лечения млекопитающего, в том числе человека, для терапии респираторного заболевания, включающий терапию указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции;(xiii) способ, как в (xii), где заболевание выбрано из группы, включающей респираторный дистресс-синдром взрослых (ARDS), бронхит, хронический бронхит, хроническое закупоривающее легочное заболевание, муковисцидоз,астму, эмфизему, бронхоэктаз, хронический синусит и ринит;(xiv) способ лечения млекопитающего, в том числе человека, для терапии септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии, церебральной ишемии, периферического васкулярного заболевания, послеишемического повреждения при реперфузии, диабета, ревматоидного артрита,рассеянного склероза, псориаза, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита, вызванного Heliobacter pylori, гастрита, вызванного не Heliobacterpylori,повреждении желудочно 19 кишечного тракта, вызванного нестероидным противовоспалительным лекарственным средством, или психотического нарушения или для заживления ран, включающий терапию указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции, и(xv) некоторые новые промежуточные продукты, описанные здесь. Следующие примеры иллюстрируют получение соединений формулы (I). Спектры 1 Н ядерного магнитного резонанса (ЯМР) во всех случаях были совместимы с предполагаемыми структурами. Характеристические химические сдвиги(8) приводятся в частях на миллион в сторону слабого поля от тетраметилсилана с использованием общепринятых аббревиатур для обозначения основных пиков; например с - синглет; д дублет; т - триплет; кв - квартет, м - мультитет,ш. - широкий. Масс-спектры (m/z) регистрировали способом ионизации термораспылением. Следующие аббревиатуры использовали для обычных растворителей: СDСl3 - дейтерохлороформ; ДМСО - диметилсульфоксид. Аббревиатура ТБДМС означает трет-бутилдиметилсилил,фунт/кв. дюйм означает фунты на квадратный дюйм и Et означает этил. Когда используют тонкослойную хроматографию (ТСХ), она относится к ТГХ на силикагеле с использованием силикагелевых пластин 60 F254. Rf представляет расстояние, пройденное соединением, разделенное на расстояние, пройденное фронтом растворителя на пластине ТСХ. Пример 1. (2S,3S,4R,5R)-5-2-[(Бензилсульфонил)амино]метил-6-[(2,2-дифенилэтил) амино]-9 Н-пурин-9-ил-N-этил-3,4-дигидрокситетрагидро-2-фуранкарбоксамид(45 мг, 0,24 ммоль). Смесь перемешивают при комнатной температуре в течение 2 ч. Растворитель удаляют при пониженном давлении и остаток растворяют в этаноле (1 мл). К раствору добавляют хлористо-водородную кислоту (1 М,1 мл) и смесь нагревают при 60 С в течение 8 ч. Растворитель удаляют при пониженном давлении и остаток подвергают азеотропной перегон 004985 20 ке с этанолом (х 2). Остаток очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава дихлорметан:метанол (95:5 по объему), постепенно изменяющегося до состава дихлорметан:метанол(90:10 по объему), при этом получая твердое вещество, которое растирают с диэтиловым эфиром, разбавляют пентаном, фильтруют и сушат с получением указанного в заголовке соединения в виде белого твердого вещества (92 мг). 1 Н-ЯМР (CDCl3 + 2 капли ДМСО-d6) : 7,79 (1 Н, ш. с), 7,13-7,38 (16 Н, м), 5,94 (1 Н, ш. с), 5,81 (2 Н, м), 4,87 (1 Н, ш. м), 4,70 (1 Н, кв),4,60 (1 Н, м), 4,49 (1 Н, д), 4,42 (1 Н, д), 4,16-4,36 Раствор (3aS,4S,6R,6aR)-6-2-(аминометил)6-[(2,2-дифенилэтил)амино]-9 Н-пурин-9-ил-Nэтил-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-карбоксамида (получение 10) (140 мг, 0,25 ммоль) и триэтиламина (0,05 мл, 0,36 ммоль) в безводном дихлорметане (1 мл) обрабатывают раствором 2-пропансульфонилхлорида (40 мг,0,28 ммоль) в безводном дихлорметане (1 мл). Смесь перемешивают при комнатной температуре в течение 18 ч, в течение данного времени растворителю дают возможность свободно выпариваться. Остаток растворяют в этаноле (1 мл), обрабатывают хлористо-водородной кислотой (1 М, 1 мл) и нагревают при 60 С в течение 4 ч. Растворитель удаляют при пониженном давлении и остаток подвергают азеотропной перегонке с этанолом (x2). Остаток затем очищают 21 колоночной хроматографией на силикагеле с элюированием градиентной системой состава дихлорметан:метанол (95:5 по объему), постепенно изменяющегося до состава дихлорметан:метанол (90:10 по объему), при этом получая твердое вещество, которое растирают с диэтиловым эфиром, разбавляют пентаном,фильтруют и сушат с получением указанного в заголовке соединения в виде белого твердого вещества (28 мг). 1 Н-ЯМР (CDCl3 + 1 капля ДМСО-d6) : 7,79 (1 Н, ш. с), 7,13-7,38 (10 Н, м), 5,90 (2 Н, м),5,64 (1 Н, т), 4,78 (2 Н, м), 4,70 (1 Н, ш. м), 4,52(1 Н, м), 4,31 (6 Н, м), 3,38 (1 Н, м), 3,20 (2 Н, м),1,37 (6 Н, д), 1,06 (3 Н, т). МС: 623 (М+). Раствор (3aS,4S,6R,6aR)-6-2-(аминометил)6-[(2,2-дифенилэтил)амино]-9 Н-пурин-9-ил-Nэтил-2,2-диметилтетрагирофуро[3,4-d][1,3]диоксол-4-карбоксамида (получение 10) (140 мг, 0,25 ммоль) и триэтиламина (0,05 мл, 0,36 ммоль) в безводном дихлорметане (1 мл) обрабатывают раствором 1-пропансульфонилхлорида (40 мг,0,28 ммоль) в безводном дихлорметане (1 мл). Смесь перемешивают при комнатной температуре в течение 18 ч, в течение данного времени растворителю дают возможность свободно выпариться. Остаток растворяют в этаноле (1 мл),обрабатывают хлористо-водородной кислотой(1 М, 1 мл) и нагревают при 60 С в течение 4 ч. Растворитель удаляют при пониженном давлении и остаток подвергают азеотропной перегонке с этанолом (x2). Остаток подвергают азеотропной перегонке с этанолом (х 2). Остаток затем очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава дихлорметан:метанол (95:5 по объему), постепенно изменяющегося до состава дихлорметан:метанол (90:10 по объему), при этом получая твердое вещество, которое растирают с диэтиловым эфиром, разбавляют пентаном, фильтруют и сушат с получением указанного в заголовке соединения в виде белого твердого вещества (90 мг). 1 Н-ЯМР (CDCl3 + 1 капля ДМСО-d6) : 7,80 (1 Н, ш. с), 7,15-7,35 (10 Н, м), 5,91 (2 Н, м),5,75 (1 Н, т), 4,77 (3 Н, м), 4,52 (1 Н, м), 4,18-4,44(140 мг, 0,25 ммоль) и триэтиламина (0,05 мл,0,36 ммоль) в безводном дихлорметане (1 мл) обрабатывают раствором бензолсульфонилхлорида (50 мг, 0,28 ммоль) в безводном дихлорметане (1 мл). Смесь перемешивают при комнатной температуре в течение 18 ч, в течение данного времени растворителю дают возможность свободно выпариться. Остаток растворяют в этаноле (1 мл), обрабатывают хлористоводородной кислотой (1 М, 1 мл) и нагревают при 60 С в течение 8 ч. Растворитель удаляют при пониженном давлении и остаток подвергают азеотропной перегонке с этанолом (x2). Остаток затем очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава дихлорметан:метанол(95:5 по объему), постепенно изменяющегося до состава дихлорметан:метанол (90:10 по объему),получая при этом твердое вещество, которое растирают со смесью диэтиловый эфир/пентан,фильтруют и сушат с получением указанного в заголовке соединения в виде белого твердого вещества (85 мг). 1(J. Pharm. Sci., 1964, 53, 73) (71 мг, 0,28 ммоль) в безводном дихлорметане (1 мл). Смесь перемешивают при комнатной температуре в течение 18 ч, в течение данного времени растворителю дают возможность свободно выпариться. Остаток растворяют в этаноле (1 мл), обрабатывают хлористо-водородной кислотой (1 М, 1 мл) и нагревают при 60 С в течение 15 ч. Растворитель удаляют при пониженном давлении и остаток подвергают азеотропной перегонке с этанолом (x2). Остаток затем очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава дихлорметан:метанол (95:5 по объему), постепенно изменяющегося до состава дихлорметан:метанол(90:10 по объему), получая при этом твердое вещество, которое растирают с диэтиловым эфиром, разбавляют пентаном, фильтруют и сушат с получением указанного в заголовке соединения в виде белого твердого вещества (110 мг). 1(140 мг, 0,25 ммоль) и триэтиламина (0,05 мл,0,36 ммоль) в безводном дихлорметане (1 мл) обрабатывают раствором 1-нафталинсульфонилхлорида (63 мг, 0,28 ммоль) в безводном дихлорметане (1 мл). Смесь перемешивают при комнатной температуре в течение 18 ч, в течение данного времени растворителю дают возможность свободно выпариться. Остаток растворяют в этаноле (1 мл), обрабатывают хлористо-водородной кислотой (1 М, 1 мл) и нагревают при 60 С в течение 5,5 ч. Растворитель удаляют при пониженном давлении и остаток подвергают азеотропной перегонке с этанолом (x2). Остаток затем очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава дихлорметан:метанол(95:5 по объему), постепенно изменяющегося до состава дихлорметан:метанол (90:10 по объему),при этом получая твердое вещество, которое растирают с диэтиловым эфиром, промывают пентаном и сушат с получением указанного в заголовке соединения в виде белого твердого вещества (98 мг). 1 Раствор (3aS,4S,6R,6aR)-6-2-(аминометил)6-[(2,2-дифенилэтил)амино]-9 Н-пурин-9-ил-Nэтил-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-карбоксамида (получение 10) (140 мг, 0,25 ммоль) и триэтиламина (0,05 мл, 0,36 ммоль) в безводном дихлорметане (1 мл) обрабатывают раствором 2-нафталинсульфонилхлорида (63 мг,0,28 ммоль) в безводном дихлорметане (1 мл). Смесь перемешивают при комнатной температуре в течение 18 ч, в течение данного времени растворителю дают возможность свободно выпариться. Остаток растворяют в этаноле (1 мл),обрабатывают хлористо-водородной кислотой(1 М, 1 мл) и нагревают при 60 С в течение 15 ч. Растворитель удаляют при пониженном давлении и остаток подвергают азеотропной перегонке с этанолом (x2). Остаток затем очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава дихлорметан:метанол (95:5 по объему), постепенно изменяющегося до состава дихлорметан:метанол (90:10 по объему) с получением твердого вещества, которое растирают с диэтиловым эфиром, промывают пентаном, фильтруют и сушат с получением указанного в заголовке соединения в виде белого твердого вещества(140 мг, 0,25 ммоль) и триэтиламина (0,05 мл,0,36 ммоль) в безводном дихлорметане (1 мл) обрабатывают раствором метансульфонилхлорида (32 мг, 0,28 ммоль) в безводном дихлорметане (1 мл). Смесь перемешивают при комнатной температуре в течение 18 ч, в течение данного времени растворителю дают возможность свободно выпариться. Остаток растворяют в этаноле (1 мл), обрабатывают хлористоводородной кислотой (1 М, 1 мл) и нагревают при 60 С в течение 4 ч. Растворитель удаляют при пониженном давлении и остаток подвергают азеотропной перегонке с этанолом (x2). Остаток затем очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава дихлорметан:метанол(95:5 по объему), постепенно изменяющегося до состава дихлорметан:метанол (90:10 по объему),получая при этом твердое вещество, которое растирают с диэтиловым эфиром, промывают пентаном и сушат с получением указанного в заголовке соединения в виде белого твердого вещества (80 мг). 1 Н-ЯМР (CDCl3 + 1 капля ДМСО-d6) : 7,81 (1 Н, ш. с), 7,13-7,37 (10 Н, м), 5,90 (3 Н, м),4,94 (1 Н, м), 4,75 (1 Н, м), 4,65 (1 Н, м), 4,50 (2 Н,м), 4,32 (4 Н, м), 3,38 (1 Н, м), 3,22 (1 Н, м), 2,90(10 мл) обрабатывают карбонатом калия (190 мг, 1,37 ммоль). Смесь перемешивают при комнатной температуре в течение 30 мин, после данного времени смесь фильтруют и растворитель удаляют из фильтрата при пониженном давлении. Остаток распределяют между дихлорметаном и водой. Органическую фазу отделяют, промывают насыщенным раствором соли,сушат над безводным сульфатом магния,фильтруют и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол (95:5 по объему), при этом получая указанное в заголовке соединение в виде белого твердого вещества (170 мг). 1(получение 22) (40 мг, 0,05 ммоль) в метаноле (2 мл) обрабатывают карбонатом калия (28 мг, 0,20 ммоль). Смесь перемешивают при комнатной температуре в течение 20 мин, после этого времени образуется осадок. К смеси для растворе 27 ния осадка добавляют дихлорметан (10 мл). Смесь затем фильтруют и фильтрат упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол(95:5 по объему) с получением указанного в заголовке соединения в виде белого твердого вещества (21 мг). 1 Н-ЯМР (ДМСО-d6) : 8,45 (2 Н, м), 8,26 2-Хлорэтансульфонилхлорид (0,12 мл, 1,16 ммоль) добавляют к раствору (2S,3S,4R,5R)-52-(аминометил)-6-[(2,2-дифенилэтил)амино]9 Н-пурин-9-ил-N-этил-3,4-дигидрокситетрагидро-2-фуранкарбоксамида (получение 27) (600 мг, 1,16 ммоль) в смеси пиридина (2,5 мл) и ацетонитрила (10 мл). Реакционную смесь перемешивают в течение 1 ч при комнатной температуре. Затем добавляют пиперидин (1,0 мл, 10 ммоль) и реакционную смесь нагревают при кипячении с обратным холодильником в течение 16 ч. Реакционную смесь затем разбавляют этилацетатом (50 мл) и промывают водой (30 мл). Слой этилацетата сушат (безводным сульфатом магния) и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол:аммиак (95:5:0,5 по объему) с повышением полярности смеси до состава дихлорметан: метанол:аммиак (90:10:1 по объему). Растворитель удаляют при пониженном давлении и остаток снова очищают колоночной хроматографией на силикагеле с элюированием смесью этилацетат:метанол: аммиак (95:5:0,5 по объему) с повышением полярности смеси до состава этилацетат:метанол:аммиак (90:10:1 по объему). Растворитель удаляют при пониженном давлении и остаток снова очищают колоночной хроматографией на силикагеле при элюировании смесью этилацетат:метанол (95:5 по объему) с повышением полярности до состава этилацетат:метанол(90:10 по объему), затем смеси этилацетат:метанол:аммиак (90:10:1 по объему). Растворитель удаляют при пониженном давлении с(1 Н, м), 2,65-2,55 (1 Н, м), 2,35-2,25 (4 Н, м), 1,651,50 (4 Н, м), 1,45-1,35 (2 Н, м), 1,10-1,05 (3 Н, м). В следующих получениях описывается получение некоторых промежуточных продуктов,используемых в предыдущих примерах. Получение 1. 2,6-Дихлор-9-тетрагидро-2 Нпиран-2-ил-9 Н-пурин 2,6-Дихлор-9 Н-пурин (20 г, 0,11 моль) и моногидрат 4-толуолсульфоновой кислоты (0,2 г) растворяют в этилацетате (300 мл), смесь нагревают до 50 С и на протяжении 30 мин медленно добавляют раствор 2,3-дигидропирана(12,6 мл, 0,14 моль) в этилацетате (50 мл). Реакционную смесь охлаждают до комнатной температуры, добавляют воду (100 мл) и рН раствора регулируют до 7 добавлением насыщенного водного раствора гидрокарбоната натрия. Органический слой отделяют, промывают последовательно водой и насыщенным раствором соли, сушат над безводным сульфатом магния,фильтруют и упаривают при пониженном давлении. Остаток подвергают азеотропной перегонке с пентаном (х 2), при этом получая указанное в заголовке соединения в виде слегка загрязненного белого твердого вещества (30,9 г). 1 Н-ЯМР (CDCl3) : 8,30 (1 Н, с), 5,75 (1 Н,дд), 4,25-4,15 (1 Н, м), 3,85-3,70 (1 Н, м), 2,20-1,60(24,8 г, 0,13 моль) и образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 3 ч. Растворитель удаляют при пониженном давлении и остаток подвергают азеотропной перегонке с этилацетатом. Остаток затем очищают колоночной хроматографией на силикагеле при элюировании с градиентной системой состава этилацетат:гексан (40:60 по объему), изменяющегося до состава этилацетат:гексан (60:40 по объему) с получением ука 29 занного в заголовке соединения в виде пены Раствор 2-хлор-N-(2,2-дифенилэтил)-9-тетрагидро-2 Н-пиран-2-ил-9 Н-пурин-6-амина (получение 2) (49,7 г, 0,11 моль) в сухом N,N-диметилформамиде (200 мл) обрабатывают тиометоксидом натрия (10 г, 14 моль) и образовавшуюся смесь нагревают в атмосфере азота при 100 С в течение 90 мин. Смесь затем перемешивают при комнатной температуре в течение 72 ч и затем снова нагревают при 100 С в течение дополнительных 2 ч. Реакционную смесь затем охлаждают и разбавляют водой (1000 мл). Образуется суспензия, которую экстрагируют в диэтиловый эфир (х 2). Объединенные органические слои промывают последовательно водой и насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и упаривают при пониженном давлении. Остаток подвергают азеотропной перегонке с диэтиловым эфиром, затем с пентаном, при этом получая указанное в заголовке соединение в виде пены(200 мл) добавляют по каплям на протяжении 2 ч к раствору N-(2,2-дифенилэтил)-2-(метилсульфанил)-9-тетрагидро-2 Н-пиран-2-ил-9 Н-пурин 6-амина (получение 3) (25 г, 56,2 ммоль) и гидрокарбоната натрия (20 г, 238 ммоль) в ацетоне(1000 мл) и воде (250 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 24 ч и фильтруют и остаток промывают ацетоном. Ацетон удаляют из фильтрата 30 при пониженном давлении и образовавшийся водный остаток экстрагируют этилацетатом и затем дихлорметаном. Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным сульфатом магния,фильтруют и упаривают при пониженном давлении. Остаток растирают с диэтиловым эфиром, фильтруют, промывают диэтиловым эфиром и пентаном и затем сушат с получением указанного в заголовке соединения в виде белого твердого вещества (20,32 г). 1N-(2,2-дифенилэтил)-2-(метилсульфонил)-9-тетрагидро-2 Н-пиран-2-ил-9 Н-пурин-6-амина (получение 4) (20,1 г, 42,1 ммоль) в сухом N,N-диметилформамиде (100 мл) обрабатывают цианидом калия (5,5 г, 84,6 ммоль) и смесь нагревают при 120 С в течение 24 ч в атмосфере азота. Смесь затем охлаждают до комнатной температуры, разбавляют водой (1000 мл) и перемешивают в течение дополнительного 1 ч. Образовавшееся твердое вещество медленно фильтруют и промывают несколько раз водой. Твердое вещество растворяют в дихлорметане и образовавшийся раствор промывают водой, сушат безводным сульфатом магния,фильтруют и упаривают при пониженном давлении. Остаток подвергают азеотропной перегонке с диэтиловым эфиром два раза с получением указанного в заголовке соединения в виде масла (17 г). 1 Н-ЯMР (CDCl3) : 8,00 (1 Н, с), 7,40-7,20(2 н, 50 мл) и смесь перемешивают при комнатной температуре в течение 24 ч. Растворитель удаляют при пониженном давлении и остаток подвергают два раза азеотропной перегонке с этанолом. Остаток растирают с диэтиловым эфиром и образовавшееся твердое вещество фильтруют, промывают диэтиловым эфиром и пентаном и сушат с получением указанного в заголовке соединения в виде белого твердого вещества (14,3 г). МС: 341 (МН+). 1 Н-ЯМР (ДМСО-d6) : 8,30 (1 Н, с), 8,058,20 (1 Н, ш. с), 7,10-7,40 (10 Н, м), 4,40-4,60 Смесь 6-[(2,2-дифенилэтил)амино]-9 Н-пурин-2-карбонитрила (получение 6) (5,00 г, 14,7 ммоль), (2S,3R,4R)-5-(ацетилокси)-4-(бензоилокси)-2-[(этиламино)карбонил]тетрагидро-3-фуранилбензоат (получение 26) (6,50 г, 14,7 ммоль) и иода (0,38 г, 15,0 ммоль) нагревают при 150 С при пониженном давлении в течение 2,5 ч и затем оставляют стоять при комнатной температуре в течение 18 ч. Остаток очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава этилацетат:пентан (40:60 по объему), постепенно изменяющегося до чистого этилацетата с получением указанного в заголовке соединения в виде пены (4,95 г). 1 Н-ЯМР (CDCl3) : 8,12 (3 Н, м), 7,79 (3 Н,м), 7,63 (1 Н, м), 7,50 (3 Н, м), 7,16-7,38 (11 Н, м),6,35 (2 Н, м), 6,10 (1 Н, т), 6,03 (1 Н, д), 4,94 (1 Н,м), 4,35 (3 Н, м), 3,57 (2 Н, м), 1,30 (3 Н, т). Получение 8. (2S,3S,4R,5R)-5-2-Циано-6[(2,2-дифенилэтил)амино]-9 Н-пурин-9-ил-Nэтил-3,4-дигидрокситетрагидро-2-фуранкарбоксамид 32 Раствор (2S,3S,4R,5R)-4-(бензоилокси)-52-циано-6-[(2,2-дифенилэтил)амино]-9 Н-пурин-9-ил-2-[(этиламино)карбонил]тетрагидро 3-фуранилбензоата (пример 7) (4,75 г, 6,59 ммоль) в этаноле (200 мл) насыщают газообразличным аммиаком и перемешивают при комнатной температуре в течение 18 ч. Растворитель удаляют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава дихлорметан:метанол (95:5 по объему), постепенно изменяющегося до состава дихлорметан:метанол (90:10 по объему) с получением указанного в заголовке соединения в виде твердого вещества (2,80 г). 1 Н-ЯМР (ДМСО-d6) : 8,65 (1 Н, с), 8,54(2S,3S,4R,5R)-5-2-циано-6[(2,2-дифенилэтил)амино]-9 Н-пурин-9-ил-Nэтил-3,4-дигидрокситетрагидро-2-фуранкарбоксамид (получение 8) (2,80 г, 5,46 ммоль) и 2,2 диметоксипропана (8,93 г, 8 5,87 ммоль) в ацетоне (70 мл) обрабатывают 10-камфорасульфоновой кислотой (1,33 г, 5,7 3 ммоль). Образовавшийся раствор перемешивают при комнатной температуре в течение 3 ч. Растворитель удаляют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава диэтиловый эфир:дихлорметан:этилацетат (66:44:0 по объему), постепенно изменяющегося до состава (100:0:0 по объему) и затем (0:0:100 по объему). Остаток затем растворяют в смеси диэтилового эфира и этилацетата и образовавшийся раствор промывают последовательно насыщенным водным гидрокарбонатом натрия, водой и насыщенным раствором соли. Органическую фазу отделяют, сушат над безводным сульфатом магния, фильтруют и упаривают при пониженном давлении с получением указанного в заголовке соединения в виде твердого вещества (2,85 г). МС: 554 (МН+). 1 Н-ЯМР (CDCl3) : 7,85 (1 Н, с), 7,20-7,40(3aS,4S,6R,6aR)-6-2-циано-6[(2,2-дифенилэтил)амино]-9 Н-пурин-9-ил-Nэтил-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-карбоксамида (получение 9) (2,70 г,4,88 ммоль) в этаноле (150 мл) насыщают газообразным аммиаком,обрабатывают 5% мас./мас. палладия на угле (1,00 г), создают повышенное давление водорода до 1034 кПа (150 фунтов/кв. дюйм) в герметизированном сосуде и перемешивают при комнатной температуре в течение 18 ч. Анализ ТСХ показал, что остается некоторое количество исходного материала и поэтому добавляют дополнительный 5% мас./мас. палладий на угле (1,00 г) и в растворе снова создают повышенное давление водорода до 1034 кПа (150 фунтов/кв. дюйм) в герметизированном сосуде и перемешивают при комнатной температуре в течение 24 ч. Смесь фильтруют через подушку арбоцела (товарный знак) и фильтрат упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава дихлорметан: метанол (95:5 по объему), постепенно изменяющегося до состава дихлорметан: метанол (90:10 по объему) с получением указанного в заголовке соединения в виде пены (2,50 г). МС: 558 (МН+). 1 Н-ЯМР (CDCl3) : 7,71 (1 Н, ш. с), 7,147,40 (10 Н, м), 6,08 (1 Н, м), 6,00 (1 Н, т), 5,66 (2 Н,м), 5,47 (1 Н, д), 4,66 (1 Н, с), 4,33 (3 Н, м), 3,95(1,00 г), создают повышенное давление водорода до 414 кПа (60 фунтов/кв. дюйм) в герметизированном сосуде и раствор перемешивают при комнатной температуре в течение 30 ч. Смесь фильтруют через подушку арбоцела (торговая марка) и растворитель удаляют при пониженном давлении. Остаток подвергают азеотропной перегонке с дихлорметаном (х 2) и затем очищают колоночной хроматографией на силикагеле с элюированием смесью состава дихлорметан:метанол (95:5 по объему), постепенно изменяющегося до состава дихлорметан:метанол:0,88 аммиак (90:10:0,5 по объему) с получением указанного в заголовке соединения Раствор N-[2-(аминометил)-9-тетрагидро 2 Н-пиран-2-ил-9 Н-пурин-6-ил]-N-(2,2-дифенилэтил)амина (получение 11) (3,70 г, 8,63 ммоль) и триэтиламина (2,20 г, 21,78 ммоль) в сухом дихлорметане (20 мл) обрабатывают 2-метил-1 пропансульфонилхлоридом (J. Prakt. Chem.,1979, 321, 107-111) (1,48 г, 9,46 ммоль) и смесь перемешивают при комнатной температуре в течение 18 ч. Анализ ТСХ показал, что некоторое количество исходного материала все же остается, и поэтому добавляют дополнительный 2 метил-1-пропансульфонилхлорид (0,2 г, 1,28 ммоль) и смесь перемешивают при комнатной температуре в течение 1 ч. Растворитель удаляют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол (98:2 по объему) с получением указанного в заголовке соединения в виде пены (4,4 г). МС: 549 (МН+). 1 Н-ЯМР (CDCl3) : 7,86 (1 Н, с), 7,16-7,36 Раствор N-(6-[(2,2-дифенилэтил)амино]9-тетрагидро-2 Н-пиран-2-ил-9 Н-пурин-2-илметил)-2-метил-1-пропансульфонамида (получение 12) (4,30 г, 7,84 ммоль) в этаноле (100 мл) нагревают до 37 С и затем обрабатывают хлористо-водородной кислотой (2 н, 15 мл). Смесь оставляют стоять при комнатной температуре в течение 18 ч, после этого времени кристаллический осадок отфильтровывают, промывают этанолом (10 мл) и сушат с получением указанного в заголовке соединения в виде твердого вещества (3,0 г). 1 Суспензию гидрохлорида N-(6-[(2,2-дифенилэтил)амино]-9 Н-пурин-2-илметил)-2-метил-1-пропансульфонамида (получение 13) (0,25 г, 0,50 ммоль) в 1,1,1,3,3,3-гексаметилдисилазане (10 мл) нагревают при кипячении с обратным холодильником в атмосфере азота в течение 90 мин до получения раствора. Раствору дают возможность охладиться до комнатной температуры и растворитель удаляют при пониженном давлении. Остаток подвергают азеотропной перегонке с дихлорметаном и затем ацетонитрилом. Остаток растворяют в ацетонитриле (5 мл) и обрабатывают раствором(2S,3R,4R)-5-(ацетилокси)-4-(бензоилокси)-2[(этиламино)карбонил]тетрагидро-3-фуранилбензоата (получение 26) (0,26 г, 0,59 ммоль) в ацетонитриле (5 мл) и триметилсилилтрифторметан сульфонатом (0,1 мл, 0,59 ммоль). Образовавшийся раствор затем перемешивают при комнатной температуре в атмосфере азота в течение 18 ч. Смесь разбавляют этилацетатом(20 мл) и промывают насыщенным водным раствором гидрокарбоната натрия. Органический слой отделяют, промывают насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава дихлорметан: метанол (99,5:0,5 по объему), постепенно изменяющегося до состава дихлорметан: метанол (99:1 по объему) с получением указанного в заголовке соединения в виде белой пены (0,29 г). МС: 846 (МН+), 868 (MNa+). 1N,N-диизопропилэтиламином (45,6 мл, 264 ммоль). Образовавшуюся смесь нагревают до 60 С, в этой точке получают раствор. В течение следующих 30 мин из реакционной смеси осаждается белое твердое вещество. После охлаждения смеси до комнатной температуры осадок отфильтровывают и промывают пропан-2-олом с получением указанного в заголовке соединения в виде белого твердого вещества (36,3 г). МС: 374 (МН+). 1 Н-ЯМР (CDCl3) : 7,90 (1 Н, с), 7,28 (2 Н,д), 6,97 (2 Н, д), 6,24 (1 Н, ш. м), 5,69 (1 Н, дд),4,78 (2 Н, ш. м), 4,15 (1 Н, дд), 3,77 (4 Н, м), 1,402,16 (6 Н, м). Получение 16. N-(4-Метоксибензил)-2-(метилсульфанил)-9-тетрагидро-2 Н-пиран-2-ил-9 Нпурин-6-амин(получение 15) (37,4 г, 100 ммоль) в N,N-диметилформамиде (150 мл) обрабатывают метантиолатом натрия (8,75 г, 125 ммоль) и смесь нагревают при 100 С в атмосфере азота в течение 17 ч. Анализ ТСХ показал, что некоторое количество исходного материала все же остается, и поэтому добавляют дополнительный метантиолат натрия (3,5 г, 50 ммоль) и смесь нагревают при 100 С в течение 1 ч. Смесь охлаждают и растворитель удаляют при пониженном давлении. Остаток распределяют между дихлорметаном и водой. Органическую фазу отделяют, промывают последовательно водой и насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и упаривают при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества (40,5 г). МС: 386 (МН+), 408(400 мл) добавляют по каплям на протяжении 1 ч к перемешиваемой суспензии N-(4-метоксибензил)-2-(метилсульфанил)-9-тетрагидро-2 Нпиран-2-ил-9 Н-пурин-6-амина (получение 16)(50 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 48 ч и 38 фильтруют и остаток промывают ацетоном. Ацетон удаляют из фильтрата при пониженном давлении и образовавшийся водный остаток экстрагируют дихлорметаном. Органическую фазу отделяют, промывают насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и упаривают с получением указанного в заголовке соединения з виде кремовой пены (32,28 г). МС: 418 (МН+), 440N-(4-метоксибензил)-2-(метилсульфонил)-9-тетрагидро-2 Н-пиран-2-ил-9 Н-пурин-6-амина (получение 17) (20,0 г, 47,9 ммоль) в N,N-диметилформамиде (100 мл) обрабатывают цианидом калия (6,24 г, 95,8 ммоль) и образовавшуюся смесь нагревают при 100 С в атмосфере азота в течение 48 ч. Смесь затем охлаждают до комнатной температуры, разбавляют водой (1000 мл) и перемешивают в течение 2 ч. Образовавшееся твердое вещество отфильтровывают и промывают несколько раз водой. Твердое вещество затем растворяют в дихлорметане и промывают последовательно водой и насыщенным раствором соли. Органический слой отделяют, сушат над безводным сульфатом магния, фильтруют и упаривают при пониженном давлении. Образовавшееся твердое вещество растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (14,76 г). МС: 365 (МН+). 1 Н-ЯМР (CDCl3) : 8,04 (1 Н, с), 7,27 (2 Н,д), 6,86 (2 Н, д), 6,28 (1 Н, ш. м), 5,70 (1 Н, дд),4,75 (2 Н, ш. м), 4,17 (1 Н, дд), 3,80 (4 Н, м), 1,602,20 (6 Н, м). Получение 19. 2-(Аминометил)-N-(метоксибензил)-9-тетрагидро-2 Н-пиран-2-ил-9 Нпурин-6-амин Суспензию 6-[(4-метоксибензил)амино]-9 тетрагидро-2 Н-пиран-2-ил-9 Н-пурин-2-карбонитрила (получение 18) (3,20 г, 8,78 ммоль) в этаноле (250 мл) насыщают газообразным аммиаком и осторожно нагревают до получения раствора. Раствор затем обрабатывают никелем Ренея (товарный знак) (0,64 г), создают в нем давление водорода до 414 кПа (60 фунтов/кв. дюйм) в герметизированном сосуде и перемешивают при 60 С в течение 18 ч. Анализ ТСХ показал, что некоторое количество исходного материала все же остается, и поэтому добавляют дополнительный никель Ренея (товарный знак)(0,15 г) и в смеси снова создают давление водорода до 414 кПа (60 фунтов/ кв. дюйм) в герметизированном сосуде и смесь перемешивают при 60 С в течение 18 ч. Смесь охлаждают и фильтруют через подушку арбоцела (товарный знак) и растворитель удаляют при пониженном давлении. Остаток подвергают азеотропной перегонке с дихлорметаном (х 2) и затем очищают колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол: 0,88 аммиак (97:2,5:0,5 по объему) с получением указанного в заголовке соединения в виде кремовой пены (1,65 г). МС: 369 (МН+). 1 40 хлорметане (20 мл) и образовавшуюся смесь перемешивают при комнатной температуре в атмосфере азота в течение 2 ч. Смесь промывают последовательно насыщенным водным гидрокарбонатом натрия и насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол (99:1 по объему) с получением указанного в заголовке соединения в виде бледножелтой пены (1,55 г). МС: 489 (МН+). 1(2 н, 4,5 мл). Смесь перемешивают при комнатной температуре в течение 18 ч, после данного времени кристаллический осадок отфильтровывают, промывают этанолом и сушат с получением указанного в заголовке соединения в виде белого твердого вещества (1,03 г). МС: 405 41 Суспензию гидрохлорида N-(6-[(4-метоксибензил)амино]-9 Н-пурин-2-илметил)-2-метил-1-пропансульфонамида (получение 21) (0,25 г, 0,57 ммоль) в 1,1,1,3,3,3-гексаметилдисилазане (10 мл) нагревают при кипячении с обратным холодильником в атмосфере азота в течение 90 мин до получения раствора. Раствору дают возможность охладиться до комнатной температуры и растворитель удаляют при пониженном давлении. Остаток подвергают азеотропной перегонке с дихлорметаном и затем ацетонитрилом. Остаток растворяют в ацетонитриле (5 мл) и обрабатывают раствором(2S,3R,4R)-5-(ацетилокси)-4-(бензоилокси)-2[(этиламино)карбонил]тетрагидро-3-фуранилбензоата (получение 26) (0,30 г, 0,68 ммоль) в ацетонитриле (5 мл) и триметилсилилтрифторметан сульфонатом (0,12 мл, 0,68 ммоль). Образовавшийся раствор перемешивают при комнатной температуре в атмосфере азота в течение 19 ч. Анализ ТСХ показал, что все же остается некоторое количество исходного материала, поэтому добавляют дополнительный триметилсилилтрифторметансульфонат(0,03 мл, 0,17 ммоль) и перемешивание продолжают в течение 3 ч. Смесь разбавляют этилацетатом (20 мл) и промывают насыщенным водным гидрокарбонатом натрия. Органический слой отделяют, промывают насыщенным раствором соли,сушат над безводным сульфатом магния,фильтруют и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава дихлорметан: метанол(99,5:0,5 по объему), постепенно изменяющегося до состава дихлорметан:метанол (99:1 по объему) с получением указанного в заголовке соединения в виде белой пены (245 мг). МС: 786 Оксалилхлорид (14,0 мл, 160 ммоль) добавляют по каплям к перемешиваемому раствору (3aS,4S,6R,6aR)-6-метокси-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-карбоновой кислоты (J. Amer. Chem. Soc, 1958, 80, 51685173) (23,30 г, 107 ммоль) в безводном дихлорметане (120 мл) и N,N-диметилформамиде (2 42 диметилформамиде (2 капли) и смесь перемешивают при комнатной температуре в течение 3 ч до тех пор, пока не прекратиться выделение газа. Анализ ТСХ показал, что некоторое количество исходного материала все же остается,поэтому добавляют дополнительный N,Nдиметилформамид (2 капли) и перемешивание продолжают в течение 1 ч. Растворитель удаляют при пониженном давлении и остаток подвергают азеотропной перегонке с безводным дихлорметаном (х 2). Остаток затем растворяют в безводном дихлорметане (200 мл) и образовавшийся раствор обрабатывают по каплям этиламином (2M в тетрагидрофуране, 140 мл, 280 ммоль). Данный раствор оставляют стоять при комнатной температуре в течение 48 ч. Добавляют диэтиловый эфир (250 мл) и смесь перемешивают в течение 15 мин, фильтруют и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава дихлорметан:этилацетат (100:0 по объему), постепенно изменяющегося до состава дихлорметан:этилацетат (44:66 по объему) с получением указанного в заголовке соединения в виде желтого твердого вещества (24,70 г). МС: 246 (МH+). 1 Н-ЯМР (CDCl3) : 6,53 (1 Н, ш. м), 5,12 Раствор (3aS,4S,6R,6aR)-N-этил-6-метокси 2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол 4-карбоксамида (получение 23) (24,60 г, 100 ммоль) и п-толуолсульфоната пиридиния (2,50 г, 10 ммоль) в метаноле (500 мл) нагревают при кипячении с обратным холодильником в течение 18 ч. Анализ ЯМР показал, что некоторое количество исходного материала все же остается. Растворитель выпаривают при пониженном давлении и остаток растворяют в метаноле (500 мл) и нагревают при кипячении с обратным холодильником в течение 8 ч. Анализ ЯМР показал, что некоторое количество исходного материала все же остается. Растворитель удаляют при пониженном давлении еще раз и остаток растворяют в метаноле (500 мл) и нагревают при кипячении с обратным холодильником в течение 24 ч. Растворитель удаляют затем при пониженном давлении и остаток подвергают азеотропной перегонке с дихлорметаном (x3) с получением указанного в заголовке соединения в виде масла (20,50 г).(400 мл) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 ч. Растворитель удаляют при пониженном давлении и остаток распределяют между диэтиловым эфиром и хлористо-водородной кислотой (1 М,300 мл). Слои разделяют и водный слой снова экстрагируют диэтиловым эфиром. Органические слои объединяют, промывают последовательно водой и насыщенным раствором соли,сушат над безводным сульфатом магния,фильтруют и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава дихлорметан: диэтиловый эфир (95:5 по объему), постепенно изменяющегося до состава дихлорметан: диэтиловый эфир (80:20 по объему) с получением указанного в заголовке соединения в виде масла и в виде смеси - и -аномеров (37,0 г). 1(3R,4R,5S)-4-(бензоилокси)-5[(этиламино)карбонил]-2-метокситетрагидро-3 фуранилбензата (получение 25) (37,0 г, 89,6 ммоль) в смеси уксусной кислоты (330 мл, 5,77 моль) и уксусного ангидрида (67 мл, 709 ммоль) охлаждают до -10 С и обрабатывают по каплям хлористо-водородной кислотой (12 н, 7,0 мл, 004985 44 132 ммоль). Смесь перемешивают в течение 18 ч, в течение указанного времени ей дают возможность нагреться до комнатной температуры. После повторного охлаждения смеси до 0 С медленно добавляют воду (1000 мл) и смесь экстрагируют этилацетатом (3 х 500 мл). Органические слои объединяют, промывают последовательно водой, насыщенным водным гидрокарбонатом натрия и насыщенным раствором соли, сушат над безводным сульфатом магния,фильтруют и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле с элюированием градиентной системы состава диэтиловый эфир:пентан (66:44), постепенно изменяющегося до состава диэтиловый эфир:пентан (100:0). Остаток далее очищают колоночной хроматографией на силикагеле с элюированием градиентной системой состава дихлорметан:диэтиловый эфир (95:5 по объему), постепенно изменяющего до состава дихлорметан:диэтиловый эфир (90:10 по объему) с получением указанного в заголовке соединения в виде смеси - и -аномеров (15,40 г). 1 Палладий 10% мас./мас. (400 мг) добавляют к раствору (2S,3S,4R,5R)-4-(бензилокси)-5[2-циано-6-[(2,2-дифенилэтил)амино]-9 Н-пурин-9-ил]-2-[(этиламино)карбонил]тетрагидро 3-фуранилбензоата (получение 7) (2,0 г, 2,70 ммоль) в этаноле, насыщенном аммиаком (40 мл). Реакционную смесь перемешивают в атмосфере водорода (414 кПа, 60 фунтов/кв. дюйм) в течение 16 ч при комнатной температуре,фильтруют через арбоцел (товарный знак) и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол:0,88 концентрированный водный аммиак (состав 95:5:0,5 по объему, постепенно изменяющийся до 90:10:1 по объему) с получением указанного в заголовке соединения в виде твердого вещества (1,2 г). 1(2 Н, м), 1,10-0,95 (3 Н, м). ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬ Все соединения примеров 1-11 были испытаны на противовоспалительную активность по их способности ингибировать функцию нейтрофилов (которая указывает на активность агониста рецептора А 2 а) способом, описанным на странице 20, и все соединения имели IC50 меньше чем 1 микромоля. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы или его фармацевтически приемлемая соль или сольват, гдеR1 представляет водород или C1-С 6-алкил,необязательно замещенный 1 или 2 заместителями, каждый из которых, независимо, выбран из фенила и нафтила, причем указанный фенил и нафтил, необязательно, замещен C1-С 6 алкилом, C1-С 6-алкокси, галогеном или циано; А представляет связь или C1-С 3-алкилен;(iii) С-связанный 4-11-членный моно- или бициклический гетероцикл, имеющий либо от 1 до 4 атомов азота в кольце либо 1 или 2 атома азота и 1 атом кислорода или 1 атом серы в кольце, и необязательно С-замещенный оксо,C1-С 6-алкокси-(C1-С 6)-алкилом, R3R3N-(C1-С 6)алкилом, фтор-(C1-С 6)-алкилом, фтор-(C1-С 6)алкокси, фтор-(C2-С 5)-алканоилом, галогеном,циано -OR5, R6, -COR5, -NR5R5, -COOR5,-S(O)mR6, -SO2NR5R5, -CONR5R5, -NR5SO2R6 илиhet, используемый в определениях R5 и R6,означает С-связанный пирролил, имидазолил,триазолил, тиенил, фурил, тиазолил, оксазолил,тиадиазолил, оксадиазолил, пиридинил, пиримидинил, пиридазинил, пиразинил, хинолинил,изохинолинил, бензимидазолил, хиназолинил,фталазинил, бензоксазолил или хиноксалинил,каждый из которых необязательно замещен C1 С 6-алкилом, C1-С 6-алкокси, циано или галогеном;R7 представляет метил, этил или циклопропилметил; и либо R8 и R9, взятые вместе с атомом азота,с которым они связаны, представляют азетидинил, пирролидинил, пиперидинил, морфолинил,пиперазинил, гомопиперидинил, гомопиперазинил или тетрагидроизохинолинил, каждый из которых необязательно замещен у атома углерода кольца C1-С 6-алкилом, C3-С 8-циклоалкилом, фенилом, C1-С 6-алкокси- (C1-C6)-алкилом,R3R3N-(C1-С 6)-алкилом,фтор-(C1-С 6)алкилом, -CONR3R3, -COOR3 или (С 2-С 5)алканоилом и необязательно замещен у атома углерода кольца, не являющегося соседним с атомом азота, фтор-(C1-С 6)-алкокси, галогеном,-OR3, циано, -S(O)mR4, -NR3R3, -SO2NR3R3,-NR3COR4 или -NR3SO2R4, и указанный пиперазин-1-ил и гомопиперазин-1-ил необязательно замещен у атома азота, не связанного с А, C1-С 6 алкилом, фенилом, C1-С 6-алкокси-(C2-С 6)-алкилом,R3R3N-(С 2-С 6)-алкилом,фтор-(C1-С 6)алкилом, C2-C5-алканоилом, -COOR4, C3-С 8 циклоалкилом,-SO2R4,-SO2NR3R3 или 3 3-CONR R ,либо R8 представляет Н, C1-С 6-алкил, С 3 С 8-циклоалкил, фенил или бензил и R9 представляет Н, C1-С 6-алкил, C3-С 8-циклоалкил, фенил, бензил, фтор-(C1-С 6)-алкил, -CONR3R3,-COOR4, С 2-С 5-алканоил или -SO2NR3R3. 2. Соединение по п.1, гдеR1 представляет водород или C1-С 6-алкил,необязательно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанный фенил и нафтил необязательно замещен C1-С 6-алкилом,C1-С 6-алкокси, галогеном или циано; А представляет связь или C1-С 6-алкилен;(i) водород, C1-С 6-алкил, С 3-С 7-циклоалкил, фенил или нафтил, причем указанный C3 С 7-циклоалкил, фенил или нафтил необязатель 47 но замещен C1-С 6-алкилом, фенилом, C1-С 6-алкокси-(C1-С 6)-алкилом, амино-(C1-С 6)-алкилом,фтор-(C1-С 6)-алкилом, фтор-(C1-С 6)-алкокси, C2 С 5-алканоилом,галогеном, -OR3,циано,3(iii) С-связанный, 4-11-членный, моно- или бициклический гетероцикл, имеющий либо от 1 до 4 атомов азота в кольце либо 1 или 2 атома азота и 1 атом кислорода или 1 атом серы в кольце, необязательно С-замещенный оксо, C1 С 6-алкокси-(C1-С 6)-алкилом, амино-(C1-С 6)-алкилом, фтор-(C1-С 6)-алкилом, фтор-(C1-С 6)алкокси, фтор-(C2-С 5)-алканоилом, галогеном,циано -OR5, R6, -COR5, -NR5R5, -COOR5,-S(O)mR6, -SO2NR5R5, -CONR5R5, -NR5SO2R6 или(iv) когда А представляет С 2-С 3-алкилен,N-связанный азетидинил, пирролидинил, пиперидинил или пиперазинил, причем каждый необязательно С-замещен C1-С 6-алкилом, фенилом, C1-С 6-алкокси-(C1-С 6)-алкилом, амино-(C1 С 6)-алкилом, фтор-(C1-С 6)-алкилом, фтор-(C1 С 6)-алкокси, C2-С 5-алканоилом, галогеном,-OR3, циано, -COOR3, С 3-С 7-циклоалкилом,-S(O)mR4, -NR3R3, -SO2NR3R3, -CONR3R3,-NR3COR4 или -NR3SO2R4, и необязательно Nзамещен C1-С 6-алкилом, фенилом, C1-С 6-алкокси(C1-С 6)-алкилом, амино-(С 2-С 6)-алкилом, фтор-(C1 С 6)-алкилом, С 2-С 5-алканоилом, -COOR3, С 3-С 7 циклоалкилом,-S(O)mR4,-SO2NR3R3 илиhet, используемый в определениях R5 и R6,означает С-связанный пирролил, имидазолил,триазолил, тиенил, фурил, тиазолил, оксазолил,тиадиазолил, оксадиазолил, пиридинил, пиримидинил, пиридазинил, пиразинил, хинолинил,изохинолинил, бензимидазолил, хиназолинил,фталазинил, бензоксазолил или хиноксалинил,каждый из которых необязательно замещен C1 С 6-алкилом, C1-С 6-алкокси, циано или галогеном; и-СН 2 СН 2-. 7. Соединение по любому одному из предыдущих пунктов, где R2 представляет C1-С 6 алкил, фенил или нафтил, причем указанный фенил необязательно замещен фенилом. 8. Соединение по п.7, где R2 представляет метил, н-пропил, изопропил, 2-метилпроп-1-ил,фенил, 4-фенилфенил, 1-нафтил или 2-нафтил. 9. Соединение по п.5 или 6, где R2 представляет -NR8R9, причем R8 и R9 имеют значения, указанные в п.1. 10. Соединение по п.9, где R8 и R9, взятые вместе с атомом азота, с которым они связаны,представляют пиперидинил. 11. Соединение по п.1, где -A-R2 представляет метил, н-пропил, изопропил, 2-метилпроп 1-ил, фенил, 4-фенилфенил, фенилметил, 1-нафтил, 2-нафтил или 2-(пиперидин-1-ил)этил. 12. Соединение по любому предыдущему пункту, где R1 представляет C1-С 6-алкил, замещенный 1 или 2 фенильными группами, причем фенильная группа(ы), необязательно, замещенаC1-С 6-алкокси. 13. Соединение по п.12, где R1 представляет 2,2-дифенилэтил или (4-метоксифенил)метил. 14. Соединение по п.1, которое выбрано из группы, состоящей из(2S,3S,4R,5R)-5-6-[(2,2-дифенилэтил)амино]-2-[([2-(1-пиперидинил)этил]сульфонил амино)метил]-9 Н-пурин-9-ил-N-этил-3,4 дигидрокситетрагидро-2-фуранкарбоксамид и их фармацевтически приемлемые соли и сольваты. 15. Фармацевтическая композиция, включающая соединение формулы (I) или его фармацевтически приемлемую соль или сольват по любому одному из предыдущих пунктов вместе с фармацевтически приемлемым наполнителем,разбавителем или носителем. 16. Применение соединения формулы (I) или его фармацевтически приемлемой соли,сольвата по любому одному из пп.1-14, соответственно, для приготовления лекарственного средства для лечения заболевания, для которого показан агонист рецептора А 2 а. 17. Применение соединения формулы (I) или его фармацевтически приемлемой соли,сольвата по любому одному из пп.1-14, соответственно, для приготовления противовоспалительного агента. 18. Применение соединения формулы (I) или его фармацевтически приемлемой соли,сольвата по любому одному из пп.1-14, соответственно, для приготовления лекарственного средства для лечения респираторного заболевания. 19. Применение по п.18, где заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых (ARDS),бронхита, хронического бронхита, хронического закупоривающего легочного заболевания, муковисцидоза, астмы, эмфиземы, бронхоэктаза,хронического синусита и ринита. 20. Применение соединения формулы (I) или его фармацевтически приемлемой соли,сольвата по любому одному из пп.1-14, соответственно, для приготовления лекарственного средства для лечения септического шока, мужской эректильной дисфункции, гипертензии,удара, эпилепсии, церебральной ишемии, периферического васкулярного заболевания, послеишемического повреждения при реперфузии,диабета, ревматоидного артрита, рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита, вызванного Heliobacter pylori, гастрита, вызванного не Heliobacter 50 кишечного тракта, вызванного нестероидным противовоспалительным лекарственным средством, или психотического нарушения или для заживления ран. 21. Способ лечения заболевания млекопитающего, включая человека, для которого показан агонист рецептора А 2 а, включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции по любому одному из пп.1-14 и 15, соответственно. 22. Способ лечения воспалительного заболевания млекопитающего, в том числе человека,включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции по любому одному из пп.1-14 и 15, соответственно. 23. Способ лечения респираторного заболевания млекопитающего, в том числе человека,включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции по любому одному из пп.1-14 и 15, соответственно. 24. Способ по п.23, отличающийся тем, что заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых(ARDS), бронхита, хронического бронхита, хронического закупоривающего легочного заболевания, муковисцидоза, астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита. 25. Способ лечения млекопитающего,включая человека, для терапии септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии, церебральной ишемии, периферического васкулярного заболевания, послеишемического повреждения при реперфузии, диабета, ревматоидного артрита,рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита,вызванного Heliobacter pylori, гастрита, вызванного не Heliobacter pylori, повреждения желудочно-кишечного тракта, вызванного нестероидным противовоспалительным лекарственным средством, или психотического нарушения или для заживления ран, включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции по любому одному из пп.1-14 и 15,соответственно. 26. Способ получения соединения формулы (I) по п.1 или 2 или его фармацевтически приемлемой соли или сольвата, который включает снятие защиты у соединения формулы (II) где R1, R2, R7 и А имеют значения, указанные в п.1 или 2, и либо Р 1 и Р 2, когда взяты по отдельности,представляют защитные группы, либо Р 1 и Р 2,когда взяты вместе, представляют защитную группу, причем защитные группы Р 1 и Р 2, когда они взяты по отдельности, удаляют либо вместе,либо последовательно; и необязательно следует превращение соединения формулы (I) в его фармацевтически приемлемую соль. 27. Способ получения соединения формулы (I) по п.1 или 2, или его фармацевтически приемлемой соли или сольвата, который включает сульфонилирование соединения формулы(VII),где X представляет уходящую группу, предпочтительно хлор, и R2 и А имеют значения, указанные в п.1 или 2; и необязательно следует превращение соединения формулы (I) в его фармацевтически приемлемую соль. 28. Способ получения соединения формулы (I) по п.1, в которой А представляет-СН 2 СН 2- и R2 представляет NR7R8, или его фармацевтически приемлемой соли, или сольвата, который включает взаимодействие соединения формулы(XXI),где R8 и R9 имеют значения, указанные в п.1; причем за указанным способом, необязательно, следует превращение соединения формулы (I) в его фармацевтически приемлемую соль. 29. Соединение формулы где Р 1 и P2, когда они взяты по отдельности,представляют защитные группы, или, когда они взяты вместе, представляют защитную группу. 30. Соединение формулы причем группа R1 представляет C1-С 6 алкил, необязательно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанный фенил и нафтил необязательно замещен C1-С 6 алкилом, C1-С 6-алкокси, галогеном или циано. 31. Соединение формулы
МПК / Метки
МПК: A61P 11/00, C07H 19/167, A61K 31/70
Метки: производные, пурина
Код ссылки
<a href="https://eas.patents.su/27-4985-proizvodnye-purina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пурина</a>
Предыдущий патент: Способ стереоселективного синтеза циклических аминокислот
Следующий патент: N-(гетероциклил)бензол- или пиридинсульфонамиды в качестве антитромботических агентов и антикоагулянтов
Случайный патент: Применение эритропоэтина для лечения миелобластного лейкоза