Соли соединений ингибиторов вич
Формула / Реферат
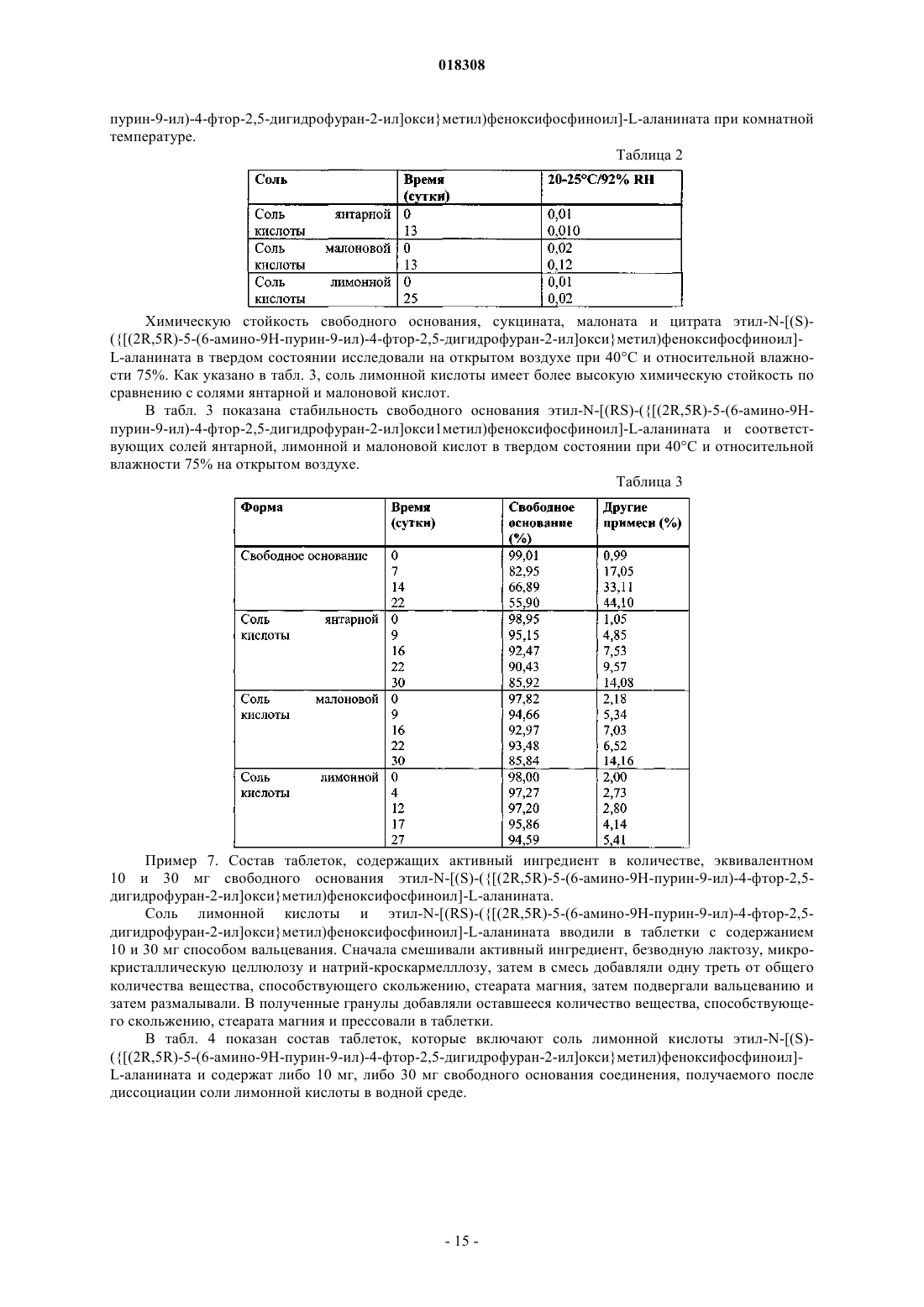
1. Соль лимонной кислоты формулы (I) или ее гидрат

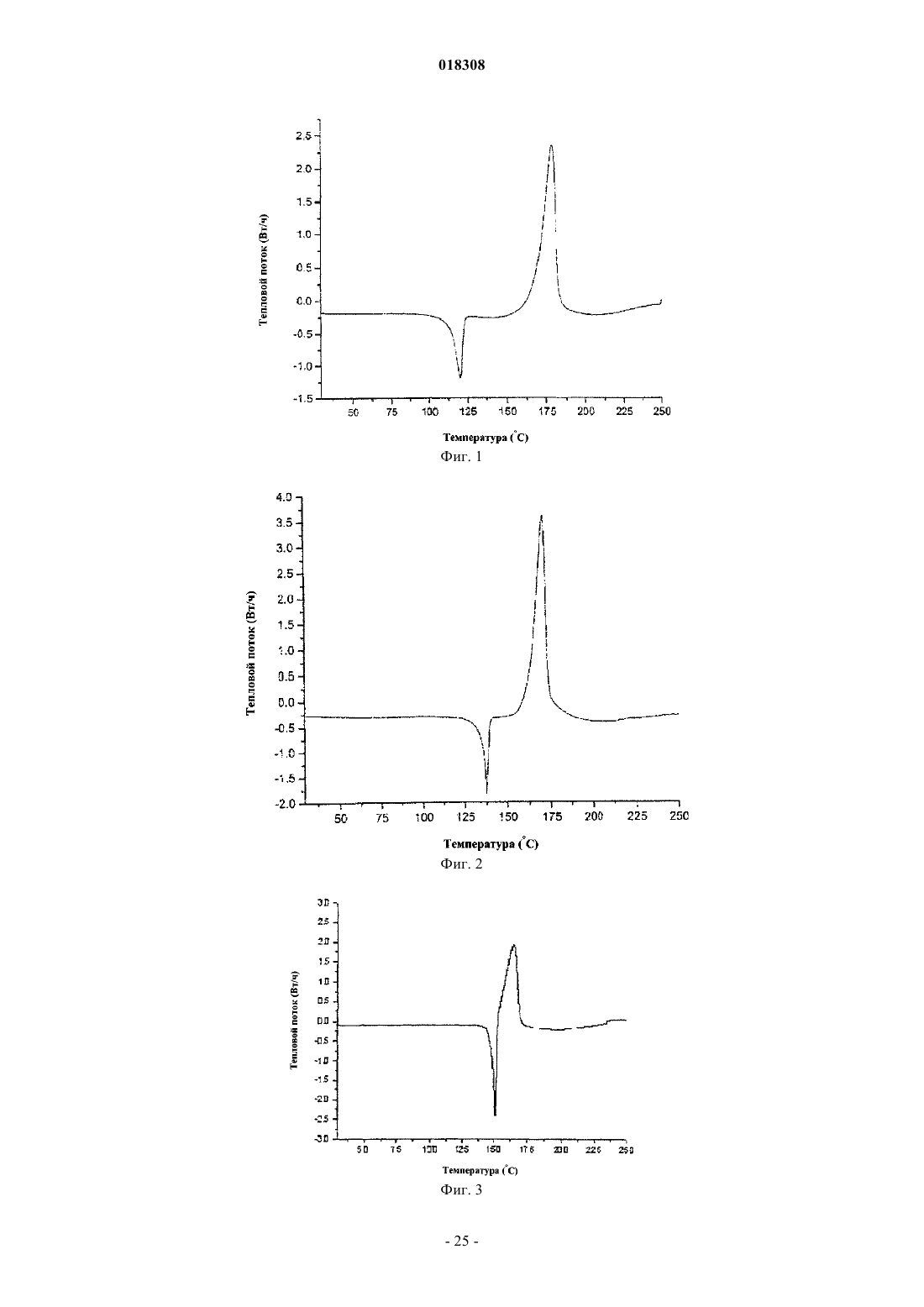
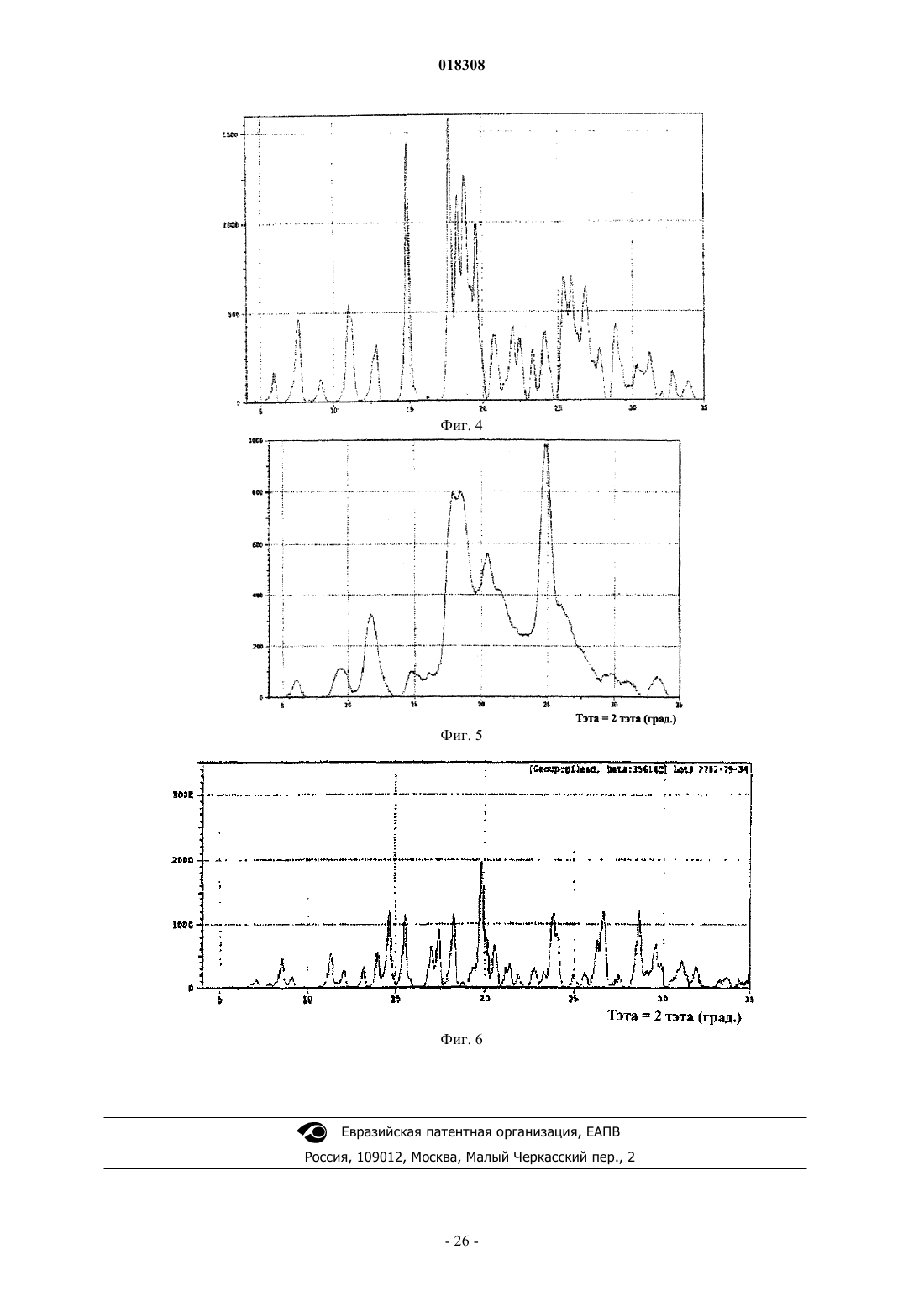
2. Соль или гидрат по п.1, отличающиеся тем, что соль представляет собой кристаллическое вещество.
3. Соль по п.2, отличающаяся тем, что полосы поглощения, наблюдаемые на порошковой рентгенограмме, характеризуются межплоскостными расстояниями, совпадающими или по существу совпадающими с расстояниями, равными 4,48, 3,12 и 6,05 ангстрем.
4. Соль по п.2, отличающаяся тем, полосы поглощения, соответствующие углам дифракции 2-тэта на порошковой рентгенограмме, совпадают или по существу совпадают с углами, равными 19,81, 28,63 и 14,64°.
5. Гидрат соли лимонной кислоты по п.2, отличающийся тем, что он является частично или полностью гидратированным.
6. Соль по п.2, отличающаяся тем, что она представляет собой безводную или по существу безводную соль.
7. Фармацевтическая композиция для лечения или предотвращения СПИД, содержащая терапевтически эффективное количество соли или гидрата по любому из пп.1-6 и фармацевтически приемлемый носитель или наполнитель.
8. Фармацевтическая композиция по п.7, отличающаяся тем, что содержит дополнительное терапевтическое средство.
9. Фармацевтическая композиция по п.8, отличающаяся тем, что дополнительное терапевтическое средство представляет собой лекарственное средство против ВИЧ.
10. Единичная лекарственная форма, содержащая фармацевтическую композицию по любому из пп.7-9.
11. Единичная лекарственная форма по п.10, отличающаяся тем, что указанная единичная лекарственная форма представляет собой таблетку.
12. Фармацевтическая композиция, изготовляемая смешиванием терапевтически эффективного количества соли или гидрата по любому из пп.1-6 с фармацевтически приемлемым носителем или наполнителем.
13. Применение соли или гидрата по любому из пп.1-6 для лечения или профилактического предотвращения ВИЧ-инфекции.
14. Применение соли или гидрата по любому из пп.1-6 для получения лекарственного средства для лечения или профилактического предотвращения ВИЧ-инфекции.
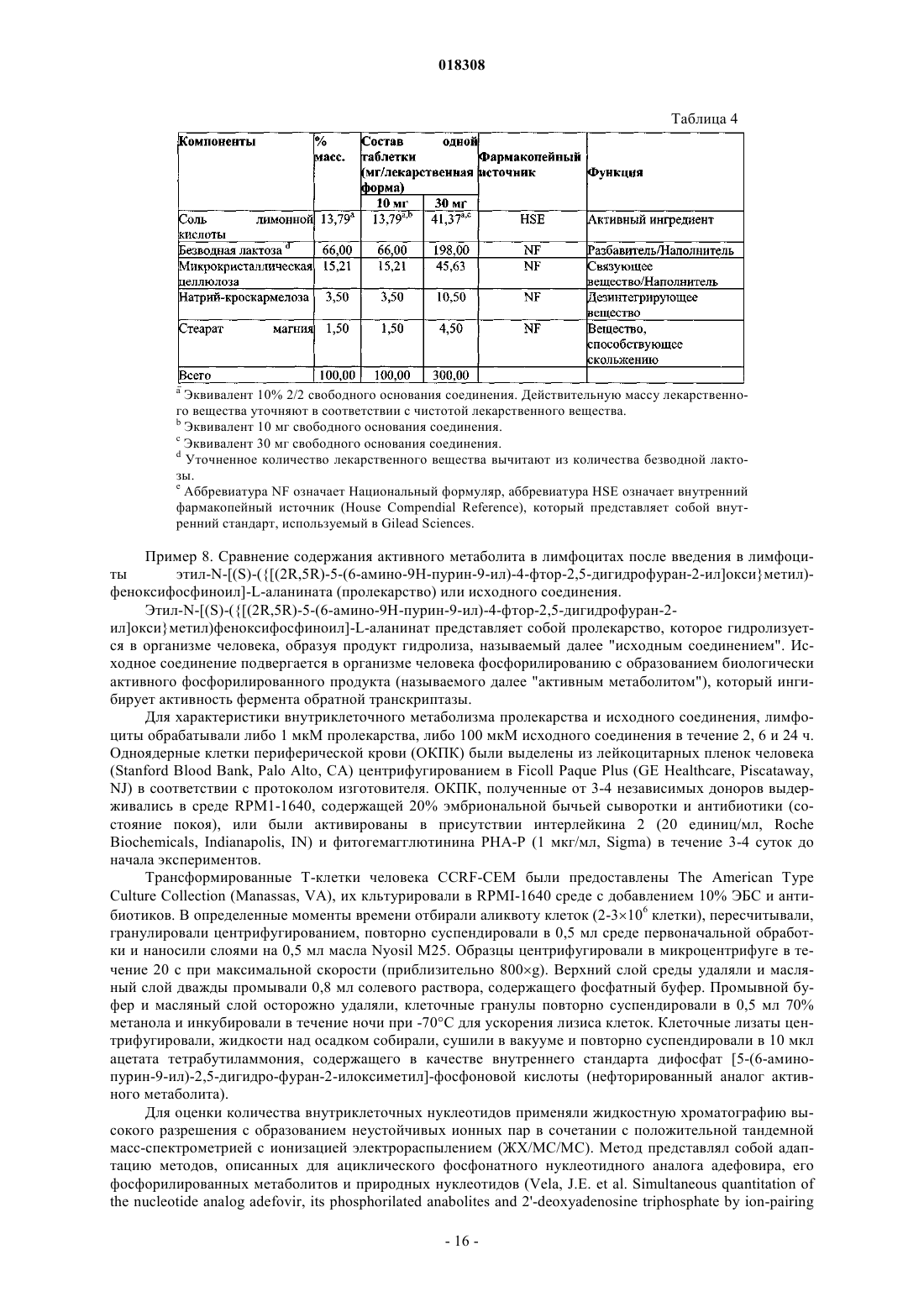
15. Применение по любому из пп.13, 14, отличающееся тем, что соль или гидрат находятся в составе фармацевтической композиции или лекарственной формы по любому из пп.7-12.
16. Соль янтарной кислоты формулы (II) или ее гидрат
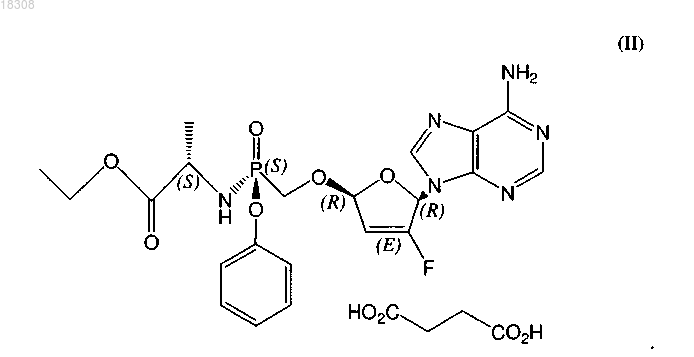
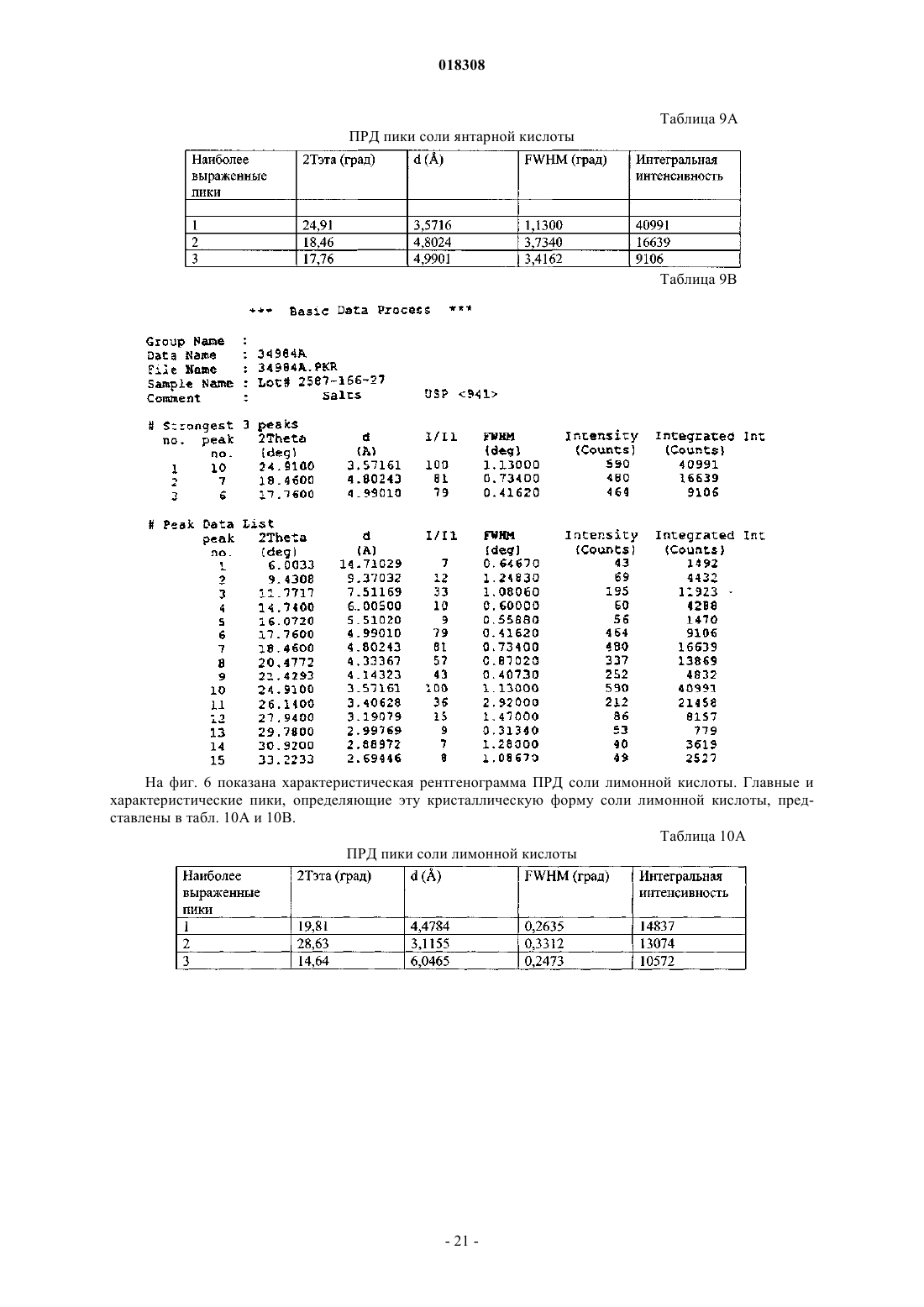
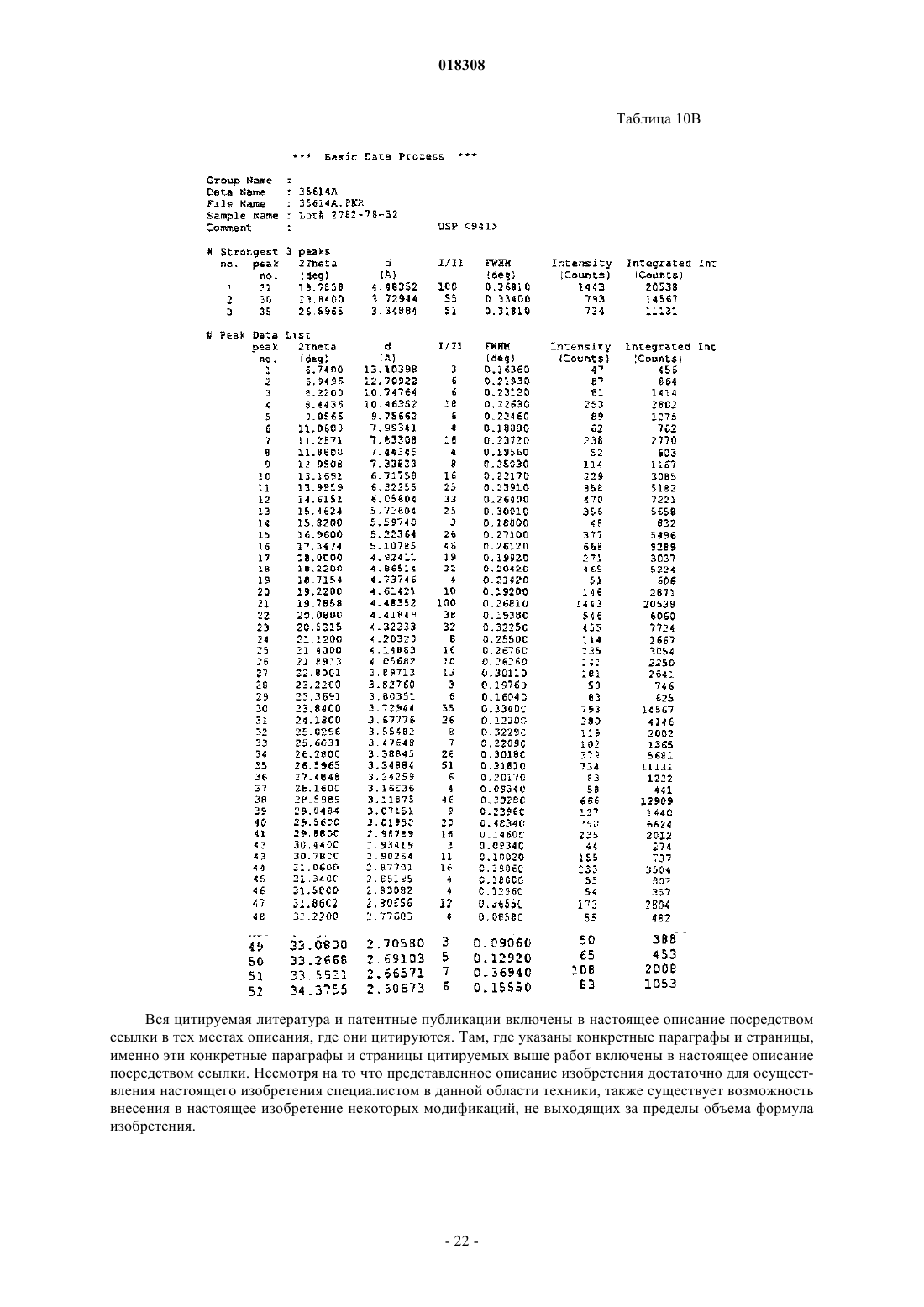
17. Соль или гидрат по п.16, отличающиеся тем, что соль представляет собой кристаллическое вещество.
18. Соль по п.17, отличающаяся тем, что полосы поглощения, наблюдаемые на порошковой рентгенограмме, характеризуются межплоскостными расстояниями, совпадающими или по существу совпадающими с расстояниями, равными 3,57, 4,80 и 4,99 ангстрем.
19. Соль по п.17, отличающаяся тем, что полосы поглощения, соответствующие углам дифракции 2-тэта на порошковой рентгенограмме, совпадают или по существу совпадают с углами, равными 24,91, 18,46 и 17,76°.
20. Фармацевтическая композиция для лечения или предотвращения СПИД, включающая терапевтически эффективное количество соли или гидрата по любому из пп.16-19 и фармацевтически приемлемый носитель или наполнитель.
21. Фармацевтическая композиция по п.20, отличающаяся тем, что содержит дополнительное терапевтическое средство.
22. Фармацевтическая композиция, изготовляемая смешиванием терапевтически эффективного количества соли или гидрата по любому из пп.16-19 с фармацевтически приемлемым носителем или наполнителем.
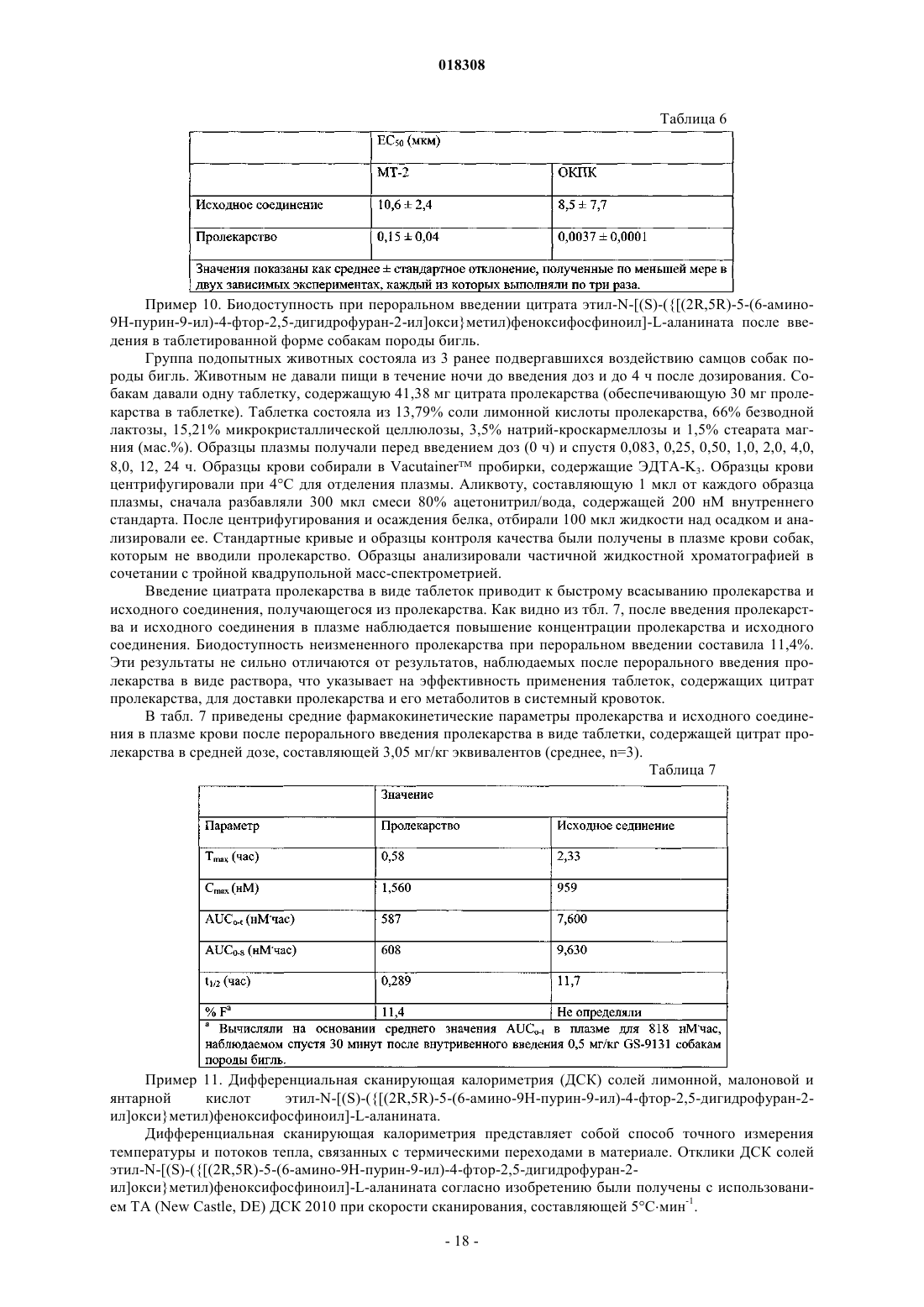
23. Применение соли или гидрата по любому из пп.16-19 для лечения или профилактического предотвращения ВИЧ-инфекции.
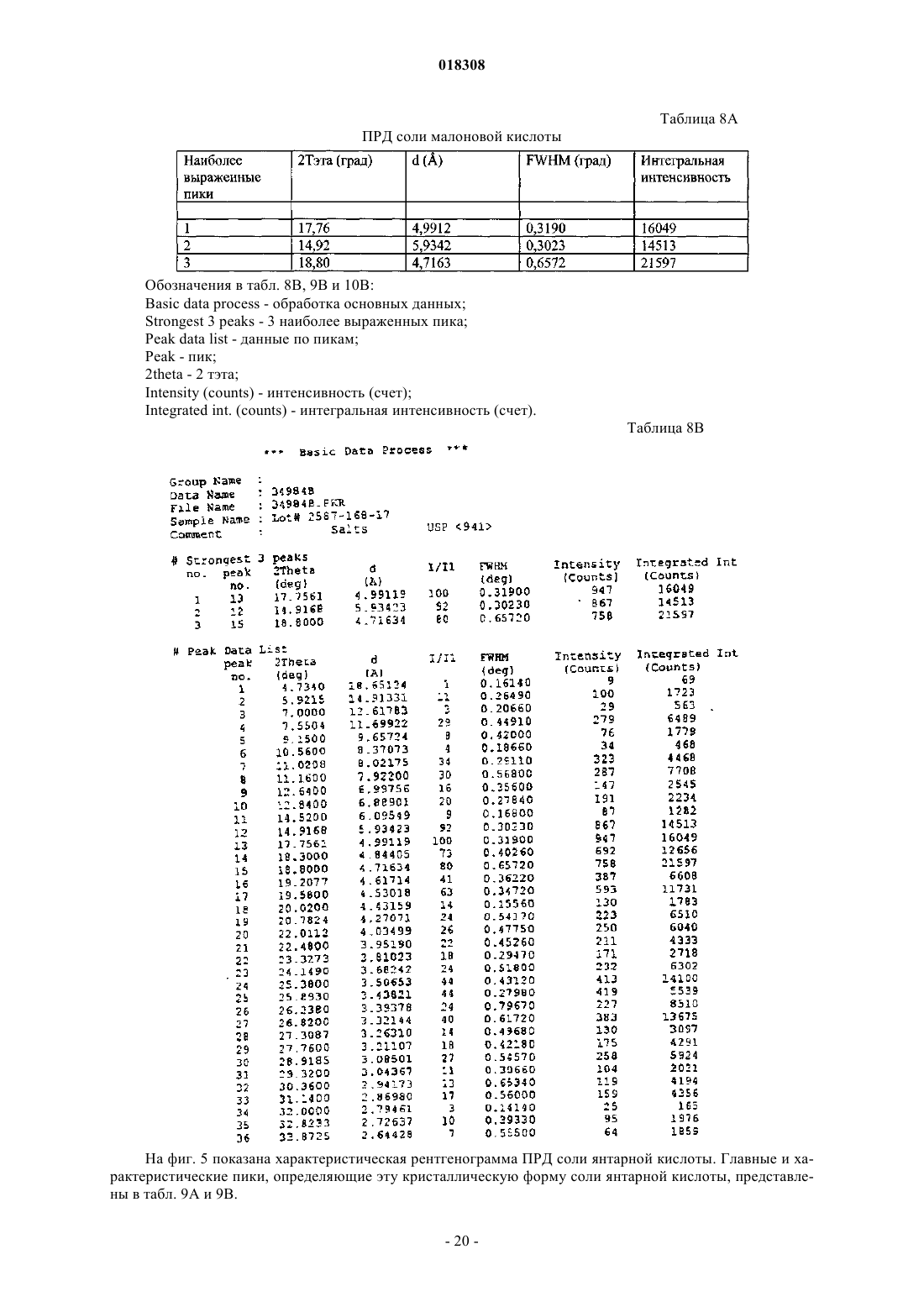
24. Соль малоновой кислоты формулы (III) или ее гидрат
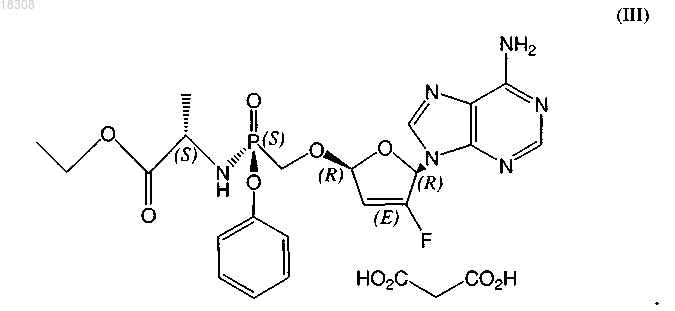
25. Соль или гидрат по п.24, отличающиеся тем, что соль представляет собой кристаллическое вещество.
26. Соль по п.25, отличающаяся тем, что полосы поглощения, наблюдаемые на порошковой рентгенограмме, характеризуются межплоскостными расстояниями, совпадающими или по существу совпадающими с расстояниями, равными 4,99, 5,93 и 4,72 ангстрем.
27. Соль по п.25, отличающаяся тем, что полосы поглощения, соответствующие углам дифракции 2-тэта на порошковой рентгенограмме, совпадают или по существу совпадают с углами, равными 17,76, 14,92 и 18,80°.
28. Фармацевтическая композиция для лечения или предотвращения СПИД, содержащая терапевтически эффективное количество соли или гидрата по любому из пп.24-27 и фармацевтически приемлемый носитель или наполнитель.
29. Фармацевтическая композиция по п.28, отличающаяся тем, что содержит дополнительное терапевтическое средство.
30. Фармацевтическая композиция, изготовляемая смешиванием терапевтически эффективного количества соли или гидрата по любому из пп.24-27 с фармацевтически приемлемым носителем или наполнителем.
31. Применение соли или гидрата по любому из пп.24-27 для лечения или профилактического предотвращения ВИЧ-инфекции.
Текст
СОЛИ СОЕДИНЕНИЙ ИНГИБИТОРОВ ВИЧ Изобретение относится к солям противовирусных соединений, композициям, содержащим такие соли, и способам терапии, которые включают введение таких солей, а также к способам и промежуточным соединениям, применяемым для изготовления таких солей. Область техники В целом, изобретение относится к солям соединений, обладающих антивирусной активностью и, в частности, обладающих активностью против ВИЧ. Уровень техники Вирус иммунодефицита человека (ВИЧ) представляет собой ретровирус, который может приводить к развитию синдрома приобретнного иммунодефицита (СПИД), т.е. состоянию человека, при котором его иммунная система ослаблена и не может противостоять воздействию угрожающих жизни инфекций,вызываемых условно-патогенными организмами (оппортунистических инфекций). Ингибиторы ВИЧ применяют для лечения ВИЧ-инфекции у млекопитающих (например, для снижения и ограничения заражения и распространения инфекции ВИЧ), а также для диагностического определения ВИЧ. Применение доступных в настоящее время ингибиторов ВИЧ до некоторой степени ограничено их токсичностью и другими побочными эффектами. Таким образом, существует потребность в разработке новых терапевтических средств для лечения и диагностики ВИЧ. Фармацевтическая композиция, содержащая терапевтическое средство, должна воспроизводимым и надежным способом доставлять терапевтическое средство пациенту, нуждающемуся в этом. Такая воспроизводимость доставки может быть достигнута, по меньшей мере частично, введением стабильной,растворимой, твердой формы терапевтического средства в фармацевтическую композицию. Кроме того,синтез целевой твердой формы терапевтического средства должен быть удобным с технической и экономической точек зрения и должен подходить для крупномасштабного коммерческого производства. Краткое описание изобретения Этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланинат представляет собой ингибитор обратной транскриптазы,который блокирует репликацию вирусов ВИЧ in vivo и in vitro и при введении человеку вызывает ограниченные нежелательные побочные эффекты. Структура этил-[N-(S)-([(2R,5R)-5-(6-амино-9H-пурин-9 ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината представлена формулой (Р) Этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланинат имеет низкую температуру плавления и представляет собой аморфное твердое вещество, плохо поддающееся выделению и очистке, не стойкое при хранении в течение длительного периода времени, на основе которого трудно получить фармацевтическую композицию. Этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланинат также представляет собой слабое основание, способное образовывать соли с кислотами. Соответственно, один из аспектов настоящего изобретения относится к стабильным солям этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината, которые имеют более высокую стабильность физических свойств, которые легче выделить и ввести в состав лекарственной формы, чем свободное основание этого соединения. Соли согласно настоящему изобретению пригодны, например, для лечения пациента-человека, инфицированного вирусом иммунодефицита человека (штаммы ВИЧ-1 или ВИЧ-2), который вызывает СПИД. Соли согласно настоящему изобретению также пригодны, например, для приготовления лекарственных средств для лечения ВИЧ или нарушений, связанных с ВИЧ. Соли согласно настоящему изобретению можно также использовать, например, для ингибирования репликации вирусов ВИЧ in vitro, и,таким образом, могут быть использованы в биологических тестах как контрольные соединения для идентификации других ингибиторов обратной транскриптазы или для исследования механизма действия обратной транскриптазы ВИЧ и его ингибирования. Таким образом, один из аспектов настоящего изобретения относится к солям лимонной, янтарной и малоновой кислот этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината и к способам получения вышеуказанных солей. В некоторых примерах осуществления соли согласно настоящему изобретению находятся в безводном состоянии, в то время как в других примерах осуществления соли согласно настоящему изобретению, по меньшей мере, частично гидратированы. В некоторых примерах осуществления соли согласно настоящему изобретению существуют в кристаллическом состоянии. Таким образом, настоящее изобретение включает соли лимонной, янтарной и малоновой кислот соединения формулы (Р), а также их гидраты. Гидраты согласно изобретению могут быть частично (например, представлять собой полугидраты) или полностью гидратированы (например, представлять собой моногидраты). Настоящее изобретение также включает названные соли в безводном или по существу в безводном состоянии. Аналогично, согласно изобретению, соли и их гидраты включают аморфные и кристаллические состояния, а также состояния, имеющие как аморфные, так и кристаллические характеристики. В настоящем описании термин "кристаллический" означает материал, имеющий молекулярную структуру с дальним порядком. Напротив, "аморфные" материалы не обладают дальним порядком. Понятно, что, в общем случае, кристаллические материалы более термодинамически стабильны, чем аморфные формы тех же самых веществ. Таким образом, за некоторыми известными исключениями, для применения в фармацевтике обычно предпочитают кристаллические материалы. Мерой степени кристалличности соединений согласно изобретению может служить, например, выраженность полос поглощения (пиков) ДСК (дифференциальной сканирующей калориметрии) и ПРД (рентгеновской дифракции порошков). Чем острее пик, тем выше степень кристалличности. Напротив, чем шире пик, тем ниже степень кристалличности. Как более подробно описано в примере 12 настоящего описания, в конкретных примерах осуществления,соль лимонной кислоты этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5 дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината отличается тем, что полосы поглощения, наблюдаемые в рентгенограмме порошка соли характеризуются межплоскостными расстояниями,составляющими 4,48, 3,12 и 6,05 ангстрем; соль янтарной кислоты этил-N-[(S)-([(2R,5R)-5-(6-амино-9Hпурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината отличается тем, что полосы поглощения, наблюдаемые в рентгенограмме порошка соли характеризуются межплоскостными расстояниями, составляющими 3,57, 4,80 и 4,99 ангстрем; и соль малоновой кислоты этил-N[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината отличается тем, что полосы поглощения, наблюдаемые в рентгенограмме порошка соли характеризуются межплоскостными расстояниями, составляющими 4,99, 5,93 и 4,72 ангстрем. В другом конкретном примере осуществления настоящее изобретение относится к соли лимонной кислоты этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5 дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината, имеющей температуру плавления,составляющую от 142 до 150C. Этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланинат представляет собой амидатное пролекарство, которое вступает в реакцию с протонными растворителями и подвергается разложению. Скорость реакции зависит от pH и температуры. Таким образом, образование стабильной соли амидатного пролекарства и лимонной кислоты, янтарной кислоты и/или малоновой кислоты, каждая из которых содержит нуклеофильные фрагменты, способные реагировать с пролекарством (например, реагировать с амидатным фрагментом пролекарства), является неожиданным и удивительным результатом. Другой аспект настоящего изобретения относится к фармацевтическим композициям, каждая из которых включает терапевтически эффективное количество соли согласно настоящему изобретению и фармацевтически приемлемый носитель или наполнитель. Фармацевтические композиции согласно настоящему изобретению также могут включать дополнительные терапевтические средства, например антивирусные, антибактериальные, противогрибковые или противораковые средства. Фармацевтические композиции согласно изобретению могут находиться в виде единичных лекарственных форм, например таблеток или капсул. Единичные лекарственные формы обычно обеспечивают эффективную суточную дозу соли согласно настоящему изобретению человеку, нуждающемуся в этом. Эффективные суточные дозы соли согласно настоящему изобретению обычно составляют от 1 до 100 мг, например от 10 до 30 мг. Другой аспект настоящего изобретения относится к способам получения солей лимонной, янтарной и малоновой кислот согласно настоящему изобретению. Таким образом, например, настоящее изобретение относится к способу изготовления соли лимонной кислоты этил-N-[(S)-([(2R,5R)-5-(6-амино-9Hпурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината, причем способ включает этап приведения в контакт приблизительно 1 свободного основания этил-N-[(S)-([(2R,5R)5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината в подходящем растворителе (например, ацетонитриле) с количеством лимонной кислоты, приблизительно составляющим от 1 до приблизительно 1,2 экв., при температуре, составляющей приблизительно от 55 до приблизительно 75C. Настоящее изобретение также относится к способу получения соли янтарной кислоты этил-N-[(S)([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]L-аланината, причем способ включает этап приведения в контакт приблизительно 1 свободного основания этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината в подходящем растворителе (например, 2-бутаноне) с количеством янтарной кислоты, приблизительно составляющим от 1 до приблизительно 1,2 экв., при температуре, составляющей приблизительно от 60 до приблизительно 70C, с образованием сукцината этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината. Также настоящее изобретение относится к способу получения соли малоновой кислоты этил-N-[(S)([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]L-аланината, причем способ включает этап приведения в контакт приблизительно 1 свободного основания этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината в подходящем растворителе (например, 2-бутаноне) с количеством малоновой кислоты, приблизительно составляющим от 1 до приблизительно 1,2 экв., при температуре, составляющей приблизительно от 50 до приблизительно 70C, с образованием малоната этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината. Другой аспект настоящего изобретения относится к способам лечения или профилактического предотвращения СПИД, причем указанные способы включают этап введения человеку, страдающему СПИД, терапевтически эффективного количества соли согласно изобретению или ее гидрата. Краткое описание чертежей На фиг. 1 показан характеристический спектр соли малоновой кислоты этил-N-[(S)-([(2R,5R)-5-(6 амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината,полученный способом дифференциальной сканирующей калориметрии (ДСК). На фиг. 2 показан характеристический спектр соли янтарной кислоты этил-N-[(S)-([(2R,5R)-5-(6 амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината,полученный способом ДСК. На фиг. 3 показан характеристический спектр соли лимонной кислоты этил-N-[(S)-([(2R,5R)-5-(6 амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината,полученный способом ДСК. На фиг. 4 показана характеристическая порошковая рентгенограмма (ПРД) соли малоновой кислоты этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината. На фиг. 5 показана характеристическая порошковая рентгенограмма (ПРД) соли янтарной кислоты этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината. На фиг. 6 показана характеристическая порошковая рентгенограмма (ПРД) соли кислоты этил-N[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината. Подробное описание примеров реализации изобретения При упоминании в настоящем описании торговых наименований изобретение независимо включает как продукт, имеющий упомянутое торговое наименование, так и активный фармацевтический ингредиент (ингредиенты) продукта, имеющего упомянутое торговое наименование. Соли этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината. Один аспект настоящего изобретения относится к солям лимонной, янтарной и малоновой кислот(цитрату, сукцинату и малонату) этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5 дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината. Соль лимонной кислоты (цитрат) представлена формулой I Соль янтарной кислоты (сукцинат) представлена формулой II Соль малоновой кислоты (малонат) представлена формулой III Способ синтеза этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината описан в примере 1 настоящего описания. Способы получения солей лимонной, янтарной и малоновой кислот этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин 9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината описаны соответственно в примерах 3, 4 и 5 настоящего описания. Некоторые физические свойства указанных солей описаны в примере 6 настоящего описания и показывают, например, что каждая из этих солей физически стабильна при хранении при 40C и относительной влажности 75%. Соли лимонной, янтарной и малоновой кислот этил-N-[(S)-([(2R,5R)-5-(6-амино-9 Н-пурин-9-ил)-4 фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината пригодны, например, для ингибирования репликации ВИЧ in vitro и in vivo. В этом отношении, как более подробно описано в примере 8 настоящего описания, этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5 дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланинат представляет собой пролекарство, которое при метаболизме в организме человека образует исходное соединение, которое, в свою очередь,подвергается фосфорилированию в организме, образуя активный метаболит, который ингибирует репликацию ВИЧ. В примере 8 настоящего описания показано, что этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланинат вызывает большее накопление активного метаболита в белых кровяных тельцах, т.е. клетках, содержащих вирус ВИЧ, по сравнению с исходным соединением. Кроме того, в примере 9 настоящего описания приведены данные, полученные in vitro, показывающие, что этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланинат при анализах in vitro оказывается более мощным лекарственным средством против ВИЧ, чем исходное соединение. Кроме того, в примере 10 настоящего описания приведены данные, показывающие, что таблетка,содержащая соль лимонной кислоты этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5 дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината, доставляет это лекарственное средство в кровоток собак породы бигль с фармакокинетикой, аналогичной полученной при пероральном введении жидкого препарата лекарственного средства. Таким образом, соль лимонной кислоты этил-N-[(S)([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]L-аланината представляет собой физически и химически стабильную композицию вещества, которая может быть введена перорально живому субъекту с целью предоставления терапевтически эффективного количества этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината, который представляет собой более эффективное средство против ВИЧ, чем исходное соединение. Фармацевтические композиции. Другой аспект настоящего изобретения относится к фармацевтическим композициям, также называемым фармацевтическими составами, которые содержат терапевтически эффективное количество одной или более солей согласно изобретению и фармацевтически приемлемый носитель или наполнитель. В то время как соли согласно изобретению можно вводить как таковые, обычно предпочтительно их вводят в виде фармацевтических композиций. Фармацевтические композиции согласно изобретению содержат традиционные носители и наполнители, выбираемые в соответствии с обычной практикой. Носитель (носители) должен быть "приемлемым", т.е. совместимым с другими ингредиентами композиции и физиологически безвредным для реципиента. Таблетки содержат такие компоненты, как вспомогательные вещества, вещества, способствующие скольжению, наполнители, связующие вещества и подобные им средства. Водные композиции готовят в стерильной форме и, если они предназначены для неперорального введения, обычно их готовят изотоническими. Все композиции могут содержать наполнители,например, описанные в публикации Handbook of Pharmaceutical Excipients (R.C. Rowe et al., Pharmaceutical Press, 5-е изд., 2006). Наполнители включают аскорбиновую кислоту и другие антиоксиданты, хелатирующие агенты, например ЭДТА, углеводы, например декстрин, гидроксиалкилцеллюлозу, гидроксиалкилметилцеллюлозу, стеариновую кислоту и подобные им вещества. Показатель pH композицийсоставляет приблизительно от 3 до приблизительно 11, но обычно приблизительно составляет от 7 до 10. Композиции удобно изготавливать в виде единичных лекарственных форм (например, таблеток), и они могут быть изготовлены любым способом, хорошо известным в фармакологии. Общее описание ме-4 018308 тодик и композиций можно найти в публикации Remington's Pharmaceutical Sciences (Mack PublishingCo., Easton, PA). Такие способы включают этап смешивания активного ингредиента с носителем, который составлен из одного или более вспомогательных ингредиентов. В общем случае композиции готовят, равномерно и тщательно смешивая активный ингредиент с жидкими носителями или мелко раздробленными твердыми носителями или носителями обоих типов, после чего, при необходимости, продукт подвергают формованию. Фармацевтические композиции, содержащие активный ингредиент, могут быть приготовлены в любой форме, подходящей для предполагаемого способа введения. Например, для перорального введения могут быть изготовлены таблетки, драже, пастилки, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсии, твердые или мягкие капсулы, сиропы или эликсиры. Композиции,предназначенные для перорального введения, могут быть изготовлены любым способом, известным в области техники для приготовления фармацевтических композиций, и для получения приемлемого препарата такие композиции могут содержать одно или более веществ, включающих подсластители, вкусовые добавки, окрашивающие вещества и консерванты. Таблетки, содержащие активный ингредиент в смеси с нетоксичным фармацевтически приемлемым наполнителем, который пригоден для изготовления таблеток, считаются приемлемыми. Такие наполнители могут представлять собой, например, инертные разбавители, например карбонат кальция или натрия, лактозу, моногидрат лактозы, натрийкроскармеллозу, повидон, фосфат кальция или натрия; гранулирующие и дезинтегрирующие средства,например маисовый крахмал или альгиновую кислоту; связующие вещества, например целлюлозу, микрокристаллическую целлюлозу, крахмал, желатин или камедь; и вещества, способствующие скольжению, например стеарат магния, стеариновую кислоту или тальк. Таблетки могут не иметь покрытия или иметь покрытие, нанесенное по одной из известных методик включая микрокапсулирование с целью замедления разрушения и абсорбции в желудочно-кишечном тракте и, таким образом, обеспечения действия в течение продолжительного времени. Для этой цели может быть использован материал, обеспечивающий замедленное действием, например глицерилмоностеарат или глицерилдистеарат, как таковой или в сочетании с воском. Композиции для перорального введения также могут быть изготовлены в виде желатиновых капсул,в которых активный ингредиент смешан с инертным твердым разбавителем, например фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водной или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом. Водные суспензии солей согласно настоящему изобретению содержат активные компоненты в смеси с наполнителями, подходящими для изготовления водных суспензий. Такие наполнители могут включать суспензирующий агент, например натрий-карбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и аравийскую камедь, и диспергирующие или смачивающие агенты, например природный фосфатид (например, лецитин), продукт конденсации алкиленоксида и жирной кислоты (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида с длинноцепочечным алифатическим спиртом (например, гептадекаэтиленоксицетанол), продукт конденсации этиленоксида с частичным сложным эфиром, полученным из жирной кислоты и ангидрида гексита (например, полиоксиэтиленсорбитанмоноолеат). Водная суспензия также может содержать один или более консервантов, например этил- или н-пропил-п-гидроксибензоат,одно или более окрашивающих веществ, одну или более вкусовых добавок и один или более подсластителей, например сахарозу или сахарин. Масляные суспензии могут быть приготовлены суспендированием активного ингредиента в растительном масле, например арахисовом масле, оливковом масле, конопляном масле или кокосовом масле,или в минеральном масле, например жидком парафине. Суспензии для перорального введения могут содержать загуститель, например пчелиный воск, твердый парафин или цетиловый спирт. Для получения приемлемого вкуса в препарат для перорального введения могут быть добавлены подсластители, например перечисленные выше, и вкусовые добавки. Такие композиции могут быть законсервированы добавлением антиоксиданта, например аскорбиновой кислоты. В диспергируемых порошках и гранулах согласно изобретению, подходящих для изготовления водной суспензии при добавлении воды, активный ингредиент находится в смеси с диспергирующим или смачивающим агентом, суспензирующим агентом и одним или более консервантов. Подходящие примеры диспергирующих или смачивающих агентов и суспензирующих агентов приведены выше. Препарат также может включать дополнительные наполнители, например подсластители, вкусовые добавки и окрашивающие вещества. Фармацевтические композиции согласно изобретению также могут представлять собой эмульсии типа "масло-в-воде". Масляная фаза может представлять собой растительное масло, например оливковое масло или арахисовое масло, минеральное масло, например жидкий парафин, или смесь указанных веществ. Подходящие эмульгаторы включают природные камеди, например аравийскую камедь и трагакантовую камедь, природные фосфатиды, например соевый лецитин, сложные эфиры или частичные сложные эфиры, полученные из жирных кислот и ангидридов гексита, например сорбитанмоноолеат, и продукты конденсации таких частичных сложных эфиров с этиленоксидом, например полиоксиэтилен-5 018308 сорбитанмоноолеат. Эмульсии также могут содержать подсластители и вкусовые добавки. Сиропы и эликсиры могут быть включать подсластители, например глицерин, сорбит или сахарозу. Такие композиции также могут содержать болеутоляющее средство, консервант, вкусовую добавку или окрашивающее вещество. Фармацевтические композиции согласно изобретению могут представлять собой стерильный инъецируемый препарат, например стерильную инъецируемую водную или масляную суспензию. Такая суспензия может быть приготовлена способами, известными в данной области техники, и включать подходящие диспергирующие или смачивающие агенты и суспендирующие агенты, упомянутые выше. Стерильный инъецируемый препарат также может представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном разбавителе или растворителе, приемлемом для парентерального введения, например раствор в 1,3-бутандиоле, или он может быть приготовлен в виде лиофилизированного порошка. Приемлемыми носителями и растворителями являются вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды могут быть использованы традиционно применяемые стерильные нелетучие масла. Для этой цели может быть использовано любое мягкое (безвкусное) нелетучее масло, включающее синтетические моно- или диглицериды. Кроме того, для приготовления инъецируемых препаратов также могут быть использованы жирные кислоты, например олеиновая кислота. Количество активного ингредиента, которое может быть смешано с материалом носителя для получения одной лекарственной формы, может быть различным, например, в зависимости от выбранного способа введения. Например, состав с замедленным высвобождением, предназначенный для перорального введения человеку, может содержать приблизительно от 1 до 1000 мг активного материала в сочетании с подходящим количеством материала носителя, которое может составлять приблизительно от 5 до приблизительно 95 мас.% от общей массы композиции. Композиции, подходящие для закапывания в глаза, включают глазные капли, в которых активный ингредиент растворен или суспендирован в подходящем носителе, в частности в водном растворителе для активного ингредиента. Композиции, подходящие для топического введения в ротовую полость, включают таблетки для рассасывания, содержащие активный ингредиент во вкусовой основе, например сахарозе и трагакантовой камеди или аравийской камеди; пастилки, содержащие активный ингредиент в инертной основе, например желатине и глицерине или сахарозе и камеди; и ополаскиватели для полости рта, включающие активный ингредиент в подходящем жидком носителе. Композиции для перректального введения могут быть изготовлены в виде суппозиториев на подходящей основе, включающей, например, масло какао или салицилат. Композиции, подходящие для внутрилегочного или интраназального введения, включают частицы,размер которых составляет, например, от 0,1 до 500 мкм (включая частицы, размер которых составляет от 0,1 до 500 мкм с шагом порядка 1 мкм, например 0,5, 1, 30, 35 мкм и т.д.), которые вводят посредством быстрого вдоха через носовой ход или вдоха через рот таким образом, что препарат достигает альвеолярных мешочков. Подходящие композиции включают водные или масляные растворы активного ингредиента. Композиции, подходящие для введения в виде аэрозолей или сухих порошков, могут быть получены традиционными способами и могут быть введены вместе с другими терапевтическими средствами,например соединениями, применяемыми для лечения или профилактики состояний, связанных с активностью ВИЧ. Композиции, подходящие для первагинального введения могут быть изготовлены в виде пессариев,тампонов, кремов, гелей, паст, пенок или спреев, содержащих, кроме активного ингредиента, подходящие носители, известные в данной области техники. Композиции, подходящие для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферные вещества, бактериостатические агенты и растворенные вещества, придающие композиции изотонические свойства в сравнении с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Композиции помещают в упаковки для однократных дозировок или в контейнеры для нескольких доз, например в запаянные ампулы и флаконы; композиции могут храниться в высушенном сублимационной сушкой (лиофилизированном) состоянии, и перед использованием в них требуется добавить стерильный жидкий носитель, например воду для инъекций. Приготовляемые для немедленного введения растворы и суспензии для инъекций готовят из стерильных порошков, гранул и таблеток, подобных описанным выше. Предпочтительные стандартные лекарственные формы содержат суточную дозу или стандартную суточную субдозу или подходящую часть стандартной суточной дозы активного ингредиента. Таким образом, например, суточная доза соли согласно настоящему изобретению может быть предоставлена в виде одной таблетки или множества таблеток (например, двух или трех таблеток). Следует отметить, что кроме ингредиентов, конкретно упомянутых выше, композиции согласно настоящему изобретению могут включать другие средства, традиционно применяемые в данной области техники для приготовления конкретного состава, например составы, подходящие для перорального вве-6 018308 дения, могут включать вкусовые добавки. Фармацевтические композиции, которые также входят в объем изобретения, обеспечивают контролируемое высвобождение активного ингредиента, что позволяет реже производить введение лекарственного средства или улучшать фармакокинетический или токсикологический профиль активного ингредиента. Соответственно, изобретение также включает фармацевтические композиции, содержащие одну или более солей согласно изобретению, находящихся в составах, пригодных для замедленного или контролируемого высвобождения. Эффективная доза соли согласно настоящему изобретению зависит, например, от того, используется ли соль для профилактики (обычно для профилактики используется меньшая доза, чем для терапевтического применения), от способа доставки и типа фармацевтической композиции, и может быть определена лечащим врачом при помощи традиционных исследований с увеличением дозы. Предположительно,эффективная доза составляет приблизительно от 0,0001 до приблизительно 100 мг/кг массы тела в сутки. Обычно она составляет приблизительно от 0,01 до приблизительно 10 мг/кг массы тела в сутки. Чаще она составляет приблизительно от 0,01 до приблизительно 5 мг/кг массы тела в сутки. Еще чаще она составляет приблизительно от 0,05 до приблизительно 0,5 мг/кг массы тела в сутки. Например, суточная доза для взрослого человека, масса тела которого составляет приблизительно 70 кг, обычно составляет от 1 до 1000 мг, предпочтительно от 5 до 500 мг, и может быть ведена в виде однократной дозировки или многократных дозировок. Например, доза соли согласно настоящему изобретению в стандартной лекарственной форме, вводимой один раз в сутки, может составлять от 1 до 100 мг, например от 30 до 60 мг,например 30 или 60 мг в сутки. Комбинированная терапия. Каждая из названных солей лимонной, янтарной и малоновой кислот этил-N-[(S)-([(2R,5R)-5-(6 амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината может быть введена в сочетании с другими терапевтическими средствами для лечения или профилактики СПИД и/или одного или более других заболеваний, имеющихся у человеческого субъекта, страдающего СПИД (например, бактериальных и/или грибковых инфекций, других вирусных инфекций, например гепатита В или гепатита С, или раковых заболеваний, например саркомы Капоши). Дополнительное терапевтическое средство (средства) может быть включено в состав вместе с одной или более солями согласно настоящему изобретению (например, включено в состав таблетки). Примеры дополнительных терапевтических средств, включающих средства, эффективные при лечении или профилактике вирусных, паразитных или бактериальных инфекций или связанных с ними состояний, или при лечении опухолей или связанных с ними состояний, включают 3'-азидо-3'-деокситимидин (зидовудин, AZT), 2'-деокси-3'-тиацитидин (3 ТС), 2',3'-дидеокси-2',3'дидегидроаденозин (D4A), 2',3'-дидеокси-2',3'-дидегидротимидин (D4T), карбовир (карбоциклический 2',3'-дидеокси-2',3'-дидегидрогуанозин), 3'-азидо-2',3'-дидеоксиуридин, 5-фтортимидин, (Е)-5-(2-бромвинил)-2'-деоксиуридин (BVDU), 2-хлордеоксиаденозин, 2-деоксикоформицин, 5-фторурацил,5-фторуридин, 5-фтор-2'-деоксиуридин, 5-трифторметил-2'-деоксиуридин, 6-азауридин, 5-фтороротовую кислоту, метотрексат, триацетилуридин, 1-(2'-деокси-2'-фтор-1-(-арабинозил)-5-йодцитидин (FIAC),тетрагидро-имидазо(4,5,1-jk)-(1,4)-бензодиазепин-2(1H)-тионGMP,6-метоксипуринарабинозид (ara-М), 6-метоксипуринарабинозид-2'-О-валерат; цитозинарабинозид (araС), 2',3'-дидеоксинуклеозиды, например 2',3'-дидеоксицитидин (ddC), 2',3'-дидеоксиаденозин (ddA) и 2',3'-дидеоксиинозин (ddI); ациклические нуклеозиды, например ацикловир, пенцикловир, фамцикловир,ганцикловир, НРМРС, РМЕА, PMEG, PMPA, PMPDAP, FPMPA, HPMPA, HPMPDAP,(2R,5R)-9-тетрагидро-5-(фосфонометокси)-2-фураниладенин, (2R,5R)-1-тетрагидро-5-(фосфонометокси)2-фуранилтимин; другие антивирусные средства, включающие рибавирин (аденинарабинозид), 2-тио-6 азауридин, туберцидин, ауринтрикарбоновую кислоту, 3-деазанеопланоцин, неопланоцин, римантидин,адамантин и фоскарнет (фосфоноформиат тринатрия); антибактериальные средства, включающие бактерицидные фторхинолоны (ципрофлоксацин, пефлоксацин и подобные им средства); аминогликозидные бактерицидные антибиотики (стрептомицин, гентамицин, амикацин и подобные им средства); ингибиторы -лактамазы (цефалоспорины, пенициллины и подобные им средства); другие антибактериальные средства, включающие тетрациклин, изониазид, рифампин, цефоперазон, клаитромицин и азитромицин,противопаразитные или противогрибковые средства, включающие пентамидин (1,5-бис-(4'аминофенокси)пентан), 9-деазаинозин, сульфаметоксазол, сульфадиазин, хинапирамин, хинин, флуконазол, кетоконазол, итраконазол, амфотерицин В, 5-фторцитозин, клотримазол, гексадецилфосфохолин и нистатин; ингибиторы экскреции с мочой, например пробеницид; ингибиторы транспорта нуклеозидов,например дипиридамол, дилазеп и нитробензилтиоинозин, иммуномодуляторы, например FK506, циклоспорин А, тимозин -1; цитокины, включающие TNF и TGF-; интерфероны, включающие IFN-,IFN-, и IFN-; интерлейкины, включающие различные интерлейкины, факторы, стимулирующие рост колоний макрофагов/гранулоцитов, включающие GM-CSF, G-CSF, M-CSF, антагонисты цитокинов,включающие анти-TNF антитела, антиинтерлейкиновые антитела, растворимые интерлейкиновые рецеторы, ингибиторы протеинкиназы С и подобные им средства. Примеры подходящих активных терапевтических средств или ингредиентов, которые можно использовать в сочетании с солями согласно настоящему изобретению, обладающие активностью против ВИЧ, включают: 1) ингибиторы протеазы ВИЧ, например ампренавир, атазанавир, фосампренавир, индинавир, лопинавир, ритонавир, лопинавир + ритонавир, нелфинавир, сакинавир, типранавир, бреканавир, дарунавир, ТМС-126, ТМС-114, мозенавир (DMP-450), JE-2147 (AG1776), AG1859, DG35, L-756423,RO0334649, KNI-272, DPC-681, DPC-684 и GW640385X, DG17, PPL-100; 2) ненуклеозидные ингибиторы обратной транскриптазы ВИЧ, например каправирин, эмивирин,делавиридин, эфавиренц, невирапин, (+) каланолид А, этравирин, GW5634, DPC-083, DPC-961, DPC-963,MIV-150 и ТМС-120, ТМС-278 (рилпивирин), эфавиренц, BILR 355 BS, VRX 840773, UK-453,061,RDEA806; 3) нуклеозидные ингибиторы обратной транскриптазы ВИЧ, например зидовудин, эмтрицитабин,диданозин, ставудин, зальцитабин, ламивудин, абакавир, амдоксовир, элвуцитабин, аловудин, MIV-210,рацивир (-FTC), D-d4FC, эмтрицитабин, фосфазид, фозивудин тидоксил, фозальвудин тидоксил, apricitibine (AVX754), амдоксовир, KP-1461, абакавир + ламивудин, абакавир + ламивудин + зидовудин, зидовудин + ламивудин; 4) нуклеотидные ингибиторы обратной транскриптазы ВИЧ, например тенофовир, тенофовир дизопроксилфумарат + эмтрицитабин, тенофовир дизопроксилфумарат + эмтрицитабин + эфавиренц и адефовир; 5) ингибитор интегразы ВИЧ, например курикумин, производные курикумина, цикориевую кислоту 2R,3R)-2,3-бис-[(Е)-3-(3,4-дигидроксифенил)проп-2-еноил]оксибутандиовую кислоту), производные цикориевой кислоты,(1S,3R,4R,5R)-3-[(2Z)-3-(3,4-дигидроксифенил)проп-2-еноил]окси-1,4,5 тригидроксициклогексанкарбоновую (3,5-dicaffeoylquinic) кислоту, производные (1S,3R,4R,5R)-3-[(2Z)3-(3,4-дигидроксифенил)проп-2-еноил]окси-1,4,5-тригидроксициклогексанкарбоновой кислоты, ауринтрикарбоновую кислоту, производные ауринтрикарбоновой кислоты, фенэтиловый эфир кофеиновой(3-(3,4-дигидроксифенил-2-пропеновой) кислоты, производные фенэтилового эфира кофеиновой кислоты, тирфостин, производные тирфостина, кверцетин, производные кверцетина, S-1360, зинтевир (zintevir)gp41, CovX и REP 9; 7) ингибитор CXCR4, например AMD-070; 8) ингибитор проникновения в клетку, например SPO1A, TNX-355; 9) ингибитор gp120, например BMS-488043 и BlockAide/CR; 10) ингибиторы G6PD и NADH-оксидазы, например иммунитин; 11) ингибитор CCR5, например аплавирок, викривирок, INCB9471, PRO-140, INCB15050,PF-232798, CCR5mAb004 и маравирок; 12) интерферон, например пэгилированный rIFN-альфа 2b, пэгилированный rIFN-альфа 2 а,rIFN-альфа 2b, IFN-альфа 2b XL, rIFN-альфа 2 а, консенсусный IFN-альфа, инферген, ребиф, локтерон,AVI-005, PEG-инферген, пэгилированный IFN-бета, интерферон альфа для перорального введения, ферон, реаферон, интермакс альфа, rIFN-бета, инферген + актиммун, IFN-омега с DUROS и альбуферон; 13) аналоги рибавирина, например ребетол, копегус, левовирин, VX-497 и вирамидин (тарибавирин); 14) ингибиторы NS5a, например А-831 и А-689; 15) ингибиторы NS5b полимеразы, например NM-283, валопицитабин, R1626, PSI-6130 (R1656),HIV-796, BILB 1941, MK-0608, NM-107, R7128, VCH-759, PF-868554, GSK625433 и XTL-2125; 16) ингибиторы NS3 протеазы, например SCH-503034 (SCH-7), VX-950 (Телапревир), ITMN-191 иBILN-2065; 17) ингибиторы альфа-глюкозидазы 1, например МХ-3253 (целгосивир) и UT-231B; 18) средства защиты печени, например IDN-6556, ME 3738, MitoQ и LB-84451; 19) ненуклеозидные ингибиторы ВИЧ, например производные бензимидазола, производные бензо 1,2,4-тиадиазина и производные фенилаланина; 20) другие лекарственные средства для лечения ВИЧ, например задаксин, нитазоксанид (алинеа),BIVN-401 (виростат), DEBIO-025, VGX-410C, EMZ-702, AVI 4065, бавитуксимаб, оглуфанид, PYN-17,KPE02003002, актилон (CPG-10101), KRN-7000, цивацир, GI-5005, ANA-975 (изаторибин), XTL-6865,ANA 971, NOV-205, тарвацин, ЕНС-18 и NIM811; 21) усилители (энхансеры) фармакокинетики, например BAS-100 и SPI452; 22) ингибиторы РНКазы Н, например ODN-93 и ODN-112; 23) другие анти-ВИЧ средства, например VGV-1, РА-457 (бевиримат), амплиген, HRG214, цитолин,полимун, VGX-410, KD247, AMZ 0026, CYT 99007, А-221 ВИЧ, BAY 50-4798, MDX010 (иплимумаб),PBS119, ALG889 и РА-1050040. Ниже в качестве примера перечислены некоторые антивирусные средства, эффективные против ВИЧ, и соответствующие им номера патентов США, которые можно использовать в сочетании с солями согласно настоящему изобретению. Примеры антивирусных средств, эффективных против ВИЧ, и соответствующие номера патентов США. Зиаген (Абакавир сульфат, US 5034394). Эпзиком (Абакавир сульфат/ламивудин, US 5034394). Гепсера (Адефовир дипивоксил, US 4724233). Агенераза (Ампренавир, US 5646180). Рейатаз (Атазанавир сульфат, US 5849911). Рескриптор (Делавиридин мезилат, US 5563142). Хивид (Дидеоксицитидин; Зальцитабин, US 5028595). Видекс (Дидеоксиинозин; Диданозин, US 4861759). Сустива (Эфавиренц, US 5519021). Эмтрива (Эмтрицитабин, US 6642245). Лексива (Фосампренавир кальция, US 6436989). Вирудин; Триаптен; Фоскавир (Фоскарнет натрия, US 6476009). Криксиван (Индинавир сульфат, US 5413999). Эпивир (Ламивудин, US 5047407). Комбивир (Ламивудин/Зидовудин, US 4724232). Алувиран (Лопинавир). Калетра (Лопинавир/ритонавир, US 5541206). Вирацепт (Нелфинавир мезилат, US 5484926). Вирамун (Невирапин, US 5366972). Хопвир (Ритонавир, US 5541206). Инвираза; Фортоваза (Сакинавир мезилат, US 5196438). Церит (Ставудин, US 4978655). Трувада (Тенофовир дизопроксил фумарат/эмтрицитабин, US 5210085). Аптивус (Типранавир). Ретровир (Зидовудин; Азидотимидин, US 4724232). Способы ингибирования ВИЧ. Другой аспект настоящего изобретения относится к способам лечения синдрома приобретенного иммунодефицита (СПИД), где каждый из способов включает этап введения человеку, страдающему СПИД, терапевтически эффективного количества соли согласно изобретению или гидрата соли согласно изобретению. Лечение СПИД включает снижение по меньшей мере одного симптома СПИД и/или замедление или предотвращение прогрессирования заболевания. Обычно терапевтически эффективное количество соли вводят человеку в виде фармацевтической композиции, описанной в разделе "Фармацевтические композиции". Обычно фармацевтическую композицию вводят перорально, например в виде таблетки. Примерами терапевтически эффективных суточных доз одной или более солей согласно изобретению или их гидратов являются от 1 до 100 мг, например от 10 до 30 мг. Соли согласно изобретению можно вводить ежесуточно, например, в виде одной или более таблеток, которые содержат количество соли, соответствующее эффективному количеству, например 10, или 30, или 60 мг свободного основания при диссоциации соли в водной среде человеческого организма. Способы введения. Одну или более солей согласно изобретению вводят любым способом, подходящим для лечения имеющегося состояния. Подходящие способы введения включают пероральное, перректальное, перназальное, топическое (включая буккальное и сублингвальное), первагинальное и парентеральное (включая подкожное, внутримышечное, внутривенное, внутрикожное, интратекальное и эпидуральное) введение и подобные им способы. Следует отметить, что предпочтительный способ может зависеть, например, от состояния реципиента. Преимущество солей согласно настоящему изобретению состоит в том, что они обладают биодоступностью при пероральном введении и могут быть введены перорально. Примеры и варианты реализации См. также документ WO 2006/110157, содержание которого полностью включено в настоящее описание посредством ссылки, в частности, включены стр. 167-174. Пример 1. Синтез этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината. Соединение (2) было синтезировано в соответствии со схемами синтеза, описанными в публикациях Tann et al., JOC, 1985, vol. 50, p. 3644 и Howell et al., JOC, 1988, vol. 53, p. 85. К раствору 1.3.5-три-O-бензоил-2-деокси-2-фторD-арабинофуранозы (1) (120 г, 258 ммоль), поставляемому Davos или CMS Chemicals, в CH2Cl2 (1 л) добавляли 33% HBr/уксусную кислоту (80 мл). Смесь перемешивали при комнатной температуре в течение 16 ч, охлаждали льдом с водой и медленно нейтрализовали в течение 1-2 ч добавлением NaHCO3 (150 г/ 1,5 л раствора). Фазу CH2Cl2 отделяли и концентрировали под уменьшенным давлением. Остаток растворяли в этилацетате и промывали NaHCO3 до полного удаления кислоты. Органическую фазу сушили надMgSO4, фильтровали и концентрировали под уменьшенным давлением, получая продукт 2 в виде желтого масла (115 г). 2-Деокси-2-фтор-3,5-ди-O-бензоилD-арабинофуранозил-9H-6-хлорпурин (3) Соединение (3) было синтезировано в соответствии со схемами синтеза, описанными в публикациях Ma et al., J. Med. Chem., 1997, vol. 40, p. 2750; Marquez et al., J. Med. Chem., 1990, vol. 33, p. 978;Hildebrand et al., J. Org. Chem., 1992, vol. 57, p. 1808 и Kazimierczuk et al., JACS, 1984, vol. 106, p. 6379. К суспензии NaH (14 г, 60%) в ацетонитриле (900 мл) 3 порциями добавляли 6-хлорпурин (52,6 г). Смесь перемешивали при комнатной температуре в течение 1,5 ч. Добавляли по каплям раствор 2(258 ммоль) в ацетонитриле (300 мл). Полученную смесь перемешивали при комнатной температуре в течение 16 ч. Реакцию гасили уксусной кислотой (3,5 мл), фильтровали и концентрировали под уменьшенным давлением. Остаток разделяли между CH2Cl2 и водой. Органическую фазу сушили над MgSO4,фильтровали и концентрировали. Остаток обрабатывали CH2Cl2 и затем EtOH (1:2 в общем) для осаждения целевого продукта 3 в виде желтоватого твердого вещества (83 г, 65% из 1). 2-Деокси-2-фторD-арабинофуранозил-6-метоксиаденин (4) К суспензии 3 (83 г, 167 ммоль) в метаноле (1 л) при 0C добавляли NaOMe (25 мас.%, 76 мл). Смесь перемешивали при комнатной температуре в течение 2 ч и затем гасили уксусной кислотой(11 мл, pH 7). Смесь концентрировали под уменьшенным давлением и полученный остаток разделяли между гексаном и водой (приблизительно 500 мл гексана и 300 мл воды). Водный слой отделяли и органический слой снова смешивали с водой (приблизительно 300 мл). Водные фракции объединяли и концентрировали под уменьшенным давлением до 100 мл. Выпадал продукт 4, который собирали фильтрованием (42 г, 88%). 2-Деокси-2-фтор-5-карбоксиD-арабинофуранозил-6-метоксиаденин (5) Соединение (5) было синтезировано в соответствии со схемами синтеза, описанными в публикацииH2O (500 мл) перемешивали при 65C в атмосфере H2 в течение 0,5 ч. Затем реакционную смесь оставили охлаждаться, помещали в вакуум и несколько раз продували N2 для полного удаления H2. Затем при комнатной температуре добавляли соединение 4 (5,1 г, 17,94 ммоль). Реакционную смесь перемешивали при 65C в атмосфере O2 (эластичный баллон) до завершения реакции по данным ЖХ-МС (обычно 24-72 ч). Смесь охлаждали до комнатной температуры и фильтровали. Катализатор Pt/C тщательно промывали H2O. Объединенные фильтраты концентрировали до 30 мл и подкисляли (рН 4) добавлениемHCl (4 н.) при 0C. Выпадало черное твердое вещество, которое собирали фильтрованием. Неочищенный продукт растворяли в минимальном количестве метанола и фильтровали через слой силикагеля (элюируя метанолом). Фильтрат концентрировали и кристаллизовали из воды, получая соединение 5 (2,5 г) в виде беловатого твердого вещества.(2'R,3'S,4'R,5'R)-6-Метокси-9-[тетрагидро-4-йод-3-фтор-5-(диэтоксифосфинил)метокси-2-фуранил]пурин (6) Соединение (6) было синтезировано в соответствии со схемами синтеза, описанными в публикацииZemlicka et al., J. Amer. Chem., Soc., 1972, vol. 94, p. 3213. К раствору 5 (22 г, 73,77 ммоль) в ДМФА (400 мл), добавляли ДМФА динеопентилацеталь (150 мл,538 ммоль) и метансульфоновую кислоту (9,5 мл, 146,6 ммоль). Реакционную смесь перемешивали при 80-93C (внутренняя температура) в течение 30 мин, затем охлаждали до комнатной температуры и концентрировали под уменьшенным давлением. Остаток разделяли между этилацетатом и водой. Органическую фазу отделяли и промывали NaHCO3 затем рассолом, сушили над MgSO4, фильтровали и концентрировали под уменьшенным давлением. Остаток и диэтил(гидроксиметил)фосфонат (33 мл, 225 ммоль) растворяли в CH2Cl2 (250 мл) и охлаждали до -40C. Добавляли по каплям раствор монобромида йода(30,5 г, 1,1 моль) в CH2Cl2 (100 мл). Смесь перемешивали при -20 до -5C в течение 6 ч. Реакцию затем гасили NaHCO3 и Na2S2O3. Органическую фазу отделяли и водную фазу экстрагировали CH2Cl2. Объединенные органические фазы промывали соляным раствором, сушили над MgSO4, фильтровали и концентрировали под уменьшенным давлением. Остаток очищали хроматографией на силикагеле, получая продукт 6 (6 г, 15,3%). Альтернативный способ синтеза 6. Раствор 5 (2,0 г, 6,7 ммоль) в ТГФ (45 мл) обрабатывали трифенилфосфином (2,3 г, 8,7 ммоль) в атмосфере N2. Медленно добавляли диизопропилазодикарбоксилат (1,8 г, 8,7 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 ч и затем концентрировали под уменьшенным давлением досуха. Остаток растворяли в CH2Cl2 (20 мл) и затем обрабатывали диэтил(гидроксиметил)фосфонатом (4,5 г, 27 ммоль). Смесь охлаждали до -60C и затем добавляли холодный раствор монобромида йода (2 г, 9,6 ммоль) в CH2Cl2 (10 мл). Реакционную смесь нагревали до -10C и затем выдерживали при -10C в течение 1 ч. Реакционную смесь разбавляли CH2Cl2, промывали насыщенным водным NaHCO3 и затем водным раствором тиосульфата натрия. Органическую фазу отделяли,сушили над MgSO4 и концентрировали под уменьшенным давлением досуха. Реакционную смесь очищали хроматографией на силикагеле (элюируя 25% этилацетата в CH2Cl2, затем заменяя на 3% метанол в(2'R,5'R)-6-Метокси-9-[3-фтор-2,5-дигидро-5-(диэтоксифосфинил)метокси-2-фуранил]пурин (7) К раствору соединения 6 (6 г, 11,3 ммоль) в уксусной кислоте (2,5 мл) и метаноле (50 мл), добавляли по каплям NaClO (10-13%) (50 мл). Реакционную смесь затем перемешивали в течение 0,5 ч и концентрировали под уменьшенным давлением. Остаток обрабатывали этилацетат и затем фильтровали для удаления твердых веществ. Фильтрат концентрировали и остаток очищали хроматографией на силикагеле, получая продукт 7 (4 г, 88%).(28-30%) (60 мл). Полученную смесь перемешивали при 120C в течение 4 ч, охлаждали и затем концентрировали под уменьшенным давлением. Остаток сушили в вакууме в течение 12 ч. Остаток растворяли в ДМФА (40 мл) и добавляли бромтриметилсилан (3,5 мл). Смесь перемешивали при комнатной температуре в течение 16 ч и затем концентрировали под уменьшенным давлением. Остаток растворяли в водном NaHCO3 (2,3 г в 100 мл воды). Раствор испаряли и остаток очищали на колонке С-18 (40 мкм), элюируя водой. Водные фракции сушили сублимационной сушкой, получая динатриевую соль 8 (1,22 г, 57%). Пример синтеза моноамидата (9) Динатриевую соль 8 (25 мг, 0,066 ммоль), гидрохлорид (S)-Ala-O-циклобутилового эфира (24 мг,2 экв., 0,133 ммоль) и фенол (31 мг, 0,333 ммоль) смешивали в безводном пиридине (1 мл). Добавляли триэтиламин (111 мкл, 0,799 ммоль) и полученную смесь перемешивали при 60C в атмосфере азота. В отдельной колбе растворяли в безводном пиридине (0,5 мл) 2'-Aldrithiol (122 мг, 0,466 ммоль) и трифенилфосфин (103 мг, 0,466 ммоль) и полученный желтый раствор перемешивали в течение 15-20 мин. Раствор затем добавляли к раствору 8 одной порцией. Объединенные смеси перемешивали при 60C в атмосфере азота в течение 16 ч, получая прозрачный раствор от желтого до светло-коричневого цвета. Смесь затем концентрировали под уменьшенным давлением. Полученное масло растворяли в CH2Cl2 и очищали хроматографией на силикагеле (элюируя линейным градиентом от 0 до 5% МеОН в CH2Cl2), получая масло. Полученное масло растворяли в ацетонитриле и воде и очищали препаративной ЖХВР (линейный градиент, 5-95% ацетонитрил в воде). Чистые фракции объединяли и сушили сублимационной сушкой,получая моноамидат 9 в виде белого порошка. Пример синтеза бис-амидата (10) Динатриевую соль 8 (12 мг, 0,032 ммоль) и гидрохлорида эфира (S)-Ala-O-n-Pr (32 мг, 6 экв.,0,192 ммоль) смешивали в безводном пиридине (1 мл). Добавляли триэтиламин (53 мкл, 0,384 ммоль) и полученную смесь перемешивали при 60C в атмосфере азота. В отдельной колбе в безводном пиридине(0,5 мл) растворяли 2'-Aldrithiol (59 мг, 0,224 ммоль) и трифенилфосфин (49 мг, 0,224 ммоль) и полученный желтый раствор перемешивали в течение 15-20 мин. Раствор затем добавляли одной порцией к раствору 8. Объединенные смеси перемешивали при 60C в атмосфере азота в течение 16 ч, получая прозрачный раствор от желтого до светло-коричневого цвета. Смесь затем концентрировали под уменьшенным давлением. Полученное масло растворяли в CH2Cl2 и очищали хроматографией на силикагеле(элюируя линейным градиентом от 0 до 5% МеОН в CH2Cl2), получая масло. Полученное масло растворяли в ацетонитриле и воде и очищали препаративной ЖХВР (линейный градиент, 5-95% ацетонитрил в воде). Чистые фракции объединяли и сушили сублимационной сушкой, получая бис-амидат в виде белого порошка. Пример синтеза моноамидата (11) Соединение 8 (1,5 г, 4 ммоль) смешивали с HCl солью этилового эфира аланина (1,23 г, 8 ммоль) и фенолом (1,88 г, 20 ммоль). Добавляли безводный пиридин (35 мл) и затем ТЭА (6,7 мл, 48 ммоль). Смесь перемешивали при 60C в атмосфере азота в течение 15-20 мин. 2'-Aldrithiol (7,3 г) смешивали в отдельной колбе с трифенилфосфином (6,2 г) в безводном пиридине (5 мл) и полученную смесь перемешивали в течение 10-15 мин, получая прозрачный светло-желтый раствор. Раствор затем добавляли полученной ранее смеси и перемешивали в течение ночи при 60C. Смесь концентрировали под уменьшенным давлением для удаления пиридина. Полученный остаток растворяли в этилацетате и промывали насыщенным раствором бикарбоната натрия (2) и затем насыщенным раствором хлорида натрия. Органический слой сушили над сульфатом натрия, фильтровали и затем концентрировали под уменьшенным давлением. Полученное масло растворяли в дихлорметане и загружали на сухую колонку CombiFlash, 40 г, элюируя линейным градиентом 0-5% метанола в дихлорметане в течение 10 мин и затем 5% метанола в дихлорметане в течение 7-10 мин. Фракции, содержащие целевой продукт, объединяли и концентрировали под уменьшенным давлением, получая пену. Пену растворяли в ацетонитриле и очищали препаративной ЖХВР, получая 11 (0,95 г). Вещество 11 (950 мг) растворяли в небольшом количестве ацетонитрила и оставляли при комнатной температуре на ночь. Твердое вещество собирали фильтрованием и промывали небольшим количеством ацетонитрила. Фильтрат испаряли в вакууме и затем загружали на колонку Chiralpak AS-H, уравновешенную буфером А, 2% этанолом в ацетонитриле. Изомер А, 12, элюировали буфером А при скорости 10 мл/мин в течение 17 мин. После этого буфер В, представляющий собой 50% раствор метанола в ацетонитриле, использовали для того, чтобы выделить изомер В, 13, из колонки путем элюирования в течение 8 мин. Все растворители удаляли и затем изомеры повторно растворяли по отдельности в ацетонитриле и воде. Образцы сушили по отдельности сублимационной сушкой (масса - 348 мг). Изомер 12 представлен ниже Пример 2. Оценка солевых форм этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5 дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината. Для оценки способности кислот образовывать подходящие кристаллические соли этил-N-[(S)([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]L-аланината исследовали следующие кислоты. Минеральные кислоты (HX, где X = галоген; Н 3 РО 4); органические сульфоновые кислоты (RSO3H,где R = Me, Et, Ph, (t)-камфор-10-сульфоновую кислоту; нафталин-2-сульфоновую кислоту; нафталин 1,5-дисульфоновую кислоту); монокарбоновые кислоты (RCO2H, где R = Н, Me, Et, Ph, транс-PhCH=CH,Cl2CH, PhCONHCH2) и дикарбоновые кислоты (малоновую, янтарную, фумаровую, адипиновую, щавелевую, малеиновую). Твердые вещества были получены при смешивании этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9 ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината с тремя из вышеуказанных кислот, а именно с трифторуксусной, малоновой и янтарной кислотами. Трифторуксусная кислота, однако, считается фармацевтически неприемлемой. Этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланинат представляет собой амидатное пролекарство, которое подвергается разложению в протонных растворителях в кислотной или щелочной среде. По этой причине, кислоты, содержащие потенциально нуклеофильные фрагменты, не были включены в первый этап оценки. Затем была произведена оценка солей лимонной кислоты, гликолевой кислоты, (S)-(+)-молочной кислоты, салициловой кислоты, (S)-(-)-яблочной кислоты, (S)-(+)-миндальной кислоты и(S)-(+)-глютаминовой кислоты. Неожиданно было обнаружено, что этил-N-[(S)-([(2R,5R)-5-(6-амино 9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланинат образует стабильную кристаллическую соль с лимонной кислотой. Этот результат был неожиданным, поскольку лимонная кислота включает гидроксильную группу, которая может действовать как нуклеофил по отношению к амидатному фрагменту этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5 дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината, и потенциально способна реагировать с ним с образованием ковалентной связи между этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4 фтор-2,5 дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланинатом и гидроксильной группой лимонной кислоты с отщеплением либо фенола, либо этилового эфира аланина. Пример 3. Синтез малоновой соли этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5 дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината. Этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланинат в виде свободного основания растворяли в теплом 2-бутаноне (15 частей) и добавляли при перемешивании малоновую кислоту (0,26 частей), получая раствор. К этому раствору добавляли гептан (5 частей) и медленно охлаждали приблизительно до 5C, осадок собирали и промывали холодным 2-бутаноном/гептаном. Целевой малонат этил-N-[(S)-([(2R,5R)-5(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината был получен с выходом приблизительно 80%. Спектр ЯМР соли малоновой кислоты имеет следующие характеристики: 1F ЯМР (376 МГц, ацетонитрил-d3) м.д. = -135,19 (s). Пример 4. Синтез соли янтарной кислоты этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4- 13018308 фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината. Этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланинат в виде свободного основания растворяли в теплом 2-бутаноне (15 частей) и добавляли при перемешивании янтарную кислоту (0,28 частей) получая раствор. Раствор медленно охлаждали до приблизительно 5C, осадок собирали и промывали холодным 2-бутаноном/гептаном, получая сукцинат этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5 дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината с выходом 80%. Спектр ЯМР соли янтарной кислоты имеет следующие характеристики: 1 Н ЯМР (400 МГц, ацетонитрил-d) м.д. = 8,26 (s, 1H), 8,15 (s, 1H), 7,29 (dd, J=7,6, 7,6 Гц, 2H), 7,16F ЯМР (376 МГц, ацетонитрил-d3) м.д. = -135,19 (s). Пример 5. Синтез соли лимонной кислоты этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4 фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината. Этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланинат в виде свободного основания (приблизительно 30 г) растворяли в горячем ацетонитриле (16 частей) и при перемешивании добавляли лимонную кислоту(0,38 частей). Полученный раствор медленно охлаждали до приблизительно 5C, осадок собирали, промывали холодным ацетонитрилом и сушили, получая цитрат этил-N-[(S)-([(2R,5R)-5-(6-амино-9Hпурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината с выходом приблизительно 84%. Спектр ЯМР соли лимонной кислоты имеет следующие характеристики: 1F ЯМР (376 МГц, ацетонитрил-d3) м.д. = -133,88 (s). МСВР (масс-спектрометрия высокого разрешения): m/z: 507,1561; Вычислено для C21H24FN6O6P: 507,1557. Анал. Вычислено для C21H24FN6O6P: С: 46,42; Н: 4,62; N: 12,03; Р: 4,43; F: 2,72; Найдено: С: 45,83; Н: 4,74; N: 11,81; Р: 4,45; F: 2,80. Пример 6. Физико-химические свойства солей этил-N-[(S)-([(2R,5R)-5-(6-амино-9 Н-пурин-9-ил)-4 фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината. Были синтезированы образцы солей малоновой, янтарной и лимонной кислот этил-N-[(S)([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]L-аланината. Были определены температуры плавления этих солей, представляющие собой грубую оценку стабильности: чем выше температура плавления, тем выше уровень стабильности. Как указано в табл. 1, самую высокую температуру плавления имеет соль лимонной кислоты. Кроме того, в табл. 1 представлены теплоты плавления (Н(плавления каждой из трех солей. Самую высокую теплоту плавления имеет соль лимонной кислоты, что указывает на более высокую степень кристалличности в твердом состоянии, чем у двух других солей. В табл. 1 приведены температуры плавления и теплоты плавления солей сукцината,малоната и цитрата этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината. Таблица 1 Свободное основание этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран 2-ил]оксиметил)феноксифосфиноил]-L-аланината представляет собой аморфное гигроскопичное вещество, химически нестабильное при хранении на открытом воздухе при 40C и 75% относительной влажности (RH). Как указано в табл. 2, соответствующие соли янтарной, малоновой и лимонной кислот негигроскопичны при хранении в течение нескольких суток при комнатной температуре при относительной влажности, равной 92%. В табл. 2 показана гигроскопичность твердых солевых форм этил-N-[(S)-([(2R,5R)-5-(6-амино-9H- 14018308 Химическую стойкость свободного основания, сукцината, малоната и цитрата этил-N-[(S)([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]L-аланината в твердом состоянии исследовали на открытом воздухе при 40C и относительной влажности 75%. Как указано в табл. 3, соль лимонной кислоты имеет более высокую химическую стойкость по сравнению с солями янтарной и малоновой кислот. В табл. 3 показана стабильность свободного основания этил-N-[(RS)-([(2R,5R)-5-(6-амино-9Hпурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]окси 1 метил)феноксифосфиноил]-L-аланината и соответствующих солей янтарной, лимонной и малоновой кислот в твердом состоянии при 40C и относительной влажности 75% на открытом воздухе. Таблица 3 Пример 7. Состав таблеток, содержащих активный ингредиент в количестве, эквивалентном 10 и 30 мг свободного основания этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5 дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината. Соль лимонной кислоты и этил-N-[(RS)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5 дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината вводили в таблетки с содержанием 10 и 30 мг способом вальцевания. Сначала смешивали активный ингредиент, безводную лактозу, микрокристаллическую целлюлозу и натрий-кроскармелллозу, затем в смесь добавляли одну треть от общего количества вещества, способствующего скольжению, стеарата магния, затем подвергали вальцеванию и затем размалывали. В полученные гранулы добавляли оставшееся количество вещества, способствующего скольжению, стеарата магния и прессовали в таблетки. В табл. 4 показан состав таблеток, которые включают соль лимонной кислоты этил-N-[(S)([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]L-аланината и содержат либо 10 мг, либо 30 мг свободного основания соединения, получаемого после диссоциации соли лимонной кислоты в водной среде. Эквивалент 10% 2/2 свободного основания соединения. Действительную массу лекарственного вещества уточняют в соответствии с чистотой лекарственного вещества.b Эквивалент 10 мг свободного основания соединения. с Эквивалент 30 мг свободного основания соединения.d Уточненное количество лекарственного вещества вычитают из количества безводной лактозы. е Аббревиатура NF означает Национальный формуляр, аббревиатура HSE означает внутренний фармакопейный источник (House Compendial Reference), который представляет собой внутренний стандарт, используемый в Gilead Sciences. Пример 8. Сравнение содержания активного метаболита в лимфоцитах после введения в лимфоциты этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината (пролекарство) или исходного соединения. Этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланинат представляет собой пролекарство, которое гидролизуется в организме человека, образуя продукт гидролиза, называемый далее "исходным соединением". Исходное соединение подвергается в организме человека фосфорилированию с образованием биологически активного фосфорилированного продукта (называемого далее "активным метаболитом"), который ингибирует активность фермента обратной транскриптазы. Для характеристики внутриклеточного метаболизма пролекарства и исходного соединения, лимфоциты обрабатывали либо 1 мкМ пролекарства, либо 100 мкМ исходного соединения в течение 2, 6 и 24 ч. Одноядерные клетки периферической крови (ОКПК) были выделены из лейкоцитарных пленок человека(Stanford Blood Bank, Palo Alto, CA) центрифугированием в Ficoll Paque Plus (GE Healthcare, Piscataway,NJ) в соответствии с протоколом изготовителя. ОКПК, полученные от 3-4 независимых доноров выдерживались в среде RPM1-1640, содержащей 20% эмбриональной бычьей сыворотки и антибиотики (состояние покоя), или были активированы в присутствии интерлейкина 2 (20 единиц/мл, RocheBiochemicals, Indianapolis, IN) и фитогемагглютинина РНА-Р (1 мкг/мл, Sigma) в течение 3-4 суток до начала экспериментов. Трансформированные Т-клетки человека CCRF-CEM были предоставлены The American TypeCulture Collection (Manassas, VA), их кльтурировали в RPMI-1640 среде с добавлением 10% ЭБС и антибиотиков. В определенные моменты времени отбирали аликвоту клеток (2-3106 клетки), пересчитывали,гранулировали центрифугированием, повторно суспендировали в 0,5 мл среде первоначальной обработки и наносили слоями на 0,5 мл масла Nyosil M25. Образцы центрифугировали в микроцентрифуге в течение 20 с при максимальной скорости (приблизительно 800g). Верхний слой среды удаляли и масляный слой дважды промывали 0,8 мл солевого раствора, содержащего фосфатный буфер. Промывной буфер и масляный слой осторожно удаляли, клеточные гранулы повторно суспендировали в 0,5 мл 70% метанола и инкубировали в течение ночи при -70C для ускорения лизиса клеток. Клеточные лизаты центрифугировали, жидкости над осадком собирали, сушили в вакууме и повторно суспендировали в 10 мкл ацетата тетрабутиламмония, содержащего в качестве внутреннего стандарта дифосфат [5-(6-аминопурин-9-ил)-2,5-дигидро-фуран-2-илоксиметил]-фосфоновой кислоты (нефторированный аналог активного метаболита). Для оценки количества внутриклеточных нуклеотидов применяли жидкостную хроматографию высокого разрешения с образованием неустойчивых ионных пар в сочетании с положительной тандемной масс-спектрометрией с ионизацией электрораспылением (ЖХ/МС/МС). Метод представлял собой адаптацию методов, описанных для ациклического фосфонатного нуклеотидного аналога адефовира, его фосфорилированных метаболитов и природных нуклеотидов (Vela, J.E. et al. Simultaneous quantitation ofLC/MC/MC. Journal of Chromatography В Anal. Technol. Biomed. Life Sci., vol. 848, 2007, p. 335-343). Стандартные кривые и образцы контроля качества были получены для всех аналитов из экстрактов необработанных клеток. Стандартные кривые были построены по семи точкам в общем диапазоне концентраций от 0,03 до 20 пмоль/млн клеток и были линейными в избытке r2, равном 0,99, для всех аналитов. Нижние границы количественной оценки составляли от 0,05 до 0,1 пмоль/млн клеток для всех аналитов. Для обеспечения точности в пределах 20% вместе с каждым аналитом в начале и в конце каждого исследования исследовали контрольные образцы с низкой и высокой концентрацией (обычно 0,2 и 10 пмоль/млн клеток соответственно). Для обеспечения точного анализа гораздо более низкого внутриклеточного накопления метаболитов, наблюдаемого после инкубации лимфоцитов с исходным соединением, исходное соединение инкубировали при концентрации, в 100 раз превышающей (100 мкм) концентрацию пролекарства (1 мкМ). Как указано в табл. 5, уровни активного метаболита, создаваемые пролекарством, в 76, 290 и 140 раз превышали уровни, создаваемые исходным соединением, после инкубации с CEM-CCRF, для ОКПК в состоянии покоя и активированных ОКПК соответственно. Уровни активного метаболита нормировали на основании внеклеточной концентрации после инкубации с 1 мкМ пролекарства или с 100 мкМ исходного соединения. Таблица 5 Пример 9. Сравнение анти-ВИЧ активности пролекарства и исходного соединения. Термины "пролекарство" и "исходное соединение" имеют значения, указанные в примере 8. Клетки МТ-2 выдерживали в среде RPMI-1640 с добавлением антибиотиков и 10% эмбриональной бычьей сыворотки (ЭБС). Клетки МТ-2 были инфицированы ВИЧ-1 IIIB при мультипликации инфекции(multiplicity of infection (moi, составляющей 0,01, и помещали на 96-лучночные планшеты, используя серийные разбавления испытуемых соединений, при плотности, составляющей 20000 клетки/лунку. После инкубации в течение 5 суток, наличие индуцируемого вирусом цитопатического эффекта определяли при помощи анализа жизнеспособности клеток CellTiter-GloTM (Promega, Madison, WI) и выражали в виде процентной доли сигнала, получаемого от образцов с полностью подавленной репликацией вируса после вычитания сигнала, получаемого от необработанных контрольных образов. Концентрацию каждого лекарственного средства, ингибирующего индуцируемый вирусом цитопатический эффект на 50%(ЕС 50), определяли методом нелинейной регрессии. Параллельно с контролем вируса дикого типа определяли активность по отношению к NRTI-резистивным мутантам и вычисляли, во сколько раз изменяется EC50. Одноядерные клетки периферической крови человека (ОКПК) были выделены из лейкоцитарных пленок доноров центрифугированием в Ficoll Paque Plus; их активировали в течение 4-5 суток в средеRPMI-1640 с добавлением 20% ЭБС, антибиотиков, интерлейкина-2 (20 единиц/мл) и фитогемагглютинина РНА-Р(1 /мл). Активированные ОКПК инфицировали ВИЧ-1 BaL в течение 3 ч, промывали, высевали в 96-луночные планшеты (250000 клеток/лунка) и инкубировали, используя серийные разбавления испытуемых соединений, в течение 5 суток, после чего собирали клеточные жидкости над осадками и определяли выработку вируса при помощи коммерческого анализа ВИЧ-1 p24 ELISA (Beckman Coulter,Miami, FL). Концентрацию каждого из лекарственных средств, ингибирующих p24 выработку антигена на 50% (EC50), определяли регрессионным анализом. Действие добавления профрагментов на анти-ВИЧ активность оценивали в МТ-2 и стимулированных ОКПК, инфицированных ВИЧ-1. Как указано в табл. 6, пролекарство оказывало в 71 и 2300 раз более мощное действие, чем исходное соединение в МТ-2 и активированных ОКПК соответственно. В табл. 6 приведена анти-ВИЧ-1 активность пролекарства и исходного соединения в клеточной линии, полученной из лимфоидной ткани, и первичных лимфоидных клетках. Пример 10. Биодоступность при пероральном введении цитрата этил-N-[(S)-([(2R,5R)-5-(6-амино 9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината после введения в таблетированной форме собакам породы бигль. Группа подопытных животных состояла из 3 ранее подвергавшихся воздействию самцов собак породы бигль. Животным не давали пищи в течение ночи до введения доз и до 4 ч после дозирования. Собакам давали одну таблетку, содержащую 41,38 мг цитрата пролекарства (обеспечивающую 30 мг пролекарства в таблетке). Таблетка состояла из 13,79% соли лимонной кислоты пролекарства, 66% безводной лактозы, 15,21% микрокристаллической целлюлозы, 3,5% натрий-кроскармеллозы и 1,5% стеарата магния (мас.%). Образцы плазмы получали перед введением доз (0 ч) и спустя 0,083, 0,25, 0,50, 1,0, 2,0, 4,0,8,0, 12, 24 ч. Образцы крови собирали в Vacutainer пробирки, содержащие ЭДТА-K3. Образцы крови центрифугировали при 4C для отделения плазмы. Аликвоту, составляющую 1 мкл от каждого образца плазмы, сначала разбавляли 300 мкл смеси 80% ацетонитрил/вода, содержащей 200 нМ внутреннего стандарта. После центрифугирования и осаждения белка, отбирали 100 мкл жидкости над осадком и анализировали ее. Стандартные кривые и образцы контроля качества были получены в плазме крови собак,которым не вводили пролекарство. Образцы анализировали частичной жидкостной хроматографией в сочетании с тройной квадрупольной масс-спектрометрией. Введение циатрата пролекарства в виде таблеток приводит к быстрому всасыванию пролекарства и исходного соединения, получающегося из пролекарства. Как видно из тбл. 7, после введения пролекарства и исходного соединения в плазме наблюдается повышение концентрации пролекарства и исходного соединения. Биодоступность неизмененного пролекарства при пероральном введении составила 11,4%. Эти результаты не сильно отличаются от результатов, наблюдаемых после перорального введения пролекарства в виде раствора, что указывает на эффективность применения таблеток, содержащих цитрат пролекарства, для доставки пролекарства и его метаболитов в системный кровоток. В табл. 7 приведены средние фармакокинетические параметры пролекарства и исходного соединения в плазме крови после перорального введения пролекарства в виде таблетки, содержащей цитрат пролекарства в средней дозе, составляющей 3,05 мг/кг эквивалентов (среднее, n=3). Таблица 7 Пример 11. Дифференциальная сканирующая калориметрия (ДСК) солей лимонной, малоновой и янтарной кислот этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината. Дифференциальная сканирующая калориметрия представляет собой способ точного измерения температуры и потоков тепла, связанных с термическими переходами в материале. Отклики ДСК солей этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината согласно изобретению были получены с использованием ТА (New Castle, DE) ДСК 2010 при скорости сканирования, составляющей 5Cмин-1. На фиг. 1 показан характеристический отклик ДСК соли малоновой кислоты этил-N-[(S)-([(2R,5R)5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-Lаланината. В термограмме ДСК имеется единичная эндотерма, соответствующая температуре плавления(120,43C, Hf=73,72 Дж/г), за которой следует единичная экзотерма, соответствующая разложению соли малоновой кислоты. На фиг. 2 показан характеристический отклик ДСК соли янтарной кислоты этил-N-[(S)-([(2R,5R)5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-Lаланината. В термограмме ДСК соли янтарной кислоты GS-9131 имеется единичная эмдотерма, соответствующая температуре плавления (137,44C, Hf=66,18 Дж/г), за которой следует единичная экзотерма соответствующая разложению соли. На фиг. 3 показан характеристический отклик ДСК соли лимонной кислоты этил-N-[(RS)([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]L-аланината. В термограмме ДСК соли лимонной кислоты имеется единичная эндотерма, соответствующая температуре плавления (149,41C, Hf=85,72 Дж/г), за которой следует единичная экзотерма, соответствующая разложению соли лимонной кислоты. Соль лимонной кислоты имеет гораздо более высокую теплоту плавления по сравнению с солями малоновой и янтарной кислот, что указывает на более высокую степень кристалличности в твердом состоянии. Пример 12. Рентгенодифракционный анализ (РДА) солей лимонной, малоновой и янтарной кислот этил-N-[(S)-([(2R,5R)-5-(6-амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2 ил]оксиметил)феноксифосфиноил]-L-аланината. Рентгенограммы рентгеновской дифракции порошков (ПРД) солей этил-N-[(S)-([(2R,5R)-5-(6 амино-9H-пурин-9-ил)-4-фтор-2,5-дигидрофуран-2-ил]оксиметил)феноксифосфиноил]-L-аланината согласно настоящему изобретению были получены двумя способами. В соответствии с первым способом использовали прибор Shimadzu РДА 6000 со следующими параметрами: рентгеновская трубка Cu,2,2 кВт, NF (нормальный фокус); монохроматор из скрученного графита; вертикальный гониометр, радиус 185 мм; щели расходимости: 0,5, 1,0, 0,05 мм; щели Соллера: 0,05, 1, 2; приемные щели: 0,15 мм, 0,3 мм; сцинцилляционный детектор (NaI) HV 500-1200. В соответствии со вторым способом использовали прибор Shimadzu РДА 6000 со следующими параметрами: рентгеновская трубка Cu, 35 кВ, ток 40 мА; непрерывное сканирование, монохроматор, щель расходимости, 1; щель Соллера 1, приемная щель 0,3 мм. Данные ПРД для солей малоновой и янтарной кислот были получены способом 1. Данные ПРД для соли лимонной кислоты были получены способом 2. Понятно, что экспериментальные отклонения могут несколько изменять форму полос поглощения(пиков) ПРД. Таким образом, значения, приведенные здесь для ПРД рентгенограмм солей согласно настоящему изобретению, будут совпадать или по существу совпадать со значениями, полученными при повторных экспериментах. В данном контексте "по существу совпадать" означает, что учитываются отклонения характерных положений и интенсивностей пиков (что является обычным для любой аналитической методики). Например, специалист в данной области техники должен понимать, что положение пиков отражает внутренние изменения параметров измерительного устройства. Например, положение 2 тэта пика обычно изменяется в пределах 0,1. Кроме того, специалист в данной области техники должен понимать, что относительные интенсивности пиков также могут колебаться в зависимости от степени кристалличности, предпочтительной ориентации, подготовки поверхности образца и других факторов,известных в данной области техники. Таким образом, относительные интенсивности пиков должны рассматриваться только как качественные характеристики. На фиг. 4 показана характеристическая рентгенограмма ПРД соли малоновой кислоты. Главные и характеристические пики, определяющие эту кристаллическую форму соли малоновой кислоты, представлены в табл. 8 А и 8 В. Таблица 8 А ПРД соли малоновой кислоты На фиг. 5 показана характеристическая рентгенограмма ПРД соли янтарной кислоты. Главные и характеристические пики, определяющие эту кристаллическую форму соли янтарной кислоты, представлены в табл. 9 А и 9 В. Таблица 9 А ПРД пики соли янтарной кислоты На фиг. 6 показана характеристическая рентгенограмма ПРД соли лимонной кислоты. Главные и характеристические пики, определяющие эту кристаллическую форму соли лимонной кислоты, представлены в табл. 10 А и 10 В. Таблица 10 А ПРД пики соли лимонной кислоты Вся цитируемая литература и патентные публикации включены в настоящее описание посредством ссылки в тех местах описания, где они цитируются. Там, где указаны конкретные параграфы и страницы,именно эти конкретные параграфы и страницы цитируемых выше работ включены в настоящее описание посредством ссылки. Несмотря на то что представленное описание изобретения достаточно для осуществления настоящего изобретения специалистом в данной области техники, также существует возможность внесения в настоящее изобретение некоторых модификаций, не выходящих за пределы объема формула изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соль лимонной кислоты формулы (I) или ее гидрат 2. Соль или гидрат по п.1, отличающиеся тем, что соль представляет собой кристаллическое вещество. 3. Соль по п.2, отличающаяся тем, что полосы поглощения, наблюдаемые на порошковой рентгенограмме, характеризуются межплоскостными расстояниями, совпадающими или по существу совпадающими с расстояниями, равными 4,48, 3,12 и 6,05 ангстрем. 4. Соль по п.2, отличающаяся тем, полосы поглощения, соответствующие углам дифракции 2-тэта на порошковой рентгенограмме, совпадают или по существу совпадают с углами, равными 19,81, 28,63 и 14,64. 5. Гидрат соли лимонной кислоты по п.2, отличающийся тем, что он является частично или полностью гидратированным. 6. Соль по п.2, отличающаяся тем, что она представляет собой безводную или по существу безводную соль. 7. Фармацевтическая композиция для лечения или предотвращения СПИД, содержащая терапевтически эффективное количество соли или гидрата по любому из пп.1-6 и фармацевтически приемлемый носитель или наполнитель. 8. Фармацевтическая композиция по п.7, отличающаяся тем, что содержит дополнительное терапевтическое средство. 9. Фармацевтическая композиция по п.8, отличающаяся тем, что дополнительное терапевтическое средство представляет собой лекарственное средство против ВИЧ. 10. Единичная лекарственная форма, содержащая фармацевтическую композицию по любому из пп.7-9. 11. Единичная лекарственная форма по п.10, отличающаяся тем, что указанная единичная лекарственная форма представляет собой таблетку. 12. Фармацевтическая композиция, изготовляемая смешиванием терапевтически эффективного количества соли или гидрата по любому из пп.1-6 с фармацевтически приемлемым носителем или наполнителем. 13. Применение соли или гидрата по любому из пп.1-6 для лечения или профилактического предотвращения ВИЧ-инфекции. 14. Применение соли или гидрата по любому из пп.1-6 для получения лекарственного средства для лечения или профилактического предотвращения ВИЧ-инфекции. 15. Применение по любому из пп.13, 14, отличающееся тем, что соль или гидрат находятся в составе фармацевтической композиции или лекарственной формы по любому из пп.7-12. 16. Соль янтарной кислоты формулы (II) или ее гидрат 17. Соль или гидрат по п.16, отличающиеся тем, что соль представляет собой кристаллическое вещество. 18. Соль по п.17, отличающаяся тем, что полосы поглощения, наблюдаемые на порошковой рентгенограмме, характеризуются межплоскостными расстояниями, совпадающими или по существу совпа- 23018308 дающими с расстояниями, равными 3,57, 4,80 и 4,99 ангстрем. 19. Соль по п.17, отличающаяся тем, что полосы поглощения, соответствующие углам дифракции 2-тэта на порошковой рентгенограмме, совпадают или по существу совпадают с углами, равными 24,91,18,46 и 17,76. 20. Фармацевтическая композиция для лечения или предотвращения СПИД, включающая терапевтически эффективное количество соли или гидрата по любому из пп.16-19 и фармацевтически приемлемый носитель или наполнитель. 21. Фармацевтическая композиция по п.20, отличающаяся тем, что содержит дополнительное терапевтическое средство. 22. Фармацевтическая композиция, изготовляемая смешиванием терапевтически эффективного количества соли или гидрата по любому из пп.16-19 с фармацевтически приемлемым носителем или наполнителем. 23. Применение соли или гидрата по любому из пп.16-19 для лечения или профилактического предотвращения ВИЧ-инфекции. 24. Соль малоновой кислоты формулы (III) или ее гидрат 25. Соль или гидрат по п.24, отличающиеся тем, что соль представляет собой кристаллическое вещество. 26. Соль по п.25, отличающаяся тем, что полосы поглощения, наблюдаемые на порошковой рентгенограмме, характеризуются межплоскостными расстояниями, совпадающими или по существу совпадающими с расстояниями, равными 4,99, 5,93 и 4,72 ангстрем. 27. Соль по п.25, отличающаяся тем, что полосы поглощения, соответствующие углам дифракции 2-тэта на порошковой рентгенограмме, совпадают или по существу совпадают с углами, равными 17,76,14,92 и 18,80. 28. Фармацевтическая композиция для лечения или предотвращения СПИД, содержащая терапевтически эффективное количество соли или гидрата по любому из пп.24-27 и фармацевтически приемлемый носитель или наполнитель. 29. Фармацевтическая композиция по п.28, отличающаяся тем, что содержит дополнительное терапевтическое средство. 30. Фармацевтическая композиция, изготовляемая смешиванием терапевтически эффективного количества соли или гидрата по любому из пп.24-27 с фармацевтически приемлемым носителем или наполнителем. 31. Применение соли или гидрата по любому из пп.24-27 для лечения или профилактического предотвращения ВИЧ-инфекции.
МПК / Метки
МПК: C07H 19/20, A61P 31/18, A61K 31/7076
Метки: ингибиторов, вич, соли, соединений
Код ссылки
<a href="https://eas.patents.su/27-18308-soli-soedinenijj-ingibitorov-vich.html" rel="bookmark" title="База патентов Евразийского Союза">Соли соединений ингибиторов вич</a>
Предыдущий патент: Композиция формовочной смеси, содержащая диэфир карбоновой кислоты с разветвленным алкандиолом, и способ изготовления литейных форм
Следующий патент: Способ и система для всестороннего анализа низкочастотных колебаний
Случайный патент: Система и способ поиска, управления, доставки и представления знаний