Радиофармацевтические агенты для диагностики болезни альцгеймера
Номер патента: 6199
Опубликовано: 27.10.2005
Авторы: Динтер Харалд, Халкс-Миллер Мередит, Йоханнсен Бернд, Мэдинг Петер, Махан Раджу, Штайнбах Йёрг, Хильгер Кристоф-Штефан, Хорук Ричард, Хессельгессер Джозеф И.
Формула / Реферат
1. Соединение формулы (I)
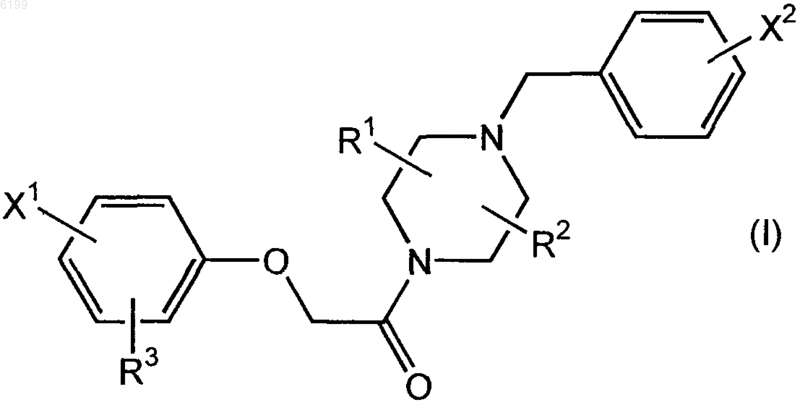
где X1 и X2, каждый независимо друг от друга, обозначает галоген;
R1 и R2, каждый независимо друг от друга, обозначает водород или алкил; и
R3 обозначает водород, амино, моноалкиламино, диалкиламино, моноаралкиламино, алкилкарбониламино, алкенилкарбониламино, галоалкилкарбониламино, арилкарбониламино, алкоксиалкилкарбониламино, алкоксикарбонилалкилкарбониламино, глицинамидо, моноалкилглицинамидо, арилкарбонилглицинамидо, аминокарбонилглицинамидо, (аминокарбонил)(алкил)глицинамидо, (алкоксиалкилкарбонил)глицинамидо, уреидо, моноалкилуреидо, моноарилуреидо, моноаралкилуреидо или аланинамидо; причем алкил или алкильный фрагмент, если не указано иное, обозначают одновалентный или двухвалентный радикал с прямой или разветвленной цепью, имеющий 1-8 атомов углерода; алкенильный фрагмент обозначает одновалентный или двухвалентный радикал с прямой или разветвленной цепью, содержащий по меньшей мере одну двойную связь и имеющий 2-8 атомов углерода; и арильный фрагмент обозначает фенил или нафтил;
и где любой из X1 и X2 выбирают из ряда, включающего 123I, 125I, 128I, 131I, 75Br, 76Br, 80Br и 18F; или где один из атомов углерода в соединении обозначает 11C;
или его фармацевтически приемлемая соль.
2. Соединение формулы (II)
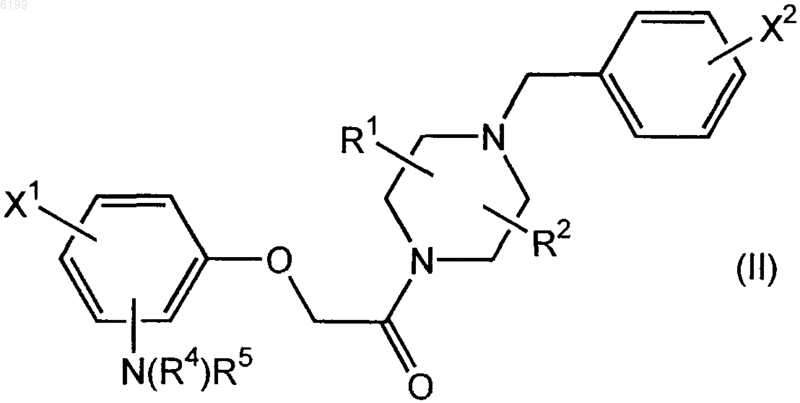
где X1 и X2, каждый независимо друг от друга, обозначает галоген;
R1 и R2, каждый независимо друг от друга, обозначает водород или алкил, где алкил обозначает одновалентный или двухвалентный радикал с прямой или разветвленной цепью, имеющий 1-8 атомов углерода; и
R4 обозначает водород; и
R5 представляет собой хелатор, обладающий способностью связываться с радиоактивным атомом металла, выбранным из ряда, включающего 99mTc, 186Re и 188Re; или его комплексы с 99mTc, 186Re и 188Re;
или его фармацевтически приемлемая соль.
3. Соединение формулы (I)

где X1, X2, R1, R2 и R3 имеют значения, указанные в п.1,
или соединение формулы (II)
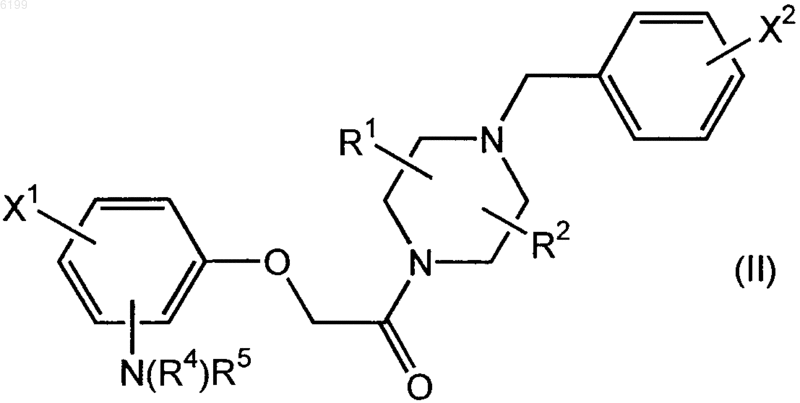
где X1, X2, R1, R2, R4 и R5 имеют значения, указанные в п.2, обладающие способностью связываться с хемокиновым рецептором CCR1 и проникать через гематоэнцефалический барьер.
4. Соединение по п.1 или 2, где R1 обозначает метил в положении 2 пиперазинильного радикала, а R2 обозначает метил в положении 5 пиперазинильного радикала.
5. Соединение по п.1 или 2, где R1 обозначает метил в положении 2 пиперазинильного радикала, а R2 обозначает водород.
6. Соединение по п.1 или 2, где X1 обозначает хлор в положении 4 фенильного радикала, а X2 обозначает атом 18F в положении 4 фенильного радикала.
7. Соединение по п.2, где R5 обозначает хелатор формулы (III)
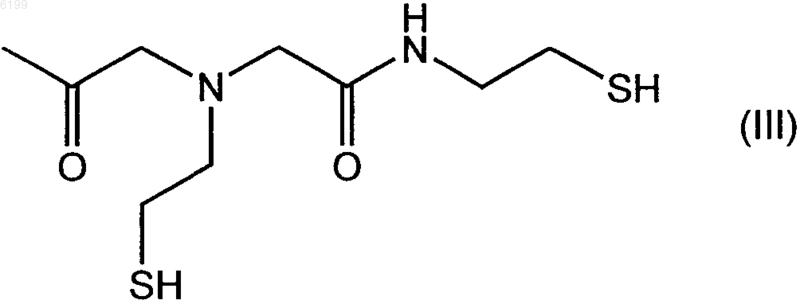
8. Соединение по п.2, где R5 обозначает хелатор формулы (IV)
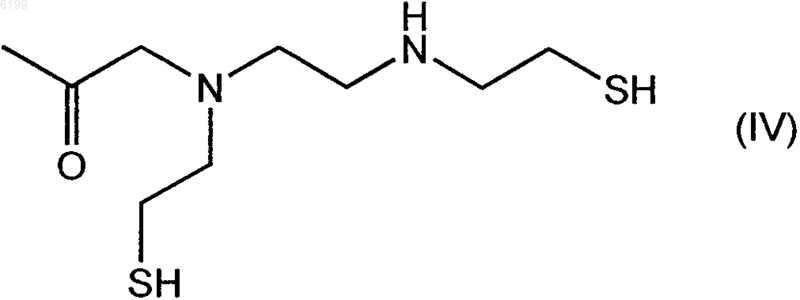
9. Соединение по п.7 или 8, где R5 дополнительно содержит линкерный фрагмент, который включает алкильный радикал, имеющий от одного до десяти атомов углерода, где алкильный радикал необязательно содержит от одной до десяти -C(O)-групп, от одной до десяти -C(O)N(R)-групп, от одной до десяти -N(R)C(O)-групп, от одной до десяти -N(R)-групп, от одной до десяти -N(R)2-групп, от одной до десяти гидроксигрупп, от одной до десяти -C(O)OR-групп, от одного до десяти атомов кислорода, от одного до десяти атомов серы, от одного до десяти атомов азота, от одного до десяти атомов галогена и от одной до десяти арильных групп, представляющих собой фенил или нафтил, в которых R обозначает водород или алкил, охарактеризованный в п.2.
10. Соединение по п.9, где линкерный фрагмент представляет собой -C(O)-CH2-N(H)-.
11. Монохлорид соединения по пп.1-10.
12. Дихлорид соединения по пп.1-10.
13. Способ диагностики болезни Альцгеймера у человека, заключающийся в том, что человеку, который нуждается в такой диагностике, вводят описанное выше соединение по любому из пп.1-12 и определяют радиоактивность, появившуюся после введения человеку соединения либо с помощью рентгеновской камеры, либо с помощью эмиссионной позитронной томографии (ПЭТ).
14. Применение соединения по пп.1-12 для приготовления радиофармацевтического агента для диагностики болезни Альцгеймера у человека.
15. Способ получения соединения формулы (I) по п.1, заключающийся в том, что соединение формулы (е)

где R1, R2, R3 и X1 имеют значения, указанные в п.1,
подвергают взаимодействию с соединением формулы (б)
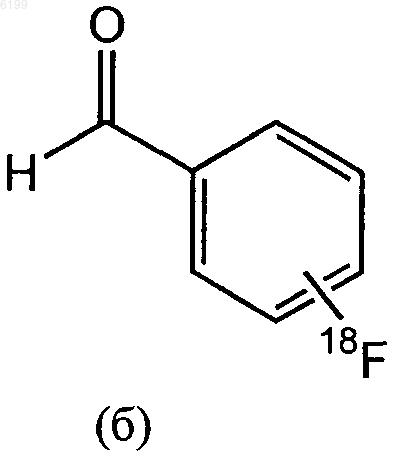
в присутствии восстановителя.
Текст
006199 Область техники, к которой относится изобретение Настоящее изобретение относится к новым радиофармацевтическим агентам, которые можно применять для диагностики болезни Альцгеймера. Краткое описание предпосылок создания изобретения Болезнь Альцгеймера представляет собой серьезное нейродегенеративное заболевание, и в настоящее время этим заболеванием страдают примерно 4 миллиона американцев. Поскольку средний возраст человека продолжает увеличиваться, то количество пациентов, страдающих болезнью Альцгеймера, может к середине следующего века достичь 14 миллионов, если не будут найдены пути лечения и профилактики этого заболевания. В настоящее время отсутствует чувствительный и специфический прижизненный тест (тест, который можно проводить при жизни пациента) для ранней диагностики этого заболевания. Болезнь Альцгеймера в настоящее время диагностируют на основе клинической картины снижения познавательных способностей, осуществляя при этом систематическое исключение других возможных причин, обусловливающих такие же симптомы. Подтвердить клинический диагноз вероятность наличия болезни Альцгеймера можно только путем оценки головного мозга после смерти пациента. Головной мозг пациентов, страдающих болезнью Альцгеймера, характеризуется наличием двух различных аномальных отложений, напоминающих белок материалов в областях головного мозга, ответственных за обучение и память (например, кора головного мозга и гиппокамп). Эти отложения представляют собой внеклеточные амилоидные бляшки, характерные для болезни Альцгеймера, и внеклеточные нейрофибриллярные сплетения (НФС), которые характерны также для других нейродегенеративных заболеваний. Амилоидные пептиды, как правило, состоят либо из 40, либо из 42 аминокислот (А 1-40 и А 1-42 соответственно), и они образуются в результате аномального процессинга более крупного связанного с мембраной протеина неизвестной функции, так называемого амилоидного протеина-предшественника(АПП). Олигомерные аггрегаты этих пептидов, вероятно, обладают нейротоксичностью, что, в конце концов, приводит к дегенерации синапса и разрушению нейрона. Количество амилоидных отложений примерно коррелирует с серьезностью симптомов к моменту смерти. В последние годы было сделано несколько попыток создать радиофармацевтические агенты, которые можно было бы использовать в качестве диагностических агентов для прижизненной диагностики болезни Альцгеймера.Bornebroek с соавторами установили с использованием радиоактивного мечения с помощью 123I, что в коре головного мозга, вероятно, в стенках сосудов, пациентов, страдающих церебральным амилоидозом,накапливаются небольшие концентрации присутствующего в сыворотке компонента связанного с амилоидом протеина, амилоида Р (SAP) (Bornebroek и др., Nucl. Med. Commun., том 17, сс. 929-933 (1996.Saito с соавторами предложили метод опосредуемого вектором переноса А 1-40, меченного с помощью 125I, через гематоэнцефалический барьер. Было установлено, что йодированный А 1-40 связывается с Аамилоидной бляшкой в срезах ткани (Saito и др., Рrос. Natl. Acad. Sci. USA, том 92, cc. 10227-10231 (1995. В патенте US 5231000 описаны антитела, специфические в отношении амилоидного полипептида А 4, обнаруженного в головном мозге пациентов, страдающих болезнью Альцгеймера. Однако метод переноса этих антител через гематоэнцефалический барьер не описан.Zhen с соавторами описали модификации связывающегося с амилоидом красителя, известного под названием Congo Red, и комплексы таких модифицированных молекул с технецием и рением. Комплексы с радиоактивными ионами могут представлять собой потенциальные агенты для визуализации болезни Альцгеймера (Zhen и др., J. Med. Chem., том 42, cc. 2805-2815 (1999. Однако способность этих комплексов проникать через гематоэнцефалический барьер является ограниченной. Группа ученых из университета Пенсильвании в США (Skovronsky M. и др., Рrос. Natl. Acad. Sci.,том 97, cc. 7609-7614 (2000 разработала флуоресцентно меченное производное красителя Congo Red,которое обладает способностью проникать в головной мозг и неспецифично связываться с амилоидными материалами (т.е. пептидами, имеющими -складчатую конформацию). В это соединение необходимо вводить радиоактивную метку и затем перед клинической оценкой проводить доклинические исследования фармакокинетических свойств и токсичности.Klunk с соавторами опубликовали результаты экспериментов с использованием производного CongoRed, хрисамина G (XG). Установлено, что XG хорошо связывается с синтетическим -амилоидом in vitro и проникает через гематоэнцефалический барьер здоровых мышей (Klunk и др., Neurobiol. Aging, т. 15,cc. 691-698 (1994.Bergstrom с соавторами описали соединение, меченное с помощью 123I, в качестве потенциального радиолиганда для визуализации мускариновых ацетилхолиновых рецепторов типа M1 и M2 у страдающих болезнью Альцгеймера пациентов (Bergstrom и др., Eur. J. Nucl. Med., т. 26, cc. 1482-1485 (1999. В настоящее время установлено, что в организме пациентов, страдающих болезнью Альцгеймера,происходит позитивная регуляция определенных специфических рецепторов хемокинов (Horuk R. и др.,J. Immunol., т. 158, cc. 2882-2890 (1997; Xia и др., J. NeuroVirol., т. 5, cc. 32-41 (1999. Кроме того, в настоящее время установлено, что в головном мозге пациентов с прогрессирующей болезнью Альцгеймера происходит позитивная регуляция хемокинового рецептора CCR1, которая отсутствует в головном-1 006199 мозге здоровых пожилых людей (Halks-Miller CCR1 Immunoreactivity in Alzheimer's Disease Brains, Societyfor Neuroscience Meeting Abstract,787.6 том 24 (1998. Антагонисты рецептора CCR1 и их применение в качестве противовоспалительных агентов описаны в опубликованной заявке РСТ WO 98/56771. Ни одно из описанных выше исследований не завершилось разработкой пригодного для клинического применения визуализирующего агента, предназначенного для ранней диагностики болезни Альцгеймера. Таким образом, все еще существует клиническая необходимость в диагностическом агенте, который можно использовать для надежной и ранней диагностики болезни Альцгеймера. Краткое изложение сущности изобретения Настоящее изобретение относится к радиофармацевтическим агентам, которые связываются с рецептором CCR1 и обладают способностью проникать через гематоэнцефалический барьер, и вследствие этого их можно применять для диагностики болезни Альцгеймера, предпочтительно на ранней стадии болезни. Таким образом, одним из объектов изобретения являются соединения формулы (I) где X1 и Х 2, каждый независимо друг от друга, обозначает галоген;R1 и R2, каждый независимо друг от друга, обозначает водород или алкил; иR3 обозначает водород, амино, моноалкиламино, диалкиламино, моноаралкиламино, алкилкарбониламино, алкенилкарбониламино, галоалкилкарбониламино, арилкарбониламино, алкоксиалкилкарбониламино, алкоксикарбонилалкилкарбониламино, глицинамидо, моноалкилглицинамидо, арилкарбонилглицинамидо, аминокарбонилглицинамидо, (аминокарбонил)(алкил)глицинамидо, (алкоксиалкилкарбонил)глицинамидо, уреидо, моноалкилуреидо, моноарилуреидо, моноаралкилуреидо или аланинамидо; и где любой из Х 1 и Х 2 выбирают из ряда, включающего 123I, 125I, 128I, 131I, 75 Вr, 76 Вr, 80 Вr и 18F; или где один из атомов углерода в соединении обозначает 11 С; или их фармацевтически приемлемые соли. Следующим объектом изобретения являются соединения формулы (II) где Х 1 и Х 2, каждый независимо друг от друга, обозначает галоген;R1 и R2, каждый независимо друг от друга, обозначает водород или алкил; иR5 представляет собой хелатор, обладающий способностью связываться с радиоактивным атомом металла, выбранного из ряда, включающего 99mТc, 186Re и 188Re; или образует комплекс с 99mТc, 186Re и 188Re; или их фармацевтически приемлемые соли. Еще одним объектом изобретения является способ диагностики болезни Альцгеймера у человека,заключающийся в том, что человеку, который нуждается в такой диагностике, вводят описанное выше соединение формулы (I) или формулы (II) и определяют радиоактивность, появившуюся после введения человеку соединения, либо с помощью рентгеновской камеры, либо с помощью позитронной эмиссионной томографии (ПЭТ). Следующим объектом изобретения является способ применения соединения по изобретению для приготовления радиофармацевтического агента для диагностики болезни Альцгеймера у человека. И еще одним объектом изобретения является способ получения соединений по изобретению. Краткое описание чертежей На чертежах показано на фиг. 1 - экспрессия CCR1 в ткани головного мозга пациента, страдающего болезнью Альцгеймера; на фиг. 2 - специфичность антитела к CCR1 в ткани головного мозга пациента, страдающего болезнью Альцгеймера; на фиг. 3 - срезы ткани, несущие двойную метку CCR1- А 1-40; на фиг. 4 - невритические бляшки, несущие двойную метку CCR1 и А 1-40; на фиг. 5 - диффузное окрашивание А 1-42 в головном мозге пациента, страдающего болезнью Альцгеймера;-2 006199 на фиг. 6 - графическое изображение зависимости между CCR1 и А 1-40, оцененное с помощью КОД-балла (клиническая оценка деменции); на фиг. 7 - графическое изображение зависимости между CCR1 и А 1-42, оцененное с помощью КОД-балла (клиническая оценка деменции); на фиг. 8 - график, демонстрирующий снижение общей радиоактивности в головном мозге с течением времени; на фиг. 9 - графическое изображение процента инъецируемой дозы в головном мозге и плазме; на фиг. 10 - графическое изображение уровней экспрессии CCR1 при других нейродегенеративных заболеваниях. Подробное описание изобретения Определения В контексте настоящего описания и в прилагаемой формуле изобретения, если не указано иное, понятия имеют следующие значения. Алкил обозначает одновалентный или двухвалентный радикал с прямой или разветвленной цепью, состоящий только из атомов углерода и водорода, не содержащий ненасыщенных связей и имеющий 1-8 атомов углерода, например метил, этил, н-пропил, 1-метилэтил (изопропил), н-бутил, н-пентил,1,1-диметилэтил (трет-бутил), н-гептил и т.п. Алкилкарбониламино обозначает радикал формулы -N-(H)-C(O)-Ra, где Ra обозначает алкильный радикал, как он определен выше, например ацетиламино, этилкарбониламино, н-пропилкарбониламино и т.п. Алкенил обозначает одновалентный или двухвалентный радикал с прямой или разветвленной цепью, состоящий только из атомов углерода и водорода, содержащий по меньшей мере одну двойную связь и имеющий 2-8 атомов углерода, например этенил, проп-1-енил, бут-1-енил, пент-1-енил, пента 1,4-диенил и т.п. Алкенилкарбониламино обозначает радикал формулы -N-(H)-C(O)-Rc, где Rc обозначает алкенильный радикал, как он определен выше, например этенилкарбониламино, проп-2-енилкарбониламино,бут-2-енилкарбониламино и т.п. Алкокси обозначает радикал формулы -ORa, где Ra обозначает алкильный радикал, как он определен выше, например метокси, этокси, н-пропокси, 1-метилэтокси(изопропокси), н-бутокси, н-пентокси,1,1-диметилэтокси (трет-бутокси) и т.п. Алкоксикарбонилалкилкарбониламино обозначает радикал формулы -N(H)-C(O)-Ra-C(O)ORa, гдеRa, каждый независимо друг от друга обозначает алкильный радикал, как он определен выше, например этоксикарбонилметилкарбониламино, метоксикарбонилметилкарбониламино, (2-этоксикарбонилэтил) карбониламино, (2-метоксикарбонилэтил)карбониламино и т.п.(Алкоксиалкилкарбонил)глицинамидо обозначает радикал формулы -N(H)-C(O)-CH2-N(H)-C(O)-Ra-O-Ra,где Ra, каждый независимо друг от друга обозначает алкильный радикал, как он определен выше, например (метоксиацетил)глицинамидо, (этоксиацетил)глицинамидо и т.п. Амино обозначает радикал -NH2. Аминокарбонилглицинамидо обозначает радикал формулы -N(H)-C(O)-CH2-N(H)-C(O)-NH2.(Аминокарбонил)(алкил)глицинамидо обозначает радикал формулы -N(H)-C(O)-CH2-N(Ra)-C(O)-NH2,где Ra обозначает алкильный радикал, как он определен выше. Арил обозначает фенильный или нафтильный радикал. Если специально не указано иное, то понятие арил или приставка ар- (как, например, в аралкиле) относится к включению арильных радикалов, необязательно замещенных одним или несколькими заместителями, выбранными из ряда, включающего галоген, алкил, алкокси, галоалкил, галоалкокси, нитро, амино, моноалкиламино и диалкиламино, как они определены в настоящем описании. Арилкарбониламино обносится к радикалу формулы -N(H)-C(O)-Rb, где Rb обозначает арильный радикал, как он определен выше, например (4-метоксифенил)карбониламино, (4-фторфенил)карбониламино, (4-хлорфенил)карбониламино и т.п. Арилкарбонилглицинамидо обозначает радикал -N(H)-C(O)-CH2-N(H)-C(O)-Rb, где Rb обозначает арильный радикал, как он определен выше, например фенилкарбонилглицинамидо, (4-фтор-3-трифторметилфенил)карбонилглицинамидо, (4-фторфенил)карбонилглицинамидо и т.п. Аралкил обозначает радикал формулы -RaRb, где Ra обозначает алкильный радикал, как он определен выше, и Rb обозначает арильный радикал, как он определен выше, например бензил и т.п. Алкоксиалкилкарбониламино обозначает радикал формулы -N(H)-C(O)-Ra-O-Ra, где Ra, каждый независимо друг от друга, обозначает алкильный радикал, как он определен выше, например метоксиметилкарбониламино, этоксиэтилкарбониламино, метоксиэтилкарбониламино и т.п. Аланинамидо обозначает радикал формулы -N(Н)-С(O)-С(СН 3)Н-NН 2. Бензил обозначает радикал формулы СН 2-Rh, где Rh обозначает фенильный радикал, необязательно замещенный одним или несколькими заместителями, выбранными из ряда, включающего галоген,алкил, алкокси, нитро, амино, моноалкиламино и диалкиламино.-3 006199 Диалкиламино обозначает радикал формулы -N(Ra)Ra, где Ra, каждый независимо друг от друга,обозначает алкильный радикал, как он определен выше, например диметиламино, метилэтиламино, диэтиламино, дипропиламино, этилпропиламино и т.п. Глицинамидо обозначает радикал формулы -N(H)-C(O)-CH2-NH2. Галоген обозначает бром, хлор, йод или фтор. Галоалкил обозначает алкильный радикал, как он определен выше, замещенный одним или несколькими атомами галогена, как он определен выше, например трифторметил, дифторметил, трихлорметил, 2-трифторэтил, 1-фторметил-2-фторэтил, 3-бром-2-фторпропил, 1-бромметил-2-бромэтил и т.п. Галоалкилкарбониламино обозначает радикал формулы -N(H)-C(O)-Rf, где Rf обозначает галоалкильный радикал, как он определен выше, например трифторметилкарбониламино, трифторметилкарбониламино, 2-бромэтилкарбониламино и т.п. Моноалкиламино обозначает радикал формулы -N(H)Ra, где Ra обозначает алкильный радикал,как он определен выше, например метиламино, этиламино, пропиламино и т.п. Моноаралкиламино обозначает радикал формулы -N(H)Rd, где Rd обозначает аралкильный радикал,как он определен выше, например бензиламино, (3,4,5-триметоксибензил)амино, (4-хлорбензил)амино и т.п. Моноалкилглицинамидо обозначает радикал формулы -N(H)-C(O)-CH2-N(H)Ra, где Ra обозначает алкильный радикал, как он определен выше. Моноалкилуреидо обозначает радикал формулы -N(H)-C(O)-N(H)Ra или радикал формулыN(Ra)-CO-NH2, где Ra обозначает алкильный радикал, как он определен выше. Моноарилуреидо обозначает радикал формулы -N(H)-C(O)-N(H)Rb или радикал формулыN(Rb)-CO-NH2, где Rb обозначает арильный радикал, как он определен выше. Моноаралкилуреидо обозначает радикал формулы -N(H)-C(O)-N(H)Rd или радикал формулыN(Rd)-CO-NH2, где Rd обозначает аралкильный радикал, как он определен выше. Необязательный или необязательно обозначает, что последовательно описываемые события могут иметь место или их может не быть и что описание включает случаи, когда событие или обстоятельство имеет место, и случаи, когда его нет. Например, необязательно замещенный арил обозначает,что арил, как он определен выше, может быть или не быть замещен и что описание включает как замещенные арильные радикалы, так и арильные радикалы, не имеющие заместителей. Фармацевтически приемлемая соль включает как кислотно-аддитивные соли, так и соли присоединения оснований. Фармацевтически приемлемая кислотно-аддитивная соль относится к солям, которые сохраняют биологическую эффективность и свойства свободных оснований и не являются нежелательными с биологической или иных точек зрения и которые образуются с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.,органическими кислотами, такими как уксусная кислота, пропионовая кислота, пировиноградная кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, паратолуолсульфоновая кислота, салициловая кислота и т.п. Особенно предпочтительными солями соединений по изобретению являются монохлориды и дихлориды. Фармацевтически приемлемая соль присоединения основания относится к солям, которые сохраняют биологическую эффективность и свойства свободных кислот и не являются нежелательными с биологической или иных точек зрения. Эти соли получают путем добавления к свободной кислоте неорганического основания или органического основания. Соли, полученные из неорганических оснований,включают (но не ограничиваясь ими) соли натрия, калия, лития, аммония, кальция, магния, цинка, алюминия и т.п. Предпочтительными неорганическими солями являются соли аммония, натрия, калия, кальция и магния. Соли, полученные из органических оснований, включают (но не ограничиваясь ими) соли первичных, вторичных и третичных аминов, замещенных аминов, включая встречающиеся в естественных условиях замещенные амины, циклические амины и основные ионообменные смолы, такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, 2-диметиламиноэтанол, 2-диэтиламиноэтанол, триметамин, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминные смолы и т.п. Осoбенно предпочтительными органическими основаниями являются изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин, холин и кофеин. Уреидо обозначает радикал формулы -N(H)-C(O)-NH2. Из приведенных выше определений и примеров должно быть очевидно, что радикалы, содержащие замещенную алкильную группу, могут быть замещены на любом атоме углерода алкильной группы. Соединения по изобретению или их фармацевтически приемлемые соли могут иметь в структуре асимметричные атомы углерода. Поэтому соединения по изобретению и их фармацевтически приемлемые соли могут существовать в виде индивидуальных энантиомеров, диастереоизомеров, рацематов и смесей энантиомеров и диастереоизомеров. Все такие индивидуальные энантиомеры, диастереоизомеры,рацематы и их смеси подпадают под объем изобретения. Абсолютную конфигурацию определенных-4 006199 атомов углерода в соединении, если она является известной, обозначают соответствующим абсолютным дескриптором R или S. Промышленное применение и пути введения Представленные в настоящем описании соединения по изобретению являются антагонистами хемокинового рецептора, известного как CCR1, и они обладают способностью проникать через гематоэнцефалический барьер. Вследствие этого соединения можно применять в качестве диагностических агентовin vivo для визуализации признаков болезни Альцгеймера. Выявление радиоактивности осуществляют с помощью методик, хорошо известных в данной области, либо с помощью рентгеновской камеры, либо с помощью эмиссионной позитронной томографии (ПЭТ). Предпочтительно соединения по изобретению в виде свободного основания или фармацевтически приемлемой соли, например монохлорида или дихлорида, используют в качестве диагностического агента в галеновой форме. Галенова форма, содержащая соединение по изобретению, необязательно может содержать вспомогательные вещества, хорошо известные в данной области, например буферы, хлорид натрия, молочную кислоту, поверхностно-активные вещества. Перед применением можно осуществлять стерилизацию галеновой формы путем фильтрации в стерильных условиях. Предназначенная для однократного введения доза радиоактивности может составлять 1-100 мКи,предпочтительно 5-30 мКи и наиболее предпочтительно 5-20 мКи. Тестирование Возможность применения соединений в качестве визуализирующих агентов для диагностики болезни Альцгеймера можно продемонстрировать с помощью экспериментальных протоколов, известных специалистам в данной области. Например, позитивную регуляцию рецепторов CCR1 в пораженном болезнью Альцгеймера головном мозге можно продемонстрировать с использованием иммуногистохимического окрашивания полученных с помощью биопсии образцов ткани головного мозга, взятых из головного мозга страдающих болезнью Альцгеймера пациентов, эти эксперименты подробно описаны в примерах. Способность соединений по изобретению связываться с рецептором CCR1 и их способность проникать через гематоэнцефалический барьер можно оценивать также с помощью известных анализовin vitro и in vivo, описанных в примерах. В частности, в примере 10 описан масштабный эксперимент,проведенный с целью определения уровня экспрессии CCR1 при различных стадиях болезни Альцгеймера. Для образцов ткани головного мозга, полученных в результате 50 аутопсий, обнаружена корреляция между уровнями серьезности клинической картины (деменция) болезни Альцгеймера и экспрессии CCR1 в дистрофичных нервных клетках. Экспрессия CCR1 в бляшкоподобных структурах в головном мозге клинически здоровых людей является редкой. Кроме того, экспрессия CCR1 не обнаружена в головном мозге пациентов, страдающих другими нейродегенеративными заболеваниями, если у них отсутствовала сопутствующая патология, связанная с болезнью Альцгеймера (для которой специфичным является наличие в бляшках А 1-42). Предпочтительные варианты осуществления Согласно различным объектам изобретения предпочтительными являются определенные соединения формулы (I). В частности, предпочтительными являются соединения формулы (I), в которых Х 1 обозначает хлор в положении 4 фенильного кольца, а Х 2 обозначает атом 18F в положении 4 фенильного кольца. Такие соединения являются особенно предпочтительными в качестве диагностических агентов при использовании эмиссионной позитронной томографии (ПЭТ). Еще более предпочтительными являются соединения формулы (I), в которых R3 находится в положении 2 фенильного кольца, R1 обозначает метил в положении 2 пиперазинильного кольца, а R2 обозначает метил в положении 5 пиперазинильного кольца. Также предпочтительными являются соединения формулы (I), в которых R3 находится в положении 2 фенильного кольца, R1 обозначает метил в положении 2 пиперазинильного кольца, а R2 обозначает водород. Наиболее предпочтительно эти предпочтительные соединения имеют форму моно- или дихлоридов. Согласно различным объектам изобретения предпочтительными являются определенные соединения формулы (II). В частности, предпочтительными являются соединения формулы (II), в которых-N(R4)R5 находится в положении 2 фенильного кольца и R1 находится в положении 2 пиперазинильного кольца, а R2 находится в положении 5 пиперазинильного кольца. Также предпочтительными являются соединения формулы (II), в которых -N(R4)R5 находится в положении 2 фенильного кольца и R1 обозначает метил в положении 2 пиперазинильного кольца, а R2 обозначает водород. Еще более предпочтительными являются соединения формулы (II), в которых R5 содержит хелатор формулы (III) а также их комплексы с 99mТc, 186Re и 188Re. Из этих предпочтительных соединений еще более предпочтительными являются соединения формулы (II), в которых R5 содержит хелатор формулы (III) или формулы (IV) и где хелатор связывается с атомом азота группы -N(R4)R5 нерадиоактивного соединения формулы (II) через линкерный фрагмент, содержащий алкильный радикал, имеющий от одного до десяти атомов углерода, где алкильный радикал содержит от одной до десяти -С(O)-групп, от одной до десяти-C(O)N(R)-гpyпп, от одной до десяти -N(R)C(О)-гpyпп, от одной до десяти -N(R)-гpyпп, от одной до десяти -N(R)2-групп, от одной до десяти гидроксигрупп, от одной до десяти -C(О)OR-гpyпп, от одного до десяти атомов кислорода, от одного до десяти атомов серы, от одного до десяти атомов азота, от одного до десяти атомов галогена, от одной до десяти арильных групп и от одного до десяти насыщенных или ненасыщенных гетероциклических колец, в которых R обозначает водород или алкил. Предпочтительно линкерный фрагмент представляет собой -C(О)-CH2-N(H)-. Из соединений по изобретению наиболее предпочтительными соединениями формулы (I) являются соединения, выбранные из следующего ряда: 1-(5-хлор-2-2-[(2R)-4-(4-фтор-18F-бензил)-2-метилпиперазин-1-ил]-2-оксоэтоксифенил)мочевина,комплекс N'-(меркаптоэт-1-ил)-N'-(5-меркапто-3-аза-2-оксопент-1-ил)-N-5-хлор-2-[2-[4-(4-фторбензил)2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицилглицинамида и технеция-99m,1-2-2-[(2R)-4-(4-фторбензил)-2-метилпиперазин-1-ил]-2-оксоэтокси-5-иод-123I-фенилмочевина,комплекс N'-(2-меркаптоэт-1-ил)-N'-(5-меркапто-3-аза-2-оксопент-1-ил)-N-5-хлор-2-[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицинамида и технеция-99m,комплекс N'-(2-меркаптоэт-1-ил)-N'-(5-меркапто-3-азапент-1-ил)-N-5-хлор-2-[2-[4-(4-фторбензил)2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицинамида и технеция-99m,2-(2-амино-4-хлорфенокси)-1-[(2SR, 5RS)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]этан-1-он,2-(2-амино-4-хлорфенокси)-1-[(2RS, 5RS)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]этан-1-он,2-(2-амино-4-хлорфенокси)-1-[(2SR, 5SR)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]этан-1-он,2-(2-амино-4-хлорфенокси)-1-[(2RS, 5SR)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]этан-1-он,2-[4-хлор-2-(диэтиламино)фенокси]-1-[(2SR, 5RS)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]этан 1-он,2-[4-хлор-2-(диэтиламино)фенокси]-1-[(2RS, 5RS)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]этан 1-он,2-[4-хлор-2-(диэтиламино)фенокси]-1-[(2SR, 5SR)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]этан 1-он,2-[4-хлор-2-(диэтиламино)фенокси]-1-[(2RS, 5SR)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]этан 1-он,1-(5-xлop-2-2-[(2RS, 5SR)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)-3(2,4-дихлорфенил)мочевина,1-(5-хлор-2-2-[(2SR, 5SR)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)-3(2,4-дихлорфенил)мочевина,1-(5-xлop-2-2-[(2RS, 5RS)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)-3(2,4-дихлорфенил)мочевина,1-(5-xлop-2-2-[(2SR, 5RS)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)-3(2,4-дихлорфенил)мочевина,1-(5-хлор-2-2-[(2RS, 5SR)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил) мочевина,1-(5-хлор-2-2-[(2SR, 5SR)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил) мочевина,1-(5-хлор-2-2-[(2RS, 5RS)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил) мочевина,1-(5-хлор-2-2-[(2SR, 5RS)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил) мочевина,1-(5-xлop-2-2-[(2RS, 5SR)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил) мочевина,1-(5-xлop-2-2-[(2SR, 5SR)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил) мочевина,1-(5-xлop-2-2-[(2RS, 5RS)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил) мочевина,-6 006199 1-(5-хлор-2-2-[(2SR, 5RS)-4-(4-фтop-18F-бeнзил)-2,5-димeтилпипepaзин-1-ил]-2-оксоэтоксифенил) мочевина,1-[(2SR, 5RS)-4-(4-фтop-18F-бeнзил)-2,5-димeтилпипepaзин-1-ил]-2-(2-изопентиламино-4-хлорфенокси) этан-1-он,1-[(2RS, 5RS)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-(2-изопентиламино-4-хлорфенокси) этан-1-он,1-[(2SR, 5SR)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-(2-изопентиламино-4-хлорфенокси) этан-1-он,1-[(2RS, 5SR)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-(2-изопентиламино-4-хлорфенокси) этан-1-он,N-(5-xлop-2-2-[(2SR, 5RS)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)-2 метилпропанамид,N-(5-xлop-2-2-[(2RS, 5RS)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)-2 метилпропанамид,N-(5-xлop-2-2-[(2SR, 5SR)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)-2 метилпропанамид,N-(5-xлop-2-2-[(2RS, 5SR)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)-2 метилпропанамид,N-(5-xлop-2-2-[(2SR, 5RS)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)-2(метокси)ацетамид,N-(5-xлop-2-2-[(2RS, 5RS)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)-2(метокси)ацетамид,N-(5-xлop-2-2-[(2SR, 5SR)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)-2(метокси)ацетамид,N-(5-xлop-2-2-[(2RS, 5SR)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)-2(метокси)ацетамид,(E)-N-(5-xлop-2-2-[(2RS, 5SR)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)2-бутенамид,(E)-N-(5-xлop-2-2-[(2SR, 5SR)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)2-бутенамид,(E)-N-(5-xлop-2-2-[(2RS, 5RS)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)2-бутенамид,(E)-N-(5-xлop-2-2-[(2SR, 5RS)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)2-бутенамид,метил-N-(5-хлор-2-2-[(2SР, 5RS)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси фенил)сукцинамат,метил-N-(5-хлор-2-2-[(2RS, 5RS)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси фенил)сукцинамат,метил-N-(5-хлор-2-2-[(2SR, 5SR)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси фенил)сукцинамат,метил-N-(5-хлор-2-2-[(2RS, 5SR)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси фенил)сукцинамат,этил-N-(5-хлор-2-2-[(2SR, 5RS)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил) сукцинамат,этил-N-(5-xлop-2-2-[(2RS, 5RS)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил) сукцинамат,этил-N-(5-хлор-2-2-[(2SR, 5SR)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил) сукцинамат,этил-N-(5-хлор-2-2-[(2RS, 5SR)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил) сукцинамат,N-(5-xлop-2-2-[(2SR, 5RS)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)ацетамид,N-(5-xлop-2-2-[(2RS, 5RS)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)ацетамид,N-(5-xлop-2-2-[(2SR, 5SR)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)ацетамид,N-(5-xлop-2-2-[(2RS, 5SR)-4-(4-фтop-18F-бeнзил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)ацетамид,N-(5-xлop-2-2-[(2SR, 5RS)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)пропанамид,N-(5-xлop-2-2-[(2RS, 5RS)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)пропанамид,-7 006199N-(5-хлор-2-2-[(2S)-4-(4-фтор-18F-бензил)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)глицинамид,а также их моно- и дихлориды. Получение соединений по изобретению А. Получение соединений формулы (I). Как правило, радиоактивные визуализирующие агенты формулы (I) по настоящему изобретению получают, подвергая взаимодействию радиоактивные производные 4-фторбензила с производными пиперазина. Для ПЭТ-визуализации предпочтительными являются производные 4-галобензила, меченные с помощью 18F. В целом, метод получения 4-фтор-18F-бензилгалогенидов описан у Iwata и др., AppliedRadiation and Isotopes, т. 52, cc. 87-92 (2000). Производные 4-фторбензила, меченные с помощью 18F, получают, подвергая взаимодействию бензальдегид формулы (а) с ионами 18F-, в результате чего образуется бензальдегид формулы (б) где LG обозначает уходящую группу, например бром, хлор, йод, нитрогруппу или N(R)3+Х- (где R обозначает алкил и Х обозначает ион галогена, такой как Вr-, Сl- или I-; ион алкановой кислоты, такой как ион ацетата (СН 3 С(О)О-); или ион алкилсульфоновой кислоты или галоалкилсульфоновой кислоты, такой как трифлат (СF3SО 3-. Предпочтительно LG обозначает трифлат. При использовании соединения формулы (б) в качестве исходного синтез соединений формулы (I) можно осуществлять различными путями. Согласно первому варианту синтеза соединение формулы (б) восстанавливают с помощью NaBH4,получая соединение формулы (в) Затем соединение формулы (в) подвергают взаимодействию с HI, Р 2I4 или Рh3 РВr2, получая йодили бромзамещенное соединение формулы (г) или (д) Соединения формул (г) и (д) можно получать с радиохимическим выходом 50-60%. При этом радиохимическая чистота (РХЧ) составляет более 95%. Удельная активность соединений составляет 5 мКи на 1 нмоль. Затем соединение формулы (г) или (д) можно подвергать взаимодействию с производным пиперазина формулы (е), получая соединение формулы (ж) (т.е. соединение формулы (I Соединения формулы (е) можно получать согласно методам, извесным специалистам в данной области, которые подробно описаны в опубликованной заявке на патент РСТ WO 98/56771. Согласно второму варианту синтеза соединение формулы (б) подвергают взаимодействию непосредственно с соединением формулы (е) в присутствии восстановителя, например муравьиной кислоты,формиата аммония, NaBH4 или NaBH3CN, получая соединение формулы (ж) (т.е. соединение формулы (I Б. Получение соединений формулы (II). Для однофотонной эмиссионной компьютерной томографии (ОФСКТ) предпочтительно применяют соединения, меченные с помощью 99mTс. Такими соединениями являются соединения формулы (II). Как правило, при синтезе таких соединений в качестве исходных используют нерадиоактивные аналоги соединений формулы (II), которые подвергают взаимодействию с Тс-связывающими хелаторами, напримерN2S2-хелаторами. Получение нерадиоактивных аналогов соединений формулы (II) подробно описано в опубликованной заявке на патент РСТ WO 98/56771. Синтез хелаторов осуществляют согласно стандартным методам, например согласно методам, описанным у A. Mahmood и др., A N2S2-Tetradenate Chelate forZhuang и др., Bioconjugate Chemistry, т. 10, с. 159 (1999). Предпочтительными хелаторами являются хелаторы формул (III) или (IV) Один из хелаторов связан либо непосредственно с атомом азота в группе -N(R4)R5 нерадиоактивного соединения формулы (II), либо с помощью линкерного фрагмента, представляющего собой алкильный радикал, имеющий от одного до десяти атомов углерода, где алкильный радикал необязательно содержит от одной до десяти -С(O)-групп, от одной до десяти -C(О)N(R)-гpyпп, от одной до десяти -N(R)C(O)гpyпп, от одной до десяти -N(R)-гpyпп, от одной до десяти -N(R)2-гpyпп, от одной до десяти гидроксигрупп, от одной до десяти -C(O)OR-гpyпп, от одного до десяти атомов кислорода, от одного до десяти атомов серы, от одного до десяти атомов азота, от одного до десяти атомов галогена, от одной до десяти арильных групп, от одного до десяти насыщенных или ненасыщенных гетероциклических колец, где R обозначает атом водорода или алкил. Предпочтительным линкерным фрагментом является -C(O)-CH2-N(H). Представленные ниже конкретные примеры приведены с целью облегчения практического воплощения изобретения и не направлены на ограничение его объема. А. К раствору (R)-(-)-2-метилпиперазина (10 г, 100 ммолей) в 250 мл метиленхлорида добавляли ДИЭА (19,10 мл, 110 ммолей). Раствор охлаждали до -10 С. Ангидрид ВОС растворяли в 250 мл метиленхлорида и образовавшийся раствор добавляли в течение 1 ч к охлажденному раствору пиперазина. Реакционной смеси давали нагреться до температуры окружающей среды в течение 16 ч. Реакционную смесь фильтровали для удаления твердых частиц и фильтрат промывали 500 мл воды, сушили над сульфатом магния, фильтровали и упаривали, получая продукт в виде масла. Масло очищали с помощью экспресс-хроматографии на колонке, в результате чего получили 14,8 г соединения формулы (а). Б. Соединение формулы (а) (11,0 г, 55 ммолей) и ДИЭА (10,5 мл, 60,4 ммоля) растворяли в 100 мл метиленхлорида. Образовавшийся раствор охлаждали до -10 С. К раствору по каплям добавляли хлорацетилхлорид (4,37 мл, 55 ммолей), поддерживая температуру на уровне -10 С. После перемешивания в течение 1 ч реакционную смесь промывали 100 мл воды, сушили над сульфатом магния, фильтровали и упаривали, получая продукт в виде масла. Масло очищали с помощью хроматографии на колонке, в результате чего получили 11,0 г соединения формулы (б). В. К раствору, содержащему соединение формулы (б) (14,8 г, 53,5 ммоля) и соединение формулы(д) (9,98 г, 53,5 ммоля) в 75 мл ДМСО, добавляли карбонат калия (18,48 г, 133,7 ммоля). Образовавшуюся смесь нагревали до 50 С в течение 3 ч. Смесь охлаждали до 30 С и сливали на 700 мл воды. Водный раствор трижды экстрагировали 200 мл этилацетата. Этилацетатные экстракты объединяли и промывали 200 мл 1 н. КОН, а затем соляным раствором. Органический слой сушили над сульфатом магния, фильтровали и упаривали, получая продукт в виде пены. Пену очищали с помощью экспресс-хроматографии на колонке, в результате чего получили 19,6 г соединения формулы (в). Г. Соединение формулы (в) (7,68 г, 18 ммолей) растворяли в 40 мл этилацетата. Образовавшийся раствор охлаждали в ледяной бане и раствор в течение 5 мин барботировали безводным газообразным НСl. Смеси давали выстояться в течение 1 ч при температуре окружающей среды, при этом происходило осаждение продукта. Продукт собирали фильтрацией, промывали осадок на фильтре свежим этилацетатом и сушили до постоянной массы в вакууме при температуре окружающей среды, в результате чего получили 5,9 г 1-(5-хлор-2-2-[(2R)-2-метилпиперазин-1-ил]-2-оксоэтоксифенил)мочевины, соединения формулы (г) в виде твердого вещества белого цвета; ЯМР (2 ротомера); (400 МГц, ДМСО) 9,7 (m, 0,5H),9,2 (m, 0,5H), 8,16 (s, 1H), 8,13 (s, 0,5H), 6,8 (s, 2H), 4,9 (m, 2 Н), 4,4 (m, 5H), 3,8 (bs, 0,5H), 3,4 (bs, 0,5H),3,2 (m, 2,5H), 3,0 (m, 2H), 1,2-1,4 (m, 3 Н) част./млн. Пример 2. Получение соединения формулы (д). К раствору 2-амино-4-хлорфенола (10 г, 69,7 ммоля) в 100 мл безводного ТГФ при комнатной температуре добавляли в виде одной порции триметилсилилизоцианат (18,8 мл, 139,4 ммоля). Раствор нагревали до 60 С и выдерживали при этой температуре в течение 22 ч, после чего добавляли воду (1,3 мл,76,7 ммоля). Через 30 мин раствор охлаждали до температуры окружающей среды и концентрировали,получая продукт в виде масла коричневого цвета. Это масло растворяли в этилацетате, обрабатывали активированным углем, сушили над сульфатом магния и фильтровали. Фильтрат концентрировали до получения твердого продукта розового цвета, который кристаллизовали из смеси толуол/метанол (10:1),в результате чего получили 5,4 г соединения формулы (д) в виде порошка рыжевато-коричневого цвета.- 12006199 Пример 3. Получение 1-(5-хлор-2-2-[(2R)-4-(4-фтор-18F-бензил)-2-метилпиперазин-1-ил]-2-оксоэтоксифенил)мочевины. А. Меченный с помощью 18F фтористый водород получали в циклотроне путем бомбардировки протонами Н 2 О-18 О. Образовавшийся фтористый водород 18F адсорбировали на анионообменный картридж. Фтористый водород 18F элюировали раствором Kriptofix 222 (15 мг, 40 мкмолей) и K2 СО 3 (2,77 мг, 20 мкмолей) в водном растворе ацетонитрила (1,5 мл, 66%). Радиоактивные фракции упаривали досуха в потоке газообразного азота. Эту процедуру повторяли трижды с использованием безводного ацетонитрила (1 мл). После добавления раствора 4-триметиламмонийбензальдегидтрифлата (2 мг, 6,4 мкмоля) в безводном ДМФ (250 мкл) образовавшуюся реакционную смесь нагревали в течение 5 мин до 100 С. После охлаждения до температуры окружающей среды добавляли раствор 1-(5-хлор-2-2-[(2R)-2 метилпиперазин-1-ил]-2-оксоэтоксифенил)мочевины, соединения формулы (г), (3 мг, 8,3 мкмоля) в 50 мкл уксусной кислоты и раствор цианборогидрида натрия (4 мг, 63,7 мкмоля) в 100 мкл безводного ДМФ. Реакционную смесь нагревали в течение 10 мин до 120 С. После добавления 5 мкл воды смесь фильтровали через фильтрующий элемент (картридж) из полистирола. Абсорбированный продукт промывали 2 мл воды, получая указанное в заголовке соединение, т.е. 1-(5-хлор-2-2-[(2R)-4-(4-фтор-18F-бензил)-2-метилпиперазин-1-ил]-2-оксоэтоксифенил)мочевину, которое элюировали с помощью 1,5 мл ацетонитрила и очищали с помощью ЖХВР. Б. Аналогичным образом получали другие соединения формулы (I), содержащие атом 18F. Пример 4. Получение N-(5-хлор-2-2-[(2R)-4-(4-фтор-18F-бензил)-2-метилпиперазин-1-ил]-2-оксоэтоксифенил)глицинамида. А. К раствору (R)-(-)-2-метилпиперазина (2,0 г, 20 ммолей) в 20 мл СН 2 Сl2 добавляли ДИЭА (5,2 г,40 ммолей) и 4-фторбензилхлорид (2,39 мл, 20 ммолей). Образовавшуюся смесь перемешивали при температуре окружающей среды в течение 15 ч. После завершения реакции реакционную смесь промывали водой (3 х 20 мл) и соляным раствором, затем сушили над Na2SO4, фильтровали и концентрировали в вакууме, в результате чего получили соединение формулы (е) (2,2 г) в виде твердого вещества белого цвета. Б. К раствору соединения формулы (е) (2,2 г, 10 ммолей) в 50 мл CH2Cl2 добавляли хлорацетилхлорид (0,84 мл, 10 ммолей). Образовавшуюся смесь перемешивали при температуре окружающей среды в течение 10 мин и затем добавляли триэтиламин (3 мл, 21 ммоль). Через 30 мин смесь промывали водой(3 х 20 мл) и соляным раствором, затем сушили над Na2SO4, фильтровали и концентрировали в вакууме,получая продукт в виде масла. После очистки с помощью экспресс-хроматографии на колонке получили соединение формулы (ж) (2,5 г). В. К раствору соединения формулы (ж) (2,4 г, 8,4 ммоля) в 50 мл ДМФ добавляли K2 СО 3 (2,5 г,17 ммолей), NaI (0,2 г) и 4-хлор-2-нитрофенол (1,3 г, 8,4 ммоля). Образовавшуюся смесь выдерживали при 70-80 С. Через 1 ч смесь концентрировали в вакууме, после чего растворяли в этилацетате (150 мл) и промывали водой (3 х 100 мл) и затем соляным раствором. Органический слой отделяли, сушили надNa2SO4, фильтровали и концентрировали в вакууме, получая продукт в виде масла. После очистки с помощью экспресс-хроматографии на колонке получили соединение формулы (з) (3,1 г). Г. К раствору соединения формулы (з) (1,1 г, 2,6 ммоля) в 10 мл этанола добавляли раствор дигидрата хлорида олова(II) (3,0 г, 13 ммолей) в 5 мл этанола. Образовавшуюся смесь выдерживали при 75 С. Через 1 ч смесь концентрировали в вакууме, после чего растворяли в этилацетате (100 мл), промывали 1 н. водным раствором NaOH (3 х 100 мл) и соляным раствором. Органический слой отделяли, сушили надNa2SO4, фильтровали и концентрировали в вакууме, получая продукт в виде масла. После очистки с помощью экспресс-хроматографии на колонке получили соединение формулы (и) (0,75 г). Д. К раствору соединения формулы (и) (0,7 г, 1,78 ммоля) в 10 мл ДМФ добавляли BOC-Gly-OSU(0,58 г, 2,13 ммоля). Образовавшуюся смесь выдерживали при 50-60 С. Через 24 ч смесь концентрировали в вакууме, затем растворяли в этилацетате (150 мл) и промывали водой (3 х 100 мл) и затем соляным раствором. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в вакууме, получая продукт в виде масла. После очистки с помощью экспресс-хроматографии на колонке получили соединение формулы (к) (0,7 г). Е. К раствору соединения формулы (к) (0,6 г, 1,1 ммоля) в 10 мл СН 2 Сl2 добавляли ТФК (5 мл). Образовавшуюся смесь выдерживали при температуре окружающей среды. После завершения реакции через 1 ч реакционную смесь концентрировали в вакууме, затем растворяли в этилацетате (100 мл), промывали 1 н. раствором NaOH в воде (2 х 100 мл) и соляным раствором. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в вакууме, получая продукт в виде масла. После очистки с помощью экспресс-хроматографии на колонке получили N-(5-хлор-2-2-[(2R)-4-(4-фтор-18F-бензил)-2 метилпиперазин-1-ил]-2-оксоэтоксифенил)глицинамид, т.е. соединение формулы (л) (0,45 г) в виде твердого вещества белого цвета; ЯМР (СDСl3) 10,2 (s, 1), 8,5 (s, 1), 7,3 (m, 2), 7,0 (m, 3), 6,8 (d, 1), 4,7 (m,2), 3,4-3,6 (m, 5), 3,0 (m, 1), 2,8 (m, 1), 2,6 (d, 1), 2,2 (m, 1), 2,0 (m, 2), 1,2-1,4 (m, 3) част./млн. Пример 5. Комплекс N'-(меркаптоэт-1-ил)-N'-(5-меркапто-3-аза-2-оксопент-1-ил)-N-5-хлор-2-[2-[4(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицилглицинамида и технеция-99m. А. К раствору, содержащему N-(5-хлор-2-2-[(2R)-4-(4-фтор-18F-бензил)-2-метилпиперазин-1-ил]-2 оксоэтоксифенил)глицинамид (175,5 мг, 0,4 ммоля) (соединение формулы (л), полученное согласно методу, описанному выше в примере 4), N-(S-тритил-2-меркаптоэт-1-ил)-N-(S-тритил-5-меркапто-3-аза-2 оксопент-1-ил)глицин (291,4 мг, 0,4 ммоля) (который можно синтезировать согласно методу, описанному у A. Mahmood и др., A N2S2-Tetradenate Chelate for Solid-Phase Synthesis: Technetium, Rhenium in Chemistryand Nuclear Medicine, т. 5, с. 71 (1999 и N-гидроксисукцинимид (45,5 мг, 0,4 ммоля) в 5 мл дихлорметана, добавляли при перемешивании по каплям раствор дициклокарбодиимида (81,4 мг, 0,4 ммоля) в 3 мл дихлорметана. Образовавшуюся суспензию перемешивали в течение ночи при температуре окружающей среды. После фильтрации образовавшийся раствор упаривали при пониженном давлении. Требуемый продукт, N'-(S-тритил-2-сульфанилэт-1-ил)-N'-(S-тритил-5-меркапто-3-аза-2-оксопент-1-ил)-N-5-хлор-2[2-[4-(4-фторбензил)-2-(2 К)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицилглицинамид (340 мг,72,8%) выделяли с помощью хроматографии на силикагеле (элюент: дихлорметан/метанол, 98:2) в виде порошка белого цвета. Элементарный анализ: Рассчитано: С 69,93, Н 5,87, N 7,20, О 6,85, S 5,49 Обнаружено: С 69,69, Н 6,05, N 7,01, О S 5,32 Б. Полученный согласно описанному выше методу N'-(S-тритил-2-сульфанилэт-1-ил)-N'-(S-тритил 5-меркапто-3-аза-2-оксопент-1-ил)-N-5-хлор-2-[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-ил)глицилглицинамид (116 мг, 0,1 ммоля) растворяли в 5 мл трифторуксусной кислоты. После добавления триэтилсилана (48 мкл, 0,3 ммоля) образовавшуюся суспензию перемешивали в течение 15 мин при температуре окружающей среды. Фильтрат упаривали при пониженном давлении и остаток растирали с 7 мл диэтилового эфира. Осадок перемешивали в течение 1 ч при температуре окружающей среды и отфильтровывали, в результате получили требуемый продукт, т.е. бистрифторацетат N'(меркаптоэт-1-ил)-N'-(5-меркапто-3-аза-2-оксопент-1-ил)-N-5-хлор-2-[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицилглицинамида (87 мг, 95,5%) в виде твердого вещества белого цвета. Элементарный анализ: Рассчитано: С 44,81, Н 4,65, N 9,22, О 15,80, S 7,04 Обнаружено: С 44,54, Н 4,91, N 8,99, О S 6,80 В. Динатрийтартрат (1 мг) и полученный согласно описанному выше методу бистрифторацетат N'(меркаптоэт-1-ил)-N'-(5-меркапто-3-аза-2-оксопент-1-ил)-N-5-хлор-2-[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицилглицинамида (100 мкг) растворяли в 500 мкл натрийфосфатного буфера (0,1 М, рН=8,5). После добавления элюата, содержащего источник 99mТc с радиоактивностью 37 МБк, добавляли 5 мкл раствора хлорида олова(II) и смесь нагревали в течение 10 мин до 100 С. На основе ЖХВР-анализа был выявлен основной пик, который свидетельствовал о том, что требуемый продукт,т.е. комплекс N'-(меркаптоэт-1-ил)-N'-(5-меркапто-3-аза-2-оксопент-1-ил)-N-5-хлор-2-[2-[4-(4-фторбен- 14006199 зил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицилглицинамида и технеция-99m, был синтезирован с РХЧ (радиохимическая чистота) 90%. Пример 6. Получение 1-2-2-[(2R)-4-(4-фторбензил)-2-метилпиперазин-1-ил]-2-оксоэтокси-5-йодфенилмочевины. А. К раствору парайодфенола (2,2 г, 10 ммолей) в 18 мл уксусной кислоты добавляли по каплям в течение 10 мин раствор HNО 3 (0,7 мл, 70%) в 5 мл уксусной кислоты. Образовавшуюся смесь перемешивали при температуре окружающей среды. Через 30 мин реакционную смесь разбавляли 100 мл ледяной воды. Осадок собирали и промывали 100 мл воды. После очистки с помощью экспресс-хроматографии на колонке получали 1,2 г 2-нитро-4-йодфенола. Б. К раствору соединения формулы (ж) (0,3 г, 1,05 ммоля) (полученного согласно методу, приведенному в настоящем описании) в 10 мл ДМФ добавляли K2 СО 3 (0,45 г, 3,2 ммоля), NaI (0,01 г) и 2 нитро-4-йодфенол (0,28 г, 1,05 ммоля). Образовавшуюся смесь выдерживали при 70-80 С. Через 1 ч реакционную смесь концентрировали в вакууме, затем растворяли в этилацетате (150 мл), промывали водой (3 х 100 мл) и соляным раствором. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали в вакууме, получая продукт в виде масла. После очистки с помощью экспрессхроматографии на колонке получили 0,28 г соединения формулы (м). В. К раствору соединения формулы (м) (0,28 г, 0,55 ммоля) в 5 мл этанола добавляли раствор дигидрата хлорида олова(II) (0,616 г, 2,73 ммоля) в 5 мл этанола. Образовавшуюся смесь выдерживали при 75 С. Через 1 ч реакционную смесь концентрировали в вакууме, затем растворяли в этилацетате (100 мл),промывали 1 н. водным раствором NaOH (3 х 100 мл) и соляным раствором. Органический слой отделяли,сушили над Na2SO4, фильтровали и концентрировали в вакууме, получая продукт в виде масла. После очистки с помощью экспресс-хроматографии на колонке получили соединение формулы (н) (0,25 г). Г. К раствору соединения формулы (н) (0,25 г, 0,52 ммоля) в 3 мл АсОН добавляли воду (6 мл). Образовавшуюся смесь перемешивали в течение 10 мин при температуре окружающей среды, после чего по каплям добавляли раствор KOCN (0,085 г, 1,0 ммоль) в 1 мл воды. Реакционную смесь перемешивали в течение 10 мин при температуре окружающей среды, затем выдерживали в течение 5 мин при 55 С. После завершения реакции реакционную смесь концентрировали в вакууме, затем растворяли в CH2Cl2 (50 мл),промывали 2 н. водным раствором NaOH (2 х 100 мл) и соляным раствором. Органический слой отделяли,сушили над Na2SO4, фильтровали и концентрировали в вакууме, получая продукт в виде масла. После очистки с помощью экспресс-хроматографии на колонке получили соединение формулы (о) (0,16 г) в виде твердого вещества белого цвета; ЯМР (CDCl3) 9,0 (s, 1), 8,6 (s, 1), 7,3 (m, 2), 7,0 (t, 3), 6,6 (d, 1) 4,9 (s, 2),4,7 (m, 2), 4,4 (m, 1), 3,4-3,6 (m, 3), 3,0 (m, 1), 2,8 (m, 1), 2,6 (d, 1) 2,2 (m, 1), 2,0 (m, 1), 1,2-1,4 (m, 3) част./млн. Пример 7. Получение 1-2-2-[(2R)-4-(4-фторбензил)-2-метилпиперазин-1-ил]-2-оксоэтокси-5-иод 123I-фенилмочевины. А. К раствору, содержащему соединение формулы (о) (1 мг), полученное согласно описанному выше методу, и 10 мкг сульфата меди(II) в 300 мкл ДМФ, добавляли раствор йодистого натрия [123I] (1 мКи). Образовавшуюся реакционную смесь нагревали в течение ночи до 100 С. После добавления 1 мл полунасыщенного водного раствора NaHCO3 продукт экстрагировали с помощью 2 мл CH2Cl2. Органический слой упаривали досуха в потоке газообразного азота. Требуемый продукт, т.е. 1-2-2-[(2R)-4-(4-фторбензил)-2-метилпиперазин-1-ил]-2-оксоэтокси-5-йод-123I-фенилмочевину, очищали, используя RP-картридж [элюент: ЕtOН/вода (2:1)].- 15006199 Б. С помощью аналогичного метода получали другие соединения формулы (I). Пример 8. Комплекс N'-(меркаптоэт-1-ил)-N'-(5-меркапто-3-аза-2-оксопент-1-ил)-N-5-хлор-2-[2-[4(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-ил)глицинамида и технеция-99m. А. К раствору, содержащему 156,7 мг (0,4 ммоля) 5-хлор-2-[2-[4-(4-фторбензил)-2-метилпиперазин 1-ил]-2-оксоэтокси]анилина (соединение формулы (и, 291,4 мг (0,4 ммоля) N-(S-тритил-2-меркаптоэт-1 ил)-N-(S-тритил-5-меркапто-3-аза-2-оксопент-1-ил)глицина (синтезированного согласно методу, описанному у A. Mahmood и др., A N2S2-Tetradenate Chelate for Solid-Phase Synthesis: Technetium, Rhenium inChemistry and Nuclear Medicine, т. 5, с. 71 (1999 и N-гидроксисукцинимид (45,5 мг, 0,4 ммоля) в 5 мл дихлорметана, добавляли при перемешивании по каплям раствор дициклогексилкарбодиимида (81,4 мг,0,4 ммоля) в 3 мл дихлорметана. Образовавшуюся суспензию перемешивали в течение ночи при температуре окружающей среды. После фильтрации образовавшийся раствор упаривали при пониженном давлении. После хроматографии на силикагеле (элюент: дихлорметан/метанол, 98:2) выделяли требуемый продукт, т.е. N'-(S-тритил-2-меркаптоэт-1-ил)-N'-тритил-5-меркапто-3-аза-2-оксопент-1-ил)-N-5-хлор-2[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицинамид (352 мг, 79,2%), в виде порошка белого цвета. Элементарный анализ: Рассчитано: С 71,36, Н 5,90, N 6,30, О 5,76, S 5,77 Обнаружено: С 71,08, Н 6,13, N 6,05, О S 5,52 Б. N'-(S-Тритил-2-меркаптоэт-1-ил)-N'-(S-тритил-5-меркапто-3-аза-2-оксопент-1-ил)-N-5-хлор-2-[2-[4(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицинамид (111,1 мг, 0,1 ммоля) растворяли в 5 мл трифторуксусной кислоты. После добавления 48 мкл (0,3 ммоля) триэтилсилана образовавшуюся суспензию перемешивали в течение 15 мин при температуре окружающей среды. Фильтрат упаривали при пониженном давлении и остаток растирали с 7 мл диэтилового эфира. Осадок перемешивали в течение 1 ч при температуре окружающей среды и отфильтровывали, получая требуемый продукт,т.е. бистрифторацетат N'-(меркаптоэт-1-ил)-N'-(5-меркапто-3-аза-2-оксопент-1-ил)-N-5-хлор-2-[2-[4-(4 фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицинамида (75 мг, 87,8%) в виде твердого вещества белого цвета. Элементарный анализ: Рассчитано: С 44,99, Н 4,60, N 8,20, О 14,98, S 7,51 Обнаружено: С 44,71, Н 4,89, N 8,03, О S 7,22 В. Динатрийтартрат (1 мг) и бистрифторацетат N'-(меркаптоэт-1-ил)-N'-(5-меркапто-3-аза-2-оксопент 1-ил)-N-5-хлор-2-[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицинамида(100 мкг) растворяли в 500 мкл натрийфосфатного буфера (0,1 М, рН=8,5). После добавления элюата, содержащего источник 99mТc с радиоактивностью 37,5 МБк, добавляли 5 мкл раствора хлорида олова(II) и смесь нагревали в течение 10 мин до 100 С. На основе ЖХВР-анализа был выявлен основной пик, который свидетельствовал о том, что требуемый продукт, т.е. комплекс N'-(меркаптоэт-1-ил)-N'-(5-меркапто 3-аза-2-оксопент-1-ил)-N-5-хлор-2-[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1 илглицинамида и технеция-99m, был синтезирован с РХЧ 90%. Пример 9. Комплекс N'-(меркаптоэт-1-ил)-N'-(5-меркапто-3-азапент-1-ил)-N-5-хлор-2-[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-ил)глицинамида и технеция-99m. А. К раствору, содержащему 156,7 мг (0,4 ммоля) 5-хлор-2-[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]анилина и 40,5 мг (0,4 ммоля) триэтиламина в 5 мл дихлорметана, добавляли при перемешивании по каплям раствор -бромацетилхлорида (63 мг, 0,4 ммоля) в 3 мл дихлорметана. Образовавшийся раствор перемешивали в течение ночи при температуре окружающей среды. Растворитель выпаривали при пониженном давлении. После хроматографии на силикагеле (элюент: дихлорметан/метанол, 99:1) выделяли требуемый продукт, т.е. N-5-хлор-2-[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-ил-2-бромацетамид (175 мг, 85,3%), в виде порошка белого цвета. Элементарный анализ: Рассчитано: С 51,53, Н 4,72, N 8,19, О 5,76 Обнаружено: С 51,28, Н 4,99, N 7,92 О Б. Раствор, содержащий N-5-хлор-2-[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-ил-2-бромацетамид (165 мг, 0,42 ммоля) и N,N'-бис(S-(4-метоксибензил)-2-меркаптоэт-1 ил)этилендиамин (841,3 мг, 2 ммоля) (синтезированный согласно методу, описанному у Z.P. Zhuang и др., Bioconjugate Chem., т. 10, с. 159 (1999 в 1,4-диоксане (5 мл), кипятили с обратным холодильником при перемешивании в течение 24 ч. Образовавшуюся реакционную смесь упаривали при пониженном давлении. Остаток растворяли в 15 мл дихлорметана и промывали насыщенным водным раствором карбоната натрия. После сушки над MgSO4 растворитель выпаривали при пониженном давлении. После хроматографии на силикагеле (элюент: дихлорметан/метанол, 9:1) выделяли требуемый продукт, т.е. N'(S-(4-метоксибензил)-2-меркаптоэт-1-ил)-N'-(S-(4-метоксибензил)-5-меркапто-3-азапент-1-ил)-N-5-хлор-2[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицинамид (154 мг, 43%), в виде порошка белого цвета.- 16006199 Элементарный анализ: Рассчитано: С 61,99, Н 6,50, N 8,22, О 9,38, S 7,52 Обнаружено: С 61,71, Н 6,58, N 8,03, О S 7,28 В. N'-(S-(4-Метоксибензил)-2-меркаптоэт-1-ил)-N'-(S-метоксибензил)-5-меркапто-3-азапент-1-ил-N5-хлор-2-[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицинамид (140 мг,0,164 ммоля) растворяли при 0 С в 5 мл трифторуксусной кислоты. После добавления Hg(OAc)2 (104,5 мг,0,328 ммоля) образовавшуюся смесь перемешивали в течение 30 мин при 0 С и в течение 15 мин насыщали Н 2S. После фильтрации растворитель выпаривали при пониженном давлении. Образовавшийся продукт в виде масла желтого цвета растирали с 3 мл диэтилового эфира. После фильтрации получали требуемый продукт, т.е. тристрифторацетат N'-(2-меркаптоэт-1-ил)-N'-(5-меркапто-3-азапент-1-ил)-N-5 хлор-2-[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицинамида (126 мг 80,5%), в виде порошка белого цвета. Элементарный анализ: Рассчитано: С 42,79, Н 4,44, N 7,34, О 15,09, S 6,72 Обнаружено: С 42,48, Н 4,73, N 7,02, О S 6,76 Г. Динатрийтартрат (1 мг) и тристрифторацетат N'-(2-меркаптоэт-1-ил)-N'-(5-меркапто-3-азапент-1 ил)-N-5-хлор-2-[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-илглицинамида(100 мкг) растворяли в 500 мкл натрий-фосфатного буфера (0,1 М, рН=8,5). После добавления элюата,содержащего источник 99mТс с радиоактивностью 37,5 МБк, добавляли 5 мкл раствора хлорида олова(II) и смесь нагревали в течение 10 мин до 100 С. На основе ЖХВР-анализа был выявлен основной пик, который свидетельствовал о том, что требуемый продукт, т.е. комплекс N'-(меркаптоэт-1-ил)-N'-(5-меркапто 3-азапент-1-ил)-N-5-хлор-2-[2-[4-(4-фторбензил)-2-(2R)-метилпиперазин-1-ил]-2-оксоэтокси]фен-1-ил глицинамида и технеция-99m, был синтезирован с РХЧ 95%. Пример 10. Иммуногистохимический анализ локализации CCR1 в головном мозге людей. Материалы и методы Первую группу образцов тканей, полученных с помощью аутопсии из головного мозга через 12 ч после смерти пациентов, использовали для иммуногистохимического окрашивания хемокинового рецептора CCR1 в головном мозге пациентов, страдающих болезнью Альцгеймера, и контрольном головном мозге. Для всех иммуногистохимических и гистохимических анализов использовали залитые в парафин некрашеные срезы фронтальной области коры головного мозга и гиппокампа. Со срезов удаляли парафин в ксилоле и их гидратировали в забуференном фосфатом физиологическом растворе, содержащем 0,005% Тритона X100 (ЗФР-Т). Для световой микроскопии (с использованием ДАБ в качестве хромогена) активность эндогенной пероксидазы блокировали путем инкубации с 0,01%-ной Н 2 О 2 в метаноле в течение 30 мин. Неспецифическое связывание уменьшали путем блокады в 10%-ной нормальной козьей сыворотке (НКС) в ЗФР в течение 30 мин. Первичные антитела (кроличье антитело к CCR1 (N-концевой пептид); мышиное антитело к нейрофиламенту; мышиное антитело к фибриллярному кислому белку глии (GFAP); мышиное антитело к Таu (АТ 8); мышиное антитело к CD68(клон KР 1); мышиное антитело к -амилоиду (фирма Boehringer Mannheim,1 381 431); кроличье антитело к CCR8 (N-концевой пептид) разбавляли в ЗФР-Т и срезы инкубировали в течение ночи при комнатной температуре. Окрашивание осуществляли с помощью набора Biogenex ABC. Для всех промывок использовали ЗФР-Т. После завершения реакции с ДАБ срезы подвергали слабому контрастному окрашиванию с гематоксилином Гилла, дегидратировали и накрывали покровными стеклами типаPermount. Перед нанесением покровных стекол некоторые срезы повторно окрашивали с помощью антитела к пептиду А, используя аналогичный метод, за исключением того, что в качестве хромогена применяли True Blue. Для экспериментов по иммунофлуоресцентному двойному мечению у срезов удаляли парафин, блокировали с помощью 10%-ной НКС и инкубировали со смесью двух первичных антител в течение ночи. Срезы промывали ЗФР-Т и затем инкубировали со смесью козьих вторичных антител,каждое из которых использовали в разбавлении 1/50. Для того чтобы избежать помех, связанных с эндогенной (желто-зеленой) флуоресценцией ткани, вторичные антитела конъюгировали либо с Су 3 (max=556 нм; козье антимышиное антитело, фирма Amersham), либо с Су 5 (mах=700 нм; козье антикроличье антитело,фирма Amersham). Срезы изучали с помощью конфокального микроскопа, снабженного криптонаргоновым лазером (модель 2010, фирма Molecular Dynamics, Саннивеил, штат Калифорния). Затем во второй группе тканей головного мозга, состоящей из 10 образцов, полученных из головного мозга пожилых людей с нормальной познавательной способностью, и 40 образцов, полученных из головного мозга страдающих болезнью Альцгеймера пациентов, у которых оценивали КОД-балл (клиническая оценка деменции), иммуногистохимически определяли уровень экспрессии CCR1. Образцы окрашивали с целью выявления CCR1 и других маркеров согласно описанному выше методу, за исключением того, что моноклональные антитела (клон 6D5), специфические в отношении А 1-42 (маркер диффузных ранних отложений амилоида, а также маркер более зрелых невритических бляшек), были предоставлены Д-ром Ursula Moenning. Эти антитела визуализировали с помощью Vector Red (фирма VectorLads.). Д-р Moenning были также предоставлены моноклональные антитела, специфические в отношении- 17006199 А 1-40 (клон 13 Е 9), представляющие собой маркеры для бляшек, обнаруженных на поздней стадии болезни, которые визуализировали с помощью True Red. Результаты В обеих группах образцов головного мозга, взятых из головного мозга пациентов с патологией, связанной с болезнью Альцгеймера, обнаружен характерный профиль окрашивания. Было установлено, что иммунореактивность в отношении CCR1 характерна для невритических (т.е. старческих) бляшек как в структуре гиппокампа, так и в коре головного мозга. Структуры, для которых характерно иммунное окрашивание, имели формы от круглой до яйцевидной и не всегда были связаны с протопластами. Они варьировали по размеру и, вероятно, были заполнены пятнистым гранулярным материалом. Было установлено, что эти структуры образовывали короны вокруг амилоидных отложений в старческих бляшках, но отличались от самого А (фиг. 1-4). На верхней панели фиг. 1 показана невритическая бляшка с короной из CCR1-позитивных образований. Протопласты некоторых СА 1- и СА 3-нейронов в образах, полученных из головного мозга страдающих болезнью Альцгеймера пациентов, в некоторых случаях окрашивались антителами к CCR1. Эти результаты проиллюстрированы на нижней панели фиг. 1. Такое окрашивание отличается от окрашивания нейрофибриллярных сплетений (НФС) или грануловаскулярных телец,хотя обычно оно присутствует в теле нейронов при указанных дегенеративных изменениях. Как проиллюстрировано на фиг. 2, предварительная инкубация антител с 16-мерным полипептидом из внеклеточной (N-концевой) области полипептида рецептора CCR1 полностью блокировала окрашивание всех тканей. В частности, на верхней панели фиг. 2 показано отсутствие окрашивания образов, полученных из головного мозга страдающих болезнью Альцгеймера пациентов, при использовании антител кCCR1, которые предварительно инкубировали с полипептидом, в то время как на нижней панели фиг. 2 показаны CCR1-позитивные структуры в таком же (сестринском) срезе, окрашенном с использованием не подвергавшихся инкубации антител. Эксперименты с использованием двойной метки позволили установить, что почти все CCR1-позитивные структуры связаны с невритическими бляшками, содержащими А 1-42 (фиг. 4). В диффузных бляшках А 1-42 (фиг. 5), как правило, не связан ни с CCR1, ни с какими-либо важными для клеточных реакций структурами. При более серьезных случаях болезни Альцгеймера обнаружено существенно большее количество А 1-40-позитивных бляшек. В ряде, но не во всех случаях, была обнаружена связь сCCR1-позитивным окрашиванием (как показано на фиг. 3). В некоторых случаях CCR1-позитивные бляшки вообще не имели А 1-40-позитивного окрашивания. В случаях серьезной стадии болезни Альцгеймера, когда происходит потеря нейронов и возникает глиоз, реактивные астроциты в опорной структуре и энторинальной области коры головного мозга также оказались CCR1-позитивными. В менее серьезных случаях CCR1-позитивные реактивные астроциты практически отсутствовали. Обследование с помощью конфокального микроскопа несущих двойную метку срезов продемонстрировало, что CCR1-иммунореактивность локализована там же, где и позитивная в отношении нейрофиламента иммунореактивность. Маркер макрофагов/микроглии CD68 не связан ни с областями, дающимиCCR1-позитивное окрашивание, ни с областями, дающими позитивную окраску при использовании антитела АТ 8, т.е. антитела к аномально фосфорилированному протеину tau. Как и ожидалось на основе данных, полученных с помощью световой микроскопии, CCR1-иммунореактивность не была связана с зонами локализации GFAP в областях астроглиоза. Лейкоциты, присутствующие в сосудах головного мозга, давали выраженную CCR1-позитивную реакцию как в образцах тканей, полученных из головного мозга страдающих болезнью Альцгеймера пациентов, так и в контрольных образцах, и они являлись позитивным внутренним контролем для методов окрашивания. На фиг. 5 продемонстрировано CCR1-позитивное окрашивание двух внутрисосудистых клеток (обозначены стрелками). Определенный CCR1-позитивный материал обнаружен также в помеченной звездочкой области, но, в целом, для диффузных бляшек не характерно наличие CCR1. При использовании ткани гиппокампа из второй группы изученных образцов (для создания которой пациентов объединяли согласно известным клиническим категориям на основе КОД-балла) осуществляли количественную оценку CCR1-позитивных бляшкоподобных структур в гиппокампе. Гистологические анализы индивидуальных срезов осуществляли вслепую, не зная данных о клиническом статусе,оцененном с помощью КОД-балла. Объемные анализы проводили с использованием несмещенных вычислительных методов. На фиг. 3 на гистологическом уровне продемонстрирована взаимосвязь между CCR1-позитивными дистрофическими невритами (коричневое окрашивание) и невритической бляшкой, содержащей А 1-40(голубое окрашивание). Указанные на фиг. 3 CCR1-позитивные образования отличаются от амилоида. Содержащие А 1-40 бляшки были дискретными, и их количество было легко подсчитать, так же как и кластеры CCR1-позитивных невритов. В срезах гиппокампа оценивали количество CCR1-позитивных корон, количество А 1-40-позитивных бляшек и количество бляшек, содержащих оба маркера. Количество указанных структур подсчитывали по областям (например, в СА 3, СА 1 и в опорной структуре) во всей структуре гиппокампа, включая энторинальную область коры головного мозга, и затем суммирова- 18006199 ли. Полученные данные позволяли оценить относительное количество структур в гиппокампе по их количеству в поперечных срезах толщиной 5 мкм структуры гиппокампа. На фиг. 6 продемонстрирована взаимосвязь между количеством CCR1-позитивных структур, количеством А 1-40-позитивных структур и КОД-баллом. Для количественной оценки А 1-42 необходима другая методика, поскольку А 1-42 присутствует в существенно большем количестве и образует диффузные бляшки, которые нелегко подсчитать (см. фиг. 5). При анализе таких срезов для оценки площади энторинальной области коры головного мозга,содержащей А 1-42, использовали автоматизированный метод (стереологическая система C.A.S.T.) Площадь выражали в виде процента общей площади коры головного мозга на срезе. Области, содержащие невриты и диффузные бляшки, подсчитывали по отдельности. Применение управляемого с помощью компьютера предметного столика микроскопа гарантировало произвольную (несмещенную) оценку срезов ткани. Объем энторинальной области коры головного мозга в %, содержащей А 1-42 (как диффузной,так и невритической), сравнивали с количеством CCR1-позитивных бляшек в таком же (сестринском) срезе энторинальной области коры головного мозга, представленном на фиг. 7. Из фиг. 6 видно, что среднее количество CCR1-позитивных дистрофичных невритов в гиппокампе повышалось в зависимости от КОД-балла болезни Альцгеймера. Количество позитивных структур на ранней стадии болезни Альцгеймера (КОД равен 0,5) повышен по сравнению с контролем (КОД равен 0). Хотя различия между контрольной группой и группой страдающих болезнью Альцгеймера пациентов не становятся статистически значимыми до тех пор, пока значение КОД не достигнет 2, выявленные схемы экспрессии подтверждают предположение о том, что даже на ранних стадиях болезни Альцгеймера в подверженных дистрофии нейронах происходит позитивная регуляция CCR1. Следует отметить, что количество содержащих А 1-40 бляшек не повышается до поздней стадии болезни. Таким образом, экспрессию CCR1 в ткани головного мозга можно рассматривать в качестве относительно раннего индикатора болезни Альцгеймера. Корреляция между количеством CCR1-позитивных бляшек в энторинальной области коры головного мозга и количеством А 1-42 продемонстрирована на фиг. 7. В целом, уровни CCR1 в энторинальной области коры головного мозга повышаются с повышением статуса заболевания; однако, площадь приведенной в качестве примера области существенно меньше площади, приведенной в качестве примера на фиг. 6. Следует отметить, что уровни А 1-42 повышаются на ранней стадии заболевания. Пример 11. Оценка с помощью 14 С-метки пригодности соединений по изобретению для исследования головного мозга. Получали 14 С-аналог 1-(5-хлор-2-2-[2R)-4-фторбензил)-2-метилпиперазин-1-ил]-2-оксоэтокси фенил)мочевины и использовали его для фармакокинетических исследований пригодности соединений по изобретению для исследования головного мозга. Мышам инъецировали внутривенно через введенные в яремные вены катетеры указанный аналог из расчета 36 мг/кг, радиоактивность которого составляла 334000 распадов в мин (dpm) на дозу. Мышей (по 4 в каждой группе) умерщвляли с помощью ингаляции СO2 через 1, 15, 30, 120 и 1440 мин после инъекции и для получения цельной крови осуществляли внутрисердечную пункцию. Затем вскрывали грудную клетку и осуществляли перфузию мышей через сердце забуференным фосфатом физиологическим раствором в течение 5 мин для удаления из компартментов крови остаточной радиоактивности, связанной введением с лекарственного средства. Головной мозг удаляли, взвешивали и определяли радиоактивность в двух различных участках коры головного мозга. Уровни радиоактивности на мг ткани в двух образцах усредняли и данные стандартизовали по отношению к общей массе головного мозга (см. фиг. 8). Усами обозначены квадратичные ошибки (n=4 мышей на каждую точку, соответствующую определенному моменту времени). В частности, из приведенного на фиг. 8 графика видно, что общее количество распадов в мин (dpm) 14 С-аналога в целом мозге мыши понижается до незначимых уровней через 2 ч после инъекции. С помощью расчетов, позволяющих оценить уровни введенного аналога через 1 мин после инъекции, установлено, что в целом мозге мыши (средний вес которого составлял 450 мг) находилось в среднем примерно 3% инъецируемой дозы. Уровень радиоактивности определяли также в образцах плазмы, полученных из цельной крови мыши. Уровень радиоактивности в равных объемах головного мозга и плазмы сравнивали в различные моменты времени в виде процентов от инъецируемой дозы, как это проиллюстрировано на фиг. 9. Процент от инъецируемой дозы (и.д.) на мл плазмы через 2 ч также снижался до незначимых уровней. Для сравнения с уровнями радиоактивности в головном мозге общее количество dpm в головном мозге также стандартизовали по отношению к грамму веса мозга и выражали в виде процента и.д. на 1 г ткани мозга. Следует отметить, что средний вес головного мозга мышей примерно 450 мг, поэтому приведенный на графике % и.д. на 1 г головного мозга мыши превышает реальные значение примерно в 2 раза. Ясно, что уровни радиоактивности аналога в головном мозге совпадают с уровнями в плазме. Хотя аналог является липофильным, в головном мозге здоровых мышей не выявлены области, в которых происходило бы накопление антагониста CCR1.- 19006199 Пример 12. Экспрессия CCR1 при других нейродегенеративных заболеваниях. Материал и методы Изучение содержания CCR1 осуществляли в полученных в результате аутопсии гистологических образцах ткани головного мозга пациентов (всего 29 случаев), страдавших семью другими нейродегенеративными заболеваниями (отличными от истинной болезни Альцгеймера). Срезы подвергали иммунологическому окрашиванию с использованием антител к CCR1 согласно методу, описанному выше в примере 10, и оценивали вслепую в условиях, когда исследователи не имели информации о конкретном нейродегенеративном заболевании. Затем аналогичные срезы метили с помощью двойной метки, т.е. с использованием антител к CCR1 (применяя в качестве хромогена ДАБ) и к А 1-42 (применяя в качестве хромогена Vector Red). Ниже приведен перечень изученных заболеваний. Болезнь Паркинсона (БП) 6 случаев Паркинсонова деменция Гуама 3 случая Конгофильная ангиопатия 4 случая Деменция, вызванная множественными инфарктами (МИД) 4 случая Диффузная деменция, связанная с тельцами Леви (ДДТЛ) 4 случая Болезнь Пика 4 случая Прогрессивный супрануклеарный паралич (ПСП) 4 случая В окрашенных срезах оценивали содержание CCR1 и А 1-42 с помощью гистологической шкалы от 0 до 4,где 0 обозначает отсутствие окрашивания, 0,5 обозначает редкие случаи экспрессии, а баллы от 1 до 4 соответствуют повышающимся уровням экспрессии, при этом наиболее высокий уровень обозначен баллом 4. Результаты Для всех шести случаев болезни Паркинсона и всех трех случаев Паркинсовой деменции Гуама характерно CCR1-отрицательное окрашивание. CCR1-позитивные бляшкоподобные структуры, аналогичные тем, которые характерны для болезни Альцгеймера, обнаружены во всех четырех случаях конгофильной ангиопатии, в трех случаях из четырех ДДТЛ, в двух случаях из четырех ПСП и в одном случае из четырех МИД и болезни Пика. Эксперименты с использованием двойной метки подтвердили предположение о том, что эти CCR1 позитивные бляшкоподобные структуры связаны с А 1-42, аналогично тому, что было установлено для случаев истинной болезни Альцгеймера (пример 10). На фиг. 10 в графической форме представлены результаты патологических оценок для всех изученных заболеваний, кроме болезни Паркинсона (при которой ткань головного мозга является CCR1- негативной). Важно отметить, что экспрессия CCR1 никогда не была обнаружена в образцах ткани головного мозга, если в ней не присутствовали А 1-42-позитивные невритические бляшки. После того как были с образцов были сняты коды, оказалось, что один из случаев болезни Пика, характеризующийся экспрессией CCR1, был диагностирован как болезнь Альцгеймера. Два случая ПСП, характеризующиеся экспрессией CCR1, также были диагностированы как болезнь Альцгеймера. Конгофильная ангиопатия и ДДТЛ представляют собой заболевания, патология которых близка к патологии болезни Альцгеймера. Поэтому не было неожиданным, что они характеризуются также высокими уровнями экспрессии CCR1 в сочетании с А 1-42. В популяции пожилых людей часто случается, что характерная для болезни Альцгеймера патология может накладываться на другие патологические процессы. Это было обнаружено для одного случая из четырех МИД. Эти результаты позволяют предположить, что CCR1 представляет собой маркер, тесно связанный с характерной для болезни Альцгеймера патологией (в частности, с А 1-42-позитивными невритическими бляшками), независимо от других сопутствующих патологических процессов, которые могут присутствовать в головном мозге. Отсюда следует, что он, вероятно, обладает высокой специфичностью в отношении характерной для болезни Альцгеймера патологии, и поэтому его можно использовать в качестве диагностического суррогатного маркера развития болезни. Хотя настоящее изобретение было описано со ссылкой на конкретные варианты его осуществления,специалистам в данной области должно быть очевидно, что можно сделать различные изменения и эквивалентные замены без отклонения от истинной сущности и объема изобретения. Кроме того, можно осуществлять многочисленные модификации для адаптации конкретной ситуации, материала, рассматриваемой композиции, процесса, стадии или стадий процесса к цели, сущности и объему настоящего изобретения. Предполагается, что все такие модификации подпадают под объем приведенной ниже формулы изобретения. где Х 1 и Х 2, каждый независимо друг от друга, обозначает галоген;R1 и R2, каждый независимо друг от друга, обозначает водород или алкил; иR3 обозначает водород, амино, моноалкиламино, диалкиламино, моноаралкиламино, алкилкарбониламино, алкенилкарбониламино, галоалкилкарбониламино, арилкарбониламино, алкоксиалкилкарбониламино, алкоксикарбонилалкилкарбониламино, глицинамидо, моноалкилглицинамидо, арилкарбонилглицинамидо, аминокарбонилглицинамидо, (аминокарбонил)(алкил)глицинамидо, (алкоксиалкилкарбонил)глицинамидо, уреидо, моноалкилуреидо, моноарилуреидо, моноаралкилуреидо или аланинамидо; причем алкил или алкильный фрагмент, если не указано иное, обозначают одновалентный или двухвалентный радикал с прямой или разветвленной цепью, имеющий 1-8 атомов углерода; алкенильный фрагмент обозначает одновалентный или двухвалентный радикал с прямой или разветвленной цепью, содержащий по меньшей мере одну двойную связь и имеющий 2-8 атомов углерода; и арильный фрагмент обозначает фенил или нафтил; и где любой из Х 1 и Х 2 выбирают из ряда, включающего 123I, 125I, 128I, 131I, 75Br, 76Br, 80Br и 18F; или где один из атомов углерода в соединении обозначает 11 С; или его фармацевтически приемлемая соль. 2. Соединение формулы (II) где X1 и X2, каждый независимо друг от друга, обозначает галоген;R1 и R2, каждый независимо друг от друга, обозначает водород или алкил, где алкил обозначает одновалентный или двухвалентный радикал с прямой или разветвленной цепью, имеющий 1-8 атомов углерода; иR5 представляет собой хелатор, обладающий способностью связываться с радиоактивным атомом металла, выбранным из ряда, включающего 99mТc, 186Re и 188Re; или его комплексы с 99mТc, 186Re и 188Re; или его фармацевтически приемлемая соль. 3. Соединение формулы (I) где X1, X2, R1, R2, R4 и R5 имеют значения, указанные в п.2, обладающие способностью связываться с хемокиновым рецептором CCR1 и проникать через гематоэнцефалический барьер. 4. Соединение по п.1 или 2, где R1 обозначает метил в положении 2 пиперазинильного радикала, а 2- 21006199 7. Соединение по п.2, где R5 обозначает хелатор формулы (III) 8. Соединение по п.2, где R5 обозначает хелатор формулы (IV) 9. Соединение по п.7 или 8, где R5 дополнительно содержит линкерный фрагмент, который включает алкильный радикал, имеющий от одного до десяти атомов углерода, где алкильный радикал необязательно содержит от одной до десяти -С(O)-групп, от одной до десяти -C(O)N(R)-гpyпп, от одной до десяти -N(R)C(О)-гpyпп, от одной до десяти -N(R)-гpyпп, от одной до десяти -N(R)2-групп, от одной до десяти гидроксигрупп, от одной до десяти -C(О)OR-гpyпп, от одного до десяти атомов кислорода, от одного до десяти атомов серы, от одного до десяти атомов азота, от одного до десяти атомов галогена и от одной до десяти арильных групп, представляющих собой фенил или нафтил, в которых R обозначает водород или алкил, охарактеризованный в п.2. 10. Соединение по п.9, где линкерный фрагмент представляет собой -C(О)-CH2-N(H)-. 11. Монохлорид соединения по пп.1-10. 12. Дихлорид соединения по пп.1-10. 13. Способ диагностики болезни Альцгеймера у человека, заключающийся в том, что человеку, который нуждается в такой диагностике, вводят описанное выше соединение по любому из пп.1-12 и определяют радиоактивность, появившуюся после введения человеку соединения либо с помощью рентгеновской камеры, либо с помощью эмиссионной позитронной томографии (ПЭТ). 14. Применение соединения по пп.1-12 для приготовления радиофармацевтического агента для диагностики болезни Альцгеймера у человека. 15. Способ получения соединения формулы (I) по п.1, заключающийся в том, что соединение формулы (е)
МПК / Метки
МПК: A61P 25/28, C07D 295/18, A61K 51/00, C07B 59/00
Метки: диагностики, радиофармацевтические, болезни, альцгеймера, агенты
Код ссылки
<a href="https://eas.patents.su/26-6199-radiofarmacevticheskie-agenty-dlya-diagnostiki-bolezni-alcgejjmera.html" rel="bookmark" title="База патентов Евразийского Союза">Радиофармацевтические агенты для диагностики болезни альцгеймера</a>
Предыдущий патент: Способ получения клопидогрела
Следующий патент: Осушитель природного газа
Случайный патент: Вакцина












