Способ лечения нейродегенеративных заболеваний, выбранных из группы, включающей болезни паркинсона, альцгеймера, луи гехрига, бинсвангера и оливопонтоцеребеллярную атрофию у животного
Формула / Реферат
1. Способ лечения нейродегенеративных заболеваний, выбранных из группы, включающей болезни Паркинсона, Альцгеймера, Луи Гехрига, Бинсвангера и оливопонтоцеребеллярную атрофию у животного, с помощью полиамина путем стерической защиты ДНК, усиления транскрипции последовательностей факторов роста, регуляции рецептора НМДА и активности ионного канала МК801 и других физиологических стабилизирующих явлений клеток головного мозга, отличающийся тем, что в качестве полиамина животному вводят эффективное количество полиамина, выбранного из группы, состоящей из циклических, линейных и разветвленных полиаминов, причем линейные полиамины представлены общей формулой
X-[(CHY)n-NH]n-CH2-X,
где X - концевая аминогруппа, Y - водород или C1-C7алкил, а n является целым числом от 1 до 7.
2. Способ по п.1, отличающийся тем, что указанные полиамины выбирают из группы, состоящей из 2,3,2-тетрамина, 2,2,2-тетрамина и 3,3,3-тетрамина.
3. Способ по п.2, отличающийся тем, что указанное животное представлено Rana pipiens.
4. Способ по п.1, отличающийся тем, что симптомы указанных болезней индуцируют внутрибрюшинной инъекцией указанному животному МРТР в однократной дозе 40 мг/кг.
5. Способ по п.4, отличающийся тем, что в качестве указанного эффективного количества выбирают однократную дозу 1,2 мМ.
6. Способ по п.1, отличающийся тем, что указанная доза содержит 2,3,2-тетрамин.
7. Способ по п.6, отличающийся тем, что указанное животное представлено Rana pipiens.
8. Способ по п.7, отличающийся тем, что симптомы указанных болезней индуцируют внутрибрюшинной инъекцией указанному животному МРТР в однократной дозе 40 мг/кг.
9. Способ по п.8, отличающийся тем, что в качестве указанного эффективного количества выбирают однократную дозу 1,2 мМ.
10. Способ по п.1, отличающийся тем, что если Y обозначает водород, то указанную концевую аминогруппу выбирают из группы, состоящей из заместителей, имеющих формулы
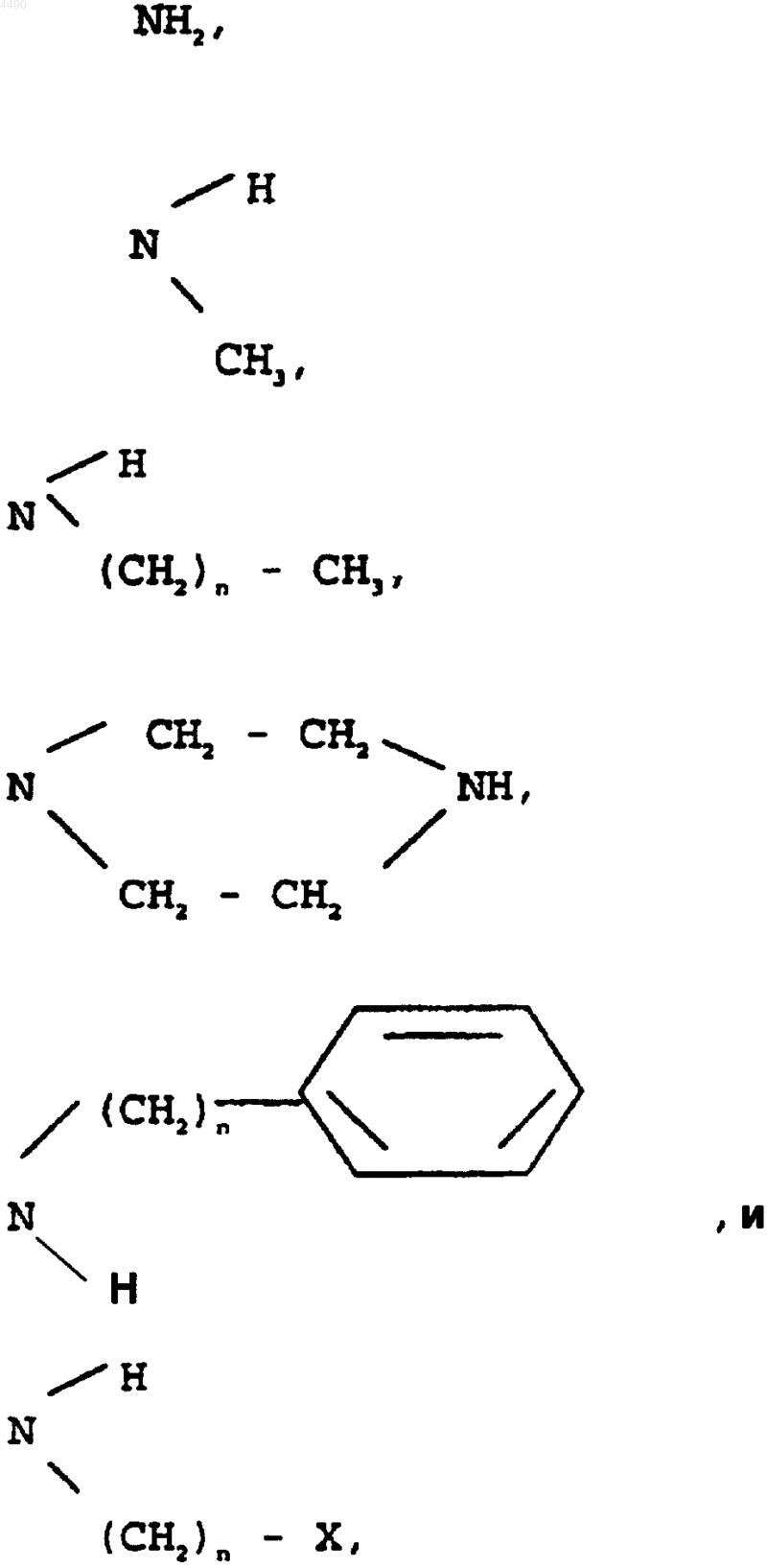
где n представлено целым числом от 1 до 7.
11. Способ по п.1, отличающийся тем, что Y означает C1-C7алкил.
12. Способ по п.1, отличающийся тем, что если Y обозначает водород, то указанная общая формула дополнительно включает соль, которую выбирают из группы, содержащей анионы (ClO4)- и (SO2)2-.
Текст
1 Область техники, к которой относится изобретение Данное изобретение касается лечения неврологических нарушений у млекопитающих и более конкретно, диагностики и терапии болезни Паркинсона, оливопонтоцеребеллярной атрофии, болезни Альцгеймера и болезни Луи Гехрига. Уровень техники Болезнь Паркинсона представляет собой дегенеративное заболевание нервной системы,которое поражает субъекта в возрасте пятидесяти - более пятидесяти лет и субъекта в возрасте двадцати - более семидесяти лет независимо от пола или социального уровня. Описанный Джеймсом Паркинсоном в 1817 г. дрожательный паралич состоит из триады тремора в состоянии покоя, мышечной ригидности и замедленности движений. Точное описание заболевания в период промышленной революции навело людей на мысль о том, что воздействие токсичных химических агентов на окружающую среду способствует заболеванию. Воздействие марганца приводило к развитию у горнорабочих синдрома Паркинсона, который включал также шизофреническое поведение. В ряде эпидемиологических исследований была обнаружена связь между промышленным воздействием меди, марганца и меди одновременно с железом и частотой болезни Паркинсона (см. работу Gorell J.M. и соавт.), между частотой болезни Паркинсона и уровнями ртути в крови (см. работу Ngim C.H. и соавт.) и уровнями смертности от болезни Паркинсона и близостью промышленных производств, связанных с медью (см. работу RybickiB.A. и соавт.). Предполагают, что ксенобиотики, природные и созданные человеком инсектициды также являются кандидатными агентами,поскольку они стимулируют при случае двигательные нарушения у животных и человека, в чем-то близкие Паркинсонизму. Таким образом неорганические и органические химические вещества могут участвовать в механизме токсичности. Другие типы паркинсонизма включают постэнцефалитный, болезнь Вильсона и вторичный паркинсонизм после цереброваскулярных повреждений при несчастных случаях, объемных поражений и индуцированных лекарствами случаев. Болезнь прогрессирует не во всех случаях. Деменция с патологическими изменениями по типу болезни Альцгеймера следует за,но не предшествует болезни Паркинсона приблизительно в одной четверти диагностированных случаев. Присутствуют также общее истощение и анорексия, при этом метаболические компоненты заболевания не связаны с гипоталамической(тубероинфундибулярной) допаминергической дисфункцией. Развитие Болезнь Паркинсона прогрессирует до различной степени у разных пациентов, чаще всего 2 в период от 7 до 10 лет после времени постановки диагноза. Некоторые пациенты испытывают общее истощение и анорексию, часто присутствуют депрессия и психические изменения и приблизительно у одной четверти развиваются клинические изменения познавательной функции по типу болезни Альцгеймера и определяемые патологические изменения, соответствующие болезни Альцгеймера, в до 40% случаев. Феноменология А. Отложение железа и замещение меди. Железо депонируется в виде гранул гемосидерина в цитоплазме, и митохондрии, наполненные гранулами ферритина, наблюдали в клетках нейронов или глии вентролатерального таламуса, хвостатого и чечевицеобразного ядер и черного вещества головного мозга, пораженного болезнью Паркинсона (см. работы EarleK.M., Asenjo А и соавт., Riederer P. и соавт.), а медь, хотя не определяется в избытке в головном мозге, перетекает в спинно-мозговую жидкость. Уровень вытекания меди коррелирует с клинической тяжестью болезни Паркинсона и уровнем повреждения по типу болезни Альцгеймера, которые имеются у пациентов (см. работу Pall H.S. и соавт.). Хотя синдромы паркинсонизма могут быть индуцированы другими металлами, как при хроническом отравлении марганцем, которое вызывает подобные паркинсонизму и психические симптомы у горнорабочих, и гепатолентикулярной дегенерации вследствие отложения меди при болезни Вильсона, избыточные уровни металлов, отличных от железа, не отмечались при идиопатическом или постэнцефалитном паркинсонизме. В. Морфология митохондрий. Митохондрии являются морфологически деформированными и имеют отложения больших количеств железа при отсутствии доказательств отложения других металлов (см. работыEarle K.M., Asenjo А и соавт., Riederer Р. и соавт.). Железо и медь могут высвобождаться из нейромеланина и поврежденных митохондрий. Наблюдается повышенный уровень свободного железа в митохондриях и цитозоле и очевидное вытекание меди из области хранения через цитозоль в спинно-мозговую жидкость. При болезни Паркинсона происходит ингибирование комплекса 1 митохондриальной цепи транспорта электронов, подавляющее дыхание митохондрий. С. Тиолметилтрансфераза. Активность тиолметилтрансферазы понижена при болезни Паркинсона и повышена при заболевании двигательных нейронов (см. работуWaring и соавт, 1989). Активность глутатион Sтрансферазы присутствует в олигодендроцитах,окончаниях астроцитов, хориоидальном сплетении и клетках эпендимы. Никакая изоформа фермента не присутствует в нейронах. Актив 3 ность фермента имеется в олигодендроцитах белого и серого вещества в виде ур-формы. ybформа имеется в астроцитах, клетках эпендимы и таницитах. Это распределение фермента позволяет предположить, что он является первой линией обороны против токсических субстанций (см. работу Cammer W. и соавт, 1989).D. Медь-цинк супероксиддисмутаза. Высокие уровни CuZn SOD были продемонстрированы иммуногистохимически в больших пирамидальных клетках контрольного головного мозга и головного мозга пациентов с болезнью Альцгеймера (см. работу Delacourte А. и соавт., 1988). Локализация гена супероксиддисмутазы на двадцать первой хромосоме и раннее проявление болезни Альцгеймера при синдроме Дауна позволяют предположить, что активность супероксиддисмутазы и образование пероксида водорода могут участвовать в патогенезе болезни Альцгеймера. Кроме того, нейроны, содержащие высокие уровни NАDРН(никотинамид-аденин-динуклеотидфосфат)диафоразы, являются относительно непораженными при неонатальной гипоксии и гипогликемии,но поражаются при болезни Альцгеймера. Повышение текучести мембран тромбоцитов, обнаруженное у подгруппы пациентов с болезнью Альцгеймера, возможно, вследствие нарушения регуляции биосинтеза мембран тромбоцитов, не связано с повышенным уровнем супероксиддисмутазы в эритроцитах (см. работу ZubenkoG.S. и соавт., 1989). Е. Моноаминоксидаза и NADPH-диафораза. Способность к образованию повреждений,соответствующих болезни Паркинсона, коррелирует с уровнем меланизации черного вещества вида и активностями моноаминоксидазы В иNADPH-диафоразы в базальных ганглиях. Моноаминоксидаза. Астроглиоз, ассоциированный со старением, приводит к повышенной активности МАО В и повышенной чувствительности к токсину МРТР, что обусловливает различия в активности МАО В у различных линий мышей (см. работу Zimmer J. и соавт., 1987). Активность МАО В повышается с возрастом у человека, а активность МАО А не повышается (см. работу Oreland L. и соавт., 1986). Активность МАО В больше повышается в белом веществе, чем в сером веществе. Уровень МАО повышен у пациентов с болезнью Альцгеймера по сравнению с соответствующими по возрасту контролями,при этом более в белом веществе, чем сером веществе (повышение на 32% за десятилетний период по сравнению с 12%-ным повышением). Активность моноаминоксидазы в головном мозге алкоголиков, которые совершили самоубийство, была ниже, чем в головном мозге неалкоголиков-самоубийц и в контроле (см. работу 4 Никотинамид-аденин динуклеотидфосфатдиафораза. Активность NADPH-диафоразы в головном мозге человека была выше в сером веществе, чем в белом веществе, равно как малатдегидрогеназы, сукцинатдегидрогеназы и цитохромоксидазы. У обезьян NADPH-диафораза головного мозга имеет большую активность в ядрах, содержащих больше нейропилей, чем в ядрах, которые являются в основном перикариальными и снова при меньшей активности в белом веществе (см. работу Friede R.L. и соавт.,1963b). Аналогичный образец распространенияNADPH-диафоразы, дегидрогеназы янтарной кислоты и цитохромоксидазы отмечен в случайных срезах головного мозга (см. работуFriede R.L и соавт., 1962). В стволе головного мозга человека содержащие NADPH-диафоразу нейроны находятся вблизи от меланин-содержащих нейронов, таких как дорзальное двигательное ядро блуждающего нерва, синее пятно и черное вещество, что предполагает их роль в процессинге меланина и липофусцина (см. работы Kowall N.W. и соавт.,1988, Friede R.L и соавт., 1962). Образование липофусцина коррелирует с окислительной активностью фермента, но он легко удаляется из нейропилей клеток глии,тогда как его накопление идет в перикариях(Friede R.L. и соавт., 1961). При болезни Альцгеймера подтип непирамидных нейронов в слоях II и III, V и VI коры головного мозга и подкорковом белом веществе, содержащих соматостатин, нейропептид Y и имеющих высокую активность NADPH-диафоразы, является уязвимым для повреждений (см. работу Kowall N.W. и соавт., 1988). По данным иммуногистохимии соматостатин, нейропептид Y присутствовали в аномальных невритах, тогда как перикарии казались нормальными. Напротив, нейроны сNADPH-диафоразой являются устойчивыми к повреждению при неонатальной гипоксииишемии. По-видимому, они являются резистентными к эксайтотоксическому повреждению, опосредуемому рецептором НМДА (Nметил-D-acпapтaтa). Среднего размера неверетенообразные нейроны, которые являютсяNADPH-диафораза-положительными, а также окрашивающимися на нейропептидазу Y и соматостатин, сохраняются при болезни Гентингтона (см. работу Ferrante R.J., 1987). АктивностьNADPH-диафоразы нейронов понижена в головном мозге, пораженном болезнью Альцгеймера, при пониженном окрашивании нейропилей, суггестивной и ретроградной дегенерации. Активность NADPH-диафоразы глии при болезни Альцгеймера повышается (см. работуF. Металлоэндопептидазы, которые вызывают избыточное образование амилоида, образование нейрофибриллярного клубка и повреждение тканей при деменциях. 5 Преаспартатпротеазы. Участки преаспартата не являются обычными участками расщепления предшественника или пропоследовательностей, или участками деградации белков известной последовательности. Они потенциально очень интересны в плане исходного материала ряда белков и пептидов,участвующих в болезни Альцгеймера, наследственном внутримозговом кровоизлиянии при амилоидозе по голландскому типу, пороках развития сосудов головного мозга и спинного мозга, болезни Баттена, старении нейронов и фракциях липопротеинов высокой плотности с остатками аспартата. В головном мозге крыс, по-видимому, отсутствует фермент типа эндопептидазы, который расщепляет связи метионин-аспартат, поскольку гидролиз пептида холецистокинина 8 и холецистокинина 5 указывает на отсутствие подобной эндопептидазы. Образование Gly TrpMet происходит в тридцать раз быстрее при использовании ССК 5 в качестве субстрата по сравнению с использованием ССК 8 в качестве субстрата, и N-концевой пентапептид, который должен был бы образовываться при расщеплении связи метионин-аспартат, в ССК 8 не образуется (см. работу Rose С. и соавт., 1988, 1989). Амилоидные бляшки не наблюдаются в головном мозге крыс, и отсутствие соответствующей ферментативной активности может быть причиной данного отличия. Процессинг интерлейкина-1. Интерлейкин-1 активируется расщеплением участка преаспартата кальций- или магний- и цинк-зависимым ферментом (см. работуBlack R. и соавт., 1989). Интерлейкин-1, инъецированный в головной мозг крысы, стимулирует астроглиоз и неоваскуляризацию (см. работу Giulian D. и соавт., 1989). Микроангиопатия,включающая нефенестрированные кровеносные сосуды, постулирована для болезни Альцгеймера (см. работу Scheibel А. В. и соавт., 1989). Интерлейкин-1 стимулирует транскрипцию мРНК-антихимотрипсина, белок которой находится в амилоидных бляшках (см. работу Baumann Н. и соавт., 1987). -1-антихимотрипсин, хотя и не обнаруженный иммуногистохимически в головном мозге человеческого эмбриона, обнаруживается в сером и белом веществе головного мозга взрослого человека, хориоиде (сосудистой оболочке глаза) и клетках эпендимы (см. работуJustice D.L. и соавт., 1987). Астроциты могут образовывать интерлейкин-1 в центральной нервной системе. Уровень ИЛ-1 повышается в спинно-мозговой жидкости при болезни Альцгеймера (см. работу Cacabelos R. и соавт., 1991). Процессинг субъединицы 9 АТФ-азы. При болезни Баттена были продемонстрированы иммунореактивность пептида амилоида (см. работу Wisniewski K.E. и соавт.,1989), а также отложение белка субъединицы 9 6 митохондриальной АТФ-азы, начинающегося с остатка аспартата (см. работу Palmer D.N. и соавт., 1989). Пептидаза, осуществляющая процессинг, представлена также металлоэндопептидазой (см. работу Schmidt В. и соавт., 1984). Процессинг аполипопротеина А 1. Белок аполипопротеина А 1 имеет гексапептидную пропоследовательность в дополнение к препоследовательности. Пропоследовательность расщепляется на участке преаспартата экстрацеллюларной металлоэндопептидазой(см. работы Edelstein С. и соавт., 1983, Kooistra Т. и соавт., 1984, Scanu A.M. и соавт., 1987,Edelstein С. и соавт., 1987). Идентичный гексапептид в таком же положении имеется в белке аполипопротеинаС 111, но он не расщепляется металлоэндопептидазой. Была обнаружена генетическая связь между аллелью аполипопротеина С 111 и болезнью Альцгеймера (см. работуSchellenberg G.D. и соавт., 1987). Продукция -амилоида. Бета-амилоид, откладывающийся при болезни Альцгеймера и наследственном внутримозговом кровоизлиянии по голландскому типу,имеет аминоконцевой аспартат (см. работу PrelliF. и соавт., 1988) и -амилоид при пороках развития сосудов головного мозга и спинного мозга, вероятно, тоже имеет аминоконцевой аспартат (см. работу Hart M. и соавт., 1988). Кальцийзависимая серинпротеаза, которая расщепляет участок метионин-аспартат и ингибируется 1,10-фенантролином, EGTA и DFP, 1 антихимотрипсином и секретируемым белком-предшественником, была идентифицирована в ткани головного мозга, пораженного болезнью Альцгеймера (см. работу AbrahamC.R. и соавт., 1991 а). Металлзависимая тиолпротеаза, которой требуется восстанавливающий агент, также была частично очищена (см. работу Abraham C.R. и соавт., 1991b). Класс ферментов, который расщепляет предшественник -белка на участке физиологического расщепления последовательности пептида, как продемонстрировано (см. работуSisodia S.S. и соавт., 1989), пока неизвестен. Белок С представляет собой цистеинпротеазу, которая вызывает инактивацию фактораVa, фактора VIII и фибринолизис, обусловливая таким образом антикоагуляционный эффект. Учитывая, что цистатин С является физиологическим ингибитором белка С, вариант белка цистатина С в сыворотке и спинно-мозговой жидкости пациентов с исландским наследственным внутримозговым кровоизлиянием вызывает кровоизлияние(я) вследствие отсутствия ингибирования антикоагуляции и фибринолизиса,опосредованных белком С. Топографическое распространение данной протеазы и ее ингибитора в связи с участками кровоизлияния при исландском наследственном внутримозговом кровоизлиянии неизвестно. Регуляция уровней 7 фактора V еще более усложняется тем, что ему требуется тиолпротеаза, и на данные протеазы будут также влиять ингибиторы протеаз (см. работу Rodgers G.M. и соавт., 1987). Металлзависимая тиолпротеаза расщепляет связь метионин-аспартат белка-предшественника амилоида(см. работу Abraham C.R. и соавт., 1991). Бактериальная преаспартатпротеаза. Преаспартатпротеазы существуют на ранних этапах эволюции, цинк и кобальтзависимая преаспартатпротеаза описывается у Pseudomonas Fragi (см. работу Noreau J. и соавт., 1979). Распространение преаспартатпротеаз в центральной нервной системе и сосудистой сети еще не описано. Процессинг катепсина D в головном мозге. Зрелый катепсин D из коровьего головного мозга имеет аминоконцевой остаток аспартата(см. работу Whitaker J.N. и соавт., 1979), тогда как катепсин D коровьей селезенки начинается в остатка глицина (см. работу Press E.M. и соавт.,1960). Катепсин D представляет собой аспартилпротеазу, которая расщепляет связь лейцинфенилаланин -эндорфина, связи аланин-аланин липотрофина и связь фенилаланин-фенилаланин основного белка миелина, субстанции Р и соматостатина. Активность катепсина D повышена в коре головного мозга, гиппокампе и спинном мозге кролика, которому инъецирован алюминий (см. работу Suzuki H. и соавт., 1988). Введение спирта крысам различного возраста значительно повышало активности катепсинов В иD (см. работу Suleiman S.A. и соавт., 1987). Активность катепсина D постоянно повышается при развитии плода (см. работу Dorn А. и соавт.,1986). В работе Matus А. и соавт. (1987) показано двукратное повышение активности протеазы,подобной катепсину D, в головном мозге старых крыс при повышенном уровне деградации MAP 1 и MAP 2, что могло бы вызывать сборку дефектных микротрубочек в головном мозге, пораженном болезнью Альцгеймера, как предполагают в работе Iqbal K. и соавт., 1986. Другие эндопептидазы Образование субстанции Р. Образующие эндопептидазу субстанция Р(1-7) и субстанция Р (1-8) представляют собой металлофермент с основными группами SH,который расщепляет связи Phe-Phe и Phe-Gly и ингибируется дозазависимым образом пептидом, относящимся к гену кальцитонина, в немиелинизированных афферентных С-волокнах в спинном мозге (см. работу Nyberg F. и соавт.,1988). Эндопептидаза основного белка миелина. Была выделена цинкзависимая эндопептидаза, разрушающая основной белок миелина,отличающаяся от калпаинов, которые расщепляют основной белок миелина у грызунов (см. работу Chantry А. и соавт., 1988, Earl С. и соавт., 004400 8 1988, Groome N. и соавт., 1988). Ее распределение в головном мозге пока неизвестно. Кальций-активируемые нейтральные протеазы I и II. Уровень активности кальций-активируемой нейтральной протеазы в белом веществе мозолистого тела в 7 раз превышает ее активность в сером веществе коры головного мозга(см. работу Chakrabasti А. K. и соавт., 1989). Дальнейшее обогащение происходит в миелиновых фракциях, которые содержат 50% активности ассоциированной с кальцием нейтральной протеазы белого вещества. Аналогично активность ассоциированной с кальцием нейтральной протеазы является очень явной в миелине. В работе Banic N.L и соавт. (1987) показана данная кальций-опосредованная протеолитическая активность в деградированном протеолипидном белке белого вещества, основном белке миелина и триплетных белках нейрофиламентов головного мозга кролика, крысы и коровы и показаны пониженные уровни активности в сером веществе относительно белого вещества. Калпаин также вызывает разрушение белков нейрофиламентов при ишемии (см. работу Ogata N. и соавт., 1989). По иммуногистохимическим данным, активность CANP1 присутствует в перикарионах нейронов, в процессах, протекающих в аксонах и дендритах, в головном и шейном отделах позвоночника и в клетках глии (см. работу Perlmutter L.S. и соавт., 1988). CANP 11,CANP с высоким содержанием кальция, более ограничен глией (см. работу Hamakubo Т. и соавт., 1986). Уровни калспастатина являются более низкими в головном мозге относительно других тканей (см. работу Blomgren K. и соавт.,1989). Катепсин В. Активность катепсина В понижена при болезни Баттена, цероидном липофусцинозе нервных клеток, возможно, вследствие вторичного накопления альдегидов или пероксидов (см. работу Dawson G. и соавт., 1988). Инъекция ингибитора тиолпротеазы лейпептина приводит к отложению липофусциноподобного пигмента с высоким содержанием долихола. Серинэндопептидазы. Инактивирующийcеринэндопептидазы холецистокинин был идентифицирован в коре головного мозга крыс (см. работу Rose С. и соавт., 1988). Его распространение в центральной нервной системе не было описано. В работеAbraham и соавт. (1991) была идентифицирована активируемая кальцием серинпротеаза молекулярной массы 20-35 кД, способная расщеплять связь метионин-аспартат на аминоконцевом участке расщепления -белка цереброваскулярного амилоида и амилоида бляшек при болезни Альцгеймера, тогда как показано, что катепсин G и металлзависимая цистеинпротеаза также расщепляют данный участок. 9 Значение ферментов, зависимых от двухвалентных металлов, в патологии деменции. Металлзависимые эндопептидазы, такие как пептидазы, расщепляющие физиологический предшественник, т.е. нелизосомные протеазы, а также калпаины активируются свободными металлами in vivo. Они могут участвовать в патологических изменениях деменции, включая образование -амилоида и нейрофибриллярного клубка, а также демиелинизации. Молекулы, участвующие в образовании телец Леви, телец Хирано, телец Пика и грануловакуолярной дегенерации, в настоящее время неизвестны. Уровни меди в головном мозге являются самыми высокими в синем пятне, черном веществе, скорлупе и бледном шаре, соответственно. Уровни железа в головном мозге являются самыми высокими в бледном шаре, скорлупе и черном веществе, соответственно. Высвобождение металлов в определенных субклеточных участках является, по-видимому, обычным событием в патогенезе деменций Альцгеймера,Паркинсона, Баттена, Пика и энцефалопатии,индуцированной диализом алюминия. Агенты,которые оказывают влияние на субклеточное распределение и распространение двухвалентных металлов, будут иметь терапевтические перспективы в плане профилактики данных патологий. Ферментативное ингибирование преаспартатпротеаз может не иметь практического применения в терапии, поскольку данные протеазы имеют физиологические функции. Регуляция активностей расщепления ферментами пептидов-предшественников посредством контроля уровней свободных металлов представляет собой интересное терапевтическое направление. Их значение в патогенезе деменций, вероятно, обусловлено отсутствием других классов ферментов, способных расщеплять участки преаспартата. Паркинсонизм горнорабочих марганцевых рудников, болезнь Вильсона и индуцированная диализом энцефалопатия. Образование амилоида, нейрофибриллярного клубка и события демиелинизации, соответствующие болезни Альцгеймера, связаны с двухвалентыми металлами, как описано выше. Однако, в противоположность трем стадиям развития заболевания при болезни Паркинсона,болезни Альцгеймера и болезни Луи Гехрига,описанных на модели ниже, паркинсонизм горнорабочих марганцевых рудников, и болезнь Вильсона, и индуцированная диализом алюминиевая энцефалопатия не включают бляшки,клубки идемиелинизацию. При этом избыточное содержание меди, марганца и алюминия не связаны с образованием бляшек и клубков и демиелинизацией. При болезни Вильсона избыток свободной меди в сыворотке, обусловленный врожденным отсутствием медь-связывающего белка церулоплазмина, откладывается в головном мозге и 10 печени, начиная с раннего возраста. Болезнь Паркинсона, болезнь Альцгеймера, болезнь Луи Гехрига, оливопонтоцеребеллярная атрофия,болезнь Бинсвангера, церебральная амилоидная ангиопатия и наследственное внутримозговое кровоизлияние голландского типа не связаны с врожденным дефицитом церулоплазмина или других металлсвязывающих белков. Гибель клеток при болезни Вильсона наступает от прямых купротоксических эффектов, таких как ингибирование ферментов цикла Кребса. Уровни меди как в головном мозге, так и в печени являются очень высокими у нелеченных пациентов, и даже у успешно леченных пациентов они остаются значительно выше нормальных. Болезнь Вильсона отзывается на хелаты меди любого типа, унитиолы, дитиолы, тетрамины и цинк в качестве медь-заместительной терапии. Терапевтический эффект в плане купруреза и снижения уровней меди в тканях существует в течение от нескольких дней до недель. Изменения численности рецепторов подтипов допаминовых рецепторов (см. работу Schlaug D. и соавт.) не являются специфическими при болезни Вильсона и существуют, например, при шизофрении и болезни Гентингтона. Повышение численности подтипа рецепторов могло бы иметь место при пониженном, неизмененном или повышенном уровне допамина в зависимости от имеющегося состояния болезни. При болезни Паркинсона, болезни Альцгеймера, оливопонтоцеребеллярной атрофии,болезни Луи Гехрига, болезни Бинсвангера и церебральной амилоидной ангиопатии медь не откладывается в перикапиллярных пространствах. Патологические явления при болезни Паркинсона, пост-энцефалитном паркинсонизме,болезни Альцгеймера, оливопонтоцеребеллярной атрофии, болезни Луи Гехрига и церебральной амилоидной ангиопатии включают нейрофибриллярные клубки, амилоидные бляшки,грануловакуолярную дегенерацию, тельца Хирано, тельца Леви, тельца Бумина, демиелинизацию и изменения в распространении энкефалина в головном мозге. Данные изменения не наблюдаются при болезни Вильсона. Кроме того, болезнь Вильсона не связана с чувствительностью к ксенобиотикам, тогда как ксенобиотики имитируют и способствуют повреждению,связанному с МРТР, и вызывают двигательные повреждения у млекопитающих и человека. Такие металлы, как железо, цинк, свинец, кобальт,ртуть или никель не вызывают патологических изменений, соответствующих болезни Вильсона или паркинсонизму горнорабочих марганцевых рудников."защитные" ферменты. При болезни Паркинсона уровень каталазы, восстановленного глутатиона и глутатионпероксидазы также понижены (см. работу Ambani А. и соавт., Perry T.L. и соавт.). Уровни 11 восстановленного глутатиона являются очень низкими в черном веществе у пациентов с болезнью Паркинсона, тогда как нормальное черное вещество представляет ядро с высокими уровнями восстановленного глутатиона по сравнению с другими ядрами головного мозга человека (см. работу Perry T.L. и соавт.). Связывание глутатиона спермидином и зависимая от возраста потеря полиаминов могут понизить уровни глутатиона (см. работу Dublin D.T.,1959). Хвостатое тело и скорлупа у человека содержат более низкие уровни спермидина, чем другие области головного мозга, а также имеют более низкое соотношение спермидин-спермин(см. работу Kremzner L.T.). В печени уровни спермидина снижаются в процессе старения,тогда как уровни спермина несколько повышаются, таким образом соотношение спермидинспермин снижается. Однако в головном мозге соотношение повышается, поскольку уровни спермина снижаются больше, чем уровни спермидина (см. работу Janne J., 1964). Активность пероксидазы в черном веществе, хвостатом теле, скорлупе снижается, равно как и активность каталазы в черном веществе и скорлупе головного мозга, пораженного болезнью Паркинсона (см. работу Ambani A. и соавт.). Цистеин, необходимый для синтеза глутатиона, может быть истощен в допанергических нейронах с помощью феомеланина, который полимеризован с нейромеланином (см. работуProta G.). Данный дисбаланс может являться причиной повышенного окислительно-восстановительного стресса, связанного с синтезом меланина в допаминергических нейронах (см. работу Seals R.C.). В головном мозге человека активности глутатион пероксидазы и глутатионредуктазы снижаются при старении (см. работу Marttila R.J. и соавт., 1988). Высокие уровни CuZn SOD были имуногистохимически продемонстрированы в больших пирамидальных клетках головного мозга контрольных и пораженных болезнью Альцгеймера пациентов (см. работу Delacourte А. и соавт.,1988). Локализация гена супероксиддисмутазы на двадцать первой хромосоме и раннее проявление болезни Альцгеймера при синдроме Дауна позволяют предположить, что активность супероксиддисмутазы и образование пероксида водорода могут способствовать патогенезу болезни Альцгеймера. Кроме того, нейроны, содержащие высокие уровни NADPH-диафоразы,не затрагиваются при неонатальной гипоксии и гипогликемии, но поражаются болезнью Альцгеймера. Повышение текучести мембран тромбоцитов, отмеченное в подгруппе пациентов с болезнью Альцгеймера, возможно, вследствие дисрегуляции биосинтеза мембран тромбоцитов, не связано с более высоким уровнем супероксиддисмутазы в эритроцитах (см. работу 12 Супероксид является ингибитором каталазы и глутатионпероксидазы. Радикалы супероксида и гидроксила ингибируют каталазу, радикалы пероксида водорода и гидроксила ингибируют глутатионпероксидазу, и пероксид водорода ингибирует супероксиддисмутазу (см. работу Pigeolet E. и соавт.). Система ферментов базальных ганглиев работает в следующих рамках. Зависимое от возраста и связанное с заболеванием падение активностей ферментов, которые удаляют пероксид водорода, в особенности наблюдается в капиллярах и вследствие этого способность защитных ферментов может преодолеваться сверхактивацией медь- и марганецзависимых супероксиддисмутаз. Ферменты являются активными только в ограниченных пределах, поскольку избыток субстрата или продукт будут ингибировать их. Краткое описание окислительновосстановительной среды при болезни Паркинсона, МРТР-паркинсонизме и деменции Гуамана-Паркинсона. Феноменология болезни Паркинсона включает избыток окисленного железа и замещение меди. Физиологическая основа меланини липофусцин содержащих ядер с низкими уровнями глутатионпероксидазы и каталазы,ферментов, которые ингибируются избытком субстрата или продуктов супероксида, показывает, что допустимыми являются только ограниченные сдвиги окислительно-восстановительной активности в любом направлении.NADPH-диафораза может защитить данные ядра от окислительного стресса как при неонатальной аноксии, но делает их более уязвимыми к действию восстанавливающих агентов. Радикалы супероксида и гидроксила ингибируют каталазу, радикалы пероксида водорода и гидроксила ингибируют глутатионпероксидазу, и пероксид водорода ингибирует супероксиддисмутазу (см. работу Pigeolet Е. и соавт.). Цинк замещал окислительно-восстановительный металл и был эффективным в предотвращении токсичности параквата в Е. coli (см. работу Korbashi P. и соавт.), и гистидин успешно препятствовал МРР+-индуцированному повреждению в Е. coli (см. работу Haskel Y. и соавт.). Диэтилтиокарбамид, ингибитор супероксиддисмутазы, способствовал эффекту МРТР в плане снижения уровней допамина в полосатом теле мышей (см. работу Corsini P. и соавт.). Напротив, токсичность МРТР в гепатоцитах не повышалась при добавлении 1,3-бис(2-хлорэтил)-1-нитрозомочевины (БХНМ) (см. работуSmith M. и соавт.), и десфероксамин (ДФО) и пеницилламин не были эффективными в предупреждении токсичности МРТР в изолированных гепатоцитах (см. работу Smith M. и соавт.) и уBarbeau А. и соавт., 1985b). Кроме того, МРТР и МРР+ не вызывали перокисления липидов в 13 изолированных гепатоцитах, тогда как MPDP+ вызывал (см. работу Ekstrom G. и соавт.). Замещение металлов цинком и связывание металлов гистидином может быть антагонистом токсичности МРТР в бактериальных культурах. Восстанавливающие агенты и ингибиторы супероксиддисмутазы, а также агенты, которые мобилизуют медь, такие как десфероксаминовый хелат железа, способствуют проявлению токсичности МРТР. В работах Smith и Ekstrom показано, что МРТР и МРР+ являются восстанавливающими агентами. Кроме того, очевидно, что тиолсодержащие соединения, такие как диэтилтиокарбамат и пеницилламин, которые действуют как восстанавливающие агенты, при этом диэтилтиокарбамат является ингибитором супероксиддисмутазы, снижают уровни допамина и дополняют снижение допамина в головном мозге,вызываемое МРТР. Десфероксамин также снижал уровень допамина в головном мозге (см. работу Barbeau А. и соавт., 1986). Полагают, что нейротоксичность десфероксамина является результатом мобилизации меди. Восстановительный стресс является обычным как для МРР+-повреждений, так и для деменции Гуамана-Паркинсона у человека. МРР+токсичность связана с выходом кальция из митохондрий (см. работу Frei В.). Мобилизация митохондриального кальция может следовать за проникновением кальция в клетки вследствие агонизма с рецептором НМДА. Антагонисты НМДА имеют некоторый успех в предупреждении гистологического повреждения черного вещества у мышей, которым вводили МРТР (см. работу 24 L. Tursky и соавт.). Порядок активности при предупреждении повреждения, вызываемого МРТР, не был связан с антагонизмом квисквалата. Токсичность В N-метиламино-Lаланина, аминокислоты, обнаруженной в семенах саговника (Cycas circinalis - саговник завитой) и связанной с амиотрофическим боковым склерозом и деменцией Гуамана-Паркинсона, а также с моделями паркинсонизма, может также предотвращаться антагонистами рецептора глутамата А 1 2-амино-7-фосфоногептановой кислотой (АР 7) (см. работы Ross S.M., 1987a,1987b) и МК 801 (см. работу Zeevalk G.D. и соавт.). Восстанавливающий агент дитиотреитол повышает уровень опосредованной рецептором НМДА смерти клеток среди клеток ганглиев сетчатки, показывая, что окислительно-восстановительный статус клетки влияет на ответ на глутамат и проникновение кальция (см. работуLevy D.I.). Пигментация и депигментация, вызываемые окислением и восстановлением. В жизнеспособных нейронах при болезни Паркинсона происходит повышенный круговорот допамина. Ядра головного мозга, наиболее чувствительные к повреждением, имеют высо 004400 14 кий уровень метаболизма, требуя таким образом высоких уровней оборота митохондриальных ферментов. Они содержат высокие уровни связанных металлов в окисленной и восстановленной формах и, ввиду низких уровней защитных ферментов, они обладают ограниченной способностью к управлению окислительным и восстановительным стрессами. Учитывая, что нейроны могут окислять предшественники аминов,амины и их продукты до нейромеланина и поддерживать отложение в сети, а не разрушение меланина, они могут продолжать накапливать металлы. Даже в присутствии некоторого избытка металлов синтез катехоламина и индоламина будет повышаться, поскольку металлзависимые реакции гидроксилирования влияют на образование нейраминов. В жизнеспособных нейронах при болезни Паркинсона существует повышенный круговорот допамина, который поддерживается повышенными абсолютными уровнями восстановленного железа, хотя соотношение окисленного и восстановленного железа сдвигается в сторону окисленного железа (см. работу Riederer P. и соавт.). Отложение нейромеланина происходит постепенно и не определяется макроскопически у человека, по меньшей мере, до шестилетнего возраста. Повышенное отложение нейромеланина происходит при старении человека. Допамин, норэпинефрин и эпинефрин окисляются тирозиназой с образованием аминохрома, норадренохрома и адренохрома. Автоокисление аминов происходит через хиноновые промежуточные соединения, которые циклизируются до полимеров нейромеланина (см. работу GrahamD.G. и соавт., 1978 а). Двухвалентные железо и марганец повышают уровень автоокисления допамина in vitro (см. работу Barbeau А. и соавт., 1986). Допамин как источник полифенольных соединений, как было обнаружено, является значительно более токсичным в отношении клеток нейробластомы С 1300, чем -гидроксилированные катехоламины норэпинефрин и эпинефрин,поскольку либо он быстрее окислялся в клетке,либо его хиноновые продукты были более реактивными (см. работу Graham D.G. и соавт.). Гидроксихиноновый продукт 6-гидроксидопамина ковалентно связан с цистеинильными остатками глутатиона (см. работу Liang Y.O. и соавт.). Уровни пигментации в черном веществе повышаются по мере увеличения степени родства животных и человека в эволюционном плане (см. работу Marsden С). Скорость автоокисления изменяется обратно максимальной продолжительности жизни вида (см. работу Cutler R.G.). Уровни железа в черном веществе, бледном шаре, красном ядре и скорлупе являются самыми высокими в головном мозге человека, а уровни меди являются самыми высокими в синем пятне и черном веществе, уровни меди так 15 же являются высокими в бледном шаре и скорлупе. Данные полимеры могут образовывать структуру поглощения металлов и электронов и могут высвобождать металлы во время депигментации. Свободные железо и медь также могут стимулировать активность преаспартатпротеаз, семь из которых представляют собой металлопротеазы, и активность калпаина. Повреждение митохондрий при болезни Паркинсона и болезни Альцгеймера А. Цитохромы митохондрий. Митохондрии тромбоцитов пациентов с идиопатической болезнью Паркинсона имеют пониженную активность комплекса 1NADH-цитохром С-редуктазы эндоплазматического ретукулюма тромбоцитов имеет место при болезни Альцеймера (см. работу Zubenko G.S. и соавт., 1989) и недостаточность цитохромоксидазы (комплекса IV) - в митохондриях тромбоцитов пациентов с болезнью Альцгеймера (см. работу Parker W.D. и соавт., 1990). Нейротоксин МРТР ингибирует NАDН-дегидрогеназу (см. работу Singer I.P. и соавт.). Такие антибиотики,как хлорамфеникол, также ингибируют активность митохондриальной NADH-дегидрогеназы. Такие соединения, как метилвиологен, которые удаляют электроны из цепи транспорта электронов, вызывают двигательные эффекты и значительно снижают уровни допамина и норэпинефрина в головном мозге после длительного применения. Б. Энкефалины при болезни Паркинсона. В головном мозге при болезни Паркинсона уровни met- и leu-энкефалина понижены в скорлупе, черном веществе и области крыши желудочков. В полосатом теле met- и leu-энкефалин могут накапливаться в одном и том же нейроне и образовываться из проэнкефалина А. В черном веществе и таламической области желудочков met- и leu-энкефалин не могут накапливаться в одном и том же нейроне или не могут образовываться из одного и того же предшественника. Проэнкефалин В содержит последовательность пронодинорфина, динорфина и leuэнкефалина, но не met-энкефалина. Динорфин и неоэндорфин присутствуют в высоких концентрациях в черном веществе, тогда как динорфин и неоэндорфин не отмечены в высоких концентрациях в полосатом теле. Избирательная дегенерация путей биосинтеза проэнкефалина А или нейронов объяснила бы, почему уровни обоих пептидов снижены в полосатом теле, тогда как повреждения касаются только уровней metэнкефалина в черном веществе (см. работуTaquet Н.). Согласно измерению связывания амида D-аlа-2mеt-5(3 Н)-энкефалина, связывание опиатного рецептора снижается в плотной части черного вещества при болезни Паркинсона. Активность энкефалиназы, по-видимому, пониже 004400 16 на (см. работу Llorens-Cortes С. и соавт.). Введение МРТР макаке резус избирательно снижает концентрации энкефалина в черном веществе,оставляя без изменений концентрации других пептидов. Уровень mеt-энкефалин-аrg-glу-lеu и выделенных из проэнкефалина В пептидов неоэндорфина и динорфина понижен в скорлупе, но уровни met- и leu-энкефалина не снижались в бледном шаре после введения МРТР (см. работу Lamir N.). В. Энкефалины и МРТР. Нейротоксин МРТР также снижает уровниmet-энкефалина в черном теле у макаки резус. Корреляция изменений уровня энкефалина с анатомическими областями указывает на избирательную дегенерацию путей биосинтеза проэнкефалина А или экспрессии их генов при болезни Паркинсона (см. работу Taquet H. 1983). Способность МРТР вызывать паркинсонизм может быть связана с его эффектами на экспрессию опиоидов и участки связывания энкефалина. Энкефалины влияют на круговорот и выход допамина, который, в свою очередь,воздействует на основной метаболизм в областях базальных ганглиев головного мозга. Г. Цитокрофины. Учитывая, что МРТР, опиатное производное, индуцирует синдром Паркинсона и что продукты проэнкефалина А имеют пониженный уровень при болезни Паркинсона, эндогенный опиоид является возможным кандидатом, вызывающим некоторые патофизиологические нарушения при болезни Паркинсона. Ферментативное расщепление коровьего цитохрома b приводит к образованию пептида с последовательностью Tyr-Pro-Phe-Thr, т.е. фрагмента 345349 человеческого митохондриального цитохрома b, называемого цитокрофин-4. Он обладает опиоидной активностью, которую измеряют относительно ряда опиоидов по ингибированию электрически индуцированных сокращений сплетения мышечной оболочки подвздошной кишки морской свинки/препарата продольного слоя мышечной оболочки (см. работу Brantl V. и соавт.). Такая же пентапептидная последовательность Tyr-Pro-Phe-Thr-Ile присутствует в митохондриальном цитохроме b человека (см. работу Anderson S. и соавт.), но не в митохондриальном цитохроме b мыши (см. работу BibbM.J. и соавт.). Данные последовательности цитокрофина присутствуют также в цепи 4 человеческойNADH-убихиноноксидоредуктазы (комплекс 1),активность которой понижена при болезни Паркинсона. Патогенез болезни Паркинсона. Избыток железа, низкие активности каталаз, ингибирование митохондриального метаболизма, морфологическое повреждение митохондрий и повреждение энкефалинергических путей биосинтеза при болезни Паркинсона являются результатом повреждения ДНК и протео 17 лиза транслируемых с них нефункциональных цитохромов. Среда, окружающая митохондриальную ДНК, ее повреждение и отсутствие системы репарации пиримидинового димера предрасполагают к развитию болезни Паркинсона. Образование бляшек и клубков при болезни Паркинсона и развивающаяся в результате этого болезнь Альцгеймера вызываются выходом железа, меди и кальция, которые активируют металлопротеиназы. Отличающееся анатомическое распространение повреждения при постэнцефалитном паркинсонизме связано с тем, каким образом вирус гриппа воздействовал на ядерную ДНК и синтез белка. Болезнь Паркинсона может быть результатом связанного с возрастом повреждения ДНК в митохондриях, вызываемого накоплением свободных радикалов, ксенобиотиков, допамина,хинонов, радиации и возрастного снижения уровней полиаминов. Медь является особенно активной в плане стимуляции повреждения оснований ДНК, индуцированного ксенобиотиками (см. работу Yourtee D.M. и соавт., 1992). Паракват и полиамины, путресцин и спермидин демонстрируют реципрокное конкурентное ингибирование поглощения. Это показывает, что паракват использует систему поглощения полиаминов (см. работу Grabie V. и соавт., 1993). Митохондриальная ДНК мутирует почти в 17 раз быстрее, чем кодирующие последовательности ядерной ДНК (см. работу Wallace D.G. и соавт., 1987) и почти в 6 раз превышая скорость молчащих мутаций (см. работы Lanave С. и соавт., 1984, Miyata Т. и соавт., 1982). В митохондриях отсутствует система репарации пиримидиновых димеров (см. работу Clayton D.A. и соавт.). Делеция из 5000 пар оснований была отмечена в некоторых областях головного мозга при старении и у пациентов с паркинсонизмом(см. работу Ikebe S. и соавт.). Мутация одной пары оснований или делеция в каком-либо из нескольких сайтов может вызывать недостаточность комплекса I у пациентов с митохондриальной миопатией (см. работу Holt I.J. и соавт.). Важность данных делеций, хотя они, повидимому, являются редкими среди всех случаев болезни Паркинсона, состоит в том, что случайное повреждение оснований ДНК может привести к образованию болезни аналогичного типа. В лейкоцитах пациентов с боковым амиотрофическим склерозом, который начинается в возрасте 60-70 лет, показан устойчивый к повреждениям синтез ДНК после обработки алкилирующими агентами (см. работу Lambert C.W. и соавт., 1989). Данный вариант не был очевидным в случаях более раннего начала болезни и может быть вторичным. Репарация недостающей ДНК описана в фибробластах пациентов с болезнью Альцгеймера (см. работу Li J.C. и соавт., 1985). 18 Нарушение цитохромной регуляции привело бы к недостатку железа и опиоидов. Избыточная транскрипция, избыточная трансляция нормального митохондриального транскрипта или вариантов с аномальной последовательностью или сплайсингом, или избыточный протеолиз внутри митохондрий служили бы источником повышенного уровня железа внутри митохондрий, повышенного уровня железа и эндогенного опиоида цитокрофина в клетке. Уровни свободного железа в жидкостях тела составляют порядка 10-18 М. Большая часть железа в сыворотке связана с трансферрином, и поглощение железа клетками зависит от активности рецепторов трансферрина (см. работу Testa U.). Повышенные уровни железа стимулируют окисление катехоламинов через промежуточные хиноновые соединения, а также свободнорадикальную токсичность. Эндогенный опиоид может вызывать супрессию транскрипции проэнкефалина А или влиять на посттранскрипционную регуляцию, а также воздействовать на допамин и другие амины запаса в везикулах и на постсинаптический эффект. Ингибирование митохондриальных цитохромов путем блокады митохондриальной транскрипции или митохондриальной трансляции должно приводить к образованию сдвига в окислительно-восстановительном состоянии к сетевому восстановлению и депигментации. Далее был тестирован ряд ксенобиотиков: рифампицин, бромистый этидий, хлорамфеникол и окситетрациклин. Изменения белков и матричных рибонуклеиновых кислот при болезни Паркинсона. Глиоз постоянно присутствует при идиопатическом паркинсонизме и демиелинизация нейронов черного вещества обычно видна, даже если не наблюдается потеря нейронов (см. работу Friede R.). Значительное увеличение аберрантной матричной РНК отмечают в глии на ранних стадиях болезни и аналогичное повышение матричных РНК нейронов отмечают на более поздних стадиях заболевания (см. работуGomirato С.и соавт.). Доля аденина в РНК пораженной нейроглии повышается, а доля гуанина и урацила снижается. Повышение содержания матричной РНК является обратно пропорциональным содержанию меланина в нейронах черного вещества пациентов с болезнью Паркинсона, которые умерли на ранних стадиях заболевания. Жизнеспособные двигательные нейроны при боковом амиотрофическом склерозе содержат включения - тельца Бумина с высоким содержанием рибонуклеиновой кислоты,которые подобны тельцам Леви или являются эозинофильными (см. работу Chou S.M., 1979). Был заявлен аномальный электрофоретический образец белков эритроцитов пациентов с болезнью Паркинсона, что приводит к предположению о том, что паркинсонизм может вклю 19 чать дисфункцию синтеза белка в глии, результатом которой является биохимическая и функциональная дедифференциация (см. работуWeisberger A.S. и соавт.). Синтез митохондриальной ДНК, рРНК, мРНК и белка повышаются в ответ на метаболические потребности, как,например, было продемонстрировано с митохондриальным цитохромом b в мышечной ткани в ответ на сократительную активность (см. работу Williams S.R., 1986). Увеличение числа копий было больше, чем имеет место в случае ядерных генов, и пропорции 16s рРНК и 12S рРНК не были изменены (см. работу Williams S. и соавт., 1986). Хлорамфеникол повышает синтез митохондриальной РНК, ингибирует синтез митохондриального белка и снижает активность митохондриальной NADH-дегидрогеназы. Основываясь на том, что хлорамфеникол ингибирует синтез белка в пролиферирующих клетках(см. работу Weisberger A.S. и соавт.), на пациентах с болезнью Паркинсона было проведено исследование без контроля по введению хлорамфеникола в дозе 1,5 до 2,0 г ежедневно в течение 6 недель. Клиническое улучшение ригидности и дискинезии и впоследствии тремора у пациентов с болезнью Паркинсона начинается с четвертого до семнадцатого дней от начала терапии, при этом улучшение прогрессирует в течение 10 до 12 дней после того, как становится очевидным для врача или пациента (см. работу Steffanis G.N., и соавт.). Если снижение обмена цитохрома имеет благоприятный эффект в борьбе в болезненным процессом, он снижается путем ингибирования NADH-дегидрогеназы и потребностью экстра-детоксификации, вызываемой хлорамфениколом. Сравнение МРТР-паркинсонизма с идиопатическим паркинсонизмом. Модель паркинсонизма с использованием МРТР приводит к образованию опиоидных изменений в головном мозге, которые не являются идентичными изменениям при болезни Паркинсона. МРР+ в митохондриях и цитозоле действует как восстанавливающий агент, устраняя необходимость выхода иона двухвалентного железа из цитохромов. Свободный радикал может влиять на активность энкефалина, удаление электронов из цепи транспорта электронов и связывания или высвобождение металлов. Таким образом, при получении повреждений пути биосинтеза опиоидов вмешательство в реакции переноса электронов, ингибирование цитохрома, истощение АТФ, изменение доступности окислительно-восстановительных металлов быстро имитируют ход развития дефектов болезни Паркинсона, не вызывая повреждения ДНК или дефекта транскрипции. Однако истощение аденозинтрифосфата и повышение уровней аденозиндифосфата повышают скорость трансляции в митохондриях, что является гомеостатическим регуляторным механизмом. Тельца Леви отсутствуют. Однако аттенюированное введение 20 МРТР обезьянам может привести к патологии типа образования незрелых телец Леви. Они содержат случайным образом ориентированные филаменты или трубочки, напоминающие нейротрубочки (см. работу Forno L.S. и соавт.,1988). Несмотря на отсутствие образования синдрома Паркинсона у грызунов, он является токсическим в высоких дозах. Возможность индуцировать МРТР-паркинсонизм у разных видов зависит от уровня меланизации у них и степени потери глутатионпероксидазы и каталазы при старении. Деменция Гуамана-Паркинсона и рецептор НМДА. Токсичность МРР+ связана с выходом кальция из митохондрий (см. работу Frei В.). Мобилизация митохондриального кальция может следовать за проникновением кальция в клетки вследствие агонизма с рецептором НМДА. Антагонисты НМДА дают некоторый успех в предотвращении гистологического повреждения в черном веществе у мышей, которым вводят МРТР (см. работу 24 L. Turski и соавт.). Порядок активности предотвращения повреждений МРТР не связан с антагонизмом квисквалата. Токсичность В N-метиламино-Lаланина, аминокислоты, обнаруженной в семенах саговника (Cycas circinalis) и связанной с амиотрофическим боковым склерозом и деменцией Гуамана-Паркинсона, а также с моделями паркинсонизма, может также предотвращаться антагонистами рецептора глутамата А 1 2 амино-7-фосфоногептановой кислотой (АР 7)(см. работу Zeevalk G.D. и соавт.). Восстанавливающий агент дитиотреитол повышает уровень опосредованной рецептором НМДА смерти клеток среди клеток ганглиев сетчатки, показывая,что окислительно-восстановительный статус клетки влияет на ответ на глутамат и проникновение кальция (см. работу Levy D.I.). Рецепторы НМДА и полиамины. Полиамины обладают двухфазным действием на рецептор НМДА, агонистическим на низких дозах и антагонистическим при более высоких дозах, диапазон интенсивности агонизма и антагонизма различается в зависимости от длины цепи и распределения заряда вокруг концевых атомов азота. Спермин повышает активность рецепторов НМДА в гиппокампе. Отмечено повышение в 3,5 раза выявленной аффинности к глицину в присутствии 1 мМ спермина и повышение максимальной реакции на НМДА. Зависимый от напряжения блок существует и, вероятно, обусловлен связыванием полиамина в области (3 Н) МК 801 ионного канала(см. работу Beneviste М., и соавт., 1993). Другие полиамины, такие как путресцин, ингибируют спермин-индуцированное потенцирование ответа на НМДА (см. работу McGurk J.F., 1990). 21 Медь и опиатные рецепторы. Ион меди, окислитель тиола, вызывает обратимую налоксоном аналгезию при интрацеребровентрикулярном введении мышам. Дитиотреитол, восстановитель тиола, приводит к реверсии аналгезии, но не обладает эффектом в окисленной форме (см. работу Mazullo G. и соавт., 1980). Комплекс глутатион-медь ингибирует опиатные рецепторы в эритроцитах человека. Медь превращает высокоаффинные опиатные участки в низкоаффинные, что является необходимой стадией активации и связывания эффекторной системы рецептора (см. работу Sadee W. и соавт., 1982). Медь, кадмий и ртуть ингибируют связывание агонистов опиоидов с рецепторами в большей степени, чем с рецепторами. Цинк ингибирует связывание рецептора, тогда как - и -рецепторы являются нечувствительными к цинку. Магний и марганец стимулируют связывание сданными рецепторами в коре головного мозга крыс (см. работуTejwani G.A. и соавт., 1990). Цинк и медь в микромолярных концентрациях снижают число и аффинность энкефалиновых участков в головном мозге крыс (см. работу Ogawa N. и соавт.,1985). Полиамины и протеинкиназа С. Полиамины, такие как спермин, могут ингибировать каталитический домен протеинкиназы С оптимально в концентрации 5 мМ (см. работу Mezetti G. и соавт., 1988). Ингибирование фосфорилирования гистона является неконкурентным и является результатом связывания полиаминов с фосфолипидами. Триэтилентетрамин также ингибирует связывание протеинкиназы С с фосфолипидфосфатидилсерином(см. работу Moruzzi M.S. и соавт., 1990). Очевидно, положительно заряженные концевые аминогруппы, соответствующая алифатическая боковая цепь, подходящее расстояние между внутренними атомами азота и внутримолекулярная гидрофобность являются необходимыми структурными требованиями. Спермин ингибирует образование комплексов между протеинкиназой С и мембранами при концентрации кальция ниже 0,1 мкМ. При более высоких концентрациях кальция спермин влияет на соотношение между обратимо и необратимо связанными с мембраной молекулами фермента (см. работу Moruzzi и соавт., 1995). Медь ингибирует протеинкиназу С приIC50 (50%-ая ингибирующая концентрация,ИK50) приблизительно 30 мкМ. Ингибирование преодолевается повышением концентрации фосфатидилсерина (см. работу Speizer L.A. и соавт.). Полиамины и регенерация нейронов. Спермин, спермидин и путресцин способствуют регенерации аксонов поврежденных нейронов гиппокампа (см. работу Chu P. и соавт.). Путресцин, спермин и спермидин при 22 подкожной инъеции крысам повышали уровень определяемого иммуногистохимически фактора роста нервов (см. работу Gilad G. и соавт.). При назерн-блоттинге было показано, что трансгенные мыши со сверхэкспрессией орнитиндекарбоилазы, у которых были высокие уровни путресцина в тканях, имели повышенные уровни мРНК мозгового (выделенного из головного мозга) нейротрофического фактора (BDNF),фактора роста нервов (NGF) и нейротрофина-3(NT-3) в гиппокампе (см. работу Reeben M. и соавт.). Медь и холинергические рецепторы. Медь в концентрации 3 мкМ снижала число участков связывания для(3 Н)-1 хинуклидинилбензилата на 40-50% при повышении аффинности и уменьшала аффинность агонистов на мускариновых участках. 2,2,2 тетрамин приводил к реверсии эффектов меди. Пеницилламин вызывал аналогичные эффекты в отношении меди, возможно, за счет формирования дисульфидной связи с сульфгидрильной группой (см. работу Farrar и соавт., 1984). Медь повышала аффинность М 1- и М 2-агонистов в гиппокампе и коре головного мозга крыс без воздействия на аффинность мускариновых антагонистов (см. работу Fisher А. и соавт.), а также в головном мозге коров (см. работу Baron В. и соавт., 1984). Дефицит меди снижал число и аффинность мускариновых холинергических рецепторов в головном мозге крыс (см. работуFarrar и соавт., 1985). Сущность изобретения Настоящее изобретение является результатом попытки выйти за рамки традиционных способов заместительной терапии при лечении дегенеративных неврологических нарушений,таких как терапия с замещением допамина LDopa, повышение уровня ацетилхолина в постсинаптических участках при использовании лекарственных препаратов антихолинэстеразы при лечении болезни Альцгеймера или введение факторов роста, или трансплантация диффундирующих в клетку нейропептидов, таких как субстанция Р, при лечении болезни Паркинсона и болезни Альцгеймера. Вместо этого, изобретение направлено на внутреннюю регуляцию активностей клетки при болезни Паркинсона, болезни Альцгеймера,деменции Гуамана-Парксинсона, боковом амиотрофическом склерозе, оливопонтоцеребеллярной ангиопатии, болезни Баттена и при нервных осложнениях при болезни Бинсвангeра. Найдено понимание того, почему определенные нейроны являются первичными мишенями повреждения при данных болезнях, механизма развития болезни Паркинсона до болезни Альцгеймера и того, как различающиеся этиологические события определяют особенности повреждения при болезни Паркинсона, и болезни Альцгеймера, и болезни Баттена в противоположность относительной важности более поздних событий в 23 каскаде патогенеза бокового амиотрофического склероза (болезни Луи Гехрига) и деменции Гуамана-Паркинсона. Дальнейшее понимание достигнуто на стадиях, когда могли бы быть разработаны диагностические тесты и где возможно использование терапии. Каскад событий при патогенезе. При болезни Паркинсона митохондриальная ДНК повреждается допамином и ксенобиотиками в присутствии пониженных уровней существующих в естественных условиях полиаминов. Полиамины защищают ДНК от повреждения органическими молекулами путем стерических взаимодействий. Полиамины конкурентно блокируют поглощение ксенобиотиков. Они также индуцируют транскрипцию факторов роста, таких как фактор роста нервов, мозговой нейротрофический фактор. Полиамины регулируют активность рецептора НМДА и воздействуют на уровень агонизма и антагонизма в ионном канале МК 801. Полиамины регулируют окислительно-восстановительный гомеостаз путем связывания глутатиона. Данные первичные дефициты, связанные с недостаточностью полиаминов, вызывают процессы дедифференцирования данной болезни посредством изменений в уровнях или соотношениях факторов роста, быстрого проникновения кальция через ионный канал МК 801 и метаболических последствий, обусловленных транскриптами поврежденной РНК, вызывающими продукцию дефектных цитохромов. Во-вторых, дефектные цитохромы подвергаются протеолизу, и продукты высвобождают энкефалин, а также выделяют свободное железо в митохондриальный матрикс. Железо вытекает из поврежденных нагруженных кальцием митохондрий в цитозоль нейронов. Активация рецептора НМДА вызывает проникновение кальция в клетки. В-третьих, повышение уровня свободного металла, такого как железо, вызывает замещение других металлов, таких как медь, никель,кобальт и свинец на тех участках, с которыми они связаны. Один или более из данных металлов обеспечивает сверхактивацию преаспартатпротеаз, которые могут образовывать -амилоид и ассоциированные с клубками белки. При болезни Паркинсона и болезни Альцгеймера имеет место повышение уровней свободной меди в отсутствие абсолютного повышения уровней меди или, более вероятно, при действительном снижении общих уровней меди в тканях вследствие ее потери в спинно-мозговой жидкости. Свободная медь будет активировать аминоксидазу, тирозиназу, медь-цинк супероксиддисмутазу и моноаминоксидазу В. Преаспартатпротеазы могут активироваться ионами различных двухвалентных металлов, включая такие, как цинк, железо, кальций, кобальт. Литературные данные относительно этих протеаз указывают,что особенно вероятными являются цинк и 24 кальций. Отведение роли двухвалентным металлам в активации преаспартатпротеаз и образовании амилоида в качестве третичного события в данной модели согласуется с клинической ситуацией, в которой присутствуют пациенты с болезнью Паркинсона и впоследствии с болезнью Альцгеймера лучше, чем противоположное утверждение. При деменции ГуаманаПаркинсона образование бляшек аналогичным образом следует за двигательным нейроном и патологией болезни Паркинсона. Более конкретно, терапевтические соединения имеют множественное действие на каскад событий, происходящий от повреждения ДНК до образования амилоида: а) конкурентное ингибирование поглощения ксенобиотиков на участке транспорта полиаминов, при котором данные органические молекулы являются причиной повреждения ДНК; б) ограничение повреждения митохондриальной ДНК посредством удаления свободных ионов меди, железа и никеля в присутствии алифатического тетрамина; в) индукция транскрипции генов фактора роста нервов, мозгового нейротрофического фактора и нейротрофина-3; г) регуляция аффинности рецепторов НМДА и блокирование ионного канала МК 801; д) связывание и защита восстановленного глутатиона; е) поддержание гомеостаза окислительновосстановительной среды в головном мозге; ж) индукция металлотионеина; з) ингибирование протеинкиназы С; и) нетоксическое хелатирование двухвалентных металлов в головном мозге; к) регуляция активности преаспартатпротеаз; л) ингибирование супероксиддисмутазы,аминоксидазы, моноаминоксидазы В; м) регуляция уровней полиаминов в головном мозге при деменциях путем поддержания уровней эндогенных полиаминов. Предшествующий уровень техники эксперимента Брадикинезия, ригидность и тремор имеют место у лягушки после инъекции МРТР в дозах,сравнимых с дозами, вызывающими эффекты у человека и обезьян (см. работу Barbeau А. и соавт., 1985 а). МРТР и паракват вызывали у лягушек ригидность, брадикинезию и тремор. Паракват исходно вызывает увеличение концентрации допамина в головном мозге, а позднее его снижение (см. работу Barbeau А. и соавт.,1985b). Двигательные эффекты также отмечались в данном контексте с хлорамфениколом. Гиперпигментация, связанная со старением, предшествует депигментации патологий деменции, и МРТР также последовательно вызывает гиперпигментацию и депигментацию. Пигментация представляет собой окислительный процесс, требующий, чтобы медь активи 25 ровала тирозиназу. Удаление меди и/или сдвиг окислительно-восстановительного состояния к сетевому восстановлению привели бы к депигментации без предварительной гиперпигментации, как было показано с соединениями со спин захватом и спин меченными соединениями. Принимая соображения, вытекающие из применения ксенобиотиков и хелатов, которые нарушают субклеточное распределение металла и жесткость системы окислительно-восстановитель-ных ферментов, при идиопатическом паркинсонизме было бы необходимо эффективное соединение для удаления избытка меди из тирозиназы, супероксиддисмутазы, моноаминоксидазы В, аминоксидазы, а также избытка железа, которое замещает медь, из областей запаса. Оно не должно быть прямым ингибитором супероксиддисмутазы или тиолсодержащим восстанавливающим агентом. Триэтилентетрамин действительно снижает активность супероксиддисмутазы без окисления глутатиона (см. работу Kelner M.J. и соавт., 1989). Удаление избытка металлов и ограничивающая деградация полиаминов являются, возможно, наиболее эффективными средствами предотвращения повреждения митохондриальной ДНК и помощи в точной репликации оснований ДНК. Тетрамины представляют собой перспективные соединения, отвечающие данным требованиям и вследствие этого были протестированы в данной системе. Они обладали эффектами в отношении метаболизма меди, железа и никеля (см. работу Sunderman F.W. и соавт., 1976,Baselt R.C. и соавт., 1977), представляют собой очень эффективные хелаторы с низкой описанной токсичностью, а также индуцируют синтез металлотионеина. Экспериментальные наблюдения. Как показано в работе Barbeau и соавт., МРТР индуцирует синдром паркинсонизма у Rana pipiens(см. работу Barbeau А. и соавт., 1985b, 1986). Данную модель с дозами МРТР, близкими к применяемым ранее (40 мг/кг), используют для подтверждения предшествующих исследований с МРТР и катехоламинами и распространения их на исследование индоламинов, для которых модель на Rana pipiens является удобной и воспроизводимой. Измерения нейраминов в рамках промежуточной временной шкалы позволили уловить переход нейротоксичности МРТР как такового в неспецифические механизмы смерти клетки, наблюдаемой в краткосрочных экспериментах на культурах клеток. Перечень фигур чертежей На фиг. 1 представлены кривые зависимости концентрации допамина (ДА) в организме животных относительно времени. На фиг. 2 представлен график в виде столбиков концентрации допамина в организме животных относительно времени. На фиг. 3 представлен график в виде столбиков средних концентраций допамина всех групп. На фиг. 4 представлен линейный график средних концентраций допамина всех групп. 26 На фиг. 5 представлены кривые зависимости уровня допамина от времени, прошедшего после введения ФБН(2,2,6,6 тетраметилпиперидин-N-оксила), и/или МРТР в организм животных. На фиг. 6 представлены кривые зависимости уровня норэпинефрина от времени, прошедшего после введения ФБН, и/или ТМПО,и/или МРТР в организм животных. На фиг. 7 представлены кривые зависимости уровня серотонина от времени, прошедшего после введения ФБН, и/или ТМПО, и/или МРТР в организм животных. На фиг. 8 представлены кривые зависимости уровня эпинефрина от времени, прошедшего после введения ФБН, и/или ТМПО, и/или МРТР в организм животных. Сведения, подтверждающие возможность осуществления изобретения Материалы и способы. Лягушек (Rana pipiens) массой 20-40 г поддерживают в полуводной среде во влажных условиях. Лягушек умерщвляют гуманно. Мозг,включающий головной мозг, удаляют и хранят при -70 С. Основу, не содержащую МРТР, растворяют в забуференном фосфатом физиологическом растворе и готовят свежий раствор ежедневно. Животным внутрибрюшинно вводят 40 мг/кг МРТР в разовой дозе. Дозы нагрузки металлов, ТМПО, ФБН, ксенобиотиков, депигментирующих агентов или физиологический раствор вводят за 1 ч до МРТР. Для каждого варианта обработки и в контрольной группе используют 6 животных. Образцы головного мозга обрабатывают ультразвуком в холодной 0,1 МHClO4,содержащей 20 мг/мл 3,4 дигидроксибензиламина. Гомогенаты центрифугируют при 15000 об./мин. в течение 15 мин при 4 С. Супернатанты вводят непосредственно в камеру ВЭЖХ. Высокоэффективную жидкостную хроматографию проводят с использованием системы Rabbit Rainin с инжекторомRheodyne. Пятнадцать нейраминов, предшественников и продуктов деградации были измерены на уровне 5 пмол при использовании способа Wester, модифицированного тем, что используют 200 нМ натрий-фосфатный буфер вместо натрий-цитратного буфера (см. работу WesterP., 1987). Уровни металлов в головном мозге измеряют с использованием атомного абсорбционного спектрофотометра. Движения оценивают в соответствии с ранее использованной системой (см. работу Barbeau А. и соавт., 1985). Пигментацию измеряют с помощью оценочной шкалы, описанной в работе Hogben и Slome. 2,3,2-Тетрамин (3,7-диазанонан-1,9-диамин). 2,3,2-тетрамин (2,3,2-тетраамин, 2,3,2 тетраамин) синтезируют с 1936 (см. работу VanAlpen J., 1936), и данный класс тетраминов был сначала использован в промышленности в качестве отверждающего агента для эпоксидных смол, в клеях и покрытиях, а также в качестве фунгицидов. Список соединений, имеющих структурную близость или демонстрирующих близкое физическое/химическое/биохимическое поведение, не подразумевающий исключение других, представлен ниже. Было обнаружено,что у крыс 2,3,2-тетрамин и 2,2,2-тетрамин(триен) являются эффективными купруретическими агентами, причем 2,3,2-производное является более эффективным (см. работу Borthwick и соавт., 1980). Его повышенная эффективность отчасти связана с тем, что его аффинность к меди в 10000 раз больше, чем у 2,2,2 тетрамина. Хромофор CuN4 в 2,3,2-тетрамине является практически планарным в противоположность 2,2,2-тетрамину. 2,2,2-тетрамин успешно использовали при лечении болезни Вильсона, включая случаи, когда приходилось прекращать введение пеницилламина, поскольку он вызывал системную красную волчанку(см. работы Walshe J.M., 1969; Harder H. и соавт., 1977 и Walshe J.M., 1975). 2,3,2-Тетрамин. Предварительная нагрузка 2,3,2-тетрамином в дозе 1,2 мМ за 1 ч до введения МРТР является полностью эффективной в плане предотвращения МРТР-индуцированной потери допамина через 12 ч после инъекции МРТР и частично защищающей через 33 ч. См. фиг. 1. 2,3,2-Тетрамин имеет период полужизни от 3 до 4 ч, тогда как МРТР выводится через 24-48 ч. Введение животным дозы 2,3,2-тетрамина путем внутрибрюшинной инъекции каждые 6 ч в течение первых 12 ч является недостаточным для обеспечения полной защиты в течение 36 ч. 2,3,2-тетрамин не обладает вредными воздействиями на пигментацию или поведение, в отличие от хелата железа 1,2-диэтил-3-гидроксипирид-4-она (СР 94), который вызывает гиперпигментацию у некоторых животных. Таблица 1 Концентрация допамина в головном мозге (мкМ) после введения МРТР и 2,3,2-тетрамина (tet) 0 3,358 2,245 Физиологический 1,419 раствор 2,176 1,969 2,597 Среднее значение 2,294 3,124 2,690 3,091 2,3,2-tet 1,585 2,307 2,901 Факториальный анализ всех образцов,приведенных в табл. 1..038 .558 .8543 Средняя разница Критическая разница Значение Р Между МРТР и 2,3,2-тетрамином (tet) имеется достоверная разница р 0,005. Между группами МРТР и 2,3,2 тетрамин+МРТР имеется достоверная разница р 0,008. Таблица 2 Содержание допамина в головном мозге (%) после введения МРТР и 2,3,2-тетрамина Часы 0 3 12 36 Физиологический раствор 100 100 100 100 2,3,2-tet 114 97 107 91 МРТР 100 78 68 61 2,3,2-tet+МРТР 114 105 102 81 Между 2,3,2-тетрамином+МРТР и МРТР имеется достоверная разница, Р=0,01 при 95% доверительном уровне. Уровни металлов в головном мозге.Rana pipiens внутрибрюшинно вводят 1 раз в день в течение 5 дней металлы и хелаторы и определяют уровни железа, меди и марганца с помощью атомной абсорбционной спектрофотометрии. 15 мМ FеНТУ (нитрилтриуксусная кислота) повышает уровни железа в головном мозге до 354 нмол/г сырой массы (179% от контролей с введением физиологического раствора). 29 15 мМ НТУ повышает уровни железа в головном мозге до 270 нмол/г сырой массы (136% от контролей с введением физиологического раствора).FеНТУ повышает уровни меди в головном мозге до 56 нмол/г сырой массы (169% от контролей). НТУ в виде монокомпонента повышает уровни железа в головном мозге до 45 нмол/г сырой массы (137% от контроля с введением физиологического раствора). 15 мМ МnНТУ снижает уровни меди до 25 нмол/г сырой массы (76% от контролей). МnНТУ повышает уровни марганца до 15 нмол/г сырой массы (157% от контролей). 1,2 мМ 2,3,2-тетрамин, 9 мМ десфероксамин и 1,8 мМ медь-трис не приводят к заметным изменениям уровней железа, меди и марганца в головном мозге. Таблица 3 Уровни железа, меди и марганца в головном мозге через 5 дней после нагрузки металлами и хелатами Уровень металла в головном мозге в нМ/г сырой массыFеНТУ 354 56 9,4 ДФО 178 31 8,2 МnНТУ 166 25 15,4 Нагрузка животного железом вызывает тремор у некоторых животных. Нагрузка медью вызывает гиперпигментацию и ригидность. Нагрузка железом индуцирует тремор, и нагрузка медью индуцируют ригидность и брадикинезию. Ксенобиотики. Ингибирование митохондриальных цитохромов блокадой митохондриальной транскрипции или митохондриальной трансляции должно привести к сдвигу в окислительновосстановительном состоянии к сетевому восстановлению и депигментации. Использованные ксенобиотики, рифампицин, бромид этидия,хлорамфеникол и окситетрациклин вызывают истощение допамина при использовании в виде монокомпонента или в комбинации с МРТР, и,кроме того, они вызывают депигментацию. Как в случае с МРТР, депигментации часто предшествует гиперпигментация, особенно при использовании хлорамфеникола. Это, возможно, связано с замещением металлов, исходно происходящим после сдвига окислительно-восстановительной среды до восстановленного состояния,когда уровни цитохрома снижаются хлорамфениколом. Хлорамфеникол в концентрации 31 30 мг/кг при ежедневном введении в комбинации с МРТР снижает уровень допамина до 33% относительно контрольных значений в течение 24 ч. Хлорамфеникол в концентрации 400 мг/кг в виде монокомпонента снижает уровень допамина до 38% относительно контрольных уровней в течение 24 ч. Напротив, рифампин и бромид этидия вызывают более быструю депигментацию. Спин-захватывающие/спин-меченные соединения. Захватывающие радикалы и восстанавливающие агенты (в плане окисления окислительно-восстановительных металлов) ТМПО и ФБН используют в еще одном анализе поведения МРТР как восстанавливающего или окисляющего соединения. Эффекты ксенобиотического МРТР в виде монокомпонента или в комбинации со спиновыми ловушками/спиновыми метками ТМПО (2,2,6,6-тетраметилпиперидин-Nоксила) в дозах 0,1 мМ, 0,25 мМ и 1,0 мМ и ФБН (N-трет-бутил-а-фенилнитрона) в дозах 0,18 мМ и 1,7 мМ, введенными животным за 1 ч до введения МРТР, характеризуются способом воздействия на гидроксилирование данных предшественников аминов. МРТР снижает уровни допамина и повышает уровни норэпинефрина и серотонина, тогда как ТМПО и ФБН снижают уровни норэпинефрина, серотонина и допамина. При введении в виде монокомпонентов они снижали плотность пигментации. Уровни допамина у животных, леченных МРТР, ТМПО и ФБН. ФБН в комбинации с МРТР снижает уровни допамина до приблизительно 10% от базового уровня. Токсичность является дозазависимой и кумулятивной как для ФБН, так и для МРТР. ТМПО аналогичным образом снижает уровень допамина больше, чем МРТР в виде монокомпонента. Токсичность ТМПО является менее доза-зависимой. Таблица 4 Средние значения концентраций допамина в головном мозге (мкМ) относительно времени Часы 0 3 12 36 Физиологич. раствор 2,495 2,477 2,214 2,067 МРТР 2,495 2,059 1,296 0,908 0,1 ТМПО 2,230 1,722 1,722 2,152 0,1 ТМПО+МРТР 2,230 2,029 1,601 0,519 0,25 ТМПО 2,007 1,805 1,331 1,496 0,25 ТМПО+МРТР 2,007 1,686 0,865 0,489 1,0 ТМПО 5,689 2,432 2,056 1,053 1,0 ТМПО+МРТР 5,689 2,907 1,445 1,425 0,18 ФБН 2,137 1,837 2,210 1,768 0,18 ФБН+МРТР 2,137 1,863 1,152 0,775 1,7 ФБН 2,026 1,400 1,825 1,879 1,7 ФБН+МРТР 2,026 1,600 0,822 0,215 МРТР - в дозе 40 мг/кг, ТМПО и ФБН в миллимолярных концентрациях, n=6/среднее значение 31 Уровни норэпинефрина у животных, леченных МРТР, ТМПО и ФБН. ФБН в концентрации 0,18 мМ приводит к частичной реверсии эффекта повышения уровня норэпинефрина, оказываемого МРТР, путем его снижения на 80% менее чем за 4 ч. Это согласуется с временем максимального эффекта ФБН. ТМПО в концентрации 0,1 мМ (в противоположность ФБН) обладает незначительным эффектом на индуцированное МРТР повышение уровня норэпинефрина в течение 3 ч, но всетаки снижает уровень норэпинефрина до базового значения через 13 ч. Таблица 5 Средние значения концентраций норэпинефрина в головном мозге (мкМ) относительно времени Часы 0 3 12 36 Физиологич. раствор 3,067 2,508 2,069 2,644 МРТР 3,0673 3,3134 3,049 2,889 0,1 ТМПО 2,260 1,829 1,367 1,800 0,1 ТМПО+МРТР 2,260 3,051 2,013 1,488 0,25 ТМПО 3,541 1,947 1,810 1,638 0,25 ТМПО+МРТР 3,541 2,309 2,125 1,700 1,0 ТМПО 3,873 6,235 5,269 4,302 1,0 ТМПО+МРТР 3,873 1,873 1,992 1,695 0,18 ФБН 2,379 1,519 2,124 1,598 0,18 ФБН+МРТР 2,379 2,010 2,536 2,567 1,7 ФБН 1,360 1,594 1,989 2,428 1,7 ФБН+МРТР 1,360 1,622 1,183 0,230 МРТР - в дозе 40 мг/кг, ТМПО и ФБН в миллимолярных концентрациях, n=6/среднее значение Уровни серотонина у животных, леченных МРТР, ТМПО и ФБН. ФБН в низкой и высокой дозах в комбинации с МРТР не имеет защитного действия против МРТР-индуцированного повышения уровня серотонина. Аналогичным образом ТМПО не обладает защитным эффектом в низкой или высокой дозах. Таблица 6 Средние значения концентраций серотонина в головном мозге (мкМ) относительно времени Часы 0 3 12 36 Физиологич. раствор 9,479 12,183 8,010 11,339 МРТР 9,479 19,436 16,321 14,749 0,1 ТМПО 8,954 7,322 6,507 13,571 0,1 ТМПО+МРТР 8,954 17,775 17,279 15,579 0,25 ТМПО 7,178 7,406 5,203 7,062 0,25 ТМПО+МРТР 7,178 14,973 15,151 16,478 1,0 ТМПО 9,617 12,289 6,936 5,874 1,0 ТМПО+МРТР 9,617 8,036 4,386 4,548 0,18 ФБН 7,494 8,736 11,364 8,153 0,18 ФБН+МРТР 7,494 14,086 16,728 16,269 1,7 ФБН 1,704 6,408 8,814 7,254 1,7 ФБН+МРТР 1,704 16,838 15,290 17,084 32 МРТР - в дозе 40 мг/кг, ТМПО и ФБН в миллимолярных концентрациях, n=6/среднее значение Уровни эпинефрина у животных, леченных МРТР, ТМПО и ФБН. Повышенные дозы ФБН и ТМПО имеют аддитивный эффект с МРТР при снижении уровня эпинефрина в течение 4 и 37 ч. Более низкие дозы ФБН и ТМПО минимизируют МРТР-индуцированную потерю эпинефрина. Несмотря на то, что МРТР повышает уровень норэпинефрина в течение первых 12 ч, уровни эпинефрина снижаются с началом воздействия МРТР. Данный результат предполагает, что при воздействии МРТР имеется больше предшественника норэпинефрина. Однако гибель клеток также имеет место, и уровни эпинефрина снижаются МРТР в виде монокомпонента и МРТР в комбинации с ТМПО и ФБН в более позднее время. Таблица 7 Средние значения концентраций эпинефрина в головном мозге (мкМ) относительно времени Часы 0 3 12 36 Физиологич. раствор 12,996 9,466 10,315 8,807 МРТР 12,996 8,953 7,389 6,367 0,1 ТМПО 10,687 9,059 8,268 10,610 0,1 ТМПО+МРТР 10,687 10,183 10,342 9,308 0,25 ТМПО 10,868 9,245 7,167 6,532 0,25 ТМПО+МРТР 10,868 8,639 6,587 6,904 1,0 ТМПО 9,779 12,043 6,379 3,206 1,0 ТМПО+МРТР 9,779 12,631 6,881 8,034 0,18 ФБН 9,775 7,390 10,330 8,036 0,18 ФБН+МРТР 9,775 7,904 8,348 11,283 1,7 ФБН 7,186 7,155 8,521 8,607 1,7 ФБН+МРТР 7,186 5,880 8,607 2,198 МРТР - в дозе 40 мг/кг, ТМПО и ФБН в миллимолярных концентрациях, n=6/среднее значение Эффекты ФБН в тестированных дозах являются острыми и кратковременными. Эффекты ТМПО появляются в более позднее время, чем эффекты ФБН, но сохраняются в течение эксперимента. Действие ТМПО или ФБН, повидимому, не различается. Связанные с временем различия могут отражать разные фармакокинетические характеристики двух соединений с различными гидрофильными и липофильными свойствами. В общем, понятно, что ТМПО и МРТР имеют существенные эффекты приблизительно в течение 12 ч, тогда как ФБН имеет заметные эффекты на уровни нейрамина в течение 1-4 ч. Снижение уровня допамина является доза-зависимым для ТМПО, а ФБН не снижает допамин ниже базового уровня в более позднее время. Антагонистический эффект в отношении МРТР-индуцированного повышения уровней норэпинефрина является очевидным при низких 33 дозах обоих соединений, особенно для ФБН. Это еще раз подчеркивает важность мобилизации меди при индукции паркинсонизма в помощью МРТР. Обсуждение Тетрамины. Уровни допамина в головном мозге являются уязвимыми для многих нейротоксинов и ксенобиотиков. Их успешная защита 2,3,2 тетрамином in vivo представляет направление терапии при болезни Паркинсона и деменциях,включающих аналогичные патогенетические события. Неспособность хелаторов железа, пеницилламина, антиоксидантов предупреждать потерю допамина и повреждения, наносимые МРТР, указывает на то, что данное семейство соединений имеет уникальный профиль действия, такой как имитация эндогенного полиамина, предупреждение повреждений ДНК, изменение агонизма в отношении НМДА и мускариновых холинергических участков, индукция факторов роста, индукция металлотионеина,антагонизм в отношении поглощения клеткой ксенобиотиков, ингибирование протеинкиназы С, связывание с глутатионом, перераспределение металлов между разными пулами запаса и уровнями свободных металлов в цитозоле, снижение активностей преаспартатпротеаз, аминооксидазы, моноаминоксидазы и супероксиддисмутазы. Распространение металлов и окислительно-восстановительное состояние. Проникновение и выведение железа из нейронов зависит от рецепторов трансферрина,которые могут препятствовать выведению избытка железа, когда железо высвобождается из внутриклеточных участков. 2,3,2-Тетрамин не приводил к значительному изменению суммарных уровней железа, меди или марганца в головном мозге. Нагрузка медью, которая вызывала заметные изменения в пигментации и поведении, и десфероксамин также не изменяли суммарных уровней железа, меди и марганца в головном мозге. Простое хелатирование не является эффективным в модели с использованием МРТР и в действительности усиливает повреждение в случае тиолов, таких как пеницилламин, посредством действия как восстанавливающие агенты и в случае десфероксамина и СР 49 посредством замещения металлов. В работе Barbeau A. и соавт. аналогично отмечено, что десфероксамин и пеницилламин были нейротоксичными при введении в виде монокомпонента и в комбинации с МРТР. В частности,усиление повреждения восстанавливающими агентами и спин-ловушками, которые захватывают органические радикалы и металлы, поддерживает данные о том, что снижение абсолютных уровней металлов и сдвиг из окисленных состояний в восстановленные нарушает гомеостаз больше, чем крайние степени окисления или восстановления, присутствующие при 34 нормальном состоянии клетки. Рецептор НМДА активируется в восстановленном состоянии. Таким образом, окислительно-восстановительный гомеостаз более уместен при профилактике повреждения, чем предупреждение окислительных состояний. 2,3,2-тетрамин в модели с использованием МРТР обладает эффектом в отношении непосредственного повреждения, вызываемого МРТР, с полной защитой допамина в течение начальных часов. Таким образом эффект 2,3,2-тетрамина на стерическую защиту ДНК от органических молекул, на рецептор НМДА, на блокирование поглощения ксенобиотиков и защиту глутатиона представляют собой основные аспекты его действия в отличие от более длительного действия хелатов, которые снижают уровни металлов в течение дней и недель. Кроме того, выведение железа и цинка может быть благоприятным при лечении болезни Паркинсона, болезни Альцгеймера и болезни Луи Гехрига, учитывая избыток железа в головном мозге, пораженном болезнью Паркинсона,и избыток железа и цинка в головном мозге,пораженном болезнью Альцгеймера, и их потенциальные роли в активации преаспартатпротеаз. Удаление кобальта, ртути, никеля, свинца,если они присутствуют в избытке, может быть полезным. Учитывая, что уровни меди в тканях,по-видимому, снижаются вследствие потери в спинно-мозговой жидкости, ее удаление из головного мозга не обязательно должно быть частью терапии. Общий эффект 2,3,2-тетрамина на уровень двухвалентного металла в субклеточной области определяют по комбинации его эффектов на транспорт металла в ткань и из нее,индукцию металлотионеина и по эффекту в отношении других металлов, которые могли бы вытеснить данный металл из связанных участков.L-Dopa-заместительная терапия. Клиническое лечение паркинсонизма фокусируется на замещении недостаточных уровней допамина путем введения предшественникаdopa. Хотя теоретически это просто, на относительную терапевтическую эффективность Ldopa-терапии при болезни Паркинсона может оказывать воздействие ранее существующий повышенный круговорот допамина в жизнеспособных нейронах, роль dopa в качестве субстрата в формировании пигмента и активность dopa в качестве хелатора или транслокатора металла. Более того, индоламины головного мозга имеют пониженный уровень в некоторых случаях болезни Паркинсона, как было показано в данном контексте на данной модели с использованием МРТР через 48 ч и позднее. Металл-зависимость образования аминов и ферментов деградации. Было показано, что МРТР снижает уровень допамина при повышении уровней серотонина и норэпинефрина. Восстановленное железо является фактором, лимитирующим скорость реакции тирозингидролазы, а медь является неэф 35 фективной (см. работу Fitzpatrick P.F.). Четыре человеческих изоформы фермента нуждаются в восстановленном железе в качестве катализатора и ингибируются никелем (см. работу HaavikJ. и соавт.). Оба фермента, тирозингидролаза и триптофангидролаза, активируются двустадийным способом кальций кальмодулин-зависимой протеинкиназой II (см. работу Hamon и соавт.) и белком-активатором I4-3-3 (см. работу Ichimura Т. и соавт.). Однако кальций-зависимая протеинкиназа представляется значительно более эффективной при активации триптофангидролазы, чем тирозингидролазы хвостатого тела человека (см. работу Rausch W.D. и соавт.). Двухвалентное железо или кальций активируют триптофангидролазу, но медь не активирует (см. работу Imai Y. и соавт.), тогда как кальций кальмодулин только просто повышает активность тирозингидролазы (см. работу RauschW.D. и соавт.). Допамин -гидролаза является особенно медь-зависимой, поскольку четыре имидазольных лиганда, связывающие медь, были продемонстрированы с помощью импульсного электронного парамагнитного резонанса (см. работу McCracken J. и соавт.). Во время каталитической реакции оба атома меди в субъединице подвергаются восстановлению и вторичному окислению с образованием промежуточного соединения гидропероксида меди (см. работуBarbeau и Ekstrom для МРТР и его свободнорадикальных продуктов MPDP+ и МРР+, являются результатом мобилизации меди и удаления железа из различных субклеточных участков. Взаимодействия органических радикалов с металлами. Ожидаемое поведение ТМПО при окислении восстановленных металлов включало бы снижение активностей железо- и медьзависимых ферментов, что в действительности наблюдается при пониженных уровнях допамина, норэпинефрина и серотонина. Интересно,что ФБН обладает эффектами, подобными эффектам ТМПО, что указывает на перекрывающуюся химическую активность. ТМПО и ФБН в комбинации с МРТР являлись антагонистами медь-зависимого эффекта в отношении допамин-гидролазы и не оказывали антагонистического действия при МРТР-индуцированном повышении активности триптофангидроксилазы. Неспособность ТМПО и ФБН при совместном введении с МРТР снижать уровень серотонина,вероятно, связано с отсутствием у них эффекта в отношении свободного кальция, на который все-таки влияет МРТР. Вследствие металлзависимости реакций, при которых образуются данные нейрамины, представляется вероятным,что МРТР мобилизует медь и кальций и удаляет железо. Данные аналогии между действием МРТР, ТМПО и ФБН согласуются с получен 004400 36 ными на основании данных in vitro выводами о том, что МРТР и МРР+ представляют собой восстанавливающие агенты. Программа продолжения исследований Терапевтический аспект. Проводятся исследования полиаминовых соединений нижеприведенной общей формулы и их производных на маленьких животных и млекопитающих.[X-[(CHY)n-NH]n-CH2-X]s,где n представлено целым числом от 1 до 7,концевые аминогруппы могут быть замещены Х и метиленовые группы замещены Y, a S, если присутствует, приводит к образованию соли соединения. Разветвленные алифатические соединения,приведенные в качестве примеров, являются более растворимыми в липидах. Некоторые линейные и разветвленные алифатические соединения, приведенные в качестве примеров, ингибируют орнитиндекарбоксилазу, снижают синтез эндогенных полиаминов и таким образом не являются оптимальными соединениями. Примеры тетраминов, такие как 2,3,2-тетрамин, готовят в виде солей,(СlO4) и (SO4)2. Сравнение действия полиаминов 2,3,2 тетрамина, 2,2,2-тетрамина, 3,3,3-тетрамина,циклама, tet а в качестве терапевтических соединений на моделях на животных и в последующих клинических испытаниях будут проведены на пациентах с болезнью Паркинсона, бо 37 лезнью Альцгеймера, деменцией ГуаманаПаркинсона, боковым амиотрофическим склерозом, оливопонтоцеребеллярной атрофией,наследственным внутримозговым кровоизлиянием голландского типа, а также болезнью Баттена, болезнью Бинсвангера и амилоидной ангиопатией. В 2,2,2-тетрамине и 3,3,3-тетрамине структура CuN4 деформирована в отличие от практически планарной структуры CuN4 2,3,2-тетрамина, 1,4,8,11-тетра-азоциклотетрадекана (циклама) и мезо-5,7,7,12,14,14-гексаметил-1,4,8,11 тетра-азоциклотетрадекана (tet а или мезо-1,7 СТН), 1,4,7,10-тетра-азоциклотетрадекана, 1,4,7,10-тетра-азоциклотридекана, 1,4,7-триазациклононана, 3-азапентан-1,5-диамина. Сравнения планарности и других конформационных деталей используют, чтобы получить представление об эффективности различных линейных, разветвленных и циклических полиаминов в качестве агентов для удаления меди, агентов для транслокации металлов из областей запаса и оценки их эффектов в отношении индукции металлотионеина, ингибирования протеинкиназы С, действия рецептора НМДА и ограничения повреждения ДНК. Далее представлены примеры линейных,разветвленных и циклических полиаминов для сравнительных исследований. Нециклические тетрамины включают 3,3',3"-триаминотрипропиламин (tpt),N,N'-ди(3-aминoпpoпил)пpoпилeндиaмин(2,3,2-tet). Циклические тетрамины включают производные 1,4,8,11-тетра-азоциклотетрадекана(циклама), мезо-5,7,7,12,14,14-гексаметил-1,4,8,11-тетра-азоциклотетрадекана (tet а или мезо 1,7-СТН), 1,4,7,10-тетра-азоциклотетрадекана,1,4,7,10-тетра-азоциклотридекана, 1,4,7-триазациклононана, 3-азапентан-1,5-диамина. Полиэтиленовые полиамины имеют общую формулу NH2(CH2CH2NH)nH, где n лежит в интервале между 1 и 5, включая диэтилентриамин, триэтилентетрамин, тетраэтиленпентамин,пентаэтиленгексамин и гексаэтиленгептамин,пропандиамин, аминопропилэтилендиамин, бисаминопропилэтилендиамин, гексаметилендиамин, моно- или диэтаноламин и аминоэтилэтаноламин. Циклические полиэтиленполиамины включают пропилен-связанные триэтилентетрамин-тетраэтиленпентамин,аминоэтилпиперазин,диэтилентриамин-триэтилентетрамин,тетраэтиленпентамин,аминоэтилпиперазин-триэтилентетрамин,аминоэтилпиперазинтетраэтиленпентамин, 004400 38 диэтилентриамин-аминопропилированный триэтилентетрамин,триэтилентетрамин,диэтилентетрамин. Исследование соединений других семейств при деменциях в связи с аналогичными и противоположными биологическими активностями также является уместным: хелаты имидазолполициклического иминоизоиндолина, алкиламиноэфиры фосфорной кислоты, диамиды аминокислот, гидроксамовые кислоты, Nкарбоксиметил-N-(гидроксибензил)аспарагиновые кислоты, N,N-фторированные бисацилгидразиды и тетракисацилгидразиды, а также разветвленные соединения вышеозначенных семейств. Диагностические тесты Анализ повреждения митохондриальной ДНК при болезни Паркинсона и болезни Альцгеймера с использованием лейкоцитов и мочи. Анализ эндогенных полиаминов при болезни Паркинсона, и болезни Альцгеймера, и болезни Пика с использованием мочи и спинномозговой жидкости. Анализ пептидов энкефалина и цитокрофина в спинно-мозговой жидкости пациентов с болезнью Паркинсона, и болезнью Альцгеймера. Заключение Таким образом, 2,3,2-тетрамин и близкие по активности соединения могут обеспечить последовательную методологию диагностики и лечения болезни Паркинсона, болезни Альцгеймера, деменции Гуамана-Паркинсона, бокового амиотрофического склероза, оливопонтоцеребеллярной атрофии, наследственного внутримозгового кровоизлияния голландского типа,болезни Баттена, нервного компонента болезни Бинсвангера и амилоидной ангиопатии. Получены представления о том, почему определенные нейроны являются первичными мишенями при данных болезнях, механизме развития болезни Паркинсона в болезнь Альцгеймера, а также о том, как различные этиологические события определяют характер повреждения при болезни Паркинсона, и болезни Альцгеймера, и болезни Баттена относительно более поздних причин при боковом амиотрофическом склерозе,деменции ГуаманаПаркинсона, оливопонтоцеребеллярной атрофии, а также о стадиях, на которых можно использовать диагностические анализы и терапию. В частности, данные соединения имеют множественное действие на каскад событий,происходящий от повреждения ДНК до образования амилоида: а) конкурентное ингибирование поглощения ксенобиотиков на участке транспорта полиаминов, при котором данные органические молекулы являются причиной повреждения ДНК; б) ограничение повреждения митохондриальной ДНК посредством удаления свободных 39 ионов меди, железа и никеля в присутствии алифатического тетрамина; в) индукция транскрипции генов фактора роста нервов, мозгового нейротрофического фактора и нейротрофина-3; г) регуляция аффинности рецепторов НМДА и блокирование ионного канала МК 801; д) связывание и защита восстановленного глутатиона; е) поддержание гомеостаза окислительновосстановительной среды в головном мозге; ж) индукция металлотионеина; з) ингибирование протеинкиназы С; и) нетоксическое хелатирование двухвалентных металлов в головном мозге; к) регуляция активности преаспартатпротеаз; л) ингибирование супероксиддисмутазы,аминоксидазы, моноаминоксидазы В; м) регуляция уровней полиаминов в головном мозге при деменциях путем поддержания уровней эндогенных полиаминов. 40 внутрибрюшинной инъекцией указанному животному МРТР в однократной дозе 40 мг/кг. 5. Способ по п.4, отличающийся тем, что в качестве указанного эффективного количества выбирают однократную дозу 1,2 мМ. 6. Способ по п.1, отличающийся тем, что указанная доза содержит 2,3,2-тетрамин. 7. Способ по п.6, отличающийся тем, что указанное животное представлено Rаnа pipiens. 8. Способ по п.7, отличающийся тем, что симптомы указанных болезней индуцируют внутрибрюшинной инъекцией указанному животному МРТР в однократной дозе 40 мг/кг. 9. Способ по п.8, отличающийся тем, что в качестве указанного эффективного количества выбирают однократную дозу 1,2 мМ. 10. Способ по п.1, отличающийся тем, что если Y обозначает водород, то указанную концевую аминогруппу выбирают из группы, состоящей из заместителей, имеющих формулы ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения нейродегенеративных заболеваний, выбранных из группы, включающей болезни Паркинсона, Альцгеймера, Луи Гехрига, Бинсвангера и оливопонтоцеребеллярную атрофию у животного, с помощью полиамина путем стерической защиты ДНК, усиления транскрипции последовательностей факторов роста, регуляции рецептора НМДА и активности ионного канала МК 801 и других физиологических стабилизирующих явлений клеток головного мозга, отличающийся тем, что в качестве полиамина животному вводят эффективное количество полиамина, выбранного из группы,состоящей из циклических, линейных и разветвленных полиаминов, причем линейные полиамины представлены общей формулойX-[(CHY)n-NH]n-CH2-X,где Х - концевая аминогруппа, Y - водород или С 1-С 7 алкил, а n является целым числом от 1 до 7. 2. Способ по п.1, отличающийся тем, что указанные полиамины выбирают из группы,состоящей из 2,3,2-тетрамина, 2,2,2-тетрамина и 3,3,3-тетрамина. 3. Способ по п.2, отличающийся тем, что указанное животное представлено Rana pipiens. 4. Способ по п.1, отличающийся тем, что симптомы указанных болезней индуцируют где n представлено целым числом от 1 до 7. 11. Способ по п.1, отличающийся тем, чтоY означает С 1-С 7 алкил. 12. Способ по п.1, отличающийся тем, что если Y обозначает водород, то указанная общая формула дополнительно включает соль, которую выбирают из группы, содержащей анионы
МПК / Метки
МПК: A61P 25/16, A61K 31/132
Метки: нейродегенеративных, гехрига, атрофию, лечения, паркинсона, включающей, способ, группы, луи, бинсвангера, альцгеймера, выбранных, заболеваний, болезни, оливопонтоцеребеллярную, животного
Код ссылки
<a href="https://eas.patents.su/22-4400-sposob-lecheniya-nejjrodegenerativnyh-zabolevanijj-vybrannyh-iz-gruppy-vklyuchayushhejj-bolezni-parkinsona-alcgejjmera-lui-gehriga-binsvangera-i-olivopontocerebellyarnuyu-atrofiyu.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения нейродегенеративных заболеваний, выбранных из группы, включающей болезни паркинсона, альцгеймера, луи гехрига, бинсвангера и оливопонтоцеребеллярную атрофию у животного</a>
Предыдущий патент: Способ получения (+/-) 3 – (3,4 – дихлорфенил) – 2 – диметиламино-2 – метилпропан-1-ола или церикламина (inn)
Следующий патент: Терапевтическое применение т-вам(cd40l)-технологии для лечения заболеваний с участием клеток гладкой мускулатуры
Случайный патент: Антисмысловые олигонуклеотиды к ил-8 и рецептору ил-8 и способ лечения злокачественных опухолей.












