Производные бензимидазола, их получение и терапевтическое применение
Номер патента: 5950
Опубликовано: 25.08.2005
Авторы: Бишон Даниэль, Ван Дорсселер Вивиан, Барт Франсис, Болкениус Франк
Формула / Реферат
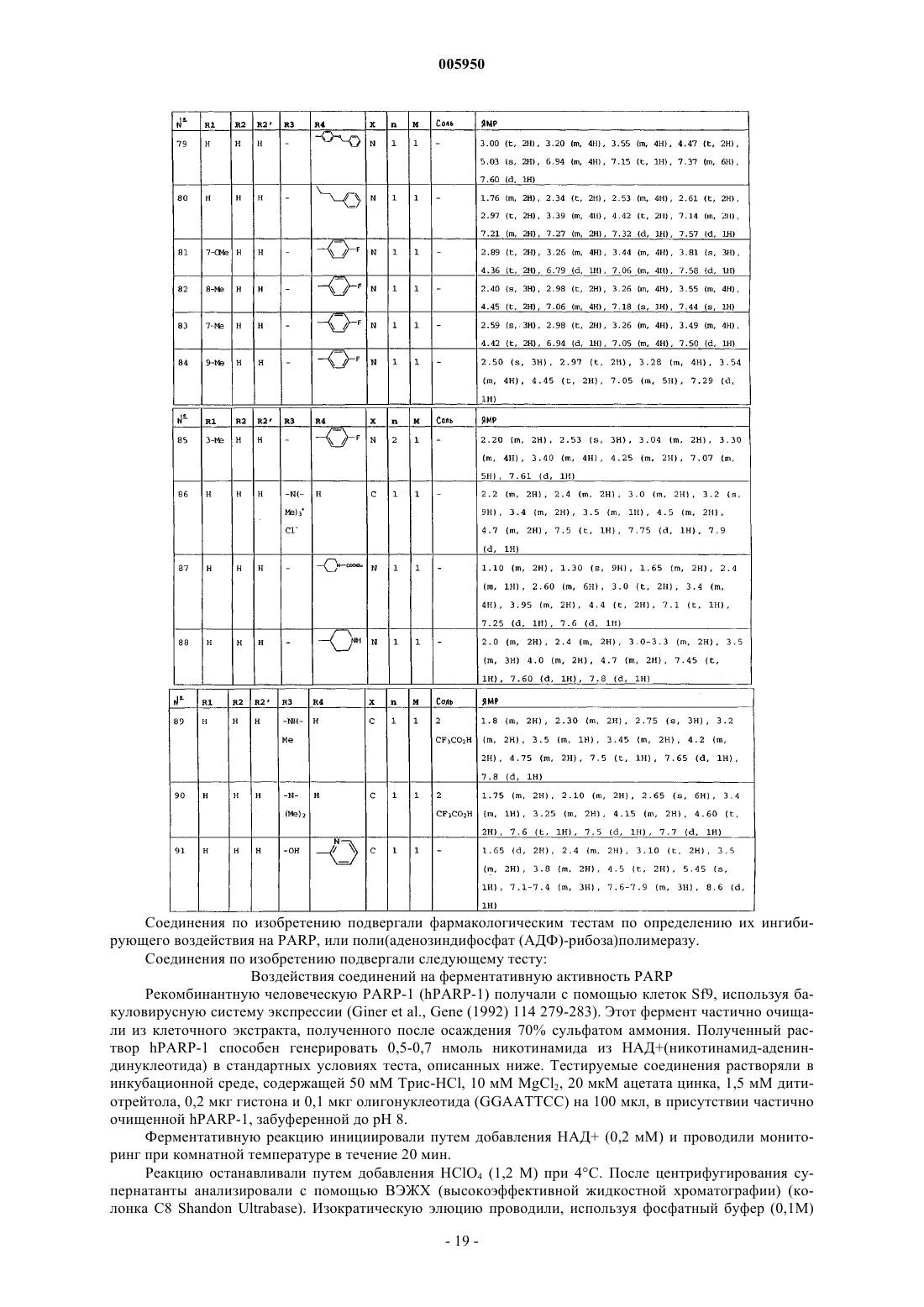
1. Соединения, соответствующие формуле (I)
в которой R1 представляет собой атом водорода, группу C1-C4алкил, атом галогена, нитрогруппу или группу C1-C4алкокси,
R2 и R2' независимо друг от друга представляют собой атом водорода или группу C1-C4алкил,
X представляет собой атом азота или атом углерода,
n равно 1 или 2,
m равно 1 или 2 и,
когда X представляет собой атом азота,
R3 представляет собой атом водорода или группу C1-C4алкил, давая соединения формулы (I), содержащие четвертичный аммоний, либо, альтернативно, не существует, давая соединения формулы (I), содержащие вторичный или третичный амин,
R4 представляет собой атом водорода,
группу C1-C6алкил,
группу C3-C7циклоалкил,
5- или 6-членную гетероциклоалкильную группу, содержащую атом азота в качестве гетероатома, возможно замещенную группой C1-C4алкил или группой -COOR, в которой R представляет собой группу C1-C6алкил,
группу -(CH2)p-гетероарил, в которой p может находиться в диапазоне от 0 до 4 и в которой группа гетероарил выбрана из групп пиридил, аминопиридил, пиримидинил, пиразинил, пиридазинил, имидазолил и тиенил, причем указанная группа гетероарил возможно замещена группой C1-C4алкил,
группу гетероарилкарбонил, причем группа гетероарил выбрана из групп фурил, пиридил, пиримидил, пиразинил, пиридазинил и имидазолил,
группу фенилкарбонил, причем группа фенил возможно замещена атомом галогена,
группу (C1-C6)алкилкарбонил,
группу -(CH2)pCOOR, в которой p может находиться в диапазоне от 0 до 4 и в которой R представляет собой группу C1-C6алкил,
группу фенилсульфонил, возможно замещенную на фенильном ядре атомом галогена, группой трифторметил, группой C1-C4алкил, нитрогруппой или группой C1-C4алкокси, или альтернативно
группу -(CH2)р-фенил, в которой р может находиться в диапазоне от 0 до 4 и в которой группа фенил возможно замещена группами в количестве от одной до трех, независимо друг от друга выбранными из группы C1-C4алкил, нитрогруппы, аминогруппы, гидроксильной группы, атома галогена, группы трифторметил, группы C1-C4алкокси, группы (C1-C4)алкоксифенил, группы C1-C4алкиламино, группы C1-C4диалкиламино, группы -NHCHO или группы -NHCOR', в которой R' представляет собой группу C1-C4алкокси или группу C1-C4алкил, причем эта группа C1-C4алкил возможно замещена группой диметиламино, и,
когда X представляет собой атом углерода,
R3 представляет собой атом водорода, группу -NR5R6, группу -N(R5)3+, группу -NHCOR7, группу -CONHR5, группу -COR7, группу -NHCONH2, группу -OH или группу -CH2OH,
R4 представляет собой
атом водорода,
группу -(CH2)p-фенил, в которой p может находиться в диапазоне от 0 до 4 и в которой группа фенил возможно замещена группами в количестве от одной до трех, независимо друг от друга выбранными из группы C1-C4алкил, нитрогруппы, аминогруппы, атома галогена, группы трифторметил или группы C1-C4алкокси,
группу -(CH2)p-гетероарил, в которой р может находиться в диапазоне от 0 до 4 и в которой группа гетероарил выбрана из группы пиридил, группы аминопиридил, группы пиримидинил, группы пиразинил или группы пиридазинил, или альтернативно
группу -(CH2)tNR7R8, в которой t равно 0 или 1,
при условии, что, когда R4 представляет собой группу -NR7R8, R3 является иным, чем группы -NR5R6, -NHCOR7, -NHCONH2 и -OH,
R5 и R6 независимо друг от друга представляют собой атом водорода или группу C1-C4алкил,
R7 и R8 независимо друг от друга представляют собой группу C1-C4алкил или C1-C4алкокси либо вместе образуют насыщенное 5-7-членное кольцо, возможно содержащее дополнительный атом азота, причем это кольцо возможно замещено на атоме углерода или на атоме азота, включая атом азота, к которому присоединены группы R7 и R8 с образованием четвертичного аммония, группой C1-C4алкил или группой -COOR", в которой R" представляет собой группу фенил или (C1-C4)алкилфенил,
в форме энантиомеров или диастереоизомеров либо смесей этих различных форм, включая рацемические смеси, а также в форме оснований или солей присоединения фармацевтически приемлемых кислот.
2. Соединения формулы (I) по п.1, отличающиеся тем, что
R1 представляетсобой атом водорода, группу C1-C4алкил или группу C1-C4алкокси,
R2 представляет собой атом водорода или группу C1-C4алкил,
R2' представляет собой атом водорода,
X представляет собой атом азота,
n равно 1 или 2,
m равно 1 или 2,
R3 представляет собой атом водорода, давая соединения формулы (I), содержащие четвертичный аммоний, либо, альтернативно, не существует, давая соединения формулы (I), содержащие вторичный или третичный амин,
R4 представляет собой
атом водорода,
группу C1-C6алкил,
группу C3-C7циклоалкил,
группу пиридил, пиримидинил или пиразинил, возможно замещенную группой C1-C4алкил,
группу гетероарилкарбонил, причем группа гетероарил выбрана из группы фурил и группы пиридил,
группу фенилкарбонил, причем группа фенил возможно замещена атомом галогена,
группу (C1-C6)алкилкарбонил,
группу -(CH2)PCOOR, в которой р может находиться в диапазоне от 0 до 4 и в которой R представляет собой группу C1-C6алкил,
группу фенилсульфонил,
группу фенил, замещенную группами в количестве от одной до трех, независимо друг от друга выбранными из группы C1-C4алкил, нитрогруппы, аминогруппы, гидроксильной группы, атома галогена, группы трифторметил, группы C1-C4алкокси, группы (C1-C4)алкоксифенил, группы (C1-C4)диалкиламино, группы -NHCHO или группы -NHCOR', в которой R' представляет собой группу C1-C4алкокси или группу C1-C4алкил, причем эта группа C1-C4алкил возможно замещена группой диметиламино,
группу -(CH2)p-фенил, в которой p может находиться в диапазоне от 0 до 4,
группу -(CH2)p-пиридил, в которой p может находиться в диапазоне от 0 до 4,
группу -(CH2)p-тиенил, в которой p может находиться в диапазоне от 0 до 4,
5- или 6-членную гетероциклоалкильную группу, содержащую атом азота в качестве гетероатома, возможно замещенную группой C1-C4алкил или группой -COOR, в которой R представляет собой группу C1-C6алкил
или альтернативно
R1 представляет собой атом водорода,
R2 и R2' независимо друг от друга представляют собой атом водорода или группу C1-C4алкил,
X представляет собой атом углерода,
n равно 1 или 2,
m равно 1,
R3 представляет собой атом водорода, группу -NR5R6, группу -N(R5)3+, группу -NHCOR7, группу -CONHR5, группу -NHCONH2, группу -OH или группу -CH2OH,
R4 представляет собой
атом водорода,
группу бензил,
группу фенил, возможно замещенную группами в количесттх от одной до трех, независимо друг от друга выбранными из группы C1-C4алкил, нитрогруппы, аминогруппы, атома галогена, группы трифторметил или группы C1-C4алкокси,
группу пиридил,
группу -NR7R8,
при условии, что, когда R4 представляет собой группу -NR7R8, R3 является иным, чем группы -NR5R6, -NHCOR7, -NHCONH2 и -OH,
R5 и R6 независимо друг от друга представляют собой атом водорода или группу C1-C4алкил,
R7 и R8 независимо друг от друга представляют собой группу C1-C4алкил или C1-C4алкокси либо вместе образуют насыщенное 5-7-членное кольцо, возможно содержащее дополнительный атом азота, причем это кольцо возможно замещено на атоме углерода или на атоме азота, включая атом азота, к которому присоединены группы R7 и R8 с образованием четвертичного аммония, группой C1-C4алкил или группой -COOR", в которой R" представляет собой группу фенил или (C1-C4)алкилфенил,
в форме энантиомеров или диастереоизомеров либо смесей этих различных форм, включая рацемические смеси, а также в форме оснований или солей присоединения фармацевтически приемлемых кислот.
3. Соединения формулы (I) по п.1 или 2, отличающиеся тем, что
R1 представляет собой атом водорода, группу метил или группу метокси,
R2 представляет собой атом водорода или группу метил,
R2' представляет собой атом водорода,
X представляет собой атом азота,
n равно 1 или 2,
m равно 1 или 2,
R3 представляет собой атом водорода давая соединения формулы (I), содержащие четвертичный аммоний, либо, альтернативно, не существует давая соединения формулы (I), содержащие вторичный или третичный амин,
R4 представляет собой
атом водорода,
группу C1-C4алкил,
группу C6-C7циклоалкил,
группу пиридил, пиримидинил или пиразинил, возможно замещенную группой C1-C4алкил,
группу гетероарилкарбонил, причем группа гетероарил выбрана из группы фурил и группы пиридил,
группу фенилкарбонил, причем группа фенил возможно замещена атомом галогена,
группу (C3-C5)алкилкарбонил,
группу -(CH2)PCOOR, в которой р равно 0 или 1 и в которой R представляет собой группу C1-C4алкил,
группу фенилсульфонил,
группу фенил, замещенную группами в количестве от одной до трех, независимо друг от друга выбранными из группы метил, нитрогруппы, аминогруппы, гидроксильной группы, атома галогена, группы трифторметил, группы метокси, группы (C1-C4)алкоксифенил, группы диметиламино, группы -NHCHO или группы -NHCOR1, в которой R' представляет собой группу C1-C4алкокси или группу C1-C4алкил, причем эта группа C1-C4алкил возможно замещена группой диметиламино,
группу -(CH2)p-фенил, в которой p равно 1, 2, 3 или 4,
группу -(CH2)p-пиридил, в которой p может находиться в диапазоне от 1 до 3,
группу -(CH2)p-тиенил, в которой p равно 2,
6-членную гетероциклоалкильную группу, содержащую атом азота в качестве гетероатома, возможно замещенную группой метил или группой -COOR, в которой R представляет собой группу C1-C4алкил,
или альтернативно:
R1 представляет собой атом водорода,
R2 и R2' независимо друг от друга представляют собой атом водорода или группу метил,
X представляет собой атом углерода,
n равно 1 или 2,
m равно 1,
R3 представляет собой атом водорода, группу -NR5R6, группу -N(CH3)3+, группу -NHCOR7, группу -CONHR5, группу -NHCONH2, группу -OH или группу -CH2OH,
R4 представляет собой
атом водорода,
группу бензил,
группу фенил, возможно замещенную группами в количестве от одной до трех, независимо друг от друга выбранными из атома галогена и группы трифторметил,
группу пиридил,
группу -NR7R8,
при условии, что, когда R4 представляет собой группу -NR7R8, R3 является иным, чем группы -NR5R6, -NHCOR7, -NHCONH2 и -OH,
R5 и R6 независимо друг от друга представляют собой атом водорода или группу C1-C4алкил,
R7 и R8 независимо друг от друга представляют собой группу C1-C4алкил либо вместе образуют насыщенное 5-7-членное кольцо, возможно содержащее дополнительный атом азота, причем это кольцо возможно замещено на атоме углерода или на атоме азота, включая атом азота, к которому присоединены группы R7 и R8 с образованием четвертичного аммония, группой метил или группой -COOR", в которой R" представляет собой группу (C1-C4)алкилфенил,
в форме энантиомеров или диастереоизомеров либо смесей этих различных форм, включая рацемические смеси, а также в форме оснований или солей присоединения фармацевтически приемлемых кислот.
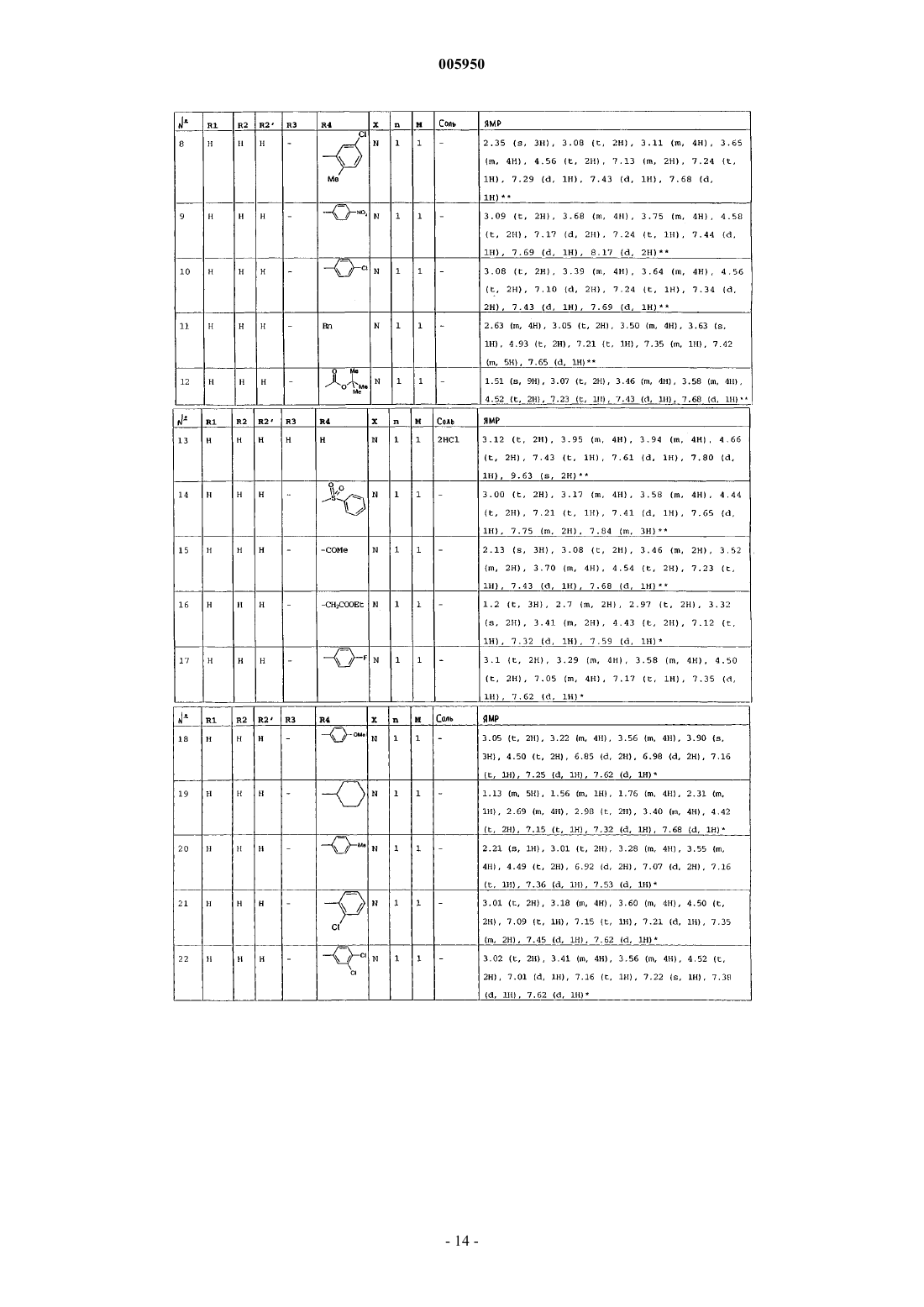
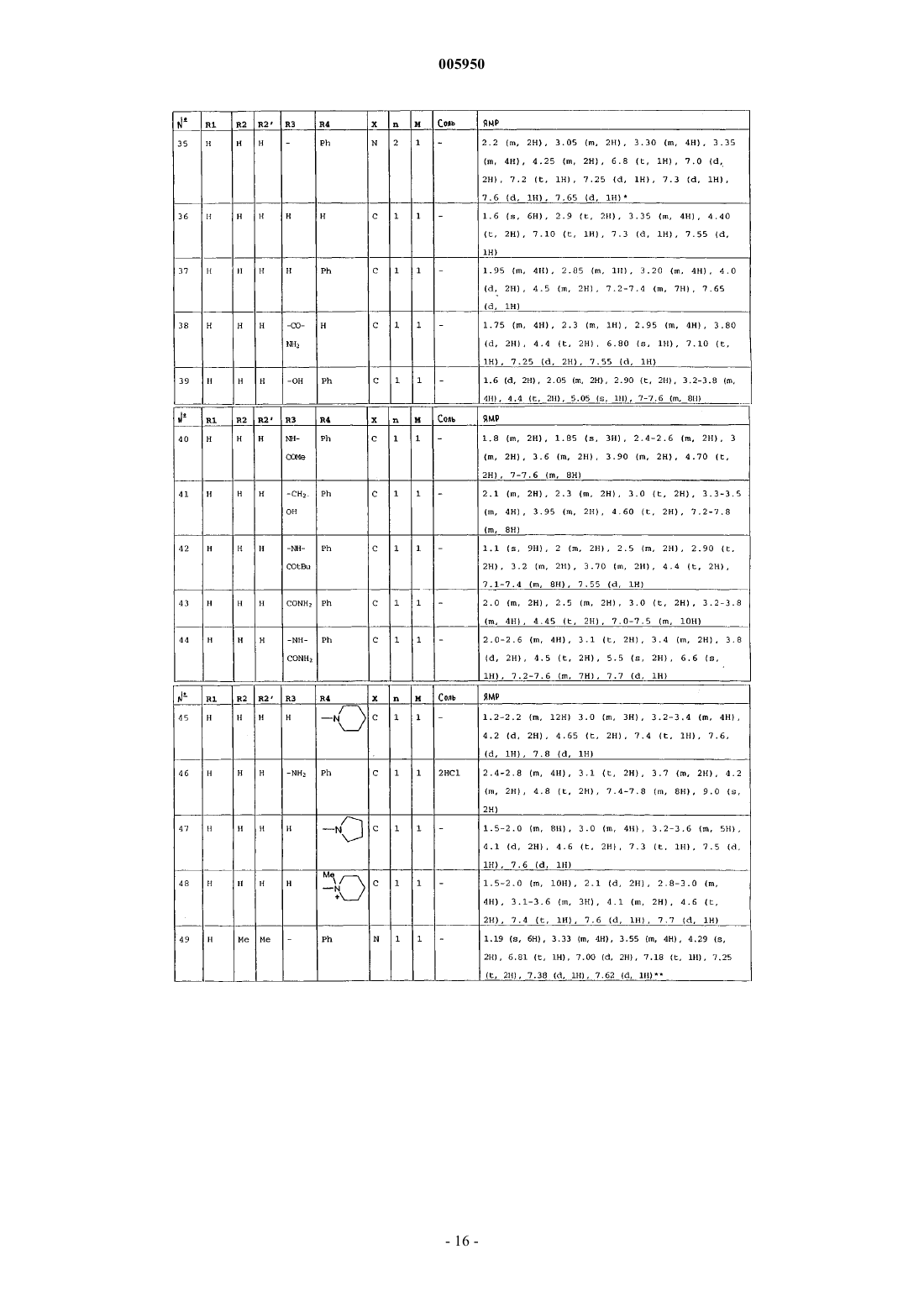
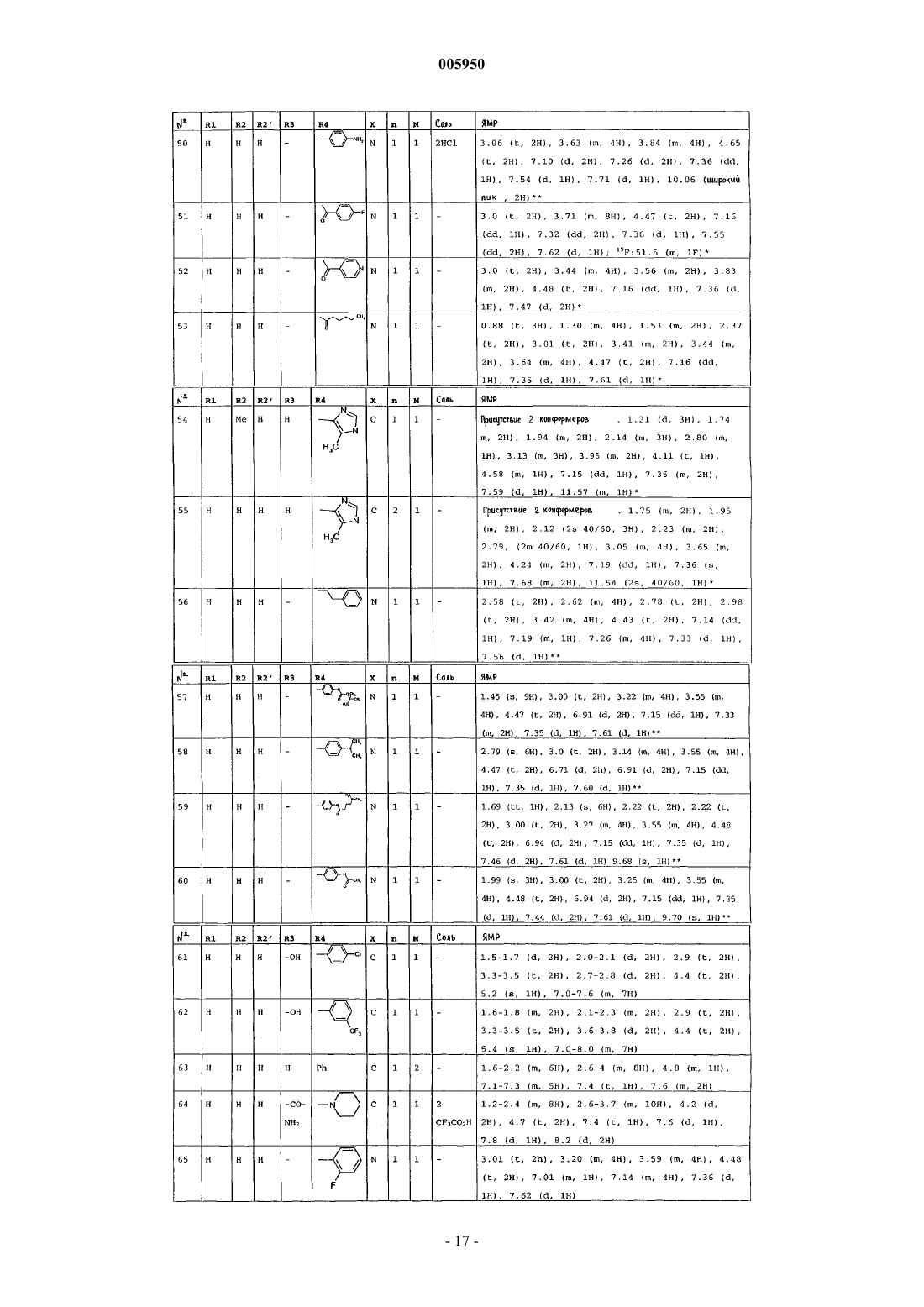
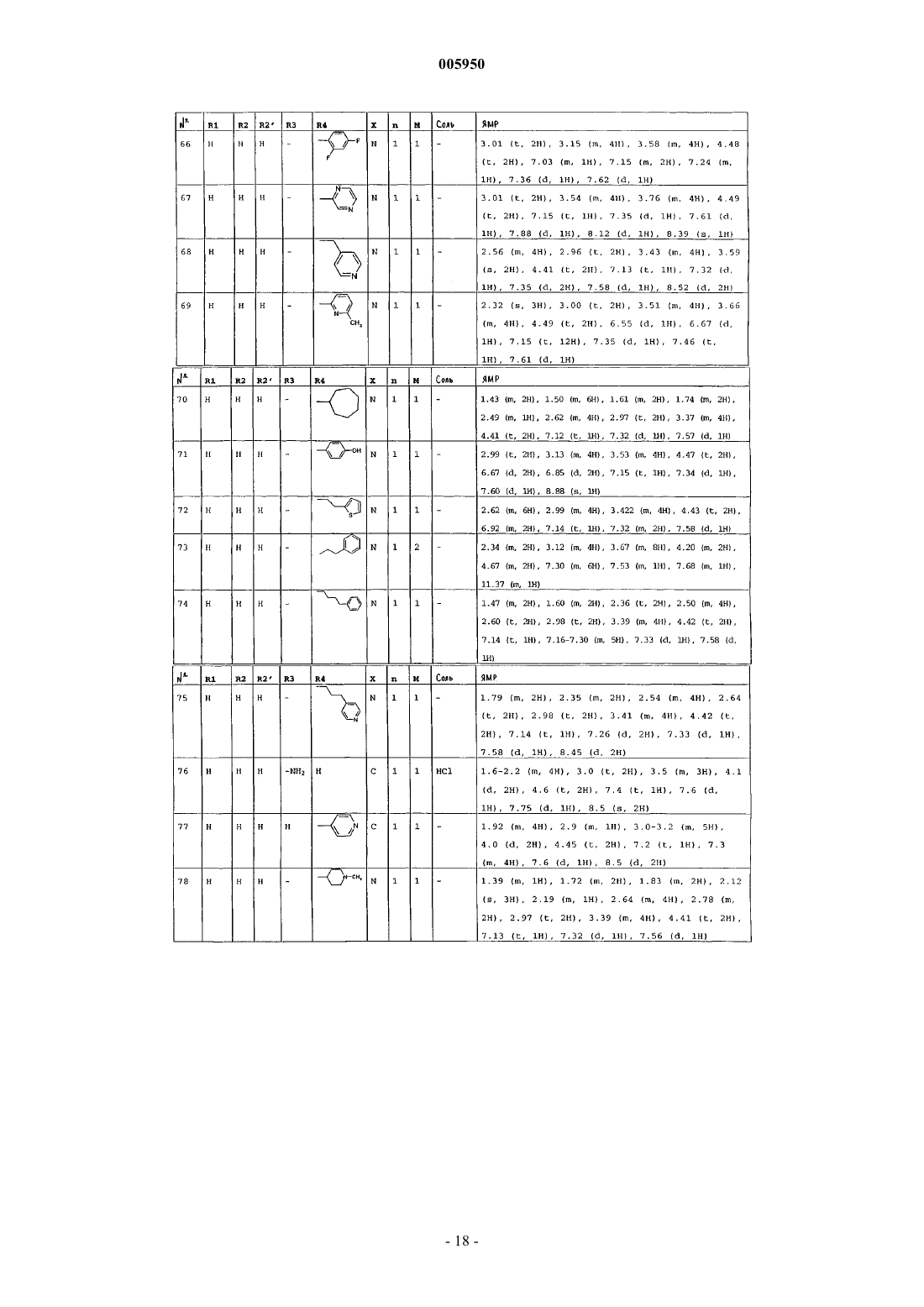
4. Соединения формулы (I) по пп.1-3, которые выбраны из группы, состоящей из
1-(6-оксо-5,6-дигидро-4H-имидазо[4,5,1-ij]хинолин-2-ил)-4-пиперидинопиперидина,
1-метил-1-[1-(6-оксо-5,6-дигидро-4H-имидазо[4,5,1-ij]хинолин-2-ил)-4-пиперидинил]пиперидина,
2-[4-(4-диметиламинофенил)пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,
2-[4-(4-трет-бутоксикарбониламинофенил)пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,
2-[4-(4-аминофенил)пиперазин-1-ил]-4,5-дигидро-4H-имидазо[4,5,1-ij]хинолин-6-она,
2-[4-(4-ацетамидофенил)пиперазин-1-ил]-4,5-дигидро-4H-имидазо[4,5,1-ij]хинолин-6-она,
2-(4-н-пропилпиперазин-1-ил)-4,5-дигидро-4H-имидазо[4,5,1-ij]хинолин-6-она,
2-(4-трет-бутоксикарбонилпиперазин-1-ил)-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,
2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,
2-(4-ацетилпиперазин-1-ил)-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,
2-[4-(4-пиридил)пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,
2-(4-бензилпиперидин-1-ил)-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,
1-(6-оксо-5,6-дигидро-4H-имидазо[4,5,1-ij]хинолин-2-ил)-4-фенил-4-пиперидинкарбоксамида,
1-(6-оксо-5,6-дигидро-4H-имидазо[4,5,1-ij]хинолин-2-ил)-4-фенил-4-аминопиперидина,
2-[4-(4-гидроксифенил)пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,
2-[4-(4-фторфенил)пиперазин-1-ил]-4,5-дигидро-9-метилимидазо[4,5,1-ij]хинолин-6-она,
1-[4-(4-фторфенил)пиперазин-1-ил]-3-метил-8,9-дигидро-7H-2,9a-диазабензо[cd]азулен-6-она,
2-[4-(4-фторфенил)пиперазин-1-ил]-4,5-дигидро-7-метилимидазо[4,5,1-ij]хинолин-6-она,
2-[4-(4-фторфенил)пиперазин-1-ил]-4,5-дигидро-8-метилимидазо[4,5,1-ij]хинолин-6-она,
2-[4-(4-фторфенил)пиперазин-1-ил]-4,5-дигидро-7-метоксиимидазо[4,5,1-ij]хинолин-6-она,
2-[4-(4-метоксифенил)пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,
1-(6-оксо-5,6-дигидро-4H-имидазо[4,5,1-ij]хинолин-2-ил)-4H-4-диметиламинопиперидина,
в форме энантиомеров или диастереизомеров или смесей этих различных форм, включая рацемические смеси, а также в форме оснований или солей присоединения фармацевтически приемлемых кислот.
5. Способ получения соединения формулы (I) по любому из пп.1-4, отличающийся тем, что производное формулы (II)

в котором R1, R2, R2' и n являются такими, как определено в п.1, а A представляет собой уходящую группу, подвергают реакции в присутствии амина формулы (III)
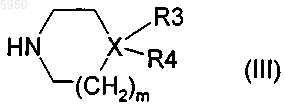
в котором X, R3, R4 и m являются такими, как определено в п.1, в растворителе, который может представлять собой спирт, простой эфир или углеводород, с получением соединения формулы (I) по п.1, причем данную реакцию можно проводить в присутствии основания, в присутствии галогенидов щелочных металлов илш т присутствии катализаторов на основе палладия или на основе никеля.
6. Соединения формулы (II), как они определены в п.5, которые полезны в качестве синтетических промежуточных соединений.
7. Лекарственный продукт, обладающий ингибирующей активностью в отношении PARP, отличающийся тем, что он содержит соединение формулы (I) по любому из пп.1-4.
8. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении PARP, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-4, а также один или более чем один подходящий фармацевтический эксципиент.
9. Применение соединения формулы (I) по любому из пп.1-4 для приготовления лекарственного продукта для предупреждения или лечения расстройств, в которые вовлечен фермент поли(АДФ-рибоза)полимераза.
10. Применение соединения формулы (I) по любому из пп.1-4 для приготовления лекарственного продукта для предупреждения или лечения инфаркта миокарда, ишемии сердца, сердечной недостаточности, атеросклероза, рестеноза после чрескожной катетерной коронаропластики или шунтирования, церебральной ишемии и церебрального инфаркта, вызванного ишемией, травмой или тромбоэмболией, нейродегенеративных заболеваний, таких как болезнь Паркинсона, болезнь Альцгеймера и хорея Хантингтона, острой почечной недостаточности, в частности, ишемического происхождения или возникающей после трансплантации почки, трансплантации сердца: лечения отторжения трансплантата и ускоренного атеросклероза трансплантатов, воспалительных патологий, иммунологических расстройств, ревматоидных заболеваний, диабета и панкреатита, септического шока, острого респираторного дистресс-синдрома, опухолей и метастазов, аутоиммунных заболеваний, синдрома приобретенного иммунодефицита (СПИДа), гепатита, псориаза, васкулита, неспецифического язвенного колита, рассеянного склероза и миастении.
11. Применение соединений формулы (I) по п.1, в которых R1=R2=R2'=R3=H, X=C, n=m=1 и R4 представляет собой либо группу 4-имидазолил, либо группу 5-метил-4-имидазолил, для изготовления лекарственного продукта для лечения или предупреждения расстройств, в которые вовлечен фермент поли(АДФ-рибоза)полимераза.
Текст
005950 Настоящее изобретение относится к производным бензимидазола, их получению и терапевтическому применению. Настоящее изобретение относится к соединениям, соответствующим формуле (I)R1 представляет собой атом водорода, группу С 1-С 4 алкил, атом галогена, нитрогруппу или группу С 1-С 4 алкокси,R2 и R2' независимо друг от друга представляют собой атом водорода или группу С 1-С 4aлкил,X представляет собой атом азота или атом углерода,n равно 1 или 2,m равно 1 или 2,и, когда X представляет собой атом азота,R3 представляет собой атом водорода или группу С 1-С 4 алкил, давая соединения формулы (I), содержащие четвертичный аммоний, либо, альтернативно, не существует давая соединения формулы (I),содержащие вторичный или третичный амин,R4 представляет собой атом водорода,группу C1-C6 алкил,группу С 3-С 7 циклоалкил,группу (С 3-С 7)гетероциклоалкил, возможно замещенную группой С 1-С 4 алкил или группой -COOR,в которой R представляет собой группу C1-С 6 алкил,группу -(СН 2)р-гетероарил, в которой р может находиться в диапазоне от 0 до 4, и в которой группа гетероарил выбрана из групп пиридил, аминопиридил, пиримидинил, пиразинил, пиридазинил, имидазолил и тиенил, причем указанная группа гетероарил возможно замещена группой С 1-С 4 алкил,группу гетероарилкарбонил, причем группа гетероарил выбрана из групп фурил, пиридил, пиримидил, пиразинил, пиридазинил и имидазолил,группу фенилкарбонил, причем группа фенил возможно замещена атомом галогена,группу (С 1-С 6)алкилкарбонил,группу -(CH2)PCOOR, в которой р может находиться в диапазоне от 0 до 4 и в которой R представляет собой группу С 1-С 6 алкил,группу фенилсульфонил, возможно замещенную на фенильном ядре атомом галогена, группой трифторметил, группой С 1-С 4 алкил, нитрогруппой или группой С 1-С 4 алкокси, или альтернативно группу-(СН 2)р-фенил, в которой р может находиться в диапазоне от 0 до 4, и в которой группа фенил возможно замещена в орто- и/или мета- и/или пара-положении группами в количестве от одной до трех, независимо друг от друга выбранными из: группы С 1-С 4 алкил, нитрогруппы, аминогруппы, гидроксильной группы, атома галогена, группы трифторметил, группы С 1-С 4 алкокси, группы (С 1-С 4)алкоксифенил, группы(С 1-С 4)алкиламино, группы (C1-С 4)диалкиламино, группы -NHCHO или группы -NHCOR', в которой R' представляет собой группу С 1-С 4 алкокси или группу С 1-С 4 алкил, причем эта группа С 1-С 4 алкил возможно замещена группой диметиламино,и, когда X представляет собой атом углерода,R3 представляет собой атом водорода, группу -NR5R6, группу -N(R5)3+, группу -NHCOR7, группу-CONHR5, группу -COR7, группу -NHCONH2, группу -ОН или группу-СН 2 ОН,R4 представляет собой атом водорода,группу -(СН 2)р-фенил, в которой р может находиться в диапазоне от 0 до 4, и в которой группа фенил возможно замещена группами в количестве от одной до трех, независимо друг от друга выбранными из: группы С 1-С 4 алкил, нитрогруппы, аминогруппы, атома галогена, группы трифторметил или группы С 1-С 4 алкокси,группу -(СН 2)р-гетероарил, в которой р может находиться в диапазоне от 0 до 4, и в которой группа гетероарил выбрана из группы имидазолил, возможно замещенной группой С 1-С 4 алкил, группы пиридил,группы аминопиридил, группы пиримидинил, группы пиразинил или группы пиридазинил, или альтернативно группу -(CH2)tNR7R8, в которой t равно 0 или 1,при условии, что, когда R4 представляет собой группу -NR7R8, R3 является иным, чем группы-NR5R6, -NHCOR7, -NHCONH2 и -ОН,R5 и R6 независимо друг от друга представляют собой атом водорода или группу С 1-С 4 алкил,R7 и R8 независимо друг от друга представляют собой группу С 1-С 4 алкил или С 1-С 4 алкокси либо-1 005950 вместе образуют насыщенное 5-7-членное кольцо, возможно содержащее дополнительный атом азота, с образованием, например, группы 1-пиперидил, группы 1-пирролидинил или группы 1-пиперазинил, причем это кольцо возможно замещено на атоме углерода или на атоме азота, включая атом азота, к которому присоединены группы R7 и R8 с образованием четвертичного аммония, группой С 1-С 4 алкил или группой -COOR", в которой R" представляет собой группу фенил или (С 1-С 4)алкилфенил,за исключением двух соединений, для которых R1 = R2 = R2' = R3 = Н, X = С, n = m = 1 и R4 представляет собой либо группу 4-имидазолил, либо группу 5-метил-4-имидазолил. Эти два соединения раскрыты в патентной заявке ЕР 646583 как соединения 16 и 17 в таблице, как лиганды серотонинергических рецепторов типа 5-НТ 3 и 5-НТ 4. Соединения формулы (I) могут содержать один или более чем один асимметрический атом углерода. Таким образом, они могут существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры и диастереоизомеры, а также их смеси, включая рацемические смеси, составляют часть изобретения. Соединения по изобретению могут существовать в форме оснований или солей присоединения фармацевтически приемлемых кислот. Такие соли присоединения также составляют часть изобретения. Применительно к настоящему изобретению термин:- группа (Сq-Сr)алкил означает линейную или разветвленную насыщенную алифатическую группу, содержащую от q до r атомов углерода, причем q и r являются целыми числами; можно упомянуть, в частности, группы метил, этил, пропил, изопропил, н-пропил, бутил, изобутил, трет-бутил, н-бутил, пентил и так далее;- атом галогена означает фтор, хлор, бром или йод;- группа С 3-С 7 циклоалкил означает циклическую алкильную группу, содержащую от 3 до 7 атомов углерода; можно упомянуть, в частности, группы циклопропил, циклобутил, циклопентил, циклогексил и циклогептил;- группа С 3-С 7 гетероциклоалкил означает циклическую алкильную группу, содержащую от 3 до 7 атомов углерода, а также один или более чем один гетероатом, например атом азота; можно упомянуть, в частности, группу пиперидил;- группа (С 1-С 4)алкоксифенил означает группу формулы -О-(СН 2)Х-фенил, в которой х может находиться в диапазоне от 1 до 4. Среди соединений формулы (I), которые являются объектами настоящего изобретения, можно упомянуть предпочтительные соединения, для которыхR1 представляет собой атом водорода, группу С 1-С 4 алкил или группу C1-С 4 алкокси,R2 представляет собой атом водорода или группу С 1-С 4 алкил,R2' представляет собой атом водорода,X представляет собой атом азота,n равно 1 или 2,m равно 1 или 2,R3 представляет собой атом водорода давая соединения формулы (I), содержащие четвертичный аммоний, либо, альтернативно, не существует давая соединения формулы (I), содержащие вторичный или третичный амин,R4 представляет собой атом водорода,группу С 1-С 6 алкил,группу С 3-С 7 циклоалкил,группу пиридил, пиримидинил или пиразинил, возможно замещенную группой С 1-С 4 алкил,группу гетероарилкарбонил, причем группа гетероарил выбрана из группы фурил и группы пиридил,группу фенилкарбонил, причем группа фенил возможно замещена атомом галогена,группу (С 1-С 6)алкилкарбонил,группу -(CH2)pCOOR, в которой р может находиться в диапазоне от 0 до 4, и в которой R представляет собой группу С 1-С 6 алкил группу фенилсульфонил,группу фенил, замещенную группами в количестве от одной до трех, независимо друг от друга выбранными из: группы С 1-С 4 алкил, нитрогруппы, аминогруппы, гидроксильной группы, атома галогена,группы трифторметил, группы С 1-С 4 алкокси, группы (С 1-С 4)алкоксифенил, группы (C1-С 4)диалкиламино,группы -NHCHO или группы -NHCOR', в которой R' представляет собой группу С 1-С 4 алкокси или группу С 1-С 4 алкил, причем эта группа С 1-С 4 алкил возможно замещена группой диметиламино,группу -(СН 2)р-фенил, в которой р может находиться в диапазоне от 0 до 4,группу -(СН 2)р-пиридил, в которой р может находиться в диапазоне от 0 до 4,группу -(СН 2)р-тиенил, в которой р может находиться в диапазоне от 0 до 4,группу (С 3-С 7)гетероциклоалкил, возможно замещенную группой С 1-С 4 алкил или группой -COOR,в которой R представляет собой группу C1-C6aлкил,-2 005950 или альтернативно предпочтительные соединения, для которыхR1 представляет собой атом водорода,R2 и R2' независимо друг от друга представляют собой атом водорода или группу С 1-С 4 алкил,X представляет собой атом углерода,n равно 1 или 2,m равно 1,R3 представляет собой атом водорода, группу -NR5R6, группу -N(R5)3+, группу -NHCOR7, группу-CONHR5, группу -NHCONH2, группу -ОН или группу -СН 2 ОН,R4 представляет собой атом водорода,группу бензил (а именно группу -(СН 2)р-фенил, в которой р равно 1),группу фенил, возможно замещенную группами в количестве от одной до трех, независимо друг от друга выбранными из: группы С 1-С 4 алкил, нитрогруппы, аминогруппы, атома галогена, группы трифторметил или группы С 1-С 4aлкокси,группу гетероарил, выбранную из группы имидазолил, возможно замещенной группой С 1-С 4 алкил,или группы пиридил,группу -NR7R8,при условии, что, когда R4 представляет собой группу -NR7R8, R3 является иным, чем группы-NR5R6, -NHCOR7, -NHCONH2 и -ОН,R5 и R6 независимо друг от друга представляют собой атом водорода или группу С 1-С 4 алкил,R7 и R8 независимо друг от друга представляют собой группу С 1-С 4 алкил или С 1-С 4 алкокси либо вместе образуют насыщенное 5-7-членное кольцо, возможно содержащее дополнительный атом азота,причем это кольцо возможно замещено на атоме углерода или на атоме азота, включая атом азота, к которому присоединены группы R7 и R8 с образованием четвертичного аммония, группой С 1-С 4 алкил или группой -COOR", в которой R" представляет собой группу фенил или (С 1-С 4)алкилфенил,за исключением двух соединений, для которых R1 = R2 = R2' = R3 = Н, X = С, n = m = 1 и R4 представляет собой либо группу 4-имидазолил, либо группу 5-метил-4-имидазолил. Среди последних предпочтительных соединений наиболее особенно предпочтительными соединениями являются соединения формулы (I), для которыхR1 представляет собой атом водорода, группу метил или группу метокси,R2 представляет собой атом водорода или группу метил,R2' представляет собой атом водорода,X представляет собой атом азота,n равно 1 или 2,m равно 1 или 2,R3 представляет собой атом водорода давая соединения формулы (I), содержащие четвертичный аммоний, либо, альтернативно, не существует, давая соединения формулы (I), содержащие вторичный или третичный амин,R4 представляет собой атом водорода,группу С 1-С 4 алкил,группу С 6-С 7 циклоалкил,группу пиридил, пиримидинил или пиразинил, возможно замещенную группой С 1-С 4 алкил,группу гетероарилкарбонил, причем группа гетероарил выбрана из группы фурил и группы пиридил,группу фенилкарбонил, причем группа фенил возможно замещена атомом галогена,группу (С 3-С 5)алкилкарбонил,группу -(CH2)PCOOR, в которой р равно 0 или 1, и в которой R представляет собой группу С 1 С 4 алкил,группу фенилсульфонил,группу фенил, замещенную группами в количестве от одной до трех, независимо друг от друга выбранными из: группы метил, нитрогруппы, аминогруппы, гидроксильной группы, атома галогена, группы трифторметил, группы метокси, группы (С 1-С 4)алкоксифенил, группы диметиламино, группы-NHCHO или группы -NHCOR', в которой R' представляет собой группу С 1-С 4 алкокси или группу С 1 С 4 алкил, причем эта группа С 1-С 4 алкил возможно замещена группой диметиламино,группу -(СН 2)р-фенил, в которой р равно 1, 2, 3 или 4,группу -(СН 2)р-пиридил, в которой р может находиться в диапазоне от 1 до 3,группу -(СН 2)р-тиенил, в которой р равно 2,группу (С 6-С 7)гетероциклоалкил, возможно замещенную группой метил или группой -COOR, в которой R представляет собой группу С 1-С 4 алкил,или альтернативно соединениями, которые являются наиболее особенно предпочтительными, являются соединения формулы (I), для которыхR1 представляет собой атом водорода,R2 и R2' независимо друг от друга представляют собой атом водорода или группу метил,X представляет собой атом углерода,n равно 1 или 2,m равно 1,R3 представляет собой атом водорода, группу -NR5R6, группу -N(СН 3)3+, группу -NHCOR7, группу-CONHR5, группу -NHCONH2, группу -ОН или группу -СН 2 ОН,R4 представляет собой атом водорода,группу бензил,группу фенил, возможно замещенную группами в количестве от одной до трех, независимо друг от друга выбранными из атома галогена и группы трифторметил,группу гетероарил, выбранную из группы имидазолил, возможно замещенной группой метил, или группы пиридил,группу -NR7R8,при условии, что, когда R4 представляет собой группу -NR7R8, R3 является иным, чем группы-NR5R6, -NHCOR7, -NHCONH2 и -ОН,R5 и R6 независимо друг от друга представляют собой атом водорода или группу С 1-C4aлкил,R7 и R8 независимо друг от друга представляют собой группу С 1-С 4 алкил либо вместе образуют насыщенное 5-7-членное кольцо, возможно содержащее дополнительный атом азота, причем это кольцо возможно замещено на атоме углерода или на атоме азота, включая атом азота, к которому присоединены группы R7 и R8 с образованием четвертичного аммония, группой метил или группой -COOR", в которой R" представляет собой группу (С 1-С 4)алкилфенил,за исключением двух соединений, для которых R1 = R2 = R2' = R3 = Н, X = С, n = m = 1 и R4 представляет собой либо группу 4-имидазолил, либо группу 5-метил-4-имидазолил. В тексте здесь ниже термин уходящая группа означает группу, которую можно легко отщепить от молекулы путем гетеролитического расщепления связи с удалением электронной пары. Таким образом,эту группу можно легко заместить другой группой во время, например, реакции замещения. Такие уходящие группы представляют собой, например, галогены или активированную гидроксильную группу,такую как мезил, тозил, трифлат, ацетил и так далее. Примеры уходящих групп и ссылки на их получение приведены в Advances in Organic Chemistry, J. March 3rd Edition, Wiley Interscience pp. 310-316. Для получения соединений формулы (I) в соответствии с изобретением осуществляют способ согласно приведенной ниже схеме синтеза 1. В соответствии с этим способом, производное формулы (II), в котором R1, R2, R2' и n являются такими, как определено выше, а А представляет собой уходящую группу, предпочтительно галоген, подвергают реакции в присутствии амина формулы (III), в котором X, R3,R4 и m являются такими, как определено выше, в растворителе, который может представлять собой спирт, такой как изоамиловый спирт, простой эфир, такой как тетрагидрофуран или TGME (монометиловый эфир триэтиленгликоля), или углеводород, такой как толуол, при температуре между комнатной температурой и точкой кипения растворителя, с получением соединения формулы (I). Эту реакцию можно проводить в присутствии основания, такого как 2,6-диметиллутидин или трет-бутоксид натрия, в присутствии галогенидов щелочных металлов, таких как фторид калия, или в присутствии катализаторов на основе палладия или на основе никеля, как описано, например, в патентной заявке ЕР 646583 или в J.Med. Chem. (1986) 29 1178-1183, Tetrahedron Letters (1997) 32 5607-5610, Tetrahedron Letters (1999) 55 12829-12842 и Tetrahedron Letters (1999) 40 6875-6879. Когда соединение формулы (I) содержит функциональную группу, свободный первичный или вторичный амин, его можно также получить путем взаимодействия производного формулы (II) с амином формулы (III), в котором указанная функциональная группа амин защищена общепринятой защитной группой амина, такой как mpem-бутилкарбамат (ВОС). Соединение формулы (I), содержащее защищенную функциональную группу амин, полученное таким образом, затем обрабатывают согласно одному из известных способов с получением желаемого соединения (I), содержащего свободную функциональную группу амин. Примеры защитных групп амина и способов удаления защиты приведены, в частности, в Т. Соединения формулы (II) можно получить согласно приведенной ниже схеме 2 согласно рабочим-4 005950 условиям, которые известны специалистам в данной области техники, в частности, путем взаимодействия соединения формулы (IV), в котором R1, R2, n и R2' являются такими, как определено выше, с галогенирующим агентом, таким как фосфорилхлорид. Схема 2 Соединения формулы (IV) можно получить согласно способу, описанному в приведенной выше схеме синтеза 2. Согласно одному варианту данного способа, диамин формулы (V), в котором R1, R2, R2' и n являются такими, как определено выше, сочетают с производным фосгена, таким как карбонилдиимидазол (КДИ). Согласно другому варианту, производное формулы (VI), в котором R1 является таким,как определено выше, алкилируют алкилирующим агентом формулы (VIII, R = С 1-С 4 алкил), в которомR2 является таким, как определено выше, с получением продуктов формулы (VII), в которых n = 1 и R2'= Н, или агентом формулы (IX, R = С 1-С 4 алкил), a Y представляет собой уходящую группу, в котором R2 и R2' являются такими, как определено выше, с получением продуктов формулы (VII), в которых n = 2. Эти соединения (VII), полученные таким образом, затем превращают в карбоновые кислоты (VII, R = Н) или в производные кислот, такие как хлорангидриды (VII, R = Cl), а затем подвергают циклизации в рабочих условиях, известных специалистам в данной области техники, с получением промежуточных соединений формулы (II) непосредственно. Способ, подобный этому второму варианту, описан, в частности, в патентной заявке JP 55111406 или в Tetrahedron Letters (1995) 36 1387-1390. Альтернативно, соединения формулы (II), в которых R2 и R2' не представляют собой атомы водорода, можно получить из соответствующих соединений (II), в которых R2' представляет собой атом водорода, путем алкилирования реагентом типа R2'Z, в котором Z представляет собой уходящую группу,предпочтительно йод. Эту реакцию можно проводить в растворителе, таком как диметилформамид, простой эфир или тетрагидрофуран, в присутствии основания, согласно способам, известным специалистам в данной области техники. Соединения формул (III), (V), (VI), (VIII) и (IX) имеются в продаже либо их можно получить в соответствии с рабочими условиями, которые известны специалистам в данной области техники. Объектом настоящего изобретения также являются новые синтетические промежуточные соединения формулы (II). Следующие примеры иллюстрируют настоящее изобретение. Номера соединений, приведенных в качестве примеров, соответствуют номерам в приведенной далее таблице, которая иллюстрирует химические структуры ряда соединений согласно изобретению. Пример 1: Получение промежуточных соединений формулы (II) 1.1 Получение 2-хлор-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она (А = Cl, R1 =Н, R2 = R2' = H, n = 1) Данное соединение получили из соединения 4H-имидазо[4,5,1-ij]хинолин-2,6-(1 Н,5 Н)дион (IV),описанного в патенте Японии: JP 55111406. 10 Г соединения (IV) подвергали взаимодействию при температуре дефлегмации с 38,6 мл оксихлорида фосфора и 6,3 г хлорида аммония в течение 1,5 ч в 250 мл трехгорлой колбе, оборудованной парциальным конденсатором. Затем эту реакционную смесь охлаждали и выливали на лед, к которому добавляли 20% водный раствор аммиака при энергичном перемешивании, пока не получили рН = 9. Эту смесь экстрагировали дважды 250 мл этилацетата, сушили над сульфатом магния, фильтровали и выпаривали. Получили 9,81 г белого твердого вещества и использовали его без дальнейшей очистки на следующей стадии. 1 Н ЯМР (200 МГц,число частей на миллион) ДМСО-5 005950 трехгорлую колбу с магнитной мешалкой, капельной воронкой и конденсатором, гидрид натрия дважды промывали пентаном и добавляли небольшое количество диметилформамида с последующим добавлением раствора этил-4-бромбутирата (14,78 г, 72 ммоль) в безводном диметилформамиде (200 мл). После перемешивания в течение одного часа при комнатной температуре к этой смеси добавляли 2-хлор-1 Нбензимидазол (10,0 г, 65,5 ммоль), растворенный в безводном диметилформамиде (200 мл). Эту реакционную смесь нагревали при 65 С в течение 8 ч, а затем выдерживали при комнатной температуре в течение ночи. После выпаривания диметилформамида остаток растворяли в этилацетате и органическую фазу промывали насыщенным хлоридом натрия, сушили над сульфатом магния, фильтровали и концентрировали. Путем флэш-хроматографии на силикагеле (750 г) сырого продукта (22 г) с градиентом элюции от 10% до 30% этилацетата в петролейном эфире получили соединение, указанное в заголовке, в форме желтого масла (16,58 г, 95%). 1 Н ЯМР (300 МГц,число частей на миллион) CDCl3: 1,25 (t, 3 Н), 2,15(квинт., 2 Н), 2,40 (t, 2 Н), 4,15 (квартет, 2 Н), 4,25 (t, 2H), 7,20-7,40 (m, 2H), 7,70 (dd, 1H). 1.2.2 3-(2-Хлор-1-бензимидазолил)бутоксид лития Этиловый эфир (16,58 г, 62,2 ммоль), растворенный в тетрагидрофуране (180 мл), вносили в 1 л одногорлую колбу с круглым дном при магнитном перемешивании с последующим добавлением водного раствора гидроксида лития (1,49 г, 24 ммоль, 100 мл дистиллированной воды). Эту смесь оставляли для взаимодействия в течение ночи при комнатной температуре, тетрагидрофуран и воду выпаривали, а затем остаток растворяли в этиловом эфире (2 л) и перемешивали в течение 2 ч. Полученный белый осадок отфильтровывали, промывали этиловым эфиром, а затем тщательно высушивали под крыльчатым вакуумным насосом над пентоксидом фосфора с получением ожидаемого соединения в форме белых кристаллов (14 г, 92%). Это соединение использовали без дальнейшей очистки для следующей стадии. 1 Н ЯМР (300 МГц,число частей на миллион) ДМСО D6 +D2O: 1,85 (m, 2 Н), 1,95 (m, 2 Н), 4,20(t, 2H), 7,25 (m, 2H), 7,55 (d, 1 Н), 7,60 (d, 1H). LC-MS (жидкостная хроматография-масс-спектрометрия): МН+ = 239 (кислота). 1.2.3: 1-Хлор-8,9-дигидро-7H-2,9 а-диазабензо[cd]азулен-6-он Литиевую соль (11,95 г, 49,7 ммоль) вносили в 2 л трехгорлую колбу с магнитной мешалкой, конденсатором и капельной воронкой в атмосфере аргона с последующим добавлением 1,2-дихлорэтана,свежедистиллированного над пентоксидом фосфора (1 л). Быстро добавляли оксалилхлорид (8,55 мл, 102 ммоль) при перемешивании и эту реакционную смесь нагревали в течение 15 мин при температуре примерно 40 С. К полученному таким образом промежуточному хлорангидриду добавляли хлорид алюминия (19,54 г, 154,5 ммоль) и эту смесь кипятили с обратным холодильником в течение 3 ч. Полученную в результате смесь охлаждали, а затем выливали на смесь лед/соль и экстрагировали 1,2-дихлорэтаном,органическую фазу промывали насыщенным раствором хлорида натрия, сушили над сульфатом магния и фильтровали, а затем растворитель выпаривали. Путем флэш-хроматографии сырого продукта (10,6 г) на силикагеле (800 г) с элюированием 20% этилацетатом в дихлорметане, получили ожидаемый продукт в форме белых кристаллов (7,06 г, 65%). 1 Н ЯМР (300 МГц,число частей на миллион) CDCl3: 2,40(квинт., 2 Н), 3,15 (t, 2H), 4,40 (t, 2H), 7,35 (t, 1H), 7,95 (d, 1 Н), 8,05 (d, 1H). LC-MS: МН+ = 221. 1.3 Получение 2-хлор-5-метил-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она (А = Cl, R1 = Н, R2 = СН 3, R2' = Н, n = 1) 1.3.1: Метил-1-метил-3-(2-хлор-1-бензимидазолил)пропионат 2-Хлор-1 Н-бензимидазол (15,25 г, 100 ммоль), растворенный в хлороформе (100 мл), вносили в 1 л трехгорлую колбу с магнитной мешалкой, капельной воронкой и конденсатором в атмосфере азота. Затем добавляли тритон В (47 мл, 110 ммоль) и метилметакрилат (107 мл, 1 моль). Эту реакционную смесь кипятили с обратным холодильником в течение 2 ч, оставляли охлаждаться, а затем выпаривали хлороформ. Остаток растворяли в этилацетате и органическую фазу промывали 3 раза водой и один раз насыщенным раствором хлорида натрия. Путем флэш-хроматографии сырого продукта (16,0 г) на силикагеле(1 кг) с градиентом элюции от 30 до 70% этилацетата в петролейном эфире получили ожидаемый продукт в форме белых кристаллов (10,1 г, 40%). 1 Н ЯМР (300 МГц,число частей на миллион) ДМСО D6: 1,15 (d, 3H), 3,05 (m, 1H), 3,50 (s, 3H), 4,25 (dd, 1H), 4,50 (dd, 1H), 7,25 (m, 2 Н), 7,60 (m, 2 Н). 1.3.2 1-Метил-3-(2-хлор-1 -бензимидазолил)пропионат лития Данное соединение получили согласно способу, описанному при получении в п. 1.2, путем обработки метил-1-метил-3-(2-хлор-1-бензимидазолил)пропионата гидроксидом лития. 1 Н ЯМР (300 МГц,число частей на миллион) ДМСО D6 +D2O: 1,35 (d, 3 Н), 2,60 (m, 1H), 4,10 (dd, 1H), 4,40 (dd, 1H), 7,25(m, 2H), 7,55 (d, 1H), 7,60 (d, 1H). LC-MS: МН+ = 239 (кислота). 1.3.3 2-Хлор-5-метил-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-он Данное соединение получили из литиевой соли согласно способу, описанному в п. 1.2, путем ее последовательной обработки оксалилхлоридом с получением промежуточного хлорангидрида и хлоридом алюминия. 1 Н ЯМР (300 МГц,число частей на миллион) ДМСО D6: 1,40 (d, 3 Н), 3,20 (m, 1H), 4,10 (dd,1H), 4,65 (dd, 1H), 7,45 (t, 1H), 7,70 (d, 1H), 7,85 (d, 1 Н). LC-MS: МН+ = 221.R2' = Н, n = 1) 1.4.12-Гидрокси-4-метилбензимидазол 2,3-Диаминотолуол (5 г, 41 ммоль), 1,1-карбонилдиимидазол (7,3 г, 45 ммоль) и 50 мл безводного диметилформамида (ДМФ) последовательно вносили в 250 мл двугорлую колбу в атмосфере аргона при магнитном перемешивании. После нагревания этой смеси при 90-95 С в течение 4 ч растворитель отгоняли в вакууме и полученный остаток растворяли в воде (250 мл) и экстрагировали этилацетатом (3x250 мл). Нерастворимый продукт, образовавшийся во время экстракции, выделяли (4,8 г) и объединенные органические фазы снова промывали насыщенным раствором NaCl, сушили над MgSO4, фильтровали и концентрировали с получением дополнительных 1,2 г желаемого продукта (6 г количественно). 1 Н ЯМР(300 МГц,число частей на миллион) ДМСО D6: 2.27 (s, 3 Н), 6.72 (m, 2 Н), 6.82 (m, 1 Н). 1.4.2 2-Хлор-4-метилбензимидазол 2-Гидрокси-4-метилбензимидазол (5,92 г, 40 ммоль) и 40 мл фосфорилхлорида вносили в 250 мл двугорлую колбу в атмосфере аргона при магнитном перемешивании. Эту смесь кипятили с обратным холодильником в течение 20 ч и фосфорилхлорид выпаривали в вакууме. Полученное в результате твердое вещество растворяли в воде (250 мл), нейтрализовали до рН = 8 28% водным аммиаком и водную фазу экстрагировали этилацетатом (3x250 мл). После обычной обработки продукт, указанный в заголовке, получили при выходе 93% (6,23 г). 1 Н ЯМР (300 МГц,число частей на миллион) ДМСО D6: 2,47 (s,3 Н), 7,01 (d, 1 Н), 7,11 (t, 1 Н), 7,32 (d, 1 Н). 1.4.3 Метил-1-метил-3-(2-хлор-4-метил-1-бензимидазолил)пропионат Соединение, указанное в заголовке, получили согласно методике, описанной в примере 1.3.1 (7,85 г,94%). 1 Н ЯМР (300 МГц,число частей на миллион) ДМСО D6: 2,48 (s, 3H), 2,86 (t, 2H), 3,56 (s, 3 Н),4,49 (t, 2H), 7,06 (d, 1 Н), 7,19 (t, 1H), 7,44 (d, 1H). 1.4.4 1 -Метил-3-(2-хлор-4-метил-1-бензимидазолил)пропионат лития Соединение, указанное в заголовке, получили согласно методике, описанной в примере 1.3.2 (6,94 г,94%). 1 Н ЯМР (300 МГц,число частей на миллион) ДМСО D6: 2,3 (dd, 2H), 2,48 (s, 3 Н), 4,32 (dd, 2H),7,01 (d, 1H), 7,15 (t, 1 Н), 7,41 (d, 1H) (кислота). 1.4.5 2-Хлор-4,5-дигидро-9-метилимидазо[4,5,1-ij]хинолин-6-он Соединение, указанное в заголовке, получили согласно методике, описанной в примере 1.3.3 (4,72 г,76%). 1 Н ЯМР (300 МГц,число частей на миллион) ДМСО D6: 2,58 (s, 3 Н), 3,05 (t, 2H), 4,53 (t, 2H), 7,19R2 = R2' = R3 = Н, R4 = 1-пиперидил, X = С, n = m = 1) (соединение 45) 400 мг хлорпроизводного формулы (II), описанного в п.1.1, 5 мл диметилформамида, 70 мг фторида калия, 0,2 мл 2,6-лутидина и 500 мг 4-пиперидинопиперидина подвергали взаимодействию вместе в течение 2 ч при 140 С. После выпаривания растворителя остаток подвергали хроматографии на силикагеле(элюент: дихлорметан + 8% метанол). Получили 375 мг продукта в форме беловатого твердого вещества. 1 Н ЯМР (200 МГц,число частей на миллион) ДМСО D6: 1,2-2,2 (m, 12H), 3,0 (m, 3 Н), 3,2-3,4 (m, 4 Н),4,2 (d, 2H), 4,65 (t, 2H), 7,4 (t, 1H), 7,6 (d, 1H), 7,8 (d, 1H). Пример 3: Хлорид 1-метил-1-[1-(6-оксо-5,6-дигидро-4 Н-имидазо[4,5,1-ij]хинолин-2-ил)-4 пиперидинил]пиперидиния (R1 = R2 = R2' = R3 = Н, R4 = N-метил-1-пиперидил, Х = С, n = 1, m = 1) (соединение 48) 3.1: 4-(N-пиперидино)-Вос-пиперидин 3,98 г 4-оксо-N-Вос-пиперидина, 1,7 г пиперидина и 7,1 г изопропоксида Ti (IV) смешивали вместе в трехгорлой колбе с круглым дном в атмосфере азота и эту смесь оставляли перемешиваться в течение одного часа при комнатной температуре. Затем добавляли 20 мл абсолютного этанола и 850 мгNaBH3CN. Полученную в результате смесь оставляли для взаимодействия в течение 17 ч при комнатной температуре, добавляли 5 мл воды и эту смесь перемешивали в течение 5 мин и фильтровали через ватман. Розовый раствор упаривали, остаток растворяли в 100 мл этилацетата и этот раствор сушили над сульфатом магния и упаривали. Полученный остаток подвергали хроматографии на 100 г диоксида кремния и элюировали ацетоном. Получили 2,2 г масла, которое кристаллизовалось, спектр ЯМР которого соответствует ожидаемой структуре и этот продукт использовали без дальнейшей очистки для следующей стадии. 3.2 Хлорид N-Вос-4-(N-метилпиперидиний)пиперидина Полученное выше соединение (2,2 г) перемешивали с 5 мл СН 3l в течение 17 ч в отсутствие света, а затем упаривали. Получили 3,10 г белых кристаллов, которые использовали без дальнейшей очистки на следующей стадии. 3.3: Хлорид 4-(N-метилпиперидиний)пиперидина Полученные выше кристаллы суспендировали в 20 мл дихлорметана, к которому добавляли 5 мл насыщенного раствора хлороводорода в диэтиловом эфире. Полученный вязкий осадок повторно растворяли в 20 мл метанола, выпаривали до сухости и растворяли в 5 мл метанола. Этот раствор охлаждали до-7 005950 0 С, добавляли 1,35 мл метоксида натрия (при концентрации 30% в метаноле) и эту смесь перемешивали в течение 15 минут, фильтровали и выпаривали с использованием вакуумного насоса. Полученный амин использовали без дальнейшей очистки для следующего сочетания. 3.4 Хлорид 1-метил-1-[1-(6-оксо-5,6-дигидро-4H-имидазо[4,5,1-ij]хинолин-2-ил)-4-пиперидил]пиперидиния 400 мг 2-хлор-4,5-дигидро-6 Н-имидазо[4,5,1-ij]хинолин-6-она в 5 мл диметилформамида, 70 мг фторида калия, 0,2 мл 2,6-лутидина и 1,6 г хлорида 4-(N-метилпиперидиний)пиперидина добавляли в трехгорлую колбу в атмосфере аргона и оставляли перемешиваться в течение 5 ч при 140 С. Эту смесь упаривали с использованием вакуумного насоса и полученный остаток подвергали хроматографии на 70 г диоксида кремния Н (Merck) (элюент: дихлорметан с 10% метанолом и 0,5% триэтиламином). Получили 50 мг чистого продукта, спектр ЯМР которого соответствует желаемой структуре. Пример 4: 2-[4-(4-Диметиламинофенил)пиперазин-1-ил]4,5-дигидроимидазо[4,5,1-ij]хинолин-6-он(R1 = R2 = R2' = Н, R3 = -, R4 = пара-диметиламинофенил, X = N, n = m = 1) (соединение 58) 4.1:1 -(трет-Бутоксикарбонил)-4-(4-диметиламинофенил)пиперазин 1-Бром-4-N,N-диметиланилин (0,85 г, 4,25 ммоль), ацетат палладия (0,039 г, 0,17 ммоль), 2,2'бис(дифенилфосфино)-1,1'-динафтил (BINAP) (0,17 г, 0,25 ммоль) и tBuOK (0,67 г, 5,95 ммоль) последовательно вносили в атмосфере азота в колбу с круглым дном, оборудованную конденсатором, при магнитном перемешивании. Эту колбу продували 3 раза азотом, вносили толуол (25 мл) и N-третбутоксикарбонилпиперазин (0,95 г, 5,1 ммоль) и эту реакционную смесь кипятили с обратным холодильником в течение 20 ч. После охлаждения до комнатной температуры добавляли этилацетат и органическую фазу дважды промывали водой. После сушки органической фазы над сульфатом натрия, фильтрования и концентрирования получили остаток (1,38 г), который подвергали хроматографии на силикагеле с градиентом дихлорметан/этилацетат (от 9/1 до 1/1). Соединение, указанное в заголовке, получили с выходом 50% (0,67 г). 1 Н ЯМР (300 МГц,число частей на миллион) CDCl3: 1,47 (s, 9 Н), 2,99 (m, 4 Н),3,57 (m, 4H), 6,72 (d, 2H), 6,89 (d, 2H). 4.2: N-1-(4-Диметиламинофенил)пиперазин Продукт, описанный в примере 1.1 (0,67 г, 2,2 ммоль), растворяли в трифторуксусной кислоте(трифторуксусная кислота, 20 мл) и поддерживали при магнитном перемешивании в течение 2,5 ч при комнатной температуре. После выпаривания трифторуксусной кислоты остаток растворяли в насыщенном растворе карбоната натрия и водную фазу дважды экстрагировали этилацетатом. Объединенные органические фазы промывали до значения рН нейтральной среды насыщенным раствором хлорида натрия,сушили над сульфатом натрия и концентрировали. После хроматографии остатка на силикагеле (95/5/0,1 дихлорметан/метанол/NH4 ОН) получили продукт, указанный в заголовке, с выходом 69% (0,31 г, Rf: 0,1). 4.3: 2-[4-(4-Диметиламинофенил)пиперазин-1-ил]4,5-дигидроимидазо[4,5,1-ij]хинолин-6-он Промежуточное хлор-соединение, описанное в пункте 1.1 (0,2 г, 0,969 ммоль), 1 мл монометилового эфира триэтиленгликоля (TGME), лутидин (0,125 мл, 1,07 ммоль), фторид цезия (0,148 г, 0,969 ммоль) и раствор производного из примера 1.2 (0,219 г, 1,07 ммоль) в TGME (1 мл) последовательно вносили в колбу с круглым дном, оборудованную конденсатором, при магнитном перемешивании. Эту реакционную смесь нагревали при 140 С в течение 1,5 ч и оставляли охлаждаться, добавляли воду и эту смесь дважды экстрагировали этилацетатом. Органические фазы дважды промывали водой, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток (0,38 г) подвергали хроматографии на силикагеле (этилацетат) и полученное в результате масло (0,246 г) растворяли в небольшом количестве дихлорметана, и оно кристаллизовалось при добавлении диэтилового эфира. Белое твердое вещество, которое соответствует ожидаемому соединению (0,208 г, 57%), отфильтровывали. LC-MS: MH+ = 376. 1 Н ЯМР (360 МГц,число частей на миллион) ДМСО D6: 2,79 (s, 6 Н), 3,0 (t, 2 Н), 3,14 (m, 4 Н), 3,55 (m, 4 Н), 4,47 (t,2 Н), 6,71 (d, 2H), 6,91 (d, 2H), 7,15 (dd, 1H), 7,35 (d, 1H), 7,60 (d, 1H). Пример 5: 2-[4-(4-трет-Бутоксикарбониламинофенил)пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1ij]хинолин-6-он (R1 = R2 = R2' = Н, R3 = -, X = N, R4 = 4-трет-бутоксикарбониламинофенил, n = m = 1)(соединение 57) 5.1: 1-[2-(Триметилсилил)этилкарбонил]-4-(4-нитрофенил)пиперазин Раствор 1-(4-нитрофенил)пиперазина (10 г, 48,31 ммоль) и 2-(триметилсилил)этил-паранитрофенилкарбоната (14,4 г, 50,73 ммоль) в тетрагидрофуране (220 мл) кипятили с обратным холодильником в течение 3 ч при магнитном перемешивании, а затем перемешивали в течение 20 ч при комнатной температуре. Эту реакционную смесь концентрировали, остаток растворяли в дихлорметане и органическую фазу промывали 4 раза 1 н гидроксидом натрия и дважды водой. Затем органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали; полученный маслянистый остаток использовали без дальнейшей очистки на следующей стадии (12 г, выход: 71%). 1 Н ЯМР (300 МГц,число частей на миллион) CDCl3: 0,04 (s, 9H), 1,02 (m, 2H), 3,43 (m, 4H), 3,65 (m, 4H), 4,22 (m, 2H), 6,82 (d, 2H),8,13 (d, 2H). 5.2: 1-[2-(Триметилсилил)этилкарбонил]-4-(4-аминофенил)пиперазин Смесь нитропроизводного, описанного выше (12 г, 34,2 ммоль), и от 4 до 5 шпателей никеля Ренея-8 005950 в 300 мл этанола поддерживали в атмосфере водорода при атмосферном давлении в течение 18 ч при энергичном магнитном перемешивании. После фильтрования и концентрирования полученный остаток использовали без дальнейшей очистки на следующей стадии: ожидаемый продукт, который присутствовал при концентрации примерно 50% согласно ЯМР и LC-MS, трудно очистить. 1 Н ЯМР (300 МГц,число частей на миллион) CDCl3: 0,04 (s, 9H), 1,03 (m, 2H), 2,96 (m, 4H), 3,59 (m, 4 Н), 4,18 (m, 2H), ароматические протоны невозможно определить из-за присутствия примесей. 5.3: 1-[2-(Триметилсилил)этилкарбонил]-4-(4-трет-бутоксикарбониламинофенил)пиперазин Сырую реакционную смесь из вышеописанной стадии (оценили как 31 ммоль) и ди-третбутилдикарбонат (7,5 г, 34,1 ммоль) в тетрагидрофуране (50 мл) последовательно добавляли в колбу с круглым дном, оборудованную конденсатором, и эту смесь кипятили с обратным холодильником в течение 44 ч. Тетрагидрофуран выпаривали, остаток растворяли в смеси вода/этилацетат и органическую фазу дважды промывали водой. Органическую фазу сушили над сульфатом натрия и концентрировали и остаток подвергали хроматографии на силикагеле (1/1 дихлорметан/этилацетат). Полученный неочищенный продукт использовали без дальнейшей очистки для следующей стадии. LC-MS: MH+ = 422. 5.4: 1-(4-трет-Бутоксикарбониламинофенил)пиперазин Промежуточное соединение, описанное в приведенном выше пункте (3 г, считают как 7,12 ммоль),и фторид тетрабутиламмония (3,37 г, 10,68 ммоль) в тетрагидрофуране (60 мл) последовательно вносили в колбу с круглым дном, оборудованную конденсатором, при магнитном перемешивании. Эту реакционную смесь кипятили с обратным холодильником в течение 2 ч и концентрировали и остаток растворяли в воде и этилацетате. Органическую фазу дважды промывали водой, а затем насыщенным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали. Соединение, указанное в заголовке (0,99 г, 50% за 3 стадии), получили после хроматографии на силикагеле (90/10/0,1 дихлорметан/метанол/NН 4 ОН). 1 Н ЯМР (300 МГц,число частей на миллион) CDCl3: 1,50 (s, 9H), 3,04 (m, 8H),6,60 (s, 1H), 6,87 (d, 2 Н), 7,23 (d, 2H). 5.5: 2-[4-(4-трет-Бутоксикарбониламинофенил)пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-он Промежуточное хлор-соединение, описанное в п. 1.1 (0,7 г, 3,39 ммоль), TGME (7 мл), лутидин(0,514 г,3,39 ммоль) и 1-(4-третбутоксикарбониламинофенил)пиперазин (1,03 г, 3,73 ммоль) последовательно вносили в колбу с круглым дном, оборудованную конденсатором, при магнитном перемешивании. Эту реакционную смесь нагревали при 140 С в течение 2 ч и оставляли охлаждаться, добавляли воду и эту смесь дважды экстрагировали этилацетатом. Органические фазы дважды промывали водой, сушили над сульфатом натрия,фильтровали и концентрировали. Путем хроматографии остатка на силикагеле (градиент дихлорметан/этилацетат: от 75/25 до 1/1) получили ожидаемое соединение, которое затем кристаллизовалось в смеси дихлорметан/диэтиловый эфир с получением белого твердого вещества (1,1 г, 73%). LC-MS: MH+= 448. 1 Н ЯМР (500 МГц,число частей на миллион) ДМСО D6: 1,45 (s, 9H), 3,00 (t, 2H), 3,22 (m, 4 Н),3,55 (m, 4 Н), 4,47 (t, 2 Н), 6,91 (d, 2 Н), 7,15 (dd, 1 Н), 7,33 (m, 2 Н), 7,35 (d, 1 Н), 7,61 (d, 1H). Пример 6: Дигидрохлорид 2-[4-(4-аминофенил)пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она (R1 = R2 = R2' = Н, R3 = -, R4 = пара-аминофенил, X = N, n = m = 1) (соединение 50) Раствор газа хлороводорода в этаноле добавляли к соединению из примера 5 (0,22 г, 0,497 ммоль) и эту реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Полученную в результате смесь концентрировали и получили ожидаемое соединение после растирания из диэтилового эфира в форме белого твердого вещества (0,155 г, 80%). 1 Н ЯМР (500 МГц,число частей на миллион) ДМСО= R2 = R2' = Н, R3 = -, R4 = пара-ацетамидофенил, X = N, n = m = 1) (соединение 60) Соединение из примера 6 (0,20 г, 0,48 ммоль) и триэтиламин (80 мкл, 0,572 ммоль) добавляли к раствору уксусной кислоты (27 мкл, 0,468 ммоль) и карбонилдиимидазола (0,152 г, 0,936 ммоль) в ДМФ (4 мл). Эту реакционную смесь поддерживали при магнитном перемешивании при 70 С в течение 20 ч. После выпаривания ДМФ в вакууме остаток растворяли в воде и растирали и полученное твердое вещество отфильтровывали. Путем промывания этого твердого вещества минимальным количеством дихлорметана, а затем диэтиловым эфиром получили ожидаемое соединение (0,12 г, 64%). 1 Н ЯМР (500 МГц,число частей на миллион) ДМСО D6: 1,99 (s, 3 Н), 3,00 (t, 2 Н), 3,25 (m, 4 Н), 3,55 (m, 4H), 4,48 (t, 2H), 6,94 (d,2H), 7,15 (dd, 1H), 7,35 (d, 1H), 7,44 (d, 2H), 7,61 (d, 1H), 9,70 (s, 1H). Пример 8: Дигидрохлорид 2-(4-н-пропилпиперазин-1-ил)-4,5-дигидроимидазо[4,5,1-ij]хинолин-6 онa (R1 = R2 = R2' = R4 = Н, X = N, R3 = н-пропил, n = m = 1) (соединение 26) Промежуточное соединение формулы (II) из пункта 1.1 (0,2 г, 0,969 ммоль), 1 мл монометилового эфира триэтиленгликоля (TGME), лутидин (0,37 мл, 3,30 ммоль), фторид цезия (0,148 г, 0,969 ммоль) и раствор дигидробромида N-пропилпиперазина (0,296 г, 1,18 ммоль) в TGME (1 мл) последовательно вносили в колбу с круглым дном, оборудованную конденсатором, при магнитном перемешивании. Эту реак-9 005950 ционную смесь нагревали при 140 С в течение 2 ч 15 мин и оставляли охлаждаться, добавляли насыщенный раствор карбоната натрия и твердый хлорид натрия и эту смесь дважды экстрагировали этилацетатом. Органические фазы дважды промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и концентрировали. Полученный остаток подвергали хроматографии на силикагеле (95/5/0,5 дихлорметан/метанол/NH4 ОН) и соль дигидрохлорид полученного масла (0,203 г) синтезировали путем его растворения в небольшом количестве дихлорметана и добавления насыщенного раствора газа хлороводорода в безводном диэтиловом эфире. Белое твердое вещество, которое соответствует ожидаемому продукту (0,23 г), отфильтровывали. LC-MS: MH+ = 299. 1 Н ЯМР (360 МГц,число частей на миллион) ДМСО D6: 0,94 (t, 3 Н), 1,78 (m, 2 Н), 3,08 (m, 4 Н), 3,28 (m, 2 Н), 3,62 (3, 2 Н), 3,88 (m,2 Н), 4,25 (m, 2 Н), 4,65 (t, 2H), 7,42 (t, 1H), 7,60 (d, 1H), 7,76 (d, 1H), 11,66 (s, 1H). Пример 9: 2-(4-трет-Бутилоксикарбонилпиперазин-1-ил)-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-он(0,155 мл, 1,33 ммоль), фторид цезия (0,184 г, 1,21 ммоль) и раствор трет-бутил-1 пиперазинкарбоксилата (0,237 г, 1,28 ммоль) в TGME (1,5 мл) последовательно вносили в колбу с круглым дном, оборудованную конденсатором, при магнитном перемешивании. Эту реакционную смесь нагревали при 120 С в течение 3 ч и оставляли охлаждаться, добавляли воду и эту смесь дважды экстрагировали этилацетатом. Органические фазы дважды промывали водой, сушили над сульфатом натрия,фильтровали и концентрировали. Полученный остаток подвергали хроматографии на силикагеле (1/1 дихлорметан/этилацетат) с получением ожидаемого соединения в форме белого твердого вещества (0,315 г, 73%). LC-MS: MH+ = 357. 1 Н ЯМР (500 МГц,число частей на миллион) ДМСО D6: 1,51 (s, 9 Н), 3,07= R2' = R3 = R4 = Н, X = N, n = m = 1) (соединение 13) Насыщенный раствор газа хлороводорода в безводном диэтиловом эфире добавляли к соединению из примера 9 (0,1 г, 0,28 ммоль), предварительно растворенному в минимальном количестве метанола и эту смесь поддерживали при магнитном перемешивании при комнатной температуре в течение ночи. Эту смесь концентрировали, и остаток кристаллизовался в смеси метанол/дихлорметан. Ожидаемое соединение получили в форме белого твердого вещества (0,07 г). LC-MS: MH+ = 257. 1 Н ЯМР (500 МГц,число частей на миллион) ДМСО D6: 3,12 (t, 2H), 3,95 (m, 4H), 3,94 (m, 4 Н), 4,66 (t, 2H), 7,43 (t, 1H), 7,61 (d,1H), 7,80 (d, 1H), 9,63 (s, 2H). Пример 11: Дигидрохлорид 2-(4-ацетилпиперазин-1-ил)-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-он(R1 = R2 = R2' = Н, R3 = -, R4 = СОСН 3, X = N, n = m = 1) (соединение 15) Соединение из примера 10 (0,085 г, 0,26 ммоль) и триэтиламин (75 мкл, 0,52 ммоль) добавляли к раствору уксусной кислоты (20 мкл, 0,349 ммоль), гидроксибензотриазола (0,055 г, 0,349 ммоль) и диизопропилазодикарбоксилата (55 мкл, 0,349 ммоль) в дихлорметане (5 мл). Эту реакционную смесь поддерживали при магнитном перемешивании при комнатной температуре в течение ночи и разбавляли этилацетатом и 1 н раствором соляной кислоты. Сырой продукт получили путем обычной кислотнощелочной экстракции и водных промывок с последующей сушкой органических фаз над сульфатом натрия и выпариванием. Путем хроматографии на силикагеле (95/5 дихлорметан/этанол) получили ожидаемое соединение (0,04 г). LC-MS: MH+ = 299. 1 Н ЯМР (500 МГц,число частей на миллион) ДМСО(125 мкл, 0,969 ммоль), фторид цезия (0,148 г, 0,969 ммоль) и раствор 1-(4-пиридил)пиперазина (0,238 г,1,02 ммоль) в TGME (1 мл) последовательно вносили в колбу с круглым дном, оборудованную конденсатором, при магнитном перемешивании. Эту реакционную смесь нагревали при 140 С в течение 1 ч 50 мин и оставляли охлаждаться, добавляли насыщенный раствор карбоната натрия и твердый хлорид натрия и эту смесь дважды экстрагировали этилацетатом. Органические фазы дважды промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и концентрировали. Полученный остаток подвергали хроматографии на силикагеле (95/5/0,5 дихлорметан/метанол/NН 4 ОН) с получением ожидаемого соединения в форме белого твердого вещества (0,071 г). LC-MS: MH+ = 334. 1 Н ЯМР (360 МГц, 6 число частей на миллион) ДМСО D6: 3,01 (t, 2H), 3,58 (m, 8H), 4,51 (t, 2H), 6,91 (d, 2H),7,18 (t, 2H), 7,37 (d, 1H), 7,63 (d, 1H), 8,20(d, 2H). Пример 13: Дигидрохлорид 2-(4-бензилпиперидин-1-ил)-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-онa- 10005950 ммоль) в толуоле (2 мл) последовательно вносили в колбу с круглым дном, оборудованную конденсатором, при магнитном перемешивании и в атмосфере азота. Эту реакционную смесь нагревали при 85 С в течение ночи, оставляли охлаждаться, разбавляли этилацетатом и последовательно промывали водой (3 раза) и насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток подвергали хроматографии (0,24 г, 8/2 дихлорметан/этилацетат) с получением ожидаемого продукта (0,075 г). LC-MS: MH+ = 346. 1 Н ЯМР (360 МГц,число частей на миллион) ДМСОd, 1 Н), 4,40 (t, 2 Н), 7,12 (t, 1 Н), 7,20 (m, 3 Н), 7,26-7,37 (m, 1 Н и d, 1H), 7,5 (d, 1H). Пример 14: 1-(6-Оксо-5,6-дигидро-4 Н-имидазо[4,5,1-ij]хинолин-2-ил)-4-фенил-4-пиперидинкарбоксамид (R1 = R2 = R2' = Н, R3 = CONH2, R4 = фенил, Х = C,n = m = 1) (соединение 43) 14.1: Соединение формулы (III): 4-фенил-пиперидин-4-карбоксамид ЭТО соединение получили согласно синтезу, описанному в литературе: Bioorg. Med. Chem. Lett. 7(19), 1997, 2531-2536. 14.2: 1-(6-Оксо-5,6-дигидро-4 Н-имидазо[4,5,1 -ij]хинолин-2-ил)-4-фенил-4-пиперидинкарбоксамид 300 мг соединения (II), описанного в пункте 1.1, 5 мл диметилформамида 70 мг фторида калия, 0,2 мл 2,6-лутидина и 510 мг соединения (IV), описанного выше, вносили в 50 мл трехгорлую колбу в атмосфере азота. Эту смесь перемешивали в течение 4 ч при 140 С, а затем упаривали в высоком вакууме. Полученный остаток подвергали хроматографии на силикагеле (70-200 микрон) смесью 2% метанол в дихлорметане. Затем полученный продукт перекристаллизовывался из минимального количества горячего ацетона. Получили 270 мг белых кристаллов. Сигналы на спектре ЯМР соответствуют ожидаемому продукту: 1 Н ЯМР (200 МГц,число частей на миллион) ДМСО D6: 2,0 (m, 2 Н), 2,5 (m, 2 Н), 3,0 (t, 2 Н),3,2-3,8 (m, 4 Н), 4,45 (t, 2H), 7,0-7,5 (m, 10 Н). Пример 15: Дигидрохлорид 1-(6-оксо-5,6-дигидро-4 Н-имидазо[4,5,1-ij]хинолин-2-ил)-4-фенил-4 аминопиперидина (R1 = R2 = R2' = Н, R3 = NH2, R4 = фенил, Х = С, n = m = 1) (соединение 46) 4 мл концентрированного водного раствора соляной кислоты добавляли к соединению 42 из таблицы (0,53 г, 1,21 ммоль), полученному согласно способам, описанным выше, предварительно растворенному в 5 мл метанола, и поддерживали при магнитном перемешивании при комнатной температуре в течение 30 мин. Эту смесь концентрировали в вакууме и остаток растворяли в абсолютном этаноле, а затем повторно выпаривали до сухости. Ожидаемое соединение получили в форме белого твердого вещества (0,45 г). 1 Н ЯМР (200 МГц,число частей на миллион) ДМСО D6: 2,4-2,8 (m, 4H), 3,1 (t, 2H), 3,7(10 мл), этиленгликоль (0,216 г, 3,49 ммоль), пара-толуолсульфоновую кислоту (0,01 г) и триметилортоформиат (0,372 г, 3,49 ммоль) последовательно вносили в колбу с круглым дном, оборудованную конденсатором, при магнитном перемешивании, и эту смесь дополняли 13 мл 1,2-дихлорэтана. Полученную в результате смесь кипятили с обратным холодильником в течение 24 ч, добавляли те же количества реагентов (этиленгликоля, пара-толуолсульфоновой кислоты и триметилортоформиата) и эту смесь нагревали в течение дополнительных 18 ч. После выпаривания растворителя остаток растворяли в этилацетате и промывали разбавленным раствором карбоната натрия, а затем водой, и органическую фазу сушили и выпаривали до сухости. Остаток подвергали хроматографии на силикагеле (градиент: от чистого дихлорметана до 96/4 дихлорметан/этилацетат) с получением соединения, указанного в заголовке (0,54 г,74%). МН+ = 251. 16.2 Получение этиленкеталя 2-[4-(4-бензилоксифенил)пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1ij]хинолин-6-онa Промежуточное соединение, описанное в пункте 16.1 (0,54 г, 2,16 ммоль), TGME (3 мл), лутидин(277 мкл, 2,38 ммоль), фторид цезия (0,328 г, 2,16 ммоль) и 1-(4-бензилоксифенил)пиперазин (0,725 г,2,38 ммоль) последовательно вносили в колбу с круглым дном, оборудованную конденсатором, при магнитном перемешивании. Эту реакционную среду нагревали при 100 С в течение 3 ч, добавляли лутидин(300 мкл, 2,57 ммоль) и эту смесь нагревали при 120 С в течение 8 ч. Эту смесь охлаждали, добавляли воду и полученную в результате смесь дважды экстрагировали этилацетатом. Органические фазы дважды промывали водой, сушили над сульфатом натрия, фильтровали и концентрировали. Полученный остаток дважды очищали посредством хроматографии на силикагеле (градиент: от 90/10 дихлорметан/этилацетат до 40/60 дихлорметан/этилацетат, а затем градиент от этилацетата до 95/5 этилацетат/метанол) с получением ожидаемого соединения, загрязненного примерно 50% кетона, образовавшегося в результате гидролиза функциональной группы кеталь (0,365 г). LC-MS: MH+=483, МН+=439. 16.3 Получение этиленкеталя 2-[4-(4-гидроксифенил)пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1ij]хинолин-6-онa Смесь соединений из примера 16.2 (0,365 г), этанола (60 мл), дихлорметана (примерно 0,5 мл) и- 11005950 10% палладия на угле (0,04 г) вносили в колбу с круглым дном и поддерживали при магнитном перемешивании и в атмосфере водорода в течение 17 ч при комнатной температуре. После фильтрования и выпаривания растворителя остаток подвергали хроматографии на силикагеле (градиент от дихлорметана до 94/6 дихлорметан/метанол) с получением продукта, указанного в заголовке (0.132 г). 1 Н ЯМР (300 МГц,число частей на миллион) ДМСО D6: 2,2 (t, 2H), 3,13 (m, 4 Н), 3,46 (m, 3 Н), 4,08-4,20 (m, 4H), 4,21 (t, 2H),6,68 (dd, 2H), 6,86 (dd, 2H), 7,04 (m, 2H), 7,32 (m, 1H), 8,91 (s, 1H). 16.4 Получение 2-[4-(4-гидроксифенил)-пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1-ij]хинолин-6 онa Этиленкетал ь 2-[4-(4-гидроксифенил)пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-онa(0,055 г, 0,14 ммоль) растворяли в 11 мл тетрагидрофурана и добавляли 3,6 мл водного 5% раствора соляной кислоты. Эту смесь оставляли при магнитном перемешивании в течение 16 ч при комнатной температуре, а затем при 50 С в течение 2 ч. После разбавления водой эту смесь подщелачивали бикарбонатом натрия, дважды экстрагировали этилацетатом и органические фазы сушили над сульфатом натрия. После обычной обработки остаток очищали посредством хроматографии на силикагеле (градиент от дихлорметана до 94/6 дихлорметан/метанол) с получением продукта, указанного в заголовке (0,027 г, 55%). 1 Н ЯМР (500 МГц,число частей на миллион) ДМСО D6: 2,99 (t, 2H), 3,13 (m, 4 Н), 3,53 (m, 4 Н), 4,47 (t,2H), 6,67 (d, 2H), 6,85 (d, 2H), 7,15 (t, 1H), 7,34 (d, 1 Н), 7,60 (d, 1H), 8,88(s, 1H). Пример 17: 2-[4-(4-Фторфенил)пиперазин-1-ил]-4,5-дигидро-9-метилимидазо[4,5,1-ij]хинолин-6-он(0,116 мл, 0,998 ммоль), фторид цезия (0,138 г, 0,907 ммоль) и 4-фторфенилпиперазин (0,180 г, 0,998 ммоль) последовательно вносили в колбу с круглым дном, оборудованную конденсатором, при магнитном перемешивании. Эту реакционную смесь нагревали при 140 С в течение 3 ч и оставляли охлаждаться, добавляли воду и эту смесь дважды экстрагировали этилацетатом. Органические фазы дважды промывали водой, сушили над сульфатом натрия, фильтровали и концентрировали. Полученный остаток подвергали хроматографии на силикагеле (градиент от чистого дихлорметана до 98/2 дихлорметан/метанол) с получением ожидаемого соединения в форме белого твердого вещества (0,206 г, 62%). 1 Н ЯМР (500 МГц,число частей на миллион) ДМСО D6: 2,50 (s, 3H), 2,97 (t, 2H), 3,28 (m, 4 Н), 3,54 (m,4 Н), 4,45 (t, 2 Н), 7,05 (m, 5 Н), 7,29 (d, 1H). Пример 18: 1-[4-(4-Фторфенил)-пиперазин-1-ил]-3-метил-8,9-дигидро-7 Н-2,9 а-диазабензо[сd]азулен-6-он (R1 = 3-СН 3, R2 = R2' = Н, R3 = -, X = N, R4 = 4-фторфенил, n = 2, m = 1) (соединение 85) 1-Хлор-3-метил-8,9-дигидро-7 Н-2,9 а-диазабензо[сd]азулен-6-он (0,2 г, 0,852 ммоль), TGME (2 мл),лутидин (0,109 мл, 0,937 ммоль), фторид цезия (0,130 г, 0,852 ммоль) и 4-фторфенилпиперазин (0,169 г,0,937 ммоль) последовательно вносили в колбу с круглым дном, оборудованную конденсатором, при магнитном перемешивании. Эту реакционную смесь нагревали при 140 С в течение 3,5 ч и оставляли охлаждаться, добавляли воду и эту смесь дважды экстрагировали этилацетатом. После обычной обработки полученный остаток подвергали хроматографии на силикагеле (градиент от чистого дихлорметана до 60/40 дихлорметан/этилацетат) с получением соединения, указанного в заголовке, в форме белого твердого вещества (0,137 г, 42%). 1 Н ЯМР (500 МГц,число частей на миллион) ДМСО D6: 2,0 (m, 2 Н), 2,53(R1 = 7-СН 3, R2 = R2' = Н, R3 = -, X = N, R4 = 4-фторфенил, n = m = 1) (соединение 83) 2-Хлор-4,5-дигидро-7-метилимидазо[4,5,1-ij]хинолин-6-он (0,245 г, 1,1 ммоль), TGME (2,5 мл), лутидин (0,161 мл, 1,21 ммоль), фторид цезия (0,167 г, 1,1 ммоль) и 4-фторфенилпиперазин (0,219 г, 1,1 ммоль) последовательно вносили в колбу с круглым дном, оборудованную конденсатором, при магнитном перемешивании. Эту реакционную смесь нагревали при 140 С в течение 2,5 ч и оставляли охлаждаться, добавляли воду и эту смесь дважды экстрагировали этилацетатом. После обычной обработки полученный остаток подвергали хроматографии на силикагеле (градиент от 80/20 дихлорметан/этилацетат до 40/60 дихлорметан/этилацетат) с получением соединения, указанного в заголовке, в форме белого твердого вещества (0,26 г, 65%). 1 Н ЯМР (500 МГц,число частей на миллион) ДМСО D6: 2,59 (s, 3H),2,98 (t, 2 Н), 3,26 (m, 4 Н), 3,49 (m, 4 Н), 4,42 (t, 2 Н), 6,94 (d, 1 Н), 7,05 (m, 4 Н), 7,50 (d, 1 Н). Пример 20: 2-[4-(4-Фторфенил)пиперазин-1-ил]-4,5-дигидро-8-метилимидазо[4,5,1-ij]хинолин-6-он(R1 = 8-СН 3, R2 = R2' = Н, R3 = -, X = N, R4 = 4-фторфенил, n = m = 1) (соединение 82) Соединение, указанное в заголовке, получили из 1/2 смеси 2-хлор-4,5-дигидро-8 метилимидазо[4,5,1-ij]хинолин-6-онa и 2-хлор-4,5-дигидро-7-метилимидазо[4,5,1-ij]хинолин-6-онa, используя условия, описанные в примере 19. После хроматографии на силикагеле двумя последовательными кристаллизациями получили желаемый изомер, загрязненный только 4% другого изомера (0,053 г,выход, вычисленный по соответствующему изомеру: 48%). 1 Н ЯМР (500 МГц,число частей на миллион) ДМСО D6: 2,40 (s, 3H), 2,98 (t, 2 Н), 3,26 (m, 4 Н), 3,55 (m, 4 Н), 4,45 (t, 2 Н), 7,06 (m, 4 Н), 7,18 (s, 1H),7,44 (s, 1 Н).- 12005950 Пример 21: 2-[4-(4-Фторфенил)пиперазин-1-ил]-4,5-дигидро-7-метоксиимидазо[4,5,1-ij]хинолин-6 он (R1 = 7-ОСН 3, R2 = R2' = Н, R3 = -, X = N, R4 = 4-фторфенил, n = m = 1) (соединение 81) Соединение, указанное в заголовке, получили из 2-хлорпиперазин-1-ил-4,5-дигидро-7 метоксиимидазо[4,5,1-ij]хинолин-6-онa, используя условия, описанные в примере 19 (29%). 1 Н ЯМР (500 МГц,число частей на миллион) ДМСО D6: 2,89 (t, 2 Н), 3,26 (m, 4 Н), 3,44 (m, 4 Н), 3,81 (s, 3H), 4,36 (t,2H), 6,79 (d, 1 Н), 7,06 (m,4 Н), 7,58 (d,1H). В следующей таблице проиллюстрированы химические структуры и физические свойства ряда соединений по изобретению, соответствующих общей формуле (I). В зависимости от того, чему равно n, 1 или 2, в этой формуле, два соединения формулы (I) представлены ниже с нумерацией атомов на бензимидазольном ядре для каждого из них. В данной таблице:- HCl представляет собой соль гидрохлорид, a CF3CO2H представляет собой соль трифторацетат,тогда как - представляет собой соединение в свободной форме,- Me, Et, n-Pr и tBu представляют собой соответственно группы метил, этил, н-пропил и трет-бутил,- Вn и Ph представляют собой соответственно группы бензил и фенил,- за исключением того, где указано иначе, анализы ЯМР соответствуют протонным ЯМР, и измерения проведены в d6-ДМСО.иозначают, что измерения проведены соответственно при 360 МГц и при 500 МГц. Если никакого указания подобного типа не дано, то измерение проведено при 200 МГц. Таблица Соединения по изобретению подвергали фармакологическим тестам по определению их ингибирующего воздействия на PARP, или поли(аденозиндифосфат (АДФ)-рибоза)полимеразу. Соединения по изобретению подвергали следующему тесту: Воздействия соединений на ферментативную активность PARP Рекомбинантную человеческую PARP-1 (hPARP-1) получали с помощью клеток Sf9, используя бакуловирусную систему экспрессии (Giner et al., Gene (1992) 114 279-283). Этот фермент частично очищали из клеточного экстракта, полученного после осаждения 70% сульфатом аммония. Полученный раствор hPARP-1 способен генерировать 0,5-0,7 нмоль никотинамида из НАД+(никотинамид-адениндинуклеотида) в стандартных условиях теста, описанных ниже. Тестируемые соединения растворяли в инкубационной среде, содержащей 50 мМ Трис-HCl, 10 мМ MgCl2, 20 мкМ ацетата цинка, 1,5 мМ дитиотрейтола, 0,2 мкг гистона и 0,1 мкг олигонуклеотида (GGAATTCC) на 100 мкл, в присутствии частично очищенной hPARP-1, забуференной до рН 8. Ферментативную реакцию инициировали путем добавления НАД+ (0,2 мМ) и проводили мониторинг при комнатной температуре в течение 20 мин. Реакцию останавливали путем добавления НСlO4 (1,2 М) при 4 С. После центрифугирования супернатанты анализировали с помощью ВЭЖХ (высокоэффективной жидкостной хроматографии) (колонка С 8 Shandon Ultrabase). Изократическую элюцию проводили, используя фосфатный буфер (0,1 М)- 19005950 рН 4,5, содержащий 6% ацетонитрила, впрыскиваемый при скорости 1,25 мл/мин в течение 6 мин. Образовавшийся никотинамид детектировали с помощью измерения поглощения УФ (ультрафиолета) элюата при 265 нм и анализировали количественно по сравнению с пиком, образованным с внешним стандартом никотинамида (2 нмоль). Остаточную активность hPARP-1, измеренную в присутствии изменяющихся концентраций соединений по изобретению сравнивали с активностью, полученной в их отсутствие. Все измерения проводили по меньшей мере в двух повторах и значения ИК 50 вычисляли, используя сигмоидальное уравнение доза-воздействие. Соединения, которые наиболее активны в данном тесте, характеризуются значениями ИК 50 между 5 и 500 нМ. Кроме того, соединения в соответствии с изобретением также активны в отношении PARP-2, соединения, которые наиболее активны в отношении данного фермента, также характеризуются значениями ИК 50 между 5 и 500 нМ. Из вышесказанного ясно, что соединения по изобретению обладают избирательной ингибирующей активностью в отношении PARP, в частности, PARP-1 и PARP-2. Таким образом, соединения по изобретению можно использовать для приготовления лекарственных продуктов, в частности, лекарственных продуктов, ингибирующих PARP. Эти лекарственные продукты находят применение в терапии, в частности, в предупреждении или лечении инфаркта миокарда, ишемии сердца, сердечной недостаточности, атеросклероза, рестеноза после чрескожной катетерной коронаропластики или шунтирования, церебральной ишемии и церебрального инфаркта, вызванного ишемией,травмой или тромбоэмболией, нейродегенеративных заболеваний, таких как болезнь Паркинсона, болезнь Альцгеймера и хорея Хантингтона, острой почечной недостаточности, в частности, ишемического происхождения или возникающей после трансплантации почки, трансплантации сердца: лечения отторжения трансплантата и ускоренного атеросклероза трансплантатов, воспалительных патологий, иммунологических расстройств, ревматоидных заболеваний, диабета и панкреатита, септического шока, острого респираторного дистресс-синдрома, опухолей и метастазов, аутоиммунных заболеваний, синдрома приобретенного иммунодефицита (СПИДа), гепатита, псориаза, васкулита, неспецифического язвенного колита, рассеянного склероза и миастении. Таким образом, соединения формулы (I) в соответствии с изобретением можно применять для приготовления лекарственного продукта для лечения и предупреждения расстройств, в которые вовлечен фермент PARP. Согласно следующему аспекту, объектом настоящего изобретения является применение соединений формулы (I), для которых R1 = R2 = R2' = R3 = Н,Х = С, n = m = 1 и R4 представляет собой либо группу 4-имидазолил, либо группу 5-метил-4-имидазолил, для изготовления лекарственного продукта для лечения или предупреждения расстройств, в которые вовлечен фермент поли(АДФрибоза)полимераза, или PARP, таких как расстройства, упомянутые выше. Наконец, настоящее изобретение также относится к фармацевтическим композициям, содержащим соединение по изобретению в качестве активного начала. Эти фармацевтические композиции содержат эффективную дозу соединения по изобретению, а также один или более чем один подходящий фармацевтический эксципиент. Указанные эксципиенты выбраны в соответствии с желаемыми фармацевтической формой и способом введения. В фармацевтических композициях по настоящему изобретению для перорального, подъязычного,подкожного, внутримышечного, внутривенного, местного, интратрахеального, интраназального, чрескожного или ректального введения активное начало приведенной выше формулы (I) либо его возможные соль или гидрат можно вводить в стандартной форме введения в смеси с общепринятыми фармацевтическими эксципиентами животным и людям для профилактики или лечения приведенных выше расстройств или заболевания. Стандартные формы введения, которые являются подходящими, включают в себя формы для перорального введения, такие как таблетки, гелевые капсулы, порошки, гранулы и пероральные растворы или суспензии, формы для подъязычного, трансбуккального, интратрахеального и интраназального введения, формы для подкожного, внутримышечного или внутривенного введения и формы для ректального введения. Для местного применения соединения по изобретению можно использовать в кремах, мазях или лосьонах. Доза активного начала, вводимая в сутки, может находиться в диапазоне от 0,1 до 1000 мг/кг посредством перорального, парентерального или ректального способа введения. Могут быть специальные случаи, при которых подходят более высокие или более низкие дозы, причем такие дозы также составляют часть изобретения. В обычной практике доза, которая подходит для каждого пациента, определяется врачом в соответствии со способом введения, а также массой и реакцией указанного пациента. При приготовлении твердой композиции в форме таблеток основной активный ингредиент смешивают с фармацевтическим эксципиентом, таким как желатин, крахмал, лактоза, стеарат магния, тальк,аравийская камедь или тому подобное. Таблетки можно покрывать сахарозой, производным целлюлозы или другими веществами. Таблетки можно изготавливать с помощью различных методик, таких как прямое таблетирование, сухое гранулирование, влажное гранулирование или горячее плавление. Препарат в форме гелевых капсул получают путем смешивания активного ингредиента с разбавите- 20005950 лем и наполнения мягких или твердых гелевых капсул полученной смесью. Водные суспензии, изотонические физиологические растворы или стерильные и инъекционные растворы, которые содержат фармакологически совместимые диспергирующие агенты и/или увлажняющие агенты, например пропиленгликоль или бутиленгликоль, можно использовать для парентерального введения. Согласно другому аспекту, настоящее изобретение также относится к способу лечения патологий,указанных выше, при котором вводят соединение по изобретению или его фармацевтически приемлемую соль. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения, соответствующие формуле (I) в которой R1 представляет собой атом водорода, группу С 1-С 4 алкил, атом галогена, нитрогруппу или группу С 1-С 4 алкокси,R2 и R2' независимо друг от друга представляют собой атом водорода или группу С 1-С 4 алкил,X представляет собой атом азота или атом углерода,n равно 1 или 2,m равно 1 или 2,и, когда X представляет собой атом азота,R3 представляет собой атом водорода или группу С 1-С 4 алкил, давая соединения формулы (I), содержащие четвертичный аммоний, либо, альтернативно, не существует, давая соединения формулы (I),содержащие вторичный или третичный амин,R4 представляет собой атом водорода,группу C1-С 6 алкил,группу С 3-С 7 циклоалкил,5- или 6-членную гетероциклоалкильную группу, содержащую атом азота в качестве гетероатома, возможно замещенную группой С 1-С 4 алкил или группой -COOR, в которой R представляет собой группу C1 С 6 алкил,группу -(СН 2)р-гетероарил, в которой р может находиться в диапазоне от 0 до 4 и в которой группа гетероарил выбрана из групп пиридил, аминопиридил, пиримидинил, пиразинил, пиридазинил, имидазолил и тиенил, причем указанная группа гетероарил возможно замещена группой С 1-С 4 алкил,группу гетероарилкарбонил, причем группа гетероарил выбрана из групп фурил, пиридил, пиримидил, пиразинил, пиридазинил и имидазолил,группу фенилкарбонил, причем группа фенил возможно замещена атомом галогена,группу (С 1-С 6)алкилкарбонил,группу -(CH2)pCOOR, в которой p может находиться в диапазоне от 0 до 4 и в которой R представляет собой группу C1-С 6 алкил,группу фенилсульфонил, возможно замещенную на фенильном ядре атомом галогена, группой трифторметил, группой С 1-С 4 алкил, нитрогруппой или группой С 1-С 4 алкокси, или альтернативно группу -(СН 2)р-фенил, в которой р может находиться в диапазоне от 0 до 4 и в которой группа фенил возможно замещена группами в количестве от одной до трех, независимо друг от друга выбранными из группы С 1-С 4 алкил, нитрогруппы, аминогруппы, гидроксильной группы, атома галогена, группы трифторметил, группы С 1-С 4 алкокси, группы (С 1-С 4)алкоксифенил, группы С 1-С 4 алкиламино, группы С 1 С 4 диалкиламино, группы -NHCHO или группы -NHCOR', в которой R' представляет собой группу С 1 С 4 алкокси или группу C1-С 4 алкил, причем эта группа С 1-С 4 алкил возможно замещена группой диметиламино, и,когда X представляет собой атом углерода,R3 представляет собой атом водорода, группу -NR5R6, группу -N(R5)3+, группу -NHCOR7, группу-CONHR5, группу -COR7, группу -NHCONH2, группу -ОН или группу -СН 2 ОН,R4 представляет собой атом водорода,группу -(СН 2)р-фенил, в которой р может находиться в диапазоне от 0 до 4 и в которой группа фенил возможно замещена группами в количестве от одной до трех, независимо друг от друга выбранными из: группы С 1-С 4 алкил, нитрогруппы, аминогруппы, атома галогена, группы трифторметил или группы С 1-С 4 алкокси,группу -(СН 2)р-гетероарил, в которой р может находиться в диапазоне от 0 до 4 и в которой группа гетероарил выбрана из группы пиридил, группы аминопиридил, группы пиримидинил, группы пирази- 21005950 нил или группы пиридазинил, или альтернативно группу -(CH2)tNR7R8, в которой t равно 0 или 1,при условии, что, когда R4 представляет собой группу -NR7R8, R3 является иным, чем группы -NR5R6,-NHCOR7, -NHCONH2 и -ОН,R5 и R6 независимо друг от друга представляют собой атом водорода или группу С 1-С 4 алкил,R7 и R8 независимо друг от друга представляют собой группу С 1-С 4 алкил или С 1-С 4 алкокси либо вместе образуют насыщенное 5-7-членное кольцо, возможно содержащее дополнительный атом азота,причем это кольцо возможно замещено на атоме углерода или на атоме азота, включая атом азота, к которому присоединены группы R7 и R8 с образованием четвертичного аммония, группой С 1-С 4 алкил или группой -COOR", в которой R" представляет собой группу фенил или (С 1-С 4)алкилфенил,в форме энантиомеров или диастереоизомеров либо смесей этих различных форм, включая рацемические смеси, а также в форме оснований или солей присоединения фармацевтически приемлемых кислот. 2. Соединения формулы (I) по п.1, отличающиеся тем, чтоR1 представляет собой атом водорода, группу С 1-С 4 алкил или группу С 1-С 4 алкокси,R2 представляет собой атом водорода или группу С 1-С 4 алкил,R2' представляет собой атом водорода,X представляет собой атом азота,n равно 1 или 2,m равно 1 или 2,R3 представляет собой атом водорода, давая соединения формулы (I), содержащие четвертичный аммоний, либо, альтернативно, не существует, давая соединения формулы (I), содержащие вторичный или третичный амин,R4 представляет собой атом водорода,группу С 1-С 6 алкил,группу С 3-С 7 циклоалкил,группу пиридил, пиримидинил или пиразинил, возможно замещенную группой С 1-С 4 алкил,группу гетероарилкарбонил, причем группа гетероарил выбрана из группы фурил и группы пиридил,группу фенилкарбонил, причем группа фенил возможно замещена атомом галогена,группу (С 1-С 6)алкилкарбонил,группу -(CH2)PCOOR, в которой р может находиться в диапазоне от 0 до 4 и в которой R представляет собой группу С 1-С 6 алкил,группу фенилсульфонил,группу фенил, замещенную группами в количестве от одной до трех, независимо друг от друга выбранными из группы С 1-С 4 алкил, нитрогруппы, аминогруппы, гидроксильной группы, атома галогена,группы трифторметил, группы С 1-С 4 алкокси, группы (С 1-С 4)алкоксифенил, группы (С 1-С 4)диалкиламино,группы -NHCHO или группы -NHCOR', в которой R' представляет собой группу С 1-С 4 алкокси или группу С 1-С 4 алкил, причем эта группа С 1-С 4 алкил возможно замещена группой диметиламино,группу -(СН 2)р-фенил, в которой р может находиться в диапазоне от 0 до 4,группу -(СН 2)р-пиридил, в которой р может находиться в диапазоне от 0 до 4,группу -(СН 2)р-тиенил, в которой р может находиться в диапазоне от 0 до 4,5- или 6-членную гетероциклоалкильную группу, содержащую атом азота в качестве гетероатома,возможно замещенную группой С 1-С 4 алкил или группой -COOR, в которой R представляет собой группу С 1-С 6 алкил или альтернативноR1 представляет собой атом водорода,R2 и R2' независимо друг от друга представляют собой атом водорода или группу С 1-С 4 алкил,X представляет собой атом углерода,n равно 1 или 2,m равно 1,R3 представляет собой атом водорода, группу -NR5R6, группу -N(R5)3+, группу -NHCOR7, группу-CONHR5, группу -NHCONH2, группу -ОН или группу -СН 2 ОН,R4 представляет собой атом водорода,группу бензил,группу фенил, возможно замещенную группами в количестве от одной до трех, независимо друг от друга выбранными из группы С 1-С 4 алкил, нитрогруппы, аминогруппы, атома галогена, группы трифторметил или группы С 1-С 4 алкокси,группу пиридил,группу -NR7R8,- 22005950 при условии, что, когда R4 представляет собой группу -NR7R8, R3 является иным, чем группы NR5R6, -NHCOR7, -NHCONH2 и -ОН,R5 и R6 независимо друг от друга представляют собой атом водорода или группу С 1-С 4 алкил,R7 и R8 независимо друг от друга представляют собой группу С 1-С 4 алкил или С 1-С 4 алкокси либо вместе образуют насыщенное 5-7-членное кольцо, возможно содержащее дополнительный атом азота,причем это кольцо возможно замещено на атоме углерода или на атоме азота, включая атом азота, к которому присоединены группы R7 и R8 с образованием четвертичного аммония, группой С 1-С 4 алкил или группой -COOR", в которой R" представляет собой группу фенил или (С 1-С 4)алкилфенил,в форме энантиомеров или диастереоизомеров либо смесей этих различных форм, включая рацемические смеси, а также в форме оснований или солей присоединения фармацевтически приемлемых кислот. 3. Соединения формулы (I) по п.1 или 2, отличающиеся тем, чтоR1 представляет собой атом водорода, группу метил или группу метокси,R2 представляет собой атом водорода или группу метил,R2' представляет собой атом водорода,X представляет собой атом азота,n равно 1 или 2,m равно 1 или 2,R3 представляет собой атом водорода давая соединения формулы (I), содержащие четвертичный аммоний, либо, альтернативно, не существует давая соединения формулы (I), содержащие вторичный или третичный амин,R4 представляет собой атом водорода,группу С 1-С 4 алкил,группу С 6-С 7 циклоалкил,группу пиридил, пиримидинил или пиразинил, возможно замещенную группой С 1-С 4 алкил,группу гетероарилкарбонил, причем группа гетероарил выбрана из группы фурил и группы пиридил,группу фенилкарбонил, причем группа фенил возможно замещена атомом галогена,группу (С 3-С 5)алкилкарбонил,группу -(CH2)PCOOR, в которой р равно 0 или 1 и в которой R представляет собой группу С 1 С 4 алкил,группу фенилсульфонил,группу фенил, замещенную группами в количестве от одной до трех, независимо друг от друга выбранными из группы метил, нитрогруппы, аминогруппы, гидроксильной группы, атома галогена, группы трифторметил, группы метокси, группы (С 1-С 4)алкоксифенил, группы диметиламино, группы -NHCHO или группы -NHCOR1, в которой R' представляет собой группу С 1-С 4 алкокси или группу С 1-С 4 алкил,причем эта группа С 1-С 4 алкил возможно замещена группой диметиламино,группу -(СН 2)р-фенил, в которой р равно 1, 2, 3 или 4,группу -(СН 2)р-пиридил, в которой р может находиться в диапазоне от 1 до 3,группу -(СН 2)р-тиенил, в которой р равно 2,6-членную гетероциклоалкильную группу, содержащую атом азота в качестве гетероатома, возможно замещенную группой метил или группой -COOR, в которой R представляет собой группу С 1-С 4 алкил,или альтернативно:R1 представляет собой атом водорода,R2 и R2' независимо друг от друга представляют собой атом водорода или группу метил,X представляет собой атом углерода,n равно 1 или 2,m равно 1,R3 представляет собой атом водорода, группу -NR5R6, группу -N(СН 3)3+, группу -NHCOR7, группу-CONHR5, группу -NHCONH2, группу -ОН или группу -СН 2 ОН,R4 представляет собой атом водорода,группу бензил,группу фенил, возможно замещенную группами в количестве от одной до трех, независимо друг от друга выбранными из атома галогена и группы трифторметил,группу пиридил,группу -NR7R8,при условии, что, когда R4 представляет собой группу -NR7R8, R3 является иным, чем группы-NR5R6, -NHCOR7, -NHCONH2 и -ОН,R5 и R6 независимо друг от друга представляют собой атом водорода или группу С 1-С 4 алкил,R7 и R8 независимо друг от друга представляют собой группу С 1-С 4 алкил либо вместе образуют на- 23005950 сыщенное 5-7-членное кольцо, возможно содержащее дополнительный атом азота, причем это кольцо возможно замещено на атоме углерода или на атоме азота, включая атом азота, к которому присоединены группы R7 и R8 с образованием четвертичного аммония, группой метил или группой -COOR", в которой R" представляет собой группу (С 1-С 4)алкилфенил,в форме энантиомеров или диастереоизомеров либо смесей этих различных форм, включая рацемические смеси, а также в форме оснований или солей присоединения фармацевтически приемлемых кислот. 4. Соединения формулы (I) по пп.1-3, которые выбраны из группы, состоящей из 1-(6-оксо-5,6-дигидро-4 Н-имидазо[4,5,1-ij]хинолин-2-ил)-4-пиперидинопиперидина,1-метил-1-[1-(6-оксо-5,6-дигидро-4H-имидазо[4,5,1-ij]хинолин-2-ил)-4-пиперидинил]пиперидина,2-[4-(4-диметиламинофенил)пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,2-[4-(4-трет-бутоксикарбониламинофенил)пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,2-[4-(4-аминофенил)пиперазин-1-ил]-4,5-дигидро-4H-имидазо[4,5,1-ij]хинолин-6-она,2-[4-(4-ацетамидофенил)пиперазин-1-ил]-4,5-дигидро-4 Н-имидазо[4,5,1-ij]хинолин-6-она,2-(4-н-пропилпиперазин-1-ил)-4,5-дигидро-4 Н-имидазо[4,5,1-ij]хинолин-6-она,2-(4-трет-бутоксикарбонилпиперазин-1-ил)-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,2-(4-ацетилпиперазин-1-ил)-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,2-[4-(4-пиридил)пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,2-(4-бензилпиперидин-1-ил)-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,1-(6-оксо-5,6-дигидро-4H-имидазо[4,5,1-ij]хинолин-2-ил)-4-фенил-4-пиперидинкарбоксамида,1-(6-оксо-5,6-дигидро-4H-имидазо[4,5,1-ij]хинолин-2-ил)-4-фенил-4-аминопиперидина,2-[4-(4-гидроксифенил) пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,2-[4-(4-фторфенил)пиперазин-1-ил]-4,5-дигидро-9-метил-имидазо[4,5,1-ij]хинолин-6-она,1-[4-(4-фторфенил)пиперазин-1-ил]-3-метил-8,9-дигидро-7 Н-2,9 а-диазабензо[сd]азулен-6-она,2-[4-(4-фторфенил)пиперазин-1-ил]-4,5-дигидро-7-метилимидазо[4,5,1-ij]хинолин-6-она,2-[4-(4-фторфенил)пиперазин-1-ил]-4,5-дигидро-8-метилимидазо[4,5,1-ij]хинолин-6-она,2-[4-(4-фторфенил)пиперазин-1-ил]-4,5-дигидро-7-метоксиимидазо[4,5,1-ij]хинолин-6-она,2-[4-(4-метоксифенил)пиперазин-1-ил]-4,5-дигидроимидазо[4,5,1-ij]хинолин-6-она,1-(6-оксо-5,6-дигидро-4 Н-имидазо[4,5,1-ij]хинолин-2-ил)-4 Н-4-диметиламинопиперидина,в форме энантиомеров или диастереизомеров или смесей этих различных форм, включая рацемические смеси, а также в форме оснований или солей присоединения фармацевтически приемлемых кислот. 5. Способ получения соединения формулы (I) по любому из пп.1-4, отличающийся тем, что производное формулы (II) в котором R1, R2, R2' и n являются такими, как определено в п.1, а А представляет собой уходящую группу, подвергают реакции в присутствии амина формулы (III) в котором X, R3, R4 и m являются такими, как определено в п.1, в растворителе, который может представлять собой спирт, простой эфир или углеводород, с получением соединения формулы (I) по п.1, причем данную реакцию можно проводить в присутствии основания, в присутствии галогенидов щелочных металлов или в присутствии катализаторов на основе палладия или на основе никеля. 6. Соединения формулы (II), как они определены в п.5, которые полезны в качестве синтетических промежуточных соединений. 7. Лекарственный продукт, обладающий ингибирующей активностью в отношении PARP, отличающийся тем, что он содержит соединение формулы (I) по любому из пп.1-4. 8. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении PARP, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-4, а также один или более чем один подходящий фармацевтический эксципиент. 9. Применение соединения формулы (I) по любому из пп.1-4 для приготовления лекарственного продукта для предупреждения или лечения расстройств, в которые вовлечен фермент поли(АДФрибоза)полимераза. 10. Применение соединения формулы (I) по любому из пп.1-4 для приготовления лекарственного продукта для предупреждения или лечения инфаркта миокарда, ишемии сердца, сердечной недостаточности, атеросклероза, рестеноза после чрескожной катетерной коронаропластики или шунтирования,- 24005950 церебральной ишемии и церебрального инфаркта, вызванного ишемией, травмой или тромбоэмболией,нейродегенеративных заболеваний, таких как болезнь Паркинсона, болезнь Альцгеймера и хорея Хантингтона, острой почечной недостаточности, в частности, ишемического происхождения или возникающей после трансплантации почки, трансплантации сердца: лечения отторжения трансплантата и ускоренного атеросклероза трансплантатов, воспалительных патологий, иммунологических расстройств,ревматоидных заболеваний, диабета и панкреатита, септического шока, острого респираторного дистресс-синдрома, опухолей и метастазов, аутоиммунных заболеваний, синдрома приобретенного иммунодефицита (СПИДа), гепатита, псориаза, васкулита, неспецифического язвенного колита, рассеянного склероза и миастении. 11. Применение соединений формулы (I) по п.1, в которых R1=R2=R2'=R3=Н, X=С, n=m=1 и R4 представляет собой либо группу 4-имидазолил, либо группу 5-метил-4-имидазолил, для изготовления лекарственного продукта для лечения или предупреждения расстройств, в которые вовлечен фермент поли(АДФ-рибоза)полимераза.
МПК / Метки
МПК: A61K 31/4375, C07D 471/06, C07D 487/06, A61P 9/00
Метки: получение, терапевтическое, бензимидазола, применение, производные
Код ссылки
<a href="https://eas.patents.su/26-5950-proizvodnye-benzimidazola-ih-poluchenie-i-terapevticheskoe-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензимидазола, их получение и терапевтическое применение</a>
Предыдущий патент: Способ производства фармацевтической композиции низкой дозы
Следующий патент: Полифункциональный биосовместимый гидрогель и способ его получения
Случайный патент: Инъекционные композиции пролонгированного действия, содержащие гидрогенизированное касторовое масло