Соединения, обладающие антимикобактериальной активностью
Номер патента: 12461
Опубликовано: 30.10.2009
Авторы: Джана Гурхари, Синха Ракеш Кумар, Аджай Шанкар, Упадхайайа Рам Шанкар, Джаин Санджай, Арора Судершан Кумар, Синха Неелима
Формула / Реферат
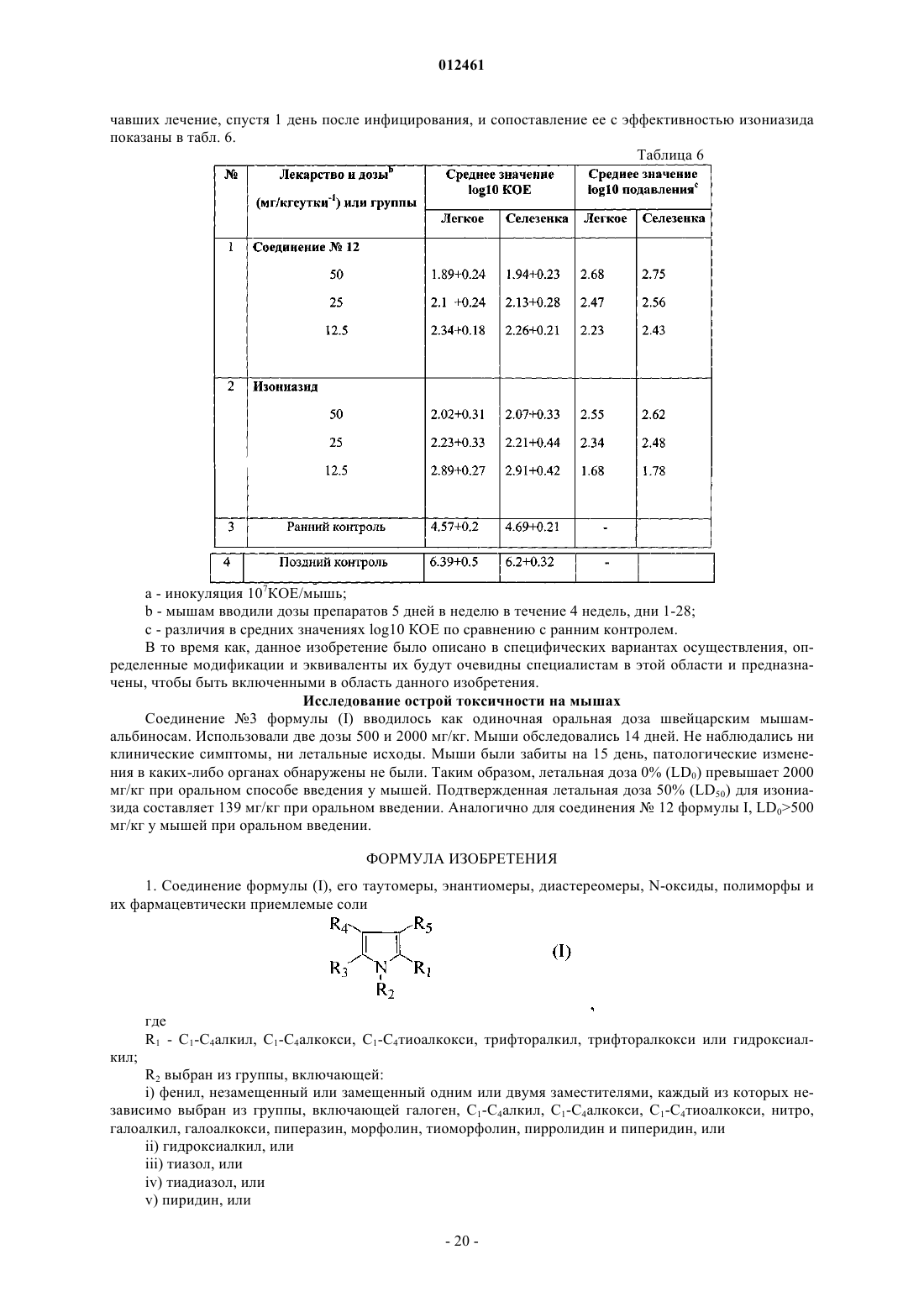
1. Соединение формулы (I), его таутомеры, энантиомеры, диастереомеры, N-оксиды, полиморфы и их фармацевтически приемлемые соли

где
R1 - С1-С4алкил, С1-С4алкокси, С1-С4тиоалкокси, трифторалкил, трифторалкокси или гидроксиалкил;
R2 выбран из группы, включающей:
i) фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, C1-C4алкил, С1-С4алкокси, С1-С4тиоалкокси, нитро, галоалкил, галоалкокси, пиперазин, морфолин, тиоморфолин, пирролидин и пиперидин, или
ii) гидроксиалкил, или
iii) тиазол, или
iv) тиадиазол, или
v) пиридин, или
vi) нафталин, или
vii) NHCOR6, где R6 - арил, гетероарил, гетероциклил;
R3 - фенил, незамещенный или замещенный 1-3 заместителями, выбранными из группы, включающей SH, NO2, CH2Cl, CH2Br, OCF3, OCH2CF3, Cl, Br, I, F, C1-C6алкокси, С1-С6алкил, С1-С6тиоалкил, С6-С10арил, С5-С6гетероарил с 1-3 гетероатомами, выбранными из О, N и S, гетероарил, если один из R4 или R5 - Н, тогда другой является-(CH2)n-R7, где n=1-3 и R7 выбран из группы
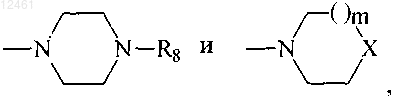
где R8 - фенил, незамещенный или замещенный 1-2 заместителями, каждый из которых независимо выбран из группы, включающей галоген,С1-С4алкил,С1-С4алкокси, С1-С4тиоалкокси, нитро, амино, галоалкил, галоалкокси; бензил или бензил, замещенный 3,4-метилендиокси; гетероарил; гетероароил; дифенилметил,
m=0-2 и
X является -NCH3, CH2, S, SO или SO2;
так что, если R2 - фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С1-С4алкил, С1-С4алкокси, С1-С4тиоалкокси, нитро, галоалкил, галоалкокси, пиперазин, морфолин, тиоморфолин, пирролидин, пиперидин и R4 - водород; R8 не является C1-С4алкилом или X не является -NCH3, S, SO или SO2, если m=1, или X не является-СН2, если m=0.
2. Соединение, его таутомеры, энантиомеры, диастереомеры, N-оксиды, полиморфы и их фармацевтически приемлемые соли по п.1, где соединение формулы I выбрано из группы, включающей
1-{[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил}-4-(4-фторфенил)пиперазин,
1-{[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил}-4-(2-метоксифенил)пиперазин,
1-{[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил}-4-(3-трифторметилфенил)пиперазин,
1-{[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил}-4-(2-пиридил) пиперазин,
1-{[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил}-4-(2-пиримидил)пиперазин,
1-{[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил}-4-(дифенилметил)пиперазин.
4-{[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил}пиперазинил-2-фурилкетон,
5-[(4-{[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил}пиперазинил)метил]-2Н-бензо[d]1,3-диоксолан,
4-{[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил}пиперазинилоксолан-2-ил-кетон,
1-{[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил}-4-(5-хлор-2-метилфенил)пиперазин,
N-(3-{[4-(4-фторфенил)пиперазинил]метил}-2-метил-5-фенилпирролил)-4-пиридилкарбоксамид,
N-(3-{[4-(3-фторфенил)пиперазинил]метил}-2-метил-5-фенилпирролил)-4-пиридилкарбоксамид,
N-(3-{[4-(2-метоксифенил)пиперазинил]метил}-2-метил-5-фенилпирролил)-4-пиридилкарбоксамид,
N-(3-{[4-(2-пиридил)пиперазинил]метил}-2-метил-5-фенилпирролил)-4-пиридилкарбоксамид,
N-(2-метил-5-фенил-3-{[4-бензилпиперазинил]метил}пирролил)-4-пиридилкарбоксамид,
N-2-метил-3-[(4-метилпиперазинил)метил]-5-фенилпирролил-4-пиридилкарбоксамид,
N-(3-{[4-(2Н-бензо[d]1,3-диоксолен-5-илметил)пиперазинил]метил}-2-метил-5-фенилпирролил)-4-пиридилкарбоксамид,
N-[2-метил-5-фенил-3-(пиперидинилметил)пирролил-4-пиридилкарбоксамид,
N-(2-метил-5-фенил-3-(пирролидинилметил)пирролил)-4-пиридилкарбоксамид,
N-[2-метил-3-(морфолин-4-ил-метил)-5-фенилпирролил]-4-пиридилкарбоксамид.
N-(2-метил-5-фенил-3-(1,4-тиазапергидроин-4-илметил)пирролил)-4-пиридилкарбоксамид,
N-(3-{[4-(4-фторфенил)пиперазинил]метил}-5-метил-2-фенилпирролил)-4-пиридилкарбоксамид,
N-(3-{[4-(3-трифторметилфенил)пиперазинил]метил}-5-метил-2-фенилпирролил)-4-пиридилкарбоксамид,
N-(3-{[4-(2Н-бензо[d]1,3-диоксолан-5-илметил)пиперазинил]метил}-5-метил-2-фенилпирролил)-4-пиридилкарбоксамид,
N-(3-{[4-(4-фторфенил)пиперазинил]метил}-2-метил-5-фенилпирролил)пиразин-2-ил-карбоксамид,
N-(3-{[4-(2-метоксифенил)пиперазинил]метил}-2-метил-5-фенилпирролил)пиразин-2-илкарбоксамид,
N-(3-{[4-(3-трифторметилфенил)пиперазинил]метил}-2-метил-5-фенилпирролил)пиразин-2-илкарбоксамид,
N-(3-{[4-(2-пиридил)пиперазинил]метил}-2-метил-5-фенилпирролил)пиразин-2-ил-карбоксамид,
N-(3-{[4-(2H-бензо[d]1,3-диоксолан-5-илметил)пиперазинил]метил}-2-метил-5-фенилпирролил)пиразин-2-илкарбоксамид,
N-(3-{[4-(дифенилметил)пиперазинил]метил}-2-метил-5-фенилпирролил)пиразин-2-илкарбоксамид,
N-(3-{[4-(4-фторфенил)пиперазинил]метил}-5-метил-2-фенилпирролил)пиразин-2-илкарбоксамид,
N-(3-{[4-(2-метоксифенил)пиперазинил]метил}-5-метил-2-фенилпирролил)пиразин-2-илхарбоксамид,
N-(3-{[4-(3-трифторметилфенил)пиперазинил]метил}-5-метил-2-фенилпирролил)пиразин-2-илкарбоксамид,
N-(3-{[4-(2-пиридил)пиперазинил]метил}-5-метил-2-фенилпирролил)пиразин-2-илкарбоксамид,
N-(3-{[4-(2Н-бензо[d]1,3-диоксолан-5-ил-метил)пиперазинил]метил}-5-метил-2-фенилпирролил)пиразин-2-илкарбоксамид,
N-(3-{[4-(дифенилметил)пиперазинил]метил}-5-метил-2-фенилпирролил)пиразин-2-илкарбоксамид,
N-(5-(4-хлорфенил)-3-{[4-(4-фторфенил)пиперазинил]метил}-2-метил-5-фенилпирролил)пиразин-2-илкарбоксамид,
N-(5-(4-хлорфенил)-3-{[4-(2-метоксифенил)пиперазинил]метил}-2-метилпирролил)пиразин-2-илкарбоксамид,
N-(5-(4-хлорфенил)-3-{[4-(3-трифторметилфенил)пиперазинил]метил}-2-метилпирролил)пиразин-2-илкарбоксамид,
N-(5-(4-хлорфенил)-3-{[4-(2-пиридил)пиперазинил]метил}-2-метилпирролил)пиразин-2-илкарбоксамид,
N-(2-(4-хлорфенил)-3-{[4-(4-фторфенил)пиперазинил]метил}пирролил)пиразин-2-илкарбоксамид,
N-(2-(4-хлорфенил)-3-{[4-(2-метоксифенил)пиперазинил]метил}-5-метилпирролил)пиразин-2-ил-карбоксамид,
N-(2-(4-хлорфенил)-3-{[4-(3-трифторметилфенил)пиперазинил]метил}-5-метилпирролил)пиразин-2-илкарбоксамид,
1-{[1-(2,4-дифторфенил)-5-(4-хлорфенил)-2-метилпиррол-3-ил]метил}-4-(4-фторфенил)пиперазин,
1-{[1-(2,4-дифторфенил)-5-(4-хлорфенил)-2-метилпиррол-3-ил]метил}-4-(2-метоксифенил)пиперазин,
1-{[1-(2,4-дифторфенил)-5-(4-хлорфенил)-2-метилпиррол-3-ил]метил}-4-(3-трифторметилфенил)пиперазин,
1-{[1-(2,4-дифторфенил)-5-(4-хлорфенил)-2-метилпиррол-3-ил]метил}-4-(2-пиридил)пиперазин,
1-{[1-(2,4-дифторфенил)-5-(4-хлорфенил)-2-метилпиррол-3-ил]метил}-4-(4-дифенилметил)пиперазин,
1-{[1-(2,4-дифторфенил)-2-(4-хлорфенил)-5-метилпиррол-3-ил]метил}-4-(дифенилметил)пиперазин,
5-[(4-{[1-(2,4-дифторфенил)-5-(4-хлорфенил)-2-метилпиррол-3-ил]метил}пиперазинил)метил]-2Н-бензо[d]1,3-диоксолан,
1-{[1-(2,4-дифторфенил)-2-метил-5-фенилпиррол-3-ил]метил}-4-(4-фторфенил)пиперазин,
1-{[1-(2,4-дифторфенил)-2-метил-5-фенилпиррол-3-ил]метил}-4-(2-метоксифенил)пиперазин,
1-{[1-(2,4-дифторфенил)-2-метил-5-фенилпиррол-3-ил]метил}-4-(3-трифторметилфенил)пиперазин,
1-{[1-(2,4-дифторфенил)-2-метил-5-фенилпиррол-3-ил]метил}-4-(2-пиридил) пиперазин,
1-{[1-(2,4-дифторфенил)-5-метил-2-фенилпиррол-3-ил]метил}-4-(4-фторфенил) пиперазин,
1-{[1-(2,4-дифторфенил)-5-метил-2-фенилпиррол-3-ил]метил}-4-(2-метоксифенил)пиперазин,
1-{[1-(2,4-дифторфенил)-5-метил-2-фенилпиррол-3-ил]метил}-4-(3-трифторметилфенил)пиперазин,
1-{[1-(2,4-дифторфенил)-5-метил-2-фенилпиррол-3-ил]метил}-4-(2-пиридил)пиперазин,
1-{[5-(4-хлорфенил)-2-метил-1-нафтилпиррол-3-ил]метил}-4-(2-метоксифенил) пиперазин,
1-{[5-(4-хлорфенил)-2-метил-1-нафтилпиррол-3-ил]метил}-4-(3-трифторметилфенил)пиперазин,
1-{[5-(4-хлорфенил)-2-метил-1-нафтилпиррол-3-ил]метил}-4-(2-пиридил)пиперазин,
5-[(4-{[5-(4-хлорфенил)-2-метил-1-нафтилпиррол-3-ил]метил}пиперазинил)метил]-2Н-бензо[d]1,3-диоксолен,
1-{[2-(4-хлорфенил)-5-метил-1-нафтилпиррол-3-ил]метил}-4-(2-метоксифенил)пиперазин,
1-{[2-(4-хлорфенил)-5-метил-1-нафтилпиррол-3-ил]метил}-4-(3-трифторметилфенил)пиперазин,
1-{[2-(4-хлорфенил)-5-метил-1-нафтилпиррол-3-ил]метил}-4-(2-пиридил)пиперазин,
N-(5-(4-хлорфенил)-3-{[4-(4-фторфенил)пиперазинил]метил}-2-метилпирролил)-4-пиридилкарбоксамид,
N-(5-(4-хлорфенил)-3-{[4-(2-метоксифенил)пиперазинил]метил}-2-метилпирролил)-4-пиридилкарбоксамид,
N-(5-(4-хлорфенил)-3-{[4-(3-трифторметилфенил)пиперазинил]метил}-2-метилпирролил)-4-пиридилкарбоксамид,
N-(5-(4-хлорфенил)-3-{[4-(2-пиридил)пиперазинил]метил}-2-метилпирролил)-4-пиридилкарбоксамид,
N-(3-{[4-(2Н-бензо[d]1,3-диоксолан-5-ил-метил)пиперазинил]метил}-5-(4-хлорфенил)-2-метилпирролил)-4-пиридилкарбоксамид,
N-(2-(4-хлорфенил)-3-{[4-(4-фторфенил)пиперазинил]метил}-5-метилпирролил)-4-пиридилкарбоксамид,
N-(2-(4-хлорфенил)-3-{[4-(2-метоксифенил)пиперазинил]метил}-5-метилпирролил)-4-пиридилкарбоксамид,
N-(2-(4-хлорфенил)-3-{[4-(3-трифторметилфенил)пиперазинил]метил}-5-метилпирролил)-4-пиридилкарбоксамид,
N-(2-(4-хлорфенил)-3-{[4-(2-пиридил)пиперазинил]метил}-5-метилпирролил)-4-пиридилкарбоксамид,
N-(3-{[4-(2Н-бензо[d]1,3-диоксолан-5-ил-метил)пиперазинил]метил}-2-(4-хлофенил)-5-метилпирролил)-4-пиридилкарбоксамид,
4-(4-фторфенил)-1-[(2-метил-5-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин,
4-(2-метоксифенил)-1-[2-метил-5-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин,
4-(3-трифторметилфенил)-1-[(2-метил-5-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин,
1-[(2-метил-5-фенил-1-(2-пиридил)пиррол-3-ил)метил]-4-(2-пиридил)пиперазин,
5-({4-[(2-метил-5-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазинил}метил)-2Н-бензо[d]1,3-диоксолан,
4-(4-фторфенил)-1-[5-метил-2-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин,
4-(2-метоксифенил)-1-[5-метил-2-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин,
4-(3-трифторметилфенил)-1-[5-метил-2-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин,
1-[(5-метил-2-фенил-1-(2-пиридил)пиррол-3-ил)метил]-4-(2-пиридил)пиперазин,
5-({4-[(5-метил-2-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазинил}метил)-2Н-бензо[d]1,3-диоксолан,
1-{[1,5-бис(4-хлорфенил)-2-этилпиррол-3-ил]метил}-4-(3-трифторметилфенил) пиперазин,
N-[5-(4-хлорфенил)-2-метил-3-(1,4-тиазапергидроин-4-ил-метил)пирролил]-4-пиридилкарбоксамид,
2-[3-(гидроксиметил)-5-метил-2-фенил-4-(1,4-тиазапергидроин-4-ил-метил)пирролил]бутан-1-ол и
2-[2-метил-5-фенил-3-(1,4-тиазапергидроин-4-илметил)пирролил]бутан-1-ол.
3. Фармацевтическая композиция, включающая:
а) по меньшей мере одно или несколько соединений по п.1 или 2, их таутомеры, энантиомеры, диастереомеры, N-оксиды, полиморфы и фармацевтически приемлемые соли;
b) их фармацевтически приемлемые носители.
4. Фармацевтическая композиция по п.3, являющаяся твердым или жидким препаратом.
5. Фармацевтическая композиция по п.3, предназначенная для орального или парентерального введения.
6. Способ ингибирования роста клетки микроорганизма по меньшей мере одним соединением формулы (I), его таутомерами, энантиомерами, диастереомерами, N-оксидами, полиморфами и их фармацевтически приемлемыми солями, с их фармацевтическими носителями или без них.
7. Способ по п.6, в котором клеткой микроорганизма является Mycobacterium tuberculosis, лекарственно резистентная М. tuberculosis, M. avium- intracellulare комплекс, М. Fortuitum и М. kansasii.
8. Способ лечения микобактериальных инфекций у млекопитающих, включающий введение эффективного противомикобактериального количества по меньшей мере одного соединения формулы (I), его таутомеров, энантиомеров, диастереомеров, N-оксидов, полиморф и их фармацевтически приемлемых солей, с их фармацевтическими носителями или без них.
9. Способ по п.7 лечения туберкулеза у млекопитающих, который включает введение эффективного противомикобактериального количества по меньшей мере одного соединения формулы I, его таутомеров, энантиомеров, диастереомеров, N-оксидов, полиморф и их фармацевтически приемлемых солей, с их фармацевтическими носителями или без них.
10. Способ получения соединения формулы (I)
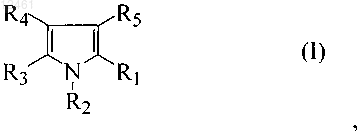
при котором данное соединение получают реакцией соединения формулы (V)

где R1 - С1-С4алкил, С1-С4алкокси,С1-С4тиоалкокси, трифторалкил, трифторалкокси или гидроксиалкил;
R2 выбран из группы, включающей:
i) фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С1-С4алкил, С1-С4алкокси, С1-С4тиоалкокси, нитро, галоалкил, галоалкокси, пиперазин, морфолин, тиоморфолин, пирролидин и пиперидин, или
ii) гидроксиалкил, или
iii) тиазол, или
iv) тиадиазол, или
v) пиридин, или
vi) нафталин, или
vii) NHCOR6, где R6 - арил, гетероарил, гетероциклил;
R3 - фенил, незамещенный или замещенный 1-3 заместителями, выбранными из группы, включающей SH, NO2, CH2Cl, CH2Br, OCF3, OCH2CF3, Cl, Br, I, F, C1-C6алкокси, С1-С6алкил, С1-С6тиоалкил, С6-С10арил, С5-С6гетероарил с 1-3 гетероатомами, выбранными из О, N и S, гетероарил,
с амином формулы R7H, где R7 выбран из группы
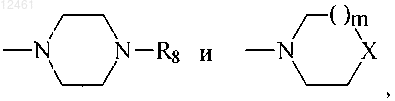
где R8 - фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С1-С4алкил, С1-С4алкокси, С1-С4тиоалкокси, нитро, амино, галоалкил, галоалкокси; бензил или бензил, замещенный 3,4-метилендиокси; гетероарил; гетероароил; дифенилметил;
m=0-2 и
X является -NCH3, CH2, S, SO или SO2,
так что, если в соединении формулы I один из R4 или R5 является Н, другой является -(CH2)n-R7, где n=1-3 и R7 выбран из группы
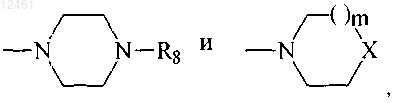
где R8 - фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С1-С4алкил, С1-С4алкокси, С1-С4тиоалкокси, нитро, амино, галоалкил, галоалкокси; бензил или бензил, замещенный 3,4-метилендиокси; гетероарил; незамещенный или замещенный гетероароил; дифенилметил; m=0-2 и
X является -NCH3, CH2, S, SO или SO2;
так что R2 - фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из групяы, включающей галоген, С1-С4алкил, С1-С4алкокси, С1-С4тиоалкокси, нитро, галоалкил, галоалкокси, пиперазин, морфолин, тиоморфолин, пирролидин, пиперидин и R4 - водород; R8 не является C1-С4алкилом или X не является -NCH3, S, SO или SO2, если m=1, или X не является -СН2, если m=0.
11. Способ по п.10, в котором соединение формулы (V) получают реакцией соединения формулы (IV)
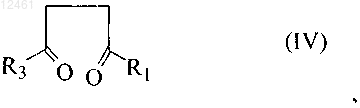
где R1 - С1-С4алкил, С1-С4алкокси, С1-С4тиоалкокси, трифторалкил, трифторалкокси или гидроксиалкил;
R3 - фенил, незамещенный или замещенный 1-3 заместителями, выбранными из группы, включающей SH, NO2, CH2Cl, CH2Br, OCF3, OCH2CF3, Cl, Br, I, F, C1-C6алкокси, С1-С6алкил, С1-С6тиоалкил, С6-С10арил, С5-С6гетероарил с 1-3 гетероатомами, выбранными из О, N и S, гетероарил,
с амином формулы R2-NH2, где R2 выбран из группы, включающей:
i) фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С1-С4алкил, С1-С4алкокси, C1-C4 тиоалкокси, нитро, галоалкил, галоалкокси, пиперазин, морфолин, тиоморфолин, пирролидин и пиперидин, или
ii) гидроксиалкил, или
iii) тиазол, или
iv) тиадиазол, или
v) пиридин, или
vi) нафталин, или
vii) NHCOR6, где R6 - арил, гетероарил, гетероциклил.
12. Способ по п.11, в котором соединение формулы (IV) получают реакцией соединения формулы (II)
![]()
где R3 - фенил, незамещенный или замещенный 1-3 заместителями, выбранными из группы, включающей SH, NO2, CH2Cl, CH2Br, OCF3, OCH2CF3, Cl, Br, I, F, C1-C6 алкокси, С1-С6алкил, С1-С6тиоалкил, С6-С10арил, C5-С6гетероарил с 1-3 гетероатомами, выбранными из О, N и S, гетероарил, с соединением формулы (III)
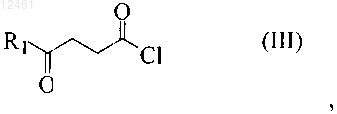
где R1 - С1-С4алкил, С1-С4алкокси, С1-С4тиоалкокси, трифторалкил, трифторалкокси или гидроксиалкил.
13. Способ по п.12, в котором соединение формулы (IV) получают реакцией соединения формулы (VI)
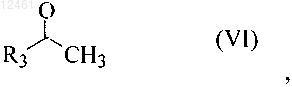
где R3 - фенил, незамещенный или замещенный 1-3 заместителями, выбранными из группы, включающей SH, NO2, CH2Cl, CH2Br, OCF3, OCH2CF3, Cl, Br, I, F, С1-С6алкокси, С1-С6алкил, С1-С6тиоалкил, С6-С10арил, С5-С6гетероарил с 1-3 гетероатомами, выбранными из О, N и S, гетероарил, с соединением формулы (VII)

где R1 - С1-С4алкил, С1-С4алкокси, С1-С4тиоалкокси, трифторалкил, трифторалкокси или гидроксиалкил.
Текст
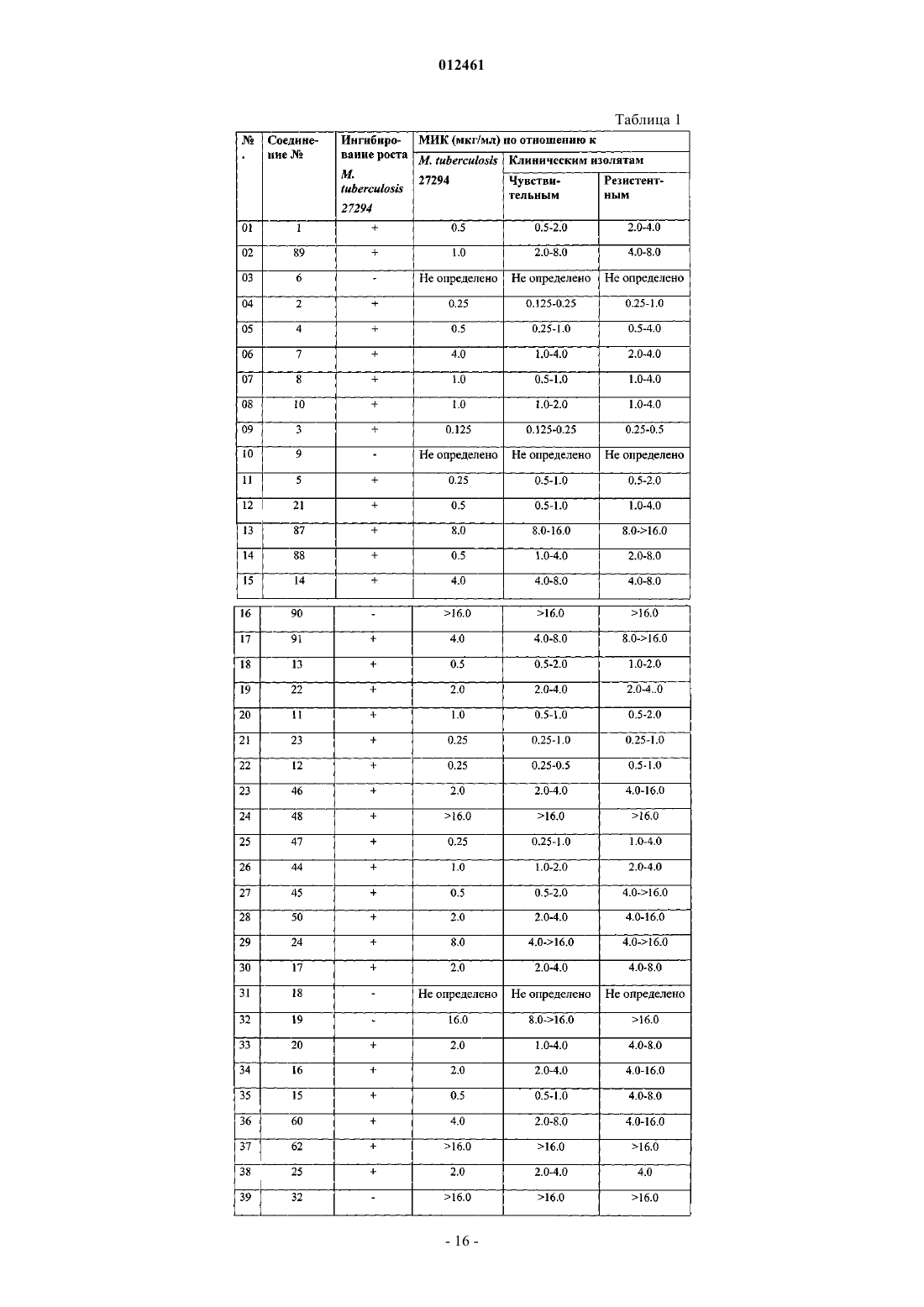
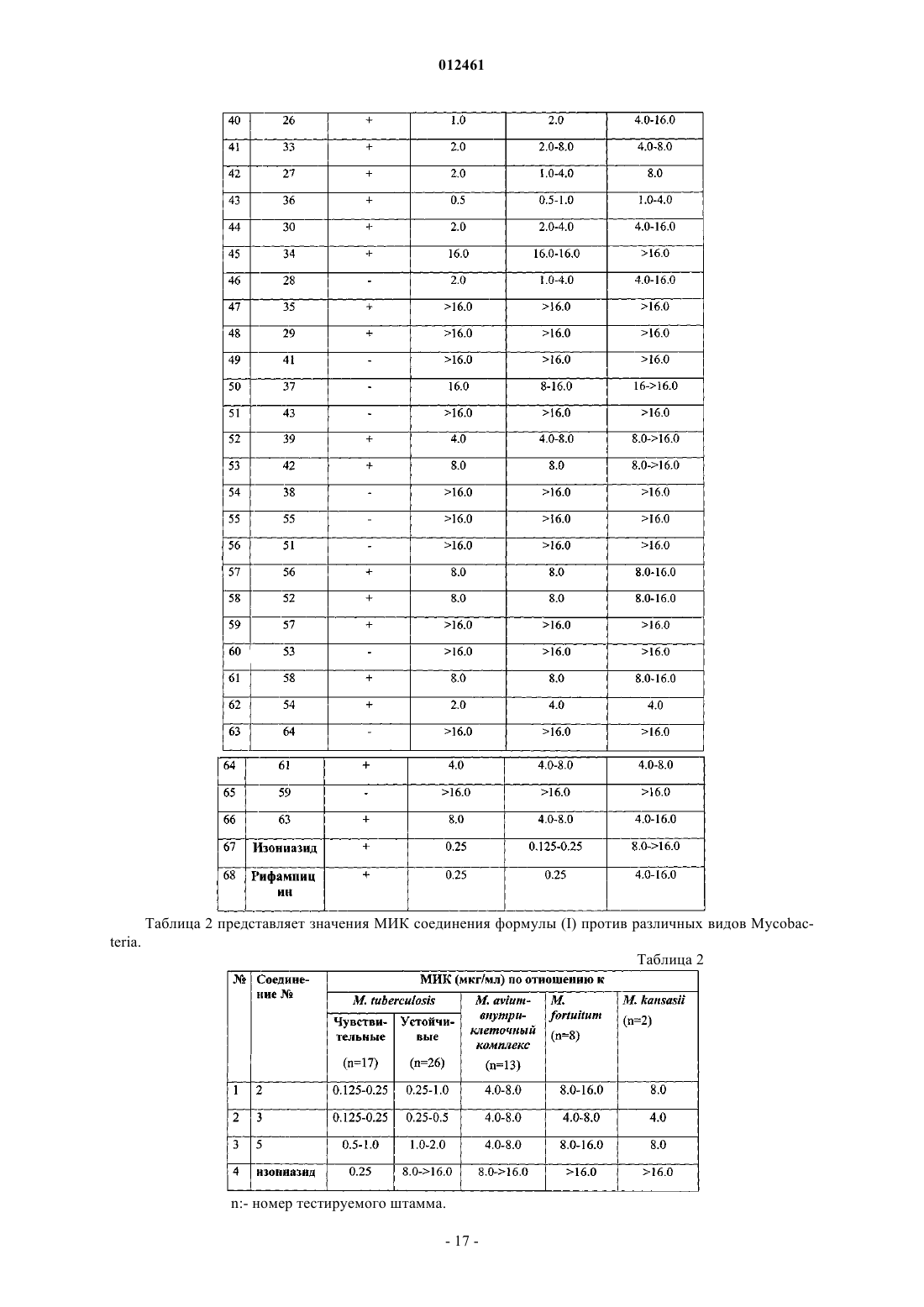
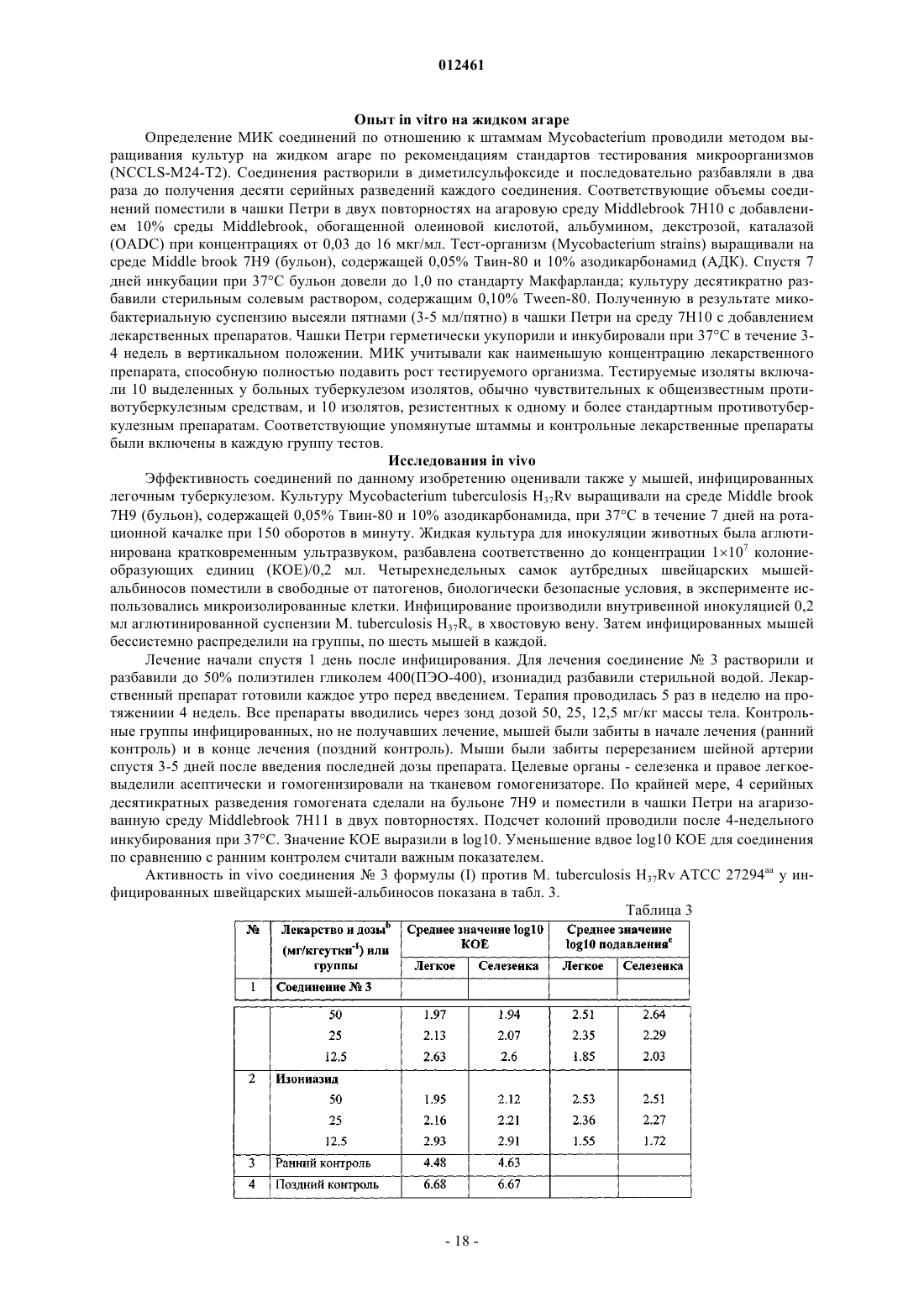
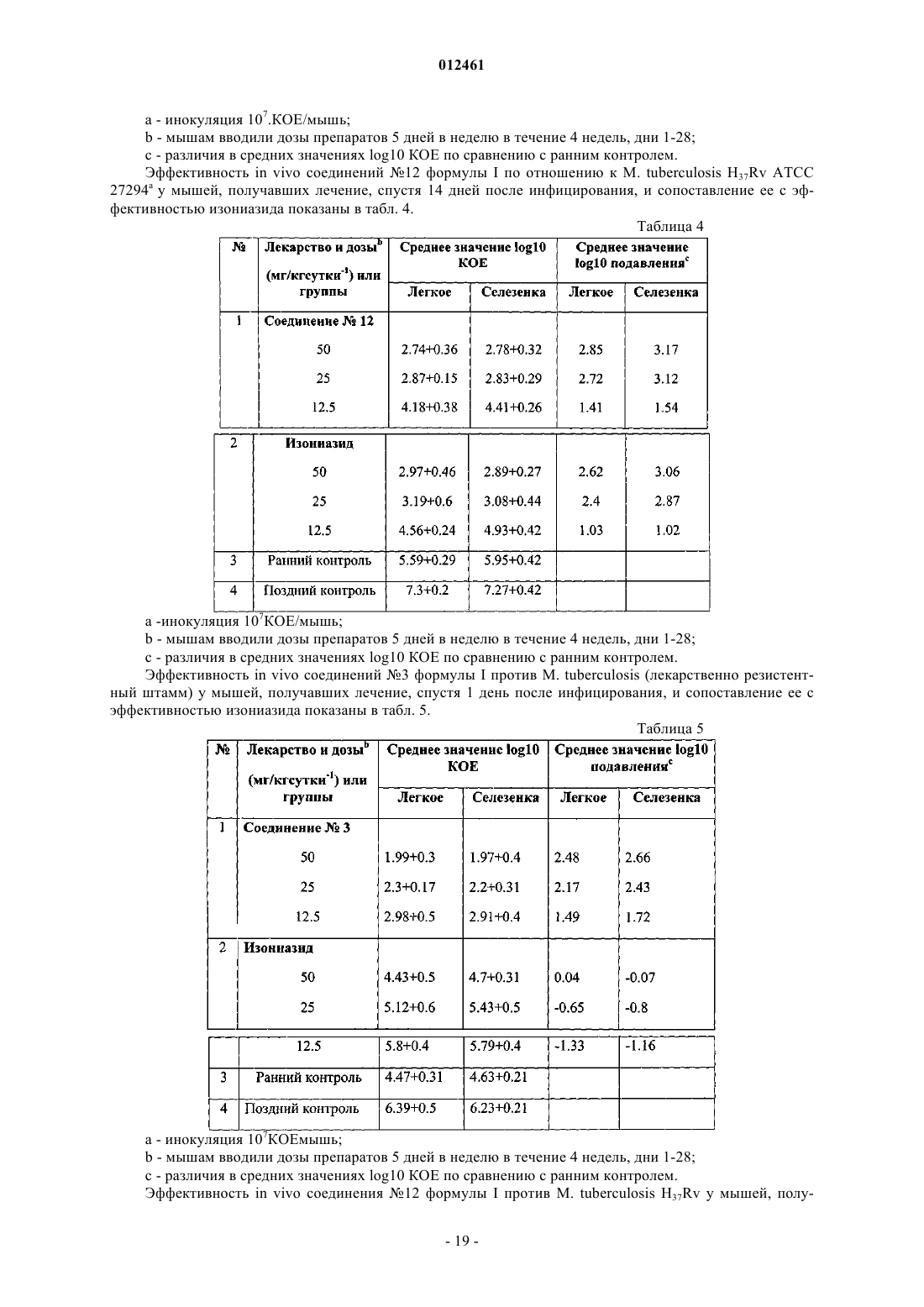
012461 Данное изобретение касается новых 3- и/или 4-(4-замещенных-пиперазинил)алкил пирролов формулы I и их фармацевтически приемлемых кислотно-аддитивных солей, проявляющих противомикобактериальную активность по отношению как к лекарственно чувствительным, так и к лекарственно резистентным штаммам Mycobacterium tuberculosis. Противомикобактериальная активность соединений по данному изобретению превосходит активность ранее известных соединений. Данное изобретение касается также применения новых соединений для лечения латентного туберкулеза, включая туберкулез, вызываемый полирезистентными туберкулезными микобактериями. Изобретение также касается способов получения новых соединений и фармацевтических композиций, содержащих упомянутые новые соединения. Предпосылки изобретения Туберкулез - инфекционная болезнь, которая обычно носит затяжной характер с возвратом общих характерных проявлений болезни, заканчиваясь в большинстве случаев летальным исходом. Это заболевание является одной из наиболее важных причин длительной инвалидности и хронической болезни. Данная болезнь вызывается туберкулезной палочковидной бактерией Mycobacterium tuberculosis, которую относительно трудно контролировать. Лекарственные препараты, такие как изониазид, рифампицин,пиразинамид, этамбутола стрептомицин, парааминосалициловая кислота, этионамид, циклосерин, капреомицин, канамицин, тиоацетазон и др., применялись и применяются в настоящее время в лечении туберкулеза. Среди них: изониазид, рифампицин, этамбутол и пиразинамид - первоочередные препараты выбора, которые вводятся либо как отдельные лекарственные композиции, либо как композиции из двух или более вышеуказанных лекарственных препаратов в определенных пропорциях. Несмотря на то что прием каждого из вышеупомянутых первоочередных препаратов выбора имеет высокую эффективность в лечении туберкулеза, эти препараты имеют ряд недостатков, таких как неприятные побочные эффекты и относительно длительный курс лечения. Последнее является результатом несоблюдения пациентом режима лечения, приводит часто к неудачам в лечении и, что особенно опасно,к развитию лекарственной резистентности туберкулезных микобактерий. Развитие лекарственной резистентности является основной проблемой в лечении туберкулеза человека. Лекарственные препараты второй очередности выбора, с одной стороны менее эффективны, с другой стороны, более дорогостоящие и токсичные. Предполагается, что в последующие двадцать лет более чем один миллиард людей на земном шаре могут быть инфицированы туберкулезом, а 35 миллионов людей погибнут от этой болезни (WHO FactSheet No. 104, Global Alliance for ТВ Drug Development-Executive Summary of the Scientific Blueprint for ТВ Development). Сегодня, с появлением туберкулеза, сопутствующего вирусу иммунодефицита человека, болезнь приобретает угрожающие размеры как одна из смертоносных болезней в мире. Основной упор в изучении противомикобактериальных средств в последнее десятилетие сделан на разработку новых соединений для лечения болезни:a) широко варьирующих по структуре,b) имеющие различный способ применения/механизм действия;c) обладающих приемлемыми фармакокинетическими свойствами;d) безопасных и имеющих низкую частоту случаев побочных эффектов;e) обеспечивающих эффективный режим приема. Каждый в отдельности новый класс соединений синтезирован и тестирован на активность по отношению к Mycobacterium tuberculosis, химические и биологические особенности этих классов изложены в последнем обзоре B.N. Roy (J. Ind. Chem. Soc, April 2002, 79, 320-335) и в процитированных там источниках. Замещенные производные пиррола составляют отдельный класс соединений, которые перспективны в качестве противомикобактериальных средств. Производные пиррола, которые синтезированы и тестированы как на противотуберкулиновую, так и на нетуберкулиновую активность, раскрыты в статьях,приведенных ниже.a) D. Deidda et. al. in Antimicrob. Agents and Chemother., Nov 1998, 3035-3037. Эта статья описывает ингибирующее действие одного из соединений пиррола, а именно ВМ 212,имеющего структурную формулу, приведенную ниже, на Mycobacterium tuberculosis, включая полирезистентный штамм микобактерии и некоторые микобактерии, не вызывающие туберкулез. Значение минимальной ингибирующей концентрации (МИК) (мг/мл) против М. tuberculosis штамм 103471, продемонстрированное соединением ВМ 212, составило 0,70 по сравнению с 0,25 у изониазида.b) M. Biava et al. in J.Med Chem. Res., 1999, 19-34. В этой статье сообщается о синтезе отдельных аналогов ВМ 212, имеющих общую формулу и противомикробную активность соединений in vitro по отношению к Candida albicans, Candida sp,Cryptococcus moformans, граммположительным или граммотрицательным бактериям, изолятам фитопатогенных грибов, Herpes simplex virus, штамм HSV1 и HSV2, М. tuberculosis, M. smegmatis, M. marinum и М. avium. Тем не менее, значение МИК (мг/мл) этих соединений по отношению к М. tuberculosis штамма 103471 хуже, чем у ВМ 212 и находится в диапазоне 4-16. с) М. Biava et. al. in Bioorg. Med. Chem. Lett, 1999, 9, 2983-2988. Эта статья описывает синтез соединений пиррола формулыR - N-метил пиперазинил или тиоморфинил,и их соответствующую активность in vitro по отношению к М. tuberculosis и видам mycobacteria, не вызывающим туберкулез. Тем не менее, значение МИК (мг/мл) этих соединений против М. tuberculosis штамма 103471 хуже,чем у ВМ 212 и находится в диапазоне 2-4.d) F. Cerreto et. al. in Eur. J. Med Chem., 1992, 27, 701-708. В этой статье сообщается о синтезе конкретных производных 3-амино-1,5-диарил-2-метил пиррола и их фунгицидной активности in vitro против Candida albicans и Candida sp. Тем не менее, не сообщается об активности таких соединений против М. tuberculosis.e) С. Gillet et. al. in Eur. J. Med Chem.-Chimica Therapeutica, March-April 1976, 11(2), 173-181. В этой статье сообщается о синтезе отдельных производных пиррола, используемых в качестве противовоспалительных средств и как антиаллергенов.f) R. Ragno et. al., Bioorg.Med. Chem., 2000, 8, 1423-1432. Эта статья сообщает о синтезе отдельных биологически активных производных пиррола, а также описывает структуру взаимосвязи между указанными соединениями пиррола и противомикобактериальной активностью. Соединения, синтезированные и протестированные авторами, приведены ниже:R2- Н, Cl, ОН или ОСН 3 и R3- Н или Cl. Ни одно из вышеупомянутых описаний не сообщает действие in vivo, включая токсичность какихлибо соединений, описанных здесь, против туберкулеза в эксперименте на животной модели. Кроме того, более высокие значения МИК этих соединений говорят о том, что они не могут эффективно ингибировать Mycobacterium tuberculosis. Цель изобретения Таким образом, основной целью данного изобретения является удовлетворение насущной потребности в новых противомикобактериальных соединениях путем предложения новых производных пиррола, которыеa) показывают более существенную противомикобактериальную активность по сравнению с существующими лекарственными препаратами;b) обеспечивают безопасный и специфический лечебный эффект при лечении туберкулеза, вызываемого полирезистентными туберкулезными микобактериями;c) эффективны в лечении пациентов, которые имеют бессимптомную/латентную форму туберкулеза. Описание изобретения Один из аспектов данного изобретения представляет соединение формулы (I), его таутомеры, энантиомеры, диастереомеры, N-оксиды, полиморфы и их фармацевтически приемлемые соли.i) фенил, который является незамещенным или замещенным одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1 С 4 тиоалкокси, нитро, галоалкил, галоалкокси, пиперазин, морфолин, тиоморфолин, пирролидин и пиперидин, илиR3 - фенил, незамещенный или замещенный 1-3 заместителями, выбранными из группы, включающей SH, NO2, CH2Cl, CH2Br, OCF3, OCH2CF3, Cl, Br, I, F, C1-C6 алкокси, С 1-С 6 алкил, С 1-С 6 тиоалкил, С 6 С 10 арил, С 5-С 6 гетероарил с 1-3 гетероатомами, выбранными из О, N и S, гетероарил, если один из R4 или где R8 - фенил, незамещенный или замещенный 1-2 заместителями, каждый из которых независимо выбран из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 тиоалкокси, нитро, амино, галоалкил, галоалкокси; бензил или бензил, замещенный 3,4-метилендиокси; гетероарил; гетероароил; дифенилметил,m = 0-2 иX является - NCH3, СН 2, S, SO или SO2; так что, если R2 - фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1 С 4 тиоалкокси, нитро, галоалкил, галоалкокси, пиперазин, морфолин, тиоморфолин, пирролидин, пиперидин и R4 - водород; R8 не является C1-С 4 алкилом или X не является-NCH3, S, SO или SO2,если m=1, или X не является-СН 2, если m=0. Описанное выше соединение формулы (I) и его различные формы, включая их фармацевтически приемлемые соли, безопасны и показывают низкий уровень токсичности. Следующий аспект данного изобретения представляет способ получения соединения формулы (I) его таутомеры, энантиомеры, диастереомеры, N-оксиды, полиморфы и их фармацевтически приемлемые соли, при котором данное соединение получают реакцией соединения формулы (V)i) фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 тиоалкокси, нитро,галоалкил, галоалкокси, пиперазин, морфолин, тиоморфолин, пирролидин и пиперидин, илиR3 - фенил, незамещенный или замещенный 1-3 заместителями, выбранными из группы, включающей SH, NO2, CH2Cl, CH2Br, OCF3, OCH2CF3, Cl, Br, I, F, C1-C6 алкокси, C1-С 6 алкил, С 1-С 6 тиоалкил, С 6 С 10 арил, C5-С 6 гетероарил с 1-3 гетероатомами, выбранными из О, N и S, гетероарил,с амином формулы R7H, где R7 выбран из группы где R8 - фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 тиоалкокси,нитро, амино, галоалкил, галоалкокси; бензил или бензил, замещенный 3,4-метилендиокси; гетероарил; гетероароил; дифенилметил; m=0-2 и где R8 - фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 тиоалкокси,-4 012461 нитро, амино, галоалкил, галоалкокси; бензил или бензил, замещенный 3,4-метилендиокси; гетероарил; незамещенный или замещенный гетероароил; дифенилметил; m=0-2 иX является -NCH3, CH2, S, SO или SO2; так что R2 - фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 тиоалкокси,нитро, галоалкил, галоалкокси, пиперазин, морфолин, тиоморфолин, пирролидин, пиперидин и R4 - водород; R8 не является С 1-С 4 алкилом или X не является-NCH3, S, SO или SO2, если m=1, или X не является-СН 2, если m=0. Следующий аспект данного изобретения представляет фармацевтические композиции, применяемые в лечении микобактериальных состояний, таких как туберкулез, включая туберкулез, вызываемый полирезистентными туберкулезными микобактериями, включающих: а) по меньшей мере одно соединение формулы (I), его таутомеры, энантиомеры, диастереомеры, N-оксиды, полиморфы и их фармацевтически приемлемые соли; b) фармацевтически приемлемые добавки. Дальнейший аспект данного изобретения представляет способ ингибирования/воздействия на микроорганизм/состояние соединениями, выбранными из соединения формулы (I), его таутомеров, энантиомеров, диастереомеров, N-оксидов, полиморфов, их фармацевтически приемлемых солей, с фармацевтически приемлемыми носителями или без них. Микроорганизмом/состоянием может быть Mycobacteriumtuberculosis, лекарственно резистентная Mycobacterium tuberculosis, Mycobacterium avium-intra cellulare комплекс, Mycobacterium fortuitum или Mycobacterium kansasii. Детальное описание изобретния В фармацевтически активном соединении формулы (I) по данному изобретению, определение групп R1, R2, R3, R4 и R5 следующее:R1 - С 1-С 4 алкил, разветвленный или неразветвленный, С 1-С 4 алкокси, С 1-С 4 тиоалкокси, трифторалкил, трифторалкокси или гидроксиалкил. Приемлемыми алкильными группами являются метил, этил, n-пропил, n-бутил, изопропил, изобутил или трет-бутил. Метил является предпочтительным. Приемлемымиалкоксильными группами являются метокси, этокси, n-пропокси, изо-пропокси, n-бутокси, изо-бутокси и трет-бутокси. Приемлемыми тиоаткильными группами являются тиометил, тиоэтил, 1-тиопропан, 2-тиопропан, 1-тиобутан, 1-метил 1-тиопропан и 1-метил-2-тиопропан. Приемлемыми трифторалкильными группами являются трифторметил и трифторэтил. Приемлемыми трифторалкоксильными группами являются трифторметокси и трифторэтокси. Приемлемыми гидроксиалкильными группами являются группы, выбранные из трифторметокси и трифторэтокси.i) фенил, незамещенный или замещенный одним или двумя заместителями, которые независимо выбраны из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 тиоалкокси, нитро, галоалкил,галоалкокси, пиперазин, морфолин, тиоморфолин, пирролидин и пиперидин, илиvii) NHCOR6, где R6 - арил, гетероарил, гетероциклил. Замещенные фенильные группы выбраны из хлорбензола, бромбензола, фторбензола, 1,2 дихлорбензола, 1,2-дибромбензола, 1,2-дифторбензола, 1,3-дихлорбензола, 1,3-дибромбензола, 1,3 дифторбензола, 1,4-дифторбензола, 1,-4-дибромбензола, 1,4-дифторбензола, метилбензола, этилбензола,о-ксилола, m-ксилола, р-ксилола, 2-этилтолуола, 3-этилтолуола, 4-этилтолуола, пропилбензола, кумола,бутилбензола, втор-бутиленола, изо-бутилбензола, трет-бутилбензола, о-кумола, m-кумола, р-кумола,1,2-диэтилбензола, 1,3-диэтилбензола, 1,4-диэтилбензола, 1,3-ди-трет-бутилбензола, 1,4-ди-третбутилбензола, 4-трет-бутилтолуола, анизола, 2-метиланизола, 3-метиланизола, 4-метиланизола, 1,2 бензолдиметанола, 1,3-бензолдиметанола, 1,4-бензолдиметанола, 1,2-диметоксибензола, 2-этоксианизола, 3,5-диэтокситолуола, бензилмеркаптана, фенэтилмеркаптана, 1,2-бензолдиметанэтиола, 1,3 бензолдиметанэтиола, 1,4-бензолдиметанэтиола, нитробензола, 1,2-динитробензола, 1,3-динитробензола,1,4-динитробензола, бензилхлорида, бензилбромида, трифторметокси, трифторэтокси и т.п., и не ограничиваются перечисленным. В группе R6, выражение "гетероарил" подразумевает какое-либо арильное кольцо, содержащее один или более гетероатомов, выбранных из N, О и S, а выражение "гетероцикл" подразумевает какие-либо гетероциклические системы.a) фенилом или замещенным фенилом. Приемлемые замещенные фенильные группы выбраны из хлорбензола, бромбензола, фторбензола, 1,2-дихлорбензола, 1,2-дибромбензола, 1,2-дифторбензола, 1,3 дихлорбензола, 1,3-дибромбензола, 1,3-дифторбензола, 1,4-дифторбензола, 1,-4-дибромбензола, 1,4 дифторбензола, метилбензола, этилбензола, о-ксилола, m-ксилола, р-ксилола, 2-этилтолуола, 3 этилтолуола, 4-этилтолуола, пропилбензола, кумола, бутилбензола, втор-бутиленола, изо-бутилбензола,трет-бутилбензола, о-кумола, m-кумола, р-кумола, 1,2-диэтилбензола, 1,3-диэтилбензола, 1,4 диэтилбензола, 1,3-ди-трет-бутилбензола, 1,4-ди-трет-бутилбензола, 4-трет-бутилтолуола, анизола, 2 метиланизола, 3-метиланизола, 4-метиланизола, 1,2-бензолдиметанола, 1,3-бензолдиметанола, 1,4 бензолдиметанола, 1,2-диметоксибензола, 2-этоксианизола, 3,5-диэтокситолуола, бензилмеркаптана, фенэтилмеркаптана, 1,2-бензолдиметанэтиола, 1,3-бензолдиметанэтиола, 1,4-бензолдиметанэтиола, нитробензола, 1,2-динитробензола, 1,3-динитробензола, 1,4-динитробензола, бензилхлорида, бензилбромида,трифторметокси, трифторэтокси и т.п., и не ограничиваются перечисленными. Илиa) фенилом, незамещенным или замещенным одним или двумя заместителями, которые независимо выбраны из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 тиоалкокси, нитро, амино,галоалкил, галоалкокси, где заместители определены выше, илиb) незамещенным или замещенным бензилом; гетероарилом; гетероароилом; дифенилметилом,m=0-2, иX является -NCH3, CH2, S, SO или SO2. К тому же, соединения формулы (I) по данному изобретению включают их фармацевтически приемлемые нетоксичные кислотно-аддитивные соли, образованные неорганическими или органическими кислотами способами, хорошо известными специалистам в этой области. Эти соли могут использоваться вместо свободных оснований. Примерами приемлемых кислот для образования таких кислотноаддитивных солей являются малеиновая, фумаровая, бензойная, аскорбиновая, памовая, янтарная, бисметиленовая, салициловая, метансульфоновая, этандисульфоновая, уксусная, пропионовая, винная, лимонная, глюконовая, аспаргиновая, стеариновая, пальмитиновая, итаконовая, гликолевая, раминобензойная, глутаминовая, бензолсульфоновая, ортофосфорная, бромоводородная, серная, хлороводородная, азотная кислоты и т.п. Данное изобретение также включает возможные таутомеры, энантиомеры, диастереомеры, Nоксиды, полиморфы соединений формулы (I), обладающие таким же действием. Данное изобретение также представляет фармацевтические композиции, содержащие соединение формулы (I), для лечения болезни, вызванной М. tuberculosis. Эти композиции содержат эффективное количество соединения формулы (I) или его таутомеров, энантиомеров, диастереомеров, N-оксидов, их фармацевтически приемлемых солей или их полиморфных форм, в сочетании с фармацевтически приемлемыми носителями и, необязательно, в присутствии наполнителя. Несколько предпочтительных специфических новых соединений (1-91) формулы (I) (названных согласно номенклатуре Международного союза теоретической и прикладной химии (ИЮПАК, которые составляют часть данного изобретения, приведены ниже: 1) 1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(4-фторфенил)пиперазин; 2) 1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(2-метоксифенил)пиперазин; 3) 1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(3-трифторметилфенил)пиперазин; 4) 1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(2-пиридил)пиперазин; 5) 1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(2-пиримидил)пиперазин; 6) 1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(дифенилметил)пиперазин; 7) 4-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метилпиперазинил-2-фурилкетон; 8) 5-[(4-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метилпиперазинил)метил]-2 Н-бензо[d]1,3 диоксолан; 9) 4-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метилпиперазинилоксолан-2-илкетон; 10) 1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил 5-хлорметилфенил) пиперазин; 11)N-(2-(4-хлорфенил)-3-[4-(3-трифторметилфенил)пиперазинил]метил-5-метилпирролил)-4 пиридилкарбоксамид; 74) N-(2-(4-хлорфенил)-3-[4-(2-пиридил)пиперазинил]метил-5-метилпирролил)-4-пиридилкарбоксамид; 75) N-(3-[4-(2 Н-бензо[-d]1,3-диоксолан-5-илметил)пиперазинил]метил-2-(4-хлорфенил)-5-метилпирролил)-4-пиридилкарбоксамид; 76) 4-(4-фторфенил)-1-[(2-метил-5-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин; 77) 4-(2-метоксифенил)-1-[(2-метил-5-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин; 78) 4-(3-трифторметилфенил)-1-[(2-метил-5-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин; 79) 1-[2-метил-5-фенил-1-(2-пиридил)пиррол-3-ил)метил]-4-(2-пиридил)пиперазин; 80) 5-(4-[(2-метил-5-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазинилметил)-2 Н-бензо[d]1,3 диоксолан; 81) 4-(4-фторфенил)-1-[(5-метил-2-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин; 82) 4-(2-метоксифенил)-1-[(5-метил-2-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин; 83) 4-(3-трифторметилфенил)-1-[(5-метил-2-фенил-1-(2-пиридил)пиррол-3-ил)метил] пиперазин; 84) 1-[(5-метил-2-фенил-1-(2-пиридил)пиррол-3-ил)метил]-4-(2-пиридил)пиперазин; 85) 5-(4-[(5-метил-2-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазинилметил)-2 Н-бензо[d]1,3 диоксолан; 86) 1-[1,5-бис(4-хлорфенил)-2-этилпиррол-3-ил]метил-4-(3-трифторметилфенил)пиперазин; 87) 4-[(2-метил-1,5-дифенилпиррол-3-ил)метил]-1,4-тиазапергидроин-1-он; 88) 4-[(2-метил-1,5-дифенилпиррол-3-ил)метил]-1,4-тиазапергидроин-1,1-дион; 89) N-[5-(4-хлорфенил)-2-метил-3-(1,4-тиазапергидроин-4-илметил)пирролил]-4-пиридилкарбоксамид; 90) 2-[3-(гидроксиметил)-5-метил-2-фенил-4-(1,4-тиазапергидроин-4-илметил)пирролил]бутан-1-ол; 91) 2-[2-метил-5-фенил-3-(1,4-тиазапергидроин-4-илметил)пирролил]бутан-1-ол. Упомянутые выше соединения формулы (I), их фармацевтически приемлемые кислые соли, их все-8 012461 возможные таутомеры, энантиомеры, диастереомеры, N-оксиды и их полиморфы показывают фармацевтическую активность особенно в лечении заболеваний, вызываемых Mycobacterium tuberculosis, устойчивой к лекарственным препаратам, комплексом Mycobacterium tuberculosis и Mycobacterium aviumintracellulare, Mycobacterium fortuitum или Mycobacterium kansasii. Фармацевтически активные соединения формулы (I) по данному изобретению могут быть получены каким-либо способом из приведенных ниже. Способ I. Схема I показывает синтез соединения формулы (I), где R1 - СН 3 R3 - замещенный или незамещенный фенил и R2, R4 и R5 определены ранее. Способ получения заключается во взаимодействии соединений R3H формулы (II) с кислой хлороводородной солью формулы (II) в присутствии AlCl3 при температуре, лежащей в диапазоне 20-30 С, на протяжении 1-2 ч до получения дикетонов формулы (IV), которые при конденсации с соответствующими аминами (R2-NH2) с последующей циклизацией в присутствии органического растворителя при температурном диапазоне 80-120 С в течение 2-3 ч дают соответствующие пирролы формулы (V), как описано М. Biava et. al. in Bioorg.Med. Chem. Lett., 1999, 9, 29832988. Соединения формулы (V) при реакции с различными гетероциклическими аминами (R7H) в присутствии органического растворителя при температурном диапазоне 20-30 С в течение 2-4 ч дают соединения формулы (I), где R1, R2, R3, R4 и R5 имеют значения, определенные выше. Исходные кислые соли хлороводородной кислоты формулы (III), известные в данной области, могут быть синтезированы по методикам, описанным Bui-Hoi, N. P. in J. Org. Chem.,1960, 25, 390. Схема I. Синтез соединений формулы (I) Способ II. В этом способе, который кратко описан схемой II, метилкетоны формулы (VI) взаимодействуют с абромметилкетонами формулы (VII), в присутствии основания и органического растворителя при температурном диапазоне 20-30 С в течение 2-6 дней до получения дикетонов формулы (IV), которые взаимодействуют с соответствующими аминами (R2-NH2) с последующей циклизацией в присутствии органического растворителя при температурном диапазоне 80-120 С в течение 2-3 ч и дают соответствующие пирролы формулы (V). Реакция соединений формулы (V) с различными аминами (R7H) в присутствии органического растворителя при температурном диапазоне 20-30 С в течение 2-4 ч дает соединения формулы (I), где R1 R2, R3, R4 и R5 имеют значения, определенные выше. Схема II. Синтез соединений формулы (I) Следует понимать, что в данных схемах, где упоминаются определенные основания, кислоты, растворители и т.д., могут применяться и другие основания, кислоты, растворители и т.д., известные специалисту в этой области. Аналогичным образом, температура и время реакции могут быть уточнены при необходимости. Изобретение описано ссылками на определенные примеры осуществления в целях иллюстрации. Многочисленные альтернативные примеры осуществления будут понятны специалистам этой области и-9 012461 считаются областью данного изобретения. Следующие примеры демонстрируют как общие, так и специфические варианты получения соединения формулы (I), которые, тем не менее, не будут подразумевать ограничение области данного изобретения. Пример 1. Получение 1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3 ил]метил-4-(3-трифторметилфенил)пиперазина (соединение 3 формулы I) по способу I. Этап 1. 1-(4-Хлорфенил)пентан-1,4-дион. К хорошо перемешанной суспензии безводного хлорида алюминия (29,66 г, 0,223 моль) в 154,7 мл хлорбензола добавили 4-оксопентаноилхлорид (25,0 г, 0,187 моль) по каплям с периодом в 30-35 мин при комнатной температуре (25-30 С). Реакционную смесь перемешивали при той же температуре в течение 1 ч. После разложения реакционной смеси добавлением твердого льда и хлористоводородной кислоты(10 мл) образовавшийся твердый осадок был отфильтрован и фильтрат выпарили ротационным выпариванием до удаления всех растворителей. Осадок растворили этилацетатом (400 мл), промыли водой(2100 мл) и солевым раствором (100 мл). Органический слой высушили на безводном сульфате натрия и растворитель выпарили. Неочищенный продукт, таким образом полученный, хроматографировали на силикагеле (с размером ячейки сита 100-200), элюент-хлороформ:гексан (90:10), получили 5,3 г (13,60 %) названого соединения. Этап 2. 1,2-бис (4-Хлорфенил)-5-метилпиррол. Смесь 1-(4-хлорфенил)пентан-1,4-диона (5,0 г, 0,024 моль), полученного на этапе 1, и 4 хлоранилина (3,33 г, 0,026 моль) в бензоле (5,0 мл) дифлегмировали с использованием либо молекулярных сит, либо аппарата Дин-Старка. Спустя 3 ч бензол собрали под уменьшенным давлением и остаток растворили этилацетатом, промыли водой (2100 мл) и солевым раствором (150 мл). Слой этилацетата высушили на безводном сульфате натрия и растворитель выпарили. Твердое вещество, таким образом полученное, промыли гексаном и получили 2,83 г (39,45%) названного соединения. Этап 3. 1-[1,5-бис(4-Хлорфенил)-2-метилпиррол-3 ил]метил-4-(3-трифторметилфенил)пиперазин. К перемешанному раствору 1,2-бис(4-хлорфенил)-5-метилпиррола (1,76 г, 0,006 моль), полученного на этапе 2, в ацетонитриле (18 мл) добавили по каплям смесь 1-(3-трифторметилфенил)пиперазина гидрохлорида (1,55 г, 0,006 моль), 40% формальдегида (0,45 мл, 0,006 моль) и уксусной кислоты (5,23 мл). После добавления реакционную смесь перемешивали при комнатной температуре 3-4 ч. Реакционную смесь нейтрализовали NaOH (20% водным раствором) и экстрагировали этилацетатом (2100 мл). Объединенный этилацетатный экстракт промыли водой (250 мл), солевым раствором (130 мл), высушили на сульфате натрия и растворитель выпарили. Неочищенный продукт, полученный таким образом, очистили колоночной хроматографией на силикагеле, элюент-этилацетат:гексан (80:10), получили 2,1 г(66,24%) названного соединения. Т.п. (точка плавления) 165-167 С, м-с (масс-спектрометрия): отношение массы к заряду (m/z) 544 (М+1). 1 Н-ЯМР (CDCl3, ): 2.05 (s, 3 Н, CH3), 2.77 (br s, 4H, 2N-CH2), 3.31 (br s, 4H, 2N-CH2), 3.59 (s, 2H,N-CH2), 6.34 (s, 1H, H-4), 6.85-7.31 (m, 12H, Ar-H). Пример 2. Получение N-(3-[4-(3-трифторметилфенил)пиперазинил]метил-5-метил-2-фенилпирролил)-4-пиридилкарбоксамида (соединение 23 формулы I) и получение N-(3-[4-(3 трифторметилфенил)пиперазинил]метил-2-метил-5-фенилпирролил)-4-пиридилкарбоксамида (соединение 12 формулы I) по способу I. Этап 1. 1-(Фенил)пентан-1,4-дион. К хорошо перемешанной суспензии безводного хлорида алюминия (27,0 г, 205,9 ммоль) в 126 мл бензола по каплям добавили 4-оксопентаноилхлорид (23,0 г, 171,6 ммоль), с периодичностью в 30-35 мин при комнатной температуре (25-30 С). Реакционную смесь перемешивали при той же температуре в течение 1 ч. После разложения реакционной смеси добавлением твердого льда и хлористоводородной кислоты (10 мл) осадок профильтровали и фильтрат выпарили ротационным выпариванием до удаления всех растворителей. Осадок растворили этилацетатом (400 мл), промыли водой (2100 мл), солевым раствором (100 мл), высушили на безводном сульфате натрия и растворитель выпарили. Неочищенный продукт, таким образом полученный, хроматографировали на силикагеле (с размером ячейки сита 100-200),элюент - хлороформ, получили 8,6 г (24,07%) названого соединения. Этап 2. N-(5-Метил-2-фенилпирролил)-4-пиридилкарбоксамид. Смесь 1-(фенил)пентан-1,4-диона (6,0 г, 28,50 ммоль), полученного на этапе 1, и изоникотинового гидразида (4,30 г, 31,35 ммоль) в бензоле (6,0 мл) дифлегмировали с помощью молекулярных сит. Спустя 2 ч бензол собрали уменьшением давления и остаток растворили в этилацетате, промыли водой (2100 мл) и солевым раствором (150 мл). Слой этилацетата высушили на безводном сульфате натрия и растворитель выпарили. Неочищенный продукт, таким образом полученный, хроматографировали на силикагеле (с размером ячейки сита 100-200), элюент - 0,2% метанол в хлороформе, получили 3,5 г (39,42%) названого соединения. Этап 3. N-(3-[4-(3-Трифторметилфенил)пиперазинил]метил-5-метил-2-фенилпирролил)-4-пиридилкарбоксамид (соединение 23 формулы I) и N-(3-[4-(3-трифторметилфенил)пиперазинил]метил-2- 10012461 метил-5-фенилпирролил)-4-пиридилкар 6 оксамид (соединение 12 формулы I). К размешанному раствору N-(5-метил-2-фенилпирролил)-4-пиридилкарбоксамида (0,300 г, 1,083 ммоль), полученному на этапе 2, в ацетонитриле (5,0 мл) добавили по каплям смесь 1-(3 трифторметилфенил)пиперазина гидрохлорида (0,288 г, 1,083 ммоль), 40% формальдегида (0,032 г, 1,083 ммоль) и уксусную кислоту (0,09 мл). После добавления реакционную смесь размешивали при комнатной температуре 4 ч. Реакционную смесь нейтрализовали гидроксидом натрия (20% водный раствор) и экстрагировали этилацетатом (250 мл). Комбинированный экстракт этилацетата промыли водой (225 мл), солевым раствором (120 мл), высушили на безводном сульфате натрия и растворитель выпарили. Тонкослойная хроматография неочищенного продукта определила две зоны, которые были разделены колоночной хроматографией на силикагеле (с размером ячейки сита 100-200). Менее полярное соединение элюировали с использованием 60% смеси этилацет гексана, получили 11,25% (0,060 г) продукта, определенного как N-(3-[4-(3-трифторметилфенил)пиперазинил]метил-5 метил-2-фенилпирролил)-4-пиридилкарбоксамид (соединение 23). Т.п.105-107 С, масс-спектрометрия:m/z 520 (М+1). 1 Н-ЯМР (CDCl3, ): 2.14 (s, 3 Н,СН 3), 2.49 (br s, 4H, 2N-CH2), 3.12 (br s, 4H, bs, 2N-CH2), 3.34 (s,2H, N-CH2), 6.03 (s, 1H, H-3), 6.96-6.99 (m, 4H, ArH), 7.09-7.27 (m, 5H, ArH), 7.40 (d, 2H, J=6 Hz, пиридильное кольцо), 8.60 (d, 2H, J=6 Hz, пиридильное кольцо). Более полярное соединение элюировали с использованием 80% смеси этилацетата и гексана, получили 24,34% (0,130 г) продукта, определенного как N-(3-[4-(3-трифторметилфенил)пиперазинил]метил-2-метил-5-фенилпирролил)-4-пиридилкарбоксамид (соединение 12). Т.п. 80-82 С, массспектрометрия: m/z 520 (М+1). 1 Н-ЯМР (CDCl3, ): 2.13 (s, 3 Н,СН 3), 2.60 (br s, 4H, 2N-CH2), 3.18 (bs, 4H, 2N-CH2), 3,41 (s, 2H, NCH2), 6.24 (s, 1H, H-4), 6.97-7.03 (4H, m, ArH), 7.22-7.29 (m, 5H, ArH), 7.53 (d, 2H, J=6 Hz, пиридильное кольцо), 8.50 (br s, 1H, NH D2O способный замещаться), 8.70 (d, 2H, J=6 Hz, пиридильное кольцо). Пример 3. Получение 1-[1,5-бис(4-хлорфенил)-2-этилпиррол-3 ил]метил-4-(3-трифторметилфенил)пиперазина (соединение 86 формулы I) по способу II. Этап 1. 1-(4-Хлорфенил)гексан-1,4-дион. Безводный хлорид цинка (3,71 г, 27,2 ммоль) поместили в круглодонную колбу и плавили под вакуумом при температуре 250-350 С в течение 15 мин. После охлаждения под вакуумом до комнатной температуры последовательно добавили бензол (15 мл), триэтиламин (2,7 мл, 19,42 ммоль) и третбутанол (1,83 мл, 19,42 ммоль).Смесь перемешивали до полного растворения хлорида цинка (около 2 ч),и последовательно добавили 1-(4-хлорфенил)этан-1-он (3,0 г, 19,42 ммоль) и 1-бромбутан-2-он (2,05 г,13.6 ммоль).Смесь перемешивали 1 ч и оставили на 4 дня при комнатной температуре, затем погасили 5% водным раствором серной кислоты. Органический слой собрали, промыли водой (250 мл), солевым раствором (125 мл), высушили на безводном сульфате натрия, растворитель выпарили. Продукт очистили колоночной хроматографией на силикагеле (с размером ячейки сита 100-200), хлороформ, получили 2,30 г (75,63%) названного соединения. Этап 2. 1,2-бис(4-Хлорфенил)-5-этилпиррол. Смесь 1-(4-хлорфенил)гексан-1,4-диона (2,10 г, 9,35 ммоль), полученного на этапе 1,4-хлоранилина(1,31 г, 10,29 ммоль) и р-толуол сульфокислоты (0,321 г, 1,80 ммоль) в толуоле (5,0 мл) дифлегмировали на молекулярных ситах или с использованием аппарата Дина-Старка. Ход реакции контролировали с помощью тонкослойной хроматографии, спустя 3 ч толуол собрали при уменьшенном давлении. Остаток растворили этилацетатом (200 мл), промыли водным раствором бикарбоната натрия (275 мл), затем водой (250 мл) и солевым раствором (125 мл). Слой этилацетата высушили на безводном сульфате натрия и растворитель выпарили. Полученное твердое вещество промыли гексаном и получили 2,39 г(81%) названного соединения. Этап 3. 1-[1,5-бис(4-Хлорфенил)-2-этилпиррол-3 ил]метил-4-(3-трифторметилфенил)пиперазин. К перемешанному раствору 1,2-бис(4-хлорфенил)-5-этилпиррола (1,20 г, 3,80 ммоль), полученного на этапе 2, в ацетонитриле (15 мл) Добавили по каплям смесь 1-(3-трифторметилфенил)пиперазина гидрохлорида (1,01 г, 3,80 ммоль), 40% формальдегида (0,114 г, 3,80 ммоль) и уксусной кислоты (3,6 мл). После добавления реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь нейтрализовали гидроксидом натрия (20% водный раствор) и экстрагировали этилацетатом(2100 мл). Комбинированный этилацетатный экстракт промыли водой (250 мл), солевым раствором(130 мл), высушили на безводном сульфате натрия и растворитель выпарили. Полученный продукт хроматографировали на силикагеле, элюент - этилацетатгексан (80:10), получили 1,05 г (47,22%) 1-[1,5 бис(4-хлорфенил)-2-этилпиррол-3-ил]метил-4-(3-трифторметилфенил)пиперазина (соединение 86 формулы I). Масс-спектрометрия: m/z 559 (М+1). 1H-ЯМР (CDCl3, ) 1.05 (t, 3 Н, CH3), 2.66 (q, 2H, J=8 Hz, CH2CH3) 2.98-3.10 (br s, 4H, 2N-CH2), 3.503.55 (br s, 4H, 2N-CH2), 3.94 (s, 2H, N-CH2), 6.50 (s, 1H, Н-4), 7.20-7.38 (m, 12H, Ar-H). Пример 4. Получение хлороводородной соли соединения 3 формулы I. Соединение 3 (1,1 г), полученное на этапе 3 примера 1, растворили в дихлорметане (3 мл) при пе- 11012461 ремешивании. К этой смеси по каплям при перемешивании добавили 6,43 М HCl-этанол (295,22 мг, 8,08 ммоль, 1,3 мл, 4 эквивалент) при 10 С. Реакционную смесь дополнительно перемешивали 2 мин и разбавили диэтиловым эфиром (10 мл). Перемешивание продолжали еще 15 мин при той же температуре. Остаток выпарили при уменьшенном давлении и осадок сушили под вакуумом в течение 1 ч, получили 1,22 г названной хлороводородной соли. Т.п.140-142 С. 1 Н-ЯМР (диметилсульфооксид d6, ): 2.03 (s, 3 Н, CH3), 3.10 (br s, 4H, 2N-CH2), 3.91 (br s, 4H, 2NCH2) 4.17 (s, 2H, N-CH2), 6.57 (s, 1H, H-4) 6.91-7.48 (m, 12H, ArH). Пример 5. Получение хлороводородной соли соединения 12 формулы I. Соединение 12 (0,405 г), полученное на этапе 3 примера 2, растворили в смеси диэтилового эфира (0,5 мл) и дихлорметана (0,5 мл) при перемешивании. К этой смеси по каплям при перемешивании добавили 1,20 М HCl-эфира (142,35 мг, 3,90 ммоль, 3,25 мл, 5 эквивалент) при 10 С. Реакционную смесь дополнительно перемешивали в течение 2 мин и разбавили диэтиловым эфиром (10 мл). Перемешивание продолжали еще 15 мин при той же температуре. Растворитель выпарили при уменьшенном давлении и осадок сушили в вакууме в течение 1 ч, получили 0,428 г названной хлороводородной соли. Т.п.174176 С. 1 Н-ЯМР (диметилсульфоксид d6, ) 2.10 (s, 3 Н,СН 3), 3.15 (br s, 4H, 2N-CH2), 3.84 (br s, 4H, 2NCH2), 4.13 (s, 2H, N-CH2), 6.47 (s, 1H, H-4), 7.00-7.38 (m, 8H, ArH), 7.85 (d, 2H, J=6 Hz, пиридильное кольцо), 8.76 (d, 2H, J=6 Hz, пиридильное кольцо). Перечень соединений по изобретению, синтезированных одним или несколькими вышеупомянутыми способами, приведен ниже. Пример 6. С использованием методик, описанных в примерах 1-3, были получены соединения 1-2, 4-11, 1322, 24-85 и 87-91, подробно охарактеризованные здесь: 1) 1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(4-фторфенил)пиперазин, т.п. 193-195 С,м-с: m/z 494 (М+1); 2) 1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(2-метоксифенил)пиперазин, т.п. 140-142 С,м-с: m/z 506 (М+1); 4) 1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(2-пиридил)пиперазин, т.п. 152-154 С,м-с: m/z 477 (М+1); 5) 1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(2-пиримидил)пиперазин, т.п. 184-186 С,м-с: m/z 478 (М+1); 6) 1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(дифенилметил)пиперазин, т.п. 188-190 С,м-с: m/z 566 (М+1); 7) 4-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метилпиперазинил-2-фурилкетон, т.п. 84-86 С,м-с: m/z 494 (М+1); 8) 5-[(4-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метилпиперазинил)метил]-2 Н-бензо[d]1,3-диоксолен, т.п.135-137 С, м-с: m/z 534 (М+1); 9) 4-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метилпиперазинилоксолан-2-ил-кетон, т.п. 150-152 С,м-с: m/z 498 (М+1); 10) 1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(5-хлоро-2-метилфенил)пиперазин, т.п. 156-158 С, м-с: m/z 524 (М+1); 11) N-(3-[4-(4-фторфенил)пиперазинил]метил-2-метил-5-фенилпирролил)-4-пиридилкарбоксамид,т.п. 98-100 С, м-с: m/z 470 (М+1); 13) N-(3-[4-(2-метоксифенил)пиперазинил]метил-2-метил-5-фенилпирролил)-4-пиридилкарбоксамид, т.п. 125-128 С, м-с: m/z 482 (М+1); 14) N-(3-[4-(2-пиридил)пиперазинил]метил-2-метил-5-фенилпирролил)-4-пиридилкарбоксамид,т.п. 93-95 С, м-с: m/z 453 (М+1); 15) N-(2-метил-5-фенил-3-[4-бензилпиперазинил]метилпирролил)-4-пиридилкарбоксамид, т.п. 87-89 С,м-с: m/z 466 (М+1); 16) N-2-метил-3-[(4-метилпиперазинил]метил-5-фенилпирролил)-4-пиридилкарбоксамид, вязкое масло м-с: m/z 390 (М+1); 17)m/z 345 (М+1). Фармакологическое испытание Способность соединений по изобретению демонстрировать противомикробактериальную активность может быть установлена в опытах с ингибированием роста в опытах с системой ВАСТЕС 460 ТВ и методом in vitro на жидком агаре, как показано в примерах, приведенных ниже. Ингибирование роста in vitro и опыт на жидком агаре для определения МИК, описанные ниже, показали, что соединения формулы (I) по данному изобретению обладают весьма низким значением МИК по отношению к штаммам М. tuberculosis, М. avium, M. fortiutum и М. kansasii. Соединение формулы (I) по данному изобретению также ингибирует рост лекарственно резистентных штаммов М. tuberculosis. Кроме того, примеры, приведенные ниже, описывают способ лечения экспериментального туберкулеза у мышей. Соединения по данному изобретению показывают лучшее действие при низких дозах по сравнению с известными лекарствами, такими как изониазид. Соединения могут вводиться орально в фармацевтических композициях. Опыт ингибирования роста микроорганизмов in vitro Способность соединений по данному изобретению ингибировать рост Mycobacterium species определяли с помощью системы ВАСТЕС 460 ТВ. Штамм М. tuberculosis H37Rv АТСС 27294 выращивали на жидкой среде Middlebrook 7H9 с добавлением 10% азодикарбонамида при 37 С на роторной качалке (150 оборотов в минуту) в течение 7 дней. Мутность культуры доводили до 1,0 по стандарту Макфарленда(McFarland). В пробирки со средой Middlebrook 7H12B высевали по 0,1 мл культуры М. tuberculosis с показателем мутности приведенным до 0,1 по стандарту Макфарленда. В контрольные пробирки высевали по 0,1 мл культуры после 100-кратного разбавления первоначального инокулюма. Набор растворов по 1 мг/мл каждого соединения в диметилсульфоксиде приготовили в отдельных стерильных пробирках. Соединения были в дальнейшем разбавлены до концентрации 25 мг/100 мл. По 0,1 мл каждого раствора добавили в пробирки, содержащие микобактериальную культуру 7 Н 12 В, так что окончательная концентрация соединения составила 6,25 мг/мл. Колпачки пробирок обработали изопропиловым спиртом, пробирки поместили в штатив. Культуры в пробирках инкубировали при 37 С без перемешивания. Опытные пробирки тестировали ежедневно на системе ВАСТЕС пока индекс роста (GI) в контрольных пробирках не достиг показателя 30. Как только GI в контроле достиг 30, GI (GI=GI(n)-GI(n-1 определили для всех опытных и контрольных пробирок. Если AGI для опытной пробирки меньше, чем для контрольной, значит культура чувствительна к тестируемому соединению. Табл. 1 представляет экспериментальные данные активности in vitro соединения формулы (I) по отношению к чувствительным и резистентным штаммам М. tuberculosis. Таблица 2 представляет значения МИК соединения формулы (I) против различных видов Mycobacteria. Таблица 2- 17012461 Опыт in vitro на жидком агаре Определение МИК соединений по отношению к штаммам Mycobacterium проводили методом выращивания культур на жидком агаре по рекомендациям стандартов тестирования микроорганизмов(NCCLS-M24-T2). Соединения растворили в диметилсульфоксиде и последовательно разбавляли в два раза до получения десяти серийных разведений каждого соединения. Соответствующие объемы соединений поместили в чашки Петри в двух повторностях на агаровую среду Middlebrook 7H10 с добавлением 10% среды Middlebrook, обогащенной олеиновой кислотой, альбумином, декстрозой, каталазой(OADC) при концентрациях от 0,03 до 16 мкг/мл. Тест-организм (Mycobacterium strains) выращивали на среде Middle brook 7H9 (бульон), содержащей 0,05% Твин-80 и 10% азодикарбонамид (АДК). Спустя 7 дней инкубации при 37 С бульон довели до 1,0 по стандарту Макфарланда; культуру десятикратно разбавили стерильным солевым раствором, содержащим 0,10% Tween-80. Полученную в результате микобактериальную суспензию высеяли пятнами (3-5 мл/пятно) в чашки Петри на среду 7 Н 10 с добавлением лекарственных препаратов. Чашки Петри герметически укупорили и инкубировали при 37 С в течение 34 недель в вертикальном положении. МИК учитывали как наименьшую концентрацию лекарственного препарата, способную полностью подавить рост тестируемого организма. Тестируемые изоляты включали 10 выделенных у больных туберкулезом изолятов, обычно чувствительных к общеизвестным противотуберкулезным средствам, и 10 изолятов, резистентных к одному и более стандартным противотуберкулезным препаратам. Соответствующие упомянутые штаммы и контрольные лекарственные препараты были включены в каждую группу тестов. Исследования in vivo Эффективность соединений по данному изобретению оценивали также у мышей, инфицированных легочным туберкулезом. Культуру Mycobacterium tuberculosis H37Rv выращивали на среде Middle brook 7H9 (бульон), содержащей 0,05% Твин-80 и 10% азодикарбонамида, при 37 С в течение 7 дней на ротационной качалке при 150 оборотов в минуту. Жидкая культура для инокуляции животных была аглютинирована кратковременным ультразвуком, разбавлена соответственно до концентрации 1107 колониеобразующих единиц (КОЕ)/0,2 мл. Четырехнедельных самок аутбредных швейцарских мышейальбиносов поместили в свободные от патогенов, биологически безопасные условия, в эксперименте использовались микроизолированные клетки. Инфицирование производили внутривенной инокуляцией 0,2 мл аглютинированной суспензии М. tuberculosis H37Rv в хвостовую вену. Затем инфицированных мышей бессистемно распределили на группы, по шесть мышей в каждой. Лечение начали спустя 1 день после инфицирования. Для лечения соединение 3 растворили и разбавили до 50% полиэтилен гликолем 400(ПЭО-400), изониадид разбавили стерильной водой. Лекарственный препарат готовили каждое утро перед введением. Терапия проводилась 5 раз в неделю на протяжениии 4 недель. Все препараты вводились через зонд дозой 50, 25, 12,5 мг/кг массы тела. Контрольные группы инфицированных, но не получавших лечение, мышей были забиты в начале лечения (ранний контроль) и в конце лечения (поздний контроль). Мыши были забиты перерезанием шейной артерии спустя 3-5 дней после введения последней дозы препарата. Целевые органы - селезенка и правое легкоевыделили асептически и гомогенизировали на тканевом гомогенизаторе. По крайней мере, 4 серийных десятикратных разведения гомогената сделали на бульоне 7 Н 9 и поместили в чашки Петри на агаризованную среду Middlebrook 7H11 в двух повторностях. Подсчет колоний проводили после 4-недельного инкубирования при 37 С. Значение КОЕ выразили в log10. Уменьшение вдвое log10 КОЕ для соединения по сравнению с ранним контролем считали важным показателем. Активность in vivo соединения 3 формулы (I) против М. tuberculosis H37Rv АТСС 27294 аа у инфицированных швейцарских мышей-альбиносов показана в табл. 3. Таблица 3b - мышам вводили дозы препаратов 5 дней в неделю в течение 4 недель, дни 1-28;c - различия в средних значениях log10 КОЕ по сравнению с ранним контролем. Эффективность in vivo соединений 12 формулы I по отношению к М. tuberculosis H37Rv ATCC 27294 а у мышей, получавших лечение, спустя 14 дней после инфицирования, и сопоставление ее с эффективностью изониазида показаны в табл. 4. Таблица 4b - мышам вводили дозы препаратов 5 дней в неделю в течение 4 недель, дни 1-28; с - различия в средних значениях log10 КОЕ по сравнению с ранним контролем. Эффективность in vivo соединений 3 формулы I против М. tuberculosis (лекарственно резистентный штамм) у мышей, получавших лечение, спустя 1 день после инфицирования, и сопоставление ее с эффективностью изониазида показаны в табл. 5. Таблица 5b - мышам вводили дозы препаратов 5 дней в неделю в течение 4 недель, дни 1-28; с - различия в средних значениях log10 КОЕ по сравнению с ранним контролем. Эффективность in vivo соединения 12 формулы I против М. tuberculosis H37Rv у мышей, полу- 19012461 чавших лечение, спустя 1 день после инфицирования, и сопоставление ее с эффективностью изониазида показаны в табл. 6. Таблица 6b - мышам вводили дозы препаратов 5 дней в неделю в течение 4 недель, дни 1-28; с - различия в средних значениях log10 КОЕ по сравнению с ранним контролем. В то время как, данное изобретение было описано в специфических вариантах осуществления, определенные модификации и эквиваленты их будут очевидны специалистам в этой области и предназначены, чтобы быть включенными в область данного изобретения. Исследование острой токсичности на мышах Соединение 3 формулы (I) вводилось как одиночная оральная доза швейцарским мышамальбиносам. Использовали две дозы 500 и 2000 мг/кг. Мыши обследовались 14 дней. Не наблюдались ни клинические симптомы, ни летальные исходы. Мыши были забиты на 15 день, патологические изменения в каких-либо органах обнаружены не были. Таким образом, летальная доза 0% (LD0) превышает 2000 мг/кг при оральном способе введения у мышей. Подтвержденная летальная доза 50% (LD50) для изониазида составляет 139 мг/кг при оральном введении. Аналогично для соединения 12 формулы I, LD0500 мг/кг у мышей при оральном введении. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I), его таутомеры, энантиомеры, диастереомеры, N-оксиды, полиморфы и их фармацевтически приемлемые солиi) фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, C1-C4 алкил, С 1-С 4 алкокси, С 1-С 4 тиоалкокси, нитро,галоалкил, галоалкокси, пиперазин, морфолин, тиоморфолин, пирролидин и пиперидин, илиR3 - фенил, незамещенный или замещенный 1-3 заместителями, выбранными из группы, включающей SH, NO2, CH2Cl, CH2Br, OCF3, OCH2CF3, Cl, Br, I, F, C1-C6 алкокси, С 1-С 6 алкил, С 1-С 6 тиоалкил, С 6 С 10 арил, С 5-С 6 гетероарил с 1-3 гетероатомами, выбранными из О, N и S, гетероарил, если один из R4 или где R8 - фенил, незамещенный или замещенный 1-2 заместителями, каждый из которых независимо выбран из группы, включающей галоген,С 1-С 4 алкил,С 1-С 4 алкокси, С 1-С 4 тиоалкокси, нитро, амино, галоалкил, галоалкокси; бензил или бензил, замещенный 3,4-метилендиокси; гетероарил; гетероароил; дифенилметил,m=0-2 иX является -NCH3, CH2, S, SO или SO2; так что, если R2 - фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1 С 4 тиоалкокси, нитро, галоалкил, галоалкокси, пиперазин, морфолин, тиоморфолин, пирролидин, пиперидин и R4 - водород; R8 не является C1-С 4 алкилом или X не является -NCH3, S, SO или SO2, если m=1, илиX не является-СН 2, если m=0. 2. Соединение, его таутомеры, энантиомеры, диастереомеры, N-оксиды, полиморфы и их фармацевтически приемлемые соли по п.1, где соединение формулы I выбрано из группы, включающей 1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(4-фторфенил)пиперазин,1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(2-метоксифенил)пиперазин,1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(3-трифторметилфенил)пиперазин,1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(2-пиридил) пиперазин,1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(2-пиримидил)пиперазин,1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(дифенилметил)пиперазин. 4-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метилпиперазинил-2-фурилкетон,5-[(4-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метилпиперазинил)метил]-2 Н-бензо[d]1,3 диоксолан,4-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метилпиперазинилоксолан-2-ил-кетон,1-[1,5-бис(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(5-хлор-2-метилфенил)пиперазин,N-(3-[4-(4-фторфенил)пиперазинил]метил-2-метил-5-фенилпирролил)-4-пиридилкарбоксамид,N-(3-[4-(3-фторфенил)пиперазинил]метил-2-метил-5-фенилпирролил)-4-пиридилкарбоксамид,N-(3-[4-(2-метоксифенил)пиперазинил]метил-2-метил-5-фенилпирролил)-4-пиридилкарбоксамид,N-(3-[4-(2-пиридил)пиперазинил]метил-2-метил-5-фенилпирролил)-4-пиридилкарбоксамид,N-(2-метил-5-фенил-3-[4-бензилпиперазинил]метилпирролил)-4-пиридилкарбоксамид,N-2-метил-3-[(4-метилпиперазинил)метил]-5-фенилпирролил)-4-пиридилкарбоксамид,N-(3-[4-(2 Н-бензо[d]1,3-диоксолен-5-илметил)пиперазинил]метил-2-метил-5-фенилпирролил)-4 пиридилкарбоксамид,N-[2-метил-5-фенил-3-(пиперидинилметил)пирролил]-4-пиридилкарбоксамид,N-(2-метил-5-фенил-3-(пирролидинилметил)пирролил)-4-пиридилкарбоксамид,N-[2-метил-3-(морфолин-4-ил-метил)-5-фенилпирролил]-4-пиридилкарбоксамид.N-(2-метил-5-фенил-3-(1,4-тиазапергидроин-4-илметил)пирролил)-4-пиридилкарбоксамид,N-(3-[4-(4-фторфенил)пиперазинил]метил-5-метил-2-фенилпирролил)-4-пиридилкарбоксамид,N-(3-[4-(3-трифторметилфенил)пиперазинил]метил-5-метил-2-фенилпирролил)-4 пиридилкарбоксамид,N-(3-[4-(2 Н-бензо[d]1,3-диоксолан-5-илметил)пиперазинил]метил-5-метил-2-фенилпирролил)-4 пиридилкарбоксамид,N-(3-[4-(4-фторфенил)пиперазинил]метил-2-метил-5-фенилпирролил)пиразин-2-ил-карбоксамид,N-(3-[4-(2-метоксифенил)пиперазинил]метил-2-метил-5-фенилпирролил)пиразин-2 илкарбоксамид,N-(3-[4-(3-трифторметилфенил)пиперазинил]метил-2-метил-5-фенилпирролил)пиразин-2 илкарбоксамид,N-(3-[4-(2-пиридил)пиперазинил]метил-2-метил-5-фенилпирролил)пиразин-2-ил-карбоксамид,N-(3-[4-(2H-бензо[d]1,3-диоксолан-5-илметил)пиперазинил]метил-2-метил-5 фенилпирролил)пиразин-2-илкарбоксамид,N-(3-[4-(дифенилметил)пиперазинил]метил-2-метил-5-фенилпирролил)пиразин-2-илкарбоксамид,N-(3-[4-(4-фторфенил)пиперазинил]метил-5-метил-2-фенилпирролил)пиразин-2-илкарбоксамид,N-(3-[4-(2-метоксифенил)пиперазинил]метил-5-метил-2-фенилпирролил)пиразин-2- 21012461 илхарбоксамид,N-(3-[4-(3-трифторметилфенил)пиперазинил]метил-5-метил-2-фенилпирролил)пиразин-2 илкарбоксамид,N-(3-[4-(2-пиридил)пиперазинил]метил-5-метил-2-фенилпирролил)пиразин-2-илкарбоксамид,N-(3-[4-(2 Н-бензо[d]1,3-диоксолан-5-ил-метил)пиперазинил]метил-5-метил-2 фенилпирролил)пиразин-2-илкарбоксамид,N-(3-[4-(дифенилметил)пиперазинил]метил-5-метил-2-фенилпирролил)пиразин-2-илкарбоксамид,N-(5-(4-хлорфенил)-3-[4-(4-фторфенил)пиперазинил]метил-2-метил-5-фенилпирролил)пиразин-2 илкарбоксамид,N-(5-(4-хлорфенил)-3-[4-(2-метоксифенил)пиперазинил]метил-2-метилпирролил)пиразин-2 илкарбоксамид,N-(5-(4-хлорфенил)-3-[4-(3-трифторметилфенил)пиперазинил]метил-2-метилпирролил)пиразин 2-илкарбоксамид,N-(5-(4-хлорфенил)-3-[4-(2-пиридил)пиперазинил]метил-2-метилпирролил)пиразин-2 илкарбоксамид,N-(2-(4-хлорфенил)-3-[4-(4-фторфенил)пиперазинил]метилпирролил)пиразин-2-илкарбоксамид,N-(2-(4-хлорфенил)-3-[4-(2-метоксифенил)пиперазинил]метил-5-метилпирролил)пиразин-2-илкарбоксамид,N-(2-(4-хлорфенил)-3-[4-(3-трифторметилфенил)пиперазинил]метил-5-метилпирролил)пиразин 2-илкарбоксамид,1-[1-(2,4-дифторфенил)-5-(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(4-фторфенил)пиперазин,1-[1-(2,4-дифторфенил)-5-(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(2-метоксифенил)пиперазин,1-[1-(2,4-дифторфенил)-5-(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(3-трифторметилфенил) пиперазин,1-[1-(2,4-дифторфенил)-5-(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(2-пиридил)пиперазин,1-[1-(2,4-дифторфенил)-5-(4-хлорфенил)-2-метилпиррол-3-ил]метил-4-(4-дифенилметил)пиперазин,1-[1-(2,4-дифторфенил)-2-(4-хлорфенил)-5-метилпиррол-3-ил]метил-4-(дифенилметил)пиперазин,5-[(4-[1-(2,4-дифторфенил)-5-(4-хлорфенил)-2-метилпиррол-3-ил]метилпиперазинил)метил]-2 Нбензо[d]1,3-диоксолан,1-[1-(2,4-дифторфенил)-2-метил-5-фенилпиррол-3-ил]метил-4-(4-фторфенил)пиперазин,1-[1-(2,4-дифторфенил)-2-метил-5-фенилпиррол-3-ил]метил-4-(2-метоксифенил)пиперазин,1-[1-(2,4-дифторфенил)-2-метил-5-фенилпиррол-3-ил]метил-4-(3-трифторметилфенил)пиперазин,1-[1-(2,4-дифторфенил)-2-метил-5-фенилпиррол-3-ил]метил-4-(2-пиридил) пиперазин,1-[1-(2,4-дифторфенил)-5-метил-2-фенилпиррол-3-ил]метил-4-(4-фторфенил) пиперазин,1-[1-(2,4-дифторфенил)-5-метил-2-фенилпиррол-3-ил]метил-4-(2-метоксифенил)пиперазин,1-[1-(2,4-дифторфенил)-5-метил-2-фенилпиррол-3-ил]метил-4-(3-трифторметилфенил)пиперазин,1-[1-(2,4-дифторфенил)-5-метил-2-фенилпиррол-3-ил]метил-4-(2-пиридил)пиперазин,1-[5-(4-хлорфенил)-2-метил-1-нафтилпиррол-3-ил]метил-4-(2-метоксифенил) пиперазин,1-[5-(4-хлорфенил)-2-метил-1-нафтилпиррол-3-ил]метил-4-(3-трифторметилфенил)пиперазин,1-[5-(4-хлорфенил)-2-метил-1-нафтилпиррол-3-ил]метил-4-(2-пиридил)пиперазин,5-[(4-[5-(4-хлорфенил)-2-метил-1-нафтилпиррол-3-ил]метилпиперазинил)метил]-2 Н-бензо[d]1,3 диоксолен,1-[2-(4-хлорфенил)-5-метил-1-нафтилпиррол-3-ил]метил-4-(2-метоксифенил)пиперазин,1-[2-(4-хлорфенил)-5-метил-1-нафтилпиррол-3-ил]метил-4-(3-трифторметилфенил)пиперазин,1-[2-(4-хлорфенил)-5-метил-1-нафтилпиррол-3-ил]метил-4-(2-пиридил)пиперазин,N-(5-(4-хлорфенил)-3-[4-(4-фторфенил)пиперазинил]метил-2-метилпирролил)-4-пиридилкарбоксамид,N-(5-(4-хлорфенил)-3-[4-(2-метоксифенил)пиперазинил]метил-2-метилпирролил)-4-пиридилкарбоксамид,N-(5-(4-хлорфенил)-3-[4-(3-трифторметилфенил)пиперазинил]метил-2-метилпирролил)-4-пиридилкарбоксамид,N-(5-(4-хлорфенил)-3-[4-(2-пиридил)пиперазинил]метил-2-метилпирролил)-4-пиридилкарбоксамид,N-(3-[4-(2 Н-бензо[d]1,3-диоксолан-5-ил-метил)пиперазинил]метил-5-(4-хлорфенил)-2-метилпирролил)-4-пиридилкарбоксамид,N-(2-(4-хлорфенил)-3-[4-(4-фторфенил)пиперазинил]метил-5-метилпирролил)-4-пиридилкарбоксамид,N-(2-(4-хлорфенил)-3-[4-(2-метоксифенил)пиперазинил]метил-5-метилпирролил)-4-пиридилкарбоксамид,N-(2-(4-хлорфенил)-3-[4-(3-трифторметилфенил)пиперазинил]метил-5-метилпирролил)-4- 22012461 пиридилкарбоксамид,N-(2-(4-хлорфенил)-3-[4-(2-пиридил)пиперазинил]метил-5-метилпирролил)-4-пиридилкарбоксамид,N-(3-[4-(2 Н-бензо[d]1,3-диоксолан-5-ил-метил)пиперазинил]метил-2-(4-хлофенил)-5 метилпирролил)-4-пиридилкарбоксамид,4-(4-фторфенил)-1-[(2-метил-5-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин,4-(2-метоксифенил)-1-[2-метил-5-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин,4-(3-трифторметилфенил)-1-[(2-метил-5-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин,1-[(2-метил-5-фенил-1-(2-пиридил)пиррол-3-ил)метил]-4-(2-пиридил)пиперазин,5-(4-[(2-метил-5-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазинилметил)-2 Н-бензо[d]1,3 диоксолан,4-(4-фторфенил)-1-[5-метил-2-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин,4-(2-метоксифенил)-1-[5-метил-2-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин,4-(3-трифторметилфенил)-1-[5-метил-2-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазин,1-[(5-метил-2-фенил-1-(2-пиридил)пиррол-3-ил)метил]-4-(2-пиридил)пиперазин,5-(4-[(5-метил-2-фенил-1-(2-пиридил)пиррол-3-ил)метил]пиперазинилметил)-2 Н-бензо[d]1,3 диоксолан,1-[1,5-бис(4-хлорфенил)-2-этилпиррол-3-ил]метил-4-(3-трифторметилфенил) пиперазин,N-[5-(4-хлорфенил)-2-метил-3-(1,4-тиазапергидроин-4-ил-метил)пирролил]-4-пиридилкарбоксамид,2-[3-(гидроксиметил)-5-метил-2-фенил-4-(1,4-тиазапергидроин-4-ил-метил)пирролил]бутан-1-ол и 2-[2-метил-5-фенил-3-(1,4-тиазапергидроин-4-илметил)пирролил]бутан-1-ол. 3. Фармацевтическая композиция, включающая: а) по меньшей мере одно или несколько соединений по п.1 или 2, их таутомеры, энантиомеры, диастереомеры, N-оксиды, полиморфы и фармацевтически приемлемые соли;b) их фармацевтически приемлемые носители. 4. Фармацевтическая композиция по п.3, являющаяся твердым или жидким препаратом. 5. Фармацевтическая композиция по п.3, предназначенная для орального или парентерального введения. 6. Способ ингибирования роста клетки микроорганизма по меньшей мере одним соединением формулы (I), его таутомерами, энантиомерами, диастереомерами, N-оксидами, полиморфами и их фармацевтически приемлемыми солями, с их фармацевтическими носителями или без них. 7. Способ по п.6, в котором клеткой микроорганизма является Mycobacterium tuberculosis, лекарственно резистентная М. tuberculosis, M. avium- intracellulare комплекс, М. Fortuitum и М. kansasii. 8. Способ лечения микобактериальных инфекций у млекопитающих, включающий введение эффективного противомикобактериального количества по меньшей мере одного соединения формулы (I), его таутомеров, энантиомеров, диастереомеров, N-оксидов, полиморф и их фармацевтически приемлемых солей, с их фармацевтическими носителями или без них. 9. Способ по п.7 лечения туберкулеза у млекопитающих, который включает введение эффективного противомикобактериального количества по меньшей мере одного соединения формулы I, его таутомеров, энантиомеров, диастереомеров, N-оксидов, полиморф и их фармацевтически приемлемых солей, с их фармацевтическими носителями или без них. 10. Способ получения соединения формулы (I) при котором данное соединение получают реакцией соединения формулы (V)i) фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 тиоалкокси, нитро,галоалкил, галоалкокси, пиперазин, морфолин, тиоморфолин, пирролидин и пиперидин, илиR3 - фенил, незамещенный или замещенный 1-3 заместителями, выбранными из группы, включающей SH, NO2, CH2Cl, CH2Br, OCF3, OCH2CF3, Cl, Br, I, F, C1-C6 алкокси, С 1-С 6 алкил, С 1-С 6 тиоалкил, С 6 С 10 арил, С 5-С 6 гетероарил с 1-3 гетероатомами, выбранными из О, N и S, гетероарил,с амином формулы R7H, где R7 выбран из группы где R8 - фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 тиоалкокси,нитро, амино, галоалкил, галоалкокси; бензил или бензил, замещенный 3,4-метилендиокси; гетероарил; гетероароил; дифенилметил; где R8 - фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 тиоалкокси,нитро, амино, галоалкил, галоалкокси; бензил или бензил, замещенный 3,4-метилендиокси; гетероарил; незамещенный или замещенный гетероароил; дифенилметил; m=0-2 иX является -NCH3, CH2, S, SO или SO2; так что R2 - фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 тиоалкокси,нитро, галоалкил, галоалкокси, пиперазин, морфолин, тиоморфолин, пирролидин, пиперидин и R4 - водород; R8 не является C1-С 4 алкилом или X не является -NCH3, S, SO или SO2, если m=1, или X не является-СН 2, если m=0. 11. Способ по п.10, в котором соединение формулы (V) получают реакцией соединения формулыR3 - фенил, незамещенный или замещенный 1-3 заместителями, выбранными из группы, включающей SH, NO2, CH2Cl, CH2Br, OCF3, OCH2CF3, Cl, Br, I, F, C1-C6 алкокси, С 1-С 6 алкил, С 1-С 6 тиоалкил, С 6 С 10 арил, С 5-С 6 гетероарил с 1-3 гетероатомами, выбранными из О, N и S, гетероарил,с амином формулы R2-NH2, где R2 выбран из группы, включающей:i) фенил, незамещенный или замещенный одним или двумя заместителями, каждый из которых независимо выбран из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 алкокси, C1-C4 тиоалкокси, нитро,галоалкил, галоалкокси, пиперазин, морфолин, тиоморфолин, пирролидин и пиперидин, илиvii) NHCOR6, где R6 - арил, гетероарил, гетероциклил. 12. Способ по п.11, в котором соединение формулы (IV) получают реакцией соединения формулы(II) где R3 - фенил, незамещенный или замещенный 1-3 заместителями, выбранными из группы, включающей SH, NO2, CH2Cl, CH2Br, OCF3, OCH2CF3, Cl, Br, I, F, C1-C6 алкокси, С 1-С 6 алкил, С 1-С 6 тиоалкил,С 6-С 10 арил, C5-С 6 гетероарил с 1-3 гетероатомами, выбранными из О, N и S, гетероарил, с соединением формулы (III) где R1 - С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 тиоалкокси, трифторалкил, трифторалкокси или гидроксиалкил. 13. Способ по п.12, в котором соединение формулы (IV) получают реакцией соединения формулы где R3 - фенил, незамещенный или замещенный 1-3 заместителями, выбранными из группы, включающей SH, NO2, CH2Cl, CH2Br, OCF3, OCH2CF3, Cl, Br, I, F, С 1-С 6 алкокси, С 1-С 6 алкил, С 1-С 6 тиоалкил,С 6-С 10 арил, С 5-С 6 гетероарил с 1-3 гетероатомами, выбранными из О, N и S, гетероарил, с соединением формулы (VII)
МПК / Метки
МПК: C07D 401/14, C07D 401/04, C07D 417/06, C07D 401/12, A61K 31/4025, C07D 207/32, C07D 403/04, A61P 31/06, C07D 403/12, C07D 405/12, C07D 405/14
Метки: антимикобактериальной, обладающие, активностью, соединения
Код ссылки
<a href="https://eas.patents.su/26-12461-soedineniya-obladayushhie-antimikobakterialnojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, обладающие антимикобактериальной активностью</a>
Предыдущий патент: Лекарство и способ для снижения потребления алкоголя и/или табака
Следующий патент: Способ ускорения роста растений с использованием амидных соединений
Случайный патент: Способ и приспособление для гибки концевых участков стержневых проводников, в частности для стержневых обмоток электрических машин