Соединения, обладающие антивирусной активностью
Номер патента: 1442
Опубликовано: 23.04.2001
Авторы: Спитцер Вейн А., Виктор Франц, Миллер Шон К., Юнгхейм Луи Н., Теббе Марк Дж.
Формула / Реферат
1. Соединение формулы I
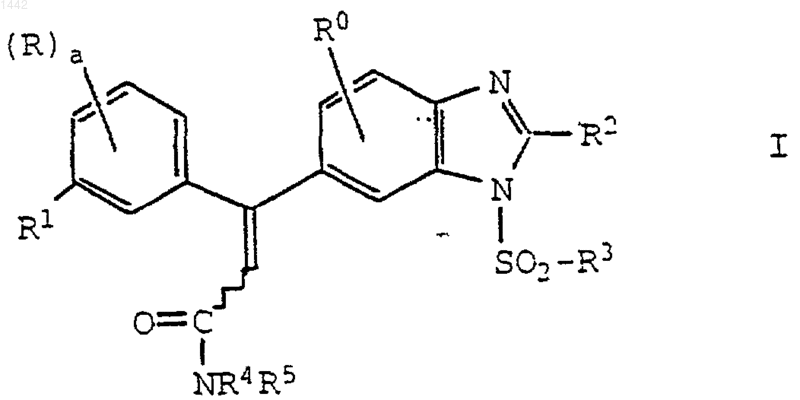
где а равно 0, 1, 2 или 3;
каждый R независимо обозначает водород, галоген, циано, амино, галоген(С1-С4)алкил, ди(С1-С4алкиламино, азидо, С1-С6-алкил, карбамоил, карбамоилокси, карбамоиламино, С1-С4-алкокси, С1-С4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, пирролидино, пиперидино или морфолино;
R0 обозначает водород, галоген, С1-С4-алкил или С1-С4-алкокси;
R1 обозначает галоген, циано-, гидрокси, метил, этил, метокси, этокси, метилтио, метилсульфинил или метилсульфонил;
R2 обозначает водород, амино или -NHC(O)(С1-С6-алкил);
R3 обозначает диметиламино, С1-С10-алкил, С3-С7-циклоалкил, замещенный С3-С7-циклоалкил, галоген(С1-С6)алкил, фенил, замещенный фенил, нафтил, фурил, тиенил, тиазолидинил, пирролидино, пиперидино, морфолино или группу формулы
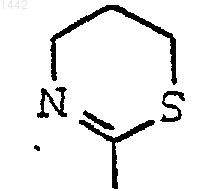
R4 и R5 независимо обозначает водород или С1-С4-алкил;
при условии, что когда R находится в положении 2 или 6, то R не может быть галогеном, циано, метилом, этилом, метокси, этокси, метилтио, метилсульфинилом или метилсульфонилом;
или его фармацевтически приемлемая соль.
2. Соединение по п.1
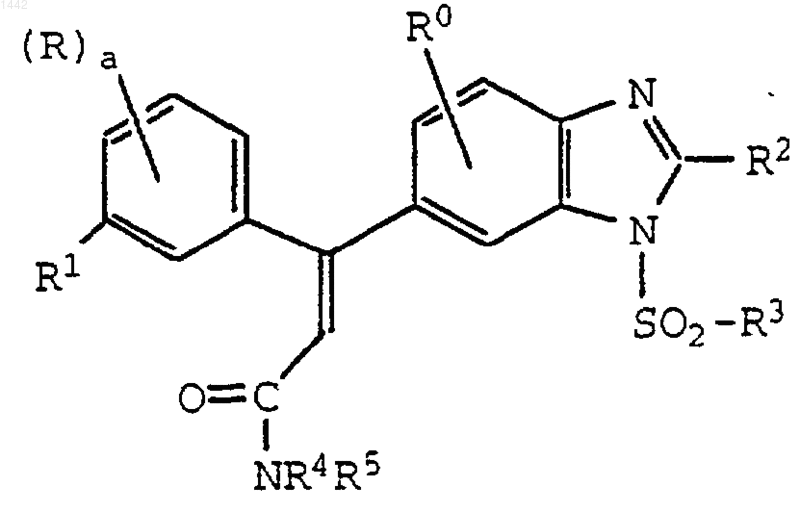
где а равно 0, 1 или 2;
каждый R независимо обозначает водород, галоген, С1-С4-алкил, С1-С4-алкокси или ди(С1-С4)алкиламино;
R0 обозначает водород;
R2 обозначает амино;
R3 обозначает диметиламино, С1-С6-алкил, галоген(С1-С6)алкил, С3-С7-циклоалкил, замещенный С3-С7-циклоалкил, тиенил, тиазолидинил, пирролидино, пиперидино или морфолино;
R4 обозначает водород, метил или этил;
R5 обозначает водород, метил или этил;
или его фармацевтически приемлемая соль.
3. Соединение по п.2, где а равно 0 или 1; каждый R независимо обозначает водород, фтор, метил, этил, метокси, этокси, диметиламино; R0 обозначает водород; R3 обозначает диметиламино, С1-С4-алкил, С3-С7-циклоалкил или пирролидино; или его фармацевтически приемлемая соль.
4. Соединение по п.3, которое представляет собой
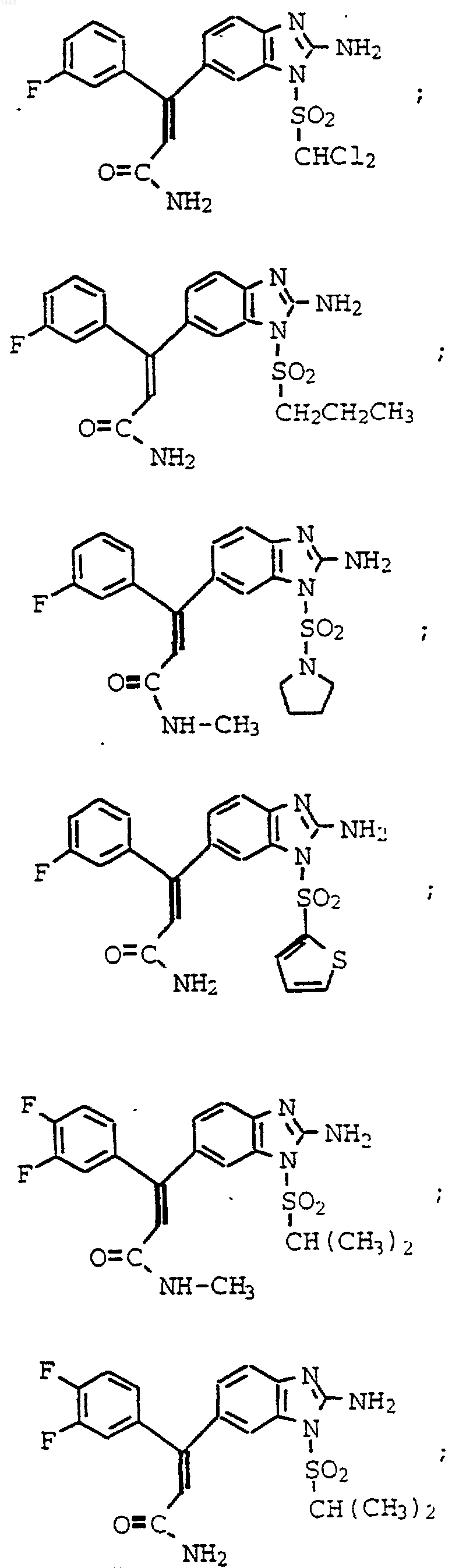
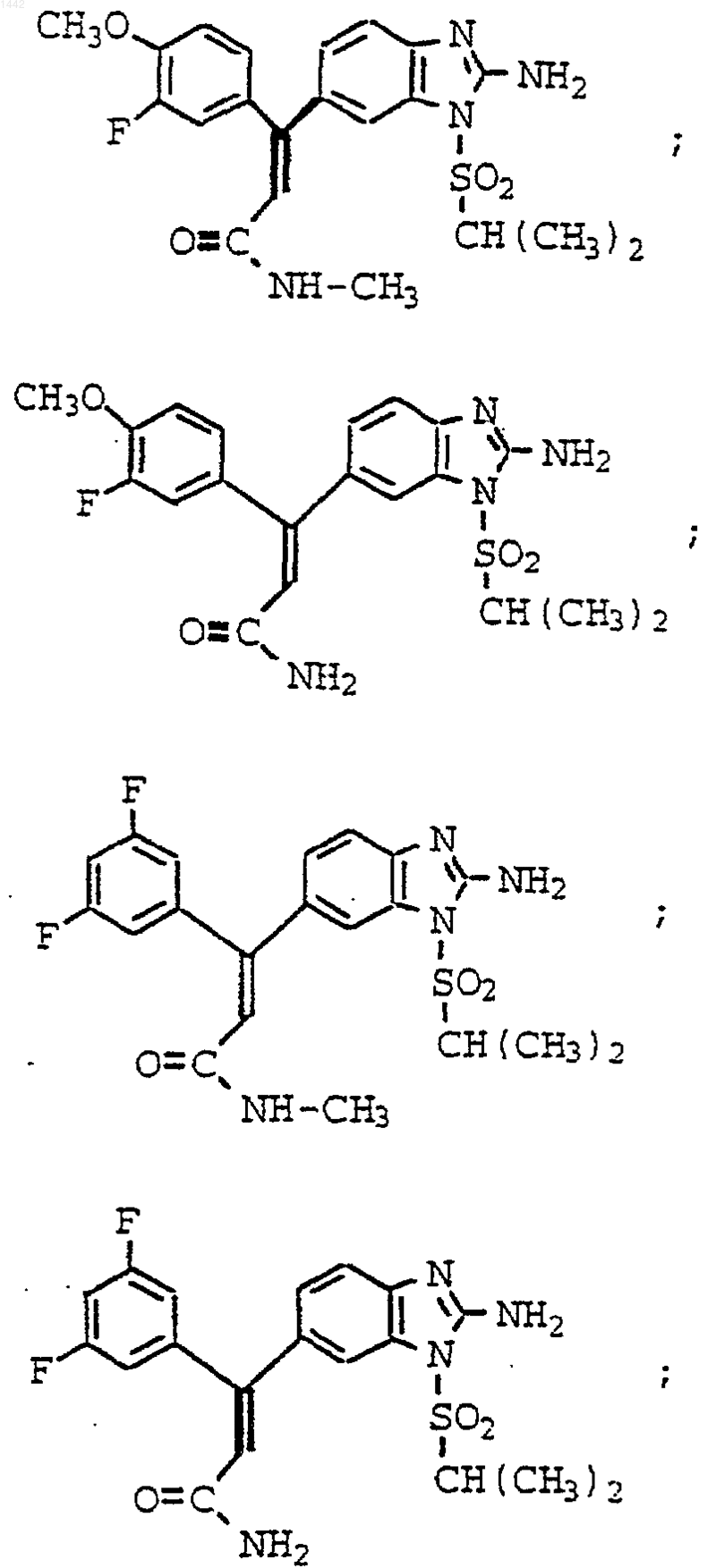
или его фармацевтически приемлемая соль.
5. Фармацевтическая композиция, содержащая эффективное количество соединения формулы I или его фармацевтически приемлемую соль по любому из пп.1-4, соединенные с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или наполнителями.
6. Применение соединения формулы I или его фармацевтически приемлемая соль, по любому из пп.1-4, в качестве фармацевтического средства.
7. Применение по п.6, отличающееся тем, что фармацевтическое средство является антивирусным средством.
Текст
1 Данное изобретение относится к области медицины, в частности к лечению вирусных инфекций. Более конкретно данное изобретение относится к лечению риновирусных, энтеровирусных и флавивирусных инфекций. Распространенность заболевания верхних дыхательных путей, простуды, является огромной. Оценено, что почти биллион случаев ежегодно имеют место только в Соединенных Штатах. Риновирус, член семейства Picornaviridae,является основным возбудителем простуды у человека. Вследствие того, что были идентифицированы более 110 штаммов риновирусов, разработка применимой на практике риновирусной вакцины является неосуществимой, и, повидимому, химиотерапия является более желательным подходом для борьбы с этим видом инфекции. Другим членом семейства Picornaviridae является энтеровирус, который включает приблизительно восемьдесят патогенов человека. Многие из этих вирусов вызывают симптомы, подобные простуде; другие вызывают более серьезные заболевания, такие как полиомиелит, конъюнктивит, асептический менингит и миокардит. Болезнь, связанная с риновирусной инфекцией, имеет такие симптомы, как выделения из носа и закупорка носа. Кроме того, считали, что она имеет отношение к воспалению среднего уха, провоцирует развитие бронхита, обостряет синусит и имеет отношение к преципитации астматического altoclis. Хотя многие считают эту болезнь лишь досадной неприятностью, ее частая встречаемость у здоровых в остальных отношениях индивидуумов и вытекающая из этого экономическая важность в виде длительного отсутствия служащих и визитов врача делает эту болезнь предметом обширного исследования. Способность химических соединений подавлять рост вирусов in vitro может быть легко продемонстрирована при помощи теста супрессии вирусных бляшек или теста цитопатогенного эффекта (СРЕ). См. Siminoff, Applied Microbiology 9(1), 66 (1961). Хотя ряд химических соединений, которые ингибируют пикорнавирусы, такие как риновирусы, был идентифицирован, многие являются неприемлемыми вследствие 1) ограниченного спектра активности, 2) нежелательных побочных эффектов или 3) неспособности предотвращения инфекции или болезни у животных или человека. См. Textbookof Human Virology, edited by Robert B.Belshe,chapter 16, "Phinoviruses", R.A, Levandowski,391-405 (1985). Таким образом, несмотря на признанную терапевтическую возможность,связанную с ингибитором риновируса, и попытки исследований, предпринятые до сих пор, еще не был выявлен жизнеспособный терапевтический агент. Например, антивирусные производные бензимидазола были описаны в U.S. Pat.Ser. Nos. 4 008 243, 4 018 790, 4 118 573, 4 118 742, 4 174 454 и 4 492 708. В целом соединения, описанные в указанных выше патентах, не имеют желательных фармакологических показателей, позволяющих использовать их для лечения риновирусных инфекций. Конкретно, эти соединения не обладают удовлетворительной пероральной биодоступностью или достаточно высокой ингибиторной активностью, чтобы компенсировать их относительно низкую пероральную биодоступность, позволяющей их широкое использование. Кроме того, в данной области широко признано,что соединения, используемые для лечения риновирусных инфекций, должны быть не токсичными. Задачей данного изобретения является создание новых соединений бензимидазола,которые ингибируют рост пикорнавирусов, таких как риновирусы, энтеровирусы, такие как полиовирусы, Коксакивирусы групп А и В, или ЕСНО-вирус, и которые имеют желательный фармакологический профиль. Данное изобретение обеспечивает соединения формулы IR3 обозначает диметиламино, C1-C10 алкил, C3-C7-циклоалкил, замещенный C3-C7 циклоалкил, галоген (C1-C6)алкил, фенил, замещенный фенил, нафтил, фурил, тиенил, тиазолидинил,пирролидино, пиперидино, морфолино или группу формулы:R4 и R5 независимо обозначают водород или C1C4-алкил; при условии, что когда R находится во 2- или 6-положении, R не может быть галогеном, циано-, метил-, этил-, метокси-, этокси-,метилтио-, метилсульфинил- или метилсульфонилгруппами; соль. Данное изобретение относится также к фармацевтической композиции, содержащей соединение данного изобретения или его фармацевтически приемлемую соль, в сочетании с фармацевтически приемлемым носителем, разбавителем или наполнителем. Данное изобретение относится также к способу ингибирования пикорнавируса, предусматривающего введение хозяину, нуждающемуся в лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли, где a, R, R0, R1, R2, R3, R4 и R5 имеют определенные выше значения. Данное изобретение также относится к производным бензимидазола формулы I, определенным выше, в качестве антивирусных агентов. Все приводимые здесь температуры даны в градусах Цельсия (С). Все единицы измерений,применяемые здесь, даны в весовых единицах,за исключением жидкостей, для которых даются единицы объема. Используемый здесь, термин "C1-C10 алкил" обозначает прямую или разветвленную алкильную цепь, имеющую от одного до десяти атомов углерода. Типичные C1-C10-алкильные группы включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил,пентил, неопентил, гексил, 2-метилгексил, гептил и т.п. Термин "C1-C10-алкил" включает в его определение термины "C1-C6-алкил" и "C1-C4 алкил"."Галоген (C1-C4)алкил обозначает прямую или разветвленную алкильную цепь, имеющую от одного до четырех атомов углерода, с присоединенными к ней 1, 2 или 3 атомами галогена. Типичные галоген(C1-C4)алкильные группы включают хлорметил, 2-бромэтил, 1-хлоризопропил, 3-фторпропил,3-бромбутил, 3-хлоризобутил, иод-трет-бутил, трихлорметил, трифторметил, 2,2-хлориодэтил, 2,3-дибромпропил и т.п."C1-C4-алкилтио" обозначает прямую или разветвленную алкильную цепь, имеющую от одного до четырех атомов углерода, присоединенную к атому серы. Типичные C1-C4 алкилтиогруппы включают метилтио, этилтио,пропилтио, изопропилтио, бутилтио и т.п."C1-C4-алкокси" обозначает прямую или разветвленную алкильную цепь, имеющую от одного до четырех атомов углерода, присоединенную к атому кислорода. Типичные C1-C4 алкоксигруппы включают метокси, этокси, пропокси, изопропокси, бутокси и т.п."Ди(C1-C4)алкиламино" обозначает две прямые или разветвленные алкильные цепи,имеющие от одного до четырех атомов углерода, присоединенные к обычной аминогруппе."C1-C4-алкилсульфинил" обозначает прямую или разветвленную алкильную цепь,имеющую от одного до четырех атомов углерода, присоединенную к сульфинильному радикалу. Типичные C1-C4-алкилсульфинильные группы включают метилсульфинил, этилсульфинил,пропилсульфинил, изопропилсульфинил, бутилсульфинил и т.п."C1-C4-алкилсульфонил" обозначает прямую или разветвленную алкильную цепь,имеющую от одного до четырех атомов углерода, присоединенную к сульфонильному радикалу. Типичные C1-C4-алкилсульфонильные группы включают метилсульфонил, этилсульфонил,пропилсульфонил, изопропилсульфонил, бутилсульфонил и т.п."Замещенный фенил" обозначает фенильное кольцо, замещенное одним-тремя заместителями, выбранными из следующих заместителей: галогена, циано, C1-C4-алкила, C1-C4 алкокси, амино или галоген (C1-C4)алкила."Замещенный C3-C7-циклоалкил" обозначает циклоалкильное кольцо, замещенное одним-тремя заместителями, выбранными из следующих заместителей: галогена, циано, C1-C4 алкила, C1-C4-алкокси, амино или галоген(C1C4)алкила. Заявленные соединения могут встречаться либо в цис-, либо в транс-конформации. Для целей данного изобретения цис- относится к соединениям, в которых карбоксамидная часть молекулы находится в цис-положении относительно бензимидазольного кольца, а трансотносится к соединениям, где карбоксамидная часть молекулы находится в транс-положении относительно бензимидазольного кольца. Оба изомера включены в объем заявленных соединений. Как упоминалось выше, данное изобретение включает фармацевтически приемлемые соли соединений формулы I. Соединение данного изобретения может обладать достаточно кислыми, достаточно основными или и теми, и другими функциональными группами и, в соответствии с этим, взаимодействовать с любым из ряда неорганических оснований и неорганическими и органическими кислотами с образованием фармацевтически приемлемой соли. Термин "фармацевтически приемлемая соль", используемый здесь, относится к солям соединений приведенной выше формулы, которые по существу являются нетоксичными для живых организмов. Типичные фармацевтически приемлемые соли включают соли, полученные реакцией соединений данного изобретения с минеральной или органической кислотой или неорганическим основанием. Такие соли из 5 вестны как кислотно-аддитивные соли и основно-аддитивные соли. Кислоты, обычно используемые для образования кислотно-аддитивных солей, являются неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, фосфорная кислота и т.п., и органическими кислотами, такими как п-толуолсульфоновая кислота,метансульфоновая кислота, этансульфоновая кислота, щавелевая кислота, п-бромфенилсульфоновая кислота, угольная кислота, янтарная кислота, лимонная кислота, бензойная кислота,уксусная кислота и т.п. Примерами таких фармацевтически приемлемых солей являются сульфат, пиросульфат,бисульфат, сульфит, бисульфит, фосфат, моногидрогенфосфат, дигидрогенфосфат, метафосфат, пирофосфат, хлорид, бромид, иодид, ацетат, пропионат, деканоат, каприлат, акрилат,формиат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат,себацат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксилолсульфонат,фенилацетат, фенилпропионат, фенилбутират,цитрат, лактат, -гидроксибутират, гликолат,тартрат, метансульфонат, этансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и т.п. Предпочтительными фармацевтически приемлемыми кислотно-аддитивными солями являются соли,образованные с минеральными кислотами, такими как соляная кислота и серная кислота, и соли, образованные с органическими кислотами, такими как малеиновая кислота и метансульфоновая кислота. Основно-аддитивные соли включают соли,образованные из неорганических оснований,таких как гидроксиды аммония или щелочного или щелочно-земельного металла, карбонаты,бикарбонаты и т.п. Такие основания, используемые при получении солей данного изобретения, включают, следовательно, гидроксид натрия, гидроксид калия, гидроксид аммония, карбонат натрия, бикарбонат натрия, бикарбонат калия, гидроксид кальция, карбонат кальция и т.п. Формы соли калия и натрия являются особенно предпочтительными. Должно быть понятно, что природа конкретного противоиона, образующего часть любой соли данного изобретения, не является решающей до тех пор, пока эта соль в целом является фармацевтически приемлемой, и до тех пор, пока этот противоион не привносит нежелательные качества соли в целом. Предпочтительными соединениями данного изобретения являются соединения формулыR5 обозначает водород, метил или этил; или их фармацевтически приемлемая соль. Из этих предпочтительных соединений более предпочтительны соединения формулы I,где а равно 0 или 1; каждый R независимо обозначает водород,фтор, метил, этил, метокси, этокси, диметиламино; R0 обозначает водород;R3 обозначает диметиламино C1-C4-алкил,C3-C7-циклоалкил или пирролидино,или их фармацевтически приемлемая соль. Из этих соединений наиболее предпочтительными соединениями являются или их фармацевтически приемлемая соль. Соединения формулы I могут быть получены в соответствии с процедурами, подробно описанными в данной области. Например, соединения формулы I могут быть получены реакцией подходящим образом замещенного ацетамида с основанием для получения соответствующего аниона, который затем взаимодействует с соответствующим образом замещенным 7 кетоном формулы IA с образованием карбинольного промежуточного соединения. Эти реакции обычно проводят в органическом растворителе в течение одного-двенадцати часов при температуре от приблизительно -90 С до комнатной температуры с использованием избытка основания и ацетамидного реагента относительно кетонового реагента. Перед применением в этой реакции ацетамид предпочтительно защищают подходящей защитной группой. Типичные основания включают гидрид натрия, диизопропиламид лития (LDA) и н-бутиллитий. Предпочтительным основанием является нбутиллитий. Выбор растворителя не является решающим, если используемый растворитель является инертным и реагенты достаточно солюбилизированы для осуществления желательной реакции. Растворителем, который пригоден для использования в этой реакции, является тетрагидрофуран, хотя в качестве растворителя может быть также использован ацетамидный реагент. Карбинольное промежуточное соединение обычно получают в течение от 1 до 18 ч,когда реакция инициируется при -78 С и ей дают медленно нагреваться до комнатной температуры. Реакция может контролироваться при помощи ВЭЖХ и гаситься добавлением кислоты, когда она по существу завершена. Типичные кислоты включают соляную кислоту, бромистоводородную кислоту, муравьиную кислоту и т.п. Предпочтительной кислотой является концентрированная соляная кислота. Полученное карбинольное промежуточное соединение предпочтительно дегидратируют без предварительного выделения или очистки. В частности, карбинольное промежуточное соединение взаимодействует с кислотой в течение 30 мин - 12 ч при температуре откомнатной до температуры дефлегмации (при нагревании с обратным холодильником) смеси с образованием целевого соединения формулы I. Типичные кислоты включают соляную кислоту,бромистоводородную кислоту, муравьиную кислоту, уксусную кислоту и сочетания кислот. Предпочтительным сочетанием кислот является муравьиная кислота, содержащая концентрированную соляную кислоту (1-6%). Целевое соединение обычно получают за период времени от 30 мин до 7 ч, когда реакцию проводят при температуре немного ниже температуры дефлегмации смеси. Реакцию предпочтительно,контролируют при помощи ВЭЖХ, например,для гарантии того, что реакция проходит до конца. Соединения формулы I предпочтительно выделяют и полученные цис/транс-изомеры разделяют при помощи процедур, известных в данной области. Например, цис- и транс-формы выделенных соединений могут быть разделены при помощи колоночной хроматографии, например, ВЭЖХ с обращенной фазой. Соединения могут быть элюированы из колонки с ис 001442 8 пользованием подходящего соотношения ацетонитрила и воды или метанола и воды. Цисформа соединения может быть превращена в цис/транс-смесь экспонированием при hvизлучении и повторно циклизована через вышеупомянутый процесс очистки. Кетоновые промежуточные соединения формулы IА, используемые в описанной выше реакции, могут быть получены, как детально описанные в данной области. Например, соединения формулы I могут быть получены в соответствии со следующей схемой реакций I. Схема реакций I Х обозначает циано или -COOR', где R' обозначает C1-C4 алкил;X' обозначает галоген; и а, R, R0, R1, R2 и R3 имеют приведенные выше значения. Схему реакций I, приведенную выше, выполняют проведением реакций 1-4. По завершении реакции промежуточное соединение может быть выделено, если желательно, при помощи процедур, известных в данной области. Например, соединение может быть кристаллизовано и затем собрано фильтрованием, или растворитель реакции может быть удален экстрагированием или декантированием. Промежуточное соединение может быть дополнительно очищено, если желательно, обычными способами, такими как кристаллизация или хроматография на твердых носителях, таких как силикагель или диоксид кремния, перед проведением следующей стадии схемы реакций. Реакцию I.1 выполняют сначала экспонированием подходящим образом замещенного галогеннитроанилина и подходящим образом замещенного фенилацетонитрила или бензоата с основанием в органическом растворителе в течение 1-24 ч при температуре от приблизительно -10 С до приблизительно 40 С для получения кетонового предшественника. Эту реакцию 9 обычно проводят с использованием эквимолярных соотношений реагирующих веществ в присутствии двух эквивалентов основания. Типичные основания включают гидрид натрия, третбутоксид калия, диизопропиламид лития (LDA). Предпочтительным основанием является третбутоксид калия. Примеры растворителей, пригодных для использования в этой реакции,включают диметилформамид, диметилацетамид и т.п. Выбор растворителя не является решающим до тех пор, пока используемый растворитель является инертным для идущей реакции и реагенты достаточно солюбилизированы для осуществления желательной реакции. Кетоновый предшественник обычно получают в течение от 1 до 15 ч, когда реакцию инициируют при 0 С и дают ей протекать при комнатной температуре. Кетоновый предшественник предпочтительно окисляют в той же самой реакционной смеси без предварительного выделения или очистки. В частности, кетоновый предшественник подвергают реакции с окислителем в течение 30 мин - 15 ч при температуре от приблизительно 0 С до приблизительно 30 С для получения соответствующего кетонового соединения. Типичные окислители включают пероксид водорода, кислород и воздух. Кислород обычно барботируют через реакционную смесь. Предпочтительным окислителем является пероксид водорода, предпочтительно в виде 30% раствора. Кетон обычно получают в течение от приблизительно 30 мин до 5 ч, когда реакцию проводят при температуре между 0 С и комнатной температурой. Реакцию обычно предпочтительно контролируют при помощи, например, ТСХ, для гарантии того, что реакция была завершена. В реакции I.2 нитрозаместитель на кетоне восстанавливают в соответствии с процедурами,известными в данной области, с получением соответствующего производного диаминобензофенона. Например, нитрозаместитель может быть восстановлен каталитическим гидрированием, например, путем взаимодействия кетона,выделенного из реакции I.1, с газообразным водородом в этаноле или тетрагидрофуране и катализатором. Предпочтительным катализатором является палладий на угле или никель Ренея. Выбор растворителя не является критическим, если используемый растворитель является инертным и нитрореагент достаточно солюбилизирован для осуществления желательной реакции. Газообразный водород обычно используют при давлении до 60psi (413685,45 Па),предпочтительно при или около 30 psi(206842,71 Па). Реакция обычно по существу завершается после приблизительно 1-24 ч, когда ее проводят при температуре в пределах от 0 С до 40 С. Реакцию предпочтительно проводят при температуре в пределах от 20 С до 30 С в течение 2-5 ч. 10 В реакции I.3 диаминобензофеноновое соединение, выделенное из реакции I.2, может быть сульфонилировано подходящим образом замедленным сульфонилгалогенидом формулыR4-SО 2-галоген , по существу в соответствии с процедурой, описанной выше, с получением соответствующих сульфонамидобензофеноновых соединений. В реакции I.4 соединение, выделенное из реакции I.3, циклизуют через нитрильное промежуточное соединение сначала экспонированием сульфонамидобензофенонового соединения с основанием в спиртовом растворителе,таком как изопропанол, с последующей реакцией с цианогенбромидом. В типичном случае,сульфонамидобензофенон и основание взаимодействуют при температуре от 0 С до 30 С. Предпочтительным основанием является гидроксид натрия, предпочтительно добавленный в виде водного раствора (1-4 М). После полного растворения сульфонамидобензофенона полученный раствор объединяют с цианогенбромидом. Цианогенбромид обычно добавляют в форме раствора (3-7 М, например, в ацетонитриле). Реакция обычно завершается после 1-18 ч, когда реакционную смесь перемешивают при комнатной температуре. Однако в некоторых случаях нитрильное промежуточное соединение будет осаждаться из реакционной смеси. Для получения целевого кетона этот осадок выделяют и затем нагревают с обратным холодильником в спиртовом растворителе, таком как изопропанол, в течение 1-4 ч для получения целевого кетонового соединения формулы I. В альтернативном случае соединение, выделенное из реакции I.3, циклизуют через нитрильное промежуточное соединение экспонированием сульфонамидобензофенонового соединения с основанием в хлорированном растворителе, таком как метиленхлорид, с последующей реакцией с цианогенбромидом. В типичном случае сульфонамидобензофенон и основание взаимодействуют при температуре от 0 С до приблизительно температуры дефлегмации смеси. Предпочтительным основанием является метоксид лития. Сульфонамидобензофенон и основание обычно образуют суспензию, которую затем объединяют с бромцианом. Бромциан обычно добавляют в виде раствора (3-7 М, например, в метиленхлориде). Реакция обычно завершается после 1-18 ч, когда реакционную смесь перемешивают при температуре в пределах от 0 С до температуры дефлегмации. Соединения формулы I, в которых R2 обозначает -NHC(O) (C1-C6-алкил), могут быть получены ацилированием соединения или соответствующего соединения формулы I, где R2 обозначает амино, в соответствии с процедурами, известными в данной области. Например,аминное соединение может быть ацилировано подходящим ацилгалогенидом, изоцианатом или хлорформиатом, предпочтительно в при 11 сутствии акцептора кислоты, такого как третичный амин, предпочтительно триэтиламин. Предпочтительным ацилирующим агентом является уксусный ангидрид. Эту реакцию обычно проводят при температуре от приблизительно 20 С до приблизительно 25 С. Типичные растворители для этой реакции включают простые эфиры и хлорированные углеводороды, предпочтительно диэтиловый эфир, хлороформ или метиленхлорид. Аминный реагент обычно применяют в эквимолярных соотношениях относительно ацилирующего реагента и предпочтительно в присутствии эквимолярных количеств акцептора кислоты, такого как третичный амин. Предпочтительным акцептором кислоты для этой реакции является N-метилморфолин(NMM). Соединения, используемые в качестве первоначальных исходных материалов в синтезе соединений данного изобретения хорошо известны в данной области и, в случае, если они коммерчески недоступны, могут быть легко синтезированы стандартными процедурами,обычно используемыми в данной области. Должно быть понятно для специалистов в данной области, что при проведении описанных выше процессов может быть желательно введение химических защитных групп в реагирующие вещества для предотвращения протекания побочных реакций. Любые амино, спиртовые,алкиламино или карбоксигруппы реагирующих веществ, могут быть защищены с применением стандартной амино-, гидрокси- или карбоксизащитной группы, которая не оказывает неблагоприятного влияния на способность остальной части молекулы реагировать желательным образом. Разнообразные защитные группы могут быть затем удалены одновременно или последовательно с использованием способов, известных в данной области. Фармацевтически приемлемые соли данного изобретения обычно получают взаимодействием соединения формулы I с эквимолярным или избыточным количеством кислоты или основания. Реагирующие вещества обычно соединяют в общем растворителе, таком как диэтиловый эфир, тетрагидрофуран, метанол, этанол,изопропанол, бензол и т.п., для кислотноаддитивных солей, или воде, спирте или хлорированном растворителе, таком как метиленхлорид, для основно-аддитивных солей. Соли обычно осаждаются из раствора в течение приблизительно одного часа - приблизительно 10 дней и могут быть выделены фильтрованием или другими общепринятыми способами. Следующие получения и примеры иллюстрируют далее специфические аспекты данного изобретения. Однако должно быть понятно, что эти примеры включены только для иллюстративных целей и не ограничивают объем данного изобретения. 12 В нижеследующих получениях и примерах термины точка плавления, спектры ядерного магнитного резонанса, масс-спектры с электронными ударами, масс-спектры с полевой десорбцией, масс-спектры с бомбардировкой ускоренными атомами, инфракрасные спектры,ультрафиолетовые спектры, элементный анализ,жидкостная хроматография высокого разрешения и тонкослойная хроматография имеют аббревиатуры "т.пл.", "NMR" (ЯМР), "EIMS"(ЭУМС), "MS(FD)" (ПДМС), "MS(FAB)" (БУАМС), "IR" (ИК), "UV" (УФ), "Analysis" (анализ),"НРLС" (ВЭЖХ) и "TLC" (ТСХ), соответственно. Данные MS(FD) представлены как массовое число, если нет других указаний. Кроме того,максимумы поглощения, перечисленные для ИК-спектров, являются только представляющими интерес максимума, но это не все наблюдаемые максимумы. В связи с ЯМР-спектрами, использовали следующие аббревиатуры: "s" обозначает синглет, "d" обозначает дублет, "dd" обозначает дублет дублетов, "t" обозначает триплет, "q" обозначает квартет, "m" обозначает мультиплет,"dm" обозначает дублет мультиплетов и "br.s","br.d", "br.t" и "br.m" обозначают широкий синглет, дублет, триплет и мультиплет, соответственно. "J" указывает константу взаимодействия в Герцах (Hz). Если нет других указаний, данные ЯМР относятся к свободному основанию испытуемого соединения. ЯМР-спектры получали на установке Bruker Corp. 270 МГц или на установке GeneralElectric QE-300 300 МГц. Химические сдвиги выражали в дельта, -величинах (миллионных долях слабопольного сдвига от тетраметилсилана). MS (ED)-спектры снимали на спектрометреVarion-Mat 731 с применением углеродных дендритных эмиттеров. EIMS-спектры получали на установке СЕС 21-110 из Consolidated Electrodynamics Corporation. ИК-спектры получали на приборе Perkin-Elmer 281. УФ-спектры получали на приборе Саrу 118. ТСХ проводили на пластинках с силикагелем Е. Merck. Точки плавления являются некорректированными. Пример 1. А. 3-Амино-4-нитро-4'-фторбензофенон. К холодному (0 С) раствору 17,25 г (100 мл) 5-хлор-2-нитроанилина и 12 мл (100 ммоль) 4-фторфенилацетонитрила в 200 мл диметилформамида добавляли 22,44 (200 ммоль) третбутоксида калия в атмосфере азота. Реакционную смесь нагревали до комнатной температуры и давали ей реагировать в течение ночи. Когда реакция была по существу завершена, согласно ТСХ (элюент 40% этилацетат в гексане),реакционную смесь охлаждали до 0 С с последующим добавлением 30 мл пероксида водорода. Когда реакция была по существу завершена,согласно ТСХ (элюент 40% этилацетат в гексане), реакционную смесь выливали в 1 л 1 н. соляной кислоты (водной), что приводило к обра 13 зованию желто-оранжевого осадка. Этот осадок выделяли фильтрованием. Выход: 23,3 г (89%). В. 3,4-Диамино-4'-фторбензофенон. К раствору 21 г примера 1 А в 120 мл тетрагирофурана и 250 мл этанола добавляли 3,0 г катализатора никеля Ренея. Реакционную смесь перемешивали в течение ночи при 30 psi(206642,71 Па) водорода (газа) и затем фильтровали. Полученный фильтрат концентрировали в вакууме с получением желтого твердого вещества, которое использовали без дополнительной очистки. С. 4 Амино-3-изопропилсульфонамидо-4'фторбензофенон. К раствору 18,14 г (79 ммоль) примера 1 В в 160 мл безводного метиленхлорида и 32 мл безводного пиридина добавляли 13,25 мл (118 ммоль) изопропилсульфонилхлорида. Реакционной смеси давали реагировать при комнатной температуре в течение 5 ч в атмосфере азота. Когда реакция по существу была завершена,согласно ТСХ (элюент этилацетат), реакционную смесь выливали в 400 мл 1 н. соляной кислоты (водной). Полученную смесь разбавляли 300 мл этилацетата и полученные слой разделяли, органический слой сушили над сульфатом магния, фильтровали и концентрировали в вакууме с получением темно-красной смолы. Эту смолу очищали препаративной ВЭЖХ (градиентный элюент 30-60% этилацетат в гексане). Фракции, содержащие соединение, объединяли и сушили в вакууме с получением 17,11 г желтой смолы, которую использовали без дополнительной очистки. Выход: 65%. К раствору 17,11 г (51 ммоль) примера 1 С и 25 мл 2 н. гидроксида натрия (водного) в 100 мл изопропанола добавляли 10 мл 5 М бромциана. Реакционной смеси давали реагировать при комнатной температуре в течение 30 мин с образованием осадка. Этот осадок выделяли фильтрованием с получением 11,68 г твердого вещества. Это твердое вещество ресуспендировали в 250 мл изопропанола и смесь нагревали с обратным холодильником до полного растворения всего вещества и затем охлаждали с получением 10,0 г целевого соединения. Выход; 55%. Анализ для C17H16FN3 О 3S: Рассчитано: С 56,50; Н 4,46; N 11,63; Найдено: С 56,71; Н 4,48; N 11,82. К холодному (-78 С) раствору бис(триметилсилил)ацетамида (8 эквивалентов) в тетрагидрофуране медленно добавляли раствор 2,5 М н-бутиллития (8 эквивалентов) в гексане. К полученной смеси добавляли пример 1 Е (1 эквивалент). Реакционную смесь перемешивали в течение 8 ч при -78 С и затем давали ей нагреться до комнатной температуры. При по существу полном завершении реакции, согласно ВЭЖХ, реакцию гасили добавлением концентрированной соляной кислоты (1 эквивалента) и затем концентрировали в вакууме с получением масла, которое затем повторно растворяли в муравьиной кислоте, содержащей 1% концентрированной соляной кислоты. Полученной смеси давали реагировать в течение 4 ч при 95 С. При по существу полном завершении реакции, согласно ВЭЖХ, смесь концентрировали в вакууме с получением масла. Это масло разделяли при помощи ОФ-ВЭЖХ (элюент ацетонитрил в воде) с получением цис- и трансизомеров. цис не охарактеризован транс Анализ для C19H19N4 О 3SF: Рассчитано: С 56,71; Н 4,76; N 13,92; S 7,97; F 4,72; Найдено: С 56,96; Н 4,76; N 13,90; S 7,96;(E=15680.556); 245.00 nm (E=26956.305). Следующие соединения получали по существу в соответствии с процедурой, описанной подробно в примере 1 А-Е. Пример 2. цис Анализ для C19H19N4O3SF: Рассчитано: С, 56,71; Н, 4,76; N, 13,92; Найдено: С, 56,50; Н, 4,78; N, 13,84.(E=25450); 214 nm (E=39883). транс Анализ для C19H19N4O3SF: Рассчитано: С 56,71; Н 4,76; N 13,92; S 7,97; F 4,72; Найдено: С 56,96; Н 5,00; N 13,68; S 7,81; F 5,02. цис Анализ для C19H18N5O3SF: Рассчитано: С 53,59; Н 4,50; N 17,36; Найдено; С 53,22; Н 4,39; N 16,86.(E=26203); 216 nm (Е=41563). транс Анализ для С 18 Н 18N5 О 3SF: Рассчитано: С 53,59; Н 4,50; N 17,36; Найдено: С 53,82; Н 4,39; N 17,13. цис Анализ для С 20 Н 21N4O3SF: Рассчитано: С 57,68; Н 5,08; N 13,45; S 7,70; F 4,56; Найдено: С 57,52; Н 4,95; N 13,17; S 7,45; F 4,57.(E=25875); 214.0 nm (Е=38753). транс Анализ для C20H21N4O3SF: Рассчитано: С 57,68; Н 5,08; N 13,45; S 7,70; F 4,56; Найдено: С 57,97; Н 4,97; N 13,18; S 7,45; цис Анализ для C19H20N5O3SF: Рассчитано: С 54,67; Н 4,83; N 16,78; Найдено: С 54,80; Н 4,74; N 16,55.(Е=25801); 216 nm (Е=38667). транс Анализ для C19H20N5O3SF; Рассчитано: С 54,67; H 4,83; N 16,78; Найдено: С 54,89; Н 4,71; N 17,01. цис Анализ для С 19 Н 19N4O3SСl: Рассчитано: С 54,48; Н 4,67; N 13,38;(E=26091); 215.5 (Е=46127). транс Анализ для C19H19N4O3SCl: Рассчитано: С 54,48; Н 4,57; N 13,38; Найдено: С 54, 23; Н 4,39; N 13,19.(E=20748); 261 nm (E=23024). транс Анализ для C21H23N4O4SF: Рассчитано: С 56,49; Н 5,19; N 12,55; Найдено: С 56,74; Н 5,08; N 12,48. 1 цис Анализ для С 21 Н 23N4 О 3SF: Рассчитано: С 58,59; Н 5,38; N 13,01; S 7,45; F 4,42; Найдено: С 58,67; Н 5,45; N 12,88; S 7,42;(E=24526). транс Анализ для C21H23N4O3SF: Рассчитано: С 58,59; Н 5,38; N 13,01; Найдено: С 58,44; Н 5,50; N 12,80. цис Анализ для С 20 Н 20N4O3SF2: Рассчитано: С 55,29; Н 4,64; N 12,90; Найдено: С 55,27; Н 4,51; N 12,77. 1 Н NMR (300 MHz, DMSO-d6):7.94 (d,J=5Hz, 1H); 7.38 (s, 1H); 7.23 (td, J=8,2Hz, 1H); 7.20 (d, J=8Hz, 1H); 7.03 (s, 2H); 6.94 (dd,J=8,1Hz, 1H); 6.85 (dd, J=8,1Hz, 1H); 6.42 (s, 1H); 3.83 (septet, J=7Hz, 1H); 2.57 (d, J=5Hz, 3H); 1.21(E=25762). транс Анализ для C20H20N4O3SF2: Рассчитано: С 55,29; Н 4,64; N 12,90; Найдено: С 55,52; Н 4,61; N 12,91. 1 Н NMR (300 MHz, DMSO-d6):8.09 (d,J=5Hz, 1H); 7.40 (d, J=1Hz, 1H); 7.21 (d, J=1Hz,1H); 7.19 (d, J=1Hz, 1H); 7.16 (s, 2H); 7.01 (dd,J=8,1Hz, 1H); 6.82 (dd, J=8,1Hz, 1H); 6.43 (s, 1H); 3.86 (septet, J=7Hz, 1H); 2.59 (d, J=5Hz, 3H); 1.22 цис Анализ для С 21 Н 23N4O4SF: Рассчитано: С 56,49; Н 5,19; N 12,55; Найдено: С 56,32; Н 5,06; N 12,43. цис Анализ для С 21 Н 23N4O3SF: Рассчитано: С 58,59; Н 5,38; N 13,01; S 7,45; F 4,42. Найдено: С 58,55; Н 5,37; N 12,92; S 7,33; F 4,70. 1(E=22850). транс Анализ для С 21 Н 23N4O3SF: Рассчитано: С 53,59; Н 5,38; N 13,01; S 7,45; F 4,42; Найдено: С 58,33; Н 5,58; N 13,07; S 7,44; F 4,70. 1 цис Анализ для C21H22N5O3SF: Рассчитано: С 56,87; Н 5,00; N 15,79; S 7,24; F 4,28; Найдено: С 57,12; Н 5,08; N 15,54; S 7,20; F 4,58. 1(E=24158); 216.25 nm (Е=36468). транс Анализ для C21H22N5O3SF: Рассчитано: С 56,87; Н 5,00; N 15,79; S 23; цис Анализ для C22H15Cl2FN4O3SF: Рассчитано: С 52,29; Н 2,99; N 11,09; Найдено: С 53,25; Н 3,25; N 12,29. 1(E=20637). транс Анализ для C22H15Cl2FN4O3SF: Рассчитано: С 52,29; Н 2,99; N 11,09; Найдено: С 52,22; Н 3,06; N 10,89. 1 цис Анализ для C20H15N4O3S2F: Рассчитано: С 54,29; Н 3,42; N 12,66; Найдено: С 52,34; Н 3,17; N 11,77. 1(Е=31371). транс Анализ для C20H15N4 О 3S2F: Рассчитано: С 54,29; Н 3,42; N 12,66; Найдено: С 54,30; Н 3,29; N 12,29. 1 цис Анализ для С 26 Н 19N4O3SF: Рассчитано: С 64,19; Н 3,94; N 11,52; Найдено: С 63,53; Н 3,84; N 11,00. 1UV/Vis (95% EtOH): = 291.3 nm (Е=17022); 258.3 nm (Е=23737). транс Анализ для С 26 Н 19N4O3SF: Рассчитано: С 64,19; Н 3,94; N 11,52; Найдено: С 64,32; Н 3,87; N 11,27. 1 цис Анализ для C23H16N5O3SF: Рассчитано: С 59,86; Н 3,50; N 15,18; Найдено: С 59,30; Н 3,62; N 14,56. 1(E=27006). транс Анализ для C23H16N5O3SF: Рассчитано: С 59,86; Н 3,50; N 15,18; Найдено: С 58,76; Н 3,64; N 15,48. 1 Н NMR (300 MHz, DMSO-d6):8.55 (s,1H); 8.28 (d, J=8.0Hz, 1H); 8.11 (d, J=8.0Hz, 1H); 7.86 (t, J=8.0Hz, 1H); 7.83 (m, 1H); 7.48-6.94 (m,10 Н); 6.49 (s, 1H). цис Анализ для C19H19N4O2SF: Рассчитано: С 56,71; Н 4,76; N 13,92; Найдено: С 56,96; Н 4,78; N 14,21. 1(E=23378); 213.0 nm (Е=38249). транс Анализ для C19H19N4O3SF: Рассчитано: С 56,71; Н 4,76; N 13,92; Найдено: С 56,74; Н 4,78; N 14,06. 1 Н NMR (300 MHz, DMSO-dg):7.48-6.92 цис Анализ для С 20 Н 20N4O3SF2: Рассчитано: С 55,29; Н 4,64; N 12,90; Найдено: С 55,37; Н 4,72; N 12,81. 1(E=23774); 213.0 nm (Е=37807). транс Анализ для С 20 Н 20N4 О 3SF2: Рассчитано: С 55,29; Н 4,64; N 12,89; Найдено: С 55,35; Н 4,66; N 12,94. 1 цис Анализ для С 24 Н 29N4 О 3SF: Рассчитано: С 61,00; Н 6,18; N 11,85; Найдено: С 60,99; Н 6,46; N 11,98. 1(E=22994); 231.0 nm (E=38882). транс Анализ для С 24 Н 29N4O3S: Рассчитано: С 61,00; Н 6,18; N 11,85; Найдено: С 60,77; Н 6,04; N 11,66. 1 цис Анализ для С 17 Н 13N4O3SСl2F: Рассчитано: С 46,06; Н 2,96; N 12,64; Найдено: С 47,02; Н 3,03; N 13,00. 1 цис не охарактеризован транс Анализ для C21H22N5O4SF: Рассчитано: С 54,89; Н 4,83; N 15,24; S 6,98; F 4,13; Найдено: С 55,04; Н 4,83; N 15,45; S 7,03; F 3,98. 1 цис Анализ для C20H21N4O4SF: Рассчитано: С 55,55; Н 4,89; N 12,95; Найдено: С 55,67; Н 4,97; N 13,09. 1(E=37042). транс Анализ для C20H21N4O4SF: Рассчитано: С 55,55; Н 4,89; N 12,95; Найдено: С 55,75; Н 4,96; N 12,97. 1 Н NMR (300 MHz, DMSO-d6):7.39 (s,2H); 7.19 (d, 1H); 7.10 (m, 3H); 6.99 (m, 1H); 6.92 цис Анализ для C19H18N4O3SF2: Рассчитано: С 54,28; Н 4,32; N 13,33; Найдено: С 54,54, Н 4,54; N 13,12. 1(E=26044); 214 nm (Е=40148). транс Анализ для C19H18N4O3SF2: Рассчитано: С 54,28; Н 4,32; N 13,33; Найдено: С 54,45; Н 4,42; N 13,54. 1 цис Анализ для C19H17N4O3SF3: Рассчитано: С 52,05; Н 3,91; N 12,78; Найдено: С 50,76; Н 4,11; N 12,16. 1(E=22034); 214.0 nm (Е=36315). транс Анализ для С 19 Н 17N4 О 3SF3: Рассчитано: С 52,05; Н 3,91; N 12,78; Найдено: С 52,17; Н 3,78; N 12,55. 1 цис Анализ для С 20 Н 19N4O3SF3: Рассчитано: С 53,09; Н 4,23; N 12,38; Найдено: С 52,37; Н 4,33; N 12,06. 1(E=25278); 214.0 nm (Е=39044). транс Анализ для C20H19N4O3SF3: Рассчитано: С 53,09; Н 4,23; N 12,38; Найдено: С 52,97; Н 4,28; N 12,26. 1 цис Анализ для C19H18N4O3SF2: Рассчитано: С 54,28; Н 4,32; N 13,33; Найдено: С 54,51; Н 4,40; N 13,28. 1(E=20610); 213.0 nm (Е=33139). транс Анализ для C19H18N4O3SF2: Рассчитано: С 54,28; Н 4,31; N 13,33; Найдено: С 54,38; Н 4,27; N 13,33. 1 цис Анализ для C21H23N4O3SF: Рассчитано: С 58,59, Н 5,38; Н 13,01; S 7,45; F 4,41; Найдено: С 58,85; Н 5,40; N 13,04; S 7,68; F 4,70. 1(E=16605). транс Анализ для C21H23N4O3SF: Рассчитано: С 58,59; Н 5,38; N 13,01; S 7,45; F 4,41; Найдено: С 58,86; Н 5,28; N 12,78; S 7,31; 29 цис Анализ для C20H20N5O4SF: Рассчитано: С 53,92; Н 4,52; N 15,72; S 7,19; F 4,26; Найдено: С 53,87; Н 4,51; N 15,51; S 7,28;(E=16841); 219.0 nm (E=28615). Данные соединения, по-видимому, ингибируют репликацию плюс - цепи вирусной РНК вмешательством в структуру и/или функцию комплекса репликации вируса (мембраносвязанного комплекса вирусных и клеточных белков). Были выделены мутантные риновирус и энтеровирус, которые обнаруживают очень низкие уровни устойчивости к лекарственным средствам. Эти мутанты содержат единственное аминокислотное замещение в белке, который экспрессируется вирусным геном, известным как "3 А". Таким образом, соединения данного изобретения ингибируют риновирус и энтеровирус путем ингибирования функции 3 А. Ген 3 А кодирует гидрофобный белок, который служит в качестве каркасного белка, который присоединяет белки комплекса репликации к внутриклеточным мембранам. Стратегия репликации флавивирусов, таких как вирус гепатита С (HCV) и вируса бычьей диареи (BVDV) сходна со стратегией риновируса и энтеровируса, обсуждаемой выше. В частности, оба семейства вирусов содержат одноцепочечную информационную смысловую РНК, которая реплицируется в цитоплазматический комплекс через промежуточную минусцепь РНК. Кроме того, оба семейства вирусов транслирует их геном в полипротеин, который затем расщепляется. Кроме того, комплексы репликации обоих вирусов прочно связаны с внутриклеточными мембранами. Наконец, оба семейства вирусов имеют аналогичные геномные структуры, в том числе, присутствие 5'- и 3'-нетранслируемого региона, которые требуются вирусам для репликации. Существуют два белка HCV, которые участвуют в этой внутриклеточной ассоциации: NS2 и NS4. Постулируется, что либо NS2, либо NS4 аналогичен белку 3 А пикорнавируса. В соответствии с этим другой задачей данного изобретения является способ лечения или предупреждения флавивирусной инфекции,предусматривающий введение хозяину, нуждающемуся в лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Это соединение предпочтительно ингибирует гепатит С. Как отмечалось выше, соединения данного изобретения применимы в качестве антивирусных агентов. Они обнаружили ингибиторную 30 активность против различных энтеровирусов и риновирусов. Одним из вариантов данного изобретения является способ лечения или предупреждения инфекции пикорнавируса, предусматривающий введение хозяину, нуждающемуся в лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Термин "эффективное количество", использующийся здесь обозначает количество соединения формулы I, которое способно ингибировать репликацию вируса. Ингибирование пикорнавируса, предполагаемое при данном способе, включает либо терапевтическое, либо профилактическое лечение, смотря по обстоятельствам. Конкретная доза вводимого соединения согласно данному изобретению для получения терапевтического или профилактического эффектов будет, конечно, определяться конкретными обстоятельствами конкретного случая, в том числе, например, вводимым соединением, способом введения, состоянием, подлежащим лечению, и индивидуумом, подлежащим лечению. Типичная суточная доза будет составлять от приблизительно 0,01 мг/кг до приблизительно 50 мг/кг веса тела активного соединения данного изобретения. Предпочтительные суточные дозы обычно будут находиться в пределах от приблизительно 0,05 мг/кг до приблизительно 20 мг/кг и идеально от 1 мг/кг до 10 мг/кг. Эти соединения могут вводиться различными путями, в том числе, перорально, ректально, трансдермально, подкожно, внутривенно, внутримышечно и интраназально (через нос). Соединения данного изобретения предпочтительно готовят перед введением. Таким образом, другой задачей данного изобретения является фармацевтическая композиция, содержащая эффективное количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, разбавитель или наполнитель. Активный ингредиент в таких препаратах составляет от 0,1 до 99,9% от веса препарата. Под "фармацевтически приемлемым" подразумевают, что носитель, разбавитель или наполнитель совместим с другими ингредиентами препарата и не является вредным для лица, принимающего препарат (реципиента). Данные фармацевтические препараты готовят известными процедурами с использованием хорошо известных и легкодоступных ингредиентов. При приготовлении композиций данного изобретения активный ингредиент обычно смешивают с носителем или разбавляют носителем, или помещают внутрь носителя, который может быть в форме капсулы, подушечки, бумаги или иного контейнера. Когда этот носитель служит в качестве разбавителя, он может быть твердым, полутвердым или жидким материалом, который действует как носитель, наполнитель или среда для активного ингредиента. Так 31 эти композиции могут быть в форме таблеток,пилюль, порошков, лепешек, подушечек, крахмальных облаток, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей, (в твердом виде или в жидкой среде), мазей, содержащих,например, до 10% по весу активного соединения, мягких и жестких желатиновых капсул,суппозиториев, стерильных инъекционных растворов, стерильных упакованных порошков и т.п. Следующие примеры препаратов являются только иллюстративными и не предназначены для ограничения объема данного изобретения каким бы то ни было путем. Термин "активный ингредиент" обозначает соединение формулы I или его фармацевтически приемлемую соль. Композиция 1. Твердые желатиновые капсулы готовят с использованием следующих ингредиентов: Количество(мг/капсулу) Активный ингредиент 250 Целлюлоза, микрокристаллическая 400 Диоксид кремния, коллоидальный 10 Стеариновая кислота 5 Всего 665 мг Эти компоненты смешивают и прессуют с образованием таблеток с весом каждой таблетки 665 мг. Композиция 3. Готовят аэрозольный раствор, содержащий следующие компоненты: Вес Активный ингредиент 0,25 Метанол 25,75 Пропеллент 22(Хлордифторметан) 70,00 Всего 100,00 Активное соединение смешивают с этанолом и смесь добавляют к части пропеллента 22,охлажденного до -30 С, и переносят в заливочное устройство. Затем необходимое количество подают в контейнер из нержавеющей стали и разбавляют оставшейся частью пропеллента. Затем на этот контейнер монтируют клапанный элемент. Композиция 4. Таблетки, каждая из которых содержит 60 мг активного ингредиента, готовят следующим образом: Количество Активный ингредиент Крахмал Микрокристаллическая целлюлоза Поливинилпирролидон(в виде 10% раствора в воде) Натрий-карбоксиметилкрахмал Стеарат магния Тальк Всего Активный ингредиент, крахмал и целлюлозу пропускают через сито No. 45 mesh U.S. и тщательно смешивают. Водный раствор, содержащий поливинилпирролидон, смешивают с полученным порошком, и затем смесь пропускают через сито No. 14 mesh U.S. Полученные таким образом гранулы сушат при 50 С и пропускают через сито No. 18 mesh U.S. Затем натрий-карбоксиметилкрахмал, стеарат магния и тальк, предварительно пропущенные через ситоNo. 60 mesh U.S., добавляют к этим гранулам,которые, после смешивания, прессуют на таблетировочной машине с получением таблеток,каждая из которых имеет вес 150 мг. Композиция 5. Капсулы, каждая из которых содержит 80 мг активного ингредиента, готовят следующим образом: Количество(мг/капсулу) Активный ингредиент 80 мг Крахмал 59 мг Микрокристаллическая целлюлоза 59 мг Стеарат магния 2 мг Всего 200 мг Активный ингредиент, целлюлозу, крахмал и стеарат магния смешивают, пропускают через сито No. 45 mesh U.S. и заполняют этой смесью твердые желатиновые капсулы по 200 мг в каждую капсулу. Композиция 6. Суппозитории, каждый из которых содержит 225 мг активного ингредиента, готовят следующим образом: Активный ингредиент Глицериды насыщенных жирных кислот Всего Активный ингредиент пропускают через сито No. 60 mesh U.S. и суспендируют в глицеридах насыщенных жирных кислот, предварительно расплавленных с использованием минимального нагревания, если необходимо. Затем эту смесь выливают в форму для суппозитория с номинальной емкостью 2 г и дают охладиться. Композиция 7. 33 Суспензии, каждая из которых содержит 50 мг активного ингредиента на дозу 5 мл, готовят следующим образом: Активный ингредиент 50 мг Натрий-карбоксиметилцеллюлоза 50 мг Сироп 1,25 мл Раствор бензойной кислоты 0, 10 мл Ароматизаторq.v. Очищенная вода до конечного объема 5 мл Активный ингредиент пропускают через сито No. 45 mesh U.S. и смешивают с натрийкарбоксиметилцеллюлозой и сиропом с образованием гладкой пасты. Раствор бензойной кислоты, ароматизатор (улучшающее вкус и запах вещество) и краситель разбавляют частью воды и добавляют при перемешивании. Затем добавляют достаточное количество воды до получения требуемого объема. Композиция 8. Внутривенная композиция может быть приготовлена следующим образом: Активный ингредиент 100 мг Изотонический солевой раствор 1000 мл Раствор указанных выше ингредиентов обычно вводят внутривенно субъекту при скорости 1 мл в минуту. Следующий далее эксперимент проводят для демонстрации способности соединений формулы I ингибировать определенный вирус. Тест-способ для анализа действия против пикорнавируса Клетки почек африканской зеленой мартышки (BSC-1) или клетки HeLa (5-3) выращивали в колбах Фалкона на 25 мл при 37 С в среде 199 с 5% инактивированной фетальной телячьей сыворотки (FBS), пенициллином (150 единиц на мл) и стрептомицином (150 микрограммов на миллилитр (мкг/мл). Когда образовались конфлюентные монослои, среду для выращивания удаляли в виде супернатанта и в каждую колбу добавляли 0,3 мл подходящего разведения вируса (ECHO-, Mengo-, Коксаки-, полио- или риновируса). После абсорбции в течение 1 ч при комнатной температуре инфицированный вирусом клеточный слой покрывали средой, содержащей одну часть 1% Ionagar No. 2 и одну часть Среды 199 двойной крепости сFBS, пенициллином и стрептомицином, содержащей лекарственное средство при концентрациях 100, 50, 25, 12, 5, 3 и 0 мкг/мл. Колба, не содержащая лекарственного средства, служила в качестве контроля для этого теста. Исходные растворы соединений винилацетиленбензимидазола разбавляли до концентрации 104 мкг/мл. Затем колбы инкубировали в течение 72 ч при 37 С для полио-, Коксаки-, ECHO- и Меngовируса и в течение 120 ч для риновируса. Вирусные бляшки (стерильные пятна) наблюдались в тех зонах клеток, которые были инфици 001442 34 рованы вирусом и где вирус репродуцировался в клетках. Раствор 10% формалина и 2% ацетата натрия добавляли в каждую колбу для инактивации вируса и фиксации клеточного слоя на поверхности колбы. Вирусные бляшки, независимо от размера, считали после окрашивания окружающих клеточных зон кристаллическим фиолетовым. Число бляшек сравнивали с числом в контроле при каждой концентрации лекарственного средства. Активность тестсоединения выражали в виде процента уменьшения числа бляшек или процента ингибирования. В альтернативном случае, концентрацию лекарственного средства, которая ингибирует бляшкообразование на 50%, можно использовать в качестве меры активности. 50%-ное ингибирование иллюстрируется символом IC50.BVDV Клетки MDBK распределяли в 96 луночном микротитрационном планшете при 10000 клеток на лунку с Минимальной эссенциальной средой, содержащей сбалансированный солевой раствор Игла (EBSS), 2% лошадиную сыворотку, пенициллин (100 единиц/мл) и стрептомицин (100 мкг/мл). Планшеты выращивали при 37 С в СО 2-термостате в течение ночи. Затем клетки MDBK инфицировали 0,02 moi(множественность заражения) вируса бычьей вирусной диареи (BVDV, АТСС VR-534). После адсорбции вируса клетками в течение 1-2 ч в лунки добавляли среду, содержащую серийные разведения лекарственного средства или только среду. После дополнительного инкубирования в течение 3-4 дней (когда сильное цитопатогенное действие (СРЕ) было обнаружено в лунках, содержащих только среду) антивирусное действие испытуемых лекарственных средств оценивали проведением ХТТ-анализа, описанного ниже. ХТТ [2,3-бис(метокси-4-нитро-5-сульфофенил)-2 Н-тетразолий-5-карбоксанилид, внутренняя соль, соль натрия] при 1 мг/мл для теплой среды без FBS готовили и сразу же использовали в свежеприготовленном виде. На каждые 5 мл раствора ХТТ добавляли 25 мкл 5 мМ ФМС (феназинметосульфата) в фосфатносолевом буфере. Затем 50 мкл свежеприготовленной смеси ХТТ/ФМС добавляли в каждую лунку микротитрационного планшета. Инкубировали при 37 С (СО 2) в течение 3-4 ч или пока не будет явным изменение окраски. Поглощение при 450 нм/ср.650 нм регистрировали в спектрофотометре. Затем концентрацию лекарственного средства, требующуюся для 50% цитотоксического эффекта в сравнении с контролем без лекарственного средства и без вируса(ТС 50) и ингибирующую развитие вирусного цитопатогенного эффекта (СРЕ), определяли из линейного участка каждой кривой доза-ответ.R3 обозначает диметиламино, С 1-С 10 алкил, С 3-С 7-циклоалкил, замещенный С 3-С 7 циклоалкил, галоген(С 1-С 6)алкил, фенил, замещенный фенил, нафтил, фурил, тиенил, тиазолидинил,пирролидино, пиперидино, морфолино или группу формулыR4 и R5 независимо обозначает водород или С 1-С 4-алкил; при условии, что когда R находится в положении 2 или 6, то R не может быть галогеном,циано, метилом, этилом, метокси, этокси, метилтио, метилсульфинилом или метилсульфонилом; или его фармацевтически приемлемая соль. 2. Соединение по п.1 36 или его фармацевтически приемлемая соль. 3. Соединение по п.2, где а равно 0 или 1; каждый R независимо обозначает водород,фтор, метил, этил, метокси, этокси, диметиламино;R3 обозначает диметиламино, С 1-С 4-алкил,С 3-С 7-циклоалкил или пирролидино; или его фармацевтически приемлемая соль. 4. Соединение по п.3, которое представляет собой 38 или его фармацевтически приемлемая соль. 5. Фармацевтическая композиция, содержащая эффективное количество соединения формулы I или его фармацевтически приемлемую соль по любому из пп.1-4, соединенные с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или наполнителями. 6. Применение соединения формулы I или его фармацевтически приемлемой соли, по любому из пп.1-4, в качестве фармацевтического средства. 7. Применение по п.6, отличающееся тем,что фармацевтическое средство является антивирусным средством.
МПК / Метки
МПК: A61K 31/4184, C07D 235/30, A61P 31/12
Метки: антивирусной, соединения, активностью, обладающие
Код ссылки
<a href="https://eas.patents.su/20-1442-soedineniya-obladayushhie-antivirusnojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, обладающие антивирусной активностью</a>
Предыдущий патент: Электрическая приводная система для транспортных средств
Следующий патент: Неводные медицинские средства для очистки толстой кишки
Случайный патент: Идентификационная карта и способ расчетов с помощью идентификационной карты












