Производные 2-(1н-индолилсульфанил)бензиламина в качестве ssri
Номер патента: 10666
Опубликовано: 30.10.2008
Авторы: Нергор Мортен Банг, Келер Ян, Юль Карстен, Сейберг Джимми
Формула / Реферат
1. Соединение общей формулы I
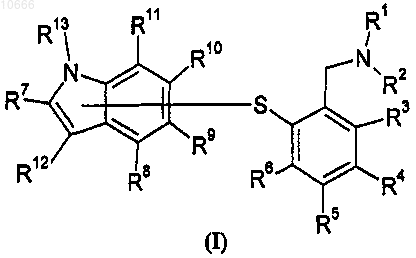
где атом серы присоединен к индолу через любой циклический углерод индола и где
R1-R2 независимо выбраны из водорода, C1-6алкила, C3-8циклоалкила и C3-8циклоалкил-C1-6алкила или R1 и R2 вместе с азотом образуют 4-7-членный цикл, не содержащий или содержащий одну двойную связь, причем необязательно указанный цикл в дополнение к указанному азоту содержит еще один гетероатом, выбранный из азота, кислорода и серы;
R3-R12 независимо выбраны из водорода, галогена, циано, нитро, C1-6алкила, C3-8циклоалкила, C3-8циклоалкил-C1-6алкила, амино, C1-6алкиламино, ди(C1-6алкил)амино, C1-6алкилкарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, гидрокси, C1-6алкилокси, C1-6-алкилтио, галогенС1-6алкила, галогенС1-6алкилсульфонила, галогенС1-6алкилсульфанила и C1-6алкилсульфонила; и
R13 выбран из водорода и C1-6алкила;
при условии, что R10 выбран из галогена, циано, C1-6алкила, гидрокси, C1-6алкокси и галоген-C1-6алкила; в виде его свободного основания или его соли; при следующих условиях:
если атом серы присоединен через атом номер 2 индола, R7 отсутствует;
если атом серы присоединен через атом номер 3 индола, R12 отсутствует;
если атом серы присоединен через атом номер 4 индола, R8 отсутствует;
если атом серы присоединен через атом номер 5 индсла, R9 отсутствует; и
если атом серы присоединен через атом номер 7 индола, R11 отсутствует.
2. Соединение по п.1, где R1 и R2 независимо выбраны из водорода и C1-6алкила; или R1 и R2 вместе с азотом образуют 4-7-членный цикл, не содержащий или содержащий одну двойную связь, причем необязательно данный цикл в дополнение к азоту содержит еще один гетероатом, выбранный из азота, кислорода и серы.
3. Соединение по любому из пп.1 и 2, где R3-R12 независимо выбраны из водорода, галогена, циано, C1-6алкила, гидрокси, C1-6алкилокси и галогенС1-6алкила.
4. Соединение по любому из пп.1-3, где R3-R6 независимо выбраны из водорода, галогена и C1-6алкила.
5. Соединение по любому из пп.1-4, где R7-R12 независимо выбраны из водорода, галогена, циано, C1-6алкила, гидрокси, C1-6алкилокси и галогенС1-6алкила.
6. Соединение по любому из пп.1-5, причем указанное соединение выбрано из следующих соединений:


в виде его свободного основания или его соли.
7. Фармацевтическая композиция, содержащая соединение по любому из пп.1-6 и по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
8. Применение соединения по любому из пп.1-6 для приготовления лекарственного средства для лечения заболевания или расстройства, где ингибитор совместного обратного захвата серотонина, норадреналина и допамина является полезным.
9. Применение по п.8, где указанное расстройство или заболевание представляет собой аффективное расстройство.
10. Применение по п.9, где аффективное расстройство представляет собой депрессивное расстройство.
11. Применение по п.10, где указанное депрессивное расстройство представляет собой депрессивный эпизод тяжелой степени, послеродовую депрессию, дистимию или депрессию, связанную с биполярным расстройством, болезнью Альцгеймера, психозом или болезнью Паркинсона.
12. Применение по п.9, где аффективное расстройство представляет собой тревожное расстройство.
13. Применение по п.12, где указанное тревожное расстройство представляет собой генерализованное тревожное расстройство, социальное тревожное расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, паническое расстройство, приступы паники, специфические фобии, социальную фобия или агорафобию.
14. Применение по п.9, где указанное расстройство или заболевание представляет собой болевое расстройство.
15. Применение по п.14, где указанное болевое расстройство представляет собой синдром фибромиалгии, общую боль, боль в спине, плечевую боль, головную боль или боль при пробуждении и в течение суточных активностей.
16. Применение по п.9, где указанное расстройство или заболевание представляет собой синдром дефицита внимания и гиперактивности.
17. Применение по п.9, где указанное расстройство или заболевание представляет собой стрессовое недержание мочи.
Текст
010666 Данное изобретение относится к соединениям, которые являются ингибиторами обратного захвата серотонина и предпочтительно также ингибиторами обратного захвата норадреналина, и к медицинскому использованию таких соединений, например, при лечении депрессии и тревожных расстройств, аффективных расстройств, болевых расстройств, синдрома дефицита внимания и гиперактивности (ADHD) и стрессового недержания мочи. Большинство современных доступных антидепрессантов может быть систематизировано по 3 классам: 1) ингибиторы моноаминоксидазы (МАО, MAOI),2) блокаторы транспортерного обратного захвата биогенных аминных нейромедиаторов [серотонина (5-НТ), норадреналина (NE) и допамина (DA)] и 3) модуляторы, в частности, блокаторы одного или нескольких 5-НТ и/или NE-рецепторов. Так как депрессия связана с относительной недостаточностью биогенных аминов, то применение блокаторов 5-НТ и/или NE-рецепторов (т.е. 5-НТ и или NE-антагонистов) не оказалось очень успешным в лечении депрессии и тревожного расстройства, и предпочтительные и наиболее эффективные на сегодня приемы лечения основаны на усилении нейротрансмиссии 5-НТ и/или NE путем блокирования их обратного захвата из синаптической щели (Slattery, D.A. et al., "The evolution of antidepressantmechanism of antidepressant therapy", Pharmacology and Therapeutics, 2004, 102, 47-60). В течение многих лет ингибирование обратного захвата моноамина исследовали с целью лечения депрессии, т.е., в особенности это относилось к моноаминам серотонину (5-НТ), норадреналину (NE) и допамину (DA). Селективные ингибиторы обратного захвата серотонина (обозначенные в данной работе как SSRI) стали первыми альтернативными терапевтическими средствами в лечении депрессии, некоторых форм тревоги и социальных фобий, так как они большей частью являются эффективными, высоко толерантными средствами и обладают благоприятным профилем безопасности в сравнении с классическими трициклическими антидепрессантами. Лекарственные средства, обозначенные как SSRI, представляют собой, например, флуоксетин, сертралин и пароксетин. Однако клинические исследования в отношении депрессии указывают, что нечувствительность к известным SSRI является существенной, вплоть до 30%. Другой, часто не учитываемый фактор в лечении антидепрессантами представляет собой длительность лечения, которая оказывает весьма глубокое воздействие на мотивацию пациента продолжать фармакотерапию. Во-первых, существует большей частью замедление в терапевтическом эффекте SSRI. Иногда симптомы даже ухудшаются в течение первых недель лечения. Во-вторых, сексуальная дисфункция большей частью является побочным эффектом обычных SSRI. Без разрешения данных проблем не реален прогресс в фармакотерапии депрессии и тревожных расстройств. Следовательно, существует необходимость в поиске соединений, способных улучшить лечение депрессии и других заболеваний, связанных с серотонином. Более новая стратегия представляла собой разработку двойных ингибиторов обратного захвата, например, комбинированный эффект ингибирования обратного захвата серотонина и ингибирования обратного захвата норэпинефрина (норэпинефрин также называют норадреналином, NA) на депрессию исследовался в клинических изучениях соединений, таких как дулоксетин (Wong, "Duloxetin (LY248686): an inhibitor of serotonin and noradrenalin uptake and an antidepressant drug candidate", Expert Opinion on Investigational Drugs, 1998, 7, 10, 1691-1699) и венлафаксин (Khan-A et al., 30, "Venlafaxin in depressed outpatients", Psychopharmacology Bulletin, 1991, 27, 141-144). Соединения, обладающие подобным эффектом, также называют как SNRI, "ингибиторы обратного захвата норадреналина и серотонина". Так как лечение селективным ингибитором обратного захвата NE ребокситином было показано для стимуляции 5-НТ-нейронов и опосредования высвобождения 5-НТ в мозге (Svensson Т. et al., J. Neural.Transmission, 2004, 111, 127), то возможен синергический эффект при применении SNRI в лечении депрессии или тревожного расстройства. Применение SNRI было показано в клинических исследованиях для получения целебного эффекта при боли (например, синдроме фибромиалгии, общей боли, боли в спине, плечевой боли, головной боли,боли при пробуждении и в течение суточных активностей) и особенно боли, связанной с депрессиейSNRI также показаны в клинических изучениях для получения целебного эффекта при синдроме дефицита внимания и гиперактивности (ADHD) (N. M. Mukaddes; Venlafaxin in attention deficit hyperactivity disorder, European Neuropsychopharmacology, Volume 12, Supplement 3, October 2002, Page 421). Кроме того, показано, что SNRI являются эффективными для лечения стрессового недержания мочи (Dmochowski R. R. et al. "Duloxetine versus placebo for the treatment of North American women with stressurinary incontinence", Journal of Urology 2003, 170:4, 1259-1263). Кроме того, Axford L. и др. описали разработку тройных ингибиторов обратного захвата 5-НТ, NE иDA для лечения депрессии (2003, BioorganicMedical Chemistry Letters, 13, 3277-3280: "Bicyclo[2.2.1.]heptanes as novel triple re-uptake inhibitors for the treatment of depression"). Веллбутрин (бупропион) , который обладает активностью обратного захвата DA in vitro и in vivo, показывает антидепрессантную активность. Другие комплексные исследования показали, что некоторое добавочное сродство к сайтам захвата DA может привести к некоторому клиническому эффекту (Nelson, J. С. J. Clin. Psychiatry 1998, 59, 65; Masand P. S. et al. Depression Anxiety 1998, 7, 89; Bodkin, J. A. et al. J. Clin. Psychiatry 1997,58, 137. Данное изобретение относится к производным 2-(1 Н-индолилсульфанил)бензиламина формулы I,которые представляют собой ингибиторы обратного захвата серотонина. В частности, изобретение относится к соединениям, обладающим комбинированным эффектом в отношении ингибирования обратного захвата серотонина и ингибирования обратного захвата норадреналина. Кроме того, некоторые из соединений являются также тройными ингибиторами обратного захвата 5-НТ, NE и DA. Дифенилсульфиды формулы (XVI) и их модификации были раскрыты как ингибиторы обратного захвата серотонина и предложены для применения в лечении депрессии, например, US 5095039, US 4056632, ЕР 396827 A1 и WO 9312080. В патенте ЕР 402097 описываются галогензамещенные дифенилсульфиды, в качестве селективных ингибиторов серотонина для лечения депрессии. WO 9717325 также раскрывает производные N,N-диметил-2-(арилтио)бензиламина, в качестве селективных ингибиторов транспорта серотонина, и предлагает их использование в качестве антидепрессантов. J. Jilek et al., 1989,Collect. Czeck. Chem. Commun., 54, 3294-3338 также раскрывает различные производные дифенилсульфидов, "фенилтиобензиламины", в качестве антидепрессантов. Кроме того, дифенилсульфиды также раскрыты в US 3803143 и предложены для применения в качестве антидепрессантов. Несколько публикаций относится к применению производных дифенилсульфидов в качестве "радиофармацевтических средств" для SERT-изображения с помощью SPECT и PET методов получения изображения, например, "S. Oya et al. J. Med. Chem. 2002, 45, 4716-4723" и "S. Oya et al. J. Med. Chem. 42,3, 333-335". P. Emond et al. (J. Med. Chem. (2002) 45, 1253-1258) и "S. Oya et al. J. Med. Chem. 42, 3, 333335)", кроме того исследовали и обсудили замещенные "дифенилсульфиды" в качестве селективных лигандов транспорта серотонина в сравнении с транспортерами допамина и норадреналина (DAT, NET) с измерением сродства in vitro к транспортерам допамина, серотонина и норадреналина. Публикация WO 0066537 также раскрывает некоторые производные дифенилсульфидов, предлагаемые как средства, обладающие более высокой селективностью для SERT по сравнению с NET и DAT.US 4018830 и US 4055665 раскрывает "фенилтиоаралкиламины" и "2-фенилтиобензиламины",структурно изображенные как "Ar1-S-Ar2, где Ar1 представляет собой фенилалкиламинный заместитель иAr2 представляет собой замещенное или незамещенное гомоциклическое или гетероциклическое кольцо с 5-6 атомами, такое как ароматическое кольцо, гетероароматическое кольцо". Соединения предложены для использования в профилактике "кардиальной аритмии".Sindelar et al." раскрывают модификации соединений формулы (XVI), где одно из колец замещено тиофеновым циклом, с оценкой селективности в качестве ингибитора обратного захвата 5-НТ и ингибитора обратного захвата NA, соответственно, для применения в качестве антидепрессантов.US 6596741 В 2 и US 6436938 В 1 и US 6410736 В 1 раскрывают биарилэфирные производные (XVII),предложенные для ингибирования обратного захвата моноаминов, например, серотонина, допамина и/или норадреналина. Ни одна из вышеприведенных ссылок не раскрывает соединения, содержащие индольную группу,подобную индолилсульфанилбензиламинам данного изобретения. Данное изобретение относится к соединению общей формулы I-2 010666 где атом серы присоединен к индолу через любой циклический углерод индола и где R1-R13 принимают значения, определенные ниже; в виде его свободного основания или его соли. Изобретение также относится к фармацевтической композиции, содержащей вышеуказанное соединение в виде его свободного основания или его фармацевтически приемлемой соли и по меньшей мере один фармацевтически приемлемый носитель или разбавитель. Изобретение также относится к применению вышеуказанного соединения в виде его свободного основания или его фармацевтически приемлемой соли для приготовления лекарственного средства для лечения заболевания или расстройства, где ингибитор совместного обратного захвата серотонина, норадреналина и допамина является полезным. Подробное описание изобретения Определения Термин "галоген" означает фтор, хлор, бром или иод. "Гало" означает галоген. Термин "C1-6 алкил" относится к разветвленной или неразветвленной алкильной группе, имеющей от одного до шести атомов углерода включительно и содержащей, без ограничения только ими, метил, этил,1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2-пропил и 2-метил-1-пропил. Аналогично, термин "С 1-4 алкил" относится к разветвленной или неразветвленной алкильной группе, имеющей от одного до четырех атомов углерода включительно и содержащей, без ограничения только ими, метил, этил, 1-пропил, 2 пропил, 1-бутил, 2-бутил, 2-метил-2-пропил и 2-метил-1-пропил. Термин "C3-8 алкил" представляет собой моноциклическое или бициклическое углеродное кольцо,содержащее от трех до восьми С-атомов, включающее, но без ограничения только ими, циклопропил,циклопентил и циклогексил. В выражении "C3-8 циклоалкил-C1-6 алкил" термины "C3-8 циклоалкил" и "C1-6 алкил" принимают значения, определенные выше. Термин "C1-6 алкилокси" относится к группам формулы C1-6 алкил-О-, где C1-6 алкилы принимают значения, определенные выше. Термины "C1-6 алкилкарбонил", "C1-6 алкиламинокарбонил" и "ди(C1-6 алкил) аминокарбонил" относятся к группам формулы C1-6 алкил-СО-, "C1-6 алкил-NH-СО- и (C1-6 алкил)2-N-CO-, соответственно, гдеC1-6 алкилы принимают значения, определенные выше. В выражениях "C1-6 алкиламино", "ди (С 1-6 алкил) амино", "C1-6 алкилтио", "галоС 1-6 алкил", "галоС 1-6 алкилсульфонил", "галоС 1-6 алкилсульфанил", "C1-6 алкилсульфонил" и "С 1-6 алкилсульфанил" и т.д., термины "C1-6 алкил" и "гало" принимают значения, определенные выше. Выражение "R1 и R2 вместе с азотом образуют 4-7-членный цикл, не содержащий или содержащий одну двойную связь, причем необязательно указанный цикл в дополнение к указанному азоту содержит еще один гетероатом, выбранный из азота, кислорода и серы" относится к гетероциклической системе колец из общих 4, 5, 6 или 7 членов, такой как, например, азетидин, пирролидин, пиперидин, пиперазин,гомопиперазин или морфолин. Данная система колец может быть незамещенной или может включать один или несколько заместителей, таких как, например, максимум один или два заместителя, например,выбранные из группы, содержащей галоген, гидрокси, C1-6 алкил, C1-6 алкокси, С 1-6 алкилтио, алкилсульфонил, трифторметил, трифторметилсульфонил и C1-6 алкилкарбонил. Атомы индола пронумерованы по IUPAC в соответствии с руководствами Комиссии по номенклатуре органической химии (Rigaudy, J.; Klesney, S.P. Nomenclature of Organic Chemistry, Pergamon Press,(1979) ISBN 0080223699). Термин "лечение", используемый в данном описании в связи с заболеванием или расстройствами,включает также профилактику как возможный случай. Соединения изобретения Данное изобретение относится к соединению общей формулы I где атом серы присоединен к индолу через любой циклический углерод индола и гдеR1-R2 независимо выбраны из водорода, C1-6 алкила, C3-8 циклоалкила и C3-8 циклоалкилС 1-6 алкила или R1 и R2 вместе с азотом образуют 4-7-членный цикл, не содержащий или содержащий одну двойную связь, причем необязательно указанный цикл в дополнение к указанному азоту содержит еще один гетероатом, выбранный из азота, кислорода и серы;R3-R12 независимо выбраны из водорода, галогена, циано, нитро, C1-6 алкила, C3-8 циклоалкила, C3-8 циклоалкилС 1-6 алкила, амино, C1-6 алкиламино, ди (C1-6-алкил) амино, C1-6 алкилкарбонила, аминокарбонила, C1-6 алкиламинокарбонила, ди (C1-6 алкил) аминокарбонила, гидрокси, C1-6 алкилокси, C1-6 алкилтио,-3 010666 галогенС 1-6 алкила, галогенС 1-6 алкилсульфонила, галогенС 1-6 алкилсульфанила и C1-6 алкилсульфонила; иR13 выбран из водорода и C1-6 алкила; при условии, что R10 выбран из галогена, циано, C1-6 алкила, гидрокси, C1-6 алкокси и галоген-C1-6 алкила; в виде его свободного основания или его соли; при следующих условиях: если атом серы присоединен через атом номер 2 индола, R7 отсутствует; если атом серы присоединен через атом номер 3 индола, R12 отсутствует; если атом серы присоединен через атом номер 4 индола, R8 отсутствует; если атом серы присоединен через атом номер 5 индола, R9 отсутствует; и если атом серы присоединен через атом номер 7 индола, R11 отсутствует. Для дальнейшего пояснения изобретения, без его ограничения, следующие варианты значений R12R находятся в объеме данного изобретения, в частности, для соединений изобретения в виде их свободных оснований или их солей:R1-R2 независимо выбраны из водорода и C1-6 алкила; или R1 и R2 вместе с азотом образуют 4-7 членный цикл, не содержащий или содержащий одну двойную связь, причем необязательно данный цикл в дополнение к азоту содержит еще один гетероатом, выбранный из азота, кислорода и серы. Для дальнейшего пояснения изобретения, без ограничения, следующие варианты значений R3-R12 находятся в пределах данного изобретения, в частности, для соединений в виде свободного основания или их солей:R3-R12 независимо выбраны из водорода, галогена, циано, C1-6 алкила, гидрокси, C1-6 алкилокси и галогенC1-6 алкила. Для дальнейшего пояснения изобретения, без ограничения, следующие варианты значений R3-R6 находятся в пределах данного изобретения, в частности, для соединений в виде свободного основания или их солей:R3-R6 независимо выбраны из водорода, галогена и C1-6 алкила. Для дальнейшего пояснения изобретения, без ограничения, следующие варианты значений R7-R12 находятся в пределах данного изобретения, в частности, для соединений в виде свободного основания или их солей:R7-R12 независимо выбраны из водорода, галогена, циано, C1-6 алкила, гидрокси, C1-6 алкилокси и галогенС 1-6 алкила. Вышеприведенные варианты осуществления данного изобретения относятся к соединениям формулы I. В частности, данное изобретение относится к соединению общей формулы I, где атом серы присоединен к индолу, как указано на представленных ниже формулах IA-ID, IF: и где R1-R13 принимают значения, определенные в данном описании,в виде его свободного основания или его соли. В дальнейшем варианте осуществления соединение по данному изобретению выбрано из следующей группы: в виде его свободного основания или его соли, такой как фармацевтически приемлемая соль. Данное изобретение относится к нижеприведенным вариантам осуществления 1-17. 1. Соединение общей формулы I где атом серы присоединен к индолу через любой циклический углерод индола и гдеR1-R2 независимо выбраны из водорода, C1-6 алкила, C3-8 циклоалкила и C3-8 циклоалкил-C1-6 алкила или R1 и R2 вместе с азотом образуют 4-7-членный цикл, не содержащий или содержащий одну двойную связь, причем необязательно указанный цикл в дополнение к указанному азоту содержит еще один гетероатом, выбранный из азота, кислорода и серы;R3-R12 независимо выбраны из водорода, галогена, циано, нитро, C1-6 алкила, C3-8 циклоалкила, C3-8 циклоалкил-C1-6 алкила, амино, C1-6 алкиламино, ди(C1-6 алкил) амино, C1-6 алкилкарбонила, аминокарбонила, C1-6 алкиламинокарбонила, ди(C1-6 алкил) аминокарбонила, гидрокси, C1-6 алкилокси, C1-6-алкилтио,галогенС 1-6 алкила, галогенС 1-6 алкилсульфонила, галогенС 1-6 алкилсульфанила и C1-6 алкилсульфонила; иR13 выбран из водорода и C1-6 алкила; при условии, что R10 выбран из галогена, циано, C1-6 алкила, гидрокси, C1-6 алкокси и галоген-C1-6 алкила; в виде его свободного основания или его соли; при следующих условиях: если атом серы присоединен через атом номер 2 индола, R7 отсутствует; если атом серы присоединен через атом номер 3 индола, R12 отсутствует; если атом серы присоединен через атом номер 4 индола, R8 отсутствует; если атом серы присоединен через атом номер 5 индола, R9 отсутствует; и если атом серы присоединен через атом номер 7 индола, R11 отсутствует. 2. Соединение по варианту осуществления 1, где R1 и R2 независимо выбраны из водорода и C1-6 алкила; или R1 и R2 вместе с азотом образуют 4-7-членный цикл, не содержащий или содержащий одну двойную связь, причем необязательно данный цикл в дополнение к азоту содержит еще один гетероатом,выбранный из азота, кислорода и серы. 3. Соединение по любому из вариантов осуществления 1 и 2, где R3-R12 независимо выбраны из водорода, галогена, циано, C1-6 алкила, гидрокси, C1-6 алкилокси и галогенС 1-6 алкила. 4. Соединение по любому из вариантов осуществления 1-3, где R3-R6 независимо выбраны из водорода, галогена и C1-6 алкила. 5. Соединение по любому из варианту осуществления 1-4, где R7-R12 независимо выбраны из водорода, галогена, циано, C1-6 алкила, гидрокси, C1-6 алкилокси и галогенС 1-6 алкила. 6. Соединение по любому из вариантов осуществления 1-5, причем указанное соединение выбрано из следующих соединений: в виде его свободного основания или его соли. 7. Фармацевтическая композиция, содержащая соединение по любому из вариантов осуществления-6 010666 1-6 и по меньшей мере один фармацевтически приемлемый носитель или разбавитель. 8. Применение соединения по любому из вариантов осуществления 1-6 для приготовления лекарственного средства для лечения заболевания или расстройства, где ингибитор совместного обратного захвата серотонина, норадреналина и допамина является полезным. 9. Применение по варианту осуществления 8, где указанное расстройство или заболевание представляет собой аффективное расстройство. 10. Применение по варианту осуществления 9, где аффективное расстройство представляет собой депрессивное расстройство. 11. Применение по варианту осуществления 10, где указанное депрессивное расстройство представляет собой депрессивный эпизод тяжелой степени, послеродовую депрессию, дистимию или депрессию, связанную с биполярным расстройством, болезнью Альцгеймера, психозом или болезнью Паркинсона. 12. Применение по варианту осуществления 9, где аффективное расстройство представляет собой тревожное расстройство. 13. Применение по варианту осуществления 12, где указанное тревожное расстройство представляет собой генерализованное тревожное расстройство, социальное тревожное расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, паническое расстройство,приступы паники, специфические фобии, социальную фобия или агорафобию. 14. Применение по варианту осуществления 9, где указанное расстройство или заболевание представляет собой болевое расстройство. 15. Применение по варианту осуществления 14, где указанное болевое расстройство представляет собой синдром фибромиалгии, общую боль, боль в спине, плечевую боль, головную боль или боль при пробуждении и в течение суточных активностей. 16. Применение по варианту осуществления 9, где указанное расстройство или заболевание представляет собой синдром дефицита внимания и гиперактивности. 17. Применение по варианту осуществления 9, где указанное расстройство или заболевание представляет собой стрессовое недержание мочи. Данное изобретение охватывает свободные основания соединений изобретения. Данное изобретение охватывает соли соединений изобретения, обычно фармацевтически приемлемые соли. Такие соли включают фармацевтически приемлемые кислотно-аддитивные соли, фармацевтически приемлемые соли металлов, аммония и алкилированные соли аммония. Кислотно-аддитивные соли включают соли неорганических кислот, а также органических кислот. Примеры подходящих неорганических кислот включают хлористоводородную, бромистоводородную,иодистоводородную, фосфорную, серную, сульфаминовую, азотную кислоты и тому подобные. Примеры подходящих органических кислот включают муравьиную, уксусную, трихлоруксусную,трифторуксусную, пропионовую, бензойную, коричную, лимонную, фумаровую, гликолевую, итаконовую, молочную, метансульфоновую, малеиновую, яблочную, малоновую, миндальную, щавелевую, пикриновую, пировиноградную, салициловую, янтарную, метансульфоновую, этансульфоновую, винную,аскорбиновую, памовую, бисметиленсалициловую, этандисульфоновую, глюкоковую, цитраконовую,аспаргиновую, стеариновую, пальмитиновую, EDTA (этилендиаминтетрауксусную), гликолевую, паминобензойную, глутаминовую, бензолсульфоновую, п-толуолсульфоновую кислоты, теофиллинуксусные кислоты, а также галогентеофиллины, например, 8-бромтеофиллин и тому подобное. Также предлагаемые фармацевтически приемлемые кислотно-аддитивные соли представляют собой гидраты, которые способны образовывать соединения данного изобретения. Кроме того, соединения данного изобретения могут существовать в несольватированных, а также в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобные. В целом, полагают, что сольватированные формы эквивалентны несольватированным формам для целей данного изобретения. Соединения данного изобретения могут иметь один или несколько асимметрических центров, и предполагается, что любые оптические изомеры (т.е., энантиомеры или диастереомеры), разделенные,чистые или частично очищенные оптические изомеры и любые их смеси, включая рацемические смеси,т.е. смеси стереоизомеров, включены в объем данного изобретения. Рацемические формы могут быть разделены на оптические антиподы известными способами, например, разделением их диастереомерных солей оптически активной кислотой и выделением оптически активного аминого производного обработкой основанием. Другой способ разделения рацематов на оптические антиподы основан на хроматографии на оптически активной матрице. Рацемические соединения данного изобретения могут быть также разделены на их оптические антиподы, например, дробной кристаллизацией. Соединения данного изобретения могут быть также разделены образованием диастереомерных производных. Для разделения оптических изомеров могут быть использованы дополнительные способы, известные специалистам в данной области. Такие способы включают способы, описанные в публикации J. Jaques, A. Collet and S. Wilen "Enantiomers, Racemates and Resolutions", John Wiley andSons, New York (1981). Оптически активные соединения могут быть также приготовлены из оптически-7 010666 активных исходных продуктов. Кроме того, если в молекуле присутствует двойная связь или частично или полностью насыщенная циклическая система, то могут образоваться геометрические изомеры. Предполагается, что любые геометрические изомеры, разделенные, чистые или частично очищенные геометрические изомеры и их смеси включены в объем данного изобретения. Аналогично, молекулы, содержащие связь с ограниченным вращением, могут образовать геометрические изомеры. Предполагается, что они также включены в данное изобретение. Более того, некоторые соединения данного изобретения могут существовать в различных таутомерных формах и предполагается, что любые таутомерные формы, которые соединения способны образовать, включены в объем данного изобретения. Изобретение также охватывает пролекарства данных соединений, которые при введении претерпевают химическое превращение под действием метаболических процессов перед тем как стать фармакологически активными веществами. В основном, такие пролекарства будут представлять собой функциональные производные соединений формулы I, IA, IB, IC, IE или IF, которые in vivo легко превращаются в требуемое соединение формулы I, IA, IB, IC, IE или IF. Обычные процедуры отбора и приготовления подходящих производных пролекарств описаны, например, в издании "Design of Prodrugs", ed. H. Bundgaard, Elsevier, 1985. Изобретение также охватывает активные метаболиты данных соединений. Как описано выше, соединения изобретения, производные 2-(1 Н-индолилсульфанил)бензиламина,являются ингибиторами обратного захвата серотонина. Соответственно, соединения формулы I в виде свободного основания или их солей, где R1-R13 принимают значения, описанные выше, являются ингибиторами обратного захвата серотонина, т.е., например, характеризуются сродством к связыванию (IC50) при 5 мкМ или менее, обычно 1 мкМ или менее,предпочтительно менее чем 500 нМ, или менее чем 100 нМ, или менее чем 50 нМ, измеренному предпочтительно способом, описанным в примере 9 - Тест на связывание с транспортером. Также соединения формулы I в виде свободного основания или их солей, где R1-R13 принимают значения, описанные выше, являются ингибиторами обратного захвата норадреналина, т.е., например,характеризуются сродством к связыванию (IC50) при 5 мкМ или менее, обычно 1 мкМ или менее, предпочтительно менее чем 500 нМ, менее чем 100 нМ или менее чем 50 нМ, измеренному предпочтительно способом, описанным в примере 9 - Тест на связывание с транспортером. Кроме того, соединения формулы I в виде свободного основания или их солей, где R1-R13 принимают значения, описанные выше, являются ингибиторами обратного захвата допамина, т.е., например, характеризуются сродством к связыванию (IC50) при 5 мкМ или менее, обычно 1 мкМ или менее, предпочтительно менее чем 500 нМ, менее чем 100 нМ или менее чем 50 нМ, измеренному предпочтительно способом, описанным в примере 9 - Тест на связывание с транспортером. Соединения изобретения (т.е. соединения формулы I, для которых R1-R13 принимают выше описанные значения), могут представлять собой двойные ингибиторы обратного захвата серотонина и норадреналина. Предпочтительный вариант осуществления относится к соединениям изобретения (т.е. к соединениям формулы I, для которых R1-R13 принимают значения, описанные в данной работе), представляющим собой тройные ингибиторы обратного захвата серотонина, норадреналина и допамина, т.е., к соединениям изобретения, которые являются одновременно ингибиторами обратного захвата норадреналина,ингибиторами обратного захвата серотонина и ингибиторами обратного захвата допамина, каждый из которых определен выше. Фармацевтическое применение В следующем аспекте изобретение относится к применению соединения формулы I для приготовления лекарственного средства. Данное изобретение также относится к фармацевтической композиции, содержащей соединение изобретения в виде его свободного основания или его соли и фармацевтически приемлемый носитель или разбавитель. В варианте осуществления фармацевтической композиции соединение изобретения присутствует в количестве от примерно 0,001 до примерно 100 мг/кг массы тела в сутки. Данное изобретение также относится к применению соединения изобретения в виде его свободного основания или его соли для приготовления лекарственного средства для лечения заболевания или расстройства, где комбинированный эффект ингибирования обратного захвата серотонина и норадреналина и ингибирования обратного захвата допамина является полезным. Лекарственное средство может включать любой из вариантов осуществления формулы I, описанных в данной работе. Следующий вариант осуществления изобретения относится к применению соединения формулы I для приготовления лекарственного средства для лечения аффективных расстройств, болевых расстройств, ADHD и стрессового недержания мочи. В частности, изобретение также относится к применению соединения изобретения в виде его свободного основания или его соли для приготовления лекарственного средства для лечения аффективных-8 010666 расстройств. Для дальнейшей иллюстрации, не ограничивающей изобретение, аффективное расстройство, предназначенное для лечения, выбрано из группы, состоящей из депрессивных расстройств и тревожных расстройств. Следующий вариант осуществления относится к применению соединения формулы I для приготовления лекарственного средства для лечения депрессивных расстройств. Обычно депрессивное расстройство, предназначенное для лечения, выбрано из группы, состоящей из депрессивного эпизода тяжелой степени, послеродовой депрессии, дистимии и депрессии, связанной с биполярным расстройством, психозом и болезнями Альцгеймера или Паркинсона. Для дальнейшей иллюстрации, не ограничивающей изобретение, вариант осуществления изобретения относится к лечению депрессивного эпизода тяжелой степени; другой вариант осуществления относится к лечению послеродовой депрессии; другой вариант осуществления относится к лечению дистимии; другой вариант осуществления относится к лечению депрессии, связанной с биполярным расстройством, психозом и болезнями Альцгеймера или Паркинсона. Для дальнейшей иллюстрации, не ограничивающей изобретение, вариант осуществления изобретения относится к лечению депрессии, связанной с биполярным расстройством; другой вариант осуществления относится к лечению депрессии, связанной с болезнью Альцгеймера; другой вариант осуществления относится к лечению депрессии, связанной с психозом; другой вариант осуществления относится к лечению депрессии, связанной с болезнью Паркинсона. В следующем варианте осуществления изобретение также относится к применению соединения изобретения в виде его свободного основания или его соли для приготовления лекарственного средства для лечения депрессии. В следующем варианте осуществления изобретение также относится к применению соединения изобретения в виде его свободного основания или его соли для приготовления лекарственного средства для лечения тревожных расстройств. Обычно тревожные расстройства, предназначенные для лечения,выбраны из группы, состоящей из генерализованного тревожного расстройства, социального тревожного расстройства, посттравматического стрессового расстройства, обсессивно-компульсивного расстройства,панического расстройства, приступов паники, специфических фобий, социальной фобии или агорафобии. В следующем варианте осуществления изобретение также относится к применению соединения изобретения в виде его свободного основания или его соли для приготовления лекарственного средства для лечения генерализованного тревожного расстройства. В следующем варианте осуществления изобретение также относится к применению соединения изобретения в виде его свободного основания или его соли для приготовления лекарственного средства для лечения социального тревожного расстройства. В следующем варианте осуществления изобретение также относится к применению соединения изобретения в виде его свободного основания или его соли для приготовления лекарственного средства для лечения посттравматического стрессового расстройства. В следующем варианте осуществления изобретение также относится к применению соединения изобретения в виде его свободного основания или его соли для приготовления лекарственного средства для лечения обсессивно-компульсивного расстройства. В следующем варианте осуществления изобретение также относится к применению соединения изобретения в виде его свободного основания или его соли для приготовления лекарственного средства для лечения панического расстройства. В следующем варианте осуществления изобретение также относится к применению соединения изобретения в виде его свободного основания или его соли для приготовления лекарственного средства для лечения приступов паники. В следующем варианте осуществления изобретение также относится к применению соединения изобретения в виде его свободного основания или его соли для приготовления лекарственного средства для лечения специфических фобий. В следующем варианте осуществления изобретение также относится к применению соединения изобретения в виде его свободного основания или его соли для приготовления лекарственного средства для лечения социальной фобии. В следующем варианте осуществления изобретение также относится к применению соединения изобретения в виде его свободного основания или его соли для приготовления лекарственного средства для лечения агорафобии. В следующем варианте осуществления данное изобретение относится к применению соединения формулы I в виде его свободного основания или его соли для приготовления лекарственного средства для лечения болевых расстройств. Для дальнейшей иллюстрации, не ограничивающей изобретение, болевое расстройство, предназначенное для лечения, выбрано из группы, состоящей из синдрома фибромиалгии (FMS), общей боли, боли в спине, плечевой боли, головной боли, а также боли при пробуждении и в течение суточных активностей. Для дальнейшей иллюстрации, не ограничивающей изобретение, вариант осуществления изобретения относится к лечению синдрома фибромиалгии; другой вариант осуществления относится к лечению общей боли; другой вариант осуществления относится к лечению боли в спине; другой вариант осуществления относится к лечению плечевой боли; другой вариант осуществления относится к лечению головной боли; другой вариант осуществления относится к лечению боли при пробуждении и в течение суточных активностей. В следующем варианте осуществления данное изобретение относится к применению соединения формулы I в виде его свободного основания или его соли для приготовления лекарственного средства для лечения синдрома дефицита внимания и гиперактивности.-9 010666 В следующем варианте осуществления данное изобретение относится к применению соединения формулы I в виде его свободного основания или его соли для приготовления лекарственного средства для лечения стрессового недержания мочи. Фармацевтическая композиция Соединения изобретения в виде свободного основания или их солей могут быть введены индивидуально или в комбинации с фармацевтически приемлемыми носителями или наполнителями, в разовых или многократных дозах. Фармацевтические композиции по изобретению могут быть приготовлены с фармацевтически приемлемыми носителями или разбавителями, а также с любыми другими известными адъювантами и наполнителями по обычным методикам, таким как описаны в издании: Remington, TheScience and Practice of Pharmacy, 19 Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA, 1995. Фармацевтические композиции могут быть специально приготовлены для введения любым подходящим способом, таким как оральный, ректальный, назальный, легочный, топикальный (включая трансбуккальный и подъязычный), трансдермальный, интрацистернальный, интраперитонеальный, вагинальный и парентеральный (включая подкожный, внутримышечный, внутриоболочечный, внутривенный и внутрикожный), при этом оральное введение является предпочтительным. Следует отметить, что предпочтительный способ введения будет зависеть от общего состояния и возраста пациента, тяжести состояния, предназначенного для лечения, и выбора активного ингредиента. Фармацевтические композиции для орального введения включают твердые дозированные формы,такие как капсулы, таблетки, драже, облатки, лепешки, порошки и гранулы. Если целесообразно, они могут быть приготовлены с покрытиями, такими как энтеросолюбильные покрытия, или они могут быть приготовлены таким образом, чтобы обеспечить контролируемое высвобождение активного ингредиента, такое как постепенное или пролонгированное высвобождение, по способам, хорошо известным в данной области. Жидкие дозированные формы для орального введения включают растворы, эмульсии, суспензии,сиропы и эликсиры. Фармацевтические композиции для парентерального введения включают стерильные водные и неводные инъецируемые растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки,предназначенные для превращения в стерильные инъецируемые растворы или дисперсии перед применением. Инъецируемые депо-формы также предусмотрены в объеме данного изобретения. Другие подходящие формы для введения включают суппозитории, разбрызгиваемые растворы, мази, кремы, гели, летучие препараты, дермальные бляшки, имплантаты, и т.п. В варианте осуществления фармацевтической композиции соединение изобретения вводили в количестве от примерно 0,001 до примерно 100 мг/кг массы тела в сутки. Для удобства соединения изобретения вводят в стандартной лекарственной форме, содержащей указанные соединения в количестве от примерно 0,01 до 100 мг. Общая суточная доза обычно находится в интервале примерно 0,05-500 мг. Типичная оральная дозировка находится в интервале от примерно 0,001 до примерно 100 мг/кг массы тела в сутки, введенная в одной или нескольких дозах, таких как от 1 до 3 доз. Точная дозировка будет зависеть от частоты и способа введения, пола, возраста, массы и общего состояния пациента, подверженного лечению, природы и тяжести состояния, подверженного лечению, и любых сопутствующих заболеваний, предназначенных для лечения, и других факторов, очевидных для специалистов в данной области. Препараты могут быть представлены для удобства в стандартной лекарственной форме способами,известными специалистам в данной области. Типичная стандартная лекарственная форма для перорального введения один или несколько раз в сутки, а именно от 1 до 3 раз в сутки, содержит от 0,01 до примерно 1000 мг, предпочтительно от примерно 0,05 до примерно 500 мг и более предпочтительно от примерно 0,5 до примерно 200 мг. Для парентерального введения, такого как внутривенное, интратекальное, внутримышечное и подобное, обычно дозы имеют порядок, равный примерно половине дозы, примененной для перорального введения. Соединения данного изобретения в основном применяются в виде свободного вещества или в виде его соли, такой как фармацевтически приемлемая соль. Один из примеров представляет собой кислотноаддитивную соль соединения, применяющегося как свободное основание. Когда соединение изобретения представляет собой свободное основание, такие соли приготавливают обычным способом путем обработки раствора или суспензии свободного основания данного изобретения химическим эквивалентом кислоты, такой как фармацевтически приемлемая кислота. Типичные примеры указаны выше. Для парентерального введения могут быть применены растворы соединения изобретения в стерильном водном растворе, водном пропиленгликоле, водном витамине Е или кунжутном или арахисовом масле. Такие водные растворы должны содержать подходящее вещество для буфера, если необходимо, и жидкий разбавитель, сначала сделанный изотоническим с помощью достаточного количества физиологического раствора или глюкозы. Водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и интраперитонеального введения. Применяемые стерильные водные среды все- 10010666 легко доступны по стандартным методикам, известным специалистам в данной области. Подходящие фармацевтические носители включают инертные твердые разбавители или наполнители, стерильные водные растворы и различные органические растворители. Примерами твердых носителей являются лактоза, гипс, сахароза, циклодекстрин, тальк, желатин, агар, пектин, аравийская камедь,стеарат магния, стеариновая кислота и низшие алкиловые эфиры целлюлозы. Примерами жидких носителей являются сироп, арахисовое масло, оливковое масло, фосфолипиды, жирные кислоты, амины жирных кислот, полиоксиэтилен и вода. Аналогично, носитель или разбавитель может включать любой продукт пролонгированного высвобождения, известный в данной области, такой как глицерилмоностеарат или глицерилдистеарат, один или в смеси с воском. Фармацевтические композиции, полученные комбинированием соединения изобретения и фармацевтически приемлемых носителей, затем легко вводятся в виде многих лекарственных форм, подходящих для раскрытых путей введения. Препараты для удобства могут быть представлены в стандартной лекарственной форме способами, известными в области фармации. Препараты данного изобретения, подходящие для орального введения, могут быть представлены в виде отдельных единиц, таких как капсулы или таблетки, каждая из которых содержит предварительно определенное количество активного ингредиента, и которая может включать подходящий наполнитель. Более того, препараты, пригодные для перорального введения, могут иметь форму порошка или гранул,раствора или суспензии в водной или неводной жидкости, или жидкой эмульсии масло-в-воде или водав-масле. Если твердый носитель используют для орального введения, то препарат может быть таблеткой,например, помещенной в прочную желатиновую капсулу в порошкообразной или пеллетированной форме, или, например, в форме таблетки или лепешки. Количество твердого носителя может изменяться, но обычно должно составлять от примерно 25 мг до примерно 1 г. Если используют жидкий носитель, то препарат может быть в форме сиропа, эмульсии, мягкой желатиновой капсулы или стерильной инъецируемой жидкости, такой как водная или неводная жидкая суспензия или раствор. Фармацевтические препараты изобретения могут быть приготовлены обычными способами, известными в данной области. Например, таблетки могут быть приготовлены смешиванием активного ингредиента с обычными адъювантами и/или разбавителями и затем прессованием смеси в стандартной машине для таблетирования. Примеры адъювантов или разбавителей включают: кукурузный крахмал, картофельный крахмал,тальк, стеарат магния, желатин, лактозу, камеди и тому подобное. Любые другие адъюванты или добавки, примененные для таких целей как окрашивание, ароматизация, консервация и т.д., могут быть применены при условии, что они совместимы с активными ингредиентами. Растворы для инъекций могут быть приготовлены растворением активного ингредиента и возможных добавок в части растворителя для инъекции, предпочтительно в стерильной воде, доведением раствора до требуемого объема, стерилизацией раствора и помещением его в подходящие ампулы или пузырьки. Могут быть использованы любые подходящие добавки, обычно применяемые в данной области,такие как тонизирующие средства, консерванты, антиоксиданты и т.д. В следующем аспекте данное изобретение относится к способу получения соединения изобретения,описанному далее. Способы получения соединений изобретения Соединения изобретения могут быть получены следующим образом. Способ 1 (для соединений формулы IA). Алкилирование амина формулы III алкилирующим производным формулы II где R1-R13 принимают значения, определенные в данной работе, и L представляет собой удаляемую группу, такую как галоген, мезилат или тозилат; при этом соединение формулы IA выделяют как свободное основание или соль в виде фармацевтически приемлемой кислотно-аддитивной соли. Способ 2 (для соединений формулы IA). Восстановление амидного производного формулы IV где R1-R13 принимают значения, определенные в данной работе; при этом соединение формулы IA выделяют как свободное основание или соль в виде фармацевтически приемлемой кислотно-аддитивной соли. Способ 3 (для соединений формулы IA, также для соединений формулы IB, когда R12 водород). Взаимодействие индола формулы V с реагентом формулы VI с использованием катализатора: где R1-R13 принимают значения, определенные в данной работе; при этом соединение формулы IA или соединение формулы IB, когда R12 водород, выделяют как свободное основание или соль в виде фармацевтически приемлемой кислотно-аддитивной соли. Способ 4 (для соединений формулы IC). Восстановление амидного производного формулы VII где R1-R13 принимают значения, определенные в данной работе; при этом соединение формулы IC выделяют как свободное основание или соль в виде фармацевтически приемлемой кислотно-аддитивной соли. Способ 5 (для соединений формулы ID). Восстановление амидного производного формулы VIII где R1-R13 принимают значения, определенные в данной работе; при этом соединение формулы ID выделяют как свободное основание или соль в виде фармацевтически приемлемой кислотно-аддитивной соли. Способ 6 (для соединений формулы IF). Восстановление амидного производного формулы X где R1-R13 принимают значения, определенные в данной работе; при этом соединение формулы IF выделяют как свободное основание или соль в виде фармацевтически приемлемой кислотно-аддитивной соли. Способ 7 (для соединений формулы IB с R12 = водород). Восстановление амидного производного формулы XI где R1-R13 принимают значения, определенные в данной работе; при этом соединение формулы IB выделяют как свободное основание или соль в виде фармацевтически приемлемой кислотно-аддитивной соли. Способ 8 (для соединений формулы IC с R2 = водород). Снятие защиты соединения формулы XII где R1, R3-R13 принимают значения, определенные в данной работе, и R' представляет собой защитную группу, такую как карбаматная группа (такую как метил-, этил-, трет-бутил-, аллил- или бензилкарбамат); при этом соединение формулы IC выделяют как свободное основание или соль в виде фармацевтически приемлемой кислотно-аддитивной соли. Способ 9 (для соединений формулы ID с R2 = водород). Снятие защиты соединения формулы XIII где R1, R3-R13 принимают значения, определенные в данной работе, и R' представляет собой защитную группу, такую как карбаматная группа (такую как метил-, этил-, трет-бутил-, аллил- или бензилкарбамат); при этом соединение формулы ID выделяют как свободное основание или соль в виде фармацевтически приемлемой кислотно-аддитивной соли. Способ 10 (для соединений формулы IF с R2 = водород). Снятие защиты соединения формулы XV где R1, R3-R13 принимают значения, определенные в данной работе, и R' представляет собой защитную группу, такую как карбаматная группа (такую как метил-, этил-, трет-бутил-, аллил- или бензилкарбамат); при этом соединение формулы IF выделяют как свободное основание или соль в виде фармацевтически приемлемой кислотно-аддитивной соли. Алкилирование по способу 1 обычно проводят в органическом растворителе, таком как соответственно кипящий спирт или кетон, предпочтительно в присутствии органического или неорганического основания (карбонат калия, диизопропилэтиламин или триэтиламин) при температуре кипения с обратным холодильником. В альтернативном случае алкилирование может быть проведено при фиксированной температуре, которая отличается от температуры кипения, в одном из вышеупомянутых растворителей или в диметилформамиде (ДМФА), диметилсульфоксиде (ДМСО) или N-метилпирролидин-2-оне(NMP), предпочтительно в присутствии основания. Алкилирующие производные формулы II могут быть получены из соответствующих бензиловых спиртов, которые, в свою очередь, синтезируют из соответст- 13010666 вующих бензойных кислот стандартными способами восстановления, например, с применением литийалюминийгидрида. Соответствующие бензойные кислоты могут быть синтезированы способами, аналогичными способам, описанным, например, в публикации: Hamel, P.; Girard, M.; Tsou, N. N.; J. Heterocycl.Chem.; 36, 1999, 643-652. Амины формулы III коммерчески доступны. Восстановление по способу 2 проводят по стандартным, описанным в литературе способам, т.е., с применением восстановителя, подобного борану, алану или литийалюминийгидриду. Амиды формулыIV могут быть получены взаимодействием соответствующих бензойных кислот (синтезированных способами, аналогичными способам, описанным, например, в публикациях: Hamel, P.; Girard, М.; Tsou, N.N.; J. Heterocycl. Chem.; 36, 1999, 643-652 и Hamel, P.; Zajac, N.; Atkinson, J. G.; Girard, Y.; J. Org. Chem; 59; 21; 1994; 6372-6377) с амином формулы III стандартными способами, например, через хлорангидрид карбоновой кислоты или активированные сложные эфиры или через применение карбоновых кислот со связующим агентом, таким как, например, дициклогексилкарбодиимид. Реакция по способу 3 может быть проведена взаимодействием N-алкил-2,3-дигидробензо[d] изотиазола формулы VI с индолом формулы V в присутствии активирующего агента, подобного, например,кислоте Льюиса, или, например, окислителя, подобного, например, N-хлорсукцинимиду.N-Алкил-2,3-дигидробензо[d]изотиазолы формулы VI могут быть получены способами, аналогичными способам, описанным в литературе, например, Hoffmann, R. W.; Goldmann, S.; Chem. Ber. 111,1978, 2716-2725 и Kanakarajan, K.; Meier, H.; Angew. Chem. 96, 1984, 220. Индолы формулы V коммерчески доступны или могут быть получены стандартными способами, описанными в стандартных руководствах, подобных, например, Houben-Weyl, Methoden der organischen Chemie (Methods of Organic Chemistry), Georg-Thieme-Verlag, Stuttgart and Organic Reactions, John WileySons, Inc. New York. Восстановление по способу 4 проводят по стандартным, описанным в литературе способам, т.е., с применением восстановителя, подобного борану, алану или литийалюминийгидриду. Амиды формулыVII могут быть получены взаимодействием соответствующих 2-меркаптобензамидов (синтезированных восстановлением соответствующих 2,2'-дитиобензамидов аналогично описанному, например, в публикации Elworthy, Т. R.; Ford, A. P. D. W.; Bantle, G. W.; Morgans, D. J.; Ozer, R. S.; et al. J. Med. Chem. 40,1997, 2674-2687) с 4-гало- или 4-псевдогалоиндолом, аналогично способам, описанным в литературе,например, Schopter, U.; Schlapbach, A. Tetrahedron; 57, 2001, 3069-3073, где "гало" представляет собой либо бром либо иод, или "псевдогало" представляет собой, например, трифлат или нонафлат. При R13 = водород в формуле VII данное положение защищают перед реакцией сочетания и снимают защиту после реакции сочетания согласно стандартным литературным методикам со стандартными защитными группами, например, такими как 4-метилфенилсульфонильная группа или трет-бутоксикарбонильная группа. Восстановление по способу 6 проводят по стандартным, описанным в литературе способам, т.е., с применением восстановителя, подобного борану, алану или литийалюминийгидриду. Амиды формулыVIII могут быть получены взаимодействием соответствующих 2-меркаптобензамидов (синтезированных восстановлением соответствующих 2,2'-дитиобензамидов аналогично описанному, например, в публикации Elworthy, Т. R.; Ford, A. P. D. W.; Bantle, G. W.; Morgans, D. J.; Ozer, R. S.; et al. J. Med. Chem. 40,1997, 2674-2687) с 5-гало- или 5-псевдогалоиндолом, аналогично способам, описанным в литературе,например, Schopter, U.; Schlapbach, A. Tetrahedron; 57, 2001, 3069-3073, где "гало" представляет собой либо бром либо иод, или "псевдогало" представляет собой, например, трифлат или нонафлат. При R13 = водород в формуле VIII данное положение защищают перед реакцией сочетания и снимают защиту после реакции сочетания согласно стандартным литературным методикам со стандартными защитными группами, например, такими как 4-метилфенилсульфонильная группа или трет-бутоксикарбонильная группа. Восстановление по способу б проводят по стандартным, описанным в литературе способам, т.е., с применением восстановителя, подобного борану, алану или литийалюминийгидриду. Амиды формулы X могут быть получены взаимодействием соответствующих 2-меркаптобензамидов (синтезированных восстановлением соответствующих 2,2'-дитиобензамидов аналогично описанному, например, в публикацииElworthy, Т. R.; Ford, A. P. D. W.; Bantle, G. W.; Morgans, D. J.; Ozer, R. S.; et al. J. Med. Chem. 40, 1997,2674-2687) с 7-гало- или 7-псевдогалоиндолом, аналогично способам, описанным в литературе, например, Schopter, U.; Schlapbach, A. Tetrahedron; 57, 2001, 3069-3073, где "гало" представляет собой либо бром либо иод, или "псевдогало" представляет собой, например, трифлат или нонафлат. При R13 = водород в формуле X данное положение защищают перед реакцией сочетания и снимают защиту после реакции сочетания согласно стандартным литературным методикам со стандартными защитными группами,например, такими как 4-метилфенилсульфонильная группа или трет-бутоксикарбонильная группа. Восстановление по способу 7 проводят по стандартным, описанным в литературе способам, т.е., с применением восстановителя, подобного борану, алану или литийалюминийгидриду. Амиды формулыXI могут быть получены перегруппировкой амидов формулы IV в присутствии кислоты (например, обработкой в растворе трифторуксусной кислоты), аналогично способам, описанным в литературе (Hamel,P.; Girard, М.; Tsou, N. N.; J. Heterocyclic Chem.; 36, 1999, 643-652; Hamel, P.; Girard, Y.; Atkinson, J. G.; J.Org. Chem; 57; 1992; 2694-2699). Удаление защиты по способу 8 может быть проведено по стандартным методикам, известным специалистам в данной области, и подробно описано в издании Protective Groups in Organic Synthesis Greene,- 14010666T. W.; Wuts, P. G. M. Wiley Interscience, (1991) ISBN 0471623016. Амин с защитой может быть получен по аналогичному способу, описанному в литературе, взаимодействием соответственно замещенного сложного эфира (2-меркаптобензил)метилкарбаминовой кислоты с соответственно замещенным 4 галоиндолом или 4-псевдогалоиндолом, где "гало" представляет собой либо бром либо иод, или "псевдогало" представляет собой, например, трифлат или нонафлат согласно Schopter, H.; Schlapbach, U. Tetrahedron; 2001, 57, 3069-3073. При R13 = водород в формуле XII данное положение защищают перед реакцией сочетания и снимают защиту после реакции сочетания согласно стандартным литературным методикам со стандартными защитными группами, например, такими как 4-метилфенилсульфонильная группа или трет-бутоксикарбонильная группа. Соответственно замещенный сложный эфир (2-меркаптобензил) метилкарбаминовой кислоты может быть получен из соответственно замещенного сложного эфира (2 бромбензил)метилкарбаминовой кислоты или соответственно замещенного сложного эфира (2 иодбензил)метилкарбаминовой кислоты при взаимодействии с триалкилсилантиолом в присутствии палладиевого катализатора с последующим десилилированием с помощью фторидного донора, такого как тетрабутиламмонийфторид (Winn, M.; et al. J. Med. Chem. 2001, 44, 4393-4403). Удаление защиты по способу 9 может быть проведено как описано в способе 9. Амин с защитой может быть получен из соответственно замещенного сложного эфира (2-меркаптобензил)метилкарбаминовой кислоты и соответственно замещенного 5-галоиндола или 5-псевдогалоиндола, где "гало" представляет собой либо бром либо иод, или "псевдогало" представляет собой, например, трифлат или нонафлат, как описано в способе 9. При R13 = водород в формуле XIII данное положение защищают перед реакцией сочетания и снимают защиту после реакции сочетания согласно стандартным литературным методикам со стандартными защитными группами, например, такими как 4-метилфенилсульфонильная группа или трет-бутоксикарбонильная группа. Удаление защиты по способу 10 может быть проведено как описано в способе 9. Амин с защитой может быть получен из соответственно замещенного сложного эфира (2-меркаптобензил) метилкарбаминовой кислоты и соответственно замещенного 7-галоиндола или 7-псевдогалоиндола, где "гало" представляет собой либо бром либо иод, или "псевдогало" представляет собой, например, трифлат или нонафлат, как описано в способе 9. При R13 = водород в формуле XV данное положение защищают перед реакцией сочетания и снимают защиту после реакции сочетания согласно стандартным литературным методикам со стандартными защитными группами, например, такими как 4-метилфенилсульфонильная группа или трет-бутоксикарбонильная группа. Предлагаемое изобретение проиллюстрировано далее следующими примерами, не ограничивающими изобретение. Примеры Общие методы Аналитические данные получали на приборе РЕ Sciex API 150 ЕХ, снабженном ионным источником фотоионизации (АРРА) и Shimadzu LC-8A/SLC-1-A LC системой. Условия ЖХ (LC) (Symmetry С 18 колонка 4,6 х 30 мм с размером частиц 3,5 мкм) представляли собой линейное градиентное элюирование с элюентами А (вода, содержащая 0,05% TFA) и В (ацетонитрил, содержащий 5% воды и 0,035% TFA). Градиент (время[мин]/%В): (0,00/10,0); (4,00/100,0); (4,10/10,0); (5,00/10,0) при скорости 2 мл/мин. Чистоту определяли объединением данных УФ (254 нм) и ELS (SEDERE SEDEX 55 с Heto CBN 8-30 охлаждающей баней). Времена удерживания, Rt, выражены в минутах. Масс-спектры получали альтернативным способом сканирования, дающим информацию по молекулярной массе. Молекулярный ион, МН+, получали при низком выходном напряжении (5 В) и фрагментацию при высоком выходном напряжении (100 В). Препаративное ЖХ-МС(LS-MS)-разделение проводили на тех же приборах. Условия ЖХ (LC)(Symmetry C18 колонка 1050 мм) представляли собой линейное.градиентное элюирование с элюентами А (вода, содержащая 0,05% TFA) и В (ацетонитрил, содержащий 5% воды и 0,035% TFA): (время[мин]/%В): (0,00/20,0); (7,00/100,0); (7,10/20,0); (8,00/20,0) при скорости 5,7 мл/мин. Сбор фракций проводили МС детектированием расщепленного потока. Для колоночной хроматографии использовали силикагель формулы Kieselgel 60, 230-400 mesh ASTM. Для ионообменной хроматографии использовали(SCX, 1 г, Varian Mega Bond Elut, Chrompack cat. No. 220776). Перед использованием SCX-колонки предварительно приводили в надлежащее состояние 10% раствором уксусной кислоты в метаноле (3 мл). Получение промежуточных продуктов Пример 1. 2-(1 Н-Индол-3-илсульфанил)-N,N-диметилбензамид.Morgans, David J.; Ozer, Rachel S.; et al. J. Med. Chem. 40, 1997, 2674-2687) (12,80 r, 35,5 ммоль) растворяли в дихлорэтане (200 мл) в Ar и к раствору осторожно добавляли с перемешиванием сульфурилхлорид(2,9 мл, 4,84 г, 35,9 ммоль) в Ar. Реакционую смесь перемешивали в течение 15 мин при комнатной температуре и полученный раствор медленно (по каплям) добавляли к охлажденному льдом раствору (0 С) индола (8,4 г, 71,7 ммоль) в сухом ДМФА (180 мл) в Ar. Смесь перемешивали при 0 С в Ar в течение 2,5 ч и затем гасили добавлением воды (180 мл) и насыщенного водного NaHCO3 (150 мл). К полученной- 15010666 эмульсии добавляли этилацетат (250 мл). Органические фазы объединяли и промывали насыщенным солевым раствором (100 мл). Затем водную фазу экстрагировали этилацетатом (2100 мл) и объединенные органические фазы промывали насыщенным солевым раствором и сушили над MgSO4 и упаривали в вакууме до темно-оранжевого масла, которое кристаллизовалось при стоянии. Продукт очищали и выделяли перекристаллизацией (ацетонитрил), получая 5,53 г (26%) кристаллического продукта (т. пл. 195,6197,6 С). Из маточной жидкости выделяли дополнительно 4,45 г (21%) продукта (т. пл. 194,3-196,4 С). Следующие соединения получены аналогичным способом: 2-(4-хлор-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,2-(4-фтор-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,2-(4-фтор-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,2-(5-фтор-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,2-(5-хлор-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,N,N-диметил-2-(7-метил-1 Н-индол-3-илсульфанил)бензамид,2-(5-метокси-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,2-(6-фтор-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,2-(6-хлор-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,N,N-диметил-2-(2-метил-1 Н-индол-3-илсульфанил)бензамид,2-(6-гидрокси-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,2-(7-метокси-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,N,N-диметил-2-(4-метил-1 Н-индол-3-илсульфанил)бензамид,N,N-диметил-2-(7-нитро-1 Н-индол-3-илсульфанил)бензамид,2-(4-гидрокси-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,2-(4-циано-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,2-(6-циано-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,2-(7-хлор-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,2-(6-метокси-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,N,N-диметил-2-(1-метил-1 Н-индол-3-илсульфанил)бензамид,2-(4-метокси-1 Н-индол-3-илсульфанил)-N,N-диметилбензамид,N,N-диметил-2-(6-метил-1 Н-индол-3-илсульфанил)бензамид. Пример 2. 2-(1 Н-Индол-3-илсульфанил)-N-метилбензамид. Карбонилдиимидазол (11 ммоль) добавляли к раствору 2-(1 Н-индол-3-илсульфанил)бензойной кислоты (Hamel, P.; Girard, М.; Tsou, N. N.; J. Heterocycl. Chem.; 36, 1999, 643-652) (10 ммоль) в сухом ТГФ(200 мл) и кипятили с обратным холодильником в течение 60 мин в аргоне. К реакционной смеси медленно добавляли метиламин (1 Мв ТГФ; 40 мл) и смесь перемешивали при комнатной температуре в течение 16 ч. Смесь упаривали в вакууме и продукт очищали колоночной хроматографией на силикагеле,применяя этилацетат в качестве элюента. Следующие соединения получены аналогичным способом. 2-(5-Фтор-1 Н-индол-3-илсульфанил)-N-метилбензамид,2-(6-Фтор-1 Н-индол-3-илсульфанил)-N-метилбензамид,2-(2-Метил-1 Н-индол-3-илсульфанил)-N-метилбензамид,2-(4-Метил-1 Н-индол-3-илсульфанил)-N-метилбензамид,2-(4-Хлор-1 Н-индол-3-илсульфанил)-N-метилбензамид. Пример 3. Трет-бутиловый эфир (2-меркаптобензил)метилкарбаминовой кислоты. трет-Бутиловый эфир (2-иодбензил)метилкарбаминовой кислоты (5,0 г, 14,4 ммоль) в сухом толуоле (30 мл) помещали в два Emrys Optimizer EXP 20 мл сосуда. В каждый сосуд последовательно добавляли трис(дибензилиденацетон)дипалладий (66 мг, 0,072 ммоль), бис(2-дифенилфосфинофениловый)эфир(78 мг, 0,14 ммоль), триизопропилсилантиол (1,44 г, 7,56 ммоль) и трет-бутоксид натрия (900 мг, 9,36 ммоль). Сосуды запаивали и подвергали микроволновому нагреванию при 160 в течение 15 минут. После охлаждения смеси продукт элюировали через слой кремнезема этилацетат-гептаном (1:10), получая 5,2 г (88%) трет-бутилового эфира (2-триизопропилсиланилсульфанилбензил)метилкарбаминовой кислоты. Данный продукт растворяли в ТГФ (70 мл) и охлаждали до 0 С. Тригидрат тетрабутиламмонийфторида (4,21 г, 13,3 ммоль), растворенный в ТГФ (40 мл), добавляли по каплям при 0 С и смесь перемешивали при данной температуре в течение 15 мин. Неочищенную смесь выливали на слой силикагеля и продукт элюировали этилацетат-гептаном (1:2), получая 3,2 г (100%) трет-бутилового эфира (2 меркаптобензил)метилкарбаминовой кислоты, загрязненного следовыми количествами триизопропилсиланфторида. Пример 4. Соединение изобретения формулы I. Синтез 1. [2-(1 Н-Индол-3-илсульфанил)бензил]диметиламин. 2-(1 Н-Индол-3-илсульфанил)-N,N-диметилбензамид (1 ммоль) растворяли в сухом тетрагидрофуране (30 мл). К данной смеси добавляли 3 мл 1 М борана в тетрагидрофуране и смесь перемешивали при комнатной температуре в течение 24 ч. Добавляли метанол (5 мл) и смесь перемешивали при комнатной температуре в течение 30 мин и затем упаривали в вакууме. Смесь перерастворяли в этилацетате (100 мл)- 16010666 и промывали насыщенным раствором гидрокарбоната натрия (20 мл), сушили над безводным MgSO4 и упаривали в вакууме. Продукт кристаллизовали в виде оксалатной соли растворением в ацетоне и добавлением одного эквивалента щавелевой кислоты. Следующие соединения получены аналогичным способом и их аналитические данные приведены в таблице 1. 2. [2-(5-Циано-1 Н-индол-3-илсульфанил)бензил]диметиламин. 3. [2-(4-Фтор-1 Н-индол-3-илсульфанил)бензил]диметиламин. 4. [2-(4-Хлор-1 Н-индол-3-илсульфанил)бензил]диметиламин. 5. [2-(5-Фтор-1 Н-индол-3-илсульфанил)бензил]диметиламин. 6. [2-(5-Хлор-1 Н-индол-3-илсульфанил)бензил]диметиламин. 7. Диметил [2-(7-метил-1 Н-индол-3-илсульфанил)бензил]амин. 8. [2-(7-Метокси-1 Н-индол-3-илсульфанил)бензил]диметиламин. 9. [2-(5-Метокси-1 Н-индол-3-илсульфанил)бензил]диметиламин. 10. [2-(6-Фтор-1 Н-индол-3-илсульфанил)бензил]диметиламин. 11. [2-(6-Хлор-1 Н-индол-3-илсульфанил)бензил]диметиламин. 12. Диметил[2-(2-метил-1 Н-индол-3-илсульфанил)бензил]амин. 13. Диметил[2-(6-метил-1 Н-индол-3-илсульфанил)бензил]амин. 14. [2-(4-Циано-1 Н-индол-3-илсульфанил)бензил]диметиламин. 15. Диметил[2-(1-метил-1 Н-индол-3-илсульфанил)бензил]амин. 16. Диметил[2-(4-метил-1 Н-индол-3-илсульфанил)бензил]амин. 17. [2-(4-Гидрокси-1 Н-индол-3-илсульфанил)бензил]метиламин. 18. [2-(6-Циано-1 Н-индол-3-илсульфанил)бензил]диметиламин. 19. [2-(7-Хлор-1 Н-индол-3-илсульфанил)бензил]диметиламин. 20. [2-(6-Метокси-1 Н-индол-3-илсульфанил)бензил]диметиламин. 21. [2-(4-Метокси-1 Н-индол-3-илсульфанил)бензил]диметиламин. Пример 5. Соединения формулы I. Синтез 22. [2-(1 Н-Индол-3-илсульфанил)бензил]метиламин. 2-Метил-2,3-дигидробензоизотиазол (VI) (Hoffmann, R. W.; Goldman, S. Chem. Ber. 111, 1978, 27162725) (75 г, 0,50 ммоль растворяли в ТГФ (1 мл) и добавляли к индолу (V) (140 мг, 0,60 ммоль) в Ar. Добавляли трихлоруксусную кислоту (90 мг, 0,55 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Добавляли 2 мл 1N NaOH (водн.). Экстракция этилацетатом (210 мл) и очистка флэш-хроматографией на силикагеле (элюент: этилацетат, затем этилацетат/метанол/триэтиламин) давали 88 мг [2-(1 Н-индол-3-илсульфанил)бензил]метиламина (выход 67%). Следующие соединения получены аналогичным способом и их аналитические данные приведены в табл. 1. 23. [2-(6-Фтор-1 Н-индол-3-илсульфанил)бензил]метиламин. 24. [2-(5-Фтор-1 Н-индол-3-илсульфанил)бензил]метиламин. 25. Метил[2-(4-метил-1 Н-индол-3-илсульфанил)бензил]амин. 26. [2-(4-Хлор-1 Н-индол-3-илсульфанил)бензил]метиламин. 27. Метил[2-(2-метил-1 Н-индол-3-илсульфанил)бензил]амин. 28. [2- (5-Фтор-2-метил-1 Н-индол-3-илсульфанил)бензил]метиламин. 29. Метил[2-(5-метил-1 Н-индол-3-илсульфанил)бензил]амин. 30. Метил[2-(7-метил-1 Н-индол-3-илсульфанил)бензил]амин. 31. [2-(4-Фтор-1 Н-индол-3-илсульфанил)бензил]метиламин. 32. [2-(7-Этил-1 Н-индол-3-илсульфанил)бензил]метиламин. 33. [2-(6-Метокси-1 Н-индол-3-илсульфанил)бензил]метиламин. 34. [2-(5-Хлор-1 Н-индол-3-илсульфанил)бензил]метиламин. 35. [2-(6-Хлор-1 Н-индол-3-илсульфанил)бензил]метиламин. 36. [2-(5-Метокси-4-метил-1 Н-индол-3-илсульфанил)бензил]метиламин. 37. [2-(5,6-Диметокси-1 Н-индол-3-илсульфанил)бензил]метиламин. 38. [2-(6-Бром-1 Н-индол-3-илсульфанил)бензил]метиламин. 39. Метил[2-(6-метил-1 Н-индол-3-илсульфанил)бензил]амин. 40. [2-(4,7-Диметокси-1 Н-индол-3-илсульфанил)бензил]метиламин. 41. [2-(5-Метокси-1 Н-индол-3-илсульфанил)бензил]метиламин. 42. [2-(4-Метокси-1 Н-индол-3-илсульфанил)бензил]метиламин. 43. [2-(5-Бром-1 Н-индол-3-илсульфанил)бензил]метиламин. 44. [2-(7-Метокси-1 Н-индол-3-илсульфанил)бензил]метиламин. 45. [5-Хлор-2-(1 Н-индол-3-илсульфанил)бензил]метиламин. 46. Метил[2-(6-Трифторметил-1 Н-индол-3-илсульфанил)бензил]амин. 47. [2-(5-Гидрокси-1 Н-индол-3-илсульфанил)бензил]метиламин. 48. [2-(4-Бром-1 Н-индол-3-илсульфанил)бензил]метиламин. 49. [2-(7-Хлор-1 Н-индол-3-илсульфанил)бензил]метиламин.- 18010666 115. [4-Хлор-2-(5-метокси-4-метил-1 Н-индол-3-илсульфанил)бензил]метиламин. 116. [4-Хлор-2-(5-метокси-1 Н-индол-3-илсульфанил)бензил]метиламин. 117. [4-Хлор-2-(6-метокси-1 Н-индол-3-илсульфанил)бензил]метиламин. 118. [4-Хлор-2-(7-метокси-1 Н-индол-3-илсульфанил)бензил]метиламин. 119. [4-Хлор-2-(4-метокси-1 Н-индол-3-илсульфанил)бензил]метиламин. 120. [4-Хлор-2-(5-хлор-1 Н-индол-3-илсульфанил)бензил]метиламин. 121. [4-Хлор-2-(6-хлор-1 Н-индол-3-илсульфанил)бензил]метиламин. 122. [4-Хлор-2-(4-хлор-1 Н-индол-3-илсульфанил)бензил]метиламин. 123. [4-Хлор-2-(7-хлор-1 Н-индол-3-илсульфанил)бензил]метиламин. 124. [4-Хлор-2-(1 Н-индол-3-илсульфанил)бензил]метиламин. 125. [4-Хлор-2-(1-метил-1 Н-индол-3-илсульфанил)бензил]метиламин. 126. [4-Хлор-2-(3-метил-1 Н-индол-3-илсульфанил)бензил]метиламин. 127. [4-Хлор-2-(5-фтор-2-метил-1 Н-индол-3-илсульфанил)бензил]метиламин. 129. [2-(5-Фтор-4-метокси-1 Н-индол-3-илсульфанил)бензил]метиламин. 130. [2-(4,5-Дифтор-1 Н-индол-3-илсульфанил)бензил]метиламин. 131. [2-(4,6-Дифтор-1 Н-индол-3-илсульфанил)бензил]метиламин. 132. 3-(2-Метиламинометилфенилсульфанил)-1 Н-индол-4-ол. 134. [2-(5,6-Дифтор-1 Н-индол-3-илсульфанил)бензил]метиламин. 135. 6-Фтор-3-(2-метиламинометилфенилсульфанил)-1 Н-индол-5-ол. 136. [2-(4-Хлор-1 Н-индол-3-илсульфанил)-5-метилбензил]метиламин. Пример 6. Соединения формулы I. Синтез 102. 5-Фтор-3-(2-пиперидин-1-илметилфенилсульфанил)-1 Н-индол 6 мл конц. H2SO4 добавляли к 2,2'-дитиобензойной кислоте (20 г, 65,3 ммоль) в 150 мл метанола. Реакционную смесь кипятили с обратным холодильником в течение трех дней, охлаждали до комнатной температуры и нейтрализовали насыщенным водным NaHCO3. Метанол удаляли в вакууме. Остаток экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме, получая 17,8 г диметилового эфира 2,2'-дитиобензойной кислоты (53,2 ммоль, 82%). Сульфурилхлорид (1,20 мл, 15 ммоль) добавляли к 5,00 г диметилового эфира 2,2'-дитиобензойной кислоты (15 ммоль) в 40 мл сухого 1,2-дихлорэтана в Ar при 0 С. Реакционную смесь перемешивали 15 мин при комнатной температуре и добавляли к 4,10 г фтор-1 Н-индола (30,3 ммоль в 50 мл сухого ТГФ в Ar. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре и гасили добавлением насыщенного водного NaHCO3. Добавляли этилацетат, разделяли две фазы и органическую фазу промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме. После очистки флэшхроматографией на силикагеле выделяли 8,30 г метилового эфира 2-(5-фтор-1 Н-индол-3-илсульфанил) бензойной кислоты (27,5 ммоль, 92%). 4,15 г Метилового эфира 2-(5-фтор-1 Н-индол-3-илсульфанил) бензойной кислоты (13,8 ммоль) в 50 мл сухого ТГФ добавляли по каплям к 0,58 г LiAlH4 (15,4 ммоль) в 20 мл сухого диэтилового эфира при 0 С. Добавляли 150 мл сухого ТГФ и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. Реакцию гасили 1 мл воды и 1 мл 2 N NaOH. Реакционную смесь перемешивали в течение 1 ч, затем к ней добавляли 2,5 мл воды и продолжали перемешивание в течение одного часа. Смесь фильтровали, сушили над MgSO4 и концентрировали в вакууме, получая 3,00 г 2-(5-фтор-1 Н-индол-3-илсульфанил)фенил]метанола (11,0 ммоль, 80%). 0,275 г пТолуолсульфонилхлорида (1,44 ммоль) добавляли к 0,375 г 2-(5-фтор-1 Н-индол-3-илсульфанил)фенил] метанола (1,37 ммоль) в 5 мл сухого ТГФ при 0 С. Реакционную смесь перемешивали 2 ч при 0 С и затем добавляли к 2,75 ммоль пиперидина в 10 мл сухого ТГФ и перемешивали 16 ч при комнатной температуре. К реакционной смеси добавляли воду и этилацетат. Разделяли две фазы и органическую фазу промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме. После очистки флэш-хроматографией выделяли 5-фтор-3-(2-пиперидин-1-илметилфенилсульфанил)-1 Н-индол. Следующие соединения получены аналогичным способом и их аналитические данные приведены в табл. 1. 103. 5-Фтор-3-(2-морфолин-4-илметилфенилсульфанил)-1 Н-индол. 104. 5-Фтор-3-(2-пирролидин-1-илметилфенилсульфанил)-1 Н-индол. Пример 7. Соединения формулы I. Синтез 128. 2-(5-Фтор-1 Н-индол-3-илсульфанил)бензиламин. 4,50 г NaBH4 (119 ммоль) добавляли порциями к 7,50 г аллилбромида (62,0 ммоль)и 8,35 г 2,2'дитиобензамида (27,4 ммоль, полученный из 2,2'-дитиобензойной кислоты через хлорангидрид 2,2'бензойной кислоты) в 80 мл метанола при 0 С. Реакционную смесь перемешивали 1 ч при комнатной температуре. 50 мл 1N HCl добавляли и продолжали перемешивание 1 ч. Метанол удаляли в вакууме. Остаток экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором,сушили над MgSO4 и концентрировали в вакууме, получая 10,0 г 2-аллилсульфанилбензамида (51,7 ммоль, 94%). 2,1 г LiAlH4 (55 ммоль) добавляли к 6,0 г 2-аллилсульфанилбензамида (31 ммоль) в 50 мл сухого ТГФ при 0 С. Реакционную смесь перемешивали в течение 16 ч при комнатной температуре. Реакцию гасили 4 мл воды и 3 мл 2 N NaOH. Реакционную смесь перемешивали в течение 1 ч, затем к ней(7,81 ммоль) и каталитическому количеству N,N-диметил-4-аминопиридина в 20 мл ТГФ. Реакционную смесь перемешивали 15 мин при комнатной температуре. 10 мл 20% лимонной кислоты добавляли и реакционную смесь перемешивали в течение 30 мин. Реакционную смесь экстрагировали этилацетатом,разделяли две фазы и органическую фазу промывали насыщенным солевым раствором, сушили надMgSO4 и концентрировали в вакууме, получая трет-бутиловый эфир (2-аллилсульфанилбензил) карбаминовой кислоты с количественным выходом. 0,70 г NaIO4 (3,3 ммоль) в 20 мл воды добавляли к 0,75 г трет-бугилового эфира (2-аллилсульфанилбензил)карбаминовой кислоты (2,7 ммоль) в 20 мл метанола и перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь фильтровали и метанол удаляли в вакууме. Остаток экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме. Остаток перерастворяли в 5 мл ТГФ и добавляли к 0,50 г фтор-1 Н-индола (3,7 ммоль) и 0,65 г трихлоруксусной кислоты (4,0 ммоль) в 5 мл ТГФ и перемешивали в течение 16 ч при 50 С. Добавляли насыщенный водный NaHCO3 и этилацетат,разделяли две фазы и органическую фазу промывали насыщенным солевым раствором, сушили надMgSO4 и концентрировали в вакууме. Остаток очищали флэш-хроматографией и выделяли 0,157 г третбутилового эфира [2-(5-фтор-1 Н-индол-3-илсульфанил)бензил]карбаминовой кислоты (0,42 ммоль, 16%) после перекристаллизации из смеси этилацетат/гептан. 8 мл диэтилового эфира, насыщенного HCl, добавляли к 0,157 г трет-бутилового эфира [2-(5-фтор-1 Н-индол-3-илсульфанил)бензил]карбаминовой кислоты (0,42 ммоль) в 8 мл метанола и перемешивали 16 ч. Реакционную смесь нейтализовали 2 N NaOH и экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме, получая 0,112 г 2-(5-фтор-1 Н-индол-3-илсульфанил)бензиламина (98%). Следующее соединение получено аналогичным способом и его аналитические данные приведены в табл. 1. 133. 2-(6-Фтор-1 Н-индол-3-илсульфанил)бензиламин. Пример 8. Соединения формулы I. Синтез [2-(1 Н-индол-5-илсульфанил)бензил]метиламина. трет-Бутиловый эфир (2-меркаптобензил)метилкарбаминовой кислоты (1,85 г, 7,30 ммоль) в сухом толуоле (15 мл) помещали в Emrys Optimizer EXP 20 мл сосуд. В сосуд добавляли трис(дибензилиденацетон)дипалладий (334 мг, 0,37 ммоль), бис(2-дифенилфосфинофениловый)эфир (197 мг, 0,37 ммоль),трег-бутил-5-броминдол-1-карбоксилат (2,38 г, 8,03 ммоль) и трет-бутоксид натрия (860 мг, 7,67 ммоль). Реакционный сосуд запаивали и подвергали микроволновому нагреванию при 160 С в течение 15 мин. После охлаждения смесь выливали на слой кремнезема и продукт элюировали этилацетат-гептаном (1:4). Выделяли 0,67 г (20%) трет-бутилового эфира 5-2-[(трет-бутоксикарбонилметиламино)метил]фенилсульфанилиндол-1-карбоновой кислоты и использовали его на следующей стадии без дополнительной очистки. Трет-бутиловый эфир 5-2-[(трет-бутоксикарбонилметиламино)метил]фенилсульфанилиндол 1-карбоновой кислоты (0,67 г, 1,43 ммоль) в метаноле (15 мл) и диэтиловый эфир, насыщенный хлористоводородной кислотой (15 мл), перемешивали при комнатной температуре в течение 1 ч и концентрировали в вакууме. К остатку добавляли лед/воду и 28% водный NaOH до рН 9. Водную фракцию экстрагировали этилацетатом (315 мл). Объединенные органические фракции сушили над MgSO4 и концентрировали в вакууме. Продукт очищали хроматографией на силикагеле при элюировании смесью этилацетат-триэтиламин (100:4), затем этилацетат-этанол-триэтиламин (100:5:5). После упаривания летучих компонентов выделяли 40 мг (10%) [2-(1 Н-индол-5-илсульфанил)бензил]метиламина. Следующие соединения получены аналогичным способом:- 20010666 Измеренная молекулярная масса, измеренное ВЭЖХ время удерживания Пример 9. Тест на связывание с транспортером. Измерение захвата [3 Н]-5-НТ в кортикальные синаптосомы крысы. Головные мозги от самцов крыс Wistar (125-225 г) полностью, за исключением мозжечка, гомогенизируют в 0,32 М сахарозе с добавкой 1 мМ ниаламида гомогенизатором из стекла/тефлона. Гомогенат центрифугируют при 600g в течение 10 мин при 4 С. Осадок отбрасывают и супернатант центрифугируют при 20000g в течение 55 мин. Конечный осадок гомогенизируют (20 с) в буфере для данного анализа (0,5 мг оригинальная ткань/ячейка). Тестируемые соединения (или буфер) и 10 нМ [3 Н]-5-НТ добавляют в 96-луночные планшеты и кратковременно встряхивают. Композиция буфера для анализа: 123 мМ NaCl,. 4,82 мМ KCl, 0,973 мМ CaCl2, 1,12 мМ MgSO4, 12,66 мМ Na2HPO4, 2,97 мМ NaH2PO4,0,162 мМ EDTA, 10 мМ глюкоза и 1 мМ аскорбиновая кислота. Буфер насыщают 95% O2/5% CO2 в течение 10 мин при 37 С и рН устанавливается 7,4. Инкубацию начинают добавлением ткани до конечного объема для анализа 0,2 мл. После 15 мин инкубации с радиолигандом при 37 С образцы фильтруют непосредственно через Unifilter GF/C стеклянно-тканевые фильтры (пропитанные в течение 1 ч 0,1% полиэтиленимином) в вакууме и незамедлительно промывают 30,2 мл буфера для анализа. Неспецифический захват определяют, используя циталопрам (10 мкМ конечная концентрация). Циталопрам включают как эталон во все эксперименты для кривой доза-ответ. Измерение захвата [3 Н]-норадреналина в кортикальные синаптосомы крысы. Сырую кору головного мозга от самцов крыс Wistar (125-220 г) гомогенизируют в 0,4 М сахарозе гомогенизатором из стекла/тефлона. Гомогенат центрифугируют при 600g в течение 10 мин при 4 С. Осадок отбрасывают и супернатант центрифугируют при 20000g в течение 55 мин. Конечный осадок гомогенизируют (20 сек) в буфере для данного анализа (6 мг оригинальная ткань/мл = 4 мг/ячейка). Тестируемые соединения (или буфер) и 10 нМ [3 Н]-норадреналин добавляют в обширные 96-луночные планшеты и кратковременно встряхивают. Композиция буфера для анализа: 123 мМ NaCl, 4,82 мМ KCl,0,973 мМ CaCl2, 1,12 мМ MgSO4, 12,66 мМ Na2HPO4, 2,97 мМ NaH2PO4, 0,162 мМ EDTA, 10 мМ глюкоза и 1 мМ аскорбиновая кислота. Буфер насыщают 95% O2/5% CO2 в течение 10 мин при 37 С и рН устанавливается 7,4. Инкубацию начинают добавлением ткани до конечного объема для анализа 1 мл. После 15 мин инкубации с радиолигандом при 37 С образцы фильтруют непосредственно через Unifilter GF/C стеклянно-тканевые фильтры (пропитанные в течение 1 ч 0,1% полиэтиленимином) в вакууме и незамедлительно промывают 31 мл буфера для анализа. Неспецифический захват определяют, используя талсупрам (10 мкМ конечная концентрация). Дулоксетин включают как эталон во все эксперименты для кривой доза-ответ.- 22010666 Результаты опытов показали, что испытанные соединения изобретения ингибируют обратный захват серотонина и норадренилина при IC50 ниже 200 нМ. Измерение захвата [3 Н]-допамина в синаптосомы крысы Приготовление ткани: самцов крыс Wistar (125-250 г) умерщвляют обезглавливанием, быстро изымают полосатое тело и помещают его в 40 об. (мас./об.) охлаждаемой льдом 0,40 М сахарозы. Ткань интенсивно гомогенизируют (стеклянно-тефлоновый гомогенизатор), получают Р 2 фракцию центрифугированием (1000 g, 10 мин и 40000 g 20 мин, 4 С) и суспендируют в 560 объемах модифицированного Кребс-Рингер-фосфатного буфера, рН 7,4. Ткань 0,25 мг/ячейка (140 мкл) (оригинальную ткань) смешивают с испытуемой суспензией. Через 5 мин предварительной инкубации добавляют 12,5 нМ 3 Н-допамина и смесь инкубируют в течение 5 мин при комнатной температуре. Инкубацию прерывают фильтрованием образцов в вакууме через Whatman GF/C фильтры с промыванием буфером, 1 мл. Фильтры сушат и добавляют соответствующую сцинтилляционную жидкость(Optiphase Supermix). После хранения в темноте в течение 2 ч определяют степень радиоактивности с помощью жидкого сцинтиллятора. Захват получают вычитанием неспецифического связывания и пассивный транспорт измеряют в присутствии 100 мкМ бензтропина. Для определения ингибирования захвата используют десять концентраций лекарственных средств, различающихся на 6 порядков. 3HyttelLarsen, Acta Pharmacol. Tox. 1985, 56, suppl. 1, 146-153. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы I где атом серы присоединен к индолу через любой циклический углерод индола и гдеR1-R2 независимо выбраны из водорода, C1-6 алкила, C3-8 циклоалкила и C3-8 циклоалкил-C1-6 алкила или R1 и R2 вместе с азотом образуют 4-7-членный цикл, не содержащий или содержащий одну двойную связь, причем необязательно указанный цикл в дополнение к указанному азоту содержит еще один гетероатом, выбранный из азота, кислорода и серы;R3-R12 независимо выбраны из водорода, галогена, циано, нитро, C1-6 алкила, C3-8 циклоалкила, C38 циклоалкил-C1-6 алкила, амино, C1-6 алкиламино, ди(C1-6 алкил)амино, C1-6 алкилкарбонила, аминокарбонила, C1-6 алкиламинокарбонила, ди(C1-6 алкил)аминокарбонила, гидрокси, C1-6 алкилокси, C1-6-алкилтио,галогенС 1-6 алкила, галогенС 1-6 алкилсульфонила, галогенС 1-6 алкилсульфанила и C1-6 алкилсульфонила; иR13 выбран из водорода и C1-6 алкила; при условии, что R10 выбран из галогена, циано, C1-6 алкила, гидрокси, C1-6 алкокси и галоген-C16 алкила; в виде его свободного основания или его соли; при следующих условиях: если атом серы присоединен через атом номер 2 индола, R7 отсутствует; если атом серы присоединен через атом номер 3 индола, R12 отсутствует; если атом серы присоединен через атом номер 4 индола, R8 отсутствует; если атом серы присоединен через атом номер 5 индсла, R9 отсутствует; и если атом серы присоединен через атом номер 7 индола, R11 отсутствует. 2. Соединение по п.1, где R1 и R2 независимо выбраны из водорода и C1-6 алкила; или R1 и R2 вместе с азотом образуют 4-7-членный цикл, не содержащий или содержащий одну двойную связь, причем необязательно данный цикл в дополнение к азоту содержит еще один гетероатом, выбранный из азота, кислорода и серы. 3. Соединение по любому из пп.1 и 2, где R3-R12 независимо выбраны из водорода, галогена, циано,C1-6 алкила, гидрокси, C1-6 алкилокси и галогенС 1-6 алкила. 4. Соединение по любому из пп.1-3, где R3-R6 независимо выбраны из водорода, галогена и C16 алкила. 5. Соединение по любому из пп.1-4, где R7-R12 независимо выбраны из водорода, галогена, циано,C1-6 алкила, гидрокси, C1-6 алкилокси и галогенС 1-6 алкила. 6. Соединение по любому из пп.1-5, причем указанное соединение выбрано из следующих соединений: в виде его свободного основания или его соли. 7. Фармацевтическая композиция, содержащая соединение по любому из пп.1-6 и по меньшей мере один фармацевтически приемлемый носитель или разбавитель. 8. Применение соединения по любому из пп.1-6 для приготовления лекарственного средства для лечения заболевания или расстройства, где ингибитор совместного обратного захвата серотонина, норадреналина и допамина является полезным. 9. Применение по п.8, где указанное расстройство или заболевание представляет собой аффективное расстройство. 10. Применение по п.9, где аффективное расстройство представляет собой депрессивное расстройство. 11. Применение по п.10, где указанное депрессивное расстройство представляет собой депрессивный эпизод тяжелой степени, послеродовую депрессию, дистимию или депрессию, связанную с биполярным расстройством, болезнью Альцгеймера, психозом или болезнью Паркинсона. 12. Применение по п.9, где аффективное расстройство представляет собой тревожное расстройство. 13. Применение по п.12, где указанное тревожное расстройство представляет собой генерализованное тревожное расстройство, социальное тревожное расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, паническое расстройство, приступы паники, специфические фобии, социальную фобия или агорафобию. 14. Применение по п.9, где указанное расстройство или заболевание представляет собой болевое расстройство. 15. Применение по п.14, где указанное болевое расстройство представляет собой синдром фибро- 24010666 миалгии, общую боль, боль в спине, плечевую боль, головную боль или боль при пробуждении и в течение суточных активностей. 16. Применение по п.9, где указанное расстройство или заболевание представляет собой синдром дефицита внимания и гиперактивности. 17. Применение по п.9, где указанное расстройство или заболевание представляет собой стрессовое недержание мочи.
МПК / Метки
МПК: C07D 401/12, A61K 31/404, A61P 29/00, C07D 209/30
Метки: производные, качестве, 2-(1н-индолилсульфанил)бензиламина
Код ссылки
<a href="https://eas.patents.su/26-10666-proizvodnye-2-1n-indolilsulfanilbenzilamina-v-kachestve-ssri.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-(1н-индолилсульфанил)бензиламина в качестве ssri</a>
Предыдущий патент: N-замещённые пиразолилкарбоксанилиды
Следующий патент: Способ и система для определения многофазных потоков флюидов из скважин
Случайный патент: Циклические мостиковые простые эфиры в качестве ингибиторов dgat1












