Фармацевтически приемлемые тельца, несущие фосфат глицерина
Формула / Реферат
1. Фармацевтическая композиция в форме разовых дозировок для введения пациенту-млекопитающему, содержащая фармацевтически приемлемые тельца и фармацевтически приемлемый носитель, характеризующаяся тем, что по меньшей мере часть телец имеет размер в интервале приблизительно от 20 нм до 500 мкм, и при этом поверхности указанных телец содержат фосфоглицеридные группы или группы, способные к преобразованию в фосфоглицеридные группы, а указанная разовая дозировка содержит от приблизительно 500 до приблизительно 2,5_109 телец.
2. Фармацевтическая композиция по п.1, отличающаяся тем, что тельца являются липосомами.
3. Фармацевтическая композиция по п.1 или 2, отличающаяся тем, что композиция существенно свободна от нелипидных фармацевтически активных форм.
4. Фармацевтическая композиция по п.3, отличающаяся тем, что композиция свободна от нелипидных фармацевтически активных форм.
5. Фармацевтическая композиция по любому из пп.2-4, отличающаяся тем, что липосомы содержат от приблизительно 60 до 100% фосфатидилглицерина, причём его головные фосфоглицеридные группы представлены на внешних поверхностях липосом.
6. Фармацевтическая композиция по п.5, отличающаяся тем, что липосомы содержат от 70 до 90% фосфатидилглицерина.
7. Фармацевтическая композиция по п.5 или 6, отличающаяся тем, что вся остальная часть липосомы является фосфатидилхолином.
8. Фармацевтическая композиция по п.1, отличающаяся тем, что указанные тельца содержат поверхностные группы, которые специфически связываются с рецепторами на клетках иммунной системы млекопитающего, специфически предназначенных для связывания фосфоглицеридных групп.
9. Фармацевтическая композиция по любому из предшествующих пунктов, отличающаяся тем, что единичная дозировка содержит от приблизительно 10000 до приблизительно 50000000 телец.
10. Применение композиции, содержащей фармацевтически приемлемые биосовместимые тельца, имеющие размер в интервале от приблизительно 20 нм до 500 мкм и имеющие множество экспрессированных или способных к экспрессии на поверхности фосфоглицеридных активных групп, причём указанная композиция существенно свободна от фармацевтически активных нелипидных форм, в производстве лекарственного средства для лечения или профилактики расстройства, выбранного из опосредованного функцией Т-клеток расстройства, воспалительного расстройства и иммунного расстройства, характеризуемого неадекватной экспрессией цитокинов.
11. Применение по п.10, отличающееся тем, что на поверхности телец экспрессированы фосфоглицеридные группы.
12. Применение по п.10 или 11, отличающееся тем, что фосфоглицеридные активные группы составляют от 60 до 100% активных групп на тельцах.
13. Применение по любому из пп.10-12, отличающееся тем, что фосфоглицеридные активные группы являются головными группами фосфатидилглицериновых (ФГ) лигандов.
14. Применение по любому из пп.10-13, отличающееся тем, что тельцами являются липосомы.
15. Применение по п.14, отличающееся тем, что липосомы на 50-100 мас.% состоят из фосфатидилглицерина.
16. Применение по п.14 или 15, отличающееся тем, что липосомы на 65-90 мас.% состоят из фосфатидилглицерина.
17. Применение по любому из пп.12-16, отличающееся тем, что липосомы имеют диаметр от приблизительно 20 до приблизительно 1000 нм.
18. Применение по любому из пп.10-17, отличающееся тем, что форма разовой дозы указанной композиции содержит от приблизительно 500 до приблизительно 2,5_109 телец.
19. Применение по п.18, отличающееся тем, что форма разовой дозы указанной композиции содержит от приблизительно 10 000 до приблизительно 50 миллионов телец.
20. Применение по любому из пп.10-19, отличающееся тем, что расстройство представляет собой опосредованное функцией Т-клеток расстройство, выбранное из язв и аутоиммунных расстройств.
21. Применение по п.20, отличающееся тем, что расстройство представляет собой аутоиммунное расстройство, выбранное из склеродермии, псориаза и ревматоидного артрита.
22. Применение по любому из пп.10-19, отличающееся тем, что расстройство представляет собой воспалительную аллергическую реакцию.
23. Применение по п.22, отличающееся тем, что расстройство представляет собой контактную гиперчувствительность.
24. Применение по п.23, отличающееся тем, что расстройство представляет собой аллергическую реакцию замедленного типа.
25. Применение композиции, содержащей фармацевтически приемлемые биосовместимые тельца, имеющие размер в интервале от приблизительно 20 нм до приблизительно 500 мкм и несущие на себе активные группы, представляющие собой, в основном, фосфоглицеридные группы или группы, способные к превращению в фосфоглицеридные группы, причём указанная композиция существенно свободна от фармацевтически активных нелипидных форм, в производстве лекарственного средства для лечения или профилактики расстройства, связанного с дисфункцией эндотелия, выбранного из болезни закупорки периферических артерий, застойной сердечной недостаточности, желудочковой экстрасистолии, смерти от внезапной остановки сердца, удара, инфаркта миокарда, стенокардии, гипертензии, вазоспастического расстройства, ишемического повреждения и ишемического повреждения вследствие повторной перфузии.
26. Применение по любому из пп.10-19, отличающееся тем, что оно направлено на производство лекарственного средства для лечения или профилактики расстройства, в котором участвует неадекватная экспрессия цитокинов.
27. Применение по п.26, отличающееся тем, что расстройство представляет собой нейродегенеративное заболевание.
28. Применение по п.27, отличающееся тем, что нейродегенеративное заболевание выбрано из синдрома Дауна, болезни Альцгеймера, болезни Паркинсона, старческого слабоумия, депрессии, болезни Хантингтона, заболеваний периферической нервной системы, синдрома Гийена-Барре, заболеваний спинного мозга, заболеваний, связанных с невропатологией суставов, хронических заболеваний с воспалительной демиелинизацией, мононевропатии, полиневропатии, симметричной периферической сенсорной невропатии, расстройств нервно-мышечных соединений, миастений и бокового амиотрофического склероза (БАС).
29. Применение по п.28, отличающееся тем, что нейродегенеративное заболевание представляет собой болезнь Альцгеймера, болезнь Паркинсона или БАС.
30. Применение композиции в форме разовых дозировок, содержащей фармацевтически приемлемые биосовместимые тельца, имеющие размер в интервале от приблизительно 20 нм до приблизительно 500 мкм, в количестве от приблизительно 500 до приблизительно 2,5_109 телец, причём указанные тельца имеют на своей поверхности активные группы, представляющие собой фосфоглицеридные группы или группы, способные к превращению в фосфоглицеридные группы, и при этом указанная композиция существенно свободна от фармацевтически активных нелипидных форм, в производстве лекарственного средства для лечения или профилактики атеросклероза.
31. Применение по п.30, отличающееся тем, что тельца представляют собой содержащие фосфатидилглицерин липосомы.
32. Применение по п.31, отличающееся тем, что липосомы на 50-90% состоят из фосфатидилглицерина.
33. Композиция, способная вызывать у млекопитающего противовоспалительную реакцию in vivo, характеризующаяся тем, что указанная композиция содержит фармацевтически приемлемые липосомы, имеющие размер от приблизительно 20 нм до приблизительно 500 мкм, причём липосомы содержат по массе от 50 до 90% фосфатидилглицерина с его фосфоглицеридными активными группами, расположенными на их внешней стороне, и при этом липосомы существенно свободны от нелипидных фармацевтически активных форм.
34. Композиция по п.33, отличающаяся тем, что липосомы содержат по меньшей мере 60 мас.% фосфатидилглицерина.
35. Композиция по п.34, отличающаяся тем, что липосомы содержат приблизительно 70-90% из фосфатидилглицерина.
36. Композиция по любому из пп.33-35, отличающаяся тем, что остальная часть липосомы представляет сосющ неактивный сокомпонент.
37. Композиция по п.36, отличающаяся тем, что неактивный сокомпонент представляет собой фосфатидилхолин.
38. Композиция по любому из пп.33-37, отличающаяся тем, что указанная композиция свободна от нелипидных фармацевтически активных форм.
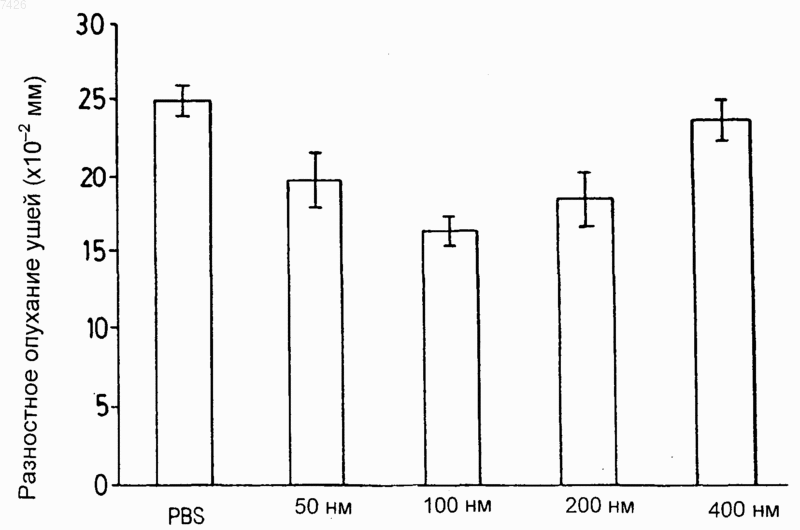
39. Композиция по любому из предшествующих пунктов, отличающаяся тем, что липосомы имеют размер приблизительно от 50 до 500 нм.
40. Композиция по п.39, отличающаяся тем, что липосомы имеют размер приблизительно от 80 до 120 нм.
41. Композиция по любому из пп.33-40, отличающаяся тем, что содержит смесь указанных содержащих фосфатидилглицерин (ФГ) липосом с неактивными липосомами и/или липосомами, состоящими из фосфолипидов, действующих по другому механизму, причём ФГ липосомы составляют по меньшей мере 10% от всей смеси.
Текст
007426 Область техники Настоящее изобретение относится к трхмерным синтетическим и полусинтетическим композициям, имеющим биологическую активность, и к их применениям для лечения и/или профилактики различных расстройств у пациентов-млекопитающих. Более конкретно оно относится к способам приготовления и применения синтетических и полусинтетических телец, которые после введения в организм пациента вызывают полезные противовоспалительные, органо-защищающие и иммуно-регуляторные эффекты. Изобретение относится также к способам лечения и к композициям для облегчения воспалительных и аутоиммунных заболеваний и симптомов. Предшествующий уровень техники Специализированные антиген-предъявляющие клетки (АПК), в том числе дендритные клетки (ДК) и макрофаги (МФ), активно захватывают и обрабатывают антигены (Аг), разрушают обломки клеток и удаляют инфекционные организмы и погибшие клетки, в том числе остатки погибших клеток. В ходе этого процесса АПК могут стимулировать продукцию либо провоспалительных цитокинов воспалительного пути Th1 (IL-12, IL-1, IFN-, TNF- и т.д.) либо регуляторных цитокинов пути Th2/Th3 (таких какIL-10, TGF-, IL-4 и т.д.), причм доминирующий ответ зависит от природы антигена (Аг) или подвергающегося фагоцитозу материала и от уровня созревания/активации АПК. АПК удаляют обломки клеток, некоторые из которых являются обрывками клеточных мембран организма, некоторые ведут происхождение от бактериальных и паразитных инфицирующих и от сосуществующих организмов, таких как бактерии кишечника. Некоторые из этих обломков клеток инициируют провоспалительную реакцию (ответ), а некоторые инициируют защитную и противовоспалительную реакцию. Нормально функционирующая иммунная система способна отличать антигены чужеродных внедрившихся организмов (чужие) от тканей и обломков, происходящих от собственных (своих), мобилизуя иммунный ответ только против чужеродных антигенов. Если иммунная система пациента утрачивает способность отличать своего от чужого, возникают аутоиммунные расстройства. Сущность изобретения Настоящее изобретение основано на открытии того, что фармацевтически приемлемые тельца, такие как липосомы, гранулы или подобные частицы, содержащие фосфоглицеридные группы, при введении пациенту-млекопитающему будут обладать противовоспалительным действием и вследствие этого могут быть использованы для лечения многих заболеваний. Эти тельца могут дополнительно содержать в качестве минорного компонента неактивную составную часть и/или составную часть, активность которой осуществляется по другому механизму. В предпочтительном варианте осуществления изобретение направлено на имеющую отношение к данной проблеме композицию, способную вызывать у млекопитающего противовоспалительный ответ invivo, причм указанная композиция содержит фармацевтически приемлемые тельца размером от приблизительно 20 нанометров (нм) до 500 микрометров (мкм), несущие множество фосфоглицеридных групп или групп, которые могут быть превращены в такие группы. Предпочтительно, чтобы тельца были, по существу, свободны от нелипидных фармацевтически активных компонентов. Предпочтительно, чтобы фосфоглицеридные группы составляли 60-100% активных групп телец. Полагают, что после введения млекопитающему тельца взаимодействуют с иммунной системой при посредстве фосфоглицеридных групп. В результате такое введение вызывает противовоспалительную реакцию. В другом варианте осуществления данное изобретение направлено на трхмерные синтетические или полусинтетические тельца, иначе называемые здесь фармацевтически приемлемыми тельцами,имеющие размер в интервале от 20 нм до 500 мкм и модифицированные таким образом, чтобы они содержали в качестве основного компонента по меньшей мере один вызывающий противовоспалительную реакцию лиганд, причм указанный лиганд имеет фосфоглицеридные группы. Ещ в одном примере осуществления данное изобретение направлено на трхмерные синтетические или полусинтетические тельца, иначе называемые здесь фармацевтически приемлемыми тельцами,имеющие размер в интервале от 20 нм до 500 мкм и имеющие фосфоглицеридные группы на их поверхности. В другом примере осуществления данное изобретение направлено на способ лечения опосредованного функцией Т-клеток расстройства, включающий введение пациенту-млекопитающему эффективного количества фармацевтически приемлемых телец, несущих эффективное число фосфоглицеридных групп,чтобы ингибировать и/или уменьшить развитие опосредованного функцией Т-клеток расстройства. Далее изобретение направлено на способ лечения воспалительного расстройства, включающий введение пациенту эффективного количества фармацевтически приемлемых телец, несущих эффективное число фосфоглицеридных групп, чтобы ингибировать и/или уменьшить развитие воспалительного расстройства. Ещ одна форма осуществления настоящего изобретения представляет собой способ лечения расстройства функции эндотелия, включающий введение пациенту-млекопитающему эффективного количе-1 007426 ства фармацевтически приемлемых телец, несущих эффективное число фосфоглицеридных групп, чтобы ингибировать и/или уменьшить развитие расстройства функции эндотелия. Другая форма осуществления представляет собой способ лечения иммунного расстройства, характеризуемого неадекватной экспрессией цитокинов, включающий введение пациенту-млекопитающему эффективного количества фармацевтически приемлемых телец, несущих эффективное число фосфоглицеридных групп, чтобы ингибировать и/или уменьшить развитие иммунного расстройства. Далее настоящее изобретение направлено на способ лечения или профилактики сердечного расстройства у млекопитающих, наличие которого или предрасположенность к которому определяются по наличию на электрокардиограмме пациента пролонгированного интервала QT-c, причм этот способ включает введение пациенту-млекопитающему, страдающему от такого сердечного расстройства или предрасположенного к нему, фармацевтической композиции, содержащей фармацевтически приемлемые биосовместимые синтетические или полусинтетические тельца, иначе называемые здесь фармацевтически приемлемыми тельцами, и фармацевтически приемлемый носитель, при этом, по меньшей мере,часть указанных телец имеет размер от приблизительно 20 нм до 500 мкм, а поверхности указанных телец модифицированы так, чтобы они несли в качестве основного компонента по меньшей мере одну обладающую противовоспалительным действием группу, причм указанной группой является фосфоглицеридная группа. Другим вариантом осуществления изобретения является фармацевтическая композиция, в форме разовых доз, для введения пациенту-млекопитающему, содержащая фармацевтически приемлемые тельца и фармацевтически приемлемый носитель, причм, по меньшей мере, часть указанных телец имеет размер от приблизительно 20 нм до 500 мкм, а поверхности указанных телец содержат фосфоглицеридные группы или группы, которые можно преобразовать в фосфоглицеридные группы, и при этом указанная разовая доза содержит от приблизительно 500 до приблизительно 2,5x109 телец. Еще один вариант осуществления настоящего изобретения - это фармацевтическая композиция, содержащая фармацевтически приемлемые биосовместимые синтетические или полусинтетические тельца(иначе называемые здесь фармацевтически приемлемыми тельцами) и фармацевтически приемлемый носитель, причм, по меньшей мере, часть указанных телец имеет размер от приблизительно 20 нм до 500 мкм, а поверхности указанных телец модифицированы так, чтобы они несли в качестве основного компонента по меньшей мере одну обладающую противовоспалительным действием группу, и при этом указанной группой является фосфоглицеридная группа. Ещ одна форма осуществления настоящего изобретения - это фармацевтическая композиция, содержащая фармацевтически приемлемые биосовместимые синтетические или полусинтетические тельца(иначе называемые здесь фармацевтически приемлемыми тельцами) и фармацевтически приемлемый носитель, причм, по меньшей мере, часть указанных телец имеет размер от приблизительно 20 нм до 500 мкм и содержит кардиолипин. По усмотрению, описанные выше тельца могут дополнительно содержать в качестве составной части неактивные поверхностные группы и/или являющиеся составной частью поверхностные группы, проявляющие активность по другому механизму, например, фосфатидилсерин. (См., например, Fadok и др. Международная публикация WO 01/66785). В другом варианте осуществления настоящее изобретение направлено на лиофилизованные или высушенные в замороженном состоянии фармацевтически приемлемые тельца, несущие фосфоглицеридные группы или группы, которые можно превратить в фосфоглицеридные группы, и комплекты, содержащие лиофилизованные или высушенные в замороженном состоянии фармацевтически приемлемые тельца, несущие фосфоглицеридные группы или группы, которые можно превратить в фосфоглицеридные группы, и фармацевтически приемлемый носитель. В другом аспекте данное изобретение направлено на способ лечения опосредованного функцией Т-клеток расстройства, включающий введение пациенту-млекопитающему, страдающему опосредованным функцией Т-клеток расстройством или подверженному риску иметь такое расстройство, эффективного количества композиции, содержащей фармацевтически приемлемые тельца, имеющие размер от приблизительно 20 нм до приблизительно 500 мкм, содержащие на своей поверхности множество фосфоглицеридных групп или групп, которые можно превратить в фосфоглицеридные группы, так что в результате введения развитие опосредованного функцией Т-клеток расстройства ингибируется и/или ослабляется. Ещ один вариант осуществления настоящего изобретения направлен на способ лечения расстройства функции эндотелия, включающий введение пациенту-млекопитающему, страдающему расстройством функции эндотелия или подверженному риску иметь такое расстройство, эффективного количества композиции, содержащей фармацевтически приемлемые тельца, имеющие размер от приблизительно 20 нм до приблизительно 500 мкм, содержащие на своей поверхности множество фосфоглицеридных групп или групп, которые можно превратить в фосфоглицеридные группы, так что в результате введения развитие расстройства функции эндотелия ингибируется и/или ослабляется. Другой вариант осуществления настоящего изобретения направлен на способ лечения иммунного расстройства у пациента-млекопитающего, страдающего иммунным расстройством или подверженного-2 007426 риску иметь такое расстройство, включающий введение такому пациенту-млекопитающему эффективного количества композиции, содержащей фармацевтически приемлемые тельца, имеющие размер от приблизительно 20 нм до приблизительно 500 мкм, содержащие на своей поверхности множество фосфоглицеридных групп или групп, которые можно превратить в фосфоглицеридные группы, так что в результате введения развитие иммунного расстройства ингибируется и/или ослабляется. Настоящее изобретение может быть также рассмотрено в ином аспекте, как использование рецепторов на клетках иммунной системы млекопитающих-например, макрофагах, которые специфически связываются с фосфоглицеридными группами. Изобретение охватывает тельца, содержащие лиганды и группы, которые будут связываться с такими рецепторами и, как следствие, вызывать противовоспалительную реакцию. Поэтому настоящее изобретение может быть определено как тельца, содержащие лиганды или их активные группы, которые конкурируют за связывание или захват экспрессирующих фосфоглицериды телец, как описано здесь для антиген-предъявляющих клеток. Специалист в данной области легко может определить, является ли конкретное тельце таким, которое будет так конкурировать, с помощью простых проверочных опытов. Например, тельца можно испытать с помощью легко доступной линии моноцитных клеток, таких как клетки U937. В первом эксперименте клетки U937 инкубируют только с флуоресцентно мечеными фосфоглицеридными липосомами, а в других экспериментах клеткиU937 инкубируют в присутствии и флуоресцентно меченых фосфоглицеридных липосом, и различных количеств испытываемого соединения. Если связывание флуоресцентно меченых липосом в этих других экспериментах снижается по сравнению со связыванием в первом эксперименте, то испытываемое соединение является конкурирующим за специфический рецептор и является соединением, попадающим в объем настоящего изобретения. Краткое описание графических материалов Фиг. 1 дат представление в виде гистограммы результатов приведнных ниже в примере 1 опытов по контактной гиперчувствительности у мышей (КГЧ, модель с опосредованным Т-клетками острым воспалением) с применением липосом в соответствии с предпочтительным осуществлением изобретения,в сравнении с другими липосомами и контролями. Фиг. 2 дат подобное графическое представление, показывающее применение липосом с различным содержанием фосфатидил-глицерина (ФГ) в мышиной модели КГЧ; в приведнном ниже примере 2. Фиг. 3 дат подобное графическое представление результатов приведнного ниже примера 3, где в мышиной модели КГЧ были применены различные концентрации липосом с 75% ФГ. Фиг. 4 дат подобное графическое представление результатов приведнного ниже примера 4, где в мышиной модели КГЧ были применены различные концентрации липосом с 100% ФГ. Фиг. 5 дат подобное графическое представление результатов приведнного ниже примера 5, где в мышиной модели КГЧ были применены липосомы различного размера. Фиг. 6 дат подобное графическое представление результатов приведнного ниже примера 6, где была применена мышиная модель аллергической реакции замедленного типа (АРЗТ, модель опосредованного Т-клетками хронического воспаления). Фиг. 7 дат подобное графическое представление результатов приведнного ниже примера 7, где в мышиной модели АРЗТ были применены кардиолипиновые липосомы. Фиг. 8 дат подобное графическое представление результатов приведнного ниже примера 8, где кардиолипиновые липосомы были применены в мышиной модели КГЧ. Фиг. 9 показывает изменение (в процентах) наклона возбуждаемого постсинаптического потенциала у контрольных и обработанных мышей, что указывает на эффект длительной потенциации (ДП) (пример 9). На фиг. 10 данные, приведнные на фиг. 9 (приведнный ниже пример 9), представлены в формате гистограммы. Фиг. 11 показывает различия в концентрации антивоспалительного цитокина IL-4 в гиппокампе контрольных и опытных мышей (приведнный ниже пример 10). Фиг. 12 показывает различия в концентрации провоспалительного цитокина IL-1 в суспензиях одиночных клеток селезнки контрольных и опытных мышей (приведнный ниже пример 11). Фиг. 13 показывает различия в концентрации TNF- в линии моноцитных клеток U937, обработанных различными концентрациями липосом с 75% ФГ (приведнный ниже пример 12). Фиг. 14 дат графическое представление результатов приведнного ниже примера 13, где исследовали, в сравнении с контролем, содержание эндотелина-1 в ушах мышей, подвергнутых лечению в соответствии с предпочтительным осуществлением настоящего изобретения. Фиг. 15 дат графическое представление результатов приведнного ниже примера 14, где определяли число позитивных по молекулам-1 межклеточной адгезии (ICAM-1) клеток культур HUVEC (клетки эндотелия пупочной вены человека) в присутствии и отсутствии композиций предпочтительного осуществления изобретения.-3 007426 Сведения, подтверждающие вожможность осуществления изобретения Согласно настоящему изобретению, пациентам вводят фармацевтически приемлемые тельца, несущие на своей поверхности фосфоглицеридные группы. Не будучи связаны с какой-либо одной теорией,полагают, что эти тельца взаимодействуют с иммунной системой пациента, что сопровождается полезными эффектами, такими как ингибирование провоспалительных цитокинов in vivo и/или стимуляция противовоспалительных цитокинов. Реагирующими клетками могут быть клетки иммунной системы,такие как специализированные или неспециализированные антиген-предъявляющие клетки, клетки эндотелия, регуляторные клетки, такие как NK-T-клетки - натуральные киллеры и другие. Эти фармацевтически приемлемые тельца включают синтетические и полусинтетические тельца,имеющие обычно (но не исключительно) сфероидную, (в том числе сплющенную и вытянутую сфероидную), цилиндрическую, эллипсоидную, змеевидную, почковидную и прочую форму, и диаметр от приблизительно 20 нм до приблизительно 500 мкм, предпочтительно измеренный вдоль их длинной оси, и содержащие на своей поверхности фосфоглицеридные группы. Фармацевтически приемлемые тельца имеют на своей внешней поверхности фосфоглицеридные группы с предварительно заданными характеристиками. Не будучи связаны с какой-либо одной теорией,полагают, что эти группы способны взаимодействовать in vivo с соответствующим рецептором (рецепторами), иным, чем исключительно рецептор фосфатидил-серина (ФС), или с антиген-предъявляющими клетками. Структура этих групп может быть изменена синтетическим путм, и включает полностью или частично исходную фосфоглицеридную группу или е модифицированную версию. Например, отрицательно заряженный атом кислорода фосфатной группы в фосфоглицеридной группе может быть преобразован в фосфоэфирную группу (например, L-OP(O)(OR')(OR"), где L - остаток фосфоглицеридной группы, R' - это -СН 2 СН(ОН)СН 2 ОН, a R" - это алкил с 1-4 атомами углерода или гидроксизамещнный алкил с 2-4 атомами углерода и 1-3 гидроксильными группами, при условии, что группа R" легче гидролизуется in vivo, чем группа R'); в дифосфатную группу, включая дифосфатные эфиры (например, LOP(O)(OR')OP(O)(OR")2, где L и R' - таковы, как они определены выше, а каждый R" - это независимо атом водорода, алкил с 1-4 атомами углерода или гидроксизамещнный алкил с 2-4 атомами углерода и 1-3 гидроксильными группами, при условии, что вторая фосфатная группа [-P(O)(OR")2] легче гидролизуется in vivo, чем группа R'); или в трифосфатную группу, в том числе трифосфатные эфиры (например,L-(OP)(O)(OR')OP(O)(OR")OP(O)(OR")2, где L и R' таковы, как определено выше, а каждый R" - это независимо атом водорода, алкил с 1-4 атомами углерода или гидроксизамещнный алкил с 2-4 атомами углерода и 1-3 гидроксильными группами, при условии, что вторая и третья фосфатные группы легче гидролизуются in vivo, чем группа R'); и в подобные этому. Такие синтетически модифицированные фосфоглицеридные группы способны in vivo проявлять фосфоглицеридные свойства и, следовательно, такие модифицированные группы являются группами, превращаемыми в фосфоглицеридные группы. Фосфатидилглицерин - это известное соединение. Оно может быть получено, например, обработкой природной димерной формы фосфатидилглицерина, кардиолипина, фосфолипазой D. Он может быть также получен ферментативным синтезом из фосфатидилхолина с помощью фосфолипазы D - см., например, патент США 5188951, авторы Tremblay и др. По химической структуре он содержит фосфоглицеридную группу и две похожих, но различных цепи С 18-С 20 жирных кислот. Подразумевается, что термин ФГ, как он использован здесь, охватывает фосфолипиды, имеющие фосфоглицеридную группу и широкое разнообразие цепей жирной кислоты по меньшей мере одной цепи, при условии, что получаемая ФГ часть молекулы является структурным компонентом липосомы. Предпочтительно, такие ФГ соединения могут быть представлены формулой 1 где R и R' независимо выбраны из C1-C24 углеводородных цепей (насыщенных или ненасыщенных, прямых цепей или содержащих ограниченное число разветвлений), причм по меньшей мере одна цепь имеет от 10 до 24 атомов углерода. Существенно, что липидные цепи R и R' образуют скорее не активный компонент, а структурный компонент липосом. Поэтому они могут варьироваться, включая две или одну из таких липидных цепей, одинаковых или различных, при условии, что они выполняют структурную функцию. Предпочтительно, липидные цепи могут быть длиной от приблизительно 10 до приблизительно 24 атомов углерода, насыщенными, мононенасыщенными или полиненасыщенными, линейными или с ограниченным числом разветвлений. Примерами пригодных насыщенных липидных цепей ФГ для применения в настоящем изобретении являются лаурат (С 12), миристат (С 14), пальмитат (С 16), стеарат(С 18), арахидат (С 20), бегенат (С 22) и лигноцерат (С 24). Примерами подходящих мононенасыщенных липидных цепей являются пальмитолеат (С 16) и олеат (С 18). Примерами подходящих полиненасыщенных липидных цепей для использования в ФГ в липосомах настоящего изобретения являются линолеат(С 18), линоленат (С 18) и арихидонат (C20). Фосфолипиды с такой одиночной липидной цепью, также пригодные для использования в настоящем изобретении, известны как лизофосфолипиды. Настоящее изобретение охватывает также использование липосом, в которых активным компонентом является димерная форма ФГ, а именно кардиолипин, но и другие димеры формулы 1 также пригодны. Предпочтительно, такие димеры не сшиты синтетическим путм с помощью синтетического сшивающего агента такого, как малеимид, но скорее сшиты путм удаления глицериновой единицы, как описано Leninger где R и R' независимо таковы, как они определены выше. Как указывалось выше, и снова не ограничиваясь какой-либо одной теорией, полагают, что группа ФГ (и е димер) является лигандом, поскольку есть уверенность, что она связывается со специфическим участком в белке или другой молекуле (ФГ-рецептор) и поэтому эта молекула фосфатидилглицерина(и е димерная форма) иногда носит здесь название лиганд или связывающаяся группа. Полагают,что такое связывание происходит через посредство фосфоглицеридной группы -O-Р(=O)(ОН)-O-СН 2 СН(ОН)-СН 2-ОН, которая иногда носит здесь название головная группа, активная группа или связывающаяся группа. В свете вышесказанного, ссылка здесь на связывание, связывающуюся группу или лиганд не подразумевает какого-либо механизма или способа действия. Тем не менее, полагают,что указанные выше фосфоглицеридные группы представлены на внешних поверхностях телец настоящего изобретения для взаимодействия с компонентами иммунной системы пациента. Следует отметить,что это взаимодействие отличается от специфического взаимодействия апоптозных клеток с фосфатидил-сериновым рецептором на антиген-предъявляющих клетках. Примеры фракций трхмерных телец или фармацевтически приемлемых телец включают биосовместимые синтетические или полусинтетические образования, такие как липосомы, тврдые шарики(бусины), полые бусины, заполненные бусины, частицы, гранулы и микросферы из биосовместимых материалов, природных или синтетических, которые обычно используются в фармацевтической промышленности. Бусины (шарики) могут быть тврдыми или полыми, или могут быть заполнены биосовместимым материалом. Термин биосовместимый относится к веществам, которые в применнных количествах или нетоксичны, или имеют приемлемые параметры токсичности, так что их применение invivo допустимо. Подобным же образом термин фармацевтически приемлемый, применнный в отношении фармацевтически приемлемых телец, относится к тельцам, включающим один или более материалов, которые фармацевтически приемлемы и пригодны для применения in vivo. Такие тельца могут включать липосомы, образованные липидами, одним из которых является ФГ. В качестве альтернативы,фармацевтически приемлемыми тельцами могут быть тврдые бусины, полые бусины, заполненные бусины, частицы, гранулы и микросферы из биосовместимых материалов, которые могут представлять собой один или же один или более биосовместимых материалов, таких как полиэтиленгликоль, поли(метилметакрилат), поливинилпирролидон, полистирол и широкий круг других природных, полусинтетических и синтетических материалов, с присоединнными к ним фосфоглицеридными группами.-5 007426 Как указано выше, предполагается, что термином фосфатидилглицерин охватываются аналоги фосфатидилглицерина с модифицированными активными группами, которые также взаимодействуют с ФГ-рецепторами на антиген-предъявляющих клетках, по тем же самым рецепторным путям, что и ФГ,или иным образом вызывают противовоспалительную реакцию. Они включают (без ограничения приведнным) соединения, в которых одна или более гидроксильных групп и/или фосфатная группа модифицированы (дериватизированы), или соединения в форме соли. Многие из таких соединений образуют invivo (либо в процессе введения, либо после введения) свободные гидроксильные группы и поэтому представляют собой способные к преобразованию ФГ группы. Относящимися к данному вопросу предпочтительными композициями являются липосомы, которые могут иметь в составе различные липиды. Однако предпочтительно, чтобы никакие из липидов не были положительно заряжены. В случае липосом фосфатидилглицерин ФГ может составлять основную часть слоя (слоев) или стенки (стенок) липосом или их полностью, и ориентироваться таким образом,чтобы его часть с фосфоглицеридными группами была направлена наружу, для действия в качестве связывающейся группы, а липидная цепь или липидные цепи образовывали бы структуру стенки. Липосомы, или липидные пузырьки, представляют собой закупоренные мешочки микронного или субмикронного размера, стенки которых (монослойные или многослойные) содержат подходящие амфипатические соединения. В норме они содержат водную среду, хотя для настоящего изобретения внутреннее содержание не имеет значения, и обычно неактивны. Поэтому в предпочтительном варианте осуществления липосомы, а также другие фармацевтически приемлемые тельца, в основном не содержат нелипидных фармацевтически активных частей (например, их меньше 1%), а более предпочтительно не содержат нелипидных фармацевтически активных частей. Такие липосомы готовят и обрабатывают таким образом, чтобы активные группы располагались на внешней поверхности тела липосомы. Таким образом, ФГ в липосомах предпочтительных форм осуществления настоящего изобретения служит и лигандом, и структурным компонентом самой липосомы. Таким образом, предпочтительная форма осуществления настоящего изобретения предусматривает липосомные тельца, которые имеют на своих поверхностях, или могут быть обработаны или индуцированы таким образом, чтобы иметь на своих поверхностях одну или более фосфоглицеридных групп, способных действовать в качестве связывающихся групп. Предпочтительным ФГ лигандом является фосфатидилглицерин, и такие липиды составляют от 10 до 100% липосомы, а остальное является неактивным компонентом (например, фосфатидилхолин - ФХ) или таким компонентом, который действует по другому механизму (например, фосфатидилсерин - ФС), или смесями таких компонентов. Предпочтительны неактивные сокомпоненты, такие как ФХ. По меньшей мере 10% по массе такой липосомы состоит из ФГ, предпочтительно по меньшей мере 50%, более предпочтительно от 60 до 100% и наиболее предпочтительно от 70 до 90%, причм в одном наиболее предпочтительном варианте осуществления ФГ составляет по массе около 75%. Могут быть использованы также смеси ФГ липосом с неактивными липосомами и/или с липосомами из фосфолипидов, действующих по другим механизмам, при условии, что общее количество ФГ остатся выше минимума в приблизительно 10% и предпочтительно выше 60% от всей смеси. Что касается нелипосомных телец для использования в настоящем изобретении, отмечено, что они включают биосовместимые тврдые или полые бусины соответствующего размера. Биосовместимые нелипосомные синтетические или полусинтетические тельца могут быть выбраны из полиэтиленгликоля,поли(метилметакрилата), поливинилпирролидона, полистирола и широкого круга других природных,полусинтетических и синтетических материалов с фосфоглицеридными группами, прикреплнными к их поверхности. Такие материалы включают биоразлагаемые полимеры, такие как раскрыты Dunn и др. в патенте США 4938763, который включн в настоящее описание посредством ссылки во всей его полноте. Биоразлагаемые полимеры известны в данной области и включают, например, линейно-цепные полимеры - такие как полилактиды, полигликолиды, поликапролактоны, полиангидриды, полиамиды, полиуретаны, полиэфирамиды, полиортоэфиры, полидиоксаноны, полиацетали, поликетали, поликарбонаты, полиортокарбонаты, полифосфазены, полиоксибутираты, полиоксивалераты, полиалкилен-оксалаты,полиалкен-сукцинаты, поли(яблочную кислоту), поли(аминокислоты), поливинилпирролидон, полиэтиленгликоль, полиоксицеллюлозу, хитин, хитозан и их сополимеры, трхкомпонентные сополимеры, и их комбинации. Другие биоразлагаемые полимеры включают, например, желатин, коллаген и др. Вещества, пригодные для модификации (дериватизации), направленной на прикрепление фосфолипидов, или их частей с группами или со связывающимися группами, к трхмерным тельцам, являются коммерчески доступными продуктами, например, Polysciences Inc., 400 Valley Road, Warrington, PA 18976 или Sigma Aldrich Fine Chemicals. Способы их дериватизации (модификации) известны в данной области. Характерные предпочтительные примеры таких способов раскрыты в международной заявкеРСТ/СА 02/01398 Vasogen Ireland Limited, которая включена в настоящее описание посредством ссылки. Предполагается, что пациенты могут быть млекопитающими, в том числе (но не ограничиваясь ими) людьми и домашними животными, такими как коровы, лошади, свиньи, собаки, кошки и подобные им.-6 007426 Фосфолипиды являются амфипатическими молекулами (то есть амфифилами), что означает, что такое соединение представляет собой молекулы, имеющие полярную водорастворимую группу, прикреплнную к водонерастворимой углеводородной цепи. Амфифилы, служащие слоями матрикса, имеют чтко очерченные полярные и неполярные области. Амфифилы могут включать, кроме ФГ в настоящем изобретении, другие, существующие в природе липиды, используемые вместе с фосфолипидом, несущим активную группу, или в смеси с другим компонентом. Амфифилы, служащие слоем (слоями) липосом,могут быть инертными, создающими структуру синтетическими соединениями, такими как алкильные простые эфиры полиоксиэтилена, алкильные сложные эфиры полиоксиэтилена и диэфиры сахарозы. Способы приготовления липосом подходящего размера известны в данной области и не являются частью настоящего изобретения. Можно сослаться на различные учебники и научные статьи по этому вопросу, например на обзорную статью Liposomes as Pharmaceutical Dosage Forms авторов YechezkelBarenholz and Daan J.A.Chrommelin, и на цитированную здесь литературу, например New R.C. Liposomes: A Practical Approach. IRL Press. Oxford University Press, 1990. Диаметр липосом, а также других фармацевтически приемлемых телец в предпочтительном варианте осуществления настоящего изобретения составляет от приблизительно 20 нм до приблизительно 500 мкм, более предпочтительно от приблизительно 20 нм до приблизительно 1000 нм, ещ более предпочтительно от приблизительно 50 нм до приблизительно 500 нм, и наиболее предпочтительно от приблизительно 80 нм до приблизительно 120 нм (диаметр предпочтительно измерен вдоль длинной оси). В одном из вариантов осуществления диаметр липосом находится в пределах от 60 нм до 500 мкм. Фармацевтически приемлемые тельца могут быть суспендированы в фармацевтически приемлемом носителе, таком как стерильный физиологический солевой раствор, стерильная вода, апирогенная вода,изотонический солевой раствор и растворы на основе фосфатного буфера (например, стерильные водные растворы, содержащие фосфатный буфер), а также другие нетоксичные совместимые вещества, используемые в фармацевтических составах, такие как, например, адъюванты, буферы, консерванты и подобные им. Предпочтительно, фармацевтически приемлемые тельца оформлены в виде жидкой суспензии в стерильной биосовместимой жидкости, такой как содержащий буфер солевой раствор, и вводятся пациенту любым подходящим путм, который обеспечивает их контакт с одним или более компонентами иммунной системы, таким как внутриартериальный, внутривенный или, что наиболее предпочтительно,внутримышечный или подкожный пути. Предполагается, что фармацевтически приемлемые тельца могут быть высушены в замороженном состоянии или лиофилизованы, так что их можно позднее ресуспендировать для введения. Настоящее изобретение направлено также на комплект, состоящий из части, содержащей лиофилизованные или высушенные в замороженном состоянии тельца, несущие связывающиеся группы, и фармацевтически приемлемого носителя, такого как стерильный физиологический солевой раствор, стерильная вода, апирогенная вода, изотонический солевой раствор и растворы на основе фосфатного буфера (например, стерильные водные растворы, содержащие фосфатный буфер), а также другие нетоксичные совместимые вещества, используемые в фармацевтических составах, такие как, например, адъюванты, буферы, консерванты и подобные им. Могут быть также включены защитные вещества для сушки в замороженном состоянии, известные в данной области, например лактоза или сахароза. Предпочтительный способ введения фармацевтически приемлемых телец пациенту - это курс инъекций, производимых ежедневно, несколько раз в неделю, еженедельно или ежемесячно, в течение периода времени от недели до нескольких месяцев. Частота и длительность курса введения может, повидимому, меняться от пациента к пациенту, в зависимости от подлежащего лечению болезненного состояния, его тяжести, и того, каким предназначено быть воздействие - профилактическим, терапевтическим или поддерживающим. Его планирование и оптимизация целиком зависят от мастерства лечащего врача. Наиболее предпочтительна внутримышечная инъекция, особенно в ягодичную мышцу. Одним из конкретных режимов инъекций, по меньшей мере, при некоторых показаниях к применению настоящего изобретения, является следующий: инъекция в ягодичную мышцу подходящего количества телец в день 1, затем инъекция в день 2, после этого инъекция в день 14, а затем бустерные инъекции с месячными интервалами, если это необходимо. Постулируется, что во многих вариантах осуществления настоящего изобретения фармацевтически приемлемые тельца, содержащие в качестве связывающихся групп на своей поверхности ФГ группы,действуют как модификаторы иммунной системы пациента, в манере, подобной действию вакцины. Поэтому их применяют в количествах и при таких способах введения, чтобы обеспечить достаточные локальные концентрации телец в месте введения. Количества таких телец, подходящие для модификации иммунной системы, могут не находиться в прямой корреляции с размером тела реципиента и могут поэтому отличаться от дозировок лекарств, которые предписываются для обеспечения терапевтических уровней активных веществ в кровотоке и тканях пациента. Таким образом, дозировки лекарственных препаратов могут, по-видимому, быть намного большими, чем дозировки препаратов, модифицирующих иммунную систему. Корреляцию между массой липосом и числом липосом можно извлечь из принятого специалистами в области липосомных составов соотношения, гласящего, что одна двухслойная везикула диаметром 100-7 007426 нм содержит 81230 липидных молекул, распределнных в соотношении приблизительно 50:50 между слоями (см. Richard Harrigan. "Transmembrane pH gradients in liposomes (microform): drug-vesicle interactions and proton flux". Диссертация на соискание степени PhD. Университет Британской Колумбии, 1992. Публикация National Library of Canada, Ottawa, Canada, 1993; University Microfilms order No.UMI00406756; Canadiana No. 942042220, ISBN 0315796936). Отсюда можно рассчитать, например, что доза 5x108 везикул (по порядку соответствующая дозе, используемой в приведнных ниже конкретных примерах применения in vivo), эквивалентна 4,06x1013 липидных молекул. Используя число Авогадро 6,023x1023 для количества молекул липида в грамм-молекуле (моле), можно определить, что это составляет 6,74x10-11 молей, что при молекулярной массе ФГ, равной 729, дат приблизительно 3,83x10-8 г или 38,3 нг ФГ в такой дозе. Подлежащие введению количества фармацевтически приемлемых телец будут варьироваться в зависимости от природы расстройства у млекопитающего, которое намереваются лечить, и от индивидуальности и характеристик пациента. Предпочтительно, чтобы эффективное количество фармацевтически приемлемых телец было нетоксично для пациента, и не было бы слишком большим, чтобы не перегрузить иммунную систему. При применении внутриартериального, внутривенного, подкожного или внутримышечного введения стерильной водной суспензии фармацевтически приемлемых телец предпочтительно вводить в каждой дозе от приблизительно 0,1 до 50 мл жидкости, содержащей количество телец,эквивалентное, как правило, 10-1000% от количества лейкоцитов, имеющегося в норме в эквивалентном объме цельной крови. Предпочтительно, чтобы количество телец, вводимых за один раз человеческому пациенту, было в интервале от приблизительно 500 до приблизительно 2,5x109 (в случае липосом менее 250 нг телец, это количество пропорционально корректируется с учетом разницы в плотностях для других вариантов осуществления телец), более предпочтительно от приблизительно 1000 до приблизительно 1500000000, ещ предпочтительнее от 10000 до приблизительно 50000000 и наиболее предпочтительно от приблизительно 200000 до приблизительно 2000000. Поскольку фармацевтически приемлемые тельца действуют в процессе применения изобретения как модификаторы иммунной системы, подобно вакцине, то число таких телец, вводимое в место инъекции за каждое введение, может быть более осмысленной количественной характеристикой, чем число или масса телец на единицу массы тела пациента. По той же самой причине теперь предполагают, что эффективные дозы или количества телец для небольшого животного нельзя прямо пересчитать в эффективные количества для более крупных животных (то есть массой более 5 кг) просто на основании соотношений массы. Настоящее изобретение предназначено для применения в профилактике и/или лечении широкого спектра расстройств у млекопитающих, которые связаны с функциями Т-клеток, воспалением, дисфункцией эндотелия и неадекватной экспрессией цитокинов. Пациент, имеющий или предположительно имеющий такое расстройство, может быть выбран для лечения. Лечением называется ослабление симптомов, такое как (но не ограничивающееся этими примерами) уменьшение остроты или числа симптомов конкретного заболевания или ограничение дальнейшего развития симптомов. Что касается расстройств, связанных с функцией Т-клеток (опосредованных Т-клетками), эти расстройства включают любые и все расстройства, опосредованные, по меньшей мере, частично, Тклетками, и включают, для примера, язвы, раны и аутоиммунные расстройства, в том числе (но не ограничиваясь ими) диабет, склеродермию, псориаз и ревматоидный артрит. Настоящее изобретение предназначено для применения в случае воспалительных аллергических реакций, расстройств, связанных с реакцией органов и клеток при трансплантации, и микробных инфекций,вызывающих воспалительные реакции. Оно также предназначено для применения в профилактической защите от окислительного стресса и/или ишемии вследствие повреждений при повторной перфузии, от проглатывания ядов, от воздействия токсических химических веществ, радиационных повреждений и воздействия происходящих из воздуха или воды веществ, вызывающих раздражение, и других факторов,вызывающих разрушающее воспаление. Оно предназначено также для применения в случае воспалительных, аллергических и опосредованных Т-клетками расстройств внутренних органов, таких как почки, печень, сердце и т.д. Что касается расстройств, включающих неадекватную экспрессию цитокинов, для которых предназначено настоящее изобретение, то они включают любые и все расстройства, при которых имеет место неадекватная экспрессия цитокинов, и включают, например, нейродегенеративные заболевания. Нейродегенеративные заболевания, в том числе синдром Дауна, болезнь Альцгеймера и болезнь Паркинсона,связаны с повышенным уровнем содержания определнных цитокинов, в том числе интерлейкина-1 (IL1) (см. Griffin W.S.T. и др. (1989); Mogi M. и др. (1996. Было также установлено, что IL-1 ингибирует длительную потенциацию в гиппокампе (Murray C.A. и др. (1998. Длительная потенциация в гиппокампе - это форма синаптической пластичности, она обычно рассматривается как подходящая модель памяти и обучения (Bliss T.V.P. и др. (1993. Поэтому в настоящее время считается, что неадекватная экспрессия цитокинов в мозгу участвует в проявлении и развитии нейродегенеративных заболеваний и нейровоспалительных расстройств.-8 007426 Поэтому настоящее изобретение предназначено для лечения и профилактики у млекопитающих большого числа нейродегенеративных и других неврологических расстройств, включая синдром Дауна,болезнь Альцгеймера, болезнь Паркинсона, старческое слабоумие, депрессию, болезнь Хантингтона, заболевания периферической нервной системы, синдром Гийена-Барре, заболевания спинного мозга, заболевания, связанные с невропатологией суставов, хронические заболевания с воспалительной демиелинизацией, невропатии, в том числе мононевропатию, полиневропатию, симметричную периферическую сенсорную невропатию, расстройства нервно-мышечных соединений, миастении и боковой амиотрофический склероз (БАС). Лечение и профилактика этих нейродегенеративных заболеваний являются особенно предпочтительным примером осуществления настоящего изобретения, при особенно предпочтительном лечении болезни Альцгеймера, болезни Паркинсона и БАС. Что касается расстройств с участием дисфункции эндотелия, настоящее изобретение предназначено для лечения и профилактики широкого круга таких расстройств у млекопитающих, включающих любые и все расстройства, по меньшей мере, частично опосредованные дисфункцией эндотелия, и включающих,например, сердечно-сосудистые заболевания, такие как атеросклероз, окклюзионное поражение периферических артерий или вообще артерий, застойную сердечную недостаточность, заболевание сосудов головного мозга (удар), инфаркт миокарда, стенокардию, гипертензию и т.д., расстройства, связанные со спазмом сосудов, такие как болезнь Рейно, кардиальный синдром X, мигрень и т.д., и нарушения, вызванные ишемией (ишемические повреждения или ишемические повреждения, связанные с повторной перфузией). В итоге, это может быть любое расстройство, в патологии которого участвует неадекватное функционирование эндотелия. Далее предназначения композиций и способов настоящего изобретения включают воздействие на пациентов с целью ускорения заживления их ран и язв, а также воздействие на пациентов перед хирургическими операциями с целью ускорения их послеоперационного восстановления, в том числе ускорения заживления у них хирургических ран и рассечений. В отношении сердечных расстройств, настоящее изобретение предназначается для лечения и профилактики широкого круга таких расстройств у млекопитающих, в том числе любых и всех расстройств, связанных с сердцем, и включающих, например, желудочковую аритмию (желудочковую тахикардию или фибрилляцию) и внезапную смерть от сердечного расстройства. На восприимчивость пациентов к сердечным расстройствам, таким как аритмии и внезапная смерть от сердечного расстройства,часто указывают удлиннные интервалы QT-c в ритме сердечного биения. Полагают, что введение композиций согласно предпочтительным формам осуществления изобретения сокращает интервалы QT-c у пациентов - млекопитающих, что указывает на снижение их предрасположенности к аритмии и внезапной смерти от сердечного расстройства. Далее изобретение описывается, в целях иллюстрации, в нижеследующих не ограничивающих примерах. Примеры В приведнных ниже примерах использованы расшифрованные далее сокращения. Если сокращение не обозначено, оно имеет общепринятый смысл. Если не указано иное, точная форма липидов, использованных в опытах, была РОФС, РОФГ и РОФХ, как изложено выше. Пример 1. Липосомы со средним диаметром 10020 нм были приготовлены согласно стандартным методам,известным в данной области, и имели следующий состав: группа А - 100% ФС; группа В - 100% ФГ; группа С - контроль, без липосом. Базовый раствор каждой липосомной композиции, содержащий 4,8x1014 липосом в мл, разбавлялиPBS, чтобы получить инъекционную суспензию, содержащую 6x106 частиц в мл. Липосомные суспензии вводили инъекцией мышам-самкам линии BALB/c (Jackson Laboratories) в возрасте 6-8 недель и весом 19-23 г, чтобы определить влияние на опухание ушей в мышиной модели контактной гиперчувствительности (КГЧ). Модель КГЧ служит тестом на воспалительные реакции, опосредованные Th-1. Мышей распределяли по 3 группам, в каждой группе по 5 животных. Группы А и В получали приблизительно по 3x105 определнных выше липосом (т.е. соответственно 100% ФС или 100% ФГ) в объме приблизительно 50 мкл. Мыши в группе С служили контролем и не получали липосом.- 10007426 Протокол опыта Опыт был проведн следующим образом. Таблица 1 В дни с 1-го по 6-й мышам групп А и В вводили соответственные препараты липосом. Приблизительно 300000 липосом вводили в объме 50 мкл путм внутримышечной (ВМ) инъекции, с суммарным введением за период испытаний около 1800000 липосом. Мыши контрольной группы (группа С) не получали липосом, но были сенсибилизированы, им вводили провокационную пробу и обследовали так же,как и мышей групп А и В, как описано выше. Сенсибилизация В 1-й день, после инъекции в этот день липосом, мышей анестезировали ВБ инъекцией 0,2 мл раствора фенобарбитала натрия 5 мг/мл. Кожу на животе мышей опрыскивали 70% EtOH и лезвием скальпеля выбривали на животе участок диаметром около 1 дюйма. Затем на выбритую область с помощью пипетки наносили 25 мкл 0,5% раствора 2,4-динитрофторбензола (ДНФБ) в смеси ацетона с оливковым маслом (4:1). Провокационная проба На 6-й день, после инъекции липосом, мышам вводили провокационную пробу ДНФБ нанесением с помощью пипетки 10 мкл 0,2% раствора ДНФБ на тыльную поверхность правого уха; на левое ухо с помощью пипетки наносили 10 мкл носителя (плацебо). Результаты На 7-й день, через 24 ч после нанесения провокационной пробы, каждое животное анестезировали галотаном и измеряли толщину ушей с помощью пружинного микрометра Peacock. Данные представляли в виде разницы в толщине между правым ухом с внеснной пробой и левым ухом, обработанным носителем (плацебо). Опыты повторяли 3 раза на одинаковых животных. Увеличение опухания ушей использовали как меру реакции на ДНФБ. Достоверность данных устанавливали по 2-параметрическомуt-критерию Стьюдента. Достоверным считали различие с р 0,05. Результаты приведены на фиг. 1 - гистограммном представлении средних величин из трх опытов по измерению опухания ушей, представленного в мкм. Фиг. 1 показывает существенное уменьшение опухания ушей, которое обеспечивает инъекция липосом в соответствии с настоящим изобретением. Липосомы с 100% ФГ давали достоверно большее снижение опухания, чем липосомы с 100% ФС. Пример 2. Липосомы со средним диаметром 10020 нм были приготовлены согласно стандартным методам,известным в данной области, и имели следующий состав: группа А - 100% ФГ; группа В - 75% ФГ,25% ФХ; группа С - 50% ФГ, 50% ФХ; группа D - 25% ФГ, 75% ФХ; группа Е - только PBS; группа F - без инъекции. Базовый раствор каждой липосомной композиции, содержащий 4,8x1014 липосом в мл, разбавляли,чтобы получить инъекционную суспензию, содержащую 12x106 частиц в мл. Липосомные суспензии были использованы для инъекции мышам, чтобы определить воздействие на опухание ушей в мышиной модели КГЧ - биологической системе, пригодной для оценки опосредованных Th-1 воспалительных реакций. Для этих опытов использовали мышей-самок линии BALB/c (Jackson Laboratories) в возрасте 6-8 недель и весом 19-23 г. Мышей определяли в одну из 6 групп (группы A-F, указанные выше) по 10 мышей в каждой группе. Также были включены контрольные группы без инъекций (группа F) или с инъекциями PBS без липосом(группа Е). Животным в группах A-D вводили инъекцией по 50 мкл определнных выше суспензий липосом, причм каждая порция содержала приблизительно 6x105 липосом.- 11007426 Протокол опыта Тест включает сенсибилизацию (Сенс) потенциально вызывающим воспаление веществом, инъекцию липосом (Ин) подопытным животным или PBS контрольным животным и введение провокационной пробы (Провок) потенциально вызывающего воспаление вещества, с последующим измерением (Изм),чтобы определить, эффективно ли инъекция липосом противодействует развитию воспаления под действием провокационной пробы. Опыт был проведн следующим образом. Таблица 2 В дни с 1-го по 6-й проводили инъекцию мышам соответственных препаратов липосом, как указано выше. Проводили ВМ инъекцию липосом в объме 50 мкл, т.е. в каждой инъекции вводили 600000 липосом, за весь период испытаний было введено всего 3600000 липосом. Мыши в контрольной группе не получали липосом, но сенсибилизацию, введение провокационной пробы и обследование проводили так же, как и в других группах мышей, как описано выше. Сенсибилизация (Сенс) На 1-й день, после инъекции в этот день липосом, мышей анестезировали ВБ инъекцией 0,2 мл раствора фенобарбитала натрия 5 мг/мл. Кожу на животе мышей опрыскивали 70% ЕЮН и лезвием выбривали на животе участок диаметром около 1 дюйма. На выбритую область с помощью пипетки наносили 25 мкл 0,5% раствора 2,4-динитрофторбензола (ДНФБ) в смеси ацетона с оливковым маслом (4:1). Провокационная проба (Провок) На 6-й день, после инъекции в этот день липосом, мышам вводили провокационную пробу (Провок) ДНФБ следующим образом: 10 мкл 0,2% раствора ДНФБ наносили на тыльную поверхность правого уха; на левое ухо с помощью пипетки наносили 10 мкл носителя (плацебо). Результаты На 7-й день, через 24 ч после нанесения провокационной пробы, каждое животное анестезировали галотаном и измеряли толщину ушей (Изм) с помощью пружинного микрометра Peacock. Увеличение опухания ушей использовали как меру реакции на ДНФБ. Данные представляли в виде разницы в толщине между правым ухом с внеснной пробой и левым ухом, обработанным носителем (плацебо). Достоверность различия между двумя группами устанавливали по 2-параметрическому t-критерию Стьюдента. Достоверным считали различие с р 0,05. Результаты представлены графически на фиг. 2 - гистограммном представлении, показывающем величину опухания ушей в мкм. В построении графика использованы средние значения из соответствующих опытов. Фиг. 2 показывает, что достоверное уменьшение опухания ушей достигалось при введении липосом с 100 и 75% ФГ. Это указывает на то, что обе эти концентрации защищают от развития воспаления, вызванного контактом с аллергенным веществом ДНФБ. Липосомы с 50 и 25% ФГ показывали также уменьшение опухания по сравнению с обоими контролями, но в этих опытах различие не было статистически достоверным. Пример 3. Липосомы со средним диаметром 10020 нм были приготовлены согласно стандартным методам,известным в данной области, и имели состав 75% ФГ, 25% ФХ. Базовую суспензию, содержащую 4,8x1014 липосом в мл, использовали, как указано выше, и разбавляли в PBS, чтобы получить инъекционную суспензию, содержащую приведнные ниже концентрации липосом: Мышей линии BALB/c разделили на 6 групп (группы A-F), включая контрольную группу, где мыши не получали липосом, но им вводили инъекцией 50 мкл PBS (группа F). Мышей сенсибилизировали введением аллергена в бок, затем проводили инъекцию выбранной для них дозы липосом (внутримышечно в мышцу правой ноги) в тот же день, что и сенсибилизация, но после не (день 1) и затем в дни 2 й, 3-й, 4-й и 5-й. На 6-й день им и проводили инъекцию, и вводили в ухо провокационную пробу, как описано в примере 1. Толщину ушей измеряли, как описано выше, через 24 ч после провокационной пробы. Результаты (фиг. 3) показывают достоверную разницу между контрольной группой (группа F) и группой С (12x108 липосом в мл), между контрольной группой и группой D (12x107 липосом в мл) и между контрольной группой и группой Е (12x106 липосом в мл). Наблюдалась небольшая разница между контрольной группой и группами А и В (соответственно 12 х 1011 и 12 х 109 липосом в мл), что позволяет предположить, что существует оптимальный интервал концентраций липосом, выше которого полезный эффект может быть снижен. В других опытах наблюдалось также уменьшение защитного эффекта, когда концентрация липосом была ниже 12x104 липосом в мл. Пример 4. Липосомы состава 100% ФГ со средним диаметром 10020 нм были приготовлены в соответствии со стандартными методами. В четырх группах мышей по 10 мышей в каждой (группы A-D) проводили сенсибилизацию, инъекции и введение провокационной пробы в соответствии с описанными в примере 3 процедурой и расписанием, со следующим количеством 100% ФГ липосом, введнным в 50 мкл суспензии: группа А - 6x107; группа В - 6x106; группа С - 6x105; группа D - 6x104. Результаты примера 4, вместе с данными контрольной группы с PBS, представлены также в форме гистограммы на фиг. 4. Для каждой из опытных групп наблюдалось достоверное уменьшение опухания ушей по сравнению с контрольной группой, однако с небольшой разницей между различными группами. Пример 5. Липосомы состава 75% ФГ, 25% ФХ и со средним диаметром 50, 100, 200 или 400 нм готовили стандартными методами. Их испытывали в мышиной модели КГЧ, как в примерах 3 и 4, используя для каждой инъекции 6x105 липосом в 50 мкл суспензии, причм расписание действий сенсибилизацияинъекции-провокация и методика были такими же, как в примере 3. Группы были следующими: группа А - липосомы диаметром 50 нм; группа В - липосомы диаметром 100 нм; группа С - липосомы диаметром 200 нм; группа D - липосомы диаметром 400 нм; группа Е - без липосом. Результаты представлены на фиг. 5. Результат группы D, в которой применялись липосомы диаметром 400 нм, не имел достоверного различия с результатом контрольной группы (группа Е), что указывает на возможную критичность диапазона размеров в этой модели. Пример 6. Базовую суспензию 75% ФГ липосом со средним диаметром 10020 нм, содержащую 4,8x1014 липосом в мл, разбавляли, чтобы получить инъекционную суспензию, содержащую 6x105 липосом в 50 мкл. Липосомные суспензии использовали для инъекций мышам, чтобы определить влияние на опухание ушей в мышиной модели КГЧ. Как и в примере 1, использовали мышей-самок линии BALB/c (Jackson- 13007426 Животных распределяли в одну из 3 групп по 10 мышей в каждой группе. Мыши в контрольной группе (группа С) получали только инъекции PBS. Животным в группах А и В делали инъекции по 50 мкл суспензии, содержавшей 6x105 липосом. Протокол опыта В дни с 13-го по 18-й мышам производили инъекцию 75% ФГ липосом, как указано ниже. Липосомы вводили ВМ инъекцией в объме 50 мкл, т.е 600 000 липосом за каждую инъекцию, а за весь период испытания полное количество составило 3 600 000 липосом. Сенсибилизацию и провокацию проводили,как описано в примере 2. Таблица 4 Результаты Результаты представлены в графической форме на сопровождающей фиг. 6 и показывают эффективность 75% ФГ липосом в модели ГЧЗТ, проявляющуюся на 16-й день через 24 ч после третьей инъекции, следующей за вторым введением провокационной пробы. Пример 7. Липосомы, образованные 100% кардиолипином (КЛ) и имеющие средний диаметр 10020 нм, готовили стандартными методами. Они были использованы в дозировке 6x105 липосом в 50 мкл в каждой инъекции в мышиной модели ГЧЗТ, описанной в примере 6. Данные полученные на мышах, которым производилась инъекция КЛ липосом (группа А, 10 мышей), сравнивали с данными, полученными на мышах, получавших только PBS (группа В, 10 мышей). Процедуры сенсибилизации, инъекции и провокации были такими, как описаны в примере 2. Результаты измерения толщины ушей, полученные на 19-й день (через 24 ч после 6-й инъекции), приведены на фиг. 7. Результаты показывают значительное уменьшение опухания ушей в результате инъекции мышам КЛ липосом (группа А). Пример 8. Липосомы со средним диаметром 100 нм, содержащие либо 100% кардиолипина, либо 75% кардиолипина и 25% ФХ, готовили стандартными методами. Три группы по 10 мышей (группы А-С) сенсибилизировали в 1-й день. Мыши в контрольной группе получали инъекции PBS в дни 1-й, 2-й и 6-й (группа С). Мыши в остальных двух группах получали инъекции липосом в объме 50 мкл в каждой инъекции по той же схеме. В каждой инъекции вводили 6x105 липосом со 100% кардиолипина (группа А) или 6x105 липосом с 75% кардиолипина (группа В). Провокационную пробу вводили мышам на 7-й день и измеряли толщину ушей, как описано в предыдущих примерах. На фиг. 8 приведены средние результаты измерений в каждой группе. В обеих группах, получавших КЛ липосомы, отмечено статистически достоверное подавление КГЧ по сравнению с контрольной группой. Пример 9. Чтобы изучить клеточные и молекулярные механизмы, лежащие в основе когнитивной функции,используют животную модель длительной потенциации (ДП). ДП - это форма синаптической пластичности, проявляющаяся при формировании гиппокампа, который, как полагают, является биологическим субстратом для обучения и запоминания (Bliss и др. // Nature. 1990. Т. 361. С. 31-39). ДП у крыс определяется электрофизиологическими методами, хорошо известными специалистам в данной области. Затем животных забивают, чтобы исследовать биохимические изменения в тканях гиппокампа. Сравнение результатов электрофизиологического исследования с биохимическими изменениями в гиппокампе полезно для определения того, как можно изменить клеточные события, лежащие в основе ДП, у животных,- 14007426 страдающих заболеваниями или расстройствами, связанными с воспалительными процессами в нервной системе, такими как старение, стресс, болезнь Альцгеймера и бактериальная инфекция. Системное введение липополисахарида (ЛПС), компонента клеточной стенки грамотрицательных бактерий, вызывает активацию иммунной системы, индуцируя повышение содержания провоспалительных цитокинов, таких как IL-1. Как указывалось выше, одним из примеров индуцированного ЛПС и IL1 нейронного дефицита является ослабление ДП в гиппокампе. Индикатором ДП является средний наклон возбуждаемого популяционного постсинаптического потенциала (ВПСП). При тетанической стимуляции наклон ВПСП (в %) резко увеличивается, указывая на повышение синаптической активности. Индуцированное ЛПС подавление ДП уменьшает скачок ВПСП и/или заставляет наклон ВПСП быстрее возвращаться к базовой линии, что указывает на то, что повышенная синаптическая активность является короткоживущей. Поэтому измерения наклона ВПСП (в %) через определнные интервалы времени после тетанической стимуляции можно использовать для тестирования памяти и е утраты после действия воспалительного раздражителя, а также воспаления в гиппокампе мозга. Липосомы со средним диаметром 10020 нм были приготовлены согласно стандартным методам,известным в данной области, и содержали 75% ФГ и 25% ФХ. Базовую суспензию липосом, содержащую приблизительно 2,9x1014 липосом в мл, разбавляли PBS, чтобы получить инъекционную суспензию, содержащую приблизительно 1,2x107 липосом в мл. Эта суспензия была использована для инъекций крысам, чтобы определить влияние на индуцированное ЛПС снижение ДП. Для этих опытов использовали крыс-самцов линии Wistar (BioResourses Unit, Trinity College, Dublin) весом около 300 г. Животных распределяли в одну из 4 групп, по 8 крыс в каждой группе, для воздействия по следующей схеме: группа А - солевой физиологический раствор + контроль; группа В - солевой физиологический раствор + ФГ липосомы; группа С - ЛПС + контроль; группа D - ЛПС + ФГ липосомы. Каждый идентифицированный выше препарат в объме 150 мкл вводили ВМ инъекцией в дни 1-й,13-й и 14-й. Мыши в группах В и D получали всего по 5 400 000 липосом (по 1800000 липосом за одну инъекцию). Процедуры ДП и приготовления ткани выполняли в день 0. Процедура ДП Крыс анестезировали ВБ введением уретана (1,5 г/кг). Крысам вводили ВБ либо ЛПС (100 мкг/кг),либо стерильный физиологический раствор. Через три часа в проводящий путь и в область тела дорсальной клетки зубчатой извилины вводили соответственно биполярный стимулирующий электрод и однополярный регистрирующий электрод. Производили 10 шоковых импульсов с частотой 0,033 Гц, а реакцию измеряли за 10 мин до и через 45 мин после высокочастотной стимуляции (подавали 3 вереницы импульсов с интервалами 30 с, 250 Гц в течение 200 мс). Крыс забивали обезглавливанием. Гиппокамп, тетанизированные и нететанизированные зубчатые извилины, кору и обонятельную кору измельчали на льду, разделяли на порции и замораживали в 1 мл раствора Кребса, содержащего 10% ДМСО (состав раствора Кребса в мМ: NaCl - 136, KCl - 2,54, KН 2 РO4- 1,18, MgSO4.7H2O - 1,18, NaHCO3 - 16, глюкоза - 10, CaCl2- 1,13). Результаты Результаты приведены на фиг. 9. График показывает разницу в возбуждаемом постсинаптическом потенциале (ВПСП), зарегистрированном в клеточных телах тучных клеток (гепариноцитов). Представленные данные являются средними из 7-8 наблюдений в каждой подвергнутой воздействию группе и выражены как среднее процентное изменение в наклоне ВПСП в каждые 30 с, нормированное к среднему значению за 5 мин. до тетанической стимуляции. Фиг. 9 показывает, что индуцированное ЛПС ингибирование ДП в синапсах проводящего пути с тучной клеткой преодолевается предварительной обработкой ФГ липосомами. Сплошные треугольники представляют группу А (солевой физиологический раствор + контроль), незаполненные треугольники представляют группу В (солевой физиологический раствор + ФГ липосомы), сплошные квадраты представляют группу С (ЛПС + контроль), а незаполненные квадраты представляют группу D (ЛПС + ФГ липосомы). Фиг. 10 показывает, что анализ средних значений через 40-45 мин после тетанической стимуляции указывает на то, что популяционный наклон ВПСП уменьшился в группе контроль-ЛПС (незаполненные столбики) и что ФГ липосомы (заштрихованные столбики) достоверно снимают этот эффект (р 0,01). В качестве индекса способности к функционированию памяти и обучения, продемонстрированное в этом примере улучшение восстанавливаемости ДП указывает на пригодность такого воздействия для лечения состояний слабоумия, например болезни Альцгеймера и ослабления памяти. Пример 10.IL-4 - один из большого числа цитокинов, секретируемых Th2 субклассом лимфоцитов, известный благодаря своему противовоспалительному действию. Фиг. 11 показывает, что концентрация IL-4 в гиппокампе была достоверно повышена в группе ЛПС, которую предварительно обрабатывали ФГ липосомами (р 0,05). Незаполненные столбики представляют контрольную группу (группа Е), а заштрихо- 15007426 ванные столбики представляют группу, которой вводили ФГ липосомы (группа F). Количество IL-4 измеряли методом твердофазного иммуноферментного анализа ELISA и выражали в пикограммах IL-4 на мг общего белка. Эта регуляция с возрастанием противовоспалительного цитокина IL-4 в мозгу указывает на полезность применения способа и композиции предпочтительных осуществлений настоящего изобретения в лечении широкого круга нейровоспалительных расстройств, включая болезнь Паркинсона,БАС, хроническое воспалительное демиелинизирующее заболевание CIPD и синдром Гийена-БарреIL-1 - один из большого числа цитокинов, секретируемых Th1 подклассом лимфоцитов, известный благодаря своему провоспалительному действию. Извлекали селезнки у животных, подвергнутых воздействиям, описанным в примере 9 (группы С и D), и собирали селезночные клетки. Их готовили следующим образом. Фиг. 12 показывает, что концентрация IL-1 в селезночных клетках была достоверно снижена в группе ЛПС, которая предварительно была обработана ФГ липосомами (р 0,05). Количество IL-1 измеряли методом твердофазного иммуноферментного анализа ELISA и выражали в пикограммах IL-1 на мг общего белка. Результаты указывают на системное провоспалительное действие способа и композиций предпочтительных форм осуществления настоящего изобретения. Пример 12.U937 - это линия моноцитных клеток лейкемии, которые можно дифференцировать в макрофаги введением форболовых эфиров. Обработка липополисахаридом (ЛПС), компонентом клеточной стенки грамотрицательных бактерий, стимулирует воспалительную реакцию в клетках U937, со стимулирующей регуляцией экспрессии большого числа провоспалительных молекул, включая TNF. Эта модель предоставляет экспериментальную систему для оценки противовоспалительной терапии. Макрофаги можно выращивать в культуральной среде в присутствии композиции с предполагаемым противовоспалительным действием, и можно измерять экспрессию TNF. Липосомы со средним диаметром 10020 нм были приготовлены согласно стандартным методам,известным в данной области, и имели состав: 75% фосфатидилглицерина (ФГ) и 25% фосфатидилхолина(ФХ). Базовую суспензию с концентрацией липида около 40 мМ разбавляли до следующей конечной концентрацией для испытаний: 100 мкМ фосфатидилглицерина (ФГ),40 мкМ ФГ,10 мкМ ФГ,4,0 мкМ ФГ,1 мкМ ФГ. Клетки U937 культивировали выращиванием в среде RPMI (GIBCO BRL) с добавкой 10% сыворотки плода коровы (fetal bovine serum, FBS) и 1% пенициллина/стрептомицина и растили при 37 С в атмосфере с 5% СO2. 5x105 клеток высевали в ячейки планшетов на 6 ячеек и вызывали их превращение в макрофаги обработкой 150 нМ форболмиристатацетата (ФМА) в течение 2-3 дней. Затем, после дифференцировки клеток U937 в макрофаги, клеточную среду заменяли полной средой. После этого клетки инкубировали в течение ещ 24 ч для минимизации плейотропных эффектов воздействия ФМА. После этого клетки инкубировали в присутствии: группа А - PBS, негативный контроль,группа В - 10 нг/мл ЛПС, позитивный контроль,группа С - 10 нг/мл ЛПС + 100 мкМ ФГ,группа D - 10 нг/мл ЛПС + 40 мкМ ФГ,группа Е - 10 нг/мл ЛПС + 10 мкМ ФГ,группа F - 10 нг/мл ЛПС + 4,0 мкМ ФГ,группа G - 10 нг/мл ЛПС + 1 мкМ ФГ. Клетки инкубировали, как описано выше, при 37 С в атмосфере с 5% СO2. Через 18 ч надосадочные жидкости в каждой группе клеток собирали и анализировали на содержание TNF с помощью стандартного набора Quantikine для анализа с помощью сшитого с ферментом иммуносорбента ELISA (RD systems, Minneapolis, USA). Результаты Фиг. 13 показывает количество секретируемого TNF в пикограммах в мл. Результаты показывают,что клетки макрофагов, полученные дифференцировкой клеток U937, при нормальных условиях экспрессируют очень низкие уровни TNF. Однако, будучи экспонированными с ЛПС, они секретируют в окружающую среду большие количества TNF, что является указанием на имевший место клеточный стресс. Инкубация клеток с ФГ липосомами ингибирует секрецию TNF с дозовой зависимостью. При этом наивысшая концентрация 100 мкМ приводит к 98% снижению, и даже самая низкая концентрация 1 мкМ вызывает 58% снижение экспрессии TNF.- 16007426 Пример 13. Чтобы установить влияние ФГ липосом предпочтительного осуществления настоящего изобретения на функцию эндотелия, определяли содержание эндотелина-1 (ЕТ-1) в ушах мышей, которые были подвергнуты исследованию КГЧ, как описано в примере 3. Эндотелин-1 - это активный сосудосокращающий агент, он обладает инотропным и митогенным действием, моделирует солевой и водяной гомеостаз и играет важную роль в поддержании тонуса сосудов и кровяного давления. Имеются различные доказательства того, что эндогенный ЕТ-1 может участвовать в патофизиологии болезненных состояний, связанных с продолжительным сокращением сосудов, таких как сердечная недостаточность. При сердечной недостаточности наблюдали повышенные уровни содержания циркулирующего ЕТ-1 и большого эндотелина (big-ET-1) (Giannesi D., Del Ry S., Vitale R.J. "The role of endothelins and their receptors in heartfailure" // Pharmacol. Res. 2001. T. 43,2. С 111-126). Вследствие этого ЕТ-1 является индикатором функционирования эндотелия, а повышенная продукция ЕТ-1 в ткани указывает на ослабление функции эндотелия. Чтобы установить уровень экспрессии ЕТ-1, в опытах по КГЧ у мышей, через 24 ч после введения провокационной пробы в правое ухо, эти правые уши удаляли. Уши забирали у мышей, которым в течение 6 дней проводили ВМ инъекцию PBS (группа А), и у мышей, которым проводили ВМ инъекцию липосом состава 75% ФГ/25% ФХ (600000 липосом в каждой инъекции; группа В). Уши хранили в устройстве для работы с РНК при -20 С до выделения РНК. Выделяли РНК и с помощью обратной транкриптазы (ОТ) получали комплементарную ДНК (кДНК), используя специфичные для ЕТ-1 праймеры. В качестве внутреннего контроля осуществляли также ПЦР с праймерами, специфичными для -актина. Продукты ПЦР разделяли электрофорезом в геле 1,5% агарозы, линии ДНК количественно оценивали с помощью денситометрического анализа. Рассчитывали соотношение ЕТ-1/-актин. Выполнение ПЦР: После 6 ежедневных инъекций мышам 75% ФГ липосом уровень ЕТ-1 у них снижался на 36% по сравнению с контрольными мышами, получавшими PBS по такому же расписанию инъекций. Результаты представлены в графическом виде на фиг. 14. Это снижение указывает на полезное воздействие на функцию эндотелия пациента-млекопитающего путм опосредованного Th1 уменьшения воспаления в результате инъекции липосом по предпочтительному осуществлению настоящего изобретения. Пример 14. Молекула-1 межклеточной адгезии (intercellular adhesion molecule-1, ICAM-1) - это молекула клеточной поверхности, экспрессируемая некоторыми типами клеток, в том числе лейкоцитами и клетками эндотелия. Она участвует в адгезии моноцитов на клетках эндотелия и играет роль в воспалительных- 17007426 процессах и в опосредованной Т-клетками системе защиты организма-хозяина. Экспрессия ICAM-1, возможно, дат вклад в клиническое проявление различных заболеваний, главным образо, препятствуя проявлению нормальной иммунной функции. Эти заболевания включают злокачественные новообразования(например, меланомы и лимфомы), многие воспалительные расстройства (например, астму и аутоиммунные расстройства), атеросклероз, ишемию, некоторые неврологические расстройства и осложнения при трансплантации аллогенных органов (Van de Stolpe A., Van der Saag P.T. "Intercellular adhesion molecule1" // J. Mol. Med. 1996. T. 74,1. С 13-33). Клетки эндотелия пупочной вены человека (human umbilical vein endothelial cells, HUVEC) - это первичная клеточная линия клеток эндотелия, выделенных из тяжей пупочной вены, как описано далее. Флаконы Т 75 подготавливали, обрабатывая их 0,2% раствором желатина (5-7 мл на флакон) в течение как минимум 15/20 мин или в течение ночи. Избыток раствора затем удаляли. Пупочный жгут перед процедурой выделения опрыскивали 70% этанолом и отрезали все остатки плаценты, ещ остававшиеся прикреплнными к жгуту. Затем жгут нарезали на куски длиной приблизительно 5-6 дюймов. Жгут имеет две толстостенные артерии и одну вену, большей толщины и тонкостенную. Вену локализовали и вводили в не зазубренный конец пробки. Затем жгут привязывали к пробке куском нити длиной около 20 см. После этого жгут многократно промывали, пропуская сквозь него забуференный фосфатом солевой физиологический раствор (PBS) (буферный раствор, состоящий из солевого физиологического раствора(PBS) и фосфатного буфера), пока PBS не выходил прозрачным. После этого в жгут вводили 15-20 мл раствора коллагеназы, его заворачивали в фольгу и инкубировали в течение 15 мин при 37 С. После инкубации привязанный конец жгута отрезали и давали раствору коллагеназы стечь в 50 мл пробирку. Затем снова сквозь жгут пропускали раствор коллагеназы, жгут массировали для высвобождения клеток эндотелия, после этого через жгут пропускали PBS и собирали его в ту же пробирку, в которой был раствор коллагеназы. Раствор центрифугировали при 1600 об/мин, надосадочную жидкость сливали, а осадок ресуспедировали в 10-12 мл полной среды М 199. В конце операции среду, содержащую клетки, помещали в желатинизированные флаконы. Липосомы со средним диаметром 10020 нм были приготовлены согласно стандартным методам,известным в данной области, и имели состав: 75% фосфатидилглицерина (ФГ) и 25% фосфатидилхолина(ФХ). Базовую суспензию с концентрацией липида 40 мМ разбавляли для испытаний до концентрации липида 100 мкМ. Клетки HUVEC распределяли в несколько флаконов для культуры ткани, давали им прикрепиться к поверхности флаконов и затем проводили следующие воздействия: группа А - PBS (негативный контроль),группа В - 500 нг/мл ЛПС (позитивный контроль),группа С - 500 нг/мл ЛПС + 100 мкМ ФГ,группа D - 500 нг/мл ЛПС + 100 мкМ ФХ. Клетки инкубировали при 37 С с 5% СO2. Через 18 ч надосадочные жидкости в каждой группе клеток собирали и анализировали на содержание ЕТ-1, используя стандартный набор для ELISA (полученный от Assay Designs), а клетки собирали для анализа ICAM-1, как указано далее. Клетки вначале промывали PBS, затем инкубировали в буфере для диссоциации клеток при 37 С в течение 25-30 мин. После этого клетки промывали центрифугированием и инкубировали с антителами кCD54 (ICAM-1) в течение 30 мин. Затем добавляли вторичные антитела с флуоресцентным зондом(FITC) и инкубировали их с клетками, как описано выше. Наконец клетки ресуспендировали в 1 мл PBS и анализировали их флуоресценцию в проточном цитометре. Результаты Результаты представлены на фиг. 15, в графическом виде, дающем процентное содержание в соответствующих культурах клеток, позитивных по окраске в отношении ICAM-1. Следует отметить, что количество клеток, позитивных по окраске, в культурах с ФГ липосомами снижено по сравнению с уровнем в негативном контроле и намного ниже, чем уровень в позитивном контроле. Пример 15. Микроглиальные клетки (макрофаги мозга) культивировали, затем измеряли производимый ими воспалительный цитокин - TNF. Клетки стимулировали иммуноглобулином (IgG) от пациентов, страдающих БАС, и в результате этого выход TNF возрастал приблизительно в 800 раз. Если такие же клетки выращивали в присутствии и IgG БАС, и ФГ липосом, выход TNF снижался приблизительно на 75%,что указывает на перспективность предпочтительного варианта осуществления настоящего изобретения для лечения БАС. Результаты представлены на фиг. 16. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция в форме разовых дозировок для введения пациентумлекопитающему, содержащая фармацевтически приемлемые тельца и фармацевтически приемлемый носитель, характеризующаяся тем, что по меньшей мере часть телец имеет размер в интервале приблизи- 18007426 тельно от 20 нм до 500 мкм, и при этом поверхности указанных телец содержат фосфоглицеридные группы или группы, способные к преобразованию в фосфоглицеридные группы, а указанная разовая дозировка содержит от приблизительно 500 до приблизительно 2,5109 телец. 2. Фармацевтическая композиция по п.1, отличающаяся тем, что тельца являются липосомами. 3. Фармацевтическая композиция по п.1 или 2, отличающаяся тем, что композиция существенно свободна от нелипидных фармацевтически активных форм. 4. Фармацевтическая композиция по п.3, отличающаяся тем, что композиция свободна от нелипидных фармацевтически активных форм. 5. Фармацевтическая композиция по любому из пп.2-4, отличающаяся тем, что липосомы содержат от приблизительно 60 до 100% фосфатидилглицерина, причм его головные фосфоглицеридные группы представлены на внешних поверхностях липосом. 6. Фармацевтическая композиция по п.5, отличающаяся тем, что липосомы содержат от 70 до 90% фосфатидилглицерина. 7. Фармацевтическая композиция по п.5 или 6, отличающаяся тем, что вся остальная часть липосомы является фосфатидилхолином. 8. Фармацевтическая композиция по п.1, отличающаяся тем, что указанные тельца содержат поверхностные группы, которые специфически связываются с рецепторами на клетках иммунной системы млекопитающего, специфически предназначенных для связывания фосфоглицеридных групп. 9. Фармацевтическая композиция по любому из предшествующих пунктов, отличающаяся тем, что единичная дозировка содержит от приблизительно 10000 до приблизительно 50000000 телец. 10. Применение композиции, содержащей фармацевтически приемлемые биосовместимые тельца,имеющие размер в интервале от приблизительно 20 нм до 500 мкм и имеющие множество экспрессированных или способных к экспрессии на поверхности фосфоглицеридных активных групп, причм указанная композиция существенно свободна от фармацевтически активных нелипидных форм, в производстве лекарственного средства для лечения или профилактики расстройства, выбранного из опосредованного функцией Т-клеток расстройства, воспалительного расстройства и иммунного расстройства, характеризуемого неадекватной экспрессией цитокинов. 11. Применение по п.10, отличающееся тем, что на поверхности телец экспрессированы фосфоглицеридные группы. 12. Применение по п.10 или 11, отличающееся тем, что фосфоглицеридные активные группы составляют от 60 до 100% активных групп на тельцах. 13. Применение по любому из пп.10-12, отличающееся тем, что фосфоглицеридные активные группы являются головными группами фосфатидилглицериновых (ФГ) лигандов. 14. Применение по любому из пп.10-13, отличающееся тем, что тельцами являются липосомы. 15. Применение по п.14, отличающееся тем, что липосомы на 50-100 мас.% состоят из фосфатидилглицерина. 16. Применение по п.14 или 15, отличающееся тем, что липосомы на 65-90 мас.% состоят из фосфатидилглицерина. 17. Применение по любому из пп.12-16, отличающееся тем, что липосомы имеют диаметр от приблизительно 20 до приблизительно 1000 нм. 18. Применение по любому из пп.10-17, отличающееся тем, что форма разовой дозы указанной композиции содержит от приблизительно 500 до приблизительно 2,5109 телец. 19. Применение по п.18, отличающееся тем, что форма разовой дозы указанной композиции содержит от приблизительно 10 000 до приблизительно 50 миллионов телец. 20. Применение по любому из пп.10-19, отличающееся тем, что расстройство представляет собой опосредованное функцией Т-клеток расстройство, выбранное из язв и аутоиммунных расстройств. 21. Применение по п.20, отличающееся тем, что расстройство представляет собой аутоиммунное расстройство, выбранное из склеродермии, псориаза и ревматоидного артрита. 22. Применение по любому из пп.10-19, отличающееся тем, что расстройство представляет собой воспалительную аллергическую реакцию. 23. Применение по п.22, отличающееся тем, что расстройство представляет собой контактную гиперчувствительность. 24. Применение по п.23, отличающееся тем, что расстройство представляет собой аллергическую реакцию замедленного типа. 25. Применение композиции, содержащей фармацевтически приемлемые биосовместимые тельца,имеющие размер в интервале от приблизительно 20 нм до приблизительно 500 мкм и несущие на себе активные группы, представляющие собой, в основном, фосфоглицеридные группы или группы, способные к превращению в фосфоглицеридные группы, причм указанная композиция существенно свободна от фармацевтически активных нелипидных форм, в производстве лекарственного средства для лечения или профилактики расстройства, связанного с дисфункцией эндотелия, выбранного из болезни закупорки периферических артерий, застойной сердечной недостаточности, желудочковой экстрасистолии, смерти от внезапной остановки сердца, удара, инфаркта миокарда, стенокардии, гипертензии, вазоспастического- 19007426 расстройства, ишемического повреждения и ишемического повреждения вследствие повторной перфузии. 26. Применение по любому из пп.10-19, отличающееся тем, что оно направлено на производство лекарственного средства для лечения или профилактики расстройства, в котором участвует неадекватная экспрессия цитокинов. 27. Применение по п.26, отличающееся тем, что расстройство представляет собой нейродегенеративное заболевание. 28. Применение по п.27, отличающееся тем, что нейродегенеративное заболевание выбрано из синдрома Дауна, болезни Альцгеймера, болезни Паркинсона, старческого слабоумия, депрессии, болезни Хантингтона, заболеваний периферической нервной системы, синдрома Гийена-Барре, заболеваний спинного мозга, заболеваний, связанных с невропатологией суставов, хронических заболеваний с воспалительной демиелинизацией, мононевропатии, полиневропатии, симметричной периферической сенсорной невропатии, расстройств нервно-мышечных соединений, миастений и бокового амиотрофического склероза (БАС). 29. Применение по п.28, отличающееся тем, что нейродегенеративное заболевание представляет собой болезнь Альцгеймера, болезнь Паркинсона или БАС. 30. Применение композиции в форме разовых дозировок, содержащей фармацевтически приемлемые биосовместимые тельца, имеющие размер в интервале от приблизительно 20 нм до приблизительно 500 мкм, в количестве от приблизительно 500 до приблизительно 2,5109 телец, причм указанные тельца имеют на своей поверхности активные группы, представляющие собой фосфоглицеридные группы или группы, способные к превращению в фосфоглицеридные группы, и при этом указанная композиция существенно свободна от фармацевтически активных нелипидных форм, в производстве лекарственного средства для лечения или профилактики атеросклероза. 31. Применение по п.30, отличающееся тем, что тельца представляют собой содержащие фосфатидилглицерин липосомы. 32. Применение по п.31, отличающееся тем, что липосомы на 50-90% состоят из фосфатидилглицерина. 33. Композиция, способная вызывать у млекопитающего противовоспалительную реакцию in vivo,характеризующаяся тем, что указанная композиция содержит фармацевтически приемлемые липосомы,имеющие размер от приблизительно 20 нм до приблизительно 500 мкм, причм липосомы содержат по массе от 50 до 90% фосфатидилглицерина с его фосфоглицеридными активными группами, расположенными на их внешней стороне, и при этом липосомы существенно свободны от нелипидных фармацевтически активных форм. 34. Композиция по п.33, отличающаяся тем, что липосомы содержат по меньшей мере 60 мас.% фосфатидилглицерина. 35. Композиция по п.34, отличающаяся тем, что липосомы содержат приблизительно 70-90% из фосфатидилглицерина. 36. Композиция по любому из пп.33-35, отличающаяся тем, что остальная часть липосомы представляет собой неактивный сокомпонент. 37. Композиция по п.36, отличающаяся тем, что неактивный сокомпонент представляет собой фосфатидилхолин. 38. Композиция по любому из пп.33-37, отличающаяся тем, что указанная композиция свободна от нелипидных фармацевтически активных форм. 39. Композиция по любому из предшествующих пунктов, отличающаяся тем, что липосомы имеют размер приблизительно от 50 до 500 нм. 40. Композиция по п.39, отличающаяся тем, что липосомы имеют размер приблизительно от 80 до 120 нм. 41. Композиция по любому из пп.33-40, отличающаяся тем, что содержит смесь указанных содержащих фосфатидилглицерин (ФГ) липосом с неактивными липосомами и/или липосомами, состоящими из фосфолипидов, действующих по другому механизму, причм ФГ липосомы составляют по меньшей мере 10% от всей смеси. Фиг. 8 ДП (наклон ВПСП) в синапсах проводящих путей с тучными клетками - эффект ФГ липосом Фиг. 9 ДП (наклон ВПСП) в синапсах проводящих путей с тучными клетками - через 40-45 мин после высокочастотных импульсов Данные представлены в виде средних значений со стандартными отклонениями Данные представлены в виде средних значений со стандартными отклонениями Данные представлены в виде средних значений со стандартными отклонениями
МПК / Метки
МПК: A61K 9/127, A61K 31/683
Метки: глицерина, фосфат, несущие, фармацевтически, тельца, приемлемые
Код ссылки
<a href="https://eas.patents.su/25-7426-farmacevticheski-priemlemye-telca-nesushhie-fosfat-glicerina.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтически приемлемые тельца, несущие фосфат глицерина</a>
Предыдущий патент: Несущая пластина, удерживающая абразивный элемент и абразивный диск
Следующий патент: Способ предотвращения или отсрочки катетерной реваскуляризации
Случайный патент: Погруженный трансформатор, самозащищенный устройством, включающим автоматический выключатель и плавкие предохранители












