Тиенодибензоазуленовые соединения в качестве ингибиторов фактора некроза опухоли
Номер патента: 6069
Опубликовано: 25.08.2005
Авторы: Пешич Дияна, Хрвачич Бошка, Жупанович Желько, Мерчеп Младен, Месич Милан
Формула / Реферат
1. Соединение формулы I и его фармакологически приемлемые соли и сольваты
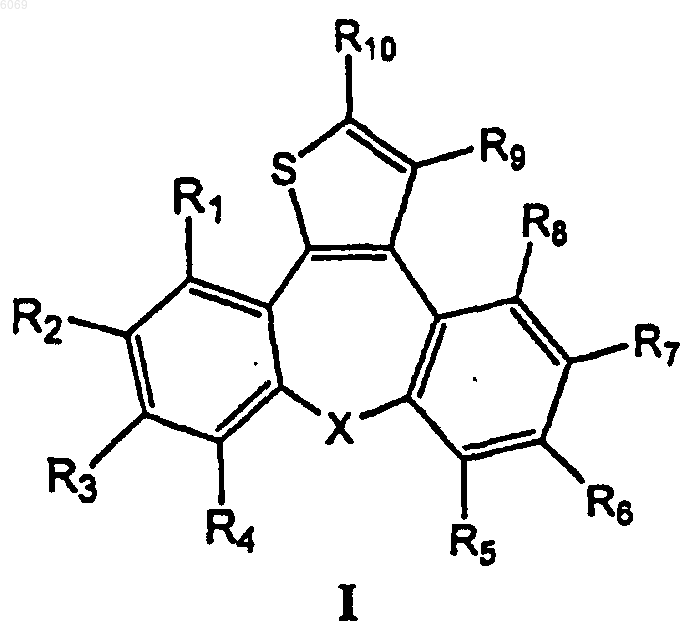
где X представляет CH2 или гетероатом, выбранный из группы, включающей O, S и NR13, в котором R13 означает водород, C7-C10арилкарбонил;
R1, R5, R7, R8 и R9 независимо друг от друга представляют водород;
R2, R3 и R4 независимо представляют водород, фтор, хлор, бром, C1-C7алкил, галогенметил, C1-C7 алкокси или C1-C7алкилтио;
R6 представляет водород, фтор, хлор, бром;
R10 представляет CH2OH, CHO или C1-C15алкиламин, представленный общей формулой
-(CH2)n-A,
в которой n означает целое число 1-3, а одна или несколько метиленовых групп могут быть замещены атомом кислорода, и
A представляет насыщенное или ненасыщенное пяти- или шестичленное кольцо с одним-тремя гетероатомами, выбранными из группы, включающей O, S и N, или группу формулы

где R11 и R12 независимо друг от друга представляют водород или C1-C7алкил.
2. Соединение и соль по п.1, где R10 представляет CH2OH, или CH2O(CH2)n-A.
3. Соединение и соль по п.2, где A представляет морфолин-4-ил, пиперидин-1-ил или пирролидин-1-ил.
4. Соединение и соль по п.1, где A представляет
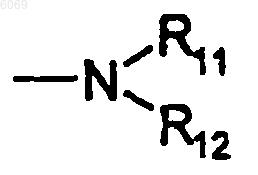
где R11 и R12 независимо друг от друга представляют водород или C1-C7алкил.
5. Соединение и соль по п.4, где R11 и R12 представляет H, -CH3 или -CH2CH3.
6. Соединение и соль по п.1, где R2 представляют H, SCH3, F, Cl, Br или CH3.
7. Соединение и соль по п.1, где R3 представляет H, OCH3, F, Cl, Br, CF3 или CH3.
8. Соединение и соль по п.1, где R4 представляет H, F, Cl или CH3.
9. Соединение и соль по п.1, где R6 представляет H, F или Cl.
10. Способ получения соединения формулы I или его фармацевтически приемлемых солей или сольватов по п.1, который включает
A) восстановление сложного эфира формулы (i),

где X, R1, R2, R3, R4, R5, R6, R7, R8 и R9 имеют значения, указанные в п.1, путем обработки гидридом металла в неполярном растворителе при температуре от 0 до 60шC в течение 1-5 ч с получением спирта, представленного формулой (ii)
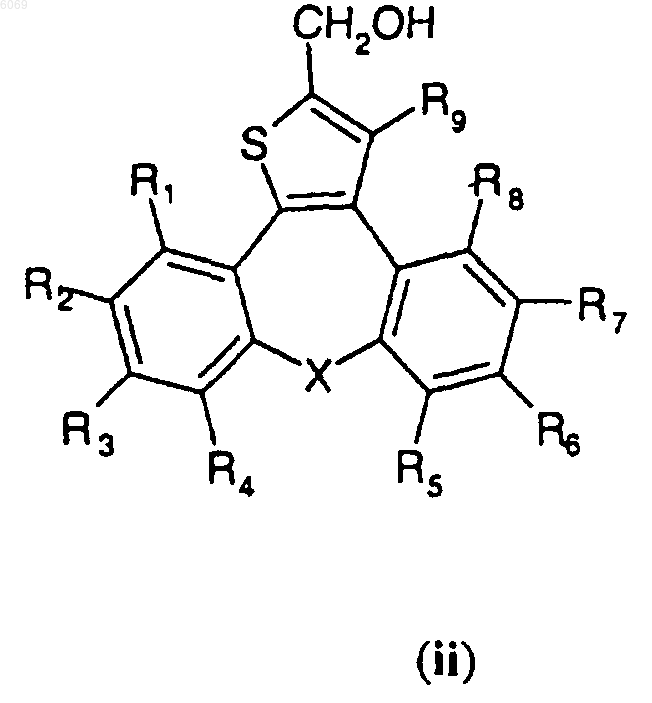
где X, R1, R2, R3, R4, R5, R6, R7, R8 и R9 имеют значения, указанные в п.1,
B) взаимодействие спирта формулы (ii) с соединением формулы III в присутствии катализатора фазового переноса, выбранного из группы, включающей бензилтриэтиламмонийхлорид, бензилтриэтиламмонийбромид и цетилтриметилбромид, в двухфазной щелочной среде при температуре от 20 до 100шC в течение 1-24 ч
Cl-(CH2)n-A III
с получением аминосоединения формулы I, где n и A имеют значения, указанные в п.1;
C) необязательно окисление спирта формулы (ii) пиридинилдихроматом или пиридинилхлорхроматом в дихлорметане при комнатной температуре в течение 1-2 ч с получением альдегида, представленного формулой (iii)
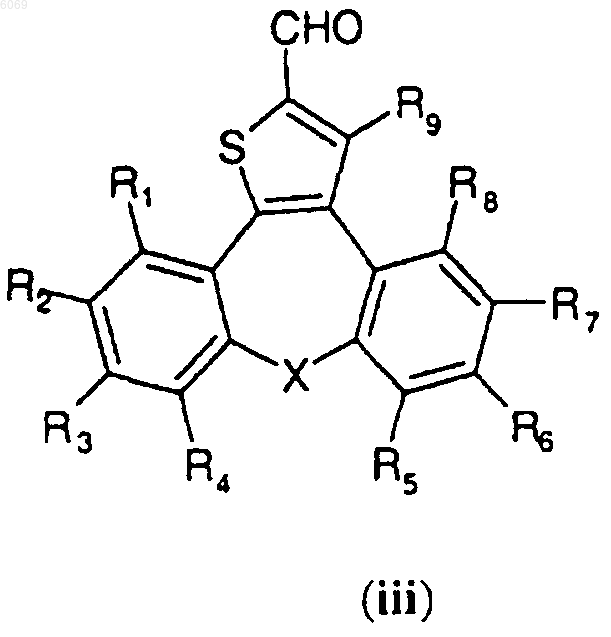
где X, R1, R2, R3, R4, R5, R6, R7, R8 и R9 имеют значения, указанные в п.1.
11. Соединение формулы I или его фармакологически приемлемые соли или сольваты по п.1, выбранные из группы:
диметил[3-(8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропил]амингидрохлорид,
диметил[2-(8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]амингидрохлорид,
4-[2-(8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]морфолингидрохлорид,
1-[2-(8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид,
1-[2-(8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пирролидингидрохлорид,
[3-(9-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропил]диметиламин,
[2-(9-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]диметиламин,
4-[2-(9-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]морфолин,
1-[2-(9-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пиперидин,
1-[2-(9-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пирролидин,
[3-(11-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропил]диметиламин,
[2-(11-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]диметиламин,
4-[2-(11-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]морфолин,
1-[2-(11-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пиперидин,
1-[2-(11-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пирролидин,
[3-(11-фтор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропил]диметиламин гидрохлорид,
[2-(11-фтор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид,
4-[2-(11-фтор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]морфолингидрохлорид,
1-[2-(11-фтор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид,
1-[2-(11-фтор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пирролидингидрохлорид,
[3-(1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид,
[2-(1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид,
4-[2-(1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]морфолингидрохлорид,
1-[2-(1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид,
1-[2-(1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пирролидингидрохлорид,
[3-(11-фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид,
[2-(11-фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид,
4-[2-(11-фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]морфолингидрохлорид,
1-[2-(11-фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид,
1-[2-(11-фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пирролидингидрохлорид,
[3-(11-хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид,
[2-(11-хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид,
4-[2-(11-хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]морфолингидрохлорид,
1-[2-(11-хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид,
1-[2-(11-хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пирролидингидрохлорид,
[3-(11-бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид,
[2-(11-бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид,
4-[2-(11-бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]морфолин,
1-[2-(11-бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пиперидин,
1-[2-(11-бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пирролидин,
[3-(10-трифторметил-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламин,
диметил[2-(10-трифторметил-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]амингидрохлорид,
4-[2-(10-трифторметил-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]морфолин,
1-[2-(10-трифторметил-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид,
1-[2-(10-трифторметил-1,8-дитиадибензю[e,h]азулен-2-илметокси)этил]пирролидингидрохлорид,
[3-(10-хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламин,
[2-(10-хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид,
1-[2-(10-хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид,
1-[2-(10-хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пирролидин,
[3-(10-бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид,
[2-(10-бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид,
1-[2-(10-бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид,
1-[2-(10-бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пирролидин,
[2-(10-бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид,
[3-(9,11-диметил-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид,
[2-(9,11-диметил-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид,
1-[2-(9,11-диметил-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пирролидингидрохлорид,
[3-(10,11-дихлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид,
[2-(10,11-дихлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид,
4-[2-(10,11-дихлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]морфолингидрохлорид,
1-[2-(10,11-дихлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид,
1-[2-(10,11-дихлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пирролидингидрохлорид,
[3-(9-хлор-11-фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид,
[2-(9-хлор-11-фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид,
3-(11-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропиламин,
3-(8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропиламин,
N,N-диметил[3-(11-метилсульфанил-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]амин,
N,N-диметил[2-(11-метилсульфанил-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]амин,
N,N-диметил[3-(10-метил-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]амин,
N,N-диметил[2-(10-метил-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]амин,
N,N-диметил[3-(11метил-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]амин,
N,N-диметил[2-(11метил-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]амин,
N,N-диметил[3-(10-метокси-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропил]амин,
N,N-диметил[2-(10-метокси-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]амин,
1-(2-(10-метокси-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пиперидин,
1-(2-(10-метокси-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пирролидин,
3-(10-метокси-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропиламин,
N,N-диметил[3-(6-хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]амин,
N,N-диметил[2-(6-хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]амин,
[3-(6-хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]амин,
N,N-диметил[3-(10-фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]амин,
N,N-диметил[2-(10-фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]амин,
[2-(3-диметиламинопропоксиметил)-1-тиа-8-азадибензо[e,h]азулен-8-ил]фенилметанон,
[2-(2-диметиламиноэтоксиметил)-1-тиа-8-азадибензо[e,h]азулен-8-ил]фенилметанон,
N,N-диметил[3-(8H-1-тиа-8-азадибензо[e,h]азулен-2-илметокси)пропил]амин,
N,N-диметил[2-(8H-1-тиа-8-азадибензо[e,h]азулен-2-илметокси)этил]амин,
[3-(11-фтор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропил]амингидрохлорид,
[3-(1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]амин,
N,N-диметил{3-[(8H-1-тиадибензо[e,h]азулен-2-ил)метокси]пропил}амин и
N,N-диметил{2-[(8H-1-тиадибензо[e,h]азулен-2-ил)метокси]этил}амин.
12. Применение соединения по п.1 для изготовления фармацевтических композиций для лечения или профилактики патологических состояний или заболеваний, индуцированных чрезмерным нерегулируемым продуцированием цитокинов или воспалительных медиаторов.
Текст
006069 Область техники, к которой относится изобретение Настоящее изобретение относится к новым производным 1-тиадибензоазулена, их фармакологически приемлемым солям, сольватам и пролекарственным формам, способам их получения и их противовоспалительному действию, в частности, к ингибированию продуцирования -фактора некроза опухоли(TNF-) и интерлейкина-1 (IL-1), и к их аналгезирующему действию. Предшествующий уровень техники Ранее в литературе уже были описаны 1-тиадибензоазулены, которые в положении 2 замещены метилом, метилкетоном, нитрогруппой или производным карбоксильной группы (Cagniant P. and Kirsch G.,С.R. Hebd. Sceances Acad. Sci., 1976, 283:638-686). Однако в соответствии со знаниями авторов изобретения и имеющимися литературными данными ни производные 1-тиадибензоазулена общей формулы I, ни какие-либо способы их получения до сих пор не описаны. Неизвестно также что-либо о том, что 1 тиадибензоазулены обладают противовоспалительным действием. В 1975 г. TNF- был определен в качестве сывороточного фактора, индуцируемого эндотоксином,вызывающего некроз опухоли в условиях in vitro и in vivo (Carswell E.A. at al., Proc. Natl. Acad. Sci U.S.A. 1975, 72:36666-3670). Помимо противоопухолевой активности TNF- обладает и некоторыми другими биологическими активностями, которые существенны для гомеостаза организма, а также для патофизиологических состояний. Основными источниками TNF- являются моноциты-макрофаги, Т-лимфоциты и тучные клетки. Обнаружение того факта, что антитела анти-TNF- (сА 2) эффективны для лечения пациентов, страдающих ревматоидным артритом (RA) (Elliott M. at al., Lancet 1994, 544:1105-1110), усилило интерес к поиску новых ингибиторов TNF- в качестве возможных сильнодействующих лекарственных средств для лечения RA. Ревматоидный артрит является аутоиммунным хроническим воспалительным заболеванием, характеризующимся необратимыми патологическими изменениями суставов. Кроме RA антагонисты TNF- применимы также для лечения некоторых патологических состояний и заболеваний, таких как спондилит, остеоартрит, подагрический артрит и другие артритные состояния, сепсис, септический шок, токсический шоковый синдром, атопический дерматит, контактный дерматит, псориаз, гломерулонефрит, красная волчанка, склеродерма, астма, кахексия, хроническое обструктивное легочное заболевание, застойная сердечная недостаточность, резистентность к инсулину, фиброз легких, множественный склероз, болезнь Крона, язвенный колит, вирусные инфекции и СПИД. Доказательство биологической важности TNF- было получено в экспериментах in vivo на мышах,обладающих инактивированными генами TNF- или его рецептора. Такие животные оказались устойчивыми к коллаген-индуцированному артриту (Mori L. at al., J. Immunol. 1996, 157:3178-3182) и к эндотоксин-индуцированному шоку (Pfeffer К. at al., Cell 1993, 73:457-467). В экспериментах на животных, обладающих повышенным уровнем TNF-, возникает хронический воспалительный полиартрит (Georgopoulos S at al., J. Inflamm. 1996, 46:86-97; Keffer J. at al., EMBO J. 1991, 20:4025-4031), течение которого временно облегчается ингибиторами продуцирования TNF-. Лечение таких воспалительных и патологических состояний обычно включает применение нестероидных противовоспалительных лекарственных средств, но в тяжелых случаях, однако, вводят соли золота, D-пеницилламин или метотрексат. Указанные лекарственные средства действуют симптоматически и не останавливают патологический процесс. Новые подходы в терапии ревматоидного артрита базируются на использовании таких лекарственных средств, как тенидап, лефлуномид, циклоспорин, FK-506, и биомолекул, нейтрализующих активностьTNF-. В настоящее время в продаже имеется химерный белок растворимого TNF-рецептора, именуемого этанерцепт (Enbrel, Immunex/Wyeth), а также мышиные и человеческие химерные моноклональные антитела, именуемые инфликсимаб (Remicade, Centocor). Кроме RA-терапии этанерцепт и инфликсимаб апробированы также для лечения болезни Крона (Exp. Opin. Invest Drugs 2000, 9, 103). В RA-терапии, помимо ингибирования секреции TNF-, важно также подавить секрецию IL-1, поскольку IL-1 является важным цитокином для клеточной регуляции, иммунорегуляции и для патофизиологических состояний, таких как воспалительный процесс (Dinarello С.A. at al., Rev. Infect. Disease, 1984,6:51). Известными биологическими активностями IL-1 являются: активация Т-клеток, индуцирование повышенной температурой, стимуляция секреции простагландина или коллагеназы, хемотаксис нейтрофилов и снижение уровня железа в плазме (Dinarello С.A. at al., J. Clinical Immunology, 1985, 5:287). Известны два рецептора, с которыми может быть связан IL-1: IL-1RI и IL-1RII. IL-1RI переносит сигнал внутриклеточно, а IL-1RII присутствует на клеточной поверхности и не осуществляет передачу сигнала внутри данной клетки. Поскольку IL-1RII связывает как IL-1, так и IL-1RI, он может действовать в качестве негативного регулятора функции IL-1. Помимо упомянутого механизма регуляции передачи сигнала, в клетках присутствует и другой природный антагонист рецептора IL-1 (IL-1ra). Этот белок связан сIL-1RI, но не осуществляет передачу какого-либо сигнала. Кроме того, его эффективность в ингибировании передачи сигнала невелика, поэтому, чтобы воспрепятствовать передаче сигнала, он должен присутствовать в концентрации в 500 раз большей, чем IL-1. Рекомбинантный IL-1ra человека (Amgen) проверили клинически (Breshihan В. at al., Artrit. Rheum. 1996, 39:73) и, в сравнении с плацебо, получили результаты, свидетельствующие об улучшении симптомов у 472 пациентов, страдающих RA. Эти результа-1 006069 ты указывают на важность ингибирования активности IL-1 при лечении таких заболеваний как RA, поскольку ингибируется продуцирование IL-1. Вследствие синергического действия TNF- и IL-1, дибензоазулены могут использоваться при лечении состояний и заболеваний, связанных с повышенной секрецией TNF- и IL-1. В соответствии с известными и ранее установленными данными соединения 1-тиадибензоазулена,являющиеся предметом настоящего изобретения, их фармакологически приемлемые соли, гидраты, пролекарственные формы и фармацевтические композиции, содержащие их, прежде не были описаны. Более того, соединения, являющиеся предметом настоящего изобретения, не были описаны ни в качестве противовоспалительного вещества, ни в качестве ингибитора секреции TNF- и IL-1, или анальгетика. Техническое решение Настоящее изобретение относится к соединением, представленным общей формулой I, производным 1-тиадибензоазулена, к их фармакологически приемлемым солям и сольватам, представленным формулой I в которой Х может представлять СН 2 или гетероатом, такой как О, S, S(=O), S(=O)2 или NR13, где R13 означает водород, C1-6 алкил, C1-6 алкилкарбонил, арилкарбонил, C1-6 алкилсульфонил или арилсульфонил, аR1, R2, R3, R4, R5, R6, R7, R8, R9, независимо друг от друга, представляют заместители, которые могут представлять собой водород, галогены (фтор, хлор или бром); или С 1-С 7 алкилы, алкенилы, арилы или гетероарилы; либо могут представлять различные группы: галогенметильную, гидрокси, С 1-С 7 алкокси или арилокси, С 1-С 7 алкилтио или арилтио, С 1-С 7 алкилсульфонильную, циано, амино, моно- и ди-С 1-С 7 замещенные амины, производные карбоксильной группы (С 1-С 7 карбоновые кислоты и их ангидриды,С 1-С 7-незамещенные, моно-, дизамещенные амиды, С 1-С 7 алкиловые или ариловые сложные эфиры),С 1-С 7-производные карбонильной группы (С 1-С 7 алкил или арилкарбонилы), а R10 может представлять заместители, такие как С 2-С 15 алкилы, С 2-С 15 алкенилы, С 2-С 15 алкинилы, арилы или гетероарилы, С 1-С 15 галогеналкилы, С 1-С 15 гидроксиалкилы, С 1-С 15 алкилокси, С 1-С 15 алкилтио, С 3-С 15 алкилкарбонилы, С 2-С 15 алкилкарбоновая кислота, С 2-С 15 алкиловые сложные эфиры, С 1-С 15 алкилсульфонилы, С 1-С 15 алкиларилсульфонилы, арилсульфонилы и С 1-С 15 алкиламины, представленные общей формулой-(СН 2)n-А,в которой n означает 1-15, а одна или несколько метиленовых групп могут быть замещены атомом кислорода или серы, а А представляет пяти- или шестичленное, насыщенное или ненасыщенное кольцо с одним, двумя или тремя гетероатомами, или в которой R11 и R12, независимо друг от друга, представляют водород, С 1-С 7 алкил, алкенил, алкинил,арил или гетероарил, либо гетероцикл с 1-3 гетероатомами. Используемые в настоящем изобретении термины определены как изложено ниже, если не оговорено иначе."Алкил" означает моновалентный алкан (углеводород), из которого получен радикал, который может быть неразветвленным, разветвленным или циклическим углеводородом, или представлять собой сочетание неразветвленного и циклического углеводородов, а также разветвленного и циклического углеводородов. Предпочтительные неразветвленные или разветвленные алкилы включают метил, этил,пропил, изопропил, бутил, втор-бутил и трет-бутил. Предпочтительные циклоалкилы включают циклопентил и циклогексил. Алкил также представляет неразветвленную или разветвленную алкильную группу, содержащую или прерванную циклоалкильной частью."Алкенил" означает углеводородный радикал, который является неразветвленным, разветвленным или циклическим углеводородом, или сочетанием неразветвленного и циклического углеводородов и разветвленного и циклического углеводородов, который обладает по меньшей мере одной двойной углерод-углеродной связью. Подразумеваются, в частности, этенил, пропенил, бутенил и циклогексенил. Как указано выше в определении "алкил", алкенил также может быть неразветвленной, разветвленной или циклической группой, а часть алкенильной группы может содержать двойные связи и она может также быть замещенной, если замещенная алкенильная группа представляет интерес. Алкенил также представляет собой неразветвленную или разветвленную алкенильную группу, содержащую или прерванную циклоалкильной частью."Алкинил" означает углеводородный радикал, который является неразветвленным или разветвленным, и содержит по меньшей мере одну и, самое большее, три тройных углерод-углеродных связи. Подразумеваются, в частности, этинильная, пропинильная и бутинильная группы."Арил" означает ароматическое кольцо, такое как фенил, замещенный фенил или аналогичные группы, а также конденсированные кольца, такие как нафтил и т.п. Арил содержит по меньшей мере одно кольцо по меньшей мере с 6 углеродными атомами, или два кольца, которые вместе содержат 10 углеродных атомов и чередующиеся с углеродными атомами двойные (резонансные) связи (в частности, фенил и нафтил). Арильные группы могут быть дополнительно замещены одним или двумя заместителями,такими как галогены (фтор, хлор и бром), гидрокси, С 1-С 7 алкил, С 1-С 7 алкокси или арилокси, С 1-С 7 алкилтио или арилтио, алкилсульфонильная, циано или аминогруппы."Гетероарил" означает моноциклический или бициклический ароматический углеводород, содержащий по меньшей мере один гетероатом, такой как О, S или N, с углеродом и азотом, представляющими центры связывания в основной формуле. Гетероарил может быть дополнительно замещен галогеном или СF3-группой и низшим алкилом, таким как метил, этил и пропил. Гетероарил означает ароматическую и частично ароматическую группу с одним или несколькими гетероатомами. Примерами данного типа являются тиофен, пиррол, имидазол, пиридин, оксазол, тиазол, пиразол, тетразол, пиримидин, пиразин и триазин. Другой целью настоящего изобретения является способ получения производных дибензоазулена,представленных формулой I. Данные соединения можно получить из тиофеновых сложных эфиров общей формулы I, в которой все радикалы и символы имеют указанные выше значения, т.е. когда радикалыR1, R2, R3, R4, R5, R6, R7, R8 и R9 имеют указанные выше значения, a R10 означает этоксикарбонил (Cagniant P. and Kirsch G., С. R. Hebd. Sceances Acad. Sci., 1976, 283:683-686). С помощью последующих реакций указанные сложные эфиры преобразуют в другие заместители, определенные как R10. Такие реакции включают восстановление сложного эфира до соответствующего спирта или альдегида, алкилирование и другие нуклеофильные реакции по этоксикарбонильной группе (схема 1). Восстановление этоксикарбонильной группы осуществляют с использованием металлогидридов для получения спирта (R10 = гидроксиметил). Данную реакцию осуществляют в соответствующих неполярных растворителях (предпочтительно в алифатических простых эфирах) при температуре от 0 до 36 С в течение от 1 до 5 ч. Выделение и очистку полученных соединений можно проводить путем перекристаллизации или колоночной хроматографией. При взаимодействии спирта общей формулы I, в которой R10 соответствует гидроксиметилу, и хлорида формулы II Сl-(СН 2)n-АII,где символы n и А имеют указанные выше значения, получают -аминоэфиры общей формулы I.-3 006069 Указанные реакции осуществляют при температуре от 20 до 100 С в течение от 1 до 24 ч в условиях межфазного катализа в двухфазной системе (предпочтительно 50% NaOH-толуол) и в присутствии межфазного катализатора (предпочтительно бензилтриэтиламмонийхлорида, бензилтриэтиламмонийбромида, цетилтриметилбромида). После обработки данной реакционной смеси полученные продукты выделяют перекристаллизацией или хроматографией на колонке с силикагелем. При окислении спирта общей формулы I, где R10 = гидроксиметилу, с помощью пиридинилдихромата или пиридинилхлорхромата получают альдегид общей формулы I, где R10 = СНО. Данную реакцию осуществляют в дихлорметане при комнатной температуре в течение от 2 до 5 ч. Получаемый альдегид выделяют очисткой в результате пропускания через колонку с флоризилом или силикагелем. Взаимодействие альдегида общей формулы I, где R10 = СНО, с различными соответствующими фосфорилидами приводит к образованию соединений общей формулы I, где R10 имеет указанные выше значения и который обладает алкеновой функцией в положении 2 цепи, определяющей R10. Данные реакции осуществляют в безводных растворителях, таких как толуол, бензол или гексан, при температуре кипения данного растворителя от 3 до 5 ч. Полученные продукты очищают с помощью колоночной хроматографии. При гидрировании соединений I, в которых R10 содержит одну или несколько двойных углеродуглеродных связей, получают соединения общей формулы I, где R10 представлен насыщенной цепью. Данные реакции осуществляют, как правило, с 5% Pd на активированном угле в этаноле, этилацетате или ином подходящем растворителе, при давлении водорода от 6,7 х 104 до 4,0 х 105 Па. После фильтрования и выпаривания растворителей получают насыщенные продукты, которые можно очистить до требуемой степени чистоты перекристаллизацией или колоночной хроматографией на силикагеле. Фармацевтически подходящие соли соединений, являющихся предметом настоящего изобретения,включают соли неорганических кислот (хлористо-водородной, бромисто-водородной, фосфорной, метафосфорной, азотной и серной кислот) или органических кислот (винной, уксусной, трифторуксусной,лимонной, малеиновой, молочной, фумаровой, бензойной, янтарной, метансульфоновой и паратолуолсульфоновой кислот). Еще одна цель настоящего изобретения заключается в применении соединений настоящего изобретения при лечении воспалительных заболеваний и состояний, в частности всех заболеваний и состояний,индуцируемых чрезмерной секрецией TNF- и IL-1. Эффективная доза ингибиторов продуцирования цитокина или медиатора воспаления настоящего изобретения, или их фармацевтически приемлемых солей, пригодна для получения лекарственных средств для лечения и профилактики какого-либо патологического состояния или заболевания, индуцированного чрезмерным нерегулируемым продуцированием цитокинов или медиаторов воспаления. В частности, настоящее изобретение относится к эффективной дозе ингибиторов TNF-, которую можно определить традиционными способами. Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим эффективную нетоксичную дозу соединений настоящего изобретения, а также фармацевтически приемлемые носители и растворители. Получение данных фармацевтических композиций может включать смешивание, гранулирование,таблетирование и растворение соответствующих ингредиентов. Химические носители могут находиться в твердой или жидкой форме. Твердые носители могут представлять собой лактозу, сахарозу, тальк, желатину, агар, пектин, магнийстеарат, жирные кислоты и т.п. Жидкие носители могут быть представлены сиропами, маслами, такими как оливковое, подсолнечное или соевое масло, водой и т.п. Точно так же,носители могут, кроме того, содержать компонент для замедленного высвобождения активного компонента, такой как глицерилмоностеарат или глицерилдистеарат. Можно изготовить несколько форм фармацевтических композиций. При использовании твердого носителя такие формы могут включать таблетки, твердые желатиновые капсулы, порошки или гранулы, которые можно вводить перорально в капсулах. Количество твердого носителя может варьироваться, но, в основном, оно колеблется в диапазоне от 25 мг до 1 г. При использовании жидкого носителя композиция может быть представлена в форме сиропа, эмульсии, мягких желатиновых капсул, стерильных жидкостей для инъекций, таких как ампулы, или неводных жидких суспензий. Соединения настоящего изобретения можно вводить перорально, парентерально, местно, интраназально, интраректально и интравагинально. "Парентерально" означает внутривенное, внутримышечное и подкожное введение. Соответствующие композиции соединений настоящего изобретения могут использоваться для профилактики, а также для лечения некоторых заболеваний и патологических воспалительных состояний, вызванных чрезмерным нерегулируемым продуцированием цитокинов или медиаторов воспаления, прежде всего TNF-. Такие заболевания и состояния включают ревматоидный артрит, ревматоидный спондилит, остеоартрит и иные артритные патологические состояния и заболевания, экзему,псориаз, а также другие воспалительные состояния кожи, такие как ожоги, вызванные УФ-облучением Ингибирующий эффект соединений настоящего изобретения на секрецию TNF- и IL-1 определяли в следующих ниже экспериментах in vitro и in vivo: Определение секреции TNF- и IL-1 в моноядерных клетках периферической крови человека in vitro. Моноядерные клетки периферической крови (РМВС) готовили из гепаринизированной цельной крови после отделения РМВС на Фиколл-Гипаке (Amersham-Pharmacia). Для определения уровня TNF культивировали 3,5-5 х 104 клеток в общем объеме 200 мкл в течение 18-24 ч в плоскодонных планшетах для микротитрования (96 лунок, Falcon) в среде RPMI 1640 с добавлением 10% инактивированной нагреванием АВ-сыворотки человека (Hrvatski zavod za transfuzijsku medicinu, Zagreb), пенициллина 100 единиц/мл, стрептомицина 100 мг/мл и 20 мМ HEPES (GIBCO). Клетки инкубировали при 37 С в атмосфере с 5% СО 2 и влажности 90%. Клетки для негативного контроля культивировали лишь в данной среде (NC), а секрецию TNF- в позитивном контроле стимулировали добавлением липополисахарида 1 мкг/мл (LPS, Е. coli серотип 0111:В 4, SIGMA) (PC), и действие испытуемых веществ на секрецию TNFпроверяли после их добавления к клеточным культурам, стимулированным LPS (TS). Уровень TNF- в клеточном супернатанте определяли с помощью ELISA в соответствии с указаниями производителей(RD Systems). Чувствительность теста составляла 3 пкг/мл TNF-. Определение уровня IL-1 осуществляли как указано для определения TNF-, за тем исключением, что использовали 1 х 105 клеток/лунка иLPS в количестве 0.1 нг/мл. Уровень IL-1 определяли с помощью ELISA (RD Systems). Процент ингибирования продуцирования TNF- или IL-1 в процентах вычисляли с помощью следующего уравнения:% ингибирования = [1-(TS-NC)/(PC-NC)]100. Величину IC-50 определяли как концентрацию данного вещества, при которой ингибируется продуцирование 50% TNF-. Соединения, демонстрирующие IC-50 при концентрациях 20 мкМ или ниже,считаются активными. Определение секреции TNF- и IL-1 мышиными перитонеальными макрофагами in vitro Для получения перитонеальных макрофагов самцам мышей BALB/c в возрасте 8-12 недель инъецировали i.p. 300 мкг зимозана (SIGMA), растворенного в фосфатном буфере (PBS) в общем объеме 0,1 мл/мышь. Через 24 ч инъецированных мышей подвергали эйтаназии в соответствии с Laboratory AnimalsWelfare Act (Закон о гуманном отношении к лабораторным животным). Брюшинную полость мыши промывали 5 мл стерильного физиологического раствора. Полученные перитонеальные макрофаги дважды промывали стерильным физраствором и после заключительного центрифугирования (800 g) их ресуспендировали в RPMI 1640. Для определения секреции TNF- макрофаги в концентрации 5 х 104 клеток/лунка общим объемом 200 мкл культивировали в течение 18-24 ч в плоскодонных планшетах для микротитрования (96 лунок, Falcon) в среде RPMI 1640 с добавлением 10% инактивированной нагреванием околоплодной сыворотки теленка (FCS), пенициллина 100 единиц/мл, стрептомицина 100 мг/мл, 20 мМ HEPES и 50 мкМ 2- меркаптоэтанола (все от GIBCO). Данные клетки инкубировали при 37 С в атмосфере с 5% СO2 и 90% влажности. В негативном контроле клетки культивировали в одной лишь данной среде (NC), а в положительном контроле секрецию TNF- стимулировали добавлением липополисахарида 1 мкг/мл (LPS, Е. coli серотип 0111:В 4, SIGMA) (PC) и влияние испытуемых веществ на секрециюTNF- проверяли после их добавления к клеточной культуре, стимулированной LPS (TS). Уровень TNF в клеточном супернатанте определяли с помощью ELISA в соответствии с инструкциями производителя (RD Systems, Biosource). Определение уровня IL-1 осуществляли, как указано для определения TNF, за тем исключением, что использовали 1 х 105 клеток/лунка и 0,1 нг/мл LPS. Уровень IL-1 определяли с помощью ELISA (RD Systems). Процент ингибирования продуцирования TNF- или IL-1 рассчитывали с помощью следующего уравнения:% ингибирования = [1-(TS-NC)/PC-NC]100. Величину IC-50 определяли в виде концентрации данного вещества, при которой ингибируется продуцирование 50% TNF-. Соединения, показывающие IC-50 при концентрации 10 мкМ или ниже,считают активными.(Badger A.M. at al., J. of Pharmac. and Env. Therap. 1996, 279:1453-1461). В опыте использовали группу из 6-10 самцов мышей BALB/c в возрасте 8-12 недель. Животных подвергали р.о. обработке либо одного лишь растворителя (в негативном и позитивном контроле), либо растворами данного вещества за 30 мин до i.p. воздействия с помощью LPS (Е. coli серотип 0111:В 4, Sigma) в дозе 25 мкг/животное. Через два часа данных животных подвергали эйтаназии посредством i.p. инъекции Roumpun (Bayer) и Кетанеста (Park-Davis). У каждого животного отбирали образец крови в пробирку "vacutaner" (Becton Dickinson) и в соответствии с инструкциями изготовителя отделяли плазму. Уровень TNF- в плазме определяли с помощью ELISA (Biosource, RD Systems) в соответствии со способом, предусмотренным производителем. Чувствительность теста равна 3 пкг/мл TNF% ингибирования = [1-(TS-NC)/PC-NC]100. Соединения, демонстрирующие 30% ингибирования продуцирования TNF- или больше при дозе 10 мг/кг, считают активными. Тест на анальгетическую активность при болевой судороге В данном опыте боль у мышей индуцировали инъекцией в брюшную полость раздражающего средства, обычно уксусной кислоты. Инъецированные животные отвечали на это характерными судорогами,которые и дают название осуществляемому тесту. (Collier H.O.J. at al., Pharmac. Chemother., 1968, 32:295310; Fukawa К. at al., J. Pharmacol. Meth., 1980, 4:251-259; Schweizer A. at al., Agents Actions, 1988, 23:2931). Данный тест пригоден для определения анальгетической активности соединений. Способ: использовали самцов мышей BALB/c (Charles River, Италия) в возрасте 8-12 недель. В контрольной группе мышам вводили метилцеллюлозу р.о. за 30 мин до i.p. введения уксусной кислоты в концентрации 0,6%, а в подопытных группах мышам вводили р.о. в метилцеллюлозе эталонное вещество (ацетилсалициловая кислота) или испытуемые вещества за 30 мин до i.p. введения 0,6% уксусной кислоты (в объеме 0,1 мл/10 г). Мышей индивидуально помещали под стеклянные воронки и в течение 20 мин регистрировали количество болевых судорог каждого животного. Процент ингибирования болевых судорог рассчитывали по уравнению% ингибирования = (среднее значение числа болевых судорог в контрольной группе - число болевых судорог в подопытной группе)/число болевых судорог в контрольной группе 100. Соединения, демонстрирующие такую же или лучшую анальгетическую активность в сравнении с ацетилсалициловой кислотой, считают активными.In vivo-модель индуцированного LPS шока у мышей Использовали самцов мышей BALB/c в возрасте 8-12 недель (Charles River, Италия). LPS, выделенный из Serratie marcessans, (Sigma, L-6136) разводили в стерильном физиологическом растворе. Первую инъекцию LPS вводили подкожно в дозе 4 мкг/мышь. Через 18-24 ч вводили заключительную i.v. инъекцию LPS в дозе 200 мкг/мышь. В контрольной группе вводили две инъекции LPS описанным выше способом. Подопытным группам соответствующие вещества вводили р.о. за полчаса и за 1 ч перед каждым введением LPS. Выживаемость наблюдали через 24 ч. Соединения, приводящие к 40% или большей выживаемости при дозе 30 мг/кг, считают активными. Соединения примеров 1, 5, 19 и 21 демонстрируют активность по меньшей мере в двух проведенных опытах. Вместе с тем, данные результаты иллюстрируют лишь биологическую активность данных соединений и никоим образом не ограничивают настоящее изобретение. Способы получения и примеры Настоящее изобретение хотя и иллюстрируется, но в любом случае не ограничивается следующими ниже примерами. Пример А. Получение спирта. К суспензии LiAlH4 в безводном эфире (10 ммоль/15 мл сухого эфира) по каплям добавляют эфирный раствор сложного эфира (2 ммоль/15 мл сухого эфира). Данную реакционную смесь перемешивают при комнатной температуре в течение 4 ч. Затем, после того как весь сложный эфир израсходован в данной реакции (ход реакции отслеживают с помощью тонкослойной хроматографии), избыток LiAlH4 разлагают добавлением диэтилового эфира и воды. Полученный белый осадок отфильтровывают и, после высушивания над безводным Na2SO4, полученный фильтрат выпаривают при пониженном давлении. Полученный неочищенный продукт очищают с помощью колоночной хроматографии. В соответствии со способом примера А и исходя из соответствующих сложных эфиров, получают дибензоазуленовые спирты, представленные формулой I, в которой R1, R5, R6, R7, R8 и R9 = H, a R2, R3, R4 и Х имеют значения, которые проиллюстрированы в табл. 1. Соединения, описанные в примерах 1-5, были получены из спирта 1 и соответствующего хлоралкилдиалкиамингидрохлорида в соответствии со способом, описанным в примере 1. Пример 1. Диметил[3-(8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропил]амингидрохлорид. К раствору 3-диметиламинопропилхлоридгидрохлорида (2,2 г, 0,014 моль) в 50%-ном гидроксиде натрия (5 мл) добавляют бензилтриэтиламмонийхлорид (0,1 г, 0,44 ммоль) и толуольный раствор спирта 1 (0,28 г, 0,001 моль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 4 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,25 г). После добавления в холодный этанольный раствор амина концентрированной хлористо-водородной кислоты получают кристаллический продукт с т. пл. 162-165 С. Анализ С, Н, N, S: С 65,45 (вычисл. 65,74); Н 6,12 (вычисл. 6,02); N 3,89 (вычисл. 3,48); S 8,52 (вычисл. 7,98). 1H-ЯМР (м.д., СDСl3): 2,18 (м, 2 Н); 2,79 (д, 6 Н); 3,15 (м, 2 Н); 3,68 (т, 2 Н); 4,71 (с, 2 Н); 7,15-7,58 (м,9 Н), 12,29 (с, 1 Н). Пример 2. Диметил[2-(8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]амингидрохлорид. В результате взаимодействия спирта 1 (0,45 г, 0,0015 моль) и 2-диметиламиноэтилхлоридгидрохлорида (3,05 г, 0,021 моль) получают маслянистый продукт (0,3 г), который переводят в гидрохлорид,т. пл. 203 С. Анализ С, Н, N: С 64,85 (вычисл. 65,02); Н 5,80 (вычисл. 5,72); N 3,48 (вычисл. 3,61). 1-7 006069 В результате взаимодействия спирта 1 (0,45 г, 0,0015 моль) и 4-(2-хлорэтил)морфолингидрохлорида(3,9 г, 0,021 моль) получают маслянистый продукт (0,34 г), который превращают в гидрохлорид, т. пл. 164 С. Анализ С, Н, N: С 63,57 (вычисл. 64,25); Н 5,76 (вычисл. 5,6); N 3,79 (вычисл. 3,26). 1H-ЯМР (м.д., CDCl3): 2,99 (шир.с, 2 Н); 3,23 (м, 2 Н); 3,55 (д, 2 Н); 3,94 (д, 2 Н); 4,14 (м, 2 Н); 4,27 (м,2 Н); 4,75 (с, 2 Н); 7,14-7,44 (м, 9 Н); 13,16 (с, 1 Н). Пример 4. 1-[2-(8-Окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид. В результате взаимодействия спирта 1 (0,45 г, 0,0015 моль) и 1-(2-хлорэтил)пиперидинмоногидрохлорида (3,86 г, 0,021 моль) получают маслянистый продукт (0,48 г), который превращают в гидрохлорид, т. пл. 179 С. Анализ С, Н, N: С 67,53 (вычисл. 67,35); Н 6,30 (вычисл. 6,12); N 3,61 (вычисл. 3,27). 1H-ЯМР (м.д., СDСl3): 1,83 (м, 4 Н); 2,25 (м, 2 Н); 2,74 (м, 2 Н); 3,18 (м, 2 Н); 3,6 (м, 2 Н); 4,10 (м, 2 Н); 4,73 (с, 2 Н); 7,13-7,5 (м, 9 Н); 12,15 (с, 1 Н). Пример 5. 1-[2-(8-Окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пирролидингидрохлорид. В результате взаимодействия спирта 1 (0,45 г, 0,0015 моль) и 1-(2-хлорэтил)пирролидингидрохлорида (3,6 г, 0,021 моль) получают маслянистый продукт (0,41 г), который переводят в гидрохлорид, т. пл. 203-205 С. Анализ С, Н, N: С 67,12 (вычисл. 67,35); Н 6,03 (вычисл. 5,84); N 3,91 (вычисл. 3,38). 1H-ЯМР (м.д., CDCl3): 2,02 (м, 2 Н); 2,18 (м, 2 Н); 2,91 (ю, 2 Н); 3,27 (м, 2 Н); 3,81 (м, 2 Н); 4,08 (м, 2 Н); 4,75 (с, 2 Н); 7,12-7,5 (м, 9 Н); 12,7 (с, 1 Н). Соединения, описанные в примерах 6-10, получены из спирта 2 и соответствующего хлоралкилдиалкиламингидрохлорида, в соответствии со способом, описанным в примере 6. Пример 6. [3-(9-Хлор-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)пропил]диметиламин. К раствору 3-диметиламинопропилхлоридгидрохлорида (2,37 г, 0,015 моль) в 50%-м гидроксиде натрия (5 мл) добавляют бензилтриэтиламмонийхлорид (0,25 г) и толуольный раствор спирта 2 (0,2 г,0,64 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 3 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,11 г). 1H-ЯМР (м.д., CDCl3): 1,93 (м, 2 Н); 2,39 (с, 6 Н); 2,59 (м, 2 Н); 3,64 (м, 2 Н); 4,72 (с, 2 Н); 7,05-7,56 (м,8 Н). Пример 7. [2-(9-Хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]диметиламин. В результате взаимодействия спирта 2 (0,2 г, 0,64 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (2,6 г, 0,015 моль) получают маслянистый продукт (0,15 г). 1H-ЯМР (м.д., CDCl3): 2,42 (с, 6 Н); 2,72 (м, 2 Н); 3,74 (м, 2 Н); 4,76 (с, 2 Н); 7,08-7,55 (м, 8 Н). Пример 8. 4-[2-(9-Хлор-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)этил]морфолин. В результате взаимодействия спирта 2 (0,2 г, 0,64 ммоль) и 4-(2-хлорэтил)морфолингидрохлорида(2,8 г, 0,015 моль) получают маслянистый продукт (0,19 г). 1H-ЯМР (м.д., СDСl3): 2,51 (м, 4 Н); 3,71 (м, 8 Н); 4,75 (с, 2 Н); 7,08-7,56 (м, 8 Н). Пример 9. 1-[2-(9-Хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пиперидин. В результате взаимодействия спирта 2 (0,2 г, 0,64 ммоль) и 1-(2-хлорэтил)пиперидинмоногидрохлорида (2,76 г, 0,015 моль) получают маслянистый продукт (0,13 г). Пример 10. 1-[2-(9-Хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пирролидин. В результате взаимодействия спирта 2 (0,2 г, 0,64 ммоль) и 1-(2-хлорэтил)пирролидингидрохлорида(2,55 г, 0,015 моль) получают маслянистый продукт (0,15 г). 1H-ЯМР (м.д., CDCl3): 2,02 (м, 2 Н); 2,2 (м, 2 Н); 2,94 (м, 2 Н); 3,32 (м, 2 Н); 3,87 (м, 2 Н); 4,11 (м, 2 Н); 4,79 (с, 2 Н); 7,07-7,56 (м, 8 Н). Соединения, описанные в примерах 11-15, получают из спирта 3 и соответствующего хлоралкилдиалкиламингидрохлорида в соответствии со способом, описанным в примере 11. Пример 11. [3-(11-Хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропил]диметиламин. К раствору 3-диметиламинопропилхлоридгидрохлорида (2,2 г, 0,014 моль) в 50%-м гидроксиде натрия (5 мл), добавляют бензилтриэтиламмонийхлорид (0,25 г) и толуольный раствор спирта 3 (0,19 г, 0,6 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 5 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,18 г). 1(м, 8 Н). Пример 12. [2-(11-Хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]диметиламин. В результате взаимодействия спирта 3 (0,19 г, 0,6 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (2,01 г, 0,014 моль) получают маслянистый продукт (0,2 г). 1-8 006069 Пример 13. 4-[2-(11-Хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]морфолин. В результате взаимодействия спирта 3 (0,19 г, 0,6 ммоль) и 4-(2-хлорэтил)морфолингидрохлорида(2,8 г, 0,015 моль) получают маслянистый продукт (0,3 г). 1 Н-ЯМР (м.д., CDCl3): 2,61-2,84 (м, 6 Н); 3,82 (м, 6 Н); 4,77 (с, 2 Н); 7,2-7,48 (м, 8 Н). Пример 14. 1-[2-(11-Хлор-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)этил]пиперидин. В результате взаимодействия спирта 3 (0,19 г, 0,6 ммоль) и 1-(2-хлорэтил)пиперидинмоногидрохлорида (2,76 г, 0,015 моль) получают маслянистый продукт (0,21 г). 1H-ЯМР (м.д., СDСl3): 1,43 (м, 2 Н); 1,85 (м, 2 Н); 2,25 (м, 2 Н); 2,75 (м, 2 Н); 3,14 (м, 2 Н); 3,65 (м, 2 Н); 4,01-4,15 (м, 2 Н); 4,84 (с, 2 Н); 7,15-7,65 (м, 8 Н). Пример 15. 1-[2-(11-Хлор-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)этил]пирролидин. В результате взаимодействия спирта 3 (0,19 г, 0,6 ммоль) и 1-(2-хлорэтил)пирролидингидрохлорида(2,55 г, 0,015 моль) получают маслянистый продукт (0,25 г). 1H-ЯМР (м.д., СDCl3): 1,8-2,2 (м, 8 Н); 2,9-3,25 (м, 2 Н); 3,98 (м, 2 Н); 4,8 (с, 2 Н); 7,19-7,45 (м, 8 Н). Соединения, описанные в примерах 16-20, получают из спирта 4 и соответствующего хлоралкилдиалкиламингидрохлорида в соответствии со способом, описанным в примере 16. Пример 16. [3-(11-Фтор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид. К раствору 3-диметиламинопропилхлоридгидрохлорида (2,2 г, 0,014 моль) в 50%-м гидроксиде натрия (5 мл), добавляют бензилтриэтиламмонийхлорид (0,15 г) и толуольный раствор спирта 4 (0,2 г, 0,63 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 4 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,14 г). Пример 17. [2-(11-Фтор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид. В результате взаимодействия спирта 4 (0,2 г, 0,63 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (2,01 г, 0,014 моль) получают маслянистый продукт (0,24 г), который переводят в гидрохлорид, т. пл. 178-179 С. Анализ С, Н, N, S: С 61,53 (вычисл. 62,14); Н 5,19 (вычисл. 5,21); N 3,72 (вычисл. 3,45); S 8,15 (вычисл. 7,90). 1H-ЯМР (м.д., СDCl3): 2,91 (д, 6 Н); 3,28 (м, 2 Н); 4,10 (м, 2 Н); 4,79 (с, 2 Н); 6,97-7,5 (м, 8 Н); 12,75 (с,1 Н). Пример 18. 4-[2-(11-Фтор-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)этил]морфолингидрохлорид. В результате взаимодействия спирта 4 (0,2 г, 0,63 ммоль) и 4-(2-хлорэтил)морфолингидрохлорида(2,6 г, 0,014 моль) получают маслянистый продукт (0,25 г), который превращают в гидрохлорид, т. пл. 207-208 С. Анализ С, Н, N, S: С 61,28 (вычисл. 61,67); Н 5,33 (вычисл. 5,18); N 3,36 (вычисл. 3,13); S 7,44 (вычисл. 7,16). 1H-ЯМР (м.д., СDCl3): 3,05 (м, 2 Н); 3,25 (м, 2 Н); 3,57 (д, 2 Н); 3,97 (д, 2 Н); 4,19 (м, 2 Н); 4,35 (м, 2 Н); 4,79 (с, 2 Н); 7,0-7,47 (м, 8 Н). Пример 19. 1-[2-(11-Фтор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид. В результате взаимодействия спирта 4 (0,2 г, 0,63 ммоль) и 1-(2-хлорэтил)пиперидинмоногидрохлорида (2,6 г, 0,014 моль) получают маслянистый продукт (0,2 г), который превращают в гидрохлорид,т. пл. 122-124 С. 1H-ЯМР (м.д., СDCl3): 1,95 (м, 4 Н); 2,17 (м, 2 Н); 2,27 (м, 2 Н); 2,75 (м, 2 Н); 3,12 (м, 2 Н); 3,65 (д, 2 Н); 4,78 (с, 2 Н); 6,98-7,68 (м, 8 Н); 12,2 (с, 1 Н). Пример 20. 1-[2-(11-фтор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пирролидингидрохлорид. В результате взаимодействия спирта 4 (0,2 г, 0,63 ммоль) и 1-(2-хлорэтил)пирролидингидрохлорида(2,4 г, 0,014 моль) получают маслянистый продукт (0,27 г), который превращают в гидрохлорид, т. пл. 210 С. Анализ С, Н, N, S: С 63,02 (вычисл. 63,95); Н 5,42 (вычисл. 5,37); N 3,48 (вычисл. 3,24); S 7,62 (вычисл. 7,42). 1H-ЯМР (м.д., CDCl3): 2,09 (м, 2 Н); 2,17 (м, 2 Н); 2,94 (м, 2 Н); 3,31 (м, 2 Н); 3,85 (м, 2 Н); 4,10 (м, 2 Н); 4,79 (с, 2 Н); 6,97-7,48 (м, 8 Н); 12,3 (с, 1 Н). Соединения, описанные в примерах 21-25, получают из спирта 5 и соответствующего хлоралкилдиалкиламингидрохлорида в соответствии со способом, описанным в примере 21. Пример 21. [3-(1,8-Дитиадибензо[е,h]азулен-2-илметокси)пропил]диметиламингидрохлорид. К раствору 3-диметиламинопропилхлоридгидрохлорида (2,2 г, 0,012 моль) в 50%-м гидроксиде натрия (5 мл), добавляют бензилтриэтиламмонийхлорид (0,15 г, 0,65 ммоль) и толуольный раствор спирта 5 (0,33 г, 0,0011 моль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят-9 006069 с обратным холодильником в течение 5 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,32 г). После добавления концентрированной хлористоводородной кислоты в холодный раствор этанольного амина получают кристаллический продукт. Анализ С, Н, N, S: С 62,74 (вычисл. 63,21); Н 5,83 (вычисл. 5,79); N 3,63 (вычисл. 3,35); S 15,51 (вычисл. 15,34). 1H-ЯМР (м.д., СDCl3): 2,20 (м, 2 Н); 2,80 (д, 6 Н); 3,17 (м, 2 Н); 3,72 (м, 2 Н); 4,73 (с, 2 Н); 7,11-7,63 (м,9 Н); 12,27 (с, 1 Н). Пример 22. [2-(1,8-Дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид. В результате взаимодействия спирта 5 (0,25 г, 0,84 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (2,7 г, 0,019 моль) получают маслянистый продукт (0,22 г), который превращают в гидрохлорид, т. пл. 151 С. 1H-ЯМР (м.д., CDCl3): 2,90 (м, 6 Н); 3,28 (м, 2 Н); 4,12 (м, 2 Н); 4,80 (с, 2 Н); 7,23-7,66 (м, 9 Н); 12,7 (с,1 Н). Пример 23. 4-[2-(1,8-Дитиадибензо[е,b]азулен-2-илметокси)этил]морфолингидрохлорид. В результате взаимодействия спирта 5 (0,25 г, 0,84 ммоль) и 4-(2-хлорэтил)морфолингидрохлорида(3,47 г, 0,019 моль) получают маслянистый продукт (0,3 г), который превращают в гидрохлорид, т. пл. 178-183 С. Анализ С, Н, N, S: С 59,76 (вычисл. 61,93); Н 5,30 (вычисл. 5,42); N 3,35 (вычисл. 3,14); S 13,89 (вычисл. 14,38). 1H-ЯМР (м.д., CDCl3): 3,05 (м, 2 Н); 3,25 (м, 2 Н); 3,55 (м, 2 Н); 4,0 (м, 2 Н); 4,15-4,38 (м, 4 Н); 4,7 (с,2 Н); 7,22-7,65 (м, 9 Н); 13,25 (с, 1 Н). Пример 24. 1-[2-(1,8-Дитиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид. В результате взаимодействия спирта 5 (0,25 г, 0,84 ммоль) и 1-(2-хлорэтил)пиперидинмоногидрохлорида (3,3 г, 0,018 моль) получают маслянистый продукт (0,17 г), который превращают в гидрохлорид,т. пл. 173 С. 1H-ЯМР (м.д., СDCl3): 1,46 (м, 2 Н); 1,95 (м, 4 Н); 2,27 (м, 2 Н); 2,85 (м, 2 Н); 3,32 (м, 2 Н); 3,68 (м, 2 Н); 4,12 (м, 2 Н); 7,22-7,35 (м, 9 Н); 10,97 (с, 1 Н). Пример 25. 1-[2-(1,8-Дитиадибензо[e,h]азулен-2-илметокси)этил]пирролидингидрохлорид. В результате взаимодействия спирта 5 (0,25 г, 0,84 ммоль) и 1-(2-хлорэтил)пирролидингидрохлорида (3,1 г, 0,019 моль) получают маслянистый продукт (0,2 г), который превращают в гидрохлорид. Соединения, описанные в примерах 26-30, получены из спирта 6 и соответствующего хлоралкилдиалкиламингидрохлорида в соответствии со способом, описанным в примере 26. Пример 26. [3-(11-Фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид. К раствору 3-диметиламинопропилхлоридгидрохлорида (1,8 г, 0,011 моль) в 50%-м гидроксиде натрия (5 мл), добавляют бензилтриэтиламмонийхлорид (0,15 г) и толуольный раствор спирта 6 (0,25 г, 0,8 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 5 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,18 г). После добавления концентрированной хлористоводородной кислоты в холодный этанольный раствор амина получают кристаллический продукт, т. пл. 209-214 С. 1H-ЯМР (м.д., СDСl3): 2,30 (м, 2 Н); 2,88 (д, 6 Н); 3,24 (м, 2 Н); 3,80 (м, 2 Н); 4,82 (с, 2 Н); 7,08 (м, 1 Н); 7,28-7,71 (м, 7 Н); 12,5 (с, 1 Н). Пример 27. [2-(11-Фтор-1,8-дитиадибензо[е,h]азулен-2-илметокси)этил]диметиламингидрохлорид. В результате взаимодействия спирта 6 (0,21 г, 0,67 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (1,5 г, 0,01 моль) получают маслянистый продукт (0,22 г), который превращают в гидрохлорид, т. пл. 151-155 С. 1(м, 7 Н); 12,5 (с, 1 Н). Пример 28. 4-[2-(11-Фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]морфолингидрохлорид. В результате взаимодействия спирта 6 (0,21 г, 0,67 ммоль) и 4-(2-хлорэтил)морфолингидрохлорида(1,9 г, 0,01 моль) получают маслянистый продукт (0,15 г), который превращают в гидрохлорид, т. пл. 168-170 С. 1H-ЯМР (м.д., CDCl3): 3,05 (м, 4 Н); 3,65 (м, 2 Н); 4,05 (м, 2 Н); 4,28 (м, 4 Н); 4,87 (с, 2 Н); 7,09 (м, 1 Н); 7,23-7,74 (м, 7 Н); 13,25 (с, 1 Н). Пример 29. 1-[2-(11-Фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид. В результате взаимодействия спирта 6 (0,21 г, 0,67 ммоль) и 1-(2-хлорэтил)пиперидинмоногидрохлорида (1,9 г, 0,01 моль) получают маслянистый продукт (0,2 г), который превращают в гидрохлорид,т. пл. 214-216 С. Пример 30. 1-[2-(11-Фтор-1,8-дитиадибензо[е,h]азулен-2-илметокси)этил]пирролидингидрохлорид.- 10006069 В результате взаимодействия спирта 6 (0,21 г, 0,67 ммоль) и 1-(2-хлорэтил)пирролидингидрохлорида (1,8 г, 0,01 моль) получают маслянистый продукт (0,17 г), который превращают в гидрохлорид,т. пл. 202-205 С. 1H-ЯМР (м.д., CDCl3): 2,14 (м, 2 Н); 2,24 (м, 2 Н); 3,01 (м, 2 Н); 3,85 (м, 2 Н); 3,93 (м, 2 Н); 4,21 (м, 2 Н); 4,88 (с, 2 Н); 7,09 (м, 1 Н); 7,24-7,69 (м, 7 Н); 12,7 (с, 1 Н). Соединения, описанные в примерах 31-35, получают из спирта 7 и соответствующего хлоралкилдиалкиламингидрохлорида в соответствии со способом, описанным в примере 31. Пример 31. [3-(11-Хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид. К раствору 3-диметиламинопропилхлоридгидрохлорида (1,7 г, 0,011 моль) в 50%-м гидроксиде натрия (5 мл), добавляют бензилтриэтиламмонийхлорид (0,15 г) и толуольный раствор спирта 7 (0,25 г,0,75 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 3 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,17 г), который превращают в гидрохлорид, т. пл. 199-200 С. 1H-ЯМР (м.д., CDCl3): 2,31 (м, 2 Н); 2,89 (д, 6 Н); 3,25 (м, 2 Н); 3,80 (м, 2 Н); 4,8 (с, 2 Н); 7,26-7,69 (м,8 Н); 12,5 (с, 1 Н). Пример 32. [2-(11-Хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид. В результате взаимодействия спирта 7 (0,25 г, 0,75 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (1,5 г, 0,011 моль) получают маслянистый продукт (0,2 г), который превращают в гидрохлорид, т. пл. 165-167 С. 1H-ЯМР (м.д., СDСl3): 2,98 (с, 6 Н); 3,35 (м, 2 Н); 4,2 (м, 2 Н); 4,87 (с, 2 Н); 7,29-7,68 (м, 8 Н); 12,55 (с,1 Н). Пример 33. 4-[2-(11-Хлор-1,8-дитиадибензо[е,b]азулен-2-илметокси)этил]морфолингидрохлорид. В результате взаимодействия спирта 7 (0,2 г, 0,61 ммоль) и 4-(2-хлорэтил)морфолингидрохлорида(1,9 г, 0,01 моль) получают маслянистый продукт (0,21 г), который превращают в гидрохлорид, т. пл. 190 С. 1H-ЯМР (м.д., CDCl3): 3,08 (м, 2 Н); 3,32 (м, 2 Н); 3,63 (м, 2 Н); 4,05 (м, 2 Н); 4,25 (м, 4 Н); 4,87 (с, 2 Н); 7,29-7,69 (м, 8 Н); 13,25 (с, 1 Н). Пример 34. 1-[2-(11-Хлор-1,8-дитиадибензо[е,h]азулен-2-илметокси)этил]пиперидингидрохлорид. В результате взаимодействия спирта 7 (0,2 г, 0,61 ммоль) и 1-(2-хлорэтил)пиперидинмоногидрохлорида (1,9 г, 0,01 моль) получают маслянистый продукт (0,43 г), который превращают в гидрохлорид,т. пл. 184-185 С. 1H-ЯМР (м.д., СDCl3): 1,51 (м, 3 Н); 2,23 (м, 7 Н); 3,07 (м, 2 Н); 3,18 (м, 2 Н); 4,23 (м, 2 Н); 7,32-7,74 (м,8 Н); 12,3 (с, 1 Н). Пример 35. 1-[2-(11-Хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пирролидингидрохлорид. В результате взаимодействия спирта 7 (0,2 г, 0,61 ммоль) и 1-(2-хлорэтил)пирролидингидрохлорида(1,8 г, 0,01 моль) получают маслянистый продукт (0,27 г), который превращают в гидрохлорид, т. пл. 238 С. 1H-ЯМР (м.д., СDCl3): 2,14 (м, 2 Н); 2,29 (м, 2 Н); 3,01 (м, 2 Н); 3,38 (м, 2 Н); 3,93 (м, 2 Н); 4,25 (м, 2 Н); 4,88 (с, 2 Н); 7,28-7,69 (м, 8 Н); 12,7 (с, 1 Н). Соединения, описанные в примерах 36-40, получают из спирта 8 и соответствующего хлоралкилдиалкиламингидрохлорида в соответствии со способом, описанным в примере 36. Пример 36. [3-(11-Бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид. К раствору 3-диметиламинопропилхлоридгидрохлорида (1,7 г, 0,011 моль) в 50%-ном гидроксиде натрия (5 мл), добавляют бензилтриэтиламмонийхлорид (0,15 г) и толуольный раствор спирта 8 (0,23 г,0,61 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 3 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,25 г), который переводят в гидрохлорид, т. пл. 170-176 С. 1H-ЯМР (м.д., CDCl3): 2,28 (м, 2 Н); 2,88 (д, 6 Н); 3,25 (м, 2 Н); 3,79 (м, 2 Н); 4,81 (с, 2 Н); 7,28-7,71 (м,8 Н); 12,5 (с, 1 Н). Пример 37. [2-(11-Бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид. В результате взаимодействия спирта 8 (0,23 г, 0,61 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (1,5 г, 0,01 моль) получают маслянистый продукт (0,31 г), который переводят в гидрохлорид, т. пл. 147-150 С. 1H-ЯМР (м.д., СDCl3): 2,22 (с, 6 Н); 2,97 (м, 2 Н); 4,22 (м, 2 Н); 4,86 (с, 2 Н); 7,28-7,72 (м, 8 Н); 12,25 (с,1 Н). Пример 38. 4-[2-(11-Бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]морфолин. В результате взаимодействия спирта 8 (0,23 г, 0,61 ммоль) и 4-(2-хлорэтил)морфолингидрохлорида(2,2 г, 0,012 моль) получают маслянистый продукт (0,11 г). Пример 39. 1-[2-(11-Бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пиперидин.- 11006069 В результате взаимодействия спирта 8 (0,23 г, 0,61 ммоль) и 1-(2-хлорэтил)пиперидинмоногидрохлорида (2,2 г, 0,012 моль) получают маслянистый продукт (0,09 г). Пример 40. 1-[2-(11-Бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пирролидин. В реакции спирта 8 (0,23 г, 0,61 ммоль) и 1-(2-хлорэтил)пирролидингидрохлорида (2,2 г, 0,012 моль) получают маслянистый продукт (0,17 г). 1H-ЯМР (м.д., СDCl3): 2,02 (м, 4 Н); 3,05 (м, 6 Н); 3,96 (м, 2 Н); 4,81 (с, 2 Н), 7,23-7,76 (м, 8 Н). Соединения, описанные в примерах 41-45, получают из спирта 9 и соответствующего хлоралкилдиалкиламингидрохлорида в соответствии со способом, описанным в примере 41. Пример 41. [3-(10-Трифторметил-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламин. К раствору 3-диметиламинопропилхлоридгидрохлорида (1,1 г, 0,007 моль) в 50%-ном гидроксиде натрия (5 мл), добавляют бензилтриэтиламмонийхлорид (0,15 г) и толуольный раствор спирта 9 (0,18 г,0,5 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 3 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,11 г). 1H-ЯМР (м.д., CDCl3): 2,21 (м, 2 Н); 2,48 (с, 6 Н); 2,71 (м, 2 Н); 3,69 (т, 2 Н); 4,76 (с, 2 Н), 7,23-7,89 (м,8 Н). Пример 42. Диметил[2-(10-трифторметил-1,8-дитиадибензо[е,h]азулен-2-илметокси)этил]амингидрохлорид. В результате взаимодействия спирта 9 (0,18 г, 0,5 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (1 г, 0,007 моль) получают маслянистый продукт, который переводят в гидрохлорид (0,1 г). 1H-ЯМР (м.д., СDCl3): 2,94 (с, 6 Н); 3,32 (м, 2 Н); 4,18 (м, 2 Н); 4,85 (с, 2 Н); 7,29-7,70 (м, 7 Н); 7,93 (с,1 Н); 12,85 (с, 1 Н). Пример 43. 4-[2-(10-Трифторметил-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]морфолин. В результате взаимодействия спирта 9 (0,18 г, 0,5 ммоль) и 4-(2-хлорэтил)морфолингидрохлорида(1,3 г, 0,007 моль) получают маслянистый продукт (0,20 г). 1 Н-ЯМР (м.д., CDCl3): 2,55 (м, 7 Н); 3,58 (м, 2 Н); 3,74 (м, 3 Н); 4,79 (с, 2 Н); 7,24-7,90 (м, 8 Н). Пример 44. 1-[2-(10-Трифторметил-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид. В результате взаимодействия спирта 9 (0,18 г, 0,5 ммоль) и 1-(2-хлорэтил)пиперидинмоногидрохлорида (1,3 г, 0,007 моль) получают маслянистый продукт (0,18 г), который превращают в гидрохлорид. 1H-ЯМР (м.д., СDСl3): 1,85 (м, 2 Н); 2,75-3,17 (м, 6 Н); 3,23 (м, 2 Н); 3,88 (м, 4 Н); 4,81 (с, 2 Н); 7,257,90 (м, 8 Н); 12,3 (с, 1 Н). Пример 45. 1-[2-(10-трифторметил-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пирролидингидрохлорид. В результате взаимодействия спирта 9 (0,18 г, 0,5 ммоль) и 1-(2-хлорэтил) пирролидингидрохлорида (1,2 г, 0,007 моль) получают маслянистый продукт (0,1 г), который превращают в гидрохлорид. 1H-ЯМР (м.д., CDCl3): 2,01 (м, 2 Н); 2,75 (м, 2 Н); 3,10 (м, 4 Н); 3,99 (м, 2 Н), 4,17 (м, 2 Н); 4,83 (с, 2 Н); 7,26-7,91 (м, 8 Н); 12,3 (с, 1 Н). Соединения, описанные в примерах 46-49, получают из спирта 10 и соответствующего хлоралкилдиалкиламингидрохлорида в соответствии со способом, описанным в примере 46. Пример 46. [3-(10-Хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламин. К раствору 3-диметиламинопропилхлоридгидрохлорида (1,1 г, 0,007 моль) в 50%-м гидроксиде натрия (5 мл), добавляют бензилтриэтиламмонийхлорид (0,15 г) и толуольный раствор спирта 10 (0,16 г,0,48 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 3 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,17 г). 1H-ЯМР (м.д., СDCl3): 1,91 (м, 2 Н); 2,36 (с, 6 Н); 2,56 (м, 2 Н), 3,69 (т, 2 Н); 4,74 (с, 2 Н); 7,2-7,7 (м,8 Н). Пример 47. [2-(10-Хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид. В результате взаимодействия спирта 10 (0,16 г, 0,48 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (0,98 г, 0,0068 моль) получают маслянистый продукт, который превращают в гидрохлоридH-ЯМР (м.д., СDCl3): 2,36 (с, 6 Н); 2,65 (м, 2 Н); 3,73 (м, 2 Н); 4,78 (с, 2 Н); 7,2-7,7 (м, 8 Н); 7,93 (с,1 Н). Пример 48. 1-[2-(10-Хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид. В результате взаимодействия спирта 10 (0,16 г, 0,48 ммоль) и 1-(2-хлорэтил)пиперидинмоногидрохлорида (1,25 г, 0,0067 моль) получают маслянистый продукт (0,11 г), который превращают в гидрохлорид. 1- 12006069 Пример 49. 1-[2-(10-Хлор-1,8-дитиадибензо[е,h]азулен-2-илметокси)этил]пирролидин. В результате взаимодействия спирта 10 (0,16 г, 0,48 ммоль) и 1-(2-хлорэтил)пирролидингидрохлорида (1,15 г, 0,0067 моль) получают маслянистый продукт (0,14 г). 1H-ЯМР (м.д., CDCl3): 1,87 (м, 4 Н); 2,76 (м, 4 Н); 2,88 (м, 2 Н); 3,86 (м, 2 Н); 4,78 (с, 2 Н); 7,2-7,65 (м,8 Н). Соединения, описанные в примерах 50-54, получают из спирта 11 и соответствующего хлоралкилдиалкиламингидрохлорида в соответствии со способом, описанным в примере 50. Пример 50. [3-(10-Бром-1,8-дитиадибензо[е,h]азулен-2-илметокси)пропил]диметиламингидрохлорид. К раствору 3-диметиламинопропилхлоридгидрохлорида (1,18 г, 0,0074 моль) в 50%-ном гидроксиде натрия (5 мл), добавляют бензилтриэтиламмонийхлорид (0,15 г) и толуольный раствор спирта 11 (0,2 г,0,53 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 3 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,17 г), который превращают в гидрохлорид. 1H-ЯМР (м.д., CDCl3): 2,23 (м, 2 Н); 2,81 (д, 6 Н); 3,17 (м, 2 Н); 3,74 (м, 2 Н), 4,75 (с, 2 Н); 7,21-7,81 (м,8 Н); 12,3 (с, 1 Н). Пример 51. [2-(10-Бром-1,8-дитиадибензо[е,h]азулен-2-илметокси)этил]диметиламингидрохлорид. В результате взаимодействия спирта 11 (0,2 г, 0,53 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (1,18 г, 0,0074 моль) получают маслянистый продукт, который превращают в гидрохлорид (0,12 г). 1H-ЯМР (м.д., CDCl3): 2,91 (м, 6 Н); 3,27 (м, 2 Н); 4,15 (м, 2 Н); 4,80 (с, 2 Н); 7,23-7,84 (м, 8 Н); 12,4 (с,1 Н). Пример 52. 1-[2-(10-Бром-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид. В результате взаимодействия спирта 11 (0,2 г, 0,53 ммоль) и 1-(2-хлорэтил)пиперидинмоногидрохлорида (1,27 г, 0,0074 моль) получают маслянистый продукт (0,15 г), который переводят в гидрохлорид. 1H-ЯМР (м.д., CDCl3): 1,38 (м, 2 Н); 1,85 (м, 2 Н); 2,17-2,36 (м, 2 Н); 2,76 (м, 2 Н), 3,12 (м, 2 Н); 3,17 (м,2 Н); 4,18 (м, 2 Н); 4,78 (с, 2 Н); 7,25-7,90 (ш, 8 Н); 12,3 (с, 1 Н). Пример 53. 1-[2-(10-Бром-1,8-дитиадибензо[е,h]азулен-2-илметокси)этил]пирролидин. В результате взаимодействия спирта 11 (0,2 г, 0,53 ммоль) и 1-(2-хлорэтил)пирролидингидрохлорида (1,37 г, 0,0074 моль) получают маслянистый продукт (0,09 г). 1H-ЯМР (м.д., CDCl3): 1,69 (м, 4 Н); 2,62 (м, 4 Н); 2,69 (м, 2 Н); 3,81 (м, 2 Н); 4,78 (с, 2 Н); 7,22-7,85 (м,8 Н). Пример 54. [2-(10-Бром-1,8-дитиадибензо[е,h]азулен-2-илметокси)пропил]диметиламингидрохлорид. В результате взаимодействия спирта 11 (0,2 г, 0,53 ммоль) и 1-диметиламино-2-пропилхлоридгидрохлорида (1,18 г, 0,0074 моль) получают маслянистый продукт (0,12 г), который превращают в гидрохлорид. 1H-ЯМР (м.д., CDCl3): 1,17 (д, 3 Н); 2,47 (с, 6 Н); 3,02 (м, 1 Н); 3,68 (м, 2 Н); 4,77 (с, 2 Н); 7,1-7,85 (м,8 Н). Соединения, описанные в примерах 55-57, получают из спирта 12 и соответствующего хлоралкилдиалкиламингидрохлорида в соответствии со способом, описанным в примере 55. Пример 55. [3-(9,11-Диметил-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид. К раствору 3-диметиламинопропилхлоридгидрохлорида (1,23 г, 0,0077 моль) в 50%-ном гидроксиде натрия (5 мл), добавляют бензилтриэтиламмонийхлорид (0,15 г) и толуольный раствор спирта 12 (0,18 г,0,55 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 3 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,13 г), который переводят в гидрохлорид. 1H-ЯМР (м.д., CDCl3): 2,22 (м, 2 Н); 2,29 (с, 3H); 2,61 (с, 3H); 2,81 (с, 6 Н); 3,17 (м, 2 Н); 3,74 (м, 2 Н); 4,75 (с, 2 Н); 7,11-7,67 (м, 7 Н); 12,3 (с, 1 Н). Пример 56. [2-(9,11-Диметил-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид. В результате взаимодействия спирта 12 (0,18 г, 0,55 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (1,12 г, 0,0077 моль) получают маслянистый продукт, который превращают в гидрохлорид (0,09 г). 1H-ЯМР (м.д., СDСl3): 2,29 (с, 3H); 2,61 (с, 3H); 2,91 (м, 6 Н); 3,28 (м, 2 Н); 4,13 (м, 2 Н); 4,80 (с, 2 Н); 7,12-7,67 (м, 7 Н); 12,3 (с, 1 Н). Пример 57. 1-[2-(9,11-Диметил-1,8-дитиадибензо[е,b]азулен-2-илметокси)этил]пирролидингидрохлорид. В результате взаимодействия спирта 12 (0,18 г, 0,55 ммоль) и 1-(2-хлорэтил)пирролидингидрохлорида (1,32 г, 0,0077 моль) получают маслянистый продукт (0,11 г).H-ЯМР (м.д., CDCl3): 2,07 (м, 2 Н); 2,24 (м, 2 Н); 2,69 (м, 2 Н); 2,29 (с, 3H), 2,61 (с, 3H); 2,95 (м, 2 Н); 3,31 (м, 2 Н); 3,85 (м, 2 Н); 4,12 (м, 2 Н); 4,80 (с, 2 Н); 7,22-7,85 (м, 7 Н); 12,5 (с, 2 Н). Соединения, описанные в примерах 58-62, получают из спирта 13 и соответствующего хлоралкилдиалкиламингидрохлорида в соответствии со способом, описанным в примере 58. Пример 58.[3-(10,11-Дихлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид. К раствору 3-диметиламинопропилхлоридгидрохлорида (1,5 г, 0,0095 моль) в 50%-м гидроксиде натрия (5 мл), добавляют бензилтриэтиламмонийхлорид (0,15 г) и толуольный раствор спирта 13 (0,2 г,0,68 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 3 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт, который переводят в гидрохлорид (0,075 г). 1H-ЯМР (м.д., СDCl3): 2,25 (м, 2 Н); 2,83-(с, 6 Н); 3,19 (м, 2 Н); 3,75 (м, 2 Н); 4,76 (с, 2 Н); 7,22-7,74 (м,7 Н); 12,35 (с, 1 Н). Пример 59. [2-(10,11-Дихлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид. В результате взаимодействия спирта 13 (0,2 г, 0,68 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (1,4 г, 0,0095 моль) получают маслянистый продукт, который переводят в гидрохлоридH-ЯМР (м.д., CDCl3): 2,97 (с, 6 Н); 3,47 (м, 2 Н); 4,15 (м, 2 Н); 4,81 (с, 2 Н); 7,23-7,74 (м, 7 Н); 12,3 (с,1 Н). Пример 60. 4-[2-(10,11-Дихлор-1,8-дитиадибензо[е,b]азулен-2-илметокси)этил]морфолингидрохлорид. В результате взаимодействия спирта 13 (0,2 г, 0,68 ммоль) и 4-(2-хлорэтил)морфолингидрохлоридаH-ЯМР (м.д., CDCl3): 3,02 (м, 2 Н); 3,27 (м, 2 Н); 3,60 (м, 2 Н); 3,99 (м, 2 Н); 4,16-4,36 (м, 4 Н); 4,80 (с,2 Н); 7,22-7,74 (м, 7 Н); 12,55 (с, 1 Н). Пример 61. 1-[2-(10,11-Дихлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]пиперидингидрохлорид. В результате взаимодействия спирта 13 (0,2 г, 0,68 ммоль) и 1-(2-хлорэтил)пиперидинмоногидрохлоридаH-ЯМР (м.д., CDCl3): 1,42 (м, 2 Н); 1,87 (м, 2 Н); 2,23-2,37 (м, 2 Н); 2,78 (м, 2 Н); 3,22 (м, 2 Н); 3,65 (м,2 Н); 4,19 (м, 2 Н); 4,79 (с, 2 Н); 7,22-7,74 (м, 7 Н); 12,1 (с, 1 Н). Пример 62. 1-[2-(10,11-Диметил-1,8-дитиадибензо[е,h]азулен-2-илметокси)этил]пирролидингидрохлорид. В результате взаимодействия спирта 13 (0,2 г, 0,68 ммоль) и 1-(2-хлорэтил)пирролидингидрохлорида (1,62 г, 0,0095 моль) получают маслянистый продукт, который превращают в гидрохлорид (0,09 г). 1H-ЯМР (м.д., СDCl3): 2,02-2,25 (м, 4 Н); 2,94 (м, 2 Н); 3,32 (м, 2 Н); 3,88 (м, 2 Н); 4,15 (м, 2 Н); 4,81 (с,2 Н); 7,22-7,73 (м, 7 Н); 12,4 (с, 1 Н). Соединения, описанные в примерах 63-64, получают из спирта 14 и соответствующего хлоралкилдиалкиламингидрохлорида в соответствии со способом, описанным в примере 63. Пример 63. [3-(9-Хлор-11-фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]диметиламингидрохлорид. К раствору 3-диметиламинопропилхлоридгидрохлорида (1,22 г, 0,0077 моль) в 50%-м гидроксиде натрия (5 мл), добавляют бензилтриэтиламмонийхлорид (0,15 г) и толуольный раствор спирта 14 (0,19 г,0,55 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 3 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт, который превращают в гидрохлорид (0,095 г). 1H-ЯМР (м.д., CDCl3): 2,24 (м, 2 Н); 2,82 (с, 6 Н); 3,18 (м, 2 Н); 3,74 (м, 2 Н); 4,77 (с, 2 Н); 7,11-7,73 (м,7 Н); 12,35 (с, 1 Н). Пример 64. [2-(9-хлор-11-фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]диметиламингидрохлорид. В результате взаимодействия спирта 14 (0,19 г, 0,55 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (1,12 г, 0,0077 моль) получают маслянистый продукт, который превращают в гидрохлорид (0,07 г). 1H-ЯМР (м.д., СDCl3): 2,97 (м, 6 Н); 3,37 (м, 2 Н), 4,2 (м, 2 Н); 4,87 (с, 2 Н); 7,08-7,79 (м, 7 Н); 12,5 (с,1 Н). Пример 65. 3-(11-Хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропиламин. К раствору 3-хлорпропиламингидрохлорида (1,03 г, 7,96 ммоль) в 50%-м гидроксиде натрия (10 мл) добавляют бензилтриэтиламмонийхлорид (0,3 г) и толуольный раствор спирта 3 (0,25 г, 0,79 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодиль- 14006069 ником в течение 3 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт. 1 Н-ЯМР (м.д., СDCl3): 1,91 (м, 2 Н); 2,99 (т, 2 Н); 3,67 (т, 2 Н); 4,73 (с, 2 Н); 7,15-7,45 (м, 8 Н). МС (m/z): 372,1 (МН+). Пример 66. 3-(8-Окса-1-тиадибензо[e,h]азулен-2-илметокси)пропиламин. Данное соединение получают, как описано в примере 65 в результате взаимодействия спирта 1 (0,3 г, 1,1 ммоль) и 3-хлорпропиламингидрохлорида (1,4 г, 0,011 моль), после чего получают маслянистый продукт. 1H-ЯМР (м.д., CDCl3): 2,02 (м, 2 Н); 3,14 (т, 2 Н); 3,66 (т, 2 Н); 4,72 (с, 2 Н); 7,15-7,45 (м, 9 Н). МС (m/z): 338,2 (МН+). Пример 67. N,N-Диметил[3-(11-метилсульфанил-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]амин. К раствору 3-диметиламинопропилхлоридгидрохлорида (1,3 г, 0,0082 моль) в 50%-м гидроксиде натрия (6 мл) добавляют бензилтриэтиламмонийхлорид (0,18 г, 0,79 ммоль) и толуольный раствор спирта 20 (0,2 г, 0,58 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 4 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,11 г). 1H-ЯМР (м.д., CDCl3): 2,03 (м, 2 Н); 2,48 (с, 3H); 2,53 (с, 6 Н); 2,79 (т, 2 Н); 3,69 (т, 2 Н); 4,74 (с, 2 Н); 7,15-7,65 (м, 8 Н). Пример 68. N,N-диметил[2-(11-метилсульфанил-1,8-дитиадибензо[е,h]азулен-2-илметокси)этил] амин. Данное соединение получают, как описано в примере 67 в результате взаимодействия спирта 20 (0,2 г, 0,58 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (1,2 г, 8,2 ммоль), после чего получают маслянистый продукт (0,13 г). 1H-ЯМР (м.д., CDCl3): 2,45 (с, 3H); 2,47 (с, 6 Н); 2,77 (т, 2 Н); 3,81 (м, 2 Н); 4,77 (с, 2 Н); 7,2-7,6 (м, 8 Н). Пример 69. N,N-Диметил[3-(10-метил-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]амин. К раствору 3-диметиламинопропилхлоридгидрохлорида (1,4 г, 8,8 ммоль) в 50%-м гидроксиде натрия (7 мл) добавляют бензилтриэтиламмонийхлорид (0,2 г, 0,88 ммоль) и толуольный раствор спирта 21(0,25 г, 0,63 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 4 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт. 1H-ЯМР (м.д., СDCl3): 2,01 (м, 2 Н); 2,34 (с, 3H); 2,53 (с, 6 Н); 2,82 (с, 2 Н); 3,68 (т, 2 Н); 4,73 (с, 2 Н); 7,15-7,65 (м, 8 Н). МС (m/z): 396 (МН+). Пример 70. N,N-Диметил[2-(10-метил-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]амин. Данное соединение получают, как описано в примере 69 в результате взаимодействия спирта 21(0,25 г, 0,63 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (1,28 г, 8,8 ммоль), после чего получают маслянистый продукт (0,2 г). 1H-ЯМР (м.д., СDCl3): 2,34 (с, 3H); 2,43 (с, 6 Н); 2,73 (т, 2 Н); 3,77 (т, 2 Н); 4,78 (с, 2 Н); 7,1-7,6 (м, 8 Н). Пример 71. N,N-Диметил[3-(11-метил-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]амин. К раствору 3-диметиламинопропилхлоридгидрохлорида (1,4 г, 8,8 ммоль) в 50%-ном гидроксиде натрия (10 мл) добавляют бензилтриэтиламмонийхлорид (0,2 г, 0,88 ммоль) и толуольный раствор спирта 22 (0,25 г, 0,63 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 4 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,21 г). 1H-ЯМР (м.д., CDCl3): 1,91 (м, 2 Н); 2,34 (с, 6 Н); 2,38 (с, 3H); 2,53 (т, 2 Н); 3,69 (т, 2 Н); 4,77 (с, 2 Н); 7,15-7,67 (м, 8 Н). Пример 72. N,N-Диметил[2-(10-метил-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]амин. Данное соединение получают, как описано в примере 71 в результате взаимодействия спирта 22(0,25 г, 0,63 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (1,3 г, 8,8 ммоль), после чего получают маслянистый продукт (0,2 г). 1H-ЯМР (м.д., CDCl3): 2,34 (с, 3H); 2,56 (с, 6 Н); 2,87 (м, 2 Н); 3,87 (м, 2 Н); 4,78 (с, 2 Н); 7,1-7,6 (м,8 Н). Пример 73. N,N-Диметил[3-(10-метокси-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)пропил]амин. К раствору 3-диметиламинопропилхлоридгидрохлорида (0,75 г, 4,17 ммоль) в 50%-ном гидроксиде натрия (10 мл) добавляют бензилтриэтиламмонийхлорид (0,1 г, 0,44 ммоль) и толуольный раствор спирта 23 (0,2 г, 0,64 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 4 ч. Затем ее охлаждают до комнатной температуры, разбавляют- 15006069 водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,075 г). 1H-ЯМР (м.д., CDCl3): 1,94 (м, 2 Н); 2,39 (с, 6 Н); 2,82 (м, 2 Н); 3,63 (т, 2 Н); 3,83 (с, 3H); 4,7 (с, 2 Н); 6,7-7,46 (м, 8 Н). МС (m/z): 396 (МН+). Пример 74. N,N-Диметил[2-(10-метокси-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]амин. Данное соединение получают, как описано в примере 73 в результате взаимодействия спирта 23 (0,2 г, 0,64 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (0,75 г, 5,15 ммоль), после чего получают маслянистый продукт (0,063 г). 1H-ЯМР (м.д., CDCl3): 2,65 (с, 6 Н); 2,99 (м, 2 Н); 3,84 (с,3H); 3,91 (м, 2 Н); 4,76 (с, 2 Н); 6,73-7,4 (м,8 Н). МС (m/z): 382 (МН+). Пример 75. 1-[2-(10-Метокси-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)этил]пиперидин. Данное соединение получают, как описано в примере 73 в результате взаимодействия спирта 23 (0,2 г, 0,64 ммоль) и 1-(2-хлорэтил)пиперидингидрохлорида (0,75 г, 4,1 ммоль), после чего получают маслянистый продукт (0,04 г). МС (m/z): 421 (MH+). Пример 76. 1-[2-[10-Метокси-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)этил]пирролидин. Данное соединение получают, как описано в примере 73 в результате взаимодействия спирта 23 (0,2 г, 0,64 ммоль) и 1-(2-хлорэтил)пирролидингидрохлорида (0,75 г, 4,4 ммоль), после чего получают маслянистый продукт (0,050 г). МС (m/z): 408 (МН+). Пример 77. 3-(10-Метокси-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропиламин. Данное соединение получают, как описано в примере 73 в результате взаимодействия спирта 23 (0,2 г, 0,64 ммоль) и 3-хлорпропамингидрохлорида (0,75 г, 5,7 ммоль), после чего получают маслянистый продукт (0,04 г). МС (m/z): 368,2 (МН+). Пример 78. N,N-Диметил[3-(6-хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]амин. К раствору 3-диметиламинопропилхлоридгидрохлорида (0,48 г, 3,0 ммоль) в 50%-ном гидроксиде натрия (5 мл) добавляют бензилтриэтиламмонийхлорид (0,2 г, 0,88 ммоль) и толуольный раствор спирта 24 (0,1 г, 0,3 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 4 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,09 г). 1H-ЯМР (м.д., СDCl3): 1,91 (м, 2 Н); 2,35 (с, 6 Н); 2,55 (т, 2 Н); 3,66 (т, 2 Н); 4,73 (с, 2 Н); 7,16-7,64 (м,8 Н). МС (m/z): 416 (МН+). Пример 79. N,N-Диметил[2-(6-хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]амин. Данное соединение получают, как описано в примере 78 в результате взаимодействия спирта 24(0,15 г, 0,63 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (0,65 г, 4,5 ммоль), после чего получают маслянистый продукт (0,08 г). 1H-ЯМР (м.д., СDCl3): 2,56 (с, 6 Н); 2,89 (т, 2 Н); 3,88 (т, 2 Н); 4,78 (с, 2 Н); 7,2-7,6 (м, 8 Н). МС (m/z): 402 (МН+). Пример 80. 3-[(6-Хлор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]амин. Данное соединение получают, как описано в примере 27 в результате взаимодействия спирта 24(0,15 г, 0,45 ммоль) и 3-хлоропропиламингидрохлорида (0,59 г, 4,5 ммоль), после чего получают маслянистый продукт (0,1 г). МС (m/z): 388,1 (МН+). Пример 81. N,N-Диметил[3-(10-фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]амин. К раствору 3-диметиламинопропилхлоридгидрохлорида (1,41 г, 8,9 ммоль) в 50%-ном гидроксиде натрия (7 мл) добавляют бензилтриэтиламмонийхлорид (0,2 г, 0,88 ммоль) и толуольный раствор спирта 27 (0,2 г, 0,64 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 4 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,097 г). 1H-ЯМР (м.д., СDCl3): 1,9 (м, 2 Н); 2,37 (с, 6 Н); 2,58 (м, 2 Н); 3,67 (т, 2 Н); 4,73 (с, 2 Н); 7,0-7,65 (м,8 Н). Пример 82. N,N-Диметил [2-(10-фтор-1,8-дитиадибензо[e,h]азулен-2-илметокси)этил]амин. Данное соединение получают, как описано в примере 81 в результате взаимодействия спирта 27 (0,2 г, 0,64 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (1,28 г, 8,9 ммоль), после чего получают маслянистый продукт (0,085 г). 1- 16006069 Пример 83. [2-(3-Диметиламинопропоксиметил)-1-тиа-8-азадибензо[e,h]азулен-8-ил]фенилметанон. Данное соединение получают, как описано в примере 81 в результате взаимодействия спирта 25(0,15 г, 0,39 ммоль) и 3-диметиламинопропилхлоридгидрохлорида (0,62 г, 3,9 ммоль), после чего получают маслянистый продукт (0,03 г). 1H-ЯМР (м.д., CDCl3): 1,96 (п, 2 Н); 2,38 (с, 6 Н); 2,60 (т, 2 Н); 3,70 (т, 2 Н); 4,79 (с, 2 Н); 7,10-7,60 (м,14 Н). Пример 84. [2-(2-Диметиламиноэтоксиметил)-1-тиа-8-азадибензо[e,h]азулен-8-ил]фенилметанон. Данное соединение получают, как описано в примере 81 в результате взаимодействия спирта 25(0,15 г, 0,39 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (0,56 г, 3,9 ммоль), после чего получают маслянистый продукт (0,04 г). 1H-ЯМР (м.д., CDCl3): 2,17 (с, 6 Н); 2,45 (т, 2 Н); 3,58 (т, 2 Н); 4,65 (с, 2 Н); 6,90-7,63 (м, 14 Н). Пример 85. N,N-Диметил[3-(8 Н-1-тиа-8-азадибензо[е,h]азулен-2-илметокси)пропил]амин. Данное соединение получают, как описано в примере 81 в результате взаимодействия спирта 26(0,03 г, 0,107 ммоль) и 3-диметиламинопропилхлоридгидрохлорида (0,17 г, 1,07 ммоль), после чего получают маслянистый продукт (0,03 г). 1H-ЯМР (м.д., CDCl3): 1,98 (п, 2 Н); 2,49 (с, 6 Н); 2,70 (т, 2 Н); 3,63 (т, 2 Н); 4,68 (с, 2 Н); 5,24 (с, 1 Н); 6,75-7,35 (м, 9 Н). Пример 86. N,N-Диметил[2-(8 Н-1-тиа-8-азадибензо[е,h]азулен-2-илметокси)этил]амин. Данное соединение получают, как описано в примере 81 в результате взаимодействия спирта 26(0,04 г, 0,143 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (0,29 г, 2,0 ммоль), после чего получают маслянистый продукт (0,04 г). 1H-ЯМР (м.д., CDCl3): 2,47 (с, 6 Н); 2,77 (т, 2 Н); 3,76 (т, 2 Н); 4,71 (с, 2 Н); 5,27 (с, 1 Н); 6,80-7,35 (м,9 Н). Пример 87. [3-(11-Фтор-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)пропил]амингидрохлорид. Данное соединение получают, как описано в примере 81 в результате взаимодействия спирта 4 (0,25 г, 0,84 ммоль) и 3-хлорпропиламингидрохлорида (1,53 г, 0,012 ммоль), после чего получают маслянистый продукт, который превращают в гидрохлорид (0,05 г). 1H-ЯМР (м.д., СDCl3): 1,9 (м, 2 Н); 3,04 (м, 2 Н); 3,20 (м, 2 Н); 3,71 (м, 2 Н); 4,74 (с, 2 Н); 6,91-7,55 (м,8 Н). МС (m/z): 356,2 (МН+). Пример 88. [3-(1,8-Дитиадибензо[е,h]азулен-2-илметокси)пропил]амин. Данное соединение получают, как описано в примере 81 в результате взаимодействия спирта 5 (0,25 г, 0,84 ммоль) и 3-хлорпропиламингидрохлорида (1,54 г, 0,012 ммоль), после чего получают маслянистый продукт (0,14 г). 1H-ЯМР (м.д., СDCl3): 1,89 (м, 2 Н); 2,98 (т, 2 Н); 3,29 (ушир.с, 2 Н); 3,67 (т, 2 Н); 4,74 (с, 2 Н); 7,167,63 (м, 9 Н). МС (m/z): (ES+):354 (MH+). Пример 89. N,N-Диметил 3-[3-(8-окса-1-тиадибензо[е,h]азулен-2-ил)пропилокси]пропиламин. К раствору 3-диметиламинопропилхлоридгидрохлорида (0,65 г, 0,0041 моль) в 50%-м гидроксиде натрия (5 мл) добавляют бензилтриэтиламмонийхлорид (0,15 г) и толуольный раствор спирта 15 (0,09 г,0,29 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 3 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,05 г). 1H-ЯМР (м.д., CDCl3): 2,02 (м, 2 Н); 2,13 (м, 2 Н); 2,73 (с, 6 Н); 2,96 (т, 2 Н); 3,09 (т, 2 Н); 3,54 (м, 4 Н); 7,07 (с, 1 Н); 7,14-7,46 (м, 8 Н). Пример 90. N,N-Диметил 2-[3-(8-окса-1-тиадибензо[е,h]азулен-2-ил)пропилокси]этиламин. Данное соединение получают, как описано в примере 89 в результате взаимодействия спирта 15(0,09 г, 0,29 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (0,58 г, 0,004 моль), после чего получают маслянистый продукт (0,025 г). 1H-ЯМР (м.д., СDCl3): 2,04 (м, 2 Н); 2,38 (с, 6 Н); 2,66 (т, 2 Н); 2,97 (т, 2 Н); 3,56 (т, 2 Н); 3,62 (т, 2 Н); 7,06 (с, 1 Н); 7,13-7,46 (м, 8 Н). Пример 91. N,N-Диметил 3-[3-(1,8-дитиадибензо[е,h]азулен-2-ил)пропилокси]пропиламин. К раствору 3-диметиламинопропилхлоридгидрохлорида (0,90 г, 0,0052 моль) в 50%-ном гидроксиде натрия (5 мл) добавляют бензилтриэтиламмонийхлорид (0,15 г) и толуольный раствор спирта 16 (0,12 г,0,37 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 3 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,035 г). 1- 17006069 Данное соединение получают, как описано в примере 91 в результате взаимодействия спирта 16(0,21 г, 0,63 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (1,27 г, 0,009 моль), после чего получают маслянистый продукт (0,13 г). 1H-ЯМР (м.д., CDCl3): 2,03 (м, 2 Н); 2,35 (с, 6 Н); 2,64 (т, 2 Н); 2,96 (т, 2 Н); 3,54 (т, 2 Н); 3,59 (т, 2 Н); 7,02 (с, 1 Н); 7,21-7,65 (м, 8 Н). Пример 93. N,N-Диметил 3-[8 Н-(1-тиадибензо[е,h]азулен-2-ил)метокси]пропиламин. К раствору 3-диметиламинопропилхлоридгидрохлорида (1,14 г, 0,0072 моль) в 50%-м гидроксиде натрия (5 мл) добавляют бензилтриэтиламмонийхлорид (0,15 г) и толуольный раствор спирта 17 (0,2 г,0,72 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 3 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,20 г). 1H-ЯМР (м.д., СDСl3): 1,93 (м, 2 Н); 2,37 (с, 6 Н); 2,57 (т, 2 Н); 3,67 (т, 2 Н); 3,75 (м, 2 Н); 4,75 (с, 2 Н); 7,20-7,55 (м, 9 Н). Пример 94. N,N-Диметил 2-[8 Н-(1-тиадибензо[е,h]азулен-2-ил)метокси]этиламин. Данное соединение получают, как описано в примере 93 в результате взаимодействия спирта 17(0,20 г, 0,72 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (1,03 г, 0,007 моль), после чего получают маслянистый продукт (0,19 г). 1H-ЯМР (м.д., CDCl3): 2,54 (с, 6 Н); 2,88 (т, 2 Н); 3,75 (м, 2 Н); 3,85 (т, 2 Н); 4,79 (с, 2 Н); 7,20-7,52 (м,9 Н). Пример 95. N,N-Диметил 3-[3-(1,8-дитиадибензо[e,h]азулен-2-ил)аллилокси]пропиламин. К раствору 3-диметиламинопропилхлоридгидрохлорида (0,34 г, 0,0022 моль) в 50%-ном гидроксиде натрия (5 мл), добавляют бензилтриэтиламмонийхлорид (0,15 г) и толуольный раствор спирта 18 (0,05 г,0,15 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 3 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,012 г). МС (m/z): 408,2 (МН+). Пример 96. N,N-Диметил 2-[3-(1,8-дитиадибензо[е,h]азулен-2-ил)аллилокси]этиламин. Данное соединение получают, как описано в примере 95 в результате взаимодействия спирта 18(0,11 г, 0,34 ммоль) и 2-диметиламиноэтилхлоридгидрохлорида (0,64 г, 0,004 моль), после чего получают маслянистый продукт (0,018 г). МС (m/z): 394,2 (МН+). Пример 97. N,N-Диметил[3-(8-бензил-8 Н-1-тиа-8-азадибензо[e,h]азулен-2-илметокси)пропил]амин. К раствору 3-диметиламинопропилхлоридгидрохлорида (1,2 г, 0,0054 моль) в 50%-ном гидроксиде натрия (5 мл) добавляют бензилтриэтиламмонийхлорид (0,15 г) и толуольный раствор спирта 19 (0,20 г,0,54 ммоль). Данную реакционную смесь нагревают при энергичном перемешивании и кипятят с обратным холодильником в течение 3 ч. Затем ее охлаждают до комнатной температуры, разбавляют водой и экстрагируют дихлорметаном. После очистки с помощью колоночной хроматографии выделяют маслянистый продукт (0,15 г). 1H-ЯМР (м.д., CDCl3): 1,97 (м, 2 Н); 2,42 (с, 6 Н); 2,66 (т, 2 Н); 3,68 (т, 2 Н); 4,76 (с, 2 Н); 4,99 (д, 2 Н); 6,95-7,40 (м, 14 Н). Пример 98. N,N-Диметил[2-(8-бензил-8 Н-1-тиа-8-азадибензо[e,h]азулен-2-илметокси)этил]амин. Данное соединение получают, как описано в примере 97 в результате взаимодействия спирта 19(0,20 г, 0,54 ммоль) и 2-диметиламиноэтилхлорилгидрохлорида (1,10 г, 0,008 моль), после чего получают маслянистый продукт (0,15 г). 1H-ЯМР (м.д., CDCl3): 2,70 (с, 6 Н); 3,06 (т, 2 Н); 3,98 (т, 2 Н); 4,82 (с, 2 Н); 5,00 (д, 2 Н); 6,97-7,40 (м,14 Н). Пример 99. N-Метил[3-(11-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропил]амин. К метанольному раствору соединения структуры I (Х=O, R1=R3=R4=R5=R6=R7=R8=R9=H, R2=Cl,R10=CH2OCH2CH2CH2N(СН 3)2) (1,79 г, 4,48 ммоль) в 50 мл метанола, добавляют тригидрат ацетата натрия (3,05 г, 0,022 моль) и йод (1,2 г, 4,7 ммоль). Реакционную смесь выдерживают на свету с использованием лампы в 500 Вт и смесь перемешивают при комнатной температуре в течение 5 ч. После того как все указанные реагенты израсходованы(ход реакции отслеживают с помощью тонкослойной хроматографии), в эту реакционную смесь добавляют тиосульфат натрия и растворитель выпаривают. Полученный остаток экстрагируют этилацетатом. После очистки на колонке выделяют 1,2 г маслянистого продукта. 1(с, 2 Н); 7,18-7,47 (м, 8 Н). Пример 100. N-Метил[2-(11-хлор-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)этил]амин. К метанольному раствору соединения структуры I (Х=O, R1=R3=R4=R5=R6=R7=R8=R9=H, R2=Cl,R10=СН 2OСН 2 СН 2N(СН 3)2) (0,47 г, 1,22 ммоль), в 30 мл метанола, добавляют тригидрат ацетата натрия(0,83 г, 6,1 ммоль) и йод (0,32 г, 1,28 ммоль). Реакционную смесь выдерживают на свету с использованием лампы в 500 Вт и смесь перемешивают при комнатной температуре в течение 5 ч. После того как все указанные реагенты израсходованы (ход реакции отслеживают с помощью тонкослойной хроматографии), в данную реакционную смесь добавляют тиосульфат натрия и растворитель выпаривают. Полученный остаток экстрагируют этилацетатом. После очистки на колонке выделяют 0,29 г маслянистого продукта. 1(м, 8 Н). Пример 101. N-Метил[3-(8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропил]амин. К метанольному раствору соединения структуры I (Х=O, R1=R2=R3=R4=R5=R6=R7=R8=R9=H,R10=СН 2OСН 2 СН 2 СН 2N(СН 3)2) (1,18 г, 0,49 ммоль, в 10 мл метанола), добавляют тригидрат ацетата натрия (0,33 г, 2,46 ммоль) и йод (0,13 г, 0,52 ммоль). Реакционную смесь выдерживают на свету с использованием лампы в 500 Вт и смесь перемешивают при комнатной температуре в течение 5 ч. После того как все указанные реагенты израсходованы (ход реакции отслеживают с помощью тонкослойной хроматографии), в данную реакционную смесь добавляют тиосульфат натрия и растворитель выпаривают. Полученный остаток экстрагируют этилацетатом. После очистки на колонке выделяют 0,1 г маслянистого продукта. 1H-ЯМР (м.д., CDCl3): 2,2 (м, 2 Н); 2,72 (с, 3H); 3,15 (м, 2 Н); 3,72 (т, 2 Н); 4,75 (с, 2 Н); 7,15-7,47 (м,9 Н); 9,44 (ушир.с, 1 Н). Пример 102. N-Метил[3-(1,8-дитиадибензо[e,h]азулен-2-илметокси)пропил]амин. К метанольному раствору соединения структуры I (Х=O, R1=R2=R3=R4=R5=R6=R7=R8=R9=H,R10=СН 2OСН 2 СН 2 СН 2N(СН 3)2) (0,14 г, 0,37 ммоль в 10 мл метанола), добавляют тригидрат ацетата натрия (0,25 г, 1,83 ммоль) и йод (0,1 г, 0,39 ммоль). Реакционную смесь выдерживают на свету с использованием лампы в 500 Вт и смесь перемешивают при комнатной температуре в течение 5 ч. После того как все указанные реагенты израсходованы (ход реакции отслеживают с помощью тонкослойной хроматографии), в реакционную смесь добавляют тиосульфат натрия и растворитель выпаривают. Полученный остаток экстрагируют этилацетатом. После очистки на колонке выделяют 0,09 г маслянистого продукта. 1(с, 2 Н); 7,20-7,63 (м, 9 Н). Пример 103. 2-Бромметил-1,8-дитиадибензо[e,h]азулен. Раствор спирта 5 (0,5 г, 1,69 ммоль) в 47%-й бромистоводородной кислоте (1,4 мл) нагревают при температуре кипения с обратным холодильником в течение 3 ч. После того, как все реагенты израсходованы (ход реакции отслеживают с помощью тонкослойной хроматографии), в данную реакционную смесь добавляют воду (10 мл) и полученный продукт экстрагируют этилацетатом. Неочищенный продукт выделяют очисткой с помощью хроматографии на колонке. В итоге выделяется 0,5 г маслянистого продукта. 1H-ЯМР (м.д., CDCl3): 4,80 (с, 2 Н); 7,27-7,65 (м, 9 Н). Пример 104. (1,8-Дитиадибензо[e,h]азулен-2-ил)ацетонитрил. К этанольному раствору 2-бромметил-1,8-дитиадибензо[е,h]азулена (0,5 г, 1,4 ммоль) в 8 мл этанола) добавляют цианид натрия (0,105 г, 2,1 ммоль) и полученную реакционную смесь кипятят с обратным холодильником в течение 8 ч. После того, как все реагенты израсходованы (ход реакции отслеживают с помощью тонкослойной хроматографии), растворитель выпаривают и сухой остаток экстрагируют в системе диэтиловый эфир/вода. Выделяют 0,4 г маслянистого продукта. ИК (пленка): 3055 см-1, 2972 см-1, 2922 см-1, 2851 см-1, 2252 см-1 (CN), 1713 см-1, 1476 см-1. Пример 105. 2-(1,8-Дитиадибензо[e,h]азулен-2-ил)этиламин. К суспензии LiAlH4 в сухом эфире (0,1 г, 2,62 ммоль) в 20 мл диэтилового эфира, по каплям добавляют эфирный раствор соединения структуры I (X=S, R1=R2=R3=R4=R5=R6=R7=R8=R9=H, R10=CH2CN)(0,4 г, 1,31 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 4 ч. Затем после того как все количество сложного эфира израсходовано в данной реакции (ход реакции отслеживают с помощью тонкослойной хроматографии), избыток LiAlH4 разлагают добавлением диэтилового эфира и воды. Полученный белый осадок отфильтровывают и, после высушивания над безводнымNa2SO4, полученный фильтрат выпаривают при пониженном давлении. Полученный неочищенный продукт выделяют очисткой с помощью хроматографии на колонке. Выделяется 0,025 г маслянистого продукта. МС m/z (ES+): 293,2 (M-NH2); 310,2 (МН+). Получение альдегидов К дихлорметановому раствору спирта (0,002 моль/15 мл) (таблица 1) добавляют дипиридиноксид хрома (VI) (пиридилдихромат, PDC, 0,003 моль). Данную реакционную смесь перемешивают при комнатной температуре в течение 3-18 ч. К этой реакционной смеси добавляют диэтиловый эфир (20 мл) и разбавленную таким образом реакционную смесь подвергают очистке на колонке с флоризилом. Полученный продукт дополнительно очищают на колонке с силикагелем.- 19006069 В соответствии со способом примера В, исходя из соответствующего спирта (табл. 1, соединения 1,3, 4 и 5) получают производные дибензоазулена, в которых R1, R3, R4, R5, R6, R7, R8 и R9=H, R10=CHO, a Следующие ниже соединения, описанные в примерах 106-113, получают из альдегидов, представленных в табл. 2, и соответствующих фосфорилидов в соответствии со способом, описанным в примере 106. Пример 106. Метиловый эфир 4-(11-фтор-8-окса-1-тиадибензо[е,h]азулен-2-ил)акриловой кислоты. К раствору альдегида 28 (0,07 г, 0,0024 моль в толуоле (10 мл) добавляют илид III (метил(трифенил) фосфоранилидацетат) (0,08 г, 0,0024 моль). Данную реакционную смесь перемешивают при кипячении с обратным холодильником в течение 4 ч и затем охлаждают до комнатной температуры, выпаривают досуха и экстрагируют этилацетатом. После очистки с помощью колоночной хроматографии выделяют кристаллический продукт (0,03 г). 1H-ЯМР (м.д., CDCl3): 3,82 (с, 3H); 6,31 (д, 1 Н, J=15,67 Гц); 7,01-7,07 (м, 2 Н); 7,12-7,17 (м, 1 Н); 7,217,46 (м, 4 Н); 7,48 (с, 1 Н); 7,80 (д, 1 Н, J=15,69 Гц). Пример 107. Метиловый эфир 4-(11-хлор-8-окса-1-тиадибензо[е,h]азулен-2-ил)акриловой кислоты. К раствору альдегида 29 (0,15 г, 0,48 ммоль) в тетрагидрофуране (20 мл) добавляют илид III (0,24 г,0,72 ммоль). Данную реакционную смесь перемешивают при кипячении с обратным холодильником в течение 4 ч и затем охлаждают до комнатной температуры, выпаривают досуха и экстрагируют этилацетатом. После очистки с помощью колоночной хроматографии выделяют кристаллический продукт (0,08 г). 1H-ЯМР (м.д., CDCl3): 3,82 (с, 3H); 6,30 (д, 1 Н, J=15,68 Гц); 7,08-7,57 (м, 8 Н); 7,80 (д, 1 Н, J=15,68 Гц). Пример 108. 4-(11-Фтор-8-окса-1-тиадибензо[e,h]азулен-2-ил)-4-бур-3-ен-2-он. К раствору альдегида 28 (0,14 г, 0,47 ммоль) в толуоле (10 мл) добавляют илид IV (ацетилметилентрифенилфосфоран) (0,15 г, 0,47 ммоль). Данную реакционную смесь перемешивают при кипячении с обратным холодильником в течение 4 ч и затем охлаждают до комнатной температуры, выпаривают досуха и экстрагируют этилацетатом. После очистки с помощью колоночной хроматографии выделяют кристаллический продукт (0,08 г). 1H-ЯМР (м.д., CDCl3): 2,35 (с, 3H); 6,60 (д, 1 Н, J=15,85 Гц); 7,02-7,08 (м, 2 Н); 7,14-7,17 (м, 1 Н); 7,227,48 (м, 4 Н); 7,52 (с, 1 Н); 7,65 (д, 1 Н, J=15,86 Гц). Пример 109. 4-(11-Хлор-8-окса-1-тиадибензо[e,h]азулен-2-ил)-4-бут-3-ен-2-он. К раствору альдегида 29 (0,15 г, 0,48 ммоль) в тетрагидрофуране (10 мл) добавляют илид IV (0,15 г,0,47 ммоль). Данную реакционную смесь перемешивают при кипячении с обратным холодильником в течение 4 ч и затем охлаждают до комнатной температуры, выпаривают досуха и экстрагируют этилацетатом. После очистки с помощью колоночной хроматографии выделяют кристаллический продукт (0,08 г). 1H-ЯМР (м.д., СDСl3): 2,39 (с, 3H): 6,61 (д, 1 Н, J=15,87 Гц); 7,01-7,60 (м, 8 Н); 7,65 (д, 1 Н, J=15,86 Гц). Пример 110. 3-(11-Фтор-8-окса-1-тиадибензо[e,h]азулен-2-ил)акриловая кислота. Гидролиз сложного эфира, полученного как описано в примере 106 (0,03 г, 0,085 ммоль), осуществляют с помощью 2 М KОН (кипячение с обратным холодильником 2-5 ч) и подкисляют данную реакционную смесь концентрированной НСl. Полученный кристаллический продукт отфильтровывают и промывают водой (0,02 г). 1H-ЯМР (м.д., CDCl3): 6,3 (д, 1 Н); 7,02-7,09 (м, 2 Н); 7,12-7,17 (м, 1 Н); 7,22-7,48 (м, 4 Н); 7,53 (с, 1 Н); 7,9 (д, 1 Н). Пример 111. 3-(11-Фтор-8-окса-1-тиадибензо[e,h]азулен-2-ил)пропионовая кислота. В этанольный раствор (10 мл) кислоты, полученной в примере 107, добавляют 5% Pd/C (5 мг), увлажненного водой (50%). Данную реакционную смесь перемешивают при комнатной температуре в атмосфере водорода при давлении 300 кПа. После отфильтровывания катализатора и выпаривания растворителя получают продукт, который выделяют очисткой с помощью колоночной хроматографии на колонке с силикагелем. 1- 20006069 Пример 112. Метил 3-(8-окса-1-тиадибензо[e,h]азулен-2-ил)пропеноат. В раствор альдегида 30 (0,6 г, 2,16 ммоль) в толуоле (20 мл) добавляют метил(трифенилфосфоранилид)ацетат (0,72 г, 2,16 ммоль). Полученную реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение 4 ч и затем охлаждают до комнатной температуры, выпаривают досуха и экстрагируют этилацетатом. После очистки с помощью колоночной хроматографии выделяют кристаллический продукт (0,90 г). 1H-ЯМР (м.д., CDCl3): 3,82 (с, 3H); 6,30 (д, 1 Н, J=15,68 Гц); 7,20-7,74 (м, 9 Н); 7,84 (д, 1 Н, J=15,68 Гц). Пример 113. Метил 3-(1,8-дитиадибензо[e,h]азулен-2-ил)пропеноат. В раствор альдегида 31 (0,25 г, 0,89 ммоль) в толуоле (20 мл) добавляют метил(трифенилфосфоранилид)ацетат (0,28 г, 0,85 ммоль). Полученную реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение 4 ч и затем охлаждают до комнатной температуры, выпаривают досуха и экстрагируют этилацетатом. После очистки с помощью колоночной хроматографии выделяют кристаллический продукт (0,25 г). 1H-ЯМР (м.д., CDCl3): 3,82 (с, 3H); 6,30 (д, 1 Н, J=15,68 Гц); 7,20-7,74 (м, 9 Н); 7,84 (д, 1 Н, J=15,68 Гц). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I и его фармакологически приемлемые соли и сольватыR1, R5, R7, R8 и R9 независимо друг от друга представляют водород;-(СН 2)n-А,в которой n означает целое число 1-3, а одна или несколько метиленовых групп могут быть замещены атомом кислорода, и А представляет насыщенное или ненасыщенное пяти- или шестичленное кольцо с одним-тремя гетероатомами, выбранными из группы, включающей О, S и N, или группу формулы где R11 и R12 независимо друг от друга представляют водород или С 1-С 7 алкил. 2. Соединение и соль по п.1, где R10 представляет СН 2OН, или СН 2O(СН 2)n-А. 3. Соединение и соль по п.2, где А представляет морфолин-4-ил, пиперидин-1-ил или пирролидин 1-ил. 4. Соединение и соль по п.1, где А представляет где R11 и R12 независимо друг от друга представляют водород или С 1-С 7 алкил. 5. Соединение и соль по п.4, где R11 и R12 представляет Н, -СН 3 или -СН 2 СН 3. 6. Соединение и соль по п.1, где R2 представляют Н, SСН 3, F, Cl, Вr или СН 3. 7. Соединение и соль по п.1, где R3 представляет Н, ОСН 3, F, Cl, Вr, СF3 или СН 3. 8. Соединение и соль по п.1, где R4 представляет Н, F, Cl или СН 3. 9. Соединение и соль по п.1, где R6 представляет Н, F или Cl. 10. Способ получения соединения формулы I или его фармацевтически приемлемых солей или сольватов по п.1, который включает А) восстановление сложного эфира формулы (i),где X, R1, R2, R3, R4, R5, R6, R7, R8 и R9 имеют значения, указанные в п.1, путем обработки гидридом металла в неполярном растворителе при температуре от 0 до 60 С в течение 1-5 ч с получением спирта,представленного формулой (ii) где X, R1, R2, R3, R4, R5, R6, R7, R8 и R9 имеют значения, указанные в п.1,B) взаимодействие спирта формулы (ii) с соединением формулы III в присутствии катализатора фазового переноса, выбранного из группы, включающей бензилтриэтиламмонийхлорид, бензилтриэтиламмонийбромид и цетилтриметилбромид, в двухфазной щелочной среде при температуре от 20 до 100 С в течение 1-24 ч Сl-(СН 2)n-АIII с получением аминосоединения формулы I, где n и А имеют значения, указанные в п.1;C) необязательно окисление спирта формулы (ii) пиридинилдихроматом или пиридинилхлорхроматом в дихлорметане при комнатной температуре в течение 1-2 ч с получением альдегида, представленного формулой (iii) где X, R1, R2, R3, R4, R5, R6, R7, R8 и R9 имеют значения, указанные в п.1. 11. Соединение формулы I или его фармакологически приемлемые соли или сольваты по п.1, выбранные из группы: диметил[3-(8-окса-1-тиадибензо[е,h]азулен-2-илметокси)пропил]амингидрохлорид,диметил[2-(8-окса-1-тиадибензо[е,h]азулен-2-илметокси)этил]амингидрохлорид,4-[2-(8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]морфолингидрохлорид,1-[2-(8-окса-1-тиадибензо[е,h]азулен-2-илметокси)этил]пиперидингидрохлорид,1-[2-(8-окса-1-тиадибензо[е,h]азулен-2-илметокси)этил]пирролидингидрохлорид,[3-(9-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)пропил]диметиламин,[2-(9-хлор-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)этил]диметиламин,4-[2-(9-хлор-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)этил]морфолин,1-[2-(9-хлор-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)этил]пиперидин,1-[2-(9-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]пирролидин,[3-(11-хлор-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)пропил]диметиламин,[2-(11-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]диметиламин,4-[2-(11-хлор-8-окса-1-тиадибензо[e,h]азулен-2-илметокси)этил]морфолин,1-[2-(11-хлор-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)этил]пиперидин,1-[2-(11-хлор-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)этил]пирролидин,[3-(11-фтор-8-окса-1-тиадибензо[е,h]азулен-2-илметокси)пропил]диметиламин гидрохлорид,- 22006069N,N-диметил 2-[(8H-1-тиадибензо[е,h]азулен-2-ил)метокси]этиламин. 12. Применение соединения по п.1 для изготовления фармацевтических композиций для лечения или профилактики патологических состояний или заболеваний, индуцированных чрезмерным нерегулируемым продуцированием цитокинов или воспалительных медиаторов.
МПК / Метки
МПК: A61K 31/55, C07D 495/04, A61P 35/00
Метки: опухоли, тиенодибензоазуленовые, ингибиторов, фактора, качестве, соединения, некроза
Код ссылки
<a href="https://eas.patents.su/25-6069-tienodibenzoazulenovye-soedineniya-v-kachestve-ingibitorov-faktora-nekroza-opuholi.html" rel="bookmark" title="База патентов Евразийского Союза">Тиенодибензоазуленовые соединения в качестве ингибиторов фактора некроза опухоли</a>
Предыдущий патент: Оптимизированный препарат тобрамицина для аэрозолизации
Следующий патент: Противоопухолевые аналоги ет-743
Случайный патент: Производные арилсульфониламиногидроксамовой кислоты