Противоопухолевые аналоги ет-743
Номер патента: 6070
Опубликовано: 25.08.2005
Авторы: Куэвас Кармен, Перес Марта, Мант Саймон, Мансанарес Игнасио, Мартин Мария Хесус, Родригес Альберто
Формула / Реферат
1. Соединение формулы
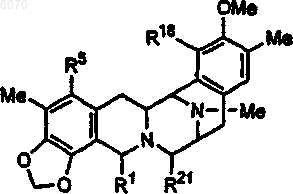
где R1 представляет -CH2-NHRa или -CH2-ORa, где Ra представляет алкил-CO-; галогеналкил-CO-; циклоалкилалкил-CO-; галогеналкил-O-CO-; арилалкенил-CO-; гетероарил-CO-; алкенил-CO-; алкенил или аминокислотный ацил;
R5 представляет -OR", где R" представляет H; алкил-CO-; циклоалкил-CO-; галогеналкил-CO- или защитную группу;
R18 представляет -OR, где R представляет H, алкил-CO-; циклоалкилалкил-CO- или защитную группу;
R21 представляет -CN или R1 представляет -CH2-N(Ra)2 или -CH2-ORa, где Ra представляет H; алкил-CO-; галогеналкил-CO-; циклоалкилалкил-CO-; галогеналкил-O-CO-; арилалкил-CO-; арилалкенил-CO-; гетероарил-CO-; алкенил-CO-; алкенил; аминокислотный ацил или защитную группу;
R5 представляет -OR", где R" представляет H; алкил-CO-; циклоалкил-CO-; галогеналкил-CO- или защитную группу;
R18 представляет -OR, где R представляет H, алкил-CO-; циклоалкилалкил-CO- или защитную группу;
R21 представляет -OH,
где указанный алкил имеет 1-12 атомов углерода, указанный алкенил имеет 2-12 атомов углерода, указанный арил имеет 1-3 кольца и 6-18 атомов углерода, указанный циклоалкил имеет 3-12 атомов углерода, а указанный гетероарил имеет 1, 2, или 3 гетероатома, выбранных из N, O и S.
2. Соединение по п.1, которое имеет формулу
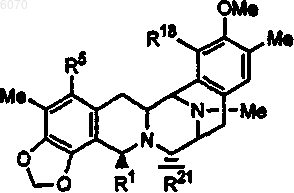
где R1, R5, R18 и R21 определены выше.
3. Соединение по п.1 или 2, где R1 представляет -CH2-NHRa.
4. Соединение по п.3, в котором Ra представляет аминокислотный ацил, и где указанный аминокислотный ацил кроме того замещен одной или несколькими группами Ra.
5. Соединение по любому из пп.1-4, в котором R1 представляет -CH2-NH-aa-Rb, где аа представляет аминокислоту, а Rb представляет водород; защитную группу; арилалкенил-CO-; галогеналкил-CO-; алкил-CO-; арилалкил-CO- или аминокислотный ацил.
6. Соединение по п.5, в котором R1 представляет -CH2-NH-aa-Rb, где аа представляет аланин, а Rb представляет водород; Boc; PhNHCS-, CF3CO-, PhNAcCS-, трифторциннамоил, циннамоил; C3F7CO-; бутирил, 3-хлорпропионил, гидроциннамоил, гексаноил, фенилацетил, Cbz-Val или ацетил; -CH2-aa-Rb, где аа представляет валин, а Rb представляет Cbz или Boc; -CH2-aa-Rb, где aa представляет фенилаланин, а Rb представляет Boc; -CH2-aa-Rb, где aa представляет пролин, а Rb представляет Boc; -CH2-aa-Rb, где aa представляет аргинин, а Rb представляет Boc; или -CH2-aa-Rb, где aa представляет триптофан, а Rb представляет Boc.
7. Соединение по любому из пп.1-4, в котором R1 представляет -CH2-NRa-aa-Rb, где aa представляет аминокислоту, Ra представляет алкил-CO-, а Rb представляет галогеналкил-CO-.
8. Соединение по п.7, в котором R1 представляет -CH2-NRa-aa-Rb, где aa представляет ацетилаланин, Ra представляет ацетил или бутирил, а Rb представляет CF3-CO-.
9. Соединение по любому из пп.1-3, в котором R1 представляет -CH2-NHRa, где Ra представляет алкил-CO-; алкенил-CO-; арилалкенил-CO-; гетероарил-CO-; циклоалкилалкил-CO- или алкенил.
10. Соединение по любому из пп.1-3, в котором R1 представляет -CH2-NHRa, где Ra представляет ацетил, изовалероил, деканоил, циннамоил, пропионил, миристоил, стеароил, гексаноил, кротонил, хлорникотиноил, циклогексилацетил, циклогексилпропионил или аллил.
11. Соединение по п.1 или 2, в котором R1 представляет -CH2-ORa, где Ra представляет защищенный цистеин; цистеиновое производное формулы ProtSH-S-CH2-C(NHProtNH)-CO-, где ProtSH и ProtNH представляют защитные группы для тиола и для амино; алкил-CO-; арилалкенил-CO-; цистеиновое производное формулы ProtSH-S-CH2-C(=NOProtOH)-CO-, где ProtSH и ProtOH представляют защитные группы для тиола и для гидрокси; или цистеиновое производное формулы ProtSH-S-CH=C(-OProtOH) -CO-, где ProtSH и ProtOH представляют защитные группы для тиола и гидрокси.
12. Соединение по п.11, в котором R1 представляет -CH2-ORa, где Ra представляет S-Fm-O-TBDMS-цистеин; цистеиновое производное формулы ProtSH-S-CH2-C(NHProtNH)-CO-, где ProtSH представляет Fm, и ProtOH представляет Troc; бутирил; трифторметилциннамоил; циннамоил; цистеиновое производное формулы ProtSH-S-CH2-C(=NOProtOH)-CO-, где ProtSH представляет Fm, а ProtOH представляет метокси; или цистеиновое производное формулы ProtSH-S-CH=C(-OProtOH)-CO-, где ProtSH представляет Fm, а ProtOH представляет MOM.
13. Соединение по любому из пп.1-12, в котором R5 представляет -OR", где R" представляет H; алкил-CO-, где алкил имеет нечетное число атомов углерода, w-циклогексилалкил-CO- или защитную группу.
14. Соединение по п.13, где R5 представляет -OCOCH3.
15. Соединение по любому из пп.1-14, в котором R18 представляет -OR, где R представляет H; алкил-CO- или защитную группу.
16. Соединение по п.1 или 2, в котором R21 представляет -CN и R1 представляет -CH2-ORa, где Ra представляет защищенный цистеин; цистеиновое производное формулы ProtSH-S-CH2-C(NHProtNH)-CO-, где ProtSH и ProtNH представляют защитные группы для тиола и для амино; алкил-CO-; арилалкенил-CO-; цистеиновое производное формулы ProtSH-S-CH2-C(=NOProtOH)-CO-, где ProtSH и ProtOH представляют защитные группы для тиола и для гидрокси; или цистеиновое производное формулы ProtSH-S-CH=C(-OProtOH)-CO-, где ProtSH и ProtOH представляют защитные группы для тиола и гидрокси.
17. Соединение по п.16, в котором R1 представляет -CH2-ORa, где Ra представляет S-Fm-O-TBDMS-цистеин; цистеиновое производное формулы ProtSH-S-CH2-C(NHProtNH)-CO-, где ProtSH представляет Fm и ProtOH представляет Troc; бутирил; трифторметилциннамоил; циннамоил; цистеиновое производное формулы ProtSH-S-CH2-C(=NOProtOH)-CO-, где ProtSH представляет Fm, а ProtOH представляет метокси; или цистеиновое производное формулы ProtSH-S-CH=C(-OProtOH)-CO-, где ProtSH представляет Fm, а ProtOH представляет MOM.
18. Соединение по п.1 или 2, в котором R21 представляет -OH и R1 представляет -CH2-ORa, где Ra представляет водород; защищенный цистеин; цистеиновое производное формулы ProtSH-S-CH2-C(NHProtNH)-CO-, где ProtSH и ProtNH представляют защитные группы для тиола и для амино; защитную группу; алкил-CO-; арилалкил-CO-; арилалкенил-CO-; цистеиновое производное формуыы ProtSH-S-CH2-C(=NOProtOH)-CO-, где ProtSH и ProtOH представляют защитные группы для тиола и для гидрокси; или цистеиновое производное формулы ProtSH-S-CH=C(-OProtOH) -CO-, где ProtSH и ProtOH представляют защитные группы для тиола и гидрокси.
19. Соединение по п.18, в котором R1 представляет -CH2-ORa, где Ra представляет водород; S-Fm-O-TBDMS-цистеин; цистеиновое производное формулы ProtSH-S-CH2-C(NHProtNH) -CO-, где ProtSH представляет Fm и ProtOH представляет Troc; TBDPS; бутирил; трифторметилциннамоил; циннамоил; гидроциннамоил; цистеиновое производное формулы ProtSH-S-CH2-C(=NOProtOH)-CO-, где ProtSH представляет Fm, а ProtOH представляет метокси; или цистеиновое производное формулы ProtSH-S-CH=C (-OProtOH) -CO-, где ProtSH представляет Fm, а ProtOH представляет MOM.
20. Соединение по любому из предшествующих пунктов, в котором R5 представляет -OR", где R" представляет H; алкил-CO-, где алкил имеет нечетное число атомов углерода, w-циклогексилалкил-CO- или защитную группу.
21. Соединение по п.20, в котором R5 представляет -OCOCH3.
22. Соединение по любому из предшествующих пунктов, в котором R18 представляет -OR, где R представляет H; алкил-CO-или защитную группу.
23. Соединение по п.22, в котором R18 представляет -OH.
24. Соединение нижеследующей общей структуры (I)

где каждый из R', X2, R1 и R6 независимо выбраны из групп, определенных ниже

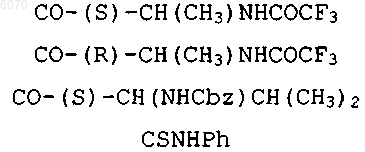
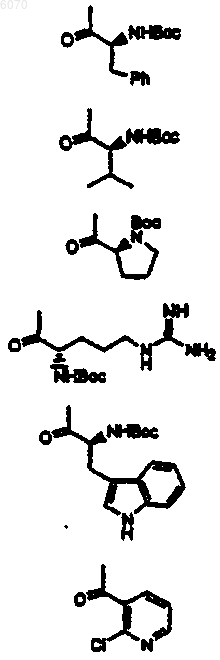
25. Соединение нижеследующей общей структуры (II) или (III)
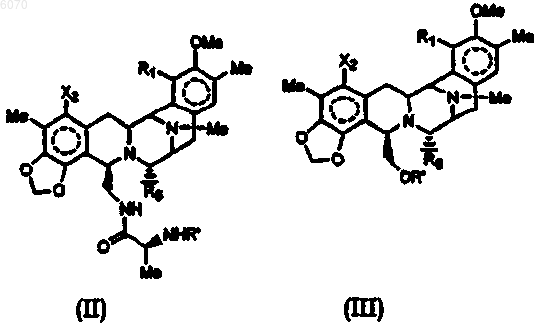
где каждый из R', X2, R1 и R6 независимо выбраны из групп, определенных ниже
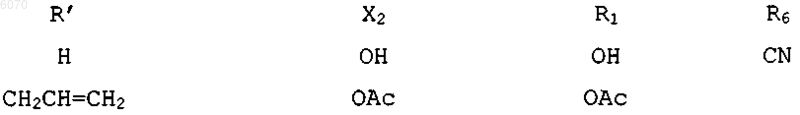

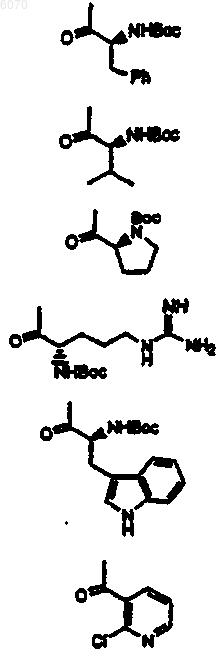
26. Соединение нижеследующей общей структуры I, II или III
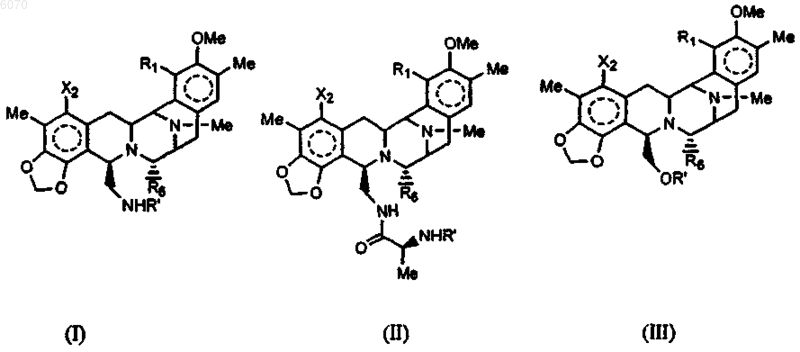
где каждый из R', X2, R1 и R6 независимо выбраны из групп, определенных ниже


27. Соединение по п.1 формулы

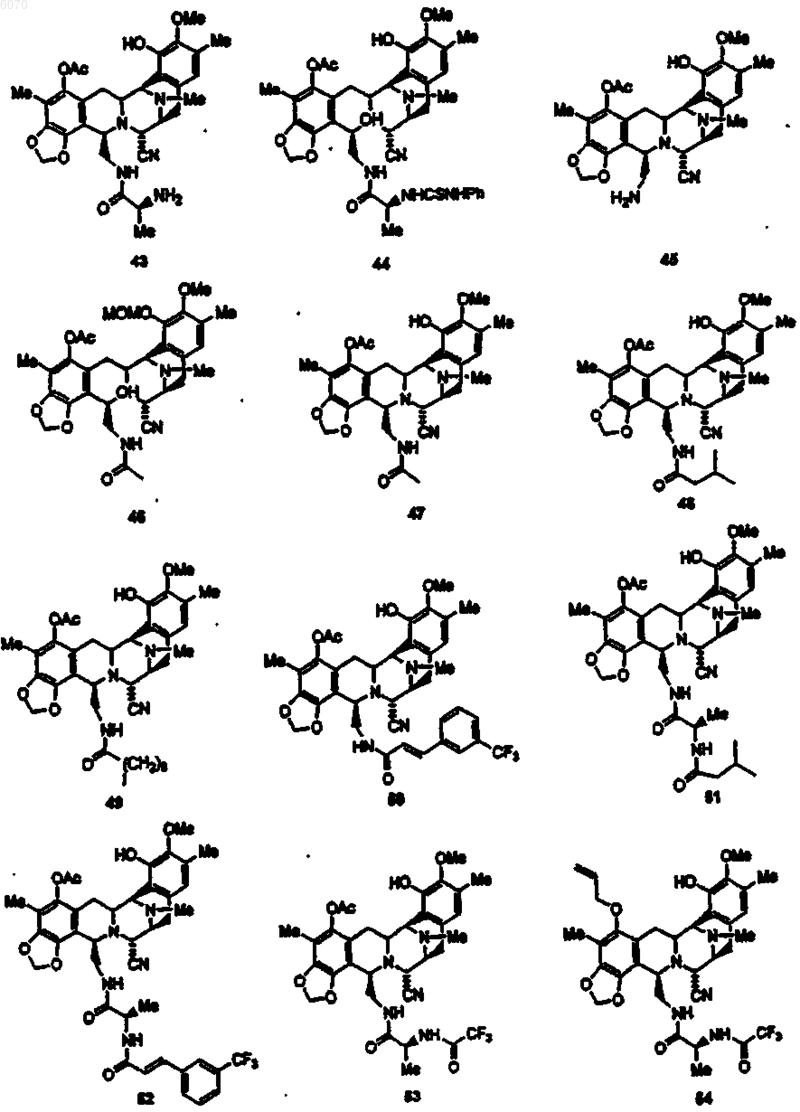
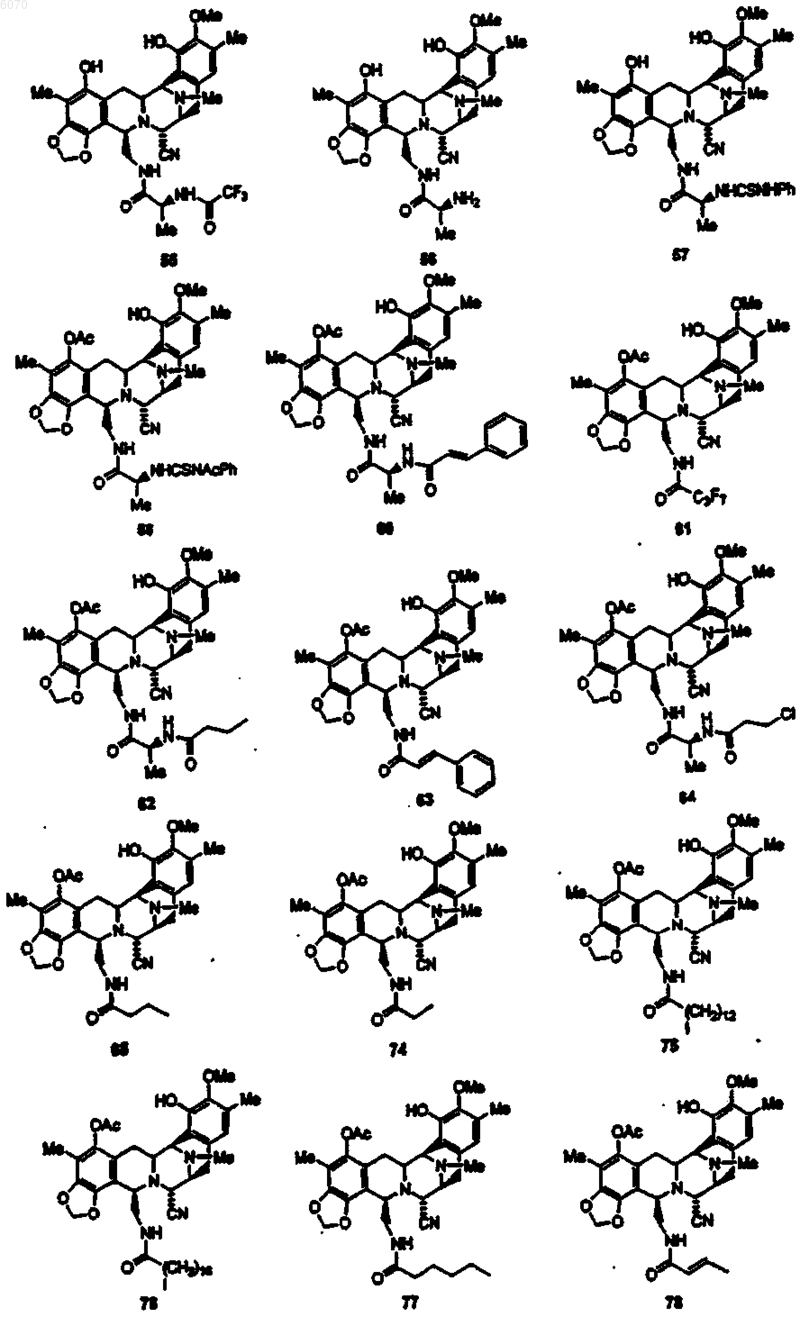
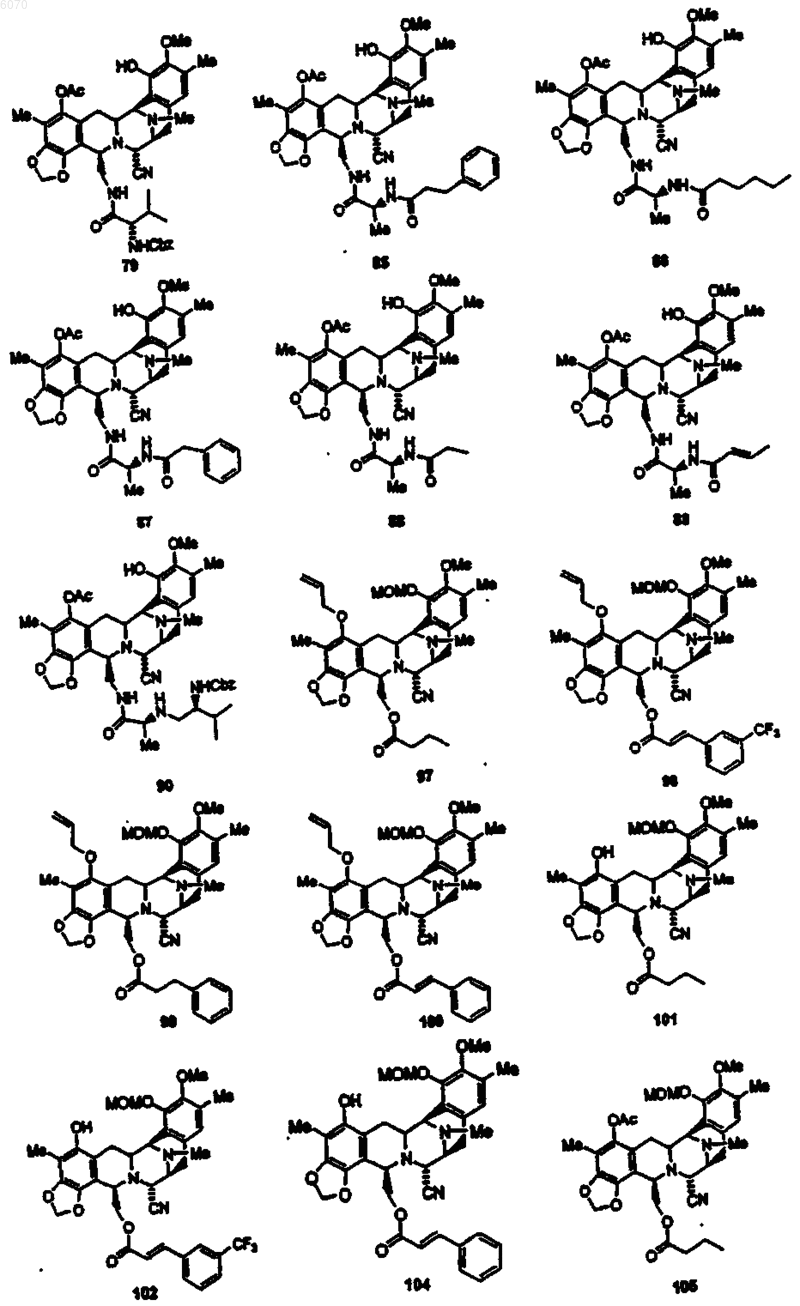
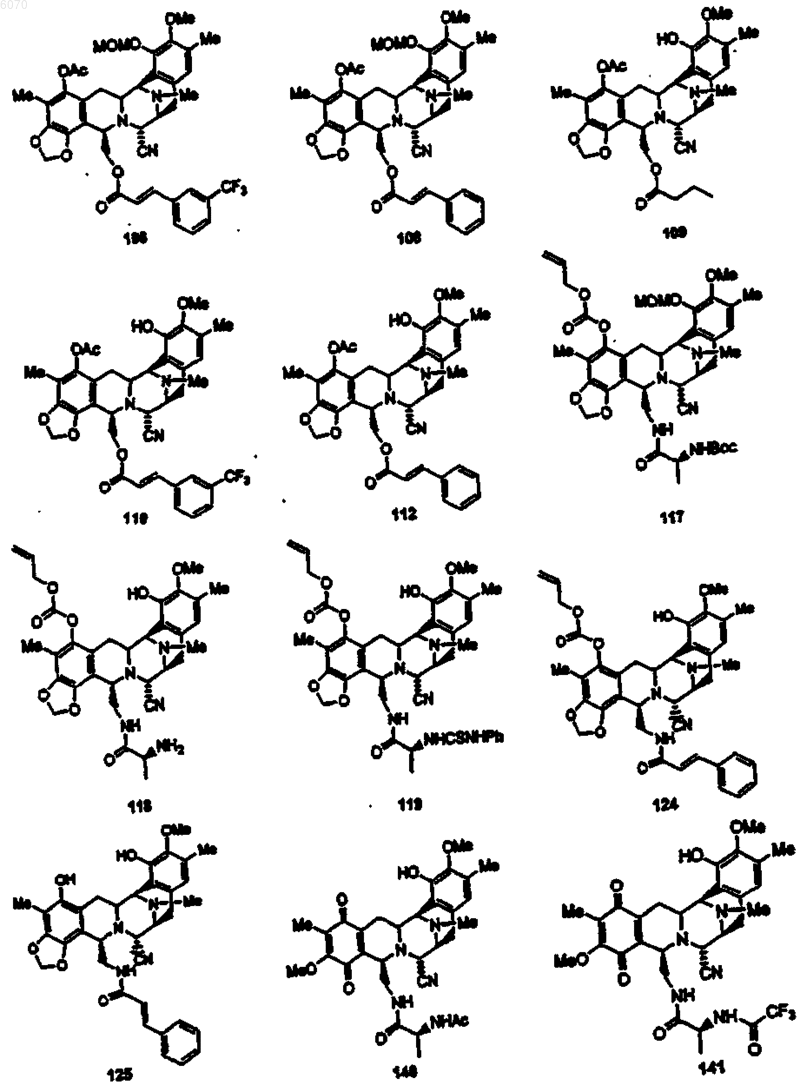
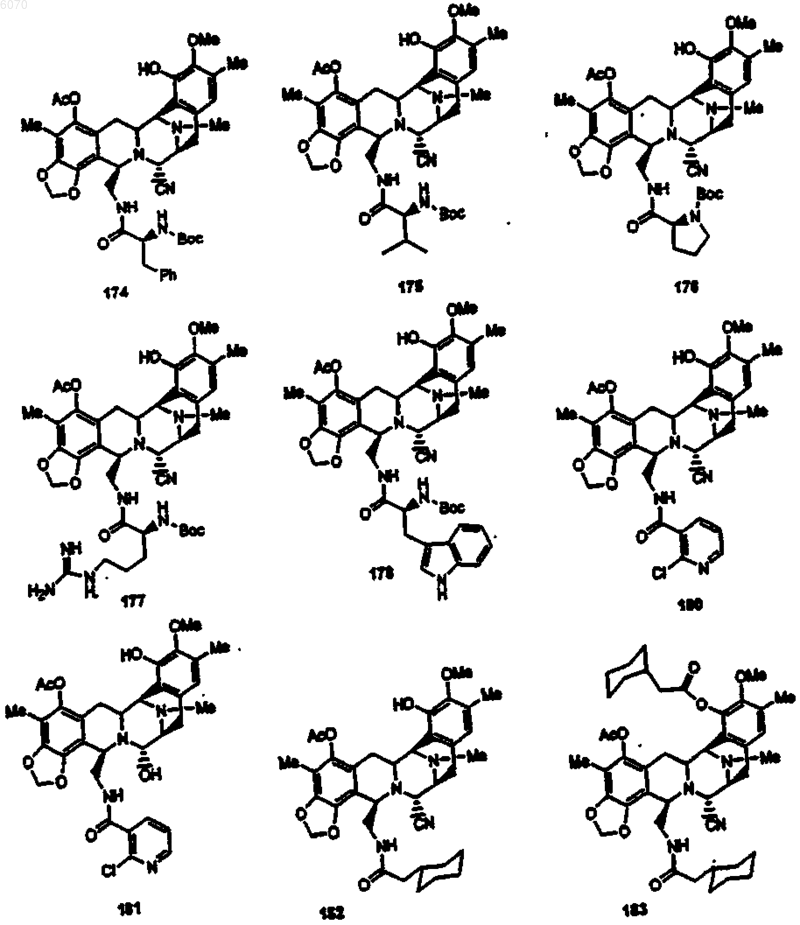
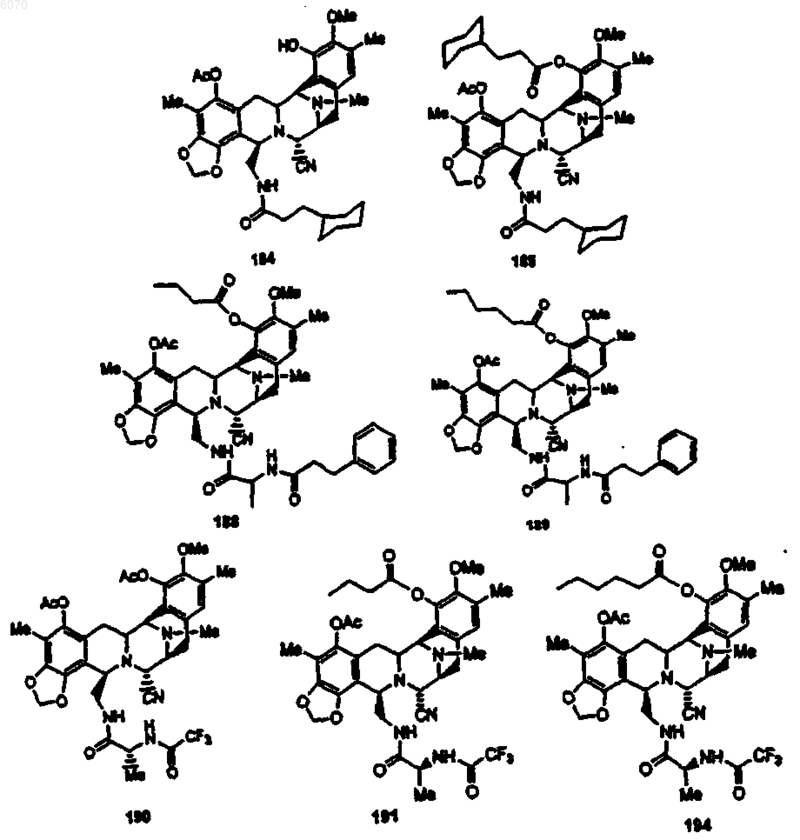
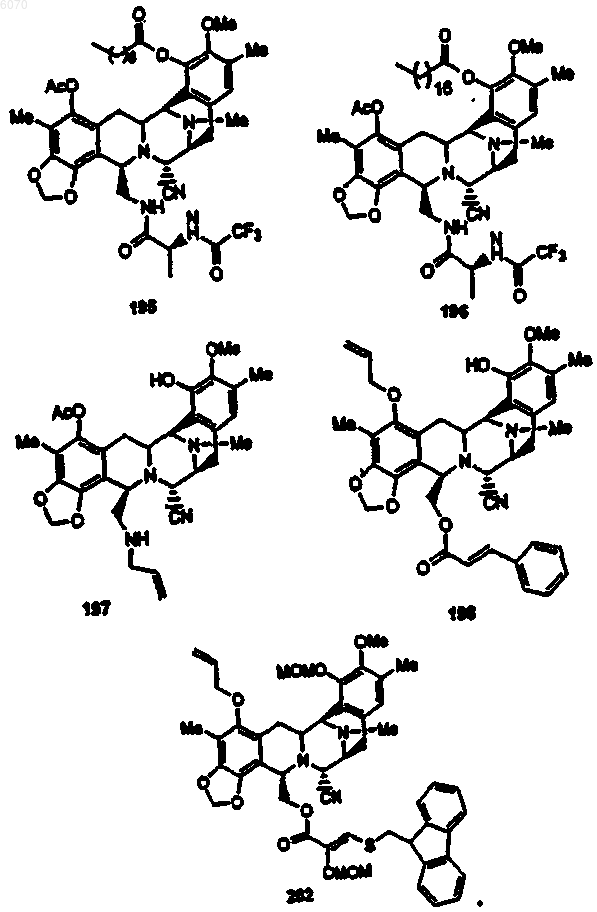
28. Соединение по п.27 формулы (50)

29. Соединение по п.27 формулы (100)
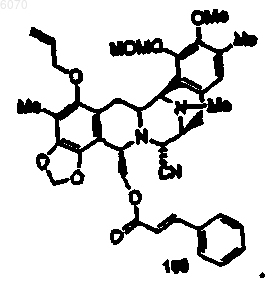
30. Соединение по п.27 формулы (102)
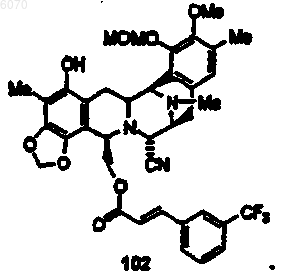
31. Соединение по п.27 формулы (104)
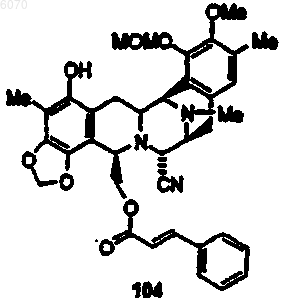
32. Соединение по п.27 формулы (108):
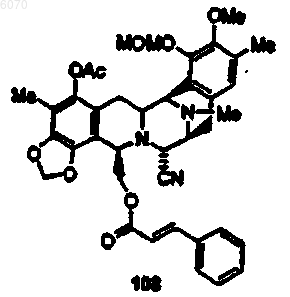
33. Соединение по п.27 формулы (112)
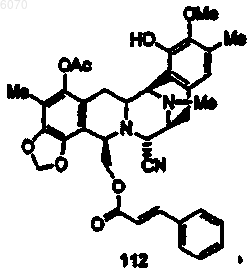
34. Соединение по п.27 формулы (198)
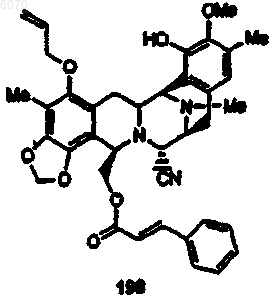
35. Соединение по п.1 формулы
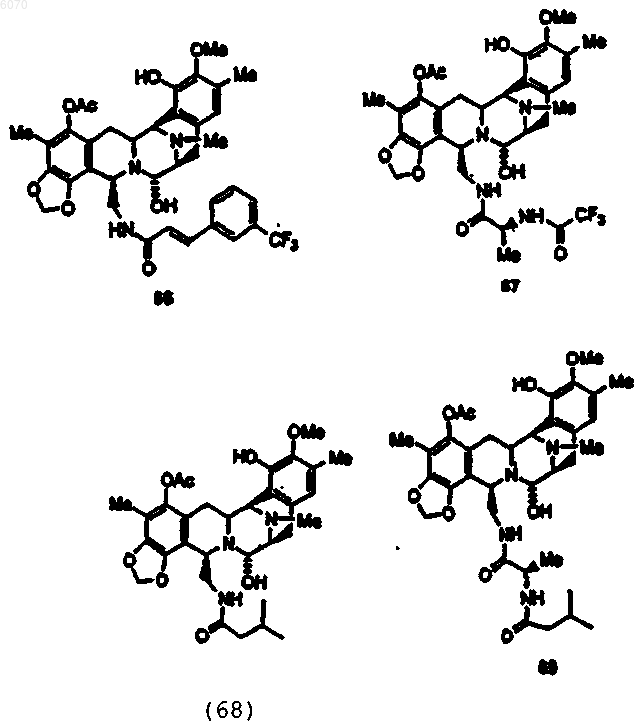
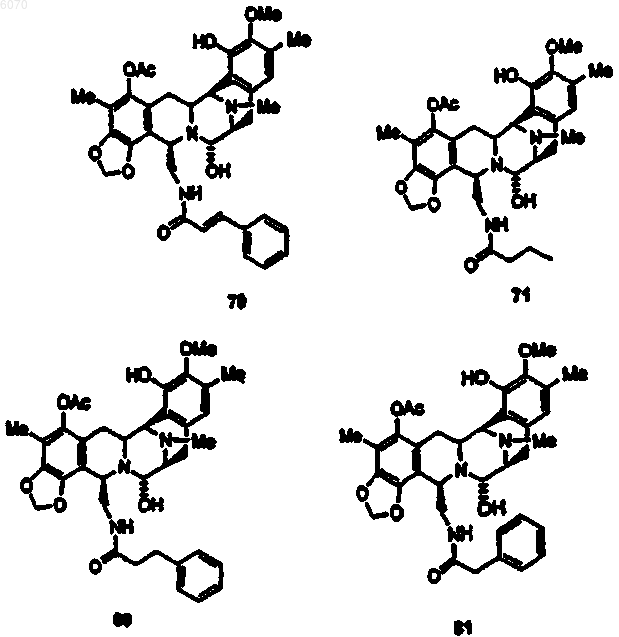
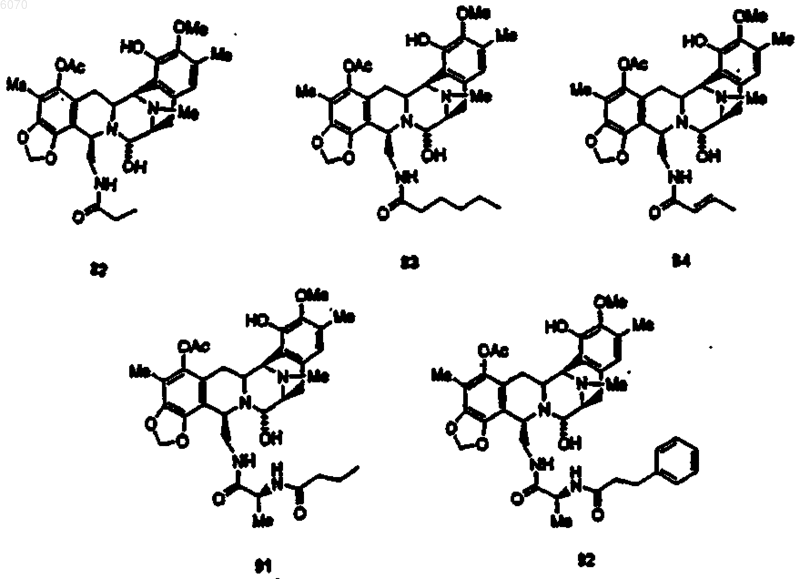
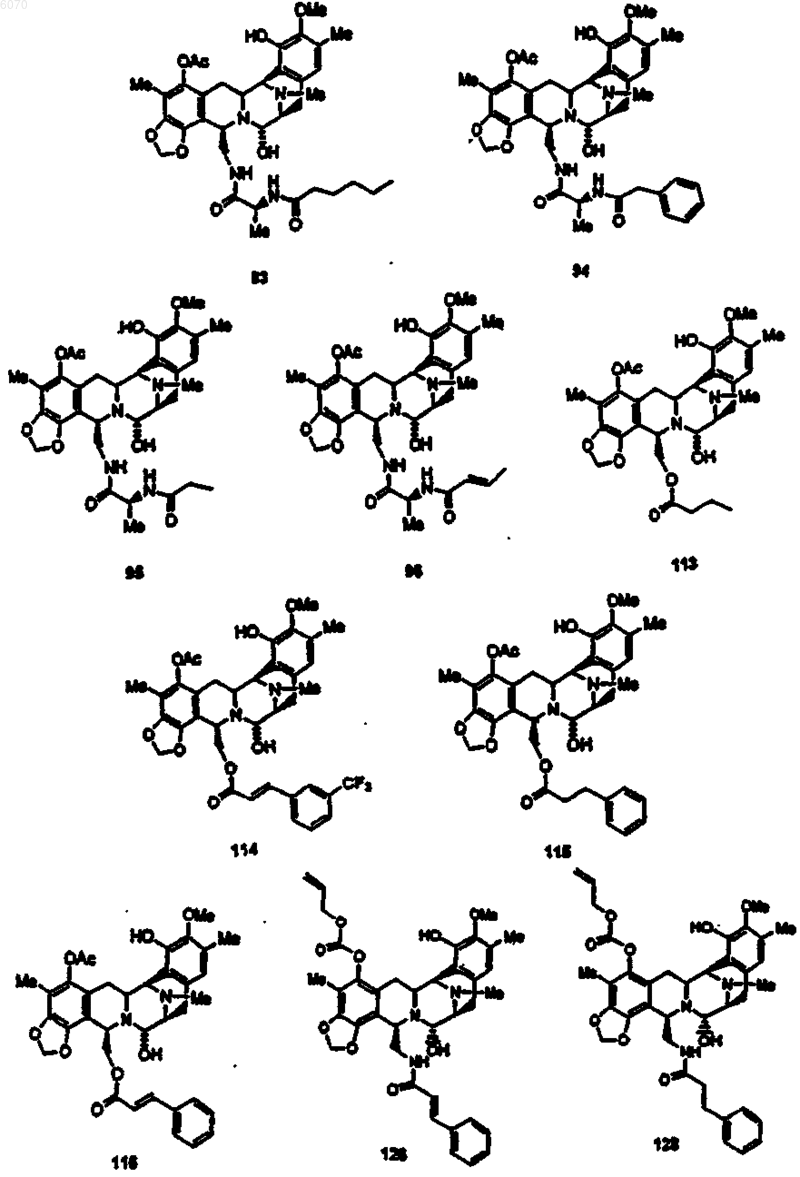
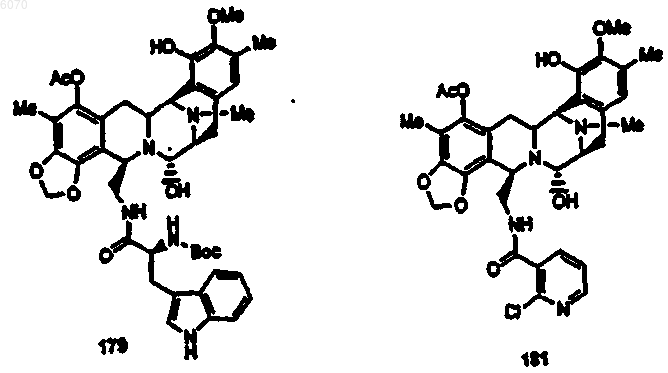
36. Соединение (66) формулы

37. Соединение (116) формулы
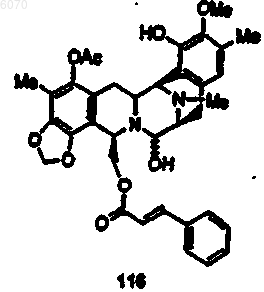
38. Фармацевтическая композиция, содержащая соединение по любому из предыдущих пунктов вместе с фармацевтически приемлемым носителем.
39. Применение соединения по любому из пп.1-37 при получении фармацевтической композиции, предназначенной для лечения опухолей.
Текст
006070 Настоящее изобретение относится к противоопухолевым соединениям, а в частности к противоопухолевым аналогам эктеинасцидина 743, ЕТ-743. Предпосылки создания изобретения Европейский патент 309477 относится к эктеинасцидинам 729, 743, 745, 759 А, 759 В и 770. Описаны соединения эктеинасцидина, обладающие антибактериальными и другими полезными свойствами. В настоящее время проводятся клинические испытания эктеинасцидина 743 как противоопухолевого агента. Эктеинасцидин 743 имеет сложную трис(тетрагидроизохинолинфенольную) структуру формулы (I): В эктеинасцидине 743 1,4-мостик имеет структуру формулы (IV): Другими известными эктеинасцидинами являются соединения с другой мостиковой циклической кольцевой системой, такой как встречается в эктеинасцидинах 722 и 736, где указанный мостик имеет структуру формулы (V) в эктеинасцидинах 583 и 597, где указанный мостик имеет структуру формулы (VI) и в эктеинасцидинах 594 и 596, где указанный мостик имеет структуру формулы (VII) Полная структура этих и родственных соединений приводится в J. Am. Chem. Soc. (1996) 118, 90179023. Эта статья вводится в настоящее описание посредством ссылки. В настоящее время, эктеинасцидины получают путем их выделения из экстрактов морских оболочников (туникатов) Ecteinascidin turbinata. Этот способ дает низкий выход, и были предприняты поиски альтернативных способов их получения. Синтетический способ получения соединений эктеинасцидина описан в патенте США 5721362, см. также WO 9812198. Заявленный способ является трудоемким и сложным. В качестве иллюстрации приводятся 38 примеров, в каждом из которых описана одна или несколько последовательных стадий синтеза с получением эктеинасцидина 743. Пункт 25 формулы изобретения патента США 5721362 относится к промежуточному фенольному соединению указанной формулы (11), которое авторы настоящей заявки также называют промежуточным соединением 11 или Int-11. Это соединение имеет следующую бис(тетрагидроизохинолинфенольную) структуру (II) где MOM представляет метоксиметильный заместитель, a TBDPS представляет третбутилдифенилсилильный заместитель. Из промежуточного соединения 11 можно синтезировать другой представляющий интерес противоопухолевый агент, фталасцидин, см Proc. Natl. Acad. Sci., USA, 96, 3496-3501, 1999. Флатасцидин представляет собой производное бис(тетрагидроизохинолинфенола) формулы (III) В более общих чертах, фталасцидин и родственные соединения описаны в WO 0018233. Пункт 1 формулы изобретения относится к соединениям формулы где каждая из замещающих групп, определенных R1, R2, R3, R4, R5, R6, R7, R8 и R9, независимо выбрана из группы, состоящей из Н, ОН, OR', SH, SR', SOR', SO2R' , NO2, NH2, NHR', N(R')2, NHC(O)R', CN, галогена, =O, C(=O)H, C(=O)R', CO2H, CO2R', С 1-С 12-алкила, С 2-С 12 алкенила, С 2-С 12 алкинила, замещенного или незамещенного арила, замещенного или незамещенного аралкила и замещенной или незамещенной гетероароматической группы; каждая из групп R' независимо выбрана из группы, состоящей из Н, ОН, NO2,NH2, SH, CN, галогена, =O, C(=O)H, С(=О)СН 3, СО 2 Н, СО 2 СН 3, С 1-С 12 алкила, С 2-С 12 алкенила, С 2-С 12 алкинила, арила, аралкила и гетероароматической группы; каждое пунктирное кольцо представляет одну,две или три необязательных двойных связи;R7 и R8, взятые вместе, могут образовывать карбоциклическую или гетероциклическую кольцевую систему; и каждый из X1 и Х 2 независимо определен как описано выше для R1-R8 и, кроме того, включает различные допустимые определения. Известны и другие природные соединения, у которых отсутствует циклическая кольцевая система с мостиками. Такими соединениями являются противоопухолевые-противомикробные бис(тетрагидроизохинолинхинон)содержащие антибиотики сафрацины и сафрамицины и природные морские продукты рениерамицины и ксестомицины, выделенные из культивированных микробов или губок. Все они имеют общий димерный тетрагидроизохинолиновый углеродный каркас. Эти соединения могут быть разделены на четыре типа, типы I-IV, в соответствии с характером окисления ароматических колец. Димерные изохинолинхиноны типа I представляют собой систему формулы (VIII), наиболее часто встречающуюся в соединениях этого класса, см. нижеследующую табл. I. Таблица I. Структура сафрамициновых антибиотиков типа I указанные значения являются взаимозаменяемыми где группа Q представляет группу формулы (IX) Ароматические кольца типа I наблюдаются в сафрамицинах А, В и С; G и Н; и S, выделенных изStreptomyces lavendulae, в виде минорных (второстепенных) компонентов. Циано-производное сафрамицина А, названное цианохинонамином, описано в Japanese Kokai JP-A2 59/225189 и 60/084288. Сафрамицины Y3, Yd1, Ad1 и Yd2 были продуцированы S.lavendulae путем прямого биосинтеза при внесении в культуральные среды соответствующих добавок. Димеры сафрамицина Y2b и Y2b-d, образованные путем связывания азота у С-25 одного звена с С-14 другого звена, также были продуцированы в культуральной среде S.lavendulae, в которую были введены добавки. Сафрамицин AR1(=AH2), продукт микробного восстановления сафрамицина А у С-25, продуцируемый Rhodococcus amidophilus, был также получен путем нестереоселективного химического восстановления сафрамицина А боргидридом натрия в виде смеси(1:1) эпимеров, с последующим хроматографическим разделением [второй изомер AH1 является менее полярным]. Другой продукт восстановления сафрамицин AR3, 21-дециано-25-дигидросафрамицина А(=25-дигидросафрамицин В) был получен посредством того же самого микробного превращения. В результате микробного превращения сафрамицина А другого типа с использованием Nocardia продуцировался сафрамицин В, а в результате последующего Mycobacterium-восстановления продуцировался сафрамицин АН 1 Ас. 25-О-ацетаты сафрамицина АН 2 и AH1 были получены также химическим способом для биологических исследований. Соединения типа I формулы (X) были также выделены из морских губок, см. табл. II. Таблица II. Структуры соединений типа I из морских губок Рениерамицины A-D, наряду с биогенетически родственными мономерными изохинолинами, рениероном и родственными соединениями, были выделены из антимикробного экстракта губок видаReniera, собранных в Мексике. Структура рениерамицина А была первоначально отнесена к обращенной стереохимии при С-3, С-11 и С-13. Однако тщательная оценка данных ЯМР для новых родственных соединений рениерамицинов Е и F, выделенных из тех же самых губок, собранных в Палау, выявила, что место конденсации колец рениерамицинов идентично месту конденсации колец сафрамицинов. Этот результат позволил сделать вывод, что первоначально определенная стереохимия рениерамицинов A-D должна быть такой же, как и у сафрамицинов. Ксестомицин был обнаружен в губках вида Xestospongia, собранных в водах, омывающих ШриЛанка. Соединения типа II формулы (XI) с восстановленным гидрохиноновым кольцом представляют собой сафрамицины D и F, выделенные из S. lavendulae, и сафрамицины Мх-1 и Мх-2, выделенные из Структура типа III была обнаружена в антибиотиках сафрацинов А и В, выделенных из Pseudomonas fluorescens. Эти антибиотики формулы (XII) состоят из тетрагидроизохинолинхиноновой субъединицы и тетрагидроизохинолинфенольной субъединицы. где R21 представляет -Н в сафрацине А и -ОН в сафрацине В. Сафрамицин R единственное соединение, классифицированное как соединение структуры типа IV,было также выделено из S.lavendulae. Это соединение формулы (XIII), состоящее из гидрохинонового кольца с боковой гликолевой сложноэфирной цепью у одного из атомов кислорода фенола, может служить пролекарством сафрамицина А из-за его умеренной токсичности. Все эти известные соединения имеют конденсированную систему из пяти колец (А)-(Е), как показано на представленной ниже структуре формулы (XIV) В эктеинасцидинах и в некоторых других соединениях кольца А и Е являются фенольными, тогда как в других соединениях, а в частности, в сафрамицинах, указанные кольца А и Е являются хинольными. В известных соединениях кольца В и D представляют собой тетрагидро, а кольцо С представляет собой пергидро. Краткое описание изобретения Настоящее изобретение относится к новым соединениям с конденсированной системой из пяти колец (А)-(Е). В частности, настоящее изобретение относится к новым соединениям, которые могут быть получены из промежуточных соединений, описанных в WО 9812198, или новым способом, который является частью данного изобретения. В этом последнем отношении, авторы ссылаются на свою работуWO 0069862, опубликованную 23 ноября 2000 г., которая относится к полусинтетическим способам, и к новым соединениям. В настоящей заявке испрашивается приоритет с даты подачи заявки РСТ, и авторы настоящей заявки включают этот текст посредством ссылки на ту часть описания изобретения, которая не присутствует в описании настоящей заявки. В WO 0069862 описаны различные способы получения соединений эктеинасцидина, включая эктеинасцидин 743, а также аналогов эктеинасцидина, включая фталисцидин. Настоящее изобретение частично основано на использовании промежуточных соединений WO 0069862 для получения других аналогов эктеинасцидинов. Предпочтительные варианты осуществления настоящего изобретения В одном из важных аспектов своего осуществления настоящее изобретение относится к соединениям формулы где R1 представляет -CH2-NHRa или -CH2-ORa, где Ra представляет алкил-СО-; галогеналкил-СО-; циклоалкилалкил-СО-; галогеналкил-О-СО-; арилалкенил-СО-; гетероарил-СО-; алкенил-СО-; алкенил или аминокислотный ацил; R5 представляет -OR", где R" представляет Н; алкил-СО-; циклоалкил-СО-; галогеналкил-СО- или защитную группу; R18 представляет -OR, где R представляет Н, алкил-СО-; циклоалкилалкил-СО-; или защитную группу; R21 представляет -CN, или R1 представляет -CH2-N(Ra)2 или-CH2-ORa, где Ra представляет Н; алкил-СО-; галогеналкил-СО-; циклоалкилалкил-СО-; галогеналкил-ОСО-; арилалкил-СО-; арилалкенил-СО-; гетероарил-СО-; алкенил-СО-; алкенил; аминокислотный ацил или защитную группу;R21 представляет -ОН. Обычно, такое соединение имеет формулу где R1, R5, R18 и R21 определены выше. В указанных предпочтительных соединениях настоящего изобретения, R1 может представлятьRa может представлять аминокислотный ацил. Аминокислотный ацил, кроме того, необязательно замещен одной или несколькими группами Ra. В еще более предпочтительных соединениях R1 представляет -CH2-NH-aa-Rb, где аа представляет аминокислоту, a Rb представляет водород; защитную группу; арилалкенил-СО-; галогеналкил-СО-; алкил-СО-; арилалкил-СО- или аминокислотный ацил. Такими соединениями являются соединения, где R1 представляет -CH2-NH-aa-Rb, где аа представляет аланин, a Rb представляет водород; ВОС; PhNHCS-,CF3CO-; PhNAcCS-; трифторциннамоил; циннамоил; C3F7CO-; бутирил, 3-хлорпропионил, гидроциннамоил, гексаноил, фенилацетил, Cbz-Val или ацетил; -CH2-aa-Rb, где аа представляет валин, a Rb представляет Cbz или Воc; -CH2-aa-Rb, где аа представляет фенилаланин, a Rb представляет Воc; -CH2-aa-Rb, где аа представляет пролин, a Rb представляет Воc; -CH2-aa-Rb, где аа представляет аргинин, a Rb представляет Воc; или -CH2-aa-Rb, где аа представляет триптофан, a Rb представляет Воc.R1 представляет предпочтительно -CH2-NRa-aa-Rb, где аа представляет аминокислоту, Ra представляет алкил-СО-, a Rb представляет галогеналкил-СО-. Такими соединениями являются соединения, где R1 представляет -CH2-NRa-aa-Rb, где аа представляет ацетилаланин, Ra представляет ацетил или бутирил, аR1 может представлять -CH2-NHRa, где Ra представляет водород, защитную группу, алкил-СО-; алкенил-СО-; арилалкенил-СО-; арилалкил-СО-; гетероарил-СО-; циклоалкилалкил-СО- или алкенил. Такими соединениями являются соединения, в которых R1 представляет -CH2-NHRa, где Ra представляет водород, Troc, ацетил, изовалероил, деканоил, циннамоил, гидроциннамоил, фенилацетил, пропионил,меристоил, стеароил, гексаноил, кротонил, хлорникотиноил, циклогексилацетил, циклогексилпропионил или аллил.R1 может представлять -CH2-ORa, где Ra представляет водород; защищенный цистеин; цистеиновое производное формулы ProtSH-S-CH2-C(NHProtNH)-CO-, где ProtSH и ProtNH представляют защитные группы для тиола и для амино; защитную группу; алкил-СО-; арилалкил-СО; арилалкенил-СО-; цистеиновое производное формулы ProtSH-S-CH2-C (=NOProtOH) -СО-, где ProtSH иProtOH представляют защитные группы для тиола и для гидрокси; или цистеиновое производное формулы ProtSH-S=CH-C (-OProtOH) -CO-, где ProtSH и ProtOH представляют защитные группы для тиола и гидрокси. Такими соединениями являются соединения, в которых R1 представляет -CH2-ORa, где Ra представляет водород; S-Fm-O-TBDMS-цистеин; цистеиновое производное формулы ProtSH-S-CH2-C(NHProtNH)-CO-, где ProtSH представляет Fm, и ProtOH представляет Troc; TBDPS; бутирил; трифторметилциннамоил; циннамоил; гидроциннамоил; цистеиновое производное формулы ProtSH-S-CH2-C(=NOProtOH)-CO-, где ProtSH представляет Fm, a ProtOH представляет метокси; или цистеиновое производное формулы ProtSH-S-CH=C(-OProtOH)-CO-, где ProtSH представляет Fm, a ProtOH представляет MOM. В указанных предпочтительных соединениях, подходящий R5 представляет -OR", где R" представляет Н; алкил-СО-, где алкил имеет нечетное число атомов углерода, -циклогексилалкил-СО- или защитную группу. В указанных предпочтительных соединениях, подходящий R18 представляет -OR, где R представляет Н; алкил-СО- или защитную группу. Особенно предпочтительными вариантами осуществления настоящего изобретения являются новые эктеинасцидин-подобные соединения, которые имеют нижеследующие общие структуры I, II и III, и которые были получены из соединений 17, 25, 43 и 45, происходящих от цианосафрацина В. Соединение 25 соответствует синтетическому промежуточному соединению 3, описанному в патенте США 6124292.-6 006070 где каждый из R', Х 2, R1 и R6 независимо выбраны из групп, определенных ниже: Предпочтительную группу соединений настоящего изобретения составляют соединения, раскрытые далее под 9, 10, 42-58, 60, 61-65, 74-79, 85-90, 97-102, 104-106, 108-110, 112, 117-119, 124, 125, 140,141, 174-178, 180-186, 188-191, 194-198 и 202. Среди них особенно предпочтительны соединения 50,100, 102, 104, 108, 112 и 198.-7 006070 Другую предпочтительную группу соединений настоящего изобретения составляют соединения,раскрытые далее под 66-71, 80-84, 91-96, 113-116, 126, 128, 179 и 181. Среди них особенно предпочтительны соединения 66 и 116. Было обнаружено, что соединения настоящего изобретения обладают исключительной активностью при лечении раковых заболеваний, таких как лейкозы, рак легких, рак толстой кишки, рак почек и меланома. Таким образом, настоящее изобретение относится к применению соединений настоящего изобретения при получении фармацевтической композиции, предназначенной для лечения опухолей, в частности для лечения любых млекопитающих, а в частности, человека, с раковым заболеванием. Настоящее изобретение также относится к фармацевтическим композициям, которые содержат в качестве активного ингредиента соединение или соединения настоящего изобретения, а также к способам их получения. Примерами фармацевтических композиций являются любые твердые (таблетки, пилюли, капсулы,гранулы и т.п.) или жидкие (растворы, суспензии или эмульсии) композиции, имеющие подходящий состав, или предназначенные для перорального, местного или парентерального введения, и эти композиции могут содержать чистое соединение или соединение в комбинации с любым носителем или с другими фармакологически активными соединениями. При парентеральном введении, эти композиции следует стерилизовать. Введение соединений или композиций настоящего изобретения может быть осуществлено любым подходящим способом, таким как внутривенное вливание, пероральное, внутрибрюшинное и внутривенное введение. При этом, предпочтительно, чтобы продолжительность вливания составляла вплоть до 24 ч, более предпочтительно 2-12 ч, а наиболее предпочтительно 2-6 ч. Непродолжительное время вливания, которое позволяет проводить лечение, не оставляя пациента в больнице на ночь, является особенно предпочтительным. Однако вливание может проводиться в течение 12-24 ч или даже больше, если это необходимо. Вливание можно проводить с интервалами примерно в 2-4 недели. Фармацевтические композиции, содержащие соединение настоящего изобретения, могут быть доставлены путем их инкапсулирования в липосомах или в наносферах, в виде препаратов замедленного высвобождения или с помощью других стандартных средств доставки. Точная доза указанных соединений может варьироваться в зависимости от конкретной композиции,способа введения и от конкретно обрабатываемого участка, пациента и опухоли. Должны также учитываться и другие факторы, такие как возраст, масса тела, пол, режим питания, время введения, скорость экскреции, состояние пациента, комбинация лекарственных средств, реакционная восприимчивость и тяжесть заболевания. Введение может быть осуществлено непрерывно или периодически в пределах максимально допустимой дозы. Соединения и композиции настоящего изобретения могут быть использованы вместе с другими лекарственными средствами для проведения комбинированной терапии. Такие другие лекарственные средства могут составлять часть той же самой композиции, либо они могут быть использованы в виде отдельной композиции для одновременного введения или для введения в разное время. Тип указанного другого лекарственного средства не имеет конкретных ограничений, и подходящими кандидатами являются:a) лекарственные средства с антимитотическим действием, а особенно лекарственные средства, которые нацелены на элементы цитоскелета, включая модуляторы микротрубочек, такие как таксановые лекарственные средства (такие как таксол, паклитаксел, таксотер, доцетаксел), подофилотоксины или алкалоиды барвинка (винкристин, винбластин);c) алкилирующие агенты, такие как азотные аналоги горчичного газа (такие как циклофосфамид или ифосфамид);d) лекарственные средства, мишенью которых являются ДНК, такие как антрациклиновые лекарственные средства, адриамицин, доксорубицин, фарморубицин или эпирубицин;e) лекарственные средства, мишенью которых являются топоизомеразы, такие как этопозид;f) гормоны и агонисты или антагонисты гормонов, такие как эстрогены, антиэстрогены (тамоксифен и родственные соединения) и андрогены, флутамид, лейпрорелин, гозерелин, ципротрон или октреотид;g) лекарственные средства, мишенью которых является передача сигнала в опухолевых клетках,включая производные антител, такие как герцептин;h) алкилирующие лекарственные средства, такие как платиновые лекарственные средства (цисплатин, карбоплатин, оксалиплатин, параплатин) или нитрозомочевины;i) лекарственные средства, потенциально влияющие на метастазы опухолей, такие как ингибиторы металлопротеиназы матрикса;j) агенты для генной терапии и антисмысловые агенты;l) другие биологически активные соединения морского происхождения, а особенно, дидемнины, такие как аплидин;p) агенты для защиты скелетных мышц, такие как L-карнитин или аминокислоты-предшественники. Настоящее изобретение также относится к соединениям настоящего изобретения, предназначенным для применения в способе лечения, и к применению этих соединений при получении композиции для лечения рака. В одном из аспектов настоящего изобретения притязания заявителей не относятся к соединениям 2,3, 5, 8-ОН-2 и 14-21, описанным в одной или нескольких патентных заявках Великобритании с приоритетом по отношению к авторской заявке РСТ, опубликованной под номером 0069862. В соответствующем аспекте настоящее изобретение относится к соединениям, которые отличаются одним или несколькими заместителями, присутствующими на С-1, С-5, С-7, С-8 или С-18 в соединениях указанных приоритетных патентных заявок Великобритании. Соединениями настоящего изобретения являются соединения, которые не имеют гидроксигруппу в положении С-18. Кроме того, соединениями настоящего изобретения являются соединения, которые не имеют дикарбоксиимидометильного заместителя, такого как фталимидометил, в положении С-1. В частности, авторами настоящего изобретения были получены активные соединения, у которых заместительX1 не является таким, как он был описан в предпоследней строке на странице 19 заявки WO 0018233. В одном из своих аспектов аналоги настоящего изобретения представляют собой соединения,обычно имеющие формулу (XVIIа)R1 представляет необязательно защищенную или дериватизированную (переведенную в свое производное) аминометиленовую группу, необязательно защищенную или дериватизированную гидроксиметиленовую группу;R14a и R14b, оба представляют -Н, либо один из них представляет -Н, а другой представляет -ОН,-ОСН 3 или -ОСН 2 СН 3, либо, R14a и R14b, взятые вместе, образуют кетогруппу; иR21 представляет -Н, -ОН или -CN; и производные, включая их ацильные производные, а особенно, гдеR5 представляет ацетилокси или другую ацилоксигруппу, имеющую вплоть до 4 атомов углерода. В настоящем изобретении ключевым классом используемых промежуточных продуктов являются фталасцидины, которые имеют общую формулу (XX): где R1 представляет амидометиленовую группу; R5 представляет небольшую боковую оксицепь; a R21 представляет цианогруппу или гидроксигруппу. Для фталасцидина, R1 представляет фталимидометиле-9 006070 новую группу; R5 представляет ацетоксигруппу; а R21 представляет цианогруппу. Другими группами дляR1 являются моно- и ди-N-замещенные амидометилены, а также другие циклические амидометилены, а другими группами для R5 являются другие С 1-С 4-ацильные группы, а также С 1-С 4-алкильные группы. В настоящем изобретении ключевой класс используемых промежуточных соединений и аналогов основного класса включает промежуточное соединение 11 и имеет общую формулу (XXI) где Prot1 и Prot2 представляют гидроксизащитные группы, предпочтительно, различные. Для самого промежуточного соединения 11, группа Prot1 представляет метоксиметильную группу, a Prot2 представляет трет-бутилдифенилсилильную группу. Исходя из вышеприведенных объяснений, очевидно, что в зависимости от кольца А, этими соединениями являются соединения формулы (XXIIа)R1 представляет -CH2NH2 или -СН 2 ОН, либо защищенный или дериватизированный вариант такой группы, a R4 представляет -Н;R5 представляет -ОН либо защищенный или дериватизированный вариант указанной группы;R14a и R14b, оба представляют -Н, либо один из них представляет -Н, а другой представляет -ОН или защищенный, или дериватизированный вариант указанной группы, -ОСН 3 или -ОСН 2 СН 3, либо, R14a иR15 представляет -Н, -ОН либо защищенный или дериватизированный вариант указанной группы; иR18 представляет -ОН либо защищенный или дериватизированный вариант указанной группы. В одном из вариантов, по крайней мере, R1, R5, R14a, R14b, R15 или R18 предпочтительно представляют защищенную или дериватизированную группу. В одном из вариантов, R1 не является трет-бутилдифенилсилильным заместителем и/или группа R18 не является метоксиметилоксигруппой.R1 предпочтительно представляет -CH2NH2 или -СН 2 ОН либо защищенный или дериватизированный вариант указанной группы, a R4 представляет -Н. Предпочтительно оба R14a и R14b представляют -Н. R12 предпочтительно представляет -СН 3. Один из предпочтительных классов промежуточных соединений включает соединение, которое было идентифицировано как соединение 25, имеющее формулу- 10006070 Предпочтительный класс соединений таким образом имеет общую формулу, где группа MOM заменена любой другой защитной группой, и/или аллил заменен любой другой защитной группой. Другими предпочтительными промежуточными соединениями являются соединения, которые были идентифицированы авторами изобретения как соединения 17, 43 и 45. Другие N-ацильные производные могут быть легко получены из соединения 45 и являются важной частью настоящего изобретения. Подходящими ацильными группами являются группы, упомянутые ранее. Также могут быть полезны соответствующие 21-гидроксисоединения и соединения из числа активных соединений, обнаруженных авторами настоящего изобретения. Исходя из данных активности и других соображений, очевидно, что активными соединениями являются соединения предпочтительного класса общей формулы (XXIII) где R1 определен выше для формулы (XVIIb) и предпочтительно представляет дериватизированную аминометиленовую группу умеренного объема;R5 определен выше для формулы (XVIIb) и предпочтительно представляет дериватизированную гидроксигруппу небольшого объема;R1 представляет соответствующую гидрофобную группу, которая не содержит свободных амино-,гидрокси- или других гидрофильных функциональных групп. Обычно R1 представляет группу -CH2-NH2CO-Ra, где Ra определен выше, но предпочтительно, имеет длину линейной цепи менее чем в 20 атомов,а более предпочтительно, менее чем в 15 или 10 атомов, где 1,4-фенил имеет, как было определено, длину цепи из четырех атомов, и это также относится к другим циклическим группам (например, 1,2 циклогексил имеет длину цепи из двух атомов), при этом, сама линейная цепь длиной менее чем 10, 15 или 20 атомов может быть замещена. В частности, полученные данные дают основание полагать, что может быть достигнут баланс между отсутствием такой группы Ra-CO- и наличием большой объемной группы. В частности, предпочтительным является R1, не содержащий циклических групп, а особенно, ароматических групп. В соответствующем варианте настоящее изобретение не включает соединения, которые были описаны в статье Proc. Natl. Acad. Sci. USA, 96, 3496-3501, 1999, вводимой в настоящее описание посредством ссылки. В соответствии с настоящим изобретением из предпочтительных групп для R1 исключены соответствующие заместители CH2R2, приведенные в табл. 1 указанной статьи, а в частности,группы А, В, С и D для R2.R5 предпочтительно представляет ацетильную группу. В особенно предпочтительных соединениях группа R1 ацилирована по группе -NH2 и, например, Nацильные производные могут быть образованы из групп -CH2NH2 и -СН 2-NH-aa. Указанными ацильными производными могут быть N-ацил или его N-тиоацильные производные. Ацильные группы могут иметь формулу -CO-Ra, где Ra определен выше и выбран так, чтобы он удовлетворял указанным критериям. Подходящими ацильными группами являются аланильная, аргинильная, аспартильная, аспарагильная,цистильная, глутамильная, глутаминильная, глицильная, гистидильная, гидроксипропильная, изолейцильная, лейцильная, лизильная, метионильная, фенилаланильная, пропильная, серильная, треонильная,тиронильная, триптофильная, тирозильная, валильная, а также другие аминокислотные ацильные группы, которые могут присутствовать в L- и D-форме. Такие аминокислотные ацильные группы предпочтительно дериватизируют по указанной аминогруппе с сообщением ей гидрофобности. В одном из вариантов настоящего изобретения группа R1 представляет дериватизированную гидроксиметиленовую группу. То же самое можно сказать в отношении дериватизированной аминометиленовой группы.- 11006070 Настоящее изобретение относится к соединениям, в которых различные заместители у кольца являются такими, как они были определены в работе WO 0018233, которая вводится в настоящее описание посредством ссылки. Таким образом, если это необходимо, то заместители в соединениях настоящего изобретения могут быть выбраны, наряду с другими возможными вариантами, из Н, ОН, OR', SH, SR',SOR', SO2R', NO2, NH2, NHR', N(R')2, NHC(O)R', CN, галогена, =O, C1-С 6 алкила, замещенного или незамещенного арила, замещенного или незамещенного аралкила и замещенной или незамещенной гетероароматической группы; где каждая из групп R' независимо выбрана из группы, состоящей из Н, ОН, NO2,NH2, SH, CN, галогена, =O, C(=O)H, С(=О)СН 3, СО 2 Н, СО 2 СН 3, С 1-С 6 алкила, фенила, бензила и гетероароматической группы. Подходящими галогеновыми заместителями в соединениях настоящего изобретения являются F, Cl,Br и I. Алкильные группы, предпочтительно, имеют от 1 до примерно 12 атомов углерода, более предпочтительно, от 1 до примерно 8 атомов углерода, еще более предпочтительно, от 1 до примерно 6 атомов углерода, а наиболее предпочтительно 1, 2, 3 или 4 атома углерода. Особенно предпочтительными алкильными группами в соединениях настоящего изобретения являются метил, этил и пропил, включая изопропил. Используемый здесь термин "алкил", если это не оговорено иначе, означает циклические и нециклические группы, при этом, циклические группы могут иметь, по крайней мере, три углеродных кольца. Предпочтительные алкенильные и алкинильные группы в соединениях настоящего изобретения имеют одну или несколько ненасыщенных связей и от 2 до примерно 12 атомов углерода, более предпочтительно, от 2 до примерно 8 атомов углерода, еще более предпочтительно, от 2 до примерно 6 атомов углерода, а наиболее предпочтительно 1, 2, 3 или 4 атома углерода. Используемые здесь термины"алкенил" и "алкинил" означают циклические и нециклические группы, хотя, в основном, более предпочтительными являются прямые или разветвленные нециклические группы. Предпочтительными алкоксигруппами в соединениях настоящего изобретения являются группы,имеющие одну или несколько кислородных связей и от 1 до примерно 12 атомов углерода, более предпочтительно, от 1 до примерно 8 атомов углерода, еще более предпочтительно, от 1 до примерно 6 атомов углерода, а наиболее предпочтительно 1, 2, 3 или 4 атома углерода. Предпочтительные алкитиогруппы в соединениях настоящего изобретения имеют одну или несколько простых тиоэфирных связей и от 1 до примерно 12 атомов углерода, более предпочтительно, от 1 до примерно 8 атомов углерода, еще более предпочтительно, от 1 до примерно 6 атомов углерода. Особенно предпочтительными являются алкилтиогруппы, имеющие 1, 2, 3 или 4 атома углерода. Предпочтительными алкилсульфинильными группами в соединениях настоящего изобретения являются группы, имеющие одну или несколько сульфоксидных (SO) групп и от 1 до примерно 12 атомов углерода, более предпочтительно, от 1 до примерно 8 атомов углерода, еще более предпочтительно, от 1 до примерно 6 атомов углерода. Особенно предпочтительными являются алкилсульфинильные группы,имеющие 1, 2, 3 или 4 атома углерода. Предпочтительными алкилсульфонильными группами в соединениях настоящего изобретения являются группы, имеющие одну или несколько сульфонильных (SO2) групп и от 1 до примерно 12 атомов углерода, более предпочтительно, от 1 до примерно 8 атомов углерода, еще более предпочтительно, от 1 до примерно 6 атомов углерода. Особенно предпочтительными являются алкилсульфонильные группы,имеющие 1, 2, 3 или 4 атома углерода. Предпочтительными аминоалкильными группами в соединениях настоящего изобретения являются группы, имеющие одну или несколько первичных, вторичных и/или третичных аминогрупп и от 1 до примерно 12 атомов углерода, более предпочтительно, от 1 до примерно 8 атомов углерода, еще более предпочтительно от 1 до примерно 6 атомов углерода, а наиболее предпочтительно 1, 2, 3 или 4 атома углерода. Вторичные и третичные аминогруппы являются, в основном, более предпочтительными, чем первичные аминогруппы. Подходящие гетероароматические группы в соединениях настоящего изобретения содержат один,два или три гетероатома, выбранные из атомов N, О или S, и такими группами являются, например, кумаринил, включая 8-кумаринил; хинолинил, включая 8-хинолинил; пиридил; пиразинил; пиримидил; фурил; пирролил; тиенил; тиазолил; оксазолил; имидазолил; индолил; бензофуранил и бензотиазол. Подходящие гетероалициклические группы в соединениях настоящего изобретения содержат один, два или три гетероатома, выбранные из атомов N, О или S, и такими группами являются, например, тетрагидрофуранильная, тетрагидропиранильная, пиперидинильная, морфолино и пирролидинильная группы. Подходящими карбоциклическими арильными группами в соединениях настоящего изобретения являются соединения с одним или несколькими кольцами, включая соединения с несколькими кольцами,содержащие отдельные и/или конденсированные арильные группы. Типичные карбоциклические арильные группы содержат 1-3 отдельных или конденсированных колец и от 6 до примерно 18 атомов углерода в кольце. Особенно предпочтительными карбоциклическими арильными группами являются фенил,включая замещенный фенил, такой как 2-замещенный фенил, 3-замещенный фенил, 2,3-замещенный фенил, 2,5-замещенный фенил, 2,3,5-замещенный фенил и 2,4,5-замещенный фенил, где один или несколь- 12006070 ко заместителей фенила представляют собой электроноакцепторную группу, такую как галоген, циано,нитро, алканоил, сульфинил, сульфонил и т.п.; нафтил, включая 1-нафтил и 2-нафтил; бифенил; фенантрил и антрацил. Любые указанные здесь замещенные группы, присутствующие в соединениях настоящего изобретения, означают конкретные части, которые могут быть замещены в одном или нескольких доступных положениях одной или несколькими подходящими группами, например, галогеном, таким как фтор,хлор, бром и иод; циано; гидроксилом; нитро; азидо; алканоилом, таким как C1-6 алканоильная группа,такая как ацил и т.п.; карбоксамидо; алкильными группами, включающими указанные группы, имеющие от 1 до примерно 12 атомов углерода или от 1 до примерно 6 атомов углерода, а более предпочтительно,1-3 атомов углерода; алкенильными и алкинильными группами, включая группы, имеющие одну или несколько ненасыщенных связей и от 2 до примерно 12 атомов углерода или от 2 до примерно 6 атомов углерода; алкоксигруппами, имеющими одну или несколько кислородных связей и от 1 до примерно 12 атомов углерода или от 1 до примерно 6 атомов углерода; арилокси, таким как фенокси; алкилтиогруппами, включая группы, имеющие одну или несколько тиоэфирных связей и от 1 до примерно 12 атомов углерода или от 1 до примерно 6 атомов углерода; алкилсульфинильными группами, включая группы,имеющие одну или несколько сульфинильных связей и от 1 до примерно 12 атомов углерода или от 1 до примерно 6 атомов углерода; алкилсульфинильными группами, включая группы, имеющие одну или несколько сульфонильных связей и от 1 до примерно 12 атомов углерода или от 1 до примерно 6 атомов углерода; аминоалкильными группами, такими как группы, имеющей один или несколько атомов N и от 1 до примерно 12 атомов углерода или от 1 до примерно 6 атомов углерода; карбоциклическим арилом,имеющим 6 или более атомов углерода, а в частности, фенилом (например, R, являющийся замещенной или незамещенной бифенильной группой); и аралкилом, таким как бензил. Не претендуя на исчерпывающее определение, относящееся к формуле можно сказать, что предпочтительные соединения настоящего изобретения имеют одно или несколько из нижеследующих определений:R1 означает -OR, где R представляет Н, ацил, в частности, ацетил, алкил-СО- (алкил, имеющий примерно до 20 атомов углерода, более предпочтительно, от 1 до примерно 12 атомов углерода, а особенно предпочтительно, нечетное число атомов углерода, например, 3, 5, 7 и 9), циклоалкилалкил-СО-, а в частности, алкильные группы с концевой цилогексильной группой, имеющие вплоть до шести дополнительных атомов углерода в боковой цепи, или защитную группу, в частности, метоксиметил, а более предпочтительно, R1 представляет ОН.R2 представляет метокси; R3 представляет метил; R4 представляет водород; R5 представляет метил или водород, а предпочтительно, метил; R6 представляет -CN или -ОН.X1 представляет -NHR', -NH-aa-R' или -OR', где аа представляет необязательно защищенную аминокислотную ацильную группу, а в частности, аланин, фенилаланин, цистеин, пролин, валин, аргинин,триптофан или другую аминокислоту. В других вариантах X1 может представлять -N(R')2, -N(R')-aa-R' и-N-(aa-R')2. В случае любой группы -aa-R', R' присутствует обычно на аминогруппе аминокислоты, и может присутствовать два таких заместителя; R' предпочтительно представляет Н; алкил-СО-(алкил,имеющий до 25 атомов углерода, например, до 17, 19 или 21 атомов углерода, а предпочтительно нечетное число атомов углерода, соответствующее жирной карбоновой кислоте с четным числом атомов углерода, или даже небольшое число атомов углерода, такое как 1-6), а в частности, СН 3- (СН 2)n-СО-, где n равно, например, 1, 2, 4, 12 или 16; алкенил, а в частности, аллил; галогеналкил-СО-, а в частности, CF3CO-; циклоалкилалкил-СО-, а предпочтительно, алкильные группы с концевой циклогексильной группой, имеющие вплоть до шести дополнительных атомов углерода в боковой цепи, а в частности, циклогексил-(СН 2)n-СО-, где n равен, например, 1 или 2; галогеналкил-O-СО-, а в частности, трихлорэтоксикарбонил; арилалкил-СО- или арилалкенил-СО-, а в частности, фенилметил/этил/винил-СО-, где арил может быть замещен как в трифторметилциннамоиле; необязательно замещенный гетероарил-СО-, где заместители и гетероциклическая группа являются такими, как они были определены в другом месте,например, как в 2-хлороникотиноиле; алкенил-СО-, а в частности, кротонил; необязательно замещенный аминоалкил-СО-, а в частности, аминокислотный ацил, а в частности, аланин, фенилаланин, цистеин,пролин, валин, аргинин, триптофан или другая аминокислота или их производные, как Вос-фенилаланин,-валин, -пролин, -аргинин или -триптофан, или как фенетилаланин, трифторэтилацетилаланин, трифтордиацетилаланин и их изомеры, или диацетил- или дипропионилтрифторацетил, или как Cbz-Val-или- 13006070 группа, фактически происходящая от цистеина и имеющая общую формулу ProtSH-S-CH2-C(=NOProtOH)CO- или ProtSH-S-CH=C(-OProtOH)-CO-, где ProtSH и ProtOH представляют защитные группы для тиола и для гидрокси, а в частности, гдеProtSH представляет Fm, a ProtOH представляет метокси для первой формулы или MOM для второй формулы; или другие возможные варианты, такие как защитная группа, как алкоксикарбонил, такая как Воc или PhNR'CS. Различные группы могут быть замещены как указано в настоящем описании.R7 и R8 представляют -О-СН 2-О-, либо R7 представляет =O, a R8 представляет ОМе, а в частности,R7 и R8 представляют -О-СН 2-О-. R9 представляет метил. Х 2 представляет -OR", где R" предпочтительно представляет Н; алкил-СО-, а в частности, ацетил; алкенил, а в частности, аллил; алкенил-O-СО-, а в частности, аллил-O-СО-; галогеналкил-СО-, а в частности, трифторметилкарбонил или хлорметилкарбонил или 2-хлорэтилкарбонил или перфторпропилкарбонил. Особый интерес представляют соединения, гдеR6 представляет -CN или -ОН; X1 представляет -NHR', где R' предпочтительно представляет алкенил, а в частности, аллил, алкил-СО- (алкил, имеющий 1-6 атомов углерода, а в частности, СН 3- (СН 2)n-СO-, где n равен, например, 1-6, а более предпочтительно, 1-4); циклоалкилалкил-СО-, а в частности, циклогексил(СН 2)n-СО, где n равен 1 или 2; арилалкил-СО- или арилалкенил-СО-, а в частности, фенэтилкарбонил,фенилвинилкарбонил или бензилкарбонил, алкенил-СО-, а в частности, СН 3-СН=СН-СО-; аминокислотный ацил, а в частности, Cbz-Val-; необязательно замещенный гетероарил-СО-, а в частности, 2 хлорпиридинилкарбонил; или X1 представляет -NH-aa-R', где аа представляет аланин, фенилаланин, триптофан или валин; R' представляет аминозаместитель и арилалкил-СО-, а в частности, фенэтилкарбонил или бензилкарбонил; алкил-СО- (алкил, имеющий 1-6 атомов углерода, а в частности, СН 3-(СН 2)n-СO-, где n равен, например,1-6, а более предпочтительно, 1, 2 или 4); алкенил-СО-, а в частности, СН 3-СН=СН-СО-; или защитную группу, а в частности, алкилокси-СО, как в Воc; или X1 представляет -OR', где R' предпочтительно представляет алкил-СО- (алкил, имеющий 1-6 атомов углерода, а в частности, СН 3-(СН 2)n-СО-, где n равен,например, 1-6, а более предпочтительно, 2); арилалкил-СО- или арилалкенил-СО-, а в частности, фенэтилкарбонил, фенилвинилкарбонил или трифторметилциннамоил;R7 и R8 представляют -О-СН 2-О-; R9 представляет метил; Х 2 представляет -OR", где R" представляет Н; ацетил, аллилоксикарбонил, хлорметилкарбонил или перфторпропилкарбонил; а более предпочтительно, R" представляет Н, ацетил или аллилоксикарбонил. В формулах (XVIIa) или (XVIIb), R1 обычно представляет аминометилен, амидометилен или R1 вместе с R4 образуют группу (IV) или (V). Подходящими амидометиленовыми группами являются группы формулы -СН 2-NH-CO-CHCH3-NH2, происходящие от аланина, и аналогичные группы, происходящие от других аминокислот, а особенно, от D- и L-глицина, валина, лейцина, изолейцина, фенилаланина, тирозина, триптофана, метионина, цистеина, аспартата, аспарагина, глутаминовой кислоты, глутамина, лизина, аргинина, пролина, серина, треонина, гистидина и гидроксипролина. Общей формулой для группыR1 является -CH2-NH-aa, где аа означает ацильную аминокислотную группу. Группа R1 может быть ацилирована по группе -NН 2-, и например, N-ацильные производные могут быть образованы из групп -CH2NH2 и -СН 2-NH-aa. Ацильные производные могут представлять собой Nацил или его N-тиоацильные производные, а также циклические амиды. Ацильными группами могут быть алканоильная, галогеналканоильная, арилалканоильная, алкеноильная, гетероциклилацильная, ароильная, арилароильная, галогенароильная, нитроароильная или другие ацильные группы. Ацильные группы могут иметь формулу -CO-Ra, где Ra может представлять различные группы, такие как алкил,алкокси, алкилен, арилалкил, арилалкилен, аминокислотный ацил или гетероциклил, каждый из которых может быть, но необязательно, замещен галогеном, циано, нитро, карбоксиалкилом, алкокси, арилом,арилокси, гетероциклилом, гетероциклилокси, алкилом, амино или замещенным амино. Другими ацилирующими агентами являются изотиоцианаты, такие как арилизотиоцианаты, а в частности, фенилизоцианат. Алкильные, алкокси или алкиленовые группы Ra обычно имеют 1-6 или 12 атомов углерода и могут быть линейными, разветвленными или циклическими. Арильными группами обычно являются фенил, бифенил или нафтил. Гетероциклические группы могут быть ароматическими, либо частично или полностью ненасыщенными, и обычно имеют 4-8 атомов в кольце, более предпочтительно, 5 или 6 томов в кольце, и один или несколько гетероатомов, выбранных из азота, серы и кислорода. Не претендуя на исчерпывающее определение, можно указать, что типичными группами Ra являются алкил, галогеналкил, алкоксиалкил, галогеналкоксиалкил, арилалкилен, галогеналкил-арилалкилен,ацил, галогенацил, арилалкил, алкенил и аминокислота. Так, например, Ra-CO- может представлять ацетил, трифторацетил, 2,2,2-трихлорэтоксикарбонил, изовалерилкарбонил, транс-3-(трифторметил)циннамоилкарбонил, гептафторбутирилкарбонил, деканоилкарбонил, транс-циннамоилкарбонил, бутирилкарбонил, 3-хлорпропионилкарбонил, циннамоилкарбонил, 4-метилциннамоилкарбонил, гидроциннамоил- 14006070 карбонил или транс-гексеноилкарбонил, или аланил, аргинил, аспартил, аспарагил, цистил, глутамил,глутаминил, глицил, гистидил, гидроксипропил, изолейцил, лейцил, лизил, метионил, фенилаланил, пролил, серил, треонил, тиронил, триптофил, тирозил, валил, а также другие менее известные аминокислотные ацильные группы, а также фталимидо и другие циклические амиды. Другие примеры можно найти среди вышеперечисленных защитных групп. Соединения, где -CO-Ra происходит от аминокислоты и включает аминогруппу, могут сами образовывать ацильные производные. Подходящими N-ацильными соединениями являются дипептиды, которые, в свою очередь, могут образовывать N-ацильные производные. В одном из вариантов осуществления изобретения, который относится к промежуточным продуктам, кольцо А модифицировано так, что оно включено в субструктуру, представленную формулами (XX) или (XXI), обсуждаемую ниже. В другом варианте осуществления изобретения, который относится к промежуточным соединениям, группа R1 может представлять -CH2O-CO-CFu-CH2-S-Prot3, происходящую из соединения формулыR14a и R14b предпочтительно, представляют водород. R15 предпочтительно представляет водород. Подходящими О-ацильными производными являются алифатические О-ацильные производные, а в частности, ацильные производные с 1-4 атомами углерода, а обычно О-ацетильная группа, например, в 5 положении. Подходящими защитными группами для фенолов и гидроксигрупп являются простые и сложные эфиры, такие как алкил, алкоксиалкил, арилоксиалкил, алкоксиалкоксиалкил, алкилсилилалкоксиалкил,алкилтиоалкил, арилтиоалкил, азидоалкил, цианоалкил, хлоралкил, гетероциклил, арилацил, галогенарилацил, циклоалкилалкил, алкенил, циклоалкил, алкиларилалкил, алкоксиарилалкил, нитроарилалкил,галогенарилалкил, алкиламинокарбониларилалкил, алкилсульфиниларилалкил, алкилсилил и другие простые эфиры, и арилацил, арилалкилкарбонат, алифатический карбонат, алкилсульфиниларилалкилкарбонат, алкилкарбонат, арилгалогеналкилкарбонат, арилалкенилкарбонат, арилкарбамат, алкилфосфинил, алкилфосфинотиоил, арилфосфинотиоил, арилалкилсульфонат и другие сложные эфиры. Такие группы могут быть, но необязательно, замещены группами, упомянутыми ранее в определении R1. Подходящими защитными группами для аминов являются карбаматы, амиды или другие защитные группы, такие как алкил, арилалкил, сульфо- или галогенарилалкил, галогеналкил, алкилсилилалкил,арилалкил, циклоалкилалкил, алкиларилалкил, гетероциклилалкил, нитроарилалкил, ациламиноалкил,нитроарилдитиоарилалкил, дициклоалкилкарбоксамидоалкил, циклоалкил, алкенил, арилалкенил, нитроарилалкенил, гетероциклилалкенил, гетероциклил, гидроксигетероциклил, алкилдитио, алкокси- или галоген- или алкилсульфиниларилалкил, гетероциклилацил и другие карбаматы, и алканоил, галогеналканоил, арилалканоил, алкеноил, гетероциклилацил, ароил, арилароил, галогенароил, нитроароил и другие амиды, а также алкил, алкенил, алкилсилилалкоксиалкил, алкоксиалкил, цианоалкил, гетероциклил, алкоксиарилалкил, циклоалкил, нитроарил, арилалкил, алкокси- или гидроксиарилалкил и многие другие группы. Такие группы могут быть, но необязательно, замещены группами, упомянутыми ранее в определении R1. Примеры указанных защитных групп представлены в нижеследующих таблицах. Примеры предпочтительных способов настоящего изобретения рассматриваются, главным образом,со ссылками на исходные соединения 45, 43 и 25. Следует отметить, что конкретные заместители, например, в положениях С-5 и С-18, могут варьироваться согласно описанию настоящего изобретения. Предпочтительные способы получения соединений формул I, II и III описаны ниже в соответствии с нижеследующими реакционными схемами, где указаны примеры типичных замещающих групп. Схема 1 Как показано на схеме 1, первая стадия получения предпочтительных соединений (I) (где R1=OH,X2=OAc и R6=CN или ОН) настоящего изобретения из соединения 45 представляет собой превращение аминогруппы в амидную группу с высоким выходом. После ацилирования аминогруппы проводят вторую стадию, которая представляет собой превращение группы CN в группу ОН посредством взаимодействия с нитратом серебра в AcCN/H2O. Получение других соединений общей формулы I настоящего изобретения из соединения 17 описано ниже (схема 4). Схема 2 Как показано на схеме 2, другая группа представляющих интерес производных формулы II (гдеR1=OH, X2=OAc и R6=CN или ОН) может быть получена из соединения 43 в соответствии с нижеследующей последовательностью реакций. После ацилирования аминогруппы получают соответствующий амид и группу CN в AcCN/H2O превращают в группу ОН посредством взаимодействия с нитратом серебра. Получение других соединений общей формулы II настоящего изобретения из соединения 17 описано ниже (схема 4). Схема 3- 18006070 Предпочтительная процедура получения соединений формулы III предусматривает превращение соединения 25 в соответствующие сложноэфирные производные путем ацилирования группы ОН, снятия защиты с фенольной группы, затем ацилирования и снятия защиты с группы MOM с получением соответствующего сложного эфира, и с последующим превращением группы CN в AcCN/H2O в группу ОН посредством взаимодействия с нитратом серебра и получением соединения формулы III (где R1=OH,X2=OAc и R6=CN или ОН) . Другие соединения общих формул I и II настоящего изобретения могут быть получены из соединения 17 через аминовое промежуточное соединение 120, как описано на схеме 4. Схема 4 Нижеследующие дополнительные соединения настоящего изобретения (включая, например, 140 и 141) были получены из цианосафрацина В (2), как подробно описано в примерах (схема 5). Схема 5 Как очевидно для каждого специалиста, описанные здесь реакционные схемы могут быть модифицированы и/или скомбинированы различным образом, а поэтому полученные соединения должны рассматриваться как часть настоящего изобретения. В частности, исходное вещество и/или реагенты и реакции могут варьироваться в соответствии с другими комбинациями замещающих групп в формулах I, II иIII. В соответствующем аспекте своего осуществления настоящее изобретение относится к применению известного соединения сафрацина В, также называемого хинонамином, в полусинтетическом способе. В более общем смысле настоящее изобретение относится к полусинтетическому способу получения промежуточных соединений, производных и родственных структур эктеинасцидина или других тетрагидроизохинолинфенольных соединений из природных бис(тетрагидроизохинолин)алкалоидов. Подходящими исходными веществами для полусинтетического способа являются антибиотики класса сафрамицинов и сафрацинов, получаемые из различных культуральных бульонов, и соединения класса рейнерамицинов и ксестомицинов, получаемые из морских губок. Общая формула (XV) для исходных соединений представляет собой: где R1 представляет амидометиленовую группу, такую как -CH2-NH-CO-CR25aR25bR25c, где R25a и R25b образуют кетогруппу, либо один из них представляет -ОН, -NH2 или -ОСОСН 3, а другой представляетR5 и R8 независимо выбраны из -Н, -ОН или -OСOСН 2OН, либо, оба R5 и R8 представляют кето, а кольцо А представляет п-бензохиноновое кольцо;R14a и R14b оба представляют -Н, либо один из них представляет -Н, а другой представляет -ОН,-ОСН 3 или -ОСН 2 СН 3, либо R14a иR15 и R18 независимо выбраны из -Н или -ОН, либо R5 и R8 оба представляют кето, а кольцо А представляет п-бензохиноновое кольцо; иR21 представляет -ОН или -CN. Более общая формула для соединений этого класса представлена ниже: где каждая из замещающих групп, определенная R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, независимо выбрана из группы, состоящей из Н, ОН, ОСН 3, CN, =O, СН 3; где X представляет другие амидные или сложноэфирные функциональные группы, содержащиеся в вышеупомянутых природных продуктах; и где каждое пунктирное кольцо представляет одну, две или три необязательных двойных связи. Таким образом, авторами настоящего изобретения были разработаны полусинтетические способы получения промежуточных соединений, включая промежуточное соединение 11, и способы получения эктеинасцидиновых соединений, а также фталасцидиновых и других соединений. Каждый из полусинтетических способов настоящего изобретения предусматривает проведение ряда стадий превращений с получением нужного продукта. Каждая стадия, сама по себе, представляет собой процесс, осуществляемый в соответствии с настоящим изобретением. Настоящее изобретение не ограничивается указанными примерами, и при необходимости, могут быть использованы альтернативные пути, предусматривающие,например, изменение порядка проведения стадий превращений. В частности, настоящее изобретение предусматривает получение исходного 21-цианосоединения общей формулы (XVI) где R1, R5, R8, R14a, R14b, R15 и R18 определены выше. Исходными веществами могут быть также другие соединения формулы (XVI) с различными заместителями в 21-положении. В общих чертах, кандидатом является любое производное, которое может быть получено нуклеофильным замещением 21-гидроксигруппы в соединениях формулы (XV), где R21 представляет гидроксигруппу. Примерами подходящих 21-заместителей являются, но не ограничиваются ими: меркаптогруппа; алкитиогруппа (алкильная группа имеет от 6 до 10 атомов углерода); арилтиогруппа (арильная группа имеет от 1 до 6 атомов углерода и является незамещенной или замещенной 1-5 заместителями, выбранными, например, из алкильной группы, имеющей 1-6 атомов углерода; алкоксигрупп, имеющих 1-6 атомов углерода; атомов галогена; меркаптогрупп и нитрогрупп); аминогруппа; моно- или диалкиламиногруппы (каждая из алкильных групп имеет от 1 до 6 атомов углерода);- 20006070 моно- или диариламиногруппы (каждая из арильных групп является такой, как она была определена выше для арилтиогрупп); -карбонилалкильная группа формулы -C(Ra) (Rb)-С (=O) Rc, где Ra и Rb выбраны из атомов водорода, алкильных групп, имеющих от 1 до 20 атомов углерода, арильных групп (как определены выше для арилтиогрупп) и аралкильных групп (в которых алкильная группа, имеющая от 1 до 4 атомов углерода, замещена арильной группой, определенной выше для арилтиогрупп), при условии,что один из Ra и Rb представляет атом водорода; Rc выбран из атомов водорода, алкильной группы,имеющей от 1 до 20 атомов углерода, арильных групп (как определены выше для арилтиогрупп) и аралкильных групп (в которых алкильная группа, имеющая от 1 до 4 атомов углерода, замещена арильной группой, определенной выше для арилтиогрупп); алкоксигрупп, имеющих от 1 до 6 атомов углерода,аминогрупп или моно- или диалкиламиногрупп, определенных выше. Таким образом, в своем более общем аспекте, настоящее изобретение относится к способам, где первую стадию проводят для образования 21-производного с использованием нуклеофильного реагента. Авторы настоящей заявки назвали такие соединения 21-Nuc-соединениями. Для некоторых конечных продуктов, а в частности, эктеинасцидина 770 и фталасцидина необходимо присутствие 21-цианогруппы, тогда как в других конечных продуктах она действует как защитная группа, которая может быть легко превращена в другой заместитель, такой как 21-гидроксигруппа эктеинасцидина 743 или 21-гидроксифталасцидина. Выбор 21-цианосоединения в качестве исходного вещества позволяет эффективно стабилизировать данную молекулу в процессе последующих стадий синтеза, после чего она может быть, но необязательно, удалена. Эти и другие преимущества можно достигнуть с использованием других 21-Nuc-соединений. В одном из важных аспектов своего осуществления настоящее изобретение относится к применению 21-цианосоединения общей формулы (XVI) для получения бис- или трис-тетрагидроизохинолинфенольных соединений. Продуктами, которые могут быть получены таким образом, являются промежуточные соединения, такие как промежуточное соединение 11 и эктеинасцидины и фталасцидин,а также новые и известные соединения с родственной структурой. Предпочтительными исходными веществами являются соединения формулы (XV) или (XVI), гдеR14a и R14b оба представляют водород. Предпочтительными исходными веществами являются соединения формулы (XV) или (XVI), где R15 представляет водород. Кроме того, предпочтительными исходными веществами являются соединения формулы (XV) или (XVI), где кольцо Е представляет фенольное кольцо. Предпочтительными исходными веществами также являются соединения формулы (XV) или (XVI),где, по крайней мере, один, а лучше два или три из R5, R8, R15 и R18 не являются водородом. Примерами подходящих исходных веществ настоящего изобретения являются сафрамицин А, сафрамицин В, сафрамицин С, сафрамицин G, сафрамицин Н, сафрамицин S, сафрамицин Y3, сафрамицинYd1, сафрамицин Ad1, сафрамицин Yd2, сафрамицин АН 2, сафрамицин АН 2 Ас, сафрамицин AH1, сафрамицин AH1Ac, сафрамицин AR3, рениерамицин А, рениерамицин В, рениерамицин С, рениерамицин D,рениерамицин Е, рениерамицин F, ксестомицин, сафрамицин D, сафрамицин F, сафрамицин Мх-1, сафрамицин Мх-2, сафрацин А, сафрацин В и сафрамицин R. Предпочтительные исходные вещества имеют цианогруппу в положении 21, для группы R21. В особенно предпочтительном аспекте своего осуществления, настоящее изобретение относится к полусинтетическому способу, где стадии превращения применяют по отношению к сафрацину В Сафрацин В Сафрацин В представляет собой кольцевую систему, близкородственную эктеинасцидинам. Это соединение имеет ту же самую пентациклическую структуру и тот же тип замещения в правом ароматическом кольце, кольце Е. Кроме того, сафрацин В имеет очень большое сходство с некоторыми синтетическими промежуточными соединениями в общем синтезе ЕТ-743, а в частности, с промежуточным соединением 11. Такое промежуточное соединение может быть превращено в Et-743 с использованием хорошо известного способа. Поэтому синтетическое превращение сафрацина В в промежуточное соединение 11 предлагает полусинтетический способ получения ЕТ-743. Таким образом, из указанного соединения сафрапцина В, авторы настоящего изобретения получили промежуточное соединение 11, а из этого промежуточного соединения 11, они получили конкретные соединения, а в частности, эктеинасцидины. Кроме того, авторами настоящего изобретения был получен фталасцидин из сафрацина В. Настоящее изобретение также относится к применению сафрацина В для- 21006070 получения промежуточного соединения 11, соединений фталасцидина, эктеинасцидина и других промежуточных соединений настоящего изобретения. Настоящее изобретение также относится к описанным здесь соединениям, полученным от других предлагаемых исходных веществ, и к их применению для получения указанных соединений. Более предпочтительные исходные вещества настоящего изобретения имеют 21-цианогруппу. Наиболее предпочтительным соединением настоящего изобретения является соединение формулы 2. Это соединение было получено непосредственно из сафрацина В и рассматривается как ключевое промежуточное соединение в полусинтетическом способе. Соединение 2 В соответствующем аспекте настоящего изобретения авторами был получен цианосафрацин В путем ферментации штамма Pseudomonas fluorescens, продуцирующего сафрацин В, и обработки культивированного бульона с использованием ионов цианида. Предпочтительным штаммом Pseudomonas fluorescens является штамм А 2-2, FERM ВР-14, который использовали в процедуре, описанной в ЕР 055299. Подходящим источником ионов цианида является цианид калия. В типичной процедуре обработки, указанный бульон фильтруют и добавляют избыток ионов цианида. После перемешивания в течение соответствующего периода времени, такого как 1 ч, рН делают щелочным, то есть рН 9,5, а после экстракции органическим растворителем получают неочищенный экстракт, который может быть затем очищен с получением цианосафрацина В. Сафрацин В имеет аланильную боковую цепь. В одном из аспектов настоящего изобретения, авторами было обнаружено, что защита свободной аминогруппы группой ВоС может давать значительные преимущества. В общих чертах, превращение исходного 21-цианосоединения в аналог эктеинасцидина настоящего изобретения может быть осуществлено в соответствии с одновременно рассматриваемой заявкой РСТ,регистрационный номер патентного поверенного wpp83894, в которой также испрашивается приоритет от даты подачи заявки РСТ, опубликованной как WO 00698 62 23 ноября 2000 г., и которая относится к полусинтетическим способам и к новым соединениям. Текст указанной одновременно рассматриваемой заявки, регистрационный номер патентного поверенного wpp83894, вводится в настоящее описание посредством ссылки на ту часть описания изобретения, которая не присутствует в описании настоящей заявки. Обычно полусинтез аналога настоящего изобретения предусматривает:a) превращение, если это необходимо, хиноновой системы для кольца Е в фенольную систему;b) превращение, если это необходимо, хиноновой системы для кольца А в фенольную систему;c) превращение фенольной системы для кольца А в метилендиоксифенольное кольцо; иd) дериватизацию, такую как ацилирование, если это необходимо. Стадия (а), превращение, если это необходимо, хиноновой системы для кольца Е в фенольную систему, может быть осуществлена стандартными методами восстановления. Подходящей системой реагентов является водород с катализатором "палладий на углероде", хотя могут быть использованы и другие системы восстановления. Стадия (b), превращение, если это необходимо, хиноновой системы для кольца А в фенольную систему, аналогична стадии (а) и не нуждается в более подробном описании. Стадия (с), превращение фенольной системы для кольца А в метилендиоксифенольное кольцо, может быть осуществлено несколькими способами, возможно, вместе со стадией (b). Так, например, хиноновое кольцо А может быть деметилировано по метокси-заместителю в 7-положении, восстановлено до дигидрохинона, и акцептировано подходящим электрофильным реагентом, таким как CH2Br2, BrCH2Cl или аналогичным двухвалентным реагентом с получением непосредственно метилендиоксициклической системы, или двухвалентным реагентом, таким как тиокарбонилдиимидазол, с получением замещенной метилендиоксициклической системы, которая может быть превращена в нужное кольцо. Дериватизация на стадии (d) может включать ацилирование, например, группой Ra-CO-, а также превращение группы 12-NCH3 в группу 12-NH или 12-NCH2CH3. Указанное превращение может быть осуществлено до или после проведения других стадий с использованием подходящих способов.- 22006070 В качестве примера можно отметить, что для получения новых аналогов целесообразно превращать цианосафрацин В более коротким и более прямым путем. Цианосафрацин В может быть превращен в промежуточное соединение 25; Промежуточное соединение 25 и из этого производного можно получить другие аналоги настоящего изобретения. Один из способов настоящего изобретения предусматривает превращение цианосафрацина В в промежуточное соединение 25 в соответствии с реакционной схемой, которая включает, в основном, (1) удаление метоксигруппы, имеющейся в кольце А, (2) восстановление кольца А и образование метилендиоксигруппы в одном сосуде, (3) гидролиз амидной функциональной группы у углерода 1, (4) превращение полученной аминогруппы в гидроксильную группу. Превращение 2-цианосоединения в промежуточное соединение 25 обычно предусматривает проведение нижеследующих стадий (см. схему II): образования защищенного соединения формулы 14 посредством взаимодействия соединения 2 с трет-бутоксикарбонильным ангидридом; превращения соединения 14 в дизащищенное соединение формулы 15 посредством его взаимодействия с бромметилметиловым эфиром и диизопропилэтиламином в ацетонитриле; селективного удаления метоксигруппы из хиноновой системы в соединении 15 посредством взаимодействия с метанольным раствором гидроксида натрия с получением соединения формулы 16; превращения соединения 16 в метилендиоксисоединение формулы 18 в соответствии с нижеследующей предпочтительной последовательностью реакций: (1) восстановления хиноновой группы соединения 16 в присутствии 10% Pd/C в атмосфере водорода; (2) превращения гидрохинонового промежуточного соединения в метилендиоксисоединение формулы 17 посредством взаимодействия с бромхлорметаном и карбонатом цезия в атмосфере водорода; (3) превращения соединения 17 в соединение формулы 18 посредством защиты свободной гидроксильной группы как группы OCH2R. Эту реакцию взаимодействия осуществляют с использованием BrCH2R и карбоната цезия, где R может представлять арил, СН=СН 2, OR' и т.п.; удаления трет-бутоксикарбонильных и метоксиметильных защитных групп соединения 18 посредством его взаимодействия с раствором HCl в диоксане с получением соединения формулы 19. Указанную реакцию взаимодействия также осуществляют посредством смешивания соединения 18 с раствором трифторуксусной кислоты в дихлорметане; образования тиомочевинного соединения формулы 20 посредством взаимодействия соединения 19 с фенилизотиоцианатом; превращения соединения формулы 20 в аминовое соединение формулы 21 посредством реакции с раствором хлористого водорода в диоксане; превращения соединения формулы 21 в N-Troc-производное 22 посредством реакции с трихлорэтилхлорформиатом и пиридином; образования защищенного гидроксисоединения формулы 23 посредством взаимодействия соединения 22 с бромметилметиловым эфиром и диизопропилэтиламином; превращения соединения формулы 23 в N-H-производное 24 посредством реакции с уксусной кислотой и цинком; превращения соединения формулы 24 в гидроксисоединение формулы 25 посредством реакции с нитритом натрия в уксусной кислоте. Альтернативно, может быть использован тетроксид азота в смеси уксусной кислоты и ацетонитрила с последующей обработкой гидроксидом натрия. Кроме того, может быть использован нитрит натрия в смеси уксусного ангидрида-уксусной кислоты с последующей обработкой гидроксидом натрия. Превращение промежуточного соединения 25 в другие аналоги настоящего изобретения может быть затем легко осуществлено как проиллюстрировано, например, на схеме III, которая обычно включает нижеследующие стадии: превращения соединения формулы 24 в производное 30 путем защиты первичной гидроксильной функциональной группы (S)-N-2,2,2-трихлорэтоксикарбонил-S-(9 Н-флуорен-9-илметил)цистеином 29; превращения защищенного соединения формулы 30 в производное фенола 31 путем отщепления аллильной группы с использованием гидрида трибутилолова и дихлорпалладий-бис(трифенилфосфина); превращения соединения фенола формулы 31 в соединение формулы 32 путем окисления ангидридом бензолселениновой кислоты при низкой температуре; Описанный выше способ превращения промежуточного соединения 25 может быть подвергнут стандартной модификации для получения других производных. Более подробно, превращение исходного 21-цианосоединения в соответствующий продукт настоящего изобретения, такой как продукт формулы (XX), обычно включает следующие стадии:a) превращения, если это необходимо, хиноновой системы для кольца Е в фенольную систему;d) превращения, если это необходимо, хиноновой системы для кольца А в фенольную систему;e) превращения указанной фенольной системы кольца А в метилендиоксифенольное кольцо. Эти стадии имеют большое сходство с предыдущими стадиями. Стадия (с) обычно предусматривает образование группы -CH2NH2 в 1-положении и ее ацилирование. Фталасцидин может быть получен с использованием промежуточных соединений, описанных в способе превращения цианосафрацина В в промежуточное соединение 25. Так, например, промежуточ- 24006070 ные соединения 21 и 17 являются подходящими исходными веществами для получения фталасцидина и других аналогов настоящего изобретения. Как показано на схеме V, синтетический способ образования фталасцидина из промежуточного соединения 21 включает последовательные стадии: превращения соединения 21 в соединение формулы 27 посредством реакции с ангидридом фталевой кислоты в дихлорметане и карбонилдиимидазолом; превращения соединения 27 в фталасцидин посредством реакции с гидридом, трибутилолова и дихлорпалладий-бис(трифенилфосфином) или с основной средой и последующей реакции с ацетилхлоридом. Схема V Как показано на схеме VI, синтетический способ получения фталасцидина из промежуточного соединения 17 включает последовательные стадии: ацетилирования гидроксильной группы соединения формулы 17 ацетилхлоридом и пиридином с получением ацетилированного промежуточного соединения формулы 42; удаления трет-бутоксикарбонильной и метилоксиметильной защитных групп соединения 42 посредством его взаимодействия с раствором HCl в диоксане с получением соединения формулы 43. Эта реакция может быть также осуществлена путем смешивания соединения 42 с раствором трифторуксусной кислоты в дихлорметане; образования соединения тиомочевины формулы 44 в результате взаимодействия соединения 4 3 с фенилизотиоцианатом; превращения соединения формулы 44 в аминовое соединение формулы 45 посредством реакции с раствором хлористого водорода в диоксане; превращения соединения 45 во фталасцидин посредством реакции с ангидридом фталевой кислоты в дихлорметане и карбонилдиимидазолом. Другие аналоги могут быть получены, например, из соединений 43 или 45 аналогичным способом. Превращение исходного 21-цианосоединения в промежуточное соединение 11 или соответствующее промежуточное соединение формулы (XXI) обычно включает следующие стадии:a) превращения, если это необходимо, хиноновой системы для кольца Е в фенольную систему;d) превращения, если это необходимо, хиноновой системы для кольца А в фенольную систему;e) превращения указанной фенольной системы кольца А в метилендиоксифенольное кольцо. На стадии (b) , образование группы -OProt1 в 18-положении кольца Е является типичной реакцией защиты для фенольной группы, и, в этом случае, каких-либо конкретных комментариев не требуется. Подходящие условия выбирают в зависимости от природы защитной группы. Другие стадии аналогичны другим реакциям. На стадии (с), образование группы -CH2-OProt2 в 1-положении кольца В обычно осуществляют посредством образования группы -CH2NH2 в 1-положении с последующим превращением функциональной аминогруппы в функциональную гидроксигруппу и защитой. Таким образом, если исходное вещество имеет группу R1, которая представляет собой -CH2-NH-CO-CR25aR25bR25c, то следует удалить N-ацильную группу. Если исходное вещество имеет группу R1, которая представляет собой -CH2-O-CO-R, то для получения эктеинасцидинового продукта, в котором R1 имеет то же самое значение, каких-либо изменений не требуется. Для получения других продуктов следует удалить О-ацильную группу. Для осуществления таких реакций деацилирования существуют различные способы. В одном варианте деацилирование и превращение в функциональную гидроксигруппу осуществляют в одну стадию. Затем, гидроксигруппа может быть ацилирована или каким-либо другим способом превращена в соответствующую группу R1. В патенте США 5721362 описаны синтетические способы получения ЕТ-743 путем продолжительного многостадийного синтеза. Одним из промежуточных соединений этого синтеза является промежуточное соединение 11. Получение промежуточного соединения 11 может быть достигнуто с использованием цианосафрацина В в качестве исходного вещества, что дает более короткий способ получения такого промежуточного соединения, а поэтому позволяет усовершенствовать способ получения ЕТ-743. Цианосафрацин В может быть превращен в промежуточное соединение 25 описанными выше способами. Из промежуточного соединения 25 можно получить промежуточное соединение 11 с использованием нижеследующих стадий, см. схему VII: образования защищенного гидроксисоединения формулы 26 посредством взаимодействия соединения 25 с трет-бутилдифенилсилилхлоридом в присутствии основания; конечного отщепления аллильной группы под действием гидрида трибутилолова и дихлорпалладий-бис(трифенилфосфина) в соединении 26 с образованием промежуточного соединения 11. Схема VII Один из вариантов синтетического способа настоящего изобретения для превращения сафрацина В в промежуточное соединение 11 предусматривает модификацию и расширение схемы VIII и включает последовательные стадии: стереоспецифического превращения соединения сафрацина В в соединение формулы 2 путем селективного замещения ОН на CN посредством взаимодействия с KCN в кислотной среде; образования соединения тиомочевины формулы 3 в результате взаимодействия соединения формулы 2 с фенилизотиоцианатом; превращения соединения тиомочевины формулы 3 в ацетамид формулы 5 путем гидролиза в кислой среде с последующим добавлением уксусного ангидрида; причем, промежуточное аминовое соединение формулы 4 может быть выделено путем гашения гидролиза в кислой среде бикарбонатом натрия, но это- 26006070 промежуточное соединение является очень нестабильным и быстро превращается в пятичленный циклический имин, называемый соединением 6; образования защищенного соединения формулы 7 посредством взаимодействия с бромметилметиловым простым эфиром и диизопропилэтиламином в дихлорметане; селективного деметилирования метоксигруппы хиноновой системы соединения формулы 7 посредством реакции с метанольным раствором гидроксида натрия с получением соединения формулы 8; превращения соединения формулы 8 в метилендиоксисоединение формулы 9 в соответствии со следующей предпочтительной последовательностью реакций: (1) восстановления хиноновой группы соединения 8 с использованием 10% Pd/C в атмосфере водорода; (2) превращения гидрохинонового промежуточного соединения в метилендиоксисоединение формулы 9 посредством взаимодействия с бромхлорметаном и карбонатом цезия в атмосфере водорода; (3) превращения соединения формулы 9 в соединение формулы 10 путем защиты свободной гидроксильной группы как группы OCH2R посредством взаимодействия с BrCH2R и карбонатом цезия, где R может представлять арил, СН=СН 2, OR' и т.п.; превращения ацетамидной группы соединения формулы 10 в соответствующую гидроксильную группу формулы 11 посредством взаимодействия с тетроксидом азота в смеси уксусной кислоты и ацетата уксусной кислоты, с последующей обработкой гидроксидом натрия; альтернативно, может быть использован нитрит натрия в смеси уксусного ангидрида и уксусной кислоты, с последующей обработкой гидроксидом натрия; альтернативно, ацетамидная группа соединения формулы 10 может быть превращена в первичную аминовую группу посредством взаимодействия с гидразином или с Boc2O, DMAP, а затем с гидразином; причем, такой первичный амин может быть превращен в соответствующую гидроксильную группу (соединение формулы 11) путем окислительного превращения первичного амина в соответствующий альдегид с использованием бензолсульфоната 4-формил-1-метилпиридиния или другого иона пиридиния, а затем с использованием DBU, или обработки другим основанием с последующим гидролизом и восстановлением альдегида до соответствующей гидроксильной группы с использованием алюмогидрида лития или другого восстановителя; образования защищенного соединения формулы 26 в результате взаимодействия с третбутилдифенилсилилхлоридом и диметиламинопиридином в дихлорметане; превращения силилированного соединения формулы 26 в промежуточное соединение 11 путем удаления защитной группы OCH2R и реакции в условиях восстановления или в кислотных условиях. Обычно, эти процедуры осуществляют с использованием палладиевой черни в атмосфере водорода или водной TFA или гидрида трибутилолова и дихлор-бис(трифенилфосфинпалладия). Еще в одном предпочтительном варианте настоящего изобретения, цианосоединение формулы 2 может быть превращено в промежуточное соединение 11 с использованием расширения схемы II, включающей дополнительные стадии: образования защищенного гидроксисоединения формулы 26 посредством взаимодействия соединения 25 с трет-бутилдифенилсилилхлоридом в присутствии основания; конечного отщепления аллильной группы под действием гидрида трибутилолова и дихлорпалладий-бис(трифенилфосфина) в соединении 26 с образованием промежуточного соединения 11. Таким образом, цианосафрацин В может быть превращен в ряд промежуточных соединений и производных с потенциальной противоопухолевой терапевтической активностью. Эти промежуточные соединения могут быть получены из уже описанных соединений или с использованием альтернативных способов. Описанные здесь промежуточные соединения включают соединение 47 и ряд амидных производных, полученных с использованием соединений 45 или 43. На схеме VIII представлено получение соединения 47 в соответствии с нижеследующей последовательностью реакций: образования соединения тиомочевины формулы 3 посредством взаимодействия соединения формулы 2 с фенилизотиоцианатом; превращения соединения тиомочевины формулы 3 в ацетамид формулы 5 путем гидролиза в кислой среде с последующим добавлением уксусного ангидрида; причем, промежуточное аминовое соединение формулы 4 может быть выделено путем гашения гидролиза в кислой среде бикарбонатом натрия, но это промежуточное соединение является очень нестабильным и быстро превращается в пятичленный циклический имин, называемый соединением 6; образования защищенного соединения формулы 7 в результате взаимодействия с бромметилметиловым простым эфиром и диизопропилэтиламином в дихлорметане; селективного деметилирования метоксигруппы хиноновой системы соединения формулы 7 с получением соединения формулы 8 посредством взаимодействия с метанольным раствором гидроксида натрия; превращения соединения формулы 8 в метилендиоксисоединение формулы 10 в соответствии со следующей предпочтительной последовательностью реакций: (1) восстанавления хиноновой группы соединения 8 в присутствии 10% Pd/C в атмосфере водорода; (2) превращения гидрохинонового промежуточного соединения в метилендиоксисоединение формулы 9 посредством взаимодействия с бромхлорметаном и карбонатом цезия в атмосфере водорода; (3) превращения соединения формулы 9 в соединение- 27006070 формулы 10 путем защиты свободной гидроксильной группы как аллилокси группы и взаимодействия с аллилбромидом и карбонатом цезия; превращения соединения формулы 9 в ацетильное производное 46 посредством взаимодействия с ацетилхлоридом в пиридине; превращения соединения формулы 46 в соединение 47 со снятой защитой посредством взаимодействия с хлористоводородной кислотой в диоксане. Схема VIII Другие ценные амидные промежуточные производные получают из уже описанного промежуточного соединения 45 в соответствии со следующей схемой. Схема IX Вторая стадия является необязательной. Этот способ является важной частью настоящего изобретения, а особенно в том случае, когда группа R представляет группу Ra, определенную ранее. Кроме того,схема VIII может быть легко расширена для получения соединений формулы (XXIII) путем включения в исходное вещество другой группы в 5-положении, либо группы, которая должна быть непосредственно включена в данный продукт, либо группы, которая может быть удалена или как-нибудь иначе модифицирована с образованием нужной группы. Из соединения 45 может быть получена группа аналогов в соответствии с нижеследующей последовательностью реакций: ацилирования аминогруппы соединения формулы 45 ацильными производными широкого ряда с получением соответствующих амидов, где предпочтительными ацильными группами являются ацетил, циннамоилхлорид, п-трифторциннамоилхлорид, изовалерилхлорид, фенилизотиоцианат или аминокислоты, либо другие примеры ранее указанных групп RaCO-, превращения группы CN в группу ОН посредством взаимодействия с нитратом серебра в смеси AcN/H2O. Другие ценные амидные промежуточные производные получают из уже описанного промежуточного соединения 43 в соответствии со следующей схемой. Из соединения 43 может быть получена другая группа представляющих интерес производных в соответствии с нижеследующей последовательностью реакций:(a) ацилирования аминогруппы соединения формулы 43 ацильными производными широкого ряда с получением соответствующих амидов, где предпочтительными ацильными группами являются ацетил,циннамоилхлорид, п-трифторциннамоилхлорид, изовалерилхлорид или аминокислоты, либо другие примеры ранее указанных групп RaCO-,(b) превращения группы CN в группу ОН посредством взаимодействия с нитратом серебра в смесиAcN/H2O. Что касается активных соединений, то важный способ их получения в соответствии с настоящим изобретением описан ниже: где R5 в конечном продукте представляет группу, определенную для соединения (XXII), но в исходном веществе он может быть другим и превращен в указанную группу в ходе данного процесса,R18 представляет гидроксигруппу в конечном продукте, но в исходном веществе, он может быть защищенной гидроксигруппой и превращен в указанную группу в ходе данного процесса,R12 в конечном продукте может быть такой же группой, как и в исходном веществе, либо он может быть превращен в нее в ходе указанного процесса,R21 в конечном продукте является таким, как он был определен выше, и если он представляет гидроксигруппу, то она может быть образована из цианогруппы в ходе данного процесса,Ra определен выше и может быть затем ацилирован в ходе данного процесса с получением конечного продукта, имеющего ацилированную группу Ra, как обсуждалось выше.R5 предпочтительно представляет оксиацетильную или другую небольшую оксиацильную группу в исходном веществе, и не изменяется в процессе реакции. R18, предпочтительно, представляет гидроксигруппу в исходном веществе, и не изменяется в процессе реакции. R12, предпочтительно, представляет-NCH3- в исходном веществе, и не изменяется в процессе реакции. R21 в конечном продукте является таким, как он был определен выше, и если он представляет гидроксигруппу, то она может быть образована из цианогруппы в ходе данного процесса. Ra в конечном продукте предпочтительно является таким, как он определен для соединения формулы (XXIII). Другой важный способ настоящего изобретения включает реакцию:- 29006070 Другой важный способ настоящего изобретения включает реакцию: Другой важный способ настоящего изобретения включает реакцию, где группу R1, которая представляет аминометилен, превращают в гидроксиметиленовую группу. Другой важный способ настоящего изобретения включает реакцию для получения 21 цианосоединения формулы (XVI), которая предусматривает взаимодействие соединения формулы (XV): где R1, R5, R8, R14a, R14b, R15 и R18 определены выше, a R21 представляет гидроксигруппу, с источником ионов цианида, с получением нужного 21-цианосоединения. Кроме того, также рассматриваются способы с использованием других нуклеофилсодержащих соединений для получения аналогичных соединений формулы (XVI), где 21-положение защищено другой нуклеофильной группой, группой 21-Nuc. Так, например, 21-Nuc-соединение формулы (XVI) с алкиламиновым заместителем в 21-положении может быть получено посредством взаимодействия соединения формулы (XV), где R21 представляет гидроксигруппу, с подходящим алкиламином. 21-Nuc-соединение формулы (XVI) с алкилтиозаместителем в 21-положении может быть получено посредством взаимодействия соединения формулы (XV), где R21 представляет гидроксигруппу, с подходящим алкантиолом. Альтернативно, 21-Nuc-соединение формулы (XVI) с -карбонилалкильным заместителем в 21 положении может быть получено посредством взаимодействия соединения формулы (XV), где R21 представляет гидроксигруппу, с подходящим карбонильным соединением, обычно в присутствии основания. Для получения других 21-Nuc-соединений существуют другие способы синтеза. Другая важная реакция настоящего изобретения включает обработку 21-цианопродукта настоящего изобретения для получения 21-гидроксисоединения. Такие соединения представляют интерес с точки зрения их свойств in vivo. Чтобы исключить всякие сомнения, следует отметить, что стереохимические структуры, указанные в описании настоящей патентной заявки, основаны на авторском представлении точной стереохимии природных продуктов. Если принять во внимание тот факт, что была обнаружена ошибка в отнесении стереохимии, то необходимо внести соответствующую поправку в формулы, представленные в описании настоящей заявки. Кроме того, если учесть, что указанные способы синтеза могут быть модифицированы, то настоящее изобретение распространяется и на стереоизомеры.
МПК / Метки
МПК: C07D 515/22, A61K 35/00, C07D 471/18, C07D 491/22, A61P 35/00
Метки: аналоги, ет-743, противоопухолевые
Код ссылки
<a href="https://eas.patents.su/30-6070-protivoopuholevye-analogi-et-743.html" rel="bookmark" title="База патентов Евразийского Союза">Противоопухолевые аналоги ет-743</a>
Предыдущий патент: Тиенодибензоазуленовые соединения в качестве ингибиторов фактора некроза опухоли
Следующий патент: Замещенные производные фенилпиперазина, их получение и применение
Случайный патент: Ветроэнергетическая система для увеличения количества вырабатываемой ветром энергии












