Замещённые спиробензазепины
Номер патента: 11089
Опубликовано: 30.12.2008
Авторы: Пател Мона, Ксианг Мин Эми, Рибжински Филип Дж.
Формула / Реферат
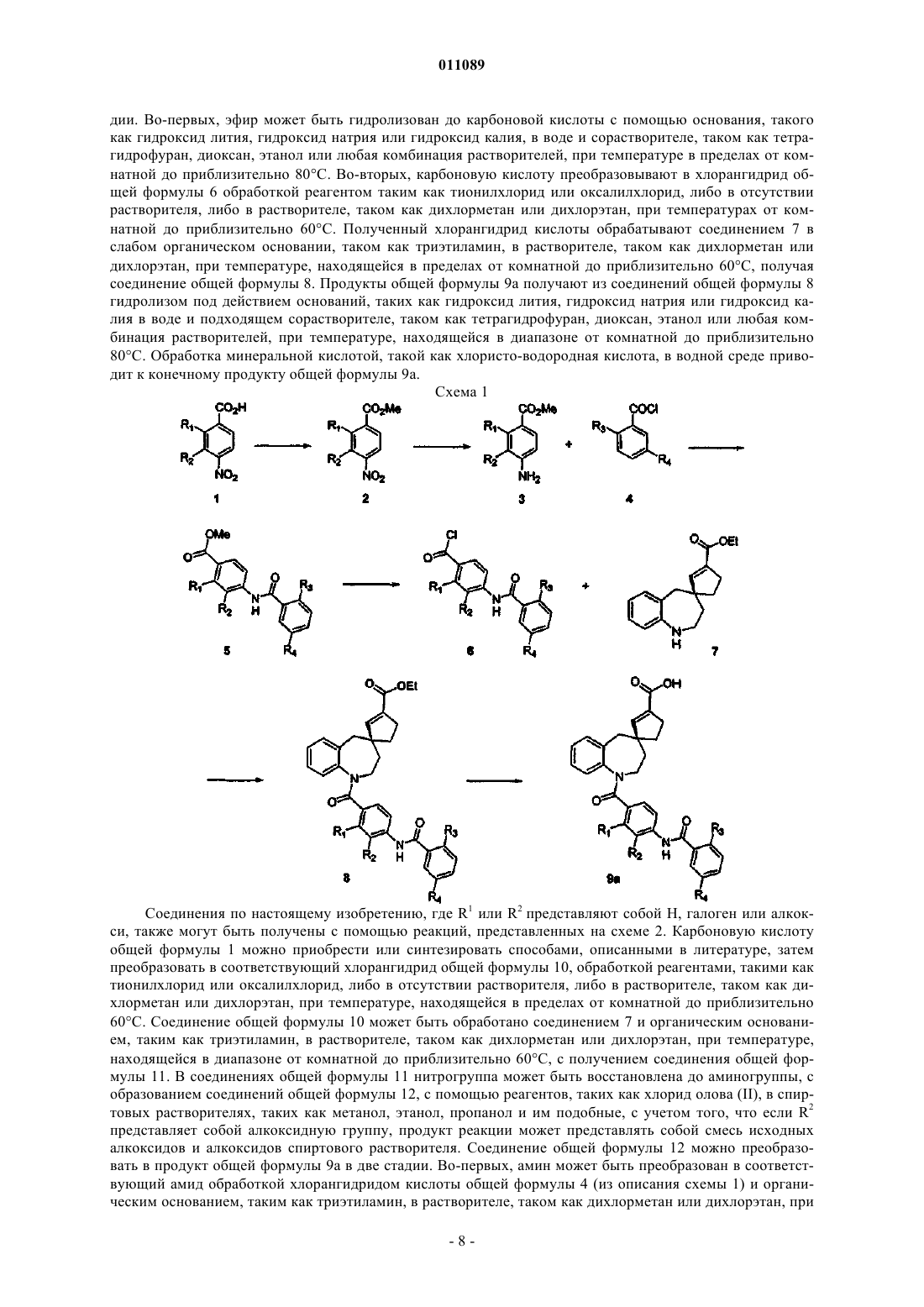
1. Соединение формулы I
в которой
один из R1 и R2 представляет собой Н, и другой представляет собой Н, NR5R6, C1-6алкокси, гидрокси или галоген; где каждый из R5 и R6 независимо представляет собой Н или C1-3алкил;
R3 представляет собой хлор;
R4 представляет собой хлор, фтор, метокси или метил;
или его фармацевтически приемлемые сложные C1-6эфиры, C1-6амиды или ди(C1-6алкил)амиды, или их соли.
2. Соединение по п.1, где R2 представляет собой аминогруппу.
3. Соединение по п.1, где R2 представляет собой C1-4алкоксигруппу.
4. Соединение по п.1, где R2 представляет собой метокси, этокси, пропокси, изопропокси, бутокси, изобутокси или трет-бутокси.
5. Соединение по п.4, где R2 представляет собой метокси или этокси.
6. Соединение по п.1, где R4 представляет собой фтор, хлор или метил.
7. Соединение по п.1, где R4 представляет собой фтор или хлор.
8. Соединение по п.1, где R4 представляет собой фтор.
9. Соединение по п.6, где R2 представляет собой метокси, этокси или изопропокси.
10. Соединение по п.6, где R1 представляет собой метокси или этокси.
11. Соединение по п.7, где R2 представляет собой метокси или этокси.
12. Соединение по п.1, выбранное из
(R)-4-(2-хлор-5-фторбензоил-3-метокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-фторбензоил-3-этокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-фторбензоил-3-изопропокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-фторбензоил-3-гидрокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-фторбензоил-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-фторбензоил-3-амино-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-фторбензоил-3-хлор-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-фторбензоил-2-хлор-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-фторбензоил-2-амино-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-фторбензоил-2-гидрокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-фторбензоил-2-метокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-метилбензоил-3-метокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-метилбензоил-3-гидрокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-метилбензоил-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-метилбензоил-3-амино-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-метилбензоил-3-хлор-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-метилбензоил-3-хлор-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-метоксибензоил-3-метокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-метоксибензоил-3-гидрокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-метоксибензоил-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-метоксибензоил-3-амино-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2-хлор-5-метоксибензоил-3-хлор-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2,5-дихлорбензоил-3-метокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2,5-дихлорбензоил-3-гидрокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2,5-дихлорбензоил-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
(R)-4-(2,5-дихлорбензоил-3-амино-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена и
(R)-4-(2,5-дихлорбензоил-3-хлор-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'-ена;
13. Соединение по п.1, где соединение выбрано из (R)-4-(2-хлор-5-фторбензоил-3-метокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]бензоундец-2'-ен и (R)-4-(2-хлор-5-фторбензоил-3-этокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]бензоундец-2'-ен

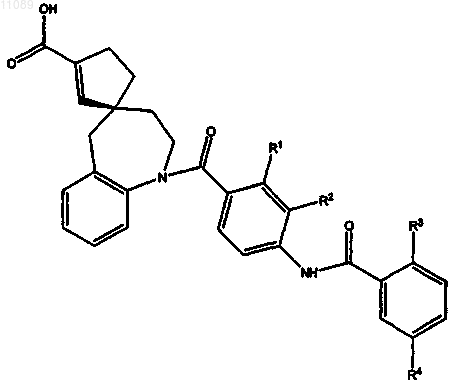
14. Соединение по п.1, где соединение представляет (R)-4-(2-хлор-5-фторбензоил-3-метокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]бензоундец-2'-ен
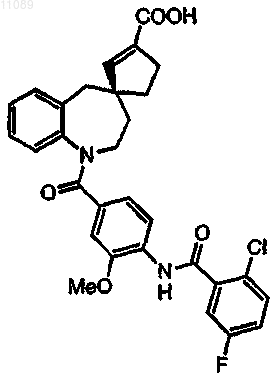
15. Соединение по п.1, где соединение представляет собой (R)-4-(2-хлор-5-фторбензоил-3-этокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]бензоундец-2'-ен формулы
16. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
17. Фармацевтическая композиция по п.16, в которой указанное соединение выбирают из соединений по пп. 5, 8, 9, 10, 13, 14 или 15.
18. Способ лечения субъекта, страдающего от состояния, связанного с активностью рецептора вазопрессина, который включает введение субъекту терапевтически эффективного количества соединения формулы I, определенного в п.1.
19. Способ задержки начала или развития у субъекта состояния, связанного с активностью рецептора вазопрессина, который включает введение субъекту профилактически эффективной дозы соединения формулы I, определенного в п.1.
20. Способ по п.18 или 19, в котором указанное состояние выбирают из расстройств внутреннего уха, гипертензии, закупорки сердечных сосудов, сердечной недостаточности, спазма коронарных сосудов, ишемии сердца, цирроза печени, спазма почечных сосудов, почечной недостаточности, диабетической нефропатии, гипонатриемии, отека мозга, ишемии мозга, инсульта, тромбоза, отечности, агрессивности, обсессивно-компульсивных расстройств, дисменореи, нефротического синдрома, тревоги и повреждений центральной нервной системы.
21. Способ по п.20, в котором указанное состояние представляет собой закупорку сосудов сердца или сердечную недостаточность.
22. Способ по п.20, в котором указанное состояние представляет собой гипонатриемию.
23. Способ по п.20, в котором указанное состояние представляет собой гипертонию.
24. Способ по п.20, в котором указанное соединение выбирают из соединений по пп.5, 8, 9, 10, 13, 14 или 15.
25. Способ получения фармацевтической композиции, включающий смешивание любого из соединений по п.1 и фармацевтически приемлемого носителя.
Текст
011089 Настоящее изобретение относится к новым, непептидным замещенным спиробензазепинам, которые применимы, например, в качестве антагонистов рецептора вазопрессина. Вазопрессин представляет собой непептидный гормон, который в основном секретируется задней долей гипофиза. Этот гормон осуществляет свое воздействие через такие подтипы рецепторов, как сосудистый V-1 и почечный V-2. Функции вазопрессина включают сокращение матки, мочевого пузыря и гладкой мускулатуры; стимуляцию расщепления гликогена в печени; индукцию агрегации тромбоцитов; выделение кортикотропина из передней доли гипофиза и стимуляцию реабсорбции воды в почках. Являясь нейростимулятором в центральной нервной системе (СНС), вазопрессин может оказывать влияние на агрессивное поведение, сексуальное поведение, стрессовую реакцию, социальное поведение и память. Рецептор V-1a опосредует воздействие на центральную нервную систему, сокращение гладкой мускулатуры и влияние вазопрессина на расщепление гликогена в печени, в то время как рецептор V-1b опосредует воздействие вазопрессина на переднюю долю гипофиза. Рецептор V-2, предположительно найденный только в почках, оказывает влияние на антидиуретическое действие вазопрессина путем стимулирования аденилатциклазы (Liebsch, G. et al. Neurosci. 1996, 217, 101). Повышенные уровни вазопрессина в плазме, по-видимому, играют роль в патогенезе закупорки сердечных сосудов (P.A. Van Zwieten, Progr. Pharmacol. Clin. Pharmacol. 1990, 7, 49). В качестве успеха в лечении закупорки сердечных сосудов непептидные антагонисты рецептора вазопрессина V-2 вызывают низкий осмоляльный акварез (диурез воды) и снижают общее периферическое сопротивление сосудов у находящихся в сознании собак с закупоркой сердечных сосудов (H.Ogawa, J.Med.Chem. 1996, 39, 3547). В определенных патологических состояниях уровни вазопрессина в плазме могут повышаться до неприемлемых для данной осмоляльности, приводя, тем самым, к задержке воды в почках и гипонатриемии. Гипонатриемия, связанная с отечными состояниями (циррозом, закупоркой сердечных сосудов, почечной недостаточностью), может сопровождаться синдромом несоответствующей секреции антидиуретического гормона (SIADH). Воздействие антагониста рецептора вазопрессина V-2 на крыс с синдромом SIADH исправляет имеющуюся у них гипонатриемию (G. Fujisawa, Kidney Int. 1993, 44(1), 19). Частично благодаря сократительному действию вазопрессина в его рецепторе V-1 в сосудистой системе, антагонисты рецептора вазопрессина V-1 понижают давление крови, в качестве потенциального лечения гипертензии. Известные антагонисты рецептора вазопрессина включают YM-087 (Yamanouchi); VPA-985, WAY140288 и CL-385004 (American Home Products); SR-121463 (Sanofi-Synthelabo); и ОРС 31260, OPC 41061 и ОРС 21268 (Otsuka). Таким образом, антагонисты рецептора вазопрессина полезны в качестве терапевтических средств при состояниях гипертензии, гипонатриемии, закупорки сердечных сосудов/сердечной недостаточности,спазма коронарных сосудов, ишемии сердца, цирроза печени, спазма почечных сосудов, диабетической нефропатии, отека и ишемии мозга, инсульта, тромбоза и отечности. Дополнительные состояния могут включать нефротический синдром, повреждения центральной нервной системы, дисменорею, агрессивность, тревожные состояния и обсессивно-компульсивные расстройства (навязчивые неврозы). Настоящее изобретение относится к соединениям, представленным следующей формулой I: в которой один из R1 и R2 представляет собой Н, и другой представляет собой Н, NR5R6, C1-6 алкокси, гидрокси или галоген; причем каждый из R5 и R6 независимо представляет собой Н или C1-3 алкил;R4 представляет собой хлор, фтор, метокси или метил; или их фармацевтически приемлемым сложным C1-6 эфирам, C1-6 амидам или ди(C1-6 алкил)амидам,или их солям. Соединения по настоящему изобретению являются антагонистами рецептора вазопрессина, которые полезны, в основном, при болезненных состояниях и расстройствах внутреннего уха, гипертензии, заку-1 011089 порке сердечных сосудов, сердечной недостаточности, гипонатриемии, спазме сердечных сосудов, ишемии сердца, циррозе печени, спазме почечных сосудов, почечной недостаточности, диабетической нефропатии, отеке и ишемии мозга, инсульте, тромбозе, отечности, агрессивности, обсессивнокомпульсивных расстройствах, дисменорее, нефротическом синдроме и повреждениях центральной нервной системы. Предпочтительно болезненное состояние выбрано из гипертензии, закупорки сердечных сосудов,сердечной недостаточности и гипонатриемии. Настоящим изобретением также предоставлена фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и любое из описанных выше соединений формулы I, причем фармацевтическая композиция получена путем смешивания одного или нескольких соединений формулы I и фармацевтически приемлемого носителя. Настоящим изобретением также предоставлен способ получения фармацевтической композиции, включающий смешивание любого из описанных выше соединений и фармацевтически приемлемого носителя. Далее изобретение предоставляет способы применения соединений и композиций по настоящему изобретению. Например, один из вариантов осуществления изобретения представляет собой способ лечения состояния, связанного с активностью рецептора вазопрессина, такого как состояние, опосредованное антагонизмом вазопрессина, у субъекта, нуждающегося в этом, включающий введение субъекту терапевтически эффективного количества любого из раскрытых в изобретении соединений или фармацевтических композиций. Другой вариант осуществления настоящего изобретения представляет собой способ ингибирования наступления или развития состояния, связанного с активностью рецептора вазопрессина у субъекта, который включает введение субъекту профилактически эффективной дозы фармацевтической композиции на основе соединения формулы I. Дополнительной иллюстрацией настоящего изобретения является способ лечения состояния, выбранного из гипертензии, закупорки сердечных сосудов, сердечной недостаточности, гипонатриемии,спазма коронарных сосудов, ишемии сердца, цирроза печени, спазма почечных сосудов, почечной недостаточности, диабетической нефропатии, отека мозга, ишемии мозга, инсульта, тромбоза и отечности у субъекта, нуждающегося в этом, включающий введение субъекту терапевтически эффективного количества любого из соединений или фармацевтических композиций, описанных выше. Предпочтительно терапевтически эффективное количество соединения, введенного для лечения любого из перечисленных состояний, составляет приблизительно от 0,05 до 1 г в день. Другие варианты осуществления и отличительные признаки изобретения раскрыты в подробном описании, примерах и приложенной формуле изобретения, приведенных ниже. Настоящее изобретение относится к непептидным замещенным соединениям из числа спиробензазепинов, которые полезны в качестве антагонистов рецепторов вазопрессина. В частности, эти замещенные спиробензазепиновые соединения ингибируют связывание вазопрессина с рецепторами V-1a, V-1b и/или V-2 и предпочтительно с рецепторами V-1a и V-2. Соединения по настоящему изобретению также демонстрируют функциональную активность за счет их способности ингибировать внутриклеточную мобилизацию кальция и аккумуляцию сАМР, индуцированную аргининвазопрессином (AVP) в трансфицированных клетках НЕК-293, которые экспрессируют человеческие рецепторы V-1a и V-2 соответственно. Непептидные замещенные соединения из числа спиробензазепинов по настоящему изобретению являются антагонистами рецептора вазопрессина. В предпочтительном варианте осуществления, соединения активны при пероральном введении. В другом предпочтительном варианте осуществления, соединения обладают способностью в большей степени блокировать связывание вазопрессина с V-1a и V-2,чем с V-1b. Как показывают описанные ниже результаты фармакологических исследований, соединения демонстрируют способность блокировать связывание вазопрессина с рекомбинантными V-1a и/или V-2 и, следовательно, полезны в качестве терапевтических или профилактических средств против таких состояний, как агрессивность, обсессивно-компульсивные расстройства, гипертензия, дисменорея, гипонатриемия, закупорка сосудов сердца/сердечная недостаточность, спазм коронарных сосудов, ишемия сердца, цирроз печени, спазм почечных сосудов, почечная недостаточность, отек, ишемия, инсульт,тромбоз, отечность, нефротический синдром, тревожные состояния и повреждения центральной нервной системы. А. Термины Следующие термины определены ниже, а также путем их использования в ходе раскрытия настоящего изобретения. Термин алкил включает необязательно замещенные углеводороды с неразветвленной и разветвленной цепью или циклические углеводороды, в которых удален по крайней мере один из атомов водорода для образования радикальной группы. Алкильные группы включают метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, 1-метилпропил, пентил, изопентил, втор-пентил, гексил, гептил, октил и т.д. Термин алкил включает циклоалкилы, такие как циклопропил, циклобутил, циклопентил и циклогексил. Например, С 3 алкилы включают н-пропил, изопропил и циклопропил; С 4 алкилы включают н-2 011089 бутил, изобутил, трет-бутил, циклобутил, циклопропилметил и метилциклопропил. Термин алкокси включает необязательно замещенные алкильные группы с неразветвленной и разветвленной цепью или циклические алкильные группы с концевым кислородом, связывающим алкильную группу с остальной частью молекулы. Термин алкокси включает метокси, этокси, пропокси,изопропокси, бутокси, трет-бутокси, пентокси и т.д. Термины аминоалкил, тиоалкил и сульфонилалкил аналогичны алкокси, у которых концевой атом кислорода алкоксигруппы заменен, соответственно, NH (или NR), S, SO и SO2. Термин гало или галоген включает фтор, хлор, бром и йод, и, предпочтительно, фтор или хлор. Входя в состав алкильной группы в количестве одного или нескольких атомов, галогены могут образовывать моно-, ди- и тризамещенные группы, такие как трифторметил, трифторметокси, трифторметилтио, дифторметокси или фторметилтио. Термин фармацевтически приемлемые соли, эфиры и амиды включает соли карбоновых кислот, аддитивные соли, сложные эфиры и амиды аминокислот, которые обладают приемлемым отношением польза/риск,фармакологически эффективны и подходят для контакта с тканями пациентов, не проявляя чрезмерной токсичности, раздражающего действия и не вызывая аллергической реакции. Эти соли, сложные эфиры и амиды могут представлять собой, например, C1-8 алкил, С 3-8 циклоалкил, арил, С 2-10 гетероарил или С 2-10 неароматические гетероциклические соли, сложные эфиры и амиды. Конкретные фармацевтически приемлемые сложные эфиры по настоящему изобретению включают С 1-7 алкиловые, С 5-7 циклоалкиловые, фениловые и фенил(C1-6)алкиловые сложные эфиры. Предпочтительные сложные эфиры включают метиловые и этиловые сложные эфиры. Другие примеры включают C1-6 алкиловые, С 1-5 алкиловые, С 1-4 алкиловые или C1-3 алкиловые сложные эфиры или амиды. Что касается диалкиламидов, то каждая из алкильных групп выбрана независимо. Конкретные соли включают гидробромид, гидрохлорид, гидройодид, перхлорат, сульфат, бисульфат, нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, боронат, бензоат, лактат,фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептанат, лактиобионат, метансульфонат, памоат, салицилат, соль сахарина (сульфимида бензойной кислоты) и лаурилсульфонат. Соли могут содержать катионы щелочных и щелочно-земельных металлов, таких как натрий,калий, кальций и магний, цинк, а также нетоксичные катионы аммония, четвертичного аммония и катионы аминов, такие как тетраметиламмоний, метиламин, триметиламин и этиламин. См. примеры у S.M.Berge, et al., "Pharmaceutical Salts", J.Pharm.Sci., 19977, 66:1-19; "Handbook of Pharmaceutical SaltsProperties, Selection and Use" P.Heinrich Stahl, CamiLle G. Wermuth-Eds., Wiley-VCH Publishers, Zurich,Switzerland, которые включены в настоящую заявку посредством ссылки. Конкретные фармацевтически приемлемые амиды по настоящему изобретению включают амиды,являющиеся производными аммиака, первичных C1-6 алкиламинов и вторичных ди(C1-6 алкил)аминов. Диалкиламиды содержат две алкильные группы, которые могут быть выбраны независимо (например, метилпропиламид). Вторичные амины включают 5- или 6-членные гетероциклические или гетероароматические кольцевые фрагменты, такие как морфолинил, содержащие по крайней мере один атом азота и,необязательно, от 1 до 2 дополнительных гетероатомов. Предпочтительные амиды являются производными аммиака, первичных алкиламинов C1-3 и ди(C1-2 алкил)аминов. Термин пациент или субъект включает млекопитающих, таких как люди и животные (собаки,кошки, лошади, крысы, кролики, мыши, не человекообразные обезьяны), нуждающихся в наблюдении,эксперименте, лечении или профилактике в связи с соответствующим заболеванием или состоянием. Предпочтительно, пациентом или субъектом является человек. Термин композиция включает в себя продукт, содержащий определенные ингредиенты в определенных количествах, а также любой продукт, который получают в результате комбинирования определенных ингредиентов, взятых в определенных количествах. Термины терапевтически эффективное количество или эффективное количество (или профилактически эффективное количество) означают такое количество активного ингредиента или фармацевтического средства, которое вызывает биологическую или медицинскую реакцию в системе тканей, животном или человеке, к которой стремится исследователь, ветеринарный врач, врач или другой клиницист, и которая включает облегчение (или предотвращение, или задержку, или замедление наступления) симптомов состояния или расстройства, подвергаемого лечению. Термин профилактически эффективное количество означает такое количество активного ингредиента или фармацевтического средства, которое вызывает биологическую или медицинскую реакцию в системе тканей, животном или человеке, к которой стремится исследователь, ветеринарный врач, врач или другой клиницист, и которая включает предотвращение или задержку, или замедление наступления симптомов состояния или расстройства, подвергаемого лечению. В отношении различных органических групп, приведенных в данном описании и в формуле изобретения, будет сделано три общих замечания. Первое замечание касается валентности. В случае всех углеводородных групп, насыщенных, ненасыщенных или ароматических, а также циклических или нециклических, с линейной или разветвленной цепью, то же самое относится и ко всем гетероциклическим группам, каждая из которых включает замещенные группы указанного типа, а также одновалентные, двухвалентные и многовалентные группы, как следует из контекста формулы изобретения. Этот контекст будет-3 011089 показывать, что заместитель представляет собой алкилен или углеводородный радикал, по крайней мере,с двумя удаленными атомами водорода (двухвалентный) или большим количеством удаленных атомов водорода (многовалентный). Во-вторых, как определено в настоящей заявке, предполагается, что группы или структурные фрагменты включают замещенные группы или структурные фрагменты. Углеводородные заместители (гидрокарбилы) включают одновалентные группы, содержащие углерод и водород, такие как алкил, алкенил,алкинил, циклоалкил и циклоалкенил (или ароматический, или ненасыщенный), а также соответствующие двухвалентные (или многовалентные) группы, такие как алкилен, алкенилен, фенилен и т.д. Гетероуглеводородные заместители (гетерокарбилы) включают одновалентные и двухвалентные (или многовалентные) группы, содержащие углерод, необязательно, водород и по крайней мере один гетероатом. Примеры одновалентных гетерокарбилов включают ацил, ацилокси, алкоксиацил, гетероциклил, гетероарил, ароил, бензоил, диалкиламино, гидроксиалкил и т.д. Используя термин алкил в качестве примера, следует понимать, что алкил включает замещенный алкил, имеющий один или несколько заместителей, как, например, от 1 до 5, от 1 до 3 или от 2 до 4 заместителей. Заместители могут быть одинаковыми (дигидрокси, диметил), сходными (хлорфтор) или различными (хлорбензил- или аминометилзамещенные). Примеры замещенных алкилов включают галогеналкилы (такие как фторметил, хорметил, дифторметил, перхлорметил, 2-бромэтил, трифторметил и 3-йодциклопентил), гидроксиалкилы (такие как гидроксиметил, гидроксиэтил, 2-гидроксипропил), аминоалкилы (такие как аминометил, 2-аминоэтил, 3 аминопропил и 2-аминопропил), нитроалкилы, алкилалкилы и т.д. Ди(С 1-6 алкил)аминогруппа включает независимо выбранные алкильные группы, которые образуют, например, метилпропиламино и изопропилметиламиногруппы, в дополнение диалкиламиногруппы могут содержать две одинаковые алкильные группы, такие как диметиламино и диэтиламино. В соответствии с одним из вариантов осуществления изобретения, кольцевые атомы водорода в формуле I, которым не приписано какое-либо обозначение (например, отсутствие R1, R2, R3 или R4), не являются замещенными. В-третьих, имеются в виду только стабильные соединения. В. Соединения Настоящее изобретение предоставляет замещенные бензазепины формулы I, которая приведена выше, обладающие фармацевтической активностью в качестве антагонистов двойного действия V1a/V2. Примеры соединений включают такие соединения, где: (a) R2 представляет собой аминогруппу; (b) R1 или R2 (или предпочтительно R2) представляют собой C1-6 алкокси или С 1-5 алкокси, или С 1-4 алкокси, илиC1-3 алкокси; (с) R1 или предпочтительно R2 представляют собой метокси, этокси, пропокси, изопропокси,циклопропокси, бутокси, изобутокси, циклобутокси, циклопропилметокси или трет-бутокси; (d) R2 представляет собой метокси или этокси; (е) R4 представляет собой фтор, хлор или метил; (f) R4 представляет собой фтор или хлор; (g) R4 представляет собой фтор; (h) R2 представляет собой метокси, этокси или изопропокси, и R4 представляет собой фтор, хлор или метил; (i) R2 представляет собой метокси или этокси,и R4 представляет собой фтор, хлор или метил; (j) R2 представляет собой метокси или этокси, и R4 представляет собой фтор или хлор; (k) R2 представляет собой метокси или этокси, и R4 представляет собой фтор или метил; (1) R2 представляет собой метокси или этокси, и R4 представляет собой фтор; (m) соединение представляет собой соединение формулы I или его фармацевтически приемлемую соль или сложный эфир; (n) соединение представляет собой соединение формулы I или его фармацевтически приемлемую соль; (о) соединение формулы I, которое в дальнейшем является незамещенным; (р) любая алкильная или алкиленовая группа соединения может быть замещена галогеном, метилом, метокси, гидрокси,амино или циано; (q) R2 представляет собой Н, гидрокси, амино, С 1-4 алкокси или галоген; (r) R1 представляет собой Н; (s) в котором использованы варианты (q) и (r); (t) в котором заместители присутствуют только в карбоксильной группе; (u) только в группах R2 и R4; (v) только в 5-членном спирокольце; (х) в котором использованы варианты (t) и (u); (у) в котором использованы варианты (t), (u) и (v); (z) R1 или R2(или, предпочтительно, R2) представляют собой амино, метиламино, этиламино, н-пропиламино, циклопропиламино или изопропиламино; (аа) R1 или предпочтительно R2 представляют собой диметиламино,метилэтиламино, метил(н- или изопропил)амино, диэтиламино, этил(изо- или н-пропил)амино или дипропиламино (bb) R2 представляет собой метиламино, диметиламино или этиламино; (cc) или комбинации двух, трех или четырех любых из перечисленных выше вариантов от (а) до (bb). Примеры предпочтительных соединений включают:(R)-4-(2,5-дихлорбензоил-3-хлор-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]безоундец-2'ен; Более предпочтительно, изобретение относится к соединению, выбранному из целевых соединений примера 6 и примера 7; или соединение представляет собой целевое соединение примера 7; или, наиболее предпочтительно, соединением по настоящему изобретению является целевое соединение примера 6. В числе прочего, отличительной особенностью изобретения является обнаружение того факта, что концевой 2-хлорфенил, дополнительно замещенный в 5 положение, по-видимому, особенно эффективен в плане двойной V-1a/V-2 активности, по сравнению, например, с монозамещенным 2-хлорфенилом или 2-метил, 5-фтор замещенным фенилом. Предпочтительно соединение обладает селективным действием,хорошей биодоступностью и низкой гепатобилиарной токсичностью. Кроме этого, особенность данного изобретения состоит в обнаружении того факта, что спирокольцо предпочтительно имеет (R) конфигурацию, как того требует формула I. Если у соединений по настоящему изобретению имеется по крайней мере один центр пространственной изомерии, они, соответственно, могут существовать в виде энантиомеров. Если у соединений имеется два или несколько центров пространственной изомерии, они могут, кроме этого, существовать в виде диастереомеров. Следует понимать, что все такие изомеры и их смеси входят в объем настоящего изобретения. Однако формула I определяет геометрию спироуглерода (R) и только (R) рассматривается в качестве предпочтительного варианта осуществления настоящего изобретения. Родственные соединения Настоящее изобретение относится к описанным соединениям, а также к тесно связанным с ними фармацевтически приемлемым формам описанных соединений, таким как соли, сложные эфиры, амиды,кислоты, гидраты или сольватированные формы соединений; скрытые или защищенные формы; а также рацемические смеси или энантиомерно или оптически чистые формы. Родственные соединения также включают соединения по настоящему изобретению, которые были модифицированы для того, чтобы-5 011089 появилась возможность их обнаружения, например соединения, меченные изотопом 18F, для применения в качестве зонда в позитрон-эмиссионной томографии (PET) или однофотонной эмиссионной компьютерной томографии (SPECT). Изобретение также включает описанные соединения, у которых имеется одна или несколько функциональных групп (например, гидроксил, амино или карбоксил), скрытых защитной группой. См., например, Green и Wuts, Protective Groups in Organic Synthesis, 3rd ed., (1999) John WileySons, NY. Некоторые из этих скрытых или защищенных соединений являются фармацевтически приемлемыми; другие могут использоваться в качестве полупродуктов. Полупродукты и способы синтеза, раскрытые в настоящей заявке, и их незначительные видоизменения, также входят в объем настоящего изобретения. Защитные группы для гидроксила Защита для гидроксильной группы включает простые метиловые эфиры, замещенные метиловые эфиры, замещенные этиловые эфиры, замещенные бензиловые эфиры и силиловые эфиры. Замещенные простые метиловые эфиры Примеры замещенных простых метиловых эфиров включают метоксиметил, метилтиометил, третбутилтиометил, бензилоксиметил, n-метоксибензилоксиметил, (4-метоксифенокси)метил, третбутоксиметил. Замещенные простые этиловые эфиры Примеры замещенных простых этиловых эфиров включают 1-этоксиэтил, 1-метил-1-метоксиэтил,1-метил-1-бензилоксиэтил, 2,2,2-трихлорэтил, трет-бутил, аллил, n-хлорфенил, n-метоксифенил и бензил. Замещенные простые бензиловые эфиры Примеры замещенных простых бензиловых эфиров включают n-метоксибензил, 3,4 диметоксибензил, n-галогенбензил, 2,6-дихлорбензил, n-цианобензил, n-фенилбензил, дифенилметил. Сложные эфиры Кроме простых эфиров, гидроксильная группа может быть защищена как сложный эфир. Примеры сложных эфиров включают формиат, бензоилформиат, ацетат, трихлорацетат, трифторацетат, метоксиацетат, феноксиацетат, п-хлорфеноксиацетат, бензоат. Сульфонаты Примеры сульфонатов включают сульфат, метилульфонат (мезилат), бензилсульфонат и тозилат. Защитные аминогруппы Защита аминогруппы включает карбаматы, амиды и специальные защитные группы -NH. Примеры карбаматов включают метил и этилкарбаматы, замещенные этилкарбаматы, карбаматы с принудительным расщеплением, карбаматы с фотолитическим расщеплением, производные типа мочевин и смешанные карбаматы. Карбаматы Примеры метил и этилкарбаматов включают метил- и этил-, 9-флуоренилметил- и 4 метоксифенацилкарбаматы. Замещенные этилкарбаматы Примеры замещенных этилкарбаматов включают 2,2,2-трихлорэтил-, 2-фенилэтил-, трет-бутил-,винил-, аллил-, 1-изопропилаллил-, бензил-, n-метоксибензил-, n-нитробензил-, n-бромбензил-, nхлорбензил-, 2,4-дихлорбензил- и дифенилметилкарбаматы. Фотолитическое расщепление Примеры карбаматов с фотолитическим расщеплением включают м-нитрофенил-, 3,5 диметоксибензил-,о-нитробензил-,3,4-диметокси-6-нитробензили фенил(онитрофенил)метилкарбаматы. Амиды Примеры амидов включают N-формил-, N-ацетил-, N-трихлорацетил-, N-трифторацетил-, Nфенилацетил-, N-3-фенилпропионил-, N-пиколиноил-, N-3-пиридилкарбоксамид, N-бензоил-, N-пфенилбензоил- и фталоиламиды. Защита карбонильной группы Циклические ацетали и кетали Примеры циклических ацеталей и кеталей включает 1,3-диоксаны и 5-метилен-1,3-диоксан. Защита карбоксильной группы Сложные эфиры Замещенные сложные метиловые эфиры Примеры замещенных сложных метиловых эфиров включают 9-флуоренилметил, метоксиметил,метилтиометил, метоксиэтоксиметил, 2-(триметилсилил)этоксиметил, бензилоксиметил, фенацил, пбромфенацил, -метилфенацил и п-метоксифенацил. Примеры сложных эфиров также включают алкиловые эфиры, неразветвленные и разветвленные, такие как трет-бутил, этил, пропил, изопропил и бутил. Замещенные бензиловые эфиры Примеры замещенных эфиров включают трифенилметил, дифенилметил, 9-антрилметил, 2,4,6 триметилбензил, п-бромбензил, о-нитробензил, п-нитробензил, п-метоксибензил, 2,6-диметоксибензил,пиперонил, 4-пиколил и п-Р-бензил.-6 011089 Силиловые эфиры Примеры силиловых эфиров включают триметилсилил, триэтилсилил, трет-бутилдиметилсилил,изопропилдиметилсилил, фенилдиметилсилил и дитрет-бутилметилсилил. С. Способы синтеза Настоящее изобретение предоставляет способы получения описанных соединений, в соответствии с традиционными методами органического синтеза, а также с матричными и комбинаторными методами синтеза. Схемы 1-3 описывают предложенные пути синтеза. Применяя эти схемы, данные ниже рекомендации и примеры, специалист в данной области сможет разработать аналогичные или сходные методики для любого соединения, которое входит в объем настоящего изобретения. Общие указания, относящиеся к синтезу, даны в следующем разделе; конкретные примеры с подробным описанием экспериментов даны в разделе Е примеры. Вспомогательную информацию можно также найти в WO 02/02531 А 1, опубликованной 10 января 2002 и включена в настоящую заявку посредством ссылки. Специалисту в данной области будет очевидно, что синтезы соединений по настоящему соединению можно облегчить за счет приобретения промежуточных соединений или защищенных промежуточных соединений, которые приведены на каждой из схем, раскрытых в настоящей заявке. Далее, специалисту в данной области будет очевидно, что в ходе выполнения любой из методик, предназначенных для получения соединений по настоящему изобретению, может быть необходимо и/или желательно защитить чувствительные или реакционноспособные группы, принадлежащие любой из участвующих в синтезе молекул. Этого можно достичь за счет использования стандартных защитных групп, например, описанных в "Protective Groups in Organic Synthesis", John WileySons, 1991. Эти защитные группы могут быть удалены на подходящей стадии при использовании методов, известных в данной области. Примеры описанных путей синтеза включают примеры синтеза 1-16. Соединения, аналогичные целевым соединениям из указанных примеров, во многих случаях могут быть получены сходными путями. Описанные соединения полезны в основном исследовании, а также в качестве фармацевтических средств, как описано в следующем разделе. Получение соединения 7 основано на химических преобразованиях, разъясненных в WO 02/02531 А 1, и кратко описывается следующим образом. 3-бензил-3-формилметилциклогексен (коммерчески доступный или полученный по схеме 1 патента США 5753715) окисляют до соответствующей кислоты. Внутримолекулярная циклизация кислоты приводит к 3-оксо[5,5]спиро[4,5]бензоундец-2'-ену. Бекмановская перегруппировка кетона через стадию образования оксима приводит к региоизомерным лактамам,которые разделяют колоночной хроматографией с получением 4-аза-3-оксо-[6,5]спиро[5,6]бензоундец-2'ена. Для получения соответствующего бензазепина лактам восстанавливают. Можно защитить бензазепин, преобразовав его в тозилат, используя тозилхлорид и поглотитель кислоты, такой как пиридин или триэтиламин, в растворителе, таком как дихлорметан или дихлорэтан. В результате озонолиза может быть получен 3'-формилспиробензазепин. Окисление формильной группы до карбоновой кислоты обработкой известными окислителями, такими как дихромат пиридиния в диметилформамиде, за которым следует удаление тозильной группы обработкой минеральной кислотой, такой как хлористоводородная или бромистоводородная кислота. Селективная кристаллизация соли камфорсульфоновой кислоты может привести к (R)-спиробензазепинкарбоновой кислоте, которая затем в примере 1 может быть преобразована в соответствующий сложный этиловый эфир этерификацией Фишера. Соединения по настоящему изобретению, где R1 или R2 представляют собой Н, галоген или алкокси, могут быть получены с помощью реакций, показанных на схеме 1. Карбоновую кислоту общей формулы 1 можно приобрести или синтезировать способами, описанными в литературе, и затем защитить путем преобразования в сложный эфир общей формулы 2, обработкой, например, алкилирующим агентом, таким как диметилсульфат, и основанием, таким как карбонат кальция, в растворителе, таком как ацетон, при температуре от комнатной до температуры дефлегмации. Альтернативно, сложный эфир общей формулы 2 может быть синтезирован взаимодействием метанола и неорганической кислоты, такой как хлористо-водородная или серная, при температуре, находящейся в пределах от комнатной до приблизительно 60 С. Нитрогруппа в соединении общей формулы 2 может быть восстановлена в подходящих условиях до соответствующего амина общей формулы 3, таких как условия каталитического гидрирования в растворителе, таком как этилацетат, метанол или этанол, катализатором, таким как палладий на угле, газообразный водород при давлении от 1 до 20 атмосфер и при температуре, изменяющейся от комнатной до приблизительно 60 С. Амин общей формулы 3 преобразовывают в соответствующий амид общей формулы 5 с помощью подходящего замещенного бензоилхлорида общей формулы 4 и органического основания, такого как триэтиламин, в растворителе, таком как дихлорметан или дихлорэтан, при температуре от комнатной до приблизительно 60 С. Бензоилхлорид общей формулы 4 можно приобрести или синтезировать способами, известными в литературе для хлорангидридов кислот, или получить соответствующую карбоновую кислоту, преобразовав ее затем в хлорангидрид обработкой реагентами,такими как тионилхлорид или оксалилхлорид, либо в отсутствии растворителя, либо в растворителе, таком как дихлорметан или дихлорэтан, при температуре от комнатной до приблизительно 60 С. Сложный эфир общей формулы 5 может быть преобразован в хлорангидрид кислоты общей формулы 6 в две ста-7 011089 дии. Во-первых, эфир может быть гидролизован до карбоновой кислоты с помощью основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в воде и сорастворителе, таком как тетрагидрофуран, диоксан, этанол или любая комбинация растворителей, при температуре в пределах от комнатной до приблизительно 80 С. Во-вторых, карбоновую кислоту преобразовывают в хлорангидрид общей формулы 6 обработкой реагентом таким как тионилхлорид или оксалилхлорид, либо в отсутствии растворителя, либо в растворителе, таком как дихлорметан или дихлорэтан, при температурах от комнатной до приблизительно 60 С. Полученный хлорангидрид кислоты обрабатывают соединением 7 в слабом органическом основании, таком как триэтиламин, в растворителе, таком как дихлорметан или дихлорэтан, при температуре, находящейся в пределах от комнатной до приблизительно 60 С, получая соединение общей формулы 8. Продукты общей формулы 9 а получают из соединений общей формулы 8 гидролизом под действием оснований, таких как гидроксид лития, гидроксид натрия или гидроксид калия в воде и подходящем сорастворителе, таком как тетрагидрофуран, диоксан, этанол или любая комбинация растворителей, при температуре, находящейся в диапазоне от комнатной до приблизительно 80 С. Обработка минеральной кислотой, такой как хлористо-водородная кислота, в водной среде приводит к конечному продукту общей формулы 9 а. Схема 1 Соединения по настоящему изобретению, где R1 или R2 представляют собой Н, галоген или алкокси, также могут быть получены с помощью реакций, представленных на схеме 2. Карбоновую кислоту общей формулы 1 можно приобрести или синтезировать способами, описанными в литературе, затем преобразовать в соответствующий хлорангидрид общей формулы 10, обработкой реагентами, такими как тионилхлорид или оксалилхлорид, либо в отсутствии растворителя, либо в растворителе, таком как дихлорметан или дихлорэтан, при температуре, находящейся в пределах от комнатной до приблизительно 60 С. Соединение общей формулы 10 может быть обработано соединением 7 и органическим основанием, таким как триэтиламин, в растворителе, таком как дихлорметан или дихлорэтан, при температуре,находящейся в диапазоне от комнатной до приблизительно 60 С, с получением соединения общей формулы 11. В соединениях общей формулы 11 нитрогруппа может быть восстановлена до аминогруппы, с образованием соединений общей формулы 12, с помощью реагентов, таких как хлорид олова (II), в спиртовых растворителях, таких как метанол, этанол, пропанол и им подобные, с учетом того, что если R2 представляет собой алкоксидную группу, продукт реакции может представлять собой смесь исходных алкоксидов и алкоксидов спиртового растворителя. Соединение общей формулы 12 можно преобразовать в продукт общей формулы 9 а в две стадии. Во-первых, амин может быть преобразован в соответствующий амид обработкой хлорангидридом кислоты общей формулы 4 (из описания схемы 1) и органическим основанием, таким как триэтиламин, в растворителе, таком как дихлорметан или дихлорэтан, при-8 011089 температуре, находящейся в пределах от комнатной до приблизительно 60 С. Образовавшийся полупродукт может быть обработан основанием, таким как гидроксид лития, гидроксид натрия или гидроксид калия, в воде и подходящем сорастворителе, таком как тетрагидрофуран, диоксан, этанол или некоторой комбинации растворителей, при температуре, находящейся в пределах от комнатной до приблизительно 80 С. Обработка минеральной кислотой, такой как хлористо-водородная кислота, в водной среде приводит к конечному продукту общей формулы 9 а. Схема 2 Соединения по настоящему изобретению, где R1 или R2 представляют собой гидроксигруппу, могут быть получены с помощью реакций, приведенных в общем виде на схеме 3. Кислоту общей формулы 13 можно обработать хлорангидридом общей формулы 4 (из описания схемы 1) и органическим основанием, таким как триэтиламин, в растворителе, таком как дихлорметан или дихлорэтан, при температуре,находящейся в диапазоне от комнатной до приблизительно 60 С, получая соединения общей формулы 14. Соединение общей формулы 15 может быть получено обработкой реагентом, таким как тионилхлорид или оксалилхлорид либо в отсутствии растворителя, либо в растворителе, таком как дихлорметан или дихлорэтан, при температурах, находящихся в диапазоне от комнатной до приблизительно 60 С. Соединение общей формулы 15 может быть обработано соединением 7 и органическим основанием, таким как триэтиламин, в растворителе, таком как дихлорметан или дихлорэтан, при температуре, находящейся в пределах от комнатной до приблизительно 60 С, с получением соединения общей формулы 16. Продукты общей формулы 9b могут быть получены из соединений общей формулы 16 гидролизом в присутствии основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в воде и сорастворителе, таком как тетрагидрофуран, диоксан, этанол или любая комбинация растворителей, при температуре, находящейся в пределах от комнатной до приблизительно 80 С. Обработка минеральной кислотой, такой как хлористо-водородная кислота, в водной среде может привести к образованию конечного продукта общей формулы 9b. Соединения по настоящему изобретению, где R1 или R2 представляют собой аминогруппу или замещенную аминогруппу, могут быть получены с помощью реакций, представленных в общем виде на схеме 4. Соединения общей формулы 17 описаны в литературе, и их можно преобразовать в соединения общей формулы 18 обработкой метанолом и каталитическим количеством неорганической кислоты, такой как серная или хлористо-водородная кислота, при температурах, находящихся в пределах от комнатной до приблизительно 60 С. Затем могут быть получены соединения общей формулы 19 путем обработки 50-100% водным гидразином при температурах, находящихся в пределах от комнатной до приблизительно 80 С. Затем соединения общей формулы 19 можно преобразовать в соединения общей формулы 20, с помощью реагента, такого как (ВОС)2 О, при комнатной температуре. Восстановление до соединений общей формулы 21 может быть достигнуто гидрированием с катализатором, таким как палладий на угле и газообразный водород при давлении от 1 до 20 атм, в растворителе, таком как метанол, этанол,этилацетат и т.п., при температуре, находящейся в диапазоне от комнатной до приблизительно 50 С. Соединения общей формулы 21 могут быть ацилированы соединениями общей формулы 4 (из описания схемы 1) в присутствии органического основания, такого как триэтиламин, в растворителе, таком как дихлорметан или дихлорэтан, при температурах, находящихся в диапазоне от комнатной до приблизительно 60 С, с получением соединений общей формулы 22. Омыление до соединений общей формулы 23 может быть осуществлено с помощью основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в воде и подходящем сорастворителе, таком как тетрагидрофуран, диоксан, этанол или любая комбинация растворителей, при температурах, находящихся в пределах от комнатной до приблизительно 80 С. Реакция сочетания соединения общей формулы 23 и соединения 7, приводящая к соединениям общей формулы 24, может быть выполнена с помощью карбодиимидных агентов сочетания, таких как DCC (дициклогексилкарбодиимид) или EDC (1-(3-диметиламинопропил)-3-этилкарбодиимид), в растворителе, таком как дихлорметан, дихлорэтан или бензол, при температурах от комнатной до 40 С. Соединения общей формулы 25, где R5 и R6 представляют собой Н, могут быть получены из соединений общей формулы 24 обработкой минеральной кислотой, такой как хлористо-водородная кислота или серная кислота, в растворителях, таких как метанол, этанол, этилацетат и т.п., при температурах, находящихся в пределах от комнатной до приблизительно 40 С. Соединения общей формулы 25, где R5 и R6 представляют собой метил, этил или пропил, могут быть получены обработкой соединений общей формулы 24, как описано выше, с последующим восстановительным аминированием в условиях, которые способствуют моноалкилированию или диалкилированию, с помощью формальдегида, ацетальдегида или пропионового альдегида и затем восстанавливающего реагента, такого как цианоборгидрид натрия, в растворителе, таком как метанол, этанол, тетрагидрофуран, диоксан и т.п., при температурах от 0 до приблизительно 40 С. Продукты общей формулы 9 с могут быть получены из соединений общей форму- 10011089 лы 25 омылением в присутствии основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в воде и подходящем сорастворителе, таком как тетрагидрофуран, диоксан, этанол или некоторой комбинация растворителей, при температуре, находящейся в диапазоне от комнатной до приблизительно 80 С. Обработка минеральной кислотой, такой как хлористо-водородная кислота, в водной среде может привести к конечному продукту общей формулы 9 с. Схема 4D. Применение и композиции Соединения формулы I полезны для лечения таких состояний, как гипертензия, гипонатриемия, закупорка сосудов сердца/сердечная недостаточность, спазм коронарных сосудов, ишемия сердца, цирроз печени, спазм почечных сосудов, почечная недостаточность, диабетическая нефропатия, отек мозга,ишемия мозга, инсульт, тромбоз и отечность. Применимость может быть изучена в соответствии с методиками, известными в данной области, такими как описано ниже в настоящей заявке в качестве биологических примеров 1-3. Следовательно, настоящее изобретение предоставляет способ лечения любого из перечисленных выше состояний у субъекта, нуждающегося в этом, включающий введение соединения формулы I в фармацевтически эффективном количестве. Соединение может быть введено пациенту любым обычным путем, включая, но, не ограничиваясь перечисленным, внутривенный, пероральный, подкожный, внутримышечный, внутрикожный и парентеральный. Настоящее изобретение также предоставляет фармацевтические композиции, содержащие одно или несколько соединений, например, два, три или четыре соединения по настоящему изобретению в сочетании с фармацевтически приемлемым носителем. Для получения фармацевтических композиций по настоящему изобретению одно или несколько соединений формулы I или, например, их солей, в качестве активного ингредиента(ов) тщательно смешивают с фармацевтическим носителем в соответствии с обычными фармацевтическими методами смешивания. Форма носителя зависит от пути введения, например перорального или парентерального, такого как внутримышечный. При получении композиций в виде пероральной дозированной формы может быть применена любая из обычных фармацевтических сред. Соответственно, для жидких пероральных препаратов, таких как суспензии, эликсиры и растворы,подходящие носители и добавки включают воду, гликоли, масла, спирты, вкусовые добавки, консерванты, красители и т.п.; для твердых пероральных препаратов, таких как, например, порошки, капсулы, таблетки в виде капсул, гелевые капсулы и таблетки, подходящие носители и добавки включают крахмалы,сахара, разбавители, гранулирующие средства, смазывающие средства, связующие средства, дезинтегрирующие средства и т.п. Благодаря легкости введения таблетки и капсулы представляют собой более пре- 11011089 имущественные пероральные дозированные формы и в этом случае в основном применяют твердые фармацевтические носители. При необходимости, таблетки могут быть покрыты сахаром или покрытием,растворимым в кишечнике, изготовленным по стандартным методикам. Для парентеральных препаратов,носитель, как правило, включает стерильную воду, хотя могут быть включены и другие ингредиенты,например, для таких целей, как увеличение растворимости или сохранность. Могут быть также получены суспензии, предназначенные для инъекций, и в этом случае могут быть применены подходящие жидкие носители, суспендирующие средства и т.п. Фармацевтические композиции по настоящему изобретению будут содержать на единицу дозировки, например, таблетку, капсулу, порошок, инъекцию, чайную ложку и т.п., количество активного ингредиента, которое необходимо для введения эффективной дозы, как описано выше. Фармацевтические композиции по настоящей заявке будут содержать на единицу дозировки, например, таблетку, капсулу, порошок, инъекцию, суппозиторий, чайную ложку и т.п., от приблизительно 0,1 мг до 1 г активного ингредиента(ов). Не ограничивающие примеры включают дозировки 0,2, 0,5, 0,75, 1, 1,2, 1,5, 2, 3, 5, 7, 10, 25, 50, 100, 250 и 500 мг. Эти дозировки, однако, могут быть изменены в зависимости от того, что требуется пациенту, тяжести состояния, которое подвергают лечению, и применяемого соединения. Можно применять или ежедневное введение, или более редкое дозирование. Данные композиции, предпочтительно, представляют собой единичные дозированные формы, такие как таблетки, пилюли, капсулы, порошки, гранулы, стерильные парентеральные растворы или суспензии, дозированные аэрозоли или жидкие спреи, капли, ампулы, устройства для аутоинъекций или суппозитории; для перорального, парентерального, интраназального, сублингвального или ректального введения или для введения путем ингаляции и инсуффляции. Альтернативно, композиция может быть представлена в форме, подходящей для введения раз в неделю или месяц, например, нерастворимая соль активного соединения, такая как. соль декановой кислоты, может быть адаптирована для получения депо препарата для внутримышечной инъекции. Для получения твердой композиции, такой как таблетки, основной активный ингредиент смешивают с фармацевтическим носителем, например обычными ингредиентами для таблетирования, такими как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеариновая кислота, стеарат магния, дикальцийфосфат или камедь, и другими фармацевтическими разбавителями, например водой, с образованием твердой предварительной композиции, содержащей гомогенную смесь соединения по настоящему изобретению или его фармацевтически приемлемой соли. Когда предварительные композиции называют гомогенными, это означает, что активный ингредиент равномерно диспергирован по всему объему композиции так, что композиция может быть легко разделена на одинаково эффективные дозированные формы, такие как таблетки, пилюли и капсулы. Эти твердые предварительные композиции затем делят на единичные дозированные формы описанных выше типов, которые содержат от 0,1 до приблизительно 1000 мг или более активного ингредиента по настоящему изобретению. Таблетки или пилюли, изготовленные из описанных композиций, могут быть покрыты или составлены другим способом для получения дозированных форм, предоставляющих преимущественно пролонгированное действие. Например, таблетка или пилюля может содержать внутренний дозирующий компонент и внешний дозирующий компонент, причем последний является оболочкой поверх первого. Два компонента могут быть разделены растворимым в кишечнике слоем, который служит для сопротивления дезитеграции в желудке и позволяет внутреннему компоненту попасть в двенадцатиперстную кишку целиком или обеспечить задержку высвобождения активного ингредиента. Для подобных растворимых в кишечнике слоев или покрытий могут быть применены различные материалы, такие как материалы,включающие ряд полимерных кислот, с материалами, такими как шеллак, цетиловый спирт и ацетат целлюлозы. Жидкие лекарственные формы, в которые могут быть включены новые композиции по настоящему изобретению, для перорального введения или введения с помощью инъекции включают жидкие растворы, сиропы с подходящим вкусом, водные или масляные суспензии и ароматизированные эмульсии, которые содержат съедобные масла, такие как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и подобные фармацевтические средства доставки. Подходящие диспергирующие или суспендирующие средства для водных суспензий включают синтетические и природные камеди, такие как трагакант, гиммиарабик, альгинат, декстран, натриевая соль карбоксиметилцеллюлозы, метилцеллюлоза, поливинилпирролидон или желатин. Если способы получения соединений по настоящему изобретению приводят к возникновению смеси стереоизомеров, эти изомеры могут быть разделены с использованием обычных методик, таких как препаративная хроматография. Соединения могут быть получены в рацемической форме или индивидуальные энантиомеры можно получить или энантиоспецифическим, или энантиоселективным синтезом или обратным растворением. Соединения могут быть, например, разделены на их энантиомерные компоненты с помощью стандартных методов, таких как образование пар диастереомеров через получение солей. Соединения также могут быть разделены с помощью образования диастереомерных сложных эфиров или амидов, с последующим хроматографическим разделением и удалением вспомогательного хирального соединения. Альтернативно, соединения могут быть разделены с использованием стереогенной ВЭЖХ колонки. Соединения по настоящему изобретению могут преимущественно вводиться в виде одной дозы- 12011089 ежедневно или общая дневная доза может вводиться в виде отдельных доз два, три или четыре раза в день, или же раз в неделю, раз в две недели или один раз в месяц. Более того, соединения по настоящему изобретению могут вводиться в интраназальной форме с помощью местного применения подходящих интраназальных средств доставки или с помощью трансдермальных кожных пластырей, хорошо известных обычному специалисту в данной области техники. При введении в форме трансдермальной системы доставки процесс введения дозы будет, безусловно, непрерывным, а не прерывистым, как это происходит при обычных режимах дозировки. В случае, например, перорального введения в форме таблеток или капсул, активный ингредиент лекарственного средства может быть объединен с пероральным, нетоксичным, фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и т.п. Кроме того, если это желательно или необходимо, в состав смеси также могут быть включены подходящие связующие вещества, смазывающие средства, дезинегрирующие средства и красители. Подходящие связующие вещества включают, не ограничиваясь перечисленным, крахмал, желатин, природные сахара, такие как глюкоза или беталактоза, гранулированные подсластители, природные и синтетические разновидности камеди, такие как гуммиарабик, трагакант или олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия,хлорид натрия и т.п. Дезинтегрирующие средства включают, не ограничиваясь перечисленными, крахмал, метилцеллюлозу, агар, бентонит, ксантановую смолу и т.п. Жидкие лекарственные формы могут быть реализованы в подходящим образом ароматизированных суспендирующих или диспергирующих средствах, таких как синтетические и природные камеди, например трагакант, гуммиарабик, метилцеллюлоза и т.п. Для парентерального введения желательны стерильные суспензии или растворы. В случае, когда желательно внутривенное введение, применяют изотонические препараты, которые, как правило, содержат подходящие консерванты. Соединения по настоящему изобретению также могут вводиться в форме липосомных систем доставки, таких как небольшие однослойные носители, большие однослойные носители и многослойные носители. Липосомы могут быть образованы из разнообразных фосфолипидов, таких как холестерин,стеариламин или фосфатидилхолины. Доставка соединений по настоящему изобретению также может быть осуществлена с применением моноклональных антител, в качестве индивидуальных носителей, к которым присоединены молекулы соединений. Соединения по настоящему изобретению также могут быть объединены с растворимыми полимерами в качестве самонацеливающихся носителей лекарственного средства. Такие полимеры могут включать поливинилпирролидон, сополимеры пирана, полигидроксипропилметакриламидфенол, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенный остатком пальмитиновой кислоты. Более того, соединения по настоящему изобретению могут быть объединены с полимерами из класса биоразлагаемых полимеров, которые применяют для достижения управляемого высвобождения лекарственного средства, например, с полимолочной кислотой, полиэпсилон-капролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, полидигидропиранами, полицианоакрилатами и поперечно-сшитыми или амфипатическими блок-сополимерами гидрогелей. Соединения по настоящему изобретению могут вводиться в составе любой из описанных выше композиций и в соответствии с режимами дозировки, установленными в данной области, всякий раз, когда требуется лечение какого-либо расстройства, связанного с сосудистой резистентностью. Предназначенные для введения оптимальные дозировки могут быть легко определены специалистом в данной области, и они будут меняться вместе с конкретным применяемым соединением, способом введения, силой препарата и степенью развития болезненного состояния. В дополнение, факторы, которые связаны с конкретным пациентом, подвергаемым лечению, включая возраст, массу, рацион питания и время введения, будут приводить к необходимости корректировать дозировку. Следующие примеры предназначены для иллюстрации изобретения, но не для его ограничения. Е. Примеры Пример 1. (R)-3-Карбоэтокси-4-аза[6,4]спиро[5,6]бензоундец-2'-ен (7) К раствору (R)-спиробензазепинкарбоновой кислоты (4 г, 16,5 ммоль) в 200 мл этанола добавляют концентрированную серную кислоту (3,35 г, 33 ммоль) и полученную реакционную смесь оставляют перемешиваться при комнатной температуре в течение 16 ч. Реакционную смесь концентрируют в вакууме и остаток, забранный в дихлорметан (200 мл), промывают насыщенным раствором бикарбоната натрия(200 мл), затем насыщенным NaCl (200 мл), полученные дихлорметановые экстракты сушат над безвод- 13011089 ным сульфатом натрия и концентрируют в вакууме. Хроматография (SiO2, элюент 25% этилацетатгексан) приводит к получению 4,25 г соединения 7 в виде прозрачного масла (теоретический выход 4,47 г, реальный выход 95%). 1 Н ЯМР (CDCl3)7,0 (м, 2 Н), 6,8 (м, 1 Н), 6,7 (м, 1 Н), 6,6 (с, 1 Н), 4,25 (кв, 2 Н), 3,15 (м, 1 Н), 3,05 (м,1 Н), 2,9 (м, 1 Н), 2,7 (м, 1 Н), 1,8 (м, 4 Н). МС (ES) m/z 272 (МН)+. Пример 2. К раствору сложного эфира 7 (4,2 г, 15 ммоль) и триэтиламина (6 г, 60 ммоль) в дихлорметане (200 мл) при 0 С добавляют 4-нитро-3-метоксибензоилхлорид (6,6 г, 30,7 ммоль) и полученную смесь оставляют перемешиваться на 2 ч при нагревании до комнатной температуры. Реакционную смесь выливают в холодный 1 н. хлорид натрия и экстрагируют дихлорметаном (2200 мл). Объединенные дихлорметановые экстракты промывают NaCl, сушат над безводным сульфатом натрия и концентрируют в вакууме,получая 5,2 г соединения 26 в виде прозрачного масла (теоретический выход 6,7 г, реальный выход 77%). К раствору соединения 26 (5,2 г, 11,5 ммоль) в этаноле (200 мл) добавляют SnCl2 (7,7 г, 38 ммоль) и полученную реакционную смесь оставляют перемешиваться при кипячении с обратным холодильником в течение 16 ч. Реакционную смесь гасят насыщенным раствором бикарбоната натрия (20 мл) и экстрагируют дихлорметаном. Объединенные дихлорметановые экстракты сушат над безводным сульфатом натрия и концентрируют в вакууме. Хроматография (SiO2, элюент 50% этилацетат-гексан) приводит к получению 1,5 г соединения 27 а в виде не совсем белого твердого вещества [MC(ES) m/z 421 (МН)+] и 1 г твердого желтого вещества 27b. MC(ES) m/z 435 (МН)+. Пример 4.(400 мл) при комнатной температуре добавляют 2-хлор-5-фторбензоилхлорид (2,85 г, 14,85 ммоль) и полученную реакционную смесь оставляют перемешиваться в течение 16 ч. Затем реакционную смесь выливают в 1 н NaOH (200 мл) и экстрагируют дихлорметаном. Объединенные дихлорметановые экстракты промывают насыщенным раствором NaCl, сушат над сульфатом натрия и концентрируют в вакууме.- 14011089 Хроматография (SiO2, элюент 50% этилацетат-гексан) приводит к получению 2,26 г соединения 28 в виде белой пены (теоретический выход 5,70 г, реальный выход 40%). MC(ES) m/z 577 (МН)+. Пример 5. К раствору этилового эфира 28 (2,26 г, 3,92 ммоль) в тетрагидрофуране (75 мл) при комнатной температуре добавляют раствор гидроксида лития (1,2 г, 28,6 ммоль) в 50 мл воды и полученную смесь оставляют перемешиваться в течение 24 ч. Реакционную смесь выливают в 1 н. HCl (75 мл) и экстрагируют этилацетатом (3100 мл). Объединенные органические экстракты промывают насыщенным растворомNaCl, сушат над безводным сульфатом натрия и концентрируют в вакууме, получая 1,75 г соединения 29 в виде бледно-желтого твердого вещества (Теоретический выход 2,15 г, реальный выход 81%). 1 Н ЯМР (CDCl3)8,7 (с, 1 Н), 8,25 (д, 1 Н), 7,5 (м, 1 Н), 7,4 (м, 1 Н), 7,3-7,1 (м, 2 Н), 7,0 (с, 1 Н), 6,95 (с,1 Н), 6,7 (м, 1 Н), 4,9 (м, 1 Н), 3,7 (с, 3 Н), 3,1 (м, 1 Н), 2,7 (м, 3 Н), 2,1 (м, 2 Н), 1,75 (м, 2 Н). К раствору соединения 27b (4 34 мг, 1 ммоль) и триэтиламина (0,56 мл, 4 ммоль) в 50 мл дихлорметана при 0 С добавляют 2-хлор-5-фторбензоилхлорид (229 мг, 1,5 ммоль) и полученную реакционную смесь оставляют при перемешивании на 2 ч, при нагревании до комнатной температуры. Реакционную смесь выливают в 1 н. NaOH и экстрагируют дихлорметаном (2200 мл). Объединенные дихлорметановые экстракты промывают насыщенным раствором NaCl, сушат над сульфатом натрия и концентрируют в вакууме, получая 500 мг соединения 30 в виде твердого белого вещества (теоретический выход 591 мг,реальный выход 85%). MC(ES) m/z 591 (МН)+. Пример 7. К раствору этилового эфира 30 (400 мг, 0,68 ммоль) в тетрагидрофуране (25 мл) при комнатной температуре добавляют раствор гидроксида лития (64,5 мг, 2,7 ммоль) в 25 мл воды и полученную реакционную смесь оставляют перемешиваться в течение 16 ч. Реакционную смесь выливают в 1 н. HCl (10- 15011089 мл) и экстрагируют этилацетатом (350 мл). Объединенные органические экстракты промывают насыщенным раствором NaCl, сушат над безводным сульфатом натрия и концентрируют в вакууме, получая 300 мг соединения 31 в виде воскообразного твердого вещества (теоретический выход 381 мг, реальный выход 79%). 1 Н ЯМР (CDCl3)8,95 (с, 1 Н), 8,25 (д, 1 Н), 7,6 (м, 1 Н), 7,4 (м, 1 Н), 7,2 (м, 1 Н), 7,1 (м, 1 Н), 7,0 (м,1 Н), 6,95 (с, 1 Н), 6,85 (с, 1 Н), 6,7 (м, 1 Н), 6,55 (с, 1 Н), 4,85 (м, 1 Н), 3,95 (м, 2 Н), 3,3 (м, 1 Н), 3,15-2,9 (м,1 Н), 2,8-2,6 (м, 3 Н), 2,15-1,95 (м, 2 Н), 1,8-1,5 (м, 2 Н). В 5-литровую трехгорлую круглодонную колбу, снабженную верхней мешалкой и 250-мл капельной воронкой, загружают 3-гидрокси-4-нитробензойную кислоту (122 г, 0,66 моль), ацетон (химически чистый, 1,5 л) и порошкообразный K2 СО 3 (185 г). К перемешиваемой суспензии по каплям добавляют диметилсульфат (127 мл). Суспензию перемешивают при комнатной температуре в течение 18 ч и фильтруют. Фильтрат концентрируют при пониженном давлении приблизительно до половины объема(750 мл), переносят в 3-литровый химический стакан и при перемешивании добавляют воду (1 л). Осажденное вещество собирают фильтрованием и сушат в вакууме, получая указанное в заголовке данного примера соединение 32 в виде белого кристаллического вещества, т.пл. 87-88 С. 1 Н ЯМР (400 MHz, CDCl3) : 7,77 (д, 1 Н), 7,68 (д, 1 Н), 7,63 (д, 1 Н), 3,94 (с, 3 Н), 3,90 (с, 3 Н). MC(ES) В 2-литровый сосуд Парра для гидрирования при высоком давлении (номинальное давление 80 psi) загружают Pd/C (10 мас.% на угле, 5 г), этилацетат (800 мл) и соединение 32 (120,5 г, 0,57 моль). Реакционную смесь насыщают Н 2 (30 psi) на аппарате Парра. Подачу Н 2 осторожно продолжают некоторое время, до тех пор, пока давление остается неизменным. Это занимает приблизительно 3 ч. Реакционную смесь встряхивают еще в течение 0,5 ч. После завершения гидрирования реакционную смесь разбавляют этилацетатом, для растворения некоторых из осажденных продуктов, сразу пропускают через тонкий слой целита и промывают этилацетатом. Растворитель выпаривают и получают метиловый эфир 4 амино-3-метоксибензойной кислоты 33 в виде белого твердого вещества. 1 В сухую 3-литровую трехгорлую круглодонную колбу, снабженную термометром и капельной воронкой, помещают раствор соединения 33 (96 г, 0,53 моль, 1,0 эквивалент) и Et3N (88 мл, 0,64 моль, 1,2 эквивалента) в дихлорметане (1,2 л). Раствор охлаждают до 0 С на ледяной бане и при этой температуре в течение 40 мин по каплям добавляют 2-хлор-5-фторбензоилхлорид (110 г, 0,57 моль, 1,05 эквивалента). После добавления реакционную смесь перемешивают при 0 С еще 1,5 ч. Органический слой три раза промывают раствором соли, сушат над MgSO4, фильтруют и упаривают, получая метиловый эфир 4-(2 хлор-5-фторбензоиламино)-3-метоксибензойной кислоты 34 в виде твердого белого вещества.LiOH (14,1 г, 0,59 моль, 1,1 эквивалент), растворенный в Н 2 О (200 мл) в течение 45 мин добавляют по каплям к раствору соединения 34 (180 г, 0,53 моль, 1 эквивалент) в 1800 мл тетрагидрофурана при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 16 ч. Растворитель выпаривают при пониженном давлении и остаток повторно растворяют в воде (приблизительно 3 л). Нерастворимое твердое вещество отфильтровывают. При энергичном перемешивании отфильтрованный водный раствор подкисляют концентрированным водным раствором НСl (37%) до рН 2. Полученный белый твердый осадок отфильтровывают и промывают водой. Затем осадок на фильтре переносят в колбу и сушат на роторном испарителе в вакууме при 50 С в течение ночи, получая 4-(2-хлор 5-фторбензоиламино)-3-метоксибензойную кислоту 35 в виде сухого, тонкодисперсного белого порошка. 1 Н ЯМР (400 MHz, ДМСО-d6) : 12,90 (с, 1 Н), 10,01 (с, 1 Н), 8,22 (д, 1 Н), 7,65-7,45 (м, 4 Н), 7,45-7,30 Соединение 35 (152 г, 0,45 моль, 1 эквивалент) суспендируют в дихлорметане (1,5 л) и добавляют диметилформамид (1 мл). В течение 30 мин при 0 С по каплям добавляют оксалилхлорид (71,6 г, 0,56 моль, 1,2 эквивалента). После добавления охлаждающую баню удаляют и затем перемешивают реакционную смесь при комнатной температуре в течение 3,5 ч. Растворитель и не вступивший в реакцию оксалилхлорид выпаривают, получая белое твердое вещество, которое затем сушат на роторном испарителе в вакууме при 40 С в течение ночи, получая сухой 4-(2-хлор-5-фторбензоиламино)-3 метоксибензоилхлорид 36 в виде твердого белого вещества. 1 Н ЯМР (400 MHz, CDCl3) : 8,97 (с, 1 Н), 8,71 (д, 1 Н), 7,91 (дд, 1 Н), 7,60 (д, 1 Н), 7,57 (дд, 1 Н), 7,47(дд, 1 Н), 7,21-7,15 (м, 1 Н), 3,99 (с, 3 Н). МС (ES) m/z 339,9 (МН)+. Способом, аналогично описанному в примере 12, 4-(2-хлор-5-фторбензоиламино)-3 метоксибензойную кислоту суспендируют в дихлорэтане и проводят реакцию, получая 4-(2-хлор-5 фторбензоиламино)-3-метоксибензоилхлорид в виде твердого белого вещества. Пример 13. (R)-1,2,3,5-тетрагидроспиро[4 Н-1-бензазепин-4,1'-[2]циклопентен]-3'-карбоновая кислота (37) В трехгорлой 5-литровой круглодонной колбе, снабженной мешалкой на основе воздушного насоса,в 2 л воды суспендируют (1R, 4S)-7,7-диметил-2-оксобицикло[2.2.1]гептанметансульфонат (4R)-2,3,4,5 тетрагидробензазепин-4-спиро-3'-циклопент-1'-енкарбоновой кислоты (500 г, 1,05 моль), получая реакционную смесь с рН приблизительно 3-4. С помощью капельной воронки к смеси медленно прибавляют- 17011089 насыщенный водный раствор NaHCO3 до достижения рН 6. Затем добавляют дихлорметан (1 л) и суспензию перемешивают в течение 1 ч. Затем отфильтровывают все оставшиеся исходные вещества. Слои разделяют и водный слой экстрагируют дихлорметаном (2150 мл). Объединенные органические слои сушат Na2SO4, фильтруют и концентрируют, получая (4R)-1,2,3,5-тетрагидроспиро[4 Н-1-бензазепин-4,1'[2]циклопентен]-3'-карбоновую кислоту 37 в виде темно-серого твердого вещества. В отношении оставшегося исходного вещества описанную методику повторяют снова, пока соль не будет полностью превращена в свободную кислоту. Все порции неочищенной (4R)-1,2,3,5-тетрагидроспиро[4 Н-1-бензазепин 4,1'-[2]циклопентен]-3'-карбоновой кислоты объединяют, суспендируют в смеси этилацетат/гексан (1:1),перемешивают в течение ночи при комнатной температуре и затем фильтруют, получая (4R)-1,2,3,5 тетрагидроспиро[4 Н-1-бензазепин-4,1'-[2]циклопентен]-3'-карбоновую кислоту 37 в виде твердого серого вещества с выходом 88%. 1 Н ЯМР (400 MHz, CDCl3) : 7,09-7,01 (м, 2 Н), 6,76 (т, 1 Н), 6,77 (с, 1 Н), 6,72 (д, 1 Н), 3,17-3,14 (м,1 Н), 3,07-3,05 (м, 1 Н), 2,82 (дд, 2 Н), 2,71-2,54 (м, 2 Н), 1,92-1,68 (м, 4 Н). К раствору нитросоединения 7 (200 мг, 0,34 ммоль) в изопропаноле (50 мл) добавляют SnCl2 (128 мг, 0,68 ммоль) и полученную реакционную смесь оставляют перемешиваться при кипячении с обратным холодильником в течение 16 ч. Реакционную смесь гасят насыщенным раствором бикарбоната натрия (20 мл) и экстрагируют дихлорметаном. Объединенные дихлорметановые экстракты сушат над безводным сульфатом натрия и концентрируют в вакууме. Хроматография (SiO2, элюент этилацетат) приводит к получению 56 мг соединения 38 в виде не совсем белого твердого вещества (190 мг теоретический выход, реальный выход 30%). MC(ES) m/z 440 (МН)+. Пример 15. (R)-4-(2-Хлор-5-фторбензоил-3-изопропокси-4-аминобензоил)-4-аза-3'-(карбометокси)[6,4]спиро[5,6]бензоундец-2'-ен (39)(25 мл) при комнатной температуре добавляют 2-хлор-5-фторбензоилхлорид (39 мг, 0,23 ммоль) и полученную реакционную смесь оставляют перемешиваться в течение 16 ч. Затем реакционную смесь выливают в 1 н. NaOH (50 мл) и экстрагируют дихлорметаном. Объединенные дихлорметановые экстракты промывают насыщенным раствором NaCl, сушат над сульфатом натрия и концентрируют в вакууме. Хроматография (SiO2, элюент 50% этилацетат-гексан) приводит к получению 80 мг соединения 39 в виде белой пены, которую без дальнейшей очистки используют на следующей стадии синтеза. Пример 16. К раствору этилового эфира 39 (80 мг, 0,15 ммоль) в 10 мл тетрагидрофурана при комнатной температуре добавляют раствор гидроксида лития (18 мг, 0,75 ммоль) в 10 мл воды и полученную реакционную смесь оставляют перемешиваться в течение 24 ч. Затем реакционную смесь выливают в 1 н. HCl (25 мл) и экстрагируют этилацетатом (350 мл). Объединенные органические экстракты промывают насыщенным раствором NaCl, сушат над безводным сульфатом натрия и концентрируют в вакууме, получая 51 мг соединения 40 в виде бледно-желтого твердого вещества (теоретический выход 64 мг, реальный выход 80%). 1 Н ЯМР (CDCl3)8,7 (с, 1 Н), 8,25 (д, 1 Н), 7,5 (м, 1 Н), 7,4 (м, 1 Н), 7,3-7,1 (м, 2 Н), 7,0 (с, 1 Н), 6,95 (с,1 Н), 6,7 (м, 1 Н), 4,9 (м, 1 Н), 4,4 (м, 1 Н), 3,1 (м, 1 Н), 2,7 (м, 3 Н), 2,1 (м, 2 Н), 1,75 (м, 2 Н), 1,3 (д, 3 Н), 1,1 (д,3 Н).(А) Исследование связывания in vitro Буферный раствор для исследования представляет собой смесь 50 мМ Tris-Cl, 5 мМ MgCl2, 0,1%(гидрохлорид 4-(2-аминоэтил)бензолсульфонилфторида, производимый Roche Diagnostics Corporation,Indianapolis, IN и распространяемый Boehringer Mannheim). Вазопрессин Н 3 представляет собой 3 Наргинин-8-вазопрессин (NEN Life Sciences, Boston, MA; 68,5 Кюри/ммоль, конечная концентрация в исследовании составляет 0,65-0,75 нМ). В лунки 96-луночного круглодонного полипропиленового планшета добавляют буфер, испытуемое соединение, мембрану (содержащую человеческий V1a или V2 рецептор) и вазопрессин Н 3. Реакционные планшеты оставляют стоять при комнатной температуре в течение одного часа. Образцы фильтруют через пластины Unifilter GF/C (PerkinElmer Life Sciences, Boston, MA),предварительно выдержанные в 0,3 полиэтиленимине. Пластины промывают 5 раз охлажденным физиологическим солевым раствором, содержащим 0,05% Tween 20. После высушивания дно фильтровальных пластин запечатывают и к каждому фильтру добавляют 0,025 мл Microscint-20 (Packard Instrument Co,Meriden, CT). Запечатывают верхние части пластин и подсчитывают импульсы радиоактивной метки. Неспецифическое связывание определяют добавлением 1,25 мкМ аргинин-8-вазопрессина в те же лунки.% ингибирования рассчитывают по следующей формуле:(В) Функциональная активность в отношении рецептора вазопрессина V1a Рецептор V1a представляет собой рецептор, связывающийся с G-белками, который в случае активации инициирует увеличение внутриклеточной мобилизации кальция. Для оценки соединений по их функциональной активности в отношении рецептора V1a, клетки НЕK-293 трансфицируют человеческим рецептором V1a (клетки V1a-HEK). Клетки НЕK-293, выращивают в DMEM (дульбекко модифицированная среда игла) с добавкой 10% FBS и глутамина. Клеткам НЕK раз в две недели проводят трипсинизацию и высевают в 96-луночные планшеты по 33000-клеток на лунку. Клетки НЕK-293 трансфицируют ДНК человеческого рецептора V1a, применяя реагент DMRIE-C фирмы Life Technologies (Carlsbad, CA). Стабильные линии генерируют путем селекции клеток, выращенных в культуральной среде, содержащей генетицин. После выращивания в 96-луночных планшетах Packard Clear-View black в течение 4-6 дней в клетки V1a-HEK вносят чувствительный к кальцию флуоресцентный краситель FLUO-3 AM. Изменение внутриклеточной мобилизации кальция определяют путем измерения внутриклеточной флуоресценции,используя прибор FLIPR (Fluorometric Imaging Plate Reader; Molecular Devices, Sunnyvale, CA). Испытуемые соединения сначала добавляют к клеткам и измеряют произошедшие изменения флуоресценции для обнаружения активности соединения в качестве антагониста рецептора. Через 5 мин клетки обрабатывают вазопрессином, чтобы испытать соединения на их активность в качестве антагонистов. Антагонисты рецептора ингибируют способность вазопрессина стимулировать увеличение внутриклеточной флуоресценции. Для соединений рассчитывают IC50. Биологический пример 2. Функциональная активность в отношении рецептора вазопрессина V2 Рецептор V2 также представляет собой рецептор, связанный с G-белками, который в случае своей активации вызывает увеличение обращения сАМР. Антагонизм против рецептора V2 определяют путем- 19011089 измерения накопления сАМР в трансфицированных клетках НЕK-293, которые экспрессируют человеческий рецептор V2 (клетки V2-HEK). Соединения испытывают на их способность блокировать стимулирующее воздействие вазопрессина на накопление сАМР. Содержание сАМР в клетках измеряют радиоиммунным анализом, используя радиационные планшеты NEN. Биологический пример 3. Устранение вызванной вазопрессином гипертензии у крыс Противогипертоническая активность соединения может быть установлена при использовании анестезированной животной модели с гипертензией, вызванной вазопрессином. Мужская особь крысы LongEvans с нормальным давлением и массой тела от 350 до 450 г может быть подвергнута анестезии с помощью фенобарбитала (35 мг/кг, интраперитонеально) и ее можно удерживать в таком состоянии с помощью интраперитонеальной инфузии 10 мг/кг/ч. Для того чтобы вызвать стабильное гипертензивное состояние (увеличение среднего артериального давления приблизительно на 50 мм Hg) можно осуществить внутривенную инфузию 30 нг/кг/мин аргининвазопрессина (AVP). Испытуемые соединения могут вводиться в режиме возрастающих дозировок, причем может быть зафиксировано максимальное уменьшение среднего артериального давления крови. ED50 может быть определена из линейного участка зависимости доза-ответ для каждого животного. Биологический пример 4. Считается, что некоторые животные модели способны имитировать различные компоненты диабетической нефропатии у людей, в частности, стрептозотоцин-индуцированная модель диабета типа 1 у крыс, db/db генетическая модель диабета типа 2 у мышей и модель почечной недостаточности у крыс,вызванной 5/6 нефректомией. JNJ-17158063 сначала оценивают на стрептозотоциновой модели диабета путем введения соединения в количестве 1,3 или 10 мг/кг/день в течение 12 недель и наблюдения в ходе исследования за несколькими конечными параметрами, которые являются показательными для диабетических заболеваний почек, включая пониженное содержание альбумина в моче, уровни креатинина в сыворотке и уровни различных цитокинов в моче. В конце исследования гистологически оценивают морфологические изменения в почке для сравнения с нормальными почками. Для подтверждения активности подобные исследования выполняют на двух других моделях. Биологический пример 5. Уровни аргининвазопрессина (AVP) резко возрастают после ишемического инсульта и травмы головы, и это вносит вклад в воспалительную реакцию тканей. Было показано, что антагонисты рецептораAVP блокируют развитие отека мозга, возникающего после травматического повреждения мозга и ишемического инсульта, благодаря регуляции транспорта воды и электролитов через эндотелий сосудов головного мозга (путем ингибирования эндотелиального рецептора V1a) и за счет стимуляции диуреза (через почечные рецепторы V2). Дополнительное нейропротективное действие антагонистов рецептораAVP может быть опосредовано ингибированием нейронных рецепторов V1a. Таким образом, соединения по настоящему изобретению могут быть полезны при ишемическом инсульте и травматическом повреждении мозга. Антагонисты V1a/V2 могут понижать пост-ишемическую воспалительную реакцию и уменьшать объем инфаркта мозговых тканей после ишемического инсульта. Поскольку многие из нейропротективных и противоотечных действий антагонистов рецепторов AVP опосредованы на уровне эндотелия сосудов мозга или почек, не так важно, проникают ли основные соединения через барьер кровь-мозг. Однако как отмечено выше, проникновение в ЦНС может увеличить приносимую пользу благодаря ограничению действия AVP на нейронные рецепторы V1a. Для оптимизации времени полужизни в плазме и оптимальных режимов дозировки, можно определить фармакокинетические свойства соединения. Это исследование включает оценку способности данных соединений преодолевать барьер кровь-мозг и непосредственное измерение концентраций и времени полужизни лекарства в тканях мозга. Нейропротективные и противоотечные свойства данных соединений могут быть определены с помощью моделирования эмболического инсульта у грызунов. На той модели отбирают аликвоту крови животного и охлаждают в течение ночи, чтобы дать возможность образоваться тромбу, обогащенному тромбином. Затем этот тромб хирургическим путем помещают в начало средней мозговой артерии и оставляют в этом месте в течение 2-4 ч, для того, чтобы вызвать продолжительную церебральную ишемию. Тромб можно оставить в этой точке навсегда или можно вызвать его распад, применяя внутривенное введение рекомбинантного активатора тканевого плазминогена (rt-PA),чтобы сделать возможной реперфузию. Антагонисты рецептора вазопрессина по настоящему изобретению могут вводиться внутривенно в различное время после внесения тромба, причем может осуществляться быстрое введение дозы, быстрое введение с последующей продолжительной внутривенной инфузией или только продолжительная внутривенная инфузия. Соединения могут вводиться в моменты времени, которые находятся в диапазоне от двух часов до одной недели после начала ишемии, с целью определения оптимального временного окна для лечения. За активным внутривенным введением также может следовать пероральное введение соединения для установления оптимальной продолжительности лечения. Параметры антагонистов рецептора вазопрессина по настоящему изобретению могут быть исследованы на модели травматического повреждения мозга у грызунов. Реализация этой модели требует открытия окна в черепе, чтобы стала доступной твердая мозговая оболочка. После этого на твердую мозговую- 20011089 оболочку роняют грузы измеренной контролируемой массы, чтобы вызвать травму. Данная модель хорошо охарактеризована и дает определенную модель потери нейронов и воспаления. Отек, воспаление и нейропротективное действие могут быть определены при применении одного или нескольких из следующих подходов: животные могут быть умерщвлены в различные моменты времени после ишемии, от 24 ч до четырех недель, затем с применением стандартных гистологических и гистохимических методик могут быть измерены объем инфаркта и отек мозга. Кроме этого животных можно подвергнуть магнитно-резонансной томографии (MRI), чтобы можно было проследить эволюцию инфаркта и отека у одного и того же животного. Наконец, можно осуществить и использовать для количественных анализов гистологические и гистохимические измерения целостности барьера кровь-мозг и инфильтрации воспалительных клеток (например, моноцитов, макрофагов, микроглий). Наконец, все животные могут быть исследованы в обширной серии поведенческих тестов для оценки влияния антагонистов рецептора вазопрессина на неврологическую функцию и поведение. Эти оценки поведения могут включать общую неврологическую оценку, оценку моторной асимметрии, а также оценку сенсомоторной интеграции, с применением таких тестов, как тест на неправильную постановку ног (foot-fault), вращательный тест (Rotarod) и тест с рычажными весами (или равновесие на перекладине)(beam-balance). Данные показаны ниже в табл. 1, причем значения приведены для V1a/V2. Рацемическая структура А представляет собой 4-(2-фенилбензоил-4-аминобензоил)-3'-[2-(N,N-диметиламиноэтилкарбонил)]-4 аза[6,4]спиро[5,6]бензоундец-2'-ен, опубликованный в WO 02/02531 А 1, стр. 43, соединение 9. Несмотря на то, что в предшествующем описании изложены основные принципы настоящего изобретения, с примерами, предназначенными для целей иллюстрации, следует понимать, что применение изобретения на практике охватывает все обычные варианты, адаптации и/или модификации, которые подпадают под объем следующей формулы изобретения и ее эквивалентов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I в которой один из R1 и R2 представляет собой Н, и другой представляет собой Н, NR5R6, C1-6 алкокси, гидрокси или галоген; где каждый из R5 и R6 независимо представляет собой Н или C1-3 алкил;R4 представляет собой хлор, фтор, метокси или метил; или его фармацевтически приемлемые сложные C1-6 эфиры, C1-6 амиды или ди(C1-6 алкил)амиды, или их соли. 2. Соединение по п.1, где R2 представляет собой аминогруппу.- 21011089 3. Соединение по п.1, где R2 представляет собой C1-4 алкоксигруппу. 4. Соединение по п.1, где R2 представляет собой метокси, этокси, пропокси, изопропокси, бутокси,изобутокси или трет-бутокси. 5. Соединение по п.4, где R2 представляет собой метокси или этокси. 6. Соединение по п.1, где R4 представляет собой фтор, хлор или метил. 7. Соединение по п.1, где R4 представляет собой фтор или хлор. 8. Соединение по п.1, где R4 представляет собой фтор. 9. Соединение по п.6, где R2 представляет собой метокси, этокси или изопропокси. 10. Соединение по п.6, где R1 представляет собой метокси или этокси. 11. Соединение по п.7, где R2 представляет собой метокси или этокси. 12. Соединение по п.1, выбранное из- 22011089 13. Соединение по п.1, где соединение выбрано из (R)-4-(2-хлор-5-фторбензоил-3-метокси-4 аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]бензоундец-2'-ен и (R)-4-(2-хлор-5-фторбензоил-3 этокси-4-аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]бензоундец-2'-ен 14. Соединение по п.1, где соединение представляет (R)-4-(2-хлор-5-фторбензоил-3-метокси-4 аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]бензоундец-2'-ен 15. Соединение по п.1, где соединение представляет собой (R)-4-(2-хлор-5-фторбензоил-3-этокси-4 аминобензоил)-4-аза-3'-(карбокси)-[6,4]спиро[5,6]бензоундец-2'-ен формулы 16. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель. 17. Фармацевтическая композиция по п.16, в которой указанное соединение выбирают из соединений по пп. 5, 8, 9, 10, 13, 14 или 15. 18. Способ лечения субъекта, страдающего от состояния, связанного с активностью рецептора вазопрессина, который включает введение субъекту терапевтически эффективного количества соединения формулы I, определенного в п.1. 19. Способ задержки начала или развития у субъекта состояния, связанного с активностью рецептора вазопрессина, который включает введение субъекту профилактически эффективной дозы соединения формулы I, определенного в п.1. 20. Способ по п.18 или 19, в котором указанное состояние выбирают из расстройств внутреннего уха, гипертензии, закупорки сердечных сосудов, сердечной недостаточности, спазма коронарных сосудов, ишемии сердца, цирроза печени, спазма почечных сосудов, почечной недостаточности, диабетической нефропатии, гипонатриемии, отека мозга, ишемии мозга, инсульта, тромбоза, отечности, агрессивности, обсессивно-компульсивных расстройств, дисменореи, нефротического синдрома, тревоги и повреждений центральной нервной системы. 21. Способ по п.20, в котором указанное состояние представляет собой закупорку сосудов сердца или сердечную недостаточность. 22. Способ по п.20, в котором указанное состояние представляет собой гипонатриемию. 23. Способ по п.20, в котором указанное состояние представляет собой гипертонию.- 23011089 24. Способ по п.20, в котором указанное соединение выбирают из соединений по пп.5, 8, 9, 10, 13,14 или 15. 25. Способ получения фармацевтической композиции, включающий смешивание любого из соединений по п.1 и фармацевтически приемлемого носителя.
МПК / Метки
МПК: A61K 31/55, C07D 223/00, A61P 9/00
Метки: спиробензазепины, замещённые
Код ссылки
<a href="https://eas.patents.su/25-11089-zameshhyonnye-spirobenzazepiny.html" rel="bookmark" title="База патентов Евразийского Союза">Замещённые спиробензазепины</a>
Предыдущий патент: Новые аминоциклические производные мочевины, их получение и фармацевтическое применение в качестве ингибиторов киназы
Следующий патент: Замещенные производные 1, 3-дифенилпроп-2-ен-1-она, получение и применение
Случайный патент: Сверхлегкая коаксиальная сигарета с многосекционным фильтром