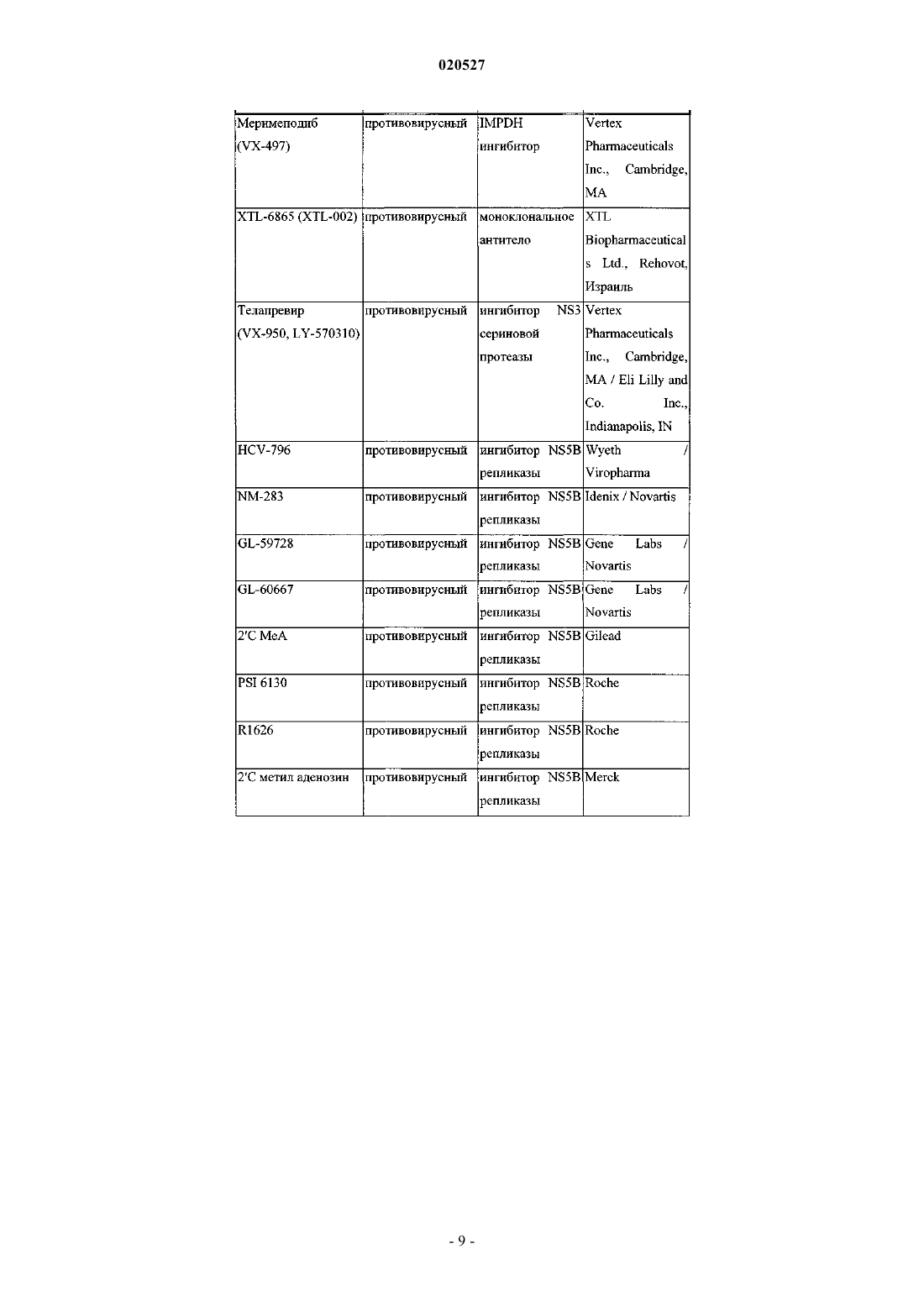
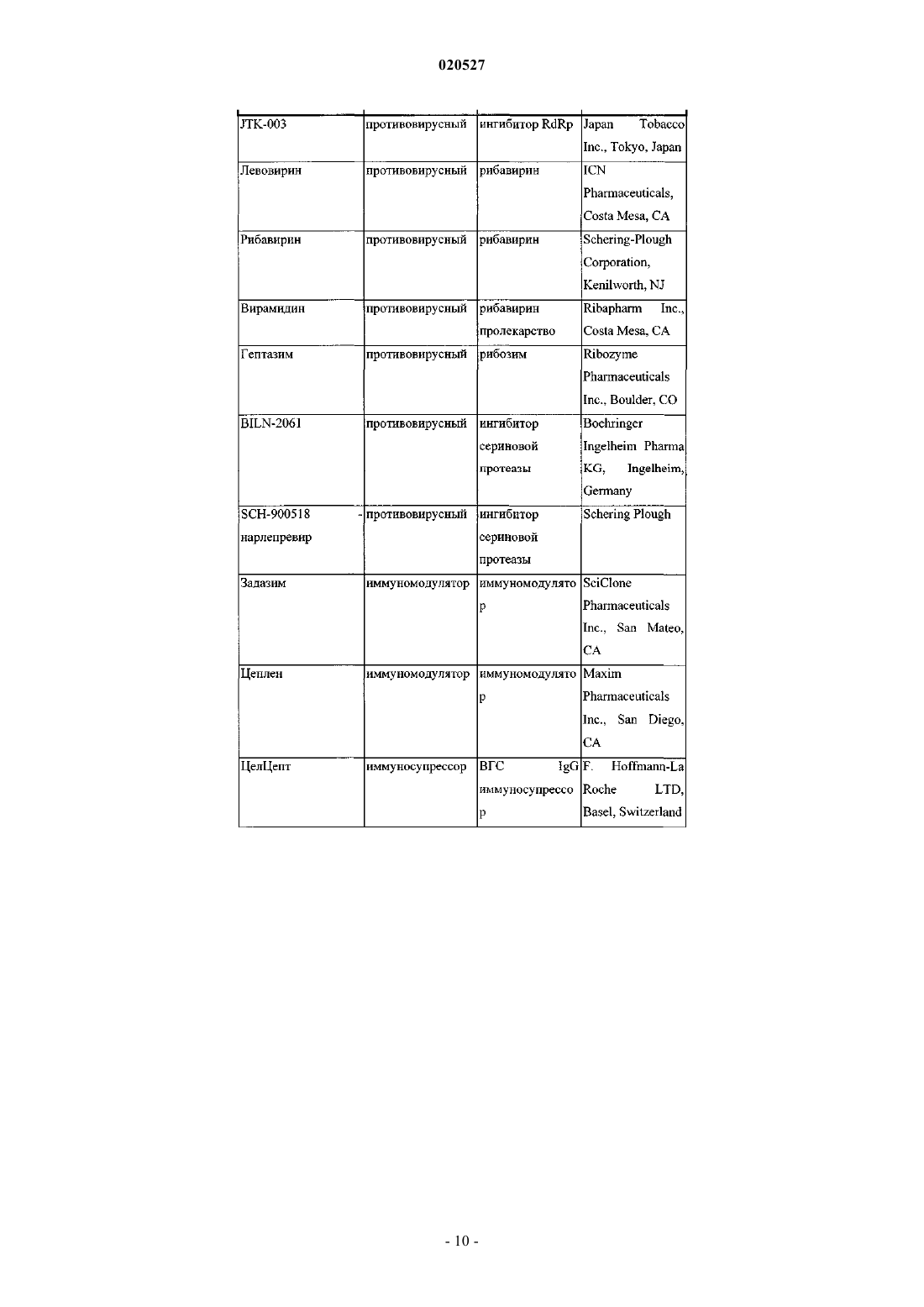
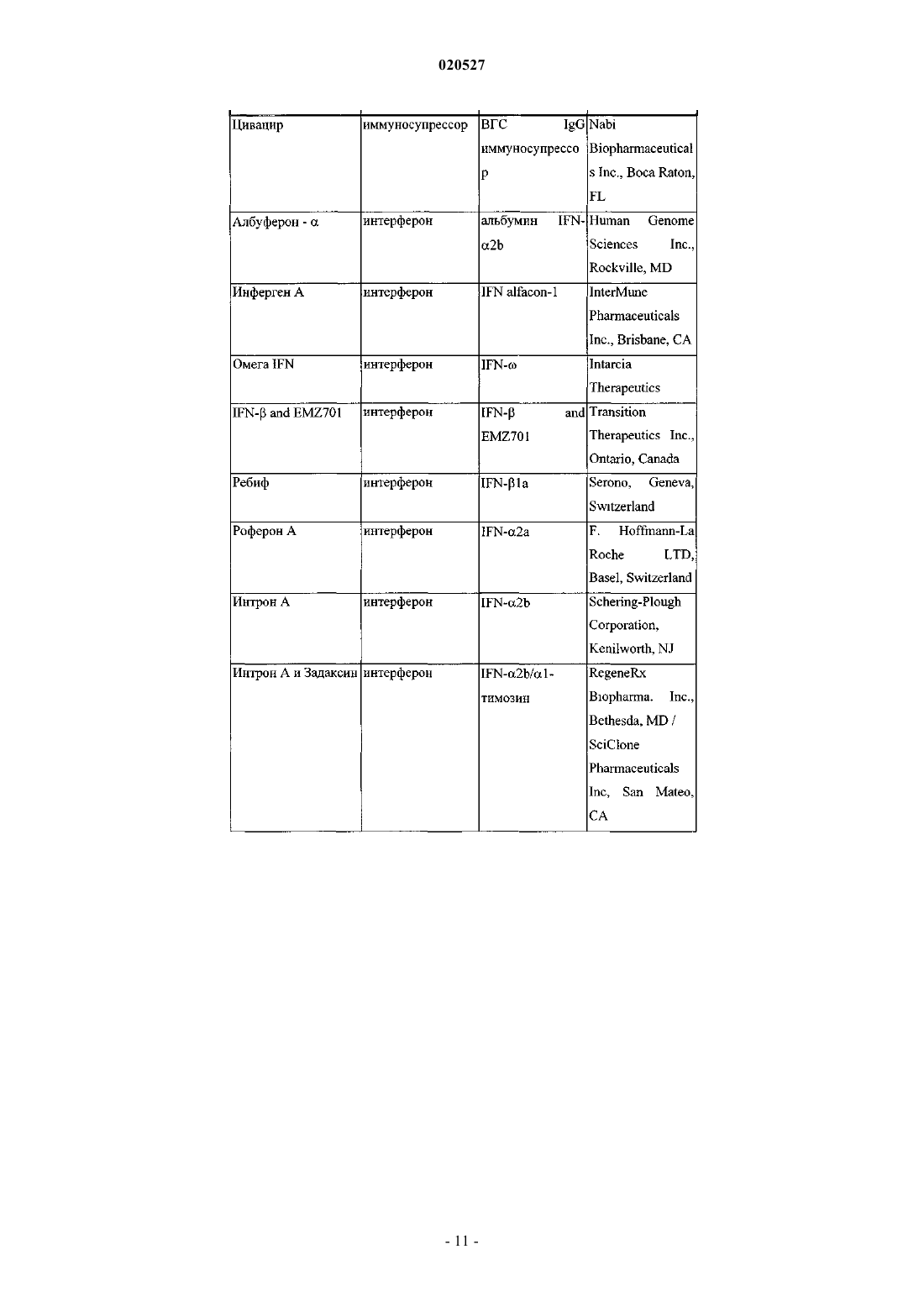
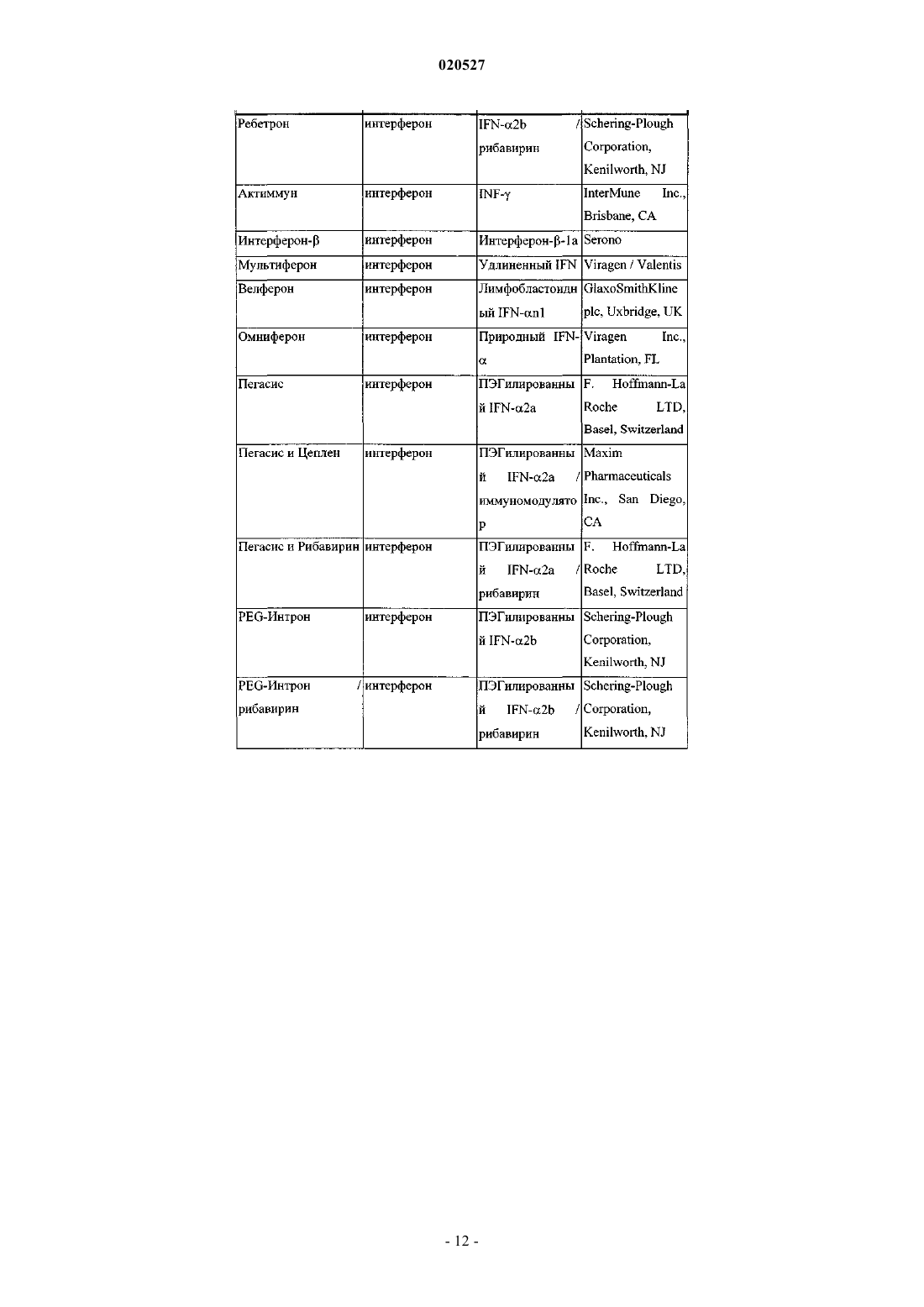
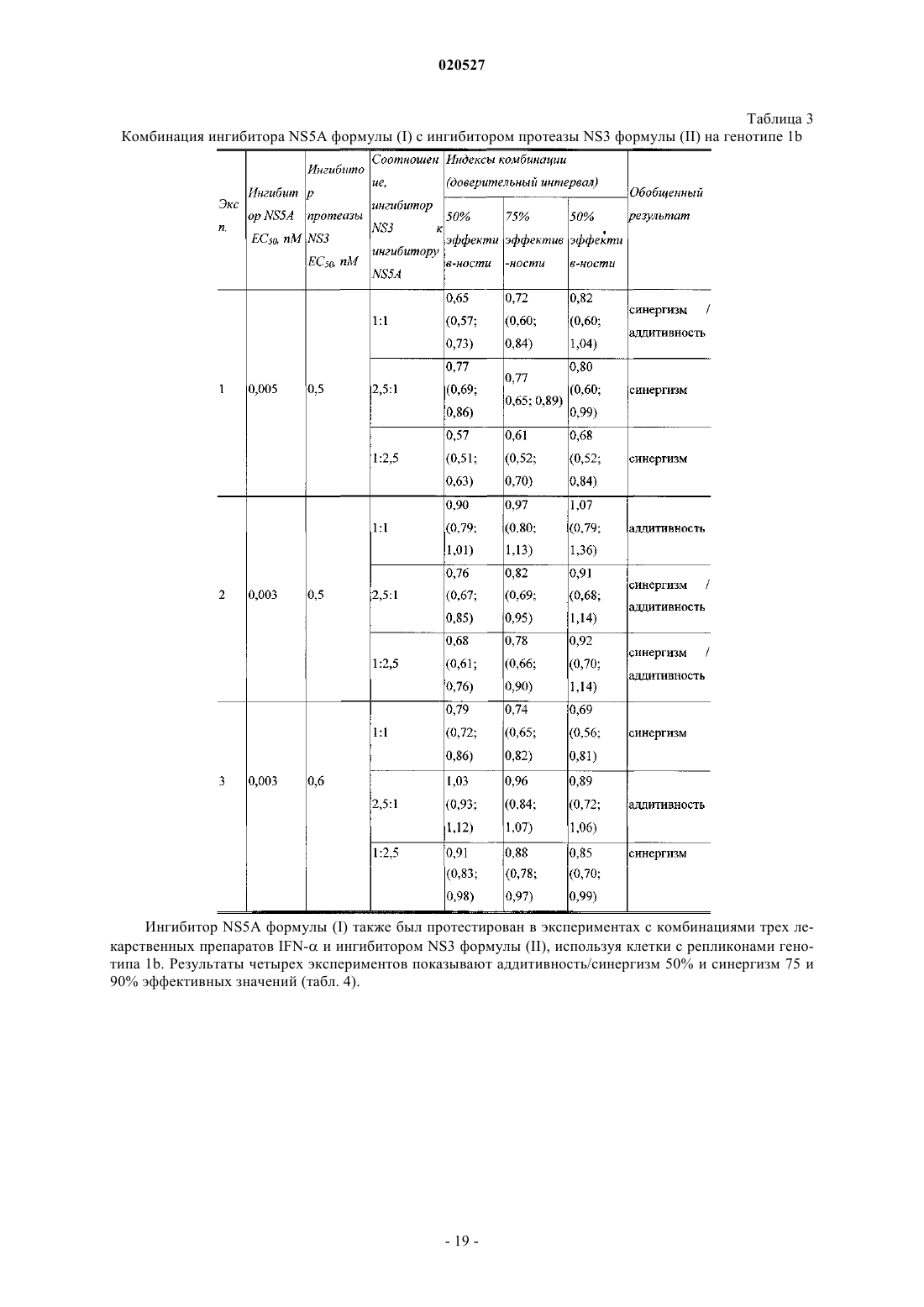
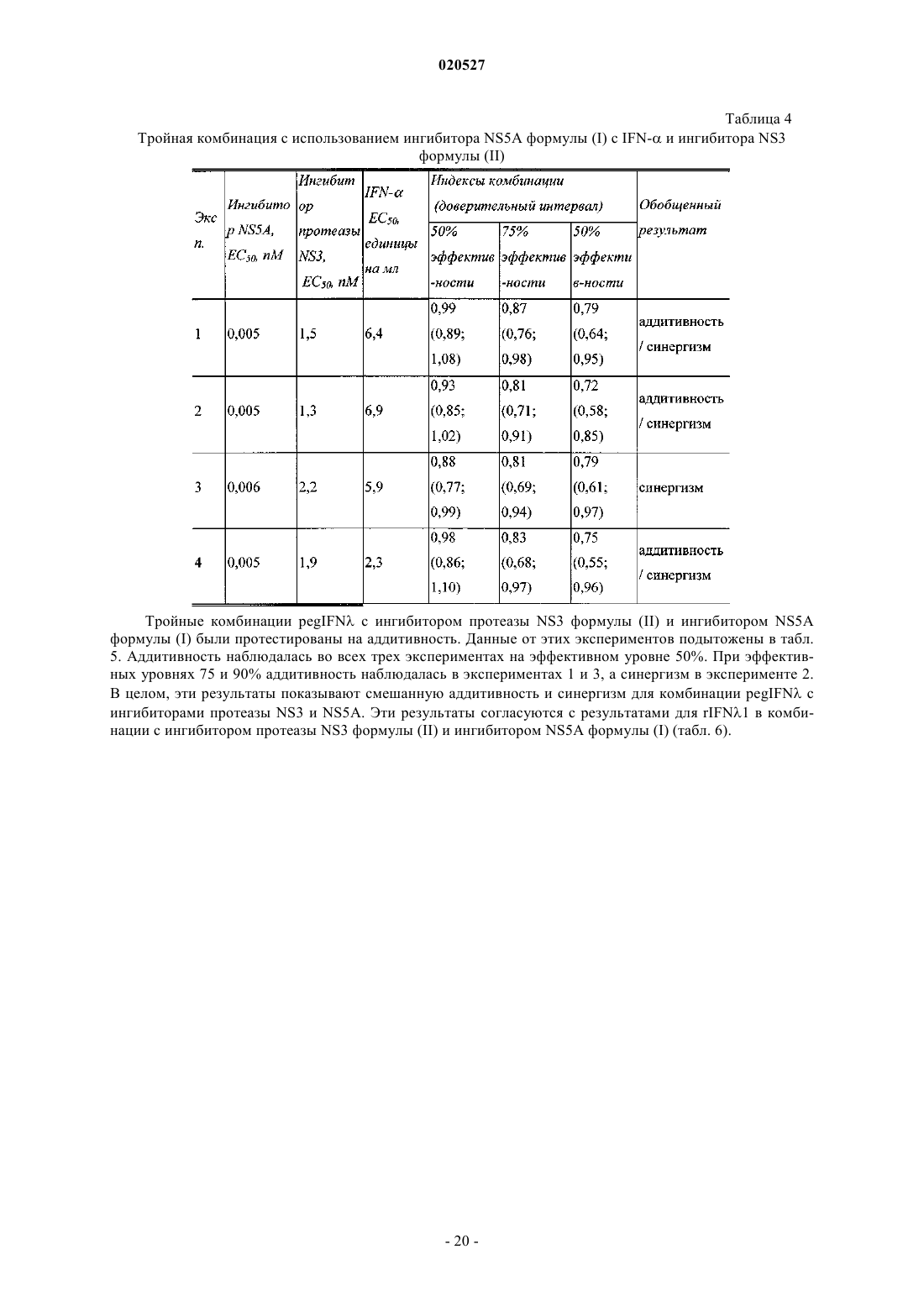
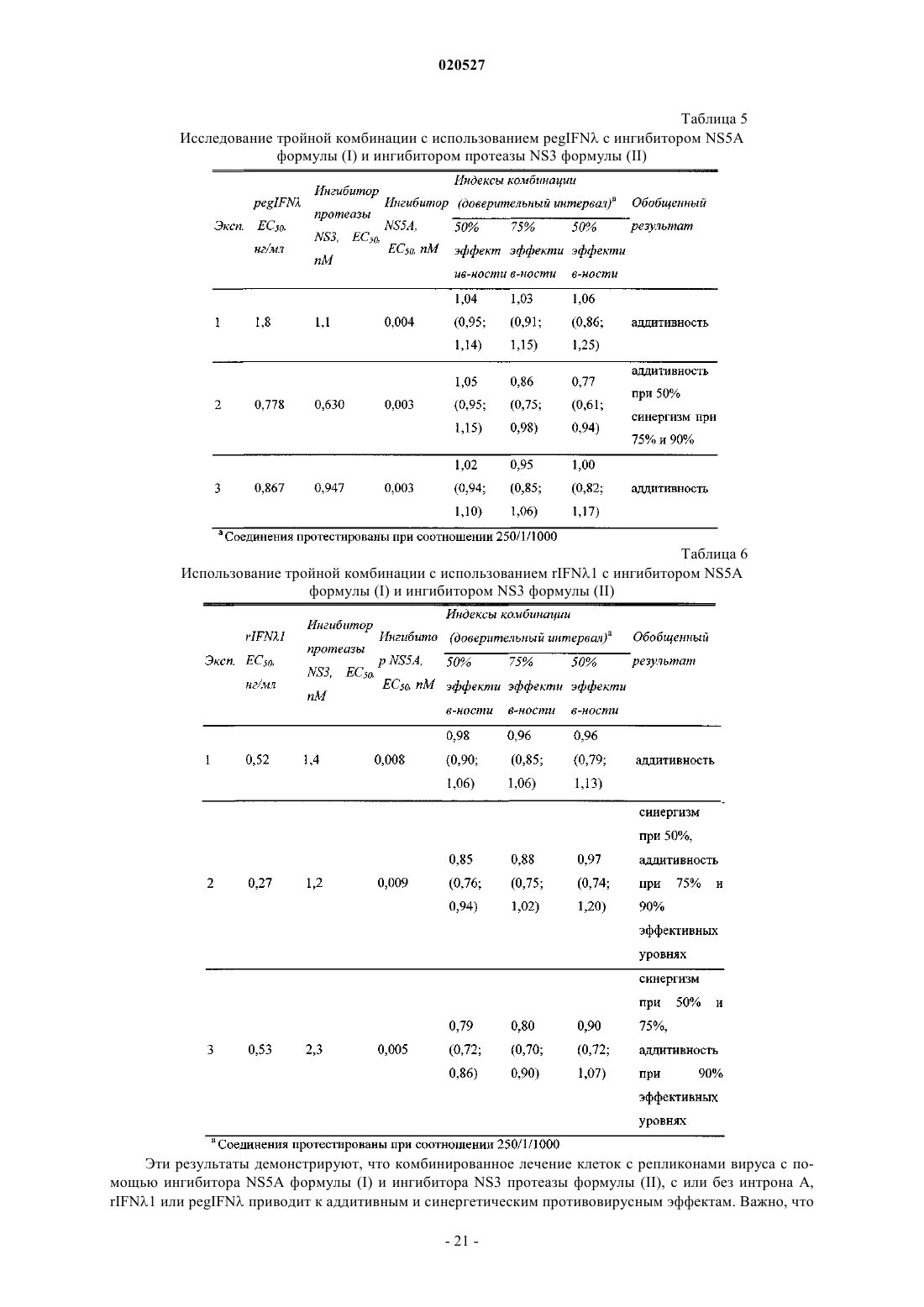
Комбинации ингибиторов вируса гепатита с
Номер патента: 20527
Опубликовано: 28.11.2014
Авторы: Лемм Джулии А., Чаниевски Сьюзан Е., Восс Стейси А., Шиффер Эмми К., Гао Мин, Макфи Фиона
Формула / Реферат
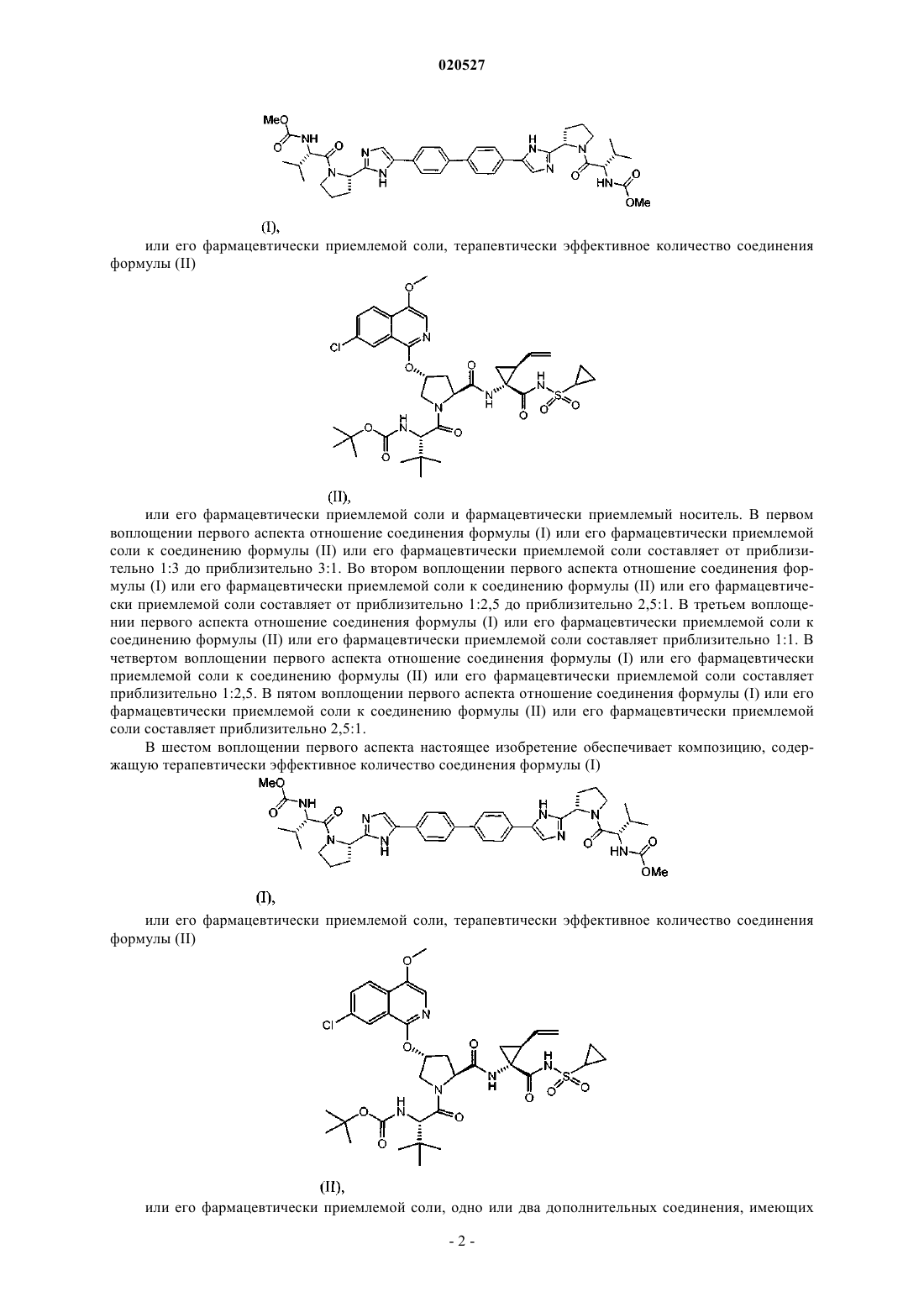
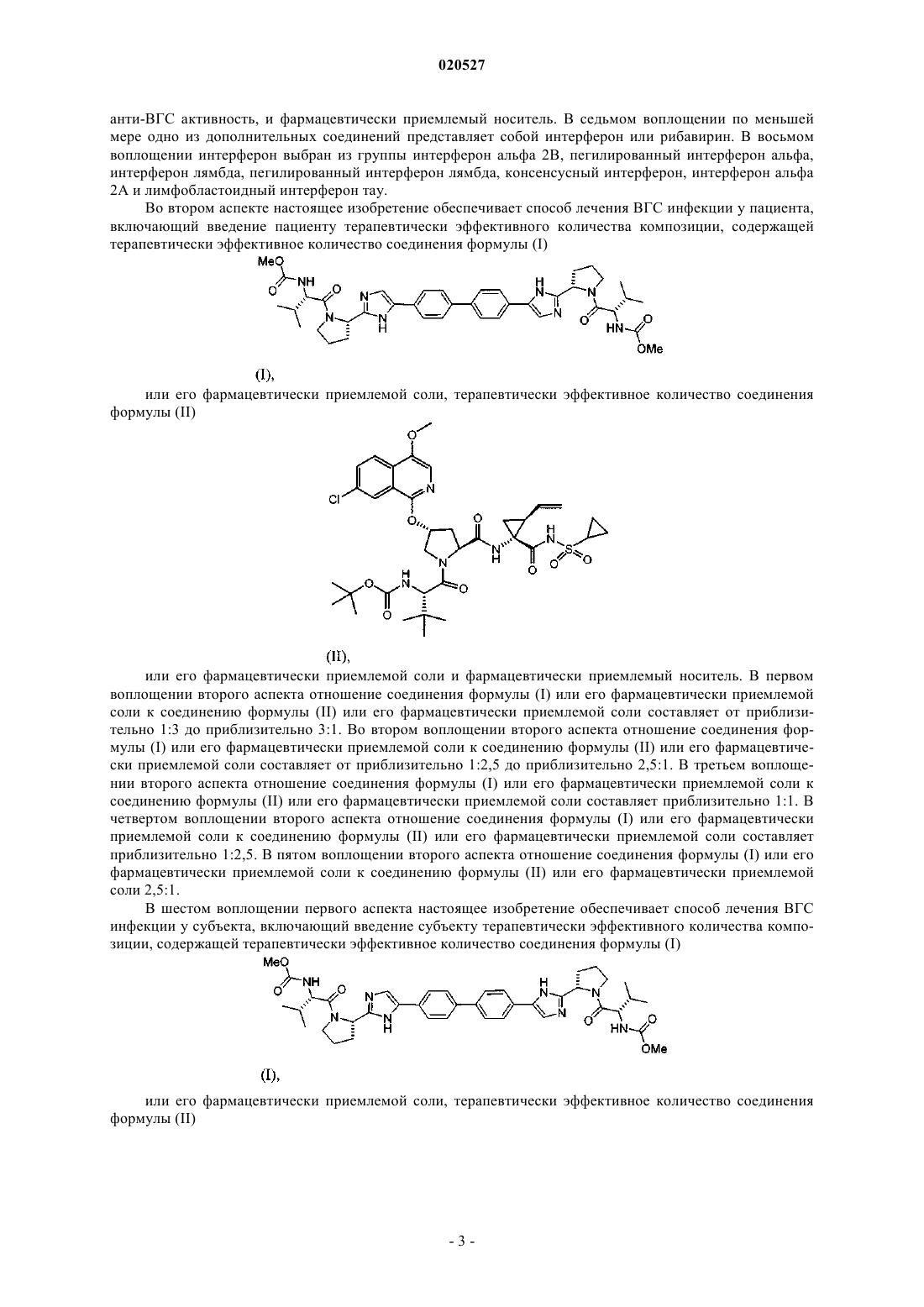
1. Композиция для лечения вируса гепатита С (ВГС) инфекции у пациента, содержащая терапевтически эффективное количество соединения формулы (I)
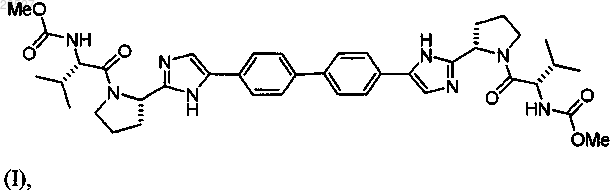
или его фармацевтически приемлемой соли, терапевтически эффективное количество соединения формулы (II)
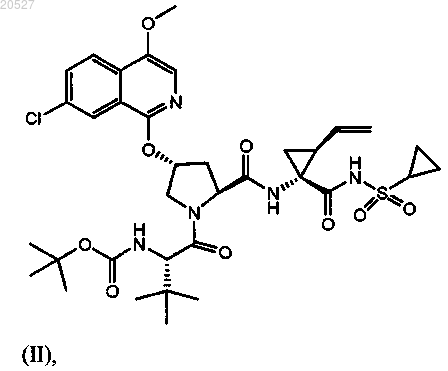
или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
2. Композиция по п.1, где отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет от примерно 1:3 до примерно 3:1.
3. Композиция по п.2, где отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет от примерно 1:2,5 до примерно 2,5:1.
4. Композиция по п.3, где отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет примерно 1:1.
5. Композиция по п.3, где отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет примерно 1:2,5.
6. Композиция по п.3, где отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет примерно 2,5:1.
7. Композиция по п.1, дополнительно содержащая один или два дополнительных соединения, имеющих анти-ВГС активность.
8. Композиция по п.7, где по меньшей мере одно дополнительное соединение представляет собой интерферон или рибавирин.
9. Композиция по п.8, где интерферон выбран из интерферона альфа 2В, пэгилированного интерферона альфа, консенсусного интерферона, интерферона альфа 2А, интерферона лямбда, пэгилированного интерферона лямбда и лимфобластоидного интерферона тау.
10. Способ лечения ВГС-инфекции у пациента, включающий введение пациенту терапевтически эффективного количества композиции по п.1.
11. Способ по п.10, дополнительно включающий введение пациенту одного или двух дополнительных соединений, имеющих анти-ВГС-активность, до, после или одновременно с композицией по п.1.
12. Способ по п.11, где по меньшей мере одно дополнительное соединение представляет собой интерферон или рибавирин.
13. Способ по п.12, где интерферон выбран из интерферона альфа 2В, пэгилированного интерферона альфа, консенсусного интерферона, интерферона альфа 2А, интерферона лямбда, пэгилированного интерферона лямбда и лимфобластоидного интерферона тау.
Текст
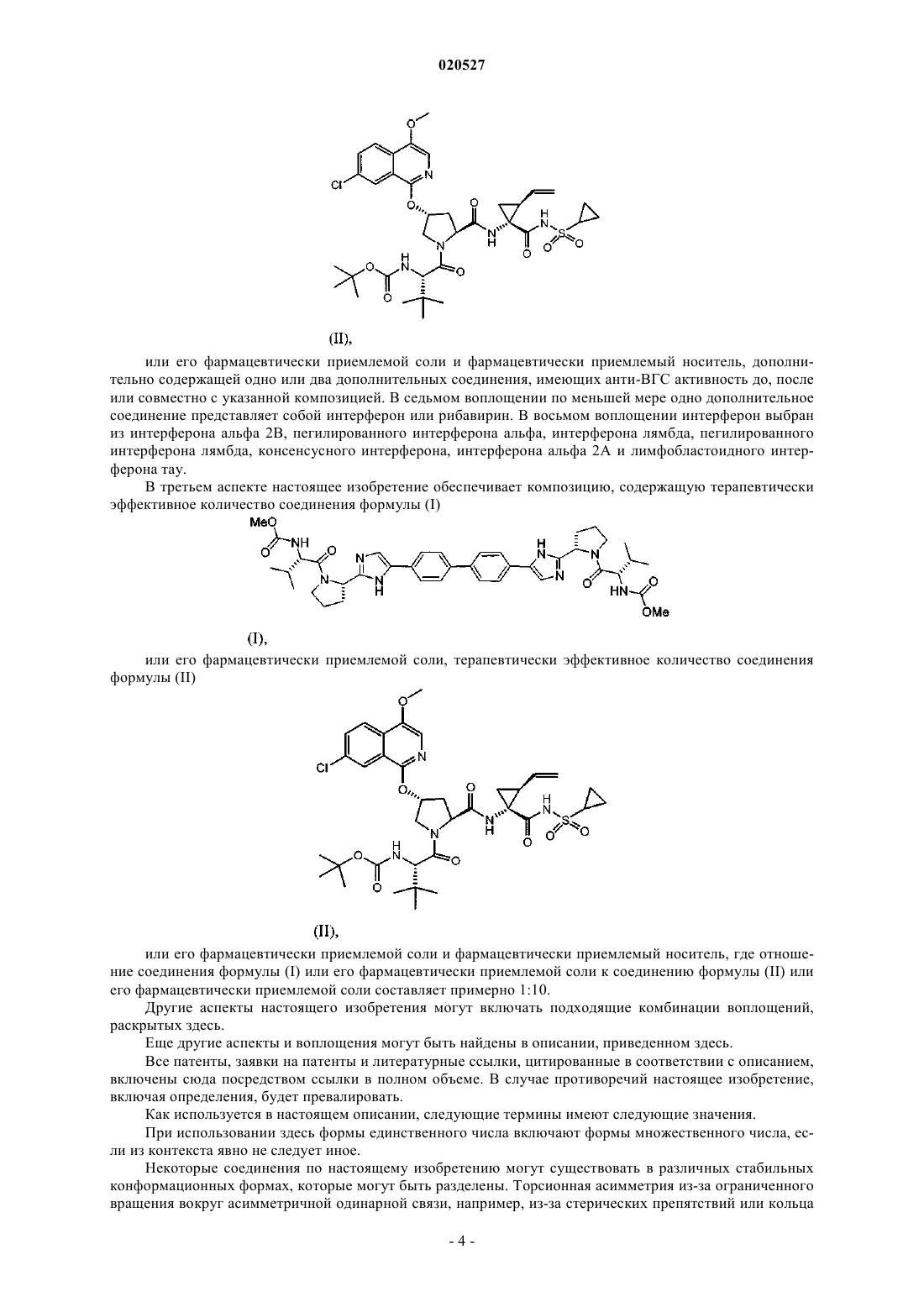
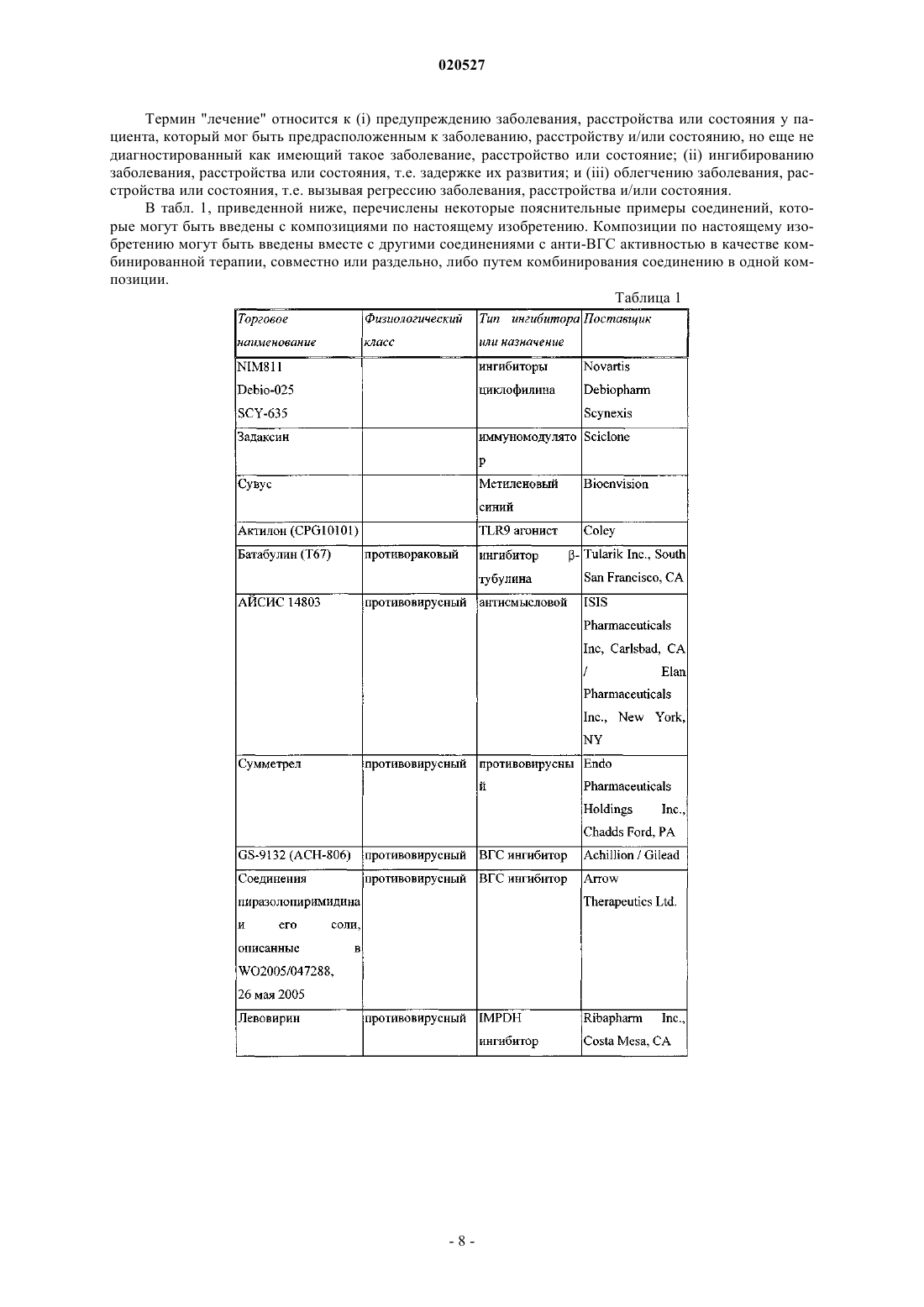
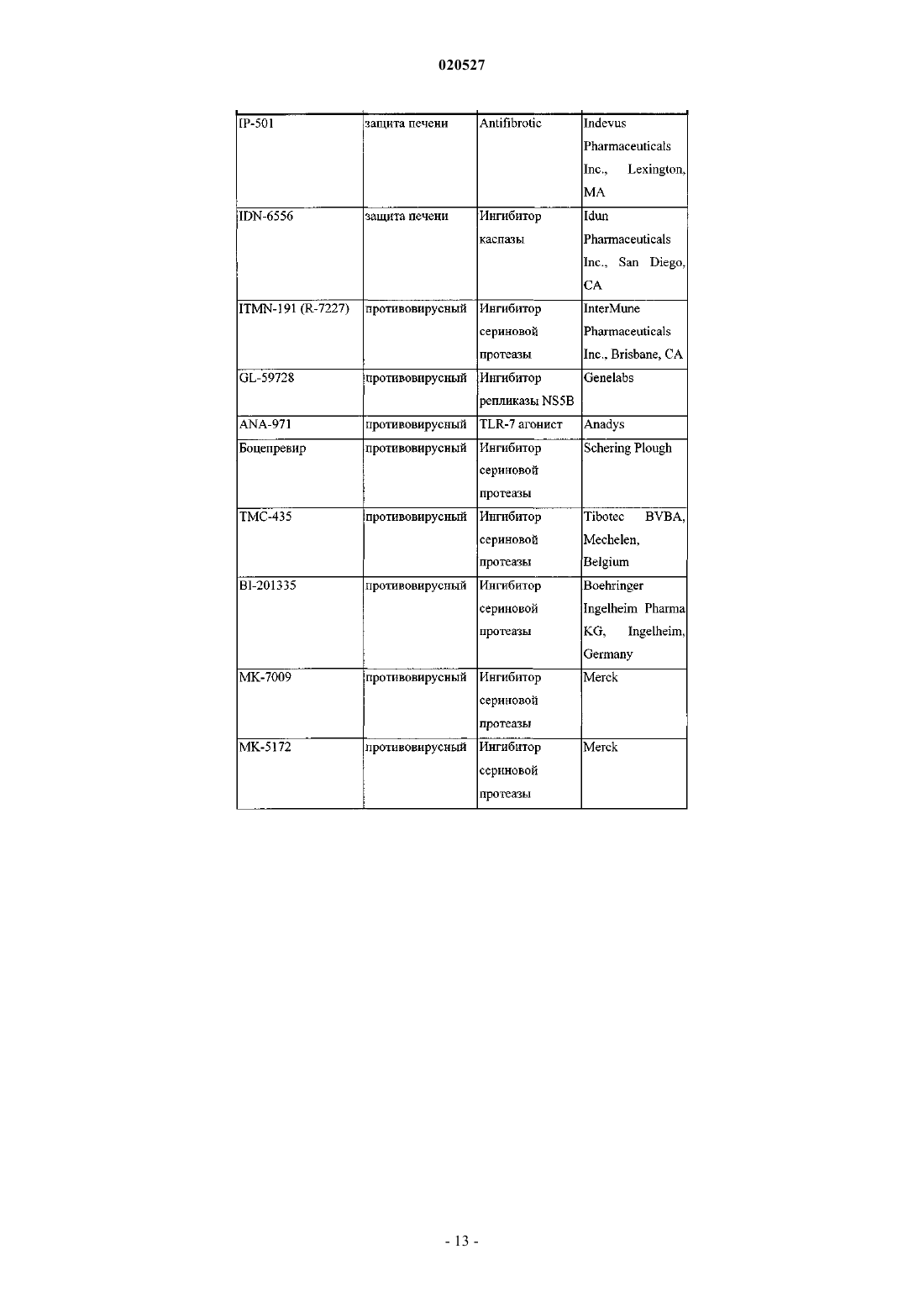
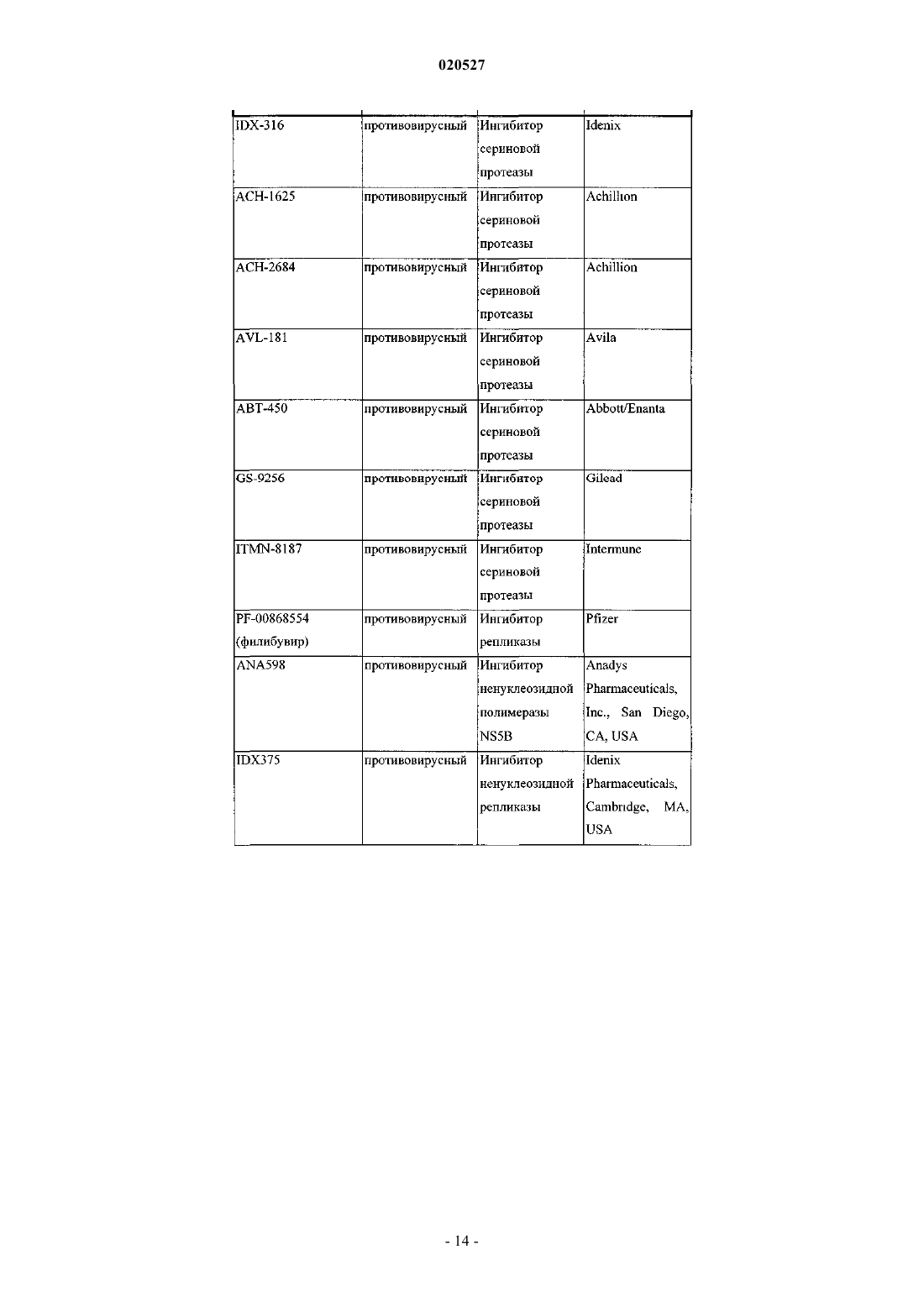
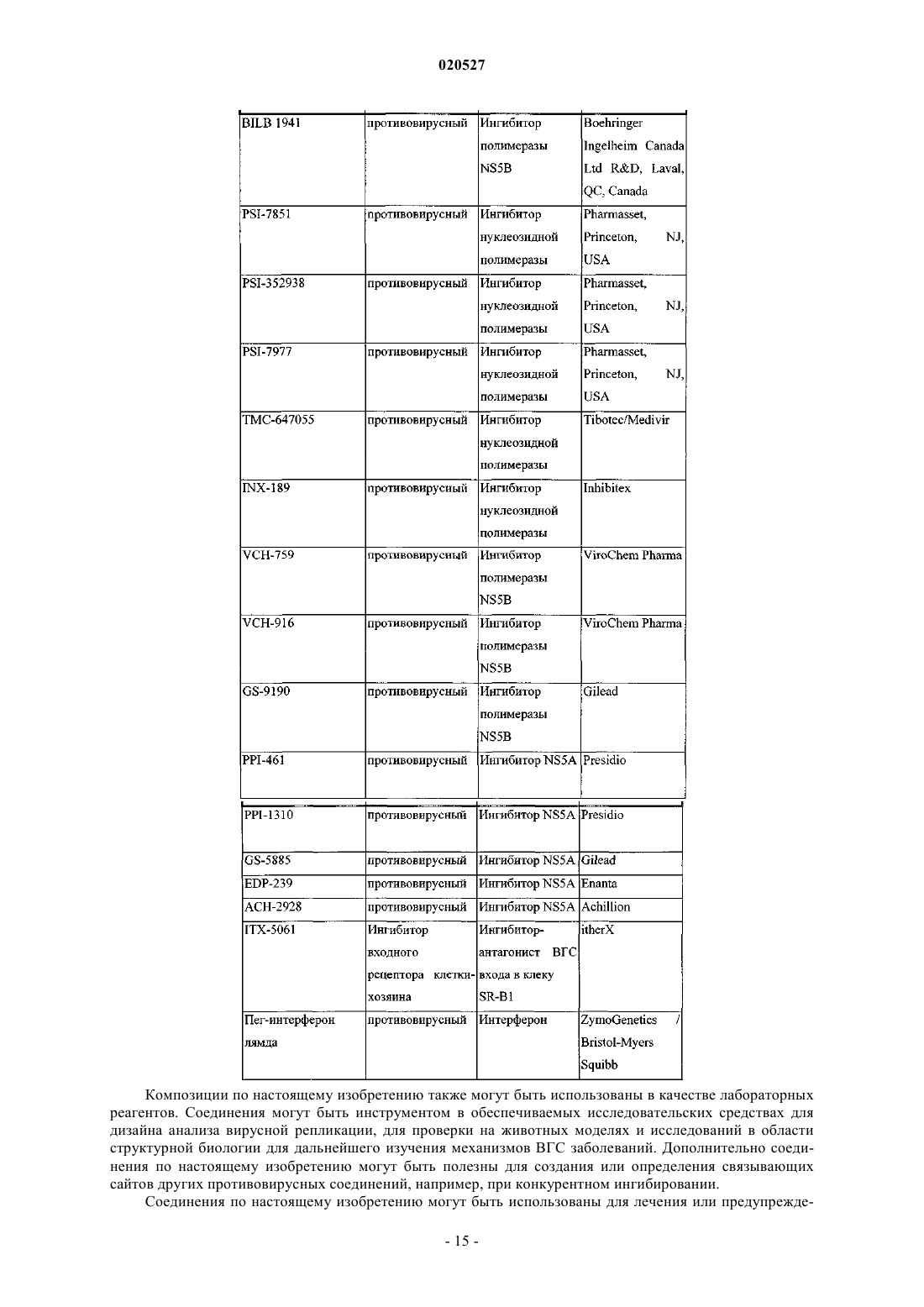
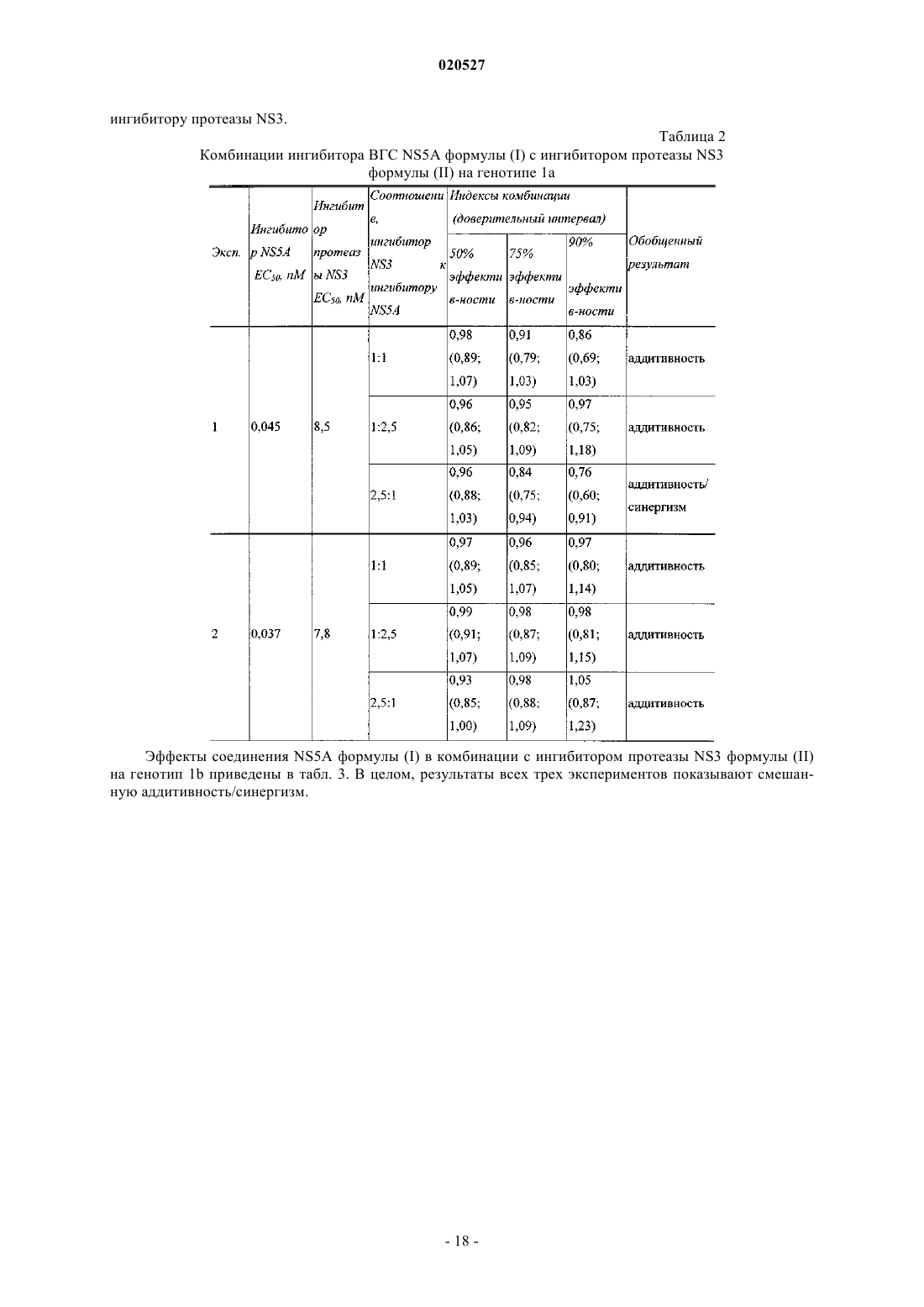
КОМБИНАЦИИ ИНГИБИТОРОВ ВИРУСА ГЕПАТИТА С Изобретение, по существу, относится к антивирусным соединениям и, более конкретно, к комбинациям соединений, которые могут ингибировать вирус гепатита С (ВГС), композициям,содержащим такие соединения, и способам лечения гепатита С с использованием таких комбинаций. Перекрестные ссылки Заявка на данный патент испрашивает приоритет по предварительной заявке США с серийным номером 61/250648, поданной 12 октября 2009 г. Настоящее изобретение по существу относится к противовирусным соединениям, конкретнее к комбинациям соединений, которые могут ингибировать вирус гепатита С (ВГС), композициям, содержащим такие соединения, и способам для лечения гепатита С, используя такие комбинации. ВГС является главным патогенном человека, которым предположительно инфицировано около 170 млн людей по всему миру - приблизительно в пять раз больше, чем инфицированных вирусом иммунодефицита человека типа 1. Основная часть таких индивидуумов, инфицированных ВГС, развивают серьезные прогрессирующие заболевания печени, включая цирроз и гепатоклеточную карциному. ВГС является РНК положительным вирусом. На основании сравнения предполагаемой аминокислотной последовательности и пространственного сходства 5'-нетранслируемой области ВГС был классифицирован как отдельный вид семейства Flaviviridae. Все члены семейства Flaviviridae имеют вирионы,покрытые оболочкой и содержащие РНК положительный геном, кодирующий все известные вирусспецифические белки через трансляцию одиночной непрерывной открытой рамки считывания. Существенная гетерогенность была обнаружена в нуклеотидной и кодируемой аминокислотной последовательности ВГС генома, соответствующая большой доле ошибки кодирующей РНК, которая зависит от РНК полимеразы, лишенной способности исправления ошибок. Были охарактеризованы по меньшей мере шесть главных генотипов и более чем 50 подтипов, распространенных по всему миру. Клиническое значение генетической гетерогенности ВГС состоит в оценке предрасположенности к мутациям,происходящим в течение монотерапевтического лечения. Таким образом, желательно использовать дополнительные варианты лечения. Одиночная цепь РНК ВГС генома составляет примерно 9500 нуклеотидов в длину и имеет одну открытую рамку считывания (ORF), кодирующую один большой полипротеин из примерно 3000 аминокислот. В инфицированных клетках этот полипротеин расщепляется в многочисленных сайтах клеточными и вирусными протеазами с получением структурных и неструктурных (NS) протеинов. В случае ВГС образование зрелых неструктурных протеинов (NS2, NS3, NS4A, NS4B, NS5A и NS5B) опосредовано двумя вирусными протеазами. Первая из них предположительно является металлопротеазой и расщепляет соединение NS2-NS3; вторая является сериновой протеазой, содержащая N-терминальный регионNS3 (также называемый здесь как NS3 протеаза), и опосредует все нижеследующие расщепления NS3,оба в cis, в NS3-NS4A сайте расщепления, и в trans, для оставшихся NS4A-NS4B, NS4B-NS5A, NS5ANS5B сайтов. NS4A белок проявляет многочисленные функции, действуя как кофактор NS3 протеазы и содействуя локализации в мембране NS3 и других вирусных репликазных компонентов. ОбразованиеNS3-NS4A комплексов необходимо для специфической протеазной активности в усиленной протеолитической эффективности расщепления. NS3 белок также проявляет нуклеозид трифосфатазную и РНК хеликазную активности. NS4B является интегрированным в мембрану белком, участвующим в образовании мембранной сети, в которой собираются ВГС комплексы репликации. NS5B (также называемый здесь как ВГС полимераза) представляет собой РНК-зависимую РНК полимеразу, которая вовлечена в репликацию ВГС с другими ВГС белками, включая NS5A, в репликазном комплексе. Действующий стандарт лечения большинства пациентов с хронической ВГС инфекцией представляет собой режим введения пэгилированного интерферона альфа и рибавирина. Однако у большей части пациентов не наблюдается ответа на такую терапию, а лечение вызывает различные побочные эффекты. Таким образом, существует огромная необходимость в развитии безопасных и более эффективных методов терапии. Хотя в настоящее время в клинической практике применяется множество малых молекул ВГС ингибиторов, на основании клинических данных от различных исследований доказано, что комбинации таких ингибиторов могут быть необходимы для продолжительного противовирусного эффекта у ВГС инфицированных пациентов. Появление резистентности у пациентов в течение лечения и после лечения возникает при применении протеазных ингибиторов, также как и нуклеозидных, и ненуклеозидных ВГС ингибиторов. Для достижения максимальной эффективности и для возможности уничтожения вируса необходимо использовать комбинированную терапию, в особенности нацеленную на различные ВГС вирусные мишени. In vitro комбинированные исследования репликона показали, что эффекты от аддитивных до синергетических достигаются различными комбинациями ВГС ингибиторов. В большинстве случаев имеющаяся заявка на патент WO 2008/021927 раскрывает соединения, которые ингибируют функции NS5A белка, кодируемого ВГС. Патент США 6995174 раскрывает соединения, которые ингибируют функции NS3 протеазы, кодируемой ВГС. Настоящее изобретение относится к комбинациям специфического ВГС NS5A ингибитора и ингибитора ВГС NS3 протеазы, которые полезны для лечения ВГС. В первом аспекте настоящее изобретение обеспечивает композицию, содержащую терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, терапевтически эффективное количество соединения формулы (II) или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. В первом воплощении первого аспекта отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет от приблизительно 1:3 до приблизительно 3:1. Во втором воплощении первого аспекта отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет от приблизительно 1:2,5 до приблизительно 2,5:1. В третьем воплощении первого аспекта отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет приблизительно 1:1. В четвертом воплощении первого аспекта отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет приблизительно 1:2,5. В пятом воплощении первого аспекта отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет приблизительно 2,5:1. В шестом воплощении первого аспекта настоящее изобретение обеспечивает композицию, содержащую терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, терапевтически эффективное количество соединения формулы (II) или его фармацевтически приемлемой соли, одно или два дополнительных соединения, имеющих анти-ВГС активность, и фармацевтически приемлемый носитель. В седьмом воплощении по меньшей мере одно из дополнительных соединений представляет собой интерферон или рибавирин. В восьмом воплощении интерферон выбран из группы интерферон альфа 2 В, пегилированный интерферон альфа,интерферон лямбда, пегилированный интерферон лямбда, консенсусный интерферон, интерферон альфа 2 А и лимфобластоидный интерферон тау. Во втором аспекте настоящее изобретение обеспечивает способ лечения ВГС инфекции у пациента,включающий введение пациенту терапевтически эффективного количества композиции, содержащей терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, терапевтически эффективное количество соединения формулы (II) или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. В первом воплощении второго аспекта отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет от приблизительно 1:3 до приблизительно 3:1. Во втором воплощении второго аспекта отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет от приблизительно 1:2,5 до приблизительно 2,5:1. В третьем воплощении второго аспекта отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет приблизительно 1:1. В четвертом воплощении второго аспекта отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет приблизительно 1:2,5. В пятом воплощении второго аспекта отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли 2,5:1. В шестом воплощении первого аспекта настоящее изобретение обеспечивает способ лечения ВГС инфекции у субъекта, включающий введение субъекту терапевтически эффективного количества композиции, содержащей терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, терапевтически эффективное количество соединения формулы (II) или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, дополнительно содержащей одно или два дополнительных соединения, имеющих анти-ВГС активность до, после или совместно с указанной композицией. В седьмом воплощении по меньшей мере одно дополнительное соединение представляет собой интерферон или рибавирин. В восьмом воплощении интерферон выбран из интерферона альфа 2 В, пегилированного интерферона альфа, интерферона лямбда, пегилированного интерферона лямбда, консенсусного интерферона, интерферона альфа 2 А и лимфобластоидного интерферона тау. В третьем аспекте настоящее изобретение обеспечивает композицию, содержащую терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, терапевтически эффективное количество соединения формулы (II) или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, где отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет примерно 1:10. Другие аспекты настоящего изобретения могут включать подходящие комбинации воплощений,раскрытых здесь. Еще другие аспекты и воплощения могут быть найдены в описании, приведенном здесь. Все патенты, заявки на патенты и литературные ссылки, цитированные в соответствии с описанием,включены сюда посредством ссылки в полном объеме. В случае противоречий настоящее изобретение,включая определения, будет превалировать. Как используется в настоящем описании, следующие термины имеют следующие значения. При использовании здесь формы единственного числа включают формы множественного числа, если из контекста явно не следует иное. Некоторые соединения по настоящему изобретению могут существовать в различных стабильных конформационных формах, которые могут быть разделены. Торсионная асимметрия из-за ограниченного вращения вокруг асимметричной одинарной связи, например, из-за стерических препятствий или кольца напряжения, может позволить разделение различных конформеров. Настоящее изобретение включает в себя каждый конформационный изомер этих соединений и их смеси. Соединения по настоящему изобретению могут существовать как фармацевтически приемлемые соли. Термин "фармацевтически приемлемая соль", как используется здесь, представляет соли или цвиттерионные формы соединений по настоящему изобретению, которые являются водно- или маслянорастворимыми или дисперсивными, которые в рамках тщательных медицинских исследований являются подходящими для использования в контакте с тканями пациента без чрезмерной токсичности, раздражения, аллергического ответа или других проблем или осложнений, соизмеримых с приемлемым соотношением польза/риск, и являются эффективными для их использования по назначению. Соли могут быть приготовлены в течение финального выделения и очистки соединений или отдельно путем взаимодействия подходящего атома азота с подходящей кислотой. Типичные соли, полученные путем добавления кислоты, включают ацетат, адипат, альгинат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат,камфорсульфонат; диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, формат, фумарат,гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, мезитиленсульфонат,метансульфонат, нафталинсульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмоат, пектинат,персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, трихлорацетат, трифлуороацетат, фосфат, глутамат, бикарбонат, паратолуенсульфонат и ундеканоат. Примеры кислот, которые могут быть использованы для формирования фармацевтически приемлемых солей, включают неорганические соли, такие как соляная, бромисто-водородная, серная и фосфорная, и органические кислоты, такие как щавелевая, малеиновая, янтарная и лимонная. Основные соли могут быть получены в течение финального выделения и очистки соединений посредством взаимодействия протона кислоты с подходящим основанием, таким как гидроксид, карбонат или бикарбонат катиона металла или с аммонием или органическим первичным, вторичным или третичным амином. Катионы фармацевтически приемлемых солей включают литий, натрий, калий, кальций,магний и алюминий, также как и нетоксичные катионы четвертичного амина, такие как аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, диэтиламин,этиламин, трибутиламин, пиридин, N,N-диметилаланин, N-метилпиперидин, N-метилморфолин, дициклогексамин, прокаин, дибензиламин, N,N-дибензилфенэтиламин и N,N'-дибензилэтилендиамин. Другие типичные органические амины, пригодные для формирования основных солей, включают этилендиамин,этаноламин, диэтаноламин, пиперидин и пиперазин. Настоящее изобретение обеспечивает фармацевтические композиции, которые включают терапевтически эффективные количества соединений формулы (I) и (II) или их фармацевтически приемлемые соли, и один или более фармацевтически приемлемых носителя, разбавителя или наполнителя. Термин"терапевтически эффективное количество", как используется здесь, относится к общему количеству каждого активного компонента, которое пригодно для появления заметного эффекта у пациента, например продолжительного сокращения вирусной нагрузки. При применении индивидуального активного ингредиента, вводимого отдельно, этот термин относится к одному ингредиенту. Когда применяется комбинация, указанный термин относится к комбинированному количеству активных ингредиентов, которые вызывают терапевтический эффект, вводимые в комбинации, последовательно или одновременно. Соединения формул (I) и (II) и их фармацевтически приемлемые соли описаны выше. Носитель(и), разбавитель(и) или наполнитель(и) должны быть приемлемы в сочетании с другими ингредиентами препарата и неопасными для реципиента. В соответствии с другим аспектом настоящего изобретения здесь также обеспечен процесс приготовления фармацевтического состава, включающего смешанные соединения формул (I) и (II) или их фармацевтически пригодные соли с одним или более фармацевтически пригодными носителями, разбавителями или наполнителями. Термин "фармацевтически пригодный" при использовании здесь относится к таким соединениям, материалам, композициям и/или формам дозирования, которые в рамках медицинского заключения являются пригодными для использования в контакте с тканями пациента без чрезмерной токсичности, раздражения, аллергического ответа или других проблем или соизмеримой сложности с соотношением разумная польза/риск и являются эффективными для продолжительного использования. Фармацевтические композиции могут быть представлены в форме однократной дозы, содержащей предопределенное количество активных ингредиентов на единицу дозы. Как правило, фармацевтические композиции по настоящему изобретению могут быть введены от приблизительно 1 до приблизительно 5 раз в день или альтернативно путем продолжительной инфузии. Такие введения могут быть использованы в качестве продолжительной или экстренной терапии. Количество активного ингредиента, которое может быть скомбинировано с носителем для получения единичной дозы, может быть различным в зависимости от условий лечения, тяжести состояния, времени введения, способа введения, уровня выведения применяемого соединения, продолжительность лечения, а также возраста, пола, веса и состояния пациента. Предпочтительные единицы дозы композиций представляют собой дневную дозу или субдозу активного ингредиента, как было процитировано выше, или ее подходящую часть. Обычно лечение начинается с малых доз, значительно меньших, чем оптимальная доза соединения. После этого доза увеличивается небольшими порциями до оптимального эффекта в данных условиях. В общем наиболее жела-5 020527 тельно введение соединения в концентрации, которая будет приводить к антивирусным эффективным результатам без каких-либо вредных или опасных побочных эффектов. Также как все композиции по этому изобретению содержат комбинации двух соединений, имеющих анти-ВГС активность, оба соединения могут быть представлены в дозе, меньшей или равной обычной дозе, вводимой в режиме монотерапии. Уровни дозы от примерно 0,01 до примерно 250 мг/кг веса тела в день, предпочтительно от примерно 0,05 до примерно 100 мг/кг веса тела в день каждого соединения по настоящему изобретению типичны в режиме монотерапии для предупреждения и лечения ВГС опосредованных заболеваний. Композиции по настоящему изобретению могут быть приготовлены совместно с одним или более дополнительных терапевтических или профилактических агентов, например,в форме монолитных и/или би/мультислойных таблеток или могут быть введены раздельно от терапевтического(их) или профилактического(их) агента(ов). Фармацевтические композиции могут быть приготовлены для введения любым подходящим способом, например орально (включая подщечно или подъязычно), ректально, назально, местно (включая подщечно, подъязычно или трансдермально), вагинально или парентерально (в том числе подкожно,внутрикожно, внутримышечно, внутрисуставно, внутригрудинно, интратекально, в повреждение, внутривенные или внутрикожные инъекции или инфузии). Такие композиции могут быть приготовлены любым методом, известным в области фармацевтики, например путем ассоциации активного ингредиента с носителем(ями) или наполнителем(ями). Фармацевтические композиции, подготовленные для введения орально, могут быть представлены в качестве отдельных единиц, таких как капсулы или таблетки, порошки или гранулы, растворы или суспензии водных или неводных жидкостей, съедобные пены или пластины, либо жидкие эмульсии "масло в воде" или "вода в масле". В действительности для орального введения в форме таблеток или капсул активный ингредиент лекарственного препарата может быть скомбинирован с нетоксичным фармацевтически пригодным инертным носителем для орального введения, таким как этанол, глицерин, вода и т.п. Порошки приготавливаются путем измельчения вещества до подходящего размера частиц и смешиванием с измельченным таким же образом фармацевтического носителя, такого как съедобный карбогидрат, например, с крахмалом или маннитолом. Ароматизаторы, консерванты, диспергирующие добавки и красители также могут присутствовать. Капсулы производятся путем смешивания порошков, как описано выше, и наполнения сформированных желатиновых оболочек. Вещества, способствующие проскальзыванию, и смазывающие соединения, такие как коллоидный кварц, тальк, стеарат магния, стеарат кальция или твердый полиэтиленгликоль, могут быть добавлены к порошковой смеси до заправки капсулы. Дезинтегрирующий или растворяющий агент, такой как агар-агар, карбонат кальция или карбонат натрия, также может быть добавлен для улучшения доступности лекарственного средства при введении капсулы. Кроме того, при желании или необходимости, также могут быть включены в смесь подходящие связующие вещества, смазки, разрыхлители и красители. Подходящие связующие вещества включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, кукурузный подсластители,природные и синтетические смолы, такие как смолы акации, трагакант или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль и т.п. Смазочные соединения, используемые в этих лекарственных формах, включают олеат натрия, хлорид натрия и т.п. Дезинтегрирующие вещества включают, без ограничения, крахмал, метилцеллюлозу, агар, бентонит, ксантановую смолу и т.п. Таблетки формируются,например, путем приготовления порошковой смеси, гранулированием или измельчением, добавлением масла и разрыхлителей и прессованием в виде таблеток. Порошковая смесь готовится путем смешивания соединений, измельченных до подходящего размера, разбавителей или основ, как описано выше, и дополнительно со связующими веществами, такими как карбоксиметилцеллюлоза, альгинат, желирующими веществами, или поливинилпирролидоном, растворимым ингибитором, такими как парафин, ускорителем резорбции, таким как четвертичные соли, и/или адсорбирующим агентом, таким как бентонит, каолин или дикальцийфосфат. Порошковая смесь может быть гранулирована путем смачивания связующим раствором, таким как сироп, крахмальные пасты, растительная слизь Acadia, либо раствором целлюлозных или полимерных материалов, и формированием гранул. В качестве альтернативы гранулирования, порошковая смесь может быть пропущена через машину формирования таблеток, в результате чего формируются бруски в виде гранул. Гранулы могут быть смазаны для предупреждения прилипания с помощью таких добавок, как стеариновая кислота, стеарат соль, тальк, или минеральным маслом. Смеси со смазывающими веществами прессуют в таблетки. Соединения по настоящему изобретению также могут быть объединены с сыпучим инертным носителем и спрессованы в таблетки непосредственно, минуя стадии гранулирования или измельчения. Прозрачный или непрозрачный защитный слой состоит из уплотненного слоя шеллака, покрытия из сахара или полимерного материала, а также глянцевого покрытия воском. Такие покрытия также могут содержать красители в различных дозах. Жидкости для орального введения, такие как растворы, сиропы и эликсиры, могут быть приготовлены в формах единиц дозирования, обеспечивая предопределенное количество соединения. Сиропы могут быть приготовлены путем растворения вещества в подходящем ароматизированном жидком рас-6 020527 творе, в то время как эликсиры приготавливаются с помощью нетоксичных средств. Также могут быть добавлены растворители и эмульгирующие вещества, такие как этоксилированные изостеариловые спирты и эфиры полиоксиэтиленсорбита, консерванты, вкусовые добавки, такие как мятное масло или натуральные подсластители, сахарин или искусственные заменители сахара и т.п. В случае необходимости,единицами дозирования препарата для приема орально могут быть микрокапсулы. Препарат может быть приготовлен для длительного или поддерживающего высвобождения, как, например, с покрытием или внедрением частиц препарата в полимеры, воск и т.п. Соединения формул (I) и (II) и их фармацевтически приемлемые соли также могут быть введены в форме систем доставки в виде липосом, таких как малые униламелярные везикулы, большие униламелярные везикулы и мультиламелярные везикулы. Липосомы могут быть сформированы из различных фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолин. Соединения формулы (I) и их фармацевтически приемлемые соли могут быть введены с использованием моноклональных антител как индивидуальных переносчиков, связывающих молекулы соединения. Соединения могут быть также связаны с растворимыми полимерами в качестве направленных переносчиков лекарственных средств. Такие полимеры могут включать поливинилпироллидон, сополимеры пирана, полигидроксипропиласпертамидефенол, полигидроксиэтиленаспертамидефенол или полиэтиленеоксидеполилизин, замещенный остатками палитоила. Дополнительно соединения могут быть связаны с различными биодергадабельными полимерами, пригодными для контролируемого высвобождения лекарственного препарата, например полимолочная кислота, полиэпсилон капролактон, полигидрокси масляная кислота, полиортоэфиры, полиацетали, полидигидропираны, полицианоакрилаты и дигидропираны, и кросс-присоединенные или амфипатические блок-сополимеры гидрогелей. Фармацевтические композиции, пригодные для трансдермального введения, могут быть представлены для отдельных участков и направлены на тесный контакт с эпидермисом реципиента в течение длительного периода времени. Например, активный ингредиент может быть введен в участок путем ионофореза, как описано в общем виде в Pharmaceutical Research, 3(6), 318 (1986). Фармацевтические композиции, пригодные для местного введения, могут быть приготовлены как мази, кремы, суспензии, лосьоны, пудры, растворы, пасты, гели, спреи, аэрозоли или масла. Для лечения глаз или других внешних тканей, например рта или кожи, композиции предпочтительно применяются как местная мазь или крем. Когда приготавливается мазь, активные ингредиент может применяться с парафиновой или водорастворимой основой мази. Альтернативно, активный ингредиент может быть приготовлен в креме с водно-масляной основой крема типа "масло в воде" или "вода в масле". Фармацевтические композиции, подготовленные для местного введения в глаза, включают глазные капли, где активный ингредиент растворен или суспендирован в подходящем носителе, в частности водном растворителе. Фармацевтические композиции, пригодные для местного введения в рот, включают таблетки, пастилки и лосьоны для рта. Фармацевтические композиции, подготовленные для ректального введения, могут быть представлены как свечи или как клизмы. Фармацевтические композиции, подготовленные для назального введения, где носитель является твердым, включают порошки грубого помола, которые вводятся тем же способом, что и нюхательный табак, т.е. резким вдыханием через назальное отверстие из контейнера с порошком, расположенным вблизи носа. Подходящие композиции, где носитель жидкий, для введения как назальный спрей или назальные капли включают жидкие или масляные растворы активного ингредиента. Фармацевтические композиции, подготовленные для введения путем ингаляции, включают мелкие частицы пыли или аэрозоля, которые могут быть приготовлены средствами различных типов дозирования, дозированными аэрозолями под давлением, распылителями или инсуффляторами. Фармацевтические композиции, подготовленные для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пенок или спреев. Фармацевтические композиции, подготовленные для патентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатики и загустители, которые обеспечивают образование раствора, изотонического в отношении крови реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Препараты могут быть представлены в виде контейнеров с однократной или многократной дозой, например в виде запаянных ампул и флаконов, и могут быть сохранены в лиофилизированном состоянии, требующим только добавления стерильного жидкого носителя, например, воды для инъекций непосредственно перед использованием. Непредусмотренные для инъекций растворы и суспензии могут быть приготовлены в виде стерильных порошков, гранул и таблеток. Следует понимать, что в дополнение к ингредиентам, в частности отмеченным выше, композиции могут включать другие агенты, общепринятые в данной области с учетом типа препарата вопроса, например препараты, пригодные для перорального введения, могут включать ароматизаторы. Термин "пациент" включает как человека, так и других млекопитающих. Термин "лечение" относится к (i) предупреждению заболевания, расстройства или состояния у пациента, который мог быть предрасположенным к заболеванию, расстройству и/или состоянию, но еще не диагностированный как имеющий такое заболевание, расстройство или состояние; (ii) ингибированию заболевания, расстройства или состояния, т.е. задержке их развития; и (iii) облегчению заболевания, расстройства или состояния, т.е. вызывая регрессию заболевания, расстройства и/или состояния. В табл. 1, приведенной ниже, перечислены некоторые пояснительные примеры соединений, которые могут быть введены с композициями по настоящему изобретению. Композиции по настоящему изобретению могут быть введены вместе с другими соединениями с анти-ВГС активностью в качестве комбинированной терапии, совместно или раздельно, либо путем комбинирования соединению в одной композиции. Таблица 1 Композиции по настоящему изобретению также могут быть использованы в качестве лабораторных реагентов. Соединения могут быть инструментом в обеспечиваемых исследовательских средствах для дизайна анализа вирусной репликации, для проверки на животных моделях и исследований в области структурной биологии для дальнейшего изучения механизмов ВГС заболеваний. Дополнительно соединения по настоящему изобретению могут быть полезны для создания или определения связывающих сайтов других противовирусных соединений, например, при конкурентном ингибировании. Соединения по настоящему изобретению могут быть использованы для лечения или предупрежде- 15020527 ния вирусного заражения материалов, следовательно, уменьшая риск вирусной инфекции лабораторного и медицинского персонала или пациентов, которые контактируют с такими материалами, например с кровью, тканями, хирургическими инструментами и одеждой, а также аппаратами и материалами для сбора и переливания крови. Настоящее изобретение в настоящее время описано в связи с некоторыми воплощениями, не ограничивая объем притязаний, напротив, настоящее изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем притязаний. Таким образом, следующие примеры, которые включают в себя конкретные варианты, призваны проиллюстрировать одну из форм настоящего изобретения, при том понимании, что примеры предназначены для иллюстрации некоторых вариантов и представлены для представления наиболее полезных и легких в понимании процедур и концептуальных аспектов. Исходные материалы могут быть получены из коммерческих источников или подготовлены широко применяемыми и описанными в литературе способами, известными специалистам в этой области. Примеры Соединения. Ингибитор ВГС NS5A (соединение формулы (I может быть приготовлено в соответствии с процедурой, описанной в общем виде в заявках на патенты WO 2008/021927 или WO 2009/020825. Ингибитор ВГС NS3 (соединение формулы (II может быть приготовлен в соответствии с процедурами, описанными в общем виде в патенте США 6995174 и в заявке на патент США 12/547158. Рекомбинантный IL29 (rIL-29 или rIFN1) экспрессирован в Е.coli, как модифицированная метилированная с N-конца форма человеческого IL-29. Рекомбинантный IL-28A (rIFN2) и rIL28B (rIFN3) также экспрессирован в E.coli. Пэгилированный rIFN1 (pegIFN1) представляет собой ковалентно конъюгированный rIFN1 (молекулярной массы 19,6 кДа) и 20 кДа линейной цепи полиэтилен гликоля (ПЭГ). Оба rIFN1 и pegIFN1,синтезированные фирмой Zymogenetics, были в значительной степени охарактеризованы с помощью многочисленных методов, включая аминокислотный анализ, N-концевая последовательность, Size ExclusionChromatography-Multi-Angle Light Scattering (SEC-MALS), анализ пептидной карты и общий масс анализ. Комбинированные анализы rIFN1 подтверждают, что очищенный белок, прежде всего в форме 1, с двумя дисульфидными в ожидаемой конформации. Кроме того, анализы подтверждают, что последовательность, как и ожидалось, основана на кДНК и экспрессии в E.coli, при этом белок имеет дополнительный N-терминальный метионин и негликозилирован. Комбинированный анализ pegIFN подтверждает, что белковая часть молекулы по-прежнему в ожидаемом виде и в ожидаемой конформации. Кроме того, анализ показал, что молекулы, в основном, ПЭГ на N-конце, как и ожидалось. Анализ SECMALS и все масс-спектрометрии подтверждают, что молекулярная масса составляет около 39,6 кДа, как и ожидалось от соединения с rIFN1 с 20 кДа ПЭГ. Клеточные линии. Клеточная линия Huh-7, использованная в этих исследованиях, была получена от Dr. Ralf Bartenschlager (University of Heidelberg, Heidelberg, Germany) и размножена в DMEM, содержащем 10% FBS, 10 ед./мл пенициллина и 10 мкг/мл стрептомицина. Репликоны ВГС, использованные в этих исследованиях,были произведены Bristol-Myers Squibb с использованием процедур, описанных в WO 2004/014852. Кодирующая последовательность известного генотипа 1b ВГС репликона (Lohmann, V., F. Korner, J.-O.Koch, U. Herian, L. Theilmann, and R. Bartenschlager 1999, Science 285:110-113) была синтезирована Operon Tehnologies, Inc. (Alameda, CA), используя набор последовательностей EMBLдоступа AJ242652,нуклеотиды от 1801 до 7758. Функциональный репликон был затем собран в плазмиду pGem9zf(+)(Promega, Madison, WI) с использованием стандартных методик молекулярной биологии. Для создания репликона, кодирующего люциферазный переносчик, ген, кодирующий гуманизированный Renilla Luciferase белок, был введен выше неомицин фосфотрансферазного гена. Полученный репликон содержит (i) ВГС 5' UTR, соединенный с 12 аминокислотами капсидного белка, (ii) ген ренила люциферазы, (iii) ген неомицин фосфотрансферазы (neo), (iv) IRES из вируса энцефаломиокардита (EMCV), (v) ВГС NS3 доNS5B гены и ВГС 3' UTR. Репликон 1 а был получен с использованием клона, описанного выше путем замещения 1b ВГС последовательности последовательностью генотипа 1 а из pCV-H77c (Yanagi, M., R. Purcell, S. Emerson, J.Bukh 1997, PNAS, 94:8738-8743; Jens Bukh, National Institute of Health, Bethesda, MD 20892) с использованием стандартных методик молекулярного клонирования. Для получения более эффективного репликона 1 а были введены адаптивные мутации P1496L (NS3) и S2204I (NS5A), используя Quick Change XL набор для сайт-направленного мутагенеза в соответствии с инструкциями производителя (Stratagene Corporation, La Jolla, CA). ВГС репликон был выделен из колонии, как описано Lohman и др. (Lohmann, V., F. Korner, J.-O.Koch, U. Herian, L. Theilmann и R. Bartenschlager 1999, Science 285:110-113), и использован во всех экспериментах. Вкратце, клоны репликона были линеаризированы ScaI и РНК транскрипты синтезированы invitro с использованием Т 7 MegaScript транскрипционного набора (Ambion, Austin, ТХ) в соответствии с инструкциями производителя. 10 в 20 мкг in vitro транскрибированной РНК реплика были введены в 4- 16020527 5106 Huh-7 клетки путем трансфекции с помощью DMRIE-C реагента (Invitrogen Corporation, Carlsbad,CA) в соответствии с протоколом производителя. После 24 ч была добавлена селективная среда, содержащая 0,5 мг/мл генетицина (G418, Gibco-BRL, Rockville, MD), которая менялась каждые 3-5 дней. После примерно 4 недель клетки были готовы для дальнейшего анализа. Клетки сохранялись при 37 С вDMEM (Gibco-BRL, Rockville, MD) с 10% телячьей сыворотки, инактивированной нагреванием (Sigma),пенициллин/стрептомицин и 0,5 мг/мл G418. Оценка цитотоксичности и люциферазной активности клеточной культуры. Для определения эффективности соединения клетки с ВГС репликонами высевались с плотностью 104 на лунку в 96-луночные планшеты в DMEM среду, содержащую 10% FBS. После ночной инкубации соединения, разведенные в DMSO стерильно, или только DMSO были добавлены в каждую лунку до конечной концентрации DMSO 0,5%. Планшеты клеток затем инкубировались при 37 С в течение 3 дней до анализа цитотоксичности и ингибирования ВГС. Жизнеспособность клеток оценивалась с использованием набора Alamar blue, a значения СС 50 рассчитывались с использованием уравнения среднего эффективного. Планшеты затем отмывались дважды с помощью PBS и оценивалась активность ренилла люциферазы с помощью Dual-Glo Luciferase системы анализа (Promega Corporation, Madison, WI) в соответствии с инструкциями производителя. Планшеты анализировали на TopCount NXT микропланшетном счетчике сцинциляции и люминисценции (Packard Instrument Company). 50% эффективная концентрация (ЕС 50) рассчитывалась с помощью Excel Fit (Version 2.0, Build 30). Известные х (концентрация соединений) и у(% относительно контрольных лунок с только DMSO) значения были использованы для расчета ЕС 50 с помощью Excel Fit уравнения 205, представленного как у=А+B-A)/(1+C/x)D, где А и В соответствуют нижнему и верхнему плато кривой соответственно, С равно среднему значению х на кривой, a D соответствует наклону кривой. Исследование комбинации. Для четырех исследований комбинации ингибиторов IFN- и ингибиторов ВГС NS5A и NS3 протеазы были протестированы каждый при одиннадцати концентрациях. Основной раствор, 200 раз желаемой конечной концентрации для анализа, был приготовлен 3-кратным разведением DMSO до добавления к клеткам/среде. Соединения тестировались в качестве монотерапии и в комбинации с соединением формулы (I) в различных соотношениях концентраций. Клетки обрабатывались соединениями в течение 3 дней, а затем степень ВГС ингибирования оценивалась с помощью анализа люциферазной активности,как описано выше. Потенциальная цитотоксичность комбинированных агентов также параллельно анализировалась с помощью красителя Alamar blue. Степень антагонизма, аддитивности или синергизма определялись в отношении диапазона концентраций лекарственного препарата, были построены кривые ответа на комбинации для оценки противовирусного эффекта лечения комбинациями лекарственных средств. Эффект комбинации лекарственных препаратов был проанализирован с помощью метода Chouin Drug Combination Studies", Pharmacological Reviews. 2006; 58(3):621-81. Все значения рассчитывались с помощью программ биостатистики SAS Proc NLIN, и четырехпараметрической логистики. Все индексы комбинации были рассчитаны для оценки отклонения от аддитивности с использованием изоболограммных методов. Асимптотические доверительные интервалы также были подсчитаны для каждого индекса комбинации. Эти интервалы использованы для оценки отклонения от аддитивности путем сравнения граничных значений - нижняя граница интервала больше 1 показывает антагонизм, верхняя граница меньше 1 показывает синергизм, а значение 1 в интервале соответствует аддитивности. Результаты. Устойчивость к антивирусной терапии стала главной проблемой в руководстве пациентов с хроническими вирусными инфекциями. Для достижения устойчивого противовирусного ответа необходимо использовать комбинированную терапию, в особенности направленные на отдельные ВГС вирусные мишени. В этой работе мы используем ВГС репликон для оценки степени антагонизма, аддитивности или синергизма при комбинировании ингибитора ВГС NS5A формулы (I) с ингибитором протеазы NS3 формулы (II), а также для сравнения эффекта при комбинировании IFN-, pegIFN или rIFN1 с обоими соединениями. Для экспериментов, показанных в табл. 2-6, ингибитор NS5A формулы (I) и ингибитор протеазыNS3 формулы были протестированы либо одиночно, либо с различными интерферонами, применяемыми для ВГС системы репликации, и представлены оцененные ЕС 50 значения для каждого, также как и индексы комбинации (CI). Потенциальная цитотоксичность этих комбинированных агентов также была проанализирована как на параллельные, так и на недостигаемые СС 50 значения. Комбинации ингибитора NS5A формулы (I) с ингибитором протеазы NS3 формулы (II) оценивались на клетках двух генотипов репликона 1 а и 1b. Как показано в табл. 2, в целом результаты от двух экспериментов на генотипе 1 а показывают аддитивность с синергетическими эффектами, которые наблюдались в одном эксперименте при 75 и 95% эффективных дозах в соотношении 2,5:1 ингибитора NS5A к ингибитору протеазы NS3. Таблица 2 Комбинации ингибитора ВГС NS5A формулы (I) с ингибитором протеазы NS3 формулы (II) на генотипе 1 а Эффекты соединения NS5A формулы (I) в комбинации с ингибитором протеазы NS3 формулы (II) на генотип 1b приведены в табл. 3. В целом, результаты всех трех экспериментов показывают смешанную аддитивность/синергизм. Ингибитор NS5A формулы (I) также был протестирован в экспериментах с комбинациями трех лекарственных препаратов IFN- и ингибитором NS3 формулы (II), используя клетки с репликонами генотипа 1b. Результаты четырех экспериментов показывают аддитивность/синергизм 50% и синергизм 75 и 90% эффективных значений (табл. 4). Тройные комбинации pegIFN с ингибитором протеазы NS3 формулы (II) и ингибитором NS5A формулы (I) были протестированы на аддитивность. Данные от этих экспериментов подытожены в табл. 5. Аддитивность наблюдалась во всех трех экспериментах на эффективном уровне 50%. При эффективных уровнях 75 и 90% аддитивность наблюдалась в экспериментах 1 и 3, а синергизм в эксперименте 2. В целом, эти результаты показывают смешанную аддитивность и синергизм для комбинации pegIFN с ингибиторами протеазы NS3 и NS5A. Эти результаты согласуются с результатами для rIFN1 в комбинации с ингибитором протеазы NS3 формулы (II) и ингибитором NS5A формулы (I) (табл. 6). Таблица 5 Исследование тройной комбинации с использованием pegIFN с ингибитором NS5A формулы (I) и ингибитором протеазы NS3 формулы (II) Таблица 6 Использование тройной комбинации с использованием rIFN1 с ингибитором NS5A формулы (I) и ингибитором NS3 формулы (II) Эти результаты демонстрируют, что комбинированное лечение клеток с репликонами вируса с помощью ингибитора NS5A формулы (I) и ингибитора NS3 протеазы формулы (II), с или без интрона A,rIFN1 или pegIFN приводит к аддитивным и синергетическим противовирусным эффектам. Важно, что ни антагонистические эффекты, ни улучшение цитотоксичности не наблюдалось ни с одной из этих комбинаций. Следовательно, эти комбинации являются прекрасными кандидатами для комбинированных режимов лечения пациентов, инфицированных ВГС. Специалистам в данной области будет понятно, что настоящее изобретение не ограничивается вышеупомянутыми иллюстрирующими примерами и что оно может быть воплощено в других частных формах, не отходя от основных замыслов настоящего изобретения. Таким образом, желательно, чтобы примеры, основанные на всех замыслах настоящего изобретения, оценивались как иллюстрирующие и неограничивающие, со ссылкой на приложенную формулу изобретения, а не на приведенные примеры, а все модификации, эквивалентные по смыслу формуле изобретения, включались в объем притязаний настоящего изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция для лечения вируса гепатита С (ВГС) инфекции у пациента, содержащая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, терапевтически эффективное количество соединения формулы (II) или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. 2. Композиция по п.1, где отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет от примерно 1:3 до примерно 3:1. 3. Композиция по п.2, где отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет от примерно 1:2,5 до примерно 2,5:1. 4. Композиция по п.3, где отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет примерно 1:1. 5. Композиция по п.3, где отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет примерно 1:2,5. 6. Композиция по п.3, где отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли составляет примерно 2,5:1. 7. Композиция по п.1, дополнительно содержащая один или два дополнительных соединения, имеющих анти-ВГС активность. 8. Композиция по п.7, где по меньшей мере одно дополнительное соединение представляет собой интерферон или рибавирин. 9. Композиция по п.8, где интерферон выбран из интерферона альфа 2 В, пэгилированного интерферона альфа, консенсусного интерферона, интерферона альфа 2 А, интерферона лямбда, пэгилированного интерферона лямбда и лимфобластоидного интерферона тау. 10. Способ лечения ВГС-инфекции у пациента, включающий введение пациенту терапевтически эффективного количества композиции по п.1. 11. Способ по п.10, дополнительно включающий введение пациенту одного или двух дополнительных соединений, имеющих анти-ВГС-активность, до, после или одновременно с композицией по п.1. 12. Способ по п.11, где по меньшей мере одно дополнительное соединение представляет собой интерферон или рибавирин. 13. Способ по п.12, где интерферон выбран из интерферона альфа 2 В, пэгилированного интерферона альфа, консенсусного интерферона, интерферона альфа 2 А, интерферона лямбда, пэгилированного интерферона лямбда и лимфобластоидного интерферона тау.
МПК / Метки
МПК: A61P 31/12, A61K 31/4178, A61K 38/16, A61K 45/06
Метки: комбинации, ингибиторов, вируса, гепатита
Код ссылки
<a href="https://eas.patents.su/24-20527-kombinacii-ingibitorov-virusa-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Комбинации ингибиторов вируса гепатита с</a>
Предыдущий патент: Применение n-(4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)-4-(4-метил-2-тиенил)-1-фталазинамина для лечения резистентного к антимитотическому агенту рака
Следующий патент: Макроциклы в качестве ингибиторов фактора xia
Случайный патент: Мобильная многофункциональная установка для очистки грунтов и рекультивации почв и пахотных земель от нефтяных загрязнений