2,3-двузамещенные -4 (3н)-хиназолиноны и содержащая их фармацевтическая композиция
Формула / Реферат
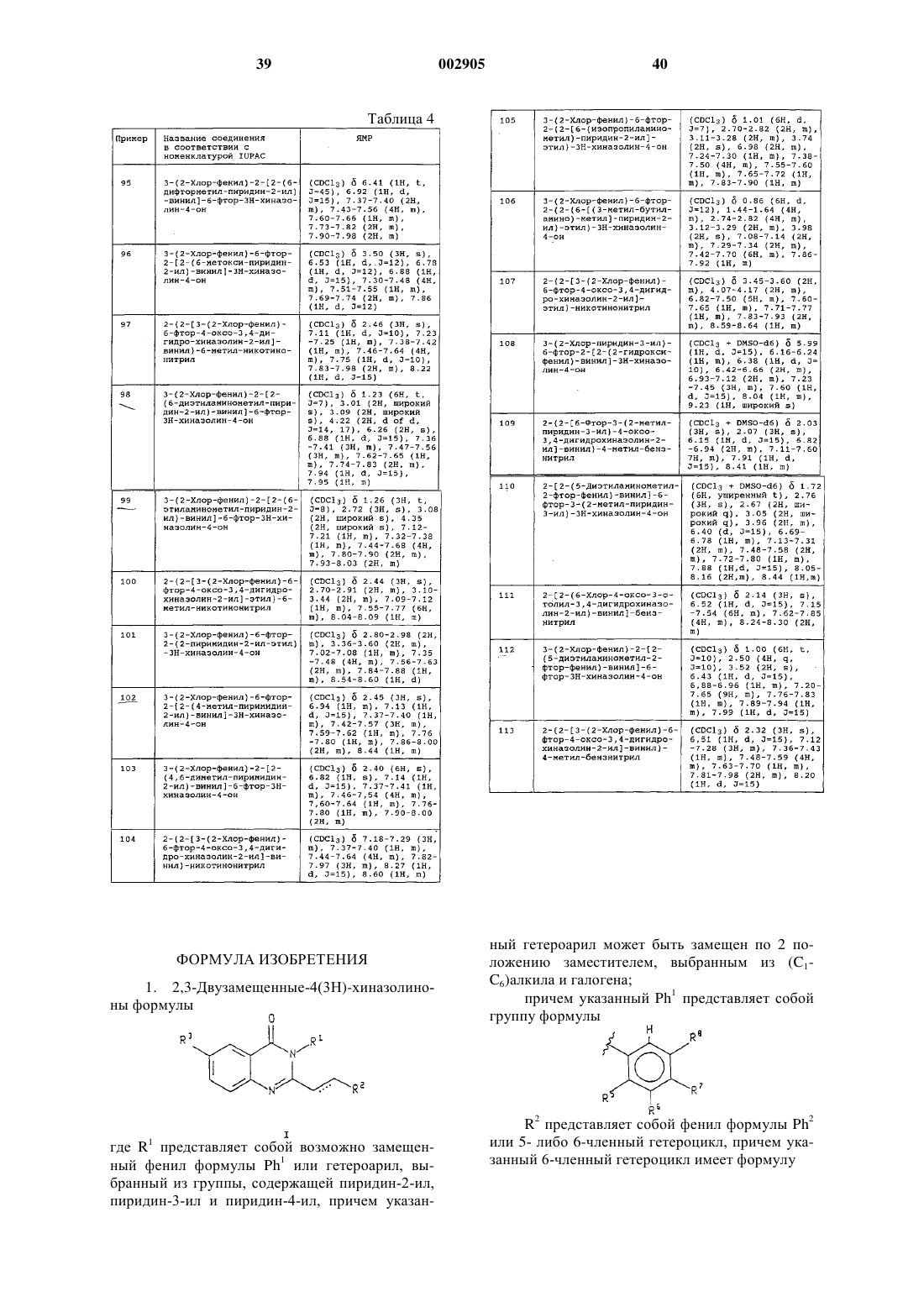
1. 2,3-Двузамещенные-4(3Н)-хиназолиноны формулы
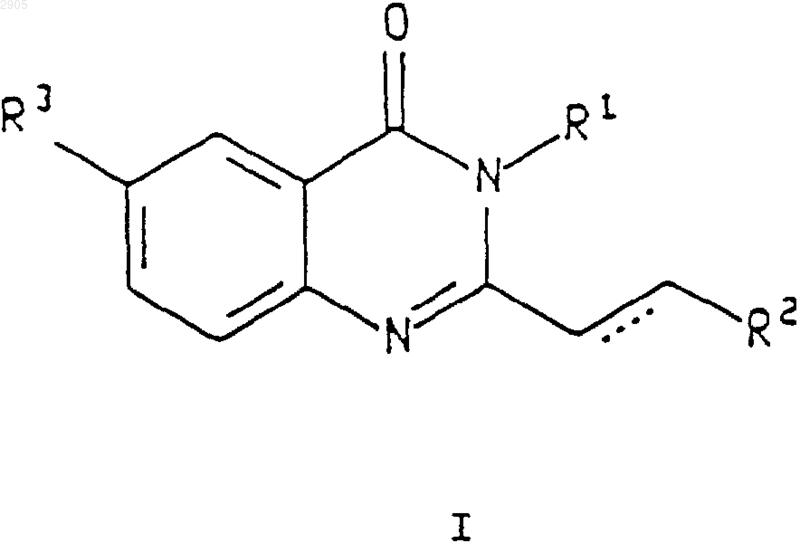
где R1 представляет собой возможно замещенный фенил формулы Ph1 или гетероарил, выбранный из группы, содержащей пиридин-2-ил, пиридин-3-ил и пиридин-4-ил, причем указанный гетероарил может быть замещен по 2 положению заместителем, выбранным из (C1-C6)алкила и галогена;
причем указанный Ph1 представляет собой группу формулы
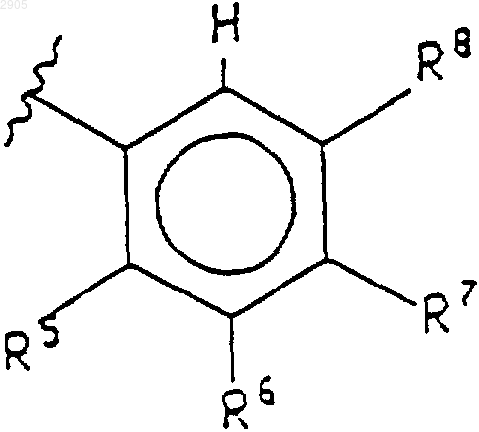
R2 представляет собой фенил формулы Ph2 или 5- либо 6-членный гетероцикл, причем указанный 6-членный гетероцикл имеет формулу

где N представляет собой азот; указанные положения К, L и М в кольце могут быть независимо выбраны из углерода или азота при том условии, что 1) только один из К, L или М может быть азотом и 2) когда К, L или М представляет собой азот, то отсутствуют их соответствующие R15, R16 или R17;
указанный 5-членный гетероцикл имеет формулу
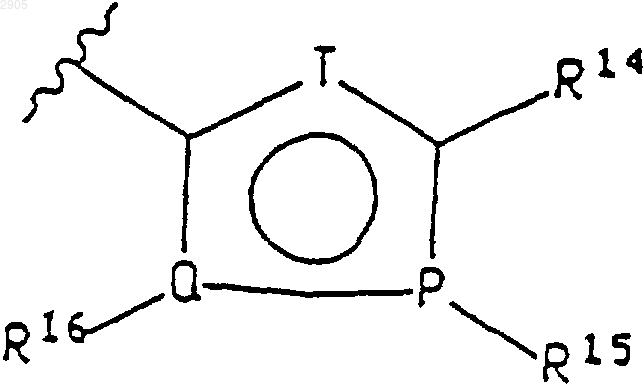
где Т представляет собой -СН-, N, NH, О или S; положения Р и Q в кольце могут быть независимо выбраны из углерода, азота, кислорода или серы при том условии, что только один из Р, Q или Т может быть кислородом или серой и, по меньшей мере, один из Р, Q или Т должен быть гетероатомом;
указанный Рh2 представляет собой группу формулы
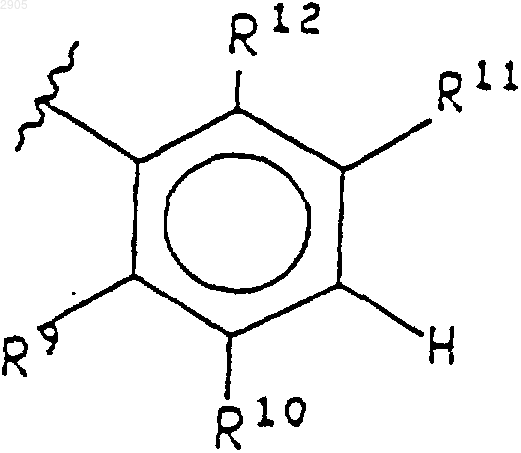
R3 представляет собой водород, галогено или (С1-С6)алкил;
R5 представляет собой водород, (С1-С6)алкил или галогено;
R6 представляет собой водород или галогено;
R7 представляет собой водород или галогено;
R8 представляет собой водород или галогено;
R9 представляет собой водород, галогено, (С1-С6)алкил, ди(С1-С6)алкил-N-(СН2)р-, гидрокси или -CN;
R10 представляет собой водород, (С1-С6)алкил, ди-(C1-C6)aлкил-N-(CH2)p-, CHO или НО-(С1-С6)алкил;
R11 представляет собой водород или галогено;
R12 представляет собой водород, -CN или галогено;
R13 представляет собой (C1-C6)алкил-(С=O)-;
R14 выбран из водорода, галогено, (С1-С6)алкила, возможно замещенного атомами галогена числом от одного до трех,
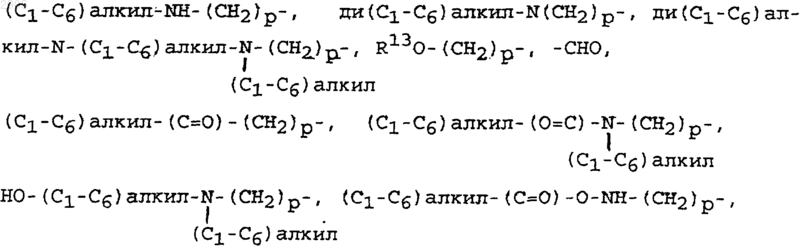
ди(С1-С6)алкил-N-(С1-С6)алкил-(С=O)-О-(СН2)p-, гидрокси-(C1-C6)алкила-, (C1-C6)алкил-O-(C1-C6)алкила-, -CN, пиперидин-(CH2)p-, пирролидин-(СН2)p- и 3-пирролин-(СН2)p-; причем указанный пиперидин группировки пиперидин-(СН2)p может быть замещен по любому из углеродных атомов кольца, способных к поддержанию дополнительной связи, заместителем (C1-C6)алкилом;
R15 представляет собой водород или (С1-С6)алкил;
R16 представляет собой водород или (С1-С6)алкил;
R17 представляет собой водород, -CN, ди(С1-С6)алкил-N(С1-С6)алкил-, (С1-С6)алкоксигруппу или CHF2;
каждое р независимо представляет собой целое число от нуля до 4;
причем подчеркнутая пунктиром связь представляет собой возможно двойную связь;
при условии, что 1) когда R9 представляет собой водород, один из R11 и R12 является отличным от водорода; 2) когда R3 представляет собой водород, R6, R7 и R8 представляют собой водород, а R5 представляет собой хлор или метил, то (а) R2 не может быть незамещенным фенилом, тиенилом либо фурилом или (б) R9 не может быть гидроксильной или метильной группой; 3) когда R3 представляет собой водород либо хлор, R5 представляет собой метил, R6, R7 и R8 представляют собой водород, а К, L и М равны углероду, то (а) один из радикалов от R14 до R17 должен быть отличным от водорода или (б) R17 должен быть отличным от водорода; 4) когда R1 представляет собой незамещенный пиридин-2-ил, а R3 представляет собой водород, бром либо иод, то R2 не может быть незамещенным фенилом; 5) когда R7 представляет собой хлор; R5, R6 и R8 представляют собой водород и R3 является водородом, то (а) R2 не может быть незамещенным фенилом, пиридилом, тиенилом либо фурилом или (б) R9 не может быть гидроксильной группой, когда R10 и R11 представляют собой водород, 6) когда R2 представляет собой незамещенный пиридин-2-ил, R5 и R7 представляют собой водород и R3 является водородом, то R6 или R8 должен отличаться от хлора; 7) когда R2 представляет собой незамещенный фенил, R3 является водородом и R5 и R7 представляют собой водород, то один из R6 или R8 должен быть отличным от хлора;
и фармацевтически приемлемые соли таких соединений.
2. Соединение по п.1, где R3 представляет собой фтор.
3. Соединение по п.1, где R1 представляет собой Ph1 и один из R5, R6, R7 или R8 представляет собой фтор, бром, хлор или метил.
4. Соединение по п.1, где R1 представляет собой Ph1 и R5 представляет собой фтор, бром, хлор или метил.
5. Соединение по п.2, где R1 представляет собой Ph1 и R5 представляет собой фтор, бром, хлор или метил.
6. Соединение по п.1, где R2 представляет собой Ph2 и либо R9 представляет собой фтор, -хлор, -CN или гидроксильную группу, либо R10 представляет собой -СНО, метил или ди(С1-С6)алкил-N-(СН2)p-.
7. Соединение по п.2, где R2 представляет собой Ph2 и либо R9 представляет собой фтор, -хлор, -CN или гидроксильную группу, либо R10 представляет собой -СНО, -метил или ди(С1-С6)алкил-N-(СН2)p-.
8. Соединение по п.1, где R1 представляет собой указанный гетероарил, возможно замещенный по 2 положению галогено или (С1-C6)алкилом.
9. Соединение по п.2, где R1 представляет собой указанный гетероарил, возможно замещенный по 2 положению галогено или (С1-C6)алкилом.
10. Соединение по п.6, где R1 представляет собой указанный гетероарил, возможно замещенный по 2 положению галогено или (C1-C6)алкилом.
11. Соединение по п.1, где R1 представляет собой пиридин-3-ил, замещенный по 2 положению пиридинового кольца хлором или метилом.
12. Соединение по п.1, где R2 является гетероарилом, представляющим собой либо возможно замещенный 6-членный гетероцикл, в котором К, L и М являются углеродом, или К и L представляют собой углерод, а М представляет собой азот (например, пиримидин-2-ил), либо указанный гетероарил представляет собой возможно замещенный 5-членный гетероцикл, в котором Т является азотом, Р представляет собой серу, a Q представляет собой углерод, или Т представляет собой азот либо серу, Q представляет собой азот либо серу, а Р представляет собой углерод, или Т представляет собой кислород, а Р и Q каждый представляют собой углерод.
13. Соединение по п.1, где R2 представляет собой возможно замещенный 6-членный гетероцикл, в котором К, L и М представляют собой углерод, R14 представляет собой водород, -СНО, хлор, фтор, метил, (С1-С6)алкил-NН-(СН2)p-, ди(С1-С6)алкил-N-(СН2)p- или цианогруппу; R17 представляет собой водород или ди(С1-С6)алкил-N-(С1-С6)алкил; либо R15 или R16 независимо представляют собой водород или метил.
14. Соединение по п.1, где R2 представляет собой возможно замещенный 6-членный гетероцикл, в котором К, L и М представляют собой углерод, а R14 представляет собой водород, -СНО, метил, (С1-С6)алкил-NН-(СН2)p-, ди(С1-С6)алкил-N-(СН2)p или цианогруппу.
15. Соединение по п.1, где R2 представляет собой возможно замещенный 5-членный гетероцикл, в котором Т представляет собой азот, Р представляет собой серу и Q представляет собой углерод, а R14 представляет собой водород, хлор, фтор или метил; и R15 и R16, каждый независимо, представляют собой водород или метил.
16. Соединение по п.1, где R2 представляет собой возможно замещенный 5-членный гетероцикл, в котором Т представляет собой азот или серу, Q представляет собой серу или азот и Р представляет собой углерод, а R14 выбран из водорода, хлора, фтора и метила; и R15 выбран из водорода и метила.
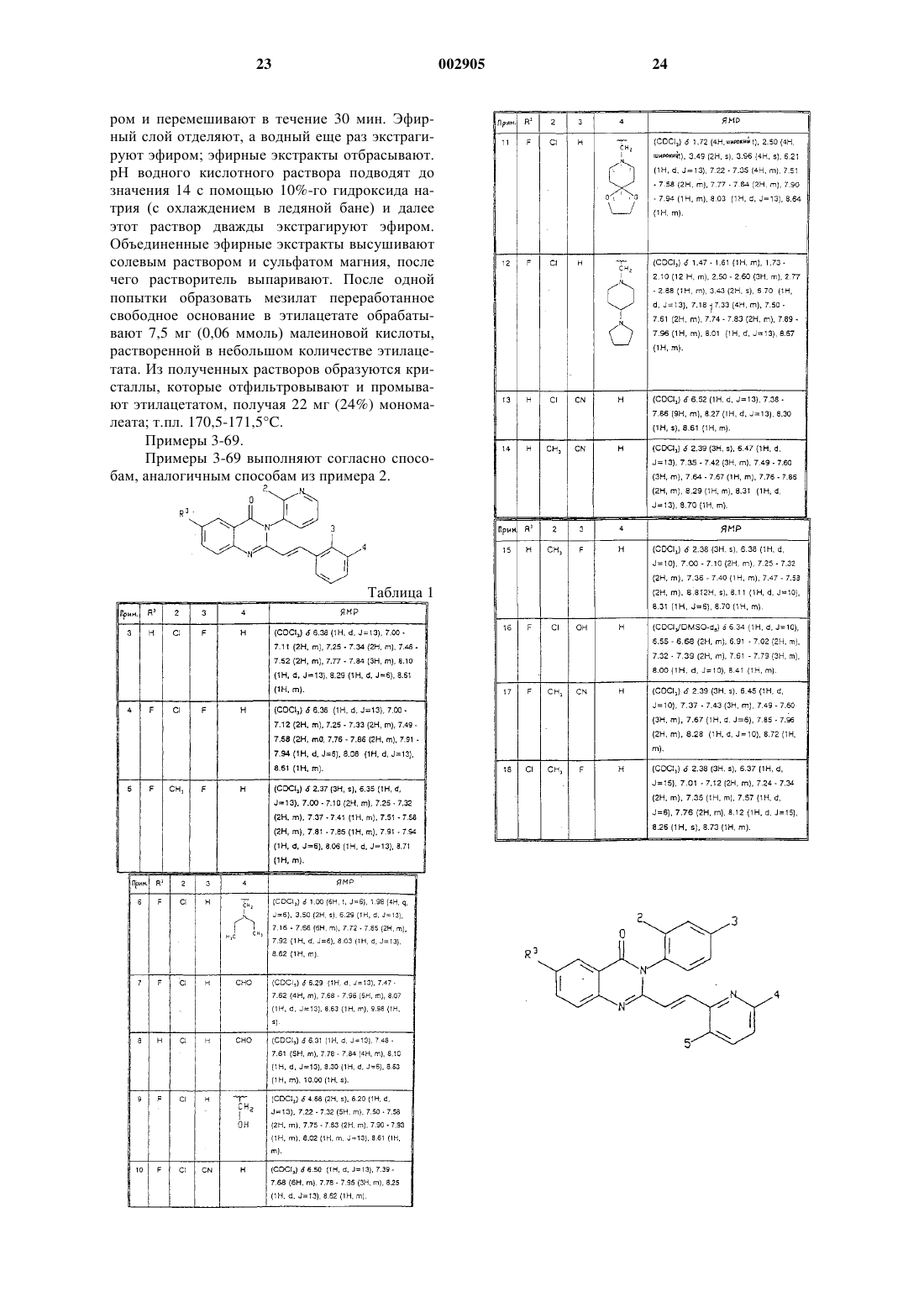
17. Соединение по п.1, выбранное из группы, содержащей
3-(2-хлорфенил)-2-[2-(5-диэтиламинометил-2-фторфенил)винил]-6-фтор-3Н-хиназолин-4-он;
3-(2-хлорфенил)-2-[2-(6-диэтиламинометилпиридин-2-ил)винил]-6-фтор-3Н-хиназолин-4-он;
3-(2-хлорфенил)-2-[2-(6-этиламинометилпиридин-2-ил)винил]-6-фтор-3Н-хиназолин-4-он;
3-(2-бромфенил)-2-[2-(6-диэтиламинометилпиридин-2-ил)винил]-6-фтор-3Н-хиназолин-4-он;
3-(2-хлорфенил)-6-фтор-2-[2-(6-метоксиметилпиридин-2-ил)винил]-3Н-хиназолин-4-он;
6-фтор-3-(2-метилпиридин-3-ил)-2-[2-(2-метилтиазол-4-ил)винил]-3Н-хиназолин-4-он;
3-(2-хлорфенил)-6-фтор-2-[2-(4-метилпиримидин-2-ил)винил]-3Н-хиназолин-4-он;
3-(2-хлорфенил)-6-фтор-2-{2-[6-(изопропиламинометил)пиридин-2-ил]этил}-3Н-хиназолин-4-он; и
2-[2-(5-диэтиламинометил-2-фторфенил)винил]-6-фтор-3-(2-метилпиридин-3-ил)-3Н-хиназолин-4-он.
18. Фармацевтическая композиция, обладающая антагонистической активностью по отношению к АМРА-рецептору, содержащая эффективное количество соединения формулы I по п.1 и фармацевтически приемлемый носитель.
Текст
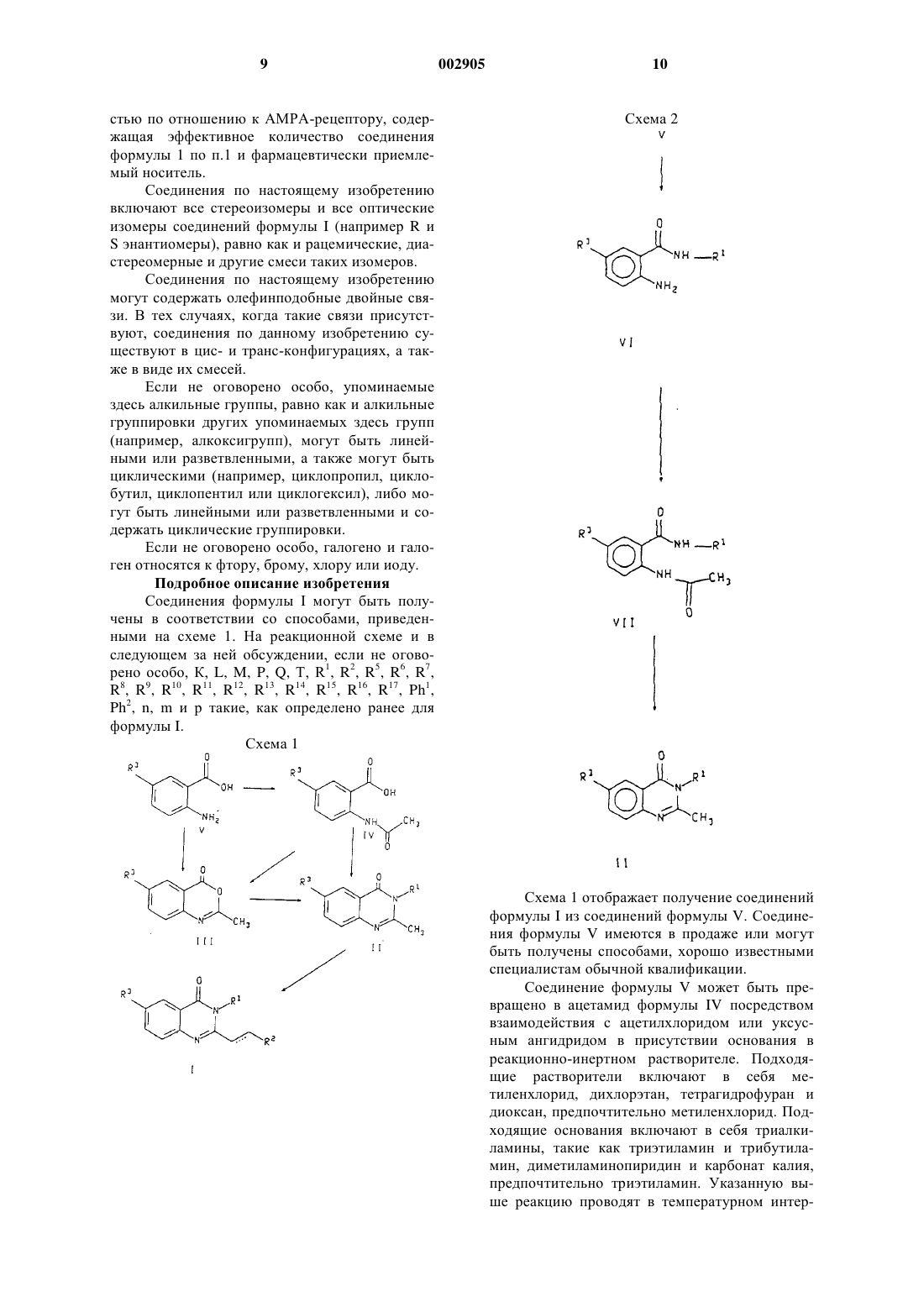
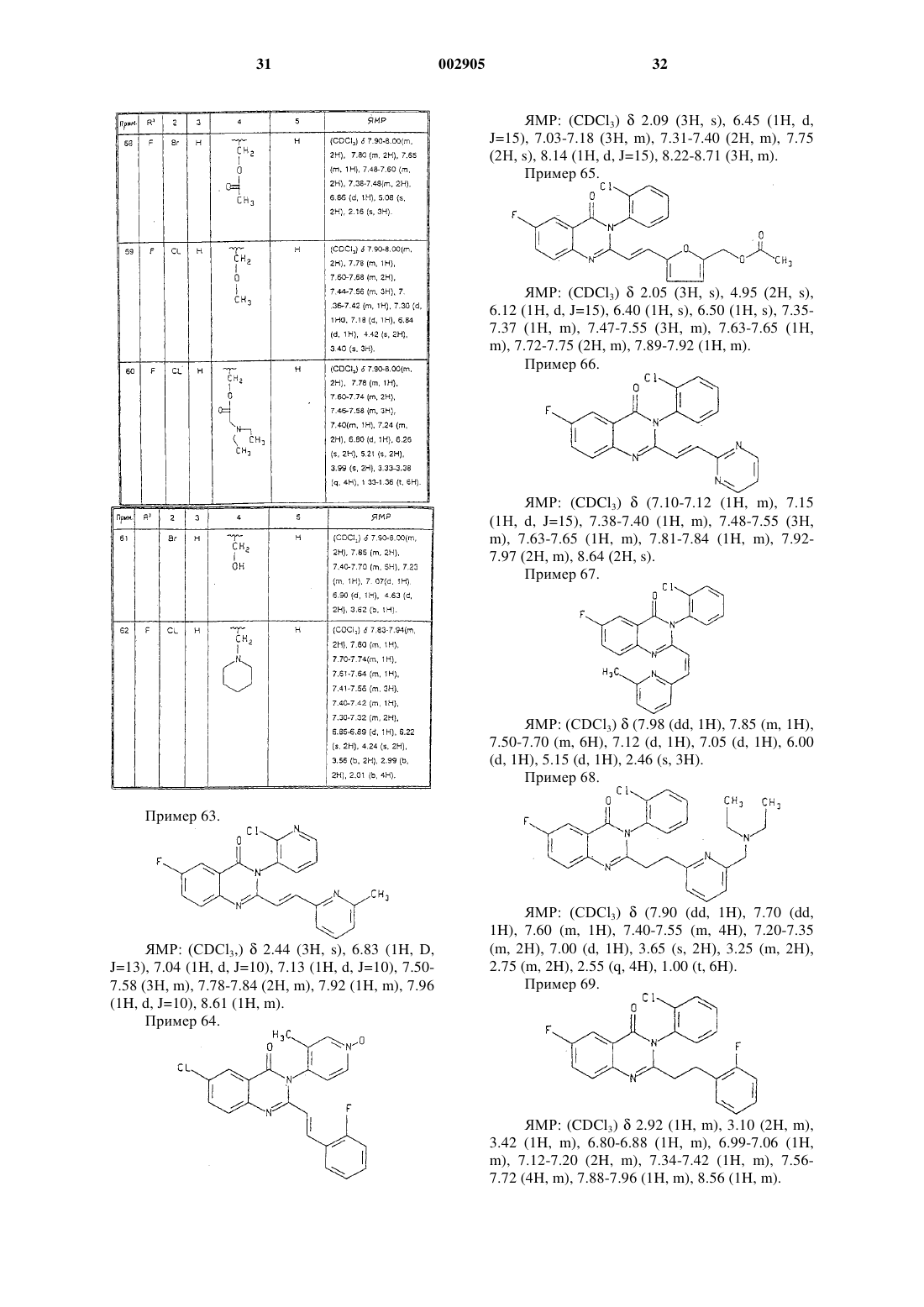
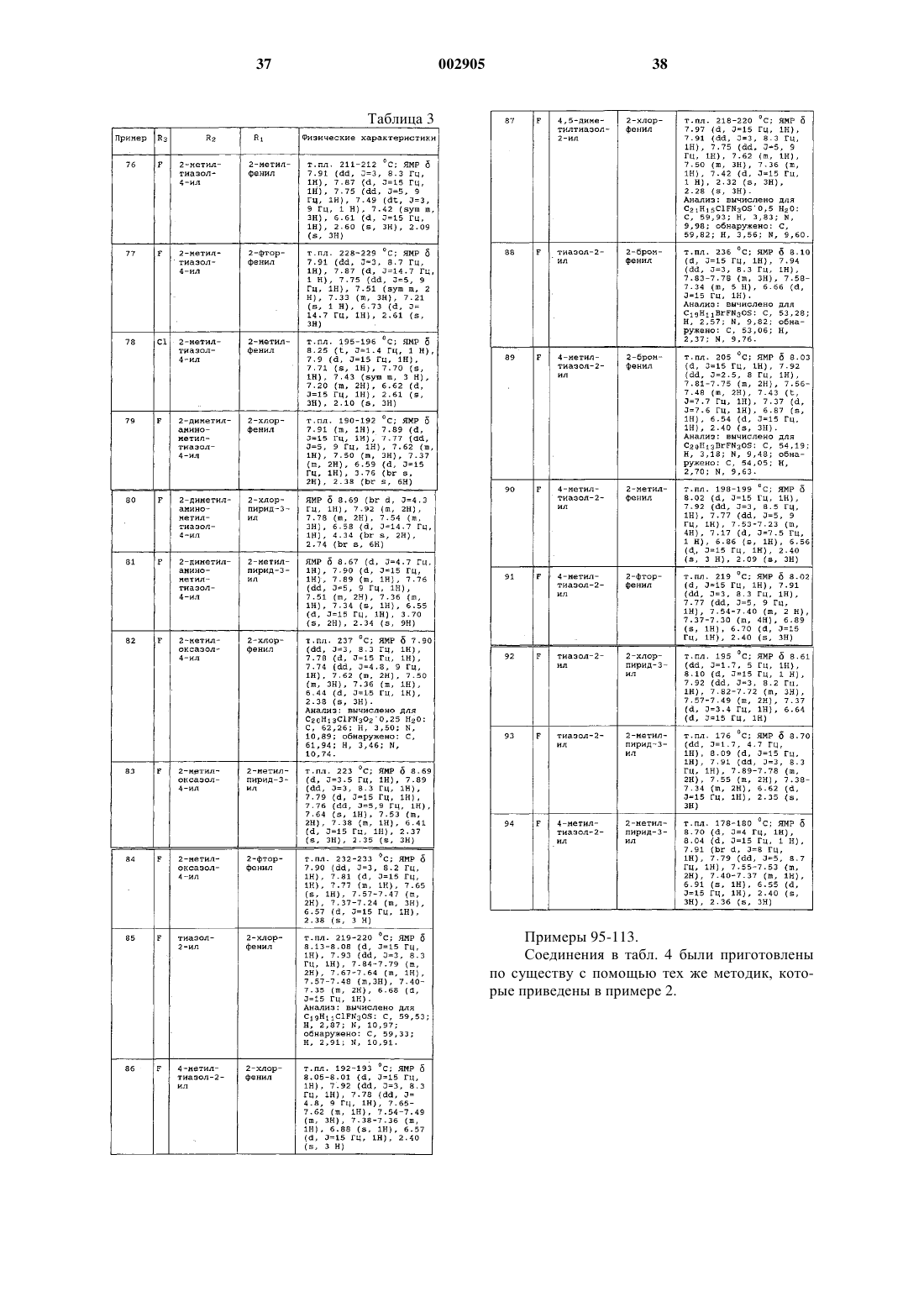
1 Предпосылки изобретения Настоящее изобретение относится к новым соединениям формулы I, приведенной ниже, их фармацевтически приемлемым солям, а также содержащим их фармацевтическим композициям. Известны (ЕР 0056637) производные 4(3 Н)-хиназолинона, полезные в качестве гипотензивных агентов для лечения гипертензий,формулы где Q является возможно замещенным фенилом,R4 и R5 представляют собой водород или алкильную группу, возможно замещенную в случае R5, a Z1 и Z2 обозначают кислород или серу.WO 9213535 описывает обладающие противосудорожным действием производные хиназолинона формулыR6 обозначают водород или галоген. Соединения по настоящему изобретению являются сильнодействующими антагонистами АМРА-рецептора. АМРА-рецепторы представляют собой подкласс глутаматных рецепторов,идентифицируемых по их способности связывать -амино-3-гидрокси-5-метил-4-изоксазолпропионовую кислоту (АМРА), которые выступают в качестве постсинаптических нейротрансмиттерных рецепторов для возбуждающих аминокислот. Роль возбуждающих аминокислот, таких как глутаминовая и аспарагиновая, как преобладающих медиаторов возбуждающей синаптической передачи в центральной нервной системе хорошо известна (WatkinsEvans, Ann.(1990. Эти аминокислоты действуют в синаптической передаче главным образом через рецепторы возбуждающих аминокислот. Данные аминокислоты и их рецепторы кроме этого принимают участие во многих других физиологических процессах, таких как двигательный контроль, дыхание, регуляция сердечно-сосудистой системы, сенсорное восприятие и познание. Рецепторы возбуждающих аминокислот подразделяют на два основных типа. Рецепторы,непосредственно связанные с открыванием катионных каналов клеточной мембраны нейронов, называют "ионотропными". Данный тип 2 рецептора подразделяется, по меньшей мере, на три подтипа в соответствии с деполяризующим действием селективных агонистов-N-метил-Dаспартата (NMDA), -амино-3-гидрокси-5 метилизоксазол-4-пропионовой кислоты(АМРА) и каиновой кислоты (КА). Второй основной тип рецепторов представляют собой рецепторы, связанные с G-белком, или вторичные, связанные с мессенджером, "метаботропные" рецепторы возбуждающих аминокислот. Этот второй тип рецепторов при активации агонистами-квисквалатом, иботенатом или транс-1 аминоциклопентан-1,3-дикарбоновой кислотой приводит к усилению гидролиза фосфоинозитида в постсинаптической клетке. Оба типа рецепторов, по-видимому, не только опосредуют нормальную синаптическую передачу по путям возбуждения, но также принимают участие в модификации синаптической связи при развитии и изменениях эффективности синаптической передачи в продолжении жизни (Schoepp,Bockaert, and Sladeczek. Trends in Pharmacol.Research Reviews, 15, 41 (1990. Избыточная или несоответствующая стимуляция рецепторов возбуждающих аминокислот приводит к гибели или утрате нейрона в результате механизма, известного под названием эксцитотоксичности. Предполагается, что этот процесс во многих состояниях опосредует дегенерацию нейронов. Медицинские последствия подобной дегенерации нейронов делают смягчение этих дегенеративных неврологических процессов важной терапевтической задачей. Эксцитотоксичность возбуждающих аминокислот вовлечена в патофизиологию ряда неврологических расстройств. Эта эксцитотоксичность вовлечена в патофизиологию острых и хронических нейродегенеративных состояний,включающих в себя церебральные нарушения в результате операции кардиального шунтирования и трансплантации, удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера (Alzheimer's), хорею Гентингтона (Huntington's), боковой амиотрофический склероз, эпилепсию, СПИД-индуцированную деменцию, перинатальную гипоксию,гипоксию (такую как состояния, вызванные странгуляцией, операцией, вдыханием дыма,асфиксией, утоплением, удушением, смертельной электротравмой или передозировкой лекарства либо алкоголя), остановку сердца, гипогликемическое поражение нейронов, нарушение зрения и ретинопатию и идиопатическую и вызванную лекарствами болезнь Паркинсона(Parkinson's). Другие неврологические состояния, вызываемые глутаматной дисфункцией,требуют нейромодуляции. Эти другие неврологические состояния включают в себя мышечные спазмы, мигрень, недержание мочи, психоз,хроническую абстиненцию (такую как алкого 3 лизм и привыкание к наркотикам, включая привыкание к опиату, кокаину и никотину), толерантность к опиатам, чувство страха, рвоту,отек мозга, хроническую боль, судороги, ретинальную невропатию, шум в ушах и позднюю дискинезию. Предполагается, что применение нейропротекторного агента, такого как антагонист АМРА-рецептора, будет полезным при лечении указанных нарушений и/или будет способствовать уменьшению степени неврологических поражений, связанных с этими расстройствами. ЕАА-антагонисты полезны также в качестве болеутоляющих агентов. Результаты нескольких исследований показали, что антагонисты АМРА-рецептора являются нейропротекторами в фокальной и глобальной ишемических моделях. Сообщалось,что конкурентный антагонист АМРАрецептора-NBQX(2,3-дигидрокси-6-нитро-7 сульфамоилбензо[f-]xинокcaлин) является эффективным средством предупреждения глобального и фокального ишемического повреждения (Sheardown et al., Science, 247, 571 (1900);et al., Brain Research. 571, 115 (1992. Показано,что неконкурентный антагонист АМРАрецептора-GKYI 52466 является эффективным нейропротекторным агентом в моделях глобальной ишемии у крыс (LaPeillet et al., BrainResearch. 571, 115 (1992. Эти исследования ясно указывают на то, что в позднюю дегенерацию нейронов при ишемии мозга вовлечена глутаматная эксцитотоксичность, по меньшей мере, частично опосредованная активацией АМРА-рецептора. Таким образом, антагонисты АМРА-рецептора могут оказаться полезными в качестве нейропротекторных агентов и улучшать неврологические последствия церебральной ишемии у людей. Краткое описание изобретения В соответствии с настоящим изобретением предложены 2,3-двузaмещенные-4(3 Н)-хиназолиноны формулы где R1 представляет собой возможно замещенный фенил формулы Ph1 или гетероарил, выбранный из группы, содержащей пиридин-2-ил,пиридин-3-ил и пиридин-4-ил, причем указанный гетероарил может быть замещен по 2 положению заместителем, выбранным из (C1C6)алкила и галогена; 4 причем указанный Ph1 представляет собой группу формулыR2 представляет собой фенил формулы Ph2 или пяти- либо шестичленный гетероцикл, причем указанный 6-членный гетероцикл имеет формулу где "N" представляет собой азот; указанные положения "К", "L" и "М" в кольце могут быть независимо выбраны из углерода или азота при том условии, что 1) только один из "К", "L" или"М" представляет собой азот, то отсутствуют их соответствующие R15, R16 или R17; указанный 5-членный гетероцикл имеет формулуS; положения "Р" и "Q" в кольце могут быть независимо выбраны из углерода, азота, кислорода или серы при том условии, что только один из "Р", "Q" или "Т" может быть кислородом или серой, и, по меньшей мере, один из "Р", "Q" или"Т" должен быть гетероатомом; указанный Ph2 представляет собой группу формулыR6 представляет собой водород или галогено;R7 представляет собой водород или галогено;R8 представляет собой водород или галогено;R11 представляет собой водород или галогено;R14 выбран из водорода, галогено, (C1C6)алкила, возможно замещенного атомами галогена числом от одного до трех, (С 1-С 6)алкилNН-(СН 2)p-, ди(С 1-С 6)алкил-N(СН 2)p-, ди(С 1-С 6) алкил-N-(С 1-С 6)алкил-N-(СН 2)p-,(С 1-С 6)алкил-(С=O)-O-NH-(СН 2)p-, ди(С 1-С 6)алкил-N-(C1-C6)алкил-(С=O)-О-(СН 2)p-, гидрокси(С 1-С 6)алкила-, (С 1-С 6)алкил-O-(С 1-С 6)алкила-,-CN, пиперидин-(СН 2)p-, пирролидин-(СН 2)p- и 3-пирролин-(СН 2)p-; причем указанный пиперидин группировки пиперидин-(CH2)p может быть замещен по любому из углеродных атомов кольца, способных к поддержанию дополнительной связи, заместителем (С 1-С 6)алкилом;R15 представляет собой водород или (C1C6)алкил;R16 представляет собой водород или (C1C6)алкил;R17 представляет собой водород, -CN,ди(С 1-С 6)алкил-N-(C1-C6)алкил-, (C1-C6)aлкоксигpуппу или CHF2; каждое р независимо представляет собой целое число от нуля до 4; причем подчеркнутая пунктиром связь представляет собой возможно двойную связь; при условии, что 1) когда R9 представляет собой водород, один из R11 и R12 является отличным от водорода; 2) когда R3 представляет собой водород, R6, R7 и R8 представляют собой водород, a R5 представляет собой хлор или метил, то (a) R2 не может быть незамещенным фенилом, тиенилом либо фурилом или (б) R9 не может быть гидроксильной или метильной группой; 3) когда R3 представляет собой водород либо хлор, R5 представляет собой метил, R6,R7 и R8 представляют собой водород, а К, L и М равны углероду, то (а) один из радикалов от R14 до R17 должен быть отличным от водорода или(б) R17 должен быть отличным от водорода; 4) когда R1 представляет собой незамещенный пиридин-2-ил, а R3 представляет собой водород,бром либо иод, то R2 не может быть незамещенным фенилом; 5) когда R7 представляет собойR3 является водородом, то (а) R2 не может быть незамещенным фенилом, пиридилом, тиенилом либо фурилом, или (б) R9 не может быть гидроксильной группой, когда R10 и R11 представляют собой водород; 6) когда R2 представляет собой незамещенный пиридин-2-ил, R5 и R7 представляют собой водород, и R3 является водородом,то R6 или R8 должен отличаться от хлора; 7) когда R2 представляет собой нeзамещенный фенил, R3 является водородом, и R5 и R7 представляют собой водород, то один из R6 или R8 должен быть отличным от хлора; и фармацевтически приемлемые соли таких соединений. Настоящее изобретение также относится к фармацевтически приемлемым солям соединений формулы I, полученным присоединением кислоты. Кислоты, используемые для приготовления фармацевтически приемлемых, полученных присоединением кислоты, солей вышеупомянутых основных соединений по изобретению,представляют собой такие кислоты, которые образуют нетоксичные полученные присоединением кислоты соли, например соли, содержащие фармакологически приемлемые анионы,такие как гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, ацетат, лактат, цитрат, кислый цитрат, тартрат, битартрат, сукцинат, малеат, фумарат,глюконат,сахарат,бензоат,метансульфонат, этансульфонат, бензолсульфонат,паратолуолсульфонат и памоат [в частности 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)]. Настоящее изобретение также относится к солям формулы I, полученным присоединением основания. Химические основания, которые могут быть использованы как реагенты для приготовления фармацевтически приемлемых основных солей тех соединений формулы I, которые по своей природе являются кислотными,представляют собой такие основания, которые с подобными соединениями образуют нетоксичные основные соли. Такие нетоксичные основные соли включают в себя, но этим не ограничиваются, соли, полученные из таких фармакологически приемлемых катионов, как катионы щелочных металлов (например калия и натрия) и катионы щелочно-земельных металлов (например, кальция и магния), соли присоединения аммония или водорастворимых аминов, таких как N-метилглюкамин (меглюмин) и (низший алканол)аммоний, и другие основные соли фармацевтически приемлемых органических аминов. Предпочтительными соединениями формулы (I) являются такие соединения, у которыхR3 представляет собой фтор. Также предпочтительными являются соединения формулы (I), где R1 представляет собой Ph1, и один из R5, R6, R7 или R8 представляет собой фтор, бром, хлор или метил. 7 Согласно еще одному аспекту изобретения, предпочтительными являются соединения формулы (I), где R1 представляет собой Ph1, и R5 представляет собой фтор, бром, хлор или метил. Также предпочтительными являются соединения формулы (I), где R1 представляет собой Ph1, и R5 представляет собой фтор, бром,хлор или метил. Согласно еще одному аспекту изобретения предпочтительными являются соединения формулы (I), где R2 представляет собой Ph2, и либоR9 представляет собой фтор, хлор, -CN или гидроксильную группу, либо R10 представляет собой -СНО, метил или ди(С 1-С 6)алкил-N-(СН 2)p-. Согласно еще одному аспекту настоящего изобретения предпочтительными являются соединения формулы (I), где R2 представляет собой Рh2, и либо R9 представляет собой фтор,хлор, -CN или гидроксильную группу, либо R10 представляет собой -СНО, метил или ди(С 1 С 6)алкил-N-(СН 2)p-. Согласно еще одному аспекту изобретения предпочтительными являются соединения формулы (I), где R1 представляет собой указанный гетероарил, возможно замещенный по 2 положению галогено или (C1-C6)алкилом. Согласно еще одному аспекту настоящего изобретения предпочтительными являются соединения формулы (I), где R1 представляет собой указанный гетероарил, возможно замещенный по 2 положению галогено или (С 1 С 6)алкилом. Также предпочтительными являются соединения формулы (I), где R1 представляет собой указанный гетероарил, возможно замещенный по 2 положению галогено или (C1C6)алкилом. Предпочтительными также являются соединения формулы (I), где R1 представляет собой пиридин-3-ил, замещенный по 2 положению пиридинового кольца хлором или метилом. В соответствии с еще одним аспектом настоящего изобретения предпочтительными являются соединения формулы (I), где R2 является гетероарилом, представляющим собой либо возможно замещенный шестичленный гетероцикл, в котором "К", "L" и "М" является углеродом, или "К" и "L" представляют собой углерод,а "М" представляет собой азот (например, пиримидин-2-ил), либо указанный гетероарил представляет собой возможно замещенный пятичленный гетероцикл, в котором "Т" является азотом, "Р" представляет собой серу, а "Q" представляет собой углерод, или "Т" представляет собой азот либо серу, "Q" представляет собой азот либо серу, а "Р" представляет собой углерод, или "Т" представляет собой кислород, а"Р" и "Q" каждый представляют собой углерод. Согласно еще одному аспекту изобретения, предпочтительными являются соединения формулы (I), где R2 представляет собой возможно замещенный шестичленный гетероцикл, в 8 котором "К", "L" и "М" представляют собой углерод, R14 представляет собой водород, -СНО,хлор, фтор, метил, (С 1-С 6)алкил-NН-(СН 2)p-,ди(С 1-С 6)алкил-N-(СН 2)p- или цианогруппу; R17 представляет собой водород или ди(С 1 С 6)алкил-N-(С 1-С 6)алкил; либо R15 или R16 независимо представляют собой водород или метил. Также предпочтительными являются соединения формулы (I), где R2 представляет собой возможно замещенный шестичленный гетероцикл, в котором "К", "L" и "М" представляют собой углерод, а R14 представляет собой водород, -СНО, метил, (С 1-С 6)алкил-NН-(СН 2)p-,ди(С 1-С 6)алкил-N-(СН 2)p или цианогруппу. Согласно еще одному аспекту изобретения предпочтительными соединениями формулы (I) являются соединения, у которых R2 представляет собой возможно замещенный пятичленный гетероцикл, в котором "Т" представляет собой азот, "Р" представляет собой серу, и "Q" представляет собой углерод, а R14 представляет собой водород, хлор, фтор или метил; и R15 и R16,каждый независимо, представляют собой водород или метил. Также являются предпочтительными соединения формулы (I), где R2 представляет собой возможно замещенный пятичленный гетероцикл, в котором "Т" представляет собой азот или серу, "Q" представляет собой серу или азот,и "Р" представляет собой углерод, а R14 выбран из водорода, хлора, фтора и метила; и R15 выбран из водорода и метила. К предпочтительным соединениям формулы (I) относятся соединения, выбранные из группы, содержащей 3-(2-хлорфенил)-2-[2-(5-диэтиламинометил-2-фторфенил)винил]-6-фтор-3 Н-хиназолин 4-он; 3-(2-хлорфенил)-2-[2-(6-диэтиламинометилпиридин-2-ил)винил]-6-фтор-3 Н-хиназолин 4-он; 3-(2-хлорфенил)-2-[2-(6-этиламинометилпиридин-2-ил)винил]-6-фтор-3 Н-хиназолин-4 он; 3-(2-бромфенил)-2-[2-(6-диэтиламинометилпиридин-2-ил)винил]-6-фтор-3 Н-хиназолин 4-он; 3-(2-хлорфенил)-6-фтор-2-[2-(6-метоксиметилпиридин-2-ил)винил]-3 Н-хиназолин-4-он; 6-фтор-3-(2-метилпиридин-3-ил)-2-[2-(2 метилтиазол-4-ил)винил]-3 Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-[2-(4-метилпиримидин-2-ил)винил]-3 Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-2-[6-(изопропиламинометил)пиридин-2-ил]этил-3 Н-хиназолин-4-он; и 2-[2-(5-диэтиламинометил-2-фторфенил) винил]-6-фтор-3-(2-метилпиридин-3-ил)-3 Нхиназолин-4-он. В соответствии с настоящим изобретением также предложена фармацевтическая композиция, обладающая антагонистической активно 9 стью по отношению к АМРА-рецептору, содержащая эффективное количество соединения формулы 1 по п.1 и фармацевтически приемлемый носитель. Соединения по настоящему изобретению включают все стереоизомеры и все оптические изомеры соединений формулы I (например R иS энантиомеры), равно как и рацемические, диастереомерные и другие смеси таких изомеров. Соединения по настоящему изобретению могут содержать олефинподобные двойные связи. В тех случаях, когда такие связи присутствуют, соединения по данному изобретению существуют в цис- и транс-конфигурациях, а также в виде их смесей. Если не оговорено особо, упоминаемые здесь алкильные группы, равно как и алкильные группировки других упоминаемых здесь групп(например, алкоксигрупп), могут быть линейными или разветвленными, а также могут быть циклическими (например, циклопропил, циклобутил, циклопентил или циклогексил), либо могут быть линейными или разветвленными и содержать циклические группировки. Если не оговорено особо, галогено и галоген относятся к фтору, брому, хлору или иоду. Подробное описание изобретения Соединения формулы I могут быть получены в соответствии со способами, приведенными на схеме 1. На реакционной схеме и в следующем за ней обсуждении, если не оговорено особо, К, L, M, P, Q, Т, R1, R2, R5, R6, R7,R8, R9, R10, R11, R12, R13, R14, R15, R16, R17, Ph1,Ph2, n, m и р такие, как определено pанее для формулы I. Схема 1 Схема 1 отображает получение соединений формулы I из соединений формулы V. Соединения формулы V имеются в продаже или могут быть получены способами, хорошо известными специалистам обычной квалификации. Соединение формулы V может быть превращено в ацетамид формулы IV посредством взаимодействия с ацетилхлоридом или уксусным ангидридом в присутствии основания в реакционно-инертном растворителе. Подходящие растворители включают в себя метиленхлорид, дихлорэтан, тетрагидрофуран и диоксан, предпочтительно метиленхлорид. Подходящие основания включают в себя триалкиламины, такие как триэтиламин и трибутиламин, диметиламинопиридин и карбонат калия,предпочтительно триэтиламин. Указанную выше реакцию проводят в температурном интер 11 вале от приблизительно 0 С до приблизительно 35 С в течение от приблизительно 1 ч до приблизительно 10 ч, предпочтительно приблизительно при 30 С в течение приблизительно 3 ч. Ацетамид формулы IV подвергают циклизации до соединения формулы III посредством взаимодействия с дегидратирующим агентом в присутствии катализатора в безводном реакционно-инертном растворителе. Подходящие дегидратирующие агенты включают в себя уксусный ангидрид, пентаоксид фосфора, дициклогексилкарбодиимид и ацетилхлорид, предпочтительно уксусный ангидрид. Подходящие катализаторы включают в себя ацетат натрия или калия, уксусную кислоту, паратолуолсульфокислоту или бортрифторид эфират, предпочтительно ацетат натрия. Подходящие растворители включают в себя диоксан, толуол, диглим или дихлорэтан, предпочтительно диоксан. Температурный интервал проведения указанной выше реакции составляет от приблизительно 80 С до приблизительно 110 С, временной интервал - от приблизительно 1 ч до приблизительно 24 ч, предпочтительно от приблизительно 3 до 10 ч при температуре приблизительно 100 С. С другой стороны, соединение формулы V может быть непосредственно превращено в соединение формулы III путем взаимодействия с уксусным ангидридом в присутствии в растворителе кислотного катализатора. Подходящие кислотные катализаторы включают в себя уксусную кислоту, серную кислоту или паратолуолсульфокислоту, предпочтительно уксусную кислоту. Подходящие растворители включают в себя уксусную кислоту, толуол или ксилол,предпочтительно уксусную кислоту. Указанную реакцию проводят в температурном интервале от приблизительно 20 С до приблизительно 150 С в течение периода времени от приблизительно 10 мин до приблизительно 10 ч, предпочтительно от приблизительно 2 до 5 ч при температуре приблизительно 120 С. Соединение формулы III, полученное любым из описанных выше способов, приводят во взаимодействие с амином формулы R1NH2 в полярном протонном растворителе в присутствии кислотного катализатора с образованием соединения формулы II. Подходящие кислотные катализаторы включают в себя уксусную кислоту, паратолуолсульфокислоту или серную кислоту, предпочтительно уксусную кислоту. Подходящие полярные растворители включают в себя уксусную кислоту, метанол, этанол или изопропанол, предпочтительно уксусную кислоту. Указанную реакцию проводят в температурном интервале от приблизительно 20 С до приблизительно 117 С в течение периода времени от приблизительно 1 ч до приблизительно 24 ч, предпочтительно в течение приблизительно 6 ч при температуре приблизительно 117 С.IV может быть непосредственно превращено в соединение формулы II путем взаимодействия с дегидратирующим агентом, амином формулыR1NH2 и основанием в реакционно-инертном растворителе. Подходящие дегидратирующие агенты включают в себя трихлорид фосфора,оксихлорид фосфора, пентахлорид фосфора или тионилхлорид, предпочтительно трихлорид фосфора. Подходящие основания включают в себя пиридин, лутидин, диметиламинопиридин,триэтиламин или N-метилморфолин, предпочтительно пиридин. Подходящие растворители включают в себя толуол, циклогексан, бензол или ксилол, предпочтительно толуол. В определенных условиях, когда объединенные реагенты представляют собой жидкость, реакция может протекать в отсутствие растворителя. Указанную реакцию проводят в температурном интервале от приблизительно 50 С до приблизительно 150 С в течение периода времени от приблизительно 1 ч до приблизительно 24 ч, предпочтительно в течение приблизительно 4 ч при температуре приблизительно 110 С. Данное соединение формулы II приводят во взаимодействие с альдегидом формулыR2 СНО в присутствии катализатора и дегидратирующего агента в подходящем растворителе с образованием соединения формулы I. Подходящие катализаторы включают в себя хлорид цинка, ацетат натрия, хлорид алюминия, хлорид олова или бортрифторид эфират, предпочтительно хлорид цинка или ацетат натрия. Подходящие дегидрагирующие агенты включают в себя уксусный ангидрид, ангидрид метансульфокислоты, трифторуксусный ангидрид или пропионовый ангидрид, предпочтительно уксусный ангидрид. Подходящие полярные растворители включают в себя уксусную кислоту,диоксан, диметоксиэтан или пропионовую кислоту. Указанную реакцию проводят в температурном интервале от приблизительно 60 С до приблизительно 100 С в течение периода времени от приблизительно 30 мин до приблизительно 24 ч, предпочтительно в течение приблизительно 3 ч при температуре приблизительно 100 С. Соединения формулы I, где пунктирной линией обозначена простая связь углеродуглерод, могут быть получены гидрированием соответствующих соединений, где пунктирной линией обозначена двойная связь углеродуглерод, с применением стандартных, хорошо известных специалистам методик. Например,восстановление двойной связи может быть осуществлено с помощью газообразного водорода(Н 2) с использованием катализаторов, таких как палладий на угле (Pd/C), палладий на сульфате бария (Pd/BaSO4), платина на угле (Pt/C) или трис(трифенилфосфин)родия хлорид (катализатор Вилкинсона (Wilkinson's, в подходящем растворителе, таком как метанол, этанол, THF, 13 диоксан или этилацетат, при давлении от приблизительно 1 до приблизительно 5 атм и при температуре от приблизительно 10 С до приблизительно 60 С, как описано (Catalytic Hydrogenation in Organic Synthesis, Paul Rylander, Academic Press Inc., San Diego, 1979, pp. 31-63). Предпочтительными являются следующие условия: Pd на угле, метанол при 25 С и давлении газообразного водорода 344,74 кПа. Данный способ пригоден также для введения изотопов водорода (например, дейтерия, трития) путем замены в указанной выше методике 1 Н 2 на 2H2 или 3H2. С другой стороны, соединение формулы V может быть превращено в соединение формулыII в соответствии со способами, приведенными на схеме 2. Образованное таким образом соединение формулы II может быть превращено в соединение формулы I в соответствии со способами схемы 1. Согласно схеме 2 соединение формулы V приводят во взаимодействие со связующим реагентом - амином формулы R1NН 2 и основанием в реакционно-инертном растворителе с образованием соединения формулы VI. Примерами подходящих связующих реагентов,активирующих карбоксильную функциональность, являются дициклогексилкарбодиимид, N3-диметиламинопропил-N'-этилкарбодиимид, 2 этокси-1-этоксикарбонил-1,2-дигидрохинолин(EEDQ), карбонилдиимидазол (CDI) и диэтилфосфорилцианид. Подходящие основания включают в себя диметиламинопиридин(DMAP), гидроксибензотриазол (НВТ) или триэтиламин, предпочтительно диметиламинопиридин. Сочетание проводят в инертном растворителе, предпочтительно апротонном растворителе. Подходящие растворители включают в себя ацетонитрил, дихлорметан, дихлорэтан и диметилформамид. Предпочтительный растворитель представляет собой дихлорметан. Температура проведения указанной выше реакции обычно составляет от приблизительно -30 С до приблизительно 80 С, предпочтительно от приблизительно 0 С до приблизительно 25 С. Соединение формулы VI превращают в соединение формулы VII посредством взаимодействия с ацетилхлоридом или уксусным ангидридом в присутствии основания в реакционноинертном растворителе. Подходящие растворители включают в себя метиленхлорид, тетрагидрофуран и хлороформ, предпочтительно метиленхлорид. Подходящие основания включают в себя триалкиламины, такие как триэтиламин и трибутиламин, диметиламинопиридин и карбонат калия, предпочтительно триэтиламин. Температурный интервал проведения указанной выше реакции составляет от приблизительно 0 С до приблизительно 35 С, время проведения реакции - от приблизительно 1 ч до приблизительно 10 ч, предпочтительно приблизительно 3 ч при температуре приблизительно 30 С. 14 Соединение формулы VII подвергают циклизации в соединение формулы II посредством взаимодействия с трифенилфосфином, основанием и диалкилазодикарбоксилатом в реакционно-инертном растворителе. Подходящие основания включают в себя пиридин, триэтиламин и 4-диметиламинопиридин, предпочтительно 4 диметиламинопиридин. Подходящие растворители включают в себя диметилформамид, тетрагидрофуран и диоксан, предпочтительно диоксан. Температурный интервал проведения указанной выше реакции составляет от приблизительно 25 С до приблизительно 125 С, время проведения реакции - от приблизительно 1 ч до приблизительно 24 ч, предпочтительно приблизительно от 8 до 15 ч при температуре приблизительно 100 С. Соединение формулы II может быть превращено в соединение формулы I в соответствии со способом, приведенным на схеме 1. Соединения формулы II, кроме этого, могут быть получены в соответствии с известными(1996 способами. Если не оговорено особо, то давление, при котором проводится каждая из упомянутых выше реакций, не является критичным. Обычно реакции следует проводить при давлении от приблизительно одной атмосферы до приблизительно трех атмосфер, предпочтительно при давлении окружающей среды (приблизительно одна атмосфера). В случае, когда R2 является гетероарилом,специалисту обычной квалификации должно быть ясно, что гетероарил выбирается из группы, состоящей из пиридин-2-ила, 1,3-пиразин-4 ила, 1,4-пиразин-3-ила, 1,3-пиразин-2-ила, пиррол-2-ила, 1,3-имидазол-4-ила, 1,3-имидазол-2 ила, 1,3,4-триазол-2-ила, 1,3-оксазол-4-ила, 1,3 оксазол-2-ила, 1,3-тиазол-4-ила, 1,3-тиазол-2 ила, 1,2,4-оксадиазол-3-ила, 1,2,4-оксадиазол-5 ила, фур-2-ила, 1,3-оксазол-5-ила и 1,3,4 оксадиазол-2-ила, причем указанный гетероарил возможно может быть замещен по любому из атомов, способных к образованию дополнительной связи, с максимальным числом заместителей до трех. Соединения формулы I, являющиеся по своей природе основными, способны к образованию большого количества разнообразных солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, часто практически желательным является первоначальное выделение соединения формулы I из реакционной смеси в виде фармацевтически неприемлемой соли и затем простое обратное превращение последней в свободное основание обработкой щелочным реагентом с последующим превращением свободного основания в фармацевтически приемлемую соль,полученную присоединением кислоты. Соли 15 основных соединений по данному изобретению,получаемые присоединением кислоты, легко готовятся обработкой основного соединения по существу эквивалентным количеством выбранной для этой цели минеральной или органической кислоты в водной среде либо в подходящем органическом растворителе, таком как метанол или этанол. После аккуратного упаривания растворителя получают желаемую соль в твердом состоянии. Для приготовления фармацевтически приемлемых, получаемых присоединением кислоты солей основных соединений по данному изобретению применяют те кислоты, которые образуют нетоксичные соли, получаемые присоединением кислоты, например соли, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидроиодид,нитрат, сульфат или бисульфат, фосфат или кислый фосфат, ацетат, лактат, цитрат или кислый цитрат, тартрат или битартрат, сукцинат,малеат, фумарат, глюконат, сахарат, бензоат,метансульфонат и памоат [например, 1,1'метилен-бис-(2-гидрокси-3-нафтоат)]. Те из соединений формулы I, которые по природе своей являются кислотными, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают в себя соли щелочных или щелочно-земельных металлов и,в частности, натриевые и калиевые соли. Все эти соли получают традиционными способами. Для приготовления фармацевтически приемлемых основных солей по данному изобретению в качестве реагентов применяют те химические основания, которые образуют нетоксичные основные соли с описанными здесь кислотными соединениями формулы I. Эти нетоксичные основные соли включают в себя те соли, которые получены из таких фармакологически приемлемых катионов, как натрий, калий, кальций, магний и так далее. Эти соли легко могут быть приготовлены обработкой соответствующих кислотных соединений водным раствором, содержащим желаемые фармакологически приемлемые катионы, с последующим упариванием полученного раствора досуха, предпочтительно при пониженном давлении. С другой стороны,они также могут быть получены путем смешивания вместе растворов кислотных соединений в низших спиртах и алкоксида желаемого щелочного металла, с последующим упариванием досуха полученного раствора тем же способом,как описано выше. В том и другом случае для обеспечения полноты реакции и максимального выхода желаемого конечного продукта предпочтительно использовать стехиометрические количества реагентов. Соединения формулы I и их фармацевтически приемлемые соли (называемые здесь далее также активными соединениями по данному изобретению) полезны для лечения нейродеге 002905 16 неративных и связанных с травмой ЦНС состояний и являются сильнодействующими антагонистами АМРА-рецепторов. Вследствие этого активные соединения по настоящему изобретению могут применяться для лечения или предотвращения церебральных нарушений в результате операции кардиального шунтирования и трансплантации, удара, церебральной ишемии,травмы спинного мозга, травмы головы, болезни Альцгеймера, хореи Гентингтона, бокового амиотрофического склероза, эпилепсии, СПИДиндуцированной деменции, мышечных спазмов,мигрени, недержания мочи, психоза, судорог,перинатальной гипоксии, гипоксии (такой как состояния, вызванные странгуляцией, операцией, вдыханием дыма, асфиксией, утоплением,удушением, смертельной электротравмой или передозировкой лекарства либо алкоголя), остановки сердца, гипогликемического поражения нейронов, толерантности к опиатам, хронической абстиненции (такой как алкоголизм и привыкание к наркотикам, включая привыкание к опиату, кокаину и к никотину), нарушения зрения, ретинопатии, ретинальной невропатии,шума в ушах, идиопатической и вызванной лекарствами болезни Паркинсона, чувства страха,рвоты, отека мозга, хронической или острой боли либо поздней дискинезии. Активность in vitro и in vivo соединений по настоящему изобретению в качестве антагонистов AМРА-рецептора может быть измерена способами, доступными для осуществления специалистами обычной квалификации. Один из способов определения активности соединений по данному изобретению заключается в ингибировании пентилентетразол (PTZ)-индуцируемых припадков. Другой способ определения активности соединений по данному изобретению состоит в блокировании 45 Са 2+-захвата, индуцируемого активацией AМРА-рецептора. Один из специфических методов определения активности соединений по данному изобретению по ингибированию пентилентетразол(PTZ)-индуцируемых припадков у мышей может быть осуществлен в соответствии со следующей методикой. В этом тесте исследуют способность соединений блокировать припадки и смерть, вызываемые PTZ. Измеряют латентный период до клонических и тонических припадков и смерти. Значения ИД 50 определяют на основании процента защиты. Эксперименты проводят на самцах CD-1 мышей из Charles River весом 14-16 г на момент получения и 25-35 г на момент тестирования. Мышей помещают по 13 животных в клетку в стандартных лабораторных условиях с осветительным циклом свет : темнота/7 ч утра : 7 ч вечера, по меньшей мере, за 7 дней до начала экспериментов. Пища и вода была доступна adlibitum до начала тестирования. Все соединения вводят в объеме 10 мл/кг. Выбор носителей для лекарств будет зависеть от 17 растворимости соединения, однако, обычно скрининг следует проводить, используя в качестве носителя для инъекции физиологический раствор,дистиллированную воду илиE:D:S/5:5:90 (5% эмульфора (Е), 5% DMSO (D) и 90% физиологического раствора (S. Мышам вводят тестируемые соединения или носитель (внутрибрюшинно, подкожно или перорально) и животных помещают в клетки из плексигласа группами по пять особей. После этих инъекций через заранее определенное время мышам делают инъекцию PTZ (внутрибрюшинно, 120 мг/кг) и животных помещают в индивидуальные плексигласовые клетки. В течение этого пятиминутного периода тестирования проводят следующие измерения: (1) латентный период до клонических припадков; (2) латентный период до тонических припадков и (3) латентный период до наступления смерти. Группы обработанных тестируемыми соединениями животных сравнивают с группами, обработанными носителем, в Kruskal-Wallis Anova иMann-Whitney U-тестах (Statview). Процент защиты рассчитывают для каждой группы (число животных, не испытавших припадков или не умерших в течение 300 с) для каждого измерения. Значения ИД 50 определяют с помощью пробит-анализа (Biostat). Другой способ определения активности соединений состоит в определении действия этих соединений на двигательную координацию у мышей. Эта активность может быть определена в соответствии со следующей методикой. Эксперименты проводят на самцах CD-1 мышей из Charles River весом в 14-16 г на момент получения и 25-35 г на момент тестирования. Мышей помещают по 13 животных в клетку в стандартных лабораторных условиях с осветительным циклом свет:темнота/7 ч утра:7 ч вечера, по меньшей мере, за 7 дней до экспериментов. Пища и вода была доступна ad libitum до начала тестирования. Все соединения вводят в объеме 10 мл/кг. Выбор носителей для лекарств будет зависеть от растворимости соединения, однако, обычно скрининг следует проводить, используя в качестве носителя для инъекции физиологический раствор, дистиллированную воду или E:D:S в соотношении 5:5:90 (5% эмульфора (Е), 5%(S. Приспособление, использованное в этих опытах, состоит из группы из пяти квадратных проволочных ячеек размером 13,3413,34 см,подвешенных на стальных стержнях длиной 11,43 см, соединенных со стержнем длиной 165,1 см, поднятым на высоту 38,1 см над лабораторной скамьей. Эти квадратные проволочные ячейки могут переворачиваться верх дном. Мышам вводят тестируемые соединения или носитель (внутрибрюшинно, подкожно или перорально) и животных помещают в клетки из 18 плексигласа группами по пять особей. После этих инъекций через заранее определенное время мышей помещают на верхнюю часть квадратных проволочных ячеек и подталкивают их таким образом, чтобы они оказались подвешенными вверх ногами. В течение одной минуты теста мыши получают оценку 0, если они падают с сетки, 1, если они удержатся вверх ногами,и 2, если они вскарабкаются наверх. Группы обработанных тестируемыми соединениями животных сравнивают с группами, обработанными носителем, в Kruskal-Wallis и MannWhitney U-тестах (Statview). Специфический способ определения блокирования 45 Са 2+-захвата, индуцируемого активацией АМРА-рецептора, описан ниже. Первичные культуры нейронов. Первичные культуры нейронов мозжечковых гранул крыс получают, как описано (Parks,T.N., Artman, L.D., Alasti, N., and Nemeth, E.F.,Modulation Of N-Methyl-D-Aspartate ReceptorMediated Increases In Cytosolic Calcium In Cultured Rat Cerebellar Granule Cells, Brain Res. 552,13-22 (1991. Согласно данному способу, мозжечок извлекают у CD-крыс возрастом 8 дней,измельчают на кусочки размером 1 мм и инкубируют при температуре 37 С в течение 15 мин в свободном от кальция и магния растворе Тирода (Tyrode's), содержащем 0,1% трипсина. Ткань далее растирают, используя пипетку Пастера с тонким отверстием. Клеточную суспензию высевают на 96-луночные планшеты для тканевых культур, покрытые поли-D-лизином,по 105 клеток на лунку. Среда состоит из минимальной поддерживающей среды (MEM) с солями по Иглу (Earle's), 10% фетальной сыворотки теленка, инактивированной нагреванием, 2 мM L-глутамина, 21 мМ глюкозы, пенициллинастрептомицина (100 единиц в мл) и 25 мМ КСl. Через 24 ч среду заменяют на свежую, содержащую 10 мкМ цитозинарабинозида для ингибирования клеточного деления. Культуры следует использовать при 6-8 DIV. 45 Са 2+-захват, индуцируемый активацией АМРА-рецептора. Действие лекарственных средств на 45 Са 2+захват, индуцируемый активацией АМРАрецептора, может быть изучено на культурах клеток мозжечковых гранул крыс. Культуры в 96-луночных планшетах предварительно инкубируют в течение приблизительно 3 ч в свободной от сыворотки среде и затем в течение 10 мин в свободном от Мg2+ сбалансированном солевом растворе (концентрация в мМ: 120NaCl; 5 KCl; 0,33 NаН 2 РO4; 1,8 CaCl2; 22,0 глюкоза и 10,0 HEPES (N-гидроксиэтил-пиперазинN-2-этансульфоновая кислота) при рН 7,4), содержащем 0,5 мМ DDT (дитиотреитол), 10 uM глицина и лекарственные средства в удвоенной конечной концентрации. Реакцию запускают путем быстрого добавления равного объема сбалансированного солевого раствора, содер 19 жащего 100 мкМ каиновой кислоты - агониста АМРА рецептора и 45 Са 2+ (конечная удельная активность 250 Ки/ммоль). По истечении 10 мин при 25 С реакцию останавливают удалением содержащего 45 Са 2+ раствора и пятикратным промыванием клеток охлажденным во льду сбалансированным солевым раствором, не содержащим добавленного кальция и содержащим 0,5 мМ ЭДТА. Далее клетки лизируют, инкубируя в течение ночи в 0,1%-м Тритоне Х-100, и измеряют радиоактивность лизата. Все протестированные соединения по настоящему изобретению показали значения ИК 50 ниже 5 мкМ. Композиции по настоящему изобретению могут быть приготовлены традиционным способом с использованием одного или более чем одного фармацевтически приемлемого носителя. Таким образом, активные соединения по изобретению могут быть изготовлены для перорального, трансбуккального, интраназального,парентерального (например, внутривенного,внутримышечного или подкожного), трансдермального или ректального введения либо в форме, подходящей для введения посредством ингаляции или инсуффляции. Фармацевтические композиции для перорального введения могут быть в форме, например таблеток или капсул, полученных традиционными способами с фармацевтически приемлемыми эксципиентами, такими как связывающие агенты(например,прежелатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); разрыхлители(например, картофельный крахмал или натрий крахмал гликолят) или увлажняющие агенты(например, лаурилсульфат натрия). Таблетки могут быть покрыты оболочкой с помощью хорошо известных специалистам способов. Жидкие препараты для перорального введения могут быть в форме, например, растворов, сиропов либо суспензий, или они могут быть представлены в виде сухого продукта для смешивания с водой или другим подходящим наполнителем перед применением. Такие жидкие препараты могут быть получены традиционными способами с фармацевтически приемлемыми вспомогательными веществами, такими как суспендирующие агенты (например, сироп сорбита, метилцеллюлоза или гидрированными пищевыми жирами); эмульгаторы (например, лецитин или аравийская камедь); неводные наполнители (например, миндальное масло, масляные эфиры или этиловый спирт); и консерванты (например,метил- или пропилпарагидроксибензоаты или сорбиновая кислота). Композиция для трансбуккального введения может быть в форме таблеток или лепешек,приготовленных традиционным способом. 20 Активные соединения по изобретению могут быть приготовлены для парентерального введения посредством инъекции, включая применение традиционных техник катетеризации или инфузии. Препараты для инъекций могут быть представлены в форме стандартной дозы,например, в ампулах или в многодозовых контейнерах с добавленным консервантом. Композиции могут быть в таких формах, как суспензии, растворы или эмульсии в масляных либо водных наполнителях, и могут содержать такие составляющие препарата, как суспендирующие,стабилизирующие агенты и/или разрыхлители. С другой стороны, активный ингредиент может быть в виде порошка для повторного смешивания с подходящим носителем, например со стерильной апирогенной водой, перед применением. Кроме того, активные соединения по изобретению могут быть приготовлены в ректальных композициях, таких как суппозитории или удерживающие клизмы, например содержащие традиционные основы для суппозиториев, такие как масло какао или другие глицериды. Активные соединения по изобретению для интраназального введения или введения посредством ингаляции удобно доставляются в форме раствора или суспензии из распыляющего под давлением резервуара, который сдавливается или выкачивается пациентом, либо как аэрозоль из находящегося под давлением резервуара или распылителя с использованием подходящего пропелланта, например дихлордифторметана,трихлорфторметана,дихлортетрафторэтана,диоксида углерода либо другого подходящего газа. В случае находящегося под давлением аэрозоля стандартная доза может быть детерминирована обеспечением клапаном для высвобождения отмеренного количества. Находящийся под давлением резервуар или распылитель может содержать раствор или суспензию активного соединения. Капсулы и картриджи (изготовленные, например, из желатина) для использования в ингаляторе или инсуффляторе могут быть изготовлены содержащими порошковую смесь соединения по изобретению и подходящую порошковую основу, такую как лактоза или крахмал. Предлагаемая доза активных соединений по изобретению для перорального, парентерального и трансбуккального введения среднему взрослому человеку для лечения состояний,отмеченных выше (например, удара), составляет по активному ингредиенту от 0,01 до 50 мг/кг на стандартную дозу, которая может быть введена,например, от 1 до 4 раз в день. Аэрозольные препараты для лечения состояний, отмеченных выше (например, удара), у среднего взрослого человека предпочтительно готовятся таким образом, что каждая отмеренная доза или "струя" аэрозоля содержит от 20 до 1000 мкг соединения по изобретению. Суммар 21 ная суточная доза в случае аэрозоля будет лежать внутри интервала от 100 мкг до 10 мг. Введение может быть выполнено несколько раз в день, например 2, 3, 4 или 8 раз, с подачей каждый раз, например, 1, 2 или 3 доз. Следующие примеры иллюстрируют получение соединений по настоящему изобретению. Имеющиеся в продаже реагенты используют без дополнительной очистки. Точки плавления не скорректированы. ЯМР-данные приведены в миллионных доляхи отнесены к лок-сигналу(сигналу синхронизации) дейтерия из образца растворителя. Если не оговорено особо, все масс-спектры снимают с использованием химических ударных условий. Температура окружающей среды или комнатная температура относится к 20-25 С. Пример 1. 3-(2-Хлорфенил)-6-фтор-2-(2 пиридин-2-илэтил)-3 Н-хиназолин-4-он гидрохлорид. Раствор 1,00 г (2,65 ммоля) 3-(2-хлорфенил)-6-фтор-2-(2-пиридин-2-илвинил)-3 Н-хиназолин-4-она в приблизительно 100 мл этилацетата обрабатывают 0,5 г 10%-го Pd/C и полученную смесь гидрируют приблизительно при давлении 0,1244 МПа в течение 2 ч, по истечении которых поглощение водорода прекращается. Катализатор отфильтровывают с помощью суперцела (supercel) (вспомогательный материал для фильтрования) и этилацетат удаляют выпариванием. Остаток растворяют в диэтиловом эфире и обрабатывают избытком раствора газообразного НСl в диэтиловом эфире. Продукт незамедлительно выпадает в осадок, и смесь перемешивают в течение 3 ч, по истечении которых продукт отделяют фильтрованием и высушивают в струе сухого азота. Продукт представляет собой 3-(2-хлорфенил)-6-фтор-2-(2 пиридин-2-илэтил)-3 Н-хиназолин-4-он гидрохлорид (1,15 г; 100%), получающийся в виде аморфного твердого вещества белого цвета. Пример 2. 3-(2-Хлорфенил)-2-[2-(6-диэтиламинометилпиридин-2-ил)винил-6-фтор-3 Нхиназолин-4-он. Способ А. 6-Фтор-2-метилхиноксалин-4 он. Раствор 12,95 г (70,0 ммоль) 2-нитро-5 фторбензойной кислоты в 200 мл ледяной уксусной кислоты и 20 мл уксусного ангидрида обрабатывают 0,625 г 10%-го палладия на угле,проводя восстановление при значении начального давления 375,8 кПа. Через 2 ч поглощение водорода прекращается. Катализатор удаляют фильтрованием и фильтрат кипятят с обратным холодильником в течение 2 ч, по прошествии которых по данным ТСХ (гексан/этилацетат в соотношении 1:1) реакция завершается. Реакционную смесь выпаривают до полукристаллической массы, которуют разводят в минимальном количестве 2-пропанола и перемешивают в ледяной бане в течение 1 ч. Кристаллическое твердое вещество отделяют фильтрованием, 002905 22 промывают минимальным количеством холодного 2-пропанола и высушивают на воздухе,получая 5,79 г (46%) желаемого продукта в виде твердого вещества коричневого цвета; т.пл. 127,5-128,5 С. Синтез 5-фтор-2-нитробензойной кислоты известен (Slothouwer J.H., Recl. Trav. Chim.Pays-Bas. 33, 336 (1914. Способ Б. 3-(2-Хлорфенил)-6-фтор-2-метил-4-(3 Н)-хиназолинон. Раствор 2,50 г (14,0 ммоль) 6-фтор-2 метилхиноксалин-4-она и 1,96 г (15,4 ммоль) 2 хлоранилина в приблизительно 20 мл ледяной уксусной кислоты, кипятят с обратным холодильником в атмосфере азота в течение 6 ч. Большую часть растворителя выпаривают из охлажденной реакционной смеси и остаток переводят в этанол и помещают в холодильник. Через 6 дней сформировавшиеся в холодильнике кристаллы отфильтровывают, промывают минимальным количеством холодного этанола и высушивают на воздухе, получая 1,79 г (44%) продукта; т.пл. 137-138 С. Способ В. 6-(2-[3-(2-Хлорфенил)-6-фтор-4 оксо-3,4-дигидрохиназолин-2-ил]винил)пиридин-2-карбальдегид. Каталитическое количество (приблизительно 100 мг) безводного хлорида цинка добавляют к раствору 576 мг (2,0 ммоль) 3-(2 хлорфенил)-6-фтор-2-метил-4-(3 Н)-хиназолинона и 270 мг (2,0 ммоль) 2,6-пиридиндикарбоксальдегида в 20-25 мл диоксана и 1,0 мл уксусного ангидрида. Реакционную смесь кипятят с обратным холодильником в атмосфере азота в течение 3 ч, пока по данным ТСХ исходный материал не израсходуется. Охлажденную реакционную смесь выливают в воду и смесь экстрагируют этилацетатом. Объединенные экстракты высушивают солевым раствором и сульфатом магния, обрабатывают обесцвечивающим углем, фильтруют и удаляют растворитель, получая желаемый продукт. Продукт переводят в смесь эфир/пентан 2:1 и кристаллы отфильтровывают, получая 266 мг (33%) продукта; т.пл. 247-248 С. Синтез пиридин-2,6-дикарбоксальдегида известен (Papadopoulos, et. al., J. Org. Chem., 31,615 (1966. Способ Г. 3-(2-Хлорфенил)-2-[2-(6-диэтиламинометилпиридин-2-ил)винил]-6-фтор-3 Нхиназолин-4-он. Раствор 65 мг (0,16 ммоль) 6-2-[3-(2 хлорфенил)-6-фтор-4-оксо-3,4-дигидрохиназолин-2-ил]винилпиридин-2-карбальдегида в 10 мл метиленхлорида при комнатной температуре в атмосфере азота обрабатывают 3 каплями диэтиламина и 73 мг (0,34 ммоль) триацетоксиборгидрида натрия. После перемешивания в течение 2,5 ч при комнатной температуре растворитель выпаривают и остаток распределяют между разбавленной соляной кислотой и эфи 23 ром и перемешивают в течение 30 мин. Эфирный слой отделяют, а водный еще раз экстрагируют эфиром; эфирные экстракты отбрасывают. рН водного кислотного раствора подводят до значения 14 с помощью 10%-го гидроксида натрия (с охлаждением в ледяной бане) и далее этот раствор дважды экстрагируют эфиром. Объединенные эфирные экстракты высушивают солевым раствором и сульфатом магния, после чего растворитель выпаривают. После одной попытки образовать мезилат переработанное свободное основание в этилацетате обрабатывают 7,5 мг (0,06 ммоль) малеиновой кислоты,растворенной в небольшом количестве этилацетата. Из полученных растворов образуются кристаллы, которые отфильтровывают и промывают этилацетатом, получая 22 мг (24%) мономалеата; т.пл. 170,5-171,5C. Примеры 3-69. Примеры 3-69 выполняют согласно способам, аналогичным способам из примера 2. 33 Пример 70. 6-Фтор-3-(2-метилпиридин-3 ил)-2-[2-(2-метилтиазол-4-ил)-винил]-3 Н-хиназолин-4-он мезилат. Безводный хлорид цинка (2,7 г; 20 ммоль) расплавляют с продувкой азотом на открытом пламени в круглодонной колбе. Реакционный сосуд оставляют охлаждаться до температуры окружающей среды, после чего в него добавляют диоксан (150 мл). К этой смеси добавляют 6 фтор-2-метил-3-(2-метилпиридин-3-ил)-3 Нхиназолин-4-он (2,6 г; 10 ммоль), уксусный ангидрид (2,8 мл; 30 ммоль) и 2-метилтиазол-4 карбоксальдегид (3,7 г; 30 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 2 ч, охлаждают до температуры окружающей среды и разбавляют водой. Добавляют карбонат натрия до тех пор, пока рН смеси не станет основным. Смесь несколько раз экстрагируют хлороформом. Объединенные хлороформенные слои промывают водой и солевым раствором, окончательно высушивают над сульфатом натрия и концентрируют, получая темный остаток. Этот остаток обрабатывают метанолом и концентрируют (эффективно азеотропно отгоняя от остатка оставшийся хлороформ) и этот процесс повторяют, получая твердое вещество коричневого цвета. Это твердое вещество растирают с эфиром (дважды), фильтруют и высушивают, что позволяет получить 3,1 г (82%) 6-фтор-3-(2-метилпиридин-3-ил)-2-[2(2-метилтиазол-4-ил)винил]-3 Н-хиназолин-4 она в виде твердого вещества рыжеватокоричневой окраски. Точка плавления: 223-224 С; ЯМР 8.70 (dd, J=1.5, 5 Гц, 1 Н), 7.90 (dd частично закрытый, J=3 Гц, 1 Н), 7.89 (d, J=15 ГЦ, 1 Н), 7.78 (dd, J=5, 9 Гц, 1 Н), 7.54 (m, 2 Н),7.39 (dd, J=5, 8 Гц, 1 Н), 7.23 (s, 1H), 6.57 (d, J=15 Гц, 1 H), 2.61 (s, 3H), 2.36 (s, 3 Н). Анализ: вычислено для C20H15FN4OS0,5H2O: С, 62,06; Н, 4,13; N, 14,58; обнаружено: С,62,39; Н, 3,96; N, 14,33. Образец переводят в этилацетат и обрабатывают 1 н. метансульфоновой кислотой в этилацетате для образования мезилатной соли. Осадок собирают, ополаскивают этилацетатом и высушивают, что позволяет получить 6-фтор-3(2-метилпиридин-3-ил)-2-[2-(2-метилтиазол-4 ил)винил]-3 Н-хиназолин-4-он мезилат в виде твердого вещества светло-желтой окраски. Точка плавления: 230-231 С; ЯМР (метанолd4)9.01 (dd, J=1.2, 5.8 Гц,1 Н), 8.65 (dd, J=1.3, 8.2 Гц, 1 Н), 8.15 (dd, J=5.9,8.2 Гц, 1 Н), 8.00 (d, J=15 Гц, 1 Н), 7.88 (sym m, 2 Н), 7.71 (m, 2 Н), 6.56 (d, J=15 Гц, 1 Н), 2.68 (s,3 Н), 2,65 (s, 3 Н), 2.62 (s, 3 Н). Анализ: вычислено для С 20H15FN4OS СН 3SО 3 Н 0,75 H2O: С, 51,69; Н, 4,20; N, 11,48; обнаружено: С, 51,80; Н, 4,18; N, 11,35. 34 Пример 71. 6-Фтор-2-[2-(2-метилтиазол-4 ил)винил]-3-(2-метилфенил)-3 Н-хиназолин-4 он. Безводный хлорид цинка (0,136 г; 1,0 ммоль) расплавляют с продувкой азотом на открытом пламени в круглодонной колбе. Реакционный сосуд оставляют охлаждаться до температуры окружающей среды, после чего в него добавляют диоксан (10 мл). К этой смеси добавляют 6-фтор-2-метил-3-(2-метилфенил)-3 Нхиназолин 4-он (0,134 г; 0,5 ммоль), уксусный ангидрид (0,141 мл; 1,5 ммоль) и 2-метилтиазол 4-карбоксальдегид (0,191 г; 1,5 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 3,5 ч, охлаждают до температуры окружающей среды и разбавляют водой. Смесь несколько раз экстрагируют хлороформом. Объединенный хлороформенный слой промывают водой и солевым раствором, окончательно высушивают над сульфатом натрия и концентрируют, получая темный остаток. Этот остаток растирают с эфиром, фильтруют и высушивают,что позволяет получить 0,04 г (21%) 6-фтор-2[2-(2-метилтиазол-4-ил)винил]-3-(2-метилфенил)-3 Н-хиназолин-4-она в виде твердого вещества рыжевато-коричневой окраски. Точка плавления: 211-212 С; ЯМР 7.91 (dd, J=3, 8.3 Гц, 1H), 7.87 (d, J= 15 Гц, 1 H), 7.75 (dd, J=5, 9 Гц, 1 Н), 7.49 (dt, J= 3, 9 Гц, 1 Н), 7.42 (sym m, 3 Н), 6.61 (d, J=15 Гц,1H), 2.60 (s, 3 Н), 2.09 (s, 3H). Пример 72. 3-(2-Хлорфенил)-6-фтор-2-[2(2-метилтиазол-4-ил)винил]-3 Н-хиназолин-4-он. Безводный хлорид цинка (0,133 г; 0,98 ммоль) расплавляют с продувкой азотом на открытом пламени в круглодонной колбе. Реакционный сосуд оставляют охлаждаться до температуры окружающей среды, после чего в него добавляют диоксан (7 мл). К этой смеси добавляют 3-(2-хлорфенил)-6-фтор-2-метил-3 Н-хиназолин 4-он (0,14 г; 0,49 ммоль), уксусный ангидрид (0,138 мл; 1,46 ммоль) и 2-метилтиазол-4 карбоксальдегид (0,185 г; 1,46 ммоль в 4 мл диоксана). Реакционную смесь кипятят с обратным холодильником в течение 4 ч, охлаждают до температуры окружающей среды и разбавляют водой. Смесь несколько раз экстрагируют хлороформом. Объединенный хлороформенный слой промывают водой и солевым раствором,окончательно высушивают над сульфатом натрия и концентрируют, получая темный остаток. Этот остаток растирают с эфиром, фильтруют и высушивают, что позволяет получить 0,16 г(57%) 3-(2-хлорфенил)-6-фтор-2-[2-(2-метилтиазол-4-ил)винил]-3 Н-хиназолин-4-она в виде твердого вещества рыжевато-коричневой окраски. Точка плавления: 231-232 С; ЯМР 7.87-7.84 (m, 2 Н), 7.80 (dd, J=4.8, 9 Гц, 1 Н), 7.63-7.61 (m, 1H), 7.52-7.47 (m, 3H), 35 7.38-7.35 (m, 1H), 7.20 (s, 1H), 6.60 (d, J=15 Гц,1H), 2.60 (s, 3 Н). Анализ: вычислено для C20H13 СlFN3OS: С,60,45; Н, 3,27; N, 10,58; обнаружено: С, 59,68; Н,3,17; N, 10,44. Пример 73. 2-[2-(2-Диметиламинометилтиазол-4-ил)винил]-6-фтор-3-(2-фторфенил)-3 Нхиназолин-4-он. Безводный хлорид цинка (0,106 г; 0,78 ммоль) расплавляют с продувкой азотом на открытом пламени в круглодонной колбе. Реакционный сосуд оставляют охлаждаться до температуры окружающей среды, после чего в него добавляют диоксан (6 мл). К этой смеси добавляют 6-фтор-3-(2-фторфенил)-2-метил-3 Н-хиназолин 4-он (0,108 г; 0,39 ммоль), уксусный ангидрид (0,111 мл; 1,18 ммоль) и 2-диметиламинометилтиазол-4-карбоксальдегид (0,280 г; 1,18 ммоль в 4 мл диоксана). Реакционную смесь кипятят с обратным холодильником в течение 4 д, охлаждают до температуры окружающей среды и разбавляют водой. К реакционной смеси добавляют карбонат натрия до тех пор, пока рН смеси не станет основным. Смесь несколько раз экстрагируют хлороформом. Объединенный хлороформенный слой промывают водным раствором бисульфита, водой и солевым раствором, окончательно высушивают над сульфатом натрия и концентрируют, получая темный остаток. Этот остаток растирают с эфиром, фильтруют и высушивают, что позволяет получить 0,051 г (31%) 2-[2-(2-диметиламинометилтиазол 4-ил)винил]-6-фтор-3-(2 фторфенил)-3 Н-хиназолин-4-она в виде твердого вещества рыжевато-коричневой окраски. Точка плавления: 163-165 С; ЯМР 7.90 (dd, J=3, 8.5 Гц, 1 Н), 7.88 (d, J= 15 Гц, 1 Н), 7.76 (dd, J=5, 9 Гц, 1 Н), 7,53 (m, 2 Н),7.33 (m, 4 Н), 6.74 (d, J=15 Гц, 1 Н), 2.48 (br s,3 Н), 1.58 (br s, 3 Н). Анализ: вычислено для C22H18F2N4S0,75H2O: С, 60,34; Н, 4,46; N, 12,80; обнаружено: С,60,37; Н, 4,38; N, 12,39. Пример 74. 3-(2-Бромфенил)-6-фтор-2-[2(2-метилтиазол-4-ил)винил]-3 Н-хиназолин-4-он. Безводный хлорид цинка (0,150 г; 1,1 ммоль) расплавляют с продувкой азотом на открытом пламени в круглодонной колбе. Реакционный сосуд оставляют охлаждаться до температуры окружающей среды, после чего в него добавляют диоксан (5 мл). К этой смеси добавляют 3-(2-бромфенил)-6-фтор-2-метил-3 Н-хиназолин 4-он (0,182 г; 0,55 ммоль), уксусный ангидрид (0,156 мл; 1,65 ммоль) и 2-метилтиазол 4-карбоксальдегид (0,209 г; 1,65 ммоль в 3 мл диоксана). Реакционную смесь кипятят с обратным холодильником в течение 3 ч, охлаждают до температуры окружающей среды и разбавляют водой. Смесь несколько раз экстрагируют хлороформом. Объединенный хлороформенный слой промывают водой и солевым раствором, 002905 36 окончательно высушивают над сульфатом магния и концентрируют, получая темный остаток. Этот остаток растирают с эфиром, фильтруют и высушивают, что позволяет получить 0,116 г(52%) 3-(2-бромфенил)-6-фтор-2-[2-(2-метилтиазол-4-ил)винил]-3 Н-хиназолин-4-она в виде твердого вещества рыжевато-коричневой окраски. Точка плавления: 233-234 С; ЯМР 7.96-7.90 (m, 1H), 7.90 (d, J=15 Гц,1H), 7.77-7.75 (m, 2 H), 7.55-7.53 (m, 2 H), 7.467.38 (m, 2H), 7.21 (s, 1H), 6.60 (d, J=15 Гц, 1 H),2.61 (s, 3H). Анализ: вычислено для C20H13BrFN3OS0,5H2O: С, 53,22; H, 3,10; N, 9,31; обнаружено: С,53,07; H, 2,93; N, 9,25. Пример 75. 3-(2-Хлорфенил)-2-[2-(2-метилтиазол-4-ил)винил]-3 Н-хиназолин-4-он. Безводный хлорид цинка (0,136 г; 1,0 ммоль) расплавляют с продувкой азотом на открытом пламени в круглодонной колбе. Реакционный сосуд оставляют охлаждаться до температуры окружающей среды, после чего в него добавляют диоксан (10 мл). К этой смеси добавляют 3-(2-хлорфенил)-2-метил-3 Н-хиназолин-4 он (0,135 г; 0,50 ммоль), уксусный ангидрид(0,141 мл; 1,5 ммоль) и 2-метилтиазол-4 карбоксальдегид (0,191 г; 1,5 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 3 ч, охлаждают до температуры окружающей среды и разбавляют водой. Смесь несколько раз экстрагируют хлороформом. Объединенный хлороформенный слой промывают водой и солевым раствором, окончательно высушивают над сульфатом натрия и концентрируют, получая воскообразный остаток рыжевато-коричневой окраски. Этот остаток растирают с эфиром, фильтруют и высушивают, что позволяет получить 0,139 г (73%) 3-(2-хлорфенил)-2[2-(2-метилтиазол-4-ил)винил]-3 Н-хиназолин-4 она в виде твердого вещества рыжеватокоричневой окраски. Точка плавления: 219-221 С; ЯМР 8,30 (d, J=7.8 Гц, 1 Н), 7.91 (d, J=15 Гц, 1 Н), 7.78 (m, 2 Н), 7.63 (m, 1 Н), 7.48 (m, 3 Н),7,38 (m, 1 Н), 7.21 (s, 1 Н), 6.63 (d, J=15 Гц, 1 Н),2.61 (s, 3 Н). Анализ: вычислено для C20H14ClN3OS0,5H2O: С, 61,85; Н, 3,87; N, 10,82; обнаружено: С,61,83; Н, 3,75; N, 10,55. Примеры 76-94. Соединения в табл. 3 были приготовлены по существу с помощью тех же методик, которые приведены в примерах 70-75. Примеры 95-113. Соединения в табл. 4 были приготовлены по существу с помощью тех же методик, которые приведены в примере 2. где R1 представляет собой возможно замещенный фенил формулы Ph1 или гетероарил, выбранный из группы, содержащей пиридин-2-ил,пиридин-3-ил и пиридин-4-ил, причем указан ный гетероарил может быть замещен по 2 положению заместителем, выбранным из (C1C6)алкила и галогена; причем указанный Ph1 представляет собой группу формулыR2 представляет собой фенил формулы Ph2 или 5- либо 6-членный гетероцикл, причем указанный 6-членный гетероцикл имеет формулу где N представляет собой азот; указанные положения К, L и М в кольце могут быть независимо выбраны из углерода или азота при том условии, что 1) только один из К, L или М может быть азотом и 2) когда К, L или М представляет собой азот, то отсутствуют их соответствующие R15, R16 или R17; указанный 5-членный гетероцикл имеет формулу где Т представляет собой -СН-, N, NH, О или S; положения Р и Q в кольце могут быть независимо выбраны из углерода, азота, кислорода или серы при том условии, что только один из Р, Q или Т может быть кислородом или серой и, по меньшей мере, один из Р, Q или Т должен быть гетероатомом; указанный Рh2 представляет собой группу формулыR6 представляет собой водород или галогено;R7 представляет собой водород или галогено;R8 представляет собой водород или галогено;R11 представляет собой водород или галогено;R14 выбран из водорода, галогено, (С 1 С 6)алкила, возможно замещенного атомами галогена числом от одного до трех, 002905 ди(С 1-С 6)алкил-N-(С 1-С 6)алкил-(С=O)-О(СН 2)p-, гидрокси-(C1-C6)алкила-, (C1-C6)алкилO-(C1-C6)алкила-, -CN, пиперидин-(CH2)p-, пирролидин-(СН 2)p- и 3-пирролин-(СН 2)p-; причем указанный пиперидин группировки пиперидин(СН 2)p может быть замещен по любому из углеродных атомов кольца, способных к поддержанию дополнительной связи, заместителем (C1C6)алкилом;R15 представляет собой водород или (С 1 С 6)алкил;R16 представляет собой водород или (С 1 С 6)алкил;R17 представляет собой водород, -CN,ди(С 1-С 6)алкил-N(С 1-С 6)алкил-, (С 1-С 6)алкоксигруппу или CHF2; каждое р независимо представляет собой целое число от нуля до 4; причем подчеркнутая пунктиром связь представляет собой возможно двойную связь; при условии, что 1) когда R9 представляет собой водород, один из R11 и R12 является отличным от водорода; 2) когда R3 представляет собой водород, R6, R7 и R8 представляют собой водород, а R5 представляет собой хлор или метил, то (а) R2 не может быть незамещенным фенилом, тиенилом либо фурилом или (б) R9 не может быть гидроксильной или метильной группой; 3) когда R3 представляет собой водород либо хлор, R5 представляет собой метил, R6,R7 и R8 представляют собой водород, а К, L и М равны углероду, то (а) один из радикалов от R14 до R17 должен быть отличным от водорода или(б) R17 должен быть отличным от водорода; 4) когда R1 представляет собой незамещенный пиридин-2-ил, а R3 представляет собой водород,бром либо иод, то R2 не может быть незамещенным фенилом; 5) когда R7 представляет собой хлор; R5, R6 и R8 представляют собой водород иR3 является водородом, то (а) R2 не может быть незамещенным фенилом, пиридилом, тиенилом либо фурилом или (б) R9 не может быть гидроксильной группой, когда R10 и R11 представляют собой водород, 6) когда R2 представляет собой незамещенный пиридин-2-ил, R5 и R7 представляют собой водород и R3 является водородом, тоR6 или R8 должен отличаться от хлора; 7) когдаR2 представляет собой незамещенный фенил, R3 является водородом и R5 и R7 представляют собой водород, то один из R6 или R8 должен быть отличным от хлора; и фармацевтически приемлемые соли таких соединений. 2. Соединение по п.1, где R3 представляет собой фтор. 3. Соединение по п.1, где R1 представляет собой Ph1 и один из R5, R6, R7 или R8 представляет собой фтор, бром, хлор или метил. 4. Соединение по п.1, где R1 представляет собой Ph1 и R5 представляет собой фтор, бром,хлор или метил. 5. Соединение по п.2, где R1 представляет собой Ph1 и R5 представляет собой фтор, бром,хлор или метил. 6. Соединение по п.1, где R2 представляет собой Ph2 и либо R9 представляет собой фтор,хлор, -CN или гидроксильную группу, либо R10 представляет собой -СНО, метил или ди(С 1 С 6)алкил-N-(СН 2)p-. 7. Соединение по п.2, где R2 представляет собой Ph2 и либо R9 представляет собой фтор,-хлор, -CN или гидроксильную группу, либо R10 представляет собой -СНО, -метил или ди(С 1 С 6)алкил-N-(СН 2)p-. 8. Соединение по п.1, где R1 представляет собой указанный гетероарил, возможно замещенный по 2 положению галогено или (С 1C6)алкилом. 9. Соединение по п.2, где R1 представляет собой указанный гетероарил, возможно замещенный по 2 положению галогено или (С 1C6)алкилом. 10. Соединение по п.6, где R1 представляет собой указанный гетероарил, возможно замещенный по 2 положению галогено или (C1C6)алкилом. 11. Соединение по п.1, где R1 представляет собой пиридин-3-ил, замещенный по 2 положению пиридинового кольца хлором или метилом. 12. Соединение по п.1, где R2 является гетероарилом, представляющим собой либо возможно замещенный 6-членный гетероцикл, в котором К, L и М являются углеродом, или К иL представляют собой углерод, а М представляет собой азот (например, пиримидин-2-ил), либо указанный гетероарил представляет собой возможно замещенный 5-членный гетероцикл, в котором Т является азотом, Р представляет собой серу, a Q представляет собой углерод, или Т представляет собой азот либо серу, Q представляет собой азот либо серу, а Р представляет собой углерод, или Т представляет собой кислород, а Р и Q каждый представляют собой углерод. 13. Соединение по п.1, где R2 представляет собой возможно замещенный 6-членный гетероцикл, в котором К, L и М представляют собой углерод, R14 представляет собой водород, -СНО,хлор, фтор, метил, (С 1-С 6)алкил-NН-(СН 2)p-,ди(С 1-С 6)алкил-N-(СН 2)p- или цианогруппу; R17 44 представляет собой водород или ди(С 1 С 6)алкил-N-(С 1-С 6)алкил; либо R15 или R16 независимо представляют собой водород или метил. 14. Соединение по п.1, где R2 представляет собой возможно замещенный 6-членный гетероцикл, в котором К, L и М представляют собой углерод, а R14 представляет собой водород,-СНО, метил, (С 1-С 6)алкил-NН-(СН 2)p-, ди(С 1 С 6)алкил-N-(СН 2)p или цианогруппу. 15. Соединение по п.1, где R2 представляет собой возможно замещенный 5-членный гетероцикл, в котором Т представляет собой азот, Р представляет собой серу и Q представляет собой углерод, а R14 представляет собой водород,хлор, фтор или метил; и R15 и R16, каждый независимо, представляют собой водород или метил. 16. Соединение по п.1, где R2 представляет собой возможно замещенный 5-членный гетероцикл, в котором Т представляет собой азот или серу, Q представляет собой серу или азот и Р представляет собой углерод, а R14 выбран из водорода, хлора, фтора и метила; и R15 выбран из водорода и метила. 17. Соединение по п.1, выбранное из группы, содержащей 3-(2-хлорфенил)-2-[2-(5-диэтиламинометил-2-фторфенил)винил]-6-фтор-3 Н-хиназолин 4-он; 3-(2-хлорфенил)-2-[2-(6-диэтиламинометилпиридин-2-ил)винил]-6-фтор-3 Н-хиназолин 4-он; 3-(2-хлорфенил)-2-[2-(6-этиламинометилпиридин-2-ил)винил]-6-фтор-3 Н-хиназолин-4 он; 3-(2-бромфенил)-2-[2-(6-диэтиламинометилпиридин-2-ил)винил]-6-фтор-3 Н-хиназолин 4-он; 3-(2-хлорфенил)-6-фтор-2-[2-(6-метоксиметилпиридин-2-ил)винил]-3 Н-хиназолин-4-он; 6-фтор-3-(2-метилпиридин-3-ил)-2-[2-(2 метилтиазол-4-ил)винил]-3 Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-[2-(4-метилпиримидин-2-ил)винил]-3 Н-хиназолин-4-он; 3-(2-хлорфенил)-6-фтор-2-2-[6-(изопропиламинометил)пиридин-2-ил]этил-3 Н-хиназолин-4-он; и 2-[2-(5-диэтиламинометил-2-фторфенил) винил]-6-фтор-3-(2-метилпиридин-3-ил)-3 Нхиназолин-4-он. 18. Фармацевтическая композиция, обладающая антагонистической активностью по отношению к АМРА-рецептору, содержащая эффективное количество соединения формулы I по п.1 и фармацевтически приемлемый носитель.
МПК / Метки
МПК: A61K 31/495, A61P 25/28, C07D 401/06
Метки: 3н)-хиназолиноны, фармацевтическая, содержащая, 2,3-двузамещенные, композиция
Код ссылки
<a href="https://eas.patents.su/23-2905-23-dvuzameshhennye-4-3n-hinazolinony-i-soderzhashhaya-ih-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">2,3-двузамещенные -4 (3н)-хиназолиноны и содержащая их фармацевтическая композиция</a>
Предыдущий патент: Фунгицидная смесь на основе амидных соединений
Следующий патент: Производные трифторметилалкиламинотриазолопиримидина, способ их получения, фунгицидная композиция, применение и способ подавления грибов в локусе
Случайный патент: Алкильные производные в качестве метаботропных рецепторов глутамата