Фармацевтическая композиция, содержащая выбранные гидраты карбоната лантана
Формула / Реферат
1. Фармацевтическая композиция для лечения гиперфосфатемии, включающая карбонат лантана формулы
La2(C03)3 • хН20, где х имеет значение от 3 до 6, в смеси или в ассоциации с фармацевтически приемлемым разбавителем или носителем.
2. Композиция по п. 1, в которой значение х в карбонате лантана составляет от 3,5 до 5.
3. Композиция по п. 2, в которой значение х в карбонате лантана составляет от 3,8 до 4,5.
4. Композиция по любому из пп. 1-3, представленная в форме, пригодной для перорально-го введения.
5. Композиция по любому из пп. 1-4, представленная в лекарственной форме стандартной дозировки, обеспечивающей введение от 0,1 до 20 г в день.
6. Применение карбоната лантана, охарактеризованного в любом из пп. 1-3, для получения лекарственного препарата для лечения гиперфосфатемии путем введения в желудочно-кишечный тракт.
Текст
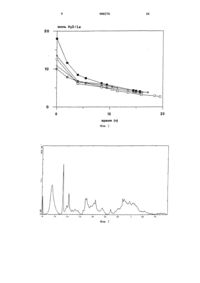
Настоящее изобретение касается нового и оригинального фармацевтического состава и способа, более конкретно оно касается состава для лечения гиперфосфатемии (повышенного содержания фосфата в крови).Гиперфосфатемия представляет собой специфическую проблему пациентов с почечной недостаточностью, использующих аппаратуру для диализа. Стандартного диализа недостаточно для снижения уровня фосфата в крови, так что уровень его растет со временем. Известен способ контролирования уровня фосфата путем перорального введения солей алюминия или СОЛСЙ КЗЛЬЦИЯ. УЧИТЫВЭЯ ИЗВССТНОС ТОКСИЧССКОС воздействие алюминия, терапии на основе алюминия стремятся избегать. В случае солей кальция, последний довольно легко абсорбируется из пищеварительного тракта и, в свою очередь,ВЫЗЫВЗСТ гиперкальциемию.Было высказано предположение (Ыакадаша е: а 1., Тгапз Апт Зое 1 шеш Огапз, 31, (1985) 1559), что водный оксид церия может использоваться в качестве шариков в ионообменной колонке, чтобы связывать фосфат в процессе диализа. Опубликованная японская заявка на патент 61 004 529, по-видимому, охватывает ту же идею, предполагая, что в колонке могут использоваться водные оксиды Ьа, Се и У. Однако,ХОТЯ РСДКОЗСМСЛЬНЫС ЗЛСМСНТЬП ООЬГЧНО считаЮТСЯ НИЗКОТОКСИЧНЫМИ СОГЛЗСНО СИСТСМС КЛЯСсификаьши Ходжа-Штернера (Ноаде-Згегпег)(Аш 1 пс 1 Ну; Аззос Оцагг, 10, (1943) 93), их токсичность при введении внутривенно, что соответствует использованию в системах диализа КРОВИ, ЯВЛЯСТСЯ ЗНЗЧИГСЛЬНОЙ, И МЫ не ОСВСДОМлены о том, чтобы предложенная ионообменная система или любая ее модификация получила широкое распространение или была клинически испытана для случаев гиперфосфатемии.Известно, что много лет назад оксид или оксалат церия вводился пациентам по различным медрщинским показаниям, но это ушло в полное забвение.В опубликованной японской заявке на патент Мг 62-145024 (Аза 111 С 11 еп 11 са 1 1 ш 1 КК) описывается, что карбонаты, бикарбонаты или соединения с органическими кислотами редкозеМСЛЬНЫХ ЗЛСМСНТОВ МОГУТ ИСПОЛЬЗОВЗТЬСЯ В качестве связывающих фосфат агентов. Один пример указанной опубликованной заявки относится к использованию карбоната лантана, хотя в описанных тестах карбонат церия и соли церия с органическими кислотами показали лучшую экстракцию фосфат-иона, чем карбонат лантана. Пример 11 указанной опубликованной заявки относится к получению Ьа 2(СО 3)3 Н 2 О,т.е. моногидрата; все другие примеры направлены на иные, чем карбонат лантана, карбонаты РСДКОЗСМСЛЬНЫХ МСТЗЛЛОВ.Теперь мы открыли, что некоторые формы карбоната лантана проявляют улучшенные эксплуатационные характеристики в ряде тестов, 000270по сравнению со стандартным промышленно выпускаемым карбонатом лантана, который, как считают, представляет собой октагидратную форму, и по сравнению с Ьа 2(СО 3)3 Н 2 О или подобными соединениями.Поэтому, согласно одному аспекту, настоящее изобретение представляет собой использование карбоната лантана формулы Ьа 2(СО 3)3 хН 2 О, где х глмеет значение от 3 до 6,предпочтительно от 3,5 до 5, особенно от 3,8 до 4,5, для приготовления лекарственного препарата для лечения гиперфосфатемии путем введения в желудочно-кишечный тракт.Далее, изобретение предлагает фармацевтическую композицию, содержащую указанный карбонат лантана, в смеси или в ассоциации с фармацевтически приемлемым разбавителем или носителем, в форме для введения в желудочно-кишечный тракт для лечения гиперфосфатемии.Изобретение может быть также описано как способ лечения гршерфосфатемии у пациентов с почечной недостаточностью, включающий введение эффективной дозы указанного карбоната лантана в желудочно-кишечный тракт.Варианты реализации настоящего изобреТСНИЯ ОПИСЗНЫ НШКС, ТОЛЬКО В КЗЧССТВС примера,со ссылкой на сопровождающие рисунки, на которых:фиг. 1 иллюстрирует способность к связыванию фосфата разновидностей карбоната ланТЗНЗ, ИМСЮЩИХ РЗЗЛИЧНЫС КОЛИЧССТВЗ кристаллизационной воды;фиг. 2 - кривые сушки для пяти порций карбоната лантана, полученного согласно способу, указанному в примере 1;фиг. 3 - данные рентгеноструктурного анализа карбоната лантана -4 Н 2 О, полученного согласно способу, указанному в примере 2;фиг. 4 - данные рентгеноструктурного анализа карбоната лантана -8,8 Н 2 О из примера 1,указанного выше.Образцы карбоната лантана для описанных далее тестов получали следующим образом:Образец 1. Промышленно производимый карбонат лантана получали у химической компании. При помощи элементного анализа (Ьа, С,Н), термогравиметрического анализа, рентгеноструктурного анализа на порошке и ИКспектроскопии определяли, что он имеет форМуЛу ЬЭ 2(СО 3)388 Н 2 О.Образцы 2-4 были получены путем натревания порций образца 1 при различных температурах в течение периодов времени различной продолжительности, либо под вакуумом, либо при атмосферном давлении, с получением ве ществ формулы Ьа 2(СО 3)3 -хН 2 О, где 0 х 8.- высушено до постоянной массы.Образец 5 представляет собой образец карбоната лантана, который при анализе идентифицирован формулой Ьа 2(СО 3)3 4 Н 2 О.Образец 6 представляет собой образец карбоната лантана, полученного согласно примеру 1 ниже и имеющего формулу Ьа 2(СО 3)3 3,8 Н 2 О.Для того чтобы показать, что некоторые гидраты карбоната лантана заметно отличаются по активности связывания фосфата как от октагидрата карбоната лантана, так и от Ьа 2(СО 3)3 Н 2 О, образцы испытывали следующим образом:1) готовили исходный раствор путем растворения 13,75 г безводного Ма 2 НРО 4, 8,5 г ЫаС 1 в 1 л деионизированной воды.11) 100 мл исходного раствора доводили до рН 3 путем добавления концентрированной НС 1.111) Брали 5 мл пробы и фильтровали через 0,02 мкм фильтр с получением исходного (соответствующего начальному моменту времени) образца. Последний анализировали на содержание фосфата с использованием тестового комплекта 13 ша Пшвпозйсз Со 1 ог 1 шегг 1 с Р 11 о 5 р 11 ог 115111) Добавляли 5 мл свежего исходного раствора до первоначального объема 100 мл и рН повторно доводили до значения приблизительно 3.у) Добавляли Ьа 2(СО 3)3-хН 2 О в виде сухого порошка в количестве, соответствующем молекулярному весу конкретного гидрата, с получением двукратного мольного избытка лантана по отношению к фосфату, и перемешивали при комнатной температуре.у 1) Отбор проб проводили на протяжении интервалов времени от 0,5 до 10 мин, и процентное содержание фосфата определяли как в пункте 111) выше. Результаты показаны в таблице 1 ниже.(Ьа 2(СО 3)3 4,4 Н 2 О); образец 5 (Ьа 2(СО 3)3 4 Н 2 О) и образец 6 (Ьа 2(СО 3)3 3,8 Н 2 О) связывают фосфат значительно быстрее, чем формы 8,8 Н 2 О,1,3 Н 2 О или 2,2 Н 2 О. Мы считаем, что результаты для Ьа 2(СО 3)3-1,3 Н 2 О согласуются с результатами, приведенными в вышеуказанной опубликованной японской заявке на патент номер 62145024, где для Ьа 2(СО 3)3 Н 2 О через 120 мин приведено значение удаления только в 90%.На фиг.1 из числа сопровождающих чертежей можно также летко видеть, что наибольшее удаление фосфата получено при помощи форм карбоната лантана, содержащих от 3 до 6 молекул воды.Настоящее изобретение дает возможность связывания фосфата без какого-либо проникновения лантана в кровоток, где его токсическое воздействие может вызвать проблемы. Указанный здесь карбонат лантана обладает ничтожно малой абсорбцией из пищеварительного тракта,как показано описанными ниже тестами 1 п у 1 уо.Везде в настоящем документе подразумевается, что термин "лечение" включает превентивное или профилактическое лечение.Процессы получения форм карбоната лантана согласно настоящему изобретению описаны в виде иллюстрации в следующих примерах 1 и 2.Пример 1. Оксид лантана (1,5 кг, 4,58 моль) суспендировали в воде (5,5 л) в 20 литровом сосуде. Азотную кислоту (аналитическая чистота 69%, плотность 1,42, 1,88 л, 29,23 моль) добавляли к перемешиваемому раствору в течение 1,5 ч с такой скоростью, чтобы поддерживать температуру в интервале 60-80 С. Образовавшийся раствор нитрата лантана оставляли остывать до комнатной температуры И фильтровали. К перемешиваемому раствору нитрата лантана добавляли раствор карбоната натрия(1,65 кг, 15,57 моль) в воде (7,75 л) в течение 45 мин. По окончании добавления рН суспензии составлял 9,74. Суспензию оставляли на ночь,фильтровали (воронка Бюхнера, бумага 540) и сушили на фильтре в токе воздуха в течение 30 мин. Твердую фазу затем повторно суспендировали в воде, перемешивали в течение 40 мин и фильтровали. Эту процедуру повторяли до поЛУЧСНИЯ, В ИТОГС ШССТИ ПрОМЫВОК, концентрации нитрата в фильтрате, которая составляла 500 млн 1. Конечное вещество (4,604 кг) распределяли по трем кюветам из стекла Пирекс(Ругех) и пробу из каждой анализировали на содержание воды. (Путем разложения взвешенного образца Ьа 2(СО 3)3-хН 2 О при 1050 С, 2 ч, до 1521203). Затем кюветы помещали в вентиляторную печь при 80 С и следили за потерей массы каждой кюветой до тех пор, пока не получали требуемую степень гидратации. Ход сушки показан ниже.Кривые сушки для пяти порций, полученных этим путем, показаны на фиг. 2.Ьа 2(СО 3)3-3,8 Н 2 О из кюветы 1 был выбран в качестве образца 6 для тестов на связывание фосфата, представленных в таблице 1.Пример 2. Повторяли процесс из примера 1, но с использоват-Шем соляной кислоты (12,28 М, 2,48 л) вместо азотной кислоты для того,чтобы растворить оксид лантана (1,5 кг). Выход сырого продукта после шести промывок составлял 4,378 кг. Продукт разделяли на три приблизительно равные части в кюветах из стекла Пирекс (Рутех) и сушили в вентиляторной печи при 80 С. Через 2 ч брали пробу с каждого лотка и проводили анализ на содержание воды путем разложения до оксида лантана, как описано выше. Эти цифры использовали для расчета потери массы, необходимой для получения вещества требуемого состава. Ход процесса сушки показан ниже.Из каждой кюветы брали образцы, объединяли и анализировали. Были получены следующие результаты.Найдено Расчет штя Ьа 2(СО,), 4 НдОДанные рентгенографического анализа для карбоната лантана :4 Н 2 О, приготовленного при помощи способа пршиера 2, показаны на фиг. 3.Фиг.4 иллюстрирует данные рентгеноструктурного анализа для карбоната лантана'8,8 Н 2 О, и очевидно, что последний имеет кристаллическую структуру, отличную от таковой карбоната лантана :4 Н 2 О, приготовленного при помощи способа из примера 2. Рентгеноструктурный анализ для карбоната лантана 4 Н 2 О,приготовленного при помощи способа из примера 1, был подобен рентгеноструктурному анализу для карбоната лантана -4 Н 2 О, приготовленного при помощи способа из примера 2.Фармацевтические композиции для перорального введения согласно настоящему изо бретению могут быть составлены и изготовлены с использоваьшем способов, хорошо известных в технологии. Подходящие носители или разбаВИГСЛИ ТЗКЖС ХОРОШО ИЗВССТНЫ. КОМПОЗИЦИИ могут находиться, желательно, в такой лекарственной форме, чтобы обеспечить единичную дневную дозировку или несколько более мелких дозировок в течение дня. Чтобы установить подходящие дозировки, могут применяться стандартные фармакологические методы. Важным является уровень содержания фосфата в гШЩе, которую принимает индивидуум. Показано, что дневные дозы находятся в диапазоне от 0,1 до 50 г, предпочтительно от 0,5 до 1.5 г. Подходящие формы для перорального введения включают твердые формы, такие как таблетки,капсулы и драже, и ясидкие формы, такие как суспензии или сиропы. В дополнение к разбавителям и носителям при составлении пероральных препаратов является стандартной практиКОЙ ВКТПОЧЗТЬ В ИХ состав НСЗКТИВНЫС ИНГрСДИенты, такие как загустители, улучшающие вкус компоненты и красители. Указанный карбонат может быть также покрыт или обработан таким образом, чтобы обеспечить формы с задержанным выделением. Предпочтительно, требуемая дневная дозировка предоставляется в форме таблетки, например, в форме разжевываемой таблетки, чтобы принимать ее с едой. Подходящую дневную дозу, составляющую около 2 г для человека в 70 кг следует сравнить с дневной дозой в 20 г для промышленно выпускаемой композиции для связывания фосфата на основе КаПЬЦИЯ.Чтобы продемонстрировать, что карбонат лантана согласно изобретению (или фосфат лантана, образованный после связывания с фосфатом в пищеварительном тракте) полностью выДСЛЯСТСЯ ИЗ оргат-Шзма И не ВЫХОДИТ ИЗ ПИЩСВЗрительного тракта в систему циркуляции при пероральном введении, трем крысам вводили дозу в 20 мг/кг Ьа 2(СО 3)3 4 Н 2 О (образец 5) и содержали их в метаболических клетках, где можно было собирать фекалии и мочу. Результаты показаны в таблице 2.Можно видеть, что через 72 ч весь лантан был выведен из организма. В образцах мочи количество лантана было ниже пороговой чувствительности. После испытаний крыс умерщв ляли И почки, печенъ И бедренную кость анализировали на содержание лантана. Во всех случаях количество лантана было ниже 0,1 млн.1. Фармацевтическая композиция для лечения гиперфосфатемии, включающая карбонат лантана формулыЬа 2(СОз)з ц ХН 2 Оз где х имеет значение от 3 до 6, в смеси или в ассоциации с фармацевтически приемлемым разбавителем или носителем.2. Композиция по п.1 в которой значение х в карбонате лантана составляет от 3,5 до 5.3. Композиция по п.2 в которой значение х в карбонате лантана составляет от 3,8 до 4,5.4. Композиция по любому из пп.1-3 представленная в форме, пригодной для перорального введения.5. Композиция по любому из пп.1-4 представленная в лекарственной форме стандартной дозировки, обеспечивающей введение от 0,1 до 20 г в день.6. Применение карбоната лантана, охарактеризованного в любом из пп.1-3, для получения лекарственного препарата для лечения ггшерфосфатемии путем введения в желудочнокишечный тракт.Число молекул воды (х)
МПК / Метки
МПК: A61K 33/24
Метки: лантана, фармацевтическая, композиция, гидраты, карбоната, выбранные, содержащая
Код ссылки
<a href="https://eas.patents.su/7-270-farmacevticheskaya-kompoziciya-soderzhashhaya-vybrannye-gidraty-karbonata-lantana.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция, содержащая выбранные гидраты карбоната лантана</a>
Предыдущий патент: Способ и устройство для создания рисунков в литых материалах
Следующий патент: Способ и устройство для обработки таблицы
Случайный патент: Способ изготовления оболочки мембран для опреснения воды и фильтрации жидкостей