Новые ингибиторы фарнезилтрансферазы, способы их получения и содержащая их фармацевтическая композиция
Номер патента: 797
Опубликовано: 24.04.2000
Авторы: Трюшон Ален, Суниго Фабьен, Пейронель Жан-Франсуа, Лебрён Ален, Зюкко Мартин, Майлие Патрик, Коммерсон Ален
Формула / Реферат
1. Соединения формулы (I)
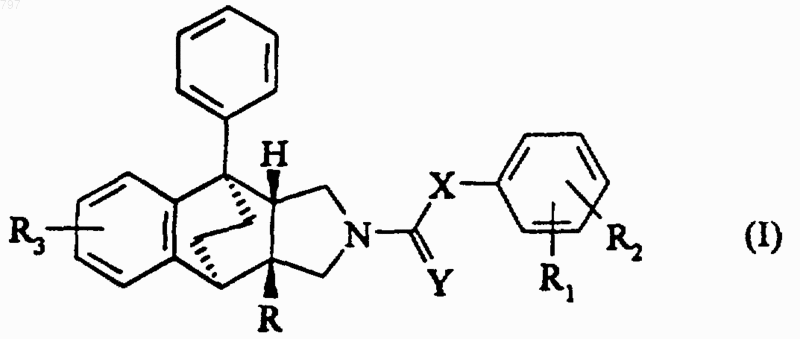
в которой R означает радикал общей формулы -(CH2)m-X1-(CH2)n-Z-, в котором
X1 означает простую связь или атом кислорода или серы,
m означает целое число, равное 0 или 1, и
n означает целое число, равное 0, 1 или 2, причем метиленовые радикалы могут быть замещены карбоксильным радикалом, алкоксикарбонильным радикалом, алкильная часть которого содержит 1-4 атома углерода, карбамоильным радикалом, алкилкарбамоильным радикалом, алкильная часть которого содержит 1-4 атома углерода, диалкилкарбамоильным радикалом, каждая алкильная часть которого содержит 1-4 атома углерода, аминогруппой, алкиламиногруппой, содержащей 1-4 атома углерода, диалкиламиногруппой, каждая алкильная часть которой содержит 1-4 атома углерода, и
Z означает карбоксильный радикал; радикал COOR4, в котором R4 означает линейный или разветвленный алкильный радикал, содержащий 1-3 атома углерода; или радикал CON(R5)(R6), в котором
R5 означает атом водорода или линейный или разветвленный алкильный радикал с 1-6 атомами углерода и
R6 означает атом водорода или линейный или разветвленный алкильный радикал с 1-6 атомами углерода, возможно замещенный аминогруппой, алкиламиногруппой с 1-4 атомами углерода, диалкиламиногруппой, каждая алкильная часть которой содержит 1-4 атома углерода, гидроксилом, алкоксилом с 1-4 атомами углерода, меркаптогруппой, алкилтиогруппой с 1-4 атомами углерода, алкилоксикарбонилом, алкильная часть которого содержит 1-4 атома углерода, карбоксилом, цианогруппой, фенилом, возможно замещенным одним или несколькими, одинаковыми или разными атомами, или радикалами, выбираемыми среди атомов галогена и алкильных радикалов с 1-4 атомами углерода, алкоксильных радикалов с 1-4 атомами углерода, диалкиламиногруппы, каждая алкильная часть которой содержит 1-4 атома углерода, трифторметила или цианогруппы; нафт-1- или -2-илом, фур-2- или -3-илом, тиен-2- или -3-илом, имидазол-4- или -5-илом, тиазол-2-, -4- или -5-илом, тиазолидин-2-, -4- или -5-илом или пирид-2-, -3- или -4-илом; или инданильным или тиохроманильным радикалом; или же
R5 означает атом водорода или линейный или разветвленный алкильный радикал с 1-6 атомами углерода и
R6 означает гидроксил, аминогруппу или алкилоксигруппу с 1-6 атомами углерода в линейной или разветвленной цепи, возможно замещенную фенильным радикалом; или радикал PO3(OR7)2, в котором R7 означает атом водорода или линейный или разветвленный алкильный радикал с 1-6 атомами углерода; или
радикал -NH-CO-T, в котором Т означает атом водорода или линейный или разветвленный алкильный радикал с 1-6 атомами углерода, возможно замещенный аминогруппой, карбоксилом, алкилоксикарбонилом, алкильная часть которого содержит 1-4 атома углерода, гидроксилом, алкилоксигруппой с 1-4 атомами углерода, меркаптогруппой или алкилтиогруппой с 1-4 атомами углерода;
или остаток четвертичного аммония формулы 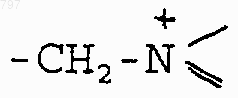
предпочтительно означает остаток пиридиниевого радикала,
R1 и R2, одинаковые или разные, означают атом водорода или галогена или алкильный радикал с 1-4 атомами углерода, алкилоксигруппу с 1-4 атомами углерода, возможно замещенную диалкиламиногруппой, каждая алкильная часть которой содержит 1-4 атома углерода или вместе с атомом азота образует насыщенный гетероцикл, содержащий 5 или 6 атомов углерода, алкилтиогруппой с 1-4 атомами углерода, алкилоксикарбонилом, алкильная часть которого содержит 1-4 атома углерода; или же R1 и R2, находящиеся в орто-положении друг к другу, образуют насыщенный или ненасыщенный гетероцикл, содержащий 1 или 2 гетероатома, выбираемых среди азота и кислорода, возможно замещенный атомом галогена или алкильным радикалом с 1-4 атомами углерода или алкилоксигруппой с 1-4 атомами углерода или еще
R1 означает атом водорода или галогена или алкильный радикал с 1-4 атомами углерода, алкилоксигруппу с 1-4 атомами углерода, возможно замещенную диалкиламиногруппой, каждая алкильная часть которой содержит 1-4 атома углерода, алкилтиогруппой с 1-4 атомами углерода, алкилоксикарбонилом, алкильная часть которого содержит 1-4 атома углерода; и
R2 означает тиоалкильный радикал с 1-4 атомами углерода, при условии, что в этом случае продукт общей формулы (I) находится в виде удвоенного посредством дисульфидного мостика продукта;
R3 означает атом водорода или галогена или алкильный радикал с 1-4 атомами углерода, алкенильный радикал с 2-4 атомами углерода, алкилоксигруппу с 1-4 атомами углерода или алкилтиогруппу с 1-4 атомами углерода;
Х означает атом кислорода или серы или группу -NH-, -СО-, метиленовую группу, этиленовую группу, алкилиденовую группу, такую как винилиден, или 1,1-циклоалкил с 3-6 атомами углерода; и
Y означает атом кислорода или серы;
в рацемической форме, так же как оптические изомеры продукта общей формулы (I).
2. Соединения по п.1, в которых один из символов R1 и R2 означает атом водорода, а другой означает алкилоксигруппу с 1-4 атомами углерода, R3 означает атом водорода, Х означает метиленовую группу, Y означает атом кислорода и R означает радикал общей формулы -(CH2)m-X1-(CH2)n-Z-, в которой m равно 0 или 1, Х1 означает связь и n равно нулю и Z означает карбоксил или радикал -COOR4, в котором R4 означает алкильный радикал с 1-3 атомами углерода или радикал CON(R5) (R6), в котором R5 и R6 имеют указанное в п.1 значение.
3. Соединение по п.1 формулы I, которое представляет собой (3аS, 4R, 9R, 9аS)-4,9-этано-2-[2-(2-метоксифенил)-проп-2-ен-1-оил]-9-фенил-1,2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновую кислоту, правовращающий энантиомер, возможно в форме сложного эфира с 1-3 атомами углерода.
4. Соединение по п.1 формулы (I), которое представляет собой (3aS,4R,9R,9aS)-N-[(S)-трет-бутилфенилглициноил]-4,9-этано-2-[(2-метоксифенил)проп-2-ен-1-оил]-9-фенил-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоксамид.
5. Соединение по п.1 формулы I, которое представляет собой (3аS,4R,9R,9aS)-N-[(3-пиридил)метил] -4,9-этано-2-[(2-метоксифенил)проп-2-ен-1-оил]-9-фенил-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоксамид.
6. Соединение по п.1 формулы I, которое представляет собой (3аS,4R,9R,9aS)-N-[(2-пиридил)метил]-4,9-этано-2-[(2-метоксифенил)проп-2-ен-1-оил] -9фенил-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоксамид.
7. Способ получения продукта по любому из пп.1, 2, 3, 4, 5 или 6, где R, R1, R2 и R3 имеют указанное в любом из пп.1 или 2 значение, Y означает атом кислорода или серы и Х означает группу -СО-, метиленовую группу, этиленовую группу, алкилиденовую группу или 1,1-циклоалкил, отличающийся тем, что кислоту общей формулы (II)
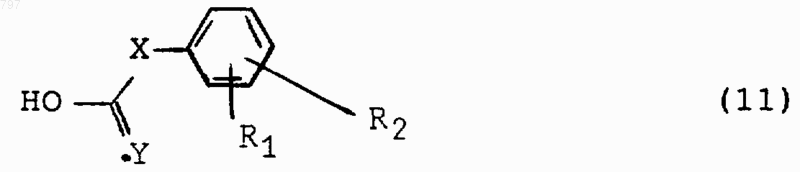
в которой R1, R2 и Х имеют вышеуказанное значение и Y означает атом кислорода или серы, или ее метиловый эфир или производное этой кислоты, такое как галоидангидрид или ангидрид, вводят во взаимодействие с продуктом общей формулы (III)
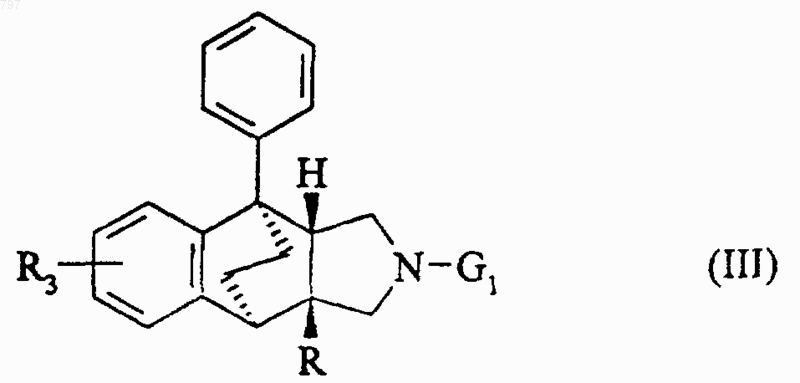
в которой R и R3 имеют вышеуказанное значение и G1 означает атом водорода, затем, в случае необходимости, когда R означает или содержит радикал -COOR4 или -PO3(OR7)2, в которых R4 и R7 означают алкильный радикал, образовавшийся продукт омыляют для получеэшя продукта общей формулы (I), в которой R означает или содержит карбоксильный радикал, или образовавшийся продукт с помощью нуклеофильного агента превращают в продукт общей формулы (I), в которой R означает или содержит радикал -РО3Н2.
8. Способ получения продукта по любому из пп.1 или 2, в котором Y означает атом кислорода или серы и Х означает атом кислорода, отличающийся тем, что галогенформиат или галогентиоформиат общей формулы (IV)
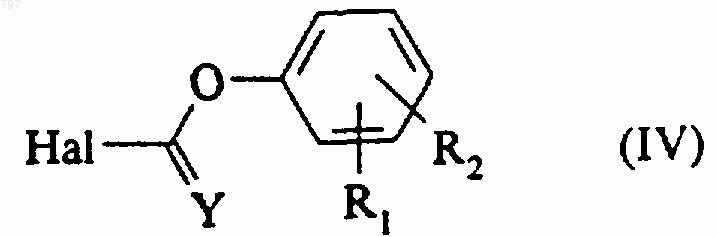
в которой Y означает атом кислорода или серы, R1 и R2 имеют указанное в любом из пп.1 или 2 значение и Hal означает атом галогена, вводят во взаимодействие с продуктом общей формулы (III), затем, в случае необходимости, когда R означает или содержит радикал -COOR4 или -PO3(OR7)2, в которых R4 и R7 означают алкильный радикал, образовавшийся продукт омыляют для получения продукта общей формулы (I), в которой R означает или содержит карбоксильный радикал, или образовавшийся продукт с помощью нуклеофильного агента превращают в продукт общей формулы (I), в которой R означает или содержит радикал -РО3Н2.
9. Способ получения продукта по любому из пп.1 или 2, в котором Y означает атом кислорода или серы и Х означает группу -NH-, отличающийся тем, что изоцианат или изотиоцианат общей формулы (V)
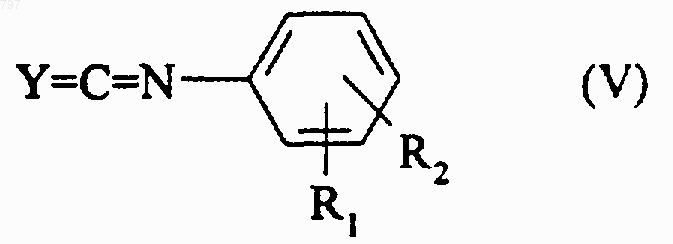
в которой Y означает атом кислорода или серы, R1 и R2 имеют указанное в любом из пп.1 или 2 значение, вводят во взаимодействие с продуктом общей формулы (III), в которой G1 означает атом водорода, затем, в случае необходимости, когда R означает или содержит радикал -COOR4 или -РО3(R7)2, в которых R4 и R7 означают алкильный радикал, образовавшийся продукт омыляют для получения продукта общей формулы (I), в которой R означает или содержит карбоксильный радикал, или образовавшийся продукт с помощью нуклеофильного агента превращают в продукт общей формулы (I), в которой R означает или содержит радикал -РО3Н2.
10. Способ получения продукта по любому из пп.1 или 2, в котором R1, R2 и R3 имеют указанное в любом из пп.1 или 2 значение, Х означает атом кислорода или серы или группу -NH-, -СО-, метиленовую группу, этиленовую группу, алкилиденовую группу или 1,1-циклоалкил и Y означает атом кислорода или серы и R означает радикал общей формулы -(CH2)m-X1-(CH2)n-Z-, в котором X1, m и n имеют указанное в любом из пп.1 или 2 значение и Z означает радикал -COOR4, в котором R4 означает линейный или разветвленный алкильный радикал с 1-3 атомами углерода, отличающийся тем, что этерифицируют продукт общей формулы (I), в которой R1, R2, R3, X, Y, X1, m и n имеют вышеуказанное значение и Z означает карбоксил.
11. Способ получения продукта по п.1, в котором R1, R2 и R3 имеют указанное в п.1 значение, Х означает атом кислорода или серы или группу -NH-, -СО-, метиленовую группу, этиленовую группу, алкилиденовую группу или 1,1-циклоалкил и Y означает атом кислорода или серы и R означает радикал общей формулы -(CH2)m-X1-(CH2)n-Z-, в которой X1, m и n имеют указанное в п.1 значение и Z означает радикал -CON(R5)(R6), в котором R5 и R6, одинаковые или разные, означают атом водорода или линейный или разветвленный алкильный радикал с 1-6 атомами углерода, и R6 означает атом водорода или линейный или разветвленный алкильный радикал с 1-6 атомами углерода, возможно замещенный аминогруппой, алкиламиногруппой, содержащей 1-4 атома углерода, диалкиламиногруппой, каждая алкильная часть которой содержит 1-4 атома углерода, алкоксилом с 1-4 атомами углерода, алкилтиогруппой с 1-4 атомами углерода, алкилоксикарбонилом, алкильная часть которого содержит 1-4 атома углерода, карбоксилом, цианогруппой; фенилом, возможно замещенным одним или несколькими, одинаковыми или разными радикалами, выбираемыми среди алкоксильных радикалов с 1-4 атомами углерода или трифторметильного радикала; нафт-1- или -2-илом, фур-2- или -3-илом, тиен-2- или -3-илом, имидазол-4- или -5-илом или тиазол-4- или -5-илом, пирид-2-, -3- или 4-илом, или инданильным или хроманильным радикалом; или же R5 означает атом водорода или линейный или разветвлённый алкильный радикал с 1-6 атомами углерода и R6 означает гидроксил, аминогруппу или алкилоксигруппу с 1-6 атомами углерода в линейной или разветвленной цепи, возможно замещенную фенильным радикалом, отличающийся тем, что продукт общей формулы HN(R5)(R6), в которой R5 и R6 имеют вышеуказанное значение, вводят во взаимодействие с продуктом общей формулы (I), в которой R1, R2, R3, X, Y, X1, m и n имеют вышеуказанное значение и Z означает карбоксил.
12. Способ получения продукта по п.1, в котором R1, R2 и R3 имеют указанное в п.1 значение, Х означает атом кислорода или серы или группу -NH-, -СО-, метиленовую группу, этиленовую группу, алкилиденовую группу или 1,1-циклоалкил, и Y означает атом кислорода или серы и R означает радикал общей формулы -NНСО-Т, в которой Т означает атом водорода или алкильный радикал с 1-6 атомами углерода, возможно замещенный аминогруппой, карбоксилом, алкилоксикарбонилом, гидроксилом, алкилоксигруппой, меркаптогруппой или алкилтиогруппой, отличающийся тем, что кислоту общей формулы Т-СО-ОН, в которой Т имеет вышеуказанное значение, вводят во взаимодействие с продуктом общей формулы (VI)
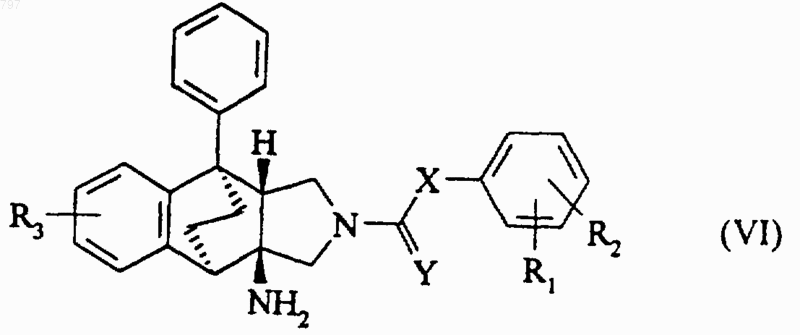
в которой R1, R2, R3, X и Y имеют вышеуказанное значение, затем, в случае необходимости, заменяют сложноэфирные функции или защищенные аминные функции, являющиеся заместителями Т, соответственно, карбоксильными радикалами или аминогруппами.
13. Способ получения продукта по п.1, в котором R означает радикал общей формулы
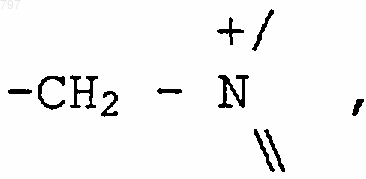
отличающийся тем, что избыток третичного амина или сильной кислоты или производного этой кислоты вводят во взаимодействие с продуктом общей формулы (VII)
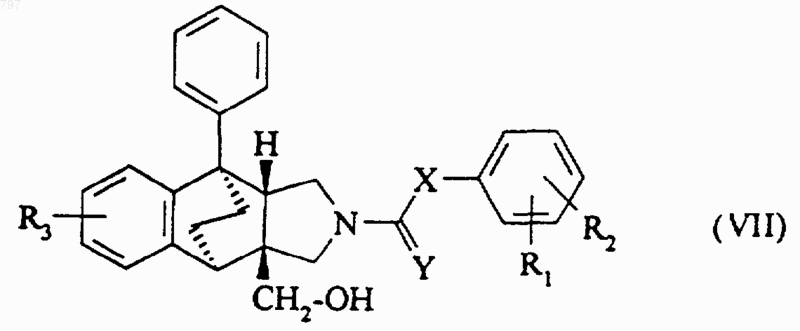
в которой R1, R2, R3, X и Y имеют указанное в п.1 значение.
14. Способ получения продукта по п.1, в котором Y означает атом серы, отличающийся тем, что осуществляют тионирование продукта по п.1, в котором Y означает атом кислорода.
15. Фармацевтическая композиция, отличающаяся тем, что она содержит, по крайней мере, один продукт по любому из пп.1, 2, 3, 4, 5 или 6 в сочетании с одним или несколькими фармацевтически приемлемыми разбавителями или добавками, являющимися инертными или биологически активными.
Текст
1 Настоящее изобретение относится к новым продуктам общей формулы (I) и их получению и содержащим их фармацевтическим композициям. В общей формуле (I)R означает радикал общей формулы-(CH2)m-X1-(CH2)n-Z, в котором X1 означает простую связь или атом кислорода или серы, m означает целое число, равное 0 или 1, и n означает целое число, равное 0, 1 или 2, причем метиленовые радикалы могут быть замещены карбоксильным радикалом, алкоксикарбонильным радикалом, алкильная часть которого содержит 14 атома углерода, карбамоильным радикалом,алкилкарбамоильным радикалом, алкильная часть которого содержит 1-4 атома углерода,диалкилкарбамоильным радикалом, каждая алкильная часть которого содержит 1-4 атома углерода, аминогруппой, алкиламиногруппой,содержащей 1-4 атома углерода, диалкиламиногруппой, каждая алкильная часть которой содержит 1-4 атома углерода, иZ означает карбоксильный радикал; радикал COOR4, в котором R4 означает линейный или разветвленный алкильный радикал, содержащий 1-3 атома углерода; или радикалCON(R5)(R6), в котором R5 означает атом водорода или линейный или разветвленный алкильный радикал с 1-6 атомами углерода и R6 означает атом водорода или линейный или разветвленный алкильный радикал с 1-6 атомами углерода, возможно замещенный аминогруппой,алкиламиногруппой с 1-4 атомами углерода,диалкиламиногруппой, каждая алкильная часть которой содержит 1-4 атома углерода, гидроксилом, алкоксилом с 1-4 атомами углерода,меркаптогруппой, алкилтиогруппой с 1-4 атомами углерода, алкилоксикарбонилом, алкильная часть которого содержит 1-4 атома углерода, карбоксилом, цианогруппой, фенилом, возможно замещенным одним или несколькими,одинаковыми или разными атомами или радикалами, выбираемыми среди атомов галогена и алкильных радикалов с 1-4 атомами углерода,алкоксильных радикалов с 1-4 атомами углерода, диалкиламиногруппы, каждая алкильная часть которой содержит 1-4 атома углерода,трифторметила или цианогруппы; нафт-1- или 2-илом, фур-2- или-3-илом, тиен-2-или -3-илом,имидазол-4- или -5-илом, тиазол-2-, -4 или -5 илом, тиазолидин-2-, -4- или -5-илом или пирид-2-, -3- или -4-илом; или инданильным или тиохроманильным радикалом; или еще R5 означает атом водорода или линейный или разветвленный алкильный радикал с 1-6 атомами углерода, и R6 означает гидроксил, аминогруппу или 2 алкилоксигруппу с 1-6 атомами углерода в линейной или разветвленной цепи, возможно замещенную фенильным радикалом; или радикалPO(OR7)2, в котором R7 означает атом водорода или линейный или разветвленный алкильный радикал с 1-6 атомами углерода; или- радикал -NH-CO-T, в котором Т означает атом водорода или линейный или разветвленный алкильный радикал с 1-6 атомами углерода,возможно замещенный аминогруппой, карбоксилом, алкилоксикарбонилом, алкильная часть которого содержит 1-4 атома углерода, гидроксилом, алкилоксигруппой с 1-4 атомами углерода, меркаптогруппой или алкилтиогруппой с 1-4 атомами углерода; или - радикал,в котором означает предпочтительно пиридиниевый радикал;R1 и R2, одинаковые или разные, означают атом водорода или галогена или алкильный радикал с 1-4 атомами углерода, алкилоксигруппу с 1-4 атомами углерода, возможно замещенную диалкиламиногруппой, каждая алкильная часть которой содержит 1-4 атома углерода или вместе с атомом азота образует насыщенный гетероцикл, содержащий 5 или 6 атомов углерода,алкилтиогруппой с 1-4 атомами углерода, алкилоксикарбонилом, алкильная часть которого содержит 1-4 атома углерода; или ещеR1 и R2, находящиеся в орто-положении друг к другу, образуют насыщенный или ненасыщенный гетероцикл, содержащий 1 или 2 гетероатома, выбираемых среди азота и кислорода, возможно замещенный атомом галогена или алкильным радикалом с 1-4 атомами углерода или алкилоксигруппой с 1-4 атомами углерода или жеR1 означает атом водорода или галогена или алкильный радикал с 1-4 атомами углерода,алкилоксигруппу с 1-4 атомами углерода, возможно замещенную диалкиламиногруппой, каждая алкильная часть которой содержит 1-4 атома углерода, алкилтиогруппой с 1-4 атомами углерода, алкилоксикарбонилом, алкильная часть которого содержит 1-4 атома углерода; иR2 означает тиоалкильный радикал с 1-4 атомами углерода, при условии, что в этом случае продукт общей формулы (I) находится в виде удвоенного с помощью дисульфидного мостика продукта;R3 означает атом водорода или галогена(йод) или алкильный радикал с 1-4 атомами углерода, алкенильный радикал с 2-4 атомами углерода, алкилоксигруппу с 1-4 атомами углерода или алкилтиогруппу с 1-4 атомами углерода,карбоксил или алкилоксикарбонил, алкильная часть которого содержит 1-4 атома углерода; 3 Х означает атом кислорода или серы или группу -NH-, -СО-, метиленовую группу, этиленовую группу, алкилиденовую группу, такую,как винилиден, или 1,1-циклоалкил с 3-6 атомами углерода; иY означает атом кислорода или серы,причем изобретение относится к продуктам общей формулы (I) как в рацемической форме, так и также в виде оптических изомеров. Согласно изобретению, новые продукты общей формулы (I), в которой R, R1, R2 и R3 имеют вышеуказанное значение, Y означает атом кислорода или серы и Х означает группу СО-, метилен, этилен, алкилиден или 1,1 циклоалкил, могут быть получены путем воздействия кислоты общей формулы (II) в которой R1, R2 и Х имеют вышеуказанное значение и Y означает атом кислорода или серы, ее метилового эфира или производного этой кислоты, такого, как галоидангидрид или ангидрид, на продукт общей формулы (III) в которой R и R3 имеют вышеуказанное значение, и G1 означает атом водорода (который может быть получен из продукта общей формулы(III), в которой G1 означает защитную группу аминной функции, такую, как бензильный, бензилоксикарбонильный или трет-бутокси карбонильный радикал, путем гидрогенолиза в присутствии катализатора, такого, как палладий-наугле, когда G1 означает бензильный или бензилоксикарбонильный радикал, или путем гидролиза в кислой среде, когда G1 означает третбутоксикарбонильный или бензилоксикарбонильный радикал) с последующим, в случае необходимости, когда R означает или содержит радикал -COOR4 или -PO(OR7)2, в которых R4 иR7 означают алкильный радикал, омылением образовавшегося продукта для получения продукта общей формулы (I), в которой R означает или содержит карбоксильный радикал, или превращением образовавшегося продукта с, помощью нуклеофильного агента для получения продукта обшей формулы (I), в которой R означает или содержит радикал -РО 3 Н 2. Обычно реакцию продукта общей формулы (II) в кислой форме с продуктом общей формулы (III) проводят в органическом растворителе, таком, как галогенированный алифатический углеводород, такой как дихлорметан, в присутствии конденсирующего агента и/или активи 000797(диметиламино)фосфонийгексафторфосфат, при температуре от 0 до 50 С. Обычно реакцию продукта общей формулы (II) в форме сложного метилового эфира с продуктом общей формулы (III) проводят в органическом растворителе, таком как диоксан или галогенированный алифатический углеводород, такой как дихлорметан, при температуре от 0 С до температуры кипения с обратным холодильником реакционной смеси. Обычно реакцию продукта общей формулы (II) в форме галоидангидрида с продуктом общей формулы (III) проводят в органическом растворителе, таком, как галогенированный алифатический углеводород, такой, как дихлорметан, в присутствии основания (как третичный алифатический амин) и при температуре от 0 до 50 С. Обычно реакцию продукта общей формулы (II) в форме ангидрида с продуктом общей формулы (III) проводят в органическом растворителе, таком как галогенированный алифатический углеводород, как дихлорметан, в присутствии основания (как третичный алифатический амин, пиридин или 4-диметиламинопиридин) и при температуре от 0 до 50 С. Обычно омыление продукта обшей формулы (I), в которой R означает или содержит сложный эфир общей формулы -COOR4, до продукта общей формулы (I), в которой R означает или содержит карбоксильный радикал,осуществляют с помощью неорганического основания, такого как гидроксид натрия или гидроксид калия или карбонат натрия, в органическом растворителе, таком как метанол или этанол. Превращение продукта общей формулы(I), в которой R означает или содержит радикал-PO(OR7)2, в продукт общей формулы (I), в которой R означает или содержит радикал-РО 3 Н 2, обычно осуществляют под действием нуклеофильного агента, такого, как триалкилсилил(триметилсилил) галогенид(иодид), или галогенида натрия или лития (иодид натрия), в присутствии триалкилгалогенсилана (триметилхлорсилан, триметилбромсилан), в полярном растворителе (тетрахлоруглерод, ацетонитрил) и при температуре от 0 до 50 С, или и путем нагревания с галогенидом щелочного металла (как иодид натрия), с последующим гидролизом. Согласно изобретению, новые продукты общей формулы (I), в которой Y означает атом кислорода или серы и Х означает атом кислорода, могут быть получены путем воздействия галогенформиата или галогентиоформиата общей формулы (IV) в которой Y означает атом кислорода или серы,R1 и R2 имеют вышеуказанное значение и Hal означает атом галогена, на продукт общей формулы (III), затем, в случае необходимости, когдаR означает или содержит радикал -COOR4 или PO(OR7)2, образовавшийся продукт, омыляют для получения продукта общей формулы (I), в которой R означает или содержит карбоксильный радикал, или образовавшийся продукт превращают с помощью нуклеофильного агента в продукт общей формулы (I), в которой R означает или содержит радикал -РО 3 Н 2. Реакцию галогенида общей формулы (IV) с продуктом обшей формулы (III) обычно проводят в органической или водно-органической среде, такой как смесь диоксана с водой, в присутствии неорганического основания (как гидроксид натрия) или органического основания(как триэтиламин) и при температуре от 0 до 50 С. Согласно изобретению, новые продукты общей формулы (I), в которой Y означает атом кислорода или серы и Х означает группу -NH-,могут быть получены путем воздействия изоцианата или изотиоцианата общей формулы (V) в которой Y означает атом кислорода или серы,R1 и R2 имеют вышеуказанное значение, на продукт общей формулы (III) с последующим, в случае необходимости, когда R означает или содержит радикал -COOR4 или -РО(ОR7)2, в которых R4 или R7 означают алкильный радикал,омылением образовавшегося продукта для получения продукта общей формулы (I), в которойR означает или содержит карбоксильный радикал, или превращением образовавшегося продукта с помощью нуклеофильного агента в продукт общей формулы (I), в которой R означает или содержит радикал -РО 3 Н 2. Реакцию продукта общей формулы (V) с продуктом общей формулы (III) обычно проводят в инертном органическом растворителе, таком, как тетрагидрофуран или толуол, в присутствии конденсирующего агента, такого, как 4 диметиламинопиридин или 4-пирролидинопиридин, при температуре от 0 до 50 С. Возможную замену радикалов -COOR4 и PO(OR7)2, соответственно, карбоксильным радикалом и радикалом -РО 3 Н 2 осуществляют в вышеописанных условиях. Согласно изобретению, новые продукты обшей формулы (I), в которой R1, R2 и R3 имеют вышеуказанное значение, Х означает атом кислорода или серы или группу -NH-, -СО-, метилен, этилен, алкилиден или 1,1-циклоалкил, и Y 6 означает атом кислорода или серы и R означает радикал обшей формулы - (CH2)m-X1-(CH2)n-Z-,в котором X1, m и n имеют вышеуказанное значение и Z означает радикал -COOR4, в которомR4 означает линейный или разветвленный алкильный радикал с 1-3 атомами углерода, могут быть получены путем этерификации продукта общей формулы (I), в которой R1, R2, R3, X, Y,X1, "m" и "n" имеют вышеуказанное значение иZ означает карбоксильный радикал. Этерификацию обычно осуществляют с помощью спирта общей формулы R4-OH, в которой R4 имеет вышеуказанное значение, в кислой среде или с помощью алкилгалогенида общей формулы R4-Hal, в которой Hal означает атом галогена (йод), в щелочной среде (карбонат щелочного металла или щелочноземельного металла, такой, как карбонат цезия),в органическом растворителе, таком, как диметилформамид, при температуре от 0 до 50 С. Согласно изобретению, новые продукты общей формулы (I), в которой R1, R2 и R3 имеют вышеуказанное значение, Х означает атом кислорода или серы или группу -NH-, -СО-, метилен, этилен, алкилиден или 1,1-циклоалкил, и Y означает атом кислорода или серы и R означает радикал общей формулы - (CH2)m-X1-(СН 2)n-Z-,в которой X1, m и n имеют вышеуказанное значение иZ означает радикал -CON(R5)(R6), в котором R5 и R6, одинаковые или разные, означают атом водорода или линейный или разветвленный алкильный радикал с 1-6 атомами углерода,и R6 означает атом водорода или линейный или разветвленный алкильный радикал с 1-6 атомами углерода, возможно замещенный аминогруппой, алкиламиногруппой с 1-4 атомами углерода, диалкиламиногруппой, каждая алкильная часть которой содержит 1-4 атома углерода,алкоксилом с 1-4 атомами углерода, алкилтиогруппой с 1-4 атомами углерода, алкилоксикарбоилом, алкильная часть которого содержит 1-4 атома углерода, карбоксилом, цианогруппой; фенилом, возможно замещенным одним или несколькими, одинаковыми или разными радикалами, выбираемыми среди алкоксильных радикалов с 1-4 атомами углерода или трифторметильного радикала, нафт-1-илом или нафт-2 илом, фур-2- или -3-илом, тиен-2- или -3 илом, имидазол-4- или -5-илом, или тиазол-4 или -5-илом, пирид-2-, -3- или -4-илом, или инданильным или хроманильным радикалом; или R5 означает атом водорода или линейный или разветвленный алкильный радикал с 1-6 атомами углерода; и R6 означает гидроксил,аминогруппу или алкилоксигруппу с 1-6 атомами углерода в линейной или разветвленной цепи, возможно замещенную фенильным радикалом,могут быть получены путем воздействия продукта общей формулы HN(R5)(R6), в которой R5 и R6 имеют вышеуказанное значение, на про 7 дукт общей формулы (I), в которой R1, R2, R3, X,Y, X1, m и n имеют вышеуказанное значение и Z означает карбоксил. Когда R5 и R6, каждый, означают атом водорода, то особенно предпочтительно проводить реакцию с аммиаком, в случае необходимости, растворенным в органическом растворителе, таком как спирт (этанол), в присутствии конденсирующего агента, такого как N,N'карбонилдиимидазол, 1,1-дициклогексилкарбодиимид, гидрохлорид 1-этил-3-[3-(диметиламино)пропил]карбодиимида, гидроксибензотриазол или бензотриазол-1-илокситрис (диметиламино) фосфонийгексафторфосфат, при температуре от 0 до 50 С. Когда R5 и R6 каждый не означают атом водорода, особенно предпочтительно проводить реакцию с амином общей формулы HN(R5)(R6) в присутствии конденсирующего агента и/или активирующего агента, таких, как 1-этил-3-[3(диметиламино)пропил]карбодиимидгидрохлорид, гидроксибензотриазол, 1,1-дициклогексилкарбодиимид или бензотриазол-1-илокситрис(диметиламино)фосфонийгексафторфосфат,в органическом растворителе, таком как галогенированный алифатический углеводород (дихлорметан), при температуре от 0 до 50 С. Когда, по крайней мере, один из символовR5 и R6 замещен аминогруппой, особенно предпочтительно ее защищать защитной группой,такой как трет-бутоксикарбонил, бензилоксикарбонил или бензил, до конденсации амина общей формулы НN(R5)(R6) с соответствующей кислотой, затем заменять защитную группу атомом водорода, например, путем гидрогенолиза с помощью водорода в присутствии катализатора, такого как палладий-на-угле, когда эта группа означает бензил или бензилоксикарбонил, или путем гидролиза в кислой среде, когда эта группа означает трет-бутоксикарбонил или бензилоксикарбонил. Когда, по крайней мере, один из символовR5 и R6 замещен карбоксилом, то особенно предпочтительно его защищать защитной группой, такой как алкильный радикал, возможно замещенный фенильным радикалом, таким как бензил, до конденсации амина общей формулыHN(R5)(R6) с соответствующей кислотой, затем заменять защитную группу атомом водорода,например, путем гидрогенолиза с помощью водорода в присутствии катализатора, такого как палладий-на-угле, или путем омыления в вышеописанных условиях. Когда в продукте общей формулы (I) R5 означает атом водорода или алкильный радикал с 1-6 атомами углерода и R6 означает алкилоксигруппу, замещенную фенилом, замена алкилоксигруппы, замещенной фенильным радикалом, на гидроксил, осуществляемая, например,путем гидрогенолиза в присутствии катализатора, такого как палладий-на-угле, позволяет получить продукт общей формулы (I), в которойR5 означает атом водорода или алкильный радикал с 1-4 атомами углерода и R6 означает гидроксил. Согласно изобретению, новые продукты общей формулы (I), в которой R1, R2 и R3 имеют вышеуказанное значение, Х означает атом кислорода или серы или группу -NH-, -СО-, метилен, этилен, алкилиден или 1,1-циклоалкил, и Y означает атом кислорода или серы и R означает радикал общей формулы -NHCO-T, в которой Т означает атом водорода или алкил с 1-6 атомами углерода, возможно замещенный аминогруппой,карбоксилом, алкилоксикарбонилом, гидроксилом, алкилоксигруппой, меркаптогруппой или алкилтиогруппой, могут быть получены путем воздействия кислоты общей формулы Т-СООН,в которой Т имеет вышеуказанное значение, на продукт общей формулы (VI) в которой R1, R2, R3, X и Y имеют вышеуказанное значение, в случае необходимости, с последующей заменой сложноэфирных функций или защищенных аминных функций, являющихся заместителями Т, соответственно, карбоксильными радикалами или аминогруппами в вышеописанных условиях. Реакцию кислоты общей формулы ТСООН в кислотной форме с продуктом общей формулы (VI) обычно проводят в органическом растворителе, таком, как галогенированный алифатический углеводород, такой как дихлорметан, в присутствии конденсирующего и/или активирующего агента, таких как 1-этил-3-[3(диметиламино)пропил]карбодиимидгидрохлорид, гидроксибензотриазол, 1,1-дициклогексилкарбодиимид или бензотриазол-1-окситрис(диметиламино)фосфонийгексафторфосфат,при температуре от 0 до 50 С. Реакцию кислоты общей формулы Т-СООН в форме галоидангидрида с продуктом общей формулы (VI) обычно проводят в органическом растворителе, таком как галогенированный алифатический углеводород, такой как дихлорметан, в присутствии основания (как третичный алифатический амин) и при температуре от 0 до 50 С. Реакцию кислоты обшей формулы Т-СООН в форме ангидрида с продуктом общей формулы (VI) обычно проводят в органическом растворителе, таком как галогенированный алифатический углеводород, такой как дихлорметан, в присутствии основания (как третичный алифатический амин, пиридин или 4 диметиламинопиридин) и при температуре от 0 до 50 С. 9 Когда Т замещен аминогруппой, е предпочитают защитить защитной группой, такой,как бензилоксикарбонил или трет.-бутоксикарбонил, до конденсации кислоты общей формулы Т-СООН с соответствующим амином, затем защитную группу заменяют атомом водорода, например, путем гидрогенолиза с помощью водорода в присутствии катализатора, такого как палладий-на-угле, или путем гидролиза в кислой среде. Когда Т замещен карбоксилом, его предпочитают защищать защитной группой, такой,как метил, этил или бензил, до конденсации кислоты общей формулы Т-СООН с соответствующим амином, затем заменяют защитную группу атомом водорода, например, путем гидрогенолиза с помощью водорода в присутствии катализатора, такого как палладий-на-угле, или путем омыления в вышеописанных условиях. Согласно изобретению, новые продукты общей формулы (I), в которой R означает радикал формулы,могут быть получены путем воздействия избытка третичного амина и сильной кислоты или производного этой кислоты на продукт общей формулы (VII) в которой R1, R2, R3, Х и Y имеют вышеуказанное значение. Третичным амином предпочтительно является пиридин, а сильной кислотой предпочтительно является трифторметансульфокислота, в случае необходимости в форме ангидрида. Согласно изобретению, новые продукты общей формулы (I), в которой Y означает атом серы, могут быть получены путем тионирования продукта общей формулы (I), в которой Y означает атом кислорода. Тионирование (введение тиокетогруппы) обычно осуществляют в стандартных условиях с помощью пентасульфида фосфора в органическом растворителе, таком как тетрагидрофуран,при температуре от 0 до 50 С. Согласно изобретению, продукты общей формулы (I), в которой один из символов R1 илиR2 означает алкоксикарбонил, могут быть получены путем ацилирования продукта общей формулы (I), в которой один из символов R1 или R2 означает гидроксил, с помощью алифатической кислоты или производного этой кислоты, такого как галоидангидрид или ангидрид, в стандартных условиях этерификации с образованием сложного эфира. 10 Продукты общей формулы (III), в которойR означает карбоксил или радикал общей формулы -COOR4, могут быть получены путем воздействия трифторметансульфокислоты на продукт общей формулы (VIII): в которой R3 имеет вышеуказанное значение, G1 означает бензил, R4 означает алкил с 1-3 атомами углерода, в случае необходимости, с последующим омылением полученного продукта и, в случае необходимости, в зависимости от случая,с последующей заменой бензила атомом водорода путем гидрогенолиза в вышеописанных условиях, затем, в случае необходимости, в зависимости от случая, с заменой атома водорода трет.-бутоксикарбонилом за счет воздействия ангидрида трет.-бутоксиугольной кислоты в органическом растворителе или бензилоксикарбонилом путем воздействия бензилоксикарбонилхлорида в органическом растворителе. Продукт общей формулы (VIII) может быть получен путем воздействияNтриалкилсилилметил-N-алкоксиметиламина,содержащего защитную группу аминной функции, такую как бензил, такого как Nтриметилсилилметил-N-H-бутоксиметилбензиламин, который может быть получен в условиях,описанных в Chem. Pharm. Bull., 276 (1985), на производное циклогексадиена общей формулы в которой R3 и R4 имеют вышеуказанное значение. Реакцию обычно проводят в органическом растворителе, таком, как галогенированный алифатический углеводород, как дихлорметан, в присутствии сильной кислоты, такой как трифторметансульфокислота, при температуре от 0 до 50 С. Продукты общей формулы (III), в которой-CON(R5)(R6), могут быть получены из продукта 11 общей формулы (VIII), в которой R означает карбоксил, путем этерификации и амидирования в вышеописанных условиях. Продукт общей формулы (IX) может быть получен путем реакции Дильса-Альдера между 1,4-дифенилбутадиеном, один из фенильных радикалов которого, в случае необходимости,замещен радикалом R3, таким как указанный выше, и пропиоловой кислотой путем нагревания, в случае необходимости, в присутствии гидрохинона, с последующей этерификацией полученного продукта. Продукты общей формулы (III), в которойm равно 1, X1 означает связь, n равно нулю и Z означает радикал -COOR4, -CON(R5)(R6) или РО(OR7)2, могут быть получены из продукта общей формулы (X) в которой R3 имеет вышеуказанное значение иG1 означает защитную группу аминной функции(бензил,бензилоксикарбонил или третбутоксикарбонил) и G2 означает удаляемую группу,такую как трифторметилсульфонилоксигруппа. Более конкретно, для получения продукта общей формулы (III), в которой Z означает карбоксил, радикал -COOR4, в котором R4 означает алкил, или радикал -CON(R4)(R5), особенно предпочтительно проходить через стадию получения соответствующего нитрила, который может быть получен путем воздействия цианида щелочного металла на продукт общей формулы(X) в полярном органическом растворителе, таком, как диметилсульфоксид, при температуре от 0 до 50 С, который затем гидролизуют до соответствующей кислоты, которую, в свою очередь, затем можно этерифировать или амидировать в стандартных условиях. Более конкретно, для получения продукта общей формулы (III), в которой Z означает радикал -PO(OR7)R2, особенно предпочтительно триалкилфосфит вводить во взаимодействие с продуктом общей формулы (X), затем, в случае необходимости, полученный фосфонат превратить в соответствующую фосфоновую кислоту. Продукты общей формулы (III), в которойR означает радикал - (CH2)m-X1-(CH2)n-Z-, в котором m равно 1, X1 означает атом кислорода или серы, n равно 1 или 2, G1 означает защитную группу аминной функции и Z означает карбоксил, радикал -COOR4, в котором R4 означает алкил, или радикал -CON(R5)(R6), могут быть получены путем воздействия сложного эфира или амида общей формулы (XI) Н - X1-(СН 2)nZ 12 в которой X1, n и Z имеют вышеуказанное значение, на продукт общей формулы (X), в безводном органическом растворителе, таком как диоксан, в присутствии гидрида щелочного металла, такого как гидрид натрия, в случае необходимости с последующим, в зависимости от случая, омылением продукта общей формулы(III), полученного таким образом. Продукты общей формулы (III), в которойm равно 1, X1 означает связь, n равно 1, причем метиленовая группа может быть замещена карбоксилом или алкоксикарбонилом или карбамоилом или алкилкарбамоилом или диалкилкарбамоилом, G1 означает защитную группу аминной функции и Z означает карбоксил, радикал -COOR4, в котором R4 означает алкил,или радикал -CON(R5)(R6), могут быть получены путем воздействия предварительно превращенной в анион малоновой кислоты или производного малоновой кислоты, предпочтительно диэфира, на продукт общей формулы (X) в безводном органическом растворителе, таком как диоксан, в присутствии гидрида щелочного металла, такого как гидрид натрия, при температуре от 0 С до температуры кипения с обратным холодильником реакционной смеси, с последующим, в зависимости от случая, омылением,этерификацией с образованием сложного эфира,амидированием или декарбоксилированием таким образом полученного продукта общей формулы (III). Продукты общей формулы (III), в которойR означает радикал -NH-CO-T, в котором Т имеет вышеуказанное значение, могут быть получены путем амидирования продукта общей формулы (III), в которой R3 имеет вышеуказанное значение, G1 означает защитную группу аминной функции и R означает аминогруппу, с помощью кислоты общей формулы Т-СООН, в которой Т имеет вышеуказанное значение, в вышеописанных условиях для амидирования продукта общей формулы (VI). Продукты общей формулы (III), в которойR означает аминогруппу, или продукты общей формулы (VI) могут быть получены способами,которые позволяют превращать карбоксил в аминогруппу, не затрагивая остальной части молекулы. Карбоксильную группу продукта общей формулы (III) или (I) обычно превращают в аминогруппу, проходя через стадию получения изоцианата, который может быть получен путем пиролиза азида кислоты, который сам может быть получен путем воздействия азида щелочного металла на галоидангидрид соответствующей кислоты. Продукты общей формулы (III), в которойR означает радикал общей формулы 13 могут быть получены путем воздействия избытка третичного амина и сильной кислоты или производного этой кислоты на продукт общей формулы (XII) в которой R3 имеет вышеуказанное значение иG1 означает защитную группу аминной функции. Продукты общей формулы (VII) или общей формулы (XII) могут быть получены соответственно путем восстановления продукта общей формулы (I) или продукта общей формулы(III), в которой R означает радикал общей формулы -COOR4, в которой R4 означает предпочтительно алкил с 1-3 атомами углерода. Реакцию обычно проводят с помощью литийалюминийгидрида в органическом растворителе, таком как простой эфир, например тетрагидрофуран, при температуре от 0 до 50 С. Продукты общей формулы (III), в которойR3 означает атом йода и G1 означает защитную группу аминной функции, могут быть получены путем иодирования продукта общей формулы(III), в которой R3 означает атом водорода и G1 означает защитную группу аминной функции. Иодирование обычно можно осуществлять либо с помощью йода в присутствии бис(трифторацетокси)иодбензола в органическом растворителе, таком как галогенированный алифатический углеводород, как дихлорметан,при температуре от 0 до 50 С, либо путем воздействия йода в присутствии содержащего четырехвалентный церий нитрата аммония в уксусной кислоте или метаноле, либо еще путем воздействия йода в присутствии трифторацетата серебра, либо путем воздействия N-иодсукцинимида в присутствии гидрокситозилоксииодбензола (реактив Koser) в метаноле, либо же путем воздействия бензилтриметиламмонийдихлориодида в присутствии хлорида цинка в уксусной кислоте. Продукты общей формулы (III), в которойR3 означает алкил, алкенил, алкилоксигруппу,адкилтиогруппу, карбоксил или алкилоксикарбонил, могут быть получены известными способами, которые позволяют заменять атом йода алкилом, алкенилом, алкилоксигруппой, алкилтиогруппой, карбоксилом или алкилоксикарбонилом. Продукты общей формулы (III), в которойR3 означает алкил, могут быть получены путем воздействия алкильного производного щелочного металла на продукт обшей формулы (III), в которой R3 означает атом йода, в инертном органическом растворителе, таком как простой эфир. 14 Продукты общей формулы (III), в которойR3 означает алкенил, могу быть получены путем воздействия бороновой кислоты общей формулы R3-В(ОН)2 или станнана общей формулы R3Sn(R')3, в котором R' означает алкил с 1-4 атомами углерода, в присутствии катализатора,такого, как палладий в сочетании с трифенилфосфиновым лигандом, в ароматическом растворителе (как бензол, толуол, ксилол), при температуре от 0 до 100 С, на продукт общей формулы (III), в которой R3 означает атом йода. Продукты общей формулы (III), в которойR3 означает алкилоксигруппу или алкилтиогруппу, могут быть получены путем воздействия алкоголята или сульфената щелочного металла на продукт общей формулы (III), в которой R3 означает атом йода. Продукты общей формулы (III), в которойR3 означает карбоксил, могут быть получены путем окисления, например, с помощью пербората натрия, продукта общей формулы (III), в которой R3 означает формил, который, в свою очередь, может быть получен путем озонолиза продукта общей формулы (III), в которой R3 означает алкенил. Продукты общей формулы (III), в которойR3 означает алкилоксикарбонил, могут быть получены путем этерификации продукта общей формулы (III), в которой R3 означает карбоксил. Изомеры продуктов общей формулы (I) могут быть получены обычными способами расщепления соответствующего рацемического продукта. Особенно предпочтительно осуществлять расщепление путем высокоэффективной жидкостной хроматографии, используя модифицированную хиральную стационарную фазу типа Pirkle и элюируя соответствующим растворителем. В качестве стационарной хиральной фазы предпочтительно можно использовать фазу, в случае которой хиральный селектор, которым является предпочтительно 3,5-диаминофенилаланин, удален от диоксида кремния за счет аминоалкильного плеча с 3-14 атомами углерода, фиксированного на функциональных аминогруппах аминопропилированного диоксида кремния, и свободные силанольные функции которого блокированы триалкилсилильными радикалами. Эта хиральная фаза может отвечать следующей структуре в которой символы R', одинаковые или разные,и R", одинаковые или разные, означают алкильные радикалы с 1-10 атомами углерода, G3 означает электроноакцепторную группу, и n означа 15 ет целое число от 3 до 13 включительно, причем пористость этой фазы близка к 100 . Хиральную фазу можно получать путем воздействия на аминопропилированный диоксид кремния ангидридом аминоалкановой кислоты с 4-14 атомами углерода, аминогруппа которой защищена защитной группой, такой как трет-бутоксикарбонил, с последующим блокированием части силанольных функций с помощью радикалов Si(R')3, указанных выше, затем,после удаления защитных групп аминофункции,аминированием с помощью аминокислоты общей формулы в которой G3 имеет вышеуказанное значение, и,наконец, блокированием остаточных силанольных функций с помощью вышеуказанных радикалов Si-(R")3. Ангидридом защищенной аминоалкановой кислоты обычно воздействуют на аминопропилированный диоксид кремния в безводном органическом растворителе, таком как диметилформамид, при температуре около 20 С. Блокирование силанольных функций группами - Si(R')3, указанными выше, осуществляют путем воздействия галогентриалкилсилана на аминопропилированный диоксид кремния, к которому привиты аминоалканоильные остатки,в органическом растворителе, таком, как дихлорметан, в присутствии основного агента,такого, как пиридин. 3 ащитные группы аминоалканоильных остатков обычно удаляют, когда защитной группой является трет-бутоксикарбонил, путем воздействия трифторуксусной кислоты в органическом растворителе, таком, как дихлорметан. Аминирование с помощью фенилаланина,аминогруппа которого защищена, осуществляют в присутствии конденсирующего агента, такого,как N-этоксикарбонил-2-этокси-1,2-дигидрохинолин, в безводном органическом растворителе,таком как диметилформамид. Блокирование остаточных силанольных функций с помощью радикалов -Si(R")3, указанных выше, обычно осуществляют с помощью триалкилсилилимидазола в органическом растворителе, таком, как дихлорметан. Аминопропилированный диоксид кремния может быть получен путем воздействия аминопропилтриэтоксисилана на диоксид кремния,пористость которого близка к 100 , в присутствии имидазола в безводном органическом растворителе, таком как ароматический углеводород, как например толуол. Нижеследующие примеры иллюстрируют настоящее изобретение. Пример 1. 450 г (2,2 моль) (Е,Е)-1,4 дифенилбутадиена, 210 г (3 моль) пропиоловой 16 кислоты и 12,1 г (0,11 моль) гидрохинона в 2,5 л ксилола кипятят с обратным холодильником в течение 24-х ч в атмосфере азота. Выделившиеся после охлаждения кристаллы отсасывают,промывают ксилолом, затем петролейным эфиром и сушат при пониженном давлении. Таким образом получают 454 г (76%) цис-3,6-дифенил 1,4-циклогексадиенкарбоновой кислоты в виде светло-бежевого порошка, характеристики которой следующие: т. пл. = 179 С. 1H-ЯМР-спектр (250 мГц, (СD3)2SO-d6,в м.д.): 4,40 (м, 2 Н, СНАr); 5,78 и 6,92 (2 дм, J=9 Гц, 1 Н каждый: СН=СН); 7,02 (м, 1 Н СН=); 7,15-7,50 (м, 10 Н: Н ароматические двух фенилов); 12,35 (массив, 1 Н:СООН). 200 г (0,73 моль) энантиомера цис-3,6 дифенил-1,4-циклогексадиенкарбоновой кислоты в 1,5 л метанола и в присутствии 7,15 г (0,073 моль) 96%-ной серной кислоты кипятят с обратным холодильником в течение 24-х ч. После охлаждения метанол удаляют при пониженном давлении. Остаток обрабатывают с помощью 2 л дихлорметана, полученный раствор промывают 750 см 3 водного насыщенного раствора гидрокарбоната натрия, затем водой до нейтральной реакции. Органическую фазу сушат над сульфатом магния, затем перемешивают в течение 30 мин с 2 кг силикагеля (70-230 меш). После отфильтровывания диоксида кремния и концентрирования при пониженном давлении получают 185 г (88%) метилового эфира цис-3,6 дифенил-1,4-циклогексадиенкарбоновой кислоты в виде желто-оранжевого масла, характеристики которого следующие: масс-спектр (десорбционно-химическая ионизация, NН 3): м/е=291 (МН+). 116,2 г (0,4 моль) метилового эфира цис 3,6-дифенил-1,4-циклогексадиенкарбоновой кислоты и 9,12 г (0,08 моль) трифторуксусной кислоты в 600 см 3 дихлорметана нагревают до температуры кипения с обратным холодильником. 3 атем, при кипячении с обратным холодильником, примерно в течение 2 ч прикапывают 335,4 г (1,2 моль) N-триметилсилилметил-Nн-бутоксиметилбензиламина, который может быть получен согласно Chem. Pharm. Bull., 276(1985). Перемешивание продолжают в течение ночи при установлении температуры около 20 С. Реакционную смесь смешивают с водным 2 н раствором соляной кислоты до достижения значения рН водной фазы, равного 1. Органическую фазу сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаточное масло коричневого цвета обрабатывают с помощью 400 см 3 толуола. После выдерживания в течение 48 ч, выделившиеся кристаллы отсасывают. Получают 123 г (67%) гидрохлорида метилового эфира 2-бензил-4,7-дифенил-2,3,3 а,4,7,7 а-гексагидро-1 Н-изоиндол-3 а-карбоновой кислоты в виде светло-бежевого порошка,характеристики которого следующие: т. пл.= 208-212 С.H-ЯМР-спектр (250 мГц, СDСl3,в м.д.): 2,55-2,80 (м, 3 Н: СН 2 в положении 1 и Н в положении 7 а); 2,87 и 3,20 (2 д, J=10 Гц, 1 Н каждый: СН 2 в положении 3); 3,30 (м, 1 Н, Н в положении 7); 3,38 (с, 3 Н:СООСН 3); 3,60 (м, 1 Н: Н в положении 4); 3,68 (с, 2 Н: NCH2Ar); 6,08 (АВ ограниченный, 2 Н: СН=СН); 7,20-7,45 (м, 15 Н: Н ароматические двух фенилов в положениях 4 и 7 и Н ароматические бензила в положении 2). К охлажденному до температуры 0-5 С раствору 92 г (0,22 моль) метилового эфира 2 бензил-4,7-дифенил-2,3,3 а,4,7,7 а-гексагидро 1 Н-изоиндол-3 а-карбоновой кислоты в 1,4 л безводного дихлорметана примерно за 2 ч прикапывают 200 см трифтормегансульфокислоты,поддерживая температуру ниже 5 С. По окончании добавления, температуру реакционной смеси оставляют повышаться до примерно 20 С,затем реакционную смесь перемешивают в течение 20 ч. После охлаждения до 0 С смесь гидролизуют с помощью 130 см 3 воды, затем 460 см 3 4 н раствора гидроксида натрия. После декантации водную фазу экстрагируют дихлорметаном, затем объединенные органические фазы промывают водой до нейтральной реакции. Остаток оранжевого цвета, получаемый путем удаления дихлорметана, кристаллизуют путем перемешивания в 800 см 3 пентана. После отфильтровывания кристаллы очищают путем высокоэффективной жидкостной хроматографии на 2 кг силикагеля (15-40 мМ), элюируя смесью циклогексана с этилацетатом (98:2 по объему). Таким образом получают 44 г (47%) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-2-бензил-4,9 этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]-изоиндол-3 а-карбоновой кислоты в виде светло-бежевого порошка, характеристики которого следующие: т. пл. = 125 С; 1(уш.д., J = 7,5 Гц, 1 Н: Н в положении 8); 6,957,15 (м, 3 Н: Н в положении 5, Н в положении 6 и Н в положении 7); 7,20-7,50 (м, 10 Н: Н ароматические фенила в положении 9 и Н ароматические бензила положении 2). 15 г (35 ммоль) метилового эфира (3aRS,4SR, 9SR, 9aRS)-2-бензил-4,9-этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]-изоиндол-3 акарбоновой кислоты в виде раствора в 360 см 3 метанола восстанавливают с помощью 6,62 г формиата аммония в присутствии 5,1 г 5%-ного палладия-на-угле (по массе) при кипячении с обратным холодильником в течение 3 ч. После охлаждения катализатор отфильтровывают и 18 метанол удаляют при пониженном давлении. При перемешивании в 200 см 3 пентана полученное масло кристаллизуется. Путем отфильтровывания получают 11,3 г (97%) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-9 фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты в виде кристаллов белого цвета, характеристики которого следующие: т. пл.=129-130 С. 1(м, 2 Н: Н в положении 5 и Н в положении 6); 7,30-7,60 (м, 6 Н: Н ароматические фенила в положении 9 и NH). 2 г (6 ммоль) метилового эфира (3aRS,4SR, 9SR, 9aRS)-4,9-этано-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты и 1 г (6 ммоль) 2-метоксифенилуксусной кислоты, растворенные в 50 см 3 дихлорметана, конденсируют путем перемешивания в присутствии 1,27 г (6,6 ммоль) дигидрохлорида 1-этил-3-[3-(диметиламино)пропил] карбодиимида и 0,16 г (1,2 ммоль) гидроксибензотриазола в течение 18 ч в атмосфере азота. После промывки путем декантации два раза с помощью 40 см 3 воды, органическую фазу сушат над сульфатом натрия, затем дихлорметан выпаривают при пониженном давлении. Остаток очищают путем флеш-хроматографии на силикагеле (70-230 меш), элюируя смесью циклогексана с этилацетатом (70:30 по объему). Таким образом получают 2,18 г (75%) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в виде светло-бежевого порошка, характеристики которого следующие: т. пл.=152153 С. 1CH2 в положении 1, COCH2Ar, 1H от CH2 в положении 3 и Н в положении 9 а); 3,48 (м, 1H: Н в положении 4); 3,55 (с, 3 Н, СООСН 3); 3,70 (массив, 3 Н: ОСН 3); 4,18 (д, J = 12,5 Гц; 1H: другой Н от CH2 в положении 3); 6,43 (уш.д., J = 7,5 Гц,1H: Н в положении 8); 6,90 (уш.т, J = 7,5 Гц, 1H: Н ароматический в пара-положении к ОСН 3); 6,96 (уш.д, J = 7,5 Гц, 1H: Н ароматический в орто-положении к ОСН 3); 7,06 (д, J = 7,5 и 2 Гц,1H: Н в положении 7); 7,10-7,25 (м, 4 Н: Н в положении 5, Н в положении 6 и Н ароматические в мета-положении к ОСН 3); 7,39 (м, 3 Н: Н аро 19 матические в орто- и пара-положении к фенилу в положении 9); 7,50 (т, J = 7,5 Гц, 2 Н: Н ароматические в мета-положении к фенилу в положении 9). Пример 2. 2,1 г (4,35 ммоль) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(2 метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в 27 см 3 метанола и 45 см 3 1 н. раствора гидроксида натрия в течение 18 ч кипятят с обратным холодильником. После охлаждения выпавшие кристаллы отсасывают, затем обрабатывают с помощью 200 см 3 1 н. соляной кислоты и экстрагируют 2 раза по 100 см 3 этилацетатом. После удаления растворителя при пониженном давлении полученное твердое вещество очищают путем перекристаллизации из 50 см 3 диизопропилового эфира. Таким образом получают 1,36 г (67%) (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в виде кристаллов белого цвета, характеристики которой, следующие: т.пл. = 242244 С. 1(1,2 ммоль) N,N'-карбонилдиимидазола растворяют в 20 см 3 безводного дихлорметана. 3 атем добавляют 10 см 0,5 н раствора аммиака в этаноле, после чего перемешивают в течение 16 ч при температуре около 20 С. После разбавления с помощью 50 см 3 дихлорметана реакционную смесь промывают последовательно путем декантации с помощью 50 см 3 4 н. раствора соляной кислоты, затем 2 раза по 25 см 3 насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток перекристаллизуют из 13 см 3 этилацетата. Таким образом получают 350 мг (75%) (3aRS, 4SR, 9SR, 9aRS)-4,9-этано 2-(2-метоксифенил)ацетил-9-фенил-2, 3, 3 а, 4, 9, 000797 20 9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоксамида в виде кристаллов белого цвета, характеристики которого следующие: т.пл.=262264 С. 1(0,1 ммоль) гидроксибензотриазола, растворенных в 30 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и перекристаллизации полученного сырого продукта из 10 см 3 смеси циклогексана с этилацетатом (40:60 по объему), получают 530 мг (92%)(1,28 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 14 мг (0,1 ммоль) гидроксибензотриазола, растворенных в 30 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и перекристаллизации полученного сырого продукта из 10 см 3 смеси циклогексана с этилацетатом (50:50 по объему), получают 525 мг (95%) (3aRS, 4SR,9SR, 9aRS)-N-(2-метиламиноэтил)-4,9-этано-2(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1H-бензо[f]изoиндoл-3a-кapбoкcaмидa в виде светло-желтых кристаллов, характеристики которого следующие: т. пл.=107 С, масс 21 спектр (десорбционно-химическая ионизация,NН 3): м/е= 524 (MH+). Пример 6. Из 500 мг (1,07 ммоль) (3aRS,4SR, 9SR, 9aRS)-4,9-этано-2-(2-метоксифенил) ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты, 735 мг (1,5 ммоль) п-толуолсульфоната дибензилового эфира аспарагиновой кислоты, 290 мг (1,5 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида, 14 мг (0,1 ммоль) гидроксибензотриазола и 152 мг (1,5 ммоль) триэтиламина, растворенных в 30 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С, затем хроматографии полученного сырого продукта на силикагеле(70-230 меш), элюируя смесью циклогексана с этилацетатом (70:30 по объему), получают 490 мг (67%) дибензилового эфира (3aRS, 4SR, 9SR,9aRS)-N-[4,9-этано-2-(2-метоксифенил)ацетил 9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f] изоиндолил-3 а-карбонил]аспарагиновой кислоты в виде порошка белого цвета с т. пл. 118 С. 470 мг (0,63 ммоль) дибензилового эфира(3aRS, 4SR, 9SR, 9aRS)-N-[4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-ил-3 а-карбонил] аспарагиновой кислоты, растворенные в 15 см 3 этанола, восстанавливают путем воздействия водорода при атмосферном давлении и в присутствии 50 мг 20%-ного по массе гидроксида палладия-на-угле в течение 5 ч. После отфильтровывания катализатора и удаления этанола при пониженном давлении, остаток перекристаллизуют из толуола. Таким образом получают 310 мг (83%) (3aRS, 4SR, 9SR, 9aRS)-N-[4,9-этано-2(2-метоксифенил)ацетил-9-фенил -2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндолил-3 а-карбонил)аспарагиновой кислоты в виде кристаллов белого цвета, характеристики которого следующие: т. пл. = 194 С, масс-спектр (электронный удар): м/е = 582 (М+). Пример 7. Из 500 мг (1,07 ммоль) (3aRS,4SR, 9SR, 9aRS)-4,9-этано-2-(2-метоксифенил) ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты, 750 мг (1,5 ммоль) п-толуолсульфоната дибензилового эфира глутаминовой кислоты, 290 мг (1,5 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида, 14 мг (0,1 ммоль) гидроксибензотриазола и 152 мг (1,5 ммоль) триэтиламина, растворенных в 30 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С, затем хроматографии полученного сырого остатка на силикагеле (70230 меш), элюируя смесью циклогексана с этилацетатом (80:20 по объему), получают 750 мг(96%) дибензилового эфира (3aRS, 4SR, 9SR,9aRS)-N-[4,9-этано-2-(2-метоксифенил)ацетил 9-фенил-2,3,3 а,4,9,9 а-гексагидро-1H-бензо[f] изоиндолил-3 а-карбонил]глутаминовой кислоты в виде масла, которое отверждается около 30 С. 22 Из 730 мг (0,96 ммоль) дибензилового эфира (3aRS, 4SR, 9SR, 9aRS)-N-[4,9-этано-2-(2 метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндолил-3 а-карбонил] глутаминовой кислоты, в присутствии 100 мг 20%-ного (по массе) гидроксида палладияна-угле, после перекристаллизации из смеси метанола с пентаном (50:50 по объему), получают 200 мг (35%) (3aRS, 4SR, 9SR, 9aRS)-N[4,9-этано-2-(2-метоксифенил)ацетил-9-фенил 2,3,3 а,4,9,9 а гексагидро-1 Н-бензо[f]изоиндолил 3 а-карбонил]глутаминовой кислоты в виде кристаллов белого цвета, характеристики которой следующие: т. пл. - 168 С, масс-спектр (электронный удар): м/е = 596 (М+). Пример 8. Из 570 мг (1,2 ммоль) (3aRS,4SR, 9SR, 9aRS)-4,9-этано-2-(2-метоксифенил) ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1Hбензо[f]изоиндол-3 а-карбоновой кислоты, 370 мг (1,54 ммоль) дигидрохлорида метилового эфира гистидина, 300 мг (1,54 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида, 18 мг (0,12 ммоль) дигидроксибензотриазола и 280 мг (2,8 ммоль) триэтиламина, растворнных в 70 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и хроматографии полученного сырого продукта на силикагеле (70-230 меш), элюируя смесью дихлорметана с метанолом и уксусной кислотой (96:2:2 по объему), получают 660 мг(89%) метилового эфира (3aRS, 4SR, 9SR,9aRS)-N-[4,9-этано-2-(2-метоксифенил)ацетил 9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f] изоиндолил-3 а-карбонил]гистидина в виде порошка белого цвета, характеристики которого следующие: т. пл. = 200-204 С, масс-спектр (десорбционно-химическая ионизация,NН 3): м/е= 619 (МН+). Из 640 мг (1,06 ммоль) метилового эфира(3aRS, 4SR, 9SR, 9aRS)-N-[4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндолил-3 а-карбонил]гистидина в 1,3 см 3 1 н. раствора гидроксида натрия и 30 см этанола, после кипячения с обратным холодильником в течение 18 ч и двух перекристаллизаций полученного сырого продукта из водного 0,25 н. раствора соляной кислоты, получают 200 мг (29%) гидрохлорида (3aRS, 4SR,9SR,9aRS)-N-[4,9-этано-2-(2-метоксифенил) ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндолил-3 а-карбонил]гистидина в виде кристаллов белого цвета, характеристики которого следующие: т. пл. = 245 С, массспектр (электронный удар): м/е= 604 (М+). Пример 9. Из 200 мг (0,42 моль) правовращающего энантиомера (3aRS, 4SR, 9SR,9aRS)-4,9-этано-2-[(2-метоксифенил)-2-метиленил-ацетил]-9-фенил-2,3,3 а,4,9,9 а-гексагидро 1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты, 60 мг (0,5 ммоль) 1(R)-фенилэтиламина, 96 мг (0,5 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 6 мг (0,045 23 ммоль) гидроксибензотриазола в виде раствора в 10 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и препаративной хроматографии полученного сырого продукта на пластине из диоксида кремния,элюируя смесью циклогексана с этилацетатом(50:50 по объему), получают 170 мг (71%) правовращающего энантиомера (3aRS, 4SR, 9SR,9aRS)-N-[1(R)-фенилэтил)]-[4,9-этано-2-(2 метоксифенил)-2-метиленилацетил]-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоксамида в виде порошка белого цвета,характеристики которого следующие: т. пл. = 235 С, масс-спектр (электронный удар): м/е = 582 (М+). Пример 10. К раствору 300 мг (0,64 ммоль)(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро 1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в 5 см 3 диметилформамида добавляют 470 мг карбоната цезия. После перемешивания в течение 30 мин при температуре около 20 С добавляют раствор 820 мг (5 ммоль) этилиодида в 2,5 см 3 диметилформамида, затем перемешивают в течение 18 ч при температуре около 20 С. После разбавления с помощью 100 см 3 воды, экстрагируют два раза по 50 см 3 этилацетатом. После удаления растворителя при пониженном давлении, полученный остаток очищают путем флешхроматографии на силикагеле (70-230 меш),элюируя смесью циклогексана с этилацетатом(70:30 по объему). Таким образом получают 170 мг (54%) этилового эфира (3aRS, 4SR, 9SR,9aRS)-4,9-этано-2-(2-метоксифенил)ацетил-9 фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в виде порошка белого цвета, характеристики которого следующие: т. пл. = 196-197 С, масс-спектр (электронный удар): м/е =495 (М+). Пример 11. К раствору 3,43 г (7,4 ммоль)(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро 1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в 20 см 3 ацетона и 6 см 3 воды, охлажденному до температуры 0-2 С и поддерживаемому в атмосфере азота, последовательно добавляют 0,9 г(8,9 ммоль) триэтиламина и 1,085 г (10 ммоль) этилхлорформиата в виде раствора в 40 см 3 ацетона. После перемешивания в течение 30 мин при температуре 0-5 С, прикапывают раствор 0,77 г (7,4 ммоль) азида натрия в 15 см 3 воды,после чего продолжают перемешивание при температуре 0-5 С в течение 1 ч. Реакционную смесь затем выливают в 200 см 3 воды и ацилазид экстрагируют 5 раз по 40 см 3 диэтилового эфира. Объединенные органические фазы промывают водой, затем сушат над сульфатом магния. После выпаривания эфира при пониженном давлении, добавляют 50 см 3 толуола. После этого нагревают постепенно до 85-90 С, затем в течение 1 ч, после окончания газовыделения,кипятят с обратным холодильником. Выделив 000797 24 шиеся после охлаждения кристаллы отсасывают, затем промывают петролейным эфиром. Таким образом получают 2,98 г (88%) (3aRS,4SR, 9SR, 9aRS)-4,9-этано-3 а-изоцианат-2-(2 метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро 1 Н-бензо[f]изоиндола в виде порошка белого цвета, характеристики которого следующие: т. пл. = 185 С, масс-спектр (электронный удар): м/е = 464 (М+). 2,95 г (6,5 ммоль) (3aRS, 4SR, 9SR, 9aRS)4,9-этано-3 а-изоцианат-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндола вместе с 760 мг (7 ммоль) бензилового спирта и 123 мг (0,65 ммоль) птолуолсульфокислоты в 100 см 3 толуола в течение 12 ч нагревают при 60 С. Таким образом получают 3,63 г (100%) (3aRS, 4SR,9SR, 9aRS)-3 а-бензилоксикарбонил-амино-4,9 этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндола в виде порошка белого цвета, характеристики которого следующие: т. пл. = 114 С, масс-спектр (десорбционно-химическая ионизация, NН 3): 573(1:2 по объему), восстанавливают путем воздействия водорода при атмосферном давлении в присутствии 0,3 г 5%-ного (по массе) палладияна-угле в течение 5 ч. После отфильтровывания катализатора и удаления растворителя при пониженном давлении остаток очищают путем флеш-хроматографии на силикагеле (70-230 меш), элюируя смесью дихлорметана с этанолом (9:1 по объему). Получают таким образом 2,42 г (88%) (3aRS, 4SR, 9SR, 9aRS)-3 а-амино 4,9-этано-2-(2-метоксифенил)ацетил-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндола в виде порошка белого цвета, характеристики которого следующие: т. пл. = 92 С. 1H-ЯMP-cпeктp (300 МГц, (СО 3)2SO-d6,в м.д.): при комнатной температуре обнаруживают смесь двух геометрических изомеров в соотношении 50:50; 1,30-2,05 (мультиплеты, 6 Н:(д, J = 12,5 Гц, 1 Н в целом: другой Н от СН 2 в положении 3); 6,38 и 6,43 (уш. 2 д, J = 7,5 Гц, 1 Н в целом: Н в положении 8); 6,85-7,55, (м, 12 Н: Н в положении 5, Н в положении 6, Н в положении 7, Н ароматические в орто-, мета- и параположении к ОСН 3 и Н ароматические фенила в положении 9). При температуре ниже 10 С прикапывают 1 см 3 уксусного ангидрида в 3 см 3 концентрированной муравьиной кислоты, затем нагревают в 25 течение 1 ч при 50 С. После охлаждения добавляют 438 г (1 ммоль) (3aRS, 4SR, 9SR, 9aRS)-3 аамино-4,9-этано-2-(2-метоксифенил)-ацетил-9 фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндола и перемешивают при температуре около 20 С в течение 12 ч. Реакционную смесь затем обрабатывают с помощью 50 см 3 воды и 50 см 3 дихлорметана. Органическую фазу отделяют путем декантации, промывают водой, затем сушат над сульфатом натрия. Выделившиеся при добавлении 50 см 3 диизопропилового эфира кристаллы отсасывают. Таким образом получают 215 мг (46%) (3aRS, 4SR, 9SR, 9aRS)-3aформиламино-4,9-этано-2-(2-метоксифенил) ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндола в виде кристаллов белого цвета, характеристики которого следующие: т. пл. = 236 С, масс-спектр (десорбционнохимическая ионизация: NН 3): м/е =429 (MH+). Пример 12. Из 400 мг (0,91 ммоль) (3aRS,4SR,9SR,9aRS)-3a-амино-4,9-этано-2-(2 метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изoиндoлa, 200 мг (0,91 ммоль) N-бензилоксикарбонилглицина, 200 мг(0,1 ммоль) гидроксибензотриазола, растворенных в 20 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и очистки полученного сырого продукта путем хроматографии на диоксиде кремния (70-230 меш), элюируя этилацетатом, получают 350 мг(3aRS,4SR,9SR,9aRS)-3 а-(Nбензилоксикарбонилглицил)амино-[4,9-этано-2(2-метоксифенил)-ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо-[f]изоиндола в виде порошка белого цвета, характеристики которого следующие: т. пл. = 118 С, масс-спектр (десорбционно-химическая ионизация:NН 3): м/е=630 (MH+). 100 мг (0,16 ммоль) (3aRS, 4SR, 9SR,9aRS)-3 а-(N-бензилоксикарбонилглицил)амино 4,9-этано-2-(2-метоксифенил)ацетил-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндола,растворенные в 5 см 3 метанола, обрабатывают водородом при атмосферном давлении в присутствии 10 мг 10%-ного (по массе) палладияна-угле в течение 4-х ч. После отфильтровывания катализатора и выпаривания растворителя,остаток очищают путем препаративной хроматографии на пластине из диоксида кремния,элюируя смесью этилацетата с метанолом (98:2 по объему). Таким образом получают 42 мг(51%) (3aRS, 4SR, 9SR, 9aRS)-3 а-глициламино 4,9-этано-2-(2-метоксифенил)-ацетил-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]-изоиндола в виде порошка белого цвета, характеристики которого следующие: т. пл. = 210 С, массспектр (десорбционно-химическая ионизация:(0,14 ммоль) гидроксибензотриазола, растворенных в 30 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и очистки полученного сырого продукта путем хроматографии на силикагеле (70-230 меш), элюируя смесью циклогексана с этилацетатом (30:70 по объему), получают 670 мг (73%)(3aRS, 4SR, 9SR, 9aRS)-3 а-(N-трет.-бутоксикарбонилметионил)амино-[4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бeнзo[f]изoиндoлa в виде порошка белого цвета, характеристики которого следующие: т. пл. = 92 С, масс-спектр (десорбционно-химическая ионизация, NН 3): м/е = 670(МН+). 400 мг (0,6 ммоль) (3aRS, 4SR, 9SR, 9aRS)3 а-(N-трет-бутоксикарбонилметионил)амино 4,9-этано-2-(2-метоксифенил)ацетил-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндола в 40 см 3 метанола и 4 см 3 4 н. соляной кислоты нагревают в течение 3 ч при температуре 50 С. После разбавления с помощью 100 см 3 воды,нейтрализации до рН = 8 с помощью 4 н. раствора гидроксида натрия, экстракции 2 раза по 100 см 3 этилацетатом, высушивания над сульфатом магния и концентрирования досуха, получают масло, которое очищают путем флешхроматографии на силикагеле (70-230 меш),элюируя смесью дихлорметана с этанолом (92:8 по объему). Таким образом получают 80 мг(22%) (3aRS, 4SR, 9SR, 9aRS)-3a-метиониламино-4,9-этано-2-(2-метоксифенил)ацетил-9 фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндола в виде порошка белого цвета, характеристики которого следующие: т. пл. выше 260 С; масс-спектр (десорбционно-химическая ионизация, NН 3): м/е = 569 (МН+). Пример 14. Исходя из 500 мг (1,14 ммоль)(0,114 ммоль) гидроксибензотриазола, растворенных в 20 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и очистки полученного сырого продукта путем хроматографии на силикагеле (70-230 меш), элюируя этилацетатом, получают 200 мг(28%) (3aRS, 4SR, 9SR, 9aRS)-3 а-(N-трет.-бутоксикарбонилсерил)амино-4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндола в виде порошка белого цвета, характеристики которого следующие: т. пл. = 110 С, масс-спектр (десорбци 27 онно-химическая ионизация, NН 3): м/е =626(3aRS, 4SR, 9SR, 9aRS)-3 а-амино-4,9-этано-2-(2 метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндола, 220 мг (1,60 ммоль) моноэтилового эфира малоновой кислоты, 300 мг (1,60 ммоль) гидрохлорида 1-этил-3(3-диметиламинопропил)карбодиимида и 20 мг(0,14 ммоль) гидроксибензотриазола, растворенных в 20 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и очистки полученного сырого продукта путем перекристаллизации из толуола, получают 680 мг (91%) (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-3 а-этоксикарбонилацетиламино-2-(2 метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндола в виде порошка белого цвета, характеристики которого следующие: т. пл. = 110 С, масс-спектр (десорбционно-химическая ионизация: NН 3): м/е = 553[f]изоиндола в 0,9 см 3 1 н. раствора гидроксида натрия и 10 см этанола, которые кипятят с обратным холодильником в течение 5 ч, после перекристаллизации из 90%-ного этанола, получают 320 мг (70%) (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-3 а-карбоксиацетиламино-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро 1 Н-бензо-[f]изоиндола в виде кристаллов белого цвета, характеристики которого следующие: т. пл. = 228 С, масс-спектр (десорбционнохимическая ионизация: NН 3): м/е = 539 (МН+). Пример 17. К раствору 310 мг (0,7 ммоль)(3aRS, 4SR, 9SR, 9aRS)-3 а-амино-4,9-этано-2-(2 метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изoиндoлa в 20 см 3 дихлорметана добавляют 90 мг (0,9 ммоль) янтарного ангидрида, затем перемешивают в течение 3 ч при температуре около 20 С. После удаления растворителей при пониженном давлении, полученный остаток растворяют в 50 см 3 0,1 н. раствора гидроксида натрия, затем водную фазу промывают 2 раза по 20 см 3 этилацетатом. После подкисления до рН=2 путем добавления 0,5 н. соляной кислоты, выпавший осадок отсасывают, затем перекристаллизуют из 50%-ного этанола. Таким образом получают 200 мг (53%)(3aRS,4SR,9SR,9aRS)-4,9-этано-3 а-(3 карбоксипропионил)-амино-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндола в виде кристаллов сурового цвета, характеристики которого следующие: т. пл. = 140 С,масс-спектр (десорбционно-химическая ионизация:NН 3): м/е = 481 [(М-СОО + H)+]. Пример 18. Раствор 13,7 г (32 ммоль) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-2 000797 28 бензил-4,9-этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1H-бензо-[f]изoиндoл-3a-кapбoнoвoй кислоты, полученной в условиях примера 1, в 130 см 3 тетрагидрофурана, при поддерживании температуры ниже 40 С, прикапывают к суспензии 1,23 г (32 ммоль) литийалюминийгидрида в 200 см 3 безводного тетрагидрофурана, затем продолжают перемешивать при температуре 40 С в течение 1 ч. После охлаждения медленно добавляют 12 см 3 1 н. раствора гидроксида натрия,затем сульфата магния. После отфильтровывания неорганических солей и концентрирования досуха, полученный остаток очищают на силикагеле (70-230 меш), элюируя смесью циклогексана с этилацетатом (30:70 по объему), и получают 12,15 г (96%) (3aRS, 4SR, 9SR, 9aRS)-2 бензил-4,9-этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-метанола в виде меренги белого цвета, характеристики которой следующие: 1NCH2Ar); 6,52 (уш.д., J = 7,5 Гц, 1 Н: Н в положении 8); 6,95-7,20 (м, 3 Н: Н в положении 5, Н в положении 6 и Н в положении 7); 7,20-7,60 (м,10 Н: Н ароматические фенила в положении 9 и Н ароматические бензила в положении 2). Исходя из 3,1 г (7,8 ммоль) (3aRS, 4SR,9SR, 9aRS)-2-бензил-4,9-этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-метанола в виде раствора в 50 см 3 метанола и в присутствии 300 мг 20%-ного (по массе) гидроксида палладия, после гидрирования в течение 2 ч с помощью водорода при атмосферном давлении отфильтровывания катализатора и концентрирования досуха при пониженном давлении, получают 2,26 г (95%) (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-метанола в виде бесцветного, очень вязкого масла, характеристики которого следующие: масс-спектр (электронный удар): м/е= 305 (М+). Исходя из 2,25 г (7,4 ммоль) (3aRS, 4SR,9SR, 9aRS)-4,9-этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-метанола, 1,23 г (7,4 ммоль) 2-метоксифенилуксусной кислоты,1,42 г (7,4 ммоль) гидрохлорида 1-этил-3-(3 диметиламинопропил)карбодиимида и 100 мг(0,74 ммоль) гидроксибензотриазола, растворенных в 60 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и перекристаллизации полученного сырого продукта из смеси толуола с диизопропиловым эфиром (1:1 по объему), получают 2,57 г (90%)H-ЯМР-спектр (250 мГц, (СD3)2SO-d6 с добавлением нескольких капель СD3 СООD-d4,при температуре 120 С,в м.д.): 1,35; 1,68; 1,90-2,15 (3 м, соответственно, 1 Н, 1H и 2 Н:(массив, 3 Н: ОСН 3); 3,90 (д, J = 12,5 Гц, 1H: другой Н от CH2 в положении 3); 6,41 (уш. д, J = 7,5 Гц, 1H: Н в положении 8); 6,85-7,00 (м, 2 Н: Н ароматические в пара- и орто-положении к ОСН 3); 7,05 (дт, J = 7,5 и 2 Гц, 1H: Н в положении 7); 7,10-7,30 (м, 4 Н: Н в положении 5, Н в положении 6 и Н ароматические в метаположении к ОСН 3); 7,30-7,55 (м, 5 Н, Н ароматические фенила в положении 9). При температуре около 20 С и в атмосфере азота, 500 мг (1,1 ммоль) (3aRS, 4SR, 9SR,9aRS)-4,9-этано-2-(2-метоксифенил)ацетил-9 фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-метанола растворяют в 10 см 3 высушенного над гидроксидом калия пиридина, затем добавляют 336 мг (1,2 ммоль) ангидрида трифторметансульфокислоты. После перемешивания в течение 3 ч при температуре около 20 С добавляют 25 см 3 воды и экстрагируют 3 раза по 25 см 3 дихлорметаном. Объединенные органические фазы промывают 0,1 н. соляной кислотой,затем водой, сушат над сульфатом магния и концентрируют досуха при пониженном давлении. Остаток очищают путем перекристаллизации из смеси метанола с диизопропиловым эфиром (60:40 по объему). Таким образом получают 310 мг (42%) (3aRS, 4SR, 9SR, 9aRS)-N-[4,9 этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндолил-3 аметил]пиридиний-трифторметан-сульфоната в виде кристаллов бледно-желтого цвета, характеристики которого следующие: т. пл. = 244 С. 1 30 ароматические фенила в положении 9); 8,15 (т. уш., J = 7 Гц, 2 Н: Н в положении 3 и Н в положении 5 пиридила); 8,65 (уш. т, J = 7 Гц, 1 Н: Н в положении 4 пиридила); 8,91 (уш. д, J = 7 Гц,2 Н: Н в положении 2 и Н в положении 6 пиридила). Пример 19. При температуре около 20 С и в атмосфере азота, 9 г (23 ммоль) (3aRS, 4SR,9SR, 9aRS)-2-бензил-4,9-этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-метанола растворяют в 100 см 3 безводного диоксана и 2,53 мг (25 ммоль) триэтиламина, затем добавляют 7,05 г (25 ммоль) ангидрида трифторметансульфокислоты. После перемешивания в течение 3 ч при температуре около 20 С разбавляют с помощью 200 см 3 воды и экстрагируют 3 раза по 250 см 3 этилацетатом. Органические фазы промывают водой, сушат над сульфатом магния, затем концентрируют при пониженном давлении. Таким образом получают 12,5 г (95%)(электронный удар): м/е= 527 (M+). 870 мг (1,65 ммоль) (3aRS, 4SR, 9SR,9aRS)-2-бензил-4,9-этано-9-фенил-3 а-(трифторметилсульфонилокси)метил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндола и 323 мг (6,6 ммоль) цианида натрия в 20 см 3 диметилсульфоксида перемешивают в течение 18 ч при температуре около 20 С. После разбавления с помощью 100 см 3 воды экстрагируют 3 раза по 50 см 3 диэтиловым эфиром. Объединенные органические фазы промывают водой, сушат над сульфатом магния и концентрируют досуха при пониженном давлении. Таким образом получают 640 мг (96%) (3aRS, 4SR, 9SR, 9aRS)-2 бензил-3 а-цианометил-4,9-этано-9-фенил-2,3,3 а,4, 9, 9 а-гексагидро-1 Н-бензо [f]изоиндола в виде белого лака, характеристики которого следующие: масс-спектр (электронный удар): м/е= 495-2-бензил-3 а-цианометил-4,9-этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1H-бензо [f]изоиндола в 4 см 3 водного 50%-ного раствора серной кислоты кипятят с обратным холодильником в течение 5 ч. После охлаждения реакционную смесь выливают в 50 см 3 ледяной воды. Выпавший осадок отсасывают, промывают 2 раза по 10 см 3 ледяной водой и сушат при пониженном давлении при 50 С, затем обрабатывают с помощью 20 см 3 метанола в присутствии 1 см 3 концентрированной серной кислоты и кипятят в течение ночи с обратным холодильником. Метанол выпаривают, затем остаток разбавляют с помощью 20 см 3 воды и экстрагируют 2 раза по 25 см 3 этилацетатом. Органические фазы промывают водой, сушат над сульфатом магния, отфильтровывают через 10 г диоксида кремния и концентрируют досуха при пониженном давлении. 31 Таким образом получают 600 мг (59%) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-2-бензил-4,9 этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-уксусной кислоты в виде порошка белого цвета, характеристики которого следующие: т. пл. = 84-86 С, масс-спектр (электронный удар): м/е= 437 (М+). Исходя из 800 мг(18 ммоль) метилового эфира (3aRS, 4SR, 9SR,9aRS)-2-бензил-4,9-этано-9-фенил-2,3,3 а,4,9,9 агексагидро-1H-бензо[f]изоиндол-3 а-уксусной кислоты, растворенных в 20 см 3 метанола, и в присутствии 100 мг 20%-ного (по массе) гидроксида палладия, после перемешивания в течение 2 ч в присутствии водорода при атмосферном давлении и при температуре 40 С, отфильтровывания катализатора и концентрирования досуха при пониженном давлении, получают 520 мг (83%) метилового эфира (3aRS, 4SR, 9SR,9aRS)-4,9-этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-уксусной кислоты в виде порошка белого цвета, характеристики которого следующие: т. пл. = 71-73 С,масс-спектр (электронный удар): м/е= 347 (М+). Исходя из 500 мг (1,44 ммоль) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-9 фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изoиндoл-3a-yкcycнoй кислоты, 260 мг (1,6 ммоль) 2-метоксифенилуксусной кислоты, 290 мг (1,6 ммоль) гидрохлорида 1-этил-3-(3-диметил аминопропил)карбодиимида и 20 мг (0,14 ммоль) гидроксибензотриазола, растворенных в 12 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и очистки путем флеш-хроматографии на силикагеле (70-230 меш), элюируя смесью циклогексана с этилацетатом (1:1 по объему), получают 430 мг (61%) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-2-(2-метоксифенил)ацетил-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-уксусной кислоты в виде порошка белого цвета, характеристики которого следующие: т. пл. = 95 С, масс-спектр (электронный удар): м/е= 495 (М+). Исходя из 394 мг (0,8 ммоль) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-2-(2-метоксифенил)ацетил-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-уксусной кислоты в 8 см 3 1 н. раствора гидроксида натрия и 4 см 3 метанола, которые кипятят с обратным холодильником в течение 4-х ч, после очистки путем перекристаллизации из диизопропилового эфира, получают 200 мг (52%)(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро 1 Н-бензо[f]изоиндол-3 а-уксусной кислоты в виде порошка белого цвета, характеристики которого следующие: т. пл. = 171 С. 1(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро 1H-бензо[f]изоиндол-3 а-уксусной кислоты,112,5 мг (0,9 ммоль) метилового эфира глицина,180 мг (0,9 ммоль) гидрохлорида 1-этил-3-(3 диметиламинопропил)-карбодиимида, 8 г (0,06 ммоль) гидроксибензотриазола и 101 мг (1 ммоль) триэтиламина в виде раствора в 10 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и очистки полученного сырого продукта путем флешхроматографии на силикагеле (70-230 меш),элюируя смесью циклогексана с этилацетатом(4:6 по объему), получают 150 мг (45%) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-N-[4,9-этано 2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-ил]ацетилглицина в виде порошка белого цвета,характеристики которого следующие: т. пл. = 95 С, масс-спектр (десорбционно-химическая ионизация:NН 3): м/е = 553 (МН+). Исходя из 290 мг (0,525 ммоль) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-N-[4,9-этано-2(2-метоксифенил)-ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]-изоиндол-3 а-ил]ацетилглицина в 10 см 3 1 н. раствора гидроксида натрия и 5 см 3 метанола, которые кипятят с обратным холодильником в течение 4-х ч, после очистки путем перекристаллизации из диизопропилового эфира, получают 180 мг (64%) (3aRS,4SR,9SR,9aRS)-N-[4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-3-Н-бензо[f]изоиндол-3 а-ил]ацетилглицина в виде порошка белого цвета, характеристики которого следующие: т. пл. = 172 С, массспектр(0,9 ммоль) метилового эфира метионина, 180 мг (0,9 ммоль) гидрохлорида 1-этил-3-(3 диметиламинопропил)карбодиимида, 8 мг (0,06 ммоль) гидроксибензотриазола и 101 мг (1 ммоль) триэтиламина в виде раствора в 10 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и после очист 33 ки путем флеш-хроматографии на силикагеле(70-230 меш), элюируя смесью циклогексана с этилацетатом (4:6 по объему), получают 200 мг(53%) метилового эфира (3aRS, 4SR, 9SR,9aRS)-N-[4,9-этано-2-(2-метоксифенил)ацетил 9-фенил-2,3,3 а,4,9,9 а-гексагидро-1H-бензо[f] изоиндол-3 а-ил]ацетилметионина в виде порошка белого цвета, характеристики которого следующие: т. пл. = 96 С, масс-спектр (десорбционно-химическая ионизация:NH3): м/е = 627(3aRS, 4SR, 9SR, 9aRS)-N-[4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-ил]ацетилметионина в 28 см 3 1 н. раствора гидроксида натрия и 14 см 3 метанола, которые кипятят с обратным холодильником в течение 12 ч, после очистки путем кристаллизации из диэтилового эфира,получают 590 мг (69%) (3aRS, 4SR, 9SR, 9aRS)N-[4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-ил]ацетилметионина в виде порошка белого цвета, характеристики которого следующие: т. пл. = 135 С, масс-спектр (десорбционно-химическая ионизация:NН 3): м/е = 613(МН+). Пример 22. Раствор 5 г (9,5 ммоль) (3aRS,4SR, 9SR, 9aRS)-2-бензил-4,9-этано-9-фенил-3 а(трифторметилсульфонилокси)-метил-2, 3, 3 а, 4,9, 9 а-гексагидро-1 Н-бензо[f]изоиндола, полученного в условиях примера 19, в 50 см 3 триэтилфосфита медленно нагревают до 100 С. В этот момент происходит бурная реакция, и внутренняя температура достигает 145-150 С. Перемешивание продолжают в течение 1 ч, поддерживая температуру в пределах от 100 до 110 С, затем в течение 18 ч оставляют стоять для снижения температуры до значения около 20 С. Реакционную смесь обрабатывают с помощью 100 см 3 воды и 200 см 3 этилацетата. Органическую фазу отделяют путем декантации,промывают водой, сушат над сульфатом магния и концентрируют досуха при пониженном давлении. Полученный остаток очищают путем флеш-хроматографии на силикагеле (70-230 меш), элюируя смесью циклогексана с этилацетатом (1:1 по объему). Таким образом получают 1,46 г (29%) диэтилового эфира (3aRS, 4SR,9SR, 9aRS)-(2-бензил-4,9-этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]-изоиндол-3 а-ил) метилфосфоновой кислоты в виде бледножелтого масла, характеристики которого следующие: масс-спектр (электронный удар): м/е= 515 (M+). Исходя из 460 мг (0,9 ммоль) этилового эфира (3aRS, 4SR, 9SR, 9aRS)-(2-бензил-4,9 этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1Hбензо[f]изоиндол-3 а-ил)метилфосфоновой кислоты в виде раствора в 20 см 3 этанола и в присутствии 100 мг 20%-ного (по массе) гидроксида палладия, после перемешивания в течение 6 ч 34 в присутствии водорода при атмосферном давлении и при температуре 60 С, отфильтровывания катализатора и концентрирования досуха при пониженном давлении, получают 370 мг(0,14 ммоль) гидроксибензотриазола в виде раствора в 20 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и очистки полученного сырого продукта путем флеш-хроматографии на силикагеле (70230 меш), элюируя смесью циклогексана с этилацетатом (1:9 по объему), получают 350 мг(43%) диэтилового эфира (3aRS, 4SR, 9SR,9aRS)-(4,9-этано-2-(2-метоксифенил)ацетил-9 фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-ил)метилфосфоновой кислоты в виде порошка белого цвета, характеристики которого следующие: т. пл. = 130 С. 1H-ЯМР-спектр (400 мГц, (СD3)2SO-d6, с добавлением нескольких капель СD3 СООD-d4,при температуре 130 С,в м.д.): 1,23 и 1,25 (2 т, J = 1 Гц, 6 Н: СН 3 этила); 1,37, 1,64, 1,90 и 2,05(массив, 3 Н: ОСН 3); 3,85-4,10 (м, 4 Н: ОСН 2 этила); 4,09 (д, J = 13 Гц, 1 Н: другой Н от СН 2 в положении 3); 6,44 (уш. д, J = 7,5 Гц, 1 Н: Н в положении 8); 6,88 (т, J = 7,5 Гц, 1 Н: Н ароматический в пара-положении к ОСН 3); 6,93 (д, J = 7,5 Гц, 1 Н: Н ароматический в орто-положении к ОСН 3); 7,07 (дт, J = 7,5 и 1,5 Гц, 1 Н: Н в положении 7); 7,15-7,35 (м, 4 Н: Н в положении 5, Н в положении 6 и Н ароматические в метаположении к ОСН 3); 7,35 (м, 3 Н: Н ароматические в орто- и пара-положении к фенилу в положении 9); 7,47 (т, J = 7,5 Гц, 2 Н: Н ароматические в мета-положении к фенилу в положении 9). Пример 23. 850 мг (1,5 ммоль) диэтилового эфира (3aRS, 4SR, 9SR, 9aRS)-(4,9-этано-2-(2 метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-ил)-метилфосфоновой кислоты растворяют в 10 см 3 безводного тетрахлорида углерода, затем охлаждают до температуры около -20 С и добавляют 600 мг (3 ммоль) триметилсиланиодида. Оставляют на 2-3 35 ч для постепенного повышения температуры до значения около -20 С, затем перемешивают еще в течение 1 ч. После этого добавляют 2 см 3 воды и 2 см 3 водного 0,1 н. раствора тиосульфата натрия, затем экстрагируют диэтиловым эфиром. Органическую фазу промывают водой, сушат над сульфатом натрия и концентрируют досуха при пониженном давлении. Остаточное масло кристаллизуют из 20 см 3 водного 80%-ного (по объему) этанола, после чего сгущают при кипячении с обратным холодильником в 25 см 3 этанола. Таким образом получают 230 мг (30%) (3aRS, 4SR, 9SR, 9aRS)(4,9-этано-2-(2-метоксифенил)ацетил-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-ил)метилфосфоновой кислоты в виде порошка белого цвета, характеристики которой следующие: т. пл. выше 260 С, масс-спектр (десорбционно-химическая ионизация: NН 3): м/е = 518 (МН+). Пример 24. Раствор 436 мг (3,3 ммоль) метилмалоната в 10 см 3 безводного диоксана прикапывают к суспензии 160 мг (3,3 ммоль) гидрида натрия (50%-ная дисперсия в масле) в 20 см 3 безводного диоксана. Перемешивают при температуре около 20 С в течение 30 мин, после окончания выделения водорода, затем медленно добавляют раствор 1,52 г (2,9 ммоль) (3aRS,4SR, 9SR, 9aRS)-2-бензил-4,9-этано-9-фенил-3 а(трифторметилсульфонилокси)метил-2,3,3 а,4,9,9 а-гексагидро-1H-бензо[f]изоиндола, полученного в условиях примера 19, в 20 см 3 безводного диоксана. Реакционную смесь кипятят с обратным холодильником в течение 1 ч, затем перемешивают в течение 18 ч при температуре около 20 С. После разбавления с помощью 100 см 3 воды экстрагируют 3 раза по 50 см 3 этилацетатом. Органические фазы промывают водой, сушат над сульфатом натрия, отфильтровывают через 10 г диоксида кремния и концентрируют досуха при пониженном давлении. Таким образом получают 1,21 г (82%) диметилового эфира(3aRS, 4SR, 9SR, 9aRS)-2-(2-бензил-4,9-этано-9 фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-ил)метилмалоновой кислоты в виде бесцветного масла, характеристики которого следующие: масс-спектр (десорбционно-химическая ионизация: NН 3): м/е = 510 (МН+). Исходя из 1,2 г (2,3 ммоль) диметилового эфира (3aRS, 4SR, 9SR, 9aRS)-2-(2-бензил-4,9 этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-ил)-метилмалоновой кислоты в виде раствора в 20 см 3 метанола и в присутствии 250 мг 20%-ного (по массе) гидроксида палладия, после гидрирования в течение 6 ч в атмосфере водорода при атмосферном давлении и при температуре 60 С, отфильтровывания катализатора и концентрирования досуха при пониженном давлении, получают 930 мг(0,13 ммоль) гидроксибензотриазола в виде раствора в 20 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и очистки полученного сырого продукта путем флеш-хроматографии на силикагеле (70230 меш), элюируя смесью циклогексана с этилацетатом (1:9 по объему), получают 350 мг(47%) диметилового эфира (3aRS, 4SR, 9SR,9aRS)-2-[4,9-этано-2-(2-метоксифенил)ацетил-9 фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-ил]метилмалоновой кислоты в виде порошка белого цвета, характеристики которого следующие: т. пл. = 75 С, масс-спектр (десорбционно-химическая ионизация:NН 3): м/е = 568(МН+). Исходя из 280 мг (0,5 ммоль) диметилового эфира (3aRS, 4SR, 9SR, 9aRS)-2-[4,9-этано-2(2-метоксифенил)-ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]-изоиндол-3 а-ил]метилмалоновой кислоты в 10 см 3 1 н. раствора гидроксида натрия и 5 см 3 метанола, которые кипятят с обратным холодильником, в течение 4-х ч,после очистки путем кристаллизации из диизопропилового эфира, получают 110 мг (41%)(3aRS, 4SR, 9SR, 9aRS)-2-(4,9-этано-[(2-метоксифенил)ацетил]-9-фенил-1,2,3,3 а,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-ил)метилмалоновой кислоты в виде порошка белого цвета, характеристики которой следующие: т. пл. = 200 С, масс-спектр (десорбционно-химическая ионизация:NН 3): м/е =539 (МН+). Пример 25. Раствор 770 мг (1,4 ммоль)(3aRS, 4SR, 9SR, 9aRS)-2-[4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-1,2,3,3 а,9,9 а-гексагидро-1 Н-бензо[f]изoиндoл-3a-ил]-метилмалоновой кислоты в 20 см 3 ацетонитрила в присутствии 19,6 мг (0,14 ммоль) оксида одновалентной меди нагревают при температуре около 8090 С вплоть до появления выделения диоксида углерода. Когда газовыделение прекратится,продолжают нагревать в течение 2 мин, затем быстро охлаждают. Разбавляют с помощью 50 см 3 этилацетата и 2 см 3 1 н. раствора аммиака. Полученный гель последовательно фильтруют через целит, затем диоксид кремния. После удаления растворителей, остаток обрабатывают с помощью 20 см 3 дихлорметана. Органическую фазу промывают 0,5 н. водным раствором соляной кислоты, сушат над сульфатом магния и концентрируют досуха при пониженном давле 37 нии. Путем кристаллизации из диизопропилового эфира получают 220 мг (32%) (3aRS, 4SR,9SR,9aRS)-3-[4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-1,2,3,3 а,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-ил]пропионовой кислоты в виде порошка белого цвета, характеристики которой следующие: т. пл. = 200 С. 1 Н-ЯМР-спектр (250 мГц, (CD3)2SO-d6, при температуре 120 С,в м.д.): 1,25 и 1,38 (2 м, 1 Н каждый: CH2 пропионилоксигруппы); 1,38; 1,67; 1,90 и 2,06 (4 м, 1H каждый: CH2CH2); 2,20 и 2,35 (2 м, 1 Н каждый, CH2COO пропионилоксигруппы); 2,38 (м, 1H: H в положении 9 а); 3,06(массив, 3 Н: ОСН 3), 4,00 (д, J = 12,5 Гц, 1H: другой Н от CH2 в положении 3); 6,44 (уш. д, J = 7,5 Гц, 1H: Н в положении 8); 6,90 (т, J = 7,5 Гц, 1H: ароматический Н в пара-положении к ОСН 3),6,95 (д, J=7,5 Гц, 1H: Н ароматический в ортоположении к ОСН 3); 7,07 (дт, J = 7,5 и 1,5 Гц,1H: Н в положении 7); 7,15-7,35 (м, 4 Н: Н в положении 5 и Н в положении 6 и Н ароматические в мета-положении к ОСН 3); 7,35 (м, 3 Н: Н ароматические в орто- и пара-положении к фенилу в положении 9); 7,48 (уш.т, J=7,5 Гц, 2 Н: Н ароматические в мета-положении к фенилу в положении 9). Пример 26. Исходя из 436 мг (3,3 ммоль) метилового эфира 3-меркаптопропановой кислоты в 10 см 3 безводного диоксана, 160 мг (3,3 ммоль) гидрида натрия (50%-ная дисперсия в масле) в 20 см 3 безводного диоксана и 1,52 г (2,9 ммоль) (3aRS, 4SR, 9SR, 9aRS)-2-бензил-4,9 тано-9-фенил-3 а-(трифторметилсульфонилокси)метил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f] изоиндола, полученного в условиях примера 19 в 20 см 3 безводного диоксана, при кипячении с обратным холодильником в течение 1 ч, затем при перемешивании в течение 18 ч при температуре около 20 С, получают 1,34 г (93%) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-3-(2 бензил-4,9-этано-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-ил)метилтиопропановой кислоты в виде бледно-желтого масла, характеристики которого следующие: масс-спектр (электронный удар): м/е = 497 (М+). К раствору, охлажденному до температуры 10 С, из 600 мг (1,2 ммоль) метилового эфира(3aRS, 4SR, 9SR, 9aRS)-3-(2-бензил-4,9-этано-9 фенил-2,3,3 а,4,9, 9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-ил)метилтиопропановой кислоты в 10 см 3 безводного дихлорметана, в атмосфере азота и при поддерживании температуры ниже 0 С,прикапывают раствор 257 мг 1-хлорэтилхлорформиата в 5 см безводного дихлорметана. После перемешивания в течение 30 мин при температуре 0 С, затем в течение 1 ч при температуре около 20 С, реакционную смесь концентрируют досуха, остаток обрабатывают с помощью 10 см 3 безводного метанола, кипятят с об 000797 38 ратным холодильником в течение 2 ч, затем перемешивают при температуре около 20 С в течение 18 ч. После удаления метанола при пониженном давлении, остаток обрабатывают с помощью 20 см 3 дихлорметана. Органическую фазу промывают водой, сушат над сульфатом натрия и концентрируют досуха. Таким образом получают 400 мг (82%) метилового эфира(0,1 ммоль) гидроксибензотриазола в виде раствора в 20 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и очистки полученного сырого продукта путем флеш-хроматографии на силикагеле (70230 меш), элюируя смесью циклогексана с этилацетатом (6:4 по объему), получают 210 мг(3aRS, 4SR, 9SR, 9aRS)-3-[4,9-этано-2-(2 метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9aгeкcaгидpo-1H-бeнзo[f]изoиндoл-3a-ил]-метилтиопропановой кислоты в 6,4 см 3 1 н. раствора гидроксида натрия и 3,2 см 3 метанола, при кипячении с обратным холодильником в течение 4-х ч, после очистки путем кристаллизации из диизопропилового эфира, получают 120 мг(69%) (3aRS, 4SR, 9SR, 9aRS)-3-[4,9-этано-2-(2 метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-ил]метилтиопропановой кислоты в виде порошка белого цвета, характеристики которой следующие: т. пл. = 120 С. 1 Н-ЯМР-спектр (250 мГц, (CD3)2SО-d6, при температуре 120 С,в м.д.): 1,38, 1,67 и 1,852,15 (3 м, соответственно, 1 Н, 1 Н и 2 Н;CH2CH2); 2,26 и 2,41 (2 д, J = 12 Гц, 1 Н каждый: СН 2S); 2,40 (т, J = 7 Гц, 2 Н: CH2COO); 2,54 (м, 1 Н: Н в положении 9 а); 2,66 (т, J=7 Гц, 2 Н: CH2S), 3,16 39 Гц, 1 Н: Н ароматический в орто-положении к ОСН 3): 7,09 (дт, J = 7,5 и 1,5 Гц, 1 Н: Н в положении 7), 7,15-7,35 (м, 4 Н: Н в положении 5, Н в положении 6 и ароматические Н в метаположении к ОСН 3); 7,35-7,45 (м, 3 Н: Н ароматические в орто- и пара-положении к фенилу в положении 9); 7,49 (уш.т, J =7,5 Гц, 2 Н: Н ароматические в мета-положении к фенилу в положении 9). Пример 27. Исходя из 1,2 г (3,6 ммоль) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1H-бензо[f]-изоиндол-3 а-карбоновой кислоты, полученного в условиях примера 1, в 36 см 3 2 н раствора гидроксида натрия и 36 см 3 этанола, при кипячении с обратным холодильником в течение 4-х ч, после очистки полученного после концентрирования сырого продукта путем растворения в 1 н. растворе гидроксида натрия и повторного осаждения за счет нейтрализации до рН=6,5 с помощью 1 н. раствора соляной кислоты, получают 1,12 г (97%) (3aRS, 4SR, 9SR,9aRS)-4,9-этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в виде порошка белого цвета, характеристики которой следующие: т. пл. выше 260 С,масс-спектр (электронный удар): м/е= 319 (М+). 500 мг (1,56 ммоль) (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-9-фенил-1,2,3,3 а,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты растворяют в 50 см 3 0,1 н. раствора гидроксида натрия и 50 см 3 диоксана при нагревании при 60 С. После охлаждения до температуры около 20 С добавляют 580 мг (3,12 ммоль) (2-метоксифенил)метилхлор-формиата, затем перемешивают в течение 4-х дней при температуре около 20 С. После концентрирования досуха, остаток очищают путем препаративной хроматографии на пластине из диоксида кремния, элюируя с помощью смеси дихлорметана с метанолом и уксусной кислотой (90:6:4 по объему). Таким образом получают 175 мг (24%) (3aRS, 4SR,9SR, 9aRS)-4,9-этано-2-(2-метоксифенил)оксикарбонил-9-фенил-1,2,3,3 а,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты в виде порошка белого цвета, характеристики которой следующие: т. пл. = 251 С; 1H-ЯМР-спектр (300 мГц, (СD3)2SO-d6,в м.д.): при комнатной температуре обнаруживают смесь геометрических изомеров в соотношении 50:50; 1,47, 1,78 и 2,00-2,50 (3 м, соответственно, 1 Н, 1H и 2 Н: CH2CH2); 3,25-3,65 (м, 5 Н:(0,9 ммоль) гидроксибензотриазола в виде раствора в 100 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и очистки полученного сырого продукта путем флеш-хроматографии на силикагеле (70230 меш), элюируя смесью циклогексана с этилацетатом (5:5 по объему), получают 286 г (60%) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-2-(2-бромфенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 акарбоновой кислоты в виде порошка белого цвета, характеристики которой следующие: т. пл. = 128-130 С, масс-спектр (десорбционнохимическая ионизация:NН 3): м/е = 530 (МН+). Из 1 г (1,82 ммоль) метилового эфира(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(2-бромфенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро 1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в 36 см 3 1 н. раствора гидроксида натрия и 36 см 3 этанола, при кипячении с обратным холодильником в течение 4-х ч, после очистки полученного сырого продукта путем флеш-хроматографии на силикагеле (70-230 меш), элюируя смесью дихлорметана с метанолом и уксусной кислотой (95:4:1 по объему), получают 430 мг(44%) (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(2 бромфенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]индoл-3a-кapбoнoвoй кислоты в виде порошка белого цвета, характеристики которой следующие: т. пл. = 167 С, масс-спектр(1,32 ммоль) пиридина и 11 мг (0,09 ммоль)4 диметиламинопиридина растворяют в 30 см 3 дихлорметана, затем добавляют 225 мг (2,2 ммоль) уксусного ангидрида. После перемешивания в течение 18 ч при температуре около 20 С, избыток уксусного ангидрида нейтрализуют путем добавления 1 н водного раствора гидроксида натрия. Отделенную путем декантации органическую фазу промывают последовательно водой, 0,1 н. раствором соляной кислоты и затем водой, сушат над сульфатом магния и концентрируют досуха при пониженном давлении. Полученный остаток очищают путем препаративной хроматографии на пластине из диоксида кремния, элюируя смесью дихлорметана с метанолом и уксусной кислотой (95:4,5: 0,5 по объему). Таким образом получают 78 мг (36%)(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(2-ацетокси 41 фенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро 1H-бензо[f]изоиндол-3 а-карбоновой кислоты в виде порошка белого цвета, характеристики которой следующие: т. пл. = 157-158 С, массспектр (электронный удар): м/е = 496 (М+). Пример 30. Из 901 мг (2,7 ммоль) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-9 фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты, 600 мг (3,3 ммоль) (2-метилтиофенил)уксусной кислоты,которая может быть получена согласно J. Organomet. Chem., 178, 800 (1979), 630 мг (3,3 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 36 мг (0,27 ммоль) гидроксибензотриазола в виде раствора в 30 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и очистки полученного сырого продукта путем флешхроматографии на силикагеле (70-230 меш),элюируя смесью циклогексана с этилацетатом(7:3 по объему), получают 1,25 г (92%) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2(2-метилтиофенил)ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в виде порошка белого цвета. характеристики которой следующие: т. пл. = 155 С,масс-спектр (десорбционно-химическая ионизация :NН 3): м/е =498 (МН+). Из 1,25 г (2,5 ммоль) метилового эфира(3aRS,4SR,9SR,9aRS)-4,9-этано-2-(2 метилтиофенил)ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в 31,5 см 3 1 н. раствора гидроксида натрия и 31,5 см 3 этанола, при кипячении с обратным холодильником в течение 4-х ч, после очистки полученного сырого продукта путем кристаллизации из диизопропилового эфира, получают 780 мг (64%) (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-2-(2-метилтиофенил)ацетил-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо-[f]изоиндол 3 а-карбоновой кислоты в виде кристаллов белого цвета со следующими характеристиками: т. пл. = 237 С, масс-спектр (десорбционнохимическая ионизация:NН 3): м/е = 484 (МН+). Пример 31. 774 мг (1,6 ммоль) (3aRS, 4SR,9SR, 9aRS)-4,9-этано-2-(2-метилтиофенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты расщепляют на колонке с хиральным диоксидом кремния,содержащим за счет прививки (3,5-динитробензил)-фенилаланин, элюируя смесью дихлорметана с изопропанолом и н-гептаном (85:10:5 по объему). Собирая вторую элюируемую фракцию(время удерживания = 15,4 мин), получают правовращающий энантиомер (3aRS, 4SR, 9SR,9aRS)-4,9-этано-2-(2-метилтиофенил)ацетил-9 фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в виде кристаллов белого цвета со следующими характеристиками: т. пл. = 133 С, вращательная способность 42 масс-спектр (десорбционно-химическая ионизация:NН 3): м/е =484 (МН+). Хиральный диоксид кремния можно получать следующим образом. В трехгорлой колбе емкостью 6 л суспендируют 948 г аминопропилированного диоксида кремния (100- 10 мкм -NH2; Macherey-Nagel) в 3 л диметилформамида. Добавляют 180 г ангидридаN-трет-бутоксикарбониламино-11 ундекановой кислоты и реакционную смесь перемешивают в течение 18 ч при температуре около 20 С. Диоксид кремния отфильтровывают и промывают последовательно 2 раза по 2500 см 3 дихлорметаном, затем 2 раза по 2500 см 3 диметилформамидом. Таким образом промытый диоксид кремния снова суспендируют в 3 л диметилформамида и добавляют 180 г ангидридаN-трет.-бутоксикарбониламино-11-ундекановой кислоты, после чего реакционную смесь перемешивают в течение 18 ч при температуре около 20 С. Диоксид кремния отфильтровывают,промывают последовательно 2 раза по 2500 см 3 дихлорметаном, 2 раза по 2500 см 3 тетрагидрофураном, 2 раза по 2500 см 3 метанолом и 2 раза по 2500 см диэтиловым эфиром, затем сушат при пониженном давлении при температуре около 20 С. Таким образом получают 971 г диоксида кремния, обозначаемого как "ВОС-С 11 С 3-диоксид кремния" в виде порошка белого цвета, структура которого подтверждена ИКспектром и элементный анализ которого следующий (найдено): С% = 9,85; Н% = 2,05; N% = 1,05. В трехгорлой колбе емкостью 6 л суспендируют 971 г диоксида кремния "ВОС-С 11-С 3 диоксид кремния" в 2,5 л дихлорметана и 470 г имидазола. Прикапывают 850 см 3 диметилоктилхлорсилана и реакционную смесь перемешивают в течение 16 ч при температуре около 20 С. Полученное твердое вещество отфильтровывают и промывают последовательно 2 раза по 2,5 л дихлорметаном, два раза по 2,5 л метанолом, 2 раза по 2,5 л тетрагидрофураном, два раза по 2,5 л дихлорметаном и 2 раза по 2,5 л диэтиловым эфиром, затем высушивают при пониженном давлении при температуре около 20 С. Таким образом получают 1179 г диоксида кремния, обозначаемого как "ВОС-С 11-С 3-диоксид кремния-O-Si(СН 3)2-(CH2)7-СН 3", в виде порошка белого цвета, структура которого подтверждена ИК-спектром и элементный анализ которого следующий (найдено): С % = 13,9; Н % = 2,83; N % = 1,16. В трехгорлой колбе емкостью 6 л суспендируют 1178 г диоксида кремния "ВОС-С 11-С 3 диоксид кремния-O-Si(СН 3)2-(CH2)7-СН 3" в 2500 см 3 5%-ного (по объему) раствора трифторуксусной кислоты в дихлорметане. Перемешивают при температуре 20 С. Диоксид кремния отфильтровывают и промывают последовательно 2 раза по 2,5 л дихлорметаном, 2 раза по 2,5 л смеси дихлорметана с диизопропилэтиламином(70:30 по объему), 2,5 л дихлорметана, 2 раза по 2,5 л тетрагидрофураном, 2 раза по 2 л метанолом и 2 раза по 2 л диэтиловым эфиром, затем высушивают при пониженном давлении при температуре около 50 С. Таким образом получают 1080,5 г диоксида кремния, обозначаемого как "С 11-С 3-диоксид кремния-O-Si(СН 3)2-(CH2)7 СН 3", в виде порошка белого цвета, структура которого подтверждена ИК-спектром и элементный анализ которого следующий (найдено): С%=12,6; Н%=2,44; N % = 1,05. В трехгорлой колбе емкостью 6 л суспендируют 1080 г диоксида кремния "С 11-С 3(диоксид кремния)-O-Si(СН 3)2-(СН 2)7-СН 3", в 2500 см 3 диметилформамида, высушенного над молекулярным ситом 4 . Добавляют 108 г Nбензоил-3,5-динитро-L-фенилаланина и 75 г Nэтоксикарбонил-2-этокси-1,2-дигидрохинолина. Реакционную смесь перемешивают в течение ночи. Диоксид кремния отфильтровывают на фриттированном стекле, затем промывают 2 раза по 2500 см 3 дихлорметаном, 2 раза по 2500 см 3 тетрагидрофураном, 2500 см 3 диметилформамида и 2500 см 3 дихлорметана. Таким образом промытый диоксид кремния снова суспендируют в 2500 см 3 диметилформамида. Добавляют последовательно 108 г N-бензоил-3,5 динитро-L-фенилаланина и 75 г N-этоксикарбонил-2-этокси-1,2-дигидрохинолина, затем перемешивают в течение ночи при 20 С. Диоксид кремния отфильтровывают на фриттированном стекле и промывают последовательно 2 раза по 2500 см 3 дихлорметаном, 2 раза по 2500 см 3 тетрагидрофураном, 2 раза по 2500 см 3 метанолом и 2 раза по 2500 см 3 диэтиловым эфиром. После высушивания при 60 С и при пониженном давлении (20 мм рт. ст.; 2,7 кПа,) получают 1093,6 г диоксида кремния, обозначаемого как-O-Si(СН 3)2(СН 2)7 СН 3", в виде порошка бледножелтого цвета, структура которого подтверждена ИК-спектром и элементный анализ которого следующий (найдено): С% = 14,5; Н% = 2,4; N%= 1,68. В трехгорлой колбе емкостью 4 л суспендируют 519 г диоксида кремния "DNB-L-PheС 11-С 3 (диоксид кремния)-O-Si(СН 3)2(СН 2)7 СН 3" в 3000 см 3 диметилформамида, высушенного над молекулярным ситом 4 . Добавляют 450 см 3 триметилсилилимидазола в течение 15 мин,затем перемешивают в течение ночи. Диоксид кремния отфильтровывают и промывают последовательно два раза по 1500 см 3 тетрагидрофураном, 2 раза по 1500 см 3 метанолом, 2 раза по 1500 см 3 ацетоном и 2 раза по 1500 см 3 дихлорметаном. После высушивания при температуре 60 С и при пониженном давлении (2,7 кПа) получают 519 г диоксида кремния, обозначаемого как "DNB-L-Phe-С 11-С 3 (диоксид кремния) - [OSi(СН 3)2(CH2)7 СН 3]-[O-Si(СН 3)3", в виде бледножелтого порошка, структура которого подтверждена ИК-спектром и элементный анализ кото 000797N-трет-бутоксикарбонил-11 аминоундекановой кислоты может быть получен следующим образом: 30,1 г N-третбутоксикарбонил-11-аминоундекановой кислоты растворяют в 480 см 3 этилацетата. Этот раствор охлаждают до температуры 5 С, затем, при поддерживании этой температуры, в течение 10 мин добавляют раствор 10,63 г дициклогексилкарбодиимида в 120 мл этилацетата. Реакционную смесь перемешивают в течение 1 ч при 5 С затем в течение 16 ч при температуре около 20 С. Выпавший осадок отфильтровывают и промывают его с помощью 30 см 3 этилацетата. Фильтрат концентрируют досуха при пониженном давлении (20 мм рт. ст.; 2,7 кПа) при температуре 30 С. Полученное твердое вещество высушивают при температуре 20 С и при пониженном давлении (20 мм рт. ст.; 2,7 кПа). Таким образом получают, с выходом около 100%, 31 г ангидрида N-трет-бутоксикарбонил-11-аминоундекановой кислоты.N-трет-Бутоксикарбонил-11-аминоундекановая кислота может быть получена следующим образом. В трехгорлую колбу емкостью 4 л, снабженную механической мешалкой и обратным холодильником, вводят последовательно 160 г 11-аминоундекановой кислоты, 2 л диоксана,1,3 л дистиллированной воды, 208 г карбоната натрия и 173 г ди-трет-бутилдикарбоната. Реакционную смесь кипятят в течение 16 ч. Таким образом получают прозрачный раствор. После охлаждения до 20 С реакционную смесь выливают на 800 г льда, затем подкисляют до рН=3-4 путем добавления 4 н. соляной кислоты. Таким образом получают осадок белого цвета, который отфильтровывают, промывают с помощью 300 см 3 воды и сушат при 20 С и при пониженном давлении (20 мм рт. ст.; 2,7 кПа). Таким образом получают, с выходом 95%, 232 г N-третбутоксикарбонил-11-аминоундекановой кислоты, т.пл. которой (68 С) согласуется с температурой плавления, указанной в J. Org. Chem., 41,1350 (1976). Пример 32. Из 1 г (3 ммоль) метилового эфира (3aRS,4SR, 9SR, 9aRS)-4,9-этано-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-уксусной кислоты, 947 мг (3,6 ммоль) гидрохлорида 2-(3 пирролидинилпропил)оксифенилуксусной кислоты, который может быть получен согласно европейскому патенту С 514 275, 690 мг (3,6 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 40 мг (0,3 ммоль) гидроксибензотриазола в виде раствора в 20 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С, получают сырой продукт в виде осадка. Выпавший осадок отсасывают и промывают водой, затем снова суспендируют в 25 см 3 воды и 25 см 3 этилацета 45 та. 3 начение рН суспензии доводят до 8 путем добавления 1 н раствора гидроксида натрия. После декантации органической фазы, водную фазу экстрагируют 2 раза по 20 см 3 этилацетатом. Объединенные органические фазы промывают водой, сушат над сульфатом магния и концентрируют досуха при пониженном давлении. Таким образом получают 1,63 г (94%) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-[2-(3 пирролидинилпропил)-оксифенил]ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в виде порошка белого цвета со следующими характеристиками: т. пл. = 118 С, масс-спектр (десорбционнохимическая ионизация:NН 3): м/е =579 (МН+). Из 1,60 г (2,77 ммоль) метилового эфира(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-[2-(3-пирролидинилпропил)-оксифенил]ацетил-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-уксусной кислоты в 55 см 3 1 н. раствора гидроксида натрия и 55 см 3 этанола при кипячении с обратным холодильником в течение 4-х ч, после концентрирования досуха при пониженном давлении, получают остаток, который обрабатывают с помощью 10 см 3 ледяной воды и 5 см 3 1 н. соляной кислоты. Таким образом полученный гидрохлорид экстрагируют 3 раза по 50 см 3 дихлорметаном. Объединенные органические фазы промывают 2 раза по 5 см 3 ледяной водой, сушат над сульфатом магния и концентрируют досуха при пониженном давлении. Путем перекристаллизации из смеси дихлорметана с диэтиловым эфиром (1:1 по объему) получают 1,24 г (75%) гидрохлорида (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2[2-(3-пирролидинилпропил)оксифенил]-ацетил 9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо-[f] изоиндол-3 а-карбоновой кислоты в виде кристаллов белого цвета со следующими характеристиками: т. пл. = 135 С, масс-спектр (десорбционно-химическая ионизация:NН 3): м/е = 565(R)-2-(2-метоксифенил)пропановой кислоты,которая может быть получена согласно европейскому патенту 0 430 771, 1,15 г (6 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 68 мг (0,5 ммоль) гидроксибензотриазола в виде раствора в 20 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С, получают смесь диастереоизомеров, которые разделяют путем высокоэффективной жидкостной хроматографии (давление 9 бар) на силикагеле (12 мкм),элюируя смесью циклогексана с этилацетатом(8:2 по объему). Таким образом последовательно получают: 670 мг (27%) диастереоизомера А метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-2-(R)-2-(2-метоксифенил)пропаноил-9 000797 46 фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]-изоиндол-3 а-карбоновой кислоты в виде порошка белого цвета со следующими характеристиками: т. пл. = 82 С, вращательная способность []36520= - 20,30,6, (с = 0,5; дихлорметан), массспектр (электронный удар) : м/е= 495 (М+). 690 мг (30%) диастереоизомера Б метилового эфира (3aRS,4SR,9SR,9aRS)-4,9-этано-2(R)-2-(2-метоксифенил)-пропаноил-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо-[f]изоиндол 3 а-карбоновой кислоты в виде порошка белого цвета со следующими характеристиками: т. пл.= 162, вращательная способность []36520 = 480,53,9, (с = 0,5; дихлорметан). Следуя методике примера 2, из 570 мг(1,15 ммоль) диастереоизомера А метилового эфира (3aRS,4SR,9SR,9aRS)-4,9-этано-2-(R)-2(2-метоксифенил)пропаноил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в 14,4 см 3 0,1 н. раствора гидроксида натрия и 14,4 см 3 этанола, при кипячении с обратным холодильником в течение 18 ч, после кристаллизации из диизопропилового эфира,получают 410 мг (76%) диастереоизомера A(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(R)-2-(2 метоксифенил)пропаноил-9-фенил-2,3,3 а,4,9,9 агексагидро-1H-бензо[f]изоиндол-3 а-карбоновой кислоты в виде кристаллов белого цвета со следующими характеристиками: т. пл. = 231 С,вращательная способность []36520 = - 28,40,7, (с = 0,5; дихлорметан), масс-спектр (десорбционно-химическая ионизация:NН 3): м/е= 482 (MH+). Пример 34. Из 1,24 г (3,7 ммоль) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-9 фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты, 800 мг (4,44 ммоль)(S)-2-(2-метоксифенил)пропановой кислоты, которая может быть получена согласно европейскому патенту 0 430 771, 850 мг (4,44 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 50 мг (0,37 ммоль) гидроксибензотриазола, растворенных в 20 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С, получают диастереоизомеры, которые разделяют путем высокоэффективной жидкостной хроматографии (5 бар) на силикагеле (12 мкм), элюируя смесью циклогексана с этилацетатом (8:2 по объему). Таким образом последовательно получают: 880 мг (48%) диастереоизомера А метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2(S)-2-(2-метоксифенил)-пропионил-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]-изоиндол 3 а-карбоновой кислоты в виде порошка белого цвета со следующими характеристиками: т. пл. 47 860 мг (47%) диастереомера Б метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(S)-2(2-метоксифенил)-пропионил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]-изоиндол-3 акарбоновой кислоты в виде порошка белого цвета со следующими характеристиками: т. пл.= + 478,3 4,1, (с = 0,5; дихлорметан). Из 720 мг (1,45 ммоль) диастереомера Б метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-2-(S)-2-(2-метоксифенил)пропионил-9 фенил-2,3,3 а,4,9,9 а-гексагидро-1H-бензо[f]изоиндол-3 а-карбоновой кислоты в 18 см 3 0,1 н. раствора гидроксида натрия и 18 см 3 этанола,при кипячении с обратным холодильником в течение 18 ч, после кристаллизации из диизопропилового эфира, получают 510 мг (76%) диастереоизомера Б (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-2-(S)-2-(2-метоксифенил)пропионил-9 фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо [f]изоиндол-3 а-карбоновой кислоты в виде кристаллов белого цвета со следующими характеристиками: т. пл. = 160 С, вращательная способность(0,28 ммоль) гидроксибензотриазола, растворенных в 100 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С, получают кристаллы, которые отфильтровывают и промывают 2 раза по 2 см 3 ледяным дихлорметаном. Таким образом получают 1,13 г[f]изоиндол-3 а-карбоновой кислоты в виде порошка белого цвета со следующими характеристиками: т. пл. = 230 С, масс-спектр (электронный удар): м/е = 569 (М+). Из 600 мг (1,05 ммоль) метилового эфира(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-(5-бром-3 индолил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в 13,2 см 3 0,1 н. раствора гидроксида натрия и 13,2 см этанола, при кипячении с обратным холодильником в течение 18 ч, после перекристаллизации из этилацетата, получают 150 мг(26%) (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(5 бром-3-индолил)-ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]-изоиндол-3 а-карбоновой кислоты в виде кристаллов белого цвета со следующими характеристиками: т. пл. = 262 С,масс-спектр (электронный удар): м/е = 555 (М+).(1949), 320 мг (1,65 ммоль) гидрохлорида 1 этил-3-(3-диметиламинопропил)-карбодиимида и 20 мг (0,15 ммоль) гидроксибензотриазола,растворенных в 20 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и очистки путем флешхроматографии на силикагеле (70-230 меш),элюируя смесью циклогексана с этилацетатом(4:6 по объему), получают 640 мг (83%) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2(2,3-диметоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в виде порошка белого цвета со следующими характеристиками: т. пл. = 196197 С, масс-спектр (электронный удар): м/е = 511 (М+). Из 320 мг (0,625 ммоль) метилового эфира(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(2,3-диметоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в 12,5 см 3 1 н раствора гидроксида натрия и 12,5 см 3 этанола, при кипячении с обратным холодильником в течение 6 ч, после кристаллизации из диизопропилового эфира, получают 150 мг (50%) (3aRS, 4SR, 9SR, 9aRS)-4,9-этано 2-(2,3-диметоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в виде кристаллов белого цвета со следующими характеристиками: т. пл. = 230 С, масс-спектр (электронный удар): м/е = 497 (М+). Пример 37. К охлажденной до температуры 0 С суспензии 3,2 г (19 ммоль) (2 метоксифенил)уксусной кислоты и 0,9 г (30 ммоль) параформальдегида, очень медленно и при поддерживании температуры ниже 5 С добавляют 40 см 3 концентрированной соляной кислоты. Доводят температуру до значения около 20 С и перемешивают в течение 18 ч. Реакционную смесь выливают на 200 г льда и экстрагируют 3 раза по 200 см 3 этилацетатом. Объединенные органические фазы промывают водой,сушат над сульфатом магния и концентрируют досуха при пониженном давлении. После очистки с помощью флеш-хроматографии на силикагеле (70-230 меш), элюируя смесью циклогексана с этилацетатом, получают 2,5 г (61%) (2 метокси-5-хлорметилфенил)уксусной кислоты в виде бледно-желтого порошка, характеристики которой следующие: т. пл. = 75-78 С. Из 2 г (6 ммоль) метилового эфира (3aRS,4SR, 9SR, 9aRS)-4,9-этано-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты, 1,54 г (7,2 ммоль) (2-метокси-5 хлорметилфенил)уксусной кислоты, 1,38 г (7,2 ммоль) гидрохлорида 1-этил-3-(3-диметил 49 аминопропил)карбодиимида и 81 мг (0,6 ммоль) гидроксибензотриазола в виде раствора в 20 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С и очистки путем флеш-хроматографии на силикагеле (70-230 меш), элюируя смесью циклогексана с этилацетатом (3:7 по объему), получают 2,92 г (92%) метилового эфира (3aRS,4SR,9SR,9aRS)-4,9 этано-2-(2-метокси-5-хлорметилфенил)ацетил 9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f] изоиндол-3 а-карбоновой кислоты, которая содержит небольшое количество 5-гидроксиметилированного производного. К раствору 2,9 г (примерно 5,4 ммоль) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-2-(2-метокси-5-хлорметилфенил)ацетил 9-фенил-2,3,3 а,4,9,9 а-гексагидро-1H-бензо[f] изоиндол-3 а-карбоновой кислоты, полученного выше, в 25 см 3 диметилформамида и 25 см 3 диоксана добавляют 960 мг (6 ммоль) этилксантата калия, затем перемешивают в течение 24-х ч при температуре около 20 С. После концентрирования досуха при пониженном давлении, остаток вносят в 100 см 3 ледяной воды. Выпавший осадок светло-бежевого цвета отсасывают, затем снова растворяют в 100 см 3 этилацетата. Органическую фазу промывают водой до тех пор, пока промывные воды не станут совершенно прозрачными. После высушивания над сульфатом магния и концентрирования досуха при пониженном давлении получают 2,73 г (96%) порошка, представляющего собой по существу метиловый эфир (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-2-(2-метокси-5-меркаптометилфенил) ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты в виде дисульфида. Из 2,72 г (2,6 ммоль) дисульфида метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2(2-метокси-5-меркапто-метилфенил)ацетил-9 фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f] изоиндол-3 а-карбоновой кислоты, полученного выше, в 5,2 см 3 1 н. раствора гидроксида натрия и 25 см 3 этанола, при кипячении с обратным холодильником в течение 12 ч, после очистки путем флеш-хроматографии на силикагеле (70230 меш), элюируя смесью дихлорметана с этилацетатом (1:1 по объему), затем путем препаративной хроматографии на пластине из диоксида кремния, элюируя смесью дихлорметана с этилацетатом и уксусной кислотой (19:80:1 по объему), получают 180 мг (7%) дисульфида(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(2-метокси 5-меркаптометилфенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в виде порошка белого цвета,характеристики которого следующие: т.пл. = 140 С. ИК-спектр (в таблетке с КВr): основные характеристические полосы поглощения, выраженные в см-1: 3065 и 3022 (n СН ароматические); 2952 и 2874 (na и nas CH2); 2387 (n СН от(g СН монозамещенного фенила). Пример 38. К раствору 25 г (0,15 моль) 2 метоксифенилуксусной кислоты в абсолютном этаноле медленно добавляют 13,5 см 3 (0,18 моль) тионилхлорида. Смесь перемешивают в течение 3-х ч при температуре кипения с обратным холодильником. После концентрирования досуха получают 30 г (100%) этилового эфира 2 метоксифенилуксусной кислоты в виде жидкости со следующими характеристиками: массспектр (электронный удар): м/е =180 (М+). 24 г (0,12 моль) этилового эфира 2 метоксифенилуксусной кислоты, 5,2 г (0,17 моль) параформальдегида, 0,68 г (1,84 ммоль) тетрабутиламмонийиодида и 28,9 г (0,21 моль) карбоната калия в толуоле кипятят с обратным холодильником в течение 20 ч. После промывки дистиллированной водой, растворитель удаляют путем концентрирования досуха. Получают 19 г(90%) этилового эфира 2-(2-метоксифенил)акриловой кислоты в виде жидкости со следующими характеристиками: масс-спектр (электронный удар): м/е= 192 (М+). Из 6 г (29 ммоль) этилового эфира 2-(2 метоксифенил) акриловой кислоты в 58 см 3 (58 ммоль) 1 н. раствора гидроксида натрия при кипячении с обратным холодильником в течение 4-х ч, после подкисления реакционной смеси и отфильтровывания выпавшего осадка, получают 3,4 г (66%) 2-(2-метоксифенил)акриловой кислоты со следующими характеристиками: т. пл.= 144 С, масс-спектр (электронный удар): м/е = 178 (М+). Из 4,1 г (12,3 ммоль) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоновой кислоты, 2 г (11,2 ммоль) 2-(2 метоксифенил)акриловой кислоты, 2,36 г (12,3 ммоль)гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 0,17 г (1,12 ммоль) гидроксибензотриазола в дихлорметане при перемешивании в течение 24-х ч при комнатной температуре, после очистки путем флешхроматографии на силикагеле (70-230 меш),элюируя смесью циклогексана с этилацетатом(60:40 по объему), получают 3,1 г (56%) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано 2-[2-(2-метоксифенил)проп-2-ен-1-оил]-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в виде меренги со следующими характеристиками: т. пл. = 8085 С, масс-спектр (десорбционно-химическая ионизация:NН 3): м/е = 494 (МН+). Из 3 г (6,08 ммоль) метилового эфира 51 кислоты в 7,5 см 3 (7,30 ммоль) 1 н раствора гидроксида натрия и этанола при кипячении с обратным холодильником, после подкисления реакционной смеси с помощью 1 н. соляной кислоты, получают масло, которое высаливают и экстрагируют этилацетатом. Органическую фазу промывают дистиллированной водой, сушат,затем концентрируют досуха при пониженном давлении. Таким образом получают 2,5 г (86%)(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-[2-(2-метоксифенил)проп-2-ен-1-оил]-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]-изоиндол-3 а-карбоновой кислоты со следующими характеристиками: т. пл. = 102-108 С. 1CH2CH2); 3,25-3,65 (м, 3 Н: СН 2 в положении 1 и Н в положении 9 а); 3,43 (м, 1 Н: Н в положении 4); 3,60 и 4,05 (соответственно, д и уш.д, J = 12,5 Гц, 1 Н каждый: СН 2 в положении 3); 3,72 (с, 3 Н: ОСН 3); 5,53 и 5,66 (2 уш. с, 1 Н каждый: =CH2); 6,42 (уш. д, J = 7,5 Гц, 1 Н: Н в положении 8); 6,90 (уш.т, J = 7,5 Гц, 1 Н: Н ароматический в пара-положении к ОСН 3); 7,00-7,10 (м, 2 Н: Н ароматический в орто-положении к ОСН 3 и Н в положении 7); 7,10-7,60 (м, 9 Н: Н ароматические в мета-положении к ОСН 3, Н в положении 5, Н в положении 6 и Н ароматические фенила в положении 9). Пример 39. 5,2 г (10,34 ммоль) (3aRS, 4SR,9SR,9aRS)-4,9-этано-2-[2-(2-метоксифенил) проп-2-ен-1-оил]-9-фенил-1,2,3,3 а,9,9 агексагидро-1 Н-бензо [f]изоиндол-3 а-карбоновой кислоты расщепляют на колонке с хиральным диоксидом кремния, содержащим за счет прививки (3,5-динитробензил)фенилаланин, элюируя с помощью смеси дихлорметана с изопропанолом и н-гептаном (85:10:5 по объему). Собирая вторую элюируемую фракцию (время удерживания = 21,8 мин), получают 2,25 г (3aS,4R, 9R, 9aS) -4,9-этано-2-[2-(2-метоксифенил) проп-2-ен-1-оил]-9-фенил-1,2,3,3 а,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты, правовращающий энантиомер, в виде кристаллов белого цвета со следующими характеристиками: т. пл. = 155 С, вращательная способность [а]D20 = + 70,11,3, (с = 0,5; дихлорметан), масс-спектр (десорбционно-химическая ионизация:NН 3): м/е = 480 (МН+). Пример 40. К раствору 10 г (0,04 моль) бензилового эфира (2-гидроксифенил)уксусной кислоты в тетрагидрофуране добавляют 8,25 см 3(0,04 моль) изопропанола. Смесь кипятят с обратным холодильником в течение 3-х ч, затем промывают дистиллированной водой. Органическую фазу сушат над сульфатом магния. После отфильтровывания растворитель выпаривают при пониженном давлении. Полученный остаток хроматографируют на силикагеле, элюи 000797 52 руя смесью циклогексана с этилацетатом (99:1 по объему). Получают 4,6 г (40%) бензилового эфира (2-изопропоксифенил)уксусной кислоты в виде жидкости со следующими характеристиками: масс-спектр (электронный удар): м/е = 284 (М+). 2,8 г (9,86 ммоль) бензилового эфира (2 изопропоксифенил)уксусной кислоты в 100 см 3(0,1 моль) 1 н. раствора гидроксида натрия кипятят с обратным холодильником в течение 15 ч. После подкисления реакционную смесь экстрагируют этилацетатом, сушат над сульфатом магния, затем отфильтровывают. После выпаривания растворителя при пониженном давлении получают 1,76 г (92%) (2-изопропоксифенил) уксусной кислоты в виде масла со следующими характеристиками: масс-спектр (электронный удар): м/е = 194 (М+). Из 1,5 г (4,5 ммоль) метилового эфира(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(2-изопропилоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в виде твердого вещества белого цвета,характеристики которого следующие: т. пл. = 135-136 С,масс-спектр(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(2-изопропилоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в 3,8 см 3 (3,8 ммоль) 1 н. раствора гидроксида натрия получают 891 мг (94%) (3aRS,4SR, 9SR, 9aRS)-4,9-этано-2-(2-изопропилоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро 1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты со следующими характеристиками: т. пл. = 260 С,масс-спектр (L.S.I.): м/е = 496 (МН+). Пример 41. К суспензии 9,4 г (42,7 ммоль) триметилсульфоксонийиодида в диметилсульфоксиде в атмосфере аргона порциями добавляют 1,22 г (42,7 ммоль) гидрида натрия. 3 атем добавляют раствор 8 г (38,8 ммоль) этилового эфира 2-(2-метоксифенил)акриловой кислоты в диметилсульфоксиде. Реакционную смесь перемешивают при температуре около 20 С в течение 2,5 ч. После гидролиза с помощью дистиллированной воды, экстракции этилацетатом,высушивания над сульфатом магния и выпаривания растворителя при пониженном давлении,остаток хроматографируют на силикагеле (70230 меш), элюируя смесью циклогексана с этилацетатом (95:5 по объему.). Таким образом получают 4,8 г (56%) этилового эфира 1-(2 метоксифенил)циклопропан-1-карбоновой кислоты в виде масла со следующими характеристиками: масс-спектр (десорбционно-химическая ионизация: NН 3): м/е = 221 (МН+). 53 4,8 г (21,8 ммоль) этилового эфира 1-(2 метоксифенил)циклопропан-1-карбоновой кислоты в 33 см 3 (32,7 ммоль) 1 н. раствора гидроксида натрия кипятят с обратным холодильником в течение 4-х ч. После подкисления реакционной смеси и отфильтровывания выпавшего осадка,получают 3,2 г(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоновой кислоты и 1,5 г (7,8 ммоль) 1- (2 метоксифенил)-циклопропан-1-карбоновой кислоты в дихлорметане получают 2,5 г (63%) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-2-[1-(2-метоксифенил)циклопропан-1 оил]-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты в виде твердого вещества белого цвета со следующими характеристиками: т. пл. = 162 С, масс-спектр(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-[1-(2-метоксифенил)циклопропан-1-оил]-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]-изоиндол 3 а-карбоновой кислоты и 3,8 см 3 (3,8 ммоль) 1 н. раствора гидроксида натрия получают 800 мг(82%) (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-[1-(2 метоксифенил)циклопропан-1-оил]-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоновой кислоты в виде твердого вещества белого цвета со следующими характеристиками: т. пл. = 146 С, масс-спектр (десорбционно-химическая ионизация:NН 3): м/е = 494(МН+). Пример 42. В раствор 1 г (5,62 ммоль) 2-(2 метокси-фенил)акриловой кислоты, полученной в условиях, описанных в примере 38, в дихлорметане при температуре -75 С и в течение 3,5 ч пропускают путем барботирования ток озона. Добавляют 1,66 см 3 (22,5 ммоль) диметилсульфида и продолжают перемешивать при повышении температуры примерно до 20 С. После концентрирования досуха реакционной смеси получают 0,7 г (69%) (2-метоксифенил) оксоуксусной кислоты в виде кристаллов со следующими характеристиками: масс-спектр (электронный удар): м/е= 180 (М+). Из 1,26 г (3,78 ммоль) метилового эфира(2-метоксифенил) оксоуксусной кислоты в дихлорметане получают 1,3 г (76%) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-[2-(2 метоксифенил)-2-оксоацетил]-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в виде твердого вещества белого цвета со следующими характеристиками: т. пл.(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-[2-(2 метоксифенил)-2-оксоацетил]-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоновой кислоты и 1,6 см 3 (1,6 ммоль) 1 н. раствора гидроксида натрия получают 168 мг= 482 (МН+). Пример 43. При температуре около 20 С в течение 1 ч перемешивают раствор 2 г (6 ммоль) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9 этано-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты и 6 г(6 ммоль) ди-трет-бутилдикарбоната в дихлорметане. После выпаривания растворителя полученный остаток кристаллизуют из петролейного эфира. Получают 2,3 г (87%) метилового эфира(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-9-фенил-2(трет-бутоксикарбонил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в виде кристаллов со следующими характеристиками: т. пл. = 142 С, масс-спектр (десорбционно-химическая ионизация:NН 3),м/е:434(MH+). При температуре около 20 С перемешивают 2,2 г (5 ммоль) метилового эфира (3aRS,4SR, 9SR, 9aRS)-4,9-этано-9-фенил-2-(третбутоксикарбонил)-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изoиндoл-3a-кapбoнoвoй кислоты и 1,29 г (5 ммоль) йода в дихлорметане. При температуре 0 С добавляют 2,29 г (5,25 ммоль) бистрифторацетоксииодбензола и смесь выдерживают при температуре 0 С в течение 1 ч. После гидролиза с помощью дистиллированной воды экстракции этилацетатом, высушивания над сульфатом магния и выпаривания растворителя при пониженном давлении, полученный остаток хроматографируют на силикагеле (70-230 меш),элюируя смесью циклогексана с этилацетатом(90:10 по объему). Таким образом получают 0,9 г (31,6%) метилового эфира (3aRS, 4SR, 9SR,9aRS)-4,9-этано-7-иод-9-фенил-2-(трет-бутоксикарбонил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в виде белой меренги со следующими характеристиками: 1 Н-ЯМР-спектр (250 мГц, (CD3)2SO-d6, при температуре 110 С,в м.д.): 1,47 (с, 9 Н: С(СН 3)3); 1,45, 1,78, 2,00-2,20 (3 м, соответственно, 1 Н, 1 Н и 2 Н: CH2CH2); 3,20-3,40 (м, 3 Н: СН 2 в положении 1 и Н в положении 9 а); 3,48 и 4,01[f]изоиндол-3 а-карбоновой кислоты в виде белой меренги со следующими характеристиками: 1CH2 в положении 3); 6,25 (уш.д, J = 7,5 Гц, 1 Н: Н в положении 8); 7,25-7,60 (м, 7 Н: Н в положении 5, Н в положении 7 и Н ароматические фенила в положении 9). При температуре около 20 С и в течение 24-х ч перемешивают раствор в метаноле 235 мг[f]изоиндол-3 а-карбоновой кислоты с большим избытком 5 н раствора хлороводорода в метаноле. После выпаривания растворителя получают 200 мг (100%) гидрохлорида метилового эфира(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-7-иод-9 фенил-2,3,3 а,4,9,9 а-гексагидро-бензо[f]изоиндол-3 а-карбоновой кислоты в виде твердого вещества белого цвета со следующими характеристиками: масс-спектр(десорбционнохимическая ионизация:NН 3): м/е= 560 (МН+). Из 0,4 г (0,8 ммоль) гидрохлорида метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-7 иод-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо(0,96 ммоль) (2-метоксифенил)уксусной кислоты в дихлорметане получают 0,26 г (53%) метилового эфира (3aRS, 4SR, 9SR, 9aRS)-4,9-этано 7-иод-2-(2-метоксифенил)-ацетил-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]-изоиндол 3 а-карбоновой кислоты в виде твердого вещества белого цвета со следующими характеристиками: масс-спектр (десорбционно-химическая ионизация:NН 3): м/е =608(МН+). Из 260 мг (0,43 ммоль) метилового эфира(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-7-иод-2-(2 метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты и 0,42 см 3 (0,42 ммоль) 1 н раствора гидроксида натрия получают 200 мг (80%)(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-7-иод-2-(2 метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты со следующими характеристиками: т. пл. выше 260 С. 1H-ЯMP-cпeктp (250 мГц, (CD3)2SO-d6, с добавкой нескольких капель СD3CООD-d4, при температуре 110 С, в м.д.): 1,40, 1,65 и 1,80 000797CH2CH2;); 3,30-3,65 (м, 7 Н: СН 2 в положении 1,COCH2Ar, 1H от СН 2 в положении 3, Н в положении 4 и Н в положении 9 а); 3,72 (с, 3 Н: ОСН 3), 4,18 (д, J = 12,5 Гц, 1H: другой Н от CH2 в положении 3), 6,72 (уш.с, 1H: Н в положении 8); 6,85-7,00 (м, 2 Н: Н ароматические в орто- и пара-положении к ОСН 3), 7,07 (уш.д., J = 7,5 Гц,1H: Н в положении 5); 7,15-7,35 (м, 2 Н: Н ароматические в мета-положении к ОСН 3); 7,357,70 (м, 6 Н: Н в положении 6 и Н ароматические фенила в положении 9). Пример 44. К раствору 332 г (0,69 ммоль) правовращающего энантиомера (3aRS, 4SR,9SR,9aRS)-4,9-этано-2-[2-(2-метоксифенил) проп-2-ен-1-оил]-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в дихлорметане добавляют 66,5 мг (0,30 ммоль) гидрохлорида метоксиамина, 133 мг (0,69 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида, 10,6 мг (0,069 ммоль) гидроксибензотриазола и 0,1 см 3 (0,80 ммоль) триэтиламина. Реакционную смесь перемешивают при температуре около 20 С в течение 24 ч, промывают 0,1 н. соляной кислотой, затем дистиллированной водой. После высушивания и концентрирования досуха органической фазы получают сырой продукт, который перекристаллизуют из смеси пентана с метанолом. Таким образом получают 63 мг (18%) (3aRS, 4SR,9SR, 9aRS)-N-метокси-4,9-этано-2-[2-(2-метоксифенил) проп-2-ен-1-оил]-9-фенил-2, 3, 3 а, 4,9, 9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоксамида в виде твердого вещества белого цвета,характеристики которого следующие: т. пл. 160-162 С,масс-спектр(3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро 1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты в дихлорметане добавляют 0,41 г (2,6 ммоль) гидрохлорида O-бензилгидроксиламина, 0,48 г (2,6 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида, 29 мг (0,214 ммоль) гидроксибензотриазола и 0,36 см 3 (2,6 ммоль) триэтиламина. Следуя методике примера 44,получают 0,83 г (68%) (3aRS, 4SR, 9SR, 9aRS)N-бензилокси-4,9-этано-2-(2-метоксифенилацетил)-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоксамида в виде твердого вещества белого цвета со следующими характеристиками: т. пл. = 188 С, масс-спектр (десорбционно-химическая ионизация:NН 3): м/е = 573(3aRS, 4SR, 9SR, 9aRS)-N-бензил-окси-4,9 этано-2-(2-метоксифенилацетил)-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоксамида, полученного в условиях примера 45, в 40 см 3 этанола в присутствии 75 мг 10%-ного (по массе) палладия-на-угле переме 57 шивают в присутствии водорода при атмосферном давлении, при температуре 20 С и в течение 2-х ч. После отфильтровывания, затем промывки катализатора этанолом, фильтрат концентрируют досуха при пониженном давлении. После очистки путем флеш-хроматографии на силикагеле (70-230 меш), элюируя смесью дихлорметана с метанолом (90:10 по объему) и после перекристаллизации из смеси диизопропилового эфира с этанолом получают 0,34 г(54%) (3aRS, 4SR, 9SR, 9aRS)-4,9-этано-2-(2 метоксифенилацетил)-9-фенил-2,3,3 а,4,9,9 агексагидро-1H-бензо[f]изоиндол-3 а-карбогидроксамовой кислоты в виде твердого вещества белого цвета со следующими характеристиками: т. пл. = 234 С, масс-спектр (L.S.I.): м/е = 483(МН+). Пример 47. 3,7 г (3aRS, 4SR, 9SR, 9aRS)4,9-этано-2-[(2-метоксифенилацетил]-9-фенил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоновой кислоты, полученной в условиях примера 2, расщепляют путем хроматографии на колонке с хиральным диоксидом кремния,содержащим за счет прививки 3,5-динитробензилфенилаланин, приготовленным в условиях, аналогичных таковым, описанным в европейском патенте 0 625 153, элюируя смесью дихлорметана с пропан-2-олом и н-гептаном(30:5:65 по объему). Путем концентрирования фракций, содержащих второй элюируемый продукт, получают 1,4 г 4,9-этано-2-[(2-метоксифенил)ацетил]-9-фенил-2,3,3 а(S), 4(R), 9(R),9 а(S)-гексагидро-1H-бензо[f]изоиндол-3 а-карбоновой кислоты со следующими характеристиками: т. пл. = 115 С, вращательная способность(0,04 ммоль) гидроксибензотриазола, в виде раствора в 5 см 3 дихлорметана, после перемешивания в течение 20 ч при температуре около 20 С, декантации, промывки органической фазы 2 раза по 10 см 3 соляной кислотой, 3 раза по 10 см 3 водой, высушивания над сульфатом магния,затем концентрирования при пониженном давлении, получают 200 мг (87%) метилового эфира N-[4,9-этано-2-(2-метоксифенил) ацетил-9 фенил-2,3, 3 а(S), 4(R), 9(R), 9 а(S)-гексагидро 1 Н-бензо[f]изоиндол-3 а-ил]карбонил-глицина в виде желтого масла. 200 мг (0,37 ммоль) метилового эфира N[4,9-этано-2-(2-метоксифенил)ацетил-9-фенил 2,3, 3 а(S), 4(R), 9(R), 9 а(S)-гексагидро-1 Н-бензо 58 воды, 18,6 см 3 этанола и 0,22 см 3 30 мас.%-ного раствора гидроксида натрия кипятят с обратным холодильником в течение 3 ч. После удаления этанола при пониженном давлении, раствор подкисляют с помощью 0,3 см 3 соляной кислоты (d = 1,18), затем экстрагируют 2 раза по 30 см 3 дихлорметаном. После декантации и промывки 3 раза по 10 см 3 водой, органическую фазу сушат над сульфатом магния, затем концентрируют при пониженном давлении. Полученный остаток очищают путем препаративной хроматографии на пластине из силикагеля,элюируя смесь дихлорметана с метанолом(80:20 по объему). Таким образом получают 85 мг (45%) N-[4,9-этано-2-(2-метоксифенил) ацетил-9-фенил-2,3, 3 а(S), 4(R), 9(R), 9 а(S)-гексагидро-1H-бензо[f]изоиндол-3 а-ил]-карбонилглицина в виде порошка белого цвета со следующими характеристиками: т. пл. = 150 С, вращательная способность []D20 = + 90, (с = 1; метанол), масс-спектр (десорбционно-химическая ионизация:NН 3): м/е = 525 (МН+). Пример 49. Из 1,5 г (3,2 ммоль) (3aRS,4SR, 9SR, 9aRS)-4,9-этано-2-(2-метоксифенил) ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изoиндoл-3a-кapбoнoвoй кислоты, 0,7 г(3,85 ммоль) гидрохлорида трет-бутилового эфира N-метилглицина, 0,5 см 3 (3,85 ммоль) триэтиламина, 0,74 г (3,85 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 0,04 г (0,3 ммоль) гидроксибензотриазола,растворенных в 40 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С, декантации, промывки органической фазы 2 раза по 100 см 3 водой, высушивания над сульфатом магния, затем концентрирования при пониженном давлении, получают остаток, который очищают путем флешхроматографии на силикагеле (70-230 меш),элюируя смесью дихлорметана с метанолом(99:1 по объему). Таким образом получают 1 г 50%-ного трет-бутилового эфира (3aRS, 4SR,9SR,9aRS)-N-[4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-ил]-карбонил-N-метилглицина в виде белого порошка. 700 мг (1,18 ммоль) трет-бутилового эфира(3aRS, 4SR, 9SR, 9aRS)-N-[4,9-этано-2-(2 метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-ил]карбонил-N-метилглицина в 12 см 3 этанола и 17,5 см 3 0,1 н. раствора гидроксида натрия кипятят с обратным холодильником в течение 4-х ч. После удаления этанола при пониженном давлении,раствор подкисляют с помощью 1 н. соляной кислоты, затем экстрагируют с помощью 50 см 3 этилацетата. После промывки путем декантации с помощью 20 см 3 воды органическую фазу сушат над сульфатом магния, после чего концентрируют при пониженном давлении. Полученный остаток порошкуют в 20 см 3 петролейного эфира. Таким образом получают 455 мг (72%)(3aRS, 4SR, 9SR, 9aRS)-N-[4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-ил]карбонил-Nметилглицина в виде порошка белого цвета со следующими характеристиками: т. пл. = 198 С,масс-спектр (L.S.I.): м/е = 539 (МН+). Пример 50. Из 830 мг (1,88 ммоль) (3aRS,4SR, 9SR, 9aRS)-4,9-этано-2-(2-метоксифенил) ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты, 3,16 г(0,188 ммоль) гидроксибензотриазола, растворенных в 30 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С, промывки органической фазы путем декантации 2 раза по 30 см 3 водой и высушивания ее над сульфатом магния, затем концентрирования при пониженном давлении, получают твердый остаток, который очищают путем перекристаллизации из этилацетата. Получают 540 мг(50%) метил-(3aRS, 4SR, 9SR, 9aRS)-N-[4,9 этано-2-(2-метоксифенил)-ацетил-9-фенил-2, 3,3 а, 4, 9, 9 а-гексагидро-1 Н-бензо [f]изоиндол-3 аил]карбонил-3-аминопропаноата в виде порошка белого цвета. 540 мг (0,98 ммоль) метил-(3aRS, 4SR,9SR,9aRS)-N-[4,9-этано-2-(2-метоксифенил) ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изoиндoл-3a-ил]карбонил-3-аминопропаноата в 20 см 3 этанола и 9,3 см 3 0,1 н. раствора гидроксида натрия кипятят с обратным холодильником в течение 6 ч. После удаления этанола при пониженном давлении, раствор подкисляют с помощью 1 н. соляной кислоты, затем экстрагируют с помощью 20 см 3 этилацетата. После промывки путем декантации с помощью 20 см 3 воды органическую фазу сушат над сульфатом магния, затем концентрируют при пониженном давлении. Полученное твердое вещество очищают путем перекристаллизации из этанола. Таким образом получают 230 мг(45%) (3aRS, 4SR, 9SR, 9aRS)-N-[4,9-этано-2-(2 метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-ил]-карбонил-3-аминопропановой кислоты в виде порошка белого цвета со следующими характеристиками: т. пл. = 150 С, масс-спектр (десорционнохимическая ионизация:NН 3): м/е = 539 (МН+). Пример 51. Из 1,5 г (3,2 ммоль) (3aRS,4SR, 9SR, 9aRS)-4,9-этано-2-(2-метоксифенил) ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изoиндoл-3a-кapбoнoвoй кислоты, 0,76 г(3,85 ммоль) гидрохлорида метилового эфира Lметионина, 0,54 мл (3,85 ммоль) триэтиламина,0,74 г (3,85 ммоль) гидрохлорида 1-этил-3-(3 диметиламинопропил)карбодиимида и 0,043 г 60 20 С, промывки органической фазы путем декантации 2 раза по 50 см 3 водой и высушивания ее над сульфатом магния, затем концентрирования при пониженном давлении, получают остаток,который очищают путем флешхроматографии на силикагеле (70-230 меш),элюируя смесью дихлорметана с метанолом(99:1 по объему). Таким образом получают 0,86 г (45%) метилового эфира (3aRS, 4SR, 9SR,9aRS)-N-[4,9-этано-2-(2-метоксифенил)-ацетил 9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-ил]карбонил-L-метионина в виде порошка белого цвета со следующими характеристиками: т. пл. = 192 С. 0,86 г (1,4 ммоль) метилового эфира (3aRS,4SR, 9SR, 9aRS)-N-[4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро 1 Н-бензо[f]изоиндол-3 а-ил]-карбонил-L-метионина в 16 см 3 этанола и 21,5 см 3 0,1 н. раствора гидроксида натрия в течение 3-х ч кипятят с обратным холодильником. После удаления этанола при пониженном давлении, раствор подкисляют с помощью 1 н. соляной кислоты, затем экстрагируют с помощью 100 см 3 этилацетата. После промывки путем декантации органической фазы с помощью 50 см 3 воды, ее сушат над сульфатом магния, затем концентрируют при пониженном давлении, получая 0,54 г (60%)(3aRS, 4SR, 9SR, 9aRS)-N-[4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1H-бензо[f]изоиндол-3 а-ил]карбонил-Lметионина в виде порошка белого цвета со следующими характеристиками: т. пл. = 196 С,масс-спектр (десорбционно-химическая ионизация:NН 3): м/е = 599 (МН+). Пример 52. Из 1,5 г (3,2 ммоль) (3aRS,4SR, 9SR, 9aRS)-4,9-этано-2-(2-метоксифенил) ацетил-9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты, 1 г(3,9 ммоль) гидрохлорида метилового эфира Sбензилцистеина, 0,53 см 3 (3,8 ммоль) триэтиламина, 0,73 г (3,8 ммоль) гидрохлорида 1-этил-3(3-диметиламинопропил)карбодиимида и 0,043 г (0,32 ммоль) гидроксибензотриазола, растворенных в 60 см 3 дихлорметана, после перемешивания в течение 18 ч при температуре около 20 С, промывки путем декантации органической фазы 2 раза по 50 см 3 водой, высушивания ее над сульфатом магния, затем концентрирования при пониженном давлении, получают остаток, который очищают путем флеш-хроматографии на силикагеле (70-230 меш), элюируя этил ацетатом. Таким образом получают 0,72 г(33%) метилового эфира (3aRS, 4SR, 9SR,9aRS)-N-[4,9-этано-2-(2-метоксифенил)ацетил 9-фенил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f] изоиндол-3 а-ил] карбонил-S-бензил-L-цистеина в виде меренги белого цвета. 0,5 г (0,74 ммоль) метилового эфира (3aRS,4SR, 9SR, 9aRS)-N-[4,9-этано-2-(2-метоксифенил)ацетил-9-фенил-2, 3, 3 а, 4, 9, 9 а-гексагидро 1 Н-бензо[f]изоиндол-3 а-ил]-карбонил-S-бензил
МПК / Метки
МПК: A61K 31/40, C07F 9/572, C07D 209/72
Метки: ингибиторы, фарнезилтрансферазы, новые, получения, содержащая, способы, фармацевтическая, композиция
Код ссылки
<a href="https://eas.patents.su/30-797-novye-ingibitory-farneziltransferazy-sposoby-ih-polucheniya-i-soderzhashhaya-ih-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">Новые ингибиторы фарнезилтрансферазы, способы их получения и содержащая их фармацевтическая композиция</a>
Предыдущий патент: Способ т1 – взвешенной магниторезонансной визуализации органов ретикуло-эндотелиальной системы
Следующий патент: Способ получения метилмеркаптана
Случайный патент: Кристаллическая калиевая соль аналогов липоксина а4












