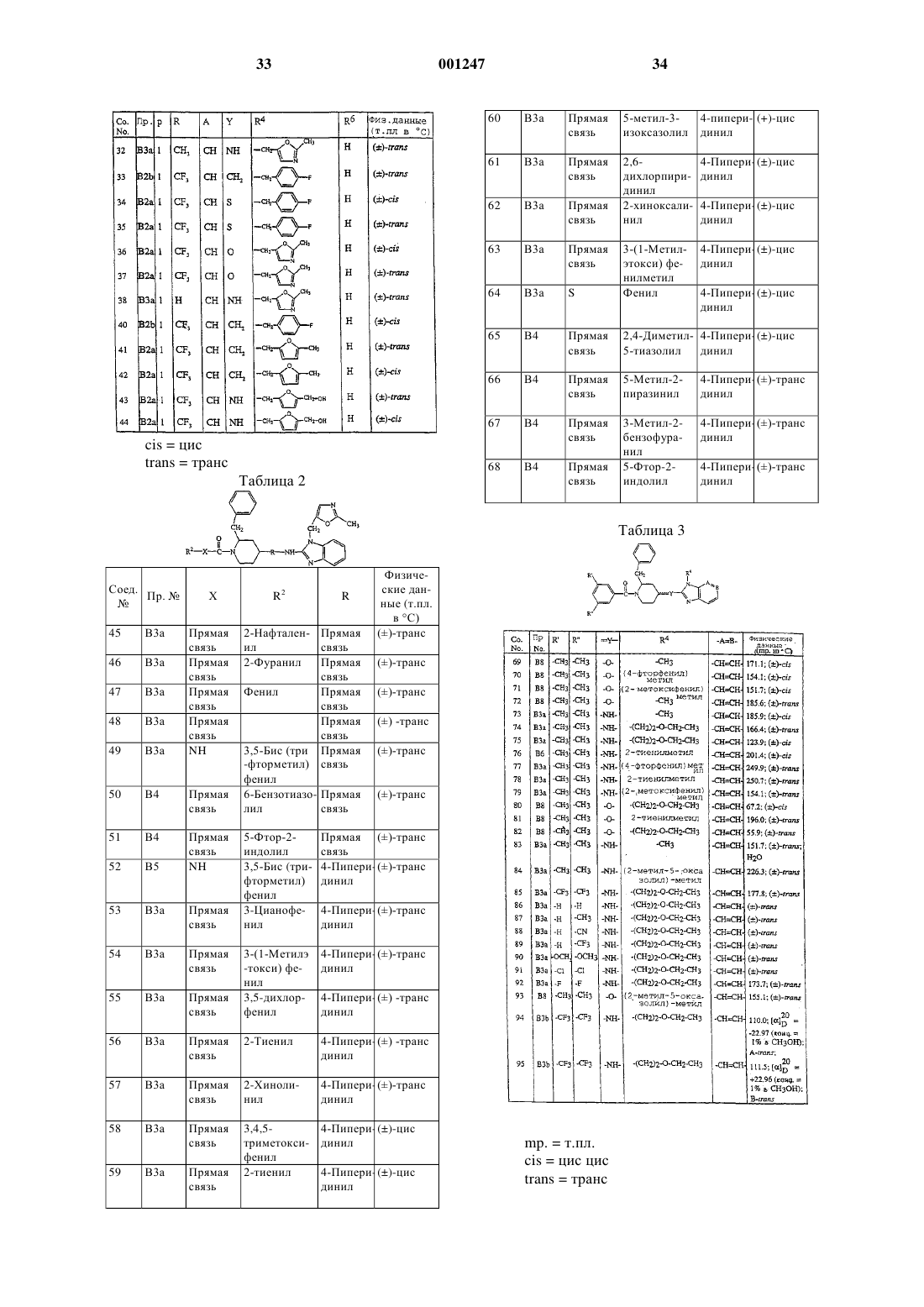
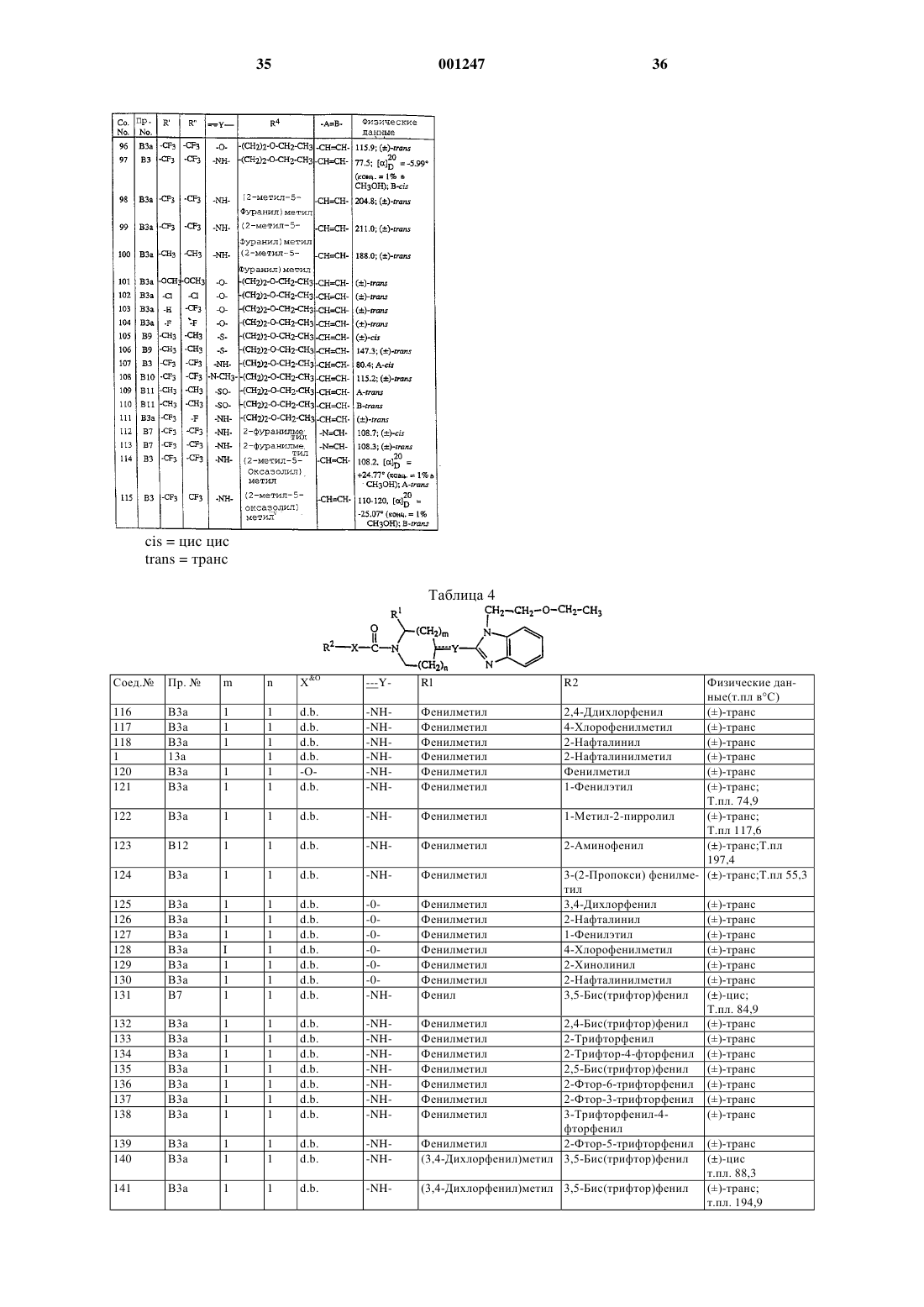
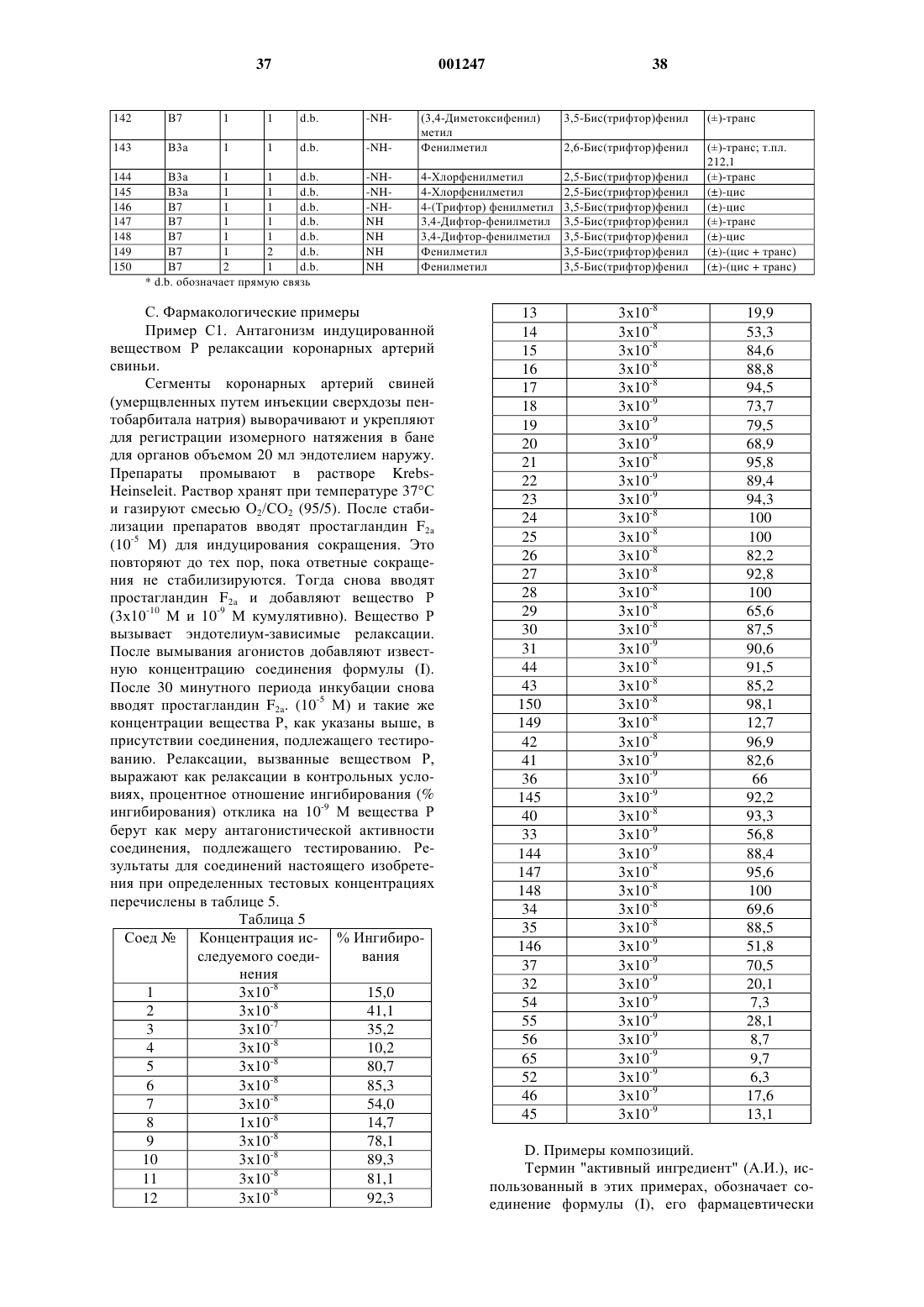
N-ацил-2-замещенный-4-(бензимидазолил- или имидазопиридинил -замещенные остатки)-пиперидины как антагонисты тахикинина.
Номер патента: 1247
Опубликовано: 25.12.2000
Авторы: Сюрлеро Доминик Луи Нестор Гилейн, Соммен Франсуа Мария, Жансенс Франс Эдуард, Ленартс Йозеф Элизабет
Формула / Реферат
1. Соединение формулы
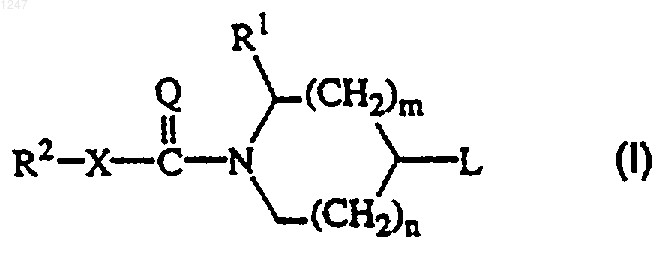
его N-оксидная форма, фармацевтически приемлемая соль присоединения и стереохимически изомерная форма, где
n равно 0, 1 или 2;
m равно 1 или 2 при условии, что если m равно 2, то n равно 1;
Х является ковалентной связью или бивалентным радикалом формулы -О-, -S-, -NR3-;
=Q является =O или =NR3;
R1 является Аr1, Аr1 C1-6 алкилом или ди(Аr1) C1-6 алкилом, где C1-6 алкильная группа необязательно замещена гидроксилом, C1-4 алкилокси-заместителем, оксо-заместителем или кетализованным оксо-заместителем формулы: -О-СН2-СН2-О- или -О-СН2-СН2-СH2-О-;
R2 является Аr2, Ar2 C1-6 алкилом, Het или HetC1-6 алкилом;
L является радикалом формулы:
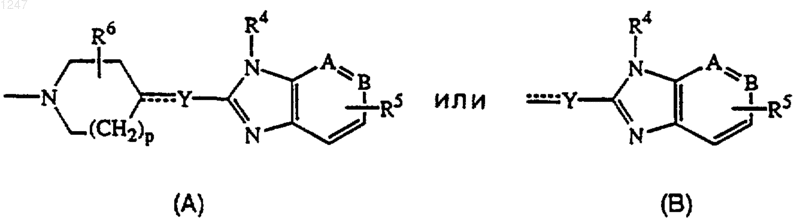
где р равно 0, 1 или 2;
---У- является бивалентным радикалом формулы: -СН2-, -СН(ОН)-, -С(=O)-, -О-, -S-, -S(=O)-, -S(=O)2-, -NR3-, -CH2-NR3- или -C(=O)-NR3-; или трехвалентным радикалом формулы =СН-;
-А=В- является бивалентным радикалом формулы -СН=СН-, -N=CH- или -CH=N-;
R3 независимо является водородом или C1-6 алкилом;
R4 является водородом, C1-6 алкилом; С3-7 циклоалкилом или радикалом формулы
-Alk-R7- (с-1) или
-Alk-Z-R8- (c-2);
где Alk является C1-6 алкандиилом;
Z является бивалентным радикалом формулы -О-, -S- или -NR3-; R7 является фенилом, фенилом, замещенным 1 или 2 заместителями, выбранными из галогена, C1-6 алкила или C1-6 алкилоксигруппы; фуранилом; фуранилом, замещенным 1 или 2 заместителями, выбранными из C1-6 алкила или гидрокси С1-6 алкила; тиенилом; тиенилом, замещенным 1 или 2 заместителями, выбранными из галогена или С1-6 алкила; оксазолилом; оксазолилом, замещенным 1 или 2 C1-6 алкильными заместителями; тиазолилом; тиазолилом, замещенным 1 или 2 C1-6 алкильными заместителями; пиридинилом или пиридинилом, замещенным 1 или 2 C1-6 алкильными заместителями;
R8 является C1-6 алкилом или C1-6 алкилом, замещенным гидроксилом, карбоксилом или C1-6 алкилоксикарбонилом;
R5 является водородом, галогеном, гидроксилом или C1-6 алкилоксигруппой;
R6 является водородом, C1-6 алкилом или Ar1C1-6 алкилом;
Аr1 является фенилом; фенилом, замещенным 1, 2 или 3 заместителями, каждый из которых независимо выбирают из галогена, C1-4 алкила, галоген-С1-4 алкила, цианогруппы, аминокарбонила, C1-4 алкилоксигруппы, галоген-С1-4 алкилокси-группы;
Аr2 является нафталинилом; фенилом; фенилом, замещенным 1, 2 или 3 заместителями, каждый из которых независимо выбирают из гидроксила, галогена, цианогруппы, нитро-группы, аминогруппы, моно- или ди(C1-4 алкил)аминогруппы, С1-4 алкила, галоген-C1-4 алкила, С1-4 алкилоксигруппы, галоген-C1-4 алкилоксигруппы, карбоксила, С1-4 алкилоксикарбонила, аминокарбонила и моно- или ди(C1-4 алкил)аминокарбонила; и
Het является моноциклическим гетероциклом, выбранным из пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила, изокса-золила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклическим гетероциклом, выбранным из хинолинила, хиноксалинила, индолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила и бензотиенила; каждый моноциклический и бициклический гетероцикл может быть необязательно замещен по атому углерода 1 или 2 заместителями, выбранными из галогена, С1-4 алкила или моно-, ди- или три (галоген) метила.
2. Соединение по п.1, где L является радикалом формулы (А), и Het является моноциклическим гетероциклом, выбранным из пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклическим гетероциклом, выбранным из хинолинила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила и бензотиенила; каждый моноциклический и бициклический гетероцикл может быть необязательно замещен по атому углерода 1 или 2 заместителями, выбранными из галогена, С1-4 алкила или моно-, ди- или три(галоген)метила.
3. Соединение по п.1, где L является радикалом формулы (В) и Het является моноциклическим гетероциклом, выбранным из пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изо-тиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклическим гетероциклом, выбранным из хинолинила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазо-лила, бензизотиазолила, бензофуранила и бензотиенила; каждый моноциклический и бициклический гетеропикл может быть необязательно замещен по атому углерода 1 или 2 заместителями, выбранными из галогена, С1-4 алкила или моно-, ди- или три(галоген)метила.
4. Соединение по любому из пп. с 1 по 3, где L является радикалом формулы (А), и р равно 0 или 1.
5. Соединение по любому из пп. с 1 по 4, где L является радикалом формулы (В), n равно 1 или 2, и m равно 1 или 2 при условии, что если m равно 2, то n равно 1.
6. Соединение по любому из пп. с 1 по 5, где R1 является Аr1С1-6 алкилом, R2 является фенилом, замещенным 2 заместителями, выбранными из метила или трифторметила, Х является ковалентной связью, и =Q является =О.
7. Соединение по любому из пп. с 1 по 6, где ---У- является -NH- или -О-; -А=В- является -СН=СН- или -N=CH-; R4 является радикалом формулы (с-1), где R7 является оксазолилом, замещенным 1 или 2 C1-6 алкильными заместителями, фуранилом, замещенным С1-6 алкилом или гидрокси С1-6 алкилом; или R4 является радикалом формулы (с-2) , где Z является бивалентным радикалом формулы -О-, и R8 C1-6 aлкилом; R5 является водородом и R6 является водородом.
8. Соединение по п.1, отличающееся тем, что выбрано из
1-[3,5-бис(трифторметил)бензоил]-4-[4-[[1-(2-этоксиэтил)-1Н-бензимидазол-2-ил]амино]-1-пиперидинил]-2-(фенилметил) пиперидина;
1-[3,5-бис(трифторметил)бензоил]-4-[4-[[1-[(2-метил-5-оксазолил)метил]-1H-бензимидазол-2-ил]амино]-1-пиперидинил]-2-(фенилметил)пиперидина;
1-[3,5-бис(трифторметил)бензоил]-4-[4-[[3-(5-метил-2-фуранил)-3Н-имидазо[4,5-b]пиридин-2-ил]амино]-1-пиперидинил]-2-(фенил-метил)пиперидина;
1-[3,5-бис(трифторметил)бензоил]-4-[3-[[3-[(5-метил-2-фуранил) метил]-3Н-имидазо[4,5-b]пиридин-2-ил]амино]-1-пирролидинил]-2-(фенилметил)пиперидинa;
1-[3,5-бис(трифторметил)бензоил]-4-[4-[[1-[(5-метил-2-фуранил)метил]-1Н-бензимидазол-2-ил]амино]-1-пиперидинил]пиперидинa;
1-[3,5-бис(трифторметил)бензоил]-4-[[1-(2-этоксиэтил)-1Н-бензимидазол-2-ил]амино]-2-(фенилметил)пиперидинa;
1-[3,5-бис(трифторметил)бензоил]-4-[[1-[(2-метил-4-оксазолил)метил]-1Н-бензимида-
зол-2-ил]амино]-2-(фенилметил)пиперидина;
1-[3,5-бис(трифторметил)бензоил]-4-[[1-[(5-метил-2-фуранил)-метил)-1Н-бензимидазол-2-ил]амино]-2-(фенилметил) пиперидина,
а также их стереоизомерные формы и фармацевтически приемлемые соли присоединения кислоты.
9. Фармацевтическая композиция, отличающаяся тем, что включает фармацевтически приемлемый носитель и в качестве активного ингредиеэтр терапевтически эффективное количество соединения по любому из пп. с 1 по 8.
10. Способ получения композиции, заявленной в п.9, отличающийся тем, что фармацевтически приемлемый носитель тщательно смешивают с терапевтически эффективным количеством соединения по любому из пп. с 1 по 8.
11. Применение соединения, заявленного в любом из пп.1-8, в качестве лекарственного средства.
12. Способ получения соединения, заявленного в п.1, отличающийся тем, что включает:
а) реакцию промежуточного соединения формулы (II), где R2, Х и =Q определены как в п.1, и W1 является подходящей уходящей группой, с промежуточным соединением формулы (III):
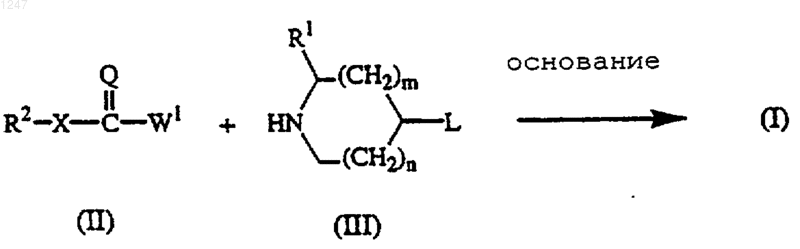
где n, m, L и R определены, как в п.1, в реакционно-инертном растворителе и в присутствии подходящего основания;
б) восстановительное N-алкилирование промежуточного соединения формулы (V), где р, ---У-, -А=В-, R4, R5 и R6 определены, как в п.1, с промежуточным соединением формулы (IV):
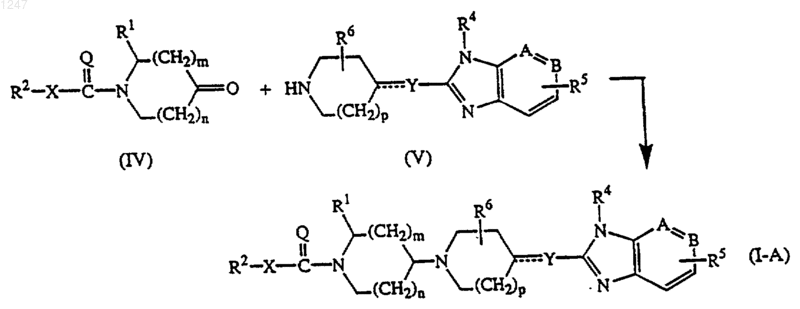
где R1, R2, X, Q, n и m определены, как в п.1, в реакционно-инертном растворителе и в присутствии восстановителя и необязательно в присутствии подходящего катализатора; с получением соединения формулы (I-A);
в) восстановительное N-алкилирование промежуточного соединения формулы (VI), где -А=В-, R3, R4 и R5 определены, как в п.1, с промежуточным соединением формулы (IV):
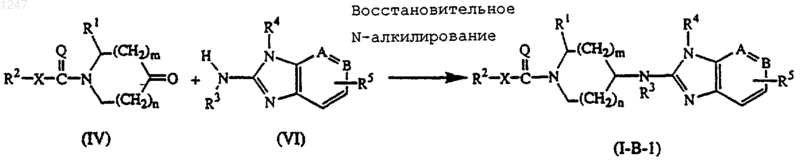
где R1, R2, X, Q, n и m определены, как в пункте 1, в реакционно-инертном растворителе и в присутствии восстановителя и необязательно в присутствии подходящего катализатора; с получением соединения формулы (I-B-1);
г) реакцию промежуточного соединения формулы (VII), где R1, R2, R3, X, Q, n и m определены как в п.1, с промежуточным соединением формулы (VIII):
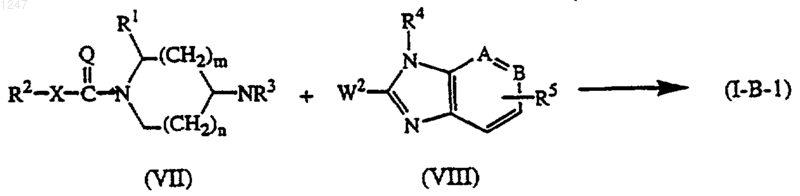
где W2 является подходящей уходящей группой, и -А=В-, R4 и R5 определены как в п.1, в присутствии подходящего катализатора и необязательно в реакционно-инертном растворителе; с получением соединения формулы (I-B-1);
д) реакцию промежуточного соединения формулы (IX), где W3 является подходящей уходящей группой, и R1, R2, X, Q, n и m определены как в п.1, с промежуточным соединением формулы (X):
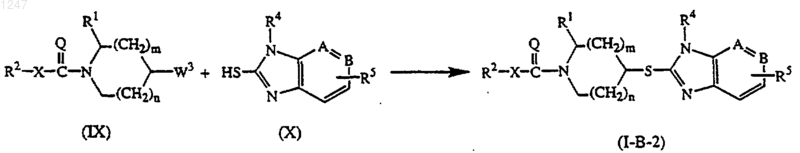
где -А=В-, R4 и R5 определены как в п.1, в реакционно-инертном растворителе и в присутствии подходящего основания; с получением соединения формулы (I-B-2);
е) реакцию промежуточного соединения формулы (XI), где R1, R2, X, Q, n и m определены как в п.1, с промежуточным соединением формулы (VIII):
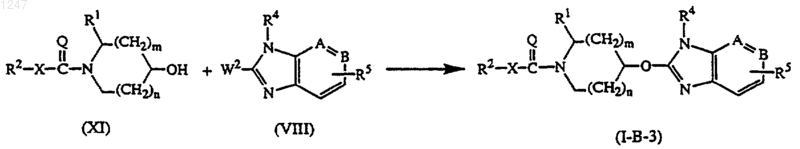
где W2 является подходящей уходящей группой, и -А=В-, R4 и R5 определены как в п.1, в реакционно-инертном растворителе и в присутствии подходящего основания; с получением соединения формулы (I-B-3);
и, если требуется, превращение соединений формулы (I) друг в друга, следуя известным в уровне техники процедурам; и, кроме того, если требуется, превращение соединений формулы (I) в терапевтически активные нетоксические соли присоединения кислоты посредством обработки кислотой, или в терапевтически активные нетоксические соли присоединения основания посредством обработки основанием; или превращение соли присоединения кислоты в свободное основание посредством обработки щелочью; или превращение соли присоединения основания в свободную кислоту посредством обработки кислотой; и, если требуется, получение их стереохимически изомерных форм или N-оксидов.
Текст
1 Настоящее изобретение касается (бензимидазолил- и имидазопиридинил) содержащих 1-(1,2-дизaмещенный пиперидинил) производных, обладающих активностью антагонистов тахикинина, в частности активностью антагонистов вещества Р, и способа их получения; кроме того, оно касается включающих их композиций,а также их применения в качестве лекарственных препаратов. Вещество Р является природным нейропептидом семейства тахикинина. Многие исследования показывают, что вещество Р и другие тахикинины участвуют в ряде биологических действий и, следовательно, играют существенную роль в различных нарушениях (Regoli и др.,Pharmacological Reviews 46(4), 1994, стр.551599, "Receptors and Antagonists for Substance Pand Related Peptides"). Разработка антагонистов тахикинина привела к появлению ряда пептидных соединений, от которых можно было ожидать, что они слишком лабильны метаболически для использования в качестве фармацевтически активных веществ (Longmore J. и др., DNP 8(1), февраль 1995, стр. 5-23, "Neurokinin Receptors"). Настоящее изобретение касается непептидных антагонистов тахикинина, в частности непептидных антагонистов вещества Р, которые в основном более стабильны метаболически и, следовательно, могут быть более подходящими в качестве фармацевтически активных веществ. В прототипах раскрыто несколько непептидных антагонистов тахикинина. Например,Европейский Патент ЕР-0 532 456-А, опубликованный 17 марта 1993, раскрывает 1-ацилпиперидиновые соединения, в частности производные 2-арилалкил-1-арилкарбонил-4-пиперидинамина, и их применение в качестве антагонистов вещества Р. Европейские патенты ЕР-0 151 824-А и ЕР 0 151 826-А раскрывают структурно родственные производные N-(бензимидазолил- и имидазопиридинил)-1-(1-(карбонил или имино)-4 пиперидинил)- 4-пиперидинамина как антагонисты гистамина и серотонина. Производные 1 карбонил-4-(бензимидазолил- и имидазопиридинил)пиперидина, все обладающие антигистаминной и противоаллергической активностью,раскрыты также в ЕР-А-232 937, ЕР-А-282 133,ЕР-Д-297 661, ЕР-А-539 421, ЕР-А-539 420, WO 92/06086 и WО 93/14083. Настоящие соединения отличаются от соединений прототипов по своей структуре и преимущественными фармакологическими характеристиками. Следовательно, настоящее изобретение касается новых соединений формулы 2 их N-оксидных форм, фармацевтически приемлемых солей присоединения и стереохимически изомерных форм, где n равно 0, 1 или 2;m равно 1 или 2, при условии, что, если m равно 2, то n равно 1; Х является ковалентной связью или бивалентным радикалом формулы -О-, -S-, -NR3-;R1 является Ar1, Ar1 C1-6 алкилом или ди(Аr1)С 1-6 алкилом, где каждая С 1-6 алкильная группа необязательно замещена гидроксилом,С 1-4 алкилокси-заместителем, оксо-заместителем или кетализованным оксо-заместителем формулы: -O-CH2-CH2-О- или -O-CH2-CH2-CH2-O-;Y - является бивалентным радикалом формулы -CH2-,-СН(ОН)-, -С(=O)-, -О-, -S-,-S(=O)-, -S(=O)2-, -NR3-, -CH2-NR3- или -С(=O)NR3-; или трехвалентным радикалом формулы-А=В- является бивалентным радикалом формулы -СН=СН-, -N=CH- или -CH=N-;R3 независимо является водородом или C1-6 алкилом;R4 является водородом, C1-6 алкилом; С 3-7 циклоалкилом или радикалом формулыZ является бивалентным радикалом формулы -О-, -S- или -NR3- ;R7 является фенилом; фенилом, замещенным 1 или 2 заместителями, выбранными из галогена, C1-6 алкила или C1-6 алкилоксигруппы; фуранилом; фуранилом, замещенным 1 или 2 заместителями, выбранными из C1-6 алкила или гидрокси C1-6 алкила; тиенилом; тиенилом, замещенным 1 или 2 заместителями, выбранными из галогена или C1-6 алкила; оксазолилом; оксазолилом, замещенным 1 или 2 C1-6 алкильными заместителями; тиазолилом; тиазолилом, замещенным 1 или 2 C1-6 алкильными заместителями; пиридинилом; пиридинилом, замещенным 1 или 2 C1-6 алкильными заместителями;R6 является водородом, C1-6 алкилом или 1 Аr C1-6 алкилом; Аr1 является фенилом; фенилом, замещенным 1, 2 или 3 заместителями, каждый из которых независимо выбирают из галогена, C1-4 ал 3 кила, галоген-С 1-4 алкила, цианогруппы, аминокарбонила, C1-4 алкилоксигруппы или галогенС 1-4 алкилоксигруппы; Аr2 является нафталинилом; фенилом; фенилом, замещенным 1, 2 или 3 заместителями,каждый из которых независимо выбирают из гидроксила, галогена, цианогруппы, нитрогруппы, аминогруппы, моно- или ди(С 1-4 алкил) аминогруппы, C1-4 алкила, галоген-С 1-4 алкила, C1-4 алкилоксигруппы, галоген-С 1-4 алкилоксигруппы, карбоксила, C1-4 алкилоксикарбонила, аминокарбонила и моно- или ди(С 1-4 алкил) аминокарбонила; иHet является моноциклическим гетероциклом, выбранным из пирролила, пиразолила,имидазолила, фуранила, тиенила, оксазолила,изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклическим гетероциклом, выбранным из хинолинила, хиноксалинила, индолила,бензимидазолила, бензоксазолила, бензизоксазолила,бензотиазолила,бензизотиазолила, бензофуранила и бензотиенила; каждый моноциклический и бициклический гетероцикл может быть необязательно замещен по атому углерода 1 или 2 заместителями, выбранными из галогена, C1-4 алкила или моно-, ди- или три(галоген)метила. Гетероциклы в определении Het предпочтительно присоединены к остатку молекулы, то есть X, -С (=Q) - или C1-6 алкилу, через атом углерода. В предыдущих определениях и здесь далее использованы следующие обозначения: галоген является общим обозначением для фтора, хлора,брома и йода; C1-4 алкил обозначает линейные или разветвленные насыщенные углеводородные радикалы, имеющие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил,бутил, 1-метилэтил, 2-метилпропил и подобные; имеют в виду, что C1-6 алкил включает C1-4 алкил и его более высокие гомологи, имеющие от 5 до 6 атомов углерода, такие как, например, пентил,2-метилбутил, гексил, 2-метилпентил и подобные; C1-4 алкандиил обозначает бивалентные линейные или разветвленные насыщенные углеводородные радикалы, имеющие от 1 до 4 атомов углерода, такие как, например, метилен,1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил и подобные; считают, что C1-6 алкандиил включает C1-4 алкандиил и его высшие гомологи,имеющие от 5 до 6 атомов углерода, такие как,например, 1,5-пентандиил, 1,6-гександиил и подобные. В предыдущих определениях и далее в данном описании галоген-C1-4 алкил определяют как моно- или полигалогензамещенный C1-4 алкил, в частности, C1-4 алкил, замещенный 1-6 атомами галогена, более конкретно дифтор- или трифторметил. Считают, что упомянутые здесь выше фармацевтически приемлемые соли присоеди 001247 4 нения включают терапевтически активные нетоксические соли присоединения кислоты, которые способны образовывать соединения формулы (I). Указанные соли можно легко получить посредством обработки основной формы соединений формулы (I) подходящими кислотами,например неорганическими кислотами, такими как галогенводородные кислоты, например соляная или бромисто-водородная кислота; серная; азотная; фосфорная и подобные кислоты; или органическими кислотами, такими как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая,малоновая, янтарная, малеиновая, фумаровая,яблочная, винная, лимонная, метансульфоновая,этансульфоновая, бензолсульфоновая, паратолуолсульфоновая, цикламовая, салициловая,пара-аминосалициловая, памоевая и подобные кислоты. Считают также, что указанные выше фармацевтически приемлемые соли присоединения включают терапевтически активные нетоксические основания, в частности соли присоединения металла или амина, которые способны образовывать соединения формулы (I). Указанные соли можно легко получить посредством обработки соединений формулы (I), содержащих кислые атомы водорода, подходящими органическими или неорганическими основаниями,такими как, соли аммония, соли щелочных или щелочно-земельных металлов, например, соли лития, натрия, калия, магния, кальция и подобные, соли органических оснований, например,соли бензатина, N-метил-D-глюкамина, гидрабамина (hydrabamine), и соли с аминокислотами,такими как, например, аргинин, лизин и подобные. Указанные соли можно перевести обратно в форму свободной кислоты или основания посредством обработки подходящим основанием или кислотой. Использованный здесь выше термин "соль присоединения" включает также сольваты, которые наряду с солями способны образовывать соединения формулы (I). Такими сольватами являются, например, гидраты, алкоголяты и подобные. Для выделения и очистки можно также использовать неприемлемые с фармацевтической точки зрения соли. Терапевтически применяют только фармацевтически приемлемые нетоксические соли, и,следовательно, такие соли являются предпочтительными. Использованный выше термин стереохимически изомерные формы обозначает все возможные изомерные, а также конформационные формы, которые могут иметь соединения формулы (I). Если не упомянуто или не указано по-другому, химические формулы соединений обозначают смеси, более конкретно, рацемические смеси возможных стереохимически и кон 5 формационно изомерных форм, указанные смеси содержат все диастереомеры, энантиомеры и/или конформеры основной молекулярной структуры. Конкретнее, стереогенные центры могут иметь R- или S-конфигурацию; заместители на бивалентных циклических насыщенных радикалах могут иметь либо цис-, либо трансконфигурацию; C=NR3 и С 3-6 алкенильные радикалы могут иметь Е-или Z-конфигурацию. Для соединений, имеющих два стереогенных центра, используют относительные стереодескрипторы R или S в соответствии с правиламиSelection Manual (CA), издание 1982 г., т. III,глава 20). Имеется в виду, что область настоящего изобретения охватывает все стереохимически изомерные формы соединений формулы(I) в чистом виде и в виде их смесей. Некоторые из соединений формулы (I) могут также существовать в таутомерной форме. Хотя такие формы не указаны отдельно в приведенной выше формуле, но подразумевают, что они входят в область настоящего изобретения. Например, соединения формулы (I), в которых Х является -NH, и =Q является =0, и соединения формулы (I), где Y- является -C(=О)=NH-,могут существовать в соответствующих таутомерных формах. Считают, что N-оксидные формы соединений формулы (I) включают такие соединения формулы (I), где один или несколько атомов азота окислены до, так называемого, N-оксида, в частности, те N-оксиды, в которых один или более пиперазиновых азотов являются Nокисленными. Подразумевают, что использованное здесь далее выражение соединение формулы (I) включает также N-оксидные формы, фармацевтически приемлемые соли присоединения и стереохимически изомерные формы. Важную группу соединений составляют те соединения формулы (I), где L является радикалом формулы (А), и Het является моноциклическим гетероциклом, выбранным из пирролила,пиразолила, имидазолила, фуранила, тиенила,оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклическим гетероциклом, выбранным из хинолинила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила и бензотиенила; каждый моноциклический и бициклический гетероцикл может быть необязательно замещен по атому углерода- 1 или 2 заместителями, выбранными из галогена, C1-4 алкила или моно-, ди- или три(галоген)метила. Другой важной группой соединений являются те соединения формулы (I), где L является радикалом формулы (В), и Het является моноциклическим гетероциклом, выбранным из пирролила, пиразолила, имидазолила, фуранила,тиенила, оксазолила, изоксазолила, тиазолила, 001247 6 изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклическим гетероциклом, выбранным из хинолинила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила и бензотиенила; каждый моноциклический и бициклический гетероцикл может быть необязательно замещен по атому углерода 1 или 2 заместителями, выбранными из галогена, C1-4 алкила или моно-, ди- или три(галоген)метила. Первая группа интересных соединений состоит из тех соединений формулы (I), к которым применимо одно или более из следующих ограничений: а) R1 является Аr1 или Аr1 C1-6 алкилом; или б) R2 является фенилС 1-6 алкилом; хинолинилом; хиноксалинилом; необязательно замещенным изоксазолилом; необязательно замещенным пиридинилом; необязательно замещенным тиазолилом; необязательно замещенным пиразинилом; необязательно замещенным бензофуранилом; бензотиазолилом; необязательно замещенным индолилом; необязательно замещенным пирролилом; тиенилом; фуранилом; нафталинилом; фенилом; фенилом, замещенным 1, 2 и 3 заместителями, каждый из которых независимо выбирают из аминогруппы, галогена,цианогруппы,C1-4 алкила,C1-4 алкилоксигруппы и галоген-С 1-4 алкила, в частности, из метила и трифторметила; или в) n равно-1 или 2; или г) m равно 1 или 2; или д) =Q является =О; или е) Х является ковалентной связью, -S-,-NH- или -О-. Вторая группа интересных соединений состоит из тех соединений формулы (I), в которых, У- является -NR3-, -CH2-, СН(ОН)-, -S-,-S(=O)- или -О-; -А=В- является -СН=СН- или-N=CH-; R4 является C1-6 алкилом; или R4 является радикалом формулы (с-1), где R7 является фенилом, замещенным галогеном или C1-6 алкокси; тиенилом; тиазолилом, необязательно замещенным C1-6 алкилом; оксазолилом, необязательно замещенным 1 или 2 C1-6 алкилами; фуранилом, необязательно замещенным C1-6 алкилом или гидроксиС 1-6 алкилом; или R4 является радикалом формулы (с-2), где Z является бивалентным радикалом формулы -О-, и R8 является C1-6 алкилом; R5 является водородом; иR6 является водородом или Аr1 C1-6 алкилом. Специальный интерес представляют те соединения формулы (I), в которых R1 является Аr1 C1-6 алкилом, R2 является фенилом, замещенным 2 заместителями, выбранными из метила или трифторметила, х является ковалентной связью, и =Q является =0. Кроме того, специальный интерес представляют те соединения формулы (I), в которыхL является радикалом формулы (А), и р равно 0 или 1. 7 Также специальный интерес представляют те соединения формулы (I), в которых L является радикалом формулы (В), n равно 1 или 2, и m равно 1 или 2 при условии, что если m равно 2,то n равно 1. Отдельная группа соединений состоит из соединений формулы (I), в которых R1 является фенилметилом; R2 является фенилом, замещенным 2 заместителями, выбранными из метила или трифторметила; m и n равны 1; Х является ковалентной связью и =Q является =О. Другая особая группа соединений состоит из соединений формулы (I), в которых У- является -NH- или -О-; -А=В-является -СН=СНили -N=CH-; R4 является радикалом формулы(с-1), где R7 является оксазолилом, замещенным 1 или 2 C1-6 алкильными заместителями, фуранилом, замещенным C1-6 алкилом или гидроксиС 1-6 алкилом; или R4 является радикалом формулы (с-2), где Z является бивалентным радикалом формулы -О-, и R8 является C1-6 алкилом; R5 является водородом; и R6 является водородом. Предпочтительными являются те соединения формулы (I), в которых R1 является фенилметилом; R2 является фенилом, замещенным 2 заместителями, выбранными из метила или трифторметила; n, m равны 1; Х является ковалентной связью; и =Q является =0; Y- является -NH-; -А=в- является -СН=СН- или -N=CH-;R4 является радикалом формулы (с-1), где Alk является метиленом; и R7 является оксазолилом,замещенным 1 или 2 метильными заместителями, фуранилом, замещенным метилом или гидроксиметилом; или R4 является радикалом формулы (с-2), где Alk является этандиилом; Z является бивалентным радикалом формулы -О-, и 1-[3,5-бис(трифторметил)бензоил]-4-1[(2-метил-4-оксазолил)метил]-1 Н-бензимидазол-2-ил]амино]-2-(фенилметил)пиперидин; 1-[3,5-бис(трифторметил)бензоил]-4-1[(5-метил-2-фуранил)метил]-1 Н-бензимидазол 2-ил]амино]-2-(фенилметил)пиперидин; их стереоизомерные формы и фармацевтически приемлемые соли присоединения кислоты. Соединения формулы (I) можно получить по реакции промежуточного соединения формулы (II) , где W1 является подходящей уходящей группой, такой как галоген, например, хлор или бром, или сульфонилоксигруппой, например, метансульфонилокси- или бензолсульфонилоксигруппой, с промежуточным продуктом формулы (III). Реакцию можно проводить в реакционно инертном растворителе, таком как хлорированный углеводород, например, дихлорметан, спирт, например, этанол, или кетон,например, метилизобутилкетон, и в присутствии подходящего основания, такого как, например,карбонат натрия, гидрокарбонат натрия или триэтиламин. Перемешивание может увеличивать скорость этой реакции. Реакцию удобно проводить при температуре в диапазоне между комнатной температурой и температурой кипения с обратным холодильником. По-другому, и в тех же условиях реакции промежуточный продукт формулы (II), где =Q является =O, можно заменить его функциональными производными, такими как, ангидриды,например, изатоевый ангидрид, получая, таким образом, соединения формулы (I), где Q является кислородом, при этом указанные соединения представлены формулой (I-1). В этом и следующих способах получения продукты реакции можно выделить из реакционной смеси и, если необходимо, затем очистить согласно известным специалистам методикам, например, способами экстракции, кристаллизации, растирания и хроматографии. Соединения формулы (I), где L является радикалом формулы (А), представлены как (IA), их можно получить путем восстановительного N-алкилирования промежуточного продукта формулы (V) промежуточным продуктом формулы (IV). Указанное восстановительное Nалкилирование можно проводить в реакционно инертном растворителе, таком как, например,дихлорметан, этанол, толуол или их смесь, и в присутствии восстановителя, такого как боргидрид, например боргидрид натрия, цианборгидрид натрия или триацетоксиборгидрид. В случае использования в качестве восстановителя боргидрида, может быть удобно применять такой катализатор как, например, изопропилат 9 титана (IУ), как описано в J. Org. Chem., 1990,55, 2552-2554. Использование указанного катализатора также может приводить в результате к улучшенному цис/транс соотношению с преобладанием транс-изомера. Также может быть удобно использовать в качестве восстановителя водород в комбинации с подходящим катализатором, таким как палладий на угле или платина на угле. В случае использования в качестве восстановителя водорода может быть полезно добавлять к реакционной смеси дегидратирующий агент, такой как, например, трет-бутоксид алюминия. Для предотвращения нежелательного дальнейшего гидрирования определенных функциональных групп в реагентах и продуктах реакции может также быть полезно добавлять к реакционной смеси подходящий катализаторный яд, например тиофен или хинолинсеру. Перемешивание и произвольно повышенная температура и/или давление могут увеличивать скорость этой реакции. Соединения формулы (I), где L является радикалом формулы (В) и Y- является -NR3-,представлены как (I-B-1), их можно получить путем восстановительного N-алкилирования промежуточного продукта формулы (VI) промежуточным продуктом формулы (IV). Указанное восстановительное N-алкилирование можно проводить аналогичным образом, как восстановительное N-алкилирование, описанное выше. По-другому, соединения формулы (I-B-1) можно также получить по реакции промежуточного соединения формулы (VII) с промежуточным соединением формулы (VIII), где W2 является подходящей уходящей группой, такой как галоген, например, хлор, в присутствии подходящего катализатора, например, меди. Реакцию можно проводить в реакционно-инертном растворителе, таком как N,N-диметилформамид. Однако удобно проводить указанную реакцию без растворителя при температуре немного выше точки плавления реагентов. Перемешивание повышает скорость этой реакции. Соединения формулы (I), где L является радикалом формулы (В), и Y- является -S-,представлены формулой (I-B-2), их можно по 001247 10 лучить по реакции промежуточного продукта формулы (IX), где W3 является подходящей уходящей группой, такой как сульфонилоксигруппа, например, метансульфонилокси- или бензолсульфонилоксигруппа, с промежуточным продуктом формулы (X). Указанную реакцию можно проводить, применяя аналогичную процедуру реакции, как при получении соединений формулы (I) из промежуточных соединений (II) и (III). Соединения формулы (I), где L является радикалом формулы (В) и У- является -О-,представлены формулой (I-B-3), их можно получить по реакции промежуточного соединения формулы (XI) с промежуточным соединением формулы (VIII). Реакцию можно проводить в реакционно-инертном растворителе, таком как,например, N,N-диметилформамид, и в присутствии подходящего основания, например, гидрида натрия. Перемешивание и повышение температуры до температуры кипения с обратным холодильником может повышать скорость этой реакции. Соединения формулы (I) можно превращать друг в друга, следуя известным в практике процедурам. Например, соединения формулы (IB-1), где R3 является водородом, можно превратить в соответствующие N-алкильные производные, используя подходящий алкилирующий агент, такой как алкилйодид, например, метилйодид, в присутствии подходящего основания, например, гидрида натрия. Также соединения формулы (I-B-2) можно превратить в соответствующие сульфоксиды,используя подходящий окислитель, например,3-хлорбензолкарбопероксоевую кислоту. Соединения формулы (I) можно переводить друг в друга, следуя известным в уровне техники процедурам превращения. Соединения формулы (I) можно также переводить в соответствующие N-оксидные формы, следуя известным процедурам превращения трехвалентного азота в его N-оксид. Указанную реакцию Nокисления обычно можно проводить при взаимодействии исходного материала формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных или щелочноземельных металлов, например, пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксикислоты,такие как бензолкарбопероксоевая кислота или галогензамещенная бензолкарбопероксоевая 11 кислота, например, 3-хлорбензолкарбопероксоевая кислота, пероксоалкановые кислоты, например, пероксоуксусная кислота, алкилгидропероксиды, например, трет-бутилгидропероксид. Подходящими растворителями являются,наример, вода, низшие алканолы, например,этанол и подобные, углеводороды, например,толуол, кетоны, например, 2-бутанон, галогенированные углеводороды, например, дихлорметан, и смеси таких растворителей. Исходные материалы и некоторые промежуточные продукты являются известными соединениями и доступны коммерчески, или их можно получить путем обычных реакций, известных специалистам. Например, промежуточные продукты формулы (III), где L является радикалом формулы (В), и промежуточные продукты формулы (V) можно получить, как описано в Европейских патентах ЕР-0 378 254-А,WO 92/06086, WO 93/14083, ЕР-0 539 421-А и ЕР-0 539 420-А. В частности, промежуточные продукты формулы (III), где L является радикалом формулы (В), и У- является -NR3-, представлены формулой (III-B-1), их можно получить по реакции промежуточного соединения формулы(XII), где Р 1 является подходящей защитной группой, такой как, например, фенилметил или С 1-6 алкилоксикарбонил, с промежуточным соединением формулы (VIII), используя такую же реакционную процедуру как для получения соединений формулы (I-а) из промежуточных продуктов (VII) и (VIII); с последующим снятием защиты полученного таким образом промежуточного соединения, используя известные в уровне техники методики снятия защиты. По-другому, промежуточные соединения формулы (III-B-1) можно также получить путем восстановительного N-алкилирования промежуточного продукта формулы (VI) промежуточным продуктом формулы (XIII), где Р 1 является подходящей защитной группой, такой как, например, фенилметил или C1-6 алкилоксикарбонил, используя такую же реакционную процедуру как для получения соединений формулы (I-В-1) из промежуточных продуктов (IV) и (VI); с последующим снятием защиты полученного таким образом промежуточного соединения, используя известные в практике приемы снятия зашиты.(III), где L является радикалом формулы (В), и У- является -О-, представлены формулой (III 001247B-3), их можно получить по реакции промежуточного соединения формулы XIV, где Р 1 является подходящей защитной группой, такой как,например,фенилметил илиC1-6 алкилоксикарбонил, с промежуточным соединением формулы (VIII), используя такую же реакционную процедуру, как для получения соединений формулы (I-B-3) из промежуточных продуктов (XI) и (VIII); с последующим снятием защиты полученного таким образом промежуточного соединения, используя известные в практике методики снятия защиты. Промежуточные соединения формулы (IV) можно получить путем конденсации промежуточного соединения формулы (II) с промежуточным соединением формулы (XV) способом,аналогичным описанному в ЕР-0 532 456-А. Способ получения промежуточных соединений формулы (XV) также описан в ЕР-0 532 456-А. Однако промежуточные соединения формулы (XV), в которых R1 необязательно замещен Ar1 C1-6 алкилом или ди(Аr1)C1-6 алкилом,где R1 представлен формулой CH(R1a)2, а указанные промежуточные соединения представлены формулой (XV-a), можно также получить,как описано на схеме 1. Схема 1 На схеме 1 промежуточные соединения формулы (XVI-b) можно получить по реакции промежуточного соединения формулы (ХVI-а) с альдегидом или кетоном формулы (XVII). C1-6Aлкилкарбаматную часть в промежуточных соединениях формулы (XVI-b) можно превратить в конденсированный оксазолон, который, в свою очередь, можно восстановить до промежуточного соединения формулы (XVI-d). С указанного промежуточного соединения (XVI-d) можно, в свою очередь, снять защиту, получив,таким образом, промежуточное соединение формулы (XV-a). Затем промежуточные соединения формулы (XV-a) можно пустить в реакцию с промежуточным соединением формулы(II) для получения промежуточных соединений 13 формулы (IV), где R1 определяют как -СН(R1a)2,при этом указанные промежуточные соединения представляют формулой (IV-a). Все реакции по схеме 1 можно проводить, следуя обычным способам, известным специалистам. Промежуточные соединения формулы(XV), в которых n и m равны 1, а R1 является Аr1, представляют формулой (XV-b), их можно получить по реакции бензальдегида формулы(XVIII) с промежуточным соединением формулы (XIX) или его функциональным производным с последующим снятием защиты полученного производного кетализованного 4 пиперидинона, используя известные в практике методики снятия защиты. Указанную реакцию можно проводить в реакционно-инертном растворителе, таком как, например, толуол, и в присутствии кислоты, такой как, например, пара-толуолсульфоновая кислота. Промежуточные продукты формулы (III), в которых L является радикалом формулы (А),представляют формулой (III-A), их можно получить взаимодействием промежуточного соединения формулы (ХIII) с промежуточным соединением формулы (V) согласно описанной выше процедуре восстановительного N-алкилирования с последующим снятием защиты с полученного таким образом промежуточного соединения. В частности, промежуточное соединение формулы (III-A), где R1 является -CH(R1a)2 и которые представляют формулой (III-A-1),можно получить, как описано на схеме 2. Схема 2 Кетализованное промежуточное соединение формулы (XVI-c) можно трансформировать в соответствующий кетон формулы (XVI-е),который затем можно восстановительно аминировать производным пирролидина, пиперидина или гомопиперидина формулы (V). Полученное таким образом промежуточное соединение можно затем восстановить подходящим восстановителем до промежуточного соединения формулы (III-A-1). 14 Стереохимически чистые изомерные формы соединений формулы (I) можно получить,применяя известные специалистам процедуры. Диастереомеры можно разделить физическими способами, такими как способы селективной кристаллизации и хроматографии, например,распределение в противотоке, жидкостная хроматография и подобные. Соединения формулы (I), полученные описанными здесь выше способами, обычно являются рацемическими смесями энантиомеров,которые можно отделить друг от друга следующими делительными процедурами, известными специалистам. Рацемические соединения формулы (I), которые являются достаточно основными или кислотными, можно перевести в соответствующие диастереомерные соли по реакции с подходящей хиральной кислотой или основанием, соответственно. Затем указанные формы диастереомерных солей разделяют, например, способом селективной или фракционной кристаллизации, и энантиомеры высвобождают при помощи щелочи или кислоты. Альтернативный способ деления энантиомерных форм соединений формулы (I) включает жидкостную хроматографию, в частности, жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные стереохимически чистые изомерные формы можно также получить из соответствующих стереохимически чистых изомерных форм подходящих исходных материалов, при обеспечении стереоспецифичности течения реакции. Если требуется специфический стереоизомер, предпочтительно синтезировать указанное соединение стереоспецифическими способами получения. В этих способах выгодно применять энантиомерно чистые исходные материалы. Соединения формулы (I) обладают ценными фармакологическими свойствами, они взаимодействуют с рецепторами тахикинина и противодействуют эффектам, индуцируемым тахикинином, в особенности, эффектам, индуцируемым веществом Р, и in vivo, и in vitro, и, таким образом, полезны при лечении опосредованных тахикинином заболеваний и, в частности, заболеваний, опосредованных веществом Р. Тахикинины, относящиеся также к нейрокининам, представляют семейство пептидов,среди которых можно указать вещество Р (SP),нейрокинин A (NKA), нейрокинин В (NKB) и нейропептид К (NPK). Это природные вещества,встречающиеся у млекопитающих, включая человека, распределены по центральной и периферической нервной системе, где они действуют в качестве нейротрансмиттеров или нейромодуляторов. Их действия опосредованы некоторыми подтипами рецепторов, таких как, например,рецепторы NK1, NK2 и NK3. Вещество Р проявляет наивысшее сродство к рецепторам NK1, в то время как NKA преимущественно связывается с рецепторами NK2, a NKB преимущественно 15 связывается с рецепторами NК 3. Однако селективность этих тахикининов относительно низкая и в физиологических условиях действие любого из этих тахикининов может быть опосредовано активацией более одного типа рецепторов. Вещество Р и другие нейрокинины участвуют в ряде биологических действий, таких как перенос боли (ноцицепция), нейрогенное воспаление, сокращение гладкой мускулатуры, транссудация протеина плазмы, расширение кровеносных сосудов, секреция, негрануляция тучных клеток, а также в активации иммунной системы. Считают, что ряд заболеваний вызван активацией рецепторов нейрокинина, в частности, рецепторов NK1 при избыточном выделении вещества Р и других нейрокининов в конкретных клетках, таких как клетки нейронного сплетения желудочно-кишечного тракта, безмиелиновые первичные сенсорные афферентные нейроны, симпатические и парасимпатические нейроны и клетки ненейронного типаAntagonists for Substance P and Related Peptides",Regoli и др.) Соединения настоящего изобретения являются активными ингибиторами нейрокининопосредованных эффектов, в частности, эффектов, опосредованных рецепторами NK1, и следовательно, их можно описать как антагонисты тахикинина, в особенности, как антагонисты вещества Р, как показано in vitro при антагонизме релаксации коронарных артерий свиньи, вызванной веществом Р, и описано далее. Сродство соединений настоящего изобретения к рецепторам нейрокинина человека, морской свинки и песчанки можно определить in vitro в тесте на связывание рецепторами с использованием 3Hвещества Р в качестве радиоактивного лиганда. Исследуемые соединения показывают также антагонистическую активность относительно вещества Р in vivo, что очевидно, например, при антагонизме вызванной веществом Р транссудации плазмы у морских свинок. С точки зрения способности противодействовать действиям тахикининов путем блокирования рецепторов тахикинина и, в частности,действиям вещества Р путем блокирования рецепторов NK1, исследуемые соединения полезны для профилактики и терапии тахикининопосредованных заболеваний, таких как, например:- боль, в частности, травматическая боль,такая как послеоперационная боль; травматическая боль при разрыве, например, плечевого сплетения; хроническая боль, такая как боль при артрите, например, при остео-, ревматоидном или псориатическом артрите; невропатическая боль, такая как постгерпетическая невралгия,тригеминальная невралгия, сегментальная или 16 межреберная невралгия, фибромиалгия, каузалгия, периферическая невропатия, диабетическая невропатия, вызванная химиотерапией невропатия, невропатия, связанная со СПИДом, затылочная невралгия, коленная невралгия, языкоглоточная невралгия, рефлекторная симпатическая дистрофия, боль фантомных конечностей; различные формы головных болей, такие как мигрень, острая или хроническая головная боль,связанная с давлением, нижнечелюстная боль,боль верхнечелюстной полости, "гистаминовая" головная боль; зубная боль; раковая боль; боль висцерального происхождения; желудочнокишечная боль; боль при ущемлении нерва; боль при спортивной травме; дисменорея; менструальная боль; менингит; арахноидит; боль скелетных мышц; боль нижней части спины,например спинальный стеноз; выпавший диск; ишиалгия; стенокардия; анкилозный спондилит; подагра; ожоги; боль рубцов; зуд и таламическая боль, такая как таламическая боль после удара;- респираторные и воспалительные заболевания, в частности воспаление при астме, гриппе, хроническом бронхите и ревматоидном артрите; воспалительные заболевания желудочнокишечного тракта, такие как болезнь Крона,язвенный колит, воспалительное заболевание кишечника и повреждения, вызванные нестероидным противовоспалительным лекарственным препаратом; воспалительные заболевания кожи,такие как герпес и экзема; воспалительные заболевания мочевого пузыря, такие как цистит и недержание мочи; воспалительные заболевания глаз и зубов;- рвота, то есть тошнота, позывы на рвоту и рвота, включая острую рвоту, замедленную рвоту и рецидивную рвоту, без различия причин, вызывающих рвоту, например рвоту могут вызывать лекарства, такие как химиотерапевтические агенты против рака, такие как алкилирующие агенты, например, циклофосфамид,кармустин, ломустин и хлорамбуцил; цитотоксические антибиотики, например, дактиномицин, доксорубицин, митомицин-С и блеомицин; антиметаболиты, например, цитарабин, метотрексат и 5-фторурацил; алкалоиды, например,этопозид, винбластин и винкристин; и другие,такие как цисплатин, дакарбазин, прокарбазин и гидроксимочевина; и их комбинации; лучевая болезнь; радиационная терапия, например, облучение грудной клетки или брюшной полости,такое как лечение рака; яды; токсины, такие как токсины, вызванные метаболическими нарушениями или инфекцией, например гастритом, или выделяющиеся в процессе бактериальной или вирусной желудочно-кишечной инфекции; беременность; вестибулярные нарушения, такие как укачивание, головокружение и болезнь Меньера; послеоперационные болезни; желудочно-кишечная непроходимость; ослабленная двигательная функция желудка и перистальти 17 ка; висцеральная боль, например, инфаркт миокарда или перитонит; мигрень; повышенное интеркраниальное давление; пониженное интеркраниальное давление (например, высотная болезнь); опиоидные анaлгетики, такие как морфин; и желудочно-пищеводный рефлюкс; изжога, чрезмерная терпимость к пище и напиткам, кислый желудок, изжога/регургитация, изжога, такая как эпизодическая изжога, ночная изжога и изжога, вызванная пищей, и диспепсия;- нарушения центральной нервной системы, в частности психозы, такие как шизофрения, мания, слабоумие, или другие познавательные нарушения, например болезнь Альцгеймера; боязнь; слабоумие, связанное со СПИДом; диабетическая невропатия; множественный склероз; депрессия; болезнь Паркинсона и зависимость от лекарств или веществ, злоупотребление ими;- аллергические нарушения, в частности аллергические заболевания кожи, такие как крапивница, и аллергические заболевания дыхательных путей, такие как ринит;- желудочно-кишечные нарушения, такие как слизистый колит;- вазоспастические нарушения, такие как стенокардия, сосудистая головная боль и болезнь Рейно;- церебральная ишемия, такая как вазоспазм вслед за субарахноидальным кровоизлиянием;- удар, эпилепсия, травма головы, травма спинного мозга и ишимическое нейронное нарушение;- нарушения, касающиеся иммунного усиления или подавления, такие как системная красная волчанка;- кашель. Соединения настоящего изобретения имеют подходящую метаболическую стабильность и демонстрируют высокую пригодность для орального применения. Они также обладают преимущественными началом действия и продолжительностью действия. С точки зрения применимости соединений формулы (I) обеспечен способ лечения теплокровных животных, включая людей, страдающих, как указано выше, от тахикинин-опосредованных заболеваний, в частности астмы. Указанный способ включает системное введение теплокровным животным, включая людей, эффективного для противодействия тахикинину 18 количества соединения формулы (I), его Nоксидной формы, фармацевтически приемлемой соли присоединения или возможной стереоизомерной формы. Следовательно, обеспечено применение соединения формулы (I) в качестве лекарственного средства и, в частности, лекарственного средства для лечения астмы. Для простоты применения рассматриваемые соединения можно приготовить в виде различных фармацевтических форм для приема. Для получения фармацевтических композиций данного изобретения терапевтически эффективное количество конкретного соединения,можно в форме соли присоединения, в качестве активного ингредиента тщательно смешивают с фармацевтически пригодным носителем, который может иметь разнообразные формы в зависимости от формы препарата, требуемой для введения. Желательно, чтобы эти фармацевтические композиции находились в виде стандартной дозированной формы, подходящей предпочтительно для орального приема, ректального введения, введения через кожу или парентерального введения. Например, при получении композиций в виде дозированной формы для орального приема можно применять любую из обычных фармацевтических сред, таких как вода, гликоли, масла, спирты и подобное в случае жидких препаратов для орального приема, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие, разрыхлители и подобное в случае порошков, пилюль, капсул и таблеток. Наиболее преимущественными стандартными дозированными формами для орального приема являются таблетки и капсулы из-за простоты применения, очевидно, что в этом случае используют твердые фармацевтические носители. Носитель композиций для парентерального введения обычно включает стерильную воду, по крайней мере, большую часть, хотя может включать другие ингредиенты, например, для повышения растворимости. Можно получить,например, растворы для инъекций, в которых носитель включает физиологический раствор,раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Растворы для инъекций, содержащие соединения формулы (I), можно приготовить в масле для пролонгированного действия. Подходящими для этой цели маслами являются, например, арахисовое масло, кунжутное масло,хлопковое масло, кукурузное масло, соевое масло, синтетические сложные эфиры глицерина жирных кислот с длинными цепями и их смеси,а также другие масла. Можно также приготовить суспензии для инъекций, в этом случае можно использовать подходящие жидкие носители, суспендирующие агенты и подобное. В композициях для введения через кожу носитель произвольно включает агент для повышения 19 проникания и/или подходящий смачивающий агент, необязательно объединенные с небольшой частью подходящих добавок любой природы, которые не оказывают существенных вредных влияний на кожу. Указанные добавки могут облегчать применение на коже и/или могут быть полезны в получении требуемых композиций. Эти композиции можно применять различными способами, например, как трансдермальную бляшку, как нанесенное пятно или как мазь. Наиболее подходящими для приготовления водных композиций являются соли присоединения кислоты или основания соединений формулы (I) вследствие своей повышенной растворимости по сравнению с соответствующими формами оснований и кислот. Для повышения растворимости и/или стабильности соединений формулы (I) в фармацевтических композициях может быть полезным использовать ,или-циклодекстрины или их производные, в частности гидроксиалкилзамещенные циклодекстрины, например, 2 гидроксипропилциклодекстрин. Повысить растворимость и/или стабильность соединений формулы (I) в фармацевтических композициях может также применение сорастворителя, такого как спирты. Особо полезно готовить указанные выше фармацевтические композиции в виде стандартной дозированной формы для простоты применения и единообразия дозировки. Использованное в описании и формуле изобретения определение "стандартная дозированная форма" обозначает физически дискретные единицы, подходящие в качестве стандартных доз, причем каждая единица содержит предварительно определенное количество активного ингредиента, рассчитанное для производства требуемого терапевтического эффекта, в ассоциации с необходимым фармацевтическим носителем. Примерами таких стандартных дозированных форм являются таблетки (включая таблетки с бороздками или в оболочке), капсулы, пилюли, пакетики с порошками, облатки, растворы или суспензии для инъекций, контейнеры с объемом чайной ложки, контейнеры с объемом столовой ложки и подобное, и их отдельные множества. Специалист по лечению тахикинин-опосредованных заболеваний может определить терапевтически эффективное дневное количество по результатам теста, представленного здесь далее. Терапевтически эффективное дневное количество составляет примерно от 0,001 до 40 мг/кг веса тела, более предпочтительно примерно от 0,01 до 5 мг/кг веса тела. Подходящим может быть введение терапевтически эффективной дозы один раз в день или в виде субдоз два, три, четыре или более раз в течение дня с подходящим интервалом. Указанные субдозы можно приготовить в виде стандартных дозированных форм, например, содержащих от 0,05 до 20 500 мг, в частности, от 0,5 до 50 мг активного ингредиента на стандартную дозированную форму. Точная дозировка и частота введения зависят от конкретного используемого соединения формулы (I), конкретных симптомов, подлежащих лечению, тяжести подлежащего лечению состояния, возраста, веса и общего физического состояния конкретного пациента, а также от других лекарственных препаратов, которые может принимать пациент, что хорошо известно специалистам. Кроме того, очевидно, что указанное эффективное дневное количество может быть ниже или выше в зависимости от реакции пациента и/или в зависимости от оценки врача,прописывающего соединения данного изобретения. Следовательно, указанные выше диапазоны эффективного дневного количества являются лишь ориентировочными. Следующие примеры приведены для иллюстрации (а не с целью ограничения) области настоящего изобретения. Экспериментальная часть Здесь далее "ДИПЭ" обозначает диизопропиловый эфир, "КТ" обозначает комнатную температуру. Для некоторых соединений формулы (I) абсолютная стереохимическая конфигурация экспериментально не определена. В этих случаях стереохимически изомерную форму, выделяемую первой, обозначают "А", а вторую "В", не ссылаясь дополнительно на действительную стереохимическую конфигурацию. А. Получение промежуточных соединений. Пример А 1. а) Смесь (+)-1,1-диметилэтил 7-(фенилметил)-1,4-диоксо-8-азаспиро[4.5]декан-8-карбоксилата (33,34 г) в HCl (6N;250 мл) перемешивают при 70 С в течение 1,5 ч. Смесь охлаждают, добавляют CH2Cl2 (100 мл) и NaOH при охлаждении до КТ. Органический слой отделяют, а водный экстрагируют CH2Cl2. Добавляют триэтиламин (20,2 г), а затем 3,5-бис(трифторметил)бензоилхлорид (27,7 г), растворенный вCH2Cl2, и смесь перемешивают в течение 2 ч. Добавляют воду и разделяют слои. Органический слой сушат, фильтруют и выпаривают растворитель. Остаток кристаллизуют из ДИПЭ,осадок отфильтровывают и сушат, получая 18,34 г фракции 1. Растворитель маточного слоя выпаривают и остаток кристаллизуют из ДИПЭ. Осадок отфильтровывают и сушат, получая 6,51 г фракции 2. Две фракции соединяют и переносят в воду и CH2Cl2. Добавляют NaOH и смесь экстрагируют. Органический слой сушат,фильтруют и выпаривают растворитель, получая 16,14 г (38%) -1-[3,5-бис(трифторметил) бензоил]-2-(фенилметил)-4-пиперидинона (промежуточное соединение 1; т.пл. 102,5 С). Пример А 2. а) Смесь[4,5]декан-8-карбоксилата (183,6 г) и трет 21 бутоксида калия (6 г) в толуоле (900 мл) перемешивают при кипячении с обратным холодильником в течение 2 ч. Растворитель выпаривают и остаток перемешивают в петролейном эфире и воде. Смесь декантируют и остаток перемешивают в ДИПЭ. Осадок отфильтровывают и сушат, получая 127,4 г (92%) -тетрагидро 1'-фенилспиро(1,3-диоксолан-2,7'(8'Н)-3 Ноксазоло[3,4-а]пиридин)-3'-она (промежуточное соединение 2). б) Смесь промежуточного соединения (2)(137 г) в метаноле (700 мл) гидрируют при 50 С в течение ночи с палладием на активированном угле (10%; 5, г) в качестве катализатора. После поглощения водорода катализатор отфильтровывают и фильтрат выпаривают. Остаток переносят в воду и экстрагируют CH2Cl2. Органический слой сушат, фильтруют и выпаривают растворитель, получая 99 г (85%) (+)-7-(фенилметил)-1,4-диокса-8-азаспиро[4.5]декана (промежуточное 3). в) смесь промежуточного соединения 3 (13 г) в НСl (6N;130 мл) перемешивают при кипячении с обратным холодильником в течение 3 ч. Смесь охлаждают, декантируют, подщелачивают 50% NaOH и экстрагируют CH2Cl2. Органический слой сушат и фильтруют, получая -7(фенилметил)-1,4-диокса-8-азаспиро [4.5]декан в CH2Cl2 (промежуточное соединение 4). г) Смесь промежуточного соединения (4),3,5-диметилбензоилхлорида (7,4 г) и триэтиламина (11 мл) перемешивают в течение ночи при КТ. Реакционную смесь промывают разбавленным NaOH и органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток кристаллизуют из ДИПЭ. Осадок отфильтровывают и сушат, получая 7,44 г (58%)(+)-1-(3,5-диметилбензоил)-2-(фенилметил)- 4 пиперидинона (промежуточное соединение 5,т.пл.107,8 С). Пример A3. а) (1)-1,1-диметилэтил транс-4-амино-2(фенилметил)-1-пиперидинкарбоксилата (5 г), 1(2-этоксиэтил)-2-хлор-1 Н-бензимидазола (4,5 г) и меди (1,28 г) перемешивают при 150 С в течение 4 ч. Смесь переносят в CH2Cl2 и фильтруют. Фильтрат промывают смесью вода/NН 3. Органический слой сушат, фильтруют и выпаривают растворитель. Остаток чистят способом колоночной хроматографии на силикагеле(элюент:CH2Cl2/(СН 3 ОН/NН 3)=98/2). Чистые фракции собирают и выпаривают растворитель,получая 6 г (73,7%) (+)-1,1-диметилэтил транс 4-1-(2-этоксиэтил)-1 Н-бензимидазол-2-ил]амино]-2-(фенилметил)-1-пиперидинкарбоксилата(промежуточное соединение 6). б) Промежуточное соединение (6) (6 г) переносят в метанол (160 мл). Добавляют НСl в 2 пропаноле (16 мл) и смесь перемешивают при кипячении с обратным холодильником в течение 1 ч. Растворитель выпаривают и остаток переносят в разбавленный NaOH и экстрагиру 001247 22 ют CH2Cl2. Органический слой отделяют и чистят на стеклянном фильтре через силикагель(элюент:CH2Cl2/(СН 3 ОН/NH3)=95/5). Чистые фракции собирают и выпаривают. Остаток кристаллизуют из ДИПЭ, получая 3 г (63,4%) транс-1(промежуточное соединение 7). Пример А 4. а) 1,1-диметил 1,3-диокса-8-азаспиро[4.5] декан-8-карбоксилат (24,3 г) в диэтиловом эфире (150 мл) и N,N,N',N'-тетраметилэтилендиамин (32 мл) перемешивают и охлаждают под током N2 на бане из 2-пропанола/СО 2. Добавляют по капле втор-бутиллитий (1,4 М; 85,7 мл) при температуре ниже -60 С и смесь перемешивают при -60 С в течение 3 ч. Добавляют 3,4 диметоксибензальдегид (19,94 г) во вторбутиллитии и смесь перемешивают при -60 С в течение 1 ч. Смесь доводят до КТ и перемешивают в течение ночи. Смесь разлагают водой,добавляют ДИПЭ и эфирный слой дважды декантируют. Осадок и водные слои экстрагируютCH2Cl2. Органический слой отделяют, сушат,фильтруют и выпаривают растворитель. Остаток кристаллизуют из ДИПЭ и осадок отфильтровывают, получая 2,7 г (8%) -1-(3,4 диметоксифенил)тетрагидроспиро[1,3-диоксолан-2,7'(1'Н)-оксазоло[3,4-а]пиридин]-3'(3'Н)она (промежуточное соединение 8, т.пл. 162,6 С). б) Трифторуксусную кислоту (5 мл) добавляют к смеси промежуточного соединения 8 (1 г) в CH2Cl2 (25 мл) и смесь перемешивают при КТ в течение нескольких часов. Смесь выливают в щелочную воду и экстрагируют CH2Cl2. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток суспендируют в ДИПЭ, отфильтровывают и сушат. Остаток перекристаллизовывают из СН 3 СN,отфильтровывают и сушат, получая 0,19 г (+)-1(3,4-диметоксифенил)тетрагидро-3 Ноксазоло[3,4-а]пиридин -3,6(1H)-диона (промежуточное соединение 9, т.пл. 180,2 С). в) Раствор промежуточного соединения 9(9 г) в метаноле (250 мл) гидрируют при 50 С с палладием на активированном угле (10%; 3 г) в качестве катализатора. После поглощения водорода катализатор отфильтровывают, а растворитель выпаривают. Остаток чистят способом колоночной хроматографии на силикагеле (элюент:CH2Cl2/(СН 3 ОН/NН 37N)=95/5). Чистые фракции собирают и выпаривают, получая 3 г-2-[(3,4-диметоксифенил)метил]-4 пиперидинона (промежуточное соединение 10). Пример А 5. а) Раствор бензальдегида (10,6 г) и 2 метил-1,3-диоксолан-2-этанамина (13,1 г) в толуоле (100 мл) перемешивают в течение 16 ч при КТ. Этот раствор при 100 С добавляют к раствору 4-метилбензолсульфоновой кислоты(34,4 г) в толуоле (100 мл) и смесь перемешива 23 ют в течение 1 ч при 100 С. Смесь вливают в баню со льдом/водой, добавляют К 2 СО 3 до рН примерно 8 и экстрагируют этилацетатом. Органический слой сушат, фильтруют и выпаривают растворитель, получая 14,3 г (70%) -7 фенил-1,3-диокса-8-азаспиро[4.5]декана (промежуточное соединение 11). б) Смесь промежуточного соединения 11(14,5 г) в НСl (6N; 150 мл) перемешивают и нагревают при 60 С в течение нескольких часов. Смесь охлаждают, вливают в насыщенный раствор К 2 СО 3 и экстрагируют CH2Cl2. Органический слой сушат, фильтруют и выпаривают растворитель. Остаток чистят способом колоночной хроматографии на силикагеле (элюент:CH2Cl2/СН 3 ОН-NН 3=95/5). Чистые фракции собирают и выпаривают, получая 7,3 г (57%) 2-фенил-4-пиперидинона (промежуточное соединение 12). Пример А 6. а) Йод (кристаллы) добавляют к стружкам магния (8,63 г) в диэтиловом эфире под токомN2. Добавляют бензилбромид и начинают реакцию Гриньяра. Бензилбромид (60,65 г) в диэтиловом эфире (443 мл) добавляют по каплям при температуре кипения с обратным холодильником и перемешивании, реакционную смесь кипятят с обратным холодильником в течение 1 ч. Реагент Гриньяра добавляют по каплям к суспензии 4-метокси-1-(фенилметил) пиридинийбромида (75 г) в диэтиловом эфире (1200 мл) и смесь перемешивают при КТ в течение 18 ч. Смесь выливают в НСl (12 М; 150 мл) и воду(600 мл), подщелачивают NH4OH и NaOH и экстрагируют CH2Cl2. Объединенные органические слои промывают водой, сушат, фильтруют и выпаривают растворитель, получая 76 г (100%)CH2Cl2. Органический слой промывают водой,сушат, фильтруют и выпаривают растворитель. Остаток чистят способом колоночной хроматографии на силикагеле (элюент: CH2Cl2/ СН 3 ОН=95/5) . Чистые фракции собирают и выпаривают растворитель, получая 40 г (54,3%)-2,3-дигидро-1,2-бис(фенилметил)-4(1 Н)пиридинона (промежуточное соединение 14). в) Промежуточный продукт 14 (40 г) гидрируют в метаноле (600 мл) с никелем Ренея (5 г) в качестве катализатора. После поглощения водорода катализатор отфильтровывают и выпаривают растворитель. Остаток чистят способом колоночной хроматографии на силикагеле(элюент:CH2Cl2/(СН 3 ОН/NН 3)=95/5). Чистые фракции собирают и выпаривают растворитель. Остаток кристаллизуют из СН 3CN, получая 5,4 г(промежуточное соединение 15, т.пл. 113,9 С). Пример А 7. Смесь промежуточного соединения 10 (2,8 г) в CH2Cl2 (50 мл) перемешивают и добавляют 3,5-бис(трифторметил)бензоилхлорид (3,32 г). При перемешивании добавляют триэтиламин(2,8 мл) и смесь перемешивают при КТ в течение 3 ч. Смесь промывают разбавленным NaOH 50%, затем водой, сушат, фильтруют и выпаривают растворитель. Остаток чистят способом колоночной хроматографии на силикагеле (элюент:CH2Cl2/СН 3 ОН=95/5). Чистые фракции собирают и выпаривают растворитель. Остаток суспендируют в ДИПЭ, фильтруют и сушат. Растворитель выпаривают и остаток сушат, получая 3,25 г (59,3%) -1-[3,5-бис(трифторметил)бензоил]-2-[(3,4-диметоксифенил)метил]4-пиперидинона (промежуточное соединение 16, т.пл. 132,7 С). Аналогичным образом получают-транс-1-(3,5-диметилбензоил)-2-(фенилметил)-4-пиперидинол (промежуточное соединение 20, т.пл. 153,2 С). Пример А 8. Триэтиламин (7 мл) и метансульфонилхлорид (3,4 мл) добавляют к смеси промежуточного соединения 18 (13 г) в CH2Cl2 (200 мл) и смесь перемешивают при КТ в течение 3 ч. Смесь промывают водой, NaOH 50% и снова водой. Органический слой сушат, фильтруют и выпаривают растворитель. Остаток чистят способом колоночной хроматографии на силикагеле (элюент:CH2Cl2/СН 3 ОН=99/1). Чистые фракции собирают и выпаривают растворитель, получая 14,4 г (90%) -цис-1-(3,5-диметилбензоил)-2-(фенилметил)-4-пиперидинол метансульфоната (сложного эфира) (промежуточное соединение 21). Пример А 9. а) Смесь -этил 4-оксо-2-(фенилметил)-1 пиперидинкарбоксилата (10 г) и бензиламина (4 г) гидрируют при 50 С в тиофене (4% раствор; 1 мл) и метаноле (150 мл) с палладием на активированном угле (10%; 3 г) в качестве катализатора. После поглощения водорода катализатор отфильтровывают и выпаривают растворитель,получая этил-2-(фенилметил)-4-[(фенилметил)амино)-1-пиперидинкарбоксилат (промежуточное соединение 22). б) Смесь промежуточного соединения 22(12 г) гидрируют при 50 С в метаноле (150 мл) с палладием на активированном угле (10%; 2 г) в 25 качестве катализатора. После поглощения водорода катализатор отфильтровывают и выпаривают растворитель. Остаток чистят способом колоночной хроматографии на силикагеле (элюент:CH2Cl2/(СН 3 ОН/NН 3) от 97/3 до 95/5). Чистые фракции собирают и выпаривают растворитель, получая 6 г (67%) этил 4-амино-2(фенилметил)-1-пиперидинкарбоксилата (промежуточное соединение 23). в) Промежуточное соединение 23 (15,1 г),2-хлор-1-(2-этоксиэтил)-1H-бензимидазол (13,5 г) и медь (3,84 г) перемешивают при 150 С в течение 4 ч. Смесь переносят в CH2Cl2 и фильтруют. Фильтрат промывают раствором NH4OH и водой. Органический слой сушат, фильтруют и выпаривают растворитель. Остаток чистят способом колоночной хроматографии на силикагеле (элюент:CH2Cl2/ СН 3 ОН=97/3). Чистые фракции собирают и выпаривают растворитель,получая 20 г (77%) -этил цис-4-1-(2 этоксиэтил)-1 Н-бензимидазол-2-ил]амино]-2(фенилметил)-1-пиперидинкарбоксилата (промежуточное соединение 24). Пример А 10. 1-(2-этоксиэтил)-1 Н-бензимидазол-2-амин(8,2 г) добавляют к этил 2-[(3,4-дихлорфенил) метил]-4-оксо-1-пиперидинкарбоксилату (13,2 г) в CH2Cl2 (20 мл). Добавляют изопропоксид титана (IV) (13,64 г) и смесь перемешивают в течение 3 ч при КТ. Добавляют боргидрид натрия (1,82 г) в этиноле (20 мл) и реакционную смесь перемешивают в течение ночи при КТ. Добавляют воду (20 мл) и смесь перемешивают в течение 5 мин. Добавляют CH2Cl2 (200 мл) и смесь перемешивают, сушат, фильтруют и выпаривают фильтрат. Остаток чистят способом колоночной хроматографии на силикагеле (элюент:CH2Cl2/СН 3 ОН от 98/2 до 97/3). Требуемые фракции собирают и выпаривают растворитель,получая 2,6 г -этил транс-2-[(3,4-дихлорфенил)метил]-4-1-(2-этоксиэтил)-1 Н-бензимидазол-2-ил]амино]-1-пиперидинкарбоксилата-1,1 диметилэтил транс-4-гидрокси-2(фенилметил)-1 -пиперидинкарбоксилат (25,6 г) растворяют в N,N-диметилформамиде (256 мл). Добавляют гидрид натрия (4,24 г) и смесь перемешивают при КТ в течение 1,5 ч. Добавляют 2 хлор-1-(2-этоксиэтил)-1H-бензимидазол (24,8 г) и смесь перемешивают при 70 С в течение 18 ч. Растворитель выпаривают, остаток переносят в воду и CH2Cl2 и слои разделяют. Органический слой сушат, фильтруют и выпаривают растворитель, получая 50 г (100%) -1,1-диметилэтил транс-4-1-(2-этоксиэтил)-1 Н-бензимидазол-2 ил]окси]-2-(фенилметил)-1-пиперидинкарбоксилата (промежуточное соединение 27). 26 Пример А 12. Смесь -этил транс-2-[(3,4-дихлорфенил) метил]-4-1-(2-этоксиэтил)-1 Н-бензимидазол-2 ил]амино]-1-пиперидинкарбоксилата (2,5 г) и КОН (2,8 г) в 2-пропаноле (50 мл) перемешивают и кипятят с обратным холодильником в течение 48 ч. Растворитель выпаривают. Остаток делят между водой и CH2Cl2. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток чистят способом колоночной хроматографии на силикагеле (элюент:CH2Cl2/(СН 3 ОН/NН 3) от 95/5 до 90/10). Чистые фракции собирают и выпаривают растворитель, получая 1,1 г(49,2%) -транс-N-[2-[(3,4 дихлорфенил)метил]-4-пиперидинил)-1-(2 этоксиэтил)-1 Н-бензимидазол-2-амина (промежуточное соединение 28). Аналогичным образом получают:-цис-1-(2-этоксиэтил)-N-[2-(фенилметил)-4 пиперидинил]-1 Н-бензимидазол-2-аминэтандиоат (1:2) (промежуточное соединение 30). Пример А 13. Смесь -цис-N-[1,2-бис(фенилметил)-4 пиперидинил]-1-метил-1 Н-бензимидазол-2 амина (4,7 г) в метаноле (200 мл) гидрируют с палладием на активированном угле (10%; 2 г) в качестве катализатора. После поглощения водорода катализатор отфильтровывают, а фильтрат выпаривают. Остаток чистят способом колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/СН 3 ОН - 95/5). Чистые фракции собирают и выпаривают растворитель. Остаток суспендируют в ДИПЭ, фильтруют и сушат, получая 0,6 г (17%) -цис-1-метил-N-[2-(фенилметил)-4-пиперидинил]-1 Н-бензимидазол-2 амина (промежуточное соединение 31, т.пл. 86,3 С). Пример А 14.-1,1-диметилэтил транс-4-1-2-этоксиэтил)-1 Н-бензимидазол-2-ил]амино]-2-(фенилметил)-1-пиперидинкарбоксилат (6 г) переносят в метанол (160 мл). Добавляют НСl в 2 пропаноле (16 мл) и смесь перемешивают и кипятят с обратным холодильником в течение 1 ч. Растворитель выпаривают, остаток переносят в воду с разбавленным NaOH и экстрагируют СН 2 Сl2. Органический слой отделяют и чистят на стеклянном фильтре через силикагель (элюент: СН 2 Сl2/(СН 3 ОН/NН 3)=95/5). Чистые фракции собирают и выпаривают растворитель. Остаток кристаллизуют из ДИПЭ, получая 3 г (63,4%)-транс-1-[(5-метил-2-фуранил)метил]-N[2-(фенилметил)-4-пиперидинил]-1H-2-бензимидазол-2-амин (промежуточное соединение 39). В. Получение соединений формулы (I). Пример В 1. Смесь промежуточного соединения (1)(4% раствор; 2 мл) и толуоле (450 мл) гидрируют в течение ночи в автоклаве при 125 С и давлении 50 кг с палладием на активированном угле (10%; 1 г) в качестве катализатора. После поглощения водорода катализатор отфильтровывают, а фильтрат выпаривают. Остаток чистят способом колоночной хроматографии на силикагеле (элюент:CH2Cl2/(СН 3 ОН/NН 3)=98/2). Фракцию 1 собирают и выпаривают. Остаток кристаллизуют из СН 3 СN, осадок отфильтровывают и сушат, получая 2,14 г (20%) -цис-1[1,3-бис(трифторметил)бензоил]-4-[4-1-(2 этоксиэтил)-1H-бензимидазол-2-ил]амино]-1 пиперидинил]-2-(фенилметил)пиперидина (соединение 5, т.пл. 201,5 С). Фракцию 2 собирают и выпаривают. Остаток перемешивают с петролейным эфиром, осадок отфильтровывают и сушат, получая 1,04 г (10%) -транс-1-[1,3 бис(трифторметил)бензоил]-4-[4-1-(2-этоксиэтил)-1 Н-бензимидазол-2-ил]амино]-1-пиперидинил]-2-(фенилметил)пиперидина (соединение 6, т.пл. 174,5 С). Пример В 2. а) Изопропоксид титана (IV) (3,55 г) добавляют к смеси промежуточного соединения 7(3,78 г) и промежуточного соединения 1 (2,74 г) в этаноле (10 мл) и смесь перемешивают при КТ в течение 6 ч. Добавляют цианоборгидрид натрия (0,65 г) в этаноле (5 мл) и смесь перемешивают в течение ночи при КТ. Добавляют воду 28 вают растворитель. Остаток чистят способом колоночной хроматографии на силикагеле (элюэнт:CH2Cl2/СН 3 ОН=98/2). Чистые фракции собирают и выпаривают. Остатки (фракция А и фракция В) чистят способом высокоэффективной жидкостной хроматографии (элюент: толуол/2-пропанол=95/5). Чистые фракции собирают и выпаривают. Остаток суспендируют в петролейном эфире, отфильтровывают и сушат, получая 0,55 г (7%) 2,4-транс-1-[3,5-бис(трифторметил)бензоил]-4-[4-1-(2-этоксиэтил)-1Hбензимидазол-2-ил]амино]-2-(фенилметил)-1 пиперидинил]-2-(фенилметил)пиперидина (соединение 13, т.пл. 115,3 С) и 0,74 г (9,3%) 2,4-транс-1-[3,5-бис(трифторметил)бензоил]4-[4-1-(2-этоксиэтил)-1 Н-бензимидазол-2-ил] амино]-2-(фенилметил)-1-пиперидинил]-2(фенилметил)пиперидина (соединение 14, т.пл. 105,9 С). Пример В 3. а) 3,5-бис(трифторметил)бензоилхлорид(1,52 г), а затем триэтиламин (1,4 мл) добавляют к промежуточному продукту 7 (1,9 г), растворенному в CH2Cl2 (100 мл) и смесь перемешивают в течение ночи. Смесь промывают водой и слои разделяют. Органический слой сушат,фильтруют и выпаривают растворитель. Остаток чистят способом колоночной хроматографии на силикагеле(СН 3 ОН/NН 3)=98/2). Чистые фракции собирают и выпаривают растворитель. Остаток кристаллизуют из ДИПЭ, получая 2,47 г (80%) транс-1-[3,5-бис(трифторметил)бензоил]-4-1(2-этоксиэтил)-1H-бензимидазол-2-ил]амино]-2(фенилметил)пиперидина(соединение 85,т.пл.177,8 С). б) Соединение 85 (0,5 г) делят на оптические изомеры способом колоночной хроматографии Chiracel AD на силикагеле (элюент:гексан/С 2 Н 5 ОН=80/20) (20 мкм). Чистые фракции собирают и выпаривают растворитель,получая 0,21 г (42,4%) (А-транс)-1-[3,5-бис(0,070 г) добавляют к -транс-1-[(2-метил-5 оксазолил)метил]-N-[1-[2-(фенилметил)-4 пиперидинил]-4-пиперидинил]-1 Н-бензимидазол-2-амину (0,100 г) в CH2Cl2 (5 мл). Смесь перемешивают в атмосфере N2. Добавляют по капле раствор триэтиламина (0,5 мл) и гидрохлорида 1-(3-диметиламинопропил)-3-этил 29 карбодиимида (1:1) (0,080 г) в CH2Cl2 (10 мл) и реакционную смесь перемешивают в течение ночи при КТ под N2. Затем выделяют соединение и чистят способом колоночной хроматографии (градиентное элюирование: (0,5% ацетат аммония в Н 2 О)/СН 3 ОН/СН 3 СN от 70/15/15 через 0/50/50 до 0/0/100). Требуемые фракции собирают и выпаривают растворитель, получая 0,060 г -транс-1-[(3-метил-2-бензофуранил) карбонил]-4-[4-1-[(2-метил-5-оксазолил)метил]-1 Н-бензимидазол-2-ил]амино]-1-пиперидинил]-2-(фенилметил)пиперидина. Пример В 5. Смесь -транс-N-[3,5-бис(трифторметил) фенил]-4-[4-1-[(2-метил-5-оксазолил)метил]1 Н-бензимидазол-2-ил]амино]-1 -пиперидинил]2-(фенилметил)-1-пиперидинкарбоксамида(0,100 г) и 3,5-бис(трифторметил) бензолизоцианата (10 капель) в CH2Cl3 (2 мл) перемешивают в течение ночи при КТ. Затем соединение выделяют и чистят способом колоночной хроматографии (градиентное элюирование: (0,5% ацетат аммония в Н 2 О)/СН 3 ОН/СН 3 СN от 70/15/15 через 0/50/50 до 0/0/100). Требуемые фракции собирают и выпаривают растворитель,получая 0,050 г -транс-N-[3,5-бис(трифторметил)фенил]-4-[4-1-[(2-метил-5-оксазолил) метил]-1H-бензимидазол-2-ил]амино]-1-пиперидинил]-2-(фенилметил)-1-пиперидинкарбоксамида (соединение 52). Пример В 6.(0,6 г) перемешивают при 150 С в течение 5 ч. Смесь переносят в CH2Cl2 и фильтруют. Фильтрат промывают разбавленным NH4OH и перемешивают. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток чистят способом колоночной хроматографии на силикагеле(СН 3 ОН/NН 3)=97/3). Чистые фракции собирают и выпаривают растворитель. Остаток кристаллизуют из СН 3 СN, получая 1,87 г (35%) -цис 1-(3,5-диметилбензоил)-2-(фенилметил)-N-[1-(2 тиенилметил)-1 Н-бензимидазол-2-ил]-4 пиперидинамина (соединение 76, т.пл. 201,4 С). Пример В 7. Смесь -1-[3,5-бис(трифторметил) бензоил]-2-(фенилметил)-4-пиперидинона (4,29 г), 3(2-фуранилметил)-3 Н-имидазо[4,5-b]пиридин-2-амина (2,14 г) и изопропоксида титана(IV) (3,41 г) в CH2Cl2 (5 мл) перемешивают при КТ в течение 3 ч. Добавляют смесь цианборгидрида натрия (0,628 г) в этаноле (5 мл). Смесь перемешивают при КТ в течение ночи. Добавляют воду (5 мл) и CH2Cl2 (300 мл). Смесь перемешивают в течение 15 мин. Бифазную смесь сушат, фильтруют и выпаривают фильтрат. Остаток чистят способом высокоэффективной жидкостной хроматографии (элюент: (0,5% 30 фракции собирают и выпаривают растворитель. Каждый остаток сушат и измельчают, получая 1,22 г (19,4%) -цис-1-[3,5-бис (трифторметил)-бензоил]-4-3-(2-фуранилметил)-3 Нимидазо[4,5-b]пиридин-2-ил]амино]-2 (фенилметил)пиперидина (соединение 112, т.пл. 108,7 С) и 0,14 г (2,2%) -транс-1-[3,5 бис(трифторметил)бензоил]-4-3-(2-фуранилметил)-3 Н-имидазо[4,5-b]пиридин-2-ил]амино]-2-(фенилметил)пиперидинаN,N-диметилформамиде (100 мл) перемешивают под N2. Добавляют гидрид натрия (60%)(0,36 г) и смесь перемешивают при 40 С в течение 1 ч. Добавляют 2-хлор-1-[(4-фторфенил)-метил]-1H-бензимидазол (2,6 г) и смесь перемешивают при 60 С в течение 20 ч. Растворитель выпаривают и остаток переносят в воду и CH2Cl2. Органический слой отделяют, сушат,фильтруют и выпаривают растворитель. Остаток чистят способом колоночной хроматографии на силикагеле(элюент:CH2Cl2/ СН 3 ОН=97/3). Чистые фракции собирают и выпаривают растворитель. Остаток кристаллизуют из ДИПЭ, получая 2,85 г (65%) -цис-1-(3,5 диметилбензоил)-4-1-[(4-фторфенил) метил]1 Н-бензимидазол-2-ил]окси]-2-(фенилметил) пиперидина (соединение 70, т.пл. 154,1 С). Пример В 9. Смесь 1-(2-этоксиэтил)-1 Н-бензимидазол 2-тиола (4,44 г), промежуточного соединения(300 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель выпаривают, остаток переносят в воду и экстрагируют CH2Cl2. Органический слой сушат,фильтруют и выпаривают растворитель. Остаток чистят способом высокоэффективной жидкостной хроматографии(Н 2 О/NН 4 ОС(O)СН 3 0,5%)=75/25). Чистые фракции собирают и выпаривают растворитель. Остаток делят способом колоночной хроматографии на силикагеле (элюент: CH2Cl2/СН 3 ОН от 98/2 до 96/4). Чистые фракции собирают и выпаривают растворитель. Остаток 1 сушат и измельчают, получая 0,71 г -цис-1-(3,5 диметилбензоил)-4-1-(2-этоксиэтил)-1 Н-бензимидазол-2-ил]тио]-2-(фенилметил)пиперидина (соединение 105). Остаток 2 сушат и измельчают, получая 1,72 г -транс-1-(3,5 диметилбензоил)-4-1-(2-этоксиэтил)-1 Нбензимидазол-2-ил]тио]-2-(фенилметил)пиперидина (соединение 106, т.пл.147,3 С). Пример В 10. Гидрид натрия добавляют к смеси соединения (85) (2,8 г) в N,N-диметилформамиде (100 мл) и перемешивают. Смесь перемешивают при 60 С в течение 45 мин. Добавляют иодметан(0,78 г) и смесь перемешивают при 70 С в тече 31 ние ночи. Растворитель выпаривают и остаток переносят в CH2Cl2 и воду. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток чистят на стеклянном фильтре через силикагель (элюент:CH2Cl2/ СН 3 ОН=97/3). Чистые фракции собирают и выпаривают растворитель. Остаток кристаллизуют из ДИПЭ, фильтруют и сушат, получая 1,19 г(0,5 г) в CH2Cl2 (10 мл) и смесь перемешивают в течение 2,5 ч при КТ. Смесь промывают разбавленным NaOH, сушат и выпаривают растворитель. Остаток кристаллизуют из СН 3 СN. Остаток чистят способом высокоэффективной жидкостной хроматографии(элюент:CH2Cl2/ СН 3 ОН=98/2). Чистые фракции собирают и выпаривают растворитель. Остатки сушат, получая 0,11 г(100 мл) и смесь кипятят с обратным холодильником в течение 18 ч. Снова добавляют изатоевый ангидрид (0,2 г) и смесь кипятят с обратным холодильником в течение 4 ч. Растворитель выпаривают и остаток чистят способом колоночной хроматографии на силикагеле (элюент:CH2Cl2/СН 3 ОН=95/5). Чистые фракции собирают и выпаривают растворитель. Остаток кристаллизуют из ДИПЭ, получая 0,5 г (33, 4%) транс-1-[2-аминобензоил]-4-1 (2-этоксиэтил)1 Н-бензимидазол-2-ил]амино]-2-(фенилметил) пиперидина (соединение 123, т.пл. 197,4 С). В следующих таблицах перечислены соединения, полученные согласно одному из приведенных выше примеров (Пр.) Прямая связь Прямая связь Прямая связь Прямая связь 2-Нафтален- Прямая ил связь 2-Фуранил Прямая связь Фенил Прямая связь Прямая связь 3,5-Бис (три Прямая-фторметил) связь фенил 6-Бензотиазо- Прямая лил связь 5-Фтор-2 индолил 3,5-Бис (трифторметил) фенил 3-Цианофенил С. Фармакологические примеры Пример С 1. Антагонизм индуцированной веществом Р релаксации коронарных артерий свиньи. Сегменты коронарных артерий свиней(умерщвленных путем инъекции сверхдозы пентобарбитала натрия) выворачивают и укрепляют для регистрации изомерного натяжения в бане для органов объемом 20 мл эндотелием наружу. Препараты промывают в растворе KrebsHeinseleit. Раствор хранят при температуре 37 С и газируют смесью O2/СO2 (95/5). После стабилизации препаратов вводят простагландин F2a(10-5 М) для индуцирования сокращения. Это повторяют до тех пор, пока ответные сокращения не стабилизируются. Тогда снова вводят простагландин F2a и добавляют вещество Р(3 х 10-10 М и 10-9 М кумулятивно). Вещество Р вызывает эндотелиум-зависимые релаксации. После вымывания агонистов добавляют известную концентрацию соединения формулы (I). После 30 минутного периода инкубации снова вводят простагландин F2a. (10-5 М) и такие же концентрации вещества Р, как указаны выше, в присутствии соединения, подлежащего тестированию. Релаксации, вызванные веществом Р,выражают как релаксации в контрольных условиях, процентное отношение ингибирования (% ингибирования) отклика на 10-9 М вещества Р берут как меру антагонистической активности соединения, подлежащего тестированию. Результаты для соединений настоящего изобретения при определенных тестовых концентрациях перечислены в таблице 5. Таблица 5 СоедКонцентрация ис- % Ингибироследуемого соедивания нения 1 3 х 10-8 15,0 2 3 х 10-8 41,1 3 3 х 10-7 35,2 4 3 х 10-8 10,2 5 3 х 10-8 80,7 6 3 х 10-8 85,3 7 3 х 10-8 54,0 8 1x10-8 14,7 9 3x10-8 78,1 10 3 х 10-8 89,3 11 3x10-8 81,1 12 3 х 10-8 92,3D. Примеры композиций. Термин "активный ингредиент" (А.И.), использованный в этих примерах, обозначает соединение формулы (I), его фармацевтически 39 пригодную соль присоединения, стереохимически изомерную форму или N-оксид. Пример D1. Раствор для орального применения. Метил 4-гидроксибензоат (9 г) и пропил 4 гидроксибензоат (1 г) растворяют в кипящей очищенной воде (4 л). В 3-х л этого раствора растворяют сначала 2,3-дигидроксибутандиоевую кислоту (10 г), а потом А.И. (20 г). Последний раствор объединяют с оставшейся частью предшествующего раствора и 1,2, 3 пропантриолом (12 л) и добавляют туда 70% раствор сорбита (3 л). Натрийсахарин (40 г) растворяют в воде (500 мл) и добавляют эссенции малины (2 мл) и крыжовника (2 мл). Последний раствор объединяют с предыдущим, добавляют воду до объема 20 л, получая раствор для орального применения, включающий 5 мг активного ингредиента на полную чайную ложку(5 мл). Полученным раствором наполняют подходящие контейнеры. Пример D2. Таблетки, покрытые оболочкой. Получение ядра таблетки. Смесь А.И. (100 г), лактозы (570 г) и крахмала (200 г) хорошо перемешивают и после этого увлажняют раствором додецилсульфата натрия (5 г) и поливинилпирролидона (10 г) в воде (200 мл). Влажный порошок просеивают, сушат и просеивают снова. Затем добавляют микрокристаллическую целлюлозу (100 г) и гидрированное растительное масло (15 г). Все хорошо перемешивают и прессуют таблетки, получая 10000 таблеток,каждая из которых содержит 10 мг активного ингредиента. Покрытие. К раствору метилцеллюлозы (10 г) в денатурированном этаноле (75 мл) добавляют раствор этилцеллюлозы (5 г) в СН 2 Сl2 (150 мл). Затем добавляют СН 2 Сl2 (75 мл) и 1,2,3-пропантриол (25 мл). Полиэтиленгликоль (10 г) расплавляют и растворяют в СН 2 Сl2 (75 мл). Последний раствор добавляют к предыдущему и затем добавляют октадеканоат магния (2,5 г), поливинилпирролидон (5 г) и концентрированную цветную суспензию (30 мл) и все гомогенизируют. Ядра таблеток покрывают полученной таким образом смесью в устройстве для нанесения покрытия. Пример D3. Раствор для инъекций. Метил 4-гидроксибензоат (1,8 г) и пропил 4-гидроксибензоат (0,2 г) растворяют в кипящей воде (500 мл) для инъекций. После охлаждения примерно до 50 С добавляют при перемешивании молочную кислоту (4 г), пропиленгликоль(0,05 г) и А.И. (4 г). Раствор охлаждают до КТ и дополняют водой для инъекций до объема 1 л,получая раствор, содержaщий 4 мг/мл А.И. Раствор стерилизуют путем фильтрации и заполняют им стерильные контейнеры. его N-оксидная форма, фармацевтически приемлемая соль присоединения и стереохимически изомерная форма, гдеm равно 1 или 2 при условии, что если m равно 2, то n равно 1; Х является ковалентной связью или бивалентным радикалом формулы -О-, -S-, -NR3-;R1 является Аr1, Аr1 C1-6 алкилом или ди(Аr1) C1-6 алкилом, где C1-6 алкильная группа необязательно замещена гидроксилом, C1-4 алкилокси-заместителем, оксо-заместителем или кетализованным оксо-заместителем формулы: где р равно 0, 1 или 2; У- является бивалентным радикалом формулы: -СН 2-, -СН(ОН)-, -С(=O)-, -О-, -S-, S(=O)-, -S(=O)2-, -NR3-, -CH2-NR3- или -C(=O)NR3-; или трехвалентным радикалом формулы-А=В- является бивалентным радикалом формулы -СН=СН-, -N=CH- или -CH=N-;R3 независимо является водородом или C1-6 алкилом;R4 является водородом, C1-6 алкилом; С 3-7 циклоалкилом или радикалом формулыZ является бивалентным радикалом формулы -О-, -S- или -NR3-; R7 является фенилом,фенилом, замещенным 1 или 2 заместителями,выбранными из галогена, C1-6 алкила или C1-6 алкилоксигруппы; фуранилом; фуранилом, замещенным 1 или 2 заместителями, выбранными из C1-6 алкила или гидрокси С 1-6 алкила; тиенилом; тиенилом, замещенным 1 или 2 заместителями, выбранными из галогена или С 1-6 алкила; оксазолилом; оксазолилом, замещенным 1 или 2Ar C1-6 алкилом; Аr1 является фенилом; фенилом, замещенным 1, 2 или 3 заместителями, каждый из которых независимо выбирают из галогена, C1-4 алкила, галоген-С 1-4 алкила, цианогруппы, аминокарбонила, C1-4 алкилоксигруппы, галоген-С 1-4 алкилоксигруппы; Аr2 является нафталинилом; фенилом; фенилом, замещенным 1, 2 или 3 заместителями,каждый из которых независимо выбирают из гидроксила, галогена, цианогруппы, нитрогруппы, аминогруппы, моно- или ди(C1-4 алкил)аминогруппы, С 1-4 алкила, галоген-C1-4 алкила, С 1-4 алкилоксигруппы, галоген-C1-4 алкилоксигруппы, карбоксила, С 1-4 алкилоксикарбонила, аминокарбонила и моно- или ди(C1-4 алкил)аминокарбонила; иHet является моноциклическим гетероциклом, выбранным из пирролила, пиразолила,имидазолила, фуранила, тиенила, оксазолила,изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклическим гетероциклом, выбранным из хинолинила, хиноксалинила, индолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила,бензофуранила и бензотиенила; каждый моноциклический и бициклический гетероцикл может быть необязательно замещен по атому углерода 1 или 2 заместителями, выбранными из галогена, С 1-4 алкила или моно-, ди- или три (галоген) метила. 2. Соединение по п.1, где L является радикалом формулы (А), и Het является моноциклическим гетероциклом, выбранным из пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклическим гетероциклом, выбранным из хинолинила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила и бензотиенила; каждый моноциклический и бициклический гетероцикл может быть необязательно замещен по атому углерода 1 или 2 заместителями, выбранными из галогена, С 1-4 алкила или моно-, ди- или три(галоген)метила. 3. Соединение по п.1, где L является радикалом формулы (В) и Het является моноциклическим гетероциклом, выбранным из пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклическим гетероциклом, выбранным из хинолинила, бензимидазолила, бензоксазолила, бензизоксазолила, 001247 42 бензотиазолила, бензизотиазолила, бензофуранила и бензотиенила; каждый моноциклический и бициклический гетероцикл может быть необязательно замещен по атому углерода 1 или 2 заместителями, выбранными из галогена, С 1-4 алкила или моно-, ди- или три(галоген)метила. 4. Соединение по любому из пп. с 1 по 3,где L является радикалом формулы (А), и р равно 0 или 1. 5. Соединение по любому из пп. с 1 по 4,где L является радикалом формулы (В), n равно 1 или 2, и m равно 1 или 2 при условии, что еслиm равно 2, то n равно 1. 6. Соединение по любому из пп. с 1 по 5,где R1 является Аr1 С 1-6 алкилом, R2 является фенилом, замещенным 2 заместителями, выбранными из метила или трифторметила, Х является ковалентной связью, и =Q является =О. 7. Соединение по любому из пп. с 1 по 6,где У- является -NH- или -О-; -А=В- является-СН=СН- или -N=CH-; R4 является радикалом формулы (с-1), где R7 является оксазолилом,замещенным 1 или 2 C1-6 алкильными заместителями, фуранилом, замещенным С 1-6 алкилом или гидрокси С 1-6 алкилом; или R4 является радикалом формулы (с-2) , где Z является бивалентным радикалом формулы -О-, и R8 C1-6aлкилом; R5 является водородом и R6 является водородом. 8. Соединение по п.1, отличающееся тем,что выбрано из 1-[3,5-бис(трифторметил)бензоил]-4-[4-1(2-этоксиэтил)-1 Н-бензимидазол-2-ил]амино]-1 пиперидинил]-2-(фенилметил) пиперидина; 1-[3,5-бис(трифторметил)бензоил]-4-[4-1[(2-метил-5-оксазолил)метил]-1H-бензимидазол-2-ил]амино]-1-пиперидинил]-2-(фенилметил)пиперидина; 1-[3,5-бис(трифторметил)бензоил]-4-[4-3(5-метил-2-фуранил)-3 Н-имидазо[4,5b]пиридин-2-ил]амино]-1-пиперидинил]-2(фенилметил)пиперидина; 1-[3,5-бис(трифторметил)бензоил]-4-[3-3[(5-метил-2-фуранил)метил]-3 Н-имидазо[4,5b]пиридин-2-ил]амино]-1-пирролидинил]-2(фенилметил)пиперидинa; 1-[3,5-бис(трифторметил)бензоил]-4-[4-1[(5-метил-2-фуранил)метил]-1 Н-бензимидазол 2-ил]амино]-1-пиперидинил]пиперидинa; 1-[3,5-бис(трифторметил)бензоил]-4-1-(2 этоксиэтил)-1 Н-бензимидазол-2-ил]амино]-2(фенилметил)пиперидинa; 1-[3,5-бис(трифторметил)бензоил]-4-1[(2-метил-4-оксазолил)метил]-1 Н-бензимидазол-2-ил]амино]-2-(фенилметил)пиперидина; 1-[3,5-бис(трифторметил)бензоил]-4-1[(5-метил-2-фуранил)-метил)-1 Н-бензимидазол 2-ил]амино]-2-(фенилметил) пиперидина,а также их стереоизомерные формы и фармацевтически приемлемые соли присоединения кислоты. 9. Фармацевтическая композиция, отличающаяся тем, что включает фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп. с 1 по 8. 10. Способ получения композиции, заявленной в п.9, отличающийся тем, что фармацевтически приемлемый носитель тщательно смешивают с терапевтически эффективным количеством соединения по любому из пп. с 1 по 8. 11. Применение соединения, заявленного в любом из пп.1-8, в качестве лекарственного средства. 12. Способ получения соединения, заявленного в п.1, отличающийся тем, что включает: а) реакцию промежуточного соединения формулы (II), где R2, Х и =Q определены как в п.1, и W1 является подходящей уходящей группой, с промежуточным соединением формулы где n, m, L и R1 определены как в п.1, в реакционно-инертном растворителе и в присутствии подходящего основания; б) восстановительное N-алкилирование промежуточного соединения формулы (V), где р, У-, -А=В-, R4, R5 и R6 определены, как в п.1, с промежуточным соединением формулы где R1, R2, X, Q, n и m определены, как в п.1, в реакционно-инертном растворителе и в присутствии восстановителя и необязательно в присутствии подходящего катализатора; с получением соединения формулы (I-A); в) восстановительное N-алкилирование промежуточного соединения формулы (VI), где-А=В-, R3, R4 и R5 определены как в п.1, с промежуточным соединением формулы (IV): где R1, R2, X, Q, n и m определены, как в пункте 1, в реакционно-инертном растворителе и в присутствии восстановителя и необязательно в при 44 сутствии подходящего катализатора; с получением соединения формулы (I-B-1); г) реакцию промежуточного соединения формулы (VII), где R1, R2, R3, X, Q, n и m определены как в п.1, с промежуточным соединением формулы (VIII): где W2 является подходящей уходящей группой,и -А=В-, R4 и R5 определены как в п.1, в присутствии подходящего катализатора и необязательно в реакционно-инертном растворителе; с получением соединения формулы (I-B-1); д) реакцию промежуточного соединения формулы (IX), где W3 является подходящей уходящей группой, и R1, R2, X, Q, n и m определены как в п.1, с промежуточным соединением формулы (X): где -А=В-, R4 и R5 определены как в п.1, в реакционно-инертном растворителе и в присутствии подходящего основания; с получением соединения формулы (I-B-2); е) реакцию промежуточного соединения формулы (XI), где R1, R2, X, Q, n и m определены как в п.1, с промежуточным соединением формулы (VIII): где W2 является подходящей уходящей группой,и -А=В-, R4 и R5 определены как в п.1, в реакционно-инертном растворителе и в присутствии подходящего основания; с получением соединения формулы (I-B-3); и, если требуется, превращение соединений формулы (I) друг в друга, следуя известным в уровне техники процедурам; и, кроме того,если требуется, превращение соединений формулы (I) в терапевтически активные нетоксические соли присоединения кислоты посредством обработки кислотой, или в терапевтически активные нетоксические соли присоединения основания посредством обработки основанием; или превращение соли присоединения кислоты в свободное основание посредством обработки щелочью; или превращение соли присоединения основания в свободную кислоту посредством обработки кислотой; и, если требуется, получение их стереохимически изомерных форм или
МПК / Метки
МПК: A61K 31/445, A61P 1/06, C07D 401/14
Метки: антагонисты, имидазопиридинил, замещенные, n-ацил-2-замещенный-4-(бензимидазолил, тахикинина, остатки)-пиперидины
Код ссылки
<a href="https://eas.patents.su/23-1247-n-acil-2-zameshhennyjj-4-benzimidazolil-ili-imidazopiridinil-zameshhennye-ostatki-piperidiny-kak-antagonisty-tahikinina.html" rel="bookmark" title="База патентов Евразийского Союза">N-ацил-2-замещенный-4-(бензимидазолил- или имидазопиридинил -замещенные остатки)-пиперидины как антагонисты тахикинина.</a>
Предыдущий патент: Синтез гидроксисульфона и родственных соединений.
Случайный патент: Фармацевтические композиции на основе тизоксанида и нитазоксанида