Трициклические бензазепины как антагонисты вазопрессина, способ их получения, фармкомпозиция на их основе и способ лечения.
Номер патента: 752
Опубликовано: 24.04.2000
Авторы: Венкатесан Аранапакан Мудумбай, Делос Сантос Эфрен Гильермо, Олбрайт Джей Дональд
Формула / Реферат
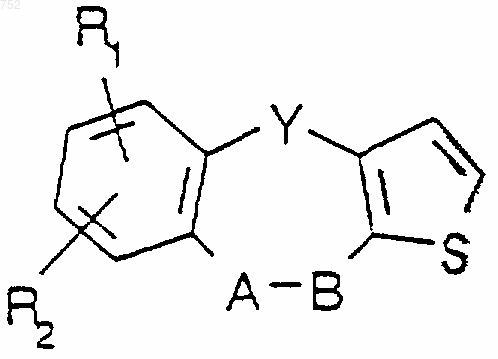
1. Соединение общей формулы I

Формула I
где Y обозначает (СН2)n, О, S, NH, NСОСН3, N-(С1-С3)алкил, СН-(С1-С3)алкил, СНNН-(С1-С3)алкил, CHNH2, СНN[(С1-С3)алкил]2, СНО-(С1-С3)алкил, СНS-(С1-С3)алкил,
где n обозначает целое число 0-2;
А-В обозначает
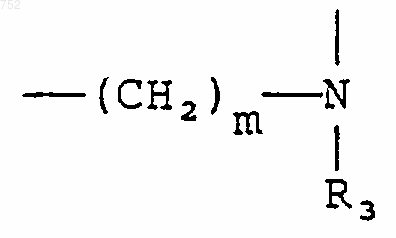
или
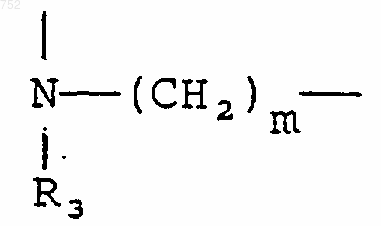
где m равно целому числу 1-2, при условии, что, когда Y представляет -(СН2)n- и n=2, то m может также быть равным нулю, и когда n равно нулю, m может также быть равным трем, и также при условии, что если Y обозначает -(СН2)n- и n равен 2, то m не может также равняться двум;
R1 обозначает водород, галоген (хлор, бром, фтор, йод), ОН, -S-(С1-С3)алкил, -SH, -SО-(С1-С3)алкил, -SО2-(С1-С3)алкил, -СО-(С1-С3)алкил, -СF3, (С1-С3)алкил, O-(С1-С3)алкил, -NO2, -NH2, -NHCO(С1-С3)алкил, -N[(С1-С3)алкил]2, -SО2NН2, -SО2NН(С1-С3)алкил или -SO2N[(С1-С3)алкил]2;
R2 обозначает водород, Cl, Br, F, I, -ОН, (С1-С3)алкил, О-(С1-С3)алкил или взятые вместе R1 и R2 представляют собой метилендиокси или этилендиокси;
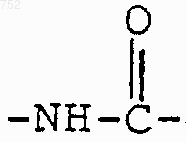
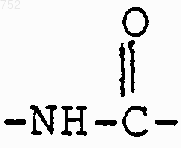
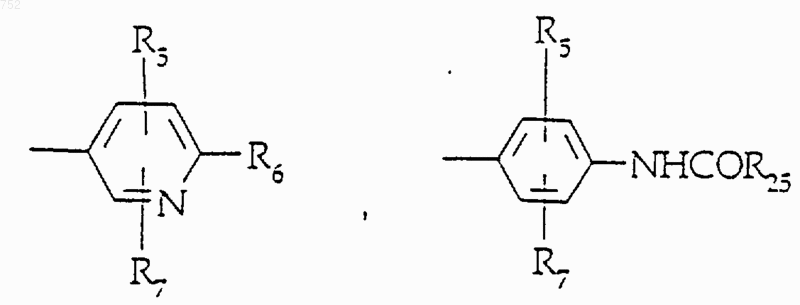
R3 обозначает радикал
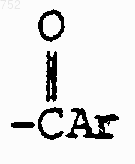
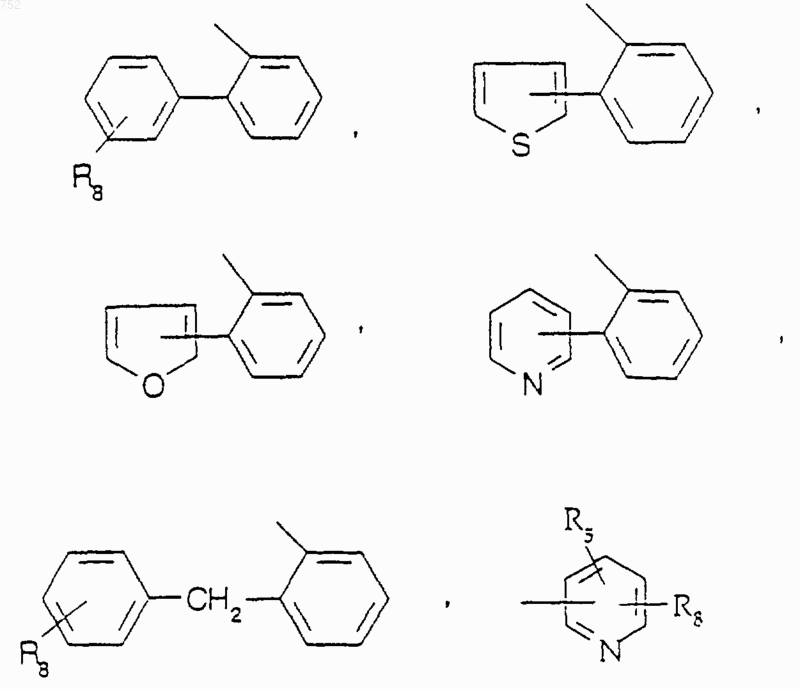
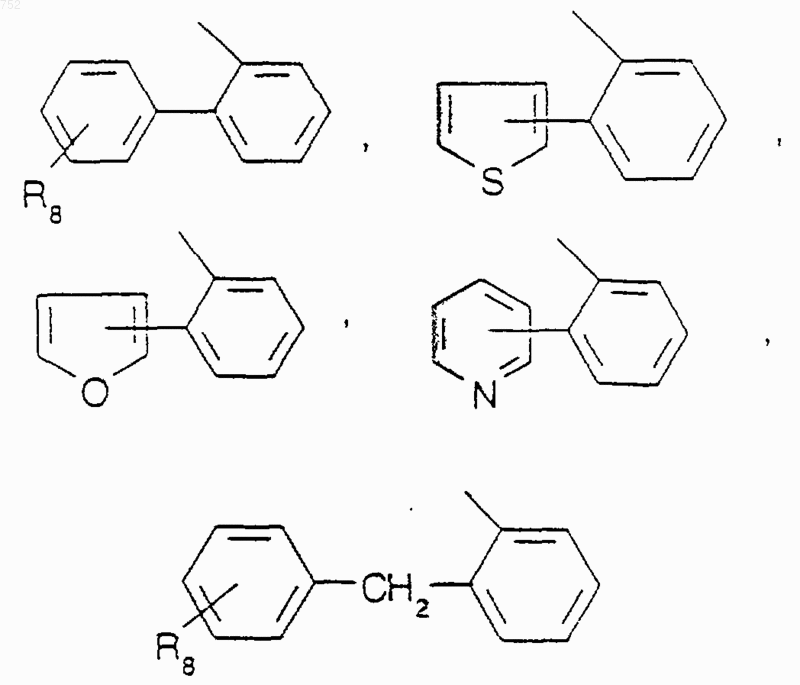
где Аr обозначает радикал, выбранный из группы
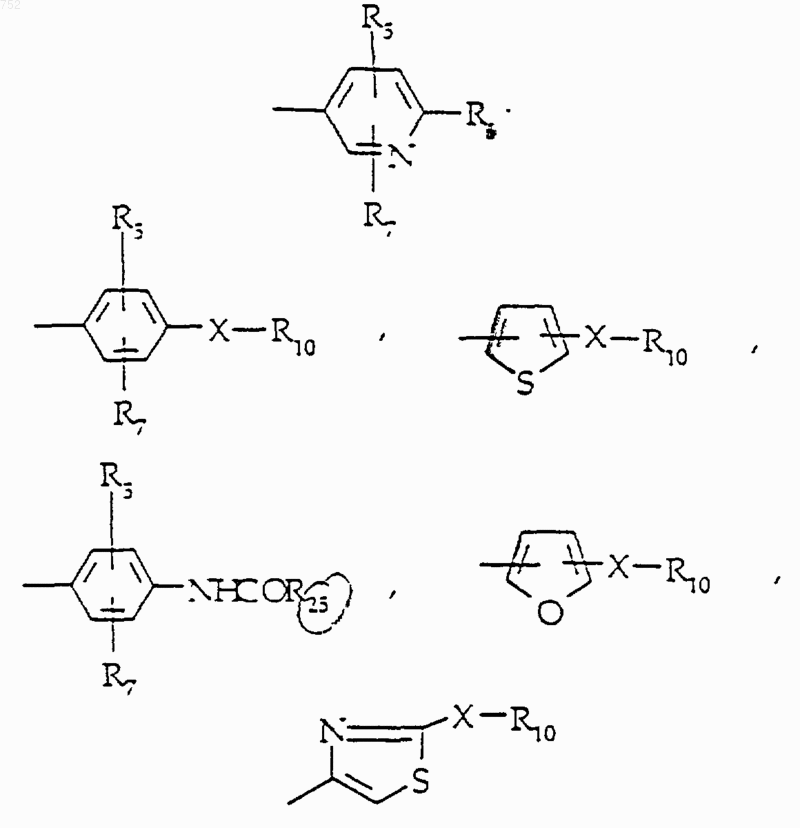
и X обозначает О, S, -NСН3 или -NH;
R4 обозначает водород, (С1-С3)алкил, -СО-(С1-С3)алкил;
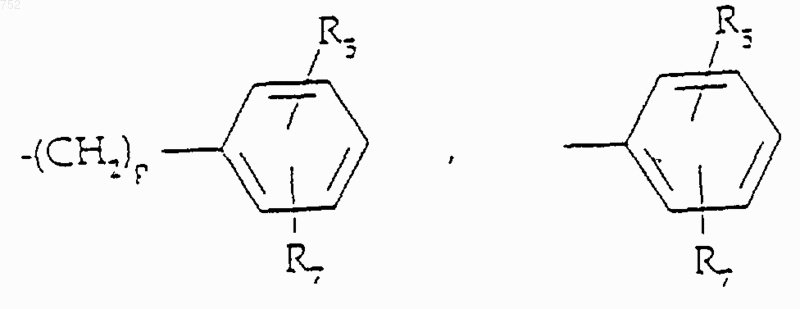
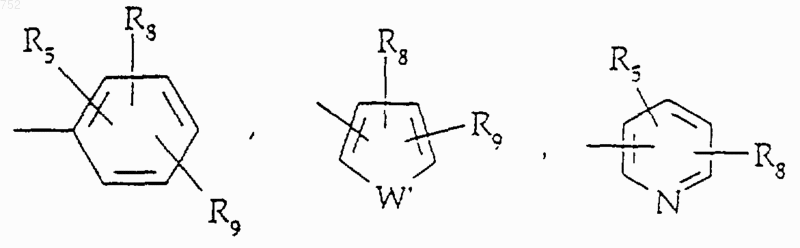
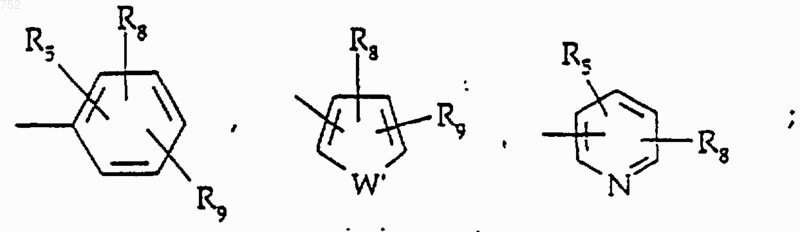
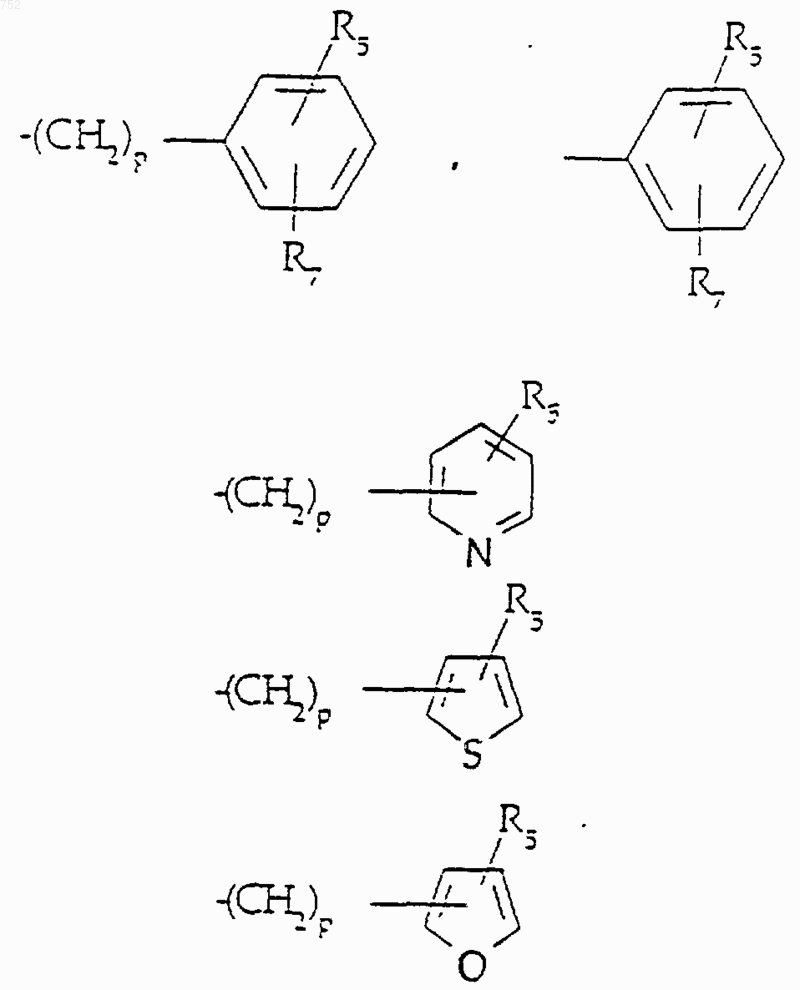
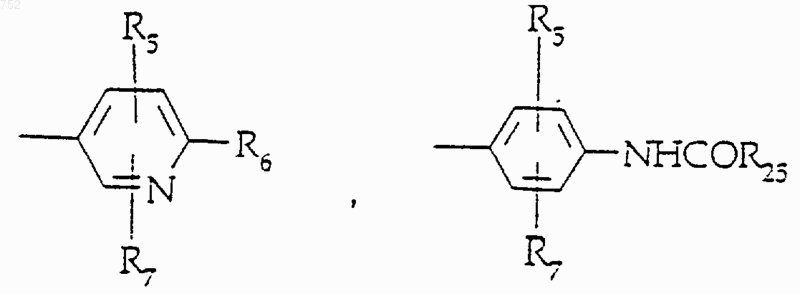
R5 и R7 выбирают из группы, включающей водород, (С1-С3)алкил, (С1-С3)алкокси и галоген;
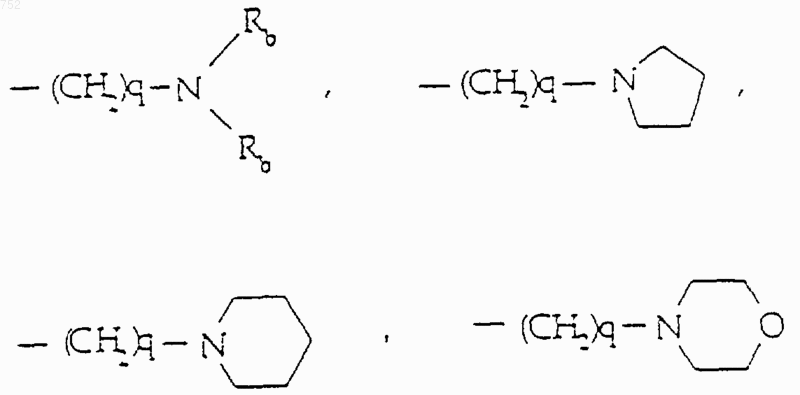
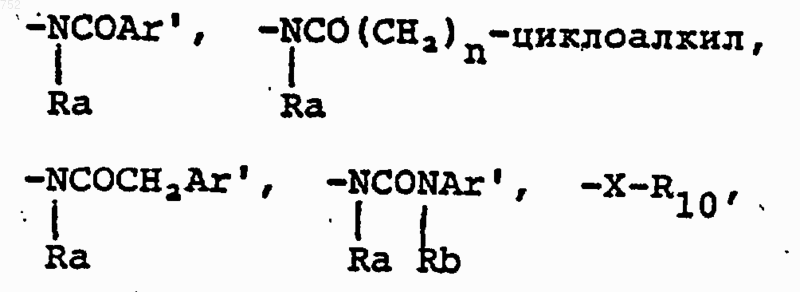
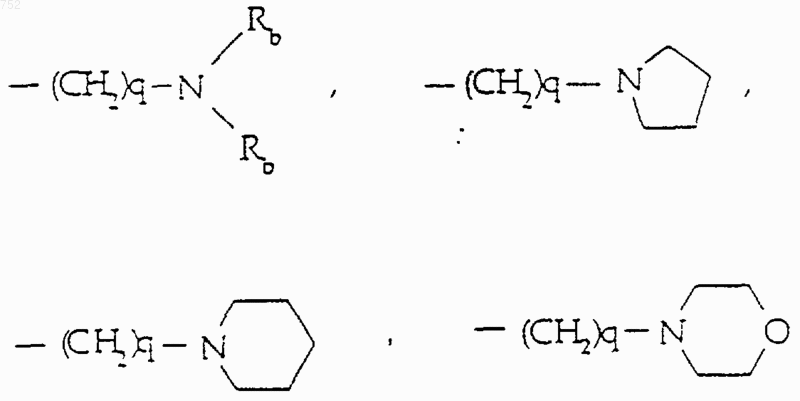
R6 выбран из
а) радикалов формулы
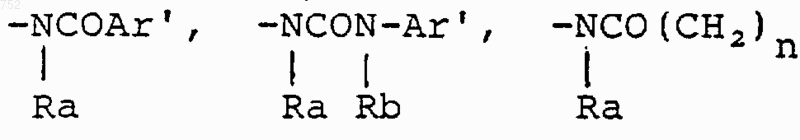
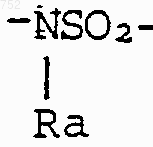
 (С3-С8)алкенил,
(С3-С8)алкенил, 
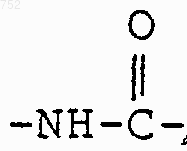

где циклоалкил определяется как С3-С6-циклоалкил, циклогексенил или циклопентенил; Ra обозначает водород, СН3, C2H5, радикалы формулы
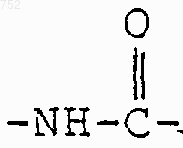
-(СН2)2O-(С1-С3)алкил или -СН2СН2ОН;
q равно единице, двум или трем;
Rb обозначает водород, -СН3, или -С2Н5;
b) радикалов формулы
-X-R10; где R10 обозначает (С3-С8)алкил, (С3-С8)алкенил, -(СН2)p (С3-С6)циклоалкил,
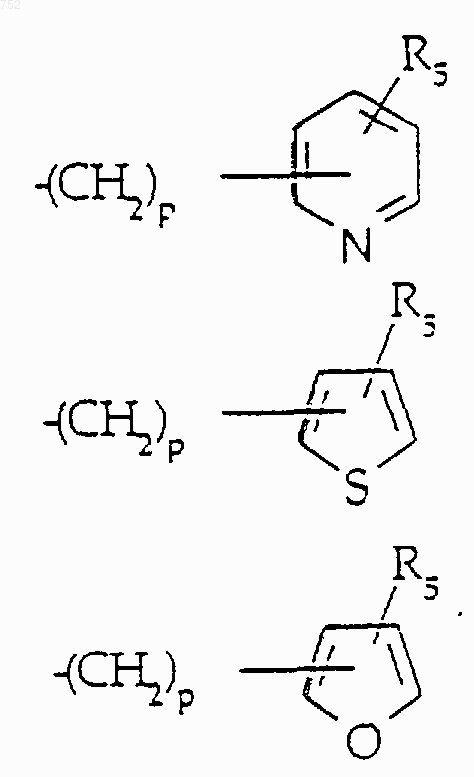
и р равно 0-3;
Х обозначает О, S, NH, NСН3,
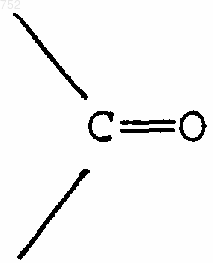
или простую связь,
и R5 и R7 имеют принятые выше значения;
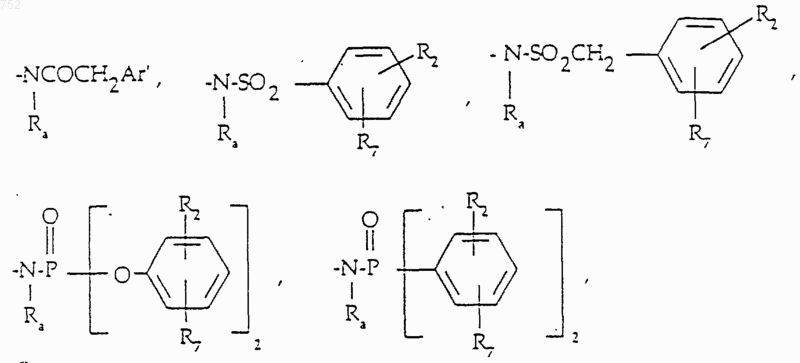
с) радикалов формулы
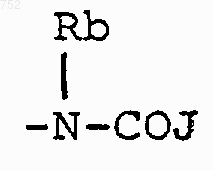
где J обозначает Ra, (С3-С8)алкил, разветвленный или неразветвленный, (С3-С8)алкенил, разветвленный или неразветвленный, -O-(С3-С8)алкил, разветвленный или неразветвленный, -O-(С3-С8)алкенил, разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен, радикалы
или -СН2-К', где К' обозначает галоген, -ОН, тетрагидрофуран, тетрагидротиофен или гетероциклический радикал
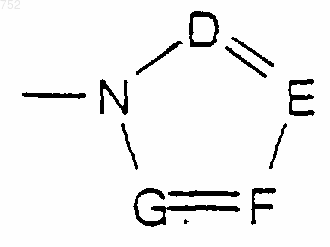
где D, Е, F и G выбраны из углерода или азота и где углеродные атомы могут необязательно быть замещены галогеном,
(С1-С3)алкилом, гидрокси, -СО-(С1-С3)алкилом, СНО, (C1-С3)алкокси, -СО2-(С1-С3)алкилом и Ra и Rb имеют указанные выше значения;
d) радикалов, имеющих следующие формулы
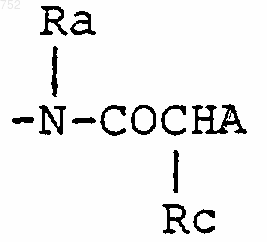
 (C1-С3)алкил, -S-(C1-С3)алкил,
(C1-С3)алкил, -S-(C1-С3)алкил,
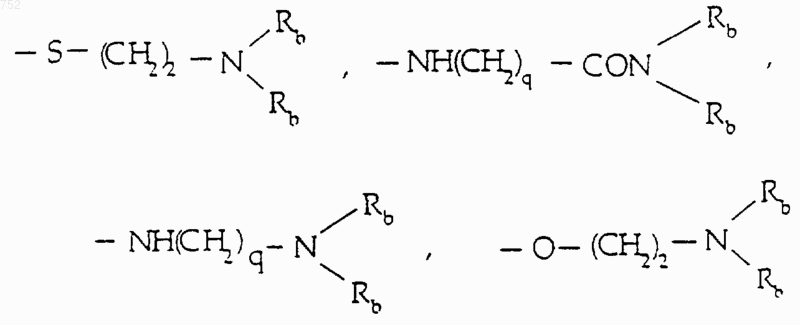
где Rc выбран из галогена, (C1-С3)алкила, -O-(C1-С3)алкила и ОН, Rb имеет принятые выше значения;
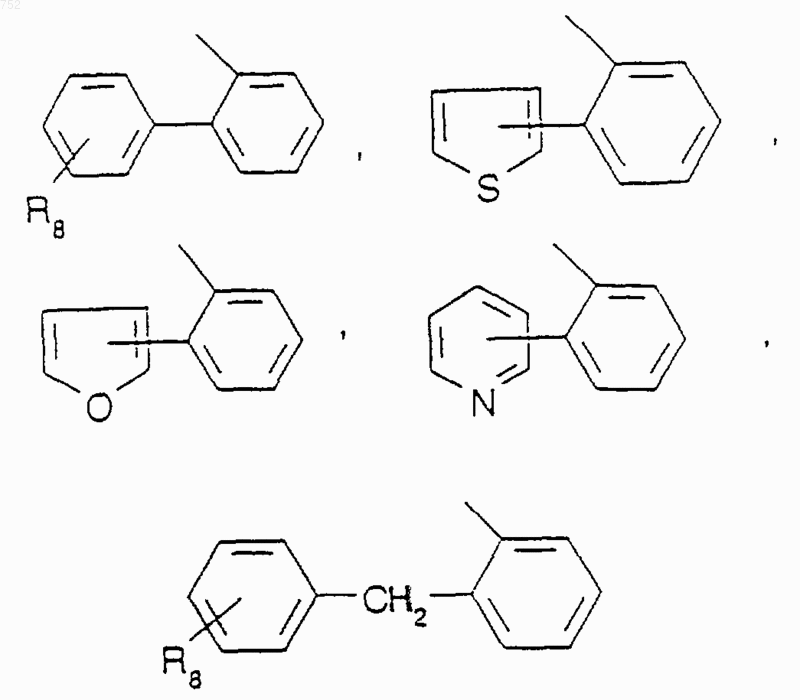
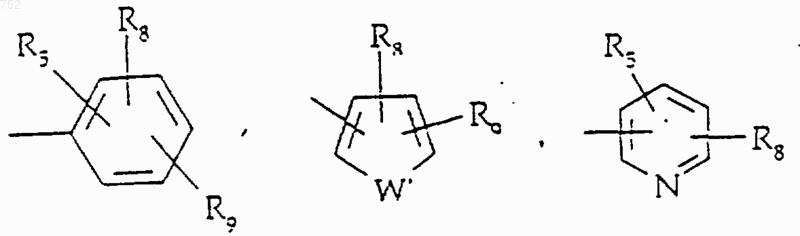
где Аr' обозначает радикал, который выбран из группы
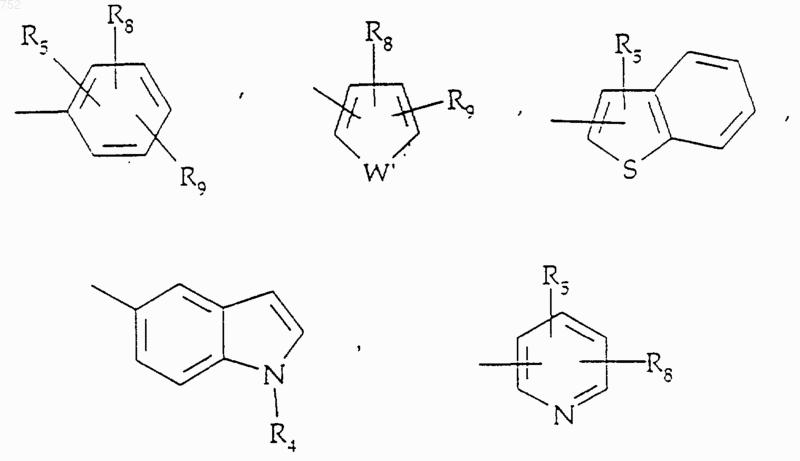
R8 и R9 независимо обозначают водород, (C1-С3)алкил, O-(C1-С3)алкил, S-(C1-С3)алкил, -СF3, -CN, -ОН, -SСF3, -ОСF3, галоген, NО2, амино или -NH-(C1-С3)алкил, -N-[(C1-С3)алкил]2, -N(Rb)(CH2)q-N(Rb)2;
W' выбран из О, S, NH, N-(C1-С3)алкила, -NСО-(C1-С3)алкила или NSО2-(C1-С3)алкила,
R25 выбран из радикалов
и группа
обозначает: 1) фенил или замещенный фенил, необязательно замещенный одним или двумя заместителями, которые выбраны из (C1-С3)алкила, галогена, амино, (C1-С3)алкокси или (C1-С3)алкиламино; 2) 5-членный ароматический (ненасыщенный гетероцикл, содержащий один гетероатом, который выбирают из О, N или S; 3) 6-членный ароматический (ненасыщенный) гетероцикл, содержащий один атом азота; 4) 5- или 6-членный ароматический (ненасыщенный) гетероцикл, содержащий два атома азота; 5) 5-членный ароматический (ненасыщенный) гетероцикл, содержащий один атом азота вместе с одним атомом кислорода, либо с одним атомом серы; где 5- или 6-членные гетероциклы необязательно замещены (C1-С3)алкилом, формилом, радикалом формулы
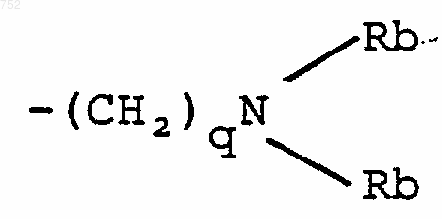
галогеном или (C1-С3)алкокси;
и их фармацевтически приемлемых солей, сложных эфиров и пролекарственных форм.
2. Соединение по п.1, отличающееся тем, что группа
выбрана из группы, включающей
фенильное кольцо, необязательно замещенное одним или двумя заместителями, выбранными из (C1-С3)алкила, галогена, амино, (C1-С3)алкокси и (C1-С3)алкиламино;
6-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее один атом азота;
6-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее два атома азота;
5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее один атом серы;
5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее один атом кислорода;
5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее один атом азота;
5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее два атома азота;
5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее один атом азота и один атом серы;
5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее один атом азота и один атом кислорода;
6-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее один атом азота, где 6-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее один атом азота, необязательно замещено (C1-С3)алкилом, формилом, радикалом формулы
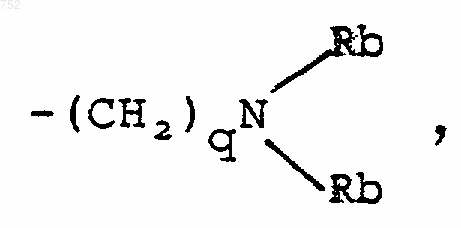
галогеном или (C1-С3)алкокси;
или 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее один атом S, где 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо необязательно замещено (C1-С3)алкилом; и его фармацевтически приемлемые соли, сложные эфиры и пролекарственные формы.
3. Соединение по п.2, отличающееся тем, что Y выбран из -СН2-
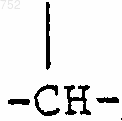 (C1-С3)алкил,
(C1-С3)алкил, 
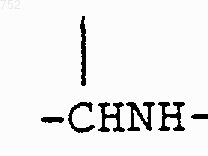
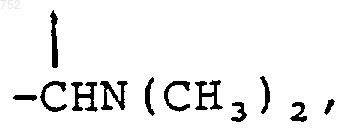
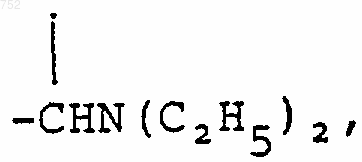
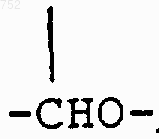 (C1-С3)алкил,
(C1-С3)алкил,
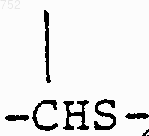 (C1-С3)алкил.
(C1-С3)алкил.
4. Соединение по п.2, отличающееся тем, что Y обозначает -(СН2)n-, где n равно 0.
5. Соединение по п.2, отличающееся тем, что Y выбран из О, S, NH, NНСОСН3 и N-(C1-С3)алкила.
6. Соединение по п.1, отличающееся тем, что Y выбран из группы, включающей -(СН2)n-,
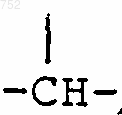 (C1-С3)алкил,
(C1-С3)алкил, 
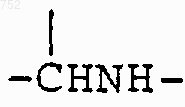 (C1-С3)алкил,
(C1-С3)алкил, 
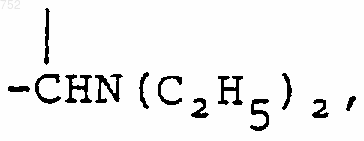
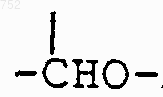 (C1-С3)алкил,
(C1-С3)алкил,
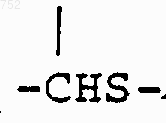
где n обозначает целое число ноль или один
и R6 выбран из группы
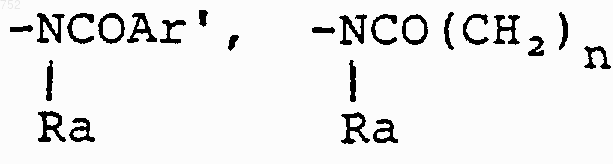

где Аr' выбран из группы
W' обозначает О или S.
7. Соединение по п.6, отличающееся тем, что n равно 1.
8. Соединение по п.7, отличающееся тем, что группа
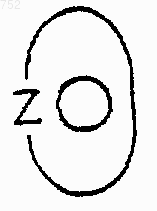
обозначает фенильное кольцо, необязательно замещенное одним или двумя заместителями, выбранными из (C1-С3)алкила, галогена, амино, (C1-С3)алкокси и (C1-С3)алкиламино.
9. Соединение по п.6, отличающееся тем, что Y обозначает -(СН2)n-, где n равно нулю
и группа
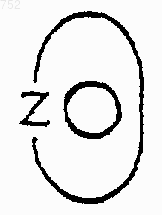
представляет фенильное кольцо, необязательно замещенное одним или двумя заместителями, выбранными из (C1-С3)алкила, галогена, амино, (C1-С3)алкиламино.
10. Соединение по п.5, отличающееся тем, что R6 выбран из группы
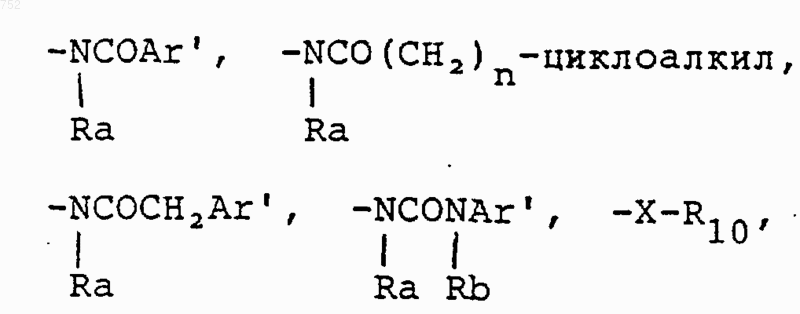
где Аr' выбран из группы
W' обозначает О или S; и
группа
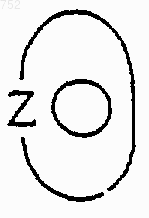
обозначает фенильное кольцо, необязательно замещенное одним или двумя заместителями, выбранными из (C1-С3)алкила, галогена, амино, (C1-С3)алкокси и (C1-С3)алкиламино.
11. Соединение по п.6, отличающееся тем, что Y обозначает -(СН2)n-, где n равно нулю; и
группа
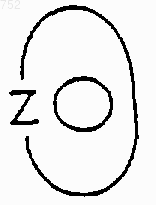
обозначает 6-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее один aтом азота.
12. Соединение по п.7, отличающееся тем, что Y обозначает -СН2-; и
группа
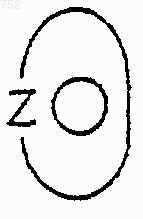
обозначает 6-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее один атом азота.
13. Соединение по п.6, отличающееся тем, что Y обозначает -(СН2)n-, n обозначает целое число ноль; и
группа
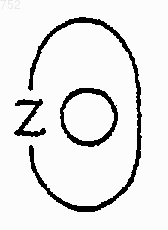
обозначает 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее один атом серы.
14. Соединение по п.7, отличающееся тем, что Y обозначает-CH2-; и
группа
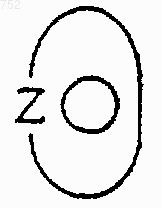
обозначает 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее один атом серы.
15. Соединение по п.5, отличающееся тем, что R6 выбран из группы
где Аr' выбран из группы
W' обозначает О или S; и
группа
обозначает 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, имеющее один атом серы.
16. Соединение по п.1, отличающееся тем, что оно имеет формулу
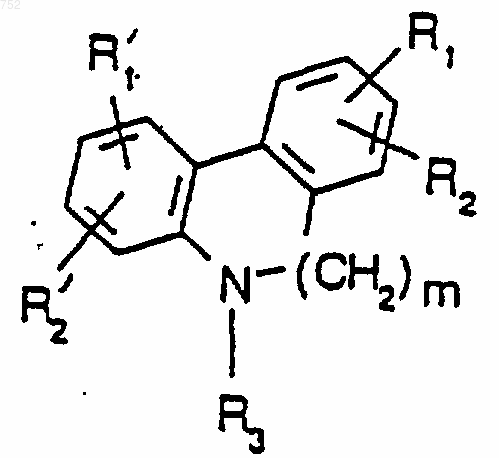
где R1' и R2' независимо обозначают водород, (C1-С3)алкил, галоген, амино, (C1-С3)алкокси или (C1-С3)алкиламино; и
m обозначает целое число ноль или два;
и его фармацевтически приемлемые соли.
17. Соединение по п.1, отличающееся тем, что оно имеет формулу
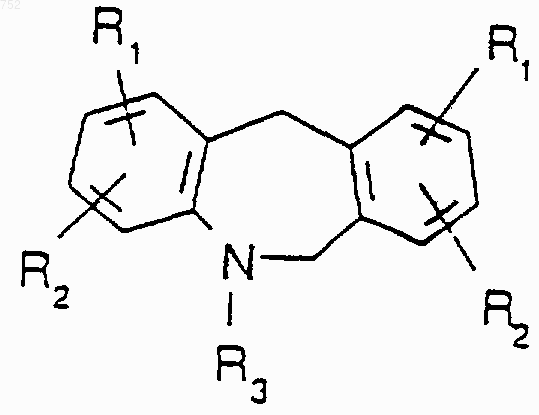
и его фармацевтичеёъш приемлемые соли.
18. Соединение, имеющее следующую формулу:
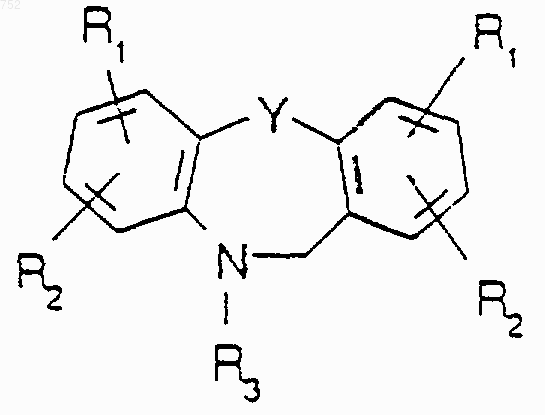
где Y выбран из О, S, NH и N-(C1-С3)алкила;
R1 обозначает водород, галоген (хлор, бром, фтор, йод), ОН, S-(C1-C3)алкил, SH, -SO-(C1-C3)алкил, -SО2-(C1-C3)алкил, -СО-(C1-C3)алкил, -СF3, (C1-C3)алкил, О-(C1-C3)алкил, -NO2, -NH2, -NHCO(C1-C3)алкил, -N-[(C1-C3)алкил]2, -NH-(C1-C3)алкил, -SO2NH2-, -SO2NH(C1-C3)алкил или -SO2N[(C1-C3)алкил]2;
R2 обозначает водород, Cl, Br, F, I, -ОН, (C1-C3)алкил, или R1 и R2 вместе образуют метилендиокси или этилендиокси;
RЗ обозначает радикал
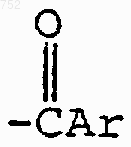
где Аr выбран из радикалов формул
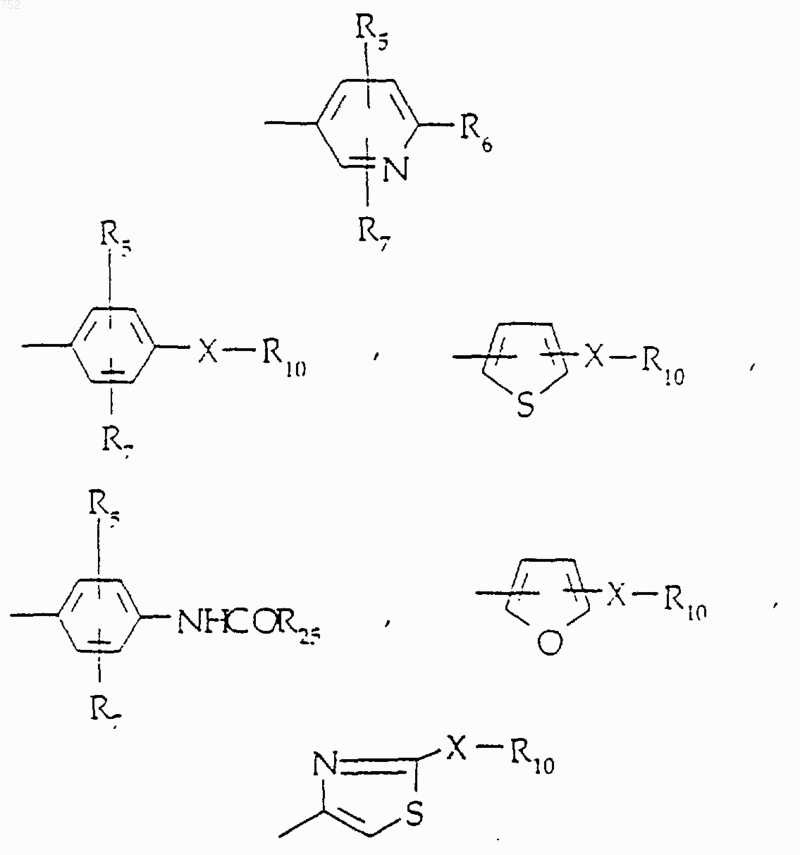
R5 и R7 выбраны из: водорода, (C1-C3)алкила, (C1-C3)алкокси и галогена;
R6 выбран из
а) радикалов формулы


 (C3-C8)алкил,
(C3-C8)алкил, 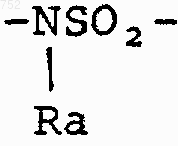 (C3-C8)алкенил,
(C3-C8)алкенил,
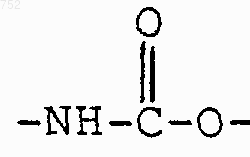
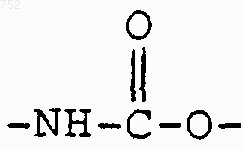
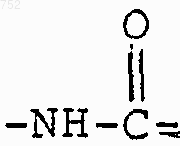
где циклоалкил определяется как С3-С6-циклоалкил, циклогексенил или циклопентенил; Ra обозначает водород, СН3, С2Н5, радикалы формул
-(СН2)2-O-(C1-C3)алкил или -СH2CH2CO; q равно одному, двум или трем; Rb обозначает водород, -СН3 или С2Н5; и
b) радикалов формулы
-X-R10, где R10 обозначает (C3-C8)алкил, (C3-C8)алкенил, -(СН2)p-(C3-C6)циклоалкил,
и р равен нулю или трем;
Х обозначает О, S, NH, NСН3,
или простую связь, а
R5 и R7 имеют указанные выше значения;
с) радикалов формулы
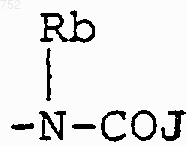
где J обозначает Ra, (C3-C8)алкил, линейный или разветвленный, (C3-C8)алкенил, линейный или разветвленный, -О-(C3-C8)алкил, линейный или разветвленный, -O-(C3-C8)алкенил, линейный или разветвленный, тетрагидрофуран, тетрагидротиофен, радикалы
или -СН2-К', где К' обозначает галоген, -ОН, тетрагидрофуран, тетрагидротиофен или гетероциклический радикал
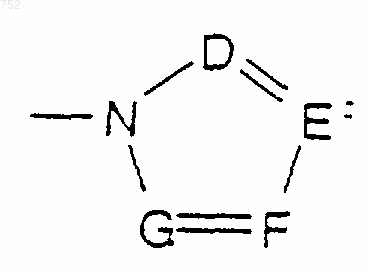
в котором D, Е, F и G выбраны из углерода или азота и где углеродные атомы могут необязательно быть замещены галогеном, (С1-С3)алкилом, гидрокси, -СО-(C1-C3)алкилом, СНО, (C1-C3)алкокси, -СО2-(C1-C3)алкилом, и Ra и Rb имеют указанные выше значения;
d) радикалов, которые выбраны из радикалов формул
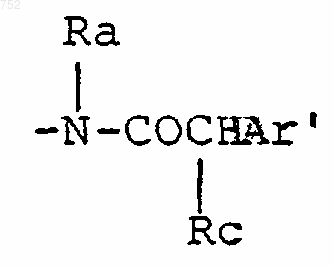
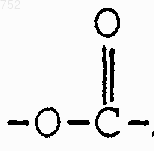
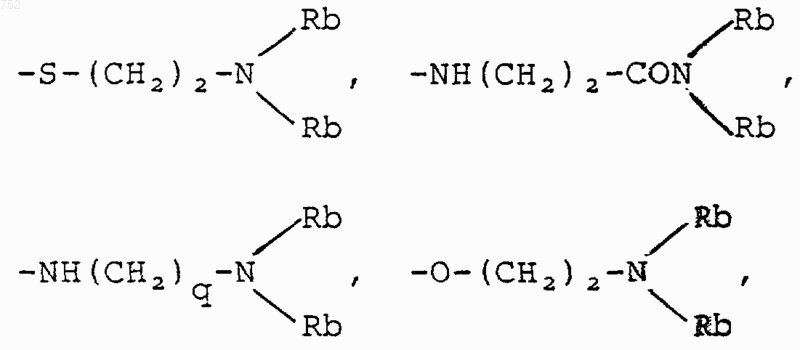
где Rc выбран из галогена, (C1-C3)алкила, -О-(C1-C3)алкила и ОН, Rb имеет указанные выше значения;
Аr' обозначает радикал, который выбран из группы

R8 и R9 независимо обозначают водород, (C1-C3)алкил, О-(C1-C3)алкил, S-(C1-C3)алкил, CF3, -CN, -ОН, -SСF3, галоген, NO2, амино или NН-(C1-C3)алкил, N-[(C1-C3)алкил]2, -N(Rb)(CH2)q-N(Rb)2;
R25 выбран из радикалов
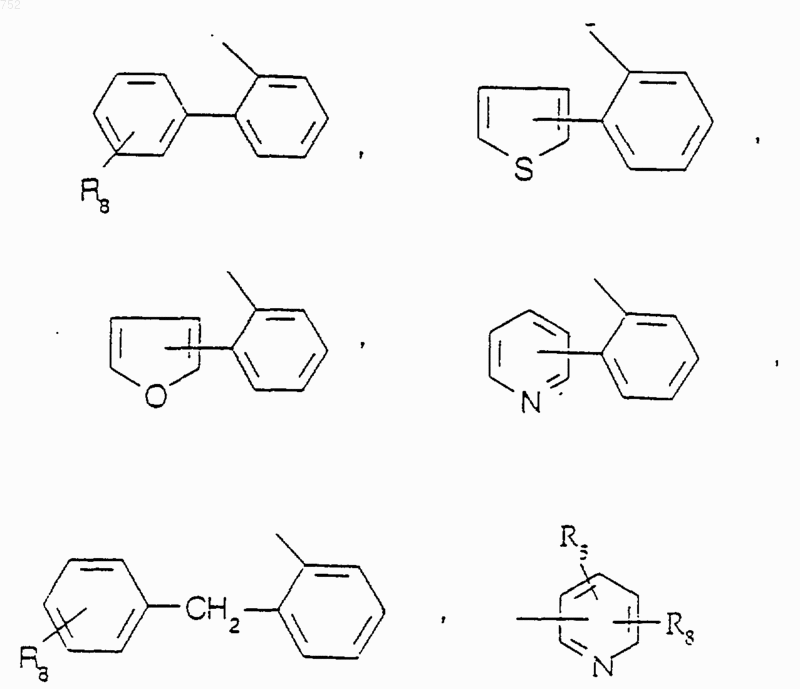
W' обозначает O, S, NH, N-(C1-C3)алкил, NCO-(C1-C3)алкил или NSO2-(C1-C3)алкил и их фармацевтически приемлемых солей.
19. Соединение по п.1, отличающееся тем, что оно выбрано из группы, включающей
N-[5-[(6,11-дигидро-5Н-дибенз[b,е]азепин-5-ил)карбонил]-2-пиридинил][1,1'-бифенил]-2-карбоксамид;
N-[5-[(6,11-дигидро-5Н-дибенз[b,е]азепин-5-ил)карбонил]-2-пиридинил]-2-диметиламино-пиридин-3-карбоксамид;
N-[5-[(6,11-дигидро-4Н-тиено[2,3-с][1]бензазепин-9-ил)карбонил]-2-пиридинил]-2-диметиламинопиридин-3-карбоксамид;
N-[5-[(4,10-дигидро-5Н-тиено[3,2-с][1]бензазепин-5-ил)карбонил]-2-пиридинил][1,1'-бифенил]-2-карбоксамид;
N-[5-[(4,10-дигидро-5Н-тиено[3,2-с][1]бензазепин-5-ил)карбонил]-2-пиридинил]-2-диметиламинопиридин-3-карбоксамид;
N-[5-[(9,10-дигидро-4Н-тиено[2,3-с][1]бензазепин-9-ил)карбонил]-2-пиридинил]-5-фтор-2-метилбензамид;
N-[5-[(4,10-диrидpo-5H-тиeнo[3,2-c][1]бензазепин-5-ил)карбонил]-2-пиридинил]-5-фтор-2-метилбензамид;
N-[5-[(4,5-дигидропиразоло[4,3-d][1]бензазепин-6(1H)-ил)карбонил]-2-пиридинил]-2-диметиламинопиридин-3-карбоксамид;
N-[5-[(4,5-дигидропиразоло[4,3-d][1]бензазепин-6(1Н)-ил)карбонил]-2-пиридинил]-5-фтор-2-бензамид;
N-[5-(пиридо[2,3-b][1,4]бензоксазепин-5(6Н)-илкарбонил]-2-пиридинил]-5-фтор-2-метилбензамид;
N-[4-(дибенз[b,f][1,4]оксазепин-10(11Н)-илкарбонил)фенил]-[1,1'-бифенил]-2-карбоксамид;
N-[4-(дибeнз[b,f][1,4]оксазепин-10(11Н)-илкарбонил)-3-хлорфенил][1,1'-бифенил]-2-карбоксамид;
N-[5-(дибенз[b,f][1,4]оксазепин-10(11H)-илкарбонил)-2-пиридинил]-5-фтор-2-метилбензамид;
N-[5-(дибенз[b,f][1,4]оксазепин-10(11H)-илкарбонил)-2-пиридинил]-2-(4-пиридинил)бензамид;
N-[5-(пиридо[2,3-b][1,5]бензоксазепин-6(5Н)-илкарбонил)-2-пиридинил][1,1'-бифенил]-2-карбоксамид;
N-[5-(пиридо[2,3-b][1,4]бензоксазепин-5(6Н)-илкарбонил)-2-пиридинил][1,1'-бифенил]-2-карбоксамид;
N-[4-(пиридо[2,3-b][1,4]бензоксазепин-5(6Н)-илкарбонил)-3-хлорфенил][1,1'-бифенил]-2-карбоксамид;
N-[4-(6,11-дигидpoпиpидo[2,3-b][1,5]бензодиазепин-6(5Н)-илкарбонил)фенил][1,1'-бифенил]-2-карбоксамид;
N-[4-(6,11-дигидропиридо[2,3-b][1,5]бензодиазепин-6(5Н)-илкарбонил)-3-хлорфенил][1,1'-бифенил]-2-карбоксамид;
N-[4-(6,11-дигидропиридо[2,3-b][1,5]бензодиазепин-6(5Н)-илкарбонил)фенил][1,1'-бифенил]-2-карбоксамид;
N-[4-(5,11-дигидро-10-дибенз[b,е][1,4]диазепин-10-ил)карбонил]-3-хлорфенил][1,1'-бифeнил]-2-кapбoкcaмид;
N-[4-(5,11-дигидро-10-дибенз[b,е][1,4]диазепин-10-ил)карбонил]-фенил][1,1'-бифенил]-2-карбоксамид;
N-[4-(5,11-дигидро-10-дибенз[b,е][1,4]диазепин-10-ил)карбонил]-3-метилфенил][1,1'-бифенил]-2-карбоксамид;
N-[4-(5,11-дигидро-10-дибенз[b,e][1,4]диазепин-10-ил)карбонил]-2-метилфенил][1,1'-бифенил]-2-карбоксамид;
N-[4-(5,11-дигидро-10-дибенз[b,е][1,4]диазепин-10-ил)карбонил]-2-хлорфенил][1,1'-бифенил]-2-карбоксамид;
N-[4-(6,11-дигидро-5Н-дибенз[b,e]азепин-5-ил)карбонил]фенил]-[1,1'-бифенил]-2-карбоксамид;
N-[4-(6,11-дигидро-5Н-дибенз[b,е]азепин-5-ил)карбонил]-3-хлорфенил][1,1'-бифенил]-2-карбоксамид;
N-[4-(6,11-дигидро-5Н-дибенз[b,е]азепин-5-ил)карбонил]-3-метилфенил][1,1'-бифенил]-2-карбоксамид;
N-[4-(6,11-дигидро-5Н-дибенз[b,е]азепин-5-ил)карбонил]-2-хлорфенил][1,1'-бифенил]-2-карбоксамид;
N-[5-(6,11-дигидро-5Н-пиридо[2,3-b][1,4]бензодиазепин-5-ил)карбонил]-2-пиридинил]-5-фтор-2-метилбензамид;
N-[4-(6,11-дигидро-5Н-пиридо[2,3-b][1,4]бензодиазепин-5-ил)карбонил]-3-хлорфенил][1,1'-бифенил]-2-карбоксамид;
N-[4-(6,11-дигидро-5Н-пиридо[2,3-b][1,4]бензодиазепин-5-ил)карбонил]фенил][1,1'-бифенил]-2-карбоксамид;
N-[4-(6,11-дигидро-5Н-пиридо[2,3-b][1,4]бензодиазепин-5-ил)карбонил]-3-метилфенил] [1,1'-бифенил]-2-карбоксамид;
N-[4-(4,5-дигидропиразоло[4,3-d][1]бензазепин-6(1Н)-ил)карбонил]фенил][1,1'-бифенил]-2-карбоксамид;
N-[4-(4,5-дигидропиразоло[4,3-d][1]бензазепин-6(1H)-ил)карбонил]-3-хлорфенил][1,1'-бифенил]-2-карбоксамид;
N-[5-(4,5-дигидропиразоло[4,3-d][1]бензазепин-6(1H)-ил)карбонил]-2-пиридинил][1,1'-бифенил]-2-карбоксамид;
N-[5-(4,5-дигидропиразоло[4,3-d][1]бензазепин-6(1H)-ил)карбонил]-2-пиридинил]-5-фтор-2-метилбензамид;
N-[5-(4Н-тиено[3,4-b][1,5]бензодиазепин-9(10H)-ил)-2-пиридинил]-5-фтор-2-метилбензамид;
N-[4-(4Н-тиено[3,4-b][1,5]бензодиазепин-9(10H)-ил)фенил]-[1,1'-бифенил]-2-карбоксамид;
N-[4-(4Н-тиено[3,4-b][1,5]бензодиазепин-9(10H)-ил)-3-хлорфенил][1,1'-бифенил]-2-карбоксамид;
N-[5-(4Н-тиено[3,4-b][1,5]бензодиазепин-9(10H)-ил)-3-хлорфенил][1,1'-бифенил]-2-карбоксамид;
N-[5-(4Н-тиено[3,4-b][1,5]бензодиазепин-9(10H)-ил)-2-пиридил][1,1'-бифенил]-2-карбоксамид;
5,11-дигидро-10-[4-(2-тиенил)бензоил]-10H-дибенз[b,е][1,4]диазепин и
5,11-дигидро-10-[4-(3-тиенил)бензоил]-10Н-дибенз[b,е][1,4]диазепин.
20. Фармацевтическая композиция, используемая при лечении заболеваний, характеризуемых избыточной почечной реабсорбцией воды, а также при лечении хронической сердечной недостаточности, цирроза печени, нефритного синдрома, заболевания центральной нервной системы, легочных заболеваний и гипонатремии у млекопитающих, содержащая активный ингредиент и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного ингредиента она содержит эффективное количество соединения по п.1.
21. Способ лечения заболеваний, характеризуемых избыточной почечной реабсорбцией воды, а также хронической сердечной недостаточности, цирроза печени, нефритного синдрома, заболевания центральной нервной системы, легочных заболеваний и гипонатремии у млекопитающих путем введения млекопитающему при необходимости такого лечения терапевтически активного ингредиента, отличающийся тем, что в качестве активного ингредиента используют эффективное для облегчения симптомов заболевания количество соединения по п.1.
22. Способ получения соединения формулы I

где Y обозначает (СН2)n, О, S, NH, NСОСН3, N-(C1-C3)алкил, СН-(C1-C3)алкил, СНNН-(C1-C3)алкил, СНNН2, CHN[(C1-C3)алкил]2, СНО-(C1-C3)алкил, СНS-(C1-C3)алкил,
где n обозначает целое число 0-2;
А-В обозначает

где m обозначает целое число 1-2, при условии, что, когда Y обозначает -(СН2)n-, и n=2, m может также быть нулем, и когда n равно нулю, m может также быть три, однако при условии, что, когда Y обозначает -(СН2)n-, и n равно 2, m не может тоже равняться двум;
R1 выбран из группы, состоящей из: водорода, галогена (хлора, брома, фтора, йода), ОН, -S-(C1-C3)алкила, -SH, -SO(C1-C3)алкила, -SО2(C1-C3)алкил, -СО-(C1-C3)алкила, -СF3, (C1-C3)алкила, O-(C1-C3)алкила, -NО2, -NH2, -NHCO(C1-C3)алкила, -N-[(C1-C3)алкила]2, -SO2NH2, -SО2NН-(C1-C3)алкила, -SO2N[(C1-C3)алкила]2;
R2 выбран из группы: водород, Cl, Br, F, I, -ОН, (C1-C3)алкил, O-(C1-C3)алкил, или R1 и R2 вместе образуют метилендиокси или этилендиокси;
R3 обозначает радикал
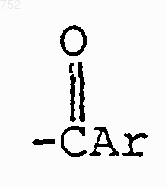
где Аr обозначает радикал, который выбран из группы
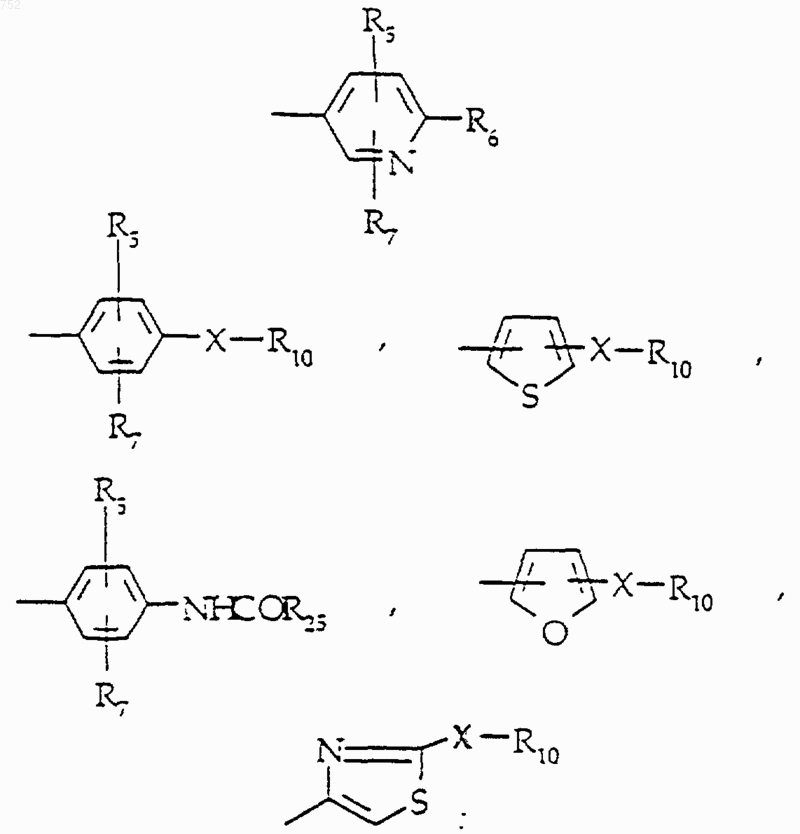
R4 обозначает водород, (C1-C3)алкил, -СО-(C1-C3)алкил; R5 и R7 выбраны из группы водород, (C1-C3)алкил, (C1-C3)алкокси и галоген;
R6 выбран из
а) радикалов формул
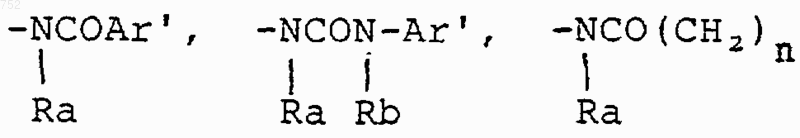


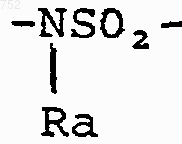 (C3-C8)алкенил,
(C3-C8)алкенил,  (C3-C8)алкил, линейный или разветвленный,
(C3-C8)алкил, линейный или разветвленный,
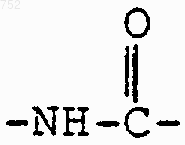 (C3-C8)алкил, линейный или разветвленный,
(C3-C8)алкил, линейный или разветвленный,
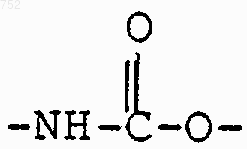 (C3-C8)алкенил, линейный или разветвленный,
(C3-C8)алкенил, линейный или разветвленный,
 (C3-C8)алкенил, линейный или разветвленный,
(C3-C8)алкенил, линейный или разветвленный,
где циклоалкил определяется как С3-С6-циклоалкил, циклогексенил или циклопентенил; Ra обозначает водород, СН3, C2H5, радикалы формулы
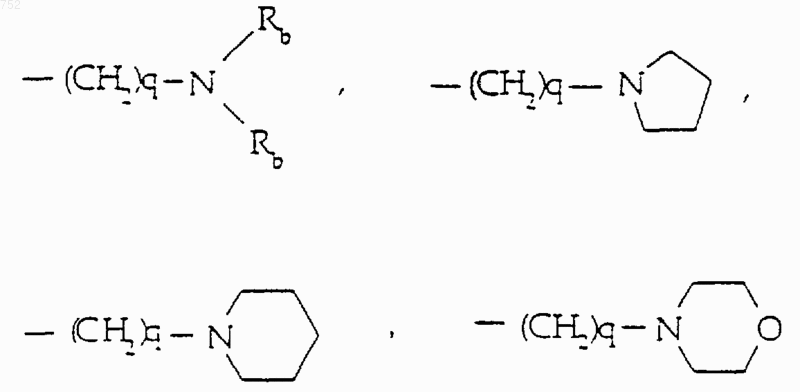
-(СН2)2-O-(С1-С3)алкил или -СH2СН2ОН; q равно одному, двум или трем; Rb обозначает водород, -СН3 или -С2Н5, и
b) радикалов формулы
-X-R10, где R10 обозначает (C3-C8)алкил, (С3-С8)алкенил, -(СН2)p-циклоалкил(С3-С6),
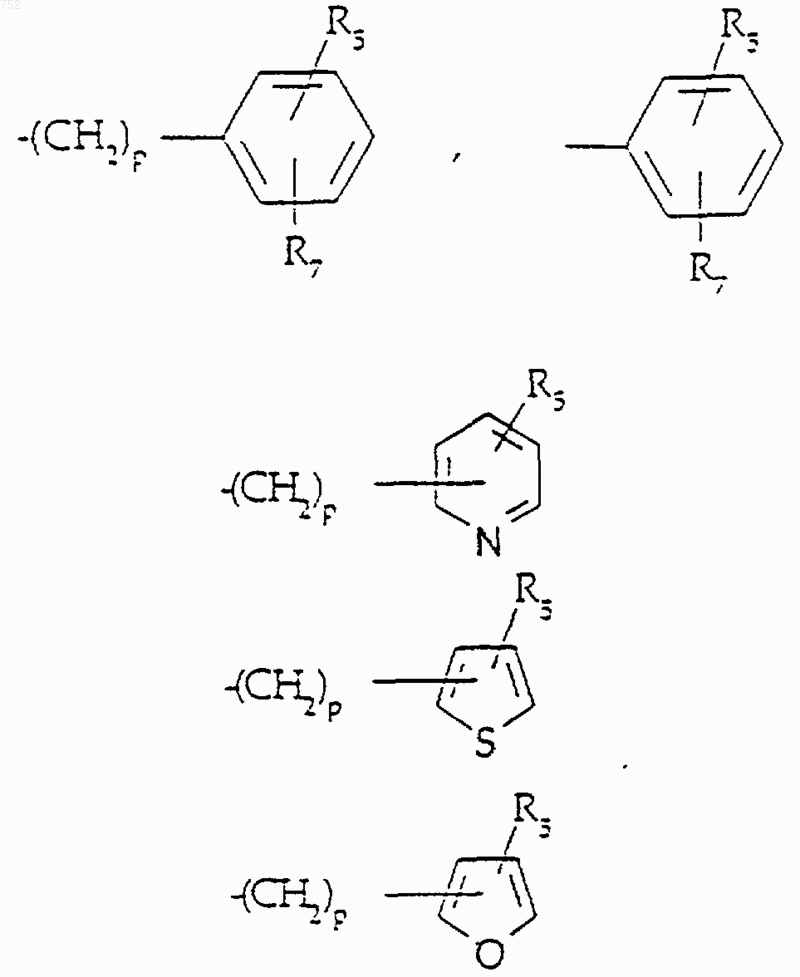
и р равно 0-3;
Х обозначает О, S, NH, NСН3,
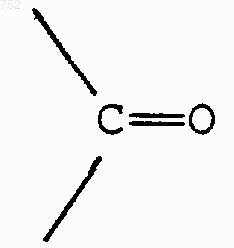
или простую связь; и
R5 и R7 имеют указанные выше значения;
с) радикалов формулы

где J обозначает Ra, (C3-C8)алкил, линейный или разветвленный, (С3-С8)алкенил, линейный или разветвленный, -O-(С3-С8)алкил, линейный или разветвленный, -O-(С3-С8)аленил, линейный или разветвленный, тетрагидрофуран, тетрагидротиофен, радикалы
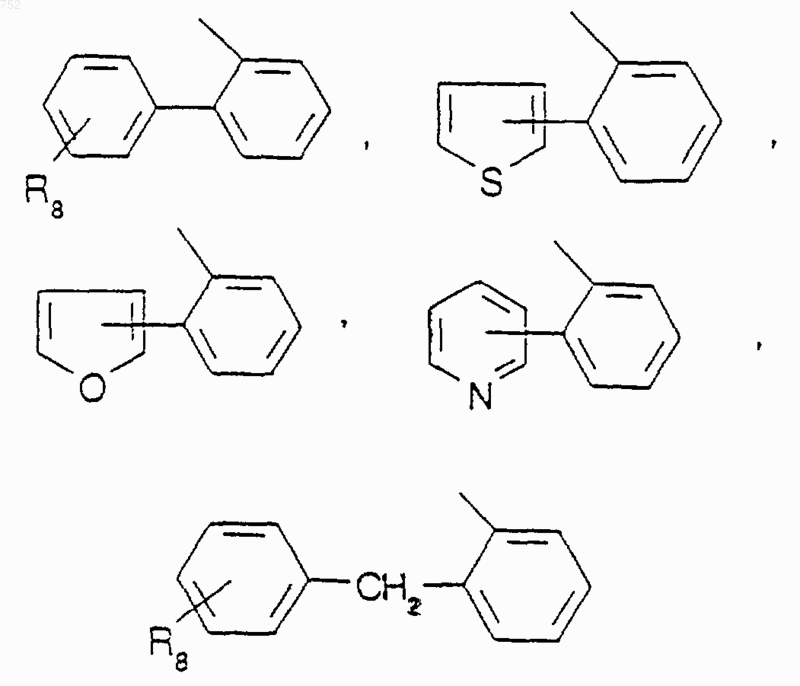
или -СН2-К', где К' обозначает галоген, -ОН, тетрагидрофуран, тетрагидротиофен или гетероциклический радикал
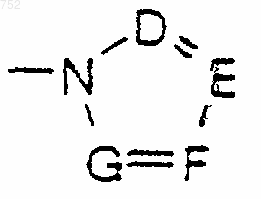
где D, Е, F и G выбраны из углерода или азота и где углеродные атомы могут быть необязательно замещены галогеном, (С1-С3)алкилом, гидрокси, -СО-(С1-С3)алкилом, СНО, (С1-С3)алкокси, -СО2-(С1-С3)алкилом, и Ra и Rb имеют указанные выше значения;
d) радикалов, которые выбирают из следующих формул:

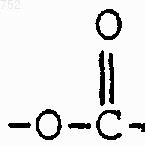 (С1-С3)алкил, -S-(С1-С3)алкил,
(С1-С3)алкил, -S-(С1-С3)алкил,
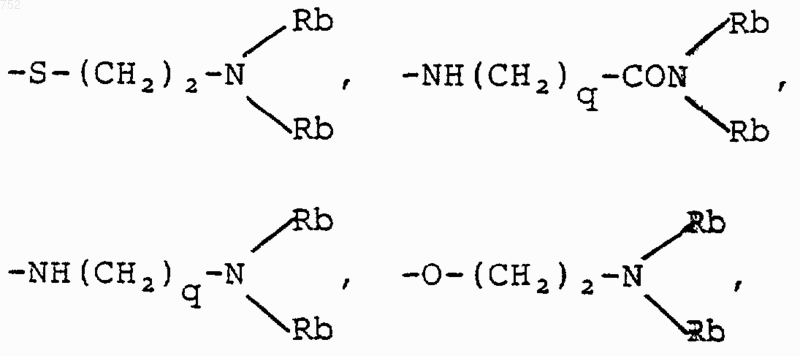
где Rс выбран из галогена, (С1-С3)алкила, -О-(С1-С3)алкила и ОН; Rb имеет указанные выше значения;
где Аr' выбран из группы
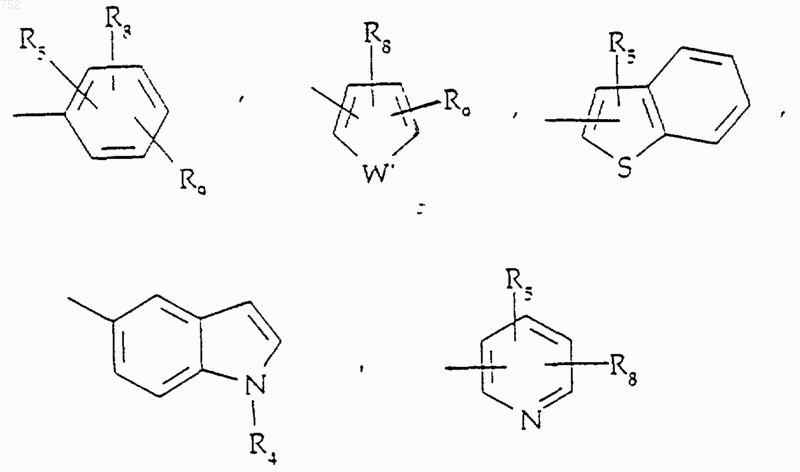
R8 и R9 независимо обозначают: водород, (С1-С3)алкил, O-(С1-С3)алкил, S-(С1-С3)алкил, -CF3, -CN, -ОН, -SСF3, -ОСF3, галоген, NO2, амино или -NН-(С1-С3)алкил, -N-[(С1-С3)алкил]2, -N(Rb) (CH2)q-N(Rb)2;
R25 выбран из радикалов
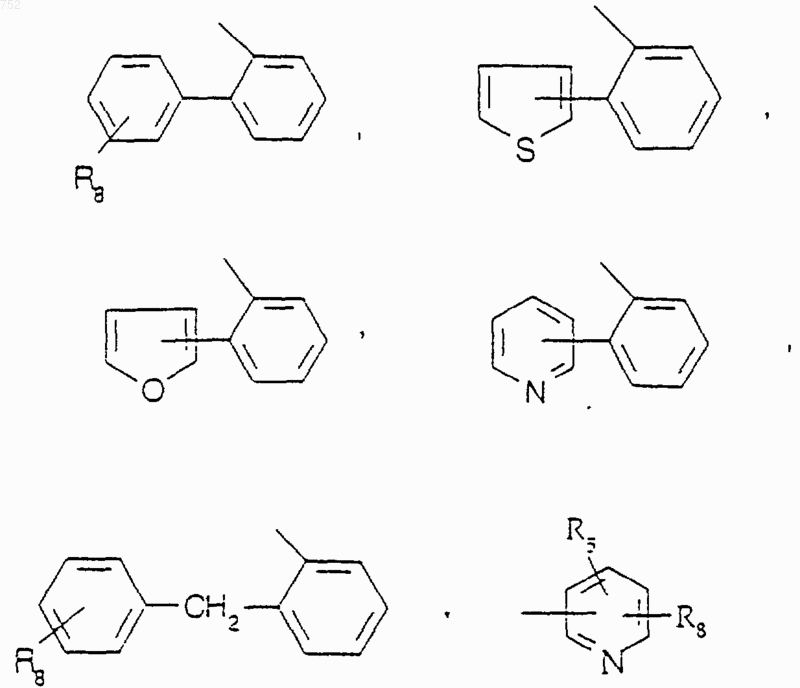
W' выбран из О, S, NH, N-(С1-С3)алкила, -NCO-(С1-С3)алкила или NSO2-(С1-С3)алкила;

обозначает 1) фенил или замещенный фенил необязательно замещенный одним или двумя заместителями, которые выбирают из (С1-С3)алкила, галогена, амино, (С1-С3)алкокси и (С1-С3)алкиламино; 2) 5-замещенный ароматический (ненасыщенный) гетероцикл, содержащий один гетероатом, который выбирают из О, N и S; 3) 6-членный ароматический (ненасыщенный) гетероцикл, содержащий один атом азота; 4) 5- или 6-членный ароматический (ненасыщенный) гетероцикл, содержащий два атома азота; 5) 5-членный ароматический (ненасыщенный) гетероцикл, содержащий один атом азота вместе с одним атомом кислорода или серы; где 5- или 6-членный гетероцикл необязательно замещен (С1-С3)алкилом, формилом, радикалом формулы
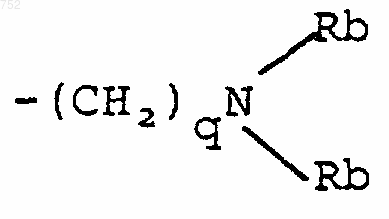
галогеном или (С1-С3)алкокси;
который включает взаимодействие соединения формулы

с соединением формулы
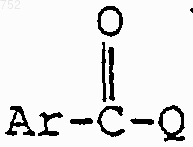
которое обозначает арилхлорид или арилкарбоновую кислоту, активированную преобразованием в смешанный ангидрид или активированную реагентом пептидного присоединения, с получением соединения формулы I.
23. Соединение по п.1, отличающееся тем, что оно имеет формулу

или его фармацевтически приемлемые соли.
24. Соединение по п.1, отличающееся тем, что оно имеет формулу
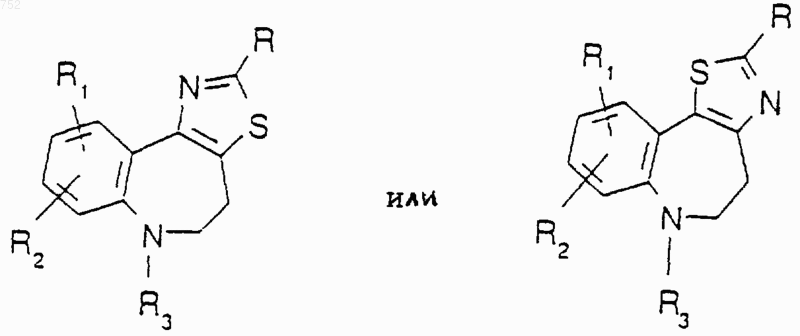
или его фармацевтически приемлемые соли.
25. Соединение по п.1, отличающееся тем, что оно имеет формулу

или его фармацевтически приемлемые соли.
26. Соединение по п.1, отличающееся тем, что оно имеет формулу
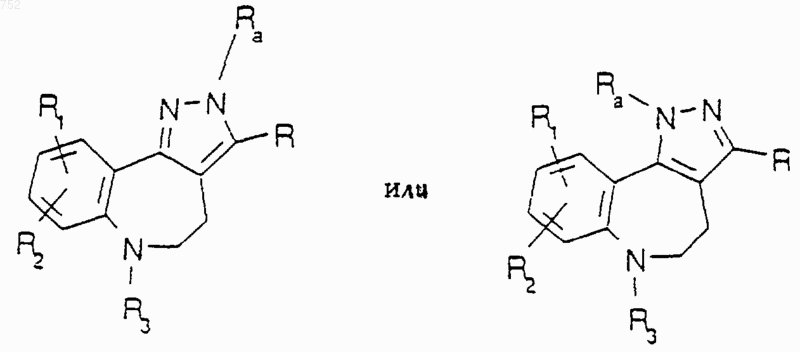
или его фармацевтически приемлемые соли.
27. Соединение по п.1, отличающееся тем, что оно имеет формулу
W' выбран из О, S, NH, N-(С1-С3)алкила, -NСО-(С1-С3)алкила или NSО2-(С1-С3)алкила или его фармацевтически приемлемые соли.
28. Соединение по п.1, отличающееся тем, что оно имеет формулу
где Y обозначает -(CH2)n-, n обозначает целое число ноль или один;
А-В обозначает

где m равно единице, когда n равно единице, и m равно единице или двум, когда n равно нулю;
или его фармацевтически приемлемые соли.
29. Соединение по п.1, отличающееся тем, что оно имеет формулу
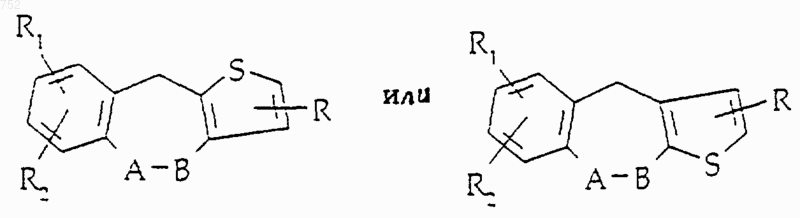
где Y обозначает -(СН2)-, О, S, NН, NCOCH3, N-(С1-С3)алкил, CH-(С1-С3)алкил, СНNН-(С1-С3)алкил, CHNH2, СНN[(С1-С3)алкил], СНО-(С1-С3)алкил, СНS-(С1-С3)алкил,
А-В обозначает

или его фармацевтически приемлемые соли.
30. Соединение по п.29, отличающееся тем, что оно имеет формулу
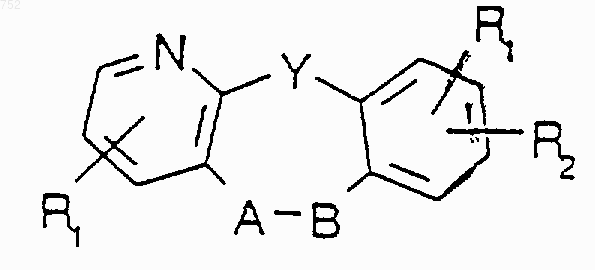
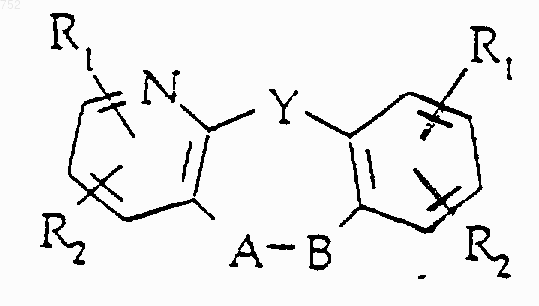
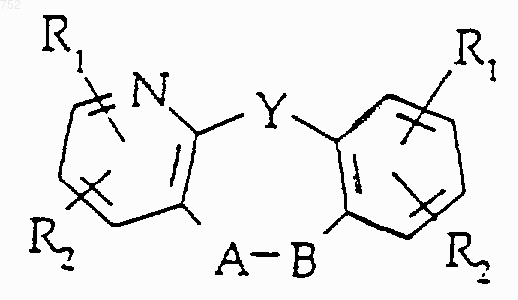
где Y выбран из О, S, NH и N-(С1-С3)алкила; или его фармацевтически приемлемые соли.
31. Соединение по п.1, отличающееся тем, что оно имеет формулу
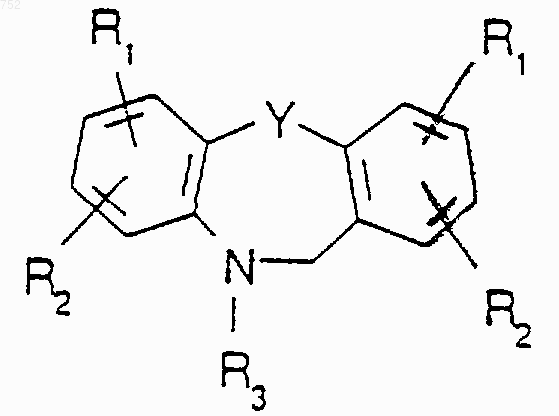
где Y выбран из О, S, NH и N-(С1-С3)алкила
или его фармацевтически приемлемые соли.
32. Соединение по п.31, отличающееся тем, что А-В имеет формулу

или его фармацевтически приемлемые соли.
33. Соединение по п.32, отличающееся тем, что А-В имеет формулу
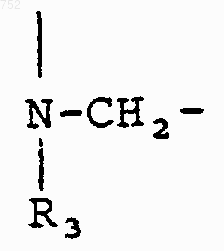
и RЗ обозначает радикал
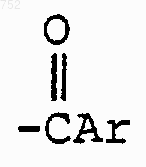
где Аr выбран из групп формул
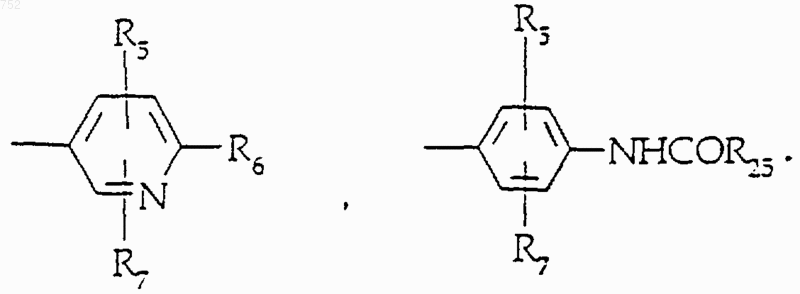
34. Соединение по п.32, отличающееся тем, что А-В имеет формулу
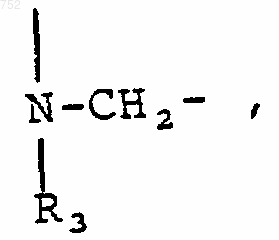
и Y обозначает 0.
35. Соединение по п.33, отличающееся тем, что Y обозначает 0.
36. Соединение по п.32, отличающееся тем, что А-В имеет формулу
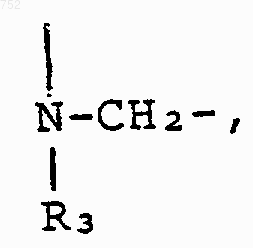
и Y обозначает NH.
37. Соединение по п.33, отличающееся тем, что Y обозначает NH.
38. Соединение по п.29, отличающееся тем, что А-В имеет формулу
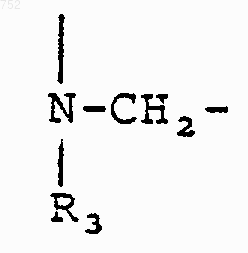
R3 обозначает радикал
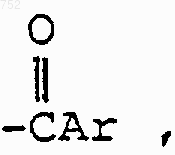
где Аr выбран из групп формул
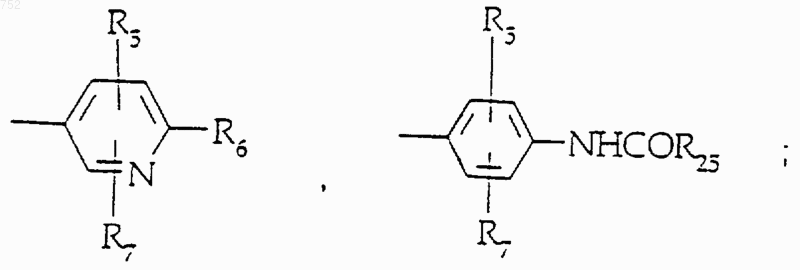
39. Соединение по п.29, отличающееся тем, что А-В имеет формулу
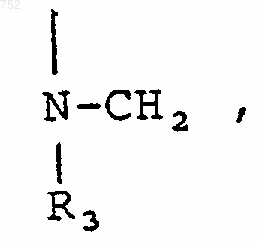
Y обозначает -(CH2)-, О или NH.
40. Соединение по п.38, отличающееся тем, что Y обозначает -(СН2)-, О или NН.
41. Соединение по п.1, отличающееся тем, что оно имеет формулу
где Y обозначает -(CH2)-, О, S, NH, NCOCH3, N-(С1-С3)алкил,
А-В обозначает

или его фармацевтически приемлемые соли.
42. Соединение по п.41, отличающееся тем, что А-В обозначает
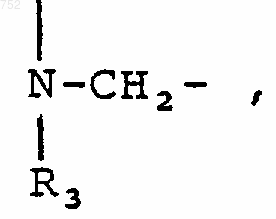
R3 обозначает радикал
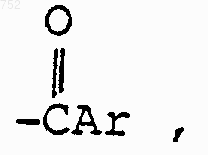
где Аr выбран из групп формул
43. Соединение по п.41, отличающееся тем, что А-В обозначает
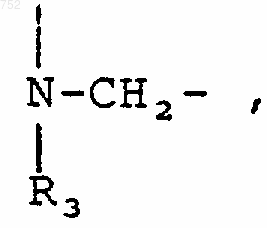
Y обозначает -(СН2)-, О или NH.
44. Соединение по п.42, отличающееся тем, что Y обозначает -(СН2)-, О или NH.
45. Соединение по п.29, отличающееся тем, что А-В обозначает
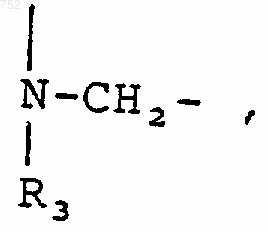
R3 обозначает радикал
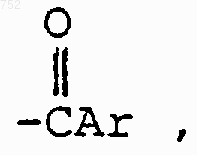
где Аr выбран из групп формул
46. Соединение по п.29, отличающееся тем, что А-В обозначает
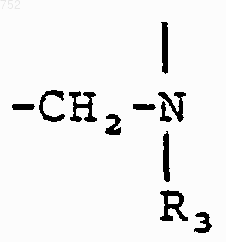
Y обозначает -(СН2)-, О или NH.
47. Соединение по п.45, отличающееся тем, что Y обозначает -(СН2)-, О или NH.
48. Соединение по п.41, отличающееся тем, что А-В обозначает

R3 обозначает радикал
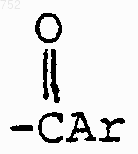
где Аr выбран из групп формул

49. Соединение по п.41, отличающееся тем, что А-В обозначает
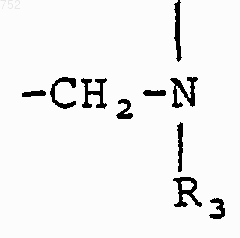
Y обозначает -(CH2)-, О или NH.
50. Соединение по п.48, отличающееся тем, что Y обозначает -(СН2)-, О или NH.
Евразийский патент действует на территории всех Договаривающихся государств, кроме AM и MD.
Текст
1 Область изобретения Данное изобретение относится к новым трициклическим непептидным вазопрессинантагонистам, полезным в лечении состояний,при которых желательно снижение уровней вазопрессина, таких как застойная сердечная недостаточность, болезни, сопровождающиеся избыточной почечной реабсорбцией воды, и состояний с повышенным сосудистым сопротивлением и коронарной вазоконстрикции. Предпосылки изобретения Вазопрессин высвобождается нейрогипофизом в ответ на повышение осмотического давления плазмы,определяемое осморецепторами головного мозга, или увеличения объема циркулирующей крови и кровяного давления, определяемое низкопрессорными волюмрецепторами и артериальными барорецепторами. Гормон оказывает свое воздействие через два хорошо определенных подкласса рецепторов: сосудистый V1 и почечный эпителиальныйV2-рецепторы. Вазопрессининдуцируемое угнетение выделения мочи почками, опосредованное почечными эпителиальными V2-рецепторами, помогает поддерживать нормальную осмоляльность плазмы, объем циркулирующей крови и кровяное давление. Вазопрессин вовлечен в некоторые случаи заболевания застойной сердечной недостаточностью, при которых повышается периферическое сопротивление сосудов. V1-антагонисты могут понижать системное сосудистое сопротивление, увеличивать минутный сердечный выброс и предупреждать вазопрессин-индуцируемую коронарную вазоконстрикцию. Таким образом, V1-антагонисты могут служить терапевтическими средствами при состояниях с вызываемыми вазопрессином возрастаниями общего периферического сопротивления сосудов и измененного локального тока крови. V1 антагонисты могут понижать кровяное давление, оказывая гипотензивные воздействия, и,таким образом, быть терапевтически полезными в лечении некоторых видов гипертензии. Блокада V2-рецепторов полезна в лечении болезней, характеризуемых избыточной почечной реабсорбцией свободной воды. Угнетение выделения мочи почками регулируется гипоталомическим высвобождением вазопрессина (антидиуретический гормон), который связывается специфическими рецепторами на клетках прямого почечного канальца. Это связывание стимулирует аденилилциклазу и стимулирует сАМР-опосредованное включение водных пор в луминальную поверхность этих клеток. V2 антагонисты могут корректировать удержание жидкости при застойной сердечной недостаточности, циррозе печени, нефритическом синдроме, нарушениях центральной нервной системы,болезни легких и гипонатремии. Повышенные уровни вазопрессина наблюдаются при застойной сердечной недостаточно 000752 2 сти, являющейся более общей для пациентов старшего возраста с хронической сердечной недостаточностью. На пациентов с гипонатремической застойной сердечной недостаточностью и повышенными уровнями вазопрессинаV2-антагонисты могут оказывать благотворное влияние, способствуя выделению свободной воды путем противодействия воздействию антидиуретического гормона. На основании биохимического и фармакологического воздействий гормона предполагается, что антагонисты вазопрессина должны быть терапевтически полезными в лечении и/или профилактике гипертензии, сердечной недостаточности, коронарного вазоспазма, ишемии сердца, почечного вазоспазма, цирроза печени, застойной сердечной недостаточности, нефритического синдрома,отека мозга, церебральной ишемии, внутримозгового кровоизлияния в результате удара, тромбообразования при кровотечении и при аномальных картинах удержания жидкости. Соответственно известному уровню техники в приведенных литературных ссылках описаны пептидные вазопрессин-антагонисты: М.Manning et(1992)], которые также обладают слабой вазопрессин-антагонистической активностью при связывании V1 и V2-рецепторами. Пептидные вазопрессин-антагонисты страдают от недостатка пероральной активности и многие из этих пептидов не являются селективными антагонистами, поскольку они также обладают частичной агонистической активностью. Недавно описаны не-пептидные вазопрессин-антагонисты, Y. Yamamura et al., Science,252, 579 (1991); Y. Yamamura et al., Br. J. Pharmacol, 105, 787 (1992); Ogawa et al., (OtsukaYamanouchi Pharm. Co., Ltd; WO 9420473; WO 9412476; WO 9414796; Fujisawa Co. Ltd., EP 620216-Al Ogawa et al., (Otsuka Pharm. Co.) EP 470514A описаны карбостирильные производные и содержащие их фармацевтические композиции. Не-пептидные окситоцин- и вазопрессинантагонист описывается в MerckCo.; M.G.Bock et al., EP 0533244A; J.M. Erb, D.F. Verber,P.D. Williams, EP 0533240A; K. Gilbert et al., EP 0533243A. Преждевременные роды могут вызывать проблемы, связанные со здоровьем младенца, и летальный исход, и ключевым посредником в механизме родов является пептидный гормон 3 окситоцин. С учетом фармакологического действия окситоцина, антагонисты этого гормона полезны в предупреждении преждевременных родов. В.Е. Evans et al., J. Med. Chem., 35, 3919(1992), J. Med. Сhem., 36, 3993 (1993) и приведенные там ссылки. Соединения по данному изобретению служат антагонистами пептидного гормона окситоксина и полезны для контроля преждевременных родов. Данное изобретение относится к новым трициклическим производным, обладающим антагонистической активностью к V1 и/или V2 рецепторам и проявляющим in vivo вазопрессин-антагонистическую активность. Соединения обладают также антагонистической активностью к окситоцин-рецепторам. Краткое описание изобретения Данное изобретение относится к новым соединениям, которые выбраны из группы соединений общей формулы I-циклоалкил, где Y обозначает (CH2)n, О, S, NH, NСОСН 3, N(C1-С 3)алкил, СН-(C1-С 3)алкил, СНNН-(C1C3)алкил, CHNH2, CHN[(С 1-С 3)алкил]2, СНО(C1-C3)алкил, СНS-(С 1-С 3)алкил, где n обозначает целое число 0-2; А-В обозначает где m равно целому числу 1-2, при условии, что,когда Y представляет -(СН 2)n- и n=2, то m может также быть равным нулю, и когда n равно нулю,m может также быть равен трем, и также при условии, что, если Y обозначает -(СН 2)n и n равно 2, то m не может также быть равным двум.R1 и R2 представляют собой метилендиокси или этилендиокси;(С 3-С 8)алкил, линейный или разветвлен(С 3-С 8)алкил, линейный или разветвлен ленный,(С 3-С 8)алкенил, линейный или разветвленный,где циклоалкил определяется как С 3 С 6 циклоалкил, циклогексенил или циклопентенил; Ra обозначает водород, СН 3, С 2 Н 5, радикалы формулы-X-R10; где R10 обозначает (С 3-С 8)алкил, (С 3 С 8)алкенил, (СН 2)р-(С 3-С 6)циклоалкил, где Rc выбран из галогена, (С 1-С 3)алкила, -О(С 1-С 3)алкила и ОН, Rb имеет принятые выше значения; Аг' обозначает радикал, который выбран из группыR5 и R7 имеют принятые выше значения. с) радикалов формулы или -СН 2-К', где К' обозначает галоген, -ОН,тетрагидрофуран, тетрагидротиофен или гетероциклический радикал где D, E, F и G выбран из углерода или азота и где углеродные атомы могут необязательно быть замещены галогеном, (С 1-C3)алкокси, -CO(С 1-С 3)алкилом, СНО, (С 1-С 3)-алкокси, -CO2(С 1-С 3)алкилом и Ra и Rb имеют принятые выше значения; обозначает: 1) фенил или замещенный фенил,необязательно замещенный одним или двумя заместителями, которые выбраны из (С 1 С 3)алкила, галогена, амино, (С 1-С 3)алкокси или(С 1-С 3)алкиламино; 2) 5-членный ароматический (ненасыщенный) гетероцикл, содержащий один гетероатом, который выбран из О, N или S; 3) 6-членный ароматический (ненасыщенный) гетероцикл, содержащий один атом азота; 4) 5 или 6-членный ароматический (ненасыщенный) гетероцикл, содержащий два атома азота; 5) 5-членный ароматический (ненасыщенный) гетероцикл, содержащий один атом азота вместе с одним атомом кислорода, либо с одним атомом серы; где 5-или 6-членные гетероциклы необязательно замещены (С 1-С 3)алкилом, формилом, радикалом формулы галогеном или (С 1-С 3)алкокси. Например, конденсированный гетероцикл может быть представлен циклом фурана, пиррола, пиразола, тиофена, тиазола, оксазола, имидазола, пиримидина или пиридина, который может быть замещенным или незамещенным. Подробное описание изобретения Из группы соединений, представленных формулой I, некоторые подгруппы соединений наиболее предпочтительны. Более предпочтительны те соединения, в которых R3 обозначает радикал и Аr выбран из радикала и где R5, R6 и R7 имеют указанные выше значения. Особенно предпочтительны соединения, в которых R3 является радикалом и Аг выбран из радикалов где R8, R9, R25 и W' имеют указанные выше значения. Также особенно желательны соединения, в которых Y в формуле I обозначает -(СН 2)n- и n равно нулю или единице; А-В обозначает и R4, R5, R6, R7, R8, R9 и R10 имеют указанные выше значения, a m обозначает целое число 1-2. Наиболее предпочтительны соединения формулы I, где Y обозначает -(СН 2)n- и n равно 1; Циклоалкил, Ra, Rb и W' имеют указанные выше значения и R8 и R9 обозначают предпочтительно орто- СF3, Сl, ОСН 3, СН 3, SСН 3 или ОСF3-заместители или Аr' обозначает дизамещенное производное, в котором R8 и R9 независимо обозначают Сl, ОСН 3, СН 3 и F. Особенно наиболее предпочтительны соединения формулы I, в которых Y обозначает-(CH2)n-, n равно нулю или 1 и группа и Ra, Rb, R1, R2, R4, R5, R6, R7, R8, R9, R25 и W' имеют указанные выше значения. где циклоалкил определяется какC3C6 циклоалкил, циклогексенил или циклопентенил и где Аr' выбирают из радикаловRa независимо выбран из водорода, СН 3 или -С 2H5; а R5, R7, R8, R9, R10, R25, X и W' имеют указанные выше значения. Также особенно предпочтительны соединения формул где m обозначает целое число 1 или 2; R1 и R2 имеют указанные выше значения; где Аr выбран из радикалов формул иm обозначает целое число 1 или 2; R1 и R2 имеют принятые выше значения;R6 обозначает где Аr выбран из радикалов формул(С 3-С 8)алкил линейный или разветвлен ный, ный,R6 обозначает(С 3-С 8)алкил линейный или разветвлен ленный,(С 3-С 8)алкенил линейный или разветв 11(C3-C8)алкенил линейный или разветвленный,где циклоалкил определяется как C3-C6 циклоалкил, циклогексенил или циклопентенил и где Аr' выбран из радикаловRa независимо выбран из водорода, СН 3 или -С 2 Н 5; иR5, R7, R8, R9, R10, R25, X и W' имеют указанные выше значения. Соединения по данному изобретению могут быть получены, как показано на схеме 1,взаимодействием трициклических производных формулы 3 а и 3b с замещенным или незамещенным 6-нитропиридин-3-карбонилхлоридом 4,что дает промежуточные продукты 5 а и 5b. Восстановление нитрогруппы промежуточных соединений 5 а и 5b дает 6-амино-3 пиридинилкарбонильные производные 6 а и 6b. Восстановление нитрогруппы промежуточных соединений 5 а и 5b может быть осуществлено в условиях каталитического восстановления(водород-Pd/C; Pd/C-гидразин-этанол) или в условиях химического восстановления (SnCl2 этанол; Zn-уксусная кислота; ТiСl3) и соответствующие условия восстановления, используемые для превращения нитрогруппы в аминогруппу,известны из уровня техники. Условия превращения нитрогруппы в аминогруппу выбирают с учетом требований сохранения других функциональных групп в молекуле. Взаимодействия соединений формулы 6 а и 6b с ароилхлоридами, гетероароилхлоридами,арилсульфонилхлоридами,диарилфосфинилхлоридами,дифеноксифосфинилхлоридами,алкил(С 3-C8)карбонилхлоридами, алкенил(С 3C8)карбонилхлоридами,алкокси(С 3-C8)карбонилхлоридами,алкенилокси(С 3-C8)карбонилхлоридами, алкил(С 3-C8)сульфонилхлоридами,алкенил(С 3-C8)сульфонилхлоридами, циклоалкилкарбонилхлоридами, арилкарбамоилхлоридами или гетероарилкарбамоилхлоридами, как иллюстрируется схемой 1, дает новые соединения 8 а и 8b по данному изобретению. Реакции могут быть проведены в растворителях, таких как хлороформ, дихлорметан, диоксан, тетрагидрофуран, толуол и тому подобные, в присутствии третичного основания, такого как триэтиламин, диизопропилэтиламин или пиридин при 0-50 С. Если во время реакции вводится более чем одна ароил-, гетероароил- или арилсульфонил-группа и т.д., то мягкая обработка основанием (NaOH, КОН и т.д.) в низшем спирте удаляет вторую такую группу, приводя к продуктам 8 а и 8b. Взаимодействие трициклических производных формулы 3 а и 3b с 6-хлор- или 6 фторпиридинин-3-карбонилхлоридом 12 дает промежуточные соединения 13 а и 13b (схема 3). Схема 3 Взаимодействие трициклических производных формулы 6 а и 6b либо с карбамоилпроизводным 9, либо с изоцианатным производным 10, дает соединения (схема 2) формулы 11 а и 11b, которые являются вазопрессинантагонистами и/или окситоцин-антагонистами формулы 1, в которой R6 обозначает Промежуточные соединения 13 а и 13b могут подвергаться взаимодействию с R10X- (14),где R10 имеет принятые выше значения и Х обозначает О, S, NH или NCH3, образуя производные 15 а и 15b, как показано в схеме 4. Соединения формулы 1, в которой Y, А-В,Z, R1, R2 и R3 имеют указанные выше значения и где R6 имеет указанные выше значения, могут быть получены, как показано в схеме 5, путем первоначального синтеза пиридинилпроизводных 16, которые присоединяются к трициклическим бензазепиновым группам. Полученные ранее пиридинилпроизводные 16 могут быть активированы для сочетания путем взаимодействия с реагентами пептидного присоединения или предпочтительно активированы превращением в пиридин-3 карбонилхлориды 17. Сочетание может быть проведено в инертном растворителе, таком как хлороформ, дихлорметан, тетрагидрофуран,диоксан, толуол и тому подобном в присутствии третичного амина, такого как триэтиламин. Реакции могут также быть проведены в пиридине или родственных алкилпиридинах. Схема 5 16 Исходные соединения 3 а и 3b в схеме 1 могут быть получены описанными в литературе способами. Например, промежуточные 6,11 дигидро-5 Н-дибенз[b,е]азепины и замещенные производные получают по приведенным в литературе методикам: L.H. Werner, et al., J. Med.Chem. Soc. Perkins Trans I, 1279-1285 (1976). Замещенные 5,11-дигидродибенз[b,e]азепин-6-оны получают по приведенным в литературе способам: J. Schmutz et al., Helv. Chim.Acta., 48, 336 (1965); и восстанавливают до замещенных 6,11-дигидро-5 Н-дибенз[b,е]азепинов, используя алюмогидрид лития, боран, боран-диметилсульфид и агенты, употребляемые для восстановления амид-карбонила до метиленовой группы. Промежуточные 10,11 дигидродибенз[b,f][1,4]тиазепины получают известными в литературе способами, например,см. К. Brewster et al., J. Chem. Soc. Perkin I, 1286Chim. Acta., 48, 336 (1965); может быть выполнено в присутствии алюмогидрида лития в инертных растворителях, таких как диоксан и тому подобные. Трициклические 6,7-дигидро 5 Н-дибенз[b,d]азепиновые промежуточные соединения формулы 30 могут быть получены известными в литературе способами: T. Ohta etal., J. Amer. Chem. Soc., 77, 675 (1955); или производные могут быть получены способами сочетания, иллюстрируемыми схемой 7. Восстановление нитросоединений структурного типа 31 с последующим замыканием цикла дает лактамы 32, которые восстанавливают, получая трициклические азепины формулы 33. 5,11-Дигидро-6 Н-пиридо[3,2-c][1]бензазепины получают литературными способами - J.Firl et al., Liebiqs Ann. Chem., 469 (1989). 11 НПиридо[2,3-b][1,4]бензодиазепин-6(5 Н)-оны описаны J.F.F. Liegeois et al., J. Med. Chem. 36,2107 (1993) и эти производные восстанавливают до 11 Н-пиридо 2,3-b][1,4]бензодиазепинов. О синтезе трициклического 1,4,5,10-тетрагидропиразоло-[4,3-с][1]бензодиазепина и 3 хлорпроизводного сообщается в G. Palazzino, etal., J. Heterocyclic Chem., 26, 71 (1989). 4,10 Дигидро-5 Н-тиено[3,2-с][1]бензазепин 21 а и 9,10-дигидро-4 Н-тиено[2,3-с] [1]бензазепин 21b могут быть получены соединением производных трибутилолова 19 и 20 с 2 нитробензилбромидом в присутствии тетракис(трифенилфосфин)-палладием (0), как показано в схеме 6. После присоединения промежуточного продукта 24 с целью получения трициклического азепина 25, нитрогруппу восстанавливают,что дает 6-аминоникотиноил-производное 26. 17 Затем производное 26 подвергают взаимодействию с соответствующими хлорангидридами кислот, как иллюстрировано в схеме 7, что дает продукты 27 и 27 а. В схеме 7 описан также синтез промежуточного трициклического азепина 30 и 33. Трициклические лактамовые производные 29 и 32 могут быть получены восстановлением промежуточных нитросоединений 28 и 31, с последующим замыканием цикла соответствующих аминопроизводных. Эти трициклические лактамовые производные 29 и 32 могут быть восстановлены алюмогидридом лития (LAH) или бораном с целью получения трициклических азепинов 30 и 33. Схема 6 Трициклические промежуточные соединения 42 для синтеза селективных вазопрессинантагонистов по данному изобретению, в которых Y в формуле 1 обозначает -СН 2- и m равен 1, могут быть получены по схеме 8. Подходящие 1-нитро-2-хлор- или 1-нитро-2-бром- гетероциклы 35 претерпевают галогеновый обмен при взаимодействии с алкиллитиевым реагентом, таким как трет-бутиллитий, вторбутиллитий или н-бутиллитий, давая промежуточные соединения 37, которые взаимодействуют с ангидридами формулы 38. R12 обозначает трет-бутил,втор-бутил,н-бутил,2,6 диметилпиперидин или смешанный ненуклеофильный диалкиламин. Нитропродукты 39 восстанавливают водородом и подходящим катализатором или восстанавливают химически(Zn - уксусная кислота, ТiСl3 и т.д.) до промежуточных аминосоединений 40. Замыкание цикла до циклических лактамов 41 обычно выполняют нагреванием в ксилоле или инертном растворителе при 100-200 С. Циклические лактамы структурного типа 41 легко восстанавливают бораном в тетрагидрофуране, борандиметилсульфидом в тетрагидрофуране или алюмогидридом лития в подходящем растворителе, таком как диоксан, получая трициклические соединения 42. Или же иначе, фениллитиевые производные 37b, получаемые при введении лития в защищенные бензальдегидные производные или при введении лития в 2-хлор- или 2-бром- защищенные бензальдегидные производные, подвергают взаимодействию с производными 38b, в которых Z имеет указанные выше значения. Производные 38b получают стандартными способами, такими как замыкание цикла 1-амино-2 карбокси-гетероароматических соединений или 1-амино-2-бензойной кислоты - производных с уксусным ангидридом (схема 8). Иначе, как показано в схеме 9, некоторые трициклические производные структурной формулы 42 могут быть получены присоединением "палладиевого" типа или индуцируемым "медью" присоединением галоидированных производных 43, приводящими к образованию трициклических лактамов 44. Восстановление лактам-карбонильной группы дает промежуточные соединения 42. Присоединение галогеновых производных 45 с целью замыкания цикла к активированным медью реагентам или реагентам "палладиевого" типа, вызывающим арильное присоединение, дает лактамы 46. Борановое восстановление лактамов 46 дает производные 47. Кросс-сочетания Ульмана галоидированных гетероциклов и 2 бромнитробензолов и соответствующие кросссочетания с использованием низковалентных палладиевых соединений, таких как [Рd(РРh3)4] и PdCl2(РРh3)2 являются известными синтетическими приемами: N. Shimizu et al., TetrahedronHeterocyclic Chem., 20, 663 (1983)]. В предшествующей литературной ссылке описан синтез 2-метил-5, 7-дигидропиримидо[5,4-d][1]бензазепин-6(6H)-онов, которые могут быть восстановлены с целью удаления лактамовой карбонильной группы, что дает трициклические производные структурного типа 54, где Z обозначает пиримидиновый цикл. Схема 10 Тетрагидро-1 Н-1-бензазепин-5-оны 51 и тетрагидро-1H-1-бензазепин-2,5-дионы 52 являются соединениями, полезными для синтеза промежуточных трициклических гетероциклических структур 53 и 54 (схема 10). Тетрагидробензазепин-5-оны 51 и 52 могут использоваться для получения гидроксиметиленовых производных или при взаимодействии либо с реагентом Вилсмейера, либо с диметилацеталем N,Nдиметилформамида могут давать диметиламинометиленовые производные. Создание гетероциклических колец из -гидроксиметиленкетонов при взаимодействии с гидразином, Nметилгидразином, гидроксиламином или фармамидином дает пиразолы, N-метилпиразолы, оксазолы или пиримидины, соответственно, что является стандартным, описанным в литературе способом. См., под редакцией Vilsmeier'a - Tetrahedron, 49, 4015-4034 (1993) и приведенные там ссылки и построение циклов - J. HeterocyclicChem., 29, 1214 (1992) и приведенные там ссылки. Замещенные и незамещенные тетрагидробензазепин-2-оны являются известными соединениями, получаемыми взаимодействием атетралонов с азидом натрия в кислой среде [J.(1993)] (реакция Шмидта). Восстановление тетрагидро-1H-бензазепин-2-онов дает тетрагидро 1 Н-бензазепины 48, ацилирование которых приводит к соединениям 49. Окисление N-ацил тетрагидро-1H-бензазепинов типа 49 с целью получения 5-он-производных представляет собой известный окислительный процесс: R.L.Augustine and W.G. Pierson, J. Orq. Chem., 34,1070 (1969). Опубликованы сообщения по синтезу 3,4 дигидро-1H-1-бензазепин-2,5-дионовR15=H), равно как превращение 3,4-дигидро-1 Н 1-бензазепин-2,5-дионов в 4-[(диметил 23 Схема 11 24 нитробензоилхлоридом 55 дают производные 56 а и 56b. Восстановление нитрогруппы в производных 56 а и 56b дает промежуточные 4 аминобензоилпродукты 57 а и 57b, которые затем взаимодействуют с хлорангидридом формулы 58, образуя продукты 59 а и 59b. Соединения, в которых арильная группа в получают взаимодействием трициклических азепинов 3 а и 3b с замещенным бензоилхлоридом, описываемым структурной формулой 60(схема 12), приводящим к образованию продуктов 61 а и 61b. По аналогичной реакции гетероарильные хлориды 62, 63 или 64 с трициклическими азепинами 3a и 3b дают продукты 65 а и 65b, где арильные группы являются такими, как описано в схеме 13. Схема 12 Соединения, в которых арильная группа в получают, как показано на схеме 11. Трициклические производные 3 а и 3b при взаимодействии с замещенным и незамещенным 4 25 Стандартный пример 1. 6,11-Дигидро-5 Ндибенз[b,e]азепин. Смесь 48,52 г(0,20 моль) 2 аминобензофенон-2'-карбоновой кислоты и 500 мл ксилола нагревают до температуры кипения с обратным холодильником в течение 67 ч, охлаждают до комнатной температуры и фильтруют. Твердый продукт промывают ксилолом,получая 43,3 г (97,8%) 5H-дибенз[b,е]азепин 6,11-диона в виде светлых рыжеватокоричневых кристаллов, т.пл. 245-248 С. К 4,46 г (0,020 моль) предшествующего соединения в 25 мл тетрагидрофурана добавляют 12 мл (0,12 моль) 10 молярного раствора борондиметилсульфида в тетрагидрофуране. Добавляют дополнительно 10 мл тетрагидрофурана и смесь перемешивают в течение ночи и затем нагревают до температуры кипения с обратным холодильником (растворение твердых продуктов) в течение 4 ч. Раствор охлаждают и добавляют по каплям 15 мл метанола. Смесь концентрируют в вакууме, добавляют 50 мл 2 н гидроокиси натрия и смесь нагревают до температуры кипения с обратным холодильником в течение 2 ч. Твердые продукты отфильтровывают, промывают водой, сушат на воздухе и экстрагируют дихлорметаном. Экстракт сушат (Na2SO4) и растворитель удаляют, получая 3,25 г (83%) кристаллов, т.пл. 117-122 С. Стандартный пример 2. 2-Хлор-5 Ндибенз[b,е]азепин-6,11-дион. Газообразный хлор барботируют через смесь (частичная суспензия) 1,0 г (450 ммоль) 5 Н-дибенз[b,е]-азепин-6,11-диона в 50 мл ледяной уксусной кислоты. Температуру смеси поднимают до 38 С. Раствор оставляют стоять, при снижении температуры раствора образуется белый твердый осадок. Смесь фильтруют, получая 0,40 г твердого продукта (смесь исходных соединений и продукта в соотношении 1:8). При стоянии из фильтрата выделяется 0,10 г продукта в виде кристаллов, т.пл. 289-293 С. Стандартный пример 3. 10,11-ДигидроN,N-диметилдибенз[b,f][1,4]оксазепин-2-сульфонамид. К 5,88 г 10,11-дигидро-N,N-диметил-11 оксодибенз[b,f][1,4]оксазепин-2-сульфонамида в 5 мл тетрагидрофурана добавляют 20 мл молярного раствора боран-диметилсульфида в тетрагидрофуране. Смесь перемешивают в течение ночи и затем нагревают до температуры кипения с обратным холодильником 2 ч. Смесь охлаждают, разбавляют 10 мл метанола и затем концентрируют, снова добавляют метанол и смесь концентрируют. К смеси добавляют 20 мл 2 н NaOH и смесь нагревают до температуры кипения с обратным холодильником в течение 2 ч. Смесь экстрагируют дихлорметаном, экстракт сушат (MgSO4) и фильтруют. Фильтрат пропускают через тонкий слой водного силиката магния, который промывают затем дихлорметаном. Фильтрат концентрируют, получая 4,8 г кри 000752 26 сталлов, т.пл. 99-102 С. Перекристаллизация из диизопропилового эфира-дихлорметана дает 3,96 г кристаллов, т.пл. 109-110 С. Масс-спектр(FAB) 305 (М+Н). Анализ. Вычислено для C15H16N2O3S: С, 59,2; Н, 5,3; N, 9,2; S, 10,6. Найдено: С, 57,6; Н, 5,2; N, 8,9; S, 10,1. Стандартный пример 4. 2-Хлор-5,6-дигидрофенантридин. К горячему раствору (70 С) 2,62 г (17 ммоль) 6(5 Н)-фенантридинона в 120 мл уксусной кислоты добавляют газообразный хлор в течение 10 мин. Раствору дают охладиться до комнатной температуры и смесь фильтруют. Отфильтровывают кристаллы, получая 1,35 г кристаллов, т.пл. 310-318 С. К вышеуказанному соединению (1,57 г) в 25 мл тетрагидрофурана добавляют 12 мл 10 молярного раствора борон-диметилсульфида в тетрагидрофуране. Смесь нагревают до температуры кипения с обратным холодильником в течение 18 ч, охлаждают и добавляют 15 мл метанола. Смесь концентрируют в вакууме и добавляют 50 мл 2 н гидроокиси натрия. Смесь нагревают 2 ч до температуры кипения с обратным холодильником и твердый продукт отфильтровывают и промывают водой, сушат на воздухе и получают продукт в виде твердого соединения. Стандартный пример 5. 9-Хлор-5 Ндибенз[b,е]азепин-6,11-дион. Смесь 11,15 г 5 Н-дибенз[b,е]азепин-6,11 диона и 600 мл ледяной уксусной кислоты нагревают на паровой бане до растворения твердого продукта. К раствору (70 С) добавляют газообразный хлор. Хлор барботируют через раствор до начала образования осадка. Смеси дают охладиться до комнатной температуры и фильтруют, получая 7,3 г продукта, т.пл. 290-295 С. Стандартный пример 6. 9-Хлор-6,11 дигидро-5 Н-дибенз[b,е]азепин. К смеси 7,28 г 9-хлор-5H-дибенз[b,е]азепин-6,11-диона в 25 мл тетрагидрофурана в атмосфере аргона добавляют 8,5 мл 10 молярного борон-диметилсульфида в тетрагидрофуране. Смесь перемешивают 18 ч при комнатной температуре, добавляют 30 мл тетрагидрофурана и смесь нагревают до температуры кипения 3 ч (растворяются твердые продукты). Раствор охлаждают до комнатной температуры и добавляют по каплям 25 мл метанола. Летучие продукты отгоняют в вакууме. К остатку добавляют 100 мл 2 н NaOH. Смесь нагревают до температуры кипения с обратным холодильником в течение ночи и фильтруют. Твердый продукт экстрагируют дихлорметаном и экстракт промывают 2 н лимонной кислотой, водой и сушат(Na2SO4). Удаляют растворитель, получая 4,2 г твердого вещества, которое растирают для кристаллизации с этилацет/гексаном (1:2), получая кристаллы, т.пл. 137-141C. 27 Стандартный пример 7. 10,11-Дигидробенз[b,f][1,4]тиазепин. К смеси 3,3 г 10,11-дигидро-11 оксодибенз[b,f][1,4]тиазепина в 25 мл тетрагидрофурана добавляют 4,0 мл 10 молярного борандиметилсульфида в тетрагидрофуране. Смесь перемешивают при комнатной температуре 18 ч,добавляют 50 мл безводного метанола и растворитель удаляют. Добавляют дополнительно 30 мл метанола и растворитель удаляют, получая белые кристаллы. Образец чистят хроматографией на силикагеле с гексан-хлороформэтилацетатом (2:1:1) в качестве растворителя,получая белые кристаллы, т.пл. 145-148 С. Приведенные далее соединения получают,как описано в стандартном примере 7. Стандартный пример 8. 4-Метил-10,11 дигидродибенз[b,f][1,4]тиазепин. Стандартный пример 9. 4-Хлор-10,11 дигидродибенз[b,f][1,4]тиазепин. Стандартный пример 10. 2-Метил-10,11 дигидродибенз[b,f][1,4]тиазепин. Стандартный пример 11. 2-Хлор-10,11 дигидродибенз[b,f][1,4]тиазепин. Стандартный пример 12. 2-Метокси 10,11 дигидродибенз[b,f][1,4]тиазепин. Стандартный пример 13. 8-Хлор-10,11 дигидродибенз[b,f][1,4]тиазепин. Стандартный пример 14. 4,8-Дихлор-10,11 дигидродибенз[b,f][1,4]тиазепин. Стандартный пример 15. 8-Хлор-4-метил 10,11-дигидродибенз[b,f][1,4]тиазепин. Стандартный пример 16. 8-Метокси-10,11 дигидродибенз[b,f][1,4]тиазепин. Стандартный пример 17. 7-Хлор-4-метил 10,11-дигидродибенз[b,f][1,4]тиазепин. Приведенные ниже соединения получают,как описано в стандартном примере 3. Стандартный пример 18. 2-Хлор-10,11 дигидродибенз[b,f][1,4]-оксазепин. Стандартный пример 19. 2-Метил-10,11 дигидродибенз[b,f][1,4]-оксазепин. Стандартный пример 20. 4-Хлор-10,11 дигидродибенз[b,f][1,4]-оксазепин. Стандартный пример 21. 3-Метил-10,11 дигидродибенз[b,f][1,4]-оксазепин. Стандартный пример 22. 7-Хлор-10,11-дигидродибенз[b,f][1,4]оксазепин. Стандартный пример 23. 8-Хлор-10,11 дигидродибенз[b,f][1,4]-оксазепин. Стандартный пример 24. 2,4-Дихлор-10,11 дигидродибенз [b,f][1,4]-оксазепин. Стандартный пример 25. 4,8-Дихлор-10,11 дигидродибенз[b,f][1,4]-оксазепин. Стандартный пример 26. 4-Хлор-8-метил 10,11-дигидродибенз[b,f][1,4]-оксазепин. Стандартный пример 27. 4-Метил-7-хлор 10,11-дигидродибенз[b,f][1,4]-оксазепин. Стандартный пример 28. 1-Хлор-4-метил 10,11-дигидродибенз[b,f][1,4]-оксазепин. 28 Стандартный пример 29. 2-Фтор-10,11 дигидродибенз[b,f][1,4]-оксазепин. Стандартный пример 30. N-(2-иодфенил)2-иодфенилацетамид. Раствор 13,32 г (0,05 моль) 2 иодфенилуксусной кислоты в 75 мл тионилхлорида нагревают до температуры кипения с обратным холодильником в течение 2 ч и легколетучие продукты отгоняют в вакууме. Добавляют толуол (3 раза) и растворитель отгоняют в вакууме после каждого добавления, что дает 2 иодфенилацетилхлорид в виде смолы. К предшествующему соединению (0,05 моль) в смеси 100 мл толуол-дихлорметана (1:1) добавляют 11 г (0,05 моль) 2-иоданилина и (0,10 моль) диизопропилэтиламина. Смесь перемешивают при комнатной температуре в течение ночи и удаляют растворитель. Остаток растворяют в дихлорметане и раствор промывают 1 н НСl, насыщенным бикарбонатом натрия, раствором соли и сушат (Na2SO4). Растворитель удаляют и остаток перекристаллизовывают из метанолдиэтилового эфира, получая 16,0 г светлокоричневых кристаллов, т.пл. 160-163 С. Стандартный пример 31. 2-Йод-N-(2 иодфенил)бензолэтанамин. К суспензии 1,39 г (3 ммоль) 2-иод-N-(2 иодфенил)бензолацетамида в 30 мл тетрагидрофуран-дихлорметана (1:1) добавляют 3,75 мл 2,0 молярного боран-диметилсульфида в тетрагидрофуране. Раствор перемешивают 1 ч при комнатной температуре и затем нагревают до температуры кипения с обратным холодильником 16 ч. Смесь охлаждают и медленно по каплям добавляют воду до прекращения выделения газа. Летучие продукты отгоняют в вакууме и водный остаток подщелачивают 2 н гидроокисью натрия. Смесь экстрагируют диэтиловым эфиром (50 мл) и экстракт промывают раствором соли и сушат (Na2SO4). Раствор фильтруют через тонкий слой водного силиката магния и слой на фильтре промывают диэтиловым эфиром и фильтрат упаривают. Оставшийся твердый продукт промывают изооктаном, получая 1,20 г белого твердого вещества. Перекристаллизация из диэтилового эфира/гексана дает белые кристаллы. Стандартный пример 32.N-(4 нитробензоил-N-(2-иодфенил)-2-иодбензолэтиламин. К раствору 0,90 г 2-иод-N-(2 иодфенил)бензолэтанамина в 4 мл тетрагидрофурана добавляют 0,41 г триэтиламина и 0,57 г 4-нитробензоилхлорида. Смесь перемешивают при комнатной температуре 2 ч и растворитель удаляют в вакууме. Остаток растворяют в этилацетат-дихлорметане (5:1) и раствор промывают 1 н НСl, насыщенным NaHCO3, раствором соли и сушат (Na2SO4). Раствор фильтруют через тонкий слой водного силиката магния. Фильтрат упаривают и оставшийся твердый продукт растирают с диэтиловым эфиром и гексаном, полу 29 чая 1,10 г продукта в виде белого твердого вещества. Стандартный пример 33. 3,4-Дигидро-1 Н 1-бензазепин-2,5-дион. К раствору 225 мл ледяной уксусной кислоты и 8,5 мл концентрированной серной кислоты добавляют 49,54 г (0,30 моль) 2'нитроацетофенона и 47,02 г (0,50 моль) глиоксалевой кислоты (гидратированной). Смесь нагревают при 100 С 16 ч. Смесь охлаждают и выливают на колотый лед. После расплавления льда смесь отфильтровывают и твердый продукт промывают охлажденной водой. Твердый продукт сушат и перекристаллизовывают из дихлорметангексана, получая 20,1 г 3-(2 нитробензоил)акриловой кислоты в виде белых кристаллов, т.пл. 153-158 С. Раствор предшествующего соединения (9,0 г) в 80 мл этанола и 1,6 г палладия-на-углероде гидрируют в аппарате Парра при 30 фунт/кв. дюйм (2,109 кг/см 2); водорода в течение 20 ч. Смесь фильтруют через диатомовую землю и растворитель удаляют. Остаток (7,0 г) хроматографируют на силикагеле с гексан-этилацетатом (1:1) в качестве растворителя,получая 4,0 г 3-(2 аминобензоил)пропионовой кислоты в виде оранжевого твердого продукта, т.пл. 103-107 С. 0,50 г образца предшествующего соединения,0,36 мл триэтиламина и 0,43 мл диэтоксифосфинилцианида в 20 мл дихлорметана перемешивают при комнатной температуре 5 дней. Растворитель удаляют, добавляют этилацетат и смесь промывают водой, 2 н лимонной кислотой,1 М NaHCO3, раствором соли и сушат (Na2SO4). Растворитель удаляют и остаток чистят хроматографией на силикагеле с этилацетат-гексаном(1:1) в качестве растворителя, получая 0,190 г светло-коричневых кристаллов, т.пл. 168-170C. Стандартный пример 34. 4-[(Диметиламино)метилен]-3,4-дигидро-1 Н-1-бензазепин 2,5-дион. Смесь 0,250 г (1,43 ммоль) 3,4-дигидро 1 Н-1-бензазепин-2,5-диона и 5,5 мл (4,93 г, 41,5 ммоль) N,N-диметилформамид-диметилацеталя нагревают до 90 С 1,5 ч. Смесь охлаждают, разбавляют диэтиловым эфиром и фильтруют. Твердый продукт хорошо промывают диэтиловым эфиром и сушат, получая 0,26 г рыжеватокоричневых кристаллов, т.пл. 203-205 С. Стандартный пример 35. 2-Метил-6,7 дигидро-5 Н-пиримидо[5,4-d][1]бензазепин. К раствору 0,308 г (3,26 ммоль) гидрохлорида ацетамидина в 15 мл метанола в атмосфере аргона добавляют 0,176 г (3,26 ммоль) метилата натрия и смесь перемешивают 5 мин. К смеси добавляют 0,50 г (2,17 ммоль) 4-[(диметиламино)метилен]-1,2,3,4-тетрагидро-5 Н-1-бензазепин-2,5-диона и смесь перемешивают при комнатной температуре в течение ночи. Смесь (содержащую плотный осадок) разбавляют 3 мл метанола, охлаждают и фильтруют. Фильтрат концентрируют досуха. Остаток и первоначаль 000752 30 ный твердый продукт объединяют и добавляют хлороформ. Смесь промывают водой, органический слой обрабатывают активированным углеродом и затем фильтруют через тонкий слой водного силиката магния. Фильтрат упаривают,получая 0,41 г кристаллов, т.пл. 257-258 С. Предшествующее соединение нагревают с 5 эквивалентами гидрида лития в диоксане в течение 24 ч, получая продукт в виде твердого соединения. Стандартный пример 36. 5,6-Дигидропиридо[2,3-b][1,4]бензотиазепин. К суспензии 11,67 г 2-тиобензойной кислоты в смеси 32 мл этанола и 11 мл воды добавляют порциями 12,72 г твердого бикарбоната натрия. После завершения добавления смесь перемешивают 15 мин и добавляют порциями 10,0 г 2-хлор-3-нитропиридина. Смесь нагревают до температуры кипения с обратным холодильником 2 ч, охлаждают и затем концентрируют в вакууме. Оставшийся водный раствор разбавляют 15 мл воды, подкисливают 2 н НСl и экстрагируют дважды 250 мл этилацетата. Экстракт концентрируют в вакууме, получая желтый твердый остаток. Остаток растворяют в минимальном количестве этилацетата, нагревая на паровой бане. Раствор охлаждают в течение ночи, фильтруют, получая 2,5 г исходного вещества. Фильтрат концентрируют, охлаждают и фильтруют, получая 12,5 г 2-(3-нитро-2 пиридинилтио)бензойной кислоты в виде желтого твердого соединения. Предшествующее соединение (5,0 г) и 0,75 г Pd/C в 60 мл этанола встряхивают в аппарате Парра при 45 фунт/кв. дюйм (17,225 кг/см 2) водорода в течение 18 ч. Смесь фильтруют через диатомную землю и плотный осадок на фильтре промывают 200 мл дихлорметана. Объединенный фильтрат упаривают в вакууме, получая твердое соединение. Твердый продукт растирают с этанолом и фильтруют, получая 3,6 г желтого твердого вещества. Этот твердый продукт (3,0 г) снова гидрируют Pd/C (0,50 г) в 50 мл этанола и 30 мл уксусной кислоты при 45 фунт/кв. дюйм водорода в течение 18 ч. Смесь фильтруют через диатомовую землю и плотный осадок на фильтре промывают метанолом. Объединенный фильтрат концентрируют в вакууме, получая 1,6 г твердого вещества. Этот твердый продукт в 25 мл N,N-диметилформамида снова восстанавливают 0,80 г Pd/C при 45 фунт/кв. дюйм водорода, получая 0,57 г твердого вещества. Перекристаллизация из этилацетата дает 0,28 г 2-(3 амино-2-пиридинилтио)бензойной кислоты. Предшествующее соединение (0,20 г) нагревают в 2-гидроксипиридине при 170 С, получая 5,6 дигидропиридо[2,3-b][1,4]бензотиазепин в виде желтого твердого соединения. Полученное соединение подвергают реакции с борандиметилсульфидом, как описано в стандартном примере 3, получая продукт в виде твердого соединения. 31 Стандартный пример 37. 2-Нитро-2'карбоксидифениламин. Перемешиваемую твердую смесь 13,7 г оаминобензойной кислоты, 20,2 г о-бромнитробензола, 13,8 г безводного карбоната калия и 0,1 г металлической меди нагревают при 200 С на масляной бане. Реакционную смесь нагревают 2 ч, охлаждают и твердый продукт промывают диэтиловым эфиром (3100 мл). Твердый продукт растворяют в горячей воде и фильтруют. Фильтрат подкисляют 40 мл НСl и собирают и сушат образовавшийся твердый продукт, получая 20,5 г требуемого продукта в виде твердого соединения, т.пл. 262-265 С. Стандартный пример 38. 2-Амино-2'карбоксидифениламин. Раствор 7,3 г 2-нитро-2'-карбоксидифениламина в 50 мл метанола, содержащего 10% палладий-на-углероде гидрируют при давлении 42 фунт/кв. дюйм (17,014 кг/см 2) в течение 24 ч. Реакционную смесь фильтруют через диатомовую землю. Фильтрат упаривают досуха в вакууме, получая 6,6 г заданного продукта в виде твердого вещества, т.пл. 72-75 С. Стандартный пример 39. 5,11-Дигидро 10 Н-дибенз[b,e][1,4]диазепин-11-он. Смесь 6,6 г 2-амино-2'-карбоксидифениламина в 300 мл ксилола нагревают до температуры кипения с обратным холодильником 20 ч. Ксилол упаривают в вакууме, остаток упаривают из 210 мл толуола в вакууме и вновь полученный остаток упаривают из 50 мл хлороформа до остатка. Остаток растворяют в 10 мл тетрагидрофурана и добавляют 400 мл охлажденного льдом гексана. Образовавшийся твердый продукт собирают, получая 4,3 г требуемого продукта в виде твердого вещества, т.пл. 121-123 С. Стандартный пример 40. 5,11-Дигидро 10 Н-дибенз[b,e][1,4]диазепин. К перемешиваемому раствору 4,3 г 5,11 дигидро-10 Н-дибенз[b,е][1,4]диазепин-11-она в 50 мл тетрагидрофурана в атмосфере азота и охлажденному до 0 С добавляют 4,0 мл 10 молярного раствора комплекса диметилсульфидборана в тетрагидрофуране. Убирают ледяную баню (через 30 мин) и реакционную смесь перемешивают при комнатной температуре 18 ч. Реакционную смесь охлаждают на ледяной бане и добавляют по каплям 30 мл безводного метанола и упаривают досуха в вакууме. Добавляют еще 30 мл метанола и упаривают до остатка. Остаток смешивают с 30 мл 40% охлажденной гидроокиси натрия и затем нагревают до 110 С 45 мин и охлаждают до комнатной температуры. Реакционную смесь разбавляют 200 мл воды и экстрагируют метиленхлоридом (3100 мл). Объединенные экстракты промывают 1 н НСl,водой и 0,5 н NaOH. Органический слой сушат и упаривают в вакууме, получая 3,2 г заданного продукта, т.пл. 114-116 С.[b,е]азепин-6,11-дион. Смесь 2,50 г 2-аминобензофенон-2'карбоновой кислоты в 50 мл ксилола перемешивают при нагревании до температуры кипения обратным холодильником 23 ч. Смесь фильтруют, получая 1,82 г заданного продукта в виде твердого соединения. Стандартный пример 42. 2-Хлор-5 Ндибенз[b,е]азепин-6,11-дион. Смесь 1,0 г 5H-дибенз[b,е]азепин-6,11 диона в 50 мл уксусной кислоты перемешивают,барботируя хлор через реакционную смесь до насыщения. Температуру повышают до 38 С. Смесь оставляют стоять, при этом образуется осадок, который отфильтровывают, промывают гексаном и сушат на воздухе, получая 0,62 г твердого продукта, который чистят хроматографически, получая заданный продукт в виде твердого соединения, т.пл. 289-293 С. Стандартный пример 43. 2-Хлор-6,11 дигидро-5 Н-дибенз[b,е]азепин. К смеси 7,28 г 2-хлор-5 Н-дибенз[b,е]азепин-6,11-диона в 25 мл безводного тетрагидрофурана в атмосфере аргона добавляют по каплям 8,5 мл (10 М) боран-диметилсульфида в тетрагидрофуране. Реакционную смесь перемешивают при комнатной температуре 18 ч. Реакционную смесь нагревают до температуры кипения с обратным холодильником 3 ч и охлаждают до комнатной температуры. При перемешивании осторожно добавляют 25 мл метилового спирта, после чего - 100 мл 2 н NaOH. Реакционную смесь нагревают до температуры кипения с обратным холодильником 24 ч и собирают твердый продукт. Твердое вещество растворяют в метиленхлориде и промывают 2 н лимонной кислотой, водой и сушат (Na2SO4). Летучие продукты упаривают в вакууме, получая 4,16 г остатка, который кристаллизуют из этилацетагексана, получая 2,05 г заданного продукта в виде кристаллического твердого соединения, т.пл. 137-141 С. Стандартный пример 44. 2-[2(Трибутилстаннил)-3-тиенил]-1,3-диоксолан. К перемешиваемому раствору 15,6 г (0,10 моль) 2-(3-тиенил)-1,3-диоксолана в 100 мл безводного диэтилового эфира добавляют по каплям н-бутиллитий (1,48 н, в гексане, 74,3 мл) в атмосфере азота и при комнатной температуре. После нагревания до температуры кипения с обратным холодильником в течение 15 мин реакционную смесь охлаждают до -78 С и добавляют по каплям три-н-бутилоловохлорид (34,18 г, 0,105 моль) в 100 мл сухого тетрагидрофурана. После завершения добавления реакционную смесь нагревают до комнатной температуры и растворитель упаривают. К маслянистому остатку добавляют 100 мл гексана и образовавшийся осадок (LiCl) отфильтровывают. Фильтрат упаривают и остаток перегоняют при пони 33 женном давлении, получая 34,16 г (77%) заданного продукта. Стандартный пример 45. 2-[2-[(2 Нитрофенил)метил]-3-тиенил]-1,3-диоксолан. Смесь 2-[2-(трибутилстаннил)-3-тиенил]1,3-диоксолана (8,8 г, 20 ммоль), 2 нитробензилбромида (4,5 г, 22 ммоль) и тетракис(трифенилфосфин)палладия (0) (200 мг) нагревают до температуры кипения с обратным холодильником в дегазированном толуоле 16 ч в атмосфере азота. По окончании реакционную смесь охлаждают до комнатной температуры и фильтруют через диатомовую землю. Толуол удаляют, концентрируя при пониженном давлении и продукт выделяют колоночной хроматографией на силикагеле, элюируя 30% этилацетат:гексаном, что дает 4,5 г заданного продукта в виде вязкой жидкости. Масс-спектр: М+ 292. Стандартный пример 46. 4,10-Дигидро-5 Нтиено[3,2-с][1]бензазепин. Перемешиваемый раствор 4 г 2-[2-[(2 нитрофенил)метил]-3-тиенил]-1,3-диоксалана в ацетоне (50 мл) и уксусной кислоте (90% 50 мл) нагревают до 60 С. Медленно добавляют порошок цинка (10 г) и после добавления реакционную смесь перемешивают 6 ч. По окончании реакционную смесь фильтруют и остаток промывают ацетоном и концентрируют. Коричневый остаток экстрагируют хлороформом и хорошо промывают водой. Органический слой сушат (Na2SO4), фильтруют и концентрируют. Продукт выделяют колоночной хроматографией на силикагеле, элюируя 20% этилацетат:гексаном, получая 2,0 г заданного продукта в виде бледно-желтого кристаллического твердого вещества, т.пл. 86 С. Масс-спектр: M+ 202. Стандартный пример 47. 4,5-Дигидро-4,4 диметил-2-[3-(2-нитрофенил)метил]-2-тиенил]оксазол. К раствору 4,5-дигидро-4,4-диметил-2-(2 тиенил)-оксазола (4,5 г, 25 ммоль) в безводном диэтиловом эфире при -70 С добавляют, капля за каплей, н-бутиллитий (2,5 молярн. раствор в гексане, 11 мл) в атмосфере азота. Реакционную смесь перемешивают при -78 С в течение 45 мин и добавляют капля за каплей три-нбутилоловохлорид (8,3 г, 25 ммоль) в сухом диэтиловом эфире. Реакционную смесь перемешивают при комнатной температуре 1 ч и гасят реакцию добавлением воды. Реакционную смесь экстрагируют диэтиловым эфиром, хорошо промывают водой, сушат и концентрируют. Полученный продукт имеет чистоту, достаточную для дальнейшего превращения. Маслянистый продукт, 4,5-дигидро-4,4-диметил-2-[3-(трибутилстаннил)-2-тиенил]оксазол, смешивают с 2 нитробензилбромид (5,5 г, 25 ммоль) в толуоле и нагревают до температуры кипения с обратным холодильником в присутствии тетракис(трифенилфосфин)палладия (0) (200 мг) в течение 16 ч. По окончании реакции смесь охлаждают до комнатной температуры и фильт 000752 34 руют. Толуол отгоняют при пониженном давлении и выделяют продукт в виде коричневого масла, используя колоночную хроматографию на силикагеле, элюируя 30% смесью этилацетат:гексан, что дает 5,7 г заданного продукта. Масс-спектр: М+ 316. Стандартный пример 48. 9,10-Дигидро-4 Нтиено[3,2-с][1]бензазепин-10-он. Раствор 4,5-дигидро-4,4-диметил-2-[3-[(2 нитрофенил)метил]-2-тиенил]оксазола 5 г нагревают до температуры кипения с обратным холодильником в смеси ацетон/вода (3:1 100 мл), содержащей 1 н НСl (30 мл) в течение 24 ч. Реакционную смесь концентрируют и остаток растворяют в ледяной уксусной кислоте (100 мл). Уксусную кислоту перемешивают при 70 С и медленно добавляют цинковую пыль (10 г). Перемешивание продолжают при 70 С в течение 6 ч. По окончании реакции смесь охлаждают до комнатной температуры и фильтруют. Уксусную кислоту удаляют при пониженном давлении и остаток экстрагируют хлороформом. Слой хлороформа сушат и концентрируют, получая 2,9 г заданного продукта в виде коричневого твердого продукта. Масс-спектр: М+ 215. Стандартный пример 49. 9,10-Дигидро-4 Нтиено[2,3-с][1]бензазепин. Перемешиваемый раствор 2,0 г 9,10 дигидро-4H-тиено[2,3-с][1]бензазепин-10-она и алюмогидрида лития (500 мг) в тетрагидрофуране нагревают до температуры кипения с обратным холодильником в течение 4 ч. По окончании реакцию осторожно гасят охлажденной льдом водой и экстрагируют хлороформом. Органический слой хорошо промывают водой и сушат над безводным Na2SO4, фильтруют и концентрируют. Продукт чистят колоночной хроматографией на силикагеле, элюируя 30% этилацетат:гексаном, что дает 1,2 г заданного продукта в виде коричнево-желтого твердого продукта. Масс-спектр: M+ 202. Стандартный пример 50. 2-Метилфуран-3 карбонилхлорид. Смесь 4,0 г метил-2-метилфуран-3 карбоксилата, 30 мл 2 н NaOH и 15 мл метанола нагревают до температуры кипения с обратным холодильником в течение 1,5 ч. Растворитель удаляют в вакууме, получая твердый продукт. Твердый продукт экстрагируют дихлорметаном(отбрасывают). Твердое вещество растворяют в воде и раствор подкисляют 2 н лимонной кислотой, получая твердый продукт. Твердый продукт промывают водой и сушат, получая кристаллы (1,05 г) кристаллической 2-метил-фуран 3-карбоновой кислоты. Полученное соединение(0,95 г) и 3 мл тионилхлорида нагревают до температуры кипения с обратным холодильником в течение 1 ч. Растворитель удаляют, добавляют толуол (20 мл, три раза) и удаляют растворитель, получая продукт в виде масла. Стандартный пример 51. 2-[2-(Трибутилстаннил)-3-тиенил]-1,3-диоксолан. 35 К перемешиваемому раствору 15,6 г (0,10 моль) 2-(3-тиенил)-1,3-диоксолана в 100 мл безводного диэтилового эфира, добавляют нбутиллитий (1,48 н, в гексане, 74,3 мл), по каплям в атмосфере азота и при комнатной температуре. После нагревания до температуры кипения с обратным холодильником в течение 15 мин реакционную смесь охлаждают до -78 С и добавляют по каплям хлорид три-н-бутилолова(34,18 г, 0,105 моль) в 100 мл сухого тетрагидрофурана. После завершения добавления смесь нагревают до комнатной температуры и упаривают растворитель. К маслянистому остатку добавляют 100 мл гексана и полученный осадок(LiCl) отфильтровывают. Фильтрат упаривают и остаток отгоняют при пониженном давлении,получая 34,16 г (77%) заданного продукта. Стандартный пример 52. Метил-6 аминопиридин-3-карбоксилат. Сухой метанол (400 мл) охлаждают на ледяной бане и барботируют через смесь газообразный НСl в течение 25 мин. К МеОН-НСl добавляют 30 г 6-аминопиридин-3-карбоновой кислоты и затем смесь перемешивают и нагревают до 90C 2 ч (растворяются все твердые продукты). Растворитель удаляют в вакууме и оставшийся твердый продукт растворяют в 100 мл воды. Кислый раствор нейтрализуют насыщенным бикарбонатом натрия (выделяется твердый продукт) и смесь охлаждают и фильтруют, получая 30 г белых кристаллов, т.пл. 150154 С. Стандартный пример 53. 6-[(5-Фтор-2 метилбензоил)амино]пиридин-3-карбоновая кислота. К смеси 4,5 г метил 6-аминопиридин-3 карбоксилата и 5,53 мл триэтиламина в 40 мл дихлорметана (охлажденный на ледяной бане) добавляют 6,38 г 5-фтор-2-метилбензоилхлорида в 10 мл дихлорметана. Смесь перемешивают при комнатной температуре в атмосфере аргона 18 ч и добавляют 3,4 г 5-фтор-2 метилбензоилхлорида. После перемешивания в течение 3 ч при комнатной температуре смесь фильтруют, получая 3,0 г метил 6-бис (5-фтор 2-метилбензоил)]амино]пиридин-3-карбоксилата. Фильтрат концентрируют досуха, остаток растирают с гексаном и этилацетатом, получая дополнительно 9,0 г бис-ацилированного соединения. Смесь 12,0 г метил 6-бис(5-фтор-2 метилбензоил)]амино]-пиридин-3-карбоксилата,60 мл метанол-тетрагидрофурана (1:1) и 23 мл 5 н NaOH перемешивают при комнатной температуре 16 ч. Смесь концентрируют в вакууме,разбавляют 25 мл воды, охлаждают и подкисляют 1 н НСl. Смесь фильтруют и твердый продукт промывают водой, получая 6,3 г продукта в виде белого твердого вещества. Используя стандартный пример 53, но применяя соответствующие ароилхлорид, гетероароилхлорид, циклоалканоилхлориды, фенил 000752 36 ацетилхлориды и подходящие хлорангидриды соответствующих кислот, получают следующие 6-[(ароиламино]пиридин-3-карбоновые кислоты, 6-[(гетероароил)амино]пиридин-3-карбоновые кислоты и соответствующие 6[(ацилированные)амино]пиридин-3-карбоновые кислоты. Стандартный пример 54. 6-[(3-Метил-2 тиенилкарбонил)амино]пиридин-3-карбоновая кислота. Стандартный пример 55. 6-[(2-Метил-3 тиенилкарбонил)амино]пиридин-3-карбоновая кислота. Стандартный пример 56. 6-[(3-Метил-2 фуранилкарбонил)амино]пиридин-3-карбоновая кислота. Стандартный пример 57. 6-[(2-Метил-3 фуранилкарбонил)амино]пиридин-3-карбоновая кислота. Стандартный пример 58. 6-[(3-Фтор-2 метилбензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 59. 6-[(2 Метилбензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 60. 6-[(2 Хлорбензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 61. 6-[(2 Фторбензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 62. 6-[(2-Хлор-4 фторбензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 63. 6-[(2,4 Дихлорбензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 64. 6-[(4-Хлор-2 фторбензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 65. 6-[(3,4,5 Триметоксибензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 66. 6-[(2,4 Дифторбензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 67. 6-[(2 Бромбензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 68. 6-[(2-Хлор-4 нитробензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 69. 6-[(Тетрагидрофуранил-2-карбонил)амино]пиридин-3 карбоновая кислота. Стандартный пример 70. 6-[(Тетрагидротиенил-2-карбонил)амино]пиридин-3-карбоновая кислота. Стандартный пример 71. 6-[(Циклогексилкарбонил)амино]пиридин-3-карбоновая кислота. 38 Стандартный пример 92. 6-[(2,6 Диметилбензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 93. 6-[(2 Метилтиобензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 94. 6-[(4-Фтор-2(трифторметил)бензоил)амино]пиридин-3 карбоновая кислота. Стандартный пример 95. 6-[(2,3 Дихлорбензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 96. 6-[(4-Фтор-2 метилбензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 97. 6-[(2,3,5 Трихлорбензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 98. 6-[(5-Фтор-2 хлорбензоил)амино]пиридин-3-карбоновая кислота. Стандартный пример 99. 6-[(2-Фтор-5(трифторметил)бензоил)амино]пиридин-3 карбоновая кислота. Стандартный пример 100. 6-[(5-Фтор-2 метилбензоил)амино]пиридин-3-карбонилхлорид. Смесь 6,2 г 6-[(5-фтор-2-метилбензоил)амино]пиридин-3-карбоновой кислоты и 23 мл тионилхлорида нагревают до температуры кипения с обратным холодильником 1 ч. Добавляют дополнительно 12 мл тионилхлорида и смесь нагревают до температуры кипения с обратным холодильником 0,5 ч. Смесь концентрируют досуха в вакууме и добавляют 30 мл толуола к остатку. Толуол отгоняют в вакууме и прием (добавление и отгонку растворителя) повторяют, получая 7,7 г сырого продукта в виде твердого вещества. По способу стандартного примера 100 получают следующие 6-(ациламино)пиридин-3 карбонилхлориды. Стандартный пример 101. 6-[(3-Метил-2 тиенилкарбонил)амино]пиридин-3-карбонилхлорид. Стандартный пример 102. 6-[(2-Метил-3 тиенилкарбонил)амино]пиридин-3-карбонилхлорид. Стандартный пример 103. 6-[(3-Метил-2 фуранилкарбонил)амино]пиридин-3-карбонилхлорид. Стандартный пример 104. 6-[(2-Метил-3 фуранилкарбонил)амино]пиридин-3-карбонилхлорид. Стандартный пример 105. 6-[(3-Фтор-2 метилбензоил)амино]пиридин-3-карбонилхлорид. Стандартный пример 106. 6-[(2 Метилбензоил)амино]пиридин-3-карбонилхлорид. 40 Стандартный пример 128. 6-[(2-Метил-5 фторбензолацетил)амино]пиридин-3-карбонилхлорид. Стандартный пример 129. 6-[(3-Метил-2 тетрагидротиенилацетил)амино]пиридин-3 карбонилхлорид. Стандартный пример 130. 6-[(2-Метил-3 тетрагидротиенилацетил)амино]пиридин-3 карбонилхлорид. Стандартный пример 131. 6-[(2,5 Дихлорбензоил)амино]пиридин-3-карбонилхлорид. Стандартный пример 132. 6-[(3,5 Дихлорбензоил)амино]пиридин-3-карбонилхлорид. Стандартный пример 133. 6-[(2-Метил-4 хлорбензоил)амино]пиридин-3-карбонилхлорид. Стандартный пример 134. 6-[(2,3 Диметилбензоил)амино]пиридин-3-карбонилхлорид. Стандартный пример 135. 6-[(2 Метоксибензоил)амино]пиридин-3-карбонилхлорид. Стандартный пример 136. 6-[(2 Трифторметоксибензоил)амино]пиридин-3 карбонилхлорид. Стандартный пример 137. 6-[(4-Хлор-2 метоксибензоил)амино]пиридин-3-карбонилхлорид. Стандартный пример 138. 6-2(Трифторметил)бензоил]амино]пиридин-3 карбонилхлорид. Стандартный пример 139. 6-[(2,6 Дихлорбензоил)амино]пиридин-3-карбонилхлорид. Стандартный пример 140. 6-[(2,6 Диметилбензоил)амино]пиридин-3-карбонилхлорид. Стандартный пример 141. 6-[(2 Метилтиобензоил)амино]пиридин-3-карбонилхлорид. Стандартный пример 142. 6-[(4-Фтор-2(трифторметил)бензоил)амино]пиридин-3 карбонилхлорид. Стандартный пример 143. 6-[(2,3 Дихлорбензоил)амино]пиридин-3-карбонилхлорид. Стандартный пример 144. 6-[(4-Фтор-2 метилбензоил)амино]пиридин-3-карбонилхлорид. Стандартный пример 145. 6-[(2,3,5 Трихлорбензоил)амино]пиридин-3-карбонилхлорид. Стандартный пример 146. 6-[(5-Фтор-2 хлорбензоил)амино]пиридин-3-карбонилхлорид. Стандартный пример 147. 6-[(2-Фтор-5(трифторметил)бензоил)амино]пиридин-3 карбонилхлорид. Согласно стандартному примеру 53, следующие бис-ацилированные продукты (табл. А) получают и чистят хроматографически на силикагеле. Эти соединения гидролизуют затем до Стандартный пример 172. 6-Амино-5 бромпиридин-3-карбоновая кислота. К перемешиваемому раствору 6 аминоникотиновой кислоты (13,8 г, 0,1 моль) в ледяной уксусной кислоте (100 мл) добавляют медленно бром (16 г, 5 мл, = 0,1 моль) в уксусной кислоте (20 мл). Реакционную смесь перемешивают 8 ч при комнатной температуре и уксусную кислоту удаляют при пониженном давлении. Желтый твердый остаток растворяют в воде и осторожно нейтрализуют 30% NH4OH. Выделившийся твердый продукт отфильтровы 42 вают и промывают водой, получая 18 г твердого соединения. Масс-спектр: 218 (М+). Стандартный пример 173. Метил 6-амино 5-бромпиридин-3-карбоксилат. 6-Амино-5-бромпиридин-3-карбоновую кислоту (10 г, 50 ммоль) растворяют в насыщенной метанольной НСl (100 мл) и нагревают до температуры кипения с обратным холодильником 24 ч. Растворитель метанол отгоняют при пониженном давлении и остаток растворяют в охлажденной льдом воде. Водный раствор нейтрализуют 0,1 н NaOH и твердые продукты отделяют фильтрацией; промывают хорошо водой и сушат на воздухе, получая 10 г продукта в виде твердого соединения; масс-спектр 231(М+). Стандартный пример 174. 6-[(2-Метилбензолацетил)амино]пиридин-3-карбоновая кислота. К охлажденной (0 С) смеси 5,0 г метил 6 аминопиридин-3-карбоксилата, 12,6 мл N,Nдиизопропилэтиламина в 40 мл дихлорметана добавляют раствор 12,2 г 2-метилбензолацетилхлорида в 10 мл дихлорметана. Смесь перемешивают в атмосфере аргона при комнатной температуре в течение ночи. Смесь разбавляют 200 мл дихлорметана и 50 мл воды и отделяют органический слой. Органический слой промывают 50 мл каждого из: 1 М NaHCO3, раствором соли и сушат (Na2SO4). Раствор фильтруют через тонкий слой водного силиката магния и фильтрат концентрируют досуха. Остаток (9,0 г) хроматографируют на колонке с силикагелем,используя гексан-этилацетат (3:1) в качестве элюента, что дает 8,6 г твердого соединения. Этот твердый продукт, в основном метил 6 бис-(2-метилбензолацетил)]амино]пиридин-3 карбоксилат, растворяют в 60 мл тетрагидрофуран-метанола (1:1) и добавляют к раствору 5 н NaOH. Смесь перемешивают при комнатной температуре в течение ночи и концентрируют в вакууме. Добавляют воду (25 мл) и смесь перемешивают и подкисливают охлажденной 1 н НСl. Смесь охлаждают и отфильтровывают твердый продукт, промывают водой и получают 5,9 г не совсем белого твердого продукта. Стандартный пример 175. 6-[(2 Метилбензолацетил)амино]пиридин-3-карбонилхлорид. Смесь 4,5 г 6-[(2-метилбензолацетил)амино]пиридин-3-карбоновой кислоты и 25 мл тионилхлорида нагревают до температуры кипения с обратным холодильником в течение 1 ч и затем концентрируют досуха в вакууме. К остатку добавляют 20 мл толуола и растворитель отгоняют в вакууме. Добавление и удаление толуола повторяют и оставшийся твердый продукт сушат при комнатной температуре в вакууме, получая 5,3 г темно-коричневого твердого соединения. 43 Стандартный пример 176. [1,1'-Дифенил]2-дифенилкарбонилхлорид. Смесь 5,6 г [1,1'-дифенил]-2-карбоновой кислоты и 29 мл тионилхлорида нагревают на паровой бане 0,5 ч и летучие продукты отгоняют в вакууме. Добавляют (дважды) толуол (40 мл) и растворитель удаляют в вакууме, получая 6,8 г желтого масла. Стандартный пример 177. Метил 6 бис(1,1'-дифенил]-2-илкарбонил)]амино]пиридин-3-карбоксилат. К охлажденному (0 С) раствору 2,64 г метил 6-аминопиридин-3-карбоксилата и 5,5 мл диизопропилэтиламина в 30 мл дихлорметана в атмосфере аргона добавляют 6,8 г [1,1'-дифенил]-2-карбонилхлорида в 10 мл дихлорметана. Смесь перемешивают при комнатной температуре 2 дня и затем разбавляют 120 мл дихлорметана и 50 мл воды. Органический слой отделяют, промывают 50 мл каждого из: 1 М NаНСО 3 и раствором соли, и сушат (Na2SO4). Раствор фильтруют через тонкий слой водного силиката магния и фильтрат концентрируют в вакууме до твердого вещества. Кристаллизация из этилацетата дает 6,2 г белых кристаллов, т.пл. 180188 С. Стандартный пример 178. 6-(1,1'дифенил)-2-илкарбонил]амино]пиридин-3 карбоновая кислота. К охлажденной смеси (0 С), 6,0 г метил 6 бис[(1,1'-дифенил)-2-илкарбонил]амино]пиридин-3-карбоксилата в 40 мл метанола и 30 мл тетрагидрофурана медленно добавляют 18 мл 2 нNaOH. Смесь перемешивают при комнатной температуре в течение ночи и доводят до рН 5 с помощью ледяной уксусной кислоты. Смесь концентрируют, подкисляют до рН 2-3 1 н НСl и экстрагируют 250 мл этилацетата. Экстракт промывают 50 мл насыщенного раствора соли,сушат (Na2SO4) и растворитель удаляют в вакууме. Оставшийся белый твердый продукт растирают с 15 мл этилацетата, получая 3,35 г белых кристаллов, т.пл. 215-217 С. Стандартный пример 179. 6-(1,1'дифенил)-2-илкарбонил]амино]пиридин-3 карбонилхлорид. Смесь 1,9 г 6-(1,1'-дифенил)-2-илкарбонил]амино]пиридин-3-карбоновой кислоты и 9 мл тионилхлорида нагревают до температуры кипения с обратным холодильником 1 ч и затем концентрируют досуха в вакууме. Толуол (15 мл) добавляют (дважды) к остатку и растворитель отгоняют в вакууме, получая 2,1 г светлокоричневого масла. Стандартный пример 180. 6-[(Циклогексилкарбонил)амино]пиридин-3-карбоновая кислота. К охлажденному (0 С) раствору 5,0 г метил 6-аминопиридин-3-карбоксилата и 12,6 мл диизопропилэтиламина в 50 мл дихлорметана в атмосфере аргона добавляют раствор 9,7 мл циклогексилкарбонилхлорида в 10 мл дихлор 000752 44 метана. Смесь перемешивают при комнатной температуре в течение ночи, разбавляют 200 мл дихлорметана и 60 мл воды. Органический слой отделяют, промывают 60 мл раствора соли и сушат (Na2SO4). Раствор фильтруют через тонкий слой водного силиката магния и фильтрат концентрируют в вакууме, получая 12,8 г твердого продукта. Полученное выше твердое соединение(12,0 г) в смеси со 150 мл тетрагидрофуранметанола (1:1) охлаждают до 0 С и добавляют 62 мл 2 н гидроокиси натрия. Смесь перемешивают при комнатной температуре 3 ч, нейтрализуют 10 мл ледяной уксусной кислоты и концентрируют в вакууме. Смесь (содержащую твердый продукт) подкисляют до рН 1 1 н НСl и экстрагируют 250 мл этилацетата и дважды 100 мл этилацетата. Объединенный экстракт промывают 100 мл раствора соли, сушат (Na2SO4) и концентрируют до белого твердого продукта. Растирание с гексаном дает 6,5 г продукта в виде белого твердого соединения. Стандартный пример 181. Метил-2-[(4 этоксиоксобутил)амино]бензоат. Смесь 19,2 г метил 2-аминобензоата и 9,6 г этил g-бром-бутирата нагревают до 80-85 С 24 ч, охлаждают до комнатной температуры и фильтруют. Твердый продукт промывают СН 2 Сl2 и фильтрат промывают 1 н НСl, Н 2 О, 1 нNaHCO3 и раствором соли. Растворитель удаляют, получая масло. Масло перегоняют и собирают фракции, кипящие при 45-75 С и 130160 С, и отбрасывают. Остаток содержит продукт (55,4 г масла). Стандартный пример 182. Метил 2-[N-(4 этокси-4-оксобутил)-N-(2-метилфенилсульфонил)-амино]бензоат. Смесь 2,65 г метил 2-[(4-этокси-4-оксобутил)амино]бензоата, 2,0 г 2-метилфенилсульфонилхлорида и пиридина нагревают на паровой бане 16 ч. Смесь концентрируют в вакууме (удаляют пиридин) и добавляют 1 н HCl. Смесь экстрагируют дихлорметаном и экстракт промывают 1 н HCl, Н 2 О, 1 М NаНСО 3, раствором соли и сушат (Na2SO4). Раствор фильтруют через тонкий слой водного силиката магния и фильтрат упаривают, получая 3,8 г твердого продукта, который кристаллизуют из этанола,получая кристаллы, т.пл. 100-102 С. Стандартный пример 183. Метил- и этил 1,2-дигидро-5-гидрокси-1-[(4-метилфенил)сульфонил]-3 Н-1-бензазепин-4-карбоксилат. К смеси 0,448 г трет-бутоксида калия в 2 мл тетрагидрофурана, охлажденной до 0 С, добавляют 0,838 г метил 2-[N-(4-этокси-4 оксобутил)-N-(2-метилфенилсульфонил)амино]бензоата в 12 мл тетрагидрофурана. Смесь перемешивают при 0 С 4 ч (в аргоне), выливают в воду и нейтрализуют 2 н лимонной кислотой. Смесь экстрагируют дихлорметаном и экстракт промывают водой, раствором соли и сушат(MgSO4). Экстракт фильтруют через тонкий 45 слой водного силиката магния и фильтрат концентрируют досуха, получая 0,59 г продукта(смесь метилового и этилового эфиров). Стандартный пример 184. 1,2,3,4 тетрагидро-1-[(2-метилфенил)сульфонил]-5 Н-1 бензазепин-5-он. 30 г-образец смеси метилового и этилового 1,2-дигидро-5-гидрокси-1-[(4-метилфенил)сульфонил]-3 Н-1-бензазепин-4-карбоксилатов в смеси 171 мл концентрированной соляной кислоты и 171 мл ледяной уксусной кислоты нагревают до температуры кипения с обратным холодильником 24 ч. Добавляют дополнительно 170 мл концентрированной соляной кислоты и смесь нагревают до температуры кипения с обратным холодильником 24 ч. Смесь концентрируют в вакууме досуха, разбавляют водой и раствор доводят до рН 8 насыщенным NаНСO3. Смесь экстрагируют дихлорметаном и экстракт промывают Н 2 О, раствором соли и сушат (Na2SO4). Раствор фильтруют через тонкий слой водного силиката магния и фильтрат упаривают, получая 12,0 г коричневого масла. Стандартный пример 185. 4[(Диметиламино)метилен]-1,2,3,4-тетрагидро-1[(2-метилфенил) сульфонил]-5 Н-1-бензазепин-5 он. Смесь 1,89 г 1,2,3,4-тетрагидро-1-[(2 метилфенил)сульфонил]-5 Н-1-бензазепин-5-она и 2,47 мл трет-бутокси-бис(диметиламино)метана (реагент Bredericks'a) в 10 мл дихлорметана нагревают в аргоне на паровой бане 16 ч. Смесь концентрируют досуха в вакууме и остаток растворяют в CH2Cl2. Раствор фильтруют через тонкий слой водного силиката магния и наполнитель промывают 5% этилацетатом вCH2Cl2. Фильтрат концентрируют досуха и остаток (1,96 г) кристаллизуют из СН 2 Сl2-гексана,получая 0,85 г кристаллов, т.пл. 180-185 С. Вторую порцию кристаллов (0,85 г) выделяют из маточника и дополнительно 0,30 г выделяют,промывая слой водного силиката магния этилацетатом. Стандартный пример 186. 1,4,5,6 тетрагидро-6-[(2-метилфенил)сульфонил]пиразоло[4,3-d] [1]бензазепин. Смесь 1,55 г 4-[(диметиламино)метилен]1,2,3,4-тетрагидро-1-[(2-метилфенил)сульфонил]-5 Н-1-бензазепин-5-она, 0,25 мл гидразина и 60 мл этанола нагревают до температуры кипения с обратным холодильником на паровой бане в аргоне 2 ч. После выдерживания в течение ночи при комнатной температуре растворитель удаляют в вакууме. Остаток растворяют вCH2Cl2 и раствор промывают водой, раствором соли и сушат (Na2SO4). Раствор фильтруют через тонкий слой водного силиката магния и фильтрат упаривают, получая 1,4 г кристаллов,т.пл. 76-79 С. При проведении реакции в больших масштабах с 18,29 г 4-[(диметиламино)метилен]1,2,3,4-тетрагидро-1-[(2-метилфенил)сульфо 000752 46 нил]-5 Н-1-бензазепин-5-она продукт в CH2Cl2 фильтруют через тонкий слой водного силиката магния и вещество на фильтре промывают этилацетатом. Фильтрат концентрируют, получая 16,5 г продукта (одно пятно в тонкослойной хроматографииH2SO4 в ледяной уксусной кислоте нагревают до 60 С 12 ч или до удаления тозил-группы. Смесь выливают на 100 мл льда и воды при охлаждении. Добавляют порциями твердый NaOH (поддерживая температуру ниже 30 С) при эффективном перемешивании и поддерживая рН 8. Смесь экстрагируют этилацетатом и экстракт сушат (Na2SO4) и удаляют растворитель, получая твердый продукт. Стандартный пример 188. 10,11 Дигидробенз[b,f][1,4]оксазепин. К суспензии 7,35 г алюмогидрида лития в 100 мл тетрагидрофурана добавляют порциями 10,0 г дибенз[b,f][1,4]оксазепин-10(11 Н)-она. Добавляют дополнительно 100 мл тетрагидрофурана и смесь нагревают до температуры кипения с обратным холодильником 6 ч и затем перемешивают при комнатной температуре в течение ночи. К охлажденной смеси добавляют по каплям 7,5 мл Н 2 О, 7,5 мл 15% NaOH и три по 7,5 мл порции Н 2 О. Смесь фильтруют и плотный осадок на фильтре промывают тетрагидрофураном и дихлорметаном. Фильтрат концентрируют досуха, получая 10,1 г твердого продукта. Твердый продукт растворяют в дихлорметане и раствор фильтруют через тонкий слой водного силиката магния. Плотный осадок на фильтре промывают дихлорметаном и фильтрат концентрируют досуха, получая 8,9 г твердого продукта. Кристаллизация из дихлорметан-гексана дает 7,5 г кристаллов, т.пл. 6971 С. Стандартный пример 189. Пиридо[2,3b][1,4]бензоксазепин-6(5 Н)-он. Смесь 21,4 г фенилсалицилата, 25,71 г 3 амино-2-хлорпиридина и 20 мл 1,2,4 трихлорбензола нагревают до температуры кипения с обратным холодильником 1 ч в атмосфере аргона и одновременно отгоняют выделившийся фенол и HCl (из нагреваемой до температуры кипения с обратным холодильником смеси) и собирают в раствор 0,1 н NaOH. Горячую смесь выливают в 200 мл этанола и осадившийся твердый продукт собирают фильтрацией. Твердый продукт промывают этанолом и сушат. Перекристаллизация из метанола-ДМФ 47 Смесь 2,8 г пиридо[2,3-b][1,4]бензоксазепин-6(5 Н)-она, 10 мл тетрагидрофурана и 3 мл 10 М боран-диметилсульфида в тетрагидрофуране перемешивают при комнатной температуре в течение ночи и затем нагревают до температуры кипения с обратным холодильником 3 ч. К смеси добавляют по каплям в атмосфере аргона 5 мл метанола. Растворитель удаляют в вакууме и добавляют метанол. Растворитель удаляют в вакууме и добавляют 12 мл 2 н NaOH к остатку. Смесь нагревают до температуры кипения с обратным холодильником 2 ч и экстрагируют этилацетатом. Экстракт промывают 2 н лимонной кислотой, Н 2 О, раствором соли и сушат(Na2SO4). Раствор фильтруют через тонкий слой водного силиката магния и фильтрат концентрируют досуха в вакууме. Остаток хроматографируют на колонке (218) из силикагеляN-(2 Гидроксифенил)-2-хлор-3-пиридинкарбоксамид. Как описано в J. Med. Chem., 37 519(1994), раствор 1,09 г 2-аминофенола в 15 мл тетрагидрофурана добавляют по каплям к смеси 2,1 г триэтиламина и 2,33 г 2-хлорпиридин-3 карбонилхлорид-гидрохлорида в 10 мл тетрагидрофурана. Смесь перемешивают при комнатной температуре один час в атмосфере аргона и затем нагревают до температуры кипения с обратным холодильником один час. Растворитель удаляют в вакууме и остаток растирают с водой: твердый продукт отфильтровывают и промывают водой, получая 1,02 г твердого соединения. Перекристаллизация из 2-пропанола дает кристаллы, т.пл. 145-146 С. Стандартный пример 192. Пиридо[2,3b][1,5]бензоксазепин-5(6 Н)он. Смесь 13,0 г N-(2-гидроксифенил) -2-хлор 3-пиридинкарбоксамида и 2,82 г метилата натрия в 100 мл N,N-диметилформамида нагревают до температуры кипения с обратным холодильником в атмосфере аргона 3 ч. Добавляют метилат натрия (0,50 г) и смесь нагревают до температуры кипения с обратным холодильником 2 ч и затем перемешивают при комнатной температуре 2 дня. Растворитель удаляют в глубоком вакууме и красно-коричневый остаток растирают с охлажденным метанолом. Смесь фильтруют и твердый продукт промывают охлажденным метанолом, получая 5,0 г белого твердого продукта, т.пл. 250-253 С. Стандартный пример 193. 5,6 Дигидропиридо[2,3-b][1,5]бензоксазепин. К перемешиваемой суспензии 0,886 г алюмогидрида лития в 20 мл тетрагидрофурана добавляют порциями 1,65 г пиридо-[2,3b][1,5]бензоксазепин-5(6 Н)-она. Смесь разбавляют 30 мл тетрагидрофурана и нагревают до температуры кипения с обратным холодильником в атмосфере аргона 18 ч. К смеси добавля 000752 48 ют 1 мл воды, 1 мл 15% NaOH и три одномиллилитровые порции Н 2 О и смесь фильтруют. Твердый продукт экстрагируют дихлорметаном и раствор пропускают через тонкий слой водного силиката магния. Фильтрат концентрируют досуха, получая кристаллы, т.пл. 125-129 С. Стандартный пример 194. 9,10-Дигидро 4 Н-тиено[2,3-с][1]бензазепин. К раствору 9,0 г 4,5-дигидро-4,4-диметил 2-(2-тиенил)-оксазола в 200 мл тетрагидрофурана, охлажденному до -78 С, добавляют 20 мл 2,5 молярного раствора н-бутиллития в гексане. Смесь перемешивают при -78 С 15 мин и при 0 С 30 мин. К перемешиваемому раствору добавляют 6,0 г 2-метилбензоксазепин-4-она. Смесь перемешивают при комнатной температуре 16 ч, обрывая реакцию охлажденной льдом водой и экстрагируя хлороформом. Экстракт концентрируют досуха и добавляют 100 мл 40%H2SO4. Смесь нагревают до температуры кипения с обратным холодильником 4 ч, охлаждают до комнатной температуры и фильтруют, получая 9,10-дигидро-4,10-диоксо-4 Н-тиено[2,3 с][1]бензазепин. Твердый продукт промывают водой, получая 2,5 г кристаллов. Твердый продукт растворяют в 100 мл сухого тетрагидрофурана и добавляют 1,0 г алюмогидрида лития. Смесь нагревают до температуры кипения с обратным холодильником 16 ч, охлаждают и добавляют по каплям охлажденную льдом воду. После разбавления водой смесь экстрагируют хлороформ-метанолом (3:1) и экстракт сушат(MgSO4). Растворитель удаляют и остаток хроматографируют через силикагель, используя этилацетат-гексан (1:1) в качестве растворителя,что дает 1,8 г твердого продукта. Масс-спектр(CI) 202 (М+Н). Стандартный пример 195. Метил 4-[([1,1'Дифенил]-2-карбонил)амино]-3-метоксибензоат. Смесь 10,0 г [1,1'-дифенил]-2-карбоновой кислоты в 75 мл метиленхлорида и 12,52 г оксалилхлорида перемешивают при комнатной температуре 15 ч. Летучие продукты упаривают в вакууме, получая 11,06 г масла. 2,16 г порцию вышеуказанного масла в 25 мл метиленхлорида подвергают взаимодействию с 1,81 г метил 4 амино-3-метоксибензоата и 1,30 г N,N-диизопропилэтиламина, перемешивая при комнатной температуре 18 ч. Реакционную смесь промывают водой, насыщенным водным NаНСO3 и органический слой сушат (Na2SO4). Органический слой пропускают через водный силикат магния и к фильтрату при кипении добавляют гексан, получая 3,20 г заданного продукта в виде твердого кристаллического вещества, т.пл. 115-117 С. Стандартный пример 196. Метил 4-[([1,1'Дифенил]-2-карбонил)амино]-2-хлорбензоат. Раствор 2,37 г [1,1'-дифенил]-2-карбонилхлорида в 10 мл метиленхлорида добавляют по каплям к охлажденному льдом раствору 1,84 г метил 4-амино-2-хлорбензоата и 1,49 г N,N 49 диизопропилэтиламина в 50 мл метиленхлорида. Реакционную смесь перемешивают при комнатной температуре 18 ч и промывают водой,насыщенным водным NаНСО 3 и органический слой сушат (Na2SO4). Органический слой пропускают через слой водного силиката магния и добавляют при кипячении гексан, получая 1,1 г заданного продукта в виде твердого кристаллического вещества, т.пл. 132-134 С, M+H=365. Стандартный пример 197. 4-[([1,1'Дифенил]-2-карбонил)амино]-2-хлорбензойную кислоту. Смесь 3,0 г метил 4-[([1,1'-дифенил]-2 карбонил)амино]-2-хлорбензоата в 75 мл абсолютного этанола и 2,0 мл 10 н гидроокиси натрия нагревают 3 ч на паровой бане. Добавляют воду, получая раствор, который экстрагируют метиленхлоридом. Водную фазу подкисляют уксусной кислотой и собирают образовавшийся твердый продукт и сушат в вакууме при 80 С,получая 0,1 г заданного продукта в виде твердого кристаллического вещества, т.пл. 217-219 С. Стандартный пример 198. 4-[([1,1'Дифенил]-2-карбонил)амино]-3-метоксибензоилхлорид. Раствор 2,69 г 4-[([1,1'-дифенил]-2 карбонил)амино]-3-метоксибензойной кислоты в 5 мл тионилхлорида нагревают 1 ч на паровой бане в атмосфере аргона. Летучие продукты удаляют в вакууме, получая остаток, который перемешивают с гексаном, получая 2,58 г кристаллического твердого продукта, т.пл. 121123 С. М+=361. Стандартный пример 199. Метил 4-[([1,1'Дифенил]-2-карбонил)амино]бензоат. Смесь 10,0 г [1,1'-дифенил]-2-карбоновой кислоты в 75 мл метиленхлорида и 12,52 г оксалилхлорида перемешивают при комнатной температуре 18 ч. Летучие продукты упаривают в вакууме, получая 11,66 г масла. 7,5 г-порцию полученного выше масла в 25 мл метиленхлорида добавляют по каплям к раствору 4,53 г метил-4-аминобензоата и 4,3 г N,N-диизопропилэтиламина в 100 мл метиленхлорида при 0 С. Реакционную смесь перемешивают при комнатной температуре 18 ч и промывают водой и насыщенным водным NаНСО 3 и сушат органический слой (Na2SO4). Органический слой пропускают через водный силикат магния и к фильтрату при кипячении добавляют гексан, получая 8,38 г заданного продукта в виде кристаллического твердого соединения, т.пл. 163-165 С. Стандартный пример 200. 4-[([1,1'Дифенил]-2-карбонил)амино]бензойная кислота. 3,15 г-образец метил 4-[([1,1'-дифенил]-2 карбонил)амино]бензоата нагревают до температуры кипения 8 ч в 100 мл этилового спирта и 2,5 мл 10 н гидроокиси натрия. Охлажденную реакционную смесь подкисляют и собирают заданный продукт и сушат, получая 2,9 г заданного продукта в виде твердого вещества, т.пл. 246-249 С. М+H=318. 50 Стандартный пример 201. 4-[(1,1'Дифенил]-2-карбонил)амино]бензоилхлорид. Смесь 1,39 г 4-[([1,1'-дифенил]-2-карбонил)амино]бензойной кислоты в 2,0 мл тионилхлорида нагревают 1 ч на паровой бане. Добавляют охлажденный гексан, собирают кристаллический твердый продукт и сушат, получая 1,34 г заданного продукта, т.пл. 118-120 С. Стандартный пример 202. 2-(Фенилметил)бензоилхлорид. Смесь 5,0 г 2-(фенилметил)бензойной кислоты в 5,0 мл тионилхлорида нагревают на паровой бане 1 ч. Летучие продукты упаривают в вакууме, получая 5,74 г заданного продукта в виде масла. М+=227 как метиловый эфир. Стандартный пример 203. Метил 4-2(фенилметил)бензоил]амино]бензоат. К 3,03 г метил-4-аминобензоата и 3,12 гN,N-диизопропил-этиламина в 75 мл метиленхлорида добавляют 5,54 г 2-(фенилметил)бензоилхлорида и реагенты перемешивают при комнатной температуре 18 ч. Реакционную смесь промывают водой, насыщенным воднымNaHCO3 и органический слой сушат (Na2SO4). Органический слой пропускают дважды через водный силикат магния и добавляют гексан к фильтрату при кипении, получая 5,04 г заданного продукта в виде кристаллического твердого вещества, т.пл. 138-139 С. Стандартный пример 204. Натрий-4-2(фенилметил)бензоил]амино]бензоат. Смесь 4,90 г метил-4-2-(фенилметил)бензоил]амино]бензоата в 100 мл абсолютного этанола и 3,50 мл 10 н гидроокиси натрия нагревают 3 ч на паровой бане. Водную фазу фильтруют и полученный твердый продукт собирают и сушат, получая 4,25 г заданного продукта, т.пл. 340-346 С. Стандартный пример 205. 4-2(Фенилметил)бензоил]амино]бензойная кислота. Смесь 4,0 г 4-2-(фенилметил)бензоил]амино]бензоата натрия суспендируют в воде и доводят рН до 5 с помощью уксусной кислоты. Твердый продукт собирают фильтрацией и сушат при 80 С в вакууме, получая 3,75 г заданного продукта, т.пл. 246-247 С. M+=332. Стандартный пример 206. 4-2(фенилметил)бензоил]амино]бензоилхлорид. Смесь 2,0 г 4-2-(фенилметил)бензоил]амино]бензойной кислоты в 2,0 мл тионилхлорида нагревают на паровой бане 1 ч. Летучие продукты упаривают в вакууме, получая 1,53 г заданного продукта в виде масла. M+=346 как метиловый эфир. Стандартный пример 207. Метил 4-(2 фенилметил)бензоил]амино]-2-хлорбензоат. Смесь 5,0 г 2-(фенилметил)бензойной кислоты в 5,0 мл тионилхлорида нагревают на паровой бане 1 ч. Летучие продукты упаривают в вакууме, получая 5,70 г масла, 2,85 г-порцию указанного выше масла в 25 мл метиленхлорида 51 добавляют к раствору 50 мл метиленхлорида,содержащего 1,85 г метил 4-амино-2 хлорбензоата и 1,65 г N,N-диизопропилэтиламина, перемешивая при комнатной температуре 18 ч. Реакционную смесь промывают водой, насыщенным водным NаНСО 3 и органический слой сушат (Na2SO4). Органический слой пропускают через водный силикат магния (дважды) и к фильтрату при кипении добавляют гексан, получая 2,96 г заданного продукта в виде кристаллического твердого вещества, т.пл. 133-135 С. М+=380. Стандартный пример 208. Метил 4-(2 фенилметил)бензоил]амино]-3-метоксибензоат. Раствор 2,85 г 2-(фенилметил)бензоилхлорида в 25 мл метиленхлорида добавляют по каплям к охлажденному льдом раствору 1,84 г метил 4-амино-3-метоксибензоата и 1,61 г N,Nди-изопропилэтиламина в 50 мл метиленхлорида. Реакционную смесь перемешивают при комнатной температуре 18 ч и промывают водой,насыщенным водным NaHCO3 и органический слой сушат (Na2SO4). Органический слой пропускают через слой водного силиката магния и добавляют при кипении гексан, получая 2,2 г заданного продукта в виде кристаллического твердого вещества, т.пл. 129-131 С. M+=376. Стандартный пример 209. 2-Хлор-4-(2 фенилметил)бензоил]амино]бензойная кислота. Смесь 2,8 г метил 2-хлор-4-(2 фенилметил)бензоил]аминобензоата в 75 мл абсолютного этанола и 1,84 мл 10 н гидроокиси натрия нагревают 3 ч на паровой бане. Добавляют воду до получения раствора, который экстрагируют метиленхлоридом. Водную фазу подкисляют уксусной кислотой и полученный твердый продукт собирают и сушат в вакууме при 80 С, получая 2,6 г заданного продукта в виде кристаллического твердого вещества, т.пл. 184-187 С. М+H=З 66. Стандартный пример 210. 3-Метокси-4(2-фенилметил)бензоил]амино]бензойная кислота. Смесь 2,05 г метил 4-(2 фенилметил)бензоил]амино]-3-метоксибензоата в 75 мл абсолютного этанола и 1,4 мл 10 н гидроокиси натрия нагревают 3 ч на паровой бане. Добавляют воду до получения раствора, который экстрагируют метиленхлоридом. Водную фазу подкисляют уксусной кислотой и полученный твердый продукт собирают и сушат в вакууме при 80 С, получая 1,87 г заданного продукта в виде кристаллического твердого вещества, т.пл. 176-178 С. M+H=З 62. Стандартный пример 211. 3-Метокси-4(2-фенилметил)бензоил]амино]бензоилхлорид. Смесь 1,71 г 3-метокси-4-(2-фенилметил)бензоил]амино]бензойной кислоты в 2,0 мл тионилхлорида нагревают на паровой бане в аргоне 1 ч и добавляют гексан. Образовавшийся твердый продукт собирают и сушат, получая 1,71 г заданного продукта в виде кристалличе 000752[4'(Трифторметил)-1,1'-дифенил]-2-карбонилхлорид. Смесь 5,0 г 4'-(трифторметил)[1,1'дифенил]-2-карбоновой кислоты в 5,0 мл тионилхлорида нагревают на паровой бане в атмосфере аргона 1 ч и добавляют гексан. Полученный твердый продукт собирают и сушат, что дает 5,36 г заданного продукта в виде бесцветного масла. M+=280 как метиловый эфир. Стандартный пример 213. Метил 4-[([4'(трифторметил)[1,1'-дифенил]карбонил)амино]бензоат. Раствор 3,13 г [4'-(трифторметил)[1,1'дифенил]-2-карбонилхлорида в 25 мл метиленхлорида добавляют по каплям к охлажденному льдом раствору 1,84 г метил 4-аминобензоата и 1,43 г N,N-диизопропилэтиламина в 50 мл метиленхлорида. Реакционную смесь перемешивают при комнатной температуре 18 ч и промывают водой, насыщенным водным NaHCO3 и органический слой сушат (Na2SO4). Органический слой пропускают через слой водного силиката магния и при кипении добавляют гексан,что дает 3,36 г заданного продукта в виде кристаллического твердого соединения, т.пл. 164165 С. M+=396. Стандартный пример 214. 3-Метокси-4[([4'-(трифторметил)[1,1'-дифенил]-2-карбонил)амино]бензоилхлорид. Смесь 2,0 г 3-метокси-4-[([4'-(трифторметил)[1,1'-дифенил]-2-карбонил)амино]бензойной кислоты в 20 мл тионилхлорида нагревают на паровой бане в атмосфере аргона 1 ч и добавляют гексан. Собирают образовавшийся твердый продукт и сушат, получая 1,92 г заданного продукта в виде кристаллического твердого соединения, т.пл. 136-138 С. Стандартный пример 215. 3-Метокси-4[([4'-трифторметил)[1,1'-дифенил]-2-карбонил)амино]бензойная кислота. Смесь 3,78 г метил 3-метокси-4-[([4'трифторметил)[1,1'-дифенил]-2-карбонил)амино]бензоата в 75 мл абсолютного этанола и 2,20 мл 10 н гидроокиси натрия нагревают на паровой бане 3 ч. Добавляют воду до получения раствора, который экстрагируют метиленхлоридом. Водную фазу подкисляют уксусной кислотой и образовавшийся твердый продукт собирают и сушат в вакууме при 80 С, получая 3,49 г заданного продукта в виде кристаллического твердого вещества, т.пл. 213-215 С. Стандартный пример 216. Метил 3 метокси-4-[([4'-трифторметил)[1,1'-дифенил]-2 карбонил)амино]бензоат. Раствор 3,56 г [4'-(трифторметил)[1,1'дифенил]-2-карбонилхлорида в 25 мл метиленхлорида добавляют по каплям к охлаждаемому льдом раствору 1,81 г метил 4-амино-3 метоксибензоата и 1,62 г N,N-диизопропил 53 этиламина в 50 мл метиленхлорида. Реакционную смесь перемешивают при комнатной температуре 18 ч и промывают водой, насыщенным водным NaHCO3 и сушат органический слой(Na2SO4). Органический слой пропускают через слой водного силиката магния и добавляют гексан при кипении, получая 3,9 г заданного продукта в виде кристаллического твердого вещества, т.пл. 112-113 С. Стандартный пример 217. 2-Хлор-4-[([4'(трифторметил)[1,1'-дифенил]-2-карбонил)амино] бензоилхлорид. Смесь 1,39 г 2-хлор-4-[([4'-(трифторметил)[1,1'-дифенил]-2-карбонил)амино]бензойной кислоты в 2,0 мл тионилхлорида нагревают на паровой бане 1 ч. Реакционную смесь концентрируют до остатка в вакууме. К остатку добавляют охлажденный гексан и собирают твердый продукт и сушат, получая 1,39 г заданного продукта. Стандартный пример 218. 2-Хлор-4-[([4'(трифторметил)[1,1'-дифенил]-2-карбонил)амино]бензойная кислота. Смесь 3,83 г метил 2-хлор-4-[([4'(трифторметил) [1,1'-дифенил]-2-карбонил)амино]бензоата в 75 мл абсолютного этанола и 2,20 мл 10 н гидроокиси натрия нагревают на паровой бане 3 ч. Добавляют воду до получения раствора, который экстрагируют метиленхлоридом. Водную фазу подкисляют уксусной кислотой и полученный твердый продукт собирают и сушат в вакууме при 80 С, получая 3,42 г заданного продукта в виде кристаллического твердого продукта, т.пл. 187-189 С. Стандартный пример 219. Метил 2-хлор-4[([4'-(трифторметил)[1,1'-дифенил]-2-карбонил)амино]бензоат. Раствор 3,56 г [4'-(трифторметил)[1,1'дифенил]-2-карбонил]хлорида в 10 мл метиленхлорида добавляют по каплям к охлажденному льдом раствору 1,86 г метил 2-хлор-4-аминобензоата и 1,6 г N,N-диизопропилэтиламина в 50 мл метиленхлорида. Реакционную смесь перемешивают при комнатной температуре 18 ч и промывают водой, насыщенным водным NaHCO3 и органический слой сушат (Na2SO4). Органический слой пропускают через слой водного силиката магния (3 Х) и к фильтрату при кипении добавляют гексан, получая 4,0 г заданного продукта в виде кристаллического твердого вещества, т.пл. 130-132 С. Стандартный пример 220. 4-[([4'(Трифторметил)[1,1'-дифенил]карбонил)амино]бензойная кислота. Смесь 3,0 г метил 4-[([4'-(трифторметил)[1,1'-дифенил]-2-карбонил)амино]бензоата в 75 мл абсолютного этанола и 2,0 мл 10 н гидроокиси натрия нагревают на паровой бане 3 ч. Добавляют воду до получения раствора, который экстрагируют метиленхлоридом. Водную фазу подкисляют уксусной кислотой и полученный твердый продукт собирают и сушат в ва 000752 54 кууме при 80 С, получая 2,93 г заданного продукта в виде кристаллического твердого вещества, т.пл. 243-245 С. M+=385. Стандартный пример 221. Метил 6-3-(2 Метилпиридинил)карбонил]амино]пиридин-3 карбоксилат. К перемешиваемой суспензии 3 г метил 6 аминопиридин-3-карбоксилата и 4 мл N,Nдиизопропилэтиламина в 100 мл метиленхлорида добавляют по каплям раствор 6,4 г 2-метилпиридин-3-карбонилхлорида в 25 мл метиленхлорида. Реакционную смесь перемешивают при комнатной температуре 2 ч и реакцию гасят водой. Органический слой промывают водой, сушат (MgSO4), фильтруют и упаривают в вакууме до остатка, который перемешивают с диэтиловым эфиром, и образовавшийся твердый продукт собирают и сушат на воздухе,получая 6,8 г заданного продукта, М+=390. Стандартный пример 222. 6-3-(2 метилпиридинил)карбонил]амино]пиридин-3 карбоновая кислота. К раствору 6,5 г метил 6-3-(2 метилпиридинил)карбонил]амино]пиридин-3 карбоксилата в 100 мл 1:1 тетрагидрофуран:метилового спирта добавляют 20 мл 5 нNaOH. Реакционную смесь перемешивают в течение ночи и упаривают в вакууме до остатка. Остаток растворяют в воде и нейтрализуют уксусной кислотой. Выделившийся твердый продукт фильтруют и сушат на воздухе, получая 3,0 г заданного продукта. M+=257. Стандартный пример 223. Метил 6-[([1,1'дифенил]-2-карбонил)амино]-пиридин-3 карбоксилат. К раствору 1,5 г метил 6-аминопиридин-3 карбоксилата в 100 мл метиленхлорида добавляют 3 мл N,N-диизопропилэтиламина при комнатной температуре. К перемешиваемой реакционной смеси медленно добавляют раствор 2,5 г [1,1'-дифенил]-2-карбонилхлорида. Реакционную смесь перемешивают при комнатной температуре 4 ч и затем реакцию гасят водой. Органический слой хорошо промывают водой и сушат над безводным MgSO4, фильтруют и упаривают в вакууме до твердого остатка. Остаток перемешивают с диэтиловым эфиром, фильтруют и сушат, получая 3,0 г заданного продукта.M+=332. Стандартный пример 224. 6-[([1,1'дифенил]-2-карбонил)амино]пиридин-3-карбоновая кислота. К перемешиваемому раствору 2,5 г метил 6-[([1,1'-дифенил]-2-карбонил)амино]-пиридин 3-карбоксилата в 50 мл 1:1 тетрагидрофуран:метанола добавляют 10 мл 5 н гидроокиси натрия и смесь перемешивают при комнатной температуре 16 ч. Реакционную смесь концентрируют в вакууме до остатка, который растворяют в воде и нейтрализуют уксусной кислотой. Выделившийся бесцветный твердый продукт 55 фильтруют и сушат на воздухе, получая 2,0 г заданного продукта: M+=318. Стандартный пример 225. Метил 2-(2 пиридинил)бензоат. Смесь 12 г метил 2-(йодметил)бензоата, 20 г н-бутилстаннана и 2 г тетракис(трифенилфосфин)палладия (0) нагревают до температуры кипения с обратным холодильником в дегазированом толуоле 48 ч. Реакционную смесь концентрируют в вакууме до остатка, который чистят колоночной хроматографией на силикагеле, элюируя 1:1 этилацетат:гексаном,что дает 5,5 г заданного продукта в виде масла М+=213. Стандартный пример 226. 2-(2 Пиридинил)бензойная кислота. Смесь 3,0 г метил 2-(2-пиридинил)бензоата и 600 мг гидроокиси натрия в 50 мл 9:1 метанол:воды нагревают до температуры кипения с обратным холодильником 4 ч. Реакционную смесь концентрируют в вакууме и остаток растворяют в 50 мл охлажденной воды. Раствор нейтрализуют ледяной уксусной кислотой и образовавшийся продукт фильтруют, промывают водой и сушат, получая 2,5 г заданного продукта: М+1=200. Пример 1. N-[5-(дибенз[b,f][1,4]оксазепин 10(11 Н)-илкарбонил)-2-пиридинил]-5-фтор-2 метилбензамид. К перемешиваемому раствору 0,39 г 10,11 дигидродибенз[b,f][1,4]-оксазепина, 1,1 мл триэтиламина в 5 мл дихлорметана добавляют 1,17 г 6-[(5-фтор-2-метилбензоил)амино]-пиридин-3 карбонилхлорида. Смесь перемешивают в атмосфере аргона при комнатной температуре 16 ч и разбавляют 50 мл дихлорметана и 20 мл воды. Органический слой отделяют, промывают 20 мл каждого из: 1 М NаНСО 3, раствором соли, и сушат (Na2SO4). Раствор фильтруют через тонкий слой водного силиката магния и фильтрат концентрируют досуха в вакууме. Остаток хроматографируют на силикагеле с этилацетатом гексаном (1:1) в качестве растворителя, получая твердое вещество. Кристаллизация из этилацетата дает 0,335 г не совсем белых кристаллов,т.пл. 180-186 С. Пример 2.N-[5-[(9,10-дигидро-4 Нтиено[2,3-с][1]бензазепин-9-ил)карбонил]-2 пиридинил]-5-фтор-2-метилбензамид. Как описано в примере 1, 9,10-дигидро-4 Н-тиено[2,3-с][1]бензазепин в дихлорметане в присутствии триэтиламина подвергают взаимодействию с 6-[(5-фтор-2-метилбензоил)амина]пиридин-3-карбонилхлоридом, получая продукт в виде некристаллического желтого твердого вещества. Пример 3. 56 фтор-2-метилбензоил)амино]пиридин-3-карбонилхлоридом, давая продукт в виде твердого вещества. Пример 4. N-[5-(пиридо[2,3-b][1,4]бензоксазепин-5(6 Н)-илкарбонил)-2-пиридинил]-5 фтор-2-метилбензамид. Как описано в примере 1, 5,6-дигидропиридо[2,3-b][1,4]-бензоксазепин реагирует в дихлорметане в присутствии триэтиламина с 6[(5-фтор-2-метилбензоил)амино]пиридин-3 карбонилхлоридом, давая продукт в виде белых кристаллов, т.пл. 187-189 С. Пример 5. N-[5-(пиридо[2,3-b][1,5]бензоксазепин-6(5 Н)-илкарбонил)-2-пиридинил]-5 фтор-2-метилбензамид. Как описано в примере 1, 5,6-дигидро[2,3b][1,5]бензоксазепин реагирует с 6-[(5-фтор-2 метилбензоил)амино]дихлорметаном в присутствии триэтиламина, давая продукт в виде некристаллического твердого вещества. Пример 6.N-[5-[(5,10-Дигидро-4 Нтиено[3,2-с][2]бензазепин-4-ил)карбонил]-2 пиридинил]-5-фтор-2-метилбензамид. Как описано в примере 1, 5,10-дигидро-4 Нтиено[3,2-c]-[2]бензазепин в дихлорметане в присутствии триэтиламина реагирует с 6-[(5 фтор-2-метилбензоил)амино]пиридин-3 57 карбонилхлоридом, давая продукт в виде твердого соединения. Пример 11. N-[5-[(4,5-дигидропиразоло[4,3-d][1]бензазепин-6(1 Н)-ил)-карбонил]-2 пиридинил]-5-фтор-2-метилбензамид. К раствору 0,20 моль 1,4,5,6 тетрагидропиразоло [4,3-d][1]-бензазепина, 0,80 моль триэтиламина добавляют 0,42 моль 6-[(5 фтор-2-метилбензоил)амино]пиридин-3-карбонилхлорида в 15 мл дихлорметана. Смесь перемешивают в аргоне 16 ч и разбавляют дихлорметаном (25 мл). Смесь промывают Н 2 О, 1 МNaOH 5 ч. Смесь нейтрализуют уксусной кислотой и растворитель удаляют. К остатку добавляют Н 2 О и смесь экстрагируют этилацетатом. Экстракт промывают водой, 1 н HCl, 1 МNаНСО 3 и сушат (Na2SO4). Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с этилацетат-гексаном в качестве растворителя, получая продукт в виде твердого соединения. Пример 12.N-[5-[(6,11-дигидро-5 Ндибенз[b,e]азепин-5-ил)карбонил]-2-пиридинил][1,1'-дифенил]-2-карбоксамид. К охлажденному (0 С) раствору 0,293 г 6,11-дигидро-5 Н-дибенз[b,е]азепина и 625 мл триэтиламина в 3,5 мл дихлорметана добавляют раствор 0,657 г 6-[([1,1'-дифенил]-2-илкарбонил)-амино]-3-пиридинкарбонилхлорида в 1,5 мл дихлорметана. Смесь перемешивают в аргоне при комнатной температуре 16 ч и разбавляют 40 мл дихлорметана в 20 мл воды. Органический слой отделяют и промывают 20 мл каждого из: 1 М NаНСО 3, раствора соли, и сушат(Na2SO4). Раствор фильтруют через тонкий слой водного силиката магния и фильтрат концентрируют досуха в вакууме. Оставшийся твердый продукт хроматографируют на силикагеле с этилацетат-гексаном в качестве растворителя,получая продукт в виде стеклообразной массы. Кристаллизация из этилацетата дает 0,395 г белых кристаллов, т.пл. 134-142 С. Пример 13.[2,3-b][1,5]бензодиазепин-6-ил)карбонил]-2 пиридинил]-2-метилфуран-3-карбоксамид. К охлажденному (0 С) раствору 0,296 г 6,11-дигидро-5 Н-пиридо[2,3-b][1,5]бензодиазепина и 624 мл триэтиламина в 3 мл дихлорметана добавляют раствор 6-[(2-метил-3-фуранилкарбонил)амино]-3-пиридинкарбонилхлорида в 4 мл дихлорметана. Смесь перемешивают при комнатной температуре 16 ч и растворитель удаляют в вакууме. К остатку добавляют 1 МNaHCO3 и смесь экстрагируют этилацетатом. Экстракт промывают Н 2 О, 1 М NaHCO3, насыщенным раствором соли и сушат (Na2SO4). Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с этилацетатгексаном в качестве растворителя, что дает продукт в виде твердого вещества. Пример 21. N-[5-[5(6 Н)-фенантридинил) карбонил]-2-пиридинил]-2-метилфуран-3 карбоксамид.(0,15 г, 0,72 ммоль). Полученную смесь перемешивают 2 ч при комнатной температуре и затем обрабатывают 4 мл 1 н NaOH. Смесь экстрагируют этилацетатом (10 мл) и экстракт промывают 1 н гидроокисью натрия и раствором соли (5 мл), сушат над безводным сульфатом натрия и фильтруют через водный силикат магния. Фильтрат упаривают и сырой продукт растирают с изооктаном, получая 0,24 г белого твердого вещества; масс спектр (CI), 372 (МН+). Пример 25. 10-([1,1'-Дифенил]-4-илкарбонил)-5,11-дигидро-10 Н-дибензо[b,е][1,4]диазепин. К охлажденному (0 С) раствору 0,5 г 5,11 дигидро-10 Н-дибензо[b,е][1,4]диазепина в 50 млCH2Cl2 и 12 мл диизопропилэтиламина добавляют по каплям раствор 0,67 г [1,1'-дифенил]-4 карбонилхлорида в 50 мл CH2Cl2. Смесь перемешивают при комнатной температуре 16 ч. Добавляют дополнительно 0,3 г [1,1]-дифенил]4-карбонилхлорида в 30 мл СН 2 Сl2 и смесь перемешивают при комнатной температуре 16 ч. Летучие продукты отгоняют в вакууме и остаток растворяют в 150 мл СHCl3. Раствор промывают 50 мл Н 2 О, сушат (Na2SO4) и удаляют растворитель. Остаток хроматографируют на силикагеле с этилацетат-гексаном (1:5) и этилацетатгексаном (1:3) в качестве растворителя, получая 0,86 г твердого соединения, т.пл. 152-154 С; Масс спектр (CI), 377 (МН+). Пример 26. 10-([1,1'-Дифенил]-4 илкарбонил)-10,11-дигидробенз[b,f][1,4]оксазепин. К охлажденному (0 С) раствору 1,0 г 10,11-дигидробенз[b,f][1,4]оксазепина и 7 мл 60 триэтиламина в 30 мл CH2Cl2 в атмосфере аргона добавляют по каплям 2,0 г [1,1'-дифенил]-4 карбонилхлорида. Смесь перемешивают при комнатной температуре 16 ч и разбавляют 50 мл СHCl3. Смесь промывают 30 мл каждого из Н 2O,2 н HCl, H2O, насыщенным NaHCO3, Н 2 О, и сушат (Na2SO4). Растворитель удаляют в вакууме,получая 1,6 г желтого твердого вещества, т.пл. 93-95 С; масс спектр (CI), 378 (МН+). Пример 27. 9-([1,1'-Дифенил]-4 илкарбонил)-9,10-дигидро-4 Н-тиено[2,3 с][1]бензазепин. Как описано в примере 26, 9,10-дигидро 4 Н-тиено[2,3-с][1]бензазепин реагирует с [1,1'дифенил]-4-карбонилхлоридом, давая продукт в виде желтой твердой массы; масс спектр (CI) 381 (МТ). Пример 28. 5-([1,1'-Дифенил]-4-илкарбонил)-6,7-дигидро-5 Н-дибенз[b,d]-азепин. Как описано в примере 26, 6,7-дигидро-5 Ндибенз[b,d]-азепин реагирует с [1,1'-дифенил]-4 карбонилхлоридом, давая продукт в виде твердого вещества. Пример 29. 6-([1,1'-Дифенил[-4-илкарбонил)5,11-дигидро-6 Н-пиридо[2,3-е][1] бензазепин. Как описано в примере 26, 5,11-дигидро 6 Н-пиридо[2,3-е][1]бензазепин реагирует с [1,1'дифенил]-4-карбонилхлоридом, давая продукт в виде твердого соединения. Пример 30. 5-([1,1'-Дифенил]-4-илкарбонил)-5,6-дигидропиридо[2,3-b][1,4]-бензотиазепин. Как описано в примере 26, 5,6 дигидропиридо[2,3-b][1,4]-бензотиазепин реагирует с [1,1'-дифенил]-4-карбонилхлоридом,давая заданный продукт в виде твердого соединения. Пример 31. 10-([1,1'-дифенил]-4-илкарбонил)-10,11-дигидро[b,f][1,4]-тиазепин. Как описано в примере 26, 10,11-дигидро[b,f][1,4]-тиазепин реагирует с [1,1'-дифенил]-4 карбонилхлоридом, давая продукт в виде твердого вещества. Пример 32. 10-(4-Бензоилбензоил)-10,11 дигидродибенз[b,f][1,4]оксазепин. Как описано в примере 26, 10,11 дигидродибенз[b,f][1,4]оксазепин реагирует с 4(бензоил)бензоилхлоридом, давая продукт в виде не совсем белого вещества, т.пл. 103106 С; масс-спектр (CI), 406 (МН+). Пример 33. 5-(4-Бензоилбензоил) 5,6,11,12-тетрагидродибенз[b,f]азоцин. Как описано в примере 26, 5,6,11,12 тетрагидродибенз-[b,f]азоцин реагирует с 4(бензоил)бензоилхлоридом, давая продукт в виде твердого соединения, т.пл. 89-92 С. Массспектр (СI), 418 (МН+). Пример 34. 10-[4-(Бензоилбензоил)-10,11 дигидро[b,f][1,Н]тиазепин. Как описано в примере 26, 10,11 дигидро[b,f][1,4]тиазепин реагирует с 4
МПК / Метки
МПК: A61K 31/55, C07D 223/20
Метки: фармкомпозиция, основе, получения, способ, трициклические, вазопрессина, антагонисты, лечения, бензазепины
Код ссылки
<a href="https://eas.patents.su/30-752-triciklicheskie-benzazepiny-kak-antagonisty-vazopressina-sposob-ih-polucheniya-farmkompoziciya-na-ih-osnove-i-sposob-lecheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Трициклические бензазепины как антагонисты вазопрессина, способ их получения, фармкомпозиция на их основе и способ лечения.</a>
Предыдущий патент: Алюмотермическая смесь
Следующий патент: Производные пиразол-4-илбензоила и их применение в качестве гербицидов.
Случайный патент: Полимеры и способ для улучшения подвижности в почве слаборастворимых инсектицидов, способ борьбы с вредителями и инсектицидный состав












