Трициклические бензазепиновые антагонисты вазопрессина.
Номер патента: 607
Опубликовано: 29.12.1999
Авторы: Рейч Марвин Фред, Олбрайт Джей Дональд, Ду Ксумей, Делос Сантос Эфрен Гильермо, Венкатесан Аранапакан Мудумбай
Формула / Реферат
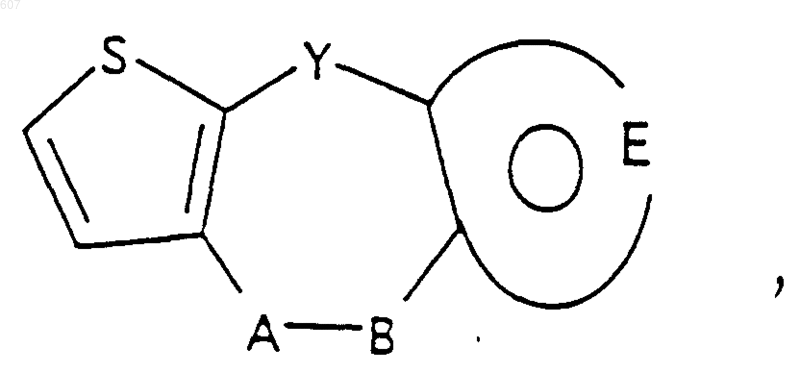
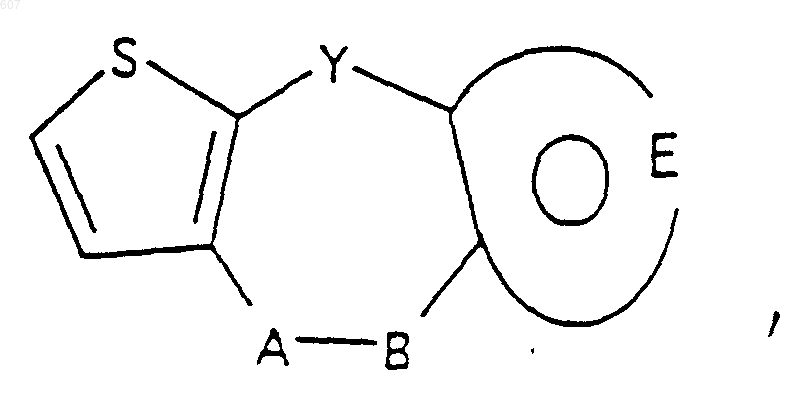
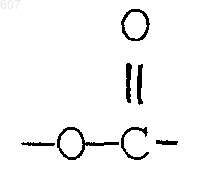
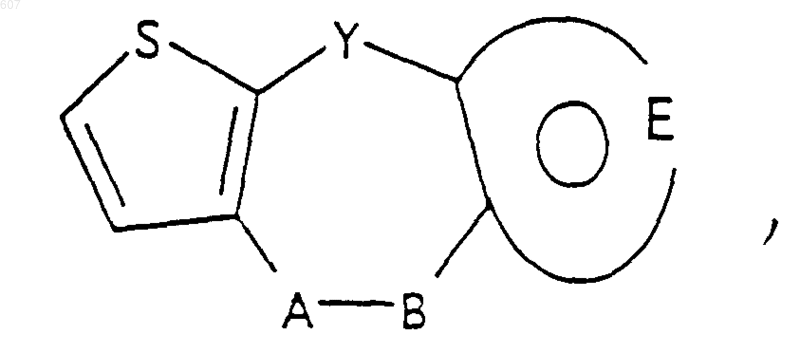
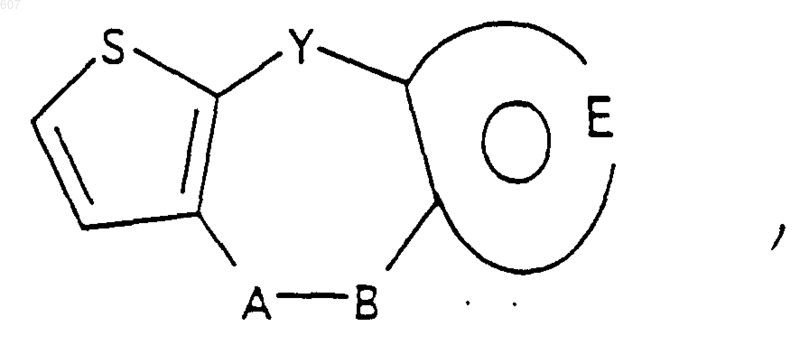
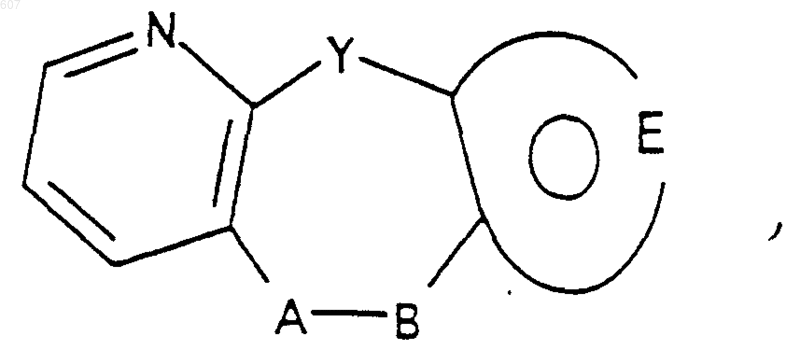
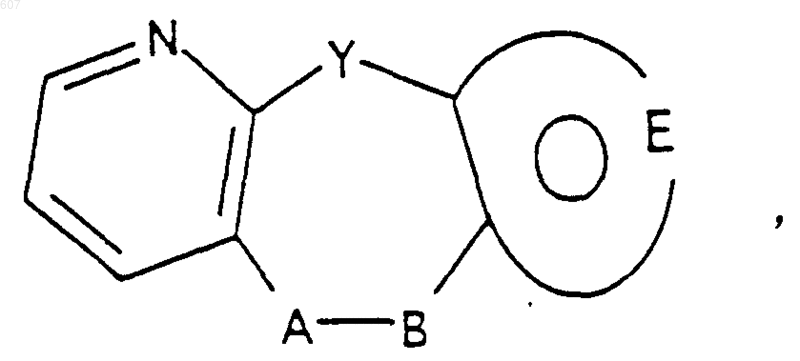
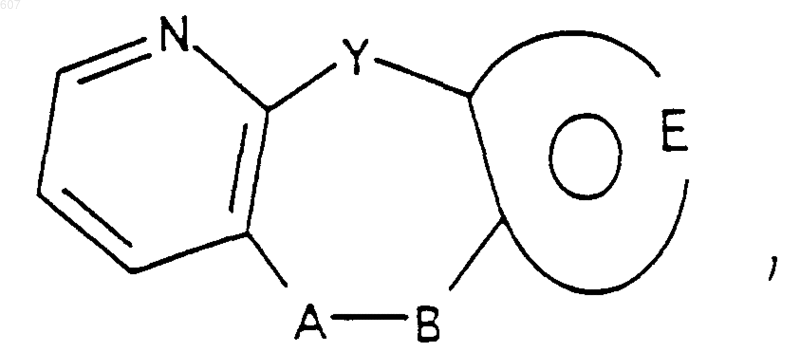
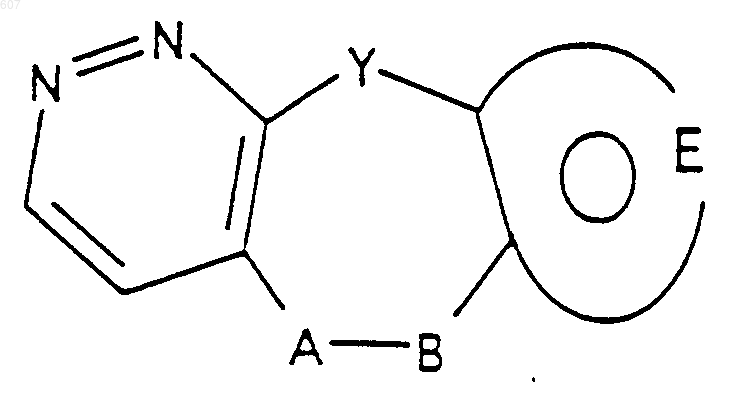
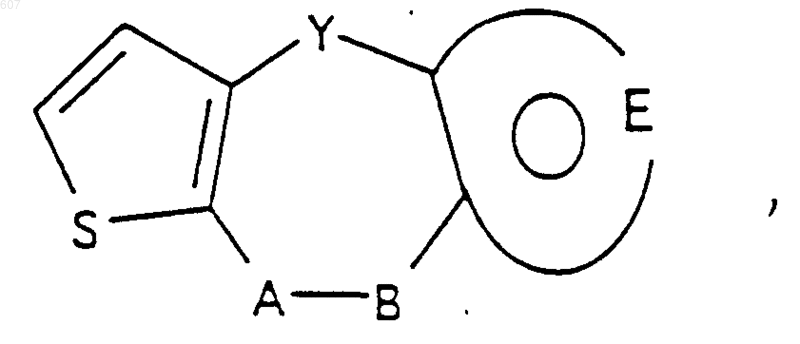
1. Трициклические бензазепины общей формулы I
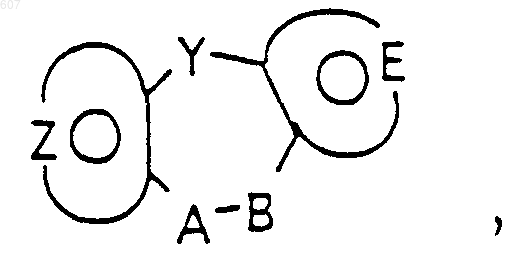
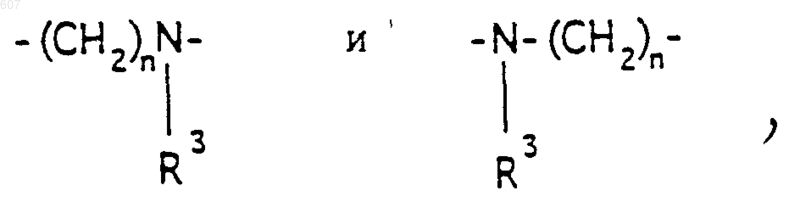
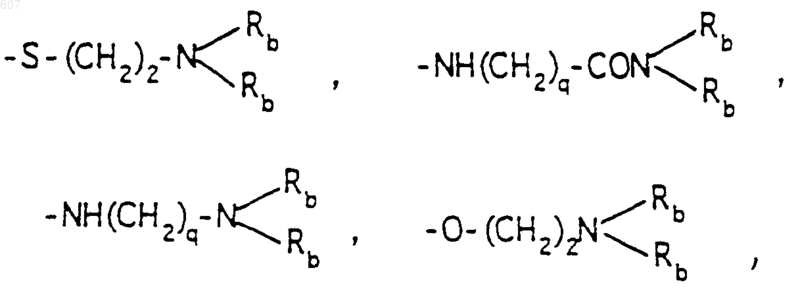
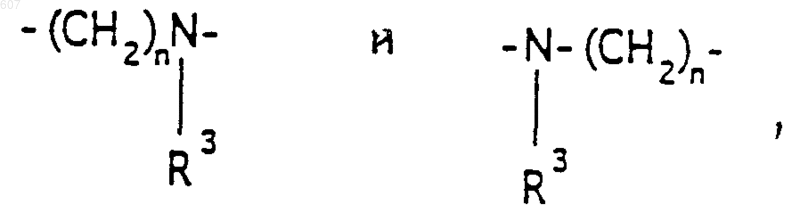
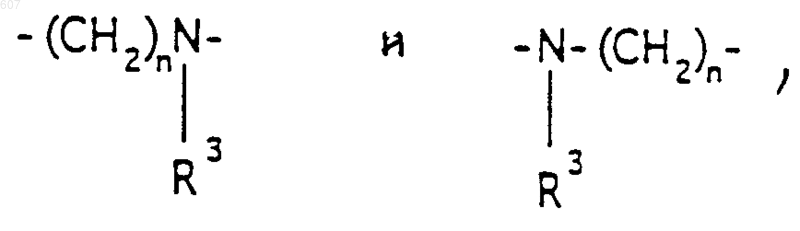
где Y представляет связь или фрагмент, выбранный из -СН2-, -СНОН, -СНО-алкил (C1-C6), -СН-S-алкил(С1-C6), -CHNH2, -CHN-алкил(C1-C6), -С[N-алкил(C1-C6)]2,
-СНОСО-алкил(С1-C6), -CHNH (CH2)mNH2, -CHNH(CH2)m-NH-алкил(C1-C6), -CHNH (CH2)m-N[алкил(C1-С6)]2; -СНNН(СН2)m-S-алкил(С1-C6), -CHNH(CH2)m-O-алкил(C1-C6),
S, О, -NH, -N-алкил (C1-C6), -NCO-алкил (C1-C6);
m представляет целое число от 2 до 6;
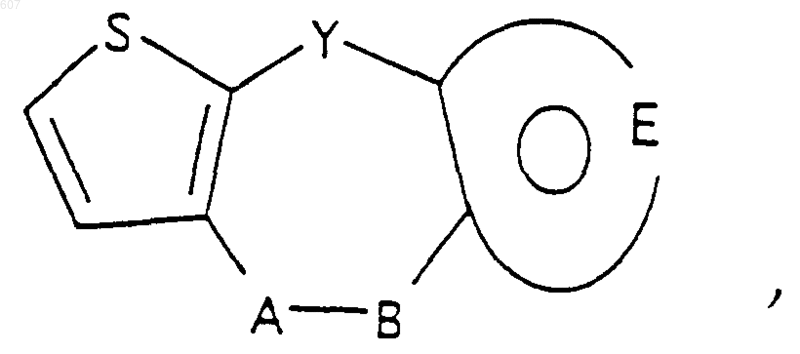
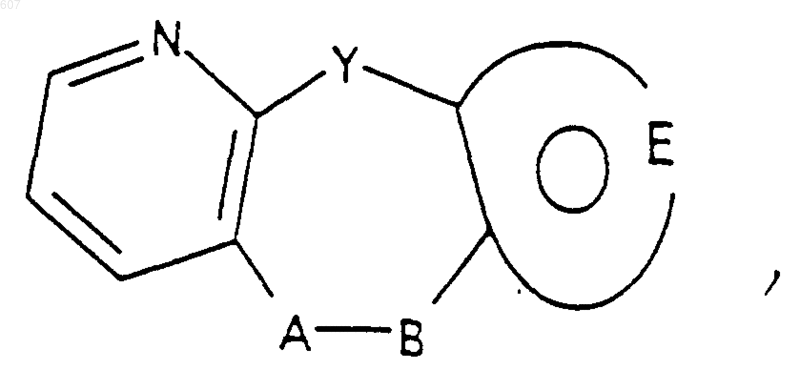
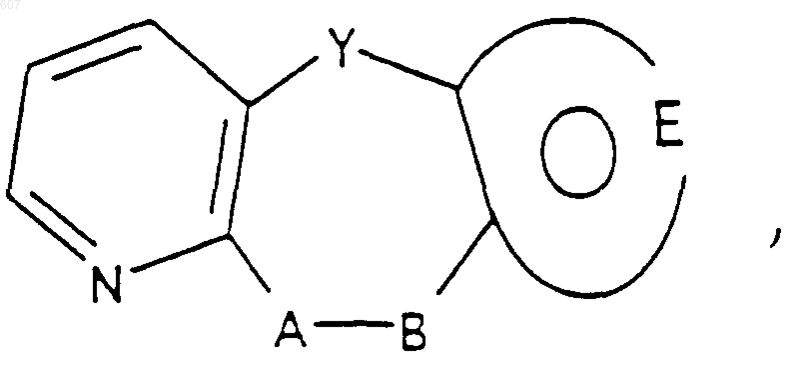
А-В представляет фрагмент, выбранный из

где n представляет целое число 1 или 2, при условии, что, если Y представляет связь, n=2;
и фрагмент
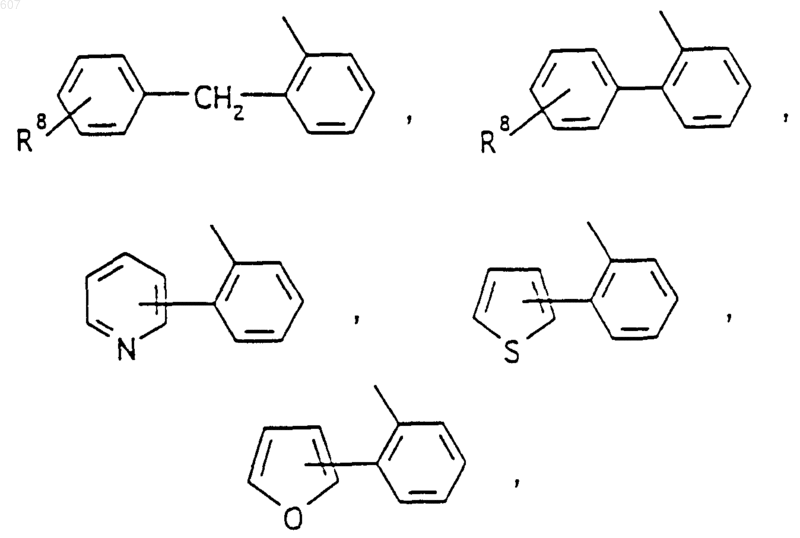
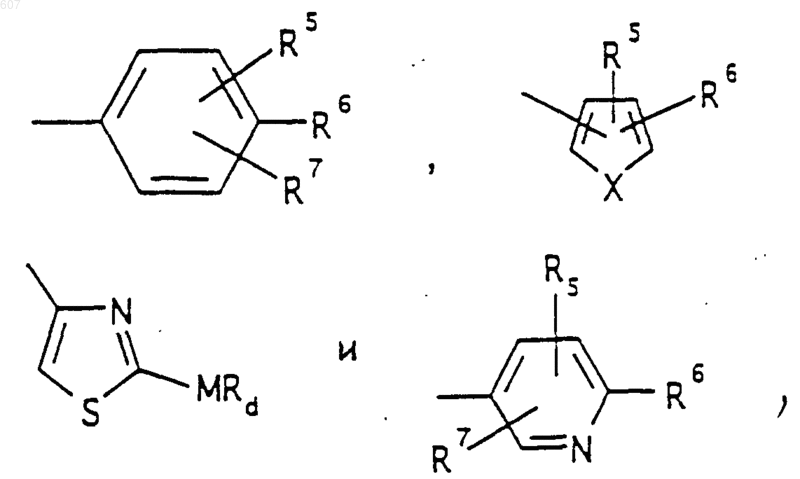
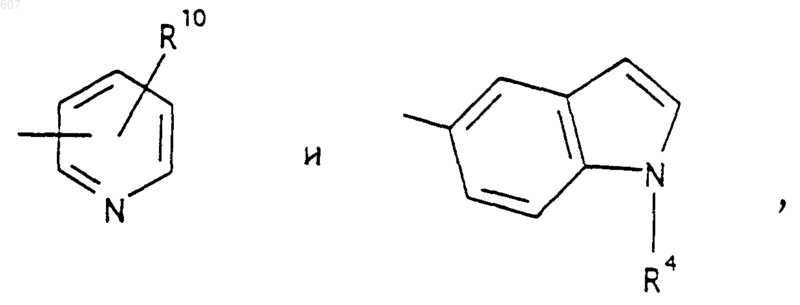
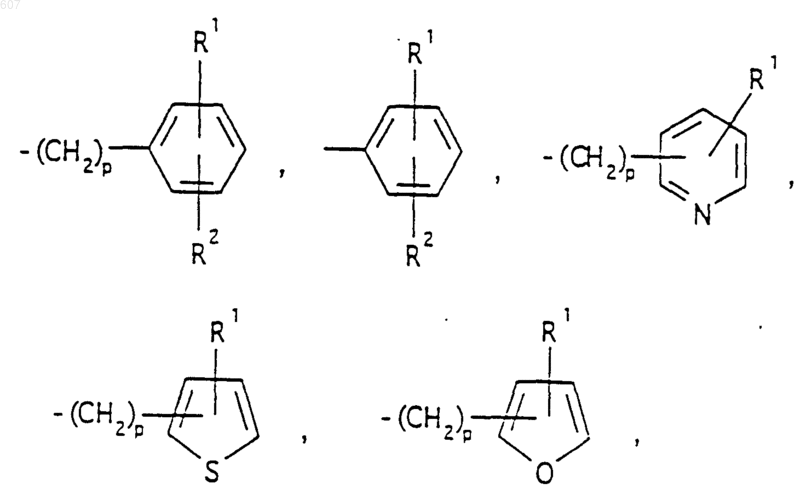
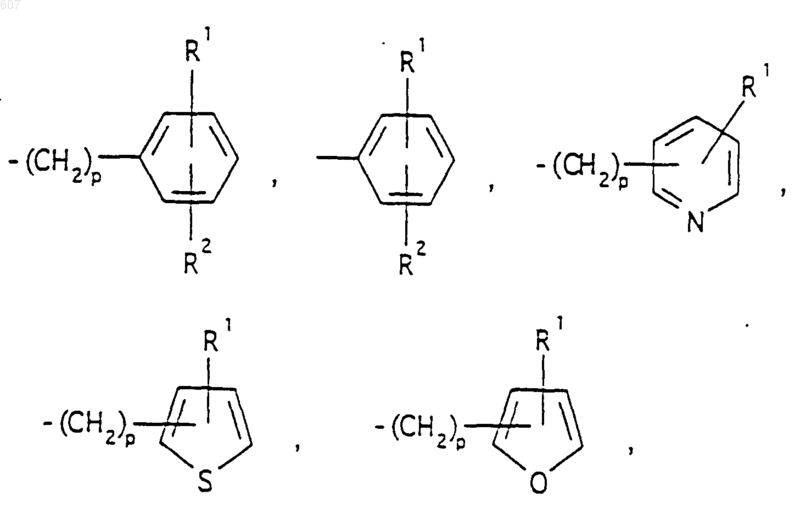
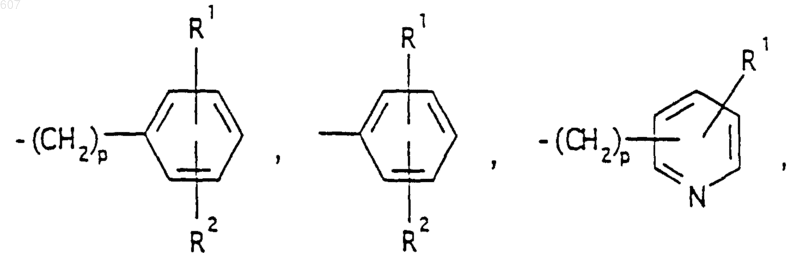
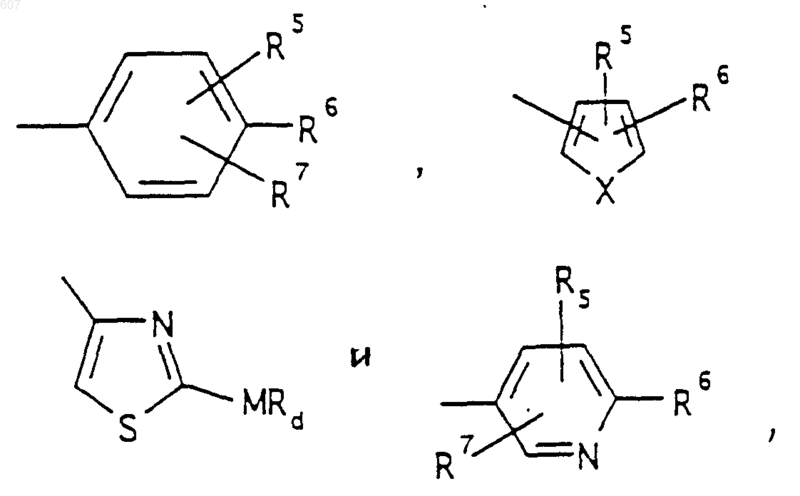
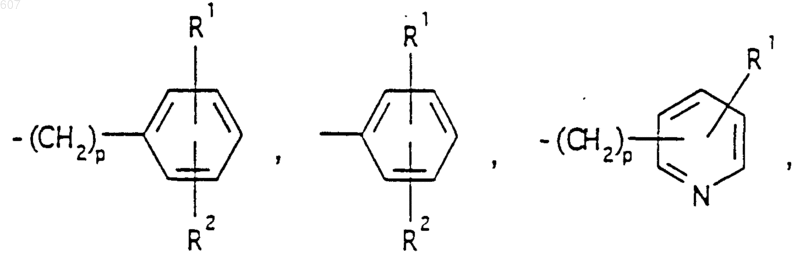
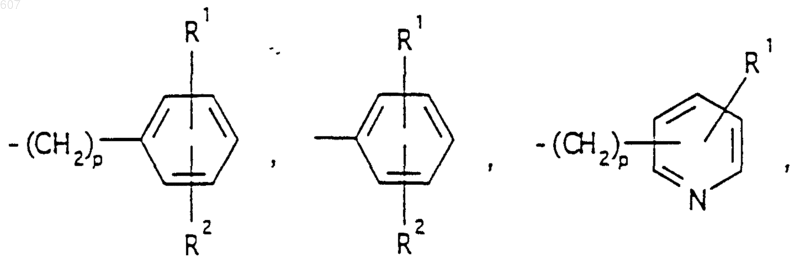
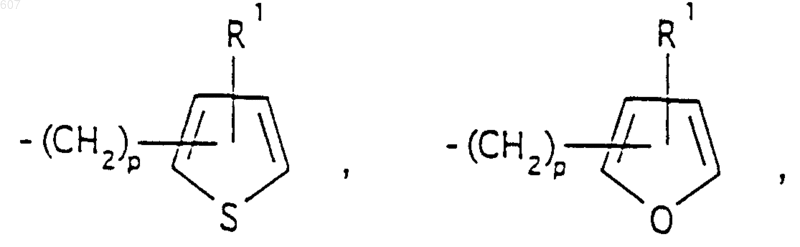
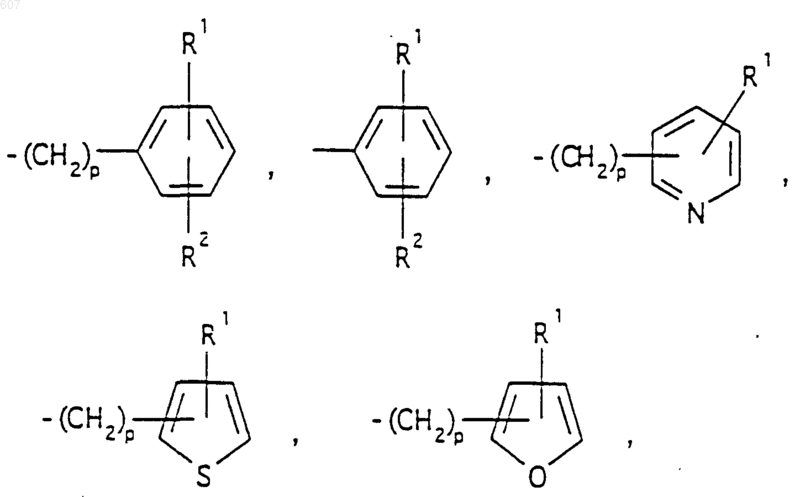
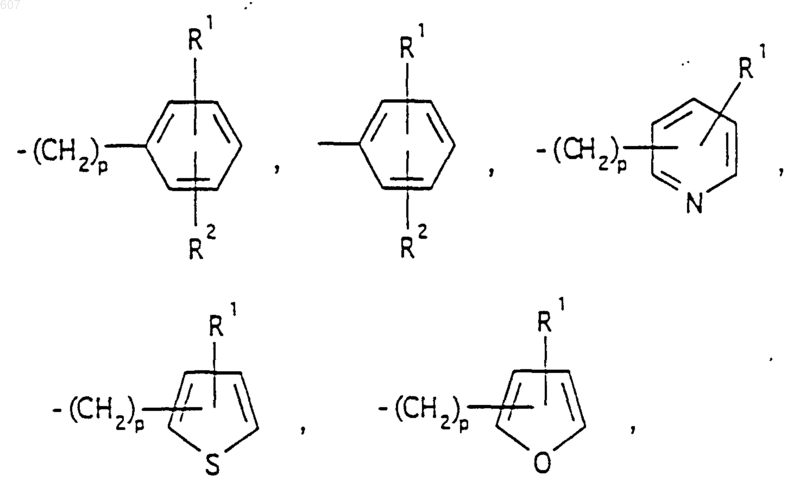
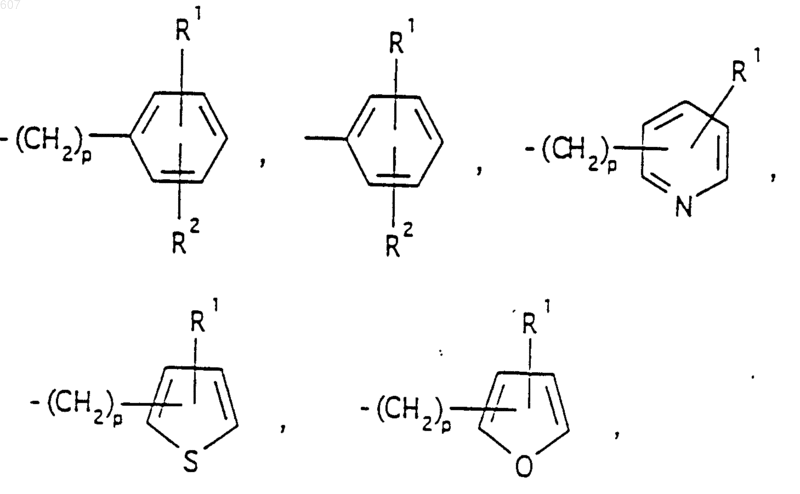
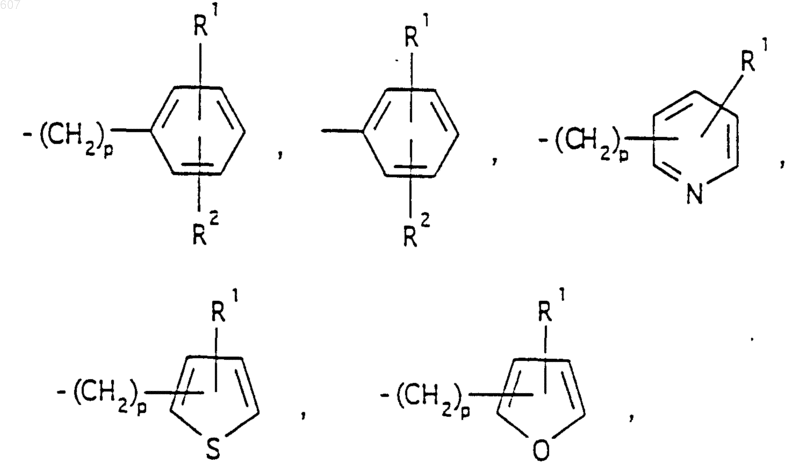
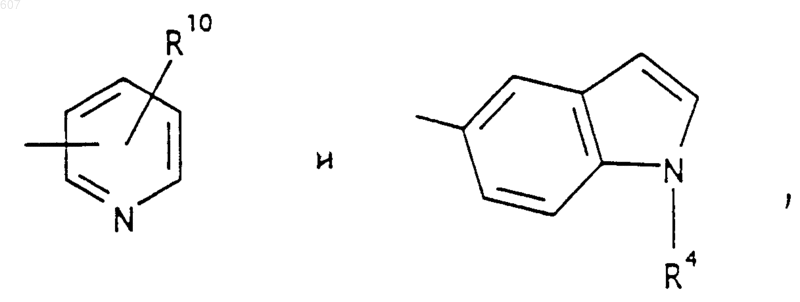
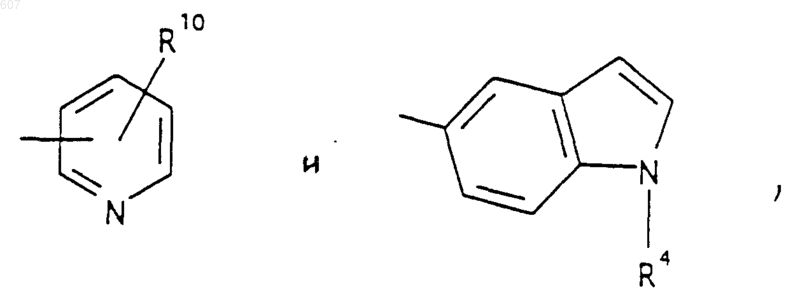
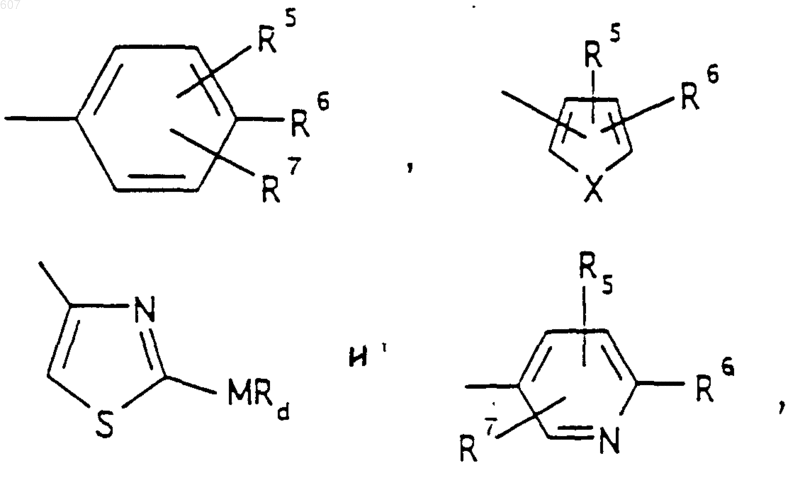
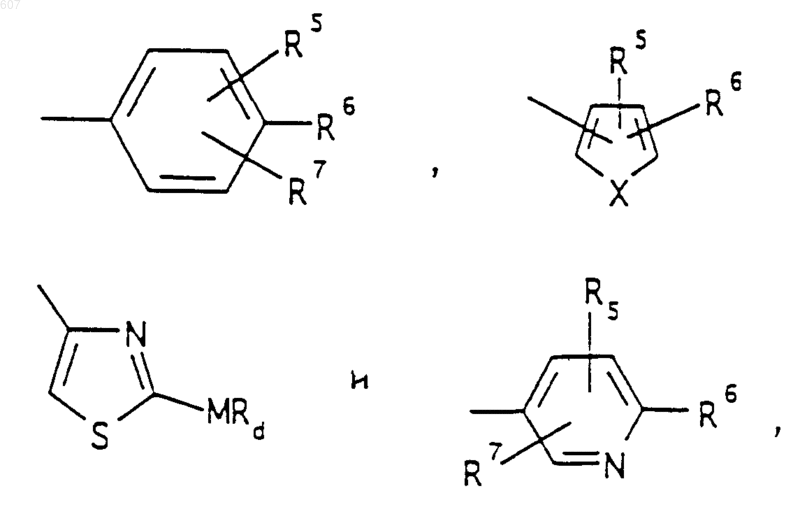
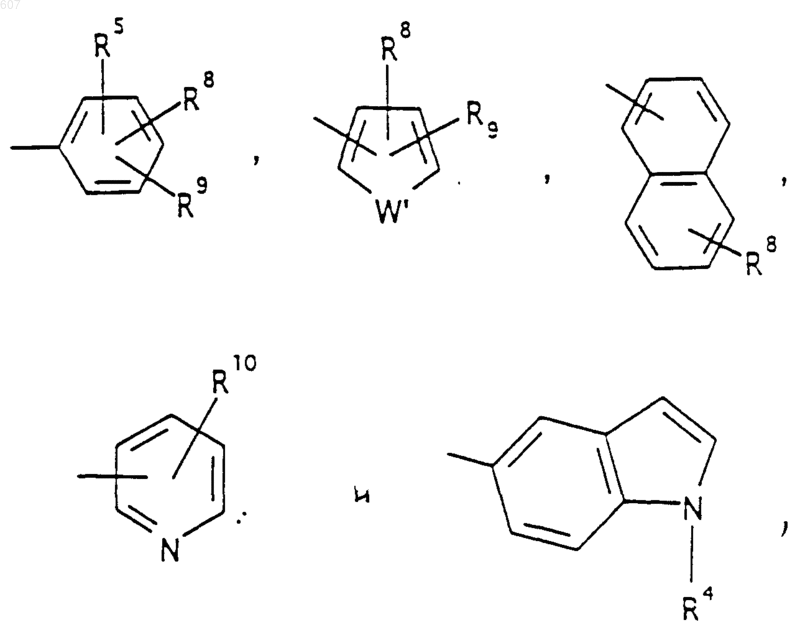
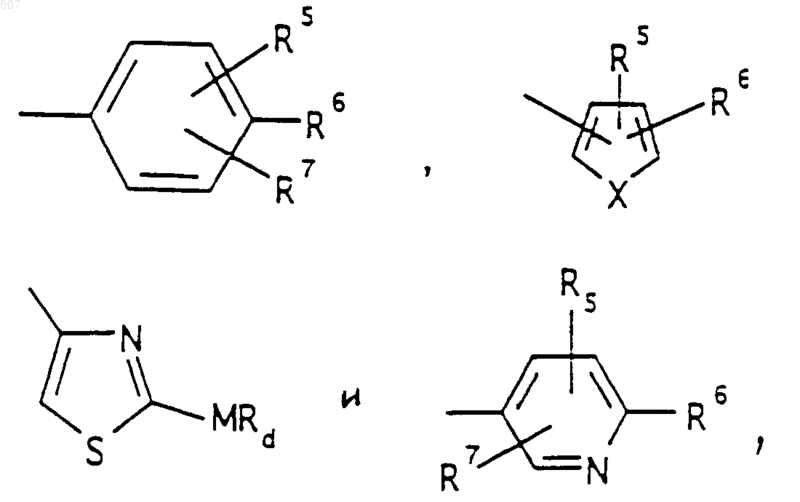
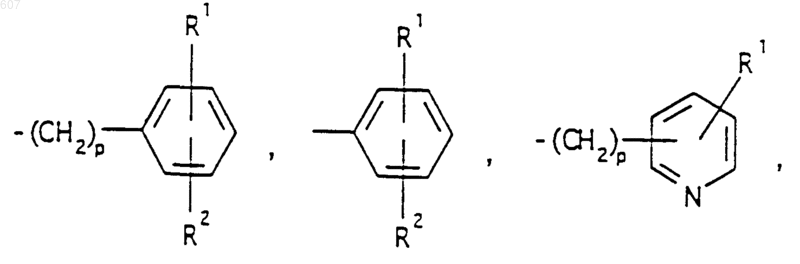
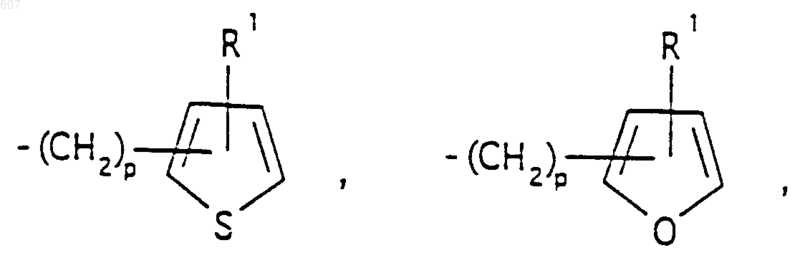
представляет: (1) ненасыщенное 6-членное ароматическое гетероциклическое кольцо, содержащее один атом азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3) алкила, галоида, амино-, (C1-C3) алкокси- или (C1-C3) алкиламиногруппы; (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О или S;
и фрагмент
представляет: (1) ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3) алкила, галоида, амино, (C1-C3) алкокси- или (C1-C3)алкиламиногруппы (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О, N или S; (3) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота; (4) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один атом азота вместе с либо одним атомом кислорода, либо с одним атомом серы; где 5- или 6-членные гетероциклические кольца необязательно замещены (C1-C3) алкилом, галоидом или (C1-C3) алкоксигруппой,
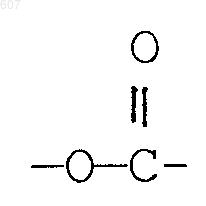
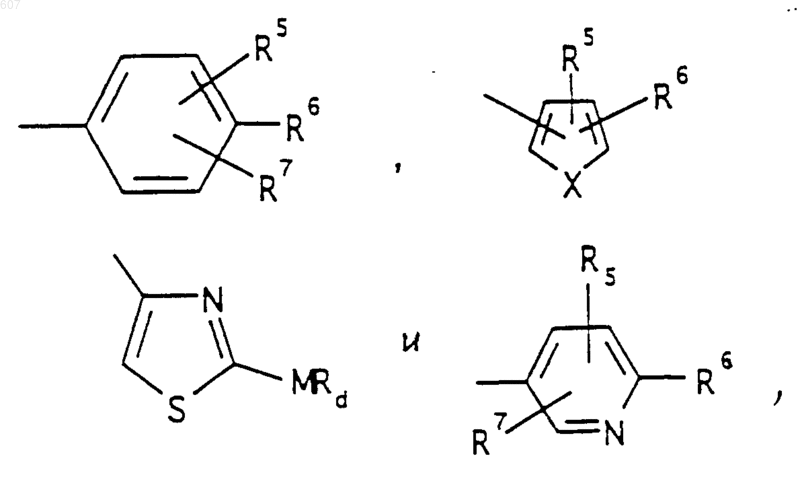
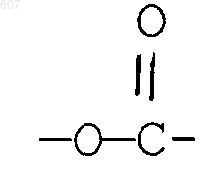
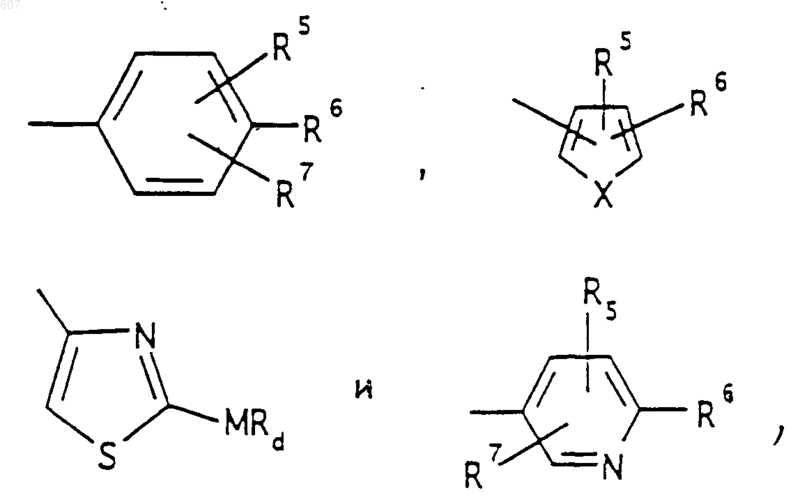
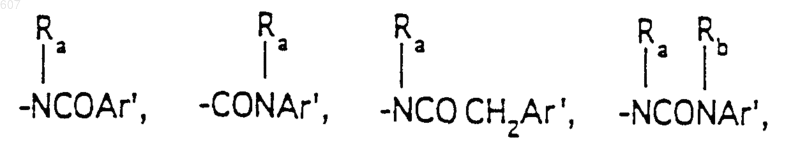
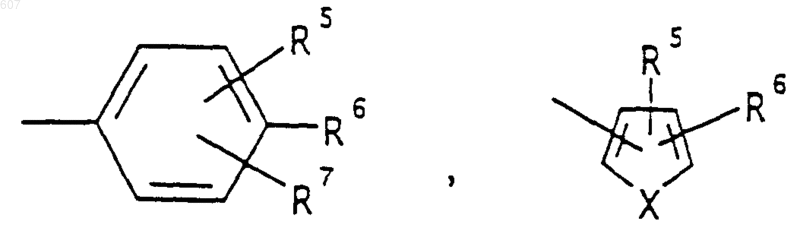
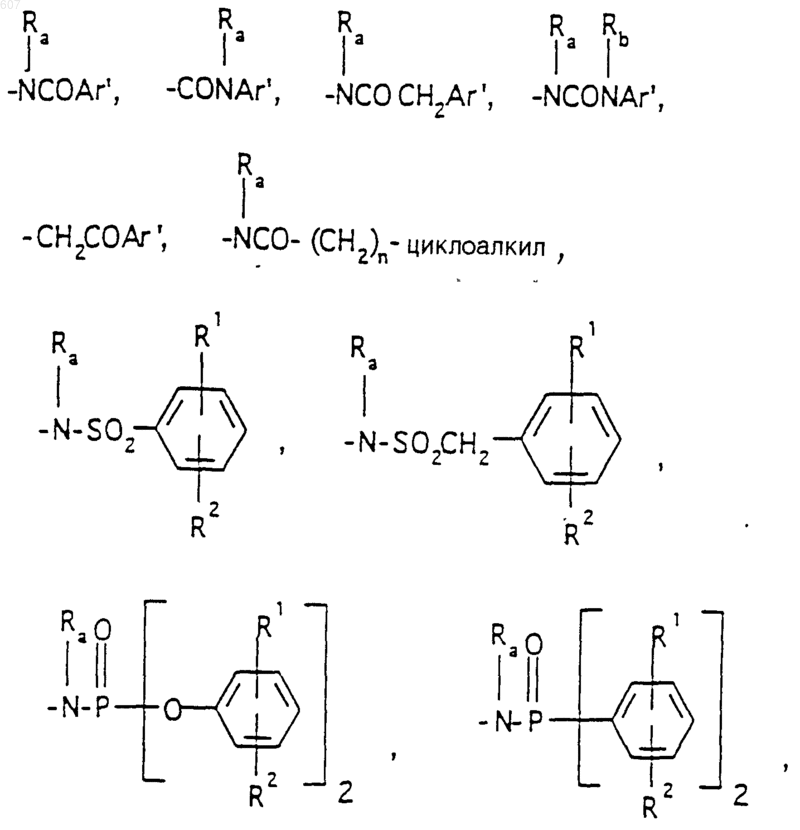
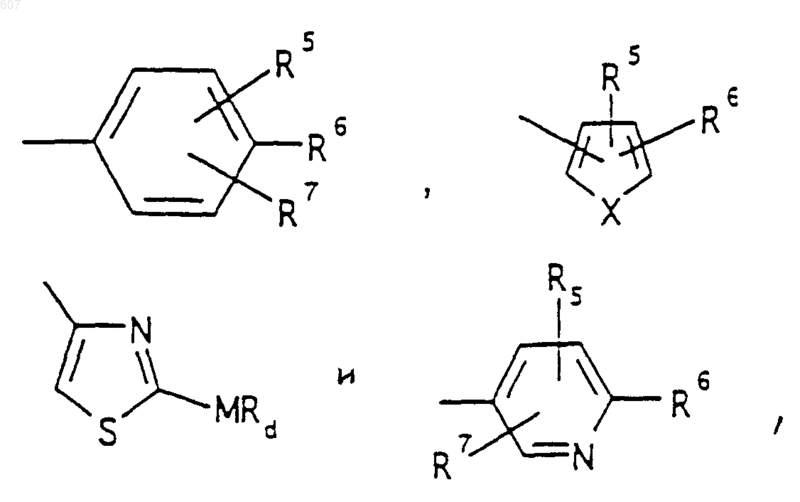
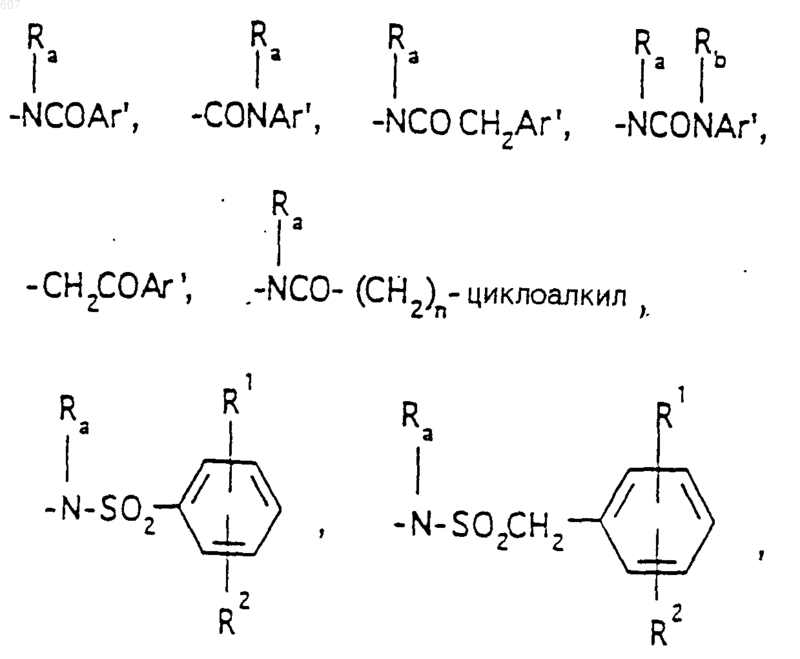
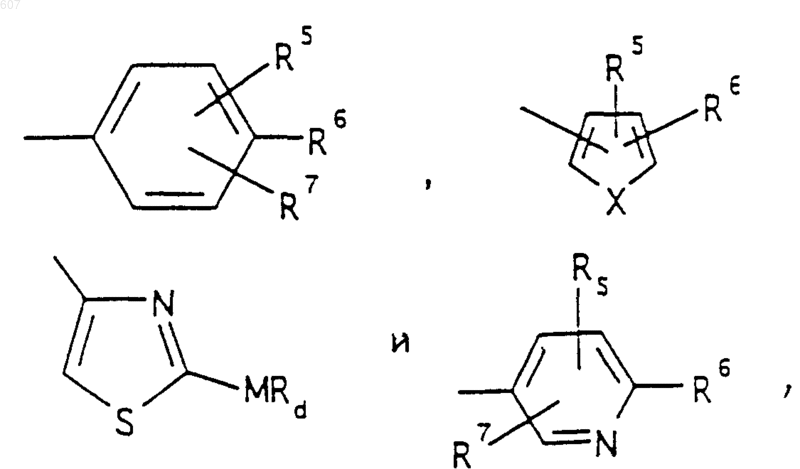
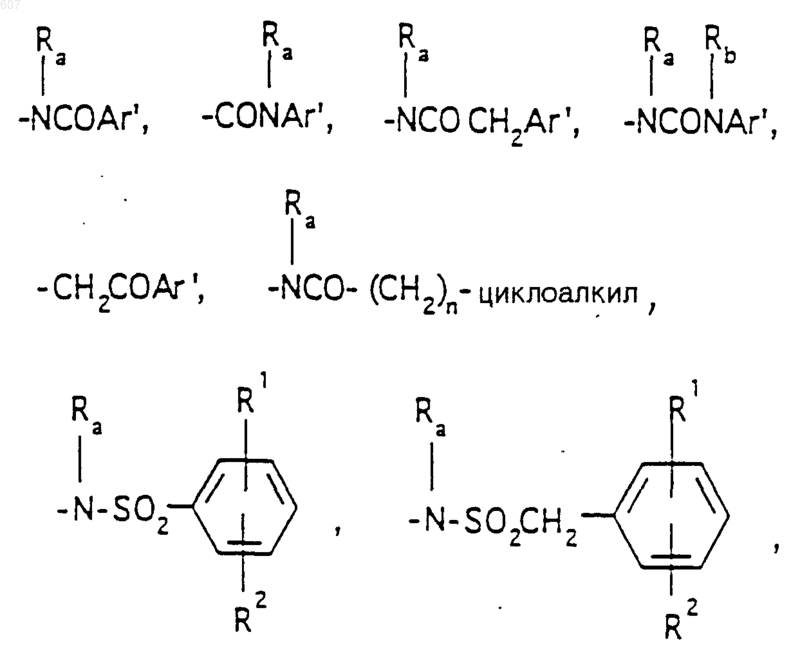
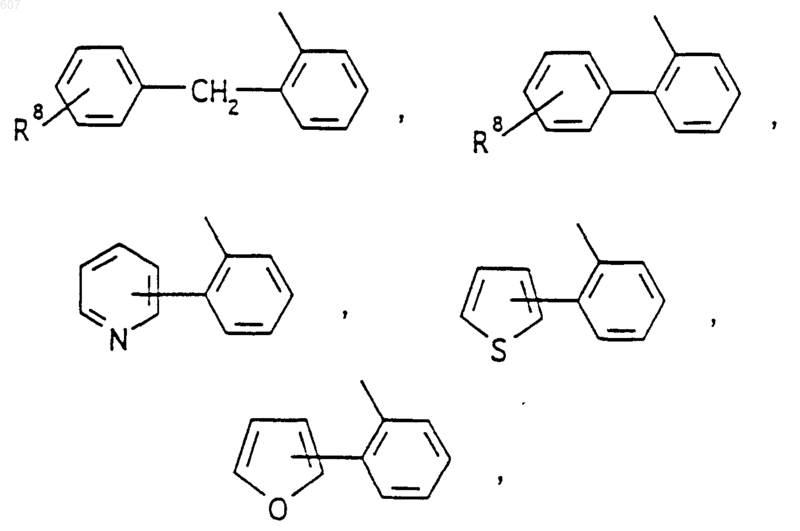
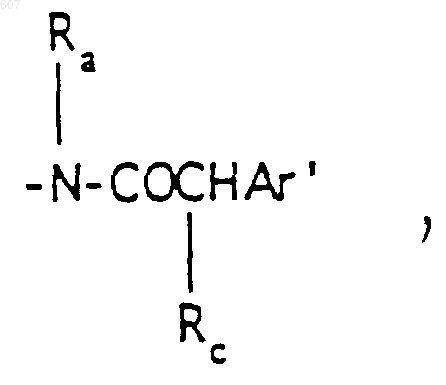
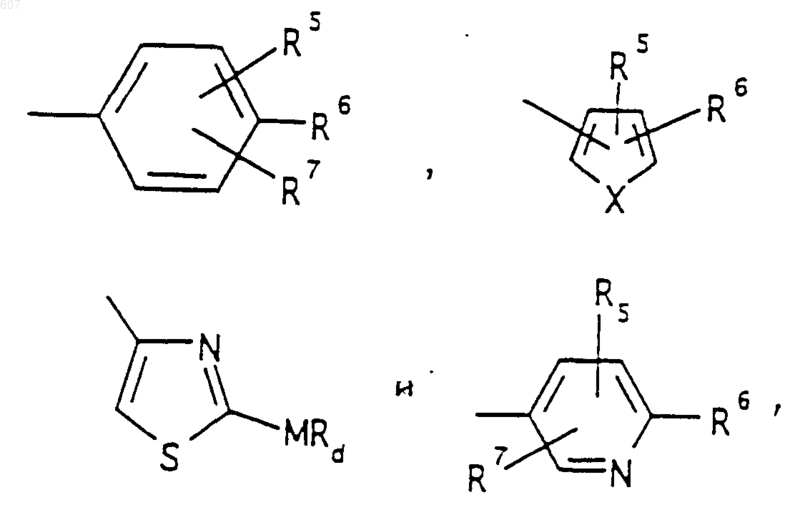
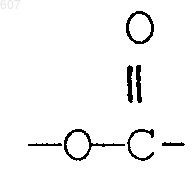
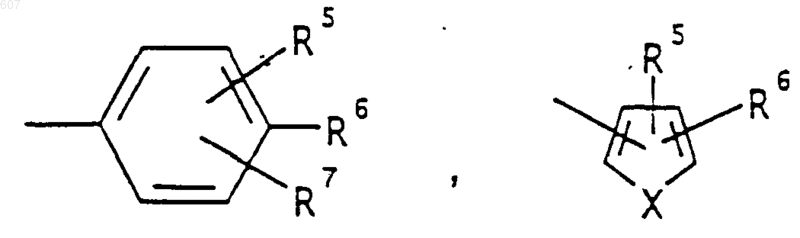
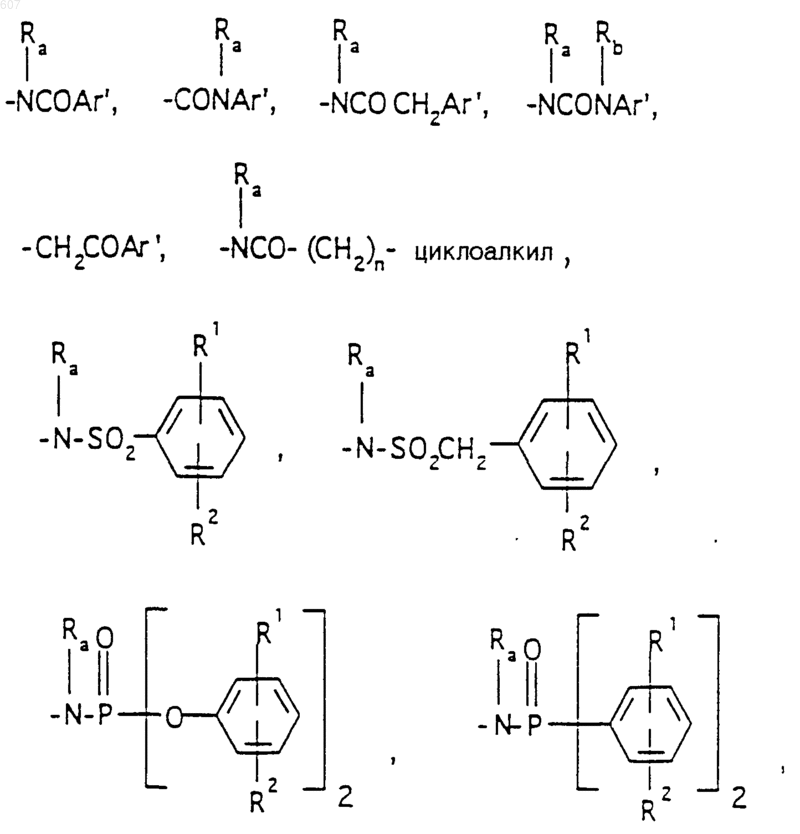
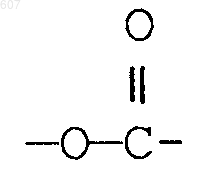
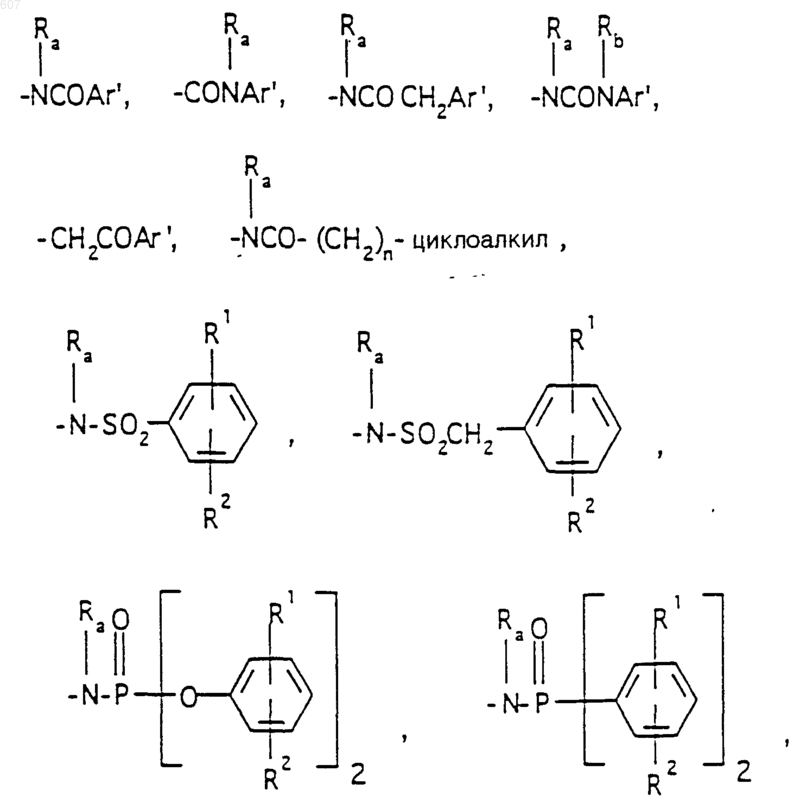
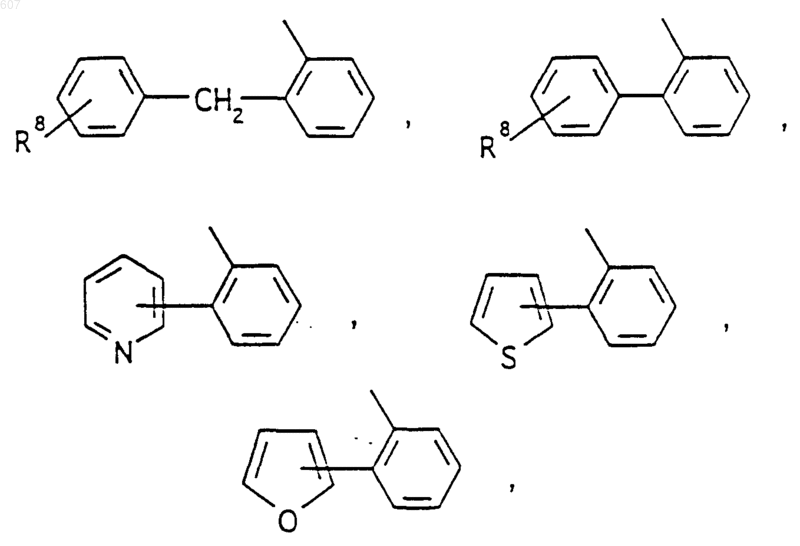
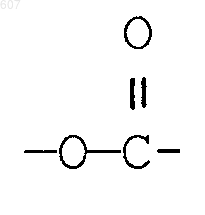
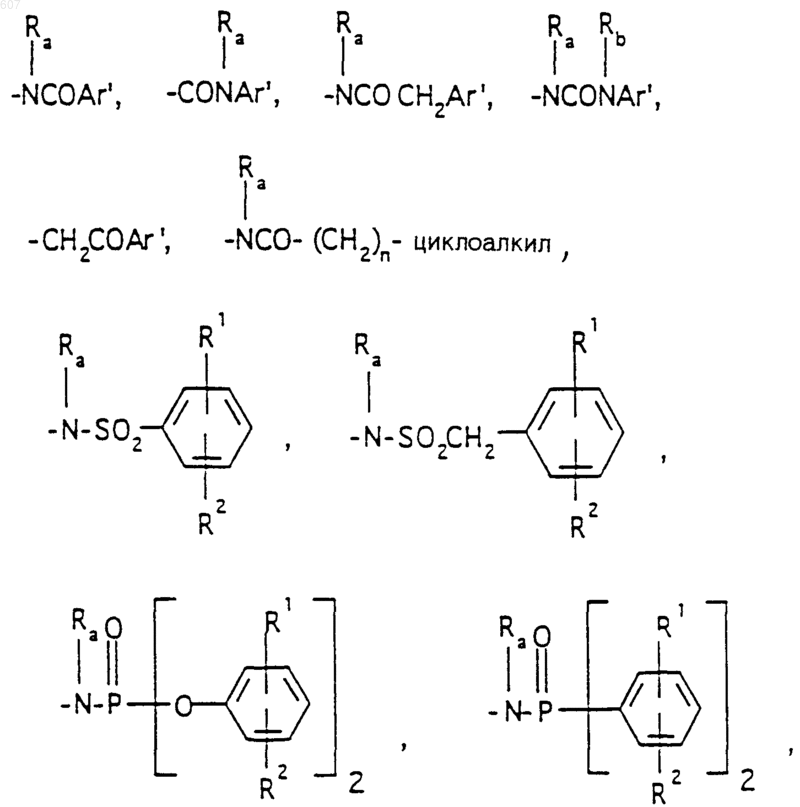
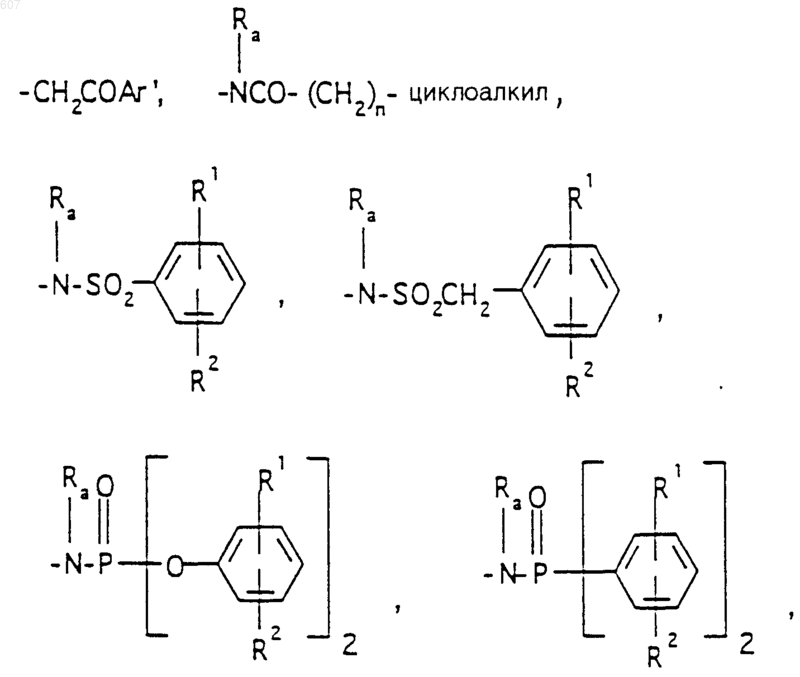
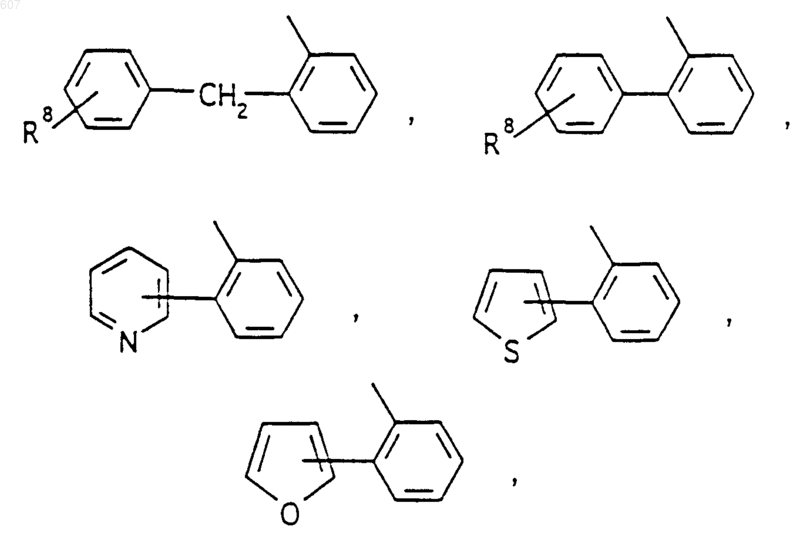
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из

где X выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила(C1-C3);
R1 и R2 выбирают из водорода, (C1-C3) алкила, (C1-C3)алкоксигруппы и галоида;
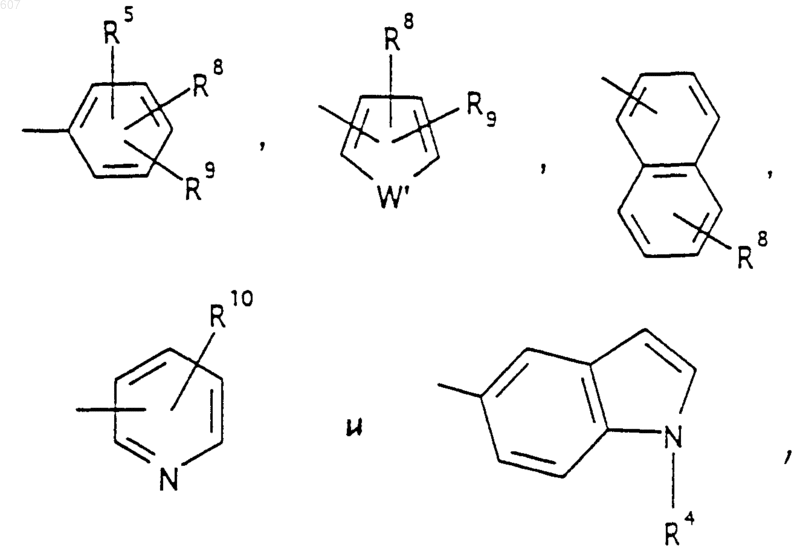
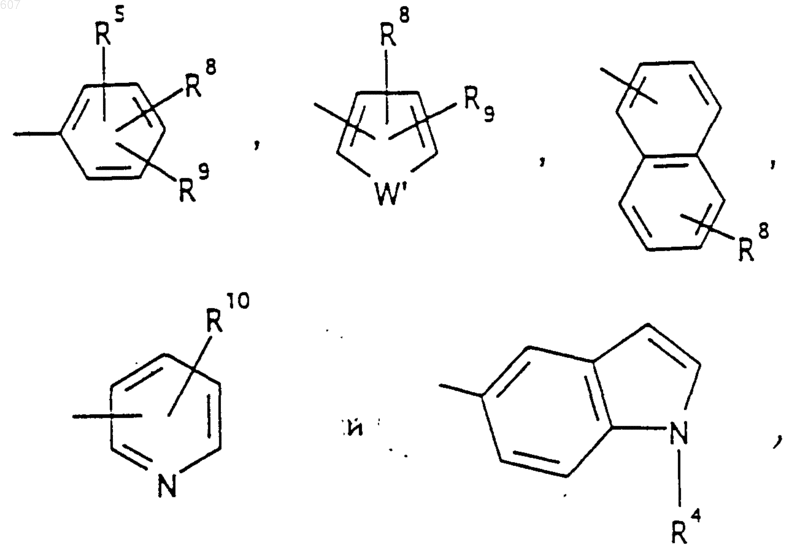
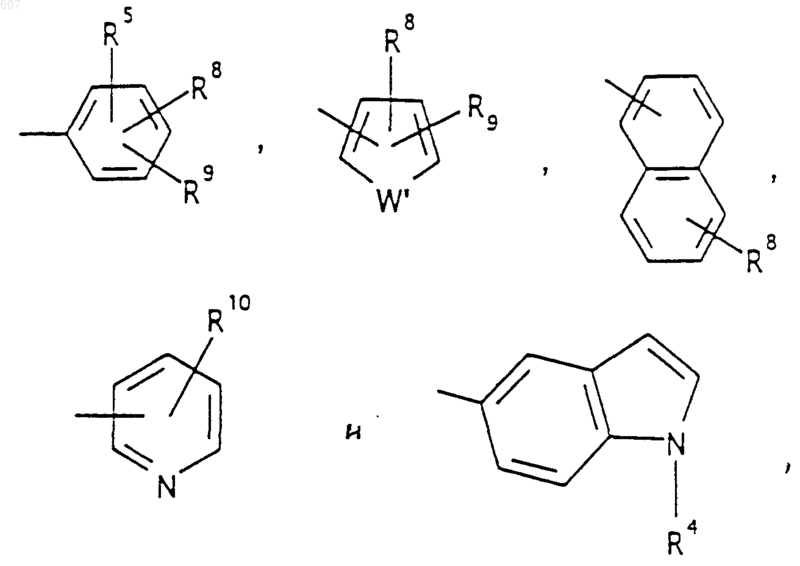
R5 выбирают из водорода, (C1-C3) алкила, (C1-C3)алкоксигруппы и галоида;
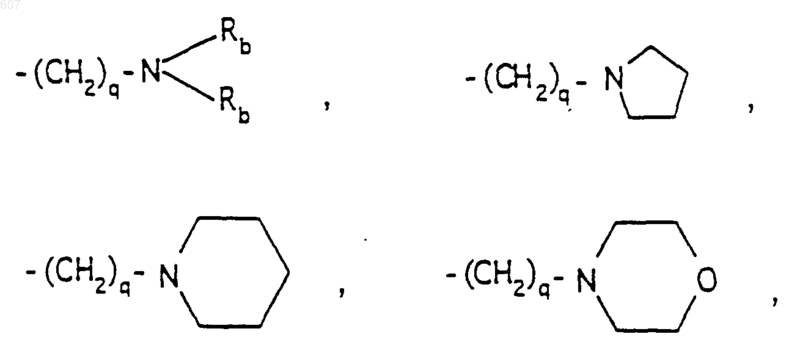
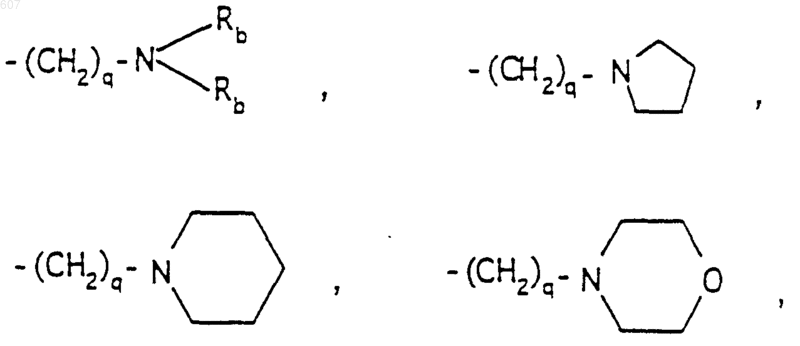
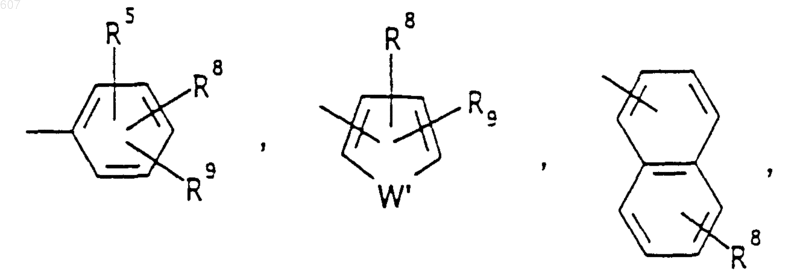
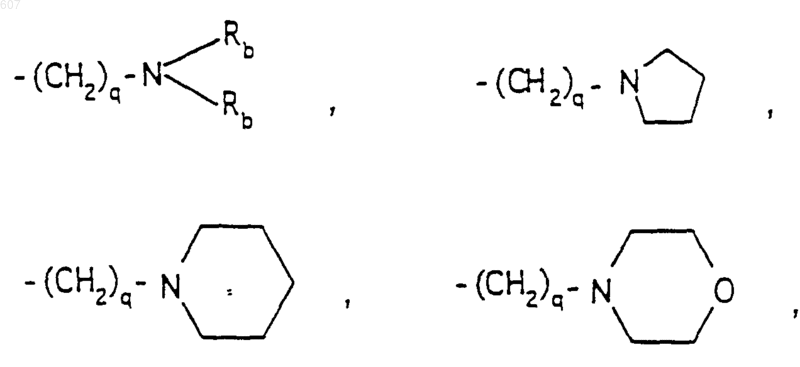
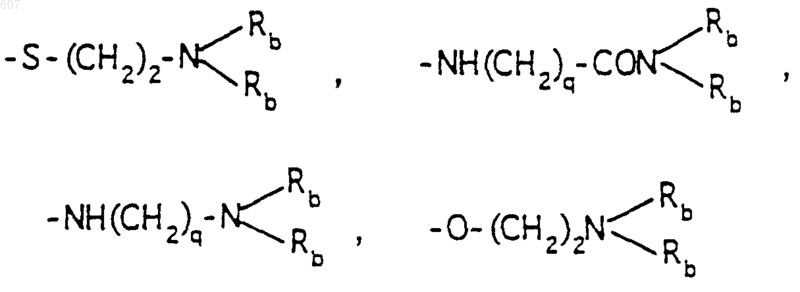
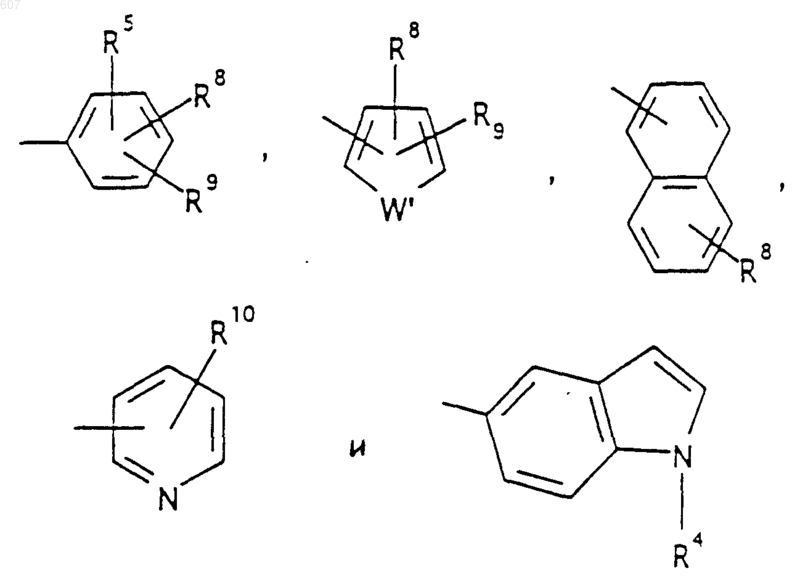
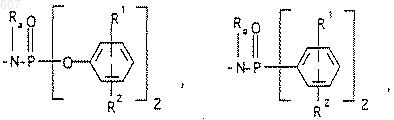
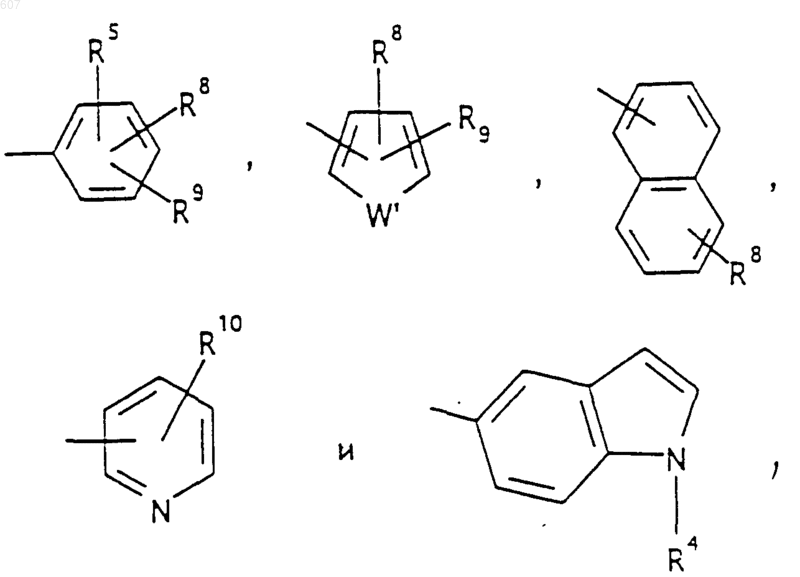
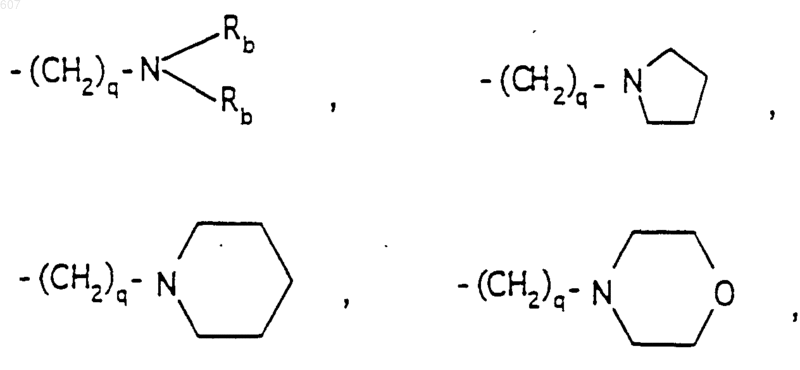
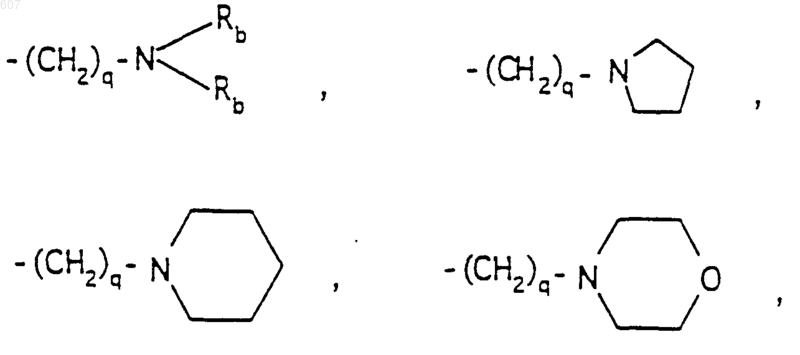
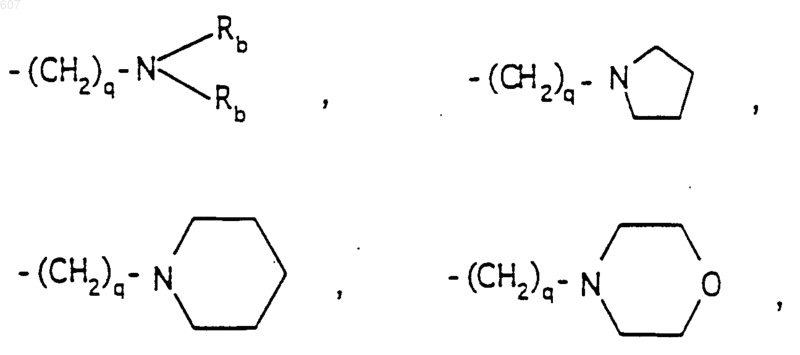
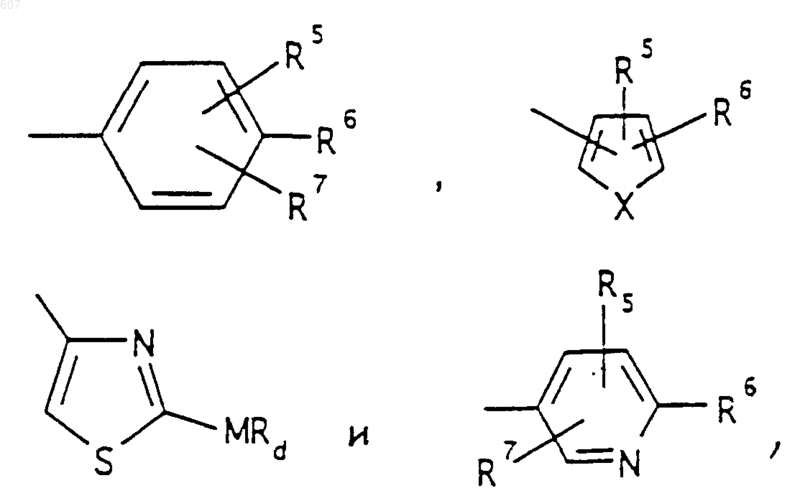
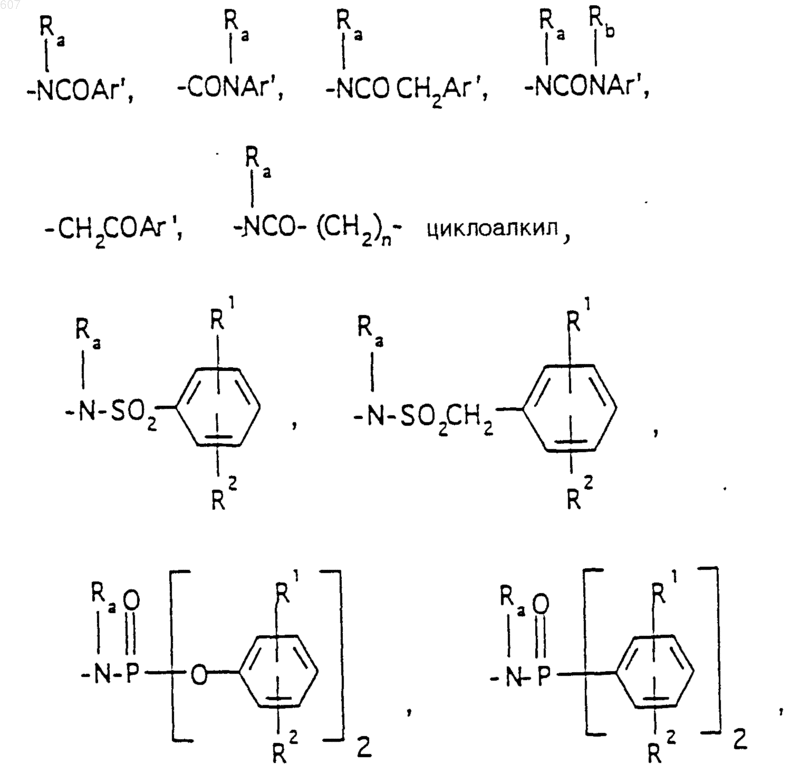
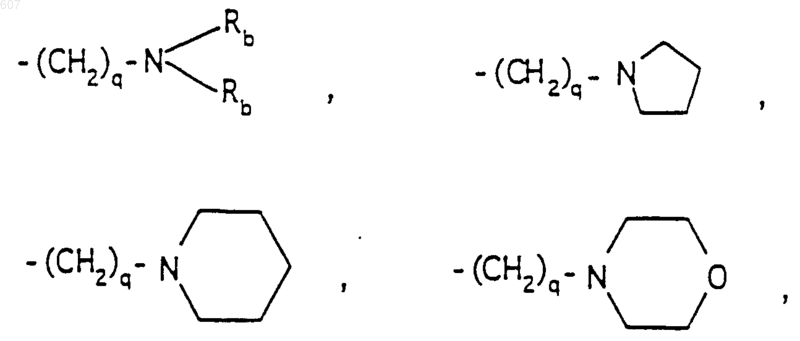
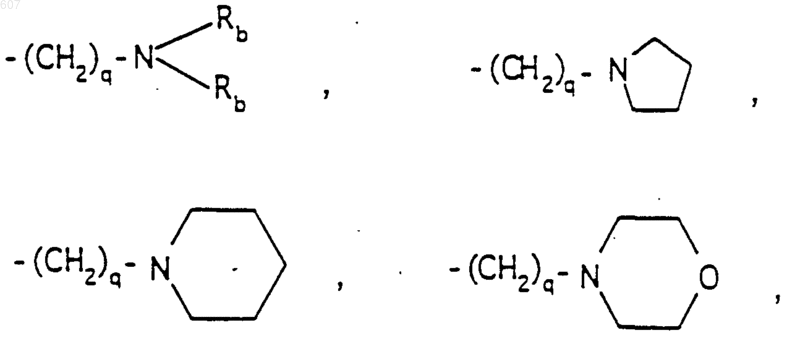
R6 выбирают из (а) фрагментов формул
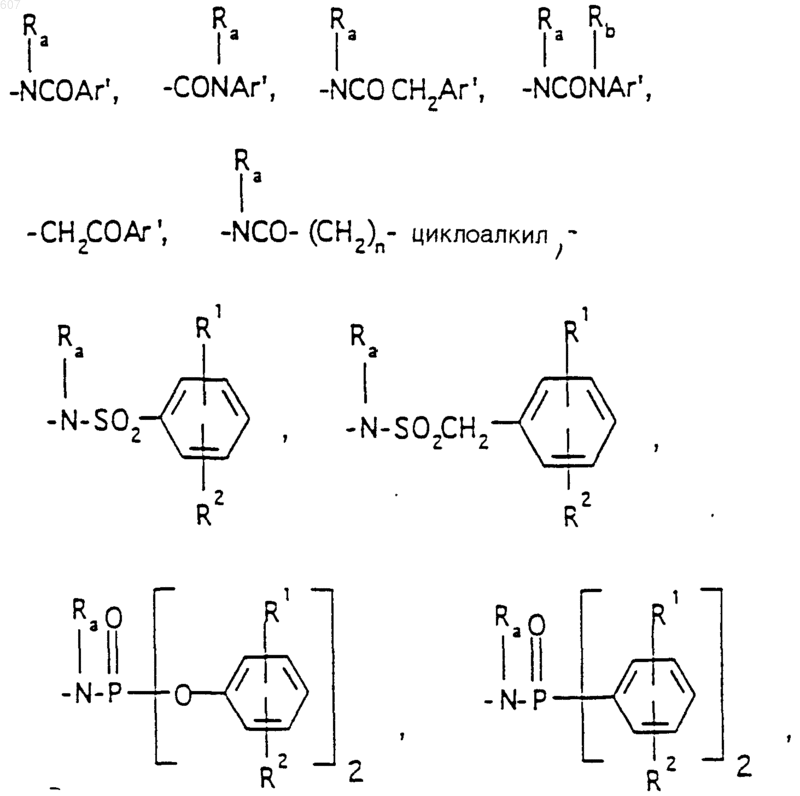
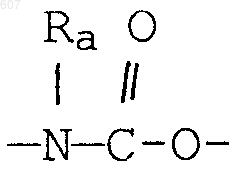
алкил(C3-С8) разветвленный или неразветвленный,

алкил(C3-С8), разветвленный или неразветвленный,

алкил(C3-С8), разветвленный или неразветвленный,
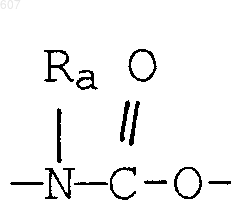
алкенил(C3-C8), разветвленный или неразветвленный,
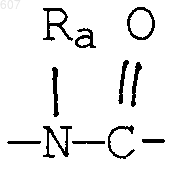
алкенил(C3-С8), разветвленный или неразветвленный,
алкенил(C3-С8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-С6)циклоалкил, циклогексенил или циклопентенил; a Ra независимо выбирают из водорода, -СН3 или -С2H5,

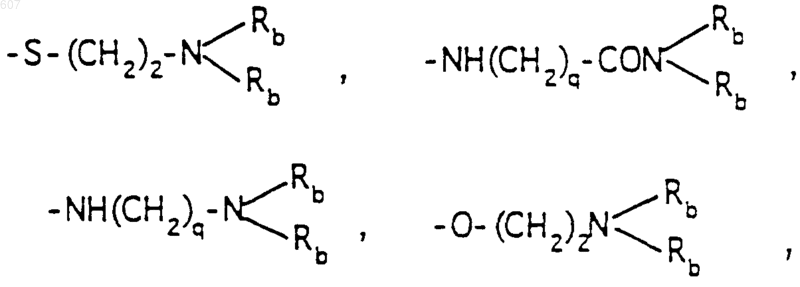
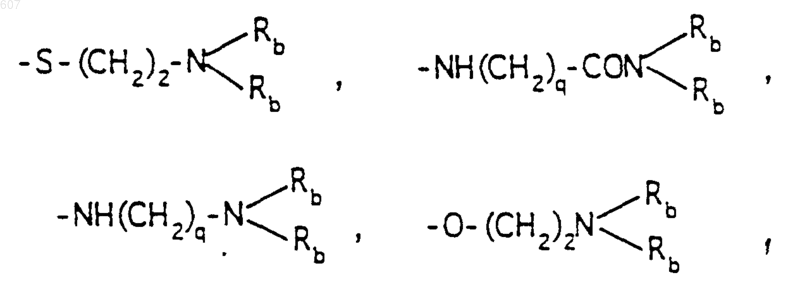
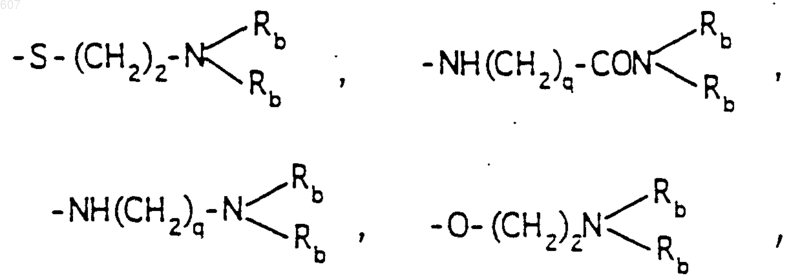
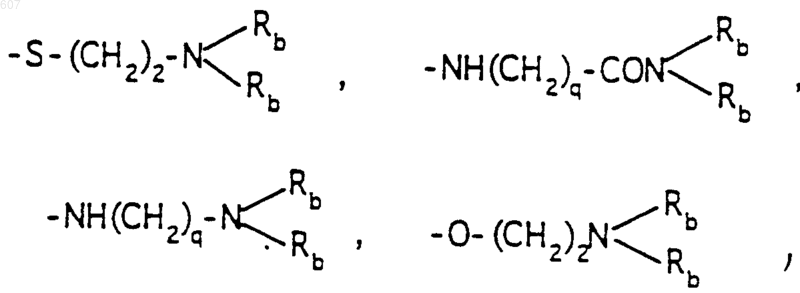
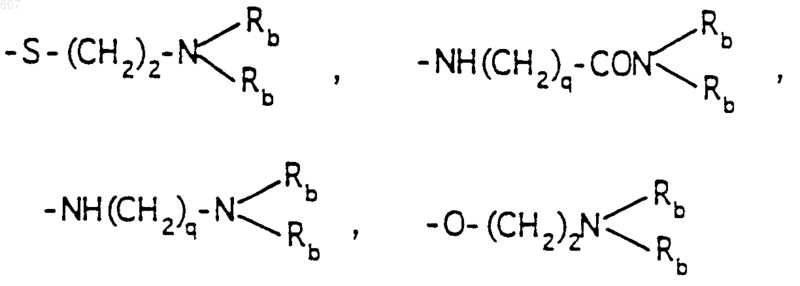
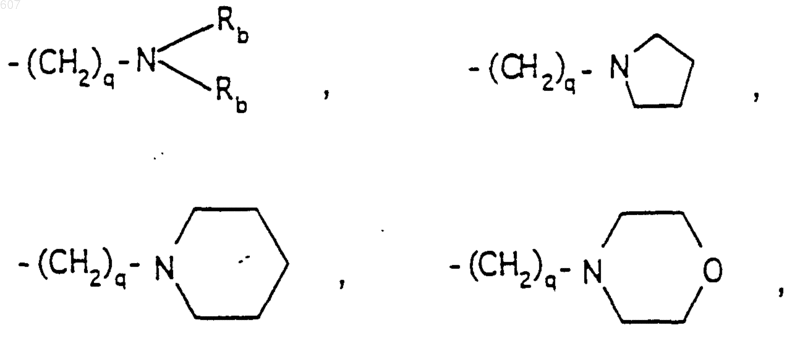
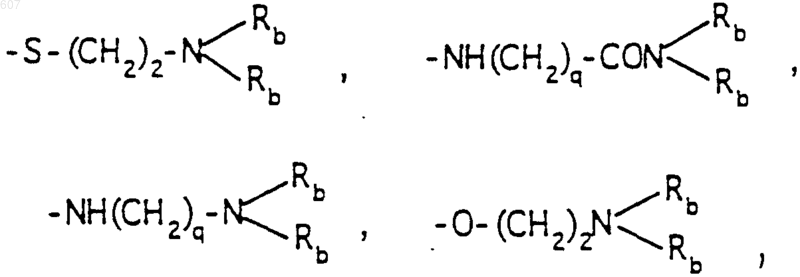
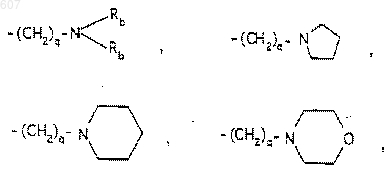
-(СН2)q-O-алкил(С1-C3), -СН2СН2OН, q равно 1, 2 или 3, Rb независимо выбирают из водорода, -СН3 или -С2Н5;
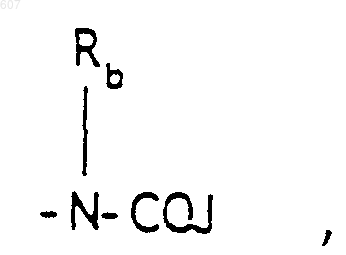
(b) фрагмента формулы:
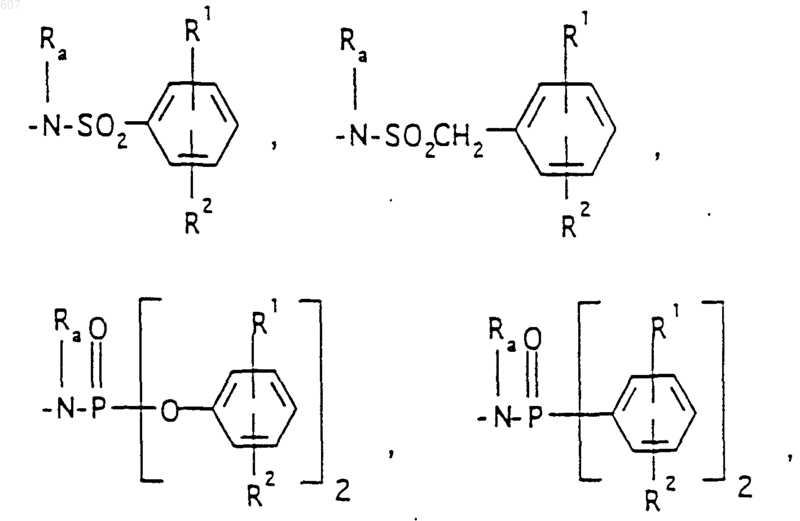
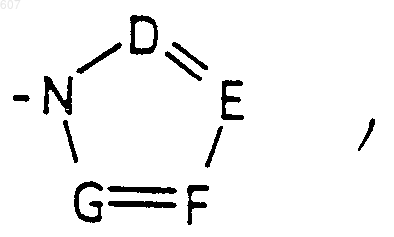
где J представляет Ra, алкил (C3-C8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил(C3-С8), разветвленный или неразветвленный, -O- алкенил(C3-С8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты
или -СН2-K', где K' представляет (C1-C3) алкоксигруппу, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
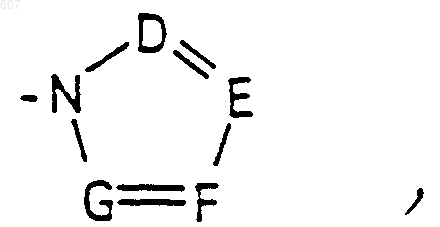
где D, Е, F и G выбирают из углерода или азота и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом-СО-(C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой, -СO2-алкилом(С1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы:
где Rc выбирают из галоида, (C1-C3) алкила, -O- алкил (C1-C3), ОН,
алкил(C1-C3), -S-алкил(C3-C3),
где Ra и Rb имеют указанные ранее значения;
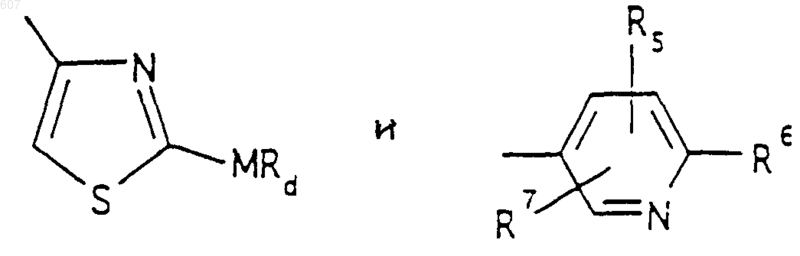
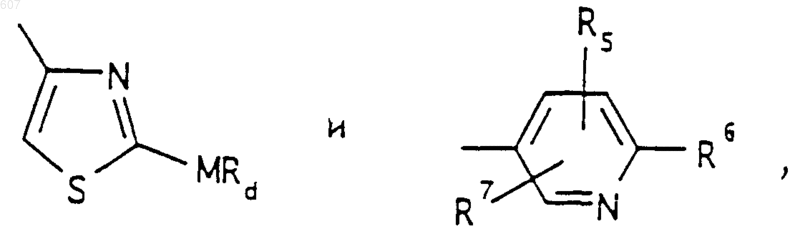
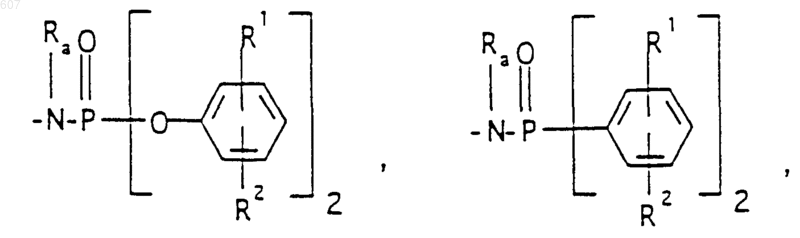
(d) фрагмента формулы - М - Rd, где Rd представляет алкил(C3-C3), алкенил(C3-С8), -(СН2)p-циклоалкил(C3-C6), М представляет О, S, NH, NСН3, и фрагмента-М-Rd, где Rd выбирают из фрагментов
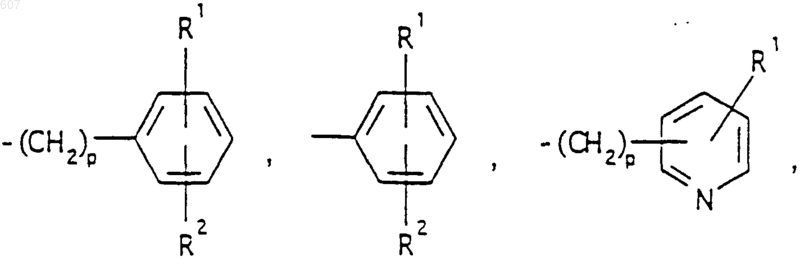
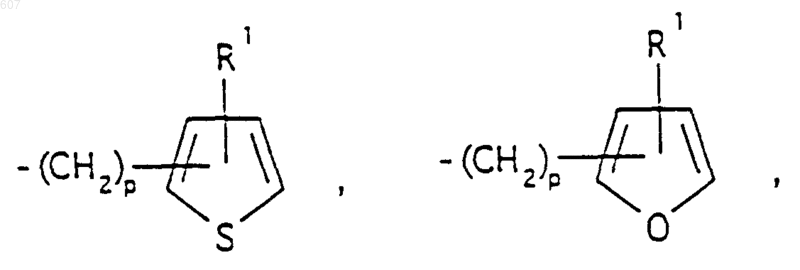
где р представляет число от 0 до 4;
а М представляет связь, или М выбирают из О, S, NH, NСН3;
R1, R2 и Ra имеют указанные ранее значения;
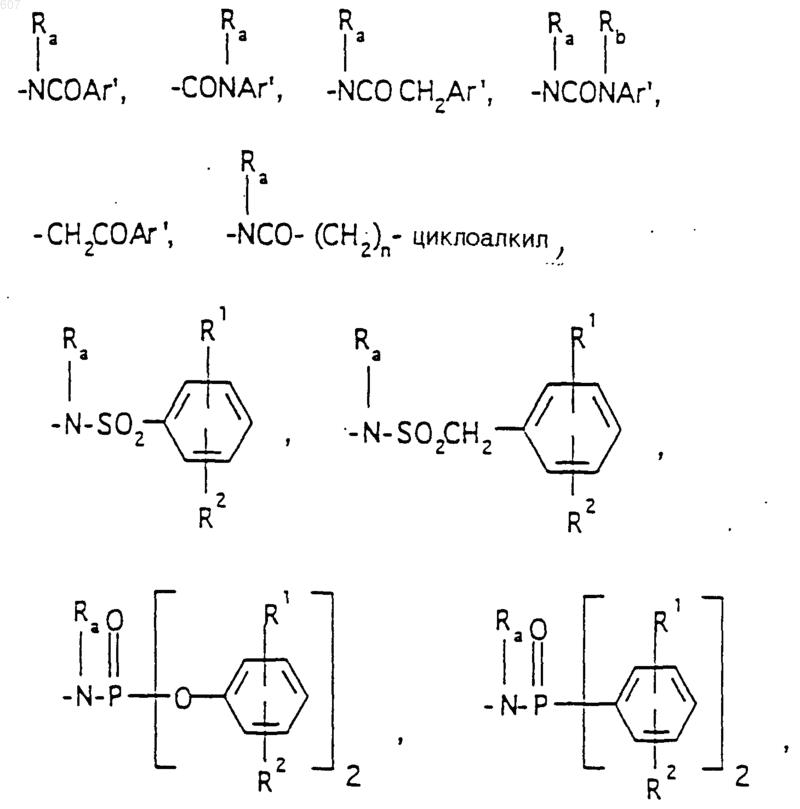
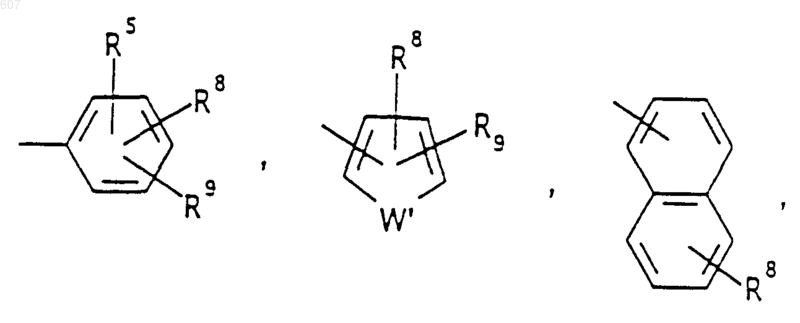
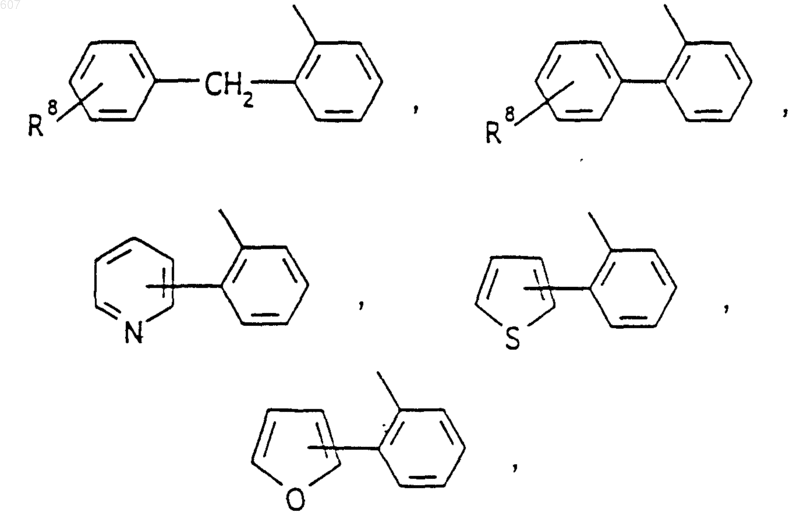
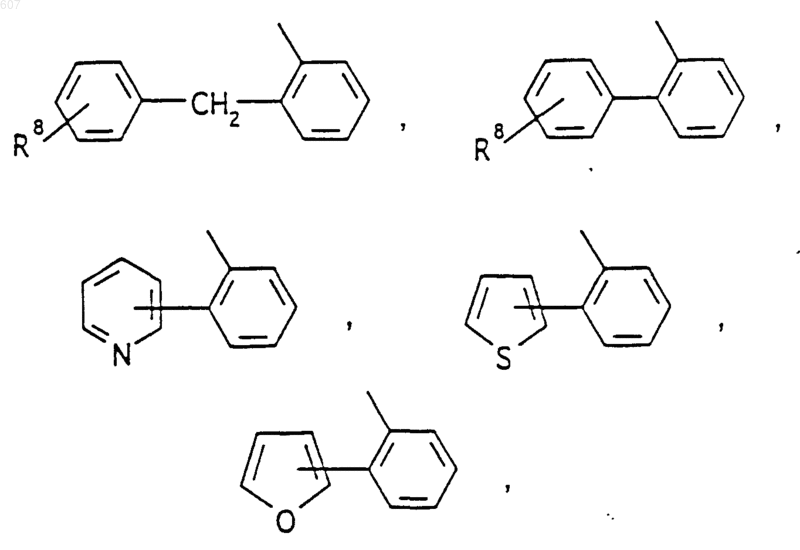
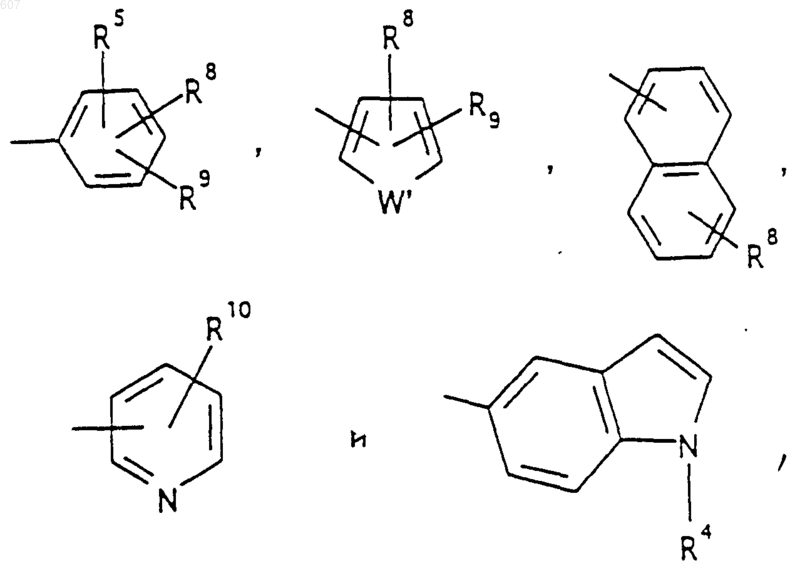
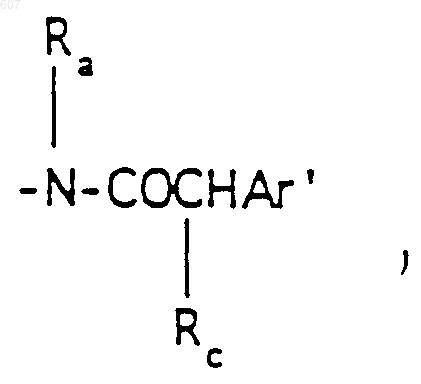
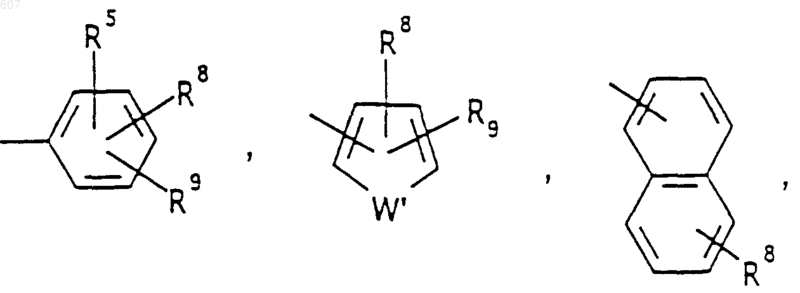
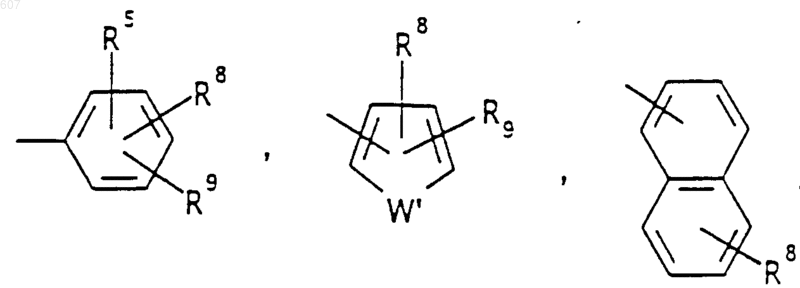
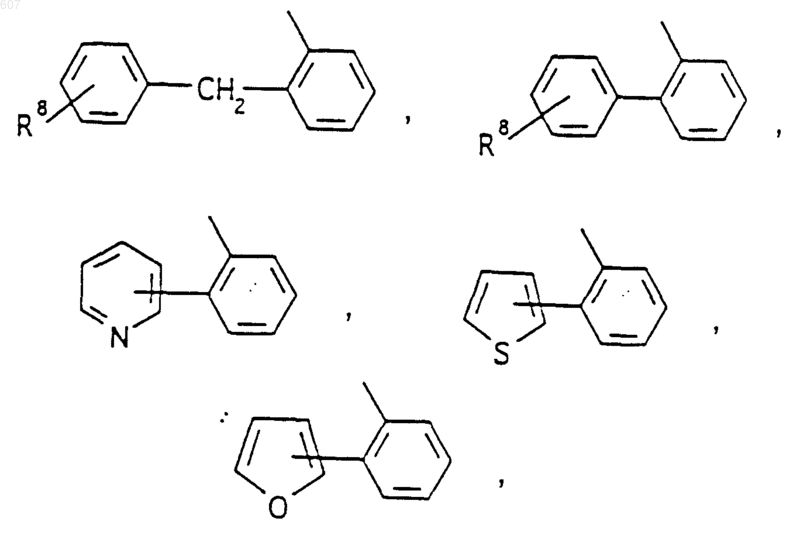
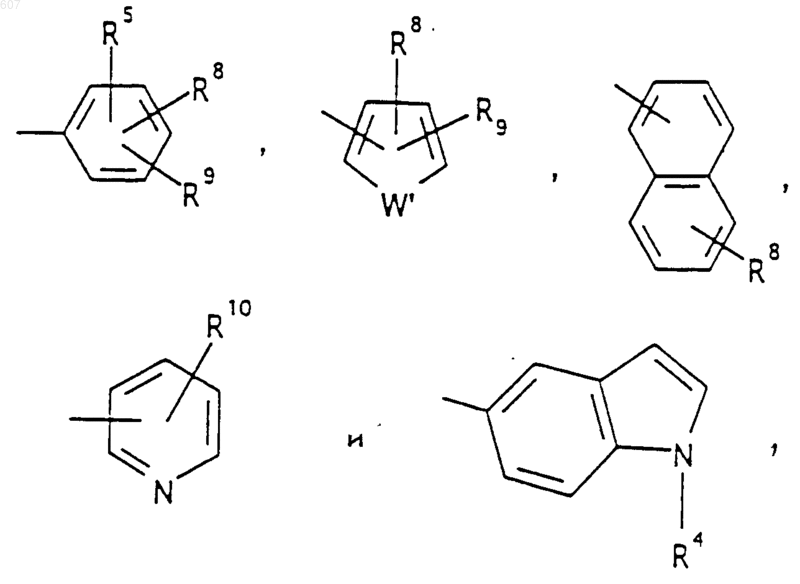
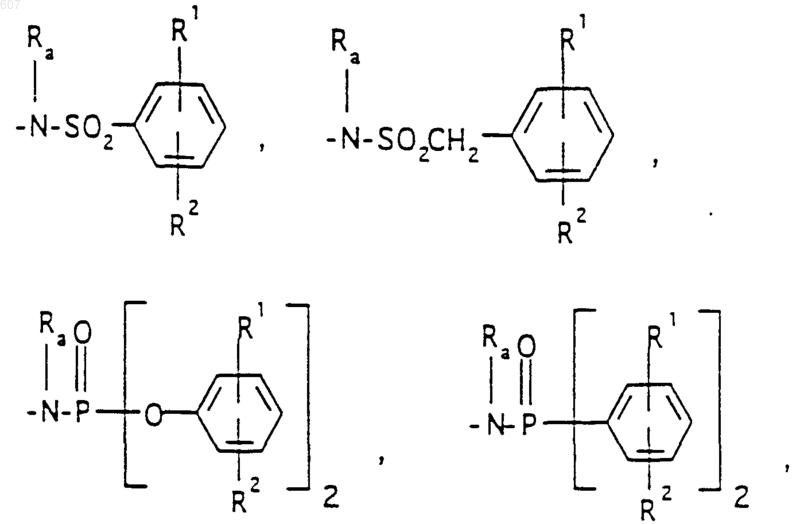
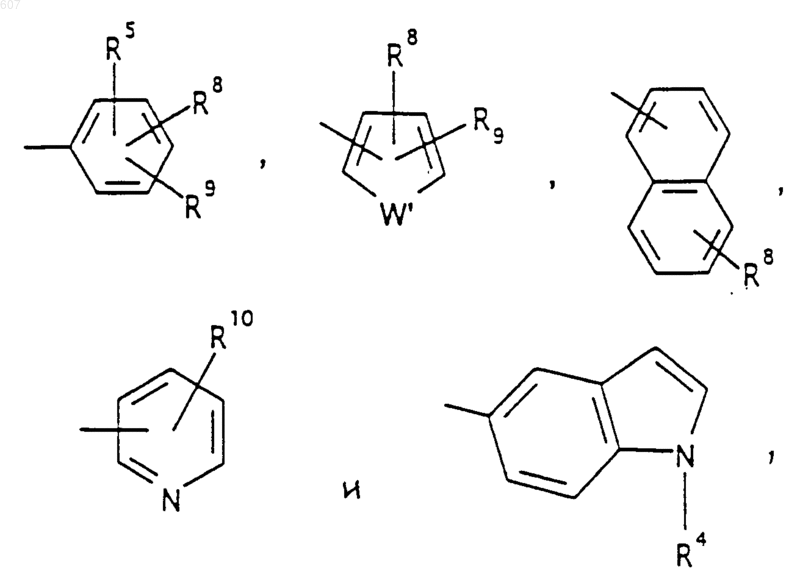
Аr' выбирают из фрагментов формул
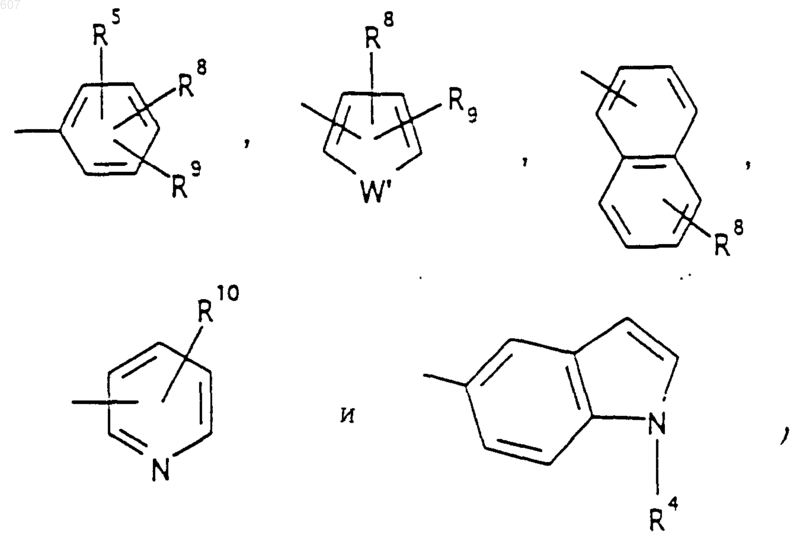
где W' выбирают из О, S, NH, N-алкил (C1-C3), NHCO-алкил (C1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила (C1-C3), галоида, O- алкила (C1-C3) и СF3;
R8 и R9 независимо выбирают шч водорода, алкила (C1-C3), -S-алкила(C1-C3), галоида, -NH-алкила(C1-C3), -N-[алкила(C1-C3)]2, -ОСF3, -ОН, -CN, -S-СF3, -NO2, -NH2, O-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила(C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила(C1-C3), -N[алкила(C1-C3)]2, -O-алкила (C1-C3), -N-(Rb) (CH2)q-N (Rb)2;
и его фармацевтически приемлемые соли.
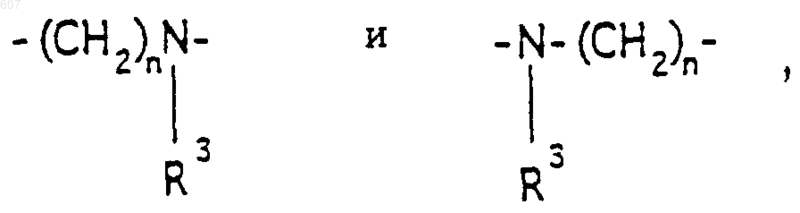
2. Соединение по п.1, где Y представляет -CH2-; А-В представляет фрагмент
где n представляет целое число 1 или 2, а R3 имеет указанные в п.1 значения.
3. Соединение по п.1, где Y представляет связь, А-В представляет фрагмент

где n представляет целое число 2, а R имеет указанные в п.1 значения.
4. Соединение по п.1, где Y представляет О, S, NH, N-алкил(C1-C6), -NCO-алкил(C1-C6), A-В представляет фрагмент
где n представляет целое число 1 или 2, a R3 имеет указанные в пункте 1 значения.
5. Соединение по п.1, где Y представляет -СН2-; А-В представляет фрагмент:

где n представляет целое число 1, а R3 имеет указанные в п.1 значения.
6. Соединение по п.1, где Y представляет О, S, NH, N-алкил(C1-C6), -NCO-алкил(C1-C6), и А-В представляет фрагмент

где n представляет целое число 1, а R имеет указанные в п.1 значения.
7. Соединение по п.1 формулы
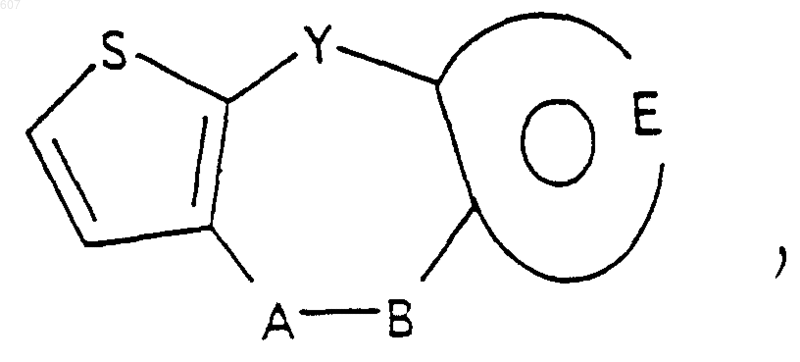
где Y представляет связь или -CH2-, A-B представляет
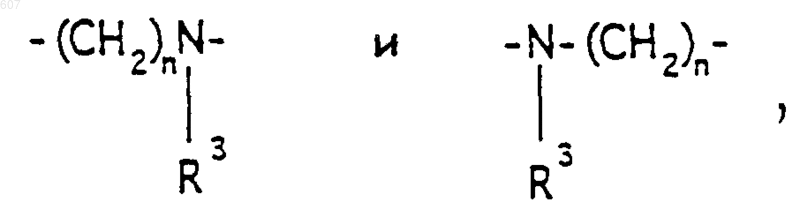
где n представляет целое число 1 или 2, при условии, что если Y представляет связь, n представляет целое число 2;
и фрагмент
представляет: (1) ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3)алкила, галоида, амино-, (C1-C3)алкокси- или (C1-C3) алкиламиногрупы; (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О, N или S; (3) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота; (4) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один атом азота вместе с либо одним атомом кислорода, либо с одним атомом серы; где 5- или 6-членные гетероциклические кольца необязательно замещены (C1-C3)алкилом, галоидом или (C1-C3) алкоксигруппой;
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из
где Х выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила(C1-C3);
R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R6 выбирают из (а) фрагментов формул
алкил(C3-С8) разветвленный или неразветвленный,
алкил(C3-С8) разветвленный или неразветвленный,
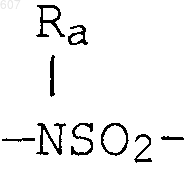
алкил(C3-С8), разветвленный или неразветвленный,
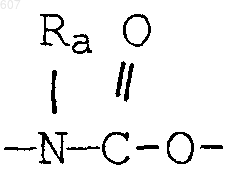
алкенил(C3-C8), разветвленный или неразветвленный,

алкенил(C3-С8), разветвленный или неразветвленный,
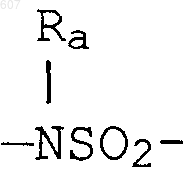
алкенил(C3-С8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-C6) циклоалкил, циклогексенил или циклопентенил, a Ra, независимо выбирают из водорода, -СН3 или -C2H5,
-(СН2)q-O-алкил (C1-C3), СН2СН2OН, q равно 1, 2 или 3;
Rb независимо выбирают из водорода, -СН3 или -C2H5;
(b) фрагмента формулы
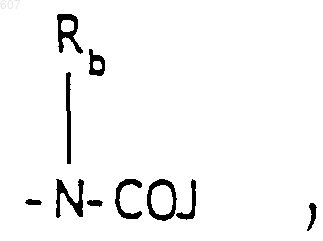
где J представляет Ra, алкил (C3-С8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил(C3-С8), разветвленный или неразветвленный, -O-алкенил(C3-С8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты
или -CH2-K', где K' представляет (C1-C3)алкоксигруппу, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
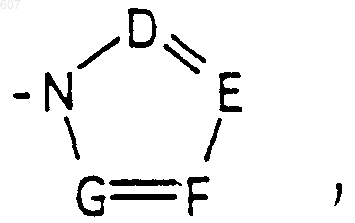
где D, Е, F и G выбирают из углерода или азота, и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3) алкилом, гидроксилом-СО-(C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой -СО2-алкилом (C1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы
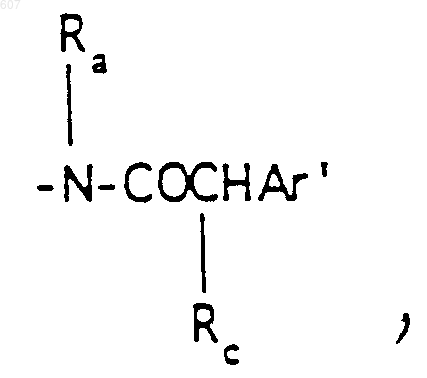
где Rc выбирают из галоида, (C1-C3) алкила, -O-алкил(C1-C3), ОН,
алкил(C1-C3), -S-алкил(C1-C3),
где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
-М - Rd,
где Rd представляет алкил(C3-C8), алкенил(C3-C8), -(СН2)p-циклоалкил(C3-C6),
М представляет О, S, NH, NНСН3,
и фрагмента -М-Rd, где Rd выбирают из фрагментов
где р принимрхт значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3; где R1, R2 и Ra имеют указанные ранее значения; где Аr' выбирают из фрагментов формул
где W' выбирают из О, S, NH, N-алкил(C1-C3), NHCO-алкил(C1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) и СF3;
R8 и R9 независимо выбирают из водорода, алкила(C1-C3), -S-алкила (C1-C3), галоида, -NH-алкила(C1-C3), -N-[алкила (C1-C3)]2, -ОСF3, -ОН, -CN, -S-СF3, -NO2, -NH2, O-алкила (C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила (C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила (C1-C3), -N[алкила (C1-C3)]2, -O-алкила (C1-C3), -N- (Rb) (СН2)q-N (Rb)2; и его фармацевтически приемлемые соли.
8. Соединение по п.1 формулы
где Y представляет связь или -СН2-, А-В представляет
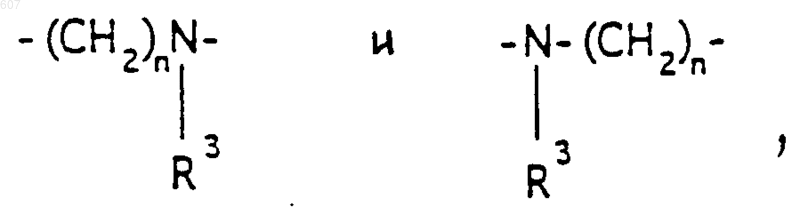
где n представляет целое число 1 или 2, при условии, что, если Y представляет связь, n представляет целое число 2;
и фрагмент
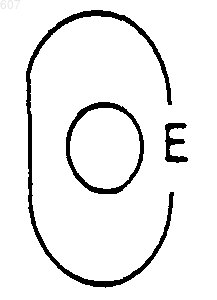
представляет: (1) ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3)алкила, галоида, амино-, (C1-C3) алкокси- или (C1-C3) алкиламиногруппы;
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из
где Х выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила (C1-C3), -СО-алкила(C1-C3); R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида; R6 выбирают из
(а) фрагментов формул
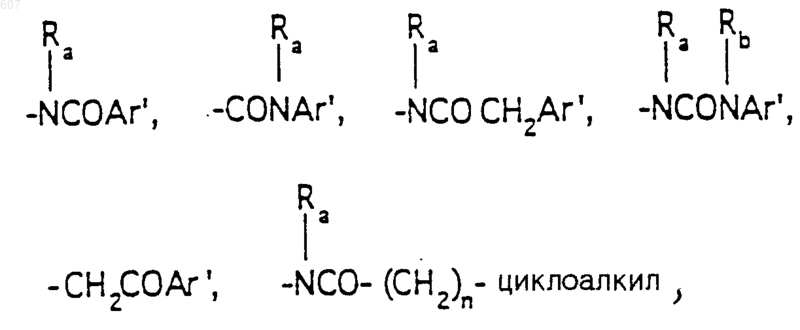
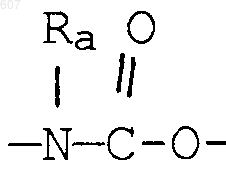
алкил(C3-С8), разветвленный или неразветвленный,
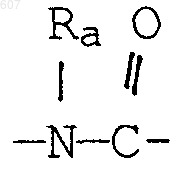
алкил(C3-С8), разветвленный или неразветвленный,
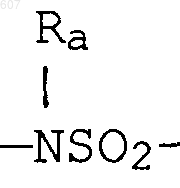
алкил(C3-С8), разветвленный или неразветвленный,
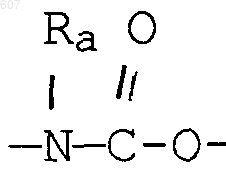
алкенил(C3-C8), разветвленный или неразветвленный,
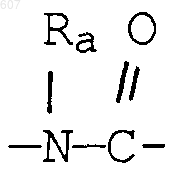
алкенил (C3-С8), разветвленный или неразветвленный,

алкенил(C3-С8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-C6)циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -C2H5,
-(CH2)q-O-алкил(С1-C3), СН2СН2OН, q равно 1, 2 или 3;
Rb, независимо, выбирают из водорода, -СН3 или -C2H5;
(b) фрагмента формулы
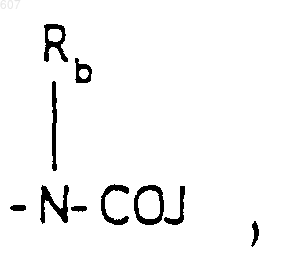
где J представляет Ra, алкил (C3-С8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил(C3-С8) разветвленный или неразветвленный, -О-алкенил(C3-С8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты:
или -СH2-K', где K' представляет (C1-C3)алкокси, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо:
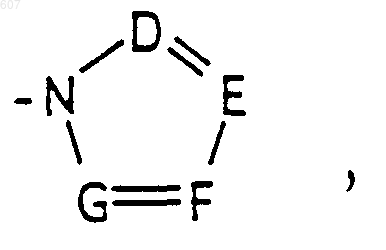
где D, Е, F и G выбирают из углерода или азота, и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3) алкилом, гидроксилом -СО-(C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой, -СО2-алкилом(С1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы
где Rc выбирают из галоида, (C1-C3) алкила, -O-алкила(C1-C3), ОН,
алкила(C1-C3), -S-алкила(C1-C3),
где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил(C3-С8), алкенил(C3-С8), -(СН2)p-циклоалкил(C3-C6), где М представляет О, S, NH, NСН3, и фрагмента -М-Rd, где Rd выбирают из фрагментов

где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения;
где Аr' выбирают из фрагментов формул
где W' выбирают из О, S, NH, N-алкил (C1-C3), NHCO-алкил(С1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) и СF3;
R8 и R9 независимо выбирают из водорода, алкила(C1-C3), -S-алкила (C1-C3), галоида, -NH-алкила (C1-C3), -N-[алкила (C1-C3)]2, -ОСF3, -ОН, -CN, -S-CF3, -NO2, -NH2, O-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила (C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила(C1-C3), -N-[алкила(C1-C3)]2, -O-алкила (C1-C3), -N-(Rb) (CH2)q-N(Rb)2;
и его фармацевтически приемлемые соли.
9. Соединение по п.1 формулы
где Y представляет связь или -СН2-, А-В представляет
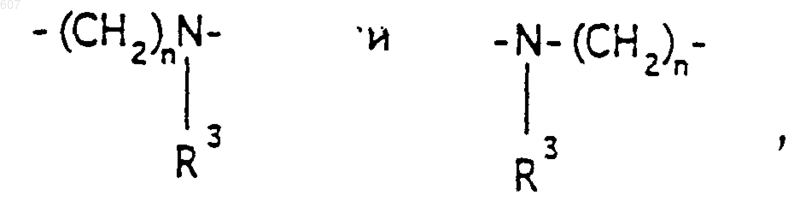
где n представляет целое число 1 или 2, при условии, что, если Y представляет связь, n представляет целое число 2;
и фрагмент
представляет 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О, N или S; где 5-членное гетероциклическое кольцо необязательно замещено (C1-C3)алкилом, галоидом, или (C1-C3)алкокси;
R3 представляет -COAr, где Ar представляет фрагмент, выбранный из группы, состоящей из
где Х выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила(C1-C3);
R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида; R6 выбирают из
(а) фрагментов формул
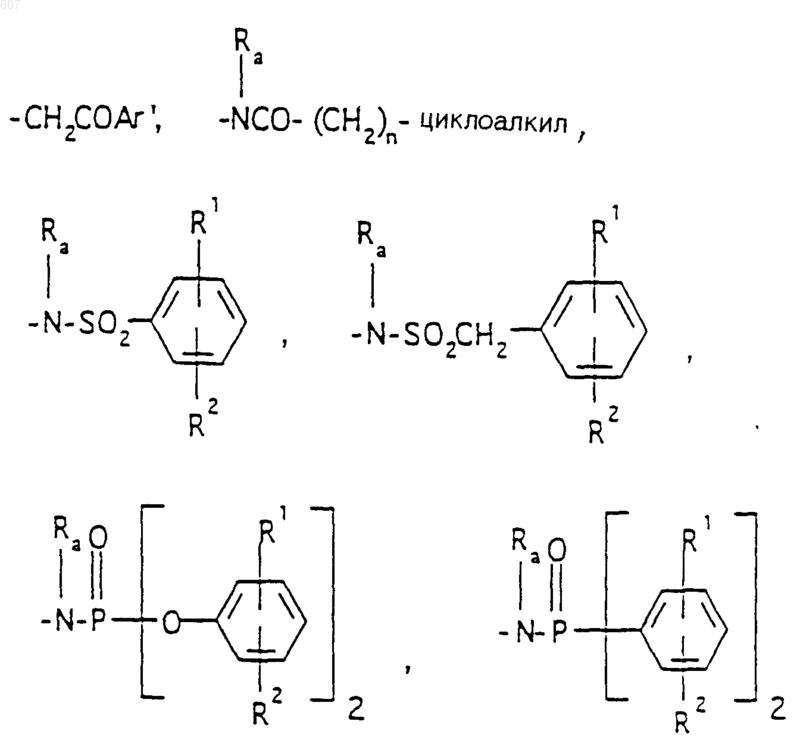
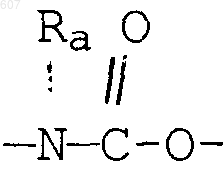
алкил(C3-С8), разветвленный или неразветвленный,
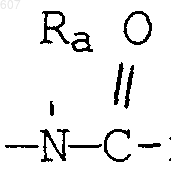
алкил(C3-С8), разветвленный или неразветвленный,
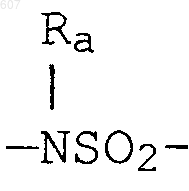
алкил(C3-С8), разветвленный или неразветвленный,
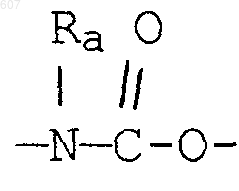
алкенил(C3-С8), разветвленный или неразветвленный,
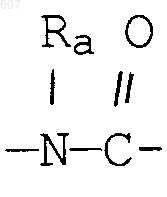
алкенил(C3-С8), разветвленный или неразветвленный,
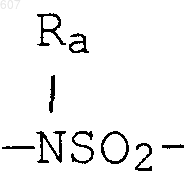
алкенил (C3-С8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-C6)циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -C2H5,
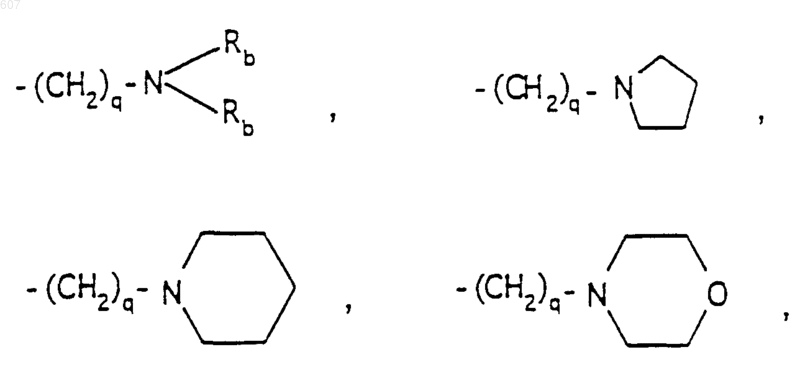
-(СН2)q-O-алкил(С1-C3), СН2СН2OН, q равно 1, 2 или 3;
Rb независимо выбирают из водорода, -СН3 или -C2Н5;
(b) фрагмента формулы
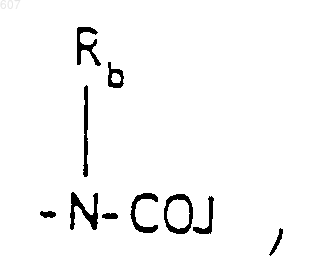
где J представляет Ra, алкил (C3-С8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O- алкил(C3-С8), разветвленный или неразветвленный, -O-алкенил(C3-С8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты
или -СН2-K', где K' представляет (C1-C3)алкоксигруппу, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
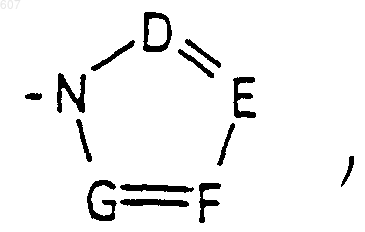
где D, E, F и G выбирают из углерода или азота, и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом -СО-(C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой, -СO2-алкилом (C1-C3); a
Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы
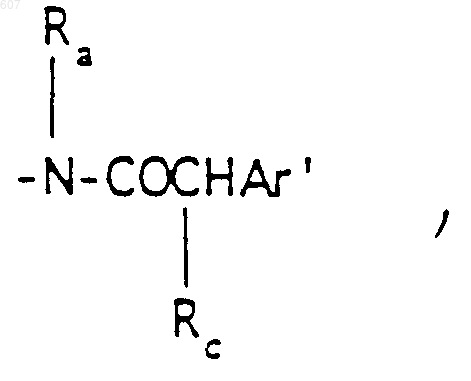
где Rc выбирают из галоида, (C1-C3) алкила, -O-алкил(C1-C3), ОН,
алкил (C1-C3), -S-алкил(C1-C3),
где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил(C3-C8), алкенил(C3-С8), -(СН2)p-циклоалкил(C3-C6),
где М представляет О, S, NH, NСН3,
и фрагмента -M-Rd, где Rd выбирают из фрагментов
где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения;
где Аr' выбирают из фрагментов формул

где W' выбирают из О, S, NH, N-алкил (C1-C3), NHCO-алкил(C1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила (C1-C3), галоида, O-алкила (C1-C3) и СF3;
R8 и R9, независимо, выбирают из водорода, алкила(C1-C3), -S-алкила(C1-C3), галоида, -NH-алкила(C1-C3), -N-[алкила(C1-C3)]2, -OCF3, -ОН, -CN, -S-СF3, -NO2, -NН2, O-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила(C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила (C1-C3), -N[алкила (C1-C3)]2, -O-алкила (C1-C3), -N-(Rb) (СН2)q-N (Rb)2;
и его фармацевтически приемлемые соли.
10. Соединение по п.1 формулы
где Y представляет связь или -СН2-, А-В представляет

где n представляет целое число 1 или 2 при условии, что, если Y представляет связь, n представляет целое число 2;
и фрагмент
представляет 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота, где 5-членное гетероциклическое кольцо необязательно замещено (C1-C3) алкилом, галоидом или (C1-C3) алкоксигруппой;
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из
где X выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила (C1-C3), -СО-алкила(C1-C3);
R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R6 выбирают из
(а) фрагментов формул
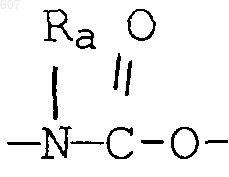
алкил (C3-C8), разветвленный или неразветвленный,
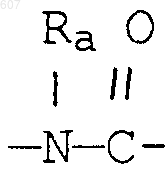
алкил(C3-С8), разветвленный или неразветвленный,
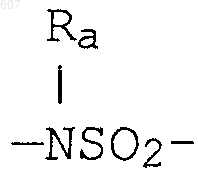
алкил(C3-С8), разветвленный или неразветвленный,
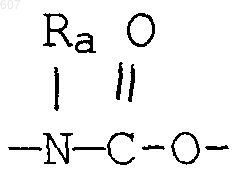
алкенил (C3-С8), разветвленный или неразветвленный,

алкенил(C3-C8), разветвленный или неразветвленный,
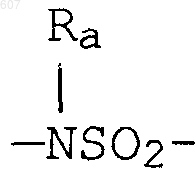
алкенил(C3-С8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-С6)циклоалкил, циклогексенил или циклопентенил,
a Ra независимо выбирают из водорода, -СН3 или -С2Н5,
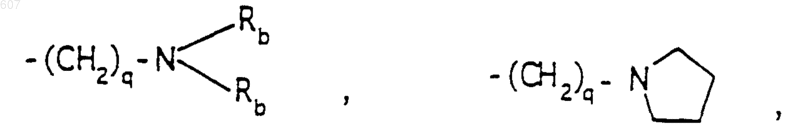
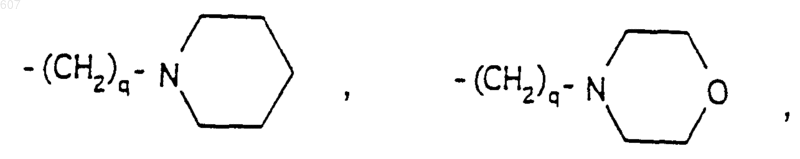
-(CH2)q-O-алкил (C1-C3), СН2СН2OН, q равно 1, 2 или 3;
Rb, независимо выбирают из водорода, -СН3 или -C2H5;
(b) фрагмента формулы

где J представляет Ra, алкил (C3-С8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил(C3-С8), разветвленный или неразветвленный, -O-алкенил(C3-C8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты
или -СН2-K', где K' представляет (C1-C3) алкоксигруппу, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
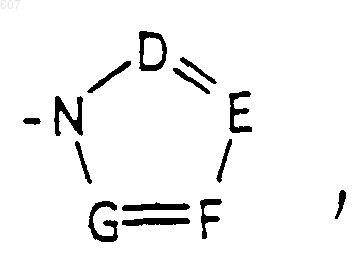
где D, Е, F и G выбирают из углерода или азота, и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом -СО-(C1-C3) алкилом, СНО, (C1-C3) алкоксигруппой, -СО2-алкилом (C1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы
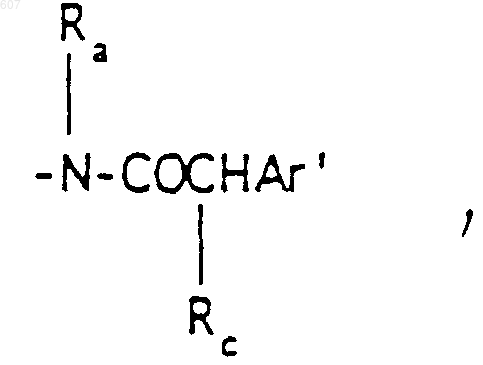
где Rc выбирают из галоида, (C1-C3) алкила, -O-алкил(C1-C3), ОН,
алкил(C1-C3), -S-алкил(C1-C3),
где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил (C3-C8), алкенил(C3-С8), -(СН2)p-циклоалкил (C3-C6),
где М представляет О, S, NH, NСН3, и фрагмента -M-Rd, где Rd выбирают из фрагментов
где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения; где Аr' выбирают из фрагментов формул
где W' выбирают из О, S, NH, N-алкил(C1-C3), NHCO-алкил(С1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) и СF3;
R8 и R9, независимо выбирают из водорода, алкила(C1-C3), -S-алкила(C1-C3), галоида, -NH-алкила (C1-C3), -N-[алкила(C1-C3)]2, -ОСF3, -ОН, -CN, -S-СF3, -NO2, -NН2, O-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила (C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила(C1-C3), -N[алкила(C1-C3)]2, -O-алкила (C1-C3), -N-(Rb) (СН2)q-N (Rb)2;
и его фармацевтически приемлемые соли.
11. Соединение по п.1 формулы
где Y представляет связь или -СН2-, А-В представляет

где n представляет целое число 1 или 2, при условии, что, если Y представляет связь, n представляет целое число 2;
и фрагмент
представляет 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один атом азота вместе с либо одним атомом кислорода, либо с одним атомом серы; где 5-членное гетероциклическое кольцо необязательно замещено (C1-C3)алкокси;
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из
где Х выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила (C1-C3);
R1 и R2 выбирают из водорода, (C1-C3) алкила, (C3-C3) алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3) алкоксигруппы и галоида;
R6 выбирают из
(а) фрагментов формул
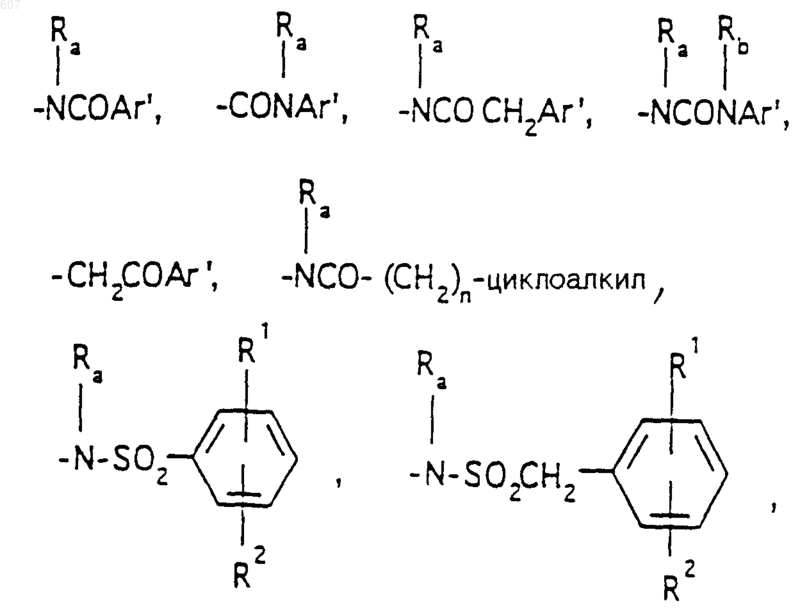
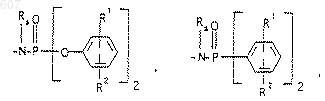
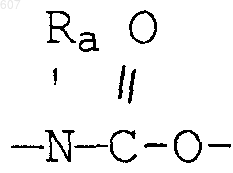
алкил(C3-С8), разветвленный или неразветвленный,

алкил(C3-С8), разветвленный или неразветвленный,
алкил (C3-С8), разветвленэыщ или неразветвленный,
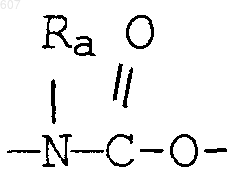
алкенил (C3-С8), разветвленный или неразветвленный,
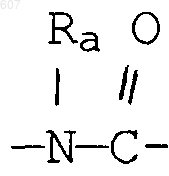
алкенил(C3-C8), разветвленный или неразветвленный,
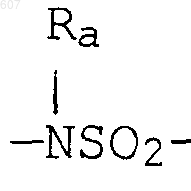
алкенил (C3-С8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-C6)циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -C2H5,
-(СН2)q-O-алкил(С1-C3), СН2СН2OН, q равно 1, 2 или 3; Rb независимо выбирают из водорода, -СН3 или -С2Н5;
(b) фрагмента формулы
где J представляет Ra, алкил (C3-C8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил (C3-C8), разветвленный или неразветвленный, -O-алкенил(C3-C8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты

или -СН2-K', где K' представляет (C1-C3)алкоксигруппу, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
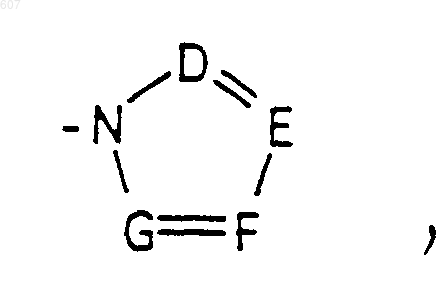
где D, Е, F и G выбирают из углерода или азота, и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3) алкилом, гидроксилом -СО-(C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой -СО2-алкилом (C1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы
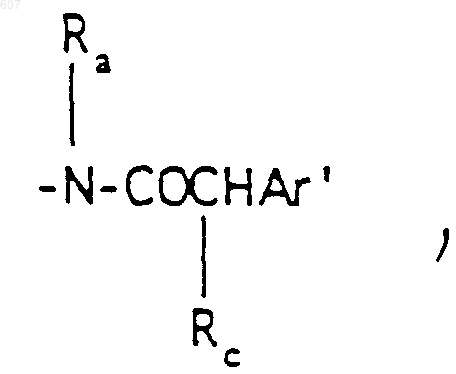
где Rc выбирают из галоида, (C1-C3) алкила, -O-алкил (C1-C3), ОН,
алкил(C1-C3), -S-алкил(C1-C3),
где Ra и Rb имеют указанные ранее значения/ (d) фрагмента формулы
- М - Rd,
где Rd представляет алкил(C3-C8), алкенил(C3-С8), -(СН2)p-циклоалкил (C3-C6), где М представляет О, S, NH, NСН3, и фрагмента -M-Rd, где Rd выбирают из фрагментов
где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3; где R1, R2 и Ra имеют указанные ранее значения;
где Аr' выбирают из фрагментов формул
где W' выбирают из О, S, NH, N-алкил (C1-C3), NHCO-алкил(C1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) и СF3; R8 и R9 независимо выбирают из водорода, алкила(C1-C3), -S-алкила(C1-C3), галоида, -NH-алкила(C1-C3), -N-[алкила (C1-C3)]2, -ОСF3, -ОН, -CN, -S-СF3, -NO2, -NH2, O-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила(C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила(C1-C3), -N[алкила(C1-C3)]2, -O-алкила (C1-C3), -N (Rb) (CH2)q-N (Rb);
и его фармацевтически приемлемые соли.
12. Соединение по п.1 формулы
где Y представляет связь, А-В представляет
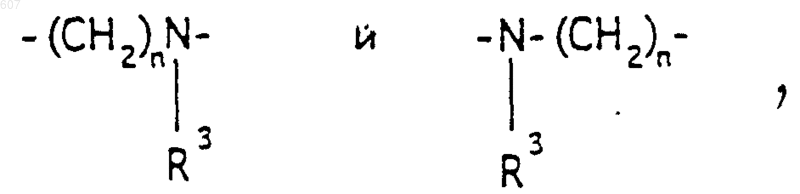
где n представляет целое число 2;
и фрагмент
представляет: (1) ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3) алкила, галоида, амино-, (C1-C3)алкокси- или (C1-C3)алкиламиногруппы; (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О, N или S; (3) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота; (4) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один атом азота вместе с либо одним атомом кислорода, либо одним атомом серы; где 5- или 6-членные гетероциклические кольца необязательно замещены (C1-C3)алкилом, галоидом или (C1-C3) алкоксигруппой;
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из
где X выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила (C1-C3), -СО-алкила (C1-C3);
R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R6 выбирают из
(а) фрагментов формул
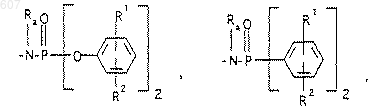

алкил(C3-С8), разветвленный или неразветвленный,
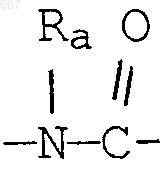
алкил(C3-С8), разветвленный или неразветвленный,
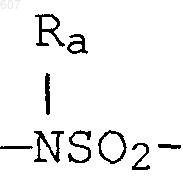
алкил(C3-С8), разветвленный или неразветвленный,
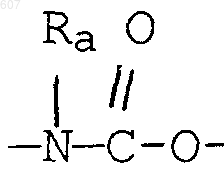
алкенил(C3-С8), разветвленный или неразветвленный,
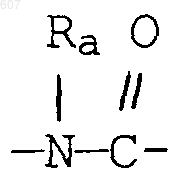
алкенил(C3-С8), разветвленный или неразветвленный,
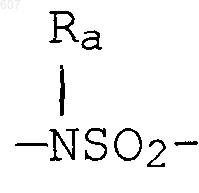
алкенил(C3-C8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-C6) циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -C2H5,
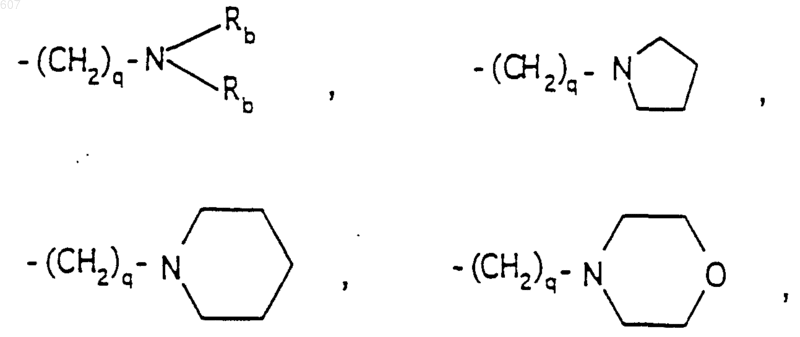
-(СН2)q-O-алкил(С1-C3), СН2СН2OН, q равно 1, 2 или 3;
Rb независимо выбирают из водорода, -СН3 или -С2H5;
(b) фрагмента формулы
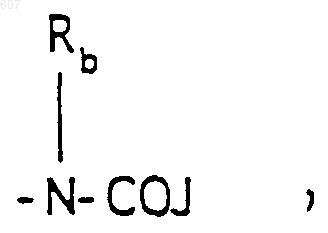
где J представляет Ra, алкил (C3-С8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил (C3-С8), разветвленный или неразветвленный, -O-алкенил(C3-С8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты
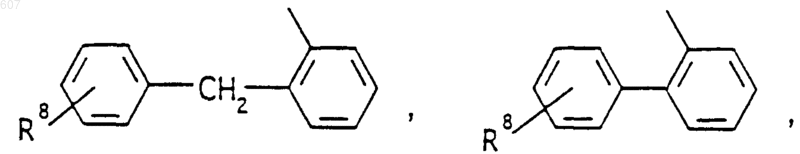
или -СН2-K', где K' представляет (C1-C3)алкоксигруппу, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
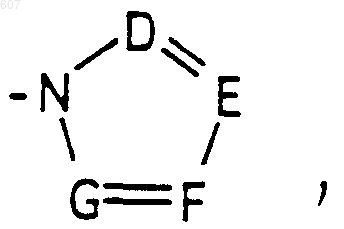
где D, Е, F и G выбирают из углерода или азота и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3) алкилом, гидроксилом -СО- (C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой, -СО2-алкилом (C1-C3), a Ra и Rb имеют указанные ранее значения:
(с) фрагмента формулы
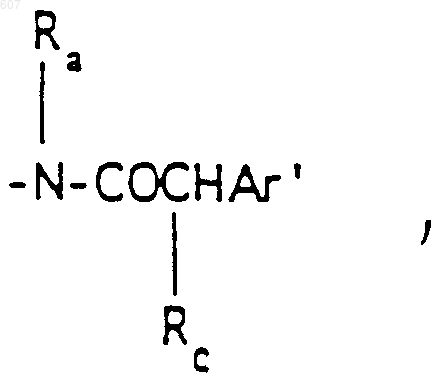
где Rc выбирают из галоида, (C1-C3) алкила, -O-алкил(C1-C3), ОН,

алкил(C1-C3), -S-алкил(C1-C3),
где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил(C3-C8), алкенил(C3-С8), -(СН2)p-циклоалкил(C3-C6), где М представляет О, S, NH, NСН3, и фрагмента -M-Rd, где Rd выбирают из фрагментов
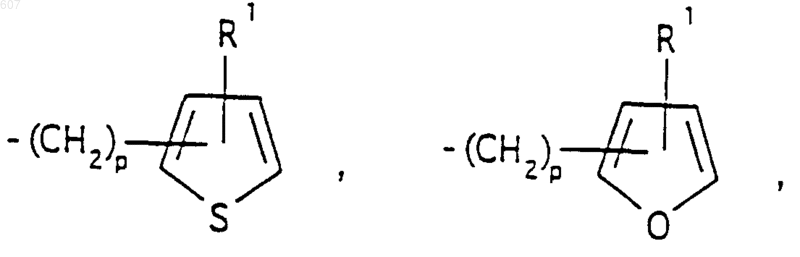
где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения; где Аr' выбирают из фрагментов формул:
где W' выбирают из О, S, NH, N-алкил (C1-C3), NНСО-алкил(C1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) и СF3;
R8 и R9 независимо выбирают из водорода, алкила(C1-C3), -S-алкила(C1-C3), галоида, -NH-алкила(C1-C3), -N-[алкила(C1-C3)]2, -ОСF3, -ОН, -CN, -S-СF3, -NO2, -NH2, O-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила (C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила(C1-C3), -N[алкила (C1-C3)]2, -O-алкила (C1-C3), -N-(Rb)(CH2)q-N(Rb)2;
и его фармацевтически приемлемые соли.
13. Соединение по п.1 формулы
где Y представляет связь или -CH2-, А-В представляет
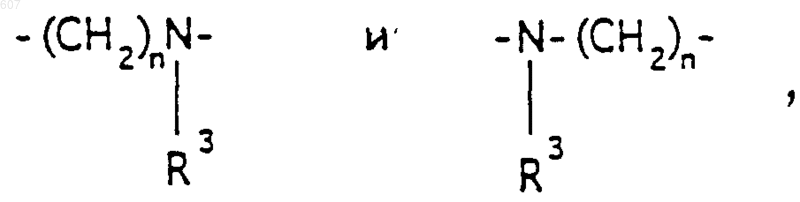
где n представляет целое число 1 или 2, при условии, что, если Y представляет связь, n представляет целое число 2;
и фрагмент
представляет: (1) ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3)алкила, галоида, амино-, (C1-C3)алкокси- или (C1-C3)алкиламиногруппы; (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О, N или S; (3) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота; (4) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один атом азота вместе с либо одним атомом кислорода, либо одним атомом серы; где 5- или 6-членные гетероциклические кольца необязательно замещены (C1-C3)алкилом, галоидом или (C1-C3) алкоксигруппой;
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из
где X выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила(C1-C3);
R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3) алкоксигруппы и галоида;
R6 выбирают из
(а) фрагментов формул
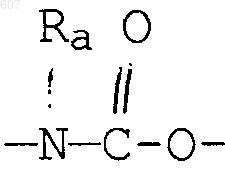
алкил(C3-С8), разветвленный или неразветвленный,
алкил(C3-С8), разветвленный или неразветвленный,
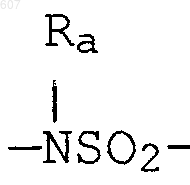
алкил(C3-С8), разветвленный или неразветвленный,

алкенил(C3-С8), разветвленный или неразветвленный,
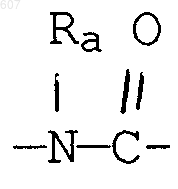
алкенил(C3-С8), разветвленный или неразветвленный,
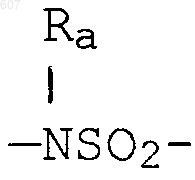
алкенил(C3-С8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-С6)циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -С2Н5,

-(СН2)q-O- алкил(С1-C3), СН2СН2OН, q равно 1, 2 или 3;
Rb независимо выбирают из водорода, -СН3 или -С2Н5;
(b) фрагмента формулы
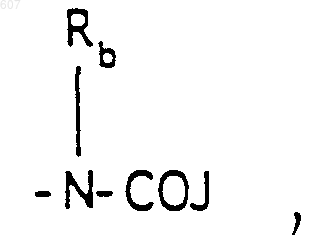
где J представляет Ra, алкил (C3-С8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный шыш неразветвленный, -O-алкил(C3-С8), разветвленный или неразветвленный, -O-алкенил(C3-С8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты

или -СН2-K', где K' представляет (C1-C3)алкокси, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
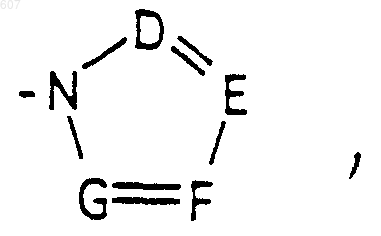
где D, Е, F и G выбирают из углерода или азота, и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом, -СО-(C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой, -СО2-алкилом (C1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы
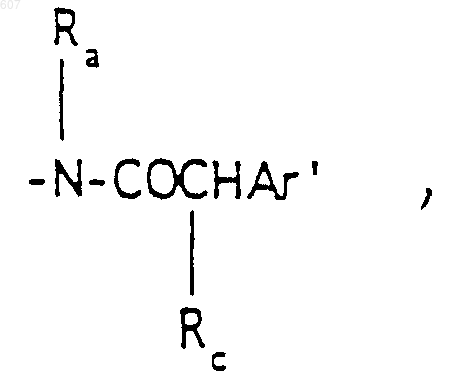
где Rc выбирают из галоида, (C1-C3) алкила, -O-алкил (C1-C3), ОН,
алкил(C1-C3), -S-алкил(C1-C3),
где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил(C3-C8), алкенил(C3-С8), -(СН2)p-циклоалкил(C3-C6), где М представляет О, S, NH, NСН3, и фрагмента -M-Rd, где Rd выбирают из фрагментов
где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения; где Аr' выбирают из фрагментов формул
где W' выбирают из О, S, NH, N-алкил (C1-C3), NHCO-алкил(С1-C3) и NSO2-алкил (C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) и СF3;
R8 и R9 независимо выбирают из водорода, алкила(C1-C3), -S-алкила (C1-C3), галоида, -NH-алкила(C1-C3), -N-[алкила(C1-C3)]2, -ОСF3, -ОН, -CN, -S-СF3, -NO2, -NH2, O-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила (C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила(C1-C3), -N[алкила (C1-C3)]2, -O-алкила (C1-C3), -N-(Rb) (CH2)q-N(Rb)2;
и его фармацевтически приемлемые соли.
14. Соединение по п.1 формулы
где Y представляет связь или -CH2-, А-В представляет
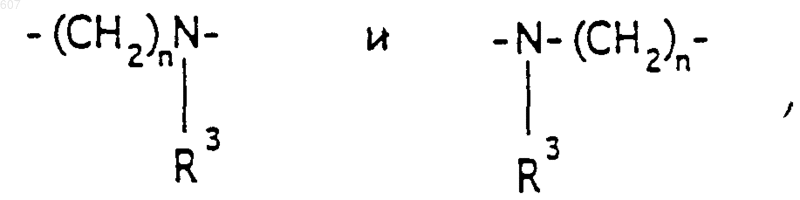
где n представляет целое число 1 или 2, при условии, что, если Y представляет связь, n представляет целое число 2; и фрагмент
представляет ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-С3)алкила, галоида, амино-, (C1-С3)алкокси- или (C1-С3)алкиламиногруппы;
R3 представляет -COAr, где Аr представляет фрагмент, выбранный из группы, состоящей из
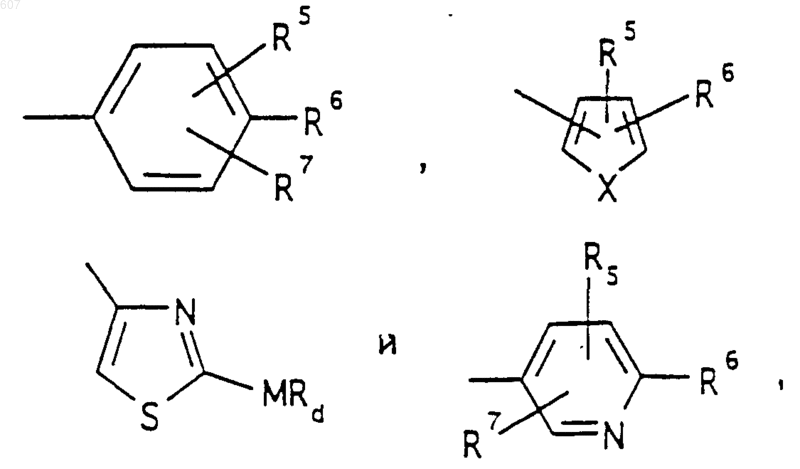
где Х выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила (C1-С3), -СО-алкила(C1-C3);
R1 и R2 выбирают из водорода,
(C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R6 выбирают из
(а) фрагментов формул

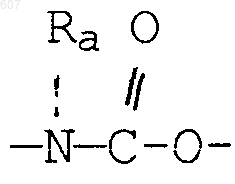
алкил(C3-С8), разветвленный или неразветвленный,
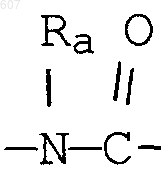
алкил(C3-С8), разветвленный или неразветвленный,
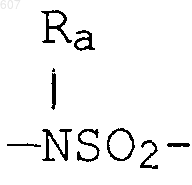
алкил(C3-С8), разветвленный или неразветвленный,
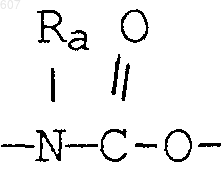
алкенил(C3-C8), разветвленный или неразветвленный,
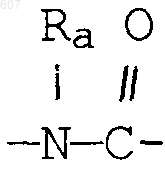
алкенил(C3-C8), разветвленный или неразветвленный,
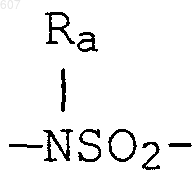
алкенил(C3-C8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-С6)циклоалкил, циклогексенил или циклопентенил; a
Ra независимо выбирают из водорода, -СН3 или -С2Н5,
-(СН2)q-O-алкил(С1-C3), CH2CH2OH, q равно 1, 2 или 3; Rb независимо выбирают из водорода, -СН3 или -C2H5;
(b) фрагмента формулы
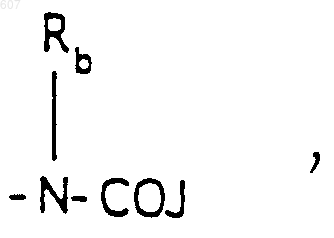
где J представляет Ra, алкил (C3-С8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил(C3-С8), разветвленный или неразветвленный, -O-алкенил(C3-С8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты
или -СН2-K', где K' представляет (C1-C3)алкоксигруппу, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
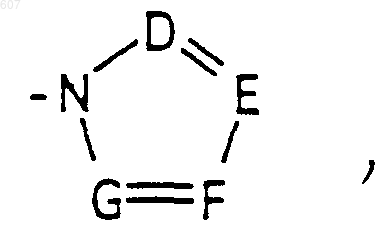
где D, Е, F и G выбирают из углерода или азота и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом, -СО- (C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой, -СO2-алкилом(С1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы
где Rc выбирают из галоида, (C1-C3)алкила, -O-алкил(C1-C3), ОН,
алкил(C1-C3), -S-алкил(C1-C3),

где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил(C3-C8), алкенил(C3-С8), -(СН2)p-циклоалкил(C3-C6), где М представляет О, S, NH, NСН3, и фрагмента -M-Rd, где Rd выбирают из фрагментов
где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения; где Аr' выбирают из фрагментов формул
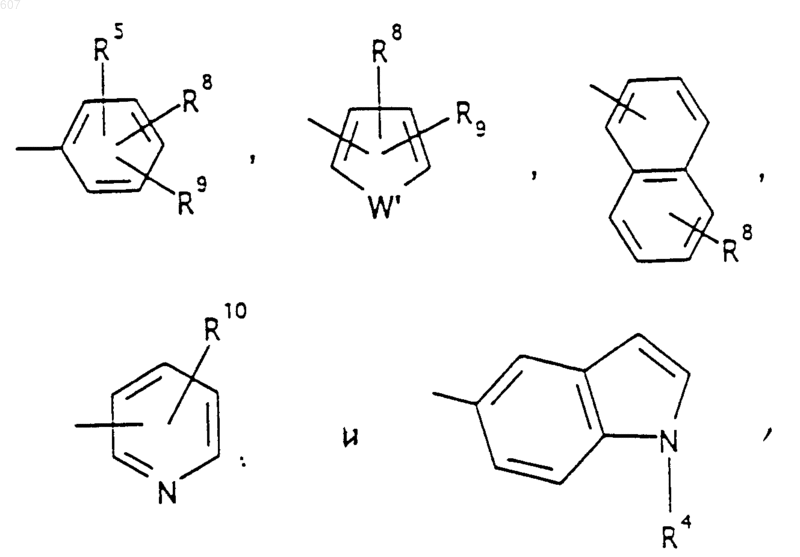
где W' выбирают из О, S, NH, N-алкил(C1-C3), NHCO-алкил(C1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) и СF3;
R8 и R9 независимо выбирают из водорода, алкила(C1-C3), -S-алкила(C1-C3), галоида, -NH-алкила(C1-C3), -N-[алкила (C1-C3)]3, -ОСF3, -ОН, -CN, -S-СF3, -NO2, -NH2, O-алкила(C1-C3), NHCO-алкила(C1-C3) -O-СО-алкила(C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила(C1-C3), -N[алкила (C1-C3)]2, -O-алкила(C1-C3), -N-(Rb) (CH2)q-N(Rb)2;
и его фармацевтически приемлемые соли.
15. Соединение по п.1 формулы
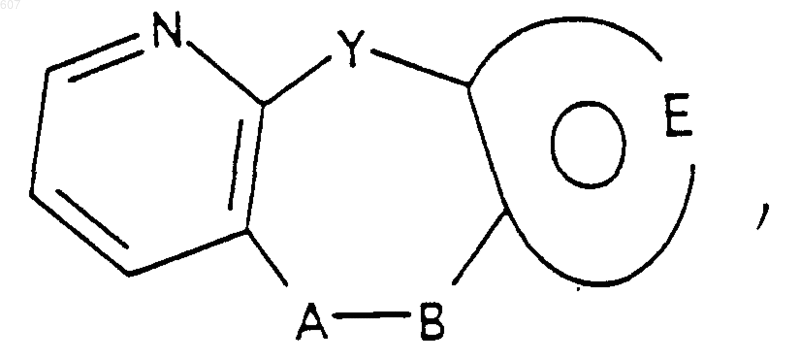
где Y представляет связь или -СН2-, А-В представляет

где n представляет целое число 1 или 2, при условии, что, если Y представляет связь, n представляет целое число 2;
и фрагмент
представляет 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О, N или S; где 5-членное гетероциклическое кольцо необязательно замещено (C1-C3)алкилом, галоидом или (C1-C3) алкокси;
R3 представляет -COAr, где Аr представляет фрагмент, выбранный из группы, состоящей из
где Х выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила(C1-C3);
R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R6 выбирают из
(а) фрагментов формул
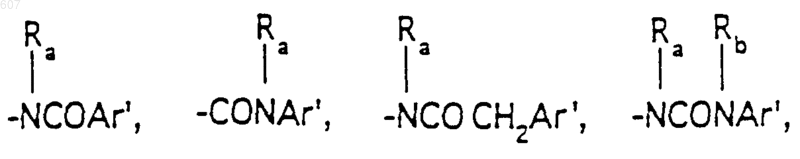
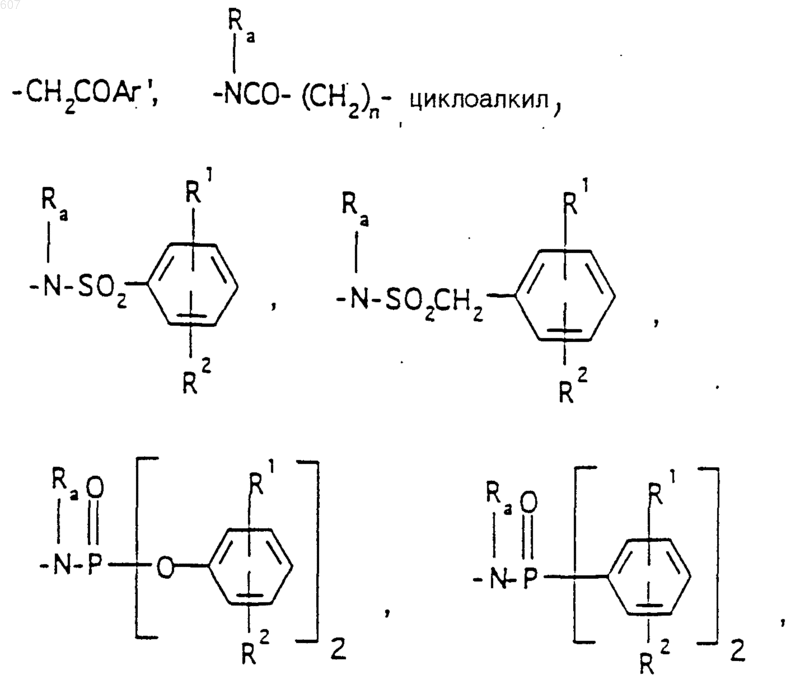
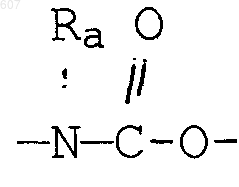
алкил(C3-C8), разветвленный или неразветвленный,
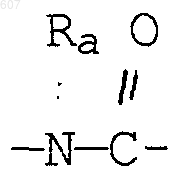
алкил(C3-С8), разветвленный или неразветвленный,

алкил(C3-С8), разветвленный или неразветвленный,
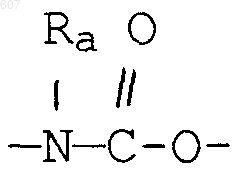
алкенил (C3-С8), разветвленный или неразветвленный,
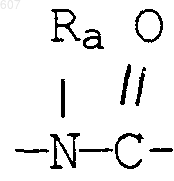
алкенил(C3-C8), разветвленный или неразветвленный,
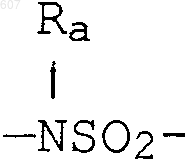
алкенил(C3-С8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-C6)циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -С2Н5,
-(CH2)q-O-алкил(С1-C3), СН2СН2OН, q равно 1, 2 или 3; Rb независимо выбирают из водорода, -СН3 или -C2H5;
(b) фрагмента формулы
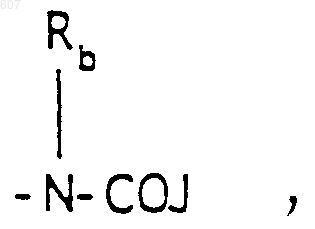
где J представляет Ra, алкил (C3-С8), разветвленный или неразветвленный, алкенил(C3-C8), разветвленный или неразветвленный, -O-алкил(C3-С8), разветвленный или неразветвленный, -O- алкенил (C3-C8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты
или -СН2-K', где K' представляет (C1-C3) алкокси, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
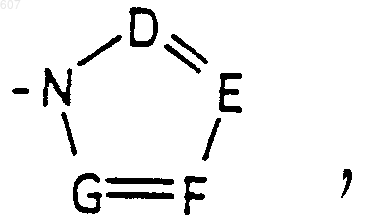
где D, Е, F и G выбирают из углерода или азота и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом, -СО-(C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой, -СO2-алкилом(С1-C3), a
Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы
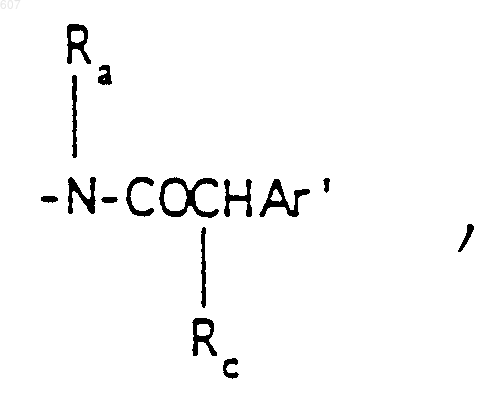
где Rc выбирают из галоида, (C1-C3)алкила, -O-алкил(C1-C3), ОН,
алкил(C1-C3), -S-алкил(C1-C3),
где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил (C3-С8), алкенил(C3-С8), -(СН2)p-циклоалкил(C3-C6),
где М представляет О, S, NH, NСН3, и фрагмента -M-Rd, где Rd выбирают из фрагментов
где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения;
где Аr' выбирают из фрагментов формул
где W' выбирают из О, S, NH, N-алкил(C1-C3), NHCO-алкил(С1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) ш СF3;
R8 и R9 независимо выбирают из водорода, алкила(C1-C3), -S-алкила(C1-C3), галоида, -NH-алкила(C1-C3), -N-[алкила (C1-C3)]2, -ОСF3, -ОН, -CN, -S-CF3, -NO2, -NH2, O-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила (C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила (C1-C3), -N[алкила (C1-C3)]2, -O-алкила (C1-C3), -N-(Rb) (CH2)q-N(Rb)2;
и его фармацевтически приемлемые соли.
16. Соединение по п.1 формулы
где Y представляет связь или -СН2-, А-В представляет
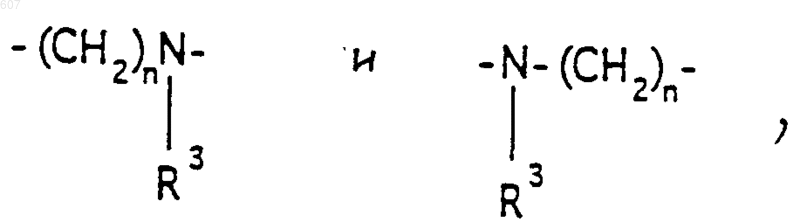
где n представляет целое число 1 или 2, при условии, что, если Y представляет связь, n представляет целое число 2;
и фрагмент
представляет 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота; где 5-членное гетероциклическое кольцо необязательно замещено (C1-C3)алкилом, галоидом или (C1-C3) алкоксигруппой;
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из
где X выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила(C1-C3);
R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида; R6 выбирают из
(а) фрагментов формул
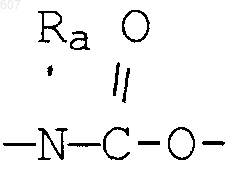
алкил(C3-С8), разветвленный или неразветвленный,
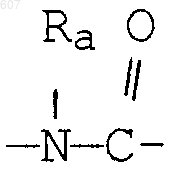
алкил(C3-С8), разветвленный или неразветвленный,
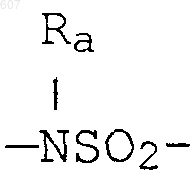
алкил(C3-C8), разветвленный или неразветвленный,
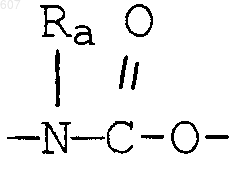
алкенил(C3-С8), разветвленный или неразветвленный,
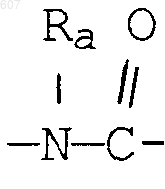
алкенил(C3-С8), разветвленный или неразветвленный,
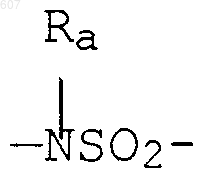
алкенил (C3-С8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-C6)циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -С2Н5,
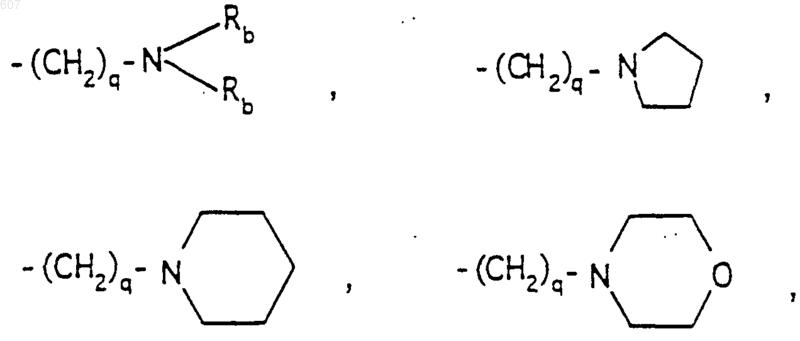
-(СН2)q-O-алкил(С1-C3), CH2CH2OH, q равно 1, 2 или 3; Rb независимо выбирают из водорода, -СН3 или -С2Н5;
(b) фрагмента формулы
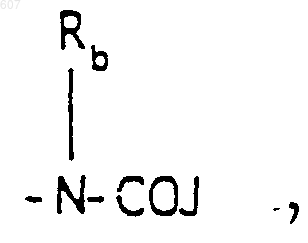
где J представляет Ra, алкил (C3-C8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил(C3-C8), разветвленный или неразветвленный, -O-алкенил(C3-C8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты

или -CH2-K', где K' представляет (C1-C3)алкоксигруппу, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
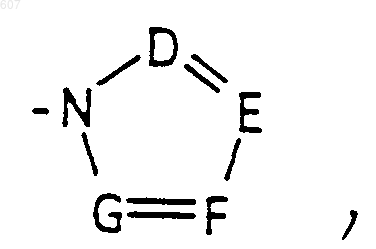
где D, Е, F и G выбирают из углерода или азота, и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом, -СО-(C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой -СO2-алкилом (C1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы

где Rc выбирают из галоида, (C1-C3)алкила, -O-алкил(C1-C3), ОН,
-алкил(C1-C3), -S-алкил(C1-C3),
где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил(C3-С8), алкенил(C3-С8), -(СН2)p-циклоалкил (C3-C6), где М представляет О, S, NH, NCH3, и фрагмента -M-Rd, где Rd выбирают из фрагментов
где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения;
где Аr' выбирают из фрагментов формул
где W' выбирают из О, S, NH, N-алкил (C1-C3), NHCO-алкил(C1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) и СF3;
R8 и R9 независимо выбирают из водорода, алкила(C1-C3), -S-алкила(C1-C3), галоида, -NH-алкила (C1-C3), -N-[алкила (C1-C3)]2, -ОСF3, -ОН, -CN, -S-CF3, -NO2, -NH2, О-алкила (C1-C3), NHCO-алкила(C1-C3), -О-СО-алкила (C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила(C1-C3), -N[алкила(C1-C3)]2, -О-алкила (C1-C3), -N-(Rb) (CH2)q-N(Rb)2;
и его фармацевтически приемлемые соли.
17 . Соединение по п.1 формулы
где Y представляет связь или -СН2-, А-В представляет
где n представляет целое число 1 или 2, при условии, что, если Y представляет связь, n представляет целое число 2;
ш фрагмент

представляет 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один атом азота вместе с либо одним атомом кислорода, либо одним атомом серы; 5-членное гетероциклическое кольцо необязательно замещено (C1-C3)алкилом, галоидом или (C1-C3) алкоксигруппой;
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из

где Х выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила(C1-C3);
R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R6 выбирают из
(а) фрагментов формул
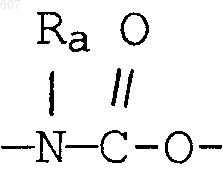
алкил(C3-C8), разветвленный или неразветвленный,
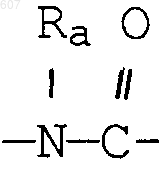
алкил(C3-C8), разветвленный или неразветвленный,
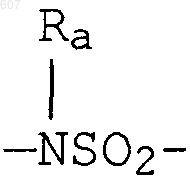
алкил(C3-С8), разветвленный или неразветвленный,
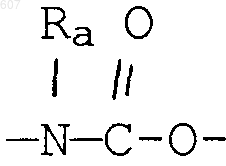
алкенил(C3-C8), разветвленный или неразветвленный,
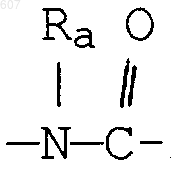
алкенил(C3-C8), разветвленный или неразветвленный,

алкенил(C3-С8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-С6)циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -С2Н5,
-(CH2)q-O-алкил(С1-C3), СН2СН2ОН, q равно 1, 2 или 3;
Rb независимо выбирают из водорода, -СН3 или -С2Н5;
(b) фрагмента формулы

где J представляет Ra, алкил (C3-С8) разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил(C3-C8), разветвленный или неразветвленный, -O-алкенил(C3-C8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты
или -СН2-K', где K' представляет (C1-C3)алкокси, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
где D, Е, F и G выбирают из углерода или азота, и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом, -СО- (C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой, -СО2-алкилом (C1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы
где Rc выбирают из галоида, (C1-C3) алкила, -O-алкил(C1-C3), ОН,
алкил (C1-C3), -S-алкил (C1-C3),
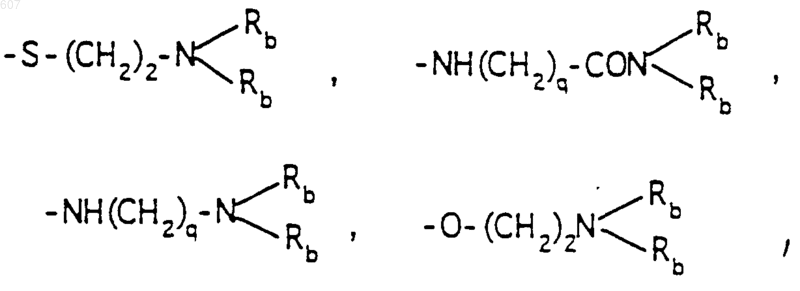
где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил(C3-С8), алкенил(C3-С8), -(СН2)p-циклоалкил(C3-C6),
где М представляет О, S, NH, NСН3, и фрагмента -M-Rd, где Rd выбирают из фрагментов
где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения; где Аr' выбирают из фрагментов формул
где W' выбирают из О, S, NH, N-алкил (C1-C3), NHCO-алкил(C1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) и СF3;
R8 и R9 независимо выбирают из водорода, алкила(C1-C3), -S-алкила (C1-C3), галоида, -NH-алкила(C1-C3), -N-[алкила (C1-C3)]2, -ОСF3, -ОН, -CN, -S-СF3, -NO2, -NH2, O-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила (C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила (C1-C3), -N[алкила (C1-C3)]2, -O-алкила (C1-C3), -N-(Rb) (CH2)q-N(Rb)2;
и его фармацевтически приемлемые соли.
18. Соединение по п.1 формулы

где Y представляет связь, А-В представляет

где n представляет целое число 2;
и фрагмент

представляет (1) ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3)алкила, галоида, амино-, (C1-C3)алкокси- или (C1-C3)алкиламиногруппы; (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О, N или S; (3) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота; (4) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один атом азота вместе с либо одним атомом кислорода, либо одним атомом серы; где 5- или 6-членные гетероциклические кольца необязательно замещены (C1-C3)алкилом, галоидом, или (C1-C3) алкоксигруппой;
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из
где Х выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила(C1-C3); R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R6 выбирают из
(а) фрагментов формул
алкил(C3-С8), разветвленный или неразветвленный,
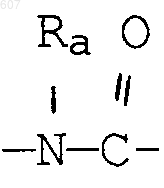
алкил(C3-C8), разветвленный или неразветвленный,
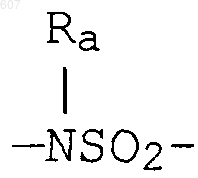
алкил (C3-C8), разветвленный или неразветвленный,
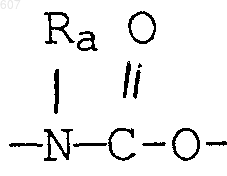
алкенил(C3-С8), разветвленный или неразветвленный,
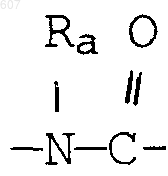
алкенил(C3-C8), разветвленный или неразветвленный,
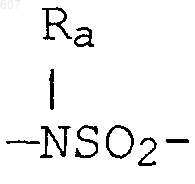
алкенил(C3-C8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-C6)циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -С2H5,
-(СН2)q-O-алкил (C1-C3), СН2СН2OН, q равно 1, 2 или 3; Rb независимо выбирают из водорода, -СН3 или -С2Н5;
(b) фрагмента формулы
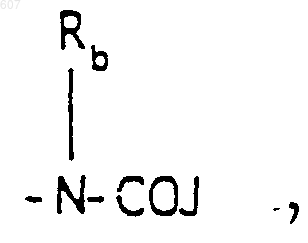
где J представляет Ra, алкил (C3-C8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил(C3-C8), разветвленный или неразветвленный, -O-алкенил(C3-C8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты


или -CH2-K', где K' представляет (C1-C3)алкоксигруппу, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо

где D, Е, F и G выбирают из углерода или азота, и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом, -СО-(C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой -СO2-алкилом (C1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы

где Rc выбирают из галоида, (C1-C3)алкила, -O-алкил(C1-C3), ОН,

-алкил(C1-C3), -S-алкил(C1-C3),

где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил(C3-С8), алкенил(C3-С8), -(СН2)p-циклоалкил (C3-C6), где М представляет О, S, NH, NCH3, и фрагмента -M-Rd, где Rd выбирают из фрагментов

где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения;
где Аr' выбирают из фрагментов формул

где W' выбирают из О, S, NH, N-алкил (C1-C3), NHCO-алкил(C1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) и СF3;
R8 и R9 независимо выбирают из водорода, алкила(C1-C3), -S-алкила(C1-C3), галоида, -NH-алкила (C1-C3), -N-[алкила (C1-C3)]2, -ОСF3, -ОН, -CN, -S-CF3, -NO2, -NH2, О-алкила (C1-C3), NHCO-алкила(C1-C3), -О-СО-алкила (C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила(C1-C3), -N[алкила(C1-C3)]2, -О-алкила (C1-C3), -N-(Rb) (CH2)q-N(Rb)2;
и его фармацевтически приемлемые соли.
17 . Соединение по п.1 формулы

где Y представляет связь или -СН2-, А-В представляет

где n представляет целое число 1 или 2, при условии, что, если Y представляет связь, n представляет целое число 2;
и фрагмент

представляет 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один атом азота вместе с либо одним атомом кислорода, либо одним атомом серы; 5-членное гетероциклическое кольцо необязательно замещено (C1-C3)алкилом, галоидом или (C1-C3) алкоксигруппой;
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из

где Х выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила(C1-C3);
R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R6 выбирают из
(а) фрагментов формул

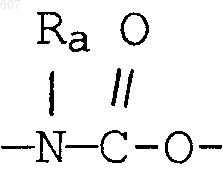
алкил(C3-C8), разветвленный или неразветвленный,
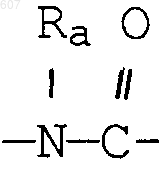
алкил(C3-C8), разветвленный или неразветвленный,
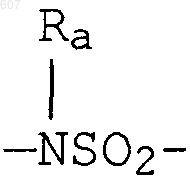
алкил(C3-С8), разветвленный или неразветвленный,
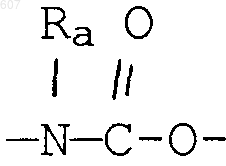
алкенил(C3-C8), разветвленный или неразветвленный,
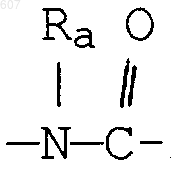
алкенил(C3-C8), разветвленный или неразветвленный,

алкенил(C3-С8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-С6)циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -С2Н5,

-(CH2)q-O-алкил(С1-C3), СН2СН2ОН, q равно 1, 2 или 3;
Rb независимо выбирают из водорода, -СН3 или -С2Н5;
(b) фрагмента формулы

где J представляет Ra, алкил (C3-С8) разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил(C3-C8), разветвленный или неразветвленный, -O-алкенил(C3-C8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты

или -СН2-K', где K' представляет (C1-C3)алкокси, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо

где D, Е, F и G выбирают из углерода или азота, и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом, -СО- (C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой, -СО2-алкилом (C1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы

где Rc выбирают из галоида, (C1-C3) алкила, -O-алкил(C1-C3), ОН,

алкил (C1-C3), -S-алкил (C1-C3),
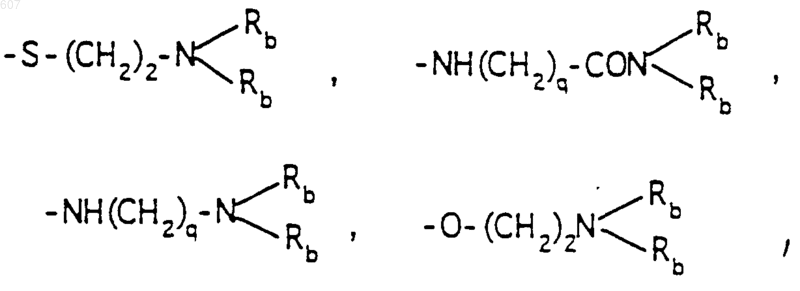
где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил(C3-С8), алкенил(C3-С8), -(СН2)p-циклоалкил(C3-C6),
где М представляет О, S, NH, NСН3, и фрагмента -M-Rd, где Rd выбирают из фрагментов

где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения; где Аr' выбирают из фрагментов формул


где W' выбирают из О, S, NH, N-алкил (C1-C3), NHCO-алкил(C1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) и СF3;
R8 и R9 независимо выбирают из водорода, алкила(C1-C3), -S-алкила (C1-C3), галоида, -NH-алкила(C1-C3), -N-[алкила (C1-C3)]2, -ОСF3, -ОН, -CN, -S-СF3, -NO2, -NH2, O-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила (C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила (C1-C3), -N[алкила (C1-C3)]2, -O-алкила (C1-C3), -N-(Rb) (CH2)q-N(Rb)2;
и его фармацевтически приемлемые соли.
18. Соединение по п.1 формулы

где Y представляет связь, А-В представляет

где n представляет целое число 2;
и фрагмент

представляет (1) ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3)алкила, галоида, амино-, (C1-C3)алкокси- или (C1-C3)алкиламиногруппы; (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О, N или S; (3) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота; (4) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один атом азота вместе с либо одним атомом кислорода, либо одним атомом серы; где 5- или 6-членные гетероциклические кольца необязательно замещены (C1-C3)алкилом, галоидом, или (C1-C3) алкоксигруппой;
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из

где Х выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила(C1-C3); R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R6 выбирают из
(а) фрагментов формул

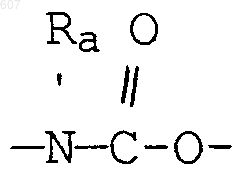
алкил(C3-С8), разветвленный или неразветвленный,
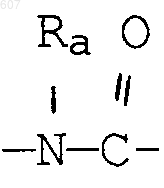
алкил(C3-C8), разветвленный или неразветвленный,
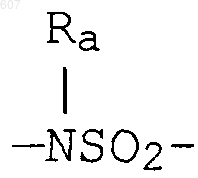
алкил (C3-C8), разветвленный или неразветвленный,
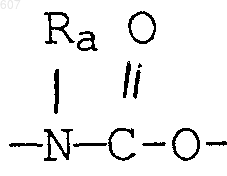
алкенил(C3-С8), разветвленный или неразветвленный,
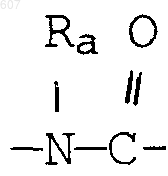
алкенил(C3-C8), разветвленный или неразветвленный,
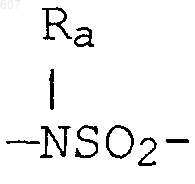
алкенил(C3-C8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-C6)циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -С2H5,

-(СН2)q-O-алкил (C1-C3), СН2СН2OН, q равно 1, 2 или 3; Rb независимо выбирают из водорода, -СН3 или -С2Н5;
(b) фрагмента формулы
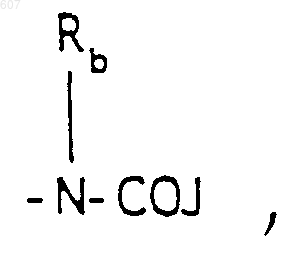
уфх J представляет Ra, алкил (C3-С8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил (C3-С8), разветвленный или неразветвленный, -O-алкенил(C3-C8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты
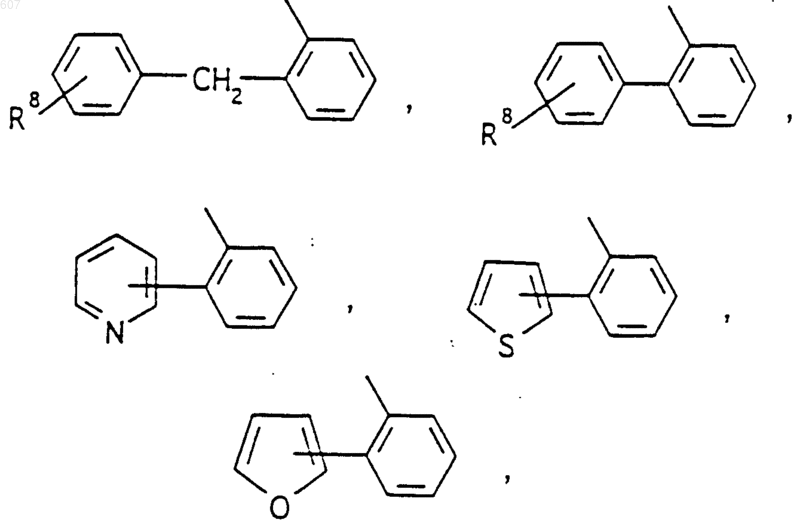
или -СН2-K', где K' представляет (C1-C3)алкоксигруппу, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
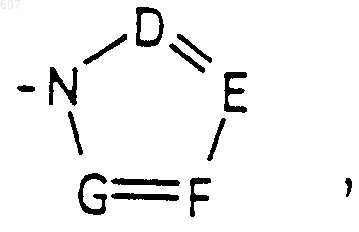
где D, E, F и G выбирают из углерода или азота, и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом, -СО-(C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой, -СO2-алкилом (C1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы
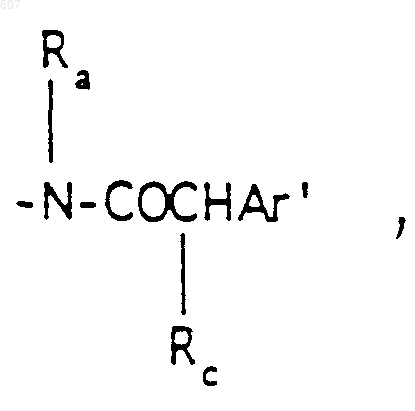
где Rc выбирают из галоида, (C1-C3) алкила, -O-алкил(C1-C3), ОН,
алкил(C1-C3), -S-алкил(C1-C3),
где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил(C3-С8), алкенил(C3-С8), -(СН2)p-циклоалкил(C3-C6),
где М представляет О, S, NH, NСН3, и фрагмента -M-Rd, где Rd выбирают из фрагментов

где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения;
где Аr' выбирают из фрагментов формул
где W' выбирают из О, S, NH, N-алкил (C1-C3), NHCO-алкил(C1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) и СF3;
R8 и R9 независимо выбирают из водорода, алкила(C1-C3), -S-алкила(C1-C3), галоида, -NH-алкила(C1-C3), -N-[алкила(C1-C3)]2, -ОСF3, -ОН, -CN, -S-СF3, -NO2, -NH2, O-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила (C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила(C1-C3), -N[алкила (C1-C3)]2, -O-алкила (C1-C3), -N-(Rb) (CH2)q-N(Rb)2;
и его фармацевтически приемлемые соли.
19. Соединение по п.1 формулы
где Y представляет связь или -СН2-, А-В представляет

где n представляет целое число 1 или 2, при условии, что, если, Y представляет связь, n представляет целое число 2;
и фрагмент
представляет (1) ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3)алкила, галоида, амино-, (C1-C3)алкокси- или (C1-C3)алкиламиногруппы; (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О, N или S; (3) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота; (4) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один атом азота вместе с либо одним атомом кислорода, либо одним атомом серы; где 5- или 6-членные гетероциклические кольца необязательно замещены (C1-C3)алкилом, галоидом или (C1-C3) алкоксигруппой;
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из
где Х выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила(C1-C3);
R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R6 выбирают из
(а) фрагментов формул

алкил(C3-С8), разветвленный или неразветвленный,
алкил(C3-С8), разветвленный или неразветвленный,
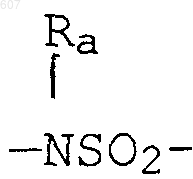
алкил(C3-С8), разветвленный или неразветвленный,
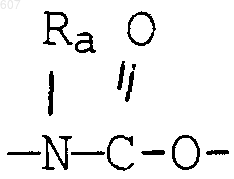
алкенил(C3-С8), разветвленный или неразветвленный,
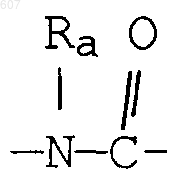
алкенил(C3-С8), разветвленный или неразветвленный,
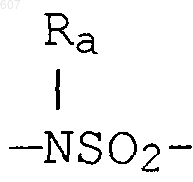
алкенил(C3-С8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-C6)циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -C2H5,
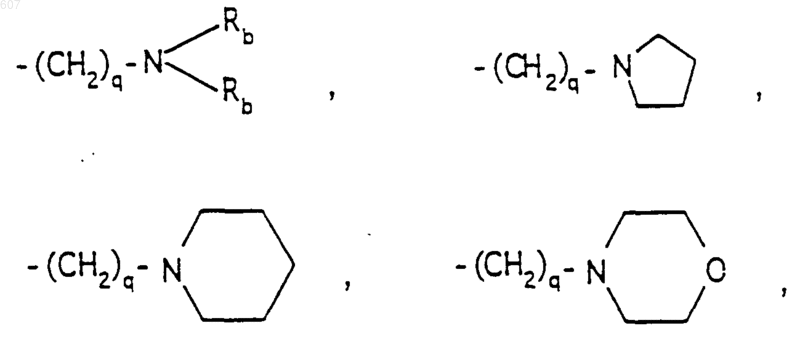
-(СН2)q-O-алкил(C1-C3), СН2СН2OН, q равно 1, 2 или 3;
Rb независимо выбирают из водорода, -СН3 или -С2H5;
(b) фрагмента формулы

где J представляет Ra, алкил (C3-С8), разветвленный или неразветвленный, алкенил(C3-C8), разветвленный или неразветвленный, -O-алкил(C3-С8), разветвленный или неразветвленный, -O-алкенил(C3-С8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты
или -CH2-K', где K' представляет (C1-C3)алкоксигруппу галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
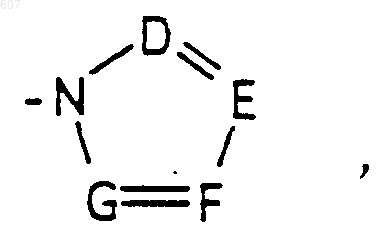
где D, Е, F и G выбирают из углерода или азота и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом, -СО-(C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой -СO2-алкилом (C1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы
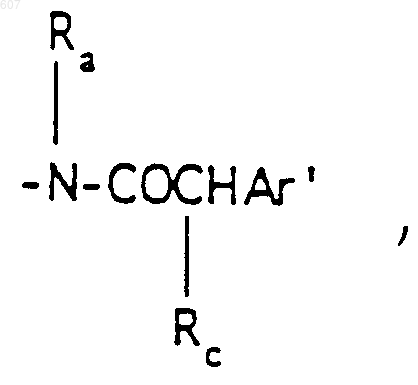
где Rc выбирают из галоида, (C1-C3)алкила, -O-алкил(C1-C3), ОН,
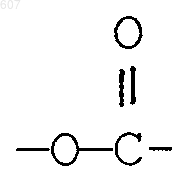
алкил(C1-C3), -S-алкил(C1-C3),
где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил(C3-С8), алкенил(C3-C8), -(СН2)p-циклоалкил(C3-C6),
где М представляет О, S, NH, NСН3, и фрагмента -M-Rd, где Rd выбирают из фрагментов
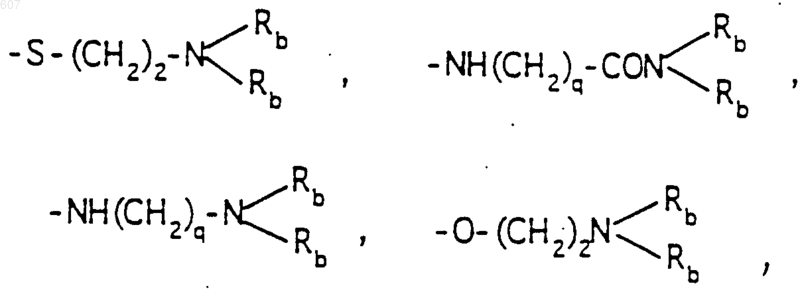
где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения;
где Аr' выбирают из фрагментов формул
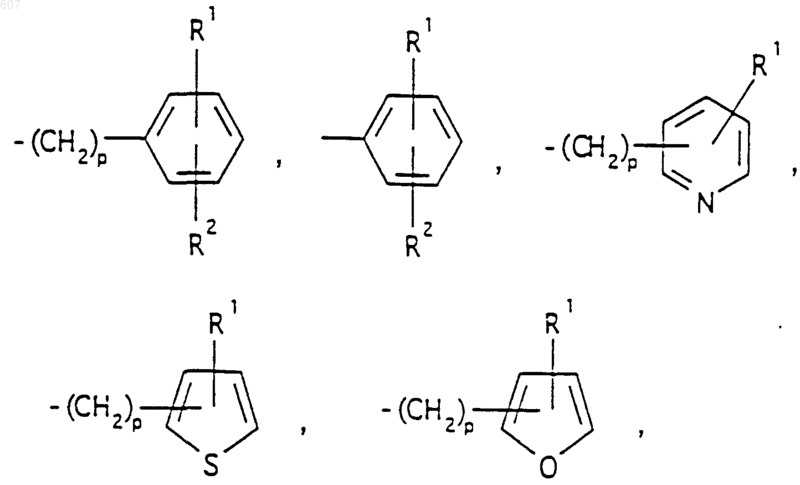
где W' выбирают из О, S, NH, N-алкил (C1-C3), NHCO-алкил(C1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) и СF3; R8 и R9 независимо выбирают из водорода, алкила(C1-C3), -S-алкила (C1-C3), галоида, -NH-алкила(C1-C3), -N-[алкила (C1-C3)]2, -ОСF3, -ОН, -CN, -S-СF3, -NO2, -NH2, O-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила (C1-C3) и СF3; и R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила(C1-C3), -N[алкила(C1-C3)]2, -O-алкила (C1-C3), -N-(Rb) (CH2)q-N(Rb)2;
и его фармацевтически приемлемые соли.
20. Соединение по п.1 формулы
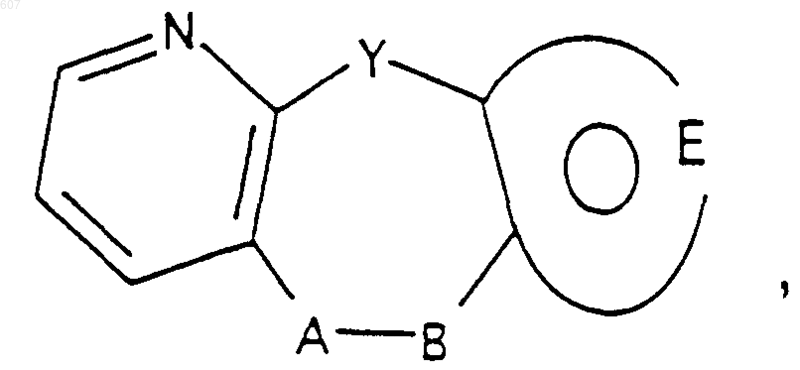
где Y представляет О, S, NH, N-алкил(C1-C6), -NCO-алкил(C1-C6);
А-В представляет
где n представляет целое число 1;
и фрагмент
представляет (1) ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3) алкила, галоида, амино-, (C1-C3)алкокси- или (C1-C3)алкиламиногруппы; (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О, N или S; (3) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота; (4) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один атом азота вместе с либо одним атомом кислорода, либо одним атомом серы; где 5- или 6-членные гетероциклические кольца необязательно замещены (C1-C3)алкилом, галоидом или (C1-C3) алкоксигруппой;
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из

где Х выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила(C1-C3);
R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R6 выбирают из
(а) фрагментов формул

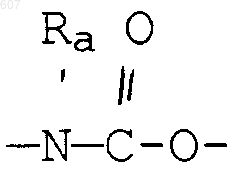
алкил(C3-C8), разветвленный или неразветвленный,
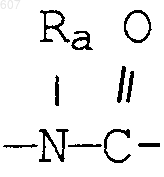
алкил(C3-С8), разветвленный или неразветвленный,
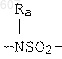
алкил(C3-С8), разветвленный или неразветвленный,
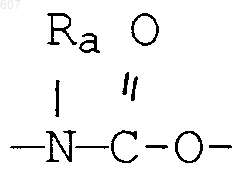
алкенил(C3-C8), разветвленный или неразветвленный,
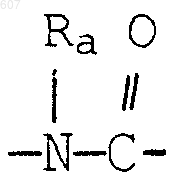
алкенил(C3-С8), разветвленный или неразветвленный,
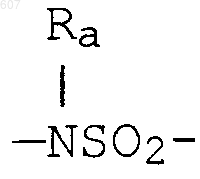
алкенил(C3-С8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-C6)циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -С2Н5,
-(CH2)q-O-алкил(С1-C3), СН2СН2OН, q равно 1, 2 или 3;
Rb независимо выбирают из водорода, -СН3 или -С2Н5;
(b) фрагмента формулы
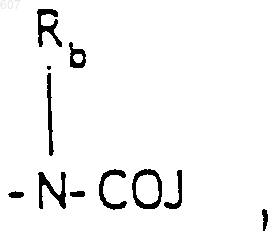
где J представляет Ra, алкил (C3-С8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил(C3-С8), разветвленный или неразветвленный, -O-алкенил(C3-С8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты
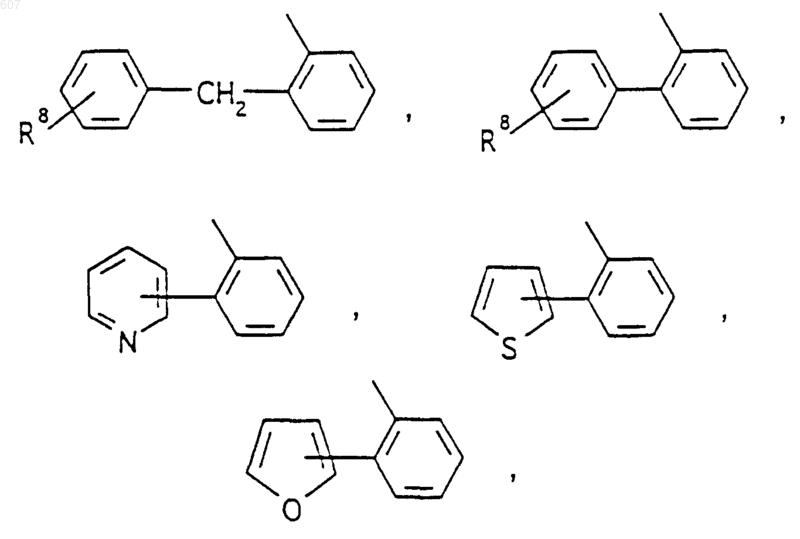
или -СН2-K', где K' представляет (C1-C3)алкоксигруппу, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
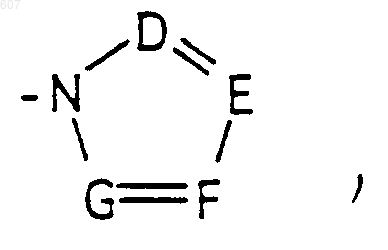
где D, Е, F и G выбирают из углерода или азота и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом, -СО-(C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой, -СО2-алкилом(С1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы
где Rc выбирают из галоида, (C1-C3) алкила, -O-алкил(C1-C3), ОН,
алкил(C1-C3), -S-алкил(C1-C3),
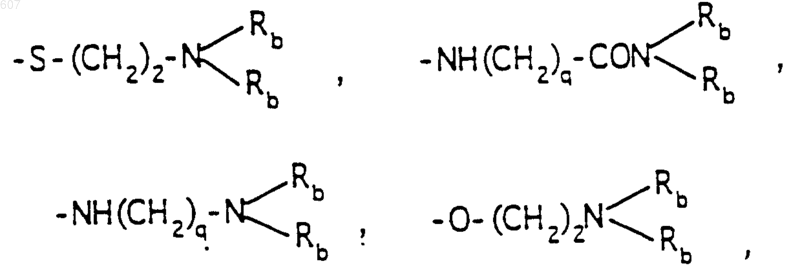
где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
М - Rd,
где Rd представляет алкил(C3-С8), алкенил(C3-С8), -(СН2)p-циклоалкил (C3-C6),
где М представляет О, S, NH, NСН3 и фрагмента -M-Rd, где Rd выбирают из фрагментов

где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения;
где Аr' выбирают из фрагментов формул
где W' выбирают из О, S, NH, N-алкил(C1-C3), NНСО-алкил(С1-C3) и NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила (C1-C3), галоида, O-алкила (C1-C3) и СF3;
R8 и R9, независимо, выбирают из водорода, алкила(C1-C3), -S-алкила(C1-C3), галоида, -NH-алкила(C1-C3), -N-[алкила(C1-C3)]2, -ОСF3, -ОН, -CN, -S-СF3, -NO2, -NH2, O-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила (C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила(C1-C3), -N[алкила(C1-C3)]2, -O-алкила (C1-C3), -N-(Rb) (CH2)q-N(Rb)2;
и его фармацевтически приемлемые соли.
21. Соединение по п.1 формулы
где Y представляет связь, -CH2-, О, S, NH, N-алкил (C1-C6), -NCO-алкил(C1-C6); А-В представляет

где n представляет целое число 1 или 2, при условии, что когда Y представляет связь, а n равно целому числу 2;
и фрагмент
представляет (1) ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3)алкила, галоида, амино-, (C1-C3)алкокси- или (C1-C3)алкиламиногруппы; (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О, N или S; (3) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота; (4) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один атом азота вместе с либо одним атомом кислорода, либо одним атомом серы; где 5- или 6-членные гетероциклические кольца необязательно замещены (C1-C3)алкилом, галоидом или (C1-C3) алкоксигруппой;
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из
где X выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила(C1-C3);
R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R6 выбирают из
(а) фрагментов формул
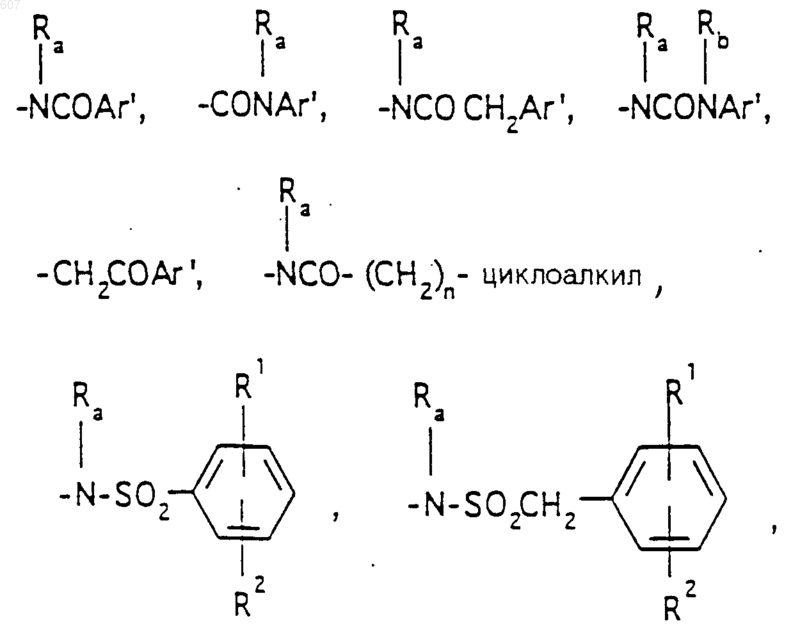
алкил(C3-C8), разветвленный или неразветвленный,
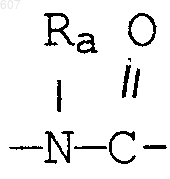
алкил(C3-C8), разветвленный или неразветвленный,
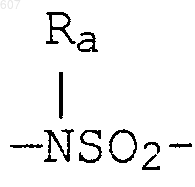
алкил(C3-C8), разветвленный или неразветвленный,
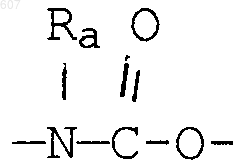
алкенил(C3-С8), разветвленный или неразветвленный,
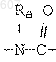
алкенил(C3-С8), разветвленный или неразветвленный,
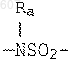
алкенил (C3-C8), разветвленный или нераз ветвленный,
где циклоалкил определен как (C3-C6)циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -С2Н5,
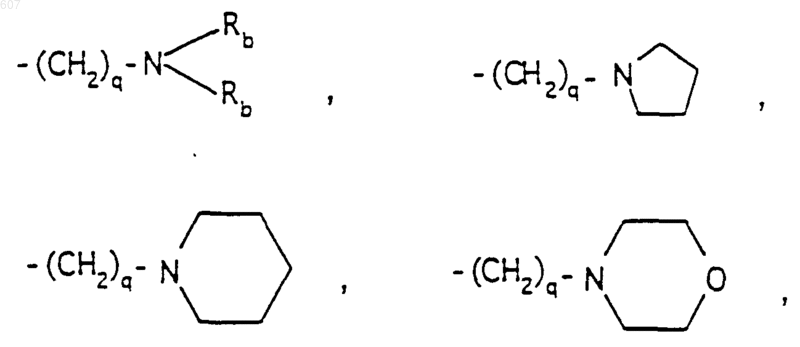
-(СН2)q-O-алкил (C1-C3), CH2CH2OH, q равно 1, 2 или 3;
Rb независимо выбирают из водорода, -СН3 или -С2Н5;
(b) фрагмента формулы
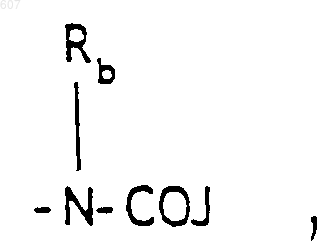
где J представляет Ra, алкил (C3-C8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил(C3-С8), разветвленный или неразветвленный, -O-алкенил(C3-C8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты

или -CH2-K', где K' представляет (C1-C3)алкоксигруппу галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
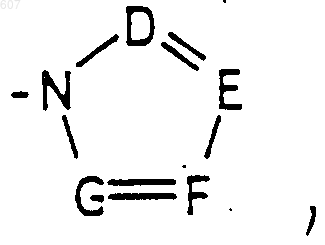
где D, Е, F и G выбирают из углерода или азота, и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом, -СО- (C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой, -CO2-алкилом (C1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы

где Rc выбирают из галоида, (C1-C3)алкила, -O-алкил (C1-C3), ОН,
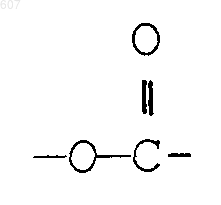
алкил(C1-C3), -S-алкил(C1-C3),
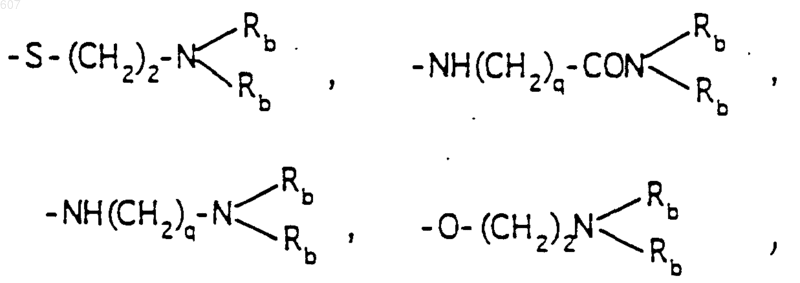
где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил(C3-C8), алкенил(C3-C8), -(CH2)p-циклоалкил (C3-С6),
где М представляет О, S, NH, NСН3, и фрагмента -M-Rd, где Rd выбирают из фрагментов
где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения;
где Аr' выбирают из фрагментов формул
где W' выбирают из О, S, NH, N-алкил (C1-C3), NHCO-алкил(С1-C3) и NSO2-алкил (C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, О-алкила (C1-C3) и СF3;
R8 и R9 независимо выбирают из водорода, алкила (C1-C3), -S-алкила(C1-C3), галоида, -NH-алкила (C1-C3), -N-[алкила(C1-C3)]2, -ОСF3, -ОН, -CN, -S-СF3, -NO2, -NH2, О-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила (C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила(C1-C3), -N[алкила(C1-C3)]2, -О-алкила(C1-C3), -N-(Rb)(CH2)q-N(Rb)2;
и его фармацевтически приемлемые соли.
22. Соединение по п.1 формулы
где Y представляет связь или -CH2-, А-В представляет
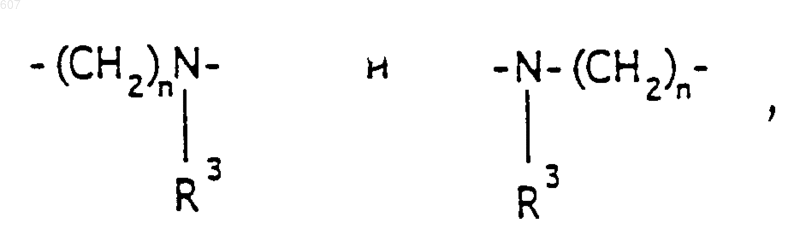
где n представляет целое число 1 или 2, при условии, что, если Y представляет связь, n представляет целое число 2;
и фрагмент
представляет (1) ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3)алкила, галоида, аминов (C1-C3)алкокси- или (C1-C3)алкиламиногруппы; (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О, N или S; (3) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота; (4) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один атом азота вместе с либо одним атомом кислорода, либо одним атомом серы; где 5- или 6-членные гетероциклические кольца необязательно замещены (C1-C3)алкилом, галоидом, или (C1-C3) алкоксигруппой;
R3 представляет -СОАr, где Аr представляет фрагмент, выбранный из группы, состоящей из
где X выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила(C1-C3);
R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида; R6 выбирают из
(а) фрагментов формул
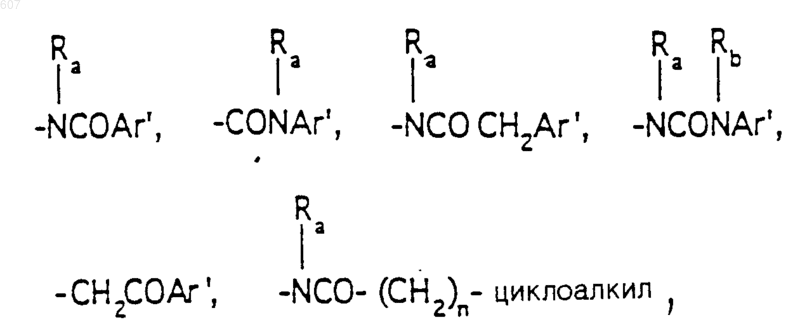
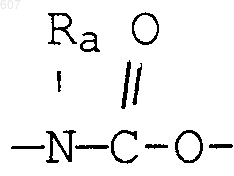
алкил(C3-C8), разветвленный или неразветвленный,
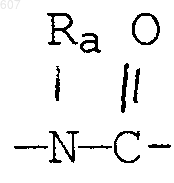
алкил(C3-C8), разветвленный или неразветвленный,
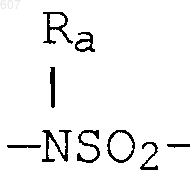
алкил(C3-C8), разветвленный или неразветвленный,
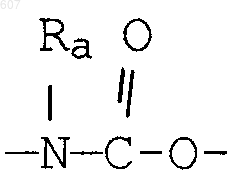
алкенил(C3-С8), разветвленный или неразветвленный,
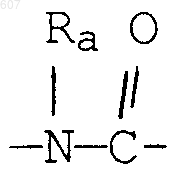
алкенил(C3-С8), разветвленный или неразветвленный,
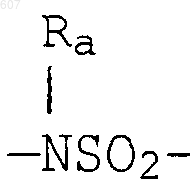
алкенил(C3-С8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-C6)циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -C2H5,
-(CH2)q-O-алкил (C1-C3), CH2CH2OН, q равно 1, 2 или 3;
Rb независимо выбирают из водорода, -СН3 или -C2Н5;
(b) фрагмента формулы
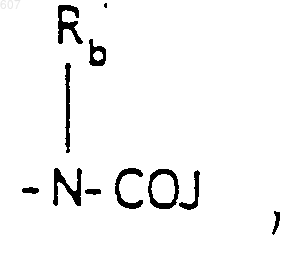
где J представляет Ra, алкил (C3-C8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил(C3-С8), разветвленный или неразветвленный, -O-алкенил(C3-С8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты
или -CH2-K', где K' представляет (C1-C3)алкоксигруппу, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо
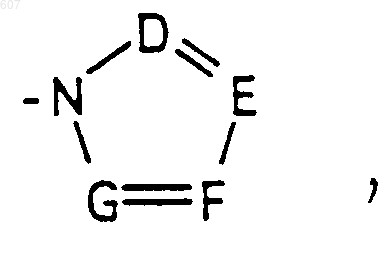
где D, Е, F и G выбирают из углерода или азота, и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом, -СО-(C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой, -СО2-алкилом(С1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы
где Rc выбирают из галоида, (C1-C3) алкила, -O-алкил(C1-C3), ОН,
алкил(C1-C3), -S-алкил(C1-C3),
где Ra и Rb имеют указанные ранее значения,
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил(C3-C8), алкенил(C3-C8), -(CH2)p-циклоалкил (C3-C6),
где М представляет О, S, NH, NСН3, и фрагмента -M-Rd, где Rd выбирают из фрагментов:
где р принимает значения от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения;
где Аr' выбирают из фрагментов формул
где W' выбирают из О, S, NH, N-алкил (C1-C3), NHCO-алкил(С1-C3) ш NSO2-алкил(C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) и СF3;
R8 и R9 независимо выбирают из водорода, алкила(C1-C3), -S-алкила (C1-C3), галоида, -NH-алкила(C1-C3), -N-[алкила(C1-C3)]2, -ОСF3, -ОН, -CN, -S-СF3, -NO2, -NH2, O-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила (C1-C3) и СF3; и
R10 выбирают из водорода, галоида, алкила (C1-C3), -NH-алкила(C1-C3), -N[алкила(C1-C3)]2, -O-алкила (C1-C3), -N-(Rb) (CH2)q-N(Rb)2;
и его фармацевтически приемлемые соли.
23. Соединение по п.1 представляет собой
N-[4-[(4,5-дигидропиразоло[3,4-d]тиено[3,2-b]азепин-6(1Н)-ил)карбонил]фенил]-2-хлор-4-фторбензамид,
N-[4-[(4,5-дигидропиразоло[3,4-d]тиено[3,2-b]азепин-6(1H)-ил)карбонил]фенил]-5-фтор-2-метилбензамид,
N-[4-[(4,5-дигидропиразоло[3,4-d]тиено[3,2-b]азепин-6(1Н)-ил)карбонил]-3-хлорфенил]-5-фтор-2-метилбензамид,
N-[4-[(4,5-дигидропиразоло[3,4-d]тиено[3,2-b]азепин-6(1Н)-ил)карбонил]-3-хлорфенил]-5-хлор-2-фторбензамид,
N-[4-[(4,5-дигидро-2-метилпиразоло[3,4-d]тиено[3,2-b]азепин-6(2Н)-ил)карбонил]фенил]-2,4-дихлорбензамид,
N-[4-[(4,5-дигидро-2-метилпиразоло[3,4-d]тиено[3,2-b]азепин-6(2Н)-ил)карбонил]фенил]циклогексан,
N-[4-[(4,5-дигидропиразоло[3,4-d]тиено[3,2-b]азепин-6(2Н)-ил)карбонил]фенил]-2-метилбензамид,
N-[5-[(4,5-дигидропиразоло[3,4-d]тиено[3,2-b]азепин-6(1Н)-ил)карбонил]-2-пиридинил]-2-хлор-4-фторбензамид,
N-[5-[(4,5-дигидропиразоло[3,4-d]тиено[3,2-b]азепин-6(1H)-ил)карбонил]-2-пиридинил]-5-фтор-2-метилбензамид,
N-[5-[(4,5-дигидропиразоло[3,4-d]тиено[3,2-b]азепин-6(1Н)-ил)карбонил]-2-пиридинил]-5-хлор-2-фторбензамид,
N-[5-[(4,5-дигидропиразоло[3,4-d]тиено[3,2-b]азепин-6(1Н)-ил)карбонил]-2-пиридинил]-3-фтор-2-метилбензамид,
N-[5-[(4,5-дигидропиразоло[3,4-d]тиено[3,2-b]азепин-6(1Н)-ил)карбонил]-3-хлор-2-пиридинил]-5-фтор-2-метилбензамид,
N-[5-[(4,5-дигидропиразоло[3,4-d]тиено[3,2-b]азепин-6(1Н)-ил)карбонил]-2-пиридинил]-2-хлор-6-фторбензамид,
N-[4-[(4,5-дигидропиразоло[3,4-d]тиено[3,2-b]азепин-6(1Н)-ил)карбонил]-3-фенил]-2-(диметиламино)пиридин-3-карбоксамид,
N-[5-[(4,5-дигидропиразоло[3,4-d]тиено[3,2-b]азепин-6(1Н)-ил)карбонил]-2-пиридинил]-2-(метиламино)пиридин-3-карбоксамид,
N-[4-[(4,5-дигидропиразоло[3,4-d]пиридо[3,2-b]азепин-6(1Н)-ил)карбонил]фенил]-5-фтор-2-метилбензамид,
N-[4-[(4,5-дигидропиразоло[3,4-d]пиридо[3,2-b]азепин-6(1Н)-ил)карбонил]-3-хлорфенил]-5-фтop-2-мeтилбeнзамид,
N-[4-[(4,5-дигидропиразоло[3,4-d]пиридо[3,2-b]азепин-6(1Н)-ил)карбонил]-3-хлорфенил]-2-метилпиридин-3-карбоксамид,
N-[5-[(4,5-дигидропиразоло[3,4-d]пиридо[3,2-b]азепин-6(1H)-ил)карбонил]-2-пиридинил]-5-фтор-2-метилбензамид,
N-[5-[(4,5-дигидропиразоло[5,4-d]пиридо[3,2-b]азепин-6(1Н)-ил)карбонил]-2-пиридинил]-5-xлoр-2-фтopбeнзамид,
N-[4-[(4,5-дигидропиразоло[3,4-d]пиридо[3,2-b]азепин-6(1H)-ил)карбонил]-3-хлорфенил][1,1'-бифенил]-2-карбоксамид,
N-[5-[(4,5-дигидропиразоло[3,4-d]пиридо[3,2-b]азепин-6(1Н)-ил)карбонил]-2-пиридинил][1,1'-бифенил]-2-карбоксамид,
N-[5-[(4,5-дигидропиразоло[3,4-d]пиридо[3,2-b]азепин-6(1Н)-ил)карбонил]-2-пиридинил]-2-(диметиламино)пиридин-3-карбоксамид,
N-[4-[(4,5-дигидропиразоло[3,4-d]пиридо[2,3-b]азепин-6(1H)-ил)карбонил]-фенил]-5-фтор-2-метилбензамид,
N-[4-[(4,5-дигидропиразоло[3,4-d]пиридо[2,3-b]азепин-6(1H)-ил)карбонил]-3-хлорфенил]-5-фтор-2-метилбензамид,
N-[5-[(4,5-дигидропиразоло[3,4-d]пиридо[2,3-b]азепин-6(1H)-ил)карбокил]-2-пиридинил]-5-фтор-2-метилбензамид,
N-[5-[(4,5-дигидропиразоло[3,4-d]пиридо[2,3-b]азепин-6(1H-ил)карбонил]-2-пиридинил]-2-(диметиламино)пиридин-3-карбоксамид,
N-[4-[(4,5-дигидропиразоло[3,4-d]пиридо[2,3-b]азепин-6(1H)-ил)карбонил]-3-хлорфенил]-2-хлорпиридин-3-карбоксамид,
N-[4-[(4,10-дигидро-5Н-пиридо[3,2-b]тиено[2,3-е]азепин-5-ил)карбонил]-3-хлорфенил]-5-фтор-2-метилбензамид,
N-[4-[(4,10-дигидро-5Н-пиридо[3,2-b]тиено[2,3-е]азепин-5-ил)карбонил]фенил]-2-(диметиламино)пиридин-3-карбоксамид,
N-[5-[(4,10-дигидро-5Н-пиридо[3,2-b]тиено[2,3-е]азепин-5-ил)карбонил]-2-пиридинил]-5-фтор-2-метилбензамид,
N-[4-[(5,10-дигидро-5Н-пиридо[3,2-b]тиено[3,2-е]азепин-5-ил)карбонил]-3-хлорфенил]-5-фтор-2-метилбензамид,
N-[4-[(6,10-дигидро-5Н-пиридо[3,2-b]тиено[3,2-е]азепин-5-ил)карбонил]фенил]-2-(диметиламино)пиридин-3-карбоксамид,
N-[5-[(6,10-дигидро-5Н-пиридо[3,2-b]тиено[3,2-е]азепин-5-ил)карбонил]-2-пиридинил]-5-фтор-2-метилбензамид,
N-[4-[(6,7-дигидро-5Н-пиридо[3,2-b]тиено[2,3-d]aзепин-5-ид)карбонил]фенил]-5-фтор-2-метилбензамид.
24. Фармацевтическая композиция для лечения заболеваний, характеризующихся избыточной реабсорбцией почками воды, таких, как застойная сердечная недостаточность, цирроз печени, нефротический синдром, поражения центральной нервной системы, болезни легких и гипонатремия у млекопитающих, отличающаяся тем, что содержит подходящий фармацевтический носитель и в качестве активного соединения эффективное количество трициклического бензазепина общей формулы I по п.1.
25. Способ лечения заболеваний, характеризующихся избыточной реабсорбцией почками воды, таких, как застойная сердечная недостаточность, цирроз печени, нефротический синдром, поражения центральной нервной системы, болезнь легких и гипонатремия у млекопитающих, отличающийся тем, что включает введение указанному млекопитающему соединения по пункту 1 в количестве, эффективном для облегчения заболевания.
26. Способ получения соединения формулы
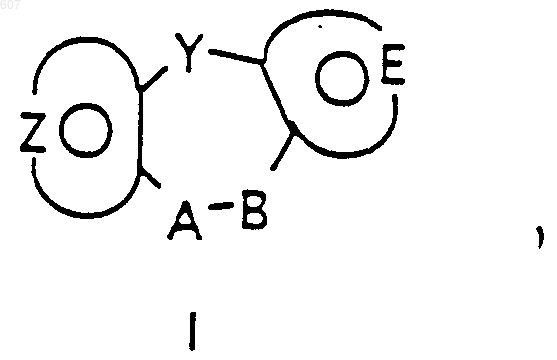
где Y представляет связь или фрагмент, выбранный из -CH2-, -СНОН, -СНО-алкил(C1-C6), -CH-S-алкил(С1-C6), -CHNH2, -СНN-алкил(C1-C6), -С[N-алкил(C1-C6)]2,
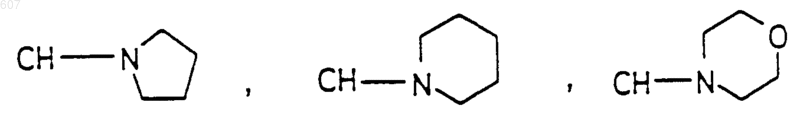
-СНОСО-алкил(С1-C6), -CHNH(CH2)mNH2, -CHNH(CH2)m -NH-алкил(C1-C6), -CHNH(CH2)m-N[алкил(C1-С6)]2; -СНNН(CH2)m-S-алкил(C1-C6), -CHNH(CH2)m-O-алкил(C1-C6),
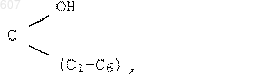
S, О, -NH, -N-алкил(C1-C6), -NCO-алкил (C1-C6),
m представляет целое число от 2 до 6;
А-В представляет фрагмент, выбранный из
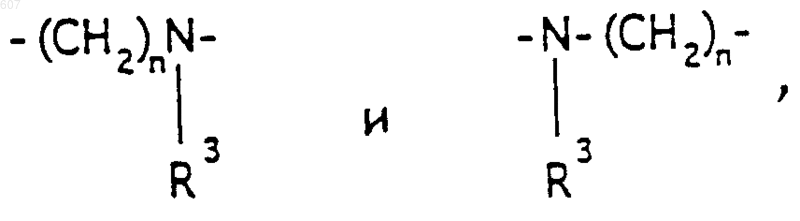
где n представляет целое число 1 или 2, при условии, что, если Y представляет связь, n представляет целое число 2;
и фрагмент
представляет: (1) ненасыщенное 6-членное ароматическое гетероциклическое кольцо, содержащее один атом азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3) алкила, галоида, амино-, (C1-C3) алкокси- или (C1-C3) алкиламиногруппы; (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О или S;
и фрагмент

представляет: (1) ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один или фтр атома азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3)алкила, галоида, амино-, (C1-C3) алкокси- или (C1-C3)алкиламиногруппы; (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О, N или S; (3) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота; (4) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один атом азота вместе с либо одним атомом кислорода, либо одним атомом серы; где 5- или 6-членные гетероциклические кольца необязательно замещены (C1-C3)алкилом, галоидом или (C1-C3) алкоксигруппой;
R3 представляет -COAr, где Аr представляет фрагмент, выбранный из группы, состоящей из
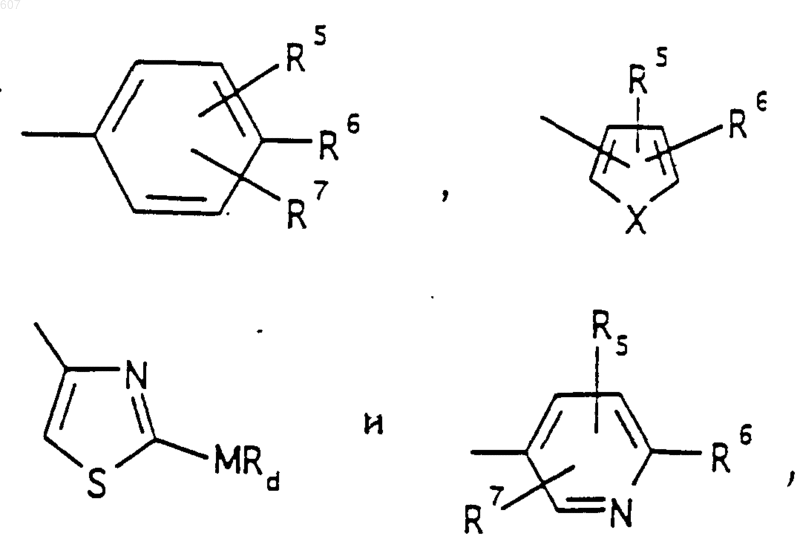
где Х выбирают из О, S, -NH, -N-СН3 и -NСОСН3;
R4 выбирают из водорода, алкила(C1-C3), -СО-алкила (C1-C3);
R1 и R2 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R5 выбирают из водорода, (C1-C3)алкила, (C1-C3)алкоксигруппы и галоида;
R6 выбирают из
(а) фрагментов формул

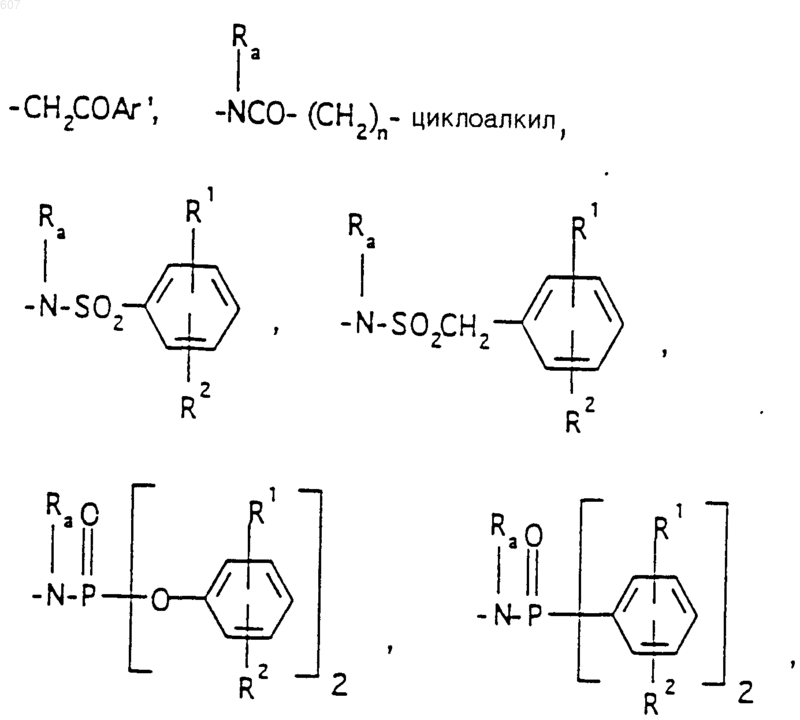
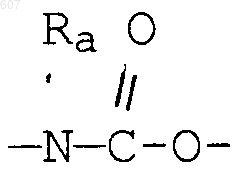
алкил(C3-С8), разветвленный или неразветвленный,
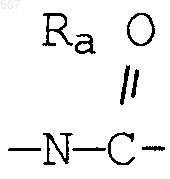
алкил(C3-С8), разветвленный или неразветвленный,
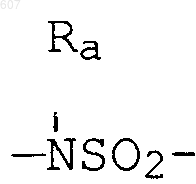
алкил(C3-C8), разветвленный или неразветвленный,
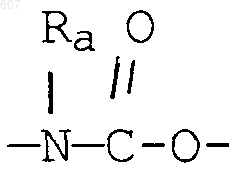
алкенил(C3-С8), разветвленный или неразветвленный,

алкенил(C3-C8), разветвленный или неразветвленный,
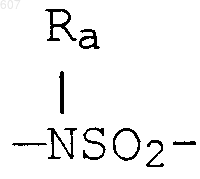
алкенил (C3-C8), разветвленный или неразветвленный,
где циклоалкил определен как (C3-C6)циклоалкил, циклогексенил или циклопентенил, a Ra независимо выбирают из водорода, -СН3 или -C2H5,
-(CH2)q-O-алкил(С1-C3), -CH2CH2OH, q равно 1, 2 или 3, Rb независимо выбирают из водорода, -СН3 или -C2H5;
(b) фрагмента формулы
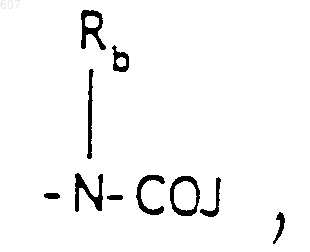
где J представляет Ra, алкил (C3-С8), разветвленный или неразветвленный, алкенил(C3-С8), разветвленный или неразветвленный, -O-алкил(C3-С8), разветвленный или неразветвленный, -O-алкенил(C3-С8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты
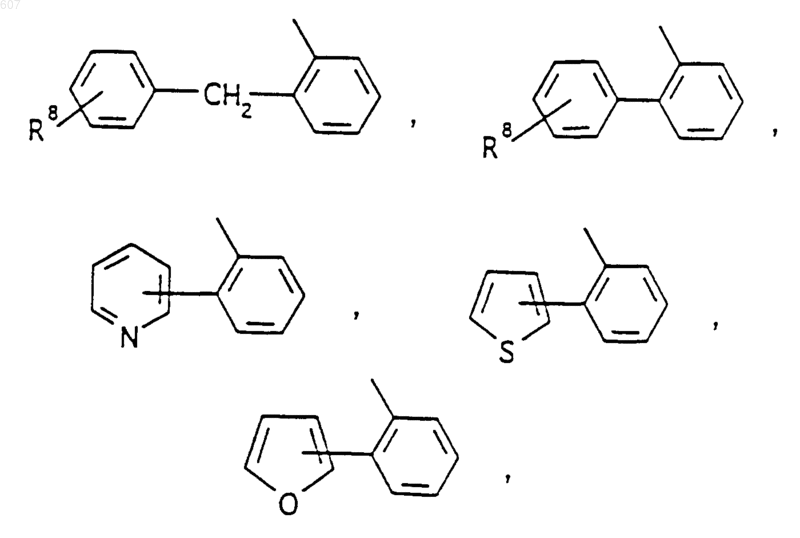
или -СН2-K', где K' представляет (C1-C3)алкоксигруппу, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклическое кольцо:

где D, Е, F и G выбирают из углерода или азота и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3)алкилом, гидроксилом, -СО-(C1-C3)алкилом, СНО, (C1-C3) алкоксигруппой, -СO2-алкилом(С1-C3), a Ra и Rb имеют указанные ранее значения;
(с) фрагмента формулы
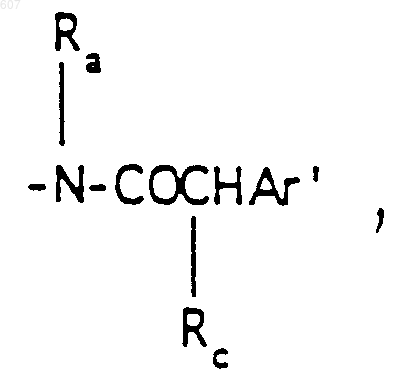
где Rc выбирают из галоида, (C1-C3)алкила, -O-алкил(C1-C3), ОН,
алкил(C1-C3), -S-алкил(C1-C3),
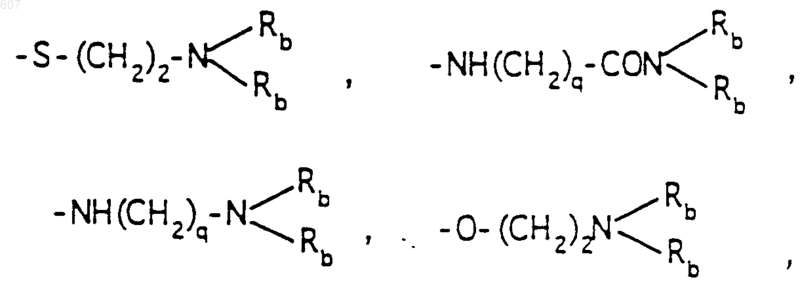
где Ra и Rb имеют указанные ранее значения;
(d) фрагмента формулы
- М - Rd,
где Rd представляет алкил(C3-С8), алкенил(C3-С8), -(CH2)p-циклоалкил(C3-C6),
где М представляет О, S, NH, NСН3, и фрагмента -M-Rd, где Rd выбирают из фрагментов
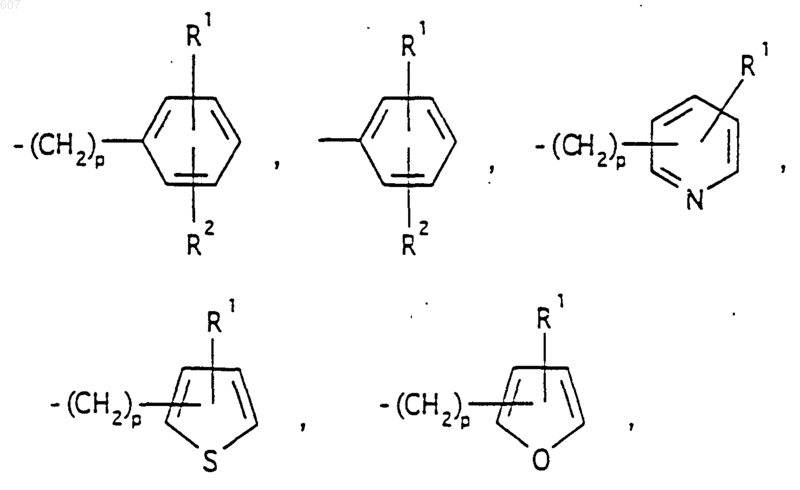
где р представляет число от 0 до 4, а М представляет связь, или М выбирают из О, S, NH, NСН3;
где R1, R2 и Ra имеют указанные ранее значения;
где Аr' выбирают из фрагментов формул
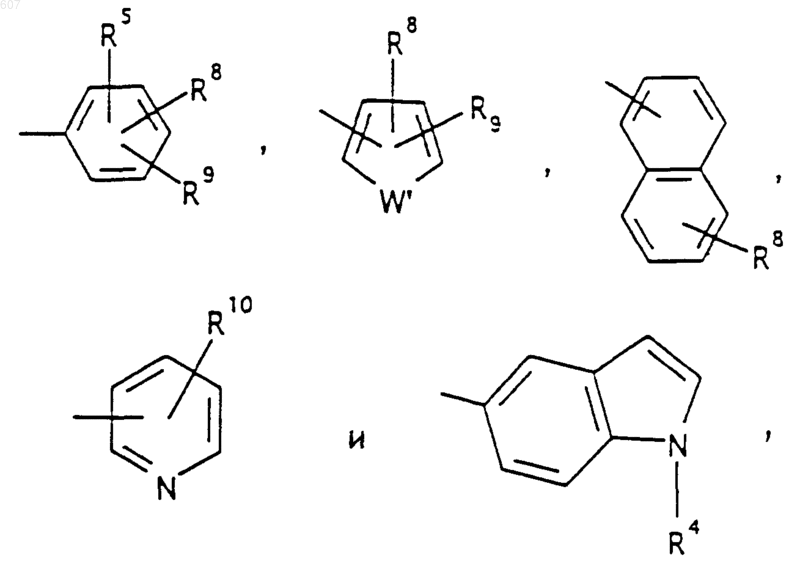
где W' выбирают из О, S, NH, N-алкил(C1-C3), NHCO-алкил(C1-C3) и NSО2-алкил(C1-C3);
R7 выбирают из водорода, алкила(C1-C3), галоида, O-алкила (C1-C3) и СF3;
R8 и R9 независимо выбирают из водорода, алкила (C1-C3), -S-алкила(C1-C3), галоида, -NH-алкила (C1-C3), -N-[алкила (C1-C3)]2, -ОСF3, -ОН, -CN, -S-СF3, -NO2, -NН2, O-алкила(C1-C3), NHCO-алкила(C1-C3), -O-СО-алкила (C1-C3) и CF3; и
R10 выбирают из водорода, галоида, алкила(C1-C3), -NH-алкила(C1-C3), -N[алкила(C1-C3)]2, -O-алкила (C1-C3), -N-(Rb) (CH2)q-N(Rb)2;
включающий взаимодействие соединения формулы I
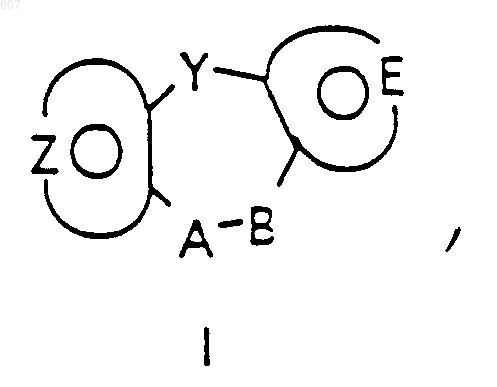
где А-В представляет
-(CH2)n-N- и -N-(CH2)n-
H H
с соединением формулы
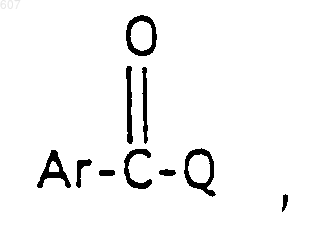
где Q представляет галоид или активирующую группу, что приводит в результате превращением арилкарбоновой кислоты в смешаный ангидрид или за счет активирования пептидным реагентом сочетания, к получению соединения формулы I.
Текст
1 Область изобретения Настоящее изобретение относится к новым трициклическим непептидным антагонистам вазопрессина, которые можно использовать при лечении таких состояний, при которых желательно понизить уровни вазопрессина, например, таких как застойная сердечная недостаточность, при болезненных состояниях, избыточная реабсорбция почками воды и при состояниях с повышенным сопротивлением сосудов и коронарной вазоконстрикцией. Описание известного уровня Вазопрессин высвобождается из задней части гипофиза либо в результате реакции на повышение осмотической концентрации плазмы, которое определяется осморецепторами мозга, либо на снижение объема крови и давления крови, воспринимаемое объмными рецепторами низкого давления и артериальными барорецепторами. Этот гормон проявляет свое действие за счет двух хорошо определенных рецепторных подтипов: сосудистого рецептораV1 и почечного эпителиального рецептора V2. Вызываемый вазопрессином антидиурез, осуществляемый за счет почечных эпителиальныхV2 рецепторов, помогает поддерживать нормальное осмотическое давление плазмы, объем крови и давление крови. Вазопрессин участвует в некоторых случаях застойной сердечной недостаточности, когда повышается сопротивление периферических сосудов. Антагонисты V1 могут снимать системное сопротивление в сосудах, повышать количество прокачиваемой сердцем крови и предотвращать вызываемую вазопрессином коронарную вазоконстрикцию. Таким образом, в состояниях с вызванным вазопрессином повышением полного периферического сопротивления и изменного локального потока крови антагонисты V1 могут понижать кровяное давление,вызывать гипотензивное действие и вследствие этого, быть терапевтически полезными при лечении некоторых типов гипертензии. Блокировка V2 рецепторов полезна при лечении заболеваний, характеризующихся избыточной реабсорбцией почками свободной воды. Антидиурез регулируется за счет высвобождения гипоталамусом вазопрессина (антидиуретического гормона), который связывается со специфическими рецепторами на клетках собирательных трубочек почки. Такое связывание стимулирует аденилилциклазу и промотирует сАМР-осуществляемое включение водных пор в люминальную поверхность этих клеток. V2 антагонисты могут корректировать удержание жидкости при застойной сердечной недостаточности, циррозе печени, нефритном синдроме,поражениях центральной нервной системы, болезнях легких и гипонатремии. Повышенные уровни вазопрессина наблюдаются при застойной сердечной недостаточности, что более характерно у пожилых пациентов 2 с хронической сердечной недостаточностью. У пациентов с гипонатремической застойной сердечной недостаточностью и повышенными уровнями вазопрессина антагонисты V2 могут помочь в промотировании выделения свободной воды за счет противодействия антидиуретическому гормону. Учитывая биохимические и физиологические действия гормона, можно ожидать, что антагонисты вазопрессина окажутся терапевтически полезными при лечении и/или профилактике гипертензии, сердечной недостаточности, коронарного вазоспазма, ишемии сердца, почечного вазоспазма, цирроза печени,застойной сердечной недостаточности, нефритного синдрома, отека мозга, ишемии головного мозга, кровоизлияния мозга, кровотечения, вызванного тромбом, и ненормального состояния удержания воды. Приводимые далее ссылки предшествующего уровня техники описывают пептидные антагонисты вазопрессина: М. Manning et. al., J. Med. Chem., 35, 382(1991). P. D. Williams и др. Они сообщают об эффективных гексапептидоокситоциновых антагонистах (J. Med. Chem. 36, 3905 (1992, которые также демонстрируют слабую антагонистическую активность в отношении вазопрессина за счет связывания V1 и V2 рецепторов. Пептидные антагонисты вазопрессина страдают недостатком активности при пероральном приеме, и многие из этих пептидов не являются селективными антагонистами, так как они также демонстрируют частичную агонистическую активность. Недавно были раскрыты непептидные антагонисты вазопрессина. Y. Yamamura et al.,Science, 252, 579 (1991); Y. Yamamura et al., Br.Fujisawa Co., LTD., EP 620216-A1. Ogawa et al.,(Otsuka Pharm. Co) EP 470514A раскрывают производные карбостирила и содержащие их композиции. Непептидный антагонист окситоцина и вазопрессина был описан в Merck andal., EP 0533243A. Преждевременные роды могут привести к проблемам со здоровьем новорожденных и к смерти, а ключевым медиатором механизма родов является пептидный гормон окситоцин. За счет фармакологического действия окситоцина 3 антагонисты этого гормона могут оказаться полезными для предотвращения преждевременных родов, В.Е. Evans et al., J. Med. Chem., 35, 3919(1992), J. Med. Chem., 36, 3993 (1993) и указанные там ссылки. Соединения настоящего изобретения являются антагонистами пептидного гормона окситоцина и полезны для контроля за преждевременными родами. Настоящее изобретение относится к новым трициклическим производным, которые демонстрируют антагонистическую активность в отношении V1 и V2 рецепторов, и демонстрируютin vivo активность антагонистов вазопрессина. Эти соединения также демонстрируют активность антагонистов рецепторов окситоцина. Краткое содержание изобретения Настоящее изобретение относится к новым соединениям, выбранным из соединений общей формулы I где Y представляет связь или фрагмент, выбранный из -CH2-, -СНОН, -СНО-низший алкил(C1-С 6),-CH-S-низший алкил(С 1-С 6),-СНNН 2, -CHN-низший алкил(C1-C6), -CHNm представляет целое число от 2 до 6; А-В представляет фрагмент, выбранный из где n представляет целое число 1 или 2, при условии, что, если Y представляет связь, n=2; и фрагмент представляет (1) ненасыщенное шестичленное ароматическое гетероциклическое кольцо, содержащее один атом азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-С 3) низшего алкила, галоида,амино; (C1-C3)низшей алкокси- или (C1C3)низшей алкиламиногруппы; (2) пятичленное ароматическое (ненасыщенное) гетероцикличе 000607 представляет: (1) ненасыщенное шестичленное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3)низшего алкила,галоида, амино-, (C1-C3)низшей алкокси- или(C1-C3)низшей алкиламиногруппы; (2) пятичленное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О, N или S; (3) пятичленное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота; (4) пятичленное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один атом азота вместе с одним атомом либо кислорода, либо серы; где 5- или 6-членные гетероциклические кольца необязательно замещены (C1-C3)низшим алкилом, галоидом, или (C1C3) низшей алкоксигруппой; R3 представляет 6 или -CH2-K', где К' представляет (C1-C3)низшую алкоксигруппу, галоид, тетрагидрофуран, тетрагидротиофен или гетероциклический фрагмент где D, Е, F и G выбирают из углерода или азота,и где атомы углерода могут быть необязательно замещены галоидом, (C1-C3) низшим алкилом,гидроксилом, -СО- (C1-C3) низшим алкилом,СНО, (C1-C3) низшей алкоксигруппой -СO2 низшим алкилом(С 1-C3), a Ra и Rb имеют указанные ранее значения;(C3 С 6)циклоалкил, циклогексенил или циклопентенил; a Rа независимо выбирают из водорода,-СН 3 или -C2 Н 5,Rb независимо выбирают из водорода, СН 3 или C2H5,(b) фрагмента формулы где Rc выбирают из галоида, (C1-C3)низшего алкила, -O-низший алкил(C1-C3), ОН,низший алкил (C1-C3), -S-низший алкил(C1-C3), где Ra и Rb имеют указанные ранее значения;- М - Rd,где Rd представляет низший алкил (C3-С 8), низший алкенил(C3-С 8), - (CH2)p-циклоалкил (C3 С 6), где М представляет О, S, NH, NСН 3 и фрагмента -M-Rd, где Rd выбирают из фрагментов где J представляет Ra, низший алкил (C3-С 8),неразветвленный, низший алкенил(C3-С 8), разветвленный или неразветвленный, -O-низший алкил(C3-С 8), разветвленный или неразветвленный, -O-низший алкенил (C3-С 8), разветвленный или неразветвленный, тетрагидрофуран, тетрагидротиофен и фрагменты где р представляет число от 0 до 4, а М представляет связь, или М выбирают из О, S, NH,NСН 3; где R1, R2 и Ra имеют указанные ранее значения; где Аr' выбирают из фрагментов формул где циклоалкил определен какRa, Rb, R1, R2, R5, R6, R7 имеют указанные ранее значения; и Аr' выбирают из фрагментовR8 и R9 независимо выбирают из водорода,низшего алкила(C1-C3), -S-низшего алкила(C1C3), галоида, -NH-низшего алкила (C1-C3), -N[низшего алкила (С 1-C3)]2, -ОСF3, -ОН, -CN, -SСF3, -NO2, -NH2, O-низшего алкила (C1-C3),NHCO низшего алкила(C1-C3), -С-СО-низшего алкила(C1-C3) и СF3; иR10 выбирают из водорода, галоида, низшего алкила (C1-C3), -NH-низшего алкила(C1C3), -N[низшего алкила(C1-C3)]2, -O-низшего алкила (C1-C3), -N-(Rb)(CH2)q-N(Rb)2; и его фармацевтически приемлемые соли. Описание изобретения В группе соединений, определяемых формулой I, наиболее предпочтительны некоторые подгруппы соединений. Наиболее предпочтительны соединения, в которых R3 представлен фрагментом где R8, R9, R10 и W' имеют указанные ранее значения. Кроме того, особенно предпочтительны соединения, в которых Y представляет СН 2,-СНОН, -СНNН 2, -CHNH-низший алкил (C1C3), -СНN[низший алкил (C1-C3)]2 и -СНОнизший алкил(C1-C3); а Ra, Rb, R1, R2, R4, R5, R6, R7, R8 и R9 имеют указанные ранее значения. Самыми предпочтительными соединениями формулы I являются соединения, в которых где Ra, Rb, R2, R5, R6 и R7 имеют указанные ранее значения. Особенно предпочтительны соединения, в которых R3 представлен фрагментом(СН 2)n-циклоалкил, где циклоалкил определен как (C3-C6)циклоалкил, циклогексенил или циклопентенил;Ra, Rb, R1, R2, R5, R7 имеют указанные ранее значения; и Аr' представляет фрагмент где R8, R9 и R10 имеют указанные ранее значения. Еще более предпочтительными соединениями формулы I являются соединения, в которых Y представляет связь или -(СН 2), -СНОН,-CHNH2,-CHNH-низший алкил(C1-C3),-СНN[низший алкил(C1-C3)]2, -СНО-низший алкил(C1-C3), где фрагмент где D представляет -СН или N; R3 представляет фрагмент представляет замещенный или незамещенный тиофен, фуран, пиррол или пиридин; и где фрагмент представляет: (1) ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один или два атома азота; (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из O, N или S; (3) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота;Ra, Rb, R1, R2, R4, R5, R7, R8 и R9 имеют указанные ранее значения; где Аr представляет где Ra, Rb, R1, R2, R5, R7, R8, R9, R10, циклоалкил и W' имеют указанные ранее значения. Также особенно предпочтительными являются соединения формулыa W' и циклоалкил имеют указанные ранее значения. Более конкретно, предпочтительными являются соединения формулы где Ra, Rb, R1, R2, R5, R6, R8, R9, R10, циклоалкил,М, Rd и W' имеют указанные ранее значения. Более конкретно предпочтительными являются соединения формул представляет (1) ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один атом азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3)низшего алкила, галоида,амино-, (C1-C3) низшей алкокси- или (C1-C3) низшей алкиламиногруппы; (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из О, N или S; (3) 5-членное ароматическое(ненасыщенное) гетероциклическое кольцо, содержащее два соседних атома азота; где 5- или 6-членные гетероциклические кольца необязательно замещены (C1-C3)низшим алкилом, галоидом или (C1-C3) низшей алкоксигруппой; где R1, R2, R5, R7, R8, R9, R10 и W' имеют указанные ранее значения. Кроме того, особенно предпочтительными являются соединения формулы представляет (1) ненасыщенное 6-членное гетероциклическое ароматическое кольцо, содержащее один атом азота, необязательно замещенное одним или двумя заместителями, выбранными из (C1-C3)низшего алкила, галоида,амино-, (C1-C3) низшей алкокси- или (C1-C3) низшей алкиламиногруппы; (2) 5-членное ароматическое (ненасыщенное) гетероциклическое кольцо, содержащее один гетероатом, выбранный из N или S; где Аr выбирают из группы фрагментовRa независимо выбирают из водорода, -СН 3 или -С 2 Н 5, а Аr' выбирают из фрагментов где Ra независимо выбирают из водорода или СН 3; Аr' выбирают из фрагментов где R1, R2, R5, R7, R8, R9 и R10 имеют указанные ранее значения. 13 Соединения настоящего изобретения можно получить, как представлено на схеме 1, за счет реакции производных азепина формулы 3 с замещенным или незамещенным 4-нитробензоилхлоридом 4 а, или замещенным или незамещенным 6-аминопиридин-3-карбонилхлоридом 4b до получения промежуточного соединения 5 а и 5b. В результате восстановления нитрогруппы в промежуточном 5 получают 4 аминобензоильное производное 6 а и 6-аминоникотиноильное производное 6b. Восстановление нитрогруппы в промежуточном 5 можно осуществить в условиях каталитического восстановления (водород-Pd/C; Pd/C-гидразинэтанол) или в условиях химического восстановления (SnСl2-этанол; Zn-уксусная кислота иTiCl3) и в родственных условиях восстановления, которые известны специалистам для превращения нитрогруппы в аминогруппу. Условия для превращения нитрогруппы в аминогруппу выбирают с учетом совместимости с требованием сохранения в молекуле других функциональных групп. Реакция соединений формулы 6 с ароилхлоридом или родственными активированными арилкарбоновыми кислотами в таких растворителях, как хлороформ, дихлорметан, диоксан,тетрагидрофуран, толуол и т.п., в присутствии такого третичного основания, как триэтиламин и диизопропилэтиламин или пиридин и т.п.,приводит к получению соединений 8, которые являются антагонистами вазопрессина. Реакция трициклических производных формулы 6 либо с карбамоильным производным 9, либо с изоцианатным производным 10, приводит к получению соединений (Схема 2) формулы 11, которые являются антагонистами вазопрессина формулы I, где R6 представляет Реакция трициклических производных формулы 6 с арилуксусными кислотами, активированными до хлорангидридов 12, ангидридов, смешанных ангидридов, или активированных известными активирующими реагентами,приводит к получению соединений 13 (Схема 3). СХЕМА 3R имеют указанные ранее значения, фрагмент 4 имеет указанные ранее значения, а фрагмент Аr' представляетN-[низший алкил(C1-C3)]2, можно получить, как представлено на схеме 4, за счет осуществления реакции трициклических производных 6 а и 6b с пиридинкарбонилхлоридом 14 до получения производных 15. Производные 15 подвергают взаимодействию с соответствующими моноалкиламинами или диалкиламинами до получения антагонистов вазопрессина формулы 16. Соединения формулы I, где Е, Y, R1, R2, R3,R и R7 имеют указанные ранее значения, а R3(-СОАr) арильная группа представлена формулой 5 где R6 представляет -M-Rd, где М представляет О, S, NH, N-СН 3 и Rd имеет указанные ранее значения, можно получить в соответствии со схемой 5, вначале превращая производные азепина 3 в промежуточные соединения 17, а затем,осуществляя взаимодействие этих никотинолильных производных промежуточных соединений с производными формулы HM-Rd, в присутствии такого ненуклеофильного основания,как N,N-диизопропилэтиламин, до получения продукта 18. Наилучшие результаты при замещении галоида в производных пиридина 17 достигаются в том случае, если атомом галоида является фтор. С нуклеофильными аминами(M=NH, NСН 3) реакцию можно вести с 6-хлор,-бром или фторпроизводными 17b (1) без ненуклеофильного основания; (2) в ненуклео 17 фильном растворителе или (3) с избытком амина и без растворителя. С производными HO-Rd для удовлетворительного превращения 17 в 18 необходимо 6-фтор-производное 17. 18 В качестве альтернативного способа получения соединений настоящего изобретения,представленных формулой I, где Ra, Rb, R1, R2,R5, R7, А и Y имеют указанные ранее значения, a В другом варианте продукты 18 можно получить, вначале получая производные формулы 19, а затем присоединяя эти производные к азепиновым соединениям 3 (схема 6). Промежуточные соединения карбоновой кислоты активируют для присоединения к азепиновым соединениям 3 за счет реакции с реагентами пептидного присоединения, или, предпочтительно, за счет превращения в хлорангидриды, ангидриды или смешанные ангидриды. СХЕМА 6 можно предложить присоединение арилкарбоновых кислот 20 к производным азепина 3 (схема 7). Арилкарбоновые кислоты активируют для присоединения за счет превращения в хлорангидрид, бромид или ангидрид или вначале осуществляя взаимодействие с таким активирующим агентом, как N,N-дициклокарбодиимид,диэтилцианофосфонат и родственные активирующие реагенты пептидного типа. Способ активирования кислот 20 для присоединения к производному азепина 3 выбирают с учетом совместимости с другими группами заместителей в этой молекуле. Предпочтительно превращение арилкарбоновой кислоты 20 в соответствующий ароилхлорид. Хлориды ариловых кислот 21 можно получить стандартными способами, известными специалистам, например, в реакциях с тионилхлоридом, оксалилхлоридом и т.п. Реакцию присоединения ведут в таких растворителях, как галоидированные углеводороды, толуол, ксилол, тетрагидрофуран, диоксан в присутствии пиридина или таких третичных оснований как триэтиламин и т.п. (схема 7). В другом варианте ароилхлориды, полученные из арилкарбоновых кислот 20, можно подвергнуть взаимодействию с производными 3 в пиридине,с 4-(диметиламино)пиридином или без него до получения производных 22. Обычно, если арилкарбоновые кислоты активируют N,N-карбонилдиимидазолом и другими активирующими реагентами пептидного типа, требуются более высокие температуры,нежели в тех случаях, когда используют ароилхлориды. Реакцию можно вести в более высококипящих растворителях (ксилоле) или без растворителя (100-150 С). Активирование арилкарбоновой кислоты за счет превращения в хлорангидриды с помощью тионилхлорида или оксалилхлорида предпочтительно, так как более реакционноспособные ароилхлориды обеспечивают более высокие выходы продукта. Отдельные примеры получения проиллюстрированы на схеме 7. 20 подкисления и дальнейшей обработки. Свободные кислоты превращают в хлорангидриды за счет тионилхлорида, и эти хлорангидридные промежуточные соединения 25 подвергают взаимодействию с производными аминоарила формулы Аr' - NHRa(26),где Аr' и Ra имеют указанные ранее значения, до получения соединений 27. СХЕМА 8 Получение соединений формулы I, где R3 представляет и где Аr' имеет указанные ранее значения, осуществляют в соответствии со схемой 8. Соединения азепина подвергают взаимодействию с монометилтерефталилхлоридом 23 (полученным из монометилтерефталата и тионилхлорида) в присутствии такого третичного основания как триэтиламин, в таких растворителях как дихлорметан, тетрагидрофуран, диоксан, толуол и т.п., до получения производных 24. Эти сложноэфирные производные 24 гидролизуют 2-10 эквивалентами таких щелочей как гидроксиды калия или натрия, в водном метаноле или этаноле до получения соответствующих кислот после Некоторые из трициклических азепинов,как представлено соединениями 33-35, получают за счет начального замыкания кольца в промежуточных ациклических производных 30 с последующим образованием третьего кольца в соответствии с известным из литературы способом (схема 9). Замыкание кольца ациклических производных структурного типа 30, в которых атом азота защищен паратолуолсульфонильной группой, приводит к получению -кетосложных эфиров 31, которые существуют в енольной форме, как это показано на схеме (структура 31). В результате декарбоксилирования получают промежуточные соединения 32, которые в соответствии с известным из литературы способом превращают в тозилзащищенные трициклические азепины 33-35. Тозилзащитные группы в производных, как например в трициклических азепинах 33-35, можно удалить описанным в литературе способом (P.P. Carpenter and M. 21 для сульфонамидного расщепления производных бензазепина. СХЕМА 9 22 ние оксим-O-тозилатов с ацетатом калия в смеси спирт-вода (например, этанол-вода или нбутанол-вода) приводит к получению 7-членных производных лактама 41. Восстановление лактама бораном или литийалюминийгидридом(LiAH) приводит к получению конденсированных гетероциклических азепинов 42. Азепины 42 можно превратить в промежуточные 43 и 44,которые полезны при получении новых соединений настоящего изобретения. Как было указано ранее, гетероциклические азепины структурных типов, представленных формулами 45-55,можно получить способами, представленными на схеме 10, или в соответствии с литературными способами для замыкания кольца до азепинов. СХЕМА 10 Некоторые промежуточные азепины с конденсированным гетероциклическим кольцом,как представлено структурой 44, которые полезны при получении промежуточных трициклических азепинов, необходимых для синтеза антагонистов вазопрессин-окситоцина настоящего изобретения, можно получить в соответствии со схемой 10. Стандартные химические реакции и условия используют для превращения азепинов структурного типа 44 в трициклические азепины формул 47-50 (через промежуточные соединения 45 и 46). Как представлено на схеме 10, расширение шестичленного кольца до семичленного лактама осуществляют за счет реакции производного кетона 36 с гидроксиламином до получения производного оксима, которое в большинстве случаев существует в виде смеси син и анти форм (структуры 37 и 38). Смесь оксимов в реакции с 4-метилбензолсульфонилхлоридом дает либо смесь оксим-O-тозилатов, либо, в некоторых случаях, отдельный O-тозилат 39. Нагрева 23 СХЕМА 10 (продолжение) Некоторые из соединений настоящего изобретения, в которых Ra имеет указанные ранее значения, получают за счет введения Ra-группы либо на конечной стадии, либо на предпоследней стадии, как это представлено на схеме 11. В производных 51 введение Ra-заместителя (Ra не представляет Н) можно осуществить на финальной стадии, вначале образуя анион амидной функции производного 51, с последующим алкилированием атома азота до получения продуктов 52. В тех производных, в которых необходимы защита - удаление защиты, производные 51 превращают в защищенные промежуточные соединения 52 а и 52b, которые после удаления защиты дают соединения 52. ГруппаR27 может быть третичной бутоксикарбонильной группой, группой ацетила или другими известными аминозащитными фрагментами.R28-группа может быть третичной бутилкарбонильной группой, ацетильной группой или другими известными гидроксизащитными фрагментами. Соединения настоящего изобретения,представленные формулой 59, можно получить из соединений, представленных формулой 58,как это видно на схеме 12. 6-хлор-, -бром- илиRa имеет указанные ранее значения, до получения соединений формулы 58. В результате реакции 6-аминоникотиноильного производного 58 с R26-хлоридом, где R26 соответствует значениям, указанным на схеме 12, получают соединения настоящего изобретения, представленные формулой 59. СХЕМА 12 Сравнительный пример 1. 6,7-Дигидробензо[b]тиофен-4(5 Н)-он, оксим. К раствору 4-кето-4,5,6,7-тетрагидротионафтена в 260 мл этанола добавляют 27,4 г гидроксиламингидрохлорида. К полученной 25 смеси добавляют 16,5 г ацетата натрия и 66 мл воды, а затем полученную смесь кипятят с обратным холодильником в течение 3,5 ч; охлаждают на ледяной бане и фильтруют. Твердую часть промывают водой и этанолом до получения 13 г твердого вещества, которое сушат при 65 С в вакууме до получения 11,7 г кристаллов. Т. плавления 124-126 С (главным образом один изомер, син или анти). Полученный фильтрат концентрируют в вакууме и экстрагируют 250 мл дихлорметана. Экстракт промывают 100 мл(каждого) воды, рассола, а затем сушат над сульфатом натрия. Растворитель удаляют и твердую часть сушат при 65 С в вакууме до получения 32 г кристаллов. Т. плавления 106109 С (главным образом один изомер, син или анти). Сравнительный пример 2. 6,7-Дигидробензо[b]тиофен-4(5 Н)-он, оксим-O-тозилат. К перемешиваемому раствору 12,2 г 6,7 дигидробензо[b]тиофен-4(5 Н)-он, оксима (смесь изомеров) в 26 мл сухого пиридина охлаждают до 0 С и добавляют 15,3 г паратолуолсульфонилхлорида (все сразу). Спустя 5 мин твердую часть выделяют и полученную смесь перемешивают при 0 С в течение 1 ч. К холодной смеси добавляют 195 мл 2 н НСl и полученную смесь фильтруют до получения твердого продукта, который промывают водой и сушат (в вакууме) до получения 21,5 г продукта в виде кристаллов. Т. плавления 117-120 С. Сравнительный пример 3. 5,6,7,8-Дигидро 4 Н-тиено[3,2-b]азепин-5-он. Смесь 21,45 г 6,7-дигидробензо[b]тиофен 4(5 Н)-он оксима-O-тозилата, 136,1 г ацетата калия, 528 мл этанола и 904 мл воды кипятят с обратным холодильником в течение 22 ч. Эту смесь концентрируют в вакууме (для удаления этанола), охлаждают и фильтруют до получения твердого продукта. Его промывают водой, сушат на воздухе и перекристаллизовывают, растворяя в горячем этилацетате и разбавляя раствор гексаном. В результате охлаждения и фильтрования получают 7,1 г кристаллов. Т. плавления 128-132 С. Сравнительный пример 4. 5,6,7,8-Дигидро 4 Н-тиено[3,2-b]азепин.(1) К смеси 4,54 г литийалюминийгидрида в 400 мл сухого тетрагидрофурана в атмосфере аргона прикапывают раствор 10,0 г 5,6,7,8 дигидро-4 Н-тиено[3,2-b]азепин-5-она в 200 мл тетрагидрофурана. После добавления полученную смесь нагревают при 45-50 С (реакция экзотермическая) и охлаждают до комнатной температуры. Полученную смесь охлаждают на ледяной бане (0 С) и прикапывают 4,5 мл воды в течение 1 ч, а затем прикапывают 4,5 мл 2 н гидроксида натрия и прикапывают дополнительно 14 мл воды. Полученную смесь фильтруют через диатомовую землю и фильтровальную лепешку промывают тетрагидрофураном. Фильтрат концентрируют до твердого вещества. 26 Твердую часть кристаллизуют из гексана и получают 5,5 г грязно-белого цвета кристаллов. Т. плавления 66-68 С.(2) К смеси 21,2 г 5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепин-5-она в 100 мл тетрагидрофурана в атмосфере аргона, охлажденной до 0 С, добавляют 25,2 мл 10 молярного раствора борандиметилсульфида в тетрагидрофуране. Полученный раствор перемешивают при комнатной температуре в течение 16 ч и кипятят с обратным холодильником в течение 5 ч. Эту смесь охлаждают до комнатной температуры и прикапывают 85 мл метанола (экзотермическая реакция). Растворитель удаляют и добавляют 100 мл метанола (2 раза) и после каждого добавления растворитель удаляют. К оставшемуся твердому веществу (высушено в вакууме) добавляют 126 мл 1 н NaOH и полученную смесь кипятят с обратным холодильником в течение 3 ч. Смесь охлаждают (2 ч) и экстрагируют дихлорметаном. Полученный экстракт сушат над сульфатом натрия и растворитель удаляют до получения 15,4 г твердого вещества коричневого цвета. Т. плавления 55-57 С. Образец в 3 г сублимируют для получения 2,6 г кристаллов. Т. плавления 64-65 С. Сравнительный пример 5. 4-(4 Нитробензоил)-5,6,7,8-тетрагидро-4 Н-тиено[3,2b]азепин. К раствору 10,71 г 5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепина и 19,4 мл триэтиламина в 150 мл дихлорметана в атмосфере аргона добавляют небольшими порциями 4-нитробензоилхлорид (экзотермическая реакция). Полученную смесь перемешивают в течение 3 ч при 25 С, а затем промывают водой, раствором бикарбоната натрия, рассолом и сушат над сульфатом натрия. Растворитель удаляют, остаток сушат в вакууме и перекристаллизовывают,растворяя в горячем этилацетате и разбавляя гексаном. После охлаждения в течение ночи и фильтрования получают 16 г кристаллов светлокоричневого цвета. Т. плавления 141-142 С. Сравнительный пример 6. 4-(4-Нитробензоил)-4,5,6,7-тетрагидро-8 Н-тиено[3,2-b] азепин-8-он. К раствору 9,0 г 4-(4-нитробензоил)5,6,7,8-тетрагидро-4 Н-тиено[3,2-b] азепина в 713 мл ацетона добавляют 6,74 г сульфата магния и 351 мл воды, а затем 8,2 г КМnО 4 и нагревают при 70 С в течение 18 ч, добавляют еще 6,24 г сульфата магния и 8,2 г КМnO4 и нагревание продолжают в течение 8 ч при 70 С. Добавляют еще 6,24 г сульфата магния и 8,2 г КМnO4 и нагревание продолжают при 70 С в течение 18 ч. Реакционную смесь фильтруют через диатомовую землю и фильтровальную лепешку промывают ацетоном и 500 мл метиленхлорида. Объединенные фильтраты выпаривают в вакууме до остатка, который промывают водой и сушат на воздухе до получения 5,7 г твердого продукта. Его кристаллизуют из этил 27 ацетата до получения 5,1 г грязно-белого твердого вещества. Т. плавления 184-186 С. Сравнительный пример 7. 4-(4-Аминобензоил)-4,5,6,7-тетрагидро-8 Н-тиено[3,2-b] азепин-8-он. К смеси 2,0 г 4-(4-нитробензоил)-4,5,6,7 тетрагидро-8 Н-тиено[3,2-b]азепин-8-она в 40 мл ледяной уксусной кислоты добавляют 20 мл 6 н соляной кислоты. Полученную смесь охлаждают и порциями добавляют 3,53 г порошка железа. Полученную смесь оставляют нагреваться до комнатной температуры, а затем нагревают при 70-80 С в течение 1 ч и затем охлаждают до 0 С. Полученную смесь подщелачивают 10 нNaOH (pH 14) и экстрагируют 200 мл этилацетата. Водный слой снова экстрагируют 200 мл этилацетата и полученные экстракты объединяют. Объединенные экстракты промывают 100 мл (каждого) воды и рассола и сушат над сульфатом натрия. Экстракт фильтруют через тонкий слой силиката магния и полученный фильтрат концентрируют до получения твердого вещества, которое кристаллизуют из смеси ацетатгексан до получения 1,24 г кристаллов. Т. плавления 216-218 С. Сравнительный пример 8. 2-Хлор-4-(4 нитробензоил)-5,6,7,8-тетрагидро-4 Н-тиено[3,2b]азепин. Раствор 6,04 г 4-(4-нитробензоил)-5,6,7,8 тетрагидро-4 Н-тиено[3,2-b]азепина в 40 мл тетрагидрофурана охлаждают до 0 С и порциями добавляют 5,34 г N-хлорсукцинимида. После добавления полученную смесь нагревают при 70 С в течение ночи. Полученную смесь концентрируют, разбавляют 300 мл дихлорметана и полученную смесь промывают 100 мл (каждого) насыщенного раствора К 2 СО 3, водой, 1 н НСl и рассола. Органический слой сушат над сульфатом натрия и фильтруют через тонкий слой водного силиката магния. Полученный фильтрат концентрируют, а остаток обрабатывают хроматографически с помощью ВЭЖХ на силикагеле(2 колонки) на приборе Waters-Prep-500, используя в качестве системы-растворителя этилацетат-дихлорметан (1:1), содержащий 2% диэтилового эфира. Средние фракции объединяют и концентрируют до получения 0,135 г 2,3 дихлор-4-(4-нитробензоил)-5,6,7,8-тетрагидро 4 Н-тиено[3,2-b]азепина. Т. плавления 140142 С. Последние фракции объединяют, концентрируют и остаток кристаллизуют из смеси этилацетат-гексан до получения 2,8 г кристаллов. Температура плавления 119-120 С. Сравнительный пример 9. 2-Хлор-4-(4 нитробензоил)-4,5,6,7-тетрагидро-8 Н-тиено[3,2b] азепин-8-он. К перемешиваемому раствору 0,336 г 2 хлор-4-(4-нитробензоил)-4,5,6,7-тетрагидро-4 Нтиено[3,2-b]азепина в 36 мл смеси ацетон-вода(2:1) добавляют 0,21 г безводного сульфата магния и 0,275 г перманганата калия. Полученную смесь нагревают при 70 С в течение ночи. До 000607 28 бавляют дополнительно 0,275 г перманганата калия и 0,21 г сульфата магния и полученную смесь нагревают при 70 С в течение 6 ч. Добавляют дополнительно 0,275 г перманганата калия и 0,21 г сульфата магния и полученную смесь перемешивают и нагревают при 70 С в течение 24 ч. Горячую смесь фильтруют и полученный фильтрат выпаривают. Остаток нагревают в нескольких мл этилацетата, охлаждают и фильтруют до получения 0,20 г продукта в виде твердого вещества. Реакцию повторяют в 10 кратном масштабе до получения 1,3 г грязнобелых кристаллов. Т. плавления 165-168 С. Сравнительный пример 10. Метил-4-[2-(2 хлорфенил)-2-циано-2-(4-морфолинил)этил] бензоат. 0,876 г образца 60% гидрида натрия в масле промывают гексаном, а затем дополнительно добавляют 60 мл сухого N,N-диметилформамида. Реакционную смесь перемешивают в течение 1 ч в атмосфере аргона при комнатной температуре после добавления 4,73 г -(2 хлорфенил)-4-морфолинацетонитрила. К реакционной смеси добавляют 4,58 г метил 4(бромметил) бензоата и перемешивание продолжают в течение 3 ч. К ледяной воде добавляют несколько капель уксусной кислоты и реакцию гасят. рН оказывается 3-4, и добавляют насыщенный раствор бикарбоната натрия для доведения рН до 6-7. После охлаждения отфильтровывают тврдую часть, которую промывают водой и сушат до получения 5,92 г твердого продукта желтого цвета. В результате кристаллизации из смеси метиленхлорид-гексан получают 2,10 г целевого продукта в виде кристаллического твердого вещества. Т. плавления 116-118 С. Сравнительный пример 11. Метил-4-[2-(2 хлорфенил)-2-оксоэтил]бензоат. Смесь 1,0 метил-[4-(2-хлорфенил)-2 циано-2-(4-морфолинил)этил]бензоата и 14 мл уксусной кислоты и 6 мл воды нагревают при кипячении с обратным холодильником в течение 20 мин, а затем выливают на измельченный лед. После перемешивания в течение 15 мин полученное твердое вещество собирают, промывают водой и сушат на воздухе до получения 0,63 г твердого продукта желто-коричневого цвета. Т. плавления 40-42 С. Сравнительный пример 12. 4-[2-(2 Хлорфенил)-2-оксоэтил]бензойная кислота. Смесь 18,78 г метил-4-[2-(2-хлорфенил)-2 оксоэтил] бензоата в 288,8 мл СН 3 ОН, 72,2 мл воды и 5,2 г NaOH кипятят с обратным холодильником в течение 3 ч, затем подкисляют 2 н лимонной кислотой. Реакционную смесь выпаривают в вакууме для удаления метанола. Водную фазу экстрагируют СН 2 Сl2 и подкисляют 1 н НСl. Полученное твердое вещество собирают и сушат в вакууме до получения 17,27 г целевого продукта. Т. плавления 168-172 С. 29 Сравнительный пример 13. Метил-4,5,6,7 тетрагидро-4-оксо-3-бензофуранкарбоксилат. К раствору 2,11 г 4-оксо-4,5,6,7 тетрагидробензо[b]фуран-3-карбоновой кислоты в 100 мл метанола добавляют 202 мг птолуолсульфоновой кислоты и полученную смесь нагревают при температуре кипения с обратным холодильником в течение 24 ч. Реакционную смесь охлаждают до комнатной температуры и метанол концентрируют в вакууме до получения остатка. Его растворяют в 100 мл этилацетата, промывают 30 мл насыщенного раствора бикарбоната натрия и 30 мл рассола. Органический слой сушат над сульфатом натрия, фильтруют и полученный фильтрат концентрируют в вакууме до получения остатка,который кристаллизуют из смеси этилацетатгексан до получения 1,75 г целевого продукта в виде твердого кристаллического вещества белого цвета. Температура плавления 100-102 С. Сравнительный пример 14. Метил-5,6,7,8 тетрагидро-5-оксо-4 Н-фтор[3,2-b]азепин-3 карбоксилат. К смеси 1,0 г метил-4,5,6,7-тетрагидро-4 оксо-3-бензофуранкарбоксилата и 502 мг азида натрия в 5 мл хлороформа прикапывают при 3236 С в атмосфере аргона 1,4 мл серной кислоты. Реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Е разбавляют 14 мл воды и подщелачивают NH4OH, а затем экстрагируют хлороформом. Выделенный органический слой промывают водой, рассолом и сушат над сульфатом натрия, а затем концентрируют в вакууме, в результате чего получают 1,0 г целевого продукта в виде твердого вещества белого цвета. Сравнительный пример 15. (Е)-4,5,6,7 тетрагидро-4-(4-метилфенил)сульфонил]окси] имино]-3-бензофуранкарбоновая кислота. К частичному раствору 2,8 г (Е)-4,5,6,7 тетрагидро-4-(гидроксиимино)-3-бензофуранкарбоновой кислоты в 7 мл пиридина порциями добавляют при 0 С 3,01 г п-толуолсульфонилхлорида в атмосфере аргона. Эту смесь перемешивают в течение 1 ч, а затем разбавляют 40 мл холодной 1 н НСl, фильтруют, промывают водой и сушат над сульфатом натрия. Полученный фильтрат концентрируют в вакууме до получения 4,78 г целевого продукта в виде твердого вещества грязно-белого цвета. Температура плавления 155-165 С. Сравнительный пример 16. 5,6,7,8-Тетрагидро-5-оксо-4 Н-фтор[3,2-b]азепин-3-карбоновая кислота. Смесь 1,0 г (Е)-4,5,6,7-тетрагидро-4-4 метилфенил)сульфонил]окси]имино]-3-бензофуранкарбоновой кислоты, 5,9 г ацетата калия, 23 мл этанола и 39 мл воды нагревают при кипении с обратным холодильником в течение 48 ч. Реакционную смесь концентрируют в вакууме,добавляют 80 мл метиленхлорида, выделенный органический слой промывают водой, рассолом 30 и сушат над сульфатом натрия. Органический слой концентрируют в вакууме до твердого вещества, которое очищают с помощью хроматографии на препаративной пластине силикагеля,элюируя 0,5% уксусной кислотой в этилацетате. Элюированную полосу промывают 1% уксусной кислотой в этилацетате. Органический слой сушат над сульфатом натрия и концентрируют в вакууме до получения 200 мг твердого вещества грязно-белого цвета, которое кристаллизуют из смеси этилацетат-гексан до получения 165 мг целевого продукта в виде твердого вещества белого цвета. Сравнительный пример 17. (Е)- и (Z)-4,5,6,7-тетрагидро-4-(гидроксиимино)-3-бензофуранкарбоновая кислота. К раствору 30,0 г 4,5,6,7-тетрагидро-4 оксо-3-бензофуранкарбоновой кислоты в 225 мл этанола добавляют 22,97 г гидроксиламингидрохлорида, а затем 18,10 г ацетата натрия и 55 мл воды. Реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 2,5 ч и концентрируют в вакууме до остатка, которым разбавляют 600 мл этилацетата, промывают 2 х 200 мл водой, рассолом и сушат над сульфатом натрия. Органический слой концентрируют в вакууме до остатка, который сушат в вакууме до получения 31,0 г целевого продукта в виде твердого вещества. Сравнительный пример 18. (Е) и (Z)-6,7 дигидро-4-(5 Н)бензофуранон, О-[4-метилфенил) сульфонил]оксим. К частичному раствору 28,0 г (Е) и (Z)4,5,6,7-тетрагидро-4-(гидроксиимино)бензофурана в 54 мл пиридина добавляют порциями при 0 С 38,8 г п-толуолсульфонилхлорида в атмосфере аргона. Полученную смесь перемешивают в течение 1 ч, затем разбавляют 600 мл этилацетата и 400 мл холодной 2 н НСl. Органический слой промывают 200 мл воды и 200 мл рассола и сушат над сульфатом натрия. Полученный фильтрат концентрируют в вакууме до получения 50 г целевого продукта в виде твердого вещества. В результате кристаллизации из этилового спирта с последующим выстаиванием при комнатной температуре получают 19,9 г игл грязно-белого цвета. Температура плавления 123-125 С. Фильтрат отстаивают, кристаллы собирают и сушат до получения 10,0 г целевого продукта в виде твердого вещества грязнобелого цвета. Температура плавления 83-85 С. Сравнительный пример 19. 4-(2-Хлор-4 нитробензоил)-5,6,7,8-тетрагидро-4 Н-тиено[3,2b]азепин. К раствору 15,0 г 5,6,7,8-тетрагидро-4 Нтиено[3,2-b]азепина в 150 мл дихлорметана, охлажденного до 0 С, добавляют 27,2 мл триэтиламина. После перемешивания в течение 5 мин медленно добавляют раствор 28,0 г 2-хлор-4 нитробензоилхлорида в 140 мл дихлорметана. Полученный раствор перемешивают при комнатной температуре в течение ночи, разбавляют 31 450 мл дихлорметана и полученный раствор промывают 200 мл (каждого) воды, 2 н лимонной кислоты, 1 М раствора бикарбоната натрия и рассола. Органический слой сушат над сульфатом натрия, фильтруют через тонкий слой силиката магния и полученный фильтрат концентрируют в вакууме. Остаток кристаллизуют из этилацетата до получения 24,3 г кристаллов грязно-белого цвета. Температура плавления 131-134 С. Сравнительный пример 20. 4-(2-Хлор-4 нитробензоил)-4,5,6,7-тетрагидро-8 Н-тиено[3,2b]азепин-8-он. К раствору 2,02 г 4-(2-хлор-4-нитробензоил)-4,5,6,7,8-тетрагидро-4 Н-тиено[3,2-b] азепина в 144 мл ацетона добавляют 1,56 г сульфата магния, 72 мл воды и 1,89 г перманганата калия. Полученную смесь перемешивают и нагревают при 70-75 С в течение 4 ч. Добавляют дополнительное количество сульфата магния(1,56 г) и перманганата калия (1,89 г) и полученную смесь перемешивают и нагревают при 75 С в течение 16 ч. Добавляют сульфат магния(1,5 г) и перманганат калия (1,89 г) и полученную смесь перемешивают и нагревают при 75 С в течение 5 ч. Эту смесь фильтруют через диатомовую землю и фильтровальную лепешку промывают ацетоном и дихлорметаном. Полученный фильтрат концентрируют и остаток (1,4 г) нагревают с этилацетатом, полученную смесь(вместе с нерастворимой частью) охлаждают и фильтруют до получения 1,0 г продукта в виде твердого вещества. Твердый продукт промывают водой и сушат до получения кристаллов. Температура плавления 180-185 С. Сравнительный пример 21. 5-Фтор-2 метилбензоилхлорид. Смесь 8,0 г 5-фтор-2-метилбензойной кислоты и 52 мл тионилхлорида нагревают на паровой бане в течение 1 ч. Летучую часть удаляют в вакууме и дважды добавляют по 50 мл толуола, растворитель удаляют в вакууме до получения 8,5 г продукта в виде смолы. Сравнительный пример 22. 2-Хлор-5(метилтио)бензоилхлорид. Смесь 2,03 г 2-хлор-5(метилтио)бензойной кислоты и 10 мл тионилхлорида нагревают на паровой бане в течение 1 ч. Летучие удаляют в вакууме, добавляют 20 мл толуола и удаляют в вакууме (дважды) до получения 2,2 г игл коричневого цвета. Сравнительный пример 23. 2-Хлор-4 нитробензоилхлорид. По способу сравнительного примера 21 25 г 2-хлор-4-нитробензойной кислоты подвергают взаимодействию с тионилхлоридом (124 мл) до получения продукта (27,0 г) в виде масла коричневого цвета. Сравнительный пример 24. 2-хлор-5 нитробензоилхлорид. По способу примера 21 5,0 г 2-хлор-5 нитробензойной кислоты подвергают взаимо 000607 32 действию с 50 мл тионилхлорида до получения 5,6 г продукта в виде твердого вещества грязнобелого цвета. Сравнительный пример 25. 2,3-Диметилбензоилхлорид. По способу примера 21 3,0 г 2,3 диметилбензойной кислоты подвергают взаимодействию с 40 мл тионилхлорида до получения 3,2 г продукта в виде бесцветного масла. Сравнительный пример 26. 2-Хлорбензоилхлорид. По способу примера 21 3,13 г 2-хлорбензойной кислоты подвергают взаимодействию с 40 мл тионилхлорида до получения 3,32 г продукта в виде полутвердого вещества грязнобелого цвета. Сравнительный пример 27. 4-[(2-Метилбензоил)амино]бензойная кислота. Смесь 43,42 г (0,26 моля) этил 4 аминобензоата и 40,8 г (0,26 моля) 2 метилбензоилхлорида в 150 мл дихлорметана охлаждают в ледяной бане и прикапывают 26,56 г (0,26 моля) триэтиламина. После добавления полученный раствор перемешивают при комнатной температуре в течение ночи. Полученную смесь выливают в воду и органический слой выделяют. Его промывают водой, 1 н НСl,1 М NаНСО 3 и сушат над сульфатом натрия. Растворитель удаляют, а твердую часть суспендируют в этилацетате и фильтруют, получая в результате 57 г этил 4-[(2-метилбензоил)амино] бензоата в виде кристаллов. Температура плавления 110-115 С. Смесь 50,7 г (0,20 моля) полученного соединения, 280 мл этанола и 55 мл 10 н NaOH кипятят с обратным холодильником в течение 5 мин. Смесь охлаждают до комнатной температуры, разбавляют 200 мл воды и подкисляют концентрированной соляной кислотой (рН 1-2). Полученную смесь фильтруют, твердую часть промывают водой и сушат до получения 51 г продукта в виде кристаллов белого цвета. Температура плавления 270-275 С. Сравнительный пример 28. 4-[(2-Метилбензоил)амино]бензоилхлорид. Смесь 10,3 г 4-[(2-метилбензоил)амино] бензойной кислоты и 32 мл тионилхлорида кипятят с обратным холодильником в течение 1,5 ч. Раствор концентрируют в вакууме, добавляют толуол и растворитель удаляют в вакууме. Добавляют толуол и полученную смесь охлаждают до получения твердого вещества желтого цвета. Температура плавления 135-141 С. Сравнительный пример 29. 4-[(2,6-Диметоксибензоил)амино]бензойная кислота. Смесь 2 г (10 ммолей) 2,6-диметоксибензоилхлорида, 1,65 г (10 ммолей) этил-4 аминобензоата, 1,11 г триэтиламина и 61 мг 4 диметиламинопиридина в 10 мл дихлорметана кипятят с обратным холодильником в течение 20 ч. Полученную смесь разбавляют водой и выделяют органический слой. Его промывают 33 водой, 1 н НСl, 1 н Na2 СО 3, рассолом и сушат над сульфатом натрия. Растворитель удаляют до получения твердого продукта, который кристаллизуют из этилацетата до получения 1,22 г этил 4-[(2,6-диметоксибензоил)амино]бензоата в виде кристаллов. Температура плавления 183185 С. Смесь 3,88 г (11,79 ммоля) полученного соединения, 17,3 мл 2 н NaOH и 20 мл метанола перемешивают при комнатной температуре в течение ночи. Добавляют метанол (30 мл) и воду (10 мл) и полученный раствор кипятят с обратным холодильником в течение получаса. Растворители удаляют в вакууме, а оставшуюся твердую часть тщательно растирают с эфиром и эфир декантируют. Твердую часть растворяют в 30 мл воды и подкисляют 2 н НСl (рН 3). Полученную смесь фильтруют, твердую часть промывают водой и сушат при 60 С в вакууме до получения 3,0 г твердого вещества. Температура плавления 236-240 С. Сравнительный пример 30. Этил-4-[(4 пиридинилкарбонил)амино]бензойная кислота. К холодной смеси 1,78 г (0,01 моля) изоникотиноилхлоридгидрохлорида в 5 мл дихлорметана добавляют 2,52 (0,025 моля) триэтиламина. К этому раствору добавляютраствор 1,65 г этил 4-аминобензоата в 5 мл дихлорметана. После перемешивания при комнатной температуре в течение ночи добавляют 50 мг 4 диметиламинопиридина и полученную смесь кипятят с обратным холодильником в течение 24 ч. Полученную смесь выливают в воду и фильтруют до получения 3,4 г твердого вещества коричневого цвета. Образец в 0,50 г тщательно растирают с этилацетатом до получения 0,37 г этил 4-[(4-пиридинилкарбонил)амино]бензоата в виде кристаллов желтого цвета. Т. плавления 143-145 С. Сравнительный пример 31. 2-Метилфуран 3-карбонилхлорид. Смесь 4,0 г метил-2-метилфуран-3 карбоксилата, 30 мл 2 н NaOH и 15 мл метанола кипятят с обратным холодильником в течение 1,5 ч. Растворитель удаляют в вакууме до получения твердого вещества, его экстрагируют дихлорметаном (сливают), твердый продукт растворяют в воде и раствор подкисляют 2 н лимонной кислотой до получения твердого продукта. Его промывают водой и сушат до получения кристаллов. Получают 1,05 г кристаллов 2-метилфуран-3-карбоновой кислоты. Полученное соединение (0,95 г) и 3 мл тионилхлорида кипятят с обратным холодильником в течение 1 ч. Растворитель удаляют, добавляют толуол (20 мл, трижды) и растворитель удаляют, получая продукт в виде масла. Сравнительный пример 32. 4-[N-метил-N(2-метилбензоил)амино]бензойная кислота. Образец 1,51 г гидрида натрия (60% в масле) промывают гексаном в атмосфере аргона для удаления масла. К промытому гидриду натрия 34 добавляют 5 мл N,N-диметилформамида. К этой смеси прикапывают раствор 8,69 г этил 4-[(2 метилбензоил)амино]бензоата в 20 мл диметилформамида. Полученную смесь перемешивают при комнатной температуре в течение 0,5 ч, а затем добавляют 5,23 г метилйодида. Полученную смесь перемешивают при комнатной температуре в течение 16 ч. Эту смесь разбавляют водой и экстрагируют дихлорметаном. Полученный экстракт сушат над сульфатом натрия,концентрируют для уменьшения объема, и полученный раствор фильтруют через тонкий слой водного силиката магния. Полученный фильтрат концентрируют в вакууме до получения 11 г масла (1:1 г смесь продукта и N,Nдиметилформамида). Полученный продукт,этил-4-[N-метил-N-(2-метилбензоил)амино] бензоат (11 г), растворяют в 30 мл метанола и добавляют 25 мл 2 н NaOH. Полученную смесь кипятят с обратным холодильником в течение 2 ч и растворитель удаляют. Остаток экстрагируют эфиром (сливают), а оставшееся растворяют в 50 мл воды. Основной раствор подкисляют 2 н лимонной кислотой, твердую часть отфильтровывают и промывают водой. Полученный продукт сушат на воздухе до получения 6,72 г кристаллов. Температура плавления 187-190 С. Сравнительный пример 33. 4-[N-метил-N(2-метилбензоил)амино]бензоилхлорид. Раствор 6,72 г 4-[N-метил-N-(2-метилбензоил)амино] бензойной кислоты в 20 мл тионилхлорида кипятят с обратным холодильником в течение 1 ч. Летучие удаляют в вакууме, добавляют толуол к остатку, а затем толуол удаляют в вакууме (это повторяют несколько раз) до получения 7,3 г продукта в виде масла коричневого цвета. По способу сравнительного примера 32, но заменяя соответствующий этил-4-[(N-ароил) амино]бензоат, получают следующие соединения: Сравнительный пример 34. 4-[N-метил-N(2-хлорбензоил)амино]бензойная кислота. Сравнительный пример 35. N-[N-метил-N(2,5-дихлорбензоил)амино]бензойная кислота. Сравнительный пример 36. N-[N-метил-N(2,4-дихлорбензоил)амино]бензойная кислота. Сравнительный пример 37. 4-[N-метил-N(2-хлор-4-метилбензоил)амино]бензойная кислота. Сравнительный пример 38. 4-[N-метил-N(2-метил-4-хлорбензоил)амино]бензойная кислота. Сравнительный пример 39. 4-[N-метил-N(2,4-диметилбензоил)амино]бензойная кислота. Сравнительный пример 40. 4-[N-метил-N(2,3-диметилбензоил)амино] бензойная кислота. Сравнительный пример 41. 4-[N-метил-N(2-метоксибензоил)амино]бензойная кислота. Сравнительный пример 42. 4-[N-метил-N(2-трифторметоксибензоил)амино]бензойная кислота. 35 Сравнительный пример 43. 4-[N-метил-N(2,4-диметоксибензоил)амино]бензойная кислота. Сравнительный пример 44. 4-[N-метил-N(2-метокси-4-хлорбензоил)амино]бензойная кислота. Сравнительный пример 45. 4-[N-метил-N(2-метилтиобензоил)амино]бензойная кислота. Сравнительный пример 46. 4-[N-метил-N(2-метилтиофен-3-ил-карбонил)амино]бензойная кислота. Сравнительный пример 47. 4-[N-метил-N(3-метилтиофен-2-ил-карбонил)амино]бензойная кислота. Сравнительный пример 48. 4-[N-метил-N(2-метилфуран-3-ил-карбонил)амино]бензойная кислота. Сравнительный пример 49. 4-[N-метил-N(3-метилфуран-3-ил-карбонил)амино]бензойная кислота. Сравнительный пример 50. 4-[N-метил-N(фенилацетил)амино]бензойная кислота. Сравнительный пример 51. 4-[N-метил-N(2-хлорфенилацетил)амино]бензойная кислота. Сравнительный пример 52. 4-[N-метил-N(2-метоксифенилацетил)амино]бензойная кислота. Сравнительный пример 53. 4-[N-метил-N(2-метилфенилацетил)aмино]бензойная кислота. Сравнительный пример 54. 4-[N-метил-N(циклогексилкарбонил)амино]бензойная кислота. Сравнительный пример 55. 4-[N-метил-N(3-циклогексенкарбонил)амино]бензойная кислота. Сравнительный пример 56. 4-[N-метил-N(циклогексилацетил)амино]бензойная кислота. Сравнительный пример 57. 7,8-Дигидро 5(6H)хинолинон. Смесь 57,93 г 3-амино-2-циклогексен-1 она, 76,8 г 3-(диметиламино)акротеина, 62,5 мл ледяной уксусной кислоты и 270 мл толуола кипятят с обратным холодильником в течение 16 ч и концентрируют в вакууме досуха. Добавляют 200 мл толуола и растворитель удаляют в вакууме. К остатку добавляют 1 л дихлорметана, а затем 200 мл насыщенного бикарбоната натрия (медленное добавление) и добавляют твердый NаНСО 3 для доведения рН до 8. Полученную смесь фильтруют и выделяют слой СН 2 Сl2. Его пропускают через тонкий слой водного силиката магния и полученный фильтрат концентрируют досуха. Оставшееся масло черного цвета экстрагируют горячим гексаном и гексан декантируют. Этот процесс повторяют до тех пор, пока гексан больше не экстрагирует продукт. Гексановые экстракты объединяют и растворитель удаляют, получая 17,3 г продукта в виде масла. Сравнительный пример 64. 7,8-Дигидро 5(6 Н)хинолинон, оксим. 36 К раствору 3,78 г 7,8-дигидро-5(6 Н) хинолона в 20 мл этанола добавляют 2,68 г гидроксиламина, гидрохлорида 3,23 ацетата натрия и 5 мл воды. Полученную смесь кипятят с обратным холодильником в атмосфере аргона в течение 4,5 ч, охлаждают и фильтруют, твердую часть промывают 30 мл смеси этанол-вода (1:1) и сушат в вакууме до получения 3,58 г твердого вещества. Температура плавления 232-236 С. В результате перекристаллизации из этанола получают кристаллы. Т. плавления 234-236 С. Сравнительный пример 65. 7,8-Дигидро 5(6 Н)хинолинон, О-[(4-метилфенил)сульфонил] оксим. К смеси 2,30 г 7,8-дигидро-5(6 Н)хинолинон оксима, 3,59 г 4-метилфенилсульфонилхлорида в 32 мл ацетона добавляют раствор 0,84 г гидроксида калия в 10 мл воды. Полученную смесь кипятят с обратным холодильником в течение 0,5 ч в атмосфере аргона и летучие удаляют в вакууме. К остатку добавляют воду и полученную смесь фильтруют, а твердую часть промывают водой и 1 н бикарбонатом натрия. Твердую часть растворяют в дихлорметане, сушат и растворитель удаляют до получения 3,83 г твердого вещества. После перекристаллизации из диэтилового эфира получают кристаллы. Температура плавления 102104 С. Сравнительный пример 66. 5,7,8,9 Тетрагидро-6 Н-пиридо[3,2-b]азепин-6-он. Смесь 8,26 г 7,8-дигидро-5(6 Н)-хинолинон,О-[(4-метилфенил)сульфонил]оксима, 54,63 г ацетата калия, 193 мл этанола и 354 мл воды кипятят с обратным холодильником в течение 20 ч. Эту смесь концентрируют в вакууме для удаления летучих компонентов и в водный остаток, который содержит твердые частицы, добавляют хлороформ. Полученную смесь фильтруют через диатомовую землю, фильтровальную лепешку промывают хлороформом и полученный фильтрат концентрируют досуха. Твердую часть перекристаллизовывают из ацетона до получения 2,81 г кристаллов. Температура плавления 156-159 С. Сравнительный пример 67. 6,7,8,9 Тетрагидро-5 Н-пиридо[3,2-b]азепин. Смесь 1,56 г 5,7,8,9-тетрагидро-6 Нпиридо[3,2-b]азепин-6-она, 3,31 г литийалюминийгидрида в 40 мл тетрагидрофурана кипятят с обратным холодильником в течение 4 ч. Полученную смесь охлаждают (0 С) и прикапывают 25 мл метанола. Полученную смесь фильтруют через диатомовую землю, фильтровальную лепешку промывают тетрагидрофураном, а полученный фильтрат концентрируют досуха в вакууме. К остатку добавляют 50 мл воды и полученную смесь экстрагируют диэтиловым эфиром. Этот экстракт сушат над сульфатом натрия и фильтруют через тонкий слой водного силиката магния (слой промывают диэтиловым эфиром). Полученный фильтрат концентрируют в 37 вакууме до получения 1,01 г кристаллов с Т. плавления 70-71 С. Сравнительный пример 68. 6,7,8,9 Тетрагидро-5-(2-хлор-4-нитробензоил)-5 Нпиридо[3,2-b]азепин. К смеси 2,90 г 6,7,8,9-тетрагидро-5 Нпиридо[3,2-b]азепина, 2,37 г триэтиламина в 40 мл дихлорметана добавляют 5,16 г 2-хлор-4 нитробензоилхлорида в 50 мл дихлорметана. Полученную смесь перемешивают при комнатной температуре в атмосфере аргона в течение 3 ч, а затем выливают в воду. Выделяют органический слой, промывают его 1 н бикарбонатом натрия, водой, рассолом и сушат над сульфатом натрия. Полученный раствор фильтруют через тонкий слой водного силиката магния, фильтровальную лепешку промывают CH2Cl2 и этилацетатом, а полученный фильтрат концентрируют досуха, оставшееся твердое вещество (7,13 г) тщательно растирают с этилацетатом до получения 4,41 г кристаллов грязно-белого цвета. Температура плавления 143-145 С. Сравнительный пример 69. 6,7,8,9 Тетрагидро-5-(4-амино-2-хлорбензоил)-5 Нпиридо[3,2-b]азепин. Смесь 3,31 г 6,7,8,9-тетрагидро-5-(2-хлор 4-нитробензоил)-5 Н-пиридо[3,2-b]азепина и 6,78 г дигидрата хлорида олова (SnCl22H2O) в 200 мл метанола кипятят с обратным холодильником в течение 2 ч в атмосфере аргона. Растворитель удаляют в вакууме добавляют 5 мл насыщенного раствора бикарбоната натрия и твердый NaHCO3 для доведения рН до 7. Полученную смесь экстрагируют этилацетатом. Экстракт фильтруют через диатомовую землю и полученный фильтрат промывают насыщенным раствором бикарбоната натрия, водой, рассолом и сушат над сульфатом натрия. Полученный фильтрат пропускают через тонкий слой водного силиката магния и полученный фильтрат концентрируют досуха до получения 2,58 г аморфного твердого вещества. Элементный анализ для C16H16ClN3O. Рассчитано: С 59,9; Н 5,7; N 13,1; Cl 11,1. Найдено: С 60,5; Н 5,0; N 12,9; Cl 11,6. Сравнительный пример 70. Meтил-6 аминопиридин-3-карбоксилат. Сухой метанол (400 мл) охлаждают на ледяной бане и газообразный НСl барботируют через смесь в течение 25 мин. К МеОН-НСl добавляют 30 г 6-аминопиридин-3-карбоновой кислоты, а затем полученную смесь перемешивают и нагревают при 90 С в течение 2 ч (при этом растворяется вся твердая часть). Растворитель удаляют в вакууме, а остаток растворяют в 100 мл воды. Кислый раствор нейтрализуют насыщенным водным бикарбонатом натрия (отделяется твердая часть) и полученную смесь охлаждают и фильтруют до получения 30 г белых кристаллов. Температура плавления 150154 С. 38 Сравнительный пример 71. 6-[(5-Фтор-2 метилбензоил)амино]пиридин-3-карбоновая кислота. К смеси 4,5 г метило-6-амино-пиридин-3 карбоксилата и 5,53 мл триэтиламина в 40 мл дихлорметана (охлаждено на бане со льдом) добавляют 6,38 г 5-фтор-2-метилбензоилхлорида в 10 мл дихлорметана. Полученную смесь перемешивают при комнатной температуре в атмосфере аргона в течение 18 ч и добавляют дополнительно 3,4 г 5-фтор-2-метилбензоилхлорида. После трехчасового перемешивания при комнатной температуре полученную смесь фильтруют до получения 3,0 г метил-6-бис-(5 фтор-2-метилбензоил)]амино]пиридин-3-карбоксилата. Полученный фильтрат концентрируют досуха, а остаток тщательно растирают с гексаном и этилацетатом до получения дополнительно 9,0 г бис-ацилированного соединения. Смесь 12,0 г метил 6-бис-(5-фтор-2 метилбензоил)]амино]пиридин-3-карбоксилата,60 мл смеси метанол:тетрагидрофуран (1:1) и 23 мл 5 н NaOH перемешивают при комнатной температуре в течение 16 ч. Полученную смесь концентрируют в вакууме, разбавляют 25 мл воды, охлаждают и подкисляют 1 н НСl. Эту смесь фильтруют и твердую часть промывают водой до получения 6,3 г продукта в виде твердого вещества белого цвета. По способу сравнительного примера 71, но заменяя соответствующий ароилхлорид гетероароилхлоридом,циклоалканоилхлоридом,фенилацетилхлоридами и родственными соответствующими хлорангидридами, получают следующие 6-[(ароил)амино]пиридин-3-карбоновые кислоты, 6-[(гетероароил)амино]пиридин-3-карбоновые кислоты и родственные 6[(ацилированные)амино]пиридин-3-карбоновые кислоты. Сравнительный пример 72. 6-[(3-Метил-2 тиенилкарбонил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 73. 6-[(2-Метил-3 тиенилкарбонил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 74. 6-[(3-Метил-2 фуранилкарбонил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 75. 6-[(2-Метил-3 фуранилкарбонил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 76. 6-[(3-Фтор-2 метилбензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 77. 6-[(2 Метилбензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 78. 6-[(2-Хлорбензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 79. 6-[(2-Фторбензоил)амино]пиридин-3-карбоновая кислота. 40 Сравнительный пример 101. 6-[(2,5 Дихлобензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 102. 6-[(3,5 Дихлорбензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 103. 6-[(2-Метил 4-хлорбензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 104. 6-[(2,3 Диметилбензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 105. 6-[(2 Метоксибензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 106. 6-[(2 Трифторметоксибензоил)амино]пиридин-3 карбоновая кислота. Сравнительный пример 107. 6-[(4-Хлор-2 метоксибензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 108. 6-(2(Трифторметил)бензоил]амино]пиридин-3 карбоновая кислота. Сравнительный пример 109. 6-[(2,6 Дихлорбензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 110. 6-[(2,6 Диметилбензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 111. 6-[(2 Метилтиобензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 112. 6-[(4-Фтор-2(трифторметил)бензоил)амино]пиридин-3 карбоновая кислота. Сравнительный пример 113. 6-[(2,3 Дихлорбензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 114. 6-[(4-Фтор-2 метилбензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 115. 6-[(2,3,5 Трихлорбензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 116. 6-[(5-Фтор-2 хлорбензоил)амино]пиридин-3-карбоновая кислота. Сравнительный пример 117. 6-[(2-Фтор-5(трифторметил)бензоил)амино]пиридин-3 карбоновая кислота. Сравнительный пример 118. 6-[(5-Фтор-2 метилбензоил)амино]пиридин-3-карбонилхлорид. Смесь 6,2 г 6-[(5-фтор-2-метилбензоил) амино]пиридин-3-карбоновой кислоты и 23 мл тионилхлорида кипятят с обратным холодильником в течение 1 ч. Добавляют дополнительно 12 мл тионилхлорида и полученную смесь кипятят с обратным холодильником в течение получаса. Смесь концентрируют досуха в вакууме и добавляют 30 мл толуола к остатку. Толуол уда 41 ляют в вакууме и процесс (добавление и удаление толуола) повторяют до получения 7,7 г сырого продукта в виде твердого вещества. По способу примера 118 получают следующие 6-[(ацил)амино]пиридин-3-карбонилхлориды. Сравнительный пример 119. 6-[(3-Метил 2-тиенилкарбонил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 120. 6-[(2-Метил 3-тиенилкарбонил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 121. 6-[(3-Метил 2-фуранилкарбонил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 122. 6-[(2-Метил 3-фуранилкарбонил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 123. 6-[(3-Фтор-2 метилбензоил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 124. 6-[(2 Метилбензоил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 125. 6-[(2-Хлорбензоил)амино]пиридин-3-карбонилхлорид,белые кристаллы. Сравнительный пример 126. 6-[(2 Фторбензоил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 127. 6-[(2-Хлор-4 фторбензоил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 128. 6-[(2,4 Дихлорбензоил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 129. 6-[(4-Хлор-2 фторбензоил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 130. 6-[(3,4,5 Триметоксибензоил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 131. 6-[(2,4 Дифторбензоил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 132. 6-[(2-Бромбензоил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 133. 6-[(2-Хлор-4 нитробензоил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 134. 6-[(Тетрагидрофуранил-2-карбонил)амино]пиридин-3 карбонилхлорид. Сравнительный пример 135. 6-[(Тетрагидротиенил-2-карбонил)амино]пиридин-3 карбонилхлорид. Сравнительный пример 136. 6-[(Циклогексилкарбонил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 137. 6-[(Циклогекс-3-ен-илкарбонил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 159. 6-[(2-Метилтиобензоил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 160. 6-4-Фтор-2(трифторметил)бензоил]амино]пиридин-3 карбонилхлорид. Сравнительный пример 161. 6-[(2,3-Дихлорбензоил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 162. 6-[(4-Фтор-2 метилбензоил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 163. 6-[(2,3,5 Трихлорбензоил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 164. 6-[(5-Фтор-2 хлорбензоил)амино]пиридин-3-карбонилхлорид. Сравнительный пример 165. 6-2-Фтор-5(трифторметил)бензоил]амино]пиридин-3-карбонилхлорид. По способу сравнительного примера 71 получают следующие бис-ацилированные продукты (табл. A) и очищают их с помощью хроматографической обработки на силикагеле. Затем эти соединения гидролизуют до кислот по способу примера 71 (табл. В). Таблица А М+ представляет молекулярный ион по данным масс-спектрометрии с бомбардировкой быстрыми атомами. Примечание к таблице В: М+ представляет молекулярный ион по данным масс-спектрометрии с бомбардировкой быстрыми атомами. Сравнительный пример 190. 6-Амино-5 бромпиридин-3-карбоновая кислота. К перемешиваемому раствору 6 аминоникотиновой кислоты (13,8 г, 0,1 моля) в ледяной уксусной кислоте (100 мл) медленно добавляют бром (16 г, 5 мл, 0,1 моля) в 20 мл уксусной кислоты. Реакционную смесь перемешивают в течение 8 ч при комнатной температуре и уксусную кислоту удаляют при пониженном давлении. Твердый остаток желтого цвета растворяют в воде и осторожно нейтрализуют 30% NH4OH. Выделенную твердую часть фильтруют и промывают водой до получения 18 г твердого вещества. Масс-спектр: 218(М+). Сравнительный пример 191. Метил-6 амино-5-бромпиридин-3-карбоксилат. 6-Амино-5-бромпиридин-3-карбоновую кислоту растворяют в насыщенной метанольной НСl (100 мл) и кипятят с обратным холодильником в течение 24 ч. Растворитель, метанол, снова удаляют при пониженном давлении, а остаток растворяют в ледяной холодной воде. Водный раствор нейтрализуют 0,1 н NaOH и твердую часть, которая выделяется, фильтруют, хорошо промывают водой и сушат на воздухе до получения 10 г продукта в виде твердого вещества. Масс-спектр: 231 (М+). 45 Сравнительный пример 192. 6-[(2-Метилбензолацетил)амино]пиридин-3-карбоновая кислота. К холодной (0 С) смеси 5,0 г метил 6 аминопиридин-3-карбоксилата, 12,6 мл N,Nдиизопропилэтиламина в 40 мл дихлорметана добавляют раствор 12,2 г 2-метилбензолацетилхлорида в 10 мл дихлорметана. Полученную смесь перемешивают в атмосфере аргона при комнатной температуре в течение ночи. Эту смесь разбавляют 200 мл дихлорметана и 50 мл воды и выделяют органический слой. Его промывают 50 мл (каждого) 1 М NаНСО 3, рассола и сушат над сульфатом натрия. Полученный раствор фильтруют через тонкий слой водного силиката магния и полученный фильтрат концентрируют досуха. Остаток (9,0 г) обрабатывают на хроматографической колонке с силикагелем,элюируя смесью этилацетат-гексан (1:3) до получения 8,6 г твердого продукта. Этот продукт,в основном 6-бис(2-метилбензолацетил)] амино]пиридин-3-карбоксилат, растворяют в 60 мл смеси тетрагидрофуранметанол (1:1) и 23 мл 5 нNaOH добавляют к раствору. Полученную смесь перемешивают при комнатной температуре в течение ночи и концентрируют в вакууме. Добавляют воду (25 мл) и полученную смесь перемешивают и подкисляют холодной 1 н НС 1. Эту смесь охлаждают, твердую часть отфильтровывают и промывают водой до получения 5,9 г твердого вещества грязно-белого цвета. Сравнительный пример 193. 6-[(2-Метилбензоацетил)амино]пиридин-3-карбонилхлорид. Смесь 4,5 г 6-[(2-метилбензолацетил) амино]пиридин-3-карбоновой кислоты и 25 мл тионилхлорида кипятят с обратным холодильником в течение 1 ч, а затем концентрируют досуха в вакууме. К остатку добавляют 20 мл толуола и растворитель удаляют в вакууме. Добавление и удаление толуола повторяют, а оставшееся твердое вещество сушат при комнатной температуре в вакууме до получения 5,3 г твердого продукта темно-коричневого цвета. Сравнительный пример 194. 2-(2-Пиридинил)бензойная кислота. Смесь метил 2-йодобензоата (12 г, 47 ммоля), 2-пиридинил-три-н-бутилстаннана (20 г, 55 ммоля) и тетра-кис-(трифенилфосфин)палладия(0) (2 г), кипятят с обратным холодильником в толуоле (обезгаженном) в течение 48 ч. Реакционную смесь концентрируют в вакууме, а остаток обрабатывают на хроматографической колонке с силикалем, элюируя 50% смесью этилацетат:гексан. Начальные фракции (2 литра) сливают, а конечный продукт, метил 2-(2 пиридинил)бензоат, элюируют и выделяют в виде масла (выход 5,5 г). Масс-спектр 213 (М+). Смесь полученного соединения (3,0 г, 14 ммолей) и NaOH (600 мг, 15 ммолей) кипятят с обратным холодильником в смеси МеОН:вода(9:1) (50 мл) в течение 4 ч. После завершения реакции реакционную смесь концентрируют в 46 вакууме и остаток растворяют в 50 мл холодной воды. В результате нейтрализации ледяной уксусной кислотой получают твердый продукт,который отфильтровывают и промывают водой до получения 2,5 г твердого вещества коричневого цвета; оно слегка растворимо в воде. Масс-спектр (химическое индуцирование): 200 (М+1). Сравнительный пример 195. Этил-3-[N-(3 этоксикарбонил-2-пиридинил)-N-(4-метилфенилсульфонил)]аминобутан-1-карбоксилат. Смесь 13,4 г этил-2-[(4-метилфенилсульфонил)амино]пиридин-3-карбоксилата, 23,1 безводного карбоната калия и 20,4 г этил 3 бромбутан-1-карбоксилата в 300 мл N,Nдиметилформамида нагревают при 110 С в атмосфере аргона в течение 6 ч. Полученную смесь концентрируют досуха в высоком вакууме и к остатку добавляют СН 2 Сl2 и воду. Органический слой выделяют и промывают водой(трижды), обрабатывают активированным углем и сушат над сульфатом магния. Растворитель удаляют, а остаток обрабатывают хроматографически на короткой колонке с силикагелем. Элюируют вначале 1900 мл СН 2 Сl2, затем 1300 мл СН 2 Сl2 и, наконец, 4 л 5% этилацетата в СН 2 Сl2. Фракции 5% этилацетата в СН 2 Сl2 объединяют и сушат над сульфатом магния, растворитель удаляют до получения 16,9 г кристаллов белого цвета. Образец в 0,5 г перекристаллизовывают из толуола, получая кристаллы белого цвета (промыты гексаном) (0,39 г). Т. плавления 129,5-130 С. Сравнительный пример 196. Этил-8,9 дигидро-5-гидрокси-9-[(4-метилфенил]сульфонил]-7 Н-пиридо[2,3-b]азепин-6-карбоновая кислота. К раствору 7,85 г (70,0 ммоля) третбутоксида калия в 150 мл тетрагидрофурана,охлажденного на бане со льдом, добавляют 15,2 г (35,0 ммоля) этил-3-[N-(3-карбэтокси-2 пиридинил)-N-(4-метилфенилсульфонил)]аминобутан-1-карбоксилата в 150 мл сухого тетрагидрофурана по каплям в течение 50 мин. Полученную смесь перемешивают на бане со льдом в течение 5 ч и выливают в 500 мл ледяной воды. рН смеси доводят до 5 за счет 10% HCl и экстрагируют этилацетатом 4 раза. Полученный экстракт сушат над сульфатом магния и растворитель удаляют в вакууме. Остаток обрабатывают хроматографически на силикагеле, элюируя 10% этилацетатом в СН 2 Сl2. Фракции, содержащие продукт, объединяют и растворитель удаляют, получая 12,8 г смолы бледно-желтого цвета. Масс-спектр (с бомбардировкой быстрыми атомами): 389b]азепин-6-карбоксилата, 265 мл диметилсульфоксида и 1,52 мл воды в атмосфере аргона нагревают при 150 С в течение 16,5 ч. Полученную смесь выливают в 2700 мл ледяной воды и смесь охлаждают в течение 16 ч. Смесь фильтруют, твердую часть промывают водой и сушат. Желто-коричневый остаток растворяют в этилацетате, полученный раствор промывают 50 мл(4 раза) воды. Добавляют активированный уголь к раствору и полученную смесь фильтруют через сульфат магния. Полученный фильтрат концентрируют досуха в вакууме до получения 10,4 г твердого продукта. 9,24 г твердого продукта фильтруют через силикагель за счет 5% этилацетата в дихлорметане в качестве растворителя. Полученный фильтрат концентрируют в вакууме до получения 6,7 г твердого вещества грязно-белого цвета. Масс-спектр (химическое индуцирование): 317 (М+Н). Сравнительный пример 198. 6,7,8,9 Тетрагидро-5-(2-хлор-4-нитробензоил)-5 Нпиридо[3, 2-b]азепин,1-оксид. К раствору 0,497 г 6,7,8,9-тетрагидро-5-(2 хлор-4-нитробензоил)-5 Н-пиридо[3,2-b]азепина в 7 мл хлороформа добавляют 1,04 г 3-хлорпербензойной кислоты. Полученную смесь кипятят с обратным холодильником в течение ночи и растворитель удаляют в вакууме. К остатку добавляют 100 мл воды и полученную смесь экстрагируют дихлорметаном. Экстракт промывают водой, 1 н NаНСО 3, водой и сушат над сульфатом натрия. Полученный раствор фильтруют через тонкий слой водного силиката магния. Фильтровальную лепешку промывают 10% метанолом в этилацетате до получения 0,49 г продукта в виде стекла (пена). Температура плавления 110-125 С. Сравнительный пример 199. 6,7,8,9 Тетрагидро-5 Н-пиридо[2,3-b]азепин-5-он. Раствор 5,00 г 6,7,8,9-тетрагидро-9-[(4 метилфенил)сульфонил]-5 Н-пиридо[3,2b]азепин-5-она в 60 мл 40% (объем/объем) серной кислоты в уксусной кислоте нагревают при 60 С в течение 11 ч. Полученную смесь охлаждают и выливают в 350 мл ледяной воды (охлажденной в бане со льдом) при тщательном перемешивании. К холодной смеси добавляют твердую NaOH до установления рН 8, поддерживая при этом температуру ниже 30 С. Полученную смесь фильтруют и твердую часть промывают этилацетатом. Органический слой фильтрата выделяют, а водный слой экстрагируют этилацетатом. Органический слой и экстракты объединяют и обрабатывают активированным углем. Полученную смесь фильтруют через MgSO4 и растворитель удаляют при пониженном давлении до получения 2,0 г кристаллов желтого цвета. Сравнительный пример 200. 6,7,8,9 тетрагидро-9-(2-хлор-4-нитробензоил)-5 Нпиридо[2,3-b]азепин-5-он. 48 К раствору 6,7,8,9-тетрагидро-5 Нпиридо[2,3-b]азепин-5-она и 0,234 г триэтиламина в 6 мл дихлорметана добавляют 0,506 г 2 хлор-4-нитробензоилхлорида в 2 мл дихлорметана. Полученную смесь перемешивают при комнатной температуре в течение ночи в атмосфере аргона. Раствор промывают водой, 10% бикарбонатом натрия и сушат над сульфатом магния. Растворитель удаляют до получения масла коричневого цвета, которое кристаллизуется. Полученную смесь обрабатывают хроматографически на силикагеле с помощью прибора Waters-Prep-500, используя в качестве растворителя смесь этилацетат-гексан (1:1), до получения 2,4 г кристаллов грязно-белого цвета. Т. плавления 162-164 С (который идентифицирован как О-2-хлор-4-нитробензоильное производное(2-хлор-4-нитробензоиленолят продукта) и 0,80 г продукта в виде кристаллов. Т. плавления при медленном разложении 160-220 С. Сравнительный пример 201. 6-(4 Аминобензоил)-1,4,5,6-тетрагидропиразоло[3,4d]-тиено[3,2-b]азепин. Смесь 2,0 г 6-(4-нитробензоил)-1,4,5,6 тетрагидропиразоло[3,4-d]тиено[3,2-b]азепина в 40 мл абсолютного этанола перемешивают в атмосфере аргона, добавляя при этом 1,6 мл гидразина. Реакционную смесь нагревают при 60 С в течение 1,5 ч. Е охлаждают до комнатной температуры, добавляют 400 мг 10% Pd/C и реакционную смесь нагревают при 100 С в течение 1,5 ч. Реакционную смесь фильтруют через диатомовую землю, а фильтровальную лепешку промывают метиленхлоридом. Полученный фильтрат концентрируют в вакууме до получения остатка, который кристаллизуют из смеси этилацетат:гексан до получения 1,4 г целевого продукта в виде кристаллов желтого цвета. Температура плавления 242-260 С. Сравнительный пример 202. 7-[(Диметиламино)метилен]-4,5,6,7-тетрагидро-4-(2 хлор-4-нитробензоил)-8 Н-тиено[3,2-b]азепин-8 он. Смесь 3,0 г 4,5,6,7-тетрагидро-4-(2-хлор-4 нитробензоил)-8 Н-тиено[3,2-b]азепин-8-она и 20 мл трет-бутокси-бис-(диметиламино)метана нагревают на паровой бане в течение 2 ч, а затем добавляют 10 мл метиленхлорида. Реакционную смесь кипятят с обратным холодильником в течение 1 ч. Реакционную смесь выпаривают в вакууме до получения остатка, который разбавляют 100 мл метиленхлорида и фильтруют через слой силиката магния. Полученный фильтрат фильтруют через короткую колонку с силикагелем до получения 2,45 г целевого продукта в виде пены желтого цвета. Сравнительный пример 203. 6-(2-хлор-4 нитробензоил)-1,4,5,6-тетрагидропиразоло[3,4d]тиено[3,2-b]азепин. К смеси 2,2 г 7-[(диметиламино)метилен]4,5,6,7-тетрагидро-4-(2-хлор-4-нитробензоил) 49 8 Н-тиено[3,2-b]азепина в 40 мл этанола добавляют 341 мкл гидразина с последующим нагреванием при 60 С в течение 1,5 ч. Летучие компоненты выпаривают в вакууме, а остаток растворяют в 100 мл этилацетата и фильтруют через слой водного силиката магния. Полученный фильтрат выпаривают в вакууме до получения 1,85 г целевого продукта в виде твердого вещества желто-оранжевого цвета. Сравнительный пример 204. 6-(2-Хлор-4 аминобензоил)-1,4,5,6-тетрагидропиразоло[3,4d]тиено[3,2-b]азепин. Смесь 1,8 г 6-(2-хлор-4-нитробензоил)1,4,5,6-тетрагидропиразоло[3,4-d]тиено[3,2b]азепина в 35 мл абсолютного этанола добавляют к 5,42 г хлорида олова (II) с последующим нагреванием при кипении с обратным холодильником в течение 1 ч при 80 С. Летучие компоненты выпаривают в вакууме до остатка,который разделяют между 150 мл этилацетата и насыщенным водным NаНСО 3; реагенты перемешивают при комнатной температуре в течение 1 ч и фильтруют. Органический слой выделяют и промывают 30 мл рассола, сушат над сульфатом натрия и фильтруют через слой водного силиката магния. Полученный фильтрат выпаривают в вакууме до получения 1,55 г пены желто-оранжевого цвета. Сравнительный пример 205. 7-[(Диметиламино)метилен]-4,5,6,7-тетрагидро-4-(4-нитробензоил)-8 Н-тиено[3,2-b]азепин-8-он. Смесь 3,2 г 4,5,6,7-тетрагидро-4-(4-нитробензоил)-8 Н-тиено[3,2-b]азепин-8-она и 32 мл трет.-бутокси-бис(диметиламино)метана нагревают на паровой бане в течение 3,5 ч. Реакционную смесь оставляют выстаиваться в течение 48 ч. Реакционную смесь выпаривают в вакууме и концентрат растворяют в 150 мл метиленхлорида, фильтруют через водный силикат магния дважды. Летучие выпаривают в вакууме до остатка, который растворяют в 25 мл этилацетата и фильтруют. Полученный фильтрат охлаждают до получения 3,2 г целевого продукта в виде твердого вещества светло-оранжевого цвета. Т. плавления 214-216 С. Сравнительный пример 206. N-[4-7-(диметиламинометилен)-(5,6,7,8-тетрагидро-8 оксо-4 Н-тиено[3,2-b]азепин-4-ил)карбонил]фенил]-2-метилбензамид. Смесь 100 мг N-[4-[(5,6,7,8-тетрагидро-8 оксо-4 Н-тиено[3,2-b]азепин-4 ил)карбонил]фенил]-2-метилбензамида и 1 мл трет-бутокси-бис(диметиламино)метана нагревают при 50 С в течение 1 ч. К реакционной смеси добавляют 3 мл метиленхлорида и нагревание продолжают в течение дополнительно 2 ч при 60-70 С. Летучие компоненты выпаривают до остатка, который растворяют в 25 мл метиленхлорида и фильтруют через водный слой силиката магния. Полученный фильтрат выпаривают в вакууме до остатка, который очищают хроматографически на препаративных толсто 000607 50 слойных пластинах силикагеля, элюируя этилацетатом до получения целевого продукта в виде твердого вещества светло-желтого цвета (20 мг). Сравнительный пример 207. 2-Хлор-7[(диметиламино)метилен]-4,5,6,7-тетрагидро-4(4-нитробензоил)-8 Н-тиено[3,2-b]азепин-8-он. Смесь 1,1 г 2-хлор-4,5,6,7-тетрагидро-4-(4 нитробензоил)-8H-тиено[3,2-b]азепин-8-она и 11 мл трет-бутокси-бис(диметиламино)метана кипятят с обратным холодильником в течение 3,5 ч. Реакционную смесь оставляют выстаиваться в течение 24 ч. Реакционную смесь выпаривают в вакууме и концентрат очищают на хроматографической колонке с силикагелем до получения 520 мг целевого продукта в виде некристаллического твердого продукта. Сравнительный пример 208. 8-Хлор 2,4,5,6-тетрагидро-2-метил-6-(4-нитробензоил)пиразоло[3,4-d]тиено[3,2-b]азепин. Смесь 500 мг 2-хлор-7-[(диметиламино)метилен]-4,5,6,7-тетрагидро-4-(4-нитробензоил)-8 Н-тиено(3,2-b]азепин-8-она в 15 мл абсолютного метанола перемешивают в атмосфере аргона, добавляя при этом 131 мкл Nметилгидразина. Реакционную смесь нагревают при 80 С в течение 18 ч, охлаждают до комнатной температуры и концентрируют в вакууме до получения 420 мг целевого продукта в виде твердого вещества. Сравнительный пример 209. 6-(2-Хлор-4 аминобензоил)-1,4,5,6-тетрагидропиразоло[3,4d]пиридо[3,2-b]азепин. По способу сравнительного примера 204 6(2-хлор-4-нитробензоил)-1,4,5,6-тетрагидропиразоло[3,4-d]пиридо[3,2-b]азепин восстанавливают хлоридом олова (SnCl2) в этаноле до получения продукта в виде твердого вещества. Сравнительный пример 210. 5-(2-Хлор-4 аминобензоил)-4,10-дигидро-5 Н-пиридо[3,2-b] тиено[3,2-е]азепин. По способу сравнительного примера 204 5(2-хлор-4-нитробензоил)-4,10-дигидро-5 Н-пиридо[3,2-b]тиено[2,3-е]азепин восстанавливают хлоридом олова (SnCl2) в этаноле до получения продукта в виде твердого вещества. Сравнительный пример 211. 5-(2-Хлор-4 аминобензоил)-6,10-дигидро-5 Н-пиридо[3,2-b] тиено[3,2-е]азепин. По способу сравнительного примера 204 5(2-хлор-4-нитробензоил)-6,10-дигидро-5 Н-пиридо[3,2-b]тиено[3,2-е]азепин восстанавливают хлоридом олова (SnCl2) в этаноле до получения продукта в виде твердого вещества. Сравнительный пример 212. 5-(4-Нитробензоил)-6,7,8,9-тетрагидро-5 Н-пиридо[3,2-b] азепин. Раствор 2,96 г 6,7,8,9-тетрагидро-5 Нпиридо [3,2-b]азепина, 3,03 г триэтиламина и 4,45 г 4-нитробензоилхлорида в 30 мл дихлорметана перемешивают в атмосфере аргона при комнатной температуре в течение 4 ч. Получен 51 ную смесь выливают в воду и органический слой выделяют и промывают насыщенным раствором бикарбоната натрия, водой и рассолом. Органический слой сушат над сульфатом натрия и фильтруют через тонкий слой водного силиката магния. Полученный фильтрат концентрируют досуха до получения 6,35 г твердого вещества. В результате тщательного растирания с 25 мл дихлорметана получают 5,50 г твердого вещества светло-желтого цвета; образец при следующем этапе тщательного растирания дает кристаллы. Температура плавления 231-233 С. Сравнительный пример 213. 5-(4 нитробензоил)-6,7,8,9-тетрагидро-5 Н-пиридо[3,2-b]азепин, 1-оксид. Смесь 1,18 г 5-(4-нитробензоил)-6,7,8,9 тетрагидро-5 Н-пиридо[3,2-b]азепина и 1,37 г 3 хлорпероксибензойной кислоты в 10 мл дихлорметана перемешивают при комнатной температуре в течение ночи в атмосфере аргона. Полученную смесь разбавляют 15 мл дихлорметана и этот раствор промывают 1 н NаНСО 3,водой, рассолом и сушат над сульфатом натрия. Полученный раствор фильтруют через тонкий слой водного силиката магния. Фильтровальный слой промывают 50 мл этилацетата. Затем его промывают смесью этилацетат-метанол (5:1),этилацетат-метанол собирают и растворители удаляют до получения 0,86 г кристаллов. Температура плавления 231-233 С. Сравнительный пример 214. 5-(2-Хлор-4 нитробензоил)-6,7,8,9-тетрагидро-5 Н-пиридо[3,2-b]азепин, 1-оксид. Смесь 0,497 г 5-(2-хлор-4-нитробензоил)6,7,8,9-тетрагидро-5 Н-пиридо[3,2-b]азепина и 0,38 г 3-хлорпероксибензойной кислоты в 7 мл дихлорметана кипятят с обратным холодильником в атмосфере аргона в течение 18 ч. Растворитель удаляют в атмосфере аргона, а к остатку добавляют воду. Полученную смесь экстрагируют дихлорметаном, экстракт промывают 1 нNаНСО 3, водой и сушат над сульфатом натрия. Раствор фильтруют через тонкий слой водного силиката магния. Фильтровальный слой промывают этилацетатом, а затем смесью этилацетатметанол (9:1). Этилацетат-метанольную промывку собирают отдельно и растворитель удаляют в вакууме до получения стеклообразного продукта. Температура плавления 110-125 С. Сравнительный пример 215. 5-(2-Хлор-4 нитробензоил)-9-гидрокси-6,7,8,9-тетрагидро 5 Н-пиридо[3,2-b]азепин, O-ацетат. Смесь 0,49 г 5-(2-хлор-4-нитробензоил)6,7,8,9-тетрагидро-5 Н-пиридо[3,2-b]азепин, 1 оксида в 5 мл уксусного ангидрида нагревают на масляной бане при 90 С в течение 36 ч, добавляют толуол (25 мл) и полученную смесь концентрируют в высоком вакууме. Процесс повторяют, а остаток обрабатывают хроматографически на препаративных пластинах силикагеля, элюируя этилацетатом до получения 52 0,24 г кристаллов. Температура плавления 162165 С. Элементный анализ для C18H15Cl N3O5: Рассчитано: С 55,5; Н 4,1; N 10,8. Найдено: С 55,5; Н 4,0; N 10,6. Сравнительный пример 216. 5-(4-Нитробензоил)-9-гидрокси-6,7,8,9-тетрагидро-5 Нпиридо[3,2-b]азепин, O-ацетат. Смесь 0,58 г 5-(4-нитробензоил)-6,7,8,9 тетрагидро-5 Н-пиридо[3,2-b]азепин, 1-оксида и 5 мл уксусного ангидрида в 10 мл дихлорметана кипятят с обратным холодильником в течение 2 дней. Добавляют дополнительно 2 мл уксусного ангидрида и полученную смесь кипятят с обратным холодильником в течение 2 дней. К этой смеси добавляют толуол 30 мл (дважды) и растворитель удаляют в высоком вакууме. Остаток обрабатывают хроматографически на препаративных пластинах силикагеля, используя в качестве растворителя этилацетат до получения 0,37 г кристаллов с температурой плавления 135137 С. Сравнительный пример 217. 5-(4-Нитробензоил)-9-гидрокси-6,7,8,9-тетрагидро-5 Нпиридо[3,2-b]азепин. К смеси 0,5 г 5-(4-нитробензоил)-9 гидрокси-6,7,8,9-тетрагидро-5 Н-пиридо[3,2b]азепин, O-ацетата в 10 мл смеси метанол-вода(8:2) добавляют КНСО 3 и полученную смесь перемешивают при комнатной температуре в течение ночи. Полученную смесь концентрируют в вакууме, разбавляют 10 мл воды и экстрагируют этилацетатом. Полученный экстракт сушат над сульфатом натрия и растворитель удаляют до получения продукта в виде твердого вещества. В результате хроматографической обработки на силикагеле, используя в качестве растворителя этилацетат, получают кристаллы. Температура плавления 182-185 С. Сравнительный пример 218. 5,6,7,8 Тетрагидро-5-(4-нитробензоил)-9 Н-пиридо[3,2b]азепин-9-он. Смесь 0,5 г 5-(4-нитробензоил)-9-гидрокси-6,7,8,9-тетрагидро-5 Н-пиридо[3,2-b]азепина в 5 мл диметилсульфоксида и 1 мл уксусного ангидрида перемешивают при комнатной температуре в течение 16 ч. К этой смеси добавляют 10 мл воды и 1 н бикарбонат натрия. Полученную смесь экстрагируют этилацетатом и экстракт промывают водой, 1 н NаНСО 3, рассолом и сушат. Растворитель удаляют до получения твердого вещества. В результате хроматографической обработки на силикагеле этилацетатом в качестве растворителя получают продукт в виде твердого вещества. Температура плавления 188-190 С. Сравнительный пример 219. 5,6,7,8-Тетрагидро-5-(2-хлор-4-нитробензоил)-9 Н-пиридо[3,2-b]азепин-9-он. По способу сравнительного примера 218 5(2-хлор-4-нитробензоил)-9 Н-гидрокси-6,7,8,9 тетрагидро-5 Н-пиридо[3,2-b]азепин подвергают 53 взаимодействию со смесью диметилсульфоксид-уксусный ангидрид до получения продукта в виде твердого вещества. Сравнительный пример 220. 6,7,8,9 тетрагидро-9-(4-нитробензоил)-5 Н-пиридо[2,3b] азепин-5-он. К раствору 2,11 г 6,7,8,9-тетрагидро-5 Нпиридо[2,3-b]азепин-5-она в 40 мл дихлорметана добавляют 3,28 г твердого NаНСО 3. К перемешиваемой смеси в атмосфере аргона прикапывают 3,14 г 4-нитробензоилхлорида в 30 мл дихлорметана, содержащего 2 мл тетрагидрофурана и смесь перемешивают в течение ночи. К этой смеси добавляют тетрагидрофуран и воду и полученную смесь фильтруют. Твердую часть промывают хлороформом (твердая часть растворяется) и выделяют органический слой фильтрата. Его фильтруют через МgSO4 и фильтрат концентрируют досуха до получения твердого вещества белого цвета. Твердую часть из двух циклов растворяют в смеси этилацетатметиленхлорид (2:8) и фильтруют через короткую колонку с силикагелем, собиpaя фракции,содержащие продукт. Растворитель удаляют,твердую часть растворяют в горячей смеси хлороформ-метанол и полученный раствор обрабатывают активированным углем. Полученную смесь фильтруют через диатомовую землю и полученный фильтрат концентрируют досуха в вакууме до получения 7,73 г кристаллов белого цвета. Масс-спектр (химическое индуцирование)(СН 4): 312 (МН+). Сравнительный пример 221. 6-[(Диметиламино)метилен]-6,7,8,9-тетрагидро-9-(4-нитробензоил)-5 Н-пиридо[2,3-b]азепин-5-он. К суспензии 0,50 г 6,7,8,9-тетрагидро-9-(4 нитробензоил)-5 Н-пиридо[2,3-b]азепин-5-она в 10 мл тетрагидрофурана в атмосфере аргона добавляют 0,70 г трет-бутоксибис(диметиламино)метана и полученную смесь перемешивают при комнатной температуре в течение ночи. Летучие компоненты удаляют в вакууме, а остаток в смеси этилацетат -CH2Cl2 (2:8) фильтруют через короткую колонку с силикагелем. Силикагель промывают этилацетатом (сливают), а затем хлороформом, содержащим 3% метанола, до получения 0,51 г продукта в виде твердого продукта желтого цвета. Сравнительный пример 222. 6-[(Диметиламино)метилен]-6,7,8,9-тетрагидро-9-(2-хлор-4 нитробензоил)-5 Н-пиридо[2,3-b]азепин-5-он. К раствору 0,20 г 6,7,8,9-тетрагидро-9-(2 хлор-4-нитробензоил)-5 Н-пиридо [2,3-b]азепин 5-она в 2 мл диоксана добавляют 0,504 г третбутокси-бис(диметиламино)метана и полученную смесь перемешивают при комнатной температуре. Летучие компоненты удаляют в высоком вакууме. Остаток растворяют в смеси этилацетат-СН 2 Сl2 (3:7), полученный раствор пропускают через короткую колонку с си 000607 54 ликагелем (этилацетат-СН 2 Сl2), элюат сливают. В результате элюирования смесью этилацетатСН 2 Сl2 (8:2) получают продукт в виде стеклообразного твердого вещества желтого цвета (0,19 г). Масс-спектр (химическое индуцирование)(СН 4): 401 (МН+). Сравнительный пример 223. 1,4,5,6 тетрагидро-6-(4-нитробензоил)пиразоло[3,4-d] пиридо[2,3-b]азепин. К суспензии 0,51 г 6-[(диметиламино) метилен]-6,7,8,9-тетрагидро-9-(4-нитробензоил)5 Н-пиридо[2,3-b] азепин-5-она в 17 мл метанола в атмосфере аргона добавляют 0,14 г гидразингидрата. Полученную смесь перемешивают в течение ночи и растворитель удаляют в вакууме. Остаток растворяют в горячей смеси хлороформ-метанол (95:5) и фильтруют через силикагель и фильтровальную лепешку промывают смесью хлороформ-метанол (95:5). Полученный фильтрат концентрируют досуха до получения 0,48 г твердого вещества желтого цвета. Сравнительный пример 224. 1,4,5,6-Тетрагидро-6-(4-аминобензоил)пиразоло[3,4-d]пиридо[2,3-b]азепин. К суспензии 0,170 г 1,4,5,6-тетрагидро-6(4-нитробензоил)пиразоло[3,4-d]пиридо[2,3-b] азепина в 8 мл этанола в атмосфере аргона добавляют 0,573 г дигидрата хлорида олова(SnCl22H2O). Полученную смесь кипятят с обратным холодильником в течение 1 ч, разбавляют смесью лед-вода и подщелачивают 10% раствором бикарбоната натрия. Полученную смесь перемешивают в течение 3,5 ч и экстрагируют трижды хлороформом. Полученные экстракты сушат над сульфатом магния, а растворитель удаляют при пониженном давлении. В результате хроматографической обработки на силикагеле, элюируя этилацетатом, получают 0,10 г кристаллов грязно-белого цвета. Сравнительный пример 225. 8-[(Диметиламино)метилен]-5,6,7,8-тетрагидро-5-(4 нитробензоил)-9 Н-пиридо[3,2-b]азепин-9-он. По способу примера 221 5,6,7,8-тетрагидро-5-(4-нитробензоил)-9 Н-пиридо[3,2-b] азепин-9-он подвергают взаимодействию с третбутокси-бис(диметиламино)метаном до получения продукта в виде твердого вещества. Сравнительный пример 226. 1,4,5,6-Тетрагидро-6-(4-нитробензоил)пиразоло[3,4-d]пиридо[3,2-b]азепин. По способу сравнительного примера 223 8-[(диметиламино)метилен]-5,6,7,8-тетрагидро 5-(4-нитробензоил)-9 Н-пиридо[3,2-b]азепин-9 он подвергают взаимодействию с гидразингидратом до получения продукта в виде твердого вещества. Т. плавления 255-256 С. Сравнительный пример 227. 5,6-Дигидро 6-(4-аминобензоил)-4 Н-изоксазоло[5,4-d]тиено[3,2-b]азепин-8-она, 0,234 г гидроксиламингидрохлорида и 16 мл метанола кипятят с обратным холодильником в течение 4 ч. Полученную смесь охлаждают и фильтруют, твердую часть промывают небольшим количеством холодного метанола и холодного этилацетата до получения 0,41 г кристаллов желто-коричневого цвета. Т. плавления 218-222 С. Полученное соединение в этаноле кипятят с обратным холодильником с SnCl2H2O в течение одного часа, охлаждают и разбавляют смесью лед-вода. Полученную смесь подщелачивают 10% NаНСО 3 и перемешивают в течение 3,5 ч при комнатной температуре. Полученную смесь экстрагируют этилацетатом и экстракт промывают рассолом. Этот экстракт сушат над сульфатом натрия и растворитель удаляют. Остаток обрабатывают хроматографически на силикагеле, элюируя смесью этилацетат-гексан до получения продукта в виде твердого вещества. Сравнительный пример 228. 5,6,7,8-Тетрагидро-5-(4-нитробензоил)-9 Н-пиридо[3,2-b]азепин-9-он. Смесь 0,313 г 5-(4-нитробензоил)-9 гидрокси-6,7,8,9-тетрагидро-5 Н-пиридо[3,2-b] азепина, 4 мл СН 2 Сl2 и 0,75 мл диметилсульфоксида охлаждают до 25 С и добавляют 0,405 г цианурового хлорида. Полученную смесь выдерживают при 25 С в течение 6,5 ч и добавляют 0,41 г триэтиламина. Полученную смесь перемешивают 10 мин и выливают в воду. Смесь экстрагируют дихлорметаном, экстракты промывают водой, рассолом и сушат над сульфатом натрия. Растворитель удаляют до получения 0,39 г твердого вещества. В результате хроматографической обработки этилацетатом на силикагеле, получают 0,17 г кристаллов. Т. плавления 188-190 С. Сравнительный пример 229. Метил-4[([1,1'-бифенил]-2-карбонил)амино]-3-метоксибензоат. Смесь 10,0 г [1,1'-бифенил]-2-карбоновой кислоты в 75 мл метиленхлорида и 12,52 г оксалилхлорида перемешивают при комнатной температуре в течение 15 ч. Летучие компоненты выпаривают в вакууме до получения 11,06 г масла. Порцию этого масла (2,16 г) в 25 мл метиленхлорида подвергают взаимодействию с 1,81 г метил 4-амино-3-метоксибензоата и 1,30 гN,N-диизопропилэтиламина при перемешивании при комнатной температуре в течение 18 ч. Реакционную смесь промывают водой, насыщенным водным бикарбонатом натрия и органический слой сушат над сульфатом натрия. Органический слой пропускают через водный силикат магния и добавляют к фильтрату гексан при кипении, получая 3,20 г целевого продукта в виде кристаллического твердого вещества. Температура плавления 115-117C. Сравнительный пример 230. Метил 4[([1,1'-бифенил]-2-карбонил)амино]-2-хлорбензоат. 56 Раствор 2,37 г [1,1'-бифенил]-2-карбонилхлорида в 10 мл метиленхлорида прикапывают к ледяному раствору 1,84 г метил-4-амино-2 хлорбензоата и 1,49 г N,N-диизопропилэтиламина в 50 мл метиленхлорида. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и промывают водой,насыщенным водным бикарбонатом натрия и органический слой сушат над сульфатом натрия. Органический слой пропускают через слой водного силиката магния, и при кипении добавляют гексан до получения 1,1 г целевого продукта в виде твердого кристаллического вещества. Температура плавления 132-134 С. Сравнительный пример 231. 4-[([1,1'-Бифенил]-2-карбонил)амино]-2-хлорбензойная кислота. Смесь 3,0 г метил-4-[([1,1'-бифенил]-2 карбонил)амино]-2-хлорбензоата в 75 мл абсолютного этанола и 2,0 мл 10 н гидроксида натрия нагревают на паровой бане в течение 3 ч. Добавляют воду для получения раствора, который экстрагируют метиленхлоридом. Водную фазу подкисляют уксусной кислотой и полученную твердую часть собирают и сушат в вакууме при 80 С до получения 0,1 г целевого продукта в виде кристаллического твердого вещества. Температура плавления 217-219 С. Сравнительный пример 232. 4-[([1,1'Бифенил]-2-карбонил)амино]-3-метоксибензоилхлорид. Раствор 2,69 г 4-[([1,1'-бифенил]-2 карбонил)амино]-3-метоксибензойной кислоты в 5 мл тионилхлорида нагревают на паровой бане в течение 1 ч в атмосфере аргона. Летучие компоненты удаляют в вакууме до получения остатка, который перемешивают с гексаном,получая 2,58 г твердого кристаллического вещества. Температура плавления 121-123 С. М+=361. Сравнительный пример 233. Метил 4[([1,1'-бифенил]-2-карбонил)амино]бензоат. Смесь 10,0 г [1,1'-бифенил]-2-карбоновой кислоты в 75 мл метиленхлорида и 12,52 г оксалилхлорида перемешивают при комнатной температуре в течение 18 ч. Летучие компоненты выпаривают в вакууме до получения 11,66 г масла. Порцию этого масла в 7,5 г в 25 мл метиленхлорида прикапывают к раствору 4,53 г метил-4-амино-бензоата и 4,3 гN,Nдиизопропилэтиламина в 100 мл метиленхлорида при 0 С. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и промывают водой, насыщенным водным бикарбонатом натрия и органический слой сушат над сульфатом натрия. Органический слой пропускают через водный силикат магния и к фильтрату добавляют при кипении гексан до получения 8,38 г целевого продукта в виде кристаллического твердого вещества. Температура плавления 163-165C. 57 Сравнительный пример 234. 4-[([1,1'-Бифенил]-2-карбонил)амино]бензойная кислота. Образец 3,15 г метил-4-[([1,1'-бифенил]-2 карбонил)амино]бензоата кипятят с обратным холодильником в течение 8 часов в 100 мл этилового спирта и 2,5 мл 10 н гидроксида натрия. Охлажденную реакционную смесь подкисляют кислотой и целевой продукт собирают и сушат до получения 1,9 г целевого продукта в виде твердого вещества. Температура плавления 246249 С. Сравнительный пример 235. 4-[([1,1'-Бифенил]-2-карбонил)амино]бензоилхлорид. Смесь 1,39 г 4-[([1,1'-бифенил]-2-карбонил)-амино]бензойной кислоты в 2,0 мл тионилхлорида нагревают на паровой бане в течение 1 ч. Добавляют холодный гексан и полученные кристаллы собирают и сушат до получения 1,34 г целевого продукта. Температура плавления 118-120 С. Сравнительный пример 236. 2-(Фенилметил)бензоилхлорид. Смесь 5,0 г 2-(фенилметил)бензойной кислоты и 5,0 мл тионилхлорида нагревают на паровой бане в течение 1 ч. Летучие компоненты выпаривают в вакууме до получения 5,74 г целевого продукта в виде масла.M+=227 (в виде сложного метилового эфира). Сравнительный пример 237. Метил 4-2(фенилметил)бензоил]амино]бензоат. К 3,03 г метил 4-аминобензоата и 3,12 гN,N-диизопропилэтиламина в 75 мл метиленхлорида добавляют 5,54 г 2(фенилметил)бензоилхлорида, и реагенты перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь промывают водой,насыщенным водным бикарбонатом натрия и органический слой сушат над сульфатом натрия. Органический слой пропускают через водный силикат магния дважды и к фильтрату при кипении добавляют гексан до получения 5,04 г целевого продукта в виде кристаллического твердого вещества. Температура плавления 138139 С. Сравнительный пример 238. Натрий-4-2(фенилметил)бензоил]амино]бензоат. Смесь 4,90 г метил-4-2-(фенилметил) бензоил]амино]бензоата в 100 мл абсолютного этанола и 3,50 мл 10 н гидроксида натрия нагревают на паровой бане в течение 3 ч. Водную фазу отфильтровывают и полученную твердую часть собирают и сушат до получения 4,25 г целевого продукта. Температура плавления 340346 С. Сравнительный пример 239. 4-2-(Фенилметил)бензоил]амино]бензойная кислота. Смесь 4,0 г натрий-4-2-(фенилметил) бензоил]амино]бензоата суспендируют в воде и рН доводят до 5 за счет уксусной кислоты. Твердую часть собирают фильтрованием и сушат при 80 С в вакууме до получения 3,75 г 58 целевого продукта. Температура плавления 246247 С. М+=332. Сравнительный пример 240. 4-2-(Фенилметил)бензоил]амино]бензоилхлорид. Смесь 2,0 г 4-2-(фенилметил)бензоил] амино]бензойной кислоты в 2,0 мл тионилхлорида нагревают на паровой бане в течение 1 ч. Летучие компоненты выпаривают в вакууме до получения 1,53 г целевого продукта в виде масла. М+=346 (в виде метилового сложного эфира). Сравнительный пример 241. Метил-4-(2 фенилметил)бензоил]амино]-2-хлорбензоат. Смесь 5,0 г 2-(фенилметил)бензойной кислоты в 5,0 мл тионилхлорида нагревают на паровой бане в течение 1 ч. Летучие компоненты выпаривают в вакууме до получения 5,70 г масла. Порцию этого масла (2,85 г) в 25 мл метиленхлорида добавляют к раствору 50 мл метиленхлорида, содержащему 1,85 г метил 4-амино 2-хлорбензоата и 1,65 гN,N-диизопропилэтиламина при перемешивании при комнатной температуре в течение 18 ч. Реакционную смесь промывают водой, насыщенным водным бикарбонатом натрия и органический слой сушат над сульфатом натрия. Органический слой пропускают через водный силикат магния дважды и к фильтрату при кипении добавляют гексан, в результате чего получают 2,96 г целевого продукта в виде кристаллического твердого вещества. Температура плавления 133-135 С.M+=380. Сравнительный пример 242. Метил-4-(2 фенилметил)бензоил]амино]-3-метоксибензоат. Раствор 2,85 г 2(фенилметил)бензоилхлорида в 25 мл метиленхлорида добавляют по каплям к ледяному раствору 1,84 г метил-4-амино-3-метоксибензоата и 1,61 г N,N-диизо-пропилэтиламина в 50 мл метиленхлорида. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и промывают водой, насыщенным водным бикарбонатом натрия, и органический слой сушат над сульфатом натрия. Органический слой пропускают через слой водного силиката магния и при кипении добавляют гексан до получения 2,2 целевого продукта в виде кристаллического твердого вещества. Температура плавления 129131 С. М+=376. Сравнительный пример 243. 2-Хлор-4-(2 фенилметил)бензоил]амино]бензойная кислота. Смесь 2,8 г метил-2-хлор-4-(2-фенилметил)бензоил]амино]бензоата в 75 мл абсолютного этанола и 1,84 мл 10 н гидроксида натрия нагревают на паровой бане в течение 3 ч. Добавляют воду для получения раствора, который экстрагируют метиленхлоридом. Водную фазу подкисляют уксусной кислотой и полученную твердую часть собирают и сушат над сульфатом натрия в вакууме при 80 С до получения 2,6 г целевого продукта в виде кристаллическо 59 го твердого вещества. Температура плавления 184-187 С. М+ Н = 366. Сравнительный пример 244. 3-метокси-4(2-фенилметил)бензоил]амино]бензоат. Смесь 2,05 г метил 4-(2-фенилметил)бензоил]амино]-3-метоксибензоата в 75 мл абсолютного этанола и 1,4 мл 10 н гидроксида натрия нагревают на паровой бане в течение 3 ч. Воду добавляют до получения раствора,который экстрагируют метиленхлоридом. Водную фазу подкисляют уксусной кислотой, а оставшуюся твердую часть собирают и сушат в вакууме при 80 С до получения 1,87 г целевого продукта в виде кристаллического твердого вещества. Температура плавления 176-178 С. M+ Н=362. Сравнительный пример 245. 3-Метокси-4(2-фенилметил)бензоил]амино]бензоилхлорид. Смесь 1,71 г 3-метокси-4-(2 фенилметил)бензоил]амино]бензойной кислоты в 2,0 мл тионилхлорида нагревают на паровой бане в атмосфере аргона в течение 1 ч и добавляют гексан. Полученное твердое вещество собирают и сушат до получения 1,71 г целевого продукта в виде кристаллического твердого вещества. Температура плавления 130-135 С.M+=376 (в виде сложного метилового эфира). Сравнительный пример 246. [4'-(Трифторметил)-1,1'-бифенил]-2-карбонилхлорид. Смесь 5,0 г 4'-(трифторметил)-[1,1'бифенил]-2-карбоновой кислоты в 5,0 мл тионилхлорида нагревают на паровой бане в атмосфере аргона в течение 1 ч и добавляют гексан. Полученное твердое вещество собирают и сушат до получения 5,38 г целевого продукта в виде бесцветного масла. М+=280 (в виде сложного метилового эфира). Сравнительный пример 247. Метил 2-xлop4-[([4'-(3-фтopмeтил)[1,1'-бифенил]карбонил] амино]бензоат. Раствор 3,13 г [4'-(трифторметил)-[1,1'бифенил]-2-карбонилхлорида в 25 мл метиленхлорида прикапывают к ледяному раствору 1,84 г метил-4-аминобензоата и 1,43 г N,Nдиизопропилэтиламина в 50 мл метиленхлорида. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и промывают водой, насыщенным водным бикарбонатом натрия и органический слой сушат над сульфатом натрия. Органический слой пропускают через слой водного силиката магния и при кипении добавляют гексан до получения 3,36 г целевого продукта в виде кристаллического твердого вещества. Температура плавления 164-165 С. М+=З 96. Сравнительный пример 248. 3-Метокси-4[(4-(трифторметил)[1,1'-бифенил]-2-карбонил) амино]бензоилхлорид. Смесь 2,0 г 3-метокси-4-[([4'-(трифторметил)[1,1'-бифенил]-2 карбонил)амино]бензойной кислоты в 20 мл тионилхлорида нагревают на паровой бане в 60 атмосфере аргона в течение 1 ч и добавляют гексан. Полученное твердое вещество собирают и сушат до получения 1,92 г целевого продукта в виде кристаллического твердого вещества. Температура плавления 136-138 С. Сравнительный пример 249. 3-Метокси-4(4'-трифторметил)[1,1'-бифенил]-3-карбонил] амино]бензойная кислота. Смесь 3,78 г метил-3-метокси-4-[(4'трифторметил)[1,1'-бифенил]-2-карбонил)амино]бензоата в 75 мл абсолютного этанола и 2,20 мл 10 н гидроксида натрия нагревают на паровой бане в течение 3 ч. Добавляют воду до получения раствора, который экстрагируют метиленхлоридом. Водную фазу подкисляют уксусной кислотой и полученный твердый продукт собирают и сушат в вакууме при 80 С до получения 3,49 г целевого продукта в виде кристаллического твердого вещества. Т. плавления 213215 С. Сравнительный пример 250. Метил-3 метокси-4-(4'-трифторметил)[1,1'-бифенил]-2 карбонил]амино]бензоат. Раствор 3,56 г (4'-трифторметил)[1,1'бифенил]-2-карбонилхлорида в 25 мл метиленхлорида прикапывают к ледяному раствору 1,81 г метил 4-амино-3-метокси-бензоата и 1,62 гN,N-диизопропилэтиламина в 50 мл метиленхлорида. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и промывают водой, насыщенным водным бикарбонатом натрия, и органический слой сушат над сульфатом натрия. Органический слой пропускают через слой водного силиката магния и при кипении добавляют гексан до получения 3,9 г целевого продукта в виде кристаллического твердого вещества. Температура плавления 112113 С. Сравнительный пример 251. 2-Хлор-4-[(4'(трифторметил)[1,1'-бифенил]-2-карбонил)амино]бензоилхлорид. Смесь 1,39 г 2-хлор-4-[(4'-(трифторметил)[1,1'-бифенил]-2-карбонил)ами-но]бензойной кислоты в 2,0 мл тионилхлорида нагревают на паровой бане в течение 1 ч. Реакционную смесь концентрируют до остатка в вакууме. Добавляют холодный гексан и твердую часть сушат до получения 1,39 г целевого продукта. Сравнительный пример 252. 2-Хлор-4-[(4'(трифторметил)[1,1'-бифенил]-2-карбонил)амино]бензойная кислота. Смесь 3,83 г метил-2-хлор-4-[(4'(трифторметил)[1,1'-бифенил]-2-карбонил) амино]бензоата в 75 мл абсолютного этанола и 2,20 мл 10 н гидроксида натрия нагревают на паровой бане в течение 3 ч. Добавляют воду для получения раствора, который экстрагируют метиленхлоридом. Водную фазу подкисляют уксусной кислотой и полученную твердую часть собирают и сушат в вакууме при 80 С до получения 3,42 г целевого продукта в виде кристал
МПК / Метки
МПК: C07D 495/14, A61K 31/55
Метки: антагонисты, трициклические, вазопрессина, бензазепиновые
Код ссылки
<a href="https://eas.patents.su/30-607-triciklicheskie-benzazepinovye-antagonisty-vazopressina.html" rel="bookmark" title="База патентов Евразийского Союза">Трициклические бензазепиновые антагонисты вазопрессина.</a>
Предыдущий патент: Производные винилсульфеновых кислот и способ их получения
Следующий патент: Комбинированный водомер
Случайный патент: Устройство и способ оптического воспроизведения изображения особенностей на поверхности руки










