Синтез гидроксисульфона и родственных соединений.
Номер патента: 1246
Опубликовано: 25.12.2000
Авторы: Муди Дэвид, Сохар Пол, Матр Дэвид Дж., Блэкер Эндрю Дж.
Формула / Реферат
1. Способ получения соединения формулы IV, имеющего структурную формулу
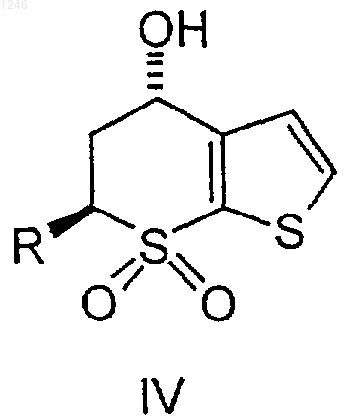
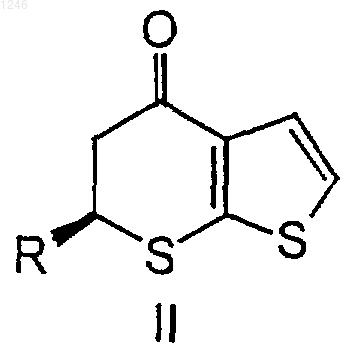
где R представляет водород, С1-4 алкил или С1-4 алкокси-С1-4 алкил, включающий добавление ангидрида к первому раствору, содержащему растворитель и соединение формулы I

где R определен выше, при поддержании температуры от примерно -5 до примерно 50шС, с получением второго раствора, содержащего соединение структурной формулы II
где R определен выше, добавление ко второму раствору от примерно 0,2 до примерно 2 эквивалентов воды, на основе исходного количества ангидрида, и окислителя, принадлежащего группе, состоящей из пероксида водорода, трет-бутилгидропероксида, периодата, перхлората и продукта электрохимического окисления, при поддержании температуры от примерно 15 до 80шС с получением соединения III
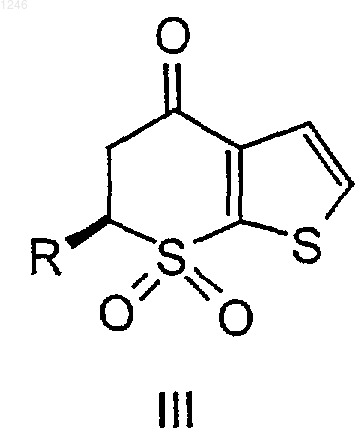
где R определен выше, восстановление соединения III с получением соединения IV и выделение соединения IV.
2. Способ по п.1, где ангидрид необязательно находится в присутствии кислот.
3. Способ по п.1, в котором R представляет собой метил, ангидрид принадлежит к группе, состоящей из трифторуксусного ангидрида, уксусного ангидрида и трихлоруксусного ангидрида, растворитель принадлежит к группе, состоящей из толуола, бензола, циклогексана, гептана и ксилола.
4. Способ по п.3, где ангидридом является трифторуксусный ангидрид, растворителем является толуол и окислителем является пероксид водорода.
5. Способ по п.1, в котором во время добавления ангидрида температуру поддерживают от около 20 до 40шС, а температура окисления составляет от 20 до около 60шС.
6. Способ по п.2, где кислота принадлежит к группе, состоящей из карбоновых кислот и неорганических кислот.
7. Способ по п.6, где неорганические кислоты принадлежат к группе, состоящей из фосфорной, полифосфорной, ортофосфорной кислот и пентоксида фосфора.
8. Способ по п.4, в котором добавляют, по меньшей мере, 2 моль-эквивалента окислителя.
9. Способ получения соединения формулы IV, имеющего структурную формулу
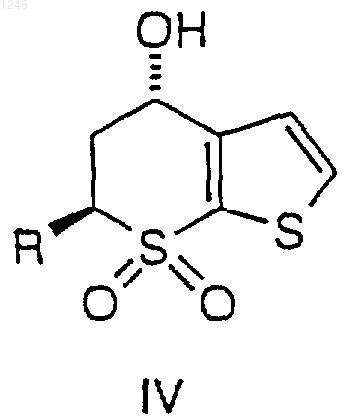
где R представляет собой метил, включающий добавление трифторуксусного ангидрида к первому раствору, содержащему толуол и соединение формулы I
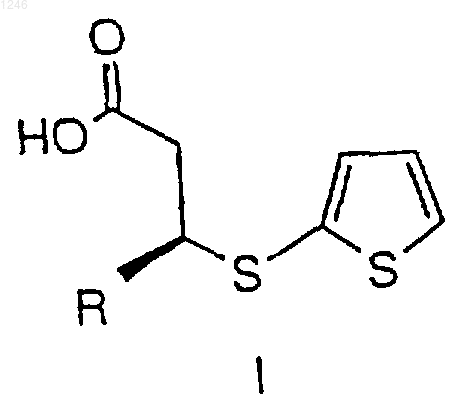
где R определен выше, при поддержании температуры от примерно 20 до примерно 40шС с получением второго раствора, содержащего соединение структурной формулы II

где R определен выше, добавление ко второму раствору от примерно 0,2 до примерно 2 эквивалентов воды на основе исходного количества ангидрида и добавление пероксида водорода при поддержании температуры от примерно 20 до 60шС с получением соединения III
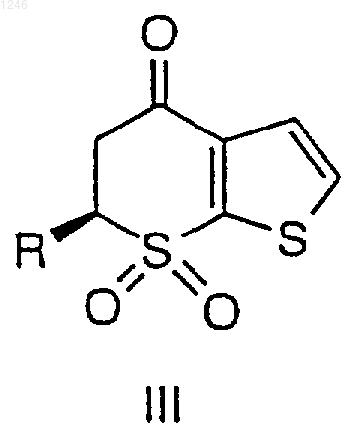
где R определен выше, восстановление соединения III с получением соединения IV и выделение соединения IV.
10. Способ по п.9, в котором при добавлении трифторуксусного ангидрида поддерживают температуру от около 25 до 35шС.
Текст
1 Предшествующий уровень техники Контроль повышенного внутриглазного давления (IOР) или глазной гипертензии, которые, как полагают, являются показателем начала и развития глаукомы, осуществляют в настоящей практике обычно с применением ряда местно наносимых средств, которые можно разделить на четыре категории: -блокаторы, симпатомиметические средства, парасимпатомиметические средства и ингибиторы холинэстеразы. Когда побочные действия вышеописанных местнодействующих средств ограничивают их применение и/или их нельзя использовать для достижения адекватного контроля IOР, в практике осуществляют вспомогательное пероральное введение ингибитора карбоангидразы (CAI). Перорально активные ингибиторы карбоангидразы могут проявлять серьезные побочные эффекты, такие как анорeксию, желудочнокишечные расстройства и парестезию. Поэтому был предпринят интенсивный и продолжительный поиск активного CAI для местного применения, который не проявляет таких побочных эффектов, благодаря способу введения и специфичности, присущей целевому органу. Поиск привел к обнаружению Baldwin et al (Патент США 4797413) класса соединений общей формулы:R1 является метилом. В патенте США 4797413 представлен способ получения рацемической модификации алкил-3-(тиен-2-илтио)бутирата и его гомологов. Предшествующий способ в данной области включает добавление 2-тиенилтиола (II) через двойную связь замещенной акриловой кислоты(IV) для получения кислоты I: с последующим синтезом конечного диастереомерного продукта, изомеры которого должны быть разделены и каждый растворен для получения наиболее активного (S,S)-энантиомера. Разделения изомеров приводят к автоматической потере основного количества химического продукта. В патенте США 4968815 представлен способ получения кислоты структурной формулы I: который включает обработку нуклеофила структуры II, структуры III, как показано ниже: где группы R являются такими, как они определены далее. В патенте США 4968814 иBlacklock et al., J. Org. Chem., 1993, 58, 16721679 также представлен способ получения хирального промежуточного соединения формулыI. Однако эти предшествующие способы включают много стадий, в них применяют окислители на основе тяжелых металлов, и они являются дорогостоящими и очень продолжительными. Следовательно целью настоящего изобретения является обеспечение способа синтеза гидроксисульфона, который является более экономичным, чем предшествующие способы, и в котором исключается применение окислителей на основе тяжелых металлов. Сущность изобретения Данное изобретение касается усовершенствованного способа синтеза гидроксисульфона структурной формулы III:C1-4-алкокси-С 1-4-алкилом. Гидроксисульфон является основным промежуточным соединением в синтезе соединения формулы V:R1 является метилом, представляющего собой ингибитор карбоангидразы, эффективный при местном применении при лечении глазной гипертензии и глаукомы. Настоящий способ уменьшает реакцию до единственного периодического процесса, устраняет применение окислителей, на основе тяжелых металлов, при этом сохраняя высокую энантиомерную чистоту продукта. Подробное описание изобретения Новый способ настоящего изобретения может быть изображен как показано ниже на схеме 1. где R определен выше. Перед добавлением окислителя любой избыток ангидрида, неиспользованного в реакции, гидролизуют путем добавления небольшого количества воды, предпочтительно от около 0,2 до около 2 эквивалентов используемого исходного ангидрида. К этому раствору добавляют, по меньшей мере, около 2 моль-эквивалентов и предпочтительно от около 2 до около 4 моль-эквивалентов окислителя,принадлежащего к группе, состоящей из пероксида водорода, трет-бутилгидропероксида, периодата, перхлората, или продукта электрохимического окисления и подобных соединений,предпочтительно пероксида водорода, при поддержании температуры от около 15 до 80 С,предпочтительно от около 20 до около 60 С в течение времени от около 1 до около 32 ч, предпочтительно от около 2 до около 12 ч, и наиболее предпочтительно от около 4 до около 8 часов, для получения соединения III: Получение соединения структурной формулы IV: где R является таким, как определено выше,ангидрида, принадлежащего к группе, состоящей из трифторуксусного ангидрида, уксусного ангидрида, трихлоруксусного ангидрида и подобных соединений или их смесей, предпочтительно трифторуксусного ангидрида, все необязательно в присутствии кислот, таких как карбоновые кислоты или неорганические кислоты,предпочтительно фосфорная, полифосфорная,ортофосфорная кислоты или пентоксида фосфора при поддержании температуры от около -5 С до около 50 С, предпочтительно от около 20 С до около 40 С, и наиболее предпочтительно от около 25 С до около 35 С в течение времени от около 1 до около 8 ч с получением раствора,содержащего соединение структурной формулы где R определен выше. Соединение III восстанавливают с получением соединения IV и затем соединение IV выделяют. Окисление сульфида до сульфоксида и затем до сульфона осуществляют непосредственно после замыкания кольца путем добавления окислителя (т.е. циклизацию и реакцию окисления осуществляют в одну стадию). Реакционная смесь в этот момент содержит побочный продукт от предыдущей реакции, представляющий собой карбоновую кислоту. Окислитель окисляет кислоту до перкислоты, которая затем осуществляет окисление сульфида до сульфоксида и затем до сульфона. Особенность этого изобретения состоит в том, что реагент, уже присутствующий в реакционной смеси, превращается в подходящий окислитель, при этом устраняется необходимость в окислителе, на основе тяжелого металла. Реакцию восстановления можно осуществлять посредством методов, известных специалистам в данной области. Так, например, соединение III может быть восстановлено путем подвергания его действию микроорганизма, такого как Ambrosiozyma, Arthroascus Rhodotorula, Saccharomycopsis, Trichosporon и подобных микроорганизмов, которые восстанавливают атом кислорода карбонильной группы в 4-положении тиенотиопиранового кольца до гидроксильной группы. Могут быть также применены химические восстановители. Они включают алюмогидрид лития, диизобутилалюмогидрид, гидрид алюминия, три-трет-бутоксигидрид, диборан и подобные соединения. Реакция может быть погашена путем добавления реакционной смеси или части реакционной смеси, предпочтительно водной окисляющей фазы двухфазного раствора к водному раствору этилацетата или водному раствору сульфита или бисульфита натрия или путем добавления водного раствора этилацетата или водного раствора сульфита или бисульфита натрия к реакционной смеси. Этилацетат может быть заменен н-бутилацетатом, метил-третбутилэфирметилэтилкетоном, метилизобутилкетоном и подобными веществами. Гексан может быть заменен пентаном, циклогексаном, циклопентаном, гептаном, петролейным эфиром и подобными веществами. Рассол может состоять из водных растворов хлорида натрия, хлорида кальция, сульфата натрия, сульфата кальция,сульфата магния, карбоната калия и подобных веществ. Примеры реакционных стадий приведены в нижеследующих примерах. Продуктом нового способа этого изобретения является эффективный для местного применения ингибитор карбоангидразы, пригодный при лечении глазной гипертензии. Его обычно применяют местно в виде раствора, содержащего от около 0,1 до 15% по весу соединения, закапываемого в глаз по одной или по две капли за один раз от одного до четырех раз в день. Пример 1. К раствору (S)-3-(2-тиенилтио) масляной кислоты (113,8 г, 0,56 моля) в толуоле(750 мл), который охладили до -5 С, добавили трифторуксусный ангидрид (106 мл, 0,75 моля). Добавление осуществляли с такой скоростью,чтобы температура реакционной смеси оставалась равной 0-5 С. Затем реакционной смеси позволили нагреться до температуры 20-25 С. Реакционную смесь контролировали посредством HPLC (высокоэффективной жидкостной хроматографии), при этом нашли, что реакция замыкания кольца завершилась через 2 ч. Затем Вещества 20% Раствор кислоты в толуоле 6 реакционную смесь охладили до 0 С и для того,чтобы температура реакционной смеси оставалась равной от 25 до 30 С медленно добавилиH2O2 (30%, 233 моля). Добавление Н 2 О 2 было сильно экзотермическим. После добавления пероксида температуру реакционной смеси продолжали поднимать в течение одного часа, температуру регулировали путем охлаждения колбы в бане со льдом. Реакция протекала в течение 24 ч при 20-25 С. Затем реакционную смесь охладили до -5 С и для поддержания температуры ниже 5 С медленно добавили насыщенный раствор бисульфита натрия (1500 мл Н 2 О, 180 гNa2SO3). Реакционной смеси позволили нагреться до 25 С, разделили слои, и водный слой промыли толуолом (500 мл). Затем объединенные органические слои промыли водой (500 мл) и концентрировали до объема 170 мл. Добавили гексан (550 мл), и раствор охладили до 0 С. Для получения 92,8 г неочищенного продукта (выход 80% относительна кислоты) соединение выделили фильтрацией. Соединение перекристаллизовали путем растворения в изопропиловом спирте (232 мл) и нагревания до 7580 С. Затем со скоростью, достаточной для поддержания температуры при 60-65 С, добавили Н 2 О (367 мл). Раствору позволили охладиться до комнатной температуры и выкристаллизовали соединение. Затем раствор охладили до 0 С и фильтрацией выделили продукт. Продукт промыли Н 2 О, которая была охлаждена до 0 С В реакции применяли 250 мл колбу RBQF,снабженную лопастной мешалкой PTFE, коротким боковым плечом Дина и Старка (DS),ведущим к двойному поверхностному конденсатору, снабженному барботером N2, термометром и 50 мл капельной воронкой. Сухую реакционную колбу продули азотом и загрузили раствором кислоты (101 г) FC 4010 стадии 3 и для обеспечения того, чтобы он был кислым (рН 4), отрегулировали рН. Боковое плечо DS заполнили сухим толуолом. Применили вакуум(около 80-100 мм Нg) и содержимое колбы нагрели с обратным холодильником и высушили азеотропически. Раствор толуола охладили до 35 С и с помощью азота устранили вакуум. На 7 всем протяжении опыта сохраняли медленное пропускание азота. В капельную воронку загрузили трифторуксусный ангидрид (25,4 г) и в течение 90 мин при поддержании температуры 30-35 С по каплям добавили к содержимому колбы. Раствор выдержали при температуре 30-35 С в течение дополнительного периода времени от 1,0 до 1,5 ч, и, как показал анализ газовой хроматографии,к этому времени циклизация завершилась. Температуру подняли до 40-45 С (скорость вращения мешалки -300 оборотов в минуту), и в течение 10 минут по каплям добавили воду (1,8 г). Когда избыток трифторуксусного ангидрида гидролизовали, произошло выделение тепла. В капельную воронку загрузили 30 вес.% раствор пероксида водорода (23,8 г) и в течение 5 ч по каплям добавили в колбу при поддержании температуры при 45-50 С путем охлаждения, когда это было необходимо, (температура бани 3540 С была адекватной для поддержания температуры). После завершения добавления реакционную смесь (теперь уже двухфазную систему) перемешали в течение дополнительного одного часа для завершения окисления (газовая хроматография показала необходимый продукт приRT 10,82). Содержимое колбы охладили до температуры окружающей среды и погрузили в 20% раствор бисульфита натрия (52 г), содержащийся в 500 мл колбе с мешалкой при поддержании температуры ниже 25 С. После перемешивания в течение 10 мин смесь перенесли в разделительную воронку и отделили нижний водный слой. Водную фазу экстрагировали толуолом(25 мл) и объединенные фазы толуола промыли 0,5% раствором бисульфита натрия (1 х 50 мл) и затем водой (2 х 50 мл). Для обеспечения рН конечной промывки между рН 4-5 контролировали рН промывок. Если было необходимо, в промывках применяли большее количество воды. Выход реакции составил около 74%. Раствор толуола загрузили в сухую колбу и под вакуумом (50 мм Нд) отгоняли толуол до тех пор, пока не собрали 70 г продукта. С помощью азота устранили вакуум и содержимое колбы охладили до 50 С. Быстро добавили изопропанол (30 г) и полученный раствор в течение одного часа охладили до 20 С и затем держали при этой температуре в течение 2-4 ч до полного завершения кристаллизации. Кристаллический продукт отфильтровали, промыли изопропанолом температуры 15-20 С (2 х 10 мл) и наконец сушили в вакуумной печи при 30-35 С. Вес продукта составил 12,78 г (концентрация газовая хроматография в сравнении с международным стандартом =98%) и степень извлечения из неочищенного продукта составила 78%. Пример 3. Кетосульфон III (50,0 г, 0,247 мол) растворили в тетрагидрофуране (700 мл),используя молекулярные сита 4 А (20 г) и изред 001246 8 ка перемешивали до тех пор, пока содержание остаточной воды не станет равным 40 мкг/мл(примерно 2 ч). 2-литровую трехгорлую колбу,снабженную механической мешалкой, входной трубкой для азота, 500 мл капельной воронкой и термопарой, покрытой тефлоном, загружали 4(декантировано из сита). К раствору добавили катализатор оксазаборолидин (R2 = СН 3, R3 =C6H5) (14,4 мл 0,86 М раствора в толуоле). Полученный раствор охладили до -15 С. В отдельном сосуде боран-метилсульфид(297 мл; остаточная вода 40 мкг/мл). Раствор боран-метилсульфида помещали в капельную воронку и добавляли к раствору кетосульфон/катализатор с такой скоростью, чтобы поддерживалась внутренняя температура при -15 С(примерно 30 мин). После того как весь боран был добавлен, реакцию выдерживали в течение 30 минут. Легко перемешиваемый осадок обычно образовывался во время выдерживания. Реакцию гасили осторожным добавлением 10 мл метанола (Предупреждение: существовал значительный индукционный период (1-2 мин) перед тем как водород начал выделяться после добавления начального метанола), поддерживая температуру при 10 С. После того как выделение водорода снизилось, добавили оставшийся метанол (365 мл). Реакционная смесь становится гомогенной во время гашения. После завершения добавления метанола, реакционную смесь нагревали до 20 С и перемешивали в течение 12 ч. Полученный раствор концентрировали при атмосферном давлении до 125 мл для удаления любых оставшихся соединений бора.Amberlyst 15 (56 г, 100 мл) суспендировали в метаноле (100 мл) (Предупреждение: суспензия выделяет тепло до примерно 40 С без внешнего охлаждения и увеличивается при увлажнении в 1,5 раза ее начального объема). Суспензию вливали в колонну 2,5 х 30 см и элюировали 1 л гидроксида аммония (15 М) в метаноле (6 об.%, примерно 1 М) до тех пор пока элюат не был основным (рН 11 при разбавлении водой 1:1). Начальный коричневый элюат отбрасывали. Колонну элюировали метанолом (примерно 500 мл) до тех пор, пока элюат не был нейтральным. Метанольный раствор -гидроксисульфона (50 г) и (s)-дифенилпролинола(3,13 г) фильтровали через слой SuperCel. Лепешку промывали метанолом (2 х 50 мл) и объединенные фильтраты доводили до объема 500 мл (10 мл/г) метанолом. Фильтрованный метанольный раствор элюировали через колонну,содержащую Amberlyst 15 (NH4+) при 3,8 мл/мин, собирая 38 мл фракций. Колонну промывали метанолом (380 мл) для удаления всех гидроксисульфоновых продуктов. Затем колонну элюировали 94:6 (об/об)смесью метанол/15 М водный аммиак (400 мл) для элюирования дифенилпролинола. Фракции 3-21, содержащие гидроксисульфон (95:5 R:S, 49r (98%), загряз 9 где R представляет водород, С 1-4 алкил или С 1-4 алкокси-С 1-4 алкил, включающий добавление ангидрида к первому раствору, содержащему растворитель и соединение формулы I 5. Способ по п.1, в котором во время добавления ангидрида температуру поддерживают от около 20 до 40 С, а температура окисления составляет от 20 до около 60 С. 6. Способ по п.2, где кислота принадлежит к группе, состоящей из карбоновых кислот и неорганических кислот. 7. Способ по п.6, где неорганические кислоты принадлежат к группе, состоящей из фосфорной, полифосфорной, ортофосфорной кислот и пентоксида фосфора. 8. Способ по п.4, в котором добавляют, по меньшей мере, 2 моль-эквивалента окислителя. 9. Способ получения соединения формулы где R определен выше, при поддержании температуры от примерно -5 до примерно 50 С, с получением второго раствора, содержащего соединение структурной формулы II где R представляет собой метил, включающий добавление трифторуксусного ангидрида к первому раствору, содержащему толуол и соединение формулы I ненные менее чем 0,4% дифенилпролинола) объединяли, концентрировали и выделяли. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы где R определен выше, добавление ко второму раствору от примерно 0,2 до примерно 2 эквивалентов воды, на основе исходного количества ангидрида, и окислителя, принадлежащего группе, состоящей из пероксида водорода, третбутилгидропероксида, периодата, перхлората и продукта электрохимического окисления, при поддержании температуры от примерно 15 до 80 С с получением соединения III где R определен выше, восстановление соединения III с получением соединения IV и выделение соединения IV. 2. Способ по п.1, где ангидрид необязательно находится в присутствии кислот. 3. Способ по п.1, в котором R представляет собой метил, ангидрид принадлежит к группе,состоящей из трифторуксусного ангидрида, уксусного ангидрида и трихлоруксусного ангидрида, растворитель принадлежит к группе, состоящей из толуола, бензола, циклогексана, гептана и ксилола. 4. Способ по п.3, где ангидридом является трифторуксусный ангидрид, растворителем является толуол и окислителем является пероксид водорода. где R определен выше, при поддержании температуры от примерно 20 до примерно 40 С с получением второго раствора, содержащего соединение структурной формулы II где R определен выше, добавление ко второму раствору от примерно 0,2 до примерно 2 эквивалентов воды на основе исходного количества ангидрида и добавление пероксида водорода при поддержании температуры от примерно 20 до 60 С с получением соединения III где R определен выше, восстановление соединения III с получением соединения IV и выделение соединения IV. 10. Способ по п.9, в котором при добавлении трифторуксусного ангидрида поддерживают температуру от около 25 до 35 С.
МПК / Метки
МПК: C07D 495/04
Метки: синтез, родственных, гидроксисульфона, соединений
Код ссылки
<a href="https://eas.patents.su/6-1246-sintez-gidroksisulfona-i-rodstvennyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Синтез гидроксисульфона и родственных соединений.</a>
Предыдущий патент: Установка для выработки волокон
Следующий патент: N-ацил-2-замещенный-4-(бензимидазолил- или имидазопиридинил -замещенные остатки)-пиперидины как антагонисты тахикинина.
Случайный патент: Броневая защита для покрытия боковой стенки шредера для автомобилей, шредер и ротор для шредера










