Производные карбазола в качестве функциональных 5-ht6 лигандов
Номер патента: 14694
Опубликовано: 30.12.2010
Авторы: Камбхампати Рама Састри, Ширсатх Викас Шрикришна, Джасти Венкатесварлу, Вишвакарма Сантош, Рамакришна Венката Сатья Нироги, Конда Джагадиш Бабу
Формула / Реферат
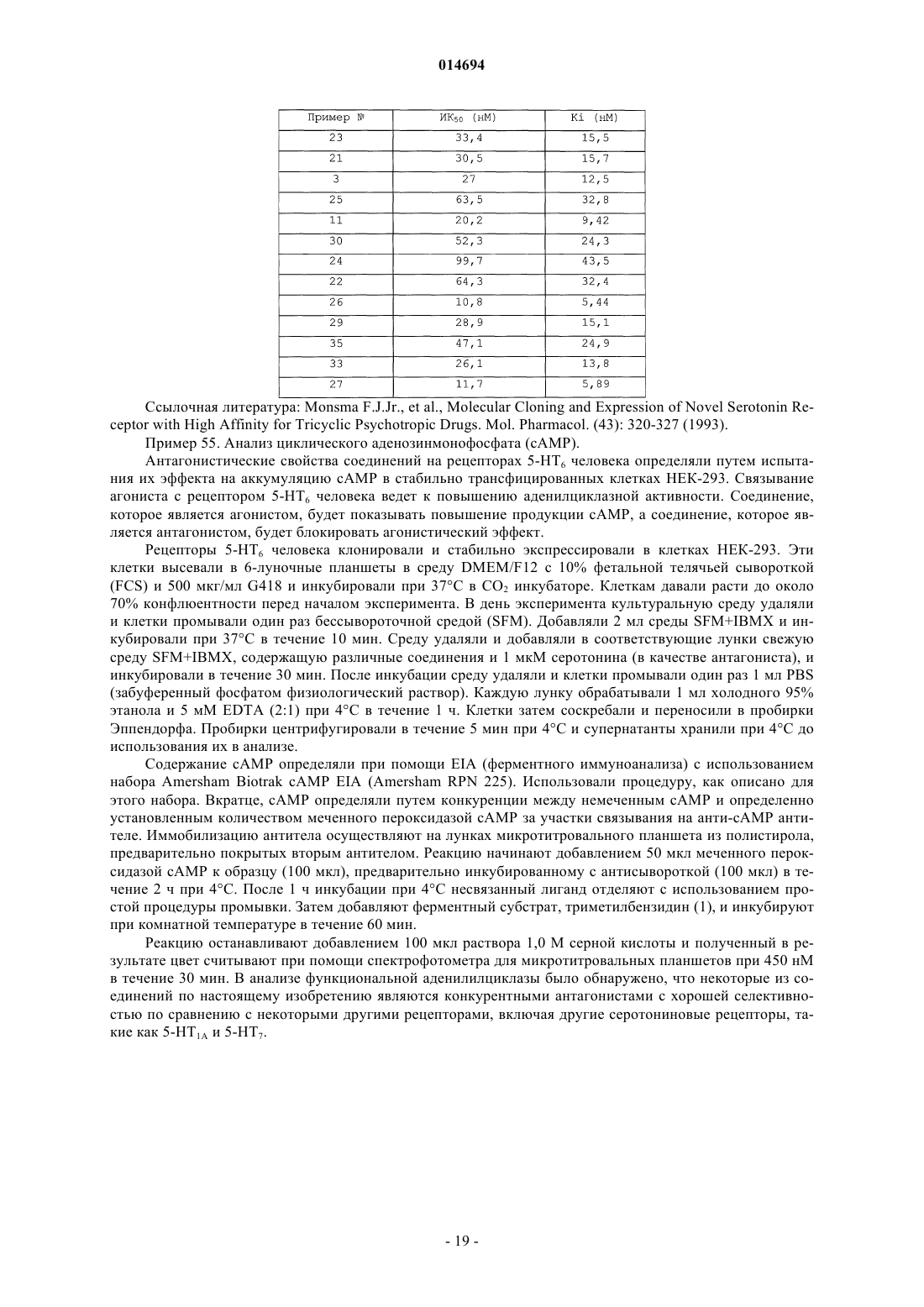
1. Соединение формулы (I)
или его стереоизомеры или фармацевтически приемлемая соль, где
Ar представляет собой фенил;
R1 представляет собой одно или несколько замещений на Ar и бензольном кольце, и R1 представляет собой водород, галоген, циано, (C1-C3)алкил, галоген(C1-C3)алкил, (C1-C3)алкокси или галоген(C1-С3)алкокси;
R представляет собой водород или (C1-С3)алкил.
2. Соединение по п.1, где R1 представляет собой водород, галоген, циано, (C1-С3)алкил, галоген(C1-С3)алкил, (C1-С3)алкокси или галоген(C1-C3)алкокси.
3. Соединение по п.1, выбранное из следующей группы:
(9-бензолсульфонил-2,3,4,9-тетрагидро-1Н-карбазол-3-ил)диметиламин;
9-[(4-бромбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
9-[(4-фторбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
9-[(4-метилбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[9-(3-хлорбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[9-(4-изопропилбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[9-(3-трифторметилбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[9-(4-метоксибензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-бром-9-(бензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-бром-9-(4-бромбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-бром-9-(4-фторбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-бром-9-(4-изопропилбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-бром-9-(3-трифторметилбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-бром-9-(2-бромбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-бром-9-(4-метоксибензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-хлор-9-бензолсульфонил-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-хлор-9-(3-трифторметилбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-хлор-9-(4-метилбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-хлор-9-(4-бромбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-хлор-9-(4-фторбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-фтор-9-бензолсульфонил-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-фтор-9-(4-метилбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-фтор-9-(4-изопропилбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-фтор-9-(4-бромбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-фтор-9-(4-фторбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-метокси-9-бензолсульфонил-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-метокси-9-(4-метилбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-метокси-9-(4-метоксибензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-метокси-9-(4-бромбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-метокси-9-(4-фторбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-метокси-9-(3-трифторметилбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-хлор-9-(2-бромбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6,8-дифтор-9-(4-метилбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6,8-дифтор-9-(бензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
[6-бром-9-(2,3-дихлорбензолсульфонил)-2,3,4,9-тетрагидро-1Н-карбазол-3-ил]диметиламин;
его стереоизомеров и фармацевтически приемлемых солей.
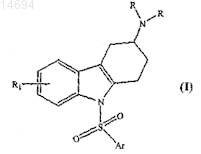
4. Способ получения соединения формулы (I) по п.1, включающий контактирование соединения формулы (а)

с сульфоновым производным формулы (b)
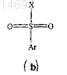
где X представляет галоген, а все другие символы имеют значения, указанные в п.1;
в присутствии основания, выбранного из карбоната калия, карбоната натрия, гидрида натрия или гидрида калия, и инертного растворителя, выбранного из тетрагидрофурана, толуола, дихлорметана, ацетона, воды, диметилформамида или диметилсульфоксида, при температуре окружающей среды с получением соединения формулы (I).
5. Способ по п.4, необязательно включающий:
1) преобразование соединения формулы (I) в другое соединение формулы (I),
2) удаление любых защитных групп или
3) образование фармацевтически приемлемой соли.
6. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и соединение формулы (I) по любому из пп.1-3.
7. Фармацевтическая композиция по п.6 для лечения клинических состояний, таких как тревожное расстройство, расстройство познавательной способности, нейродегенеративное расстройство, болезнь Альцгеймера, расстройство дефицита внимания, обсессивно-компульсивное расстройство, удар, травма головы, расстройство питания или ожирение.
8. Применение соединения по любому из пп.1-3 для получения лекарственного средства для лечения заболеваний, связанных с 5-HT6рецептором.
Текст
Настоящее изобретение обеспечивает карбазольные производные формулы (I) полезные для лечения расстройств ЦНС, которые связаны или на которые влияет 5-НТ 6 рецептор. Фармакологический профиль этих соединений включает высокую аффинность связывания с 5-НТ 6 рецептором наряду с хорошей селективностью в отношении указанного рецептора. Настоящее изобретение также включает стереоизомеры, соли, способы получения указанных карбазольных производных, а также содержащие их лекарственные средства. Рамакришна Венката Сатья Нироги,Камбхампати Рама Састри, Ширсатх Викас Шрикришна, Конда Джагадиш Бабу,Вишвакарма Сантош, Джасти Венкатесварлу (IN)(71)(73) Заявитель и патентовладелец: СУВЕН ЛАЙФ САЙЕНСИЗ ЛИМИТЕД 014694 Область изобретения Настоящее изобретение относится к некоторым производным карбазола, их стереоизомерам, их солям, их получению и содержащим их лекарственным средствам. Предпосылки изобретения Считается, что при различных расстройствах центральной нервной системы, таких как тревожное расстройство, депрессия, двигательные расстройства и т.д., имеет место нарушение нейротрансмиттера 5-гидрокситриптамина (5-HT) или серотонина. Серотонин локализуется в центральной и периферической нервной системе, известно, что он влияет на различные состояния, включая, среди прочего, психиатрические расстройства, двигательную активность, пищевое поведение, сексуальную активность и нейроэндокринную регуляцию. Подтипы 5-HT рецепторов регулируют различные эффекты серотонина. Известное семейство 5-HT рецепторов включает семейство 5-HT1 (например, 5-HT1A), семейство 5-HT2 (например, 5-HT2A), подтипы 5-HT3, 5-HT4, 5-HT5, 5-HT6 и 5-HT7. Подтип рецептора 5-HT6 был впервые клонирован из ткани крысы в 1993 г. (Monsma, F.J.; Shen, Y.;Ward, R.P.; Hamblin, M.W., Molecular Pharmacology, 1993, 43, 320-327), а затем из ткани человека (Kohen,R.; Metcalf, M.A.; Khan, N.; Druck, Т.; Huebner, K.; Sibley, D.R., Journal of Neurochemistry, 1996, 66, 47-56). Рецептор представляет собой связанный с G-белком рецептор (GPCR), положительно связанный с аденилатциклазой (Ruat, М.; Traiffort, Е.; Arrang, J-M.; Tardivel-Lacombe, L.; Diaz, L.; Leurs, R.; Schwartz, J-C.,Biochemical Biophysical Research Communications, 1993, 193, 268-276). Рецептор обнаружен, практически исключительно, в областях центральной нервной системы (ЦНС) как у крысы, так и у человека. Исследования in situ гибридизации 5-HT6 рецептора в мозге крысы с использованием мРНК указывают на основную локализацию на участках выступов 5-HT, включая полосатое тело, nucleus accumbens,обонятельные бугорки и формацию гиппокампа (Ward, R.P.; Hamblin, M.W.; Lachowicz, J.E.; Hoffman,B.J.; Sibley, D.R.; Dorsa, D.M., Neuroscience, 1995, 64, 1105-1111). Самые высокие уровни мРНК 5-HT6 рецептора наблюдали в обонятельных бугорках, полосатом теле, nucleus accumbens, зубчатой извилине, а также CA1, СА 2 и СА 3 областях гиппокампа. Более низкие уровни мРНК 5-HT6 рецептора наблюдали в гранулярном слое мозжечка, некоторых диэнцефалических ядрах, миндалевидном теле и в коре головного мозга. При помощи нозерн-блоттинга было обнаружено, что мРНК 5-HT6 рецептора, как оказалось,исключительно присутствует в головном мозге, и мало свидетельств ее присутствия в периферических тканях. Высокая аффинность некоторых антипсихотических средств в отношении 5-HT6 рецептора, в дополнение к локализации его мРНК в полосатом теле, обонятельных бугорках и nucleus accumbens говорит о том, что некоторые клинические действия этих соединений могут быть опосредованы через этот рецептор. Его способность связываться с широким рядом терапевтических соединений, применяемых в психиатрии, вместе с его распространением в головном мозге, вызывающим особый интерес, стимулировало значительную заинтересованность в новых соединениях, которые способны к взаимодействию с указанным рецептором или влиянию на него. В настоящее время не известны никакие полностью селективные агонисты. Значительные усилия предпринимаются для выяснения возможной роли 5-HT6 рецептора в психиатрии, нарушении познавательной способности, двигательной функции и контроля, памяти,настроения и т.п. В этих целях предпринимаются реальные попытки найти соединения, которые демонстрируют аффинность связывания в отношении 5-HT6 рецептора как в целях, способствующих исследованию 5-HT6 рецептора, так и в качестве потенциальных терапевтических средств для лечения расстройств центральной нервной системы, например, см. С. Reavill and D.С. Rogers, Current Opinion in Investigational Drugs, 2001, 2 (1):104-109, Pharma Press Ltd. Существует множество потенциальных терапевтических применений для 5-HT6 лигандов у человека, основанных на непосредственных эффектах и на показаниях научных исследований, информация о которых является доступной. Эти исследования включают локализацию рецептора, аффинность лигандов с известной in vivo активностью и различные исследования на животных, которые были осуществлены к настоящему времени. В настоящее время ведется поиск соединений, предпочтительно являющихся антагонистами 5-HT6 рецепторов, в качестве терапевтических средств. Одно потенциальное терапевтическое применение модуляторов функции 5-HT6 рецепторов представляет собой улучшение познавательной способности и памяти при заболеваниях человека, таких как болезнь Альцгеймера. Высокие уровни рецептора, обнаруженные в важных структурах переднего мозга, включая хвостатое ядро/оболочку, гиппокамп, nucleus accumbens и кору головного мозга, дают основание предположить, что рецептор играет определенную роль в памяти и познавательной способности, поскольку известно, что эти области играют ключевую роль в памяти (Gerard, С.; Martres, M.-P.; Lefevre, K.; Miquel, M.С.; Verge, D.; Lanfumey, R.;Doucet, E.; Hamon, M.; EI Mestikawy, S., Brain Research, 1997, 746, 207-219). Способность известных лигандов 5-HT6 рецептора к усилению холинергической трансмиссии также является подтверждением потенциального применения для улучшения познавательной способности (Bentey, J.С.; Boursson, A.; Boess,F.G.; Kone, F.С.; Marsden, С.A.; Petit, N.; Sleight, A.J., British Journal of Pharmacology, 1999, 126 (7), 15371542). В результате исследований было обнаружено, что известные селективные антагонисты 5-HT6 значительно повышают уровни глутамата и аспартата в передней коре головного мозга без повышения при-1 014694 этом уровней норадреналина, допамина или 5-HT. Такое селективное повышение уровня нейрохимических веществ, которые, как это известно, участвуют в процессах памяти и познавательной способности,является сильным аргументом, предполагающим роль 5-HT6 лигандов в познавательной способности(Dawson, L.A.; Nguyen, H.Q.; Li, P. British Journal of Pharmacology, 2000, 130 (1), 23-26). При исследовании памяти и познавательной способности у животных с использованием известного селективного антагониста 5-HT6 были обнаружены некоторые положительные эффекты (Rogers, D.С.; Hatcher, P.D.; Hagan,J. J. Society of Neuroscience, Abstracts, 2000, 26, 680). Соответствующее потенциальное терапевтическое применение для 5-HT6 лигандов - это лечение такого расстройства, как дефицит внимания (ADD, также известного как расстройство дефицита внимания с гиперактивностью, или ADHD) как у детей, так и у взрослых. Поскольку, как оказалось, антагонисты 5-HT6 повышают активность нигростриатального допаминового пути, и поскольку ADHD связывали с аномальностями в хвостатом ядре (Ernst, M.; Zametkin, A.J.; Matochik, J.H.; Jons, P.A.; Cohen, R.M.,Journal of Neuroscience, 1998, 18(15), 5901-5907), антагонисты 5-HT6 могут снижать тяжесть расстройств дефицита внимания. В Международной патентной публикации WO 03/066056 А 1 сообщается, что антагонизм в отношении 5-HT6 рецептора может промотировать рост нейронов в центральной нервной системе у млекопитающего. В другой Международной патентной публикации WO 03/065046 А 2 раскрывается новый вариант рецептора 5-HT6 человека и предполагается, что рецептор 5-HT6 человека связан с различными другими расстройствами. Последние исследования по изучению аффинности различных ЦНС лигандов с известной терапевтической применимостью или сильной структурной схожестью с известными лекарственными средствами говорят о возможной роли 5-HT6 лигандов в лечении шизофрении и депрессии. Например, клозапин(эффективное клиническое антипсихотическое средство) обладает высокой аффинностью в отношении 5HT6 подтипа рецептора. Также некоторые клинические антидепрессанты обладают высокой аффинностью в отношении этого рецептора и действуют как антагонисты на этом сайте (Branchek, Т.A.; Blackburn, Т.Р., Annual Reviews in Pharmacology and Toxicology, 2000, 40, 319-334). Кроме того, последние in vivo исследования у крыс показывают, что модуляторы 5-HT6 могут быть полезными для лечения двигательных расстройств, включая эпилепсию (Stean, Т.; Routledge, C.; Upton,N., British Journal of Pharmacology, 1999, 127 Proc. Supplement-131P; и Routledge, C.; Bromidge, S.M.;Moss, S.F.; Price, G.W.; Hirst, W.; Newman, H.; Riley, G.; Gager, Т.; Stean, Т.; Upton, N.; Clarke, S.E.; Brown,A.M., British Journal of Pharmacology, 2000, 30 (7), 1606-1612). Взятые вместе, указанные выше исследования дают веские основания для предположения, что соединения, которые являются модуляторами 5-HT6 рецептора, т.е. лигандами, могут быть полезными для терапевтических показаний, включая лечение заболеваний, связанных с дефицитом памяти, познавательной способности и способности к запоминанию, таких как болезнь Альцгеймера и расстройства дефицита внимания; лечение расстройств изменения личности, таких как шизофрения; лечение поведенческих расстройств, например тревоги, депрессии и обсессивно-компульсивных расстройств; лечение нарушений движения или двигательных расстройств, таких как болезнь Паркинсона и эпилепсия; лечения заболеваний, связанных с нейродегенерацией, таких как удар или травма головы; или синдром отмены привыкания к чрезмерному употреблению некоторых средств, включая никотиновую зависимость, алкогольную зависимость и зависимость от других веществ. Также ожидается, что такие соединения должны быть полезными для лечения некоторых желудочно-кишечных (GI) расстройств, таких как функциональное кишечное расстройство. См., например, В.L.Roth et al., J. Pharmacol. Exp. Ther., 1994, 268, pages 1403-14120, D.R. Sibley et al., Molecular Pharmacology,1993, 43, 320-327, A.J. Sleight et al., Neurotransmission, 1995, 11, 1-5, и A.J. Sleight et al., Serotonin ID Research Alert, 1997, 2(3), 115-118. Кроме того, сообщалось о действии антагонистов 5-HT6 и антисмысловых олигонуклеотидов 5-HT6 у крыс, направленном на уменьшение потребления пищи, таким образом, они являются потенциальными кандидатами для лечения ожирения. См., например, Bentley et al., British Journal of Pharmacology, 1999,Suppl., 126, A64: 255; Wooley et al., Neuropharmacology, 2001, 41: 210-129; и WO 02/098878. Международные патентные публикации WO 2004/055026 A1, WO 2004/048331 A1, WO 2004/048330 А 1 и WO 2004/048328 А 2 (все на имя Suven Life Sciences Limited) описывают известный уровень техники. Кроме того, WO 98/27081, WO 99/02502, WO 99/37623, WO 99/42465 и WO01/32646 (все на имяGlaxo SmithKline Beecham PLC) раскрывают ряд арилсульфонамидных и сульфоксидных соединений в качестве антагонистов 5-HT6 рецептора, где эти соединения заявляются как полезные для лечения различных расстройств ЦНС. Не смотря на то что были раскрыты некоторые модуляторы 5-HT6, все еще остается потребность в соединениях, которые являются полезными для модуляции 5-HT6. Поэтому целью настоящего изобретения является обеспечение соединений, которые являются полезными в качестве терапевтических средств для лечения различных расстройств центральной нервной системы, связанных с функциями 5-HT6 рецептора, или на которые влияют функции 5-HT6 рецептора. Другой целью настоящего изобретения является обеспечение терапевтических способов и фармацевтических композиций, полезных для лечения расстройств центральной нервной системы, связанных-2 014694 или с функциями 5-HT6 рецептора, или на которые влияют функции 5-HT6 рецептора. Отличительной особенностью настоящего изобретения является то, что представленные соединения также можно использовать для дальнейших исследований и выяснения роли 5-HT6 рецептора. Предпочтительным объектом настоящего изобретения является синтез сильного селективного антагониста 5-HT6 рецептора. Краткое описание изобретения Был обнаружен карбазольный класс соединений, которые демонстрируют аффинность к 5-HT6 рецептору и которые можно использовать в качестве эффективных терапевтических средств для лечения расстройств центральной нервной системы (ЦНС).(i) Настоящее изобретение относится к соединению формулы (I), а также к его стереоизомеру или его соли с неорганической или органической кислотой или его фармацевтически приемлемой соли, где прерывистая линия представляет собой необязательную двойную связь; Ar представляет собой любую группу, выбранную из фенила, нафтила, моноциклического или бициклического гетероарила, каждый из которых может быть дополнительно замещен одним или несколькими независимыми заместителями, определенными как R1; Ar-, например, может представлять собойR1 представляет собой одно или несколько замещений в бензольном кольце и включает водород,галоген, циано, (C1-С 3)алкил, галоген(C1-C3)алкил, (C1-С 3)алкокси, галоген(C1-С 3)алкокси, цикло(С 3 С 6)алкил или цикло(С 3-С 6)алкокси; R представляет собой либо водород, либо (C1-С 3)алкил; n представляет собой целое число, имеющее значение 1 или 2. Настоящее изобретение также обеспечивает способы получения, композиции, содержащие соединения формулы (I), и способы применения соединений формулы (I).(ii) В другом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим терапевтически эффективное количество по меньшей мере одного соединения формулы (I) или его индивидуальных стереоизомеров, рацемической или нерацемической смеси стереоизомеров или фармацевтически приемлемых солей или сольватов, в смеси по меньшей мере с одним подходящим носителем.(iii) В другом аспекте настоящее изобретение относится к применению терапевтически эффективного количества соединения формулы (I) для получения лекарственного средства для лечения или профилактики расстройств, где имеет место селективная аффинность к 5-HT6 рецептору.(iv) В другом аспекте настоящее изобретение, кроме того, относится к способу получения соединений формулы (I).(v) Частичный перечень таких соединений общей формулы (I) представлен ниже:[6-метилтио-9-(3-хлорбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин; их стереоизомеры и их соли. Подробное описание изобретения Рецептор 5-гидрокситриптамина-6 (5-HT6) является одним их последних рецепторов, идентифицированных путем молекулярного клонирования. Его способность связываться с широким рядом терапевтических соединений, применяемых в психиатрии, вместе с его распространением в головном мозге, вызывающим особый интерес, стимулировало значительную заинтересованность в новых соединениях, которые способны к взаимодействию с указанным рецептором или влиянию на него. К удивлению, было обнаружено, что производные карбазола формулы (I) демонстрируют аффинность к 5-HT6 рецептору, Формула (I) включая их стереоизомеры или их соли с неорганическими или органическими кислотами, где прерывистая линия представляет собой необязательную двойную связь; Ar представляет собой любую группу, выбранную из фенила, нафтила, моноциклического или бициклического гетероарила, каждый из которых может быть дополнительно замещен одним или несколькими независимыми заместителями,определенными как R1; Ar-, например, может представлять собойR1 представляет собой одно или несколько замещений в бензольном кольце и включает водород,галоген, циано, (С 1-С 3)алкил, галоген(C1-C3)алкил, (C1-С 3)алкокси, галоген(C1-С 3)алкокси, цикло(С 3 С 6)алкил или цикло(С 3-С 6)алкокси; R представляет собой либо водород, либо (C1-C3)алкил; n представляет собой целое число, имеющее значение 1 либо 2. Каждая группа соединений (I) описана ниже. Каждый термин, использованный в настоящем описании, имеет значения, указанные ниже для любого случая его использования как отдельно, так и в сочетании с другими терминами, если не указано иное. Термин "галоген", как он использован в настоящем описании и в формуле изобретения (если из-4 014694 контекста не следует иное указание), означает атом, такой как фтор, хлор, бром или йод. Термин "(C1-С 3)алкил", как он использован в настоящем описании и в формуле изобретения (если из контекста не следует иное указание), означает линейные и разветвленные алкильные радикалы, содержащие от одного до трех атомов углерода, и включает метил, этил, н-пропил и изопропил. Термин "(C1-С 3)алкокси", как он использован в настоящем описании и в формуле изобретения (если из контекста не следует иное указание), означает линейные и разветвленные алкоксирадикалы, содержащие от одного до трех атомов углерода, и включает метокси, этокси, пропилокси и изопропилокси, которые могут быть дополнительно замещены. Термин "галоген(C1-C3)алкил", как он использован в настоящем описании и в формуле изобретения(если из контекста не следует иное указание), означает линейные и разветвленные алкильные радикалы,содержащие от одного до трех атомов углерода, и включает фторметил, дифторметил, трифторметил,трифторэтил, фторэтил, дифторэтил и т.п. Термин "галоген(C1-С 3)алкокси", как он использован в настоящем описании и в формуле изобретения (если из контекста не следует иное указание), означает линейные и разветвленные алкоксирадикалы,содержащие от одного до трех атомов углерода, и включает фторметокси, дифторметокси, трифторметокси, трифторэтокси, фторэтокси, дифторэтокси и т.п. Термин "цикло(С 3-С 6)алкил", как он использован в настоящем описании и в формуле изобретения(если из контекста не следует иное указание), означает циклические алкильные радикалы, содержащие от трех до шести атомов углерода, и включает циклопропил, циклобутил, циклопентил, циклогексил, где циклоалкильная группа может быть замещенной. Термин "цикло(С 3-С 6)алкокси", как он использован в настоящем описании и в формуле изобретения(если из контекста не следует иное указание), означает циклические алкоксирадикалы, содержащие от трех до шести атомов углерода, и включает циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси, где циклоалкоксигруппа может быть замещенной, и т.п. Термин "гетероарил" означает 5- или 6-членное моноциклическое ароматическое или конденсированное 8-10-членное бициклическое ароматическое кольцо, содержащее от 1 до 3 гетероатомов, выбранных из кислорода, азота и серы. Подходящие примеры таких моноциклических ароматических колец включают тиенил, фурил, пирролил, триазолил, имидазолил, оксазолил, тиазолил, оксадиазолил, изотиазолил, изоксазолил, тиадиазолил, пиразолил, пиримидил, пиридазинил, пиразинил и пиридил. Подходящие примеры таких конденсированных ароматических колец включают бензоконденсированные ароматические кольца, такие как хинолинил, изохинолинил, хиназолинил, хиноксалинил, циннолинил, нафтиридинил, индолил, изоиндолил, индазолил, пирролопиридинил, бензофуранил, изобензофуранил, бензотиенил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензоксадиазолил, бензотиадиазолил, бензотриазолил и т.п. Гетероарильные группы, описанные выше, могут быть связаны с остальной частью молекулы через атом углерода или, если он присутствует, подходящий атом азота, если не указано иное. Должно быть понятно, что в случае, когда указанная выше арильная или гетероарильная группа содержит более одного заместителя, указанные заместители могут быть связаны с образованием кольца, например, карбоксильная и аминогруппа могут быть связаны с образованием амидной группы. Термин "5-7-членное гетероциклическое кольцо" означает неароматическое кольцо, содержащее от 1 до 3 гетероатомов, выбранных из кислорода, азота и серы. Такие кольца могут быть частично ненасыщенными. Подходящие примеры 5-7-членных гетероциклических колец включают пиперидинил, тетрагидропиридинил, пирролидинил, морфолинил, азепанил, диазепанил и пиперазинил. 5-7-членное гетероциклическое кольцо, описанное выше, может быть связано с остальной частью молекулы через атом углерода или подходящий атом азота. Некоторые соединения формулы (I) могут существовать в стереоизомерных формах (например,диастереомеры и энантиомеры), и настоящее изобретение распространяется на каждую из этих стереоизомерных форм и на их смеси, включая рацематы. Различные стереоизомерные формы можно отделить друг от друга обычными способами, или какой-либо определенный изомер можно получить путем стереоспецифического или асимметрического синтеза. Настоящее изобретение также распространяется на любые таутомерные формы и их смеси. Термин "стереоизомеры" является общим термином для всех изомеров отдельных молекул, которые отличаются только ориентацией их атомов в пространстве. Он включает изомеры зеркального отображения (энантиомеры), геометрические (цис-транс) изомеры и изомеры соединений с более чем одним хиральным центром, которые не являются зеркальными отображениями друг друга (диастереомеры). Стереоизомеры, как правило, в основном получают в виде рацематов, которые можно разделить на оптически активные изомеры способом, известным per se. В случае соединений общей формулы (I), содержащих асимметрический атом углерода, настоящее изобретение относится к D-форме, L-форме иD,L-смесям, а в случае нескольких асимметрических атомов углерода и диастереомерных форм настоящее изобретение распространяется на каждую из этих стереоизомерных форм и на их смеси, включая рацематы. Те соединения общей формулы (I), которые содержат асимметрический атом углерода и которые, как правило, получают в виде рацематов, можно отделить друг от друга обычными способами, или-5 014694 любой определенный изомер можно получить путем стереоспецифического или асимметрического синтеза. Однако также возможно использование оптически активного соединения с самого начала с получением соответственно оптически активного или диастереомерного соединения в качестве конечного соединения. Стереоизомеры соединений общей формулы (I) можно получить одним или несколькими путями,представленными ниже.i) Один или несколько из используемых реагентов можно использовать в их оптически активной форме.ii) Оптически чистый катализатор или хиральные лиганды вместе с металлическим катализатором можно использовать в способе восстановления. Металлические катализаторы можно использовать в способе восстановления. Металлический катализатор может представлять собой родий, рутений, индий и т.п. Хиральные лиганды предпочтительно могут представлять собой хиральные фосфины (Principles ofiii) Смесь стереоизомеров можно разделить традиционными способами, такими как образование диастереомерных солей с хиральными кислотами, или хиральными аминами, или хиральными аминоспиртами, хиральными аминокислотами. Полученную смесь диастереомеров затем можно разделить такими способами, как фракционированная кристаллизация, хроматография и т.п., после чего следует дополнительная стадия выделения оптически активного продукта, где это производное подвергают гидролизу (Jacques et al., "Enantiomers, Racemates and Resolution", Wiley Interscience, 1981).iv) Смесь стереоизомеров можно разделить традиционными способами, такими как микробное разделение, разделение диастереомерных солей, образованных с хиральными кислотами или хиральными основаниями. Хиральные кислоты, которые можно использовать, представляют собой винную кислоту, миндальную кислоту, молочную кислоту, камфорсульфоновую кислоту, аминокислоты и т.п. Хиральные основания, которые можно использовать, представляют собой алкалоиды хинного дерева, бруцин или основную аминогруппу, такую как лизин, аргинин и т.п. В случае соединений общей формул (I), содержащих геометрическую изомерию, настоящее изобретение относится ко всем таким геометрическим изомерам. Подходящие фармацевтически приемлемые соли будут очевидны для специалистов в данной области и включают соли, описанные в J. Pharm. Sci., 1977, 66, 1-19, такие как кислотно-аддитивные соли, образованные с неорганическими кислотами, например хлористо-водородной, бромисто-водородной, серной, азотной или фосфорной кислотой; и органическими кислотами, например янтарной, малеиновой,уксусной, фумаровой, лимонной, винной, бензойной, п-толуолсульфоновой, метансульфоновой или нафталинсульфоновой кислотой. В объем настоящего изобретения включены все возможные стехиометрические и нестехиометрические формы. Можно использовать растворители, такие как вода, ацетон, простой эфир, ТГФ, метанол, этанол, трет-бутанол, диоксан, изопропанол, изопропиловый эфир или их смеси. Помимо фармацевтически приемлемых солей другие соли также включены в настоящее изобретение. Они могут служить в качестве промежуточных соединений для очистки соединений, для получения других солей или для идентификации и характеристики соединений или промежуточных соединений. Соединения формулы (I) могут быть получены в кристаллической или некристаллической форме, и,в случае кристаллической формы, они необязательно могут быть сольватированы, например, в виде гидрата. В объем настоящего изобретения включены стехиометрические сольваты (например, гидраты), а также соединения, содержащие различные количества растворителя (например, воды). Настоящее изобретение также обеспечивает способ получения соединения формулы (I) или его фармацевтически приемлемой соли, который включает контактирование соединения формулы (а), где все заместители, такие как n, R1, R и Ar, определены для соединения формулы (I) выше, с сульфоновым производным формулы (b) где Ar определен для соединения формулы (I) выше и Lg представляет собой атом галогена (например,фтора, хлора или йода); в присутствии подходящего основания и инертного растворителя, при подходящей температуре с получением соединения формулы (I). Указанную выше реакцию предпочтительно осуществляют в растворителе, таком как ТГФ, толуол,DCM, ацетон, вода, ДМФА, DMSO, DME и т.п., или в смеси указанных растворителей, и предпочтительно используют либо ацетон, либо ДМФА. Инертную атмосферу можно поддерживать при помощи инертных газов, таких как N2, Ar или He. Реакцию можно осуществлять в присутствии основания, такого-6 014694 как K2CO3, Na2CO3, NaH или их смесей. Температура реакции может находиться в пределах от 0 до 100 С в зависимости от выбора растворителя и предпочтительно температура находится в пределах от 0 до 50 С. Продолжительность реакции может составлять от 1 до 24 ч, предпочтительно от 2 до 6 ч. Соединения, полученные указанным выше способом получения по настоящему изобретению, могут быть преобразованы в другие соединения по настоящему изобретению при помощи последующих химических модификаций с использованием хорошо известных реакций, таких как окисление, восстановление, введение защиты, удаление защиты, реакция перегруппировки, галогенирование, гидроксилирование, алкилирование, алкилтиолирование, деметилирование, О-алкилирование, О-ацилирование, Nалкилирование, N-алкенилирование, N-ацилирование, N-цианирование, N-сульфонилирование, реакция сочетания с использованием переходных металлов и т.п. Если это необходимо, можно осуществить любую одну или несколько из описанных ниже стадий:i) образование фармацевтически приемлемой соли, сольвата или пролекарства этого соединения;ii) удаление любых защитных групп илиiii) преобразование соединения формулы (I) в другое соединение формулы (I). В способе (i) фармацевтически приемлемые соли можно получить традиционным способом путем взаимодействия с соответствующей кислотой или кислотным производным, как описано подробно выше. В способе (ii) примеры защитных групп и способов их удаления можно найти в Т.W. Greene "Protective Groups in Organic Synthesis" (J. Wiley and Sons, 1991). Подходящие амино-защитные группы включают сульфонил (например, тозил), ацил (например, ацетил, 2',2',2'-трихлорэтоксикарбонил, бензилоксикарбонил или трет-бутоксикарбонил) и арилалкил (например, бензил), которые могут быть удалены посредством гидролиза (например, с использованием кислоты, такой как хлористо-водородная или трифторуксусная кислота) или путем восстановления (например, гидрогенолиз бензильной группы или восстановительное удаление 2',2',2'-трихлорэтоксикарбонильной группы с использованием цинка в уксусной кислоте), как это является подходящим. Другие подходящие амино-защитные группы включают трифторацетил (-COCF3), который можно удалить основанием посредством катализируемого гидролиза, или связанную на твердофазной смоле бензильную группу, такую как связанную на смоле Merrifield 2,6 диметоксибензильную группу (линкер Ellman), которую можно удалить посредством катализируемого кислотой гидролиза, например, с использованием трифторуксусной кислоты. Способ (iii) можно осуществить с использованием традиционных процедур взаимопреобразования,таких как эпимеризация, окисление, восстановление, алкилирование, нуклеофильное или электрофильное ароматическое замещение, сложноэфирный гидролиз или образование амидной связи. Для использования соединения формулы (I) в терапии обычно его формулируют в фармацевтическую композицию в соответствии со стандартной фармацевтической практикой. Фармацевтические композиции по настоящему изобретению могут быть сформулированы традиционным способом с использованием одного или нескольких фармацевтически приемлемых носителей. Так, активные соединения по настоящему изобретению могут быть сформулированы для орального, буккального, интраназального, парентерального (например, внутривенного, внутримышечного или подкожного) или ректального введения или в форме, подходящей для введения путем ингаляции или инсуффляции. Для орального введения фармацевтические композиции могут быть в форме, например, таблеток или капсул, полученных традиционными способами, с фармацевтически приемлемыми эксципиентами,такими как связующие (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); лубриканты (например, стеарат магния, тальк или диоксид кремния); дезинтегранты (например, картофельный крахмал или натрийкрахмалгликолят); или смачивающие вещества(например, лаурилсульфат натрия). Таблетки могут иметь покрытие, нанесенное при помощи способов,хорошо известных из уровня техники. Жидкие препараты для орального введения могут быть в форме,например, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для восстановления с использованием воды или другого подходящего носителя перед применением. Такие жидкие препараты можно получить традиционными способами, с фармацевтически приемлемыми добавками, такими как суспендирующие вещества (например, сироп сорбита, метилцеллюлоза или гидрированные пищевые жиры); эмульгаторы (например, лецитин или аравийская камедь); неводные носители (например, миндальное масло, маслянистые эфиры или этиловый спирт) и консерванты (например,метил или пропил п-гидроксибензоаты или сорбиновая кислота). Для буккального введения композиция может быть в форме таблеток или лепешек, сформулированных традиционным способом. Активные соединения по настоящему изобретению могут быть сформулированы для парентерального введения путем инъекции, включая использование традиционных методов катетеризации или инфузии. Композиции для инъекций могут быть представлены в виде единичной дозированной формы, например в ампулах или в многодозовых контейнерах, с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляном или водном носителях, и могут содержать средства для формулирования композиции, такие как суспендирующие, стабилизирую-7 014694 щие и/или диспергирующие вещества. Альтернативно, активный ингредиент может быть в форме порошка для восстановления при помощи подходящего носителя, например стерильной, не содержащей пирогенов воды, перед применением. Активные соединения по настоящему изобретению также могут быть сформулированы в ректальные композиции, такие как суппозитории или удерживаемые клизмы, например, содержащие традиционные основы для суппозиториев, такие как масло какао или другие глицериды. Для интраназального введения или введения путем ингаляции активные соединения по настоящему изобретению удобным образом доставляются в форме аэрозольного спрея из находящегося под давлением контейнера или пульверизатора, или из капсулы с использованием ингалятора или инсуффлятора. В случае аэрозоля под давлением, подходящий пропеллент, например дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ, и единицу дозирования отмеряют путем обеспечения клапана для доставки отмеренного количества. Лекарственное средство для находящегося под давлением контейнера или пульверизатора может содержать раствор или суспензию активного соединения, тогда как для капсулы оно предпочтительно должно быть в форме порошка. Капсулы и картриджи (выполненные, например, из желатина) для использования в ингаляторе или инсуффляторе могут быть сформулированы так, что они содержат порошкообразную смесь соединения по настоящему изобретению и подходящей основы для порошка, такой как лактоза или крахмал. Аэрозольные препараты для лечения состояний, указанных выше (например, мигрени), у среднего взрослого человека предпочтительно составлены таким образом, чтобы каждая отмеренная доза или"пшик" аэрозоля содержали от 20 до 1000 мкг соединения по настоящему изобретению. Общая суточная доза при использовании аэрозольного препарата составляет от 100 мкг до 10 мг. Введение можно осуществлять несколько раз в день, например 2, 3, 4 или 8 раз, отмеривая, например, 1, 2 или 3 дозы каждый раз. Эффективное количество соединения общей формулы (I) или его производных, определенное выше, можно использовать для получения лекарственного средства вместе с традиционными фармацевтическими вспомогательными веществами, носителями и добавками. Такая терапия включает множество вариантов, например введение двух совместимых соединений одновременно в одной дозированной форме или введение каждого соединения отдельно в разных дозированных формах; или, если это необходимо, в одни и те же промежутки времени или отдельно для получения максимального благоприятного эффекта или минимальных потенциальных побочных эффектов лекарственных средств в соответствии с известными принципами фармакологии. Фраза "фармацевтически приемлемый" указывает, что вещество или композиция должны быть совместимыми химически и/или токсикологически с другими ингредиентами, составляющими композицию, и/или млекопитающим, которого лечат при помощи такого вещества или композиции. Соединения по настоящему изобретению являются полезными в качестве фармацевтических средств для лечения различных состояний, где показано применение антагониста 5-HT6 рецептора, например, для лечения расстройств центральной нервной системы, таких как психоз, шизофрения, маниакальная депрессия, депрессия, неврологические расстройства, расстройства памяти, паркинсонизм, амиотрофический боковой склероз, болезнь Альцгеймера, расстройство дефицита внимания с гиперактивностью (ADHD) и болезнь Гентингтона. Термин "шизофрения" означает шизофрению, шизофренические расстройства, шизоаффективные расстройства и психотические расстройства, где термин "психотический" относится к бреду, явным галлюцинациям, дезорганизованной речи или дезорганизованному или кататоническому поведению. См."Терапевтически эффективное количество" определено как "количество соединения по настоящему изобретению, которое (i) лечит или предотвращает конкретное заболевание, состояние или расстройство,(ii) ослабляет, облегчает или устраняет один или несколько симптомов конкретного заболевания, состояния или расстройства или (iii) предотвращает или замедляет проявление одного или нескольких симптомов конкретного заболевания, состояния или расстройства, описанного в настоящем изобретении". Доза активных соединений может варьировать в зависимости от таких факторов, как путь введения,возраст и масса тела пациента, природа и тяжесть заболевания, которое лечат, и подобных факторов. Поэтому любая ссылка в настоящем описании на фармакологически эффективное количество соединений общей формулы (I) относится к указанным выше факторам. Предлагаемая доза активных соединений по настоящему изобретению для орального, парентерального, назального либо буккального введения среднему взрослому человеку для лечения состояний, указанных выше, составляет от 0,1 до 200 мг активного ингредиента на единицу дозирования, которую можно вводить, например, от 1 до 4 раз в день. В целях иллюстрации схема реакций, представленная в настоящем описании, представляет потенциальные пути синтеза соединений по настоящему изобретению, а также ключевых промежуточных соединений. Более подробное описание отдельных стадий реакций см. в разделе "примеры". Специалистам-8 014694 в данной области должно быть понятно, что можно использовать другие пути синтеза для получения соединений по настоящему изобретению. Хотя конкретные исходные вещества и реагенты указаны на схемах и обсуждаются ниже, их можно легко заменить другими исходными веществами и реагентами для обеспечения различных производных и/или реакционных условий. Кроме того, многие соединения, полученные способами, описанными ниже, могут быть далее модифицированы в свете настоящего раскрытия с использованием традиционных химических приемов, хорошо известных специалистам в данной области. Коммерческие реагенты использовали без дополнительной очистки. Комнатная температура означает температуру 25-30 С. Точки плавления не скорректированы. ИК-спектры получали с использованием KBr и в твердом состоянии. Если не указано иное, все масс-спектры получали с использованием ESI условий. Спектры 1 Н-ЯМР записывали при 400 МГц с использованием прибора Bruker. Дейтерированный хлороформ (99,8% D) использовали в качестве растворителя. TMS использовали в качестве внутреннего стандарта. Химический сдвиг выражали в миллионных долях в виде -значений. Для обозначения мультиплетности ЯМР сигналов использовали следующие аббревиатуры: с=синглет, ушир.с=уширенный синглет, д=дублет, т=триплет, кв=квартет, квинт.=квинтет, г=гептет, дд=двойной дублет, дт=двойной триплет, тт=триплет триплетов, м=мультиплет. Данные ЯМР, масс-спектрометрии скорректированы на фоновые пики. Удельное вращение измеряли при комнатной температуре с использованием натрия D(589 нм). Хроматография означает колоночную хроматографию, осуществляемую с использованием силикагеля 60-120 меш и осуществляемую под давлением азота (флэш-хроматография). Представленные ниже описания и примеры иллюстрируют получение соединений по настоящему изобретению. Промежуточное соединение 1. 4-N,N-Диметиламиноциклогексанонэтиленкеталь. Процедура. К раствору 10,0 г (222,2 мМ) диметиламина в 50 мл метанола добавляли 5,0 г(32,05 мМ) 1,4-циклогександионмоноэтиленкеталя. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре. К полученному раствору добавляли по порциям 4,02 г (64,1 мМ) цианоборогидрида натрия в течение 15 мин. По завершении этого добавления добавляли уксусную кислоту для поддержания рН на уровне около 6. Когда добавление уксусной кислоты больше не вызывало выделения газа, реакционную смесь оставляли для перемешивания при комнатной температуре в течение 18 ч. Реакционную смесь затем концентрировали при пониженном давлении и оставшуюся массу распределяли между 1 н. раствором гидроксида натрия и дихлорметаном. Водную фазу затем экстрагировали при помощи DCM. Органический слой отделяли. Эти органические фазы объединяли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 5,0 г (84%) желаемого соединения. ИК-спектр (см-1): 2945, 2874, 2776, 1448, 1282, 1159; Масс-спектр (m/z): 186,1 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,53-1,587 (4 Н, м), 1,76-1,81 (4 Н, м), 2,28 (7 Н, с), 3,94 (4 Н, с). Промежуточное соединение 2. Диметил-(2,3,4,9-тетрагидро-1 Н-карбазол-3-ил)амин. Процедура. Водный раствор серной кислоты (10% мас./об.) 30 мл помещали в круглодонную колбу,добавляли 4-N,N-диметиламиноциклогексанонэтиленкеталь (1,5 г, 8,1 мМ) с последующим добавлением фенилгидразина (1,52 г, 14,08 мМ) при комнатной температуре. Затем реакционную массу нагревали до температуры кипения с обратным холодильником (95-100 С) и поддерживали при кипячении с обратным холодильником в течение 2-3 ч. Ход реакции отслеживали методом ТСХ. По завершении реакции реакционную массу охлаждали до комнатной температуры и затем до 10-15 С. Затем массу подщелачивали при помощи водного раствора NaOH (20% мас./об.) и водный слой экстрагировали этилацетатом. Слои разделяли. Органическую фазу промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и растворитель удаляли путем перегонки в вакууме. Оставшуюся массу очищали флэш-хроматографией (этилацетат:триэтиламин 9:0,2). ИК-спектр (см-1): 3141, 3054, 2921, 2831, 2729, 1626, 1591, 743; Температурный интервал плавления(С): 132,8-139,1; Масс-спектр (m/z): 214,9 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,80-1,91 (1 Н, м), 2,19-2,27 (1 Н, м), 2,42 (6 Н, с), 2,64-2,67 (1 Н, м), 2,78-2,83 (3 Н, м),2,93-2,97 (1 Н, м), 7,05-7,13 (2 Н, м), 7,25-7,26 (1 Н, м) 7,45-7,46 (1 Н, д ушир., м), 7,90 (1 Н, ушир.с). Пример 1. (9-Бензолсульфонил-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил)диметиламин. Процедура. Гидрид калия 153,80 мг, 1,15 мМ (30% суспензия в минеральном масле) добавляли в тетрагидрофуран (15 мл) и перемешивали при 25 С в течение 10 мин. Реакционную смесь охлаждали до 10-15 С. Медленно добавляли диметил(2,3,4,9-тетрагидро-1 Н-карбазол-3-ил)амин (190 мг, 0,88 мМ), растворенный в 5 мл ТГФ, при перемешивании, поддерживая температуру массы ниже 25 С. Затем реакционную массу перемешивали в течение 1 ч при 25 С. Затем добавляли раствор бензолсульфонилхлорида(235 мг, 1,33 мМ, растворенный в 5 мл ТГФ) по каплям в течение 15 мин. Реакционную массу перемешивали, отслеживая ход реакции методом ТСХ, в течение 2 ч при 25 С. По завершении реакции смесь разбавляли при помощи 75 мл ледяной воды и экстрагировали этилацетатом; органический слой промывали насыщенным солевым раствором. Этилацетатный экстракт сушили над безводным сульфатом натрия; фильтровали и растворитель удаляли при пониженном давлении с получением неочищенного продукта.-9 014694 Оставшуюся массу очищали флэш-хроматографией (силикагель, EtOAc/н-гексан, 9/1) с получением указанного в заголовке соединения, которое было охарактеризовано при помощи ИК, ЯМР и массспектрального анализов. ИК-спектр (см-1): 3065, 2933, 1630, 1370, 1172; Масс-спектр (m/z): 355 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,67-1,71 (1 Н, м), 1,96-2,08 (1 Н, м), 2,42 (6 Н, с), 2,51-2,6 (1 Н, м), 2,72-2,8 (1 Н, м) 2,82-3,0 (2 Н, м), 3,29-3,38 (1 Н, м), 7,23-7,28 (2 Н, м), 7,34-7,36 (1 Н, м), 7,39-7,43 (2 Н, м), 7,49-7,56 (1 Н, м),7,75-7,77 (2 Н, м), 8,12-8,14 (1 Н, дд, J=8,06 Гц). Пример 2. 9-[(4-Бромбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. Температурный интервал плавления (С): 159,7-162,1; ИК-спектр (см-1): 3079, 2929, 1571, 1376,1171; Масс-спектр (m/z): 433 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,67-1,71 (1 Н, м), 2,19-2,22 (1 Н, м), 2,39 (6 Н, с), 2,52-2,56 (1 Н, м), 2,68 (1 Н, м),2,79-2,81 (1 Н, м), 2,83-2,84 (1 Н, м), 3,26-3,3 (1 Н, м), 7,24-7,27 (2 Н, м), 7,28-7,35 (1 Н, м), 7,52-7,54 (2 Н, м),7,6-7,62 (2 Н, м), 8,09-8,11 (1 Н, м). Пример 3. 9-[(4-Фторбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. Температурный интервал плавления (С): 130,2-132,8; ИК-спектр (см-1): 3098, 2942, 1588, 1376,1177; Масс-спектр (m/z): 373 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,67-1,71 (1 Н, м), 2,20-2,23 (1 Н, м), 2,39 (6 Н, с), 2,52-2,55 (1 Н, м), 2,66-2,67 (1 Н, м),2,79-2,84 (2 Н, м), 3,27-3,28 (1 Н, м), 7,05-7,10 (2 Н, м), 7,24-7,27 (2 Н, м), 7,34-7,35 (1 Н, м), 7,76-7,80 (2 Н,м), 8,10-8,12 (1 Н, м). Пример 4. 9-[(4-Метилбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. Температурный интервал плавления (С): 131,3; ИК-спектр (см-1): 3024, 2978, 2938, 1620, 1370,1172; Масс-спектр (m/z): 369,4 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,67-1,71 (1 Н, м), 2,20-2,23 (1 Н, м), 2,33 (3 Н, с), 2,40 (6 Н, с), 2,52-2,56 (1 Н, м),2,65-2,74 (1 Н, м), 2,80-2,85 (2 Н, м), 3,29-3,30 (1 Н, м), 7,18-7,27 (4 Н, м), 7,33-7,35 (1 Н, м), 7,64-7,66 (2 Н,м), 8,12-8,14 (1 Н, м). Пример 5. [9-(3-Хлорбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. Температурный интервал плавления (С): 121,2; ИК-спектр (см-1): 3093, 3070, 2932, 1616, 1367,1177; Масс-спектр (m/z): 389 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,69-1,73 (1 Н, м), 2,21-2,22 (1 Н, м), 2,53 (6 Н, с) 2,53-2,53 (1 Н, м), 2,68-2,69 (1 Н, м),2,80-2,81 (1 Н, м), 2,84-2,85 (1 Н, м) 3,26-3,27 (1 Н, м), 7,25-7,29 (2 Н, м), 7,30-7,36 (2 Н, м), 7,46-7,50 (1 Н, м),7,61-7,66 (1 Н, м), 7,67-7,76 (1 Н, м), 8,09-8,11 (1 Н, м). Пример 6. [9-(4-Изопропилбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. Температурный интервал плавления (С): 162,4; ИК-спектр (см-1): 3068, 2928, 2962, 1621, 1364,1170; Масс-спектр (m/z): 397,5 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,18-1,20 (6 Н, д, J=6,92), 1,69-1,72 (1 Н, м), 2,00-2,23 (2 Н, м), 2,40 (6 Н, с), 2,53-2,56[9-(3-Трифторметилбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. Температурный интервал плавления (С): 116,96; ИК-спектр (см-1): 3082, 2931, 1607, 1370, 1169; Масс-спектр (m/z): 423,3 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,69-1,73 (1 Н, м), 2,22-2,23 (1 Н, м), 2,39 (6 Н, с) 2,53-2,56 (1 Н, м), 2,67-2,67 (1 Н, м),2,79-2,84 (1 Н, м), 2,87-2,98 (1 Н, м), 3,28-3,29 (1 Н, м), 7,25-7,30 (2 Н, м), 7,34-7,37 (1 Н, м), 7,53-7,58 (1 Н,м), 7,76-7,79 (1 Н, м), 7,87-7,89 (1 Н, м), 8,13-8,15 (1 Н, ушир.с), 8,10-8,12 (1 Н, д, J=8,08). Пример 8. [9-(4-Метоксибензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. Температурный интервал плавления (С): 138,81; ИК-спектр (см-1): 3096, 3032, 2937, 1593, 1367,1166; Масс-спектр (m/z): 385,2 (М+Н)+; Н-ЯМР (, м.д.): 1,66-1,73 (1 Н, м), 2,17-2,22 (1 Н, м), 2,39 (6 Н, с), 2,51-2,55 (1 Н, м), 2,66-2,67 (1 Н, м),2,79-2,84 (1 Н, м), 2,86-2,96 (1H, м), 3,29-3,34 (1H, м), 3,79 (3 Н, с), 6,84-6,86 (2 Н, дд, J=7,0, 2,0 Гц), 7,227,27 (2 Н, м), 7,33-7,35 (1 Н, м), 7,70-7,72 (2 Н, дд, J=7,0, 2,0), 8,12-8,14 (1 Н, д, J=8,08). Пример 9. [6-Бром-9-(бензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3066, 2967, 2918, 2856, 1631, 1592, 1364, 1169; Масс-спектр (m/z): 433 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,68-1,71 (1 Н, м), 1,97-1,99 (1 Н, м), 2,39 (6 Н, с), 2,47-2,49 (1 Н, м), 2,69-2,75 (1 Н, м),2,76-2,81 (1 Н, м), 2,85-2,96 (1 Н, м), 3,27-3,32 (1 Н, м), 7,35-7,38 (1 Н, дд, J=8,8, 1,9), 7,41-7,45 (2 Н, м), 7,477,48 (1 Н, д, J=l,9), 7,53-7,55 (1 Н, м), 7,73-7,75 (2 Н, м), 8,00-8,02 (1 Н, д, J=8,8). Пример 10. [6-Бром-9-(4-бромбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3088, 2927, 2862, 2822, 1592, 1373, 1170; Масс-спектр (m/z): 511, 513 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,66-1,71 (1 Н, м), 2,18-2,21 (1 Н, м), 2,37 (6 Н, с), 2,48-2,51 (1 Н, м), 2,65-2,77 (3 Н, м),3,24-3,25 (1 Н, м), 7,36-7,38 (1 Н, дд, J=8,8, 1,92), 7,48-7,48 (1 Н, д, J=l,9 Гц), 7,54-7,60 (4 Н, м), 7,96-7,98(1 Н, д ущир., J=8,8). Пример 11. [6-Бром-9-(4-фторбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3063, 2932, 2860, 2775, 1589, 1375, 1175; Температурный интервал плавления (С): 158,1-160,0; Масс-спектр (m/z): 450,7 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,67-1,71 (1 Н, м), 2,19-2,22 (1 Н, м), 2,37 (6H, с), 2,48-2,51 (1 Н, м), 2,65 (1 Н, м),2,73-2,75 (1 Н, м), 2,77-2,78 (1 Н, м), 3,25-3,3 (1 Н, м), 7,08-7,12 (2 Н, м), 7,36-7,38 (1 Н, дд, J=8,84, 1,92),7,48-7,49 (1 Н, д, J=1,88), 7,74-7,78 (2 Н, м), 7,97-8,00 (1 Н, д, J=8,84). Пример 12.[6-Бром-9-(4-изопропилбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3069, 2962, 2770, 1595, 1366, 1166; Температурный интервал плавления (С): 152,75-154,98; Масс-спектр (m/z): 475,2, 477,1 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,19-1,21 (6 Н, д, J=6,88), 1,66-1,71 (1 Н, м), 2,17-2,24 (1 Н, м), 2,37 (6 Н, с), 2,48-2,51[6-Бром-9-(3-трифторметилбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3105, 3082, 2936, 2820, 1606, 1594, 1372, 1175; Масс-спектр (m/z): 501,3, 503,2[6-Бром-9-(2-бромбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3086, 2920, 2772, 1614, 1594, 1363, 1163; Температурный интервал плавления (С): 158,78-161,04; Масс-спектр (m/z): 511,1, 513,1, 515,1[6-Бром-9-(4-метоксибензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. Масс-спектр (m/z): 463,1, 465,1 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,65-1,70 (1 Н, м), 2,18-2,21 (1 Н, м), 2,37 (6 Н, с), 2,47-2,50 (1 Н, м), 2,61-2,70 (1 Н, м),2,73-2,78 (1 Н, м), 2,82-2,95 (1 Н, м), 3,27-3,31 (1 Н, м), 3,80 (3 Н, с), 6,86-6,88 (2 Н, дд, J=7,0, 2,0), 7,34-7,37(1 Н, дд, J=8,8, 2,0 Гц), 7,46-7,47 (1 Н, д, J=1,88 Гц), 7,67-7,70 (2 Н, дд, J=8,96, 2,0 Гц), 7,79-8,01 (1 Н, д,J=8,8 Гц). Пример 16. [6-Хлор-9-бензолсульфонил-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3052, 2936, 1619, 1369, 1170; Температурный интервал плавления (С): 150-155; Масс-спектр (m/z): 389,3, 391,2 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,72-1,76 (1 Н, м), 2,25-2,32 (1 Н, м), 2,47 (6 Н, с), 2,51-2,60 (1 Н, м), 2,81-2,92 (3 Н, м),3,30-3,3 (1 Н, м), 7,22-7,25 (1 Н, дд, J=8,84, 2,12 Гц), 7,32-7,32 (1 Н, д, J=2,04), 7,42-7,46 (2 Н, м), 7,54-7,55[6-Хлор-9-(3-трифторметилбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3001, 3059, 2923, 1601, 1373, 1180; Масс-спектр (m/z): 457,2, 459,2 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,74-1,77 (1 Н, м), 2,28-2,29 (1 Н, м), 2,46 (6 Н, с), 2,57 (1 Н, м), 2,81-2,90 (3 Н, м),3,29-3,33 (1 Н, м), 7,25-7,28 (1 Н, дд, J=8,0, 2,0), 7,33-7,34 (1 Н, д, J=2,04), 7,57-7,61 (1 Н, м), 7,80-7,82 (1 Н,м), 7,85-7,87 (1 Н, м), 8,02-8,05 (2 Н, м). Пример 18.[6-Хлор-9-(4-метилбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3081, 3026, 2923, 1600, 1371, 1181; Температурный интервал плавления (С): 130138; Масс-спектр (m/z): 403,3, 405,3 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,66-1,70 (1 Н, м), 2,19-2,22 (1 Н, м), 2,35 (3 Н, с), 2,38 (6 Н, с), 2,48-2,51 (1 Н, м), 2,67[6-Хлор-9-(4-бромбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3078, 2927, 1593, 1376, 1168; Масс-спектр (m/z): 467, 469,0 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,70-1,75 (1 Н, м), 2,25-2,27 (1 Н, м), 2,44 (6 Н, с), 2,53-2,57 (1 Н, м), 2,80-2,87 (3 Н, м),3,26-3,31 (1 Н, м), 7,23-7,25 (1 Н, дд, J=8,8, 1,7) 7,32-7,33 (1 Н, д, J=1,66), 7,54-7,63 (4 Н, м), 8,01-8,03 (1 Н, д,J=8,80). Пример 20. [6-Хлор-9-(4-фторбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 2933, 1590, 1492, 1454, 1377, 1173, 1068, 837, 586, 542; Температурный интервал плавления (С): 150-155; Масс-спектр (m/z): 407,3, 409,2 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,71-1,75 (1 Н, м), 2,25 (1 Н, м), 2,43 (6 Н, с), 2,54-2,54 (1 Н, м), 2,80-2,84 (3 Н, м),3,27-3,29 (1 Н, м), 7,09-7,13 (2 Н, м), 7,23-7,26 (1 Н, м), 7,33-7,33 (1 Н, д, J=2,04 Гц), 7,74-7,78 (2 Н, м), 8,038,05 (1 Н, д, J=8,84). Пример 21. [6-Фтор-9-бензолсульфонил-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3058, 2964, 2825, 2777, 1603, 1371, 1172; Температурный интервал плавления (С): 127,7-130,3; Масс-спектр (m/z): 373,2; 1 Н-ЯМР (, м.д.): 1,65-1,70 (1 Н, м), 2,18-2,21 (1 Н, м), 2,37 (6 Н, с), 2,48-2,53 (1 Н, м), 2,62-2,69 (1 Н, м),2,72-2,78 (1 Н, м), 2,84-2,95 (1 Н, м), 3,27-3,28 (1 Н, м), 6,97-7,01 (2 Н, м), 7,41-7,4 (2 Н, м), 7,52-7,54 (1 Н, м),7,73-7,75 (2 Н, м), 8,05-8,95 (1 Н, м). Пример 22.[6-Фтор-9-(4-метилбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3062, 2937, 2794, 1597, 1371, 1174; Температурный интервал плавления (С): 148,8-153; Масс-спектр (m/z): 387,3; 1 Н-ЯМР (, м.д.): 1,65-1,70 (1 Н, м), 2,18-2,22 (1 Н, м), 2,35 (3 Н, с), 2,38 (6 Н, с), 2,44-2,52 (1 Н, м),2,63-2,69 (1 Н, м), 2,72-2,79 (1 Н, м), 2,84-2,94 (1 Н, м), 3,27-3,28 (1 Н, м), 6,95-7,00 (2 Н, м), 7,19-7,21 (2 Н, д,J=8,2), 7,61-7,63 (2 Н, д, J=8,36), 8,05-8,08 (1 Н, м). Пример 23.[6-Фтор-9-(4-изопропилбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3- 12014694 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 2963, 2847, 2818, 1607, 1373, 1172; Температурный интервал плавления (С): 95,4103,8; Масс-спектр (m/z): 415,4 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,19-1,20 (6 Н, д, J=6,96), 1,67-1,71 (1 Н, м), 2,19-2,22 (1 Н, м), 2,39 (6 Н, с), 2,46-2,54[6-Фтор-9-(4-бромбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3081, 2932, 2861, 1602, 1376, 1174; Температурный интервал плавления (С): 170,6-174,1; Масс-спектр (m/z): 451, 453,2 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,67-1,71 (1 Н, м), 2,19-2,23 (1 Н, м), 2,39 (6 Н, с), 2,46-2,54 (1 Н, м), 2,68-2,76 (2 Н, м),2,82-2,93 (1 Н, м), 3,24-3,33 (1 Н, м), 6,97-7,01 (2 Н, м), 7,54-7,60 (4 Н, м), 8,02-8,06 (1 Н, м). Пример 25. [6-Фтор-9-(4-фторбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3098, 2949, 2796, 1589, 1376, 1176; Температурный интервал плавления (С): 147,5-151,2; Масс-спектр (m/z): 391,3; 1 Н-ЯМР (, м.д.): 1,67-1,72 (1 Н, м), 2,20-2,23 (1 Н, м), 2,39 (6 Н, с), 2,47-2,53 (1 Н, м), 2,69-2,78 (2 Н, м),2,83-2,93 (1 Н, м), 3,26-3,27 (1 Н, м), 6,97-7,01 (2 Н, м), 7,07-7,12 (2 Н, м), 7,74-7,77 (2 Н, м), 8,03-8,07 (1 Н,м). Пример 26. [6-Метокси-9-бензолсульфонил-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3063, 2916, 2791, 1607, 1362, 1171; Температурный интервал плавления (С): 157,7-162; Масс-спектр (m/z): 385,3 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,62-1,69 (1 Н, м), 2,18-2,21 (1 Н, м), 2,38 (6 Н, с), 2,47-2,51 (1 Н, м), 2,65-2,65 (1 Н, м),2,73-2,77 (1 Н, м), 2,82-2,94 (1 Н, м), 3,26-3,30 (1 Н, м), 3,83 (3 Н, с), 6,78-6,78 (1 Н, д, J=2,52), 6,86-6,88 (1 Н,д, J=9,0, 2,52), 7,38-7,42 (2 Н, м), 7,49-7,53 (1 Н, м), 7,72-7,74 (2 Н, м), 8,01-8,03 (1 Н, д, J=9,04). Пример 27.[6-Метокси-9-(4-метилбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3062, 2927, 2829, 2776, 1607, 1367, 1160; Температурный интервал плавления (С): 131,8-140,0; Масс-спектр (m/z): 399,2 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,66-1,70 (1 Н, м), 2,01-2,23 (1 Н, м), 2,33 (3 Н, с), 2,40 (6 Н, м), 2,44-2,52 (1 Н, м),2,67-2,81 (2 Н, м), 2,83-2,94 (1 Н, м), 3,27-3,28 (1 Н, м), 3,83 (3 Н, с), 6,77-6,78 (1 Н, д, J=2,48), 6,85-6,88 (1 Н,д, J=9,0, 2,48), 7,17-7,19 (2 Н, д, J=8,24), 7,60-7,62 (2 Н, д, J=8,28), 8,00-8,03 (1 Н, д, J=9,05). Пример 28.[6-Метокси-9-(4-метоксибензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3096, 2944, 2840, 1605, 1364, 1159; Масс-спектр (m/z): 415,2 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,65-1,7 (1 Н, м), 2,2-2,23 (1 Н, м), 2,4 (6 Н, с), 2,48-2,51 (1 Н, м), 2,64-2,72 (1 Н, м),2,74-2,81 (1 Н, м), 2,83-2,93 (1 Н, м), 3,27-3,33 (1 Н, м), 3,78 (3 Н, с), 3,83 (3 Н, с), 6,77-6,78 (1 Н, д, J=2,80),6,82-6,88 (3 Н, м), 7,65-7,69 (2 Н, м), 8,00-8,03 (1 Н, д, J=9,04). Пример 29.[6-Метокси-9-(4-бромбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3085, 2933, 2860, 2774, 1608, 1572, 1374, 1160; Температурный интервал плавления (С): 173,2-173,8; Масс-спектр (m/z): 463 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,62-1,72 (1 Н, м), 2,17-2,21 (1 Н, м), 2,38 (6 Н, с), 2,44-2,50 (1 Н, м), 2,63-2,65 (1 Н, м),2,73-2,85 (2 Н, м), 3,24-3,49 (1 Н, м), 3,83 (3 Н, с), 6,78 (1 Н, ушир.с), 6,86-6,88 (1 Н, м), 7,51-7,59 (4 Н, м),7,99 (1 Н, д, J=8,92). Пример 30.- 13014694 изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3095, 2944, 2860, 2783, 1607, 1589, 1373, 1173; Температурный интервал плавления (С): 160,7-163,4; Масс-спектр (m/z): 403,3 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,65-1,70 (1 Н, м), 2,19-2,22 (1 Н, м), 2,39 (6 Н, с), 2,48-2,51 (1 Н, м), 2,62-2,69 (1 Н, м),2,74-2,80 (1 Н, м), 2,81-2,92 (1 Н, м), 3,24-3,29 (1 Н, м), 3,83 (3 Н, с), 6,78-6,79 (1 Н, д, J=2,4), 6,86-6,89 (1 Н,дд, J=9,0, 2,5), 7,04-7,09 (2 Н, м), 7,72-7,76 (2 Н, м), 7,98-8,01 (1 Н, д, J=9,03). Пример 31. [6-Метокси-9-(3-трифторметилбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3081, 2927, 1608, 1432, 1371, 1325, 1171, 1035, 573; Температурный интервал плавления (С): 144-146; Масс-спектр (m/z): 453,4 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,64-1,72 (1 Н, м), 2,21-2,24 (1 Н, м), 2,39 (6 Н, с), 2,49-2,52 (1 Н, м), 2,6-2,7 (1 Н, м),2,73-2,78 (1 Н, м), 2,82-2,93 (1 Н, м), 3,25-3,32 (1 Н, м), 3,83 (3 Н, с), 6,783-6,789 (1 Н, д, J=2,52), 6,87-6,90(1 Н, д, J=9,06), 8,01 (1 Н, ушир.с). Пример 32. [6-Метилтио-9-бензолсульфонил-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. Температурный интервал плавления (С): 87,6; ИК-спектр (см-1): 2922, 1595, 1446, 1371, 1170, 1090,723, 599; Масс-спектр (m/z): 401,3 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,67-1,7 (1 Н, м), 2,22-2,29 (1 Н, м), 2,43 (6 Н, с), 2,51 (3 Н, с), 2,52-2,57 (1 Н, м), 2,762,85 (3 Н, м), 3,29-3,33 (1 Н, м), 7,21-7,25 (2 Н, м), 7,40-7,44 (2 Н, м), 7,51-7,53 (1 Н, м), 7,73-7,75 (2 Н, м),8,04-8,06 (1 Н, д, J=8,32). Пример 33.[6-Метилтио-9-(4-метилбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 2917, 2771, 1595, 1369, 1168; Температурный интервал плавления (С): 105,2-115; Масс-спектр (m/z): 415,3 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,66-1,71 (1 Н, м), 2,2-2,23 (1 Н, м), 2,34 (3 Н, с), 2,4 (6 Н, с), 2,48 (3 Н, с), 2,51-2,55[6-Метилтио-9-(4-бромбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 3078, 2918, 2849, 2772, 1595, 1373, 1168; Температурный интервал плавления (С): 141,1-148,1; Масс-спектр (m/z): 479,3, 481,3 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,68-1,7 (1 Н, м), 2,0-2,23 (1 Н, м), 2,39 (6 Н, с), 2,51 (3 Н, с), 2,48-2,54 (1 Н, м), 2,632,71 (1 Н, м), 2,76-2,92 (2 Н, м), 3,23-3,32 (1 Н, м), 7,20-7,26 (2 Н, м), 7,53-7,55 (2 Н, м), 7,57-7,60 (2 Н, м),8,00-8, 02 (1 Н, д, J=8,6). Пример 35.[6-Метилтио-9-(4-фторбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 2924, 2824, 2776, 1589, 1373, 1171; Температурный интервал плавления (С): 148,9-156,1; Масс-спектр (m/z): 419,3 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,64-1,73 (1 Н, м), 2,19-2,21 (1 Н, м), 2,38 (6 Н, с), 2,48-2,52 (1 Н, м), 2,51 (3 Н, с),2,61-2,69 (1 Н, м), 2,75-2,92 (2 Н, м), 3,24-3,25 (1 Н, м), 7,06-7,10 (2 Н, м), 7,21-7,26 (2 Н, м), 7,74-7,78 (2 Н,м), 8,01-8,03 (1 Н, д, J=8,6). Пример 36.[6-Хлор-9-(2-бромбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 2919, 1573, 1447, 1366, 1166, 956, 596; Масс-спектр (m/z): 466,8 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,66-1,71 (1 Н, м), 2,10-2,20 (1 Н, м), 2,39 (6 Н, с), 2,50-2,60 (1 Н, м), 2,65-2,80 (2 Н, м),2,82-2,90 (1 Н, м), 3,10-3,18 (1 Н, м), 7,14-7,17 (1 Н, дд, J=8,84, 2,16), 7,394-7,399 (1 Н, д, J=2,0), 7,40-7,49- 14014694 С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. Температурный интервал плавления (С): 160-165; ИК-спектр (см-1): 3011, 2941, 1617, 1585, 1457,1379, 1171, 959, 666, 607, 567; Масс-спектр (m/z): 405,3 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,68-1,80 (1 Н, м), 2,25-2,32 (1 Н, м), 2,39 (3 Н, с), 2,44 (6 Н, с), 2,49-2,60 (1 Н, м),2,77-2,83 (2 Н, м), 3,05-3,15 (1 Н, м), 3,35-3,45 (1 Н, м), 6,65-6,71 (1H, м), 6,80-6,83 (1H, м), 7,25-7,27 (2H, д,J=8,16), 7,72-7,74 (2 Н, д, J=8,12). Пример 38. [6,8-Дифтор-9-бензолсульфонил-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. Температурный интервал плавления (С): 150-155; ИК-спектр (см-1): 3021, 2925, 1617, 1585, 1461,1377, 1172, 959, 720, 615, 575; Масс-спектр (m/z): 391,3 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,67-1,78 (1 Н, м), 2,25-2,30 (1 Н, м), 2,41 (6 Н, с), 2,48-2,55 (1 Н, м), 2,72-2,81 (2 Н, м),3,07-3,15 (1 Н, м), 3,37-3,43 (1 Н, м), 6,66-6,71 (1 Н, дт, J=7,82, 2,32), 6,81-6,84 (1 Н, дд, J=7,82, 2,32), 7,477,52 (2 Н, м), 7,56-7,60 (1 Н, м), 7,84-7,86 (2 Н, м). Пример 39.[6-Бром-9-(2,3-дихлорбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 2946, 2775, 1597, 1438, 1370, 1171, 795, 615; Температурный интервал плавления[6-Метилтио-9-(2,3-дихлорбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 2919, 1405, 1370, 1166, 793, 619, 600; Масс-спектр (m/z): 469,3, 471,3, 473,3[6-Метилтио-9-(4-метоксибензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 2926, 1594, 1456, 1363, 1261, 1157, 1087, 959, 800, 589, 554; Масс-спектр (m/z): 431,2 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,61-1,70 (1 Н, м), 2,18-2,26 (1 Н, м), 2,39 (6 Н, с), 2,48 (3 Н, с), 2,60-2,90 (4 Н, м),3,25-3,35 (1 Н, м), 3,80 (3 Н, с), 6,84-6,88 (2 Н, м), 7,20-7,23 (1 Н, дд, J=8,6, 1,84), 7,24-7,25 (1 Н, д, J=1,61),7,67-7,72 (2 Н, м), 8,03-8,06 (1 Н, д, J=8,6). Пример 42.[6-Метилтио-9-(3-хлорбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3 ил]диметиламин. С использованием, по существу, такой же процедуры, которая описана в примере 1, и некоторых изменений, которые не являются критическими, получали указанное выше производное. ИК-спектр (см-1): 2919, 1579, 1458, 1370, 1168, 960, 796, 670, 559; Температурный интервал плавления (С): 87-89; Масс-спектр (m/z): 435,3, 437,5 (М+Н)+; 1 Н-ЯМР (, м.д.): 1,70-1,80 (1 Н, м), 2,15-2,25 (1 Н, м), 2,40 (6 Н, с), 2,50-2,60 (4 Н, м), 2,65-2,75 (1 Н, м),2,76-2,95 (2 Н, м), 3,24-3,30 (1 Н, м), 6,99-7,24 (2 Н, м), 7,33-7,38 (1 Н, т, J=7,96), 7,48-7,52 (1 Н, м), 7,58-7,62(1 Н, м), 7,74-7,75 (1 Н, т, J=1,88), 8,00-8,02 (1 Н, д, J=8,64). Пример 43. Определение количества потребляемой пищи. Использовали самцов крыс Wistar (120-140 г), которых получали от N.I.N. (National Institute of Nutrition, Hyderabad, India). Затем определяли хронический эффект соединений общей формулы (I) на потребление пищи у крыс, которых хорошо кормили, следующим образом. Крыс помещали в отдельные клетки для проживания в течение 28 дней. В течение этого периода крысы получали либо оральную, либо интраперитонеальную дозу композиции, включающей соединение формулы (I), либо соответствующую композицию (носитель) без указанного соединения (контрольная группа), раз в день. Крысы получали пищу и воду ad libitum. В день 0, 1-й, 7-й, 14-й, 21-й и 28-й крыс оставляли с предварительно отмеренным количество пищи. Потребление пищи и прибавку в весе определяли с использованием рутинных процедур. Также спо- 15014694 соб определения потребления пищи раскрыт в литературе (Kask et al., European Journal of Pharmacology,414, 2001, 215-224, и Turnball et al., Diabetes, vol. 51, August, 2002, с некоторыми предпринятыми на месте модификациями). Некоторые репрезентативные соединения показали статистически значимое снижение в потреблении пищи при осуществлении эксперимента, как указано выше, при дозах либо 10 мг/кг, либо 30 мг/кг или обеих. Пример 44. Таблетки, включающие соединение формулы (I). Ингредиенты объединяют и гранулируют с использованием растворителя, такого как метанол. Композицию затем сушат и формуют в таблетки (содержащие около 20 мг активного соединения) с использованием соответствующей машины для таблетирования. Пример 45. Композиция для орального введения. Ингредиенты смешивают и распределяют в капсулы, каждая из которых содержит около 100 мг; одна капсула должна содержать примерно общую суточную дозу. Пример 46. Жидкая оральная композиция. Ингредиенты смешивают с образованием суспензии для орального введения. Пример 47. Парентеральная композиция. Активный ингредиент растворяют в части воды для инъекций. Затем добавляют достаточное количество хлорида натрия при перемешивании, чтобы сделать раствор изотоническим. Раствор доводят до нужной массы путем добавления остальной части воды для инъекций, фильтруют через мембранный фильтр 0,2 мкм и упаковывают в стерильных условиях. Пример 48. Композиция суппозитория. Ингредиенты расплавляют вместе, смешивают на паровой бане и заливают в формы с общим содержанием смеси по 2,5 г в каждой.- 16014694 Пример 49. Композиция для местного применения. Все ингредиенты, за исключением воды, объединяют и нагревают до около 60 С при перемешивании. Затем добавляют достаточное количество воды при около 60 С при интенсивном перемешивании для эмульгирования ингредиентов, а затем добавляют воду q.s. до получения массы около 100 г. Пример 50. Модель задачи узнавания объекта. Свойства по улучшению познавательной способности соединений по настоящему изобретению оценивали с использованием модели познавательной способности животного: модели задачи узнавания объекта. В качестве экспериментальных животных использовали самцов крыс wistar (230-280 г), полученных от N.I.N. (National Institute of Nutrition, Hyderabad, India). В каждую клетку помещали по четыре крысы. Животных выдерживали на 20% пищевой депривации в течение одного дня до начала эксперимента и давали им воду ad libitum в течение всего эксперимента, поддерживая цикл 12 часов свет/темнота. Также крыс приучали к индивидуальной арене в течение 1 ч в отсутствие каких-либо объектов. Одна группа из 12 крыс получала носитель (1 мл/кг) орально, а другая группа животных получала соединение формулы (I) либо орально, либо интраперитонеально за 1 ч до испытания, включающего процедуру ознакомления (Т 1) и выбора (Т 2). Эксперимент осуществляли в 505050 см камере "открытое поле" из акрилового полимера. В фазе ознакомления (Т 1) крыс помещали индивидуально в камеру "открытое поле" на 3 мин, где в двух смежных углах на расстоянии 10 см от стенки размещали два идентичных объекта (пластиковые бутылки, 12,5 см в высоту 5,5 см в диаметре), покрытые только желтой маскировочной лентой (a1 и а 2). Через 24 ч после испытания (Т 1) на долговременную память тех же крыс помещали на ту же арену, куда их помещали для испытания Т 1. В фазе выбора (Т 2) крыс оставляли для изучения "открытого поля" на 3 мин в присутствии одного знакомого объекта (а 3) и одного нового объекта (b) (стеклянная бутылка янтарного цвета, 12 см в высоту и 5 см в диаметре). Знакомые объекты имели такую же текстуру, цвет и размеры. В процессе испытания Т 1 и Т 2 изучение каждого объекта (определяемое как обнюхивание, лизание, жевание или вибрирующие движения при направлении носа на объект на расстоянии менее 1 см) записывали отдельно с использованием секундомера. Сидение на объекте не рассматривали как изучающую активность, однако это редко наблюдали. Т 1 представляет общее время, затраченное на изучение знакомых объектов (a1+a2). Т 2 представляет общее время, затраченное на изучение знакомого объекта и нового объекта (а 3+b). Испытание узнавания объекта осуществляли, как описано Ennaceur, A., Delacour, J., 1988, A newone-trial test for neurobiological studies of memory in rats- Behavoral data, Behav. Brain Res., 31, 47-59. Репрезентативные соединения продемонстрировали положительные эффекты, показывающие улучшенное распознавание нового объекта viz; увеличение времени изучения нового объекта и более высокий показатель различения. Пример 51. Индукция жевания/зевоты/вытягивания антагонистами 5HT6R. Использовали самцов крыс Wistar с массой тела 200-250 г. Крысы получали инъекции носителя и их помещали в отдельные прозрачные камеры на 1 ч каждый день в течение 2 дней перед днем испытания, чтобы они привыкли к камерам для ведения наблюдения и процедуре испытания. В день испытания крыс помещали в камеры для ведения наблюдения сразу после введения лекарственного средства и вели непрерывное наблюдение за поведением животных, таким как зевание, вытягивание тела и жевание, в течение от 60 до 90 мин после инъекций лекарственного средства или носителя. За 60 мин до введения лекарственного средства всем животным вводили Physostigmine, 0,1 мг/кг интраперитонеально. Записывали среднее количество зеваний, вытягиваний и бессмысленных жевательных движений в течение 30-минутного периода наблюдения. Репрезентативные примеры продемонстрировали 40-60% увеличение поведения, включающего вытягивающие, зевательные и жевательные движения по сравнению с группами обработки носителем при 1, 3, 10 и 30 мг/кг. Ссылочная литература: (a) King M.V., Sleight A.J., Woolley M.L., and et al. Neuropharmacology, 2004, 47, 195-204. (b) Bentey J.C., Bourson A., Boess F.G., Fone K.С.F., Marsden С.A., Petit N.,Sleight A.J., British Journal of Pharmacology, 1999, 126 (7), 1537-1542.- 17014694 Пример 52. Водный лабиринт. Устройство водного лабиринта включало круглый бассейн (1,8 м в диаметре, 0,6 м в высоту), выполненный из черного Perspex (TSE systems, Germany), наполненный водой (242 С) и расположенный под видеокамерой с широким углом обзора для слежения за животными. 10 см 2 платформу из perspex,лежащую на 1 см ниже водной поверхности, помещали в центр одного из четырех воображаемых квадратов, что оставалось постоянным для всех крыс. Черный Perspex, используемый для конструкции лабиринта и платформы, исключал какие-либо подсказки внутри лабиринта, помогающие животным выбраться из него. В отличие от этого помещение для обучения предлагало несколько сильных визуальных сигналов вне лабиринта, способствующих формированию пространственной карты, необходимой для запоминания пути спасения. Использовали автоматическую систему отслеживания [Videomot 2 (5,51),TSE systems, Germany]. Эта программа анализирует видеоизображение, полученное при помощи цифровой камеры и табло приема изображения, где определяли длину пути, скорость плавания и количество попыток, а также продолжительность времени плавания в каждом квадрате водного лабиринта. Ссылочная литература: (a) Yamada N., Hattoria A., Hayashi Т., Nishikawa Т., Fukuda H. et al., Pharmacology, Biochem. and Behaviour, 2004, 78, 787-791. (b) Binder M.D., Hodges D.B., Hogan J В., Corsa J A., et al. TheJournal of Pharmacology and Experimental Therapeutics, 2003, 307 (2), 682-691. Пример 53. Пассивное избегание. Животных обучали по парадигме, включающей одно испытание, сквозное перемещение, пассивное избегание света-темноты. Тренировочный аппарат состоял из камеры 300 мм в длину, 260 мм в ширину и 270 мм в высоту, сконструированной в соответствии с принятыми конструкциями. Передняя часть и верх были прозрачными, позволяя экспериментатору наблюдать за поведением животного внутри аппарата. Камера была разделена на два отделения, разделенные центральной перегородкой, которая имела небольшое отверстие 50 мм в ширину и 75 мм в высоту, расположенное в непосредственной близости от передней стороны камеры. Меньшее из отделений имело 9 мм в ширину и содержало источник освещения низкой мощности (6 В). Большее из отделений имело 210 мм в ширину и не освещалось. Пол этого темного отделения представлял собой решетку из 16 прутьев из нержавеющей стали, имеющих диаметр 5 мм и расположенных на расстоянии 12,5 мм друг от друга. Генератор тока сообщал решетчатому полу ток 0,75 мА, который проходил каждые 0,5 с через 16 прутьев. Диапазон сопротивления 40-60 мкОм был рассчитан для контрольной группы крыс и аппарат был соответствующим образом откалиброван. Электронная схема, осуществляющая детекцию сопротивления животного, обеспечивала точную подачу тока путем автоматического изменения напряжения с изменением сопротивления. Этот эксперимент осуществляли, как было описано ранее (Fox et al., 1995). Использовали взрослых самцов крыс Wistar с массой тела 200-230 г. Животных приносили в лабораторию за 1 ч до эксперимента. В день обучения животных размещали так, чтобы они были обращены к задней стороне освещенного отделения аппарата. Таймер включали сразу после того, как животное полностью оборачивалось к передней стороне камеры. Латентность входа в темную камеру регистрировали (обычно 20 с), и когда животное полностью переходило в темное отделение, оно получало неизбежный шок в лапу 0,75 мА в течение 3 с. Животных затем возвращали в их клетки. В перерывах между периодами обучения оба отделения чистили для удаления каких-либо мешающих обонятельных подсказок. Ответную реакцию на этот ингибиторный стимул оценивали через 24, 72 ч и в день 7 после обучения, возвращая животное в светлое отделение и отмечая их латентность к входу в темное отделение, в качестве критерия использовали время 300 с. Некоторые соединения показали значительное увеличение латентности достижения темной зоны при 10 мг/кг оральной дозе. Ссылочная литература: (a) Callahan P.М., Ilch С.P., Rowe N.В., TehimA., Abst. 776, 19, 2004, Society for neuroscience, 2004. (b) Fox G.В., Connell A.W.U., Murphy K.J., Regan С.М., Journal of Neurochemistry, 1995, 65, 6, 2796-2799. Пример 54. Анализ связывания с рецептором 5-HT6 человека Nova screen. Фармакологические данные для соединений можно получить в соответствии со следующими процедурами испытаний. Материалы и методы. Источник рецептора: рекомбинантный рецептор человека, экспрессированный в клетках НЕК-293 Радиолиганд: [3H]LSD (60-80 Ки/ммоль) Конечная концентрация лиганда - [1,5 нМ] Неспецифическая детерминанта: Метиотепин мезилат - [0,1 мкМ] Ссылочное соединение: Метиотепин мезилат Положительный контроль: Метиотепин мезилат Условия инкубации: Реакции осуществляли в 50 мМ TRIS-HCl (рН 7,4), содержащем 10 мМ MgCl2,0,5 мМ EDTA, в течение 60 мин при 37 С. Реакцию останавливали путем быстрой вакуумной фильтрации на стекловолоконных фильтрах. Определяли радиоактивность, захваченную на фильтрах, и сравнивали с контрольными значениями для подтверждения какого-либо взаимодействия испытываемого соединения(ий) с клонированным серотонин - 5-HT6 участком связывания. Ссылочная литература: Monsma F.J.Jr., et al., Molecular Cloning and Expression of Novel Serotonin Receptor with High Affinity for Tricyclic Psychotropic Drugs. Mol. Pharmacol. (43): 320-327 (1993). Пример 55. Анализ циклического аденозинмонофосфата (сАМР). Антагонистические свойства соединений на рецепторах 5-HT6 человека определяли путем испытания их эффекта на аккумуляцию сАМР в стабильно трансфицированных клетках НЕК-293. Связывание агониста с рецептором 5-HT6 человека ведет к повышению аденилциклазной активности. Соединение,которое является агонистом, будет показывать повышение продукции сАМР, а соединение, которое является антагонистом, будет блокировать агонистический эффект. Рецепторы 5-HT6 человека клонировали и стабильно экспрессировали в клетках НЕК-293. Эти клетки высевали в 6-луночные планшеты в среду DMEM/F12 с 10% фетальной телячьей сывороткой(FCS) и 500 мкг/мл G418 и инкубировали при 37 С в CO2 инкубаторе. Клеткам давали расти до около 70% конфлюентности перед началом эксперимента. В день эксперимента культуральную среду удаляли и клетки промывали один раз бессывороточной средой (SFM). Добавляли 2 мл среды SFM+IBMX и инкубировали при 37 С в течение 10 мин. Среду удаляли и добавляли в соответствующие лунки свежую среду SFM+IBMX, содержащую различные соединения и 1 мкМ серотонина (в качестве антагониста), и инкубировали в течение 30 мин. После инкубации среду удаляли и клетки промывали один раз 1 мл PBS(забуференный фосфатом физиологический раствор). Каждую лунку обрабатывали 1 мл холодного 95% этанола и 5 мМ EDTA (2:1) при 4 С в течение 1 ч. Клетки затем соскребали и переносили в пробирки Эппендорфа. Пробирки центрифугировали в течение 5 мин при 4 С и супернатанты хранили при 4 С до использования их в анализе. Содержание сАМР определяли при помощи EIA (ферментного иммуноанализа) с использованием набора Amersham Biotrak cAMP EIA (Amersham RPN 225). Использовали процедуру, как описано для этого набора. Вкратце, сАМР определяли путем конкуренции между немеченным сАМР и определенно установленным количеством меченного пероксидазой сАМР за участки связывания на анти-сАМР антителе. Иммобилизацию антитела осуществляют на лунках микротитровального планшета из полистирола,предварительно покрытых вторым антителом. Реакцию начинают добавлением 50 мкл меченного пероксидазой сАМР к образцу (100 мкл), предварительно инкубированному с антисывороткой (100 мкл) в течение 2 ч при 4 С. После 1 ч инкубации при 4 С несвязанный лиганд отделяют с использованием простой процедуры промывки. Затем добавляют ферментный субстрат, триметилбензидин (1), и инкубируют при комнатной температуре в течение 60 мин. Реакцию останавливают добавлением 100 мкл раствора 1,0 М серной кислоты и полученный в результате цвет считывают при помощи спектрофотометра для микротитровальных планшетов при 450 нМ в течение 30 мин. В анализе функциональной аденилилциклазы было обнаружено, что некоторые из соединений по настоящему изобретению являются конкурентными антагонистами с хорошей селективностью по сравнению с некоторыми другими рецепторами, включая другие серотониновые рецепторы, такие как 5-HT1A и 5-HT7. или его стереоизомеры или фармацевтически приемлемая соль, гдеR1 представляет собой одно или несколько замещений на Ar и бензольном кольце, и R1 представляет собой водород, галоген, циано, (C1-C3)алкил, галоген(C1-C3)алкил, (C1-C3)алкокси или галоген(C1 С 3)алкокси;R представляет собой водород или (C1-С 3)алкил. 2. Соединение по п.1, где R1 представляет собой водород, галоген, циано, (C1-С 3)алкил, галоген(C1 С 3)алкил, (C1-С 3)алкокси или галоген(C1-C3)алкокси. 3. Соединение по п.1, выбранное из следующей группы:[6-бром-9-(2,3-дихлорбензолсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-3-ил]диметиламин; его стереоизомеров и фармацевтически приемлемых солей. 4. Способ получения соединения формулы (I) по п.1, включающий контактирование соединения формулы (а) с сульфоновым производным формулы (b) где X представляет галоген, а все другие символы имеют значения, указанные в п.1; в присутствии основания, выбранного из карбоната калия, карбоната натрия, гидрида натрия или гидрида калия, и инертного растворителя, выбранного из тетрагидрофурана, толуола, дихлорметана, ацетона, воды, диметилформамида или диметилсульфоксида, при температуре окружающей среды с получением соединения формулы (I). 5. Способ по п.4, необязательно включающий: 1) преобразование соединения формулы (I) в другое соединение формулы (I),2) удаление любых защитных групп или 3) образование фармацевтически приемлемой соли. 6. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и соединение формулы (I) по любому из пп.1-3. 7. Фармацевтическая композиция по п.6 для лечения клинических состояний, таких как тревожное расстройство, расстройство познавательной способности, нейродегенеративное расстройство, болезнь Альцгеймера, расстройство дефицита внимания, обсессивно-компульсивное расстройство, удар, травма головы, расстройство питания или ожирение. 8. Применение соединения по любому из пп.1-3 для получения лекарственного средства для лечения заболеваний, связанных с 5-HT6 рецептором.
МПК / Метки
МПК: A61K 31/403, C07D 209/88, A61P 25/00
Метки: качестве, 5-ht6, карбазола, производные, лигандов, функциональных
Код ссылки
<a href="https://eas.patents.su/22-14694-proizvodnye-karbazola-v-kachestve-funkcionalnyh-5-ht6-ligandov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные карбазола в качестве функциональных 5-ht6 лигандов</a>
Предыдущий патент: Терапевтически активные соединения
Следующий патент: Модулятор рецепторов глюкокортикостероидов и его применение
Случайный патент: Антитело к cd33 и способы его применения