Производные 12, 13-(пиранозил)индоло [2, 3-α] пирроло [3, 4-c]карбазола и 12, 13-(пиранозил)фуро [3, 4-c] индоло[2, 3-α]карбазола, способ их получения и фармацевтические композиции, содержащие их
Номер патента: 4737
Опубликовано: 26.08.2004
Авторы: Пьер Алан, Анизон Фабрис, Атасси Ганем, Ренар Пьер, Марминон Кристелль, Пфейффер Брюно, Прюдомм Мишель, Моро Паскаль
Формула / Реферат
1. Соединения формулы (I)
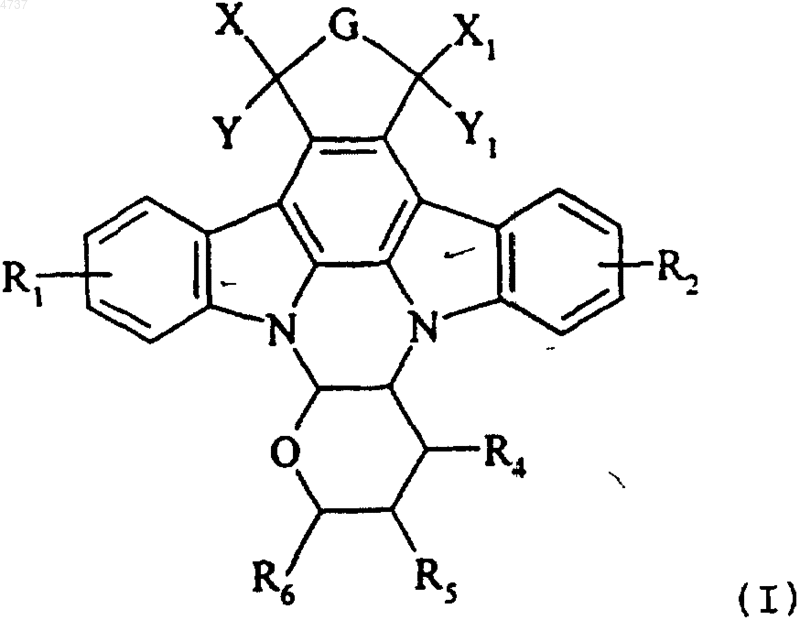
где R1 и R2, которые могут быть одинаковыми или различными, каждый независимо от другого представляет группу формулы U-V,
где U представляет одинарную связь или прямую или разветвленную (C1-C6)алкиленовую цепь, необязательно замещенную одной или несколькими гидроксигруппами,
V представляет группу, выбранную из атома водорода, атома галогена, нитрогруппы, прямой или разветвленной (C1-C6)алкильной группы, гидроксигруппы, формила, NRaRb, -C(O)-T1, -C(O)-NRa-T1, -C(O)-O-T1,
где Ra и Rb, которые могут быть одинаковыми или различными, каждый представляет группу, выбранную из атома водорода, прямой или разветвленной (C1-C6)алкильной группы,
T1 представляет группу, выбранную из прямого или разветвленного (C1-C6)алкила или прямой или разветвленной (C1-C6)алкиленовой цепи, замещенной группой, выбранной из -ORa, -NRaRb, где Ra и Rb являются такими, как определено выше,
G представляет атом кислорода или NR3 группу, где R3 представляет группу, выбранную из атома водорода, прямой или разветвленной (C1-C6)алкильной группы, -ORa группы, -NRaRb группы, -NH-C(O)-Ra группы и прямой или разветвленной (C1-C6)алкиленовой цепи, замещенной одной или более одинаковыми или различными группами, выбранными из -ORa и -NRaRb, причем группы Ra и Rb являются такими, как определено выше,
X представляет собой атом водорода,
Y представляет собой атом водорода или
X и Y вместе с атомом углерода, с которыми они соединены, образуют карбонильную группу,
X1 представляет собой атом водорода,
Y1 представляет собой атом водорода или
X1 и Y1 вместе с атомом углерода, с которым они соединены, образуют карбонильную группу,
R4 представляет группу, выбранную из гидроксигруппы и -O-C(O)-Rc группы, где Rc представляет прямую или разветвленную (C1-C6)алкильную группу (необязательно замещенную одной или более группами, выбранными из галогена и амино),
R5 представляет прямую (C1-C6)алкоксигруппу,
R6 представляет группу формулы U1-R'4, где U1 представляет одинарную связь или метиленовую группу и R'4 имеет такие же значения, как и R4, или представляет собой группу, выбранную из атома галогена, азидогруппы или NRaRb группы, где Ra и Rb имеют значения, определенные выше,
или R4, R5 и R6, взятые попарно в смежных или несмежных положениях, образуют с атомами углерода, несущими их, кольцевую систему, имеющую от 3 до 6 членов в кольце, содержащую один или два атома кислорода, причем оставшаяся группа R4, R5 или R6 имеет значение R5, приведенное выше,
их изомеры и соли их присоединения с фармацевтически приемлемыми кислотой или основанием, при условии, что из соединений формулы (I) исключаются нижеследующие соединения:
1,11-дихлоро-12,13-[1,2-(4-O-метил-b-D-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-дион,
12,13-[1,2-(4-O-метил-b-D-маннопирано-зил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-дион,
12,13-[1,2-(4-O-метил-b-D-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-a]пирроло[3,4-c]карбазол-5-он и
12,13-[1,2-(4-O-метил-b-D-маннопиранозил)]-5,6,12,13-тетрагидро-(7H)-индоло[2,3-a]пирроло[3,4-c]карбазол-7-он.
2. Соединения формулы (I) по п.1, отличающиеся тем, что G представляет NR3 группу, где R3 такой, как определен для формулы (I), их изомеры и соли присоединения их с фармацевтически приемлемыми кислотой или основанием.
3. Соединения формулы (I) по п.1, отличающиеся тем, что X и Y вместе с углеродным атомом, несущим их, образуют карбонильную группу и X1 и Y1 вместе с углеродным атомом, несущим их, образуют карбонильную группу, их изомеры и соли их присоединения с фармацевтически приемлемыми кислотой или основанием.
4. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют соединения формулы (I бис)
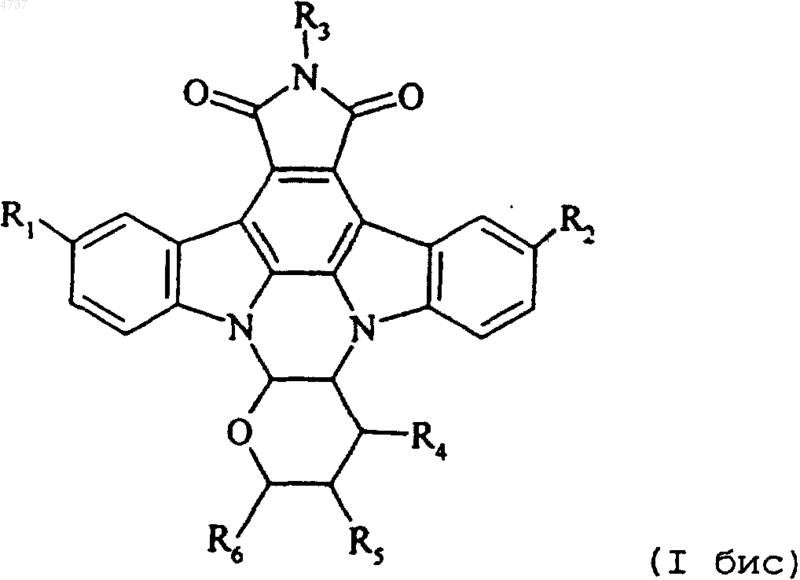
где R1, R2, R3, R4, R5 и R6 такие, как определено для формулы (I), их изомеры и соли их присоединения с фармацевтически приемлемыми кислотой или основанием.
5. Соединения формулы (I) по п.1 или 4, отличающиеся тем, что R1 и R2, которые могут быть одинаковыми или различными, представляют собой группу формулы U-V, где U представляет одинарную связь и V представляет группу, выбранную из атома галогена, атома водорода, нитрогруппы, формила и гидроксигруппы, их изомеры и соли присоединения их с фармацевтически приемлемыми кислотой или основанием.
6. Соединения формулы (I) по п.1 или 4, отличающиеся тем, что R1 и R2, являются одинаковыми, их изомеры и соли их присоединения с фармацевтически приемлемыми кислотой или основанием.
7. Соединения формулы (I) по п.1 или 4, отличающиеся тем, что R3 представляет атом водорода, гидроксигруппу или прямую или разветвленную (C1-C6)алкиленовую цепь, замещенную группой, выбранной из NRaRb и ORa, где Ra и Rb такие, как определено для формулы (I), их изомеры и соли присоединения их с фармацевтически приемлемыми кислотой или основанием.
8. Соединения формулы (I) по п.1 или 4, отличающиеся тем, что представляет соединения формулы (Iter)
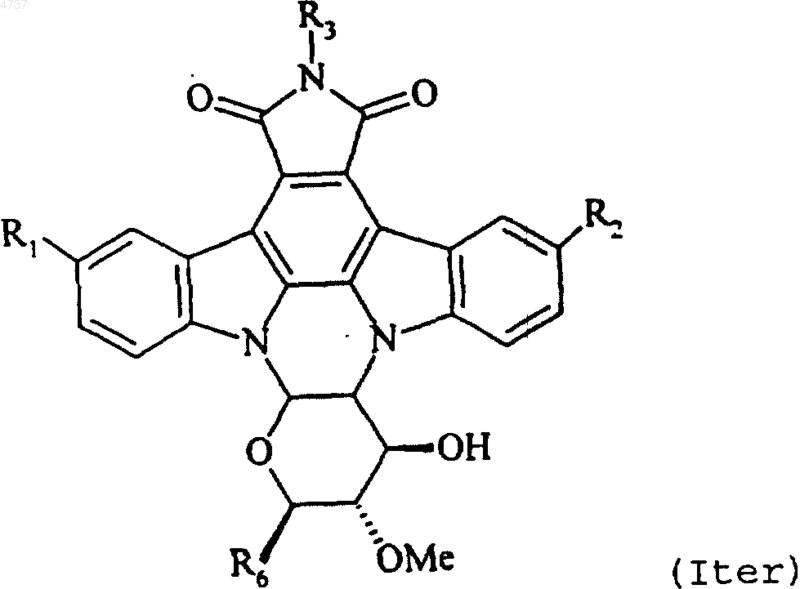
где R1, R2, R3 и R6 такие, как определено для формулы (I), их изомеры и соли присоединения их с фармацевтически приемлемыми кислотой или основанием.
9. Соединения формулы (I) по п.1, которые представляют собой
3,9-диформил-12,13-[1,2-(4-O-метил-b-D-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-дион,
3,9-динитро-12,13-[1,2-(4-O-метил-b-D-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-дион,
3-нитро-12,13-[1,2-(4-O-метил-b-D-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-дион,
9-нитро-12,13-[1,2-(4-O-метил-b-D-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-дион,
6-гидрокси-12,13-[1,2-(4-O-метил-b-D-маннопиранозил)]-6,7,1-2,13-тетрагидро-(5H)-индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-дион,
3,9-ди(гидроксиметил)-12,13-[1,2-(4-O-метил-b-D-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-a]пирроло[3,4-c] карбазол-5,7-дион,
3,9-динитро-12,13-[1,2-(3,6-ангидро-4-O-метил-b-D-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-a]пирроло[3,4-c] карбазол-5,7-дион,
3,9-дигидро-12,13-[1,2-(4-O-метил-b-D-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-дион,
3,9-дибромо-12,13-[1,2-(4-O-метил-b-D-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-дион и
6-диэтиламиноэтил-12,13-[1,2-(4-O-метил-b-D-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-дион и его гидрохлорид,
их изомеры, и соли присоединения их с фармацевтически приемлемыми кислотой или основанием.
10. Способ получения соединений формулы (I), отличающийся тем, что в качестве исходного вещества используют соединение формулы (II)
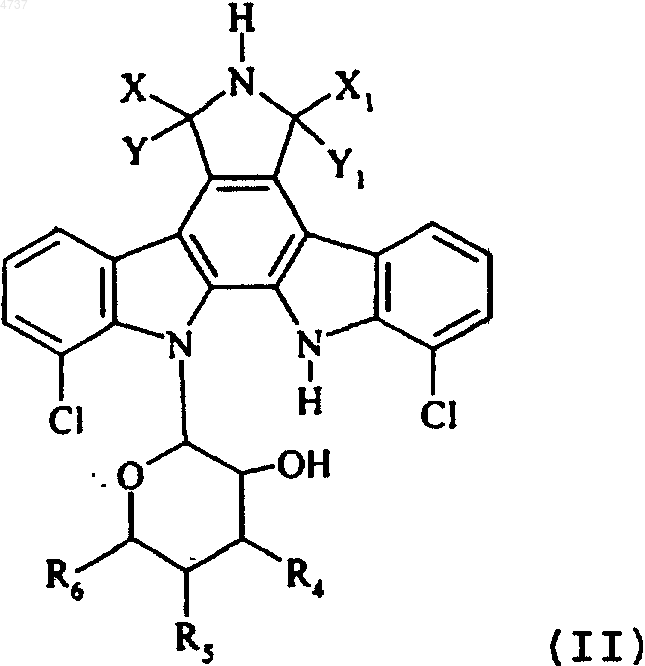
где X, Y, X1, Y1, R4, R5 и R6 такие, как определено для формулы (I), которое обрабатывают в основной среде паратолуолсульфоновой кислотой, получая соединение формулы (III)
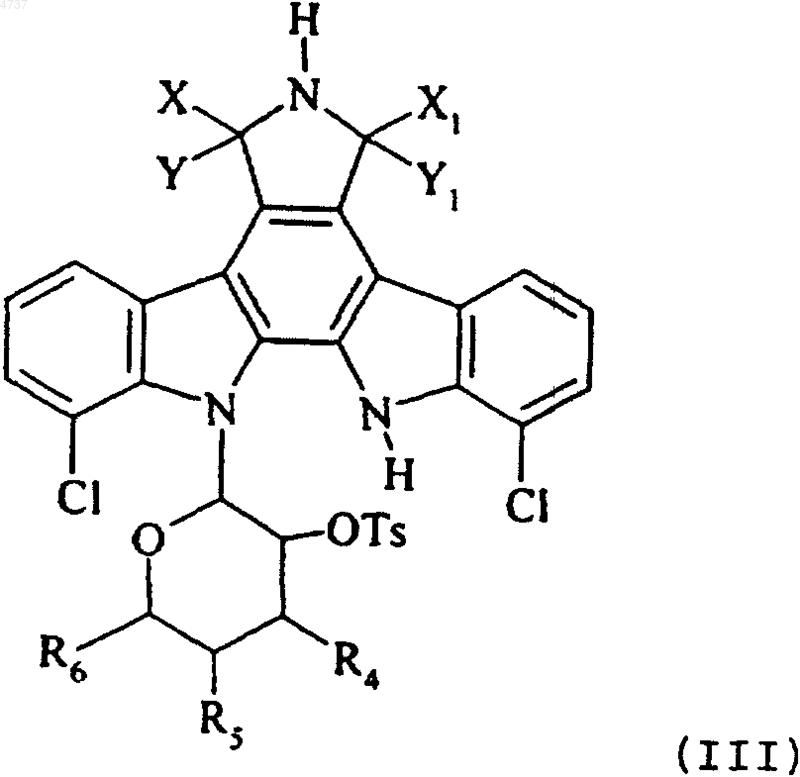
где X, Y, X1, Y1, R4, R5 и R6 такие, как определено выше, и это соединение формулы (III) подвергают взаимодействию с азидом натрия, получая, главным образом, соединение формулы (I/a), отдельного представителя соединений формулы (I)
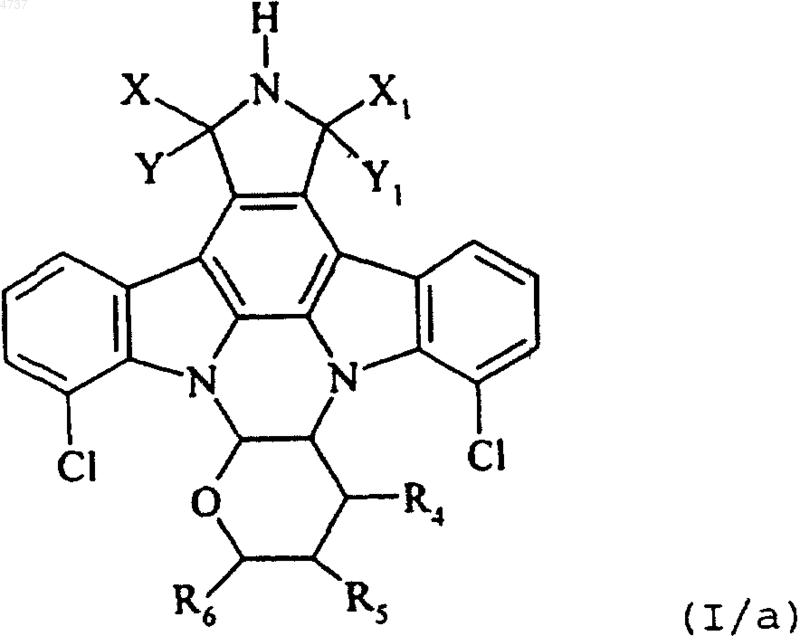
где X, Y, X1, Y1, R4, R5 и R6 такие, как определено выше, и это соединение формулы (I/a) подвергают действию условий гидрогенолиза, получая соединение формулы (I/b), отдельного представителя соединений формулы (I)
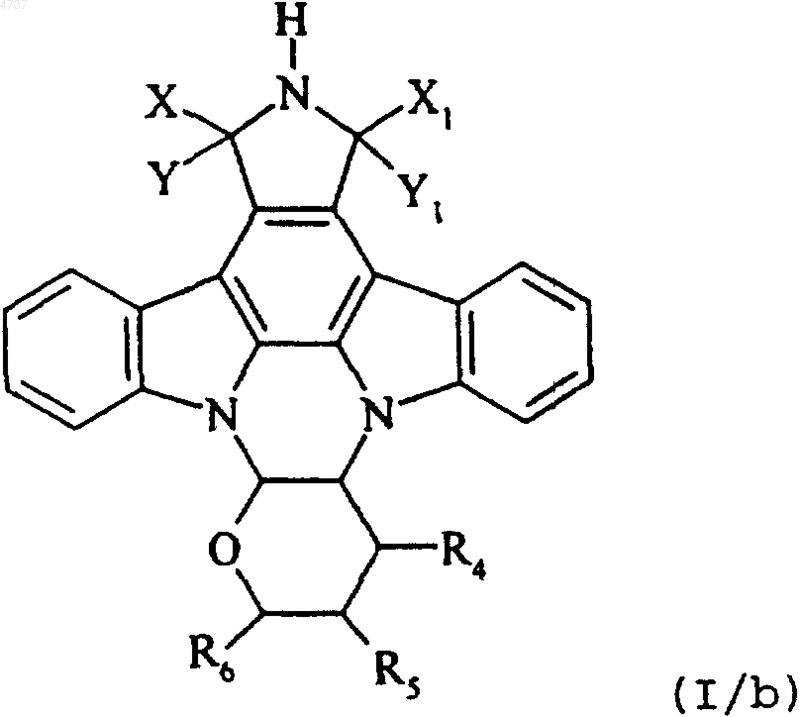
где X, Y, X1, Y1, R4, R5 и R6 такие, как определено выше, и это соединение формулы (I/b) обрабатывают водным раствором гидроксида натрия и затем обрабатывают хлористо-водородной кислотой, получая соединение формулы (I/c), отдельного представителя соединений формулы (I)
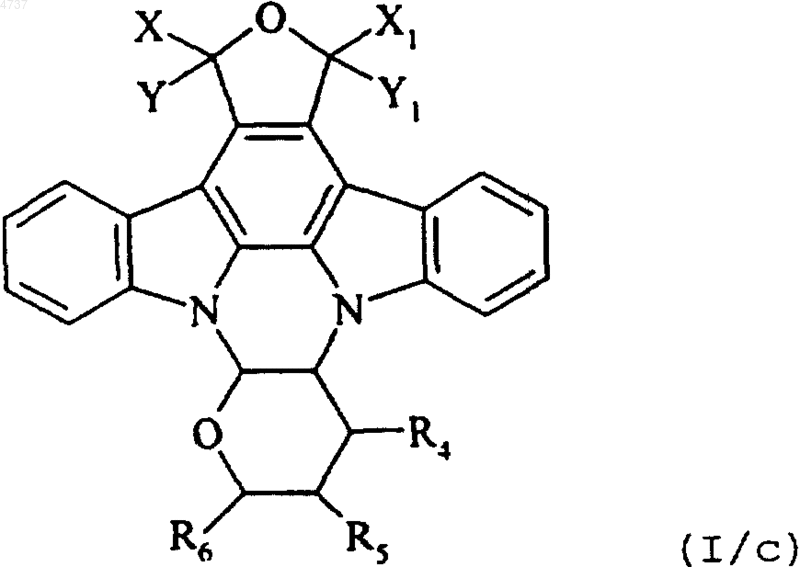
где X, Y, X1, Y1, R4, R5 и R6 такие, как определено выше, и это соединение формулы (I/c) подвергают действию соединения формулы (IV)
R3aNH2 (IV),
где R3a имеет те же определения, как R3, исключая атом водорода, получая соединение формулы (I/d), отдельного представителя соединений формулы (I)
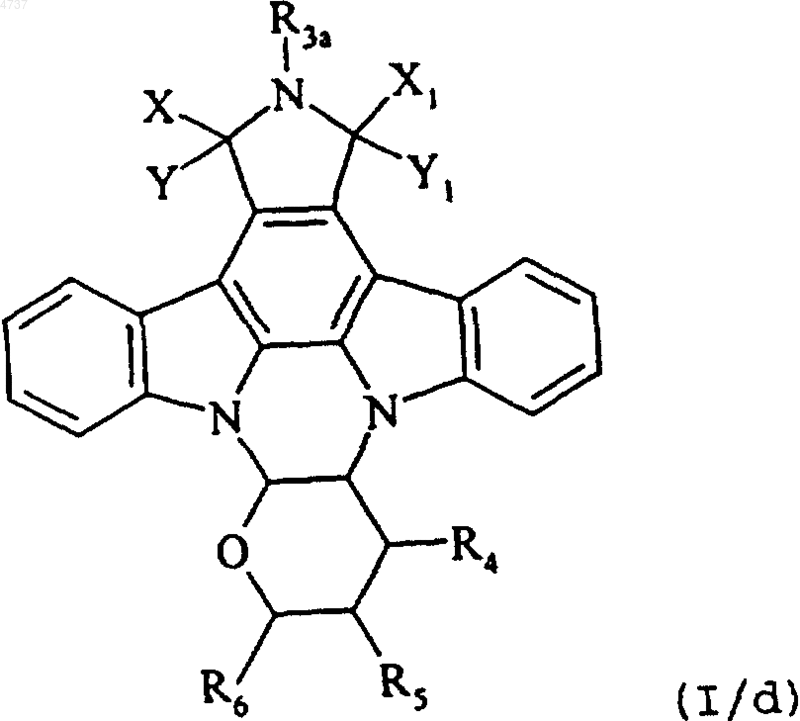
где X, Y, X1, Y1, R3a, R4, R5 и R6 такие, как определено выше, причем совокупность соединений формул от (I/b) до (I/d) составляют соединения формулы (I/e)
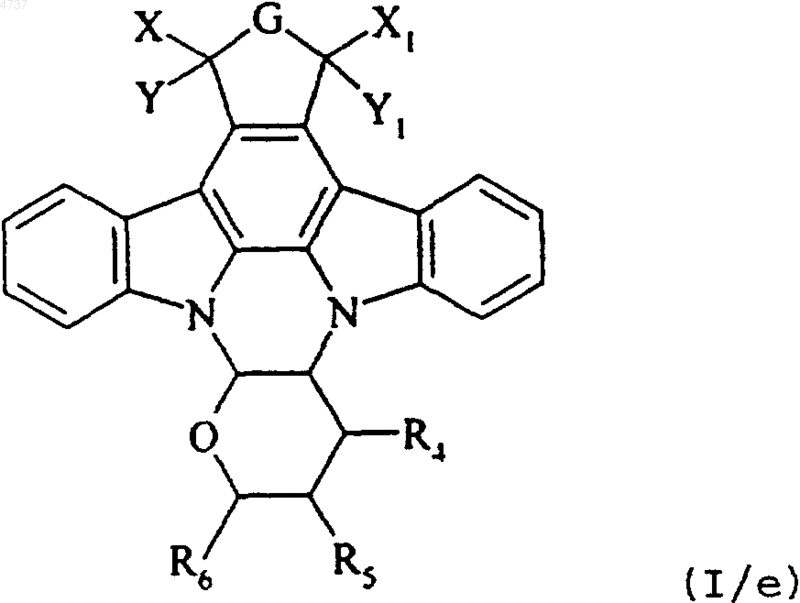
где G, X, Y, X1, Y1, R4, R5 и R6 такие, как определено для формулы (I), и это соединение формулы (I/e) подвергают реакции электрофильного ароматического присоединения или реакции нуклеофильного ароматического присоединения, в соответствии со стандартными условиями органического синтеза, известными специалисту в данной области техники, получая соединение формулы (I/f), отдельного представителя соединений формулы (I)
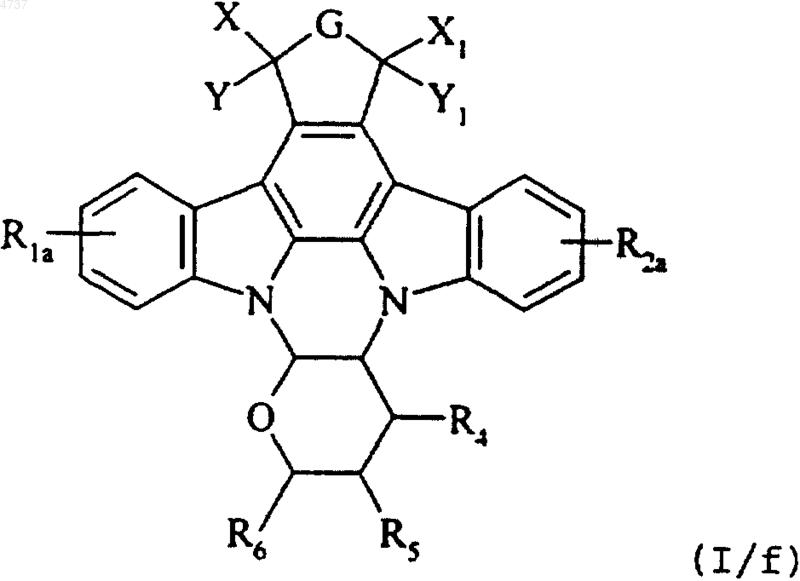
где G, X, Y, X1, Y1, R4, R5 и R6 такие, как определено выше, и R1a и R2a имеют те же определения, как R1 и R2 соответственно, за исключением того, что R1a и R2a не могут одновременно представлять атом водорода, и все соединения формул с (I/a) по (I/f) составляют в целом соединения формулы (I), которые очищают, если необходимо, в соответствии с обычной техникой очистки, которые могут быть при желании разделены на принадлежащие им различные изомеры в соответствии со стандартной техникой разделения, заместители R4, R5 и R6 которых регулируются согласно обычным способам органического синтеза, используемым в области химии сахаров, и которые превращают при желании в соли присоединения с фармацевтически приемлемыми кислотой или основанием.
11. Фармацевтическая композиция, включающая в качестве активного ингредиента по крайней мере одно соединение формулы (I) по любому из пп.1-9 само по себе или в комбинации с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми наполнителями или носителями.
12. Фармацевтическая композиция по п.11, обладающая противоопухолевой активностью.
Текст
1 Настоящее изобретение относится к новым соединениям 12,13-(пиранозил)индоло[2,3-] пирроло[3,4-с]карбазола и 12,13-(пиранозил) фуро[3,4-с]индоло[2,3-]карбазола, способу их получения и фармацевтическим композициям,содержащим их. Потребности противораковой терапии требуют постоянного развития в области разработки новых цитотоксических средств с целью получения лекарственных средств, которые были бы как более активными так и лучше переносимыми (более толерантными). Соединения настоящего изобретения обладают, например,противоопухолевыми свойствами, что делает их полезными для лечения злокачественных опухолей. С целью улучшения противоопухолевого потенциала были внесены различные химические изменения в структуру ребеккамицина или стауроспорина. Например, можно указать на описания патентов WO 98/07433, WO 99/02532 и ЕР 602597, в которых заявляются соединения ребеккамицина, включающие структурные изменения в озидной части молекулы и в заместителях, присутствующих в гексациклической системе. В статье, опубликованной в Bioorganicand Medicinal Chemistry 1998, 6, 1597-1604 также описываются такие соединения, имеющие хорошо выраженную цитотоксическую активность. Помимо того факта, что соединения данного изобретения являются новыми, они обладают удивительной in vitro и in vivo активностью, которая превосходит до сих пор наблюдаемую активность. В соответствии с этим соединения, раскрываемые заявителем, имеют противоопухолевые свойства, которые делают их особенно полезными в лечении злокачественных опухолей. Настоящее изобретение относится к соединениям формулы (I) где R1 и R2, которые могут быть одинаковыми или различными, каждый независимо от другого представляет группу формулы U-V,где U представляет одинарную связь или прямую или разветвленную (С 1-С 6)алкиленовую цепь, необязательно замещенную одной или несколькими гидроксигруппами,V представляет группу, выбранную из атома водорода, атома галогена, нитрогруппы,прямой или разветвленной (С 1-С 6)алкильной 2 группы, гидроксигруппы, формила, NRaRb,-C(O)-T1, -C(O)-NRa-T1, -C(O)-O-T1,где Ra и Rb, которые могут быть одинаковыми или различными, каждый представляет группу, выбранную из атома водорода, прямой или разветвленной (С 1-С 6)алкильной группы,Т 1 представляет группу, выбранную из прямого или разветвленного (С 1-С 6)алкила или прямой или разветвленной (С 1-С 6)алкиленовой цепи, замещенной группой, выбранной из -ORa,-NRaRb, где Ra и Rb являются такими, как определено выше,G представляет атом кислорода или NR3 группу, где R3 представляет группу, выбранную из атома водорода, прямой или разветвленной(C1-С 6)алкильной группы, -ORa группы, -NRaRb группы, -NH-C(O)-Ra группы и прямой или разветвленной (С 1-С 6)алкиленовой цепи, замещенной одной или более одинаковыми или различными группами, выбранными из -ORa и-NRaRb, причем группы Ra и Rb являются такими, как определено выше,Х представляет собой атом водорода,Y представляет собой атом водорода, или Х и Y вместе с атомом углерода, с которыми они соединены, образуют карбонильную группу,Х 1 представляет собой атом водорода,Y1 представляет собой атом водорода, или Х 1 и Y1 вместе с атомом углерода, с которым они соединены, образуют карбонильную группу,R4 представляет группу, выбранную из гидроксигруппы и -O-C(O)-Rc группы, где Rc представляет прямую или разветвленную (С 1 С 6)алкильную группу (необязательно замещенную одной или более группами, выбранными из галогена и амино),R5 представляет прямую (С 1-С 6)алкоксигруппу,R6 представляет группу формулы U1-R'4,где U1 представляет одинарную связь или метиленовую группу, и R'4 имеет такие же значения,как и R4, или представляет собой группу, выбранную из атома галогена, азидогруппы илиNRaRb группы, где Ra и Rb имеют значения, определенные выше,или R4, R5 и R6, взятые попарно в смежных или несмежных положениях, образуют с атомами углерода, несущими их, кольцевую систему,имеющую от 3 до 6 членов в кольце, содержащую один или два атома кислорода, причем оставшаяся группа R4, R5 или R6 имеет значениеR5, приведенное выше,их изомеры, и соли их присоединения с фармацевтически приемлемыми кислотой или основанием,при условии, что из соединений формулы 12,13-[1,2-(4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-а] пирроло[3,4-с]карбазол-5,7-дион,12,13-[1,2-(4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-а] пирроло[3,4-с]карбазол-5-он, и 12,13-[1,2-(4-O-метилD-маннопиранозил)]-5,6,12,13-тетрагидро-(7 Н)-индоло[2,3-а] пирроло[3,4-с]карбазол-7-он. Среди фармацевтически приемлемых кислот могут быть упомянуты в качестве неорганического примера хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, фосфоновая кислота, уксусная кислота,трифторуксусная кислота, молочная кислота,пировиноградная кислота, малоновая кислота,янтарная кислота, глутаровая кислота, фумаровая кислота, винная кислота, малеиновая кислота, лимонная кислота, аскорбиновая кислота,щавелевая кислота, метансульфоновая кислота,камфорная кислота и так далее. Среди фармацевтически приемлемых оснований могут быть упомянуты в качестве неограничивающего примера гидроксид натрия,гидроксид калия, триэтиламин, трет-бутиламин и т.д. Преимущественно,предпочтительной группой G в соответствии с данным изобретением является группа NR3, где R3 такой, как определено для формулы (I). Согласно преимущественному варианту воплощения данного изобретения, предпочтительными соединениями являются соединения,где Х и Y вместе с атомом углерода, к которому они присоединены, образуют карбонильную группу, и X1 и Y1 вместе с атомом углерода, к которому они присоединены, образуют карбонильную группу. Согласно другому преимущественному варианту воплощения изобретения, предпочтительные соединения данного изобретения представляют собой соединения формулы (I бис) где R1, R2, R3, R4, R5 и R6 такие, как определено для формулы (I). Предпочтительно заместители R1 и R2, которые, в соответствии с изобретением, могут быть одинаковыми или различными, представляют собой группу формулы U-V, где U представляет одинарную связь и V представляет группу, выбранную из атома галогена, атома водорода, нитрогруппы, формилгруппы, гидро 004737 4 ксигруппы, и прямой или разветвленной (C1C6)алкиленовой цепи, замещенной гидроксигруппой. Особенно предпочтительно, когда заместители R1 и R2 являются одинаковыми. Предпочтительными заместителями R3 в соответствии с изобретением являются атом водорода, гидроксигруппа и прямая или разветвленная (C1-C6)алкиленовая цепь, замещенная группой, выбранной из NRaRb и ORa, гдеRa и Rb такие, как определено для формулы (I). В соответствии с последним особенно преимущественным вариантом воплощения изобретения, предпочтительные соединения изобретения представляют соединения формулы где R1, R2, R3, и R6 такие, как определено для формулы (I). Предпочтительные соединения в соответствии с изобретением представляют собой 3,9-диформил-12,13-[1,2-(4-О-метилDманнопиранозил)]-6,7,12,13-тетрагидро-(5 Н)индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион,3,9-динитро-12,13-[1,2-(4-О-метилDманнопиранозил)]-6,7,12,13-тетрагидро-(5H)индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион,3-нитро-12,13-[1,2-(4-О-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло 5 6-диэтиламиноэтил-12,13-[1,2-(4-O-метил-D-маннопиранозил)]-6,7,12,13-тетрагидро(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7 дион и его гидрохлорид. Изомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием предпочтительных соединений данного изобретения составляют неотъемлемую часть изобретения. Кроме того, настоящее изобретение относится к способу получения соединений формулы (I), отличающемуся тем, что в качестве исходного вещества используют соединение формулы (II) где X, Y, X1, Y1, R4, R5 и R6 такие, как определено для формулы (I), которое обрабатывают в основной среде паратолуолсульфоновой кислотой, получая соединение формулы (III) где X, Y, X1, Y1, R4, R5 и R6 такие, как определено выше, и это соединение формулы (III) подвергают взаимодействию с азидом натрия, получая, главным образом, соединение формулы(I/a), отдельного представителя соединений формулы (I) где X, Y, X1, Y1, R4, R5 и R6 такие, как определено выше, и это соединение формулы (I/a) подвергают действию условий гидрогенолиза, получая соединение формулы (I/b), отдельного представителя соединений формулы (I) где X, Y, X1, Y1, R4, R5 и R6 такие, как определено выше, и это соединение формулы (I/b) обрабатывают водным раствором гидроксида натрия и затем обрабатывают хлористо-водородной кислотой, получая соединение формулы (I/с),отдельного представителя соединений формулы где X, Y, X1, Y1, R4, R5 и R6 такие, как определено выше, и это соединение формулы (I/с) подвергают действию соединения формулы (IV)(IV) где R3a имеет те же определения, как R3, исключая атом водорода, получая соединение формулы (I/d), отдельного представителя соединений формулы (I) где X, Y, X1, Y1, R3a, R4, R5 и R6 такие, как определено выше, причем все соединения формул от где G, X, Y, X1, Y1, R4, R5 и R6 такие, как определено для формулы (I), и это соединение формулы (I/е) подвергают реакции электрофильного ароматического присоединения или реакции 7 нуклеофильного ароматического присоединения, в соответствии со стандартными условиями органического синтеза, известными специалисту в данной области техники, получая соединение формулы (I/f), отдельного представителя соединений формулы (I) где G, X, Y, X1, Y1, R4, R5 и R6 такие, как определено выше, и R1a и R2a имеют те же определения, как R1 и R2, соответственно, за исключением того, что R1a и R2a не могут одновременно представлять атом водорода, и все соединения формул с (I/a) по (I/f) составляют в целом соединения формулы (I), которые очищают, если необходимо, в соответствии с обычной техникой очистки, которые могут быть, при желании,разделены на принадлежащие им различные изомеры в соответствии со стандартной техникой разделения, заместители R4, R5 и R6 которых регулируются согласно обычным способам органического синтеза, используемым в области химии сахаров, и которые превращают, при желании, в соли их присоединения с фармацевтически приемлемой кислотой или основанием. Соединения формул (II) и (IV) представляют собой либо коммерческие соединения,либо их получают согласно стандартным способам органического синтеза, легко доступным специалисту в данной области техники. Соединения формулы (I) обладают особенно полезными (ценными) противоопухолевыми свойствами. Они проявляют четко выраженную (превосходную) in vitro цитотоксичность на клеточных линиях и оказывают действие на клеточный цикл. Характерные свойства этих соединений дают возможность использовать их терапевтически в качестве противоопухолевых средств. Кроме того, настоящее изобретение относится к фармацевтическим композициям, включающим в качестве активного ингредиента по крайней мере одно соединение (I), его оптический изомер, или соль его присоединения с фармацевтически приемлемыми кислотой или основанием, само по себе или в комбинации с одним или несколькими инертными, фармацевтически приемлемыми наполнителями или носителями. Среди фармацевтических композиций в соответствии с изобретением можно упомянуть особенно те, которые пригодны для перорального, парентерального (внутривенного, внутримышечного или подкожного) применения, вве 004737 8 дения пер- или транскожно (чрескожно), назально, ректально, подъязычно, в глаза или респираторным путем, и особенно в виде таблеток или драже, подъязычных таблеток, желатиновых капсул, капсул, суппозиториев, кремов, мазей, гелей для кожи, инъецируемых препаратов или препаратов, годных для питья, аэрозолей,глазных капель или капель для носа, и т.д. Таким образом, благодаря характерным фармакологическим свойствам соединений формулы (I), фармацевтические композиции,включающие указанные соединения формулы(I) в качестве активного ингредиента, являются особенно полезными для лечения злокачественных опухолей. Используемая доза варьируется в зависимости от возраста и веса пациента, маршрута введения, природы и тяжести расстройства (заболевания), и от того, проводятся ли какие-либо ассоциированные лечения, и она составляет от 0,5 мг до 500 мг в один или несколько приемов в день. Нижеследующие примеры иллюстрируют данное изобретение, но никоим образом не ограничивают его. Используемые исходные вещества являются известными продуктами или их получают согласно известным способам. Структуры соединений, описываемых в примерах, определяют, используя обычные спектрофотометрические техники (инфракрасная спектроскопия, спектроскопия ядерного магнитного резонанса, масс-спектрометрия, и т.д.). Пример 1. 1,11-Дихлор-12,13-[1,2-(4-ОметилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. Стадия 1. 1,11-Дихлор-12-[4-O-метил-2-ОтозилD-глюкопиранозил]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол 5,7-дион. 1 эквивалент карбоната калия и 1 эквивалент тозилхлорида добавляют в раствор 1,7 ммоль ребеккамицина в 200 мл тетрагидрофурана. После 48-часового кипячения с обратным холодильником и концентрирования при пониженном давлении хроматография остатка на силикагеле (циклогексан/этилацетат:70/30) позволяет выделить требуемый продукт. Температура плавления 168-170 С. Стадия 2. 1,11-Дихлор-12,13-[1,2-(4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол 5,7-дион. 10 эквивалентов азида натрия добавляют в раствор 0,62 ммоль соединения, полученного на стадии 1, в 16 мл диметилформамида. Спустя 6 ч при 70 С и последующего охлаждения реакционную смесь гидролизуют и экстрагируют этилацетатом. Затем органическую фазу промывают, сушат, фильтруют и затем концентрируют 9 при пониженном давлении. Хроматография на силикагеле (этилацетат/дихлорметан: 10/90) позволяет выделить требуемый продукт. Температура плавления 296-298 С. Масс-спектр (ББА+): м/з рассчитано=551,0650 [М]+; м/з найдено =551,0647 [М]+. Пример 2. 12,13-[1,2-(4-O-МетилDманнопиранозил)-6,7,12,13-тетрагидро-(5H)индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. Смесь 0,855 ммоль соединения примера 1,0,57 г 5% Pd/C и 0,57 г формиата аммония в 200 мл метанола перемешивают при комнатной температуре в течение 48 ч и затем фильтруют через целит. После концентрирования фильтрата при пониженном давлении хроматография на силикагеле (циклогексан/этилацетат:40/60) позволяет выделить ожидаемый продукт. Температура плавления 284-286 С. Масс-спектр (ББА+): м/з рассчитано[2,3-]карбазол-5,7-дион. Раствор 0,414 ммоль соединения примера 2, 420 мг гидроксида натрия и 70 мл воды кипятят с обратным холодильником в течение 3 ч. Затем смесь разбавляют, подкисляют 1N водным раствором хлористо-водородной кислоты и экстрагируют этилацетатом. Органическую фазу промывают, сушат, фильтруют и затем концентрируют при пониженном давлении. Хроматография на силикагеле (этилацетат/циклогексан:70/30) позволяет выделить ожидаемый продукт. Температура плавления 300 С. Масс-спектр (ББА+): м/з рассчитано[М+Н]+. Пример 4. 6-Метил-12,13-[1,2-(4-О-метил-D-маннопиранозил)]-6,7,12,13-тетрагидро(5H)-индоло [2,3-]пирроло[3,4-с]карбазол-5,7 дион. 0,118 ммоль соединения примера 3 и 2 М раствор метиламина в 14 мл тетрагидрофурана перемешивают при 70 С в течение 16 ч. После охлаждения реакционную смесь гидролизуют,вызывая образование осадка, который очищают с помощью хроматографии на силикагеле (этилацетат/циклогексан:80/20), позволяя выделить ожидаемый продукт. Температура плавления 300 С. Масс-спектр (ББА+): м/з рассчитано=497,1587 (М)+; м/з найдено =497,1591 (М)+. Пример 5. 6-Гидрокси-12,13-[1,2-(4-О-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-]пирроло[3,4-с]карбазол 5,7-дион. 14,4 ммоль гидрохлорида гидроксиламина и 14,4 ммоль триэтиламина добавляют в раствор 0,207 ммоль соединения примера 3 в 5 мл диме 004737IN водный раствор хлористо-водородной кислоты, этилацетат и тетрагидрофуран. Затем органическую фазу промывают, сушат, фильтруют и затем концентрируют при пониженном давлении. Хроматография на силикагеле (тетрагидрофуран/метанол:95/5) позволяет выделить ожидаемый продукт. Температура плавления 260 С (разложение). Пример 6. 3,9-Диформил-12,13-[1,2-(3,6 ди-O-ацетил-4-O-метилD-маннопиранозил)]6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-]пирроло-[3,4-с] карбазол-5,7-дион. 0,2 мл уксусного ангидрида добавляют в охлажденный до 0 С раствор 0,207 ммоль соединения примера 2 в 2 мл пиридина. Затем реакционную смесь перемешивают при комнатной температуре в течение 18 ч. После гидролиза и экстракции этилацетатом органическую фазу промывают, сушат, фильтруют и затем выпаривают. Затем полученный остаток разбавляют в 4 мл дихлорметана, и добавляют 4,2 ммоль дихлорметил метилового эфира. После охлаждения до 0 С, добавляют 4,2 мл 1 М раствора TiCl4 в дихлорметане. Затем реакционную смесь перемешивают в течение 24 ч при комнатной температуре и затем гидролизуют и экстрагируют этилацетатом. Органическую фазу сушат,фильтруют и затем выпаривают. Хроматография остатка на силикагеле (циклогексан/этилацетат:1/1) позволяет выделить ожидаемый продукт. Инфракрасный спектр (KBr): c=o= 1690,1720 и 1755 см-1; NH,OH = 3100-3600 см-1. Температура плавления 200 С. Пример 7. 3,9-Диформил-12,13-[1,2-(4-ОметилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. 5 мл 28% водного раствора гидроксида аммония добавляют в раствор 0,074 ммоль соединения примера 6 в 10 мл тетрагидрофурана и 5 мл метанола. После 30-часовой реакции при 25 С, смесь концентрируют. Остаток поглощают дихлорметаном и промывают водой. Органическую фазу выпаривают и полученный остаток промывают ацетоном, давая возможность выделиться ожидаемому продукту. Температура плавления 300 С. Инфракрасный спектр (KBr): c=o= 1680,1710 и 1750 см-1; NH,OH = 3100-3650 см-1. Пример 8. 3,9-Ди(гидроксиметил)-12,13[1,2-(3,6-ди-О-ацетил-4-О-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. Раствор 0,116 ммоль соединения примера 6, 60 мл метанола и 101 мг никеля Ренея гидрируют при 25 С в течение 2 дней, и затем добавляют 0,591 г никеля Ренея (50%, по весу, в воде) и гидрирование поддерживают в течение 5 дней. 11 Затем реакционную смесь фильтруют через целит. После концентрирования фильтрата при пониженном давлении, хроматография на силикагеле (этилацетат/циклогексан:90/10) позволяет выделить ожидаемый продукт. Температура плавления 180 С (разложение). Инфракрасный спектр (KBr): c=o= 1720,1750 см-1; NH,OH = 3150-3650 см-1. Пример 9. 3,9-Ди-(гидроксиметил)-12,13[1,2-(4-О-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с] карбазол-5,7-дион. Методика аналогична примеру 7, используя соединение примера 8 в качестве субстрата. Температура плавления 300 С. Инфракрасный спектр (KBr): c=o= 1710,1750 см-1; NH,OH = 3100-3600 см-1. Пример 10. 12,13-[1,2-(6-Хлоро-6-дезокси 4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. 4 эквивалента РРh3 и 2 эквивалента ССl4 добавляют в раствор 0,447 ммоль соединения примера 2 в 2 мл пиридина. После 3 ч перемешивания при 25 С, реакционную смесь выливают в 1N водный раствор хлористо-водородной кислоты и затем экстрагируют этилацетатом. Органическую фазу промывают, сушат, фильтруют и затем концентрируют при пониженном давлении. Хроматография на силикагеле позволяет выделить ожидаемый продукт. Температура плавления 280 С (разложение). Инфракрасный спектр (KBr): c=o= 1710,1750 см-1; NH,OH = 3150-3600 см-1. Пример 11. 12,13-[1,2-(3,6-Ангидро-4-OметилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. Продукт выделяют во время хроматографии, осуществляемой в примере 10. Температура плавления 300 С. Инфракрасный спектр (KBr): c=о= 1720,1750 см-1; NH,OH = 3100-3600 см-1. Пример 12. 12,13-[1,2-(6-Азидо-6-дезокси 4-O-метилD-маннопиранозил)]-6,7,12,13 тетрагидро-(5 Н)-индоло[2,3-]пирроло[3,4-с] карбазол-5,7-дион. Раствор 0,1 ммоль соединения примера 10 в 1 мл диметилформамида и 10 эквивалентов азида натрия перемешивают при 80 С. После 48 ч реакционную смесь поглощают этилацетатом и промывают водой. Органическую фазу сушат,фильтруют и выпаривают. Хроматография на силикагеле (дихлорметан/этилацетат:95/5) позволяет выделить ожидаемый продукт. Температура плавления 250 С (разложение). 12 Инфракрасный спектр (KВr): c=o= 1700,1750 см-1; N=N = 2100 см-1; NH,OH = 3150-3600 см-1. Пример 13. 3,9-Динитро-12,13-[1,2-(4-OметилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. 10 эквивалентов уксусного ангидрида добавляют при 0 С в раствор 0,5 ммоль соединения примера 2 в 4,8 мл пиридина. После проведения реакции в течение 1 дня при 25 С реакционную смесь гидролизуют и затем экстрагируют этилацетатом. Затем органическую фазу промывают, сушат, фильтруют и выпаривают. Полученный остаток разбавляют в 10 мл тетрагидрофурана и добавляют 5,6 мл дымящей азотной кислоты. После 5 дней при 40 С, добавляют 2,8 мл дымящей азотной кислоты и затем смесь выдерживают при 40 С в течение 30 ч, и затем гидролизуют. После экстракции этилацетатом,органическую фазу промывают, сушат, фильтруют и затем концентрируют при пониженном давлении. Затем остаток подвергают обработке по способу, описанному в примере 8, обеспечивая выделение ожидаемого продукта. Температура плавления 300 С. Инфракрасный спектр (KBr): c=o= 1690,1740 см-1; NH,OH = 3170-3640 см-1. Пример 14. 3- и 9-Нитро-12,13-[1,2-(4-OметилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. Методика аналогична примеру 13, используя концентрированную азотную кислоту в качестве реагента и осуществляя реакцию при комнатной температуре. Хроматография позволяет выделить смесь (1,5/1) 3-нитро и 9-нитро соединений. Температура плавления смеси: 293 С. Пример 15. 3,9-Диамино-12,13-[1,2-(4-OметилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. Раствор 0,094 ммоль соединения примера 13 в 13 мл тетрагидрофурана и 1,88 ммоль SnCl2 кипятят с обратным холодильником в течение 63 ч. После охлаждения реакционную смесь гидролизуют и полученный осадок отфильтровывают. Фильтрат доводят до рН 10. После экстракции этилацетатом органическую фазу сушат, фильтруют и выпаривают, позволяя выделиться ожидаемому продукту. Температура плавления 155 С (разложение). Инфракрасный спектр (KBr): c=o= 1700,1710, 1750 см-1; NH OH NH = 3900-3600 см-1. Пример 16. 3,9-Динитро-12,13-[1,2-(3,6 ангидро-4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло 13 Методика аналогична примеру 13, используя соединение примера 11 в качестве субстрата. Температура плавления 300 С. Инфракрасный спектр (KBr): c=o= 1720,1760 см-1; NH = 3100-3500 см-1. Пример 17. 3-Нитро-12,13-[1,2-(3,6-ангидро-4-O-метилD-маннопиранозил)]-6,7,12,13 тетрагидро-(5 Н)-индоло[2,3-]пирроло[3,4-с] карбазол-5,7-дион. Продукт выделяют во время синтеза соединения примера 16. Температура плавления 300 С. Инфракрасный спектр (KBr): c=o= 1710,1750 см-1; NH = 3200 см-1. Пример 18. 3,9-Дигидрокси-12,13-[1,2-(4O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. 37 мкл 50% водного раствора Н 2O2 и затем 11 мкл 95% водного раствора серной кислоты добавляют в раствор 211 ммоль соединения примера 6 в 6 мл метанола. После 72-часового перемешивания при комнатной температуре,реакционную смесь гидролизуют и затем экстрагируют этилацетатом. Органическую фазу промывают, сушат, фильтруют и затем выпаривают. Хроматография на силикагеле (толуол/тетрагидрофуран:65/35) позволяет выделить ожидаемый продукт. Температура плавления 258 С (разложение). Пример 19. 3,9-Дибромо-12,13-[1,2-(4-OметилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. Раствор 2,07 ммоль N-бромсукцинимида в 30 мл тетрагидрофурана добавляют по каплям в охлажденный до 0 С раствор 0,207 ммоль соединения примера 2 в 20 мл тетрагидрофурана. После 7-дневной реакции при комнатной температуре смесь гидролизуют и экстрагируют этилацетатом. Органическую фазу сушат, фильтруют и затем концентрируют при пониженном давлении. Хроматография на силикагеле (этилацетат/циклогексан:70/30) позволяет выделить ожидаемый продукт. Температура плавления 300 С. Инфракрасный спектр (KBr): c=o= 1710,1760 см-1; NH,OH = 2700-3300 см-1. Пример 20. 12,13-[1,2-(3-O-Бромацетил-4O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. В раствор 0,70 ммоль соединения примера 2 в 12 мл тетрагидрофурана добавляют 79 мг третбутилата калия и затем, спустя 30 мин при комнатной температуре, 0,70 ммоль бромацетил бромида. После 24-часовой реакции реакционную смесь гидролизуют и затем экстрагируют этилацетатом. Органическую фазу сушат, 004737 14 фильтруют и концентрируют при пониженном давлении. Хроматография на силикагеле (дихлорметан/этилацетат:70/30) позволяет выделить ожидаемый продукт. Пример 21. 12,13-[1,2-(6-O-Бромацетил-4O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло(3,4-с)карбазол-5,7-дион. Методика аналогична примеру 20, используя карбонат калия в качестве основания и осуществляя реакцию при дефлегмации тетрагидрофурана. Пример 22. 1,11-Дихлоро-12,13-[1,2-(6 хлоро-6-дезокси-4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-] пирроло[3,4-с]карбазол-5,7-дион. Методика аналогична примеру 10, используя соединение примера 1 в качестве субстрата. Пример 23. 12,13-[1,2-(6-Амино-6-дезокси 4-O-метилD-маннопиранозил)]-6,1,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион гидрохлорид. 7 мг 10% Pd/C добавляют в суспензию 0,126 ммоль соединения примера 12 в 15 мл метанола и 14 мл этилацетата. Смесь гидрируют под давлением одна атмосфера в течение 40 ч,затем фильтруют через целит и промывают последовательно метанолом, тетрагидрофураном и этилацетатом. Фильтрат концентрируют при пониженном давлении и полученный остаток суспендируют в 0,3 мл метанола в присутствии 0,23 мл 1N раствора хлористо-водородной кислоты. После перемешивания и добавления дихлорметана осадок, который образуется, отфильтровывают, выделяя ожидаемый продукт. Температура плавления 300 С. Инфракрасный спектр (KBr): c=o= 1710,1760 см-1; NH,OH = 3270-3600 см-1. Пример 24. 12,13-[1,2-(6-Иод-6-дезокси-4O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. 31 ммоль иодида натрия добавляют в раствор 1,55 ммоль соединения примера 10 в 80 мл ацетона. Смесь перемешивают при температуре кипения флегмы в течение 7 дней и затем растворитель удаляют выпариванием. Остаток поглощают в этилацетате и затем промывают. Органическую фазу сушат, фильтруют и концентрируют при пониженном давлении. Хроматография на силикагеле (циклогексан/этилацетат:60/40) позволяет выделить ожидаемый продукт. Пример 25. 12,13-[1,2-(6-Диметиламино-6 дезокси-4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион гидрохлорид. 0,154 ммоль соединения примера 24 добавляют в раствор 3,14 ммоль диметиламина в 5 мл тетрагидрофурана. После перемешивания при комнатной температуре в течение 2 дней, 15 реакционную смесь гидролизуют и экстрагируют этилацетатом. Органическую фазу сушат,фильтруют и концентрируют при пониженном давлении. Остаток разбавляют в 0,3 мл метанола и добавляют 1N водный раствор хлористоводородной кислоты. После перемешивания и добавления дихлорметана осадок, который образуется, отфильтровывают, позволяя выделить ожидаемый продукт. Пример 26. 6-Амидо-12,13-[1,2-(4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-]пирроло[3,4-с]карбазол 5,7-дион. 14 ммоль гидразин гидрата добавляют к 0,20 ммоль соединения примера 2. После 1,5 часового перемешивания при 50 С реакционную смесь выливают на лед и затем экстрагируют этилацетатом. Затем органическую фазу промывают, сушат, фильтруют и затем концентрируют при пониженном давлении. Хроматография на силикагеле (этилацетат/циклогексан) позволяет выделить ожидаемый продукт. Пример 27. 6-Формамидо-12,13-[1,2-(4-OметилD-маннопиранозил)]-6,7,12,13-тетрагидроиндоло[2,3-]пирроло[3,4-с]карбазол-5,7 дион. 10 эквивалентов муравьиного гидразина добавляют в раствор 0,30 ммоль соединения примера 3 в 10 мл диметилформамида. После перемешивания в течение 1 ч при 140 С, реакционную смесь охлаждают и затем гидролизуют, вызывая образование осадка, который отфильтровывают и промывают водой и затем эфиром, позволяя выделить ожидаемый продукт. Пример 28. 6-(2-Гидроксиэтил)-12,13-[1,2(4-О-метилD-маннопиранозил)]-6,7,12,13 тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с] карбазол-5,7-дион. Раствор 0,30 ммоль соединения примера 3 и 1,3 мл этаноламина перемешивают в течение 1 ч при комнатной температуре и затем выливают на лед и экстрагируют этилацетатом. Органическую фазу сушат, фильтруют и затем концентрируют при пониженном давлении. Хроматография на силикагеле (этилацетат/циклогексан) позволяет выделить ожидаемый продукт. Пример 29. 6-Диэтиламиноэтил-12,13-[1,2(4-О-метилD-маннопиранозил)]-6,7,12,13 тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с] карбазол-5,7-дион и его гидрохлорид. 26 мкл N,N-диэтилэтилендиамина добавляют по каплям в раствор 58,5 мг соединения примера 3, растворенного в 7 мл безводного тетрагидрофурана. Смесь нагревают при 65 С в течение 4 дней вдали от света и затем охлаждают и поглощают в смеси (1N водный раствор хлористо-водородной кислоты/этилацетат). После экстракции этилацетатом органическую фазу сушат, фильтруют и затем концентрируют при пониженном давлении. Полученный оста 004737 16 ток охлаждают до 0 С и растворяют в 200 мкл метанола и туда по каплям добавляют 1,14N водный раствор хлористо-водородной кислоты(108 мкл). Смесь перемешивают и затем добавляют циклогексан. Осадок фильтруют через фритту, позволяя выделить ожидаемый продукт. Температура плавления 250 С. Инфракрасный спектр (KBr): c=o= 1700,1750 см-1; NH,OH = 3200-3600 см-1. Пример 30. 12,13-[1,2-(3,6-Ди-O-ацетил-4O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. 0,68 мл уксусного ангидрида добавляют по каплям в раствор 351 мг соединения примера 2 в 7 мл пиридина. Реакционную смесь перемешивают в течение 19 ч при комнатной температуре. После гидролиза органический продукт экстрагируют этилацетатом и затем органическую фазу промывают и сушат. После удаления растворителя выпариванием остаток очищают хроматографией на силикагеле(циклогексан/этилацетат:3/2), позволяющей выделить ожидаемый продукт. Температура плавления 106 С. Инфракрасный спектр (KBr): c=o= 1720,1750 см-1; NH,OH = 3100-3600 см-1. Пример 31. 12,13-[1,2-(3-O-Ацетил-4-ОметилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. 0,92 мл эферата трифторид бора добавляют по каплям в охлажденный до 0 С раствор 337 мг соединения примера 30, растворенного в 30 мл ацетонитрила и 3 мл воды. После 24 ч при комнатной температуре, добавляют 3 мл воды и 0,92 мл эферата трифторид бора. После дополнительных 24 ч при комнатной температуре реакционную смесь гидролизуют насыщенным водным раствором кислого карбоната натрия. Органический продукт экстрагируют этилацетатом и затем органические фазы объединяют,промывают и сушат. После удаления растворителя выпариванием хроматография на силикагеле (циклогексан/этилацетат:1/1) позволяет выделить ожидаемый продукт. Температура плавления 294 С. Инфракрасный спектр (KBr): c=o= 1720,1750 см-1; NH,OH = 3100-3600 см-1. Пример 32. 12,13-[1,2-(3-O-Ацетил-6 дезокси-6-хлоро-4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-] пирроло[3,4-с]карбазол-5,7-дион. В раствор 77 мг соединения примера 31 в 1,7 мл пиридина добавляют последовательно 154 мг трифенилфосфина и затем, по каплям,тетрахлорид углерода (43 мкл). Реакционную смесь перемешивают при 40 С в течение 65 ч,охлаждают и затем выливают в воду (30 мл). Органический продукт экстрагируют этилацетатом, промывают и затем сушат над суль 17 фатом магния. После удаления растворителя выпариванием, остаток очищают хроматографией на силикагеле (циклогексан/этилацетат:55/45), позволяющей выделить ожидаемый продукт. Температура плавления 300 С. Инфракрасный спектр (KBr): c=o= 1700,1730, 1770 см-1; NH = 3100-3600 см-1. Пример 33. 3,9-Динитро-12,13-[1,2-(3-Oацетил-6-дезокси-6-хлоро-4-O-метилDманнопиранозил)]-6,7,12,13-тетрагидро-(5H)индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. 3,5 мл дымящей азотной кислоты добавляют по каплям в охлажденный до 0 С раствор 50,6 мг соединения примера 32, растворенного в 5 мл безводного тетрагидрофурана. После 2 ч смесь возвращают к комнатной температуре и перемешивают в течение 21 ч. После гидролиза органический продукт экстрагируют этилацетатом. Органические фазы объединяют, промывают и сушат над сульфатом магния и растворитель удаляют выпариванием. Хроматография на силикагеле (толуол/тетрагидрофуран:7/3) дает ожидаемый динитропродукт. Пример 34. 3,9-Динитро-12,13-[1,2-(6-дезокси-6-хлоро-4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-] пирроло[3,4-с]карбазол-5,7-дион. Эферат трифторид бора (48 мкл) добавляют по каплям в охлажденный до 0 С раствор 22,3 мг соединения примера 33, растворенного в 3 мл ацетонитрила, 0,3 мл воды и 2 мл тетрагидрофурана. После 48 ч при 40 С, добавляют 0,3 мл воды и 1 мл эферата трифторида бора. После дополнительных 24 ч при 40 С добавляют те же пропорции воды и эферата трифторида бора. После 24 ч при комнатной температуре, реакционную смесь гидролизуют насыщенным водным раствором кислого карбоната натрия. Органический продукт экстрагируют этилацетатом и затем органические фазы объединяют, промывают и сушат над сульфатом магния. После удаления растворителя выпариванием, хроматография на силикагеле (толуол/тетрагидрофуран:1/1) и затем (циклогексан/ацетон:2/3) позволяет выделить ожидаемый продукт. Пример 35. 3,9-Динитро-12,13-[1,2-(6-азидо-6-дезокси-4-O-метилD-маннопиранозил)]6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. Методика аналогична примеру 10, используя соединение примера 34 в качестве исходного вещества. Температура плавления 300 С. Инфракрасный спектр (KBr): c=o= 1720,1760 см-1; NH = 3200-3600 см-1; N = 2100 см-1. Пример 36. 3,9-Диметоксикарбонил-12,13[1,2-(4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с] карбазол-5,7-дион. 18 Смесь 290 мг соединения примера 2 и 6 мл пиридина охлаждают до 0 С и затем добавляют 0,6 мл уксусного ангидрида. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Добавляют воду и смесь перемешивают в течение 40 мин, затем экстрагируют этилацетатом. Органическую фазу промывают и затем сушат над MgSO4. Растворитель удаляют выпариванием и остаток растворяют в 9 мл дихлорметана. Добавляют дихлорметил метиловый эфир (1,08 мл) и смесь охлаждают до 0 С до добавления 1 М раствора TiCl4 в 11,96 мл дихлорметана. Смесь перемешивают при комнатной температуре в течение 24 ч и затем гидролизуют водой. Реакционную смесь перемешивают в течение одного часа и затем экстрагируют этилацетатом. Органическую фазу сушат надMgSO4 и растворитель удаляют выпариванием. Затем остаток растворяют в 6 мл метанола до добавления 50% водного раствора пероксида водорода (0,4 мл) и затем добавления 95% серной кислоты (1,6 ml). Смесь перемешивают в течение 72 ч при комнатной температуре. После 30-минутного гидролиза, реакционную смесь экстрагируют этилацетатом. Органические фазы объединяют, сушат над сульфатом магния и фильтруют, и удаляют растворитель выпариванием. Затем полученный остаток растворяют в 22 мл метанола до добавления по каплям 28% водного раствора гидроксида аммония (10 мл). Смесь перемешивают при комнатной температуре при комнатной температуре в течение 24 ч. После удаления растворителей выпариванием остаток поглощают в смеси вода/этилацетат. Реакционную смесь экстрагируют этилацетатом. Органические фазы объединяют, промывают водным раствором хлорида натрия, сушат над сульфатом магния и фильтруют, и растворитель удаляют выпариванием. Остаток очищают хроматографией на силикагеле (циклогексан/ацетон:1/1), получая ожидаемый продукт. Пример 37. N3,N9-Биc-3-aминопропил-5,7 диоксо-12,13-[1,2-(4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3]пирроло[3,4-с]карбазол-3,9-дикарбоксамид. 0,2 мл 1,3-диаминопропана добавляют в раствор 1,26 мл 2N Аl(СН 3)3 в гексане при-20 С. Смесь перемешивают при -20 С в течение 20 мин и затем медленно возвращают к комнатной температуре. Добавляют 1,36 г соединения примера 7, растворенного в 15 мл дихлорметана, и раствор нагревают при температуре кипения с обратным холодильником в течение 24 ч. Реакционную смесь гидролизуют раствором 4 мл 0,7 М хлористо-водородной кислоты. После перемешивания в течение 30 мин,водную фазу отделяют и экстрагируют этилацетатом. Органическую фазу промывают и затем сушат. После удаления растворителя выпариванием полученный остаток очищают хромато 19 графией на колонке с диоксидом кремния, получая ожидаемый продукт. Пример 38. 3,9-Дихлоро-12,13-(1,2-(4-OметилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион. Раствор 166 мг N-хлорсукцинимида, растворенного в 6 мл тетрагидрофурана, добавляют по каплям в охлажденный до 0 С раствор 60 мг соединения примера 2 в 3 мл тетрагидрофурана. Смесь перемешивают в течение 4 дней при комнатной температуре. После 10-минутного гидролиза с 50 мл воды дихлоросоединение экстрагируют этилацетатом. Органическую фазу сушат и фильтруют, и растворитель удаляют выпариванием. Остаток очищают хроматографией на силикагеле (циклогексан/этилацетат:3/7),получая ожидаемый продукт. Пример 39. 3,9-Диамино-12,13-[1,2-(4-OметилD-маннопиранозил)]-6,7,12,13-тетрагидро-5-оксо-(5 Н)-индоло[2,3-]пирроло[3,4-с] карбазол и 3,9-диамино-12,13-[1,2-(4-O-метил-D-маннопиранозил)]-6,7,12,13-тетрагидро-7 оксо-(5 Н)-индоло[2,3-]пирроло[3,4-с]карбазол. 1 г амальгамы цинка добавляют в раствор 106 мг соединения примера 15 в 14 мл этанола в присутствии 2,3 мл 6N хлористо-водородной кислоты. Смесь кипятят с обратным холодильником в течение 4 ч и затем фильтруют. Твердый остаток промывают этилацетатом. Фильтрат выпаривают, остаток поглощают этилацетатом и промывают водным насыщенным раствором NаНСО 3, и затем водой. Органическую фазу сушат над MgSO4. Растворитель удаляют выпариванием и остаток очищают хроматографией на колонке с диоксидом кремния (этилацетат/метанол:9/1), позволяющей выделить смесь ожидаемых региоизомеров. Пример 40. 12,13-[1,2-(3-O-Лизин-4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5H)-индоло[2,3-]пирроло[3,4-с]карбазол 5,7-дион и его гидрохлорид. 68 мг гидробензотриазола и 114 мг дициклогексилкарбодиимида добавляют в охлажденный до 0 С раствор 10 мл ди-третбутоксикарбониллизина в диметилформамиде. Смесь перемешивают при комнатной температуре в течение 30 мин прежде чем добавить в суспензию 242 мг соединения примера 2 в 5 мл тетрагидрофурана, которую предварительно перемешивают при комнатной температуре в присутствии 69 мг карбоната калия. Полученную таким образом реакционную смесь нагревают при 50 С в течение 24 ч до проведения гидролиза с насыщенным раствором NaCl и затем экстрагируют этилацетатом. Объединенные органические фазы сушат и затем фильтруют и концентрируют при пониженном давлении. Хроматография остатка на силикагеле (циклогексан/этилацетат:3/7) позволяет выделить соединение, которое затем растворяют в смеси 3 М 20 НСl в 2,5 мл этилацетата. После 5-часового перемешивания при комнатной температуре реакционную смесь выпаривают, получая кристаллы, которые промывают этилацетатом, получая требуемый продукт в виде его гидрохлоридной соли. Фармакологическое исследование соединений изобретения. Пример 41. In vitro активность. Культура клеток L1210 мышиного лейкоза. Культуру клеток L1210 мышиного лейкоза используют in vitro. Клетки культивируют в полной RPMI 1640 культуральной среде, включающей 10% фетальную телячью сыворотку, 2 мМ глутамин, 50 единиц/мл пенициллина, 50 мкг/мл стрептомицина и 10 мМ Hepes, pH 7,4. Клетки распределяют по микропланшетам и подвергают воздействию цитотоксических соединений в течение четырех повторяющихся периодов, то есть 48 ч. Затем количественно определяют число жизнеспособных клеток колориметрическим анализом. Микроанализ культуры с использованием тетразолия (Microculture Tetrazolium Assay) (J. Carmichael et al.,Cancer Res., 47, 936-942, (1987. Результаты выражают в виде IC50, цитотоксическая концентрация, которая ингибирует пролиферацию обработанных клеток на 50%. Все соединения данного изобретения демонстрируют хорошо выраженную цитотоксичность по отношению к этой клеточной линии. В качестве примера, в этом тесте соединение примера 13 имеет IC50 0,13 мкМ и соединение примера 19 имеет IC50 0,14 мкМ. Человеческие клеточные линии. Кроме того, соединения изобретения были испытаны на человеческих клеточных линиях в соответствии с таким же экспериментальным протоколом, как описан для L1210 мышиного лейкоза, но в течение инкубационных периодов 4 дня, вместо 2 дней. В качестве примера, соединения примеров 14, 16, 19 и 29, все, имеютIC50 меньше, чем 1 мкМ на следующих клеточных линиях: IGROV-1 карциномы яичника, SKN-MC нейробластомы, НТ-29 карциномы толстой кишки, А 549 крупноклеточной легочной карциномы, А 431 эпидермоидной карциномы и Н 69 мелкоклеточной легочной карциномы. Эти разнообразные результаты несомненно демонстрируют существенный противоопухолевый потенциал соединений данного изобретения. Пример 42. Действие на клеточный цикл.LI210 клетки инкубируют в течение 21 ч при 37 С в присутствии различных концентраций испытываемых соединений. Затем клетки фиксируют 70% (об/об) этанолом, промывают дважды в ЗФР (PBS) и инкубируют в течение 30 мин при 20 С в ЗФР, который содержит 100 мкг/мл РНКазы (RNAse) и 50 мкг/мл иодида пропидия (propidium iodide). Результаты выражают как процент клеток, которые аккумули 21 руют в G2+M фазе спустя 21 ч, по сравнению с контролем (контроль : 20%). Соединения изобретения особенно полезны. Они индуцируют аккумуляцию по крайней мере 70% клеток вG2+M фазе спустя 21 ч при концентрации меньше, чем 1 мкМ. Пример 43. Фармацевтическая композиция: раствор для инъекций. Соединение примера 13 10 мг Дистиллированная вода 25 мл для приготовления инъекций ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) где R1 и R2, которые могут быть одинаковыми или различными, каждый независимо от другого представляет группу формулы U-V,где U представляет одинарную связь или прямую или разветвленную (C1-С 6)алкиленовую цепь, необязательно замещенную одной или несколькими гидроксигруппами,V представляет группу, выбранную из атома водорода, атома галогена, нитрогруппы,прямой или разветвленной (С 1-С 6)алкильной группы, гидроксигруппы, формила, NRaRb,-С(O)-Т 1, -C(O)-NRa-T1, -C(O)-O-T1,где Ra и Rb, которые могут быть одинаковыми или различными, каждый представляет группу, выбранную из атома водорода, прямой или разветвленной (С 1-С 6)алкильной группы, Т 1 представляет группу, выбранную из прямого или разветвленного (С 1-С 6)алкила или прямой или разветвленной (С 1-С 6)алкиленовой цепи,замещенной группой, выбранной из -ORa,-NRaRb, где Ra и Rb являются такими, как определено выше,G представляет атом кислорода или NR3 группу, где R3 представляет группу, выбранную из атома водорода, прямой или разветвленной(С 1-С 6)алкильной группы, -ORa группы, -NRaRb группы, -NH-C(O)-Ra группы и прямой или разветвленной (С 1-С 6)алкиленовой цепи, замещенной одной или более одинаковыми или различными группами, выбранными из -ORa и-NRaRb, причем группы Ra и Rb являются такими, как определено выше,Х представляет собой атом водорода,Y представляет собой атом водорода, или Х и Y вместе с атомом углерода, с которыми они соединены, образуют карбонильную группу, 004737 22 Х 1 представляет собой атом водорода,Y1 представляет собой атом водорода, или Х 1 и Y1 вместе с атомом углерода, с которым они соединены, образуют карбонильную группу,R4 представляет группу, выбранную из гидроксигруппы и -O-C(O)-Rc группы, где Rc представляет прямую или разветвленную (С 1 С 6)алкильную группу (необязательно замещенную одной или более группами, выбранными из галогена и амино),R5 представляет прямую (С 1-С 6)алкоксигруппу,R6 представляет группу формулы U1-R'4,где U1 представляет одинарную связь или метиленовую группу, и R'4 имеет такие же значения,как и R4, или представляет собой группу, выбранную из атома галогена, азидогруппы илиNRaRb группы, где Ra и Rb имеют значения определенные выше,или R4, R5 и R6, взятые попарно в смежных или несмежных положениях, образуют с атомами углерода, несущими их, кольцевую систему,имеющую от 3 до 6 членов в кольце, содержащую один или два атома кислорода, причем оставшаяся группа R4, R5 или R6 имеет значениеR5, приведенное выше,их изомеры и соли их присоединения с фармацевтически приемлемыми кислотой или основанием, при условии, что из соединений формулы (I) исключаются нижеследующие соединения: 1,11-дихлоро-12,13-[1,2-(4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дион,12,13-[1,2-(4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дион,12,13-[1,2-(4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-а]пирроло[3,4-с]карбазол-5-он, и 12,13-[1,2-(4-O-метилD-маннопиранозил)]-5,6,12,13-тетрагидро-(7 Н)-индоло[2,3-а] пирроло[3,4-с]карбазол-7-он. 2. Соединения формулы (I) по п.1, отличающиеся тем, что G представляет NR3 группу,где R3 такой, как определен для формулы (I), их изомеры и соли присоединения их с фармацевтически приемлемыми кислотой или основанием. 3. Соединения формулы (I) по п.1, отличающиеся тем, что Х и Y вместе с углеродным атомом, несущим их, образуют карбонильную группу, и Х 1 и Y1 вместе с углеродным атомом,несущим их, образуют карбонильную группу,их изомеры, и соли их присоединения с фармацевтически приемлемыми кислотой или основанием. 4. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют соединения формулы (I бис) где R1, R2, R3, R4, R5 и R6 такие, как определено для формулы (I), их изомеры, и соли их присоединения с фармацевтически приемлемыми кислотой или основанием. 5. Соединения формулы (I) по пп.1 или 4,отличающиеся тем, что R1 и R2, которые могут быть одинаковыми или различными, представляют собой группу формулы U-V, где U представляет одинарную связь и V представляет группу, выбранную из атома галогена, атома водорода, нитрогруппы, формила и гидроксигруппы, их изомеры, и соли присоединения их с фармацевтически приемлемыми кислотой или основанием. 6. Соединения формулы (I) по пп.1 или 4,отличающиеся тем, что R1 и R2, являются одинаковыми, их изомеры, и соли их присоединения с фармацевтически приемлемыми кислотой или основанием. 7. Соединения формулы (I) по пп.1 или 4, отличающиеся тем, что R3 представляет атом водорода, гидроксигруппу или прямую или разветвленную(С 1-С 6)алкиленовую цепь, замещенную группой,выбранной из NRaRb и ORa, где Ra и Rb такие, как определено для формулы (I), их изомеры, и соли присоединения их с фармацевтически приемлемыми кислотой или основанием. 8. Соединения формулы (I) по пп.1 или 4,отличающиеся тем, что представляет соединения формулы (Iter) где R1, R2, R3 и R6 такие, как определено для формулы (I), их изомеры, и соли присоединения их с фармацевтически приемлемыми кислотой или основанием. 9. Соединения формулы (I) по п.1, которые представляют собой 3,9-диформил-12,13-[1,2-(4-O-метилDманнопиранозил)]-6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион, 004737[2,3-]пирроло[3,4-с]карбазол-5,7-дион,6-гидрокси-12,13-[1,2-(4-O-метилD-маннопиранозил)]-6,7,1-2,13-тетрагидро-(5 Н)-индоло [2,3-]пирроло[3,4-с]карбазол-5,7-дион,3,9-ди(гидроксиметил)-12,13-[1,2-(4-O-метилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-]пирроло[3,4-с]карбазол 5,7-дион,3,9-динитро-12,13-[1,2-(3,6-ангидро-4-ОметилD-маннопиранозил)]-6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион,3,9-дигидро-12,13-[1,2-(4-O-метилDманнопиранозил)]-6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион,3,9-дибромо-12,13-[1,2-(4-O-метилDманнопиранозил)]-6,7,12,13-тетрагидро-(5 Н)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7-дион и 6-диэтиламиноэтил-12,13-[1,2-(4-O-метил-D-маннопиранозил)]-6,7,12,13-тетрагидро(5 Н)-индоло[2,3-]пирроло[3,4-с]карбазол-5,7 дион и его гидрохлорид,их изомеры, и соли присоединения их с фармацевтически приемлемыми кислотой или основанием. 10. Способ получения соединений формулы (I), отличающийся тем, что в качестве исходного вещества используют соединение формулы (II) где X, Y, Х 1, Y1, R4, R5 и R6 такие, как определено для формулы (I), которое обрабатывают в основной среде паратолуолсульфоновой кислотой, получая соединение формулы (III) где X, Y, Х 1, Y1, R4, R5 и R6 такие, как определено выше, и это соединение формулы (III) подвергают взаимодействию с азидом натрия, получая, главным образом, соединение формулы(I/a), отдельного представителя соединений формулы (I) где X, Y, X1, Y1, R4, R5 и R6 такие, как определено выше, и это соединение формулы (I/a) подвергают действию условий гидрогенолиза, получая соединение формулы (I/b), отдельного представителя соединений формулы (I) где X, Y, Х 1, Y1, R4, R5 и R6 такие, как определено выше, и это соединение формулы (I/b) обрабатывают водным раствором гидроксида натрия и затем обрабатывают хлористо-водородной кислотой, получая соединение формулы (I/с), отдельного представителя соединений формулы (I) где X, Y, X1, Y1, R4, R5 и R6 такие, как определено выше, и это соединение формулы (I/с) подвергают действию соединения формулы (IV)(IV),где R3a имеет те же определения, как R3, исключая атом водорода, получая соединение формулы (I/d), отдельного представителя соединений формулы (I) 26 где X, Y, Х 1, Y1, R3a, R4, R5 и R6 такие, как определено выше, причем совокупность соединений формул от (I/b) до (I/d) составляют соединения формулы (I/е) где G, X, Y, X1, Y1, R4, R5 и R6 такие, как определено для формулы (I), и это соединение формулы (I/е) подвергают реакции электрофильного ароматического присоединения или реакции нуклеофильного ароматического присоединения, в соответствии со стандартными условиями органического синтеза, известными специалисту в данной области техники, получая соединение формулы (I/f), отдельного представителя соединений формулы (I) где G, X, Y, X1, Y1, R4, R5 и R6 такие, как определено выше, и R1a и R2a имеют те же определения, как R1 и R2, соответственно, за исключением того, что R1a и R2a не могут одновременно представлять атом водорода, и все соединения формул с (I/a) по (I/f) составляют в целом соединения формулы (I), которые очищают, если необходимо, в соответствии с обычной техникой очистки, которые могут быть, при желании,разделены на принадлежащие им различные изомеры в соответствии со стандартной техникой разделения, заместители R4, R5 и R6 которых регулируются согласно обычным способам органического синтеза, используемым в области химии сахаров, и которые превращают, при желании, в соли присоединения с фармацевтически приемлемыми кислотой или основанием. 11. Фармацевтическая композиция, включающая в качестве активного ингредиента, по крайней мере, одно соединение формулы (I) по любому из пп.1-9, само по себе или в комбинации с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми наполнителями или носителями. 12. Фармацевтическая композиция по п.11,обладающая противоопухолевой активностью.
МПК / Метки
МПК: A61K 31/706, C07H 19/23, A61P 35/00
Метки: содержащие, композиции, фармацевтические, производные, 13-(пиранозил)фуро, 13-(пиранозил)индоло, пирроло, получения, 3-&alpha, 4-c]карбазола, способ, индоло[2, 3-α]карбазола
Код ссылки
<a href="https://eas.patents.su/14-4737-proizvodnye-12-13-piranozilindolo-2-3-alpha-pirrolo-3-4-ckarbazola-i-12-13-piranozilfuro-3-4-c-indolo2-3-alphakarbazola-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-soderzh.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 12, 13-(пиранозил)индоло [2, 3-α] пирроло [3, 4-c]карбазола и 12, 13-(пиранозил)фуро [3, 4-c] индоло[2, 3-α]карбазола, способ их получения и фармацевтические композиции, содержащие их</a>
Следующий патент: Новые циклобутаиндолкарбоксамидные производные, способ их получения и содержащие их фармацевтические композиции
Случайный патент: Способ резки стекла












