Способ получения ингибиторов вич – протеазы
Формула / Реферат
1. Способ получения соединения с формулой (7)
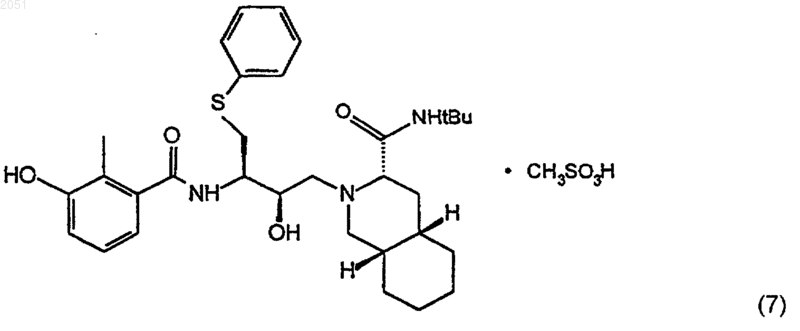
включающий превращение соединения с формулой (4)
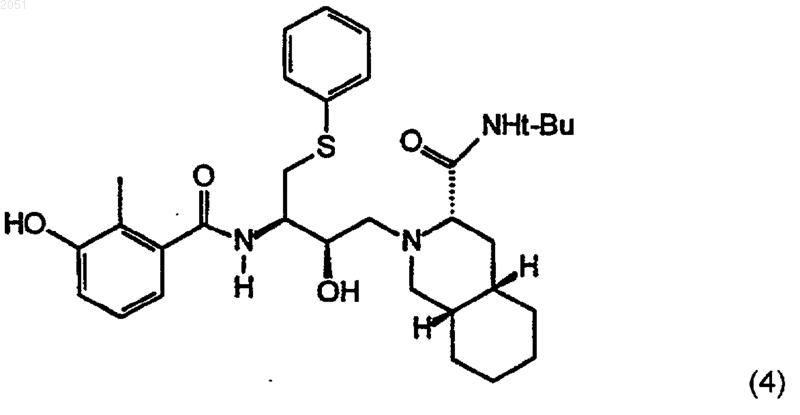
в соединение с формулой (7) путем
(а) приведения соединения с формулой (4) в контакт с органическим растворителем;
(б) приведения соединения с формулой (4) в контакт с метилсульфокислотой для образования соединения с формулой (7) и
(в) высушивания распылением соединения с формулой (7).
2. Способ по п.1, отличающийся тем, что органическим растворителем является этанол.
3. Способ по п.1, дополнительно включающий превращение соединения с формулой (3)
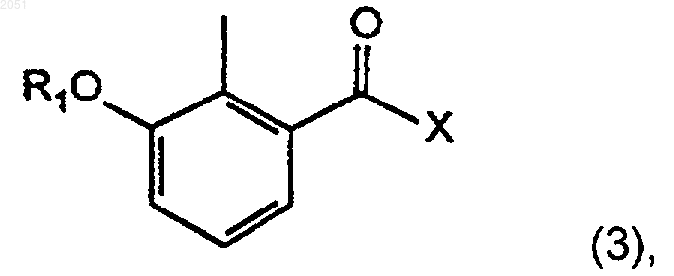
где R1 является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой или гетероарильной группой;
или группой с формулой
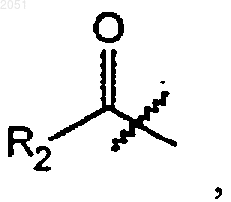
где R2 является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой или О-R6,
где R6 является алкильной группой, аралкильной группой или арильной группой;
или, кроме того, где R1 является группой с формулой
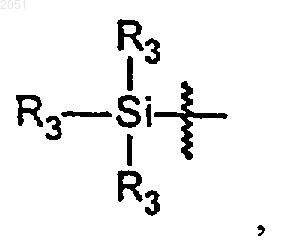
где каждый R3 независимо является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой или гетероарильной группой;
или, кроме того, где R1 является группой с формулой
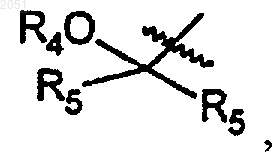
где каждый R4 и каждый R5 независимо являются алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой или гетероарильной группой;
и Х является ОН;
OR7, где R7 является алкильной или арильной группой;
галогеном;
азидом, цианидом, изоцианатом или изотиоцианатной группой;
OSO2R8, где R8 является алкильной или арильной группой;
гетероарильной группой, присоединенной через гетероатом; или
N-гидроксигетероциклическим радикалом, присоединенным через атом кислорода;
и где
алкильная группа содержит предпочтительно от одного до восьми, более предпочтительно - от одного до шести, и наиболее предпочтительно - от одного до четырех атомов углерода;
циклоалкильная группа представляет собой насыщенное или частично насыщенное, моно- или поликарбоциклическое кольцо и предпочтительно содержит 5-14 атомов углерода в кольце;
гетероциклоалкильная группа представляет собой неароматический одновалентный моноциклический, бициклический или трициклический радикал, который является насыщенным или ненасыщенным, содержит от 3 до 18 атомов в кольце и включает от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы;
арильная группа представляет собой ароматический, одновалентный моноциклический, бициклический или трициклический радикал и содержит 6, 10, 14 или 18 атомов углерода в кольце;
гетероарильная группа представляет собой ароматический одновалентный, моноциклический, бициклический или трициклический радикал, содержащий от 5 до 18 атомов в кольце, включая от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы;
в соединение формулы (4).
4. Способ по п.3, отличающийся тем, что R1 является -С(О)СН3.
5. Способ по п.3, отличающийся тем, что Х является Cl.
6. Способ по п.5, отличающийся тем, что R1 является -С(О)СН3.
7. Способ по п.3, отличающийся тем, что указанное превращение соединения формулы (3) в соединение формулы (4) включает снятие защиты с соединения с формулой (5)
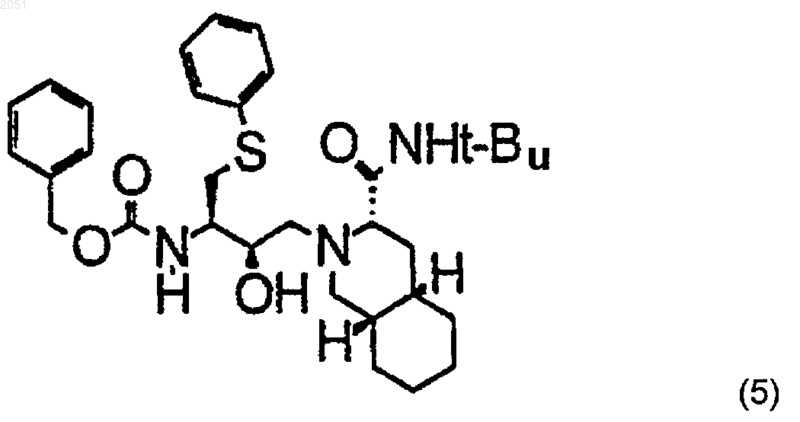
и присоединение к лишенному защиты соединению с формулой (5) соединения с формулой (3).
8. Способ по п.7, отличающийся тем, что в формуле (3) R1 является -С(O)СН3.
9. Способ по п.7, отличающийся тем, что в формуле (3) Х является Cl.
10. Способ по п.9, отличающийся тем, что в формуле (3) R1 является -С(O)СН3.
11. Способ по п.3, отличающийся тем, что указанное превращение соединения формулы (3) в соединение формулы (4) включает объединение соединения с формулой (3) с соединением формулы (6)
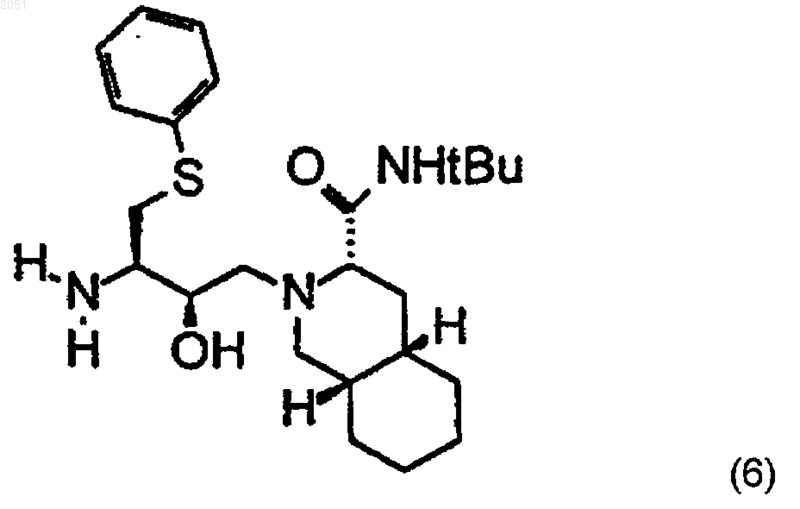
12. Способ по п.11, отличающийся тем, что в формуле (3) R1 является -С(O)СН3.
Текст
1 Данные о родственных заявках По настоящей заявке испрашивается приоритет по заявке на патент США 08/708,411,поданной 5 сентября 1996 г. Эта заявка полностью включена сюда в качестве ссылки. Кроме того, настоящая заявка связана со следующими заявками на патент США: Заявка на патент СШАДата подачи 08/133,543 7 октября 1993 08/133,696 7 октября 1993 08/190,764 2 февраля 1994 08/481,833 7 июня 1995 60/025,517 5 сентября 1996 Каждая из этих заявок на патент США также полностью включена в настоящее описание в качестве ссылок. Уровень техники Лечение ВИЧ-инфицированных лиц является одной из наиболее неотложных биомедицинских проблем последних лет. Перспективное новое направление в лечении появилось благодаря важному способу предотвращения или ингибирования быстрой пролиферации вируса в ткани человека. Ингибиторы ВИЧ-протеазы блокируют ключевой ферментативный путь в вирусе, приводя к существенному снижению вирусной нагрузки, что замедляет непрерывное угнетение иммунной системы и снижает являющееся результатом этого угнетения разрушительное влияние на здоровье человека. Было показано, что ингибитор ВИЧ-протеазы нелфинавира метилсульфонат, имеющий формулу 7, эффективен при лечении ВИЧ-инфицированных лиц. Сущность нелфинавира метилсульфоната раскрыта в патенте США 5,484,926, выданном 16 января 1996 г. Этот патент полностью включен в качестве ссылки в данную заявку на патент. Авторы настоящего изобретения открыли полезные промежуточные соединения, которые могут быть использованы в нескольких схемах реакций для получения нелфинавира метилсульфоната. Авторы настоящего изобретения также открыли новые способы получения нелфинавира метилсульфоната из свободного основания нелфинавира с формулой 4 Сущность свободного основания нелфинавира также раскрыта в патенте США 5,484,926. 2 Сущность изобретения Задачей изобретения является создание способов получения ингибиторов ВИЧпротеазы. Такие ингибиторы также пригодны для лечения ВИЧ-инфицированных людей. В первом аспекте изобретение относится к соединениям с формулой 3 где R2 является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой или О-R6, где R6 является алкильной группой, аралкильной группой, или арильной группой; или, кроме того, где R1 является группой с формулой 9 где каждый R3 независимо является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой, или гетероарильной группой; или, кроме того, где R1 является группой с формулой 10 где R4 и каждый R5 независимо являются алкильной группой, циклоалкильной группой,гетероциклоалкильной группой, арильной группой, или гетероарильной группой; и Х является ОН; OR7, где R7 является алкилом или арилом; галогеном; псевдогалогеном;OSO2R8, где R8 является алкилом или арилом; гетероарилом, присоединенным через гетероатом; или N-гидроксигетероциклическим радикалом, присоединенным через кислород, с условием, что, если R1 является -СН 3, Х не может быть -ОСН 3 или -ОН, и если R1 является СН 3 С(О)-, Х не может быть -ОН; или фармацевтически приемлемым солям или сольватам этого соединения. В различных предпочтительных способах осуществления изобретения, R1 является-С(O)СН 3 и/или Х является галогеном, предпочтительно Cl. В другом аспекте изобретение относится к соединениям с формулой 2 где R4 и каждый R5 независимо являются алкильной группой, циклоалкильной группой,гетероциклоалкильной группой, арильной группой, или гетероарильной группой. Настоящее изобретение включает способ получения соединения в соответствии с формулой 3 где каждый R3 независимо является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой, или гетероарильной группой; или, кроме того, где R1 является группой с формулой 10 Этот способ включает добавление, при подходящих и достаточных условиях, подходящей защитной группы R1 и остаточной группы Х к соединению с формулой 1 где R4 и каждый R5 независимо являются алкильной группой, циклоалкильной группой,гетероциклоалкильной группой, арильной группой, или гетероарильной группой; или фармацевтически приемлемым солям или сольватам этого соединения. Настоящее изобретение, кроме того, относится к способам получения соединений с формулами 2 и 3. В способе получения соединения с формулой 2 соединение, соответствующее формуле 1, приведенной ниже, включают в реакцию при подходящих и достаточных условиях, чтобы добавить защитную группу R1 и образовать соединение с формулой 2. В этом случае R1 является С 2-С 8 алкильной группой; циклоалкильной группой, гетероциклоалкильной группой, арильной группой, гетероарильной группой, или группой с формулой 8 где каждый R3 независимо является алкильной группой, циклоалкильной группой,гетероциклоалкильной группой, арильной группой, или гетероарильной группой; или R1 является группой с формулой 10 где каждый R3 независимо является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой, или гетероарильной группой; или, кроме того, где R1 является группой с формулой 10 где R4 и каждый R5 независимо являются алкильной группой, циклоалкильной группой,гетероциклоалкильной группой, арильной группой, или гетероарильной группой; и Х является ОН; OR7, где R7 является алкилом или арилом; галогеном; псевдогалогеном;OSO2R8, где R8 является алкилом или арилом; гетероарилом, присоединенным через гетероатом; или N-гетероциклическим радикалом, присоединенным через атом кислорода, с условием,что если R1 является -СН 3, Х не может быть-ОСН 3 или -ОН, а если R1 является СН 3 С(О)-, Х не может быть -ОН. Как указано выше, в некоторых способах осуществления изобретения, R является -С(O)СН 3 и/или Х является галогеном,предпочтительно Cl. Соединение, соответствующее формуле 3,определенное выше, также может быть получено из соединения с формулой 2. Реакция происходит путем добавления остаточной группы Х к соединению с формулой 2. В этом случае, формула 2 является такой, как определено ниже: где каждый R3 независимо является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой, или гетероарильной группой; или, кроме того, где R1 является группой с формулой 10 где R4 и каждый R5 независимо являются алкильной группой, циклоалкильной группой,гетероциклоалкильной группой, арильной группой, или гетероарильной группой. Кроме того, в этом случае, Х определен как ОН; OR7, где R7 является алкилом или арилом; галоген; псевдогалоген; OSO2R8, где R8 является алкилом или арилом; гетероарил, присоединенный через гетероатом; или N-гидроксигетероциклический радикал, присоединенный через атом кислорода. В этом способе, если R1 является -СН 3, Х не может быть -ОСН 3 или -ОН, и если R1 является СН 3 С(О)-, Х не может быть -ОН. Настоящее изобретение далее относится к способам получения ингибиторов ВИЧпротеазы. Одним из ингибиторов ВИЧпротеазы, получаемым по способу в соответствии с настоящим изобретением, является соединение с формулой 4, изображенное ниже При этом способе соединение с формулой 3 где R2 является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, или O-R6, где R6 является алкильной груп 002051 где каждый R3 независимо является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой, или гетероарильной группой; или, кроме того, где R1 является группой с формулой 10 где R4 и каждый R5 независимо является алкильной группой, циклоалкильной группой,гетероциклоалкильной группой, арильной группой, или гетероарильной группой; и Х является ОН; OR7, где R7 является алкилом или арилом; галогеном; псевдогалогеном;OSO2R8, где R8 является алкилом или арилом; гетероарилом, присоединенным через гетероатом; или N-гидроксигетероциклическим радикалом, присоединенным через атом кислорода,реагирует при подходящих и достаточных условиях с образованием соединения с формулой 4. Опять, для одного из предпочтительных способов осуществления этого процесса, переменный радикал R1 представляет собой-С(О)СН 3 и/или переменный радикал Х представляет собой Cl. Соединение, соответствующее формуле 4,идентифицированное выше, также может быть получено путем снятия защиты с соединения с формулой 5 7 где каждый R3 независимо является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой, или гетероарильной группой; или, кроме того, где R1 является группой с формулой 10 где R4 и каждый R5 независимо являются алкильной группой, циклоалкильной группой,гетероциклоалкильной группой, арильной группой, или гетероарильной группой;и Х является ОН; OR7, где R7 является алкилом или арилом; галогеном; псевдогалогеном;OSO2R8, где R8 является алкилом или арилом; гетероарилом, присоединенным через гетероатом; или N-гидроксигетероциклическим радикалом, присоединенным через атом кислорода. В другом способе осуществления настоящего изобретения соединение с формулой 4,идентифицированное выше, может быть получено путем соединения соединения с формулой 3 где каждый R3 независимо является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой, или гетероарильной группой; или, кроме того, где R1 является группой с формулой 10 где R4 и каждый R5 независимо являются алкильной группой, циклоалкильной группой,гетероциклоалкильной группой, арильной группой, или гетероарильной группой;и Х является ОН; OR7, где R7 является алкилом или арилом; галогеном; псевдогалогеном;OSО 2R8, где R8 является алкилом или арилом; гетероарилом, присоединенным через гетероатом; или N-гидроксигетероциклическим радикалом, присоединенным через атом кислорода,с соединением с формулой 6 при условиях, достаточных и подходящих для получения соединения с формулой 4. Настоящее изобретение далее относится к способам получения соединения с формулой 7. В одном примере осуществления изобретения,соединение с формулой 7 получают путем конверсии соединения с формулой 4 при достаточных и подходящих условиях в соединение с формулой 7. При этом способе конверсия соединения с формулой 4 в соединение с формулой 7 происходит путем:(б) контакта соединения с формулой 4 с метилсульфокислотой при условиях, достаточных для образования соединения с формулой 7; и(в) высушивания путем распыления соединения с формулой 7. В более специфическом способе осуществления данного способа органическим растворителем является этанол. В другом способе получения соединения с формулой 7 из соединения с формулой 4 выполняется следующая процедура:(а) соединение с формулой 4, подходящий растворитель и метилсульфокислоту объединяют для образования соединения с формулой 7,причем соединение с формулой 7 оказывается растворенным в растворе;(в) соединение с формулой 7 и первый антирастворитель совместно взбалтывают для образования продукта, имеющего твердую фазу и жидкую фазу; и(г) продукт отфильтровывают и промывают вторым антирастворителем, причем второй антирастворитель является таким же или отличается от первого антирастворителя, для получения твердого конечного продукта, соответствующего формуле 7. После того, как твердый 9 конечный продукт промыт, его можно высушить любым подходящим способом или средствами. В качестве растворителя может быть использован тетрагидрофуран, а в качестве, по крайней мере, одного из антирастворителей может быть использован диэтиловый эфир, предпочтительно, по крайней мере, в качестве первого антирастворителя. Это изобретение также относится к способу получения соединения, соответствующего формуле 4 (определенного выше), из соединения, соответствующего формуле 2. При этом способе соединение, соответствующее формуле 2, при достаточных и подходящих условиях используют в реакции для образования соединения с формулой 4. В этом случае соединение с формулой 2 определено следующим образом: где каждый R3 независимо является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой, или гетероарильной группой; или, кроме того, где R1 является группой с формулой 10 где R4 и каждый R5 независимо являются алкильной группой, циклоалкильной группой,гетероциклоалкильной группой, арильной группой, или гетероарильной группой. Еще один способ осуществления настоящего изобретения относится к способу получения соединения с формулой 7, определенного выше. При этом способе с соединения, соответствующего формуле 5, снимается защита. Затем лишенное защиты соединение с формулой 5 используют в реакции при достаточных и подходящих условиях с со 002051 где каждый R3 независимо является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой, или гетероарильной группой; или, кроме того, где R1 является группой с формулой 10 где R4 и каждый R5 независимо являются алкильной группой, циклоалкильной группой,гетероциклоалкильной группой, арильной группой, или гетероарильной группой;и Х является ОН; OR7, где R7 является алкилом или арилом; галогеном; псевдогалогеном;OSO2R8, где R8 является алкилом или арилом; гетероарилом, присоединенным через гетероатом; или N-гидроксигетероциклическим радикалом, присоединенным через атом кислорода. Реакция соединений 3 и 5 дает соединение с формулой 4, описанное выше. Соединение, соответствующее формуле 4, затем преобразуют в соединение с формулой 7, например, при помощи одного из способов, описанных выше. Сведения, подтверждающие возможность осуществления изобретения Настоящее изобретение относится к способам получения ингибиторов ВИЧ-протеазы. Как указано выше, один из аспектов настоящего изобретения относится к соединениям,которые пригодны (например, в качестве исходных материалов или промежуточных соединений) для получения ингибиторов ВИЧ-протеазы. Одна из таких групп соединений идентифицирована в этой заявке при помощи формулы 3, указанной ниже: где каждый R3 независимо является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой, или гетероарильной группой; или группой с формулой 10 где R4 и каждый R5 независимо являются алкильной группой, циклоалкильной группой,гетероциклоалкильной группой, арильной группой, или гетероарильной группой;и Х является ОН; OR7 (где R7 является алкилом или арилом); галогеном; псевдогалогеном,включая азид, цианид, изоцианат и изотиоцианат; OSO2R8 (где R8 является алкилом или арилом); гетероарилом, присоединенным через гетероатом; или N-гидроксигетероциклическим радикалом, включая гидроксисукцинимид или эфир гидроксибензотриазола, присоединенным через атом кислорода, с условием, что если R1 является -СН 3, Х не может быть -ОСН 3 или -ОН,а если R1 является СН 3 С(О)-, Х не может быть-ОН; и к фармацевтически приемлемым солям и сольватам этих соединений. Предпочтительно Х является галогеном, в особенности Cl. Настоящее изобретение также направлено на новые соединения с формулой 2 где каждый R3 независимо является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой, или гетероарильной группой; или группой с формулой 10 12 где R4 и каждый R5 независимо являются алкильной группой, циклоалкильной группой,гетероциклоалкильной группой, арильной группой, или гетероарильной группой; и на фармацевтически приемлемые соли и сольваты этих соединений. Если R1 является группой с формулой 8,где R2 является алкилом, R1 может быть, например, ацетатом, пропанатом, бутанатом, триметилацетатом или любым родственным алкиловым эфиром или смешанным эфиром угольной кислоты с такой группой, как бензильная. Другие примеры R1 групп, где R1 является группой с формулой 8, включают эфиры ароматических и гетероароматических кислот, такие как бензоат,замещенный бензоат, 1- или 2-нафтоат или замещенный 1- или 2-нафтоат, или замещенный 5 или 6-членный гетероароматический эфир. Примеры R1-групп, где R1 является алкилом,включают метильную, замещенную метильную,этильную, пропильную и бутильную группы. Примеры R1, где R1 является силиловым эфиром с формулой 9, включают триметилсилил, tбутилдиметилсилил, триизопропилсилил, трифенилсилил и силиловые эфиры, где алкильные группы R3 являются какими-либо комбинациями простых алкильных и арильных групп. Примерами R1, где R1 является частью ацеталя или кеталя с формулой 10, включают ацетонид, кеталь циклогексилидена, ацеталь бензилидена,ацеталь 2-метоксиэтоксиэтила и родственные ацетали и кетали, где R4 и R5 являются алкилом,циклоалкилом, гетероциклоалкилом, арилом,или гетероарилом. В некоторых предпочтительных соединениях с формулами 2 и 3 и в их фармацевтически приемлемых солях и сольватах,R1 является -С(О)СН 3; альтернативно определенный R2 в группе с формулой 8 является СН 3. Настоящее изобретение, кроме того, направлено на различные способы получения соединений с формулами 2, 3, 4 (свободное основание нелфинавира) и 7 (нелфинавира метилсульфонат), описанные выше. Другие способы получения свободного основания нелфинавира с использованием соединений с формулами 2 и 3 описаны в заявке на патент США с серийным 08/708,607, поданной 5 сентября 1996, которая также полностью включена сюда в качестве ссылки. Сущность других способов использования соединений с формулами 2 и 3 раскрыта в патентных документах JP 95-248183 и JP 95248184, каждый из которых полностью включен сюда в качестве ссылки. В настоящей заявке применяются следующие определения. Термин "алкил" при использовании здесь относится к замещенным или незамещенным группам с прямыми или разветвленными цепями, предпочтительно, имеющим от одного до восьми, более предпочтительно от одного до шести, и наиболее предпочтительно от одного до четырех атомов углерода. Термин "C1-C6 13 алкил" означает прямую или разветвленную алкильную цепь, имеющую от одного до шести атомов углерода. Примеры С 1-С 6-алкильных групп включают метил, этил, п-пропил, изопропил, бутил, изобутил, вторичный бутил, тетрабутил, пентил, неопентил, гексил, изогексил и тому подобные. Термин "C1-C6-алкил" включает внутри этого определения термин "С 1-С 4 алкил". Термин "циклоалкил" означает замещенное или незамещенное, насыщенное или частично насыщенное, моно- или поликарбоциклическое кольцо, предпочтительно имеющее в кольце 5-14 атомов углерода. Примеры циклоалкилов включают моноциклические кольца,имеющие от 3 до 7, предпочтительно от 3 до 6,атомов углерода, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и тому подобные. Примерами циклоалкилов являются С 5-С 7-циклоалкилы, которые являются насыщенными углеводородными кольцевыми структурами, содержащими от пяти до семи атомов углерода. Термин "арил" при использовании здесь относится к ароматическому, одновалентному моноциклическому, бициклическому или трициклическому радикалу, содержащему 6, 10, 14 или 18 атомов углерода в кольце, которое может быть незамещенным или замещенным, и к которому могут быть присоединены одна или несколько циклоалкильных групп, гетероциклоалкильных групп или гетероарильных групп, которые сами по себе могут быть незамещенными или замещенными одним или более подходящими заместителями. Иллюстративные примеры арильных групп включают, но не ограничиваются ими, фенил, нафтил, антрил, фенантрил,флуорен-2-ил, индан-5-ил и тому подобные. Термин "галоген" означает хлор, фтор,бром или иод. Термин "гало" означает хлор-,фтор-, бром-, или иод-. Термин "карбоцикл" означает замещенное или незамещенное ароматическое или насыщенное или частично насыщенное 5-14 членное моноциклическое или полициклическое кольцо,которое замещено или незамещено, например,5-7-членное моноциклическое или 7-10-членное бициклическое кольцо, где все атомы кольца являются атомами углерода. Термин "гетероциклоалкильная группа" должен означать неароматический одновалентный моноциклический, бициклический или трициклический радикал, который является насыщенным или ненасыщенным, содержит 3, 4, 5, 6,7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или 18 атомов в кольце, и который включает 1, 2, 3, 4 или 5 гетероатомов, выбранных из азота, кислорода и серы, причем радикал является незамещенным или замещенным, и к которому могут быть присоединены одна или более циклоалкильных групп, арильных групп, или гетероарильных групп, которые сами по себе могут быть неза 002051 14 мещенными или замещенными. Иллюстративные примеры гетероциклоалкильных групп включают, но не ограничиваются, азетидинил,пирролидил, пиперидил, пиперазинил, морфолинил, тетрагидро-2H-1,4-тиазинил, тетрагидрофурил, дигидрофурил, тетрагидропиранил,дигидропиранил, 1,3-диоксоланил, 1,3-диоксанил, 1,4-диоксанил, 1,3-оксатиоланил, 1,3-оксатианил, 1,3-дитианил, азабицикло[3.2.1]октил,азабицикло[3.3.1]нонил,азабицикло[4.3.0]нонил, оксабицикло[2.2.1]гептил, 1,5,9-триазациклододецил и тому подобные. Термин "гетероарильная группа" должен означать ароматический одновалентный, моноциклический, бициклический или трициклический радикал, содержащий 5, 6, 7, 8, 9, 10, 11,12, 13, 14, 15, 16, 17, или 18 атомов в кольце,включая 1, 2, 3, 4 или 5 гетероатомов, выбранных из азота, кислорода и серы, который может быть незамещенным или замещенным, и к которому могут быть присоединены одна или несколько циклоалкильных групп, гетероциклоалкильных групп или арильных групп, которые сами по себе могут быть незамещенными или замещенными. Иллюстративные примеры гетероарильных групп включают, но не ограничиваются ими, тиенил, пирролил, имидазолил,пиразолил, фурил, изотиазолил, фуразанил, изооксазолил, тиазолил, пиридил, пиразинил, пиримидинил, пиридазинил, триазинил, бензо[b]тиенил, нафто[2,3-b]тиантренил, изобензофуранил, хроменил, ксантенил, феноксатиенил,индолизинил, изоиндолил, индолил, индазолил,пуринил, изохинолил, хинолил, фталазинил,нафтиридинил, хиноксиалинил, хинзолинил,бензотиазолил, бензимидазолил, тетрагидрохинолинил, циннолинил, птеридинил, карбазолил,бета-карболинил, фенантридинил, акридинил,перимидинил, фенантролинил, феназинил, изотиазолил, фенотиазинил и феноксазинил. Термин "ацил" означает L6C(O)L4, где L6 является одинарной связью, -О, или -N, и, кроме того, где L4 предпочтительно является алкилом,аминогруппой, гидроксилом, алкоксилом или водородом. Алкильные, амино- и алкоксильные группы по выбору могут быть замещенными. Примером ацила является C1-C4-алкоксикарбонил, который является прямой или разветвленной алкоксильной цепью, имеющей от одного до четырех атомов углерода, прикрепленной к карбонильной части. Примеры С 1-С 4 алкоксикарбонильных групп включают метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, и тому подобные. Другим примером ацила является карбоксигруппа, где L6 является одинарной связью, а L4 является алкоксилом, водородом или гидроксилом. Еще одним примером ацила является N-(C1-С 4)алкилкарбамоил (L6 является одинарной связью и L4 является аминогруппой),который является прямой или разветвленной алкильной цепью, имеющей от одного до четы 15 рех атомов углерода, присоединенной к атому азота карбамоильной части. Примеры N-(С 1-С 4) алкилкарбамоильных групп включают N-метилкарбамоил, N-этилкарбамоил, N-пропилкарбамоил, N-изопропилкарбамоил, N-бутилкарбамоил, и N-тетрабутилкарбамоил и тому подобные. Еще одним примером ацила является N,Nди(С 1-С 4)алкилкарбамоил, который имеет две прямые или разветвленные алкильные цепи,каждая из которых содержит от одного до четырех атомов углерода, присоединенные к атому азота карбамоильной части. Примеры N,N-диN,N-диметилкарбамоил, N,N-этилметилкарбамоил, N,N-метилпропилкарбамоил, N,N-этилизопропилкарбамоил, N,N-бутилметилкарбамоил, N,N-вторичный бутилэтилкарбамоил и тому подобные. Подходящие защитные группы известны специалистам в данной области техники. Примеры подходящих защитных групп можно найти в работе T.GreenP.Wuts, Protective Groupsin Organic Synthesis (2d ed. 1991), которая включена сюда в качестве ссылки. Термин "аралкил" при использовании здесь относится к любой замещенной или незамещенной группе, которая sр 3-гибридизована в точке присоединения, что также включает ароматическое кольцо или кольца с такой группой. Термин "псевдогалоген" при использовании здесь относится к азидам, цианидам, изоцианатам и изотиоцианатам. Термин"N-гидроксигетероциклический радикал" при использовании здесь относится к замещенным и незамещенным группам, имеющим атом кислорода в точке присоединения,который также связан с азотом азотсодержащего гетероциклического кольца или системы колец. Примеры таких групп включают Термин "алкиловый эфир" при использовании здесь относится к эфирным группам, где группа, присоединенная к этерифицированному кислороду является алкильной группой. Термин "смешанный эфир угольной кислоты" при использовании здесь относится к соединениям,содержащим функциональную группу где Ra и Rb независимо являются алкильными,арильными или аралкильными группами. Термин "сложный эфир ароматической или гетероароматической кислоты" при использовании здесь относится к карбоновым кислотам, в которых карбоксильная группа присоединена непосредственно к замещенному или незамещенному ароматическому или гетероароматиче 002051 16 скому кольцу, такому, как бензойная кислота или 2-фуранкарбоновая кислота. Термин "ДАБЦО" при использовании здесь относится к реагенту 1,4-диазабицикло[2.2.2]октану. Термин "ДБН" при использовании здесь относится к реагенту 1,5-диазабицикло[4.3.0] нон-5-ену. Термин "ДБУ" при использовании здесь относится к реагенту 1,8-диазабицикло[5.4.0] ундец-7-ену. Термин "силиловый эфир" при использовании здесь относится к группе где Rc, Rd и Re независимо являются алкильной,арильной или аралкильной группами. Термин "перфторалкансульфонат" при использовании здесь относится к алкановым эфирам сульфокислоты, где один или несколько атомов водорода заменены атомами фтора. Термин "винилалкиловый эфир" при использовании здесь относится к эфирным группам, где алкильная группа и замещенная или незамещенная олефинсодержащая группа присоединены к кислороду эфира, и олефинсодержащая группа присоединена к кислороду эфира через один из атомов углерода с двойной связью. Термин "арилсульфокислота" при использовании здесь относится к группам с формулой где Аr является замещенным или незамещенным ароматическим кольцом. Термин "остаточная группа" при использовании здесь относится к любой группе, которая отделяется от молекулы в реакции замещения при разрыве связи. Примеры остаточных групп включают, но не ограничены ими, галиды, аренсульфонаты, алкилсульфонаты и трифториды. Термин "аренсульфонат" при использовании здесь относится к любой замещенной или незамещенной группе, которая является эфиром арилсульфокислоты. Термин "алкил- или арилкарбодиимиды" при использовании здесь относится к любому реагенту с формулой Rf-N=C=N-Rg, где Rf и Rg независимо являются арилом, алкилом или аралкилом. Термин "ДМФ" при использовании здесь относится к растворителю N,N-диметилформамиду. Термин "N-МП" при использовании здесь относится к растворителю N-метил-2-пиролидинону. Термин "ТГФ" при использовании здесь относится к растворителю тетрагидрофурану. Термин "алкилтиолаты" при использовании здесь относится к замещенным или незаме 17 щенным соединениям, которые являются алкантиоловыми солями металлов. Термин "триалкилсилиловые галиды" при использовании здесь относится к соединениям,содержащим кремний, который несет 3 алкильные группы, которые могут быть одинаковыми или различными. Термин "гидрогенолиз" при использовании здесь относится к реакции, при которой одинарная связь разрывается, а к ранее связанным атомам присоединяются атомы водорода. Примеры заместителей для алкилов и арилов включают меркапто-, тиоэфирные, нитро(NО 2), амино-, арилоксильные, галогеновые,гидроксильные, алкоксильные и ацильные, а также арильные, циклоалкильные и насыщенные и частично насыщенные гетeроциклические радикалы. Примеры заместителей для циклоалкилов включают те, которые перечислены выше для алкилов и арилов, а также арильные и алкильные группы. Примеры замещенных арилов включают фениловые или нафтиловые кольца, замещенные одним или несколькими заместителями,предпочтительно- одним-тремя заместителями, независимо выбранными из гало-; гидрокси-; морфолино(С 1-С 4)алкоксикарбонильных; пиридил(С 1-С 4)алкоксикарбонильных; гало(С 1-С 4)алкильных; С 1-С 4-алкильных; С 1-С 4-алкокси-; карбокси-; C1-C4-алкоксикарбонильных; карбамоильных;N-(С 1-С 4)алкилкарбамоильных; амино-; С 1-С 4-алкиламино; ди(С 1-С 4)алкиламиногрупп; или групп с формулой -(CH2)a-R7, где "а" равно 1, 2, 3 или 4, a R7 является гидрокси-, С 1 С 4-алкокси-, карбокси-, С 1-С 4-алкоксикарбонильной, амино-, карбамоильной, С 1-С 4-алкиламино-, или ди(С 1-С 4)алкиламиногруппой. Еще одним замещенным алкилом является гало(С 1-С 4)алкил, который представляет собой прямую или разветвленную алкильную цепь,имеющую от одного до четырех атомов углерода, с присоединенными к ней 1-3 атомами галогенов. Примеры гало(С 1-С 4)алкильных групп включают хлорметил, 2-бромэтил, 1-хлоризопропил, 3-фторпропил, 2,3-дибромбутил, 3 хлоризобутил, иодтетрабутил, трифторметил и тому подобные. Еще одним замещенным алкилом является гидрокси(С 1-С 4)алкил, который представляет собой прямую или разветвленную алкильную цепь, имеющую от одного до четырех атомов углерода, с присоединенной к ней гидроксигруппой. Примеры гидрокси(С 1-С 4)алкильных групп включают гидроксиметил, 2-гидроксиэтил, 3-гидроксипропил, 2-гидроксиизопропил,4-гидроксибутил и тому подобные. Еще одним замещенным алкилом является С 1-С 4 алкилтио(С 1-С 4)алкил, который является прямой или разветвленной С 1-С 4 алкильной группой с С 1-С 4 алкилтиогруппой, присоеди 002051 18 ненной к ней. Примеры С 1-С 4 алкилтио(С 1-С 4) алкильных групп включают метилтиометил,этилтиометил, пропилтиопропил, вторичный бутилтиометил и тому подобные. Еще одним примером замещенного алкила является гетероцикл(С 1-С 4)алкил, который является прямой или разветвленной алкильной цепью, имеющей от одного до четырех атомов углерода, с присоединенным к ней гетероциклом. Примеры гетероцикл(С 1-С 4)алкилов включают пирролилметил, хинолинилметил, 1-индолилэтил, 2-фурилэтил, 3-тиен-2-илпропил, 1 имидазолилизопропил, 4-тиазолилбутил и тому подобные. Еще одним примером замещенного алкила является арил(С 1-С 4)алкил, который является прямой или разветвленной алкильной цепью,имеющей от одного до четырех атомов углерода, с присоединенной к ней арильной группой. Примеры арил(С 1-С 4)алкильных групп включают фенилметил, 2-фенилэтил, 3-нафтилпропил,1-нафтилизопропил, 4-фенилбутил и тому подобные. Гетероциклоалкилы и гетероарилы могут,например, быть замещены 1, 2 или 3 заместителями, независимо выбранными из гало-; гало(С 1-С 4)алкильных; С 1-С 4 алкильных; С 1-С 4 алкокси-; карбокси-; С 1-С 4 алкоксикарбонильных; карбамоильной; N-(С 1-С 4)алкилкарбамоильных; амино-; С 1-С 4 алкиламино-; ди(С 1-С 4) алкиламиногрупп; или групп, имеющих структуру -(CH2)a-R7, где "а" равно 1, 2, 3 или 4, a R7 является гидрокси-, С 1-С 4 алкокси-, карбокси-,С 1-С 4 алкоксикарбонильной, амино-, карбамоильной, С 1-С 4 алкиламино- или ди(С 1-С 4)алкиламиногруппами. Примеры замещенных гетероциклоалкилов включают, но не ограничиваются ими, 3-N-третбутилкарбоксамиддекагидроизохинолинил и 6N-трет-бутилкарбоксамид октагидротиено[3,2 с]пиридинил. Примеры замещенных гетероарилов включают, но не ограничиваются ими, 3 метилимидазолил, 3-метоксипиридил, 4-хлорхинолинил, 4-аминотиазолил, 8-метилхинолинил,6-хлорхиноксалинил, 3-этилпиридил, 6-метоксибензимидазолил, 4-гидроксифурил, 4-метилизохинолинил, 6,8-дибромхинолинил, 4,8-диметилнафтил, 2-метил-1,2,3,4-тетрагидроизохинолинил, N-метилхинолин-2-ил, 2-трет-бутоксикарбонил-1,2,3,4-изохинолин-7-ил и тому подобные. Термин "фармацевтически приемлемый сольват" предназначен для того, чтобы обозначать сольват, который сохраняет биологическую эффективность и свойства биологически активных компонентов соединений с формулами 2 и 3. Примеры фармацевтически приемлемых сольватов включают, но не огpаничены ими,соединения, полученные с использованием воды, изопропанола, этанола, метанола, ДМСО, 19 этилацетата, уксусной кислоты или этаноламина. В случае твердых рецептур ясно, что соединения, являющиеся предметом изобретения,могут существовать в различных формах, таких как стабильные и метастабильные кристаллические формы и изотропные и аморфные формы,которые все входят в объем настоящего изобретения. Термин "фармацевтически приемлемая соль" предназначен для того, чтобы обозначать такие соли, которые сохраняют биологическую активность и свойства свободных кислот и оснований, и которые не являются нежелательными с биологической или другой точки зрения. Примеры фармацевтически приемлемых солей включают, но не ограничиваются ими,сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, дизамещенные фосфаты, однозамещенные фосфаты, метафосфаты,пирофосфаты, хлориды, бромиды, иодиды, ацетаты, пропионаты, деканоаты, каприлаты, акрилаты, соли муравьиной кислоты, изобутираты,капроаты, гептаноаты, пропиолаты, оксалаты,малонаты, сукцинаты, соли пробковой кислоты,соли себациновой кислоты, фумараты, малеаты,бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты,хлорбензоаты, метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты, сульфонаты, ксиленсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, -гидроксибутираты, гликоляты,тартраты, метилсульфонаты, пропилсульфонаты, нафтален-1-сульфонаты, нафтален-2-сульфонаты и соли миндальной кислоты. Если соединение, являющееся предметом изобретения, является основанием, желаемую соль можно получить с использованием любого подходящего метода, известного в данной области техники, включая обработку свободного основания неорганической кислотой, такой, как хлористо-водородная кислота; бромисто-водородная кислота; серная кислота; азотная кислота; фосфорная кислота; и тому подобные, или органической кислотой, такой, как уксусная кислота; малеиновая кислота; янтарная кислота; миндальная кислота; фумаровая кислота; малоновая кислота; пировиноградная кислота; щавелевая кислота; гликолевая кислота; салициловая кислота; пиранозидиловые кислоты, такие, как глюкуроновая кислота и галактуроновая кислота; альфа-гидроксикислоты, такие как лимонная кислота и винная кислота; аминокислоты, такие как аспарагиновая кислота и глутаминовая кислота; ароматические кислоты, такие как бензойная кислота и коричная кислота; сульфокислоты, такие как паратолуолсульфокислота или этилсульфокислота; или тому подобные. 20 Если соединение, являющееся предметом изобретения, является кислотой, желаемую соль можно получить при помощи любого подходящего метода, известного в данной области техники, включая обработку свободной кислоты неорганическим или органическим основанием,таким, как амин (первичный, вторичный, или третичный), гидроокись щелочного или щелочноземельного металла, или тому подобные соединения. Иллюстративные примеры подходящих солей включают органические соли, полученные из аминокислот, таких как глицин и аргинин; аммиака; первичных, вторичных и третичных аминов; и циклических аминов, таких,как пиперидин, морфолин и пиперазин, и неорганические соли, полученные из натрия, кальция, калия, магния, марганца, железа, меди,цинка, алюминия и лития. Все соединения, являющиеся предметом изобретения, которые содержат хотя бы один хиральный центр, могут существовать в качестве отдельных стереоизомеров, рацематов, и/или смесей энантиомеров и/или диастереомеров. Все эти отдельные стереоизомеры, рацематы и их смеси входят в объем настоящего изобретения. Предпочтительно, соединения по настоящему изобретению используются в форме, которая содержит, по меньшей мере, 90% отдельного изомера (80%-ный избыток энантиомера или диастереомера), более предпочтительно, по меньшей мере, 95% (90%-ный избыток энантиомера или диастереомера), еще более предпочтительно, по меньшей мере, 97,5% (95% избыток энантиомера или диастереомера), и наиболее предпочтительно, по крайней мере, 99%(98%-ный избыток энантиомера или диастереомера). Соединения, идентифицированные здесь,как отдельные стереоизомеры означают соединения, используемые в форме, которая содержит, по меньшей мере, 90% отдельного изомера. Соединения, являющиеся предметом изобретения, могут быть получены при помощи ранее неизвестных способов по данному изобретению, которые ниже описаны в деталях. Кроме того, эти соединения могут быть использованы для получения свободного основания нелфинавира и нелфинавира метилсульфоната в соответствии со способами, являющимися предметом изобретения, описанными ниже. Схема реакции для конверсии производных 3-гидрокси-2-метилбензойной кислоты в свободное основание нелфинавира следующая:Lancaster Labs and Sugai Chemical Industries в Японии. Также кислоту 1 можно получить в соответствии с процедурой, описанной в патенте США 5,484,926 для препарата 9 С. Если R1 является ацильной группой или эфиром ароматической или гетероароматической кислоты, R1 может быть присоединен к 3 гидрокси-2-метилбензойной кислоте (стадия 1) с использованием соответствующих ацилгалоидов или ангидридов в типичных для данного типа реакций органических растворителях, таких, как галогенированные растворители, простые эфиры и углеводороды, в сочетании с основанием. Такими основаниями типично являются неорганические основания, такие, как гидроокиси, бикарбонаты и карбонаты металлов,или органические основания, такие, как амины типа триэтиламина, диэтиламина, диэтилизопропиламина, ДАБЦО, или родственные ди- или триалкиламины, а также амидиновые основания типа ДБУ и ДБН. Эти реакции обычно происходят при любых температурах от температуры ниже комнатной до примерно 100 С. Альтернативно, этерификация может быть катализирована кислотами, такими, как серная кислота, при использовании в сочетании с ангидридами. Если R1 является эфирной группой, R1 может быть присоединен при создании условий,при которых используется соответствующая R1 группа, связанная с остаточной группой, которая впоследствии замещается. Эти реакции обычно выполняют в наиболее обычных органических растворителях, таких, как ТНФ, диэтиловый эфир, диоксан, метил-трет-бутиловый эфир, или другие простые эфиры; сложные эфиры, такие, как этил-, метил- и изопропилацетат; галогенированные растворители, такие как галогенированные метан и этан, хлорбензол и другие галогенированные бензолы; нитрилы,такие, как ацетонитрил и пропионитрил; низшие спирты, такие как этанол, изопропанол, третбутанол и родственные спирты; и полярные органические растворители, такие как диметилформамид, диметилсульфоксид, N-метил-2 пиролидинон и родственные амидсодержащие растворители. Такой процесс обычно сочетается с основанием. Основания обычно являются неорганическими основаниями, такими как гидроокиси, бикарбонаты и карбонаты металлов, или органическими, такими как амины типа триэтиламина, диэтиламина, диэтилизопропиламина,ДАБЦО или родственные ди- или триэтиламины, а также амидиновые основания типа ДБУ и ДБН. Эти реакции обычно проходят при любых температурах - от температуры ниже комнатной до примерно 100 С. Если R1 является силиловым эфиром, его можно присоединить с использованием соответствующих силиловых галоидов или перфторалкансульфонатов в наиболее типичных органических растворителях, таких как ТНФ, диэтило 002051 22 вый эфир, диоксан, метил-трет-бутиловый эфир или другие простые эфиры; сложные эфиры,такие, как этил-, метил- и изопропилацетат; галогенированные растворители, такие как галогенированные метан и этан, хлорбензол и другие галогенированные бензолы; нитрилы, такие как ацетонитрил и пропионитрил; и полярные органические растворители, такие как диметилформамид, N-метил-2-пиролидинон и родственные амидсодержащие растворители. Такой процесс обычно сочетается с основанием. Основания обычно являются неорганическими основаниями, такими как гидроокиси, бикарбонаты и карбонаты металлов, или органическими основаниями, такими как амины типа триэтиламина,диэтиламина, диэтилизопропиламина, ДАБЦО или родственные ди- или триэтиламины, а также амидиновые основания типа ДБУ и ДБН. Если R1 является частью ацеталевой или кеталевой группы, R1 может быть встроен путем алкилирования с соответствующим -галоэфиром способом, сходным с описанным выше для других галоидных алкилов. Альтернативно, может быть использовано промотируемое кислотой присоединение 3-гидрокси-2-метилбензойной кислоты к соответствующему простому алкиловому эфиру винилового спирта. Эти реакции промотируются как органическими кислотами (такими, как паратолуолсульфокислота и родственные алкил- и арилсульфокислоты,трифторуксусная кислота и родственные органические карбоновые кислоты с рК менее 2), так и неорганическими кислотами (такими как серная, хлористо-водородная, фосфорная и азотная кислоты). Группу Х встраивают на стадии 2 путем реакции с производным карбоновой кислоты 2. Галоидные ацилы с формулой 3 могут быть получены при использовании неорганических галогенирующих агентов, таких, как тионилхлорид или тионилбромид, треххлористый или трехбромистый фосфор, пятихлористый или пятибромистый фосфор, или органических агентов, таких, как оксалилхлорид или трихлорфульминуровая кислота. Этот процесс может быть катализирован припомощи ДМФ или родственных алкиламинов. Сложные эфиры с формулой 3 могут быть получены различными способами, начиная с хлорида кислоты (соединение с формулой 3),путем сочетания с желаемым спиртом в присутствии органического или неорганического основания, определенного ранее. Альтернативно,сложный эфир может быть получен путем промотируемой кислотой этерификации в присутствии желаемого спирта. Сульфонаты обычно получают путем реакции производных карбоновой кислоты (соединения с формулой 2) с алкил- или арилсульфонилхлоридами в присутствии органического аминового основания, такого, как триэтиламин, в неполярном растворителе при температурах ниже 0 С. Производные псев 23 догалогенов обычно получают из галоидангидридов (соединения с формулой 3) путем реакции с неорганическими псевдогалоидами в присутствии основания. Производные гетероарилов(соединения с формулой 2) также получают из галоидангидридов с формулой 3, используя специфическое гетероарильное соединение в присутствии аминового основания в неполярном растворителе.N-гидроксигетероциклические производные могут быть получены из галоидангидридов с формулой 3, приведенной выше, и также могут быть получены с использованием алкил- или арилкарбодиимидов и аминового основания в качестве конденсирующих агентов. Сочетание соединения 3 с амином 6 (стадия 3) может быть выполнено многими способами, в зависимости от вида X. Если используют свободную кислоту (X = ОН), сочетание может быть выполнено с применением способов на основе карбодиимидов с использованием любых обычных реагентов этого класса, включая дициклогексилкарбодиимид или родственные диалкилкарбодиимиды, ЭДК (соли 1-(3 диметиламинопропил)-3-этилкарбодиимида) или родственные водорастворимые реагенты вместе с органическим аминовым основанием в полярных органических растворителях, таких,как диоксан, ДМФ, N-МП и ацетонитрил в присутствии N-гидроксигетероциклических соединений, включая гидроксисукцинимид или эфирN-гидроксибензотриазола. Если Х является галогеном или псевдогалогеном, сочетание может быть выполнено в большинстве обычных органических растворителей, таких, как ТГФ; диэтиловый эфир, диоксан, метил-трет-бутиловый эфир или другие простые эфиры; ацетон, циклогексанон, метилизобутилкетон и другие кетоны; сложные эфиры, такие как этил-, метил- и изопропилацетат; галогенированные растворители,такие, как галогенированные метан и этан; хлорбензол и другие галогенированные бензолы; нитрилы, такие как ацетонитрил и пропионитрил; низшие спирты, такие как этанол, изопропанол, трет-бутанол и родственные спирты; и полярные органические растворители, такие как диметилформамид, диметилсульфоксид, Nметил-2-пиролидинон и родственные амидсодержащие растворители. Часто используют основание, и оно может быть любым из множества неорганических оснований (таких как гидроокиси, бикарбонаты и карбонаты металлов) или органических оснований (таких как амины типа триэтиламина, диэтиламина, диэтилизопропиламина, ДАБЦО или родственные ди- или триалкиламины, а также амидиновые основания типа ДБУ и ДБН). Удаление защитной группы выполняют с использованием любого из стандартных методов для снятия защиты определенным классом защитных групп. Сложные эфиры и карбонаты обычно удаляют водными или спиртовыми растворами неорганических оснований, таких как 24 гидроокиси, карбонаты и бикарбонаты металлов, при температурах окружающей среды до 100 С. Защиту в виде простых эфиров снимают с использованием борсодержащих кислых соединений по Льюису, таких как Вbr3 и ВСl3, алкилтиолятов или триалкилсилиловых галоидов. Как эфирные, так и карбонатные защитные группы, которые содержат бензильные группы,связанные с гетероатомами, могут быть удалены путем гидрогенолиза с палладиевым или платиновым катализатором. Защитные группы на основе ацеталя могут быть удалены в условиях водных или спиртовых кислых растворов с использованием в качестве промоторов кислот Льюиса, таких как галоиды переходных металлов или галоиды металлов 3 группы, или являющихся донорами протонов органических кислот (таких, как паратолуолсульфокислота и родственные алкил- или арилсульфокислоты,трифторуксусная кислота и родственные органические карбоновые кислоты с рК менее 2) и неорганических кислот (таких как серная, хлористо-водородная, фосфорная и азотная кислоты). Удаление защитной группы типа простого силилового эфира может быть выполнено при помощи водного или спиртового раствора кислоты или основания или при помощи промотируемого ионом фтора десилилирования с использованием неорганических источников фтора, таких как фториды калия или цезия, или фтористых солей тетраалкиламмония. Нелфинавира метилсульфонат может быть получен из 3-ацетокси-2-метилбензоилхлорида(хлорид кислоты). Хлорид кислоты может быть получен из соответствующей 3-гидрокси-2 метилбензойной кислоты при помощи следующей двухстадийной процедуры: При получении хлорида кислоты кислоту 1 конвертируют в ацетоксикислоту (соединение с формулой 2), которое обрабатывают тионилхлоридом для получения 3-ацетокси-2-метилбензоилхлорида с хорошим выходом. Хлорид кислоты затем сочетают с амином 6 при классических условиях, что приводит к получению свободного основания нелфинавира следующим образом: Хлорид кислоты обрабатывают амином 6 в присутствии триэтиламина в ТНФ при температуре окружающей среды в течение 30 мин с последующим основным гидролизом ацетатной группы для получения свободного основания нелфинавира. Свободное основание может быть 25 конвертировано в нелфинавира метилсульфонат способами, более детально описанными ниже. Получение свободного основания нелфинавира из хлорида 3-ацетокси-2-метилбензойной кислоты Сущность процесса Чтобы получить 3-ацетокси-2-метилбензоилхлорид, из 3-гидрокси-2-метилбензойной кислоты получали пасту в уксусной кислоте с уксусным ангидридом и каталитическим количеством серной кислотой. Ацетилирование гидроксигруппы завершалось в течение 2 ч при температуре внешней среды. После завершения реакции образовавшуюся пасту переносили в воду, и продукт выделяли путем фильтрования. Влажный отжатый осадок повторно разводили до пастообразного состояния в воде, выделяли путем фильтрации и высушивали под вакуумом. Продукт был получен с 80-90%-ным выходом при кажущейся чистоте 89-92% по данным высокоэффективной жидкостной хроматографии(ВЭЖХ). Неочищенную сухую 3-ацетокси-2 метилбензойную кислоту растворяли в четырех объемах этилацетата с обратным холодильником. Образующийся раствор охлаждали до 70 С, и добавляли пять объемов гексана. Смесь возвращали в систему с обратным холодильником, а затем охлаждали до 10 С в течение 1 ч. Пасту фильтровали, промывая реактор фильтратом. Продукт высушивали под вакуумом. Перекристаллизация повышала кажущуюся чистоту по данным УФ ВЭЖХ с 89-92% до 98%. Уровень наибольшего загрязнения снижался с 4-5% до 0,5%. Продуктом была 3 ацетокси-2-метилбензойная кислота. 3-Ацетокси-2-метилбензойную кислоту переводили в пастообразное состояние в метилтрет-бутиловом эфире (МТБЭ) и обрабатывали 1,2 эквивалентами тионилхлорида и каталитическим количеством диметилформамида. Через три часа при температуре окружающей среды реакция завершалась, давая коричневый раствор. Растворитель (МТБЭ) удаляли путем вакуумной перегонки. Остаточный тионилхлорид удаляли путем добавления толуола с последующей вакуумной перегонкой. Результирующий 3-ацетокси-2-метилбензоилхлорид выделяли либо непосредственно в виде масла, либо путем кристаллизации из двух объемов гептана при 10 С. Продукт получали с 100%-ным выходом при выделении в виде масла и 82-85%ным выходом при кристаллизации из гептана. Чтобы получить соединение 6 для сочетания, соединение с формулой 5 (полученное какNaOH, чтобы расщепить защитную группу CBZ с образованием соединения с формулой 6. Добавляли воду и HCl, чтобы растворить Na2CO3 и нейтрализовать избыток NaOH, получая двухфазную смесь. Смесь охлаждали, и нижний водный слой удаляли. Добавляли триэтиламин, а затем - раствор 3-ацетокси-2-метилбензоилхлорида в тетрагидрофуране, чтобы получить ацетат соединения с формулой 4. Добавляли водный раствор NaOH, и смесь нагревали с обратным холодильником, чтобы получить соединение с формулой 4. Смесь концентрировали при атмосферном давлении, чтобы удалить тетрагидрофуран, триэтиламин и большую часть этанола. Смесь добавляли к нагретому раствору воды и ледяной уксусной кислоты, чтобы преципитировать продукт. рН регулировали дополнительным количеством кислоты, и твердые вещества отфильтровывали в горячем состоянии. Влажный отжатый осадок промывали горячей водой и высушивали с получением сырого свободного основания нелфинавира. Этот способ более детально описан ниже. Получение 3-ацетокси-2-метилбензойной кислотыFW 152,15 Уксусная кислота Серная кислота Уксусный ангидрид FW 102,1 d 1.082 Очищенная вода Уксусную кислоту (8750 мл), 3-гидрокси 2-метилбензойную кислоту (3500 г) и серную кислоту (70 мл) загружали в реактор объемом 22 л. Содержимое реактора перемешивали для получения гомогенной смеси. За счет экзотермической реакции смесь нагревалась до 36 С. К смеси в 22 литровом реакторе добавляли уксусный ангидрид (2390 мл). Выделяющееся тепло нагревало содержимое реактора от 36 до 44 С. Реакционную смесь перемешивали при температуре окружающей среды в течение двух часов(содержимому реактора давали медленно остыть). Реакцию проверяли на полноту конверсии исходного материала при помощи тонкослойной хроматографии. После завершения реакции реакционная смесь обычно представляла собой желтовато-коричневую пасту. Очищенную воду (17500 мл) добавляли в экстрактор на 50 л, и к этой воде добавляли реакционную смесь из реактора на 22 л. Реактор на 22 л промывали очищенной водой (3500 мл) в экстрактор на 50 л. Реакционную смесь под 27 вергали вакуумной фильтрации, промывая реактор и влажный осадок на фильтре очищенной водой (3500 мл). Влажный осадок с фильтра переносили в экстрактор на 50 л и добавляли очищенную воду (14000 мл) при перемешивании до получения гомогенной пасты. Повторно переведенную в пастообразное состояние смесь подвергали вакуумной фильтрации, а реактор и влажный отжатый осадок на фильтре промывали очищенной водой (3500 мл). Из отжатого осадка на фильтре, насколько это возможно,вытягивали влагу, затем переносили на сушильные сковороды. Продукт сушили в вакуумном термостате при 60-80 С и 28 мм рт.ст. в течение 12-72 часов. Теоретический выход: 4466 г. Реально полученный вес: 3910 г (87.6%). Проба ВЭЖХ: 89,4% или 87,7%. Очистку производили следующим образом. Неочищенную 3-ацетокси-2-метилбензойную кислоту (3910 г, полученные в вышеуказанном способе) и этилацетат (16,0 л) загружали в реактор на 50 л. Содержимое реактора нагревали с обратным холодильником (77 С) до тех пор, пока все твердые вещества не переходили в раствор. Содержимое реактора охлаждали до 70 С. В реактор добавляли гексан (19,5 л). Содержимое реактора вновь нагревали с обратным холодильником (69 С), а затем смесь охлаждали до 10 С в течение 1 ч. Охлажденную пасту,полученную на этой стадии, подвергали вакуумной фильтрации, а реактор промывали холодными исходными жидкостями. Влажный отжатый осадок высушивали, насколько это было возможно, и затем переносили на сушильные сковороды. Продукт высушивали в вакуумном термостате при 60-70 С и 28 мм рт.ст. в течение 12-72 ч. Теоретический выход: 3910 г. Реальный полученный вес: 3128 г (80%). Эта процедура повышает кажущуюся чистоту, определенную с использованием УФ ВЭЖХ, с 8992% до 98%. Отдельное наибольшее загрязнение снизилось с 4-6% до 1%. Выделенный продукт является желтовато-коричневым твердым веществом. 1H ЯМР 8.0 (d, 1H), 7.3 (нечетко, m, 2 Н), 2.5 (s, 3H), 2.3 (s, 3 Н). Получение 3-ацетокси-2-метилбензоилхлорида(12000 мл) и диметилформамидом (60 мл). Содержимое реактора перемешивали для получения гомогенной смеси. В реактор добавляли тионилхлорид (1350 мл). Эту реакционную смесь перемешивали при температуре внешней среды в течение 19 ч. (Обычно для завершения реакции требовалось не более 3 ч, но смесь можно было выдерживать дольше для удобства). Реакционный раствор переносили в ротационный испаритель Бючи, а реактор орошали толуолом (1500 мл). Раствор концентрировали,насколько это было возможно, поддерживая температуру ванны 40-50 С. К этому концентрированному раствору добавляли толуол (6000 мл). Толуол перегоняли при помощи ротационного испарителя для удаления избытка тионилхлорида. Концентрат переносили обратно в реактор на 22 л, а колбу Бючи промывали гептаном (6000 мл). Гептановую смесь охлаждали до 5 С под азотом. После выдерживания кристаллизационной смеси при 5 С в течение 30 минут, смесь фильтровали, и отфильтрованный осадок промывали охлажденным гептаном(1500 мл, 5 С). Осадок на фильтре высушивали в вакуумном термостате при 15-20 С и 28 мм рт.ст. в течение 24 ч, получая желто-коричневое,гранулярное твердое вещество. Теоретический выход: 3285 г. Реально полученный вес: 2704 г(82.3%). Исследование с помощью ВЭЖХ 97.51%; 1H ЯМР 8,1 (d, 1H), 7.4 (нечетко m,2H), 2.4 (s, 6H). Взаимодействие 3-ацетокси-2-метилбензоилхлорида и соединения 6 с получением свободного основания нелфинавира Схема реакции Стадия А. Конверсия соединения 5 в соединение 6. Процедура. Материалы 3-Ацетокси-2 метилбензойная кислота Метил-t-бутиловый эфир Тионилхлорид Диметилформамид Толуол Гептан(2 л, дистиллированая). Смесь перемешивали и нагревали с обратным холодильником (8082 С). Все твердые вещества растворялись при 50 С с образованием прозрачного желтого раствора. Смесь становилась мутной из-за преципитации Nа 2 СО 3, когда происходила реакция(объем = 8280 мл). Депротекцию регистрировали при помощи высокоэффективной жидкостной хроматографии. Анализ через 210 мин показал полный расход соединения с формулой 5,0,95% оксазолидинона, 36% бензилового спирта и 62,5% соединения с формулой 6. Анализ через 30 300 мин показал 0,34% оксазолидинона, 36% бензилового спирта и 62,6% соединения с формулой 6. Для растворения всех твердых веществ к смеси добавляли воду (1260 мл), и смесь охлаждали до 67 С (объем = 9450 мл). Затем к смеси добавляли HCl (344 мл, 6 N, 2,06 моль, 1,2 экв). Смесь взбалтывали в течение 10 мин и затем давали отстояться в течение 20 мин с образованием двух слоев (объем = 9884 мл). Нижний водный слой с Nа 2 СО 3 удаляли при 60 С. Объем водной части был равен 365 мл, рН = 14. рН верхнего прозрачного светло-желтого слоя был 10-10,5. Верхний слой без дальнейшей обработки использовали в следующей стадии. Химические соединения Соединение 6/этил. спирт Триэтиламин Тетрагидрофуран 3-Ацетокси-2-метилбензоил хлорид Ссылка: Источник Анализ Кг 1040-090 Раствор из стадии А охлаждали до 25 С, к раствору добавляли триэтиламин (360 мл, 2,58 моль, 1,50 экв), и смесь охлаждали до 7 С (рН = 11,5-12,0). Смесь становилась мутной при 23 С(объем = 9879 мл). Эту смесь загружали к смеси 3-ацетокси-2-метилбензоилхлорида (388,5 г,98,8%, 1,81 моль, 1,05 экв) и тетрагидрофурана(440 мл) в течение 5 мин. ТГФ (10 мл) использовали для завершения переноса. Наблюдалось нагревание за счет выделения тепла на 7,4 С. Смесь в конце добавления становилась молочно-белой. (Объем = 10,717 мл). Анализ при помощи ВЭЖХ через 30 мин показал присутствие 0,2% соединения с формулой 6, 77% ацетата соединения с формулой 4, 18,2% бензилового спирта и отсутствие сложного эфира. Молочнобелую смесь использовали на следующей стадии без дополнительной обработки. Химические соединения Ацетат соединения 4/РАNaOH (50%, 364 мл, 6,88 моль, 4,0 экв) добавляли к смеси из стадии Б. Молочно-белая смесь становилась прозрачной, затем - мутной,светло-коричневой. Смесь взбалтывали при 20 С в течение 35 мин. ВЭЖХ показала присут Кг ствие 15,9% бензилового спирта, 78,6% соединения 4, и отсутствие ацетата (объем= 11,081 мл). Смесь нагревали с обратным холодильником и частично концентрировали путем открытой перегонки, пока температура не достигала 31 82 С. Объем дистиллята составлял 4275 мл. рН смеси был равен 14. Измеряли объем перегнанной жидкости (объем=6000 мл). Воду (5 л) и уксусную кислоту (100 мл) загружали в круглодонную колбу на 12 л с тремя шейками, снабженную датчиком температуры и механической мешалкой. Раствор нагревали до 54 С (рН = 2-2,5) (объем = 5100 мл). Половину смеси, содержащей соединение 4, полученной выше (3 л), добавляли к этому теплому водному раствору уксусной кислоты для преципитации мелких частиц твердого вещества. Затем рН доводили до 7-7,5 уксусной кислотой (19 мл), а температура была 53 С (объем = 8119 мл). Твердые вещества отфильтровывали при 53 С с использованием изолированного вакуума. Фильтрация была быстрой и легкой. Реактор и отфильтрованный осадок промывали теплой(35 С) водой (2,5 л), и фильтраты объединяли. Из влажного отфильтрованного осадка вытягивали воду в течение 15-20 мин. 32 Воду (5 л) и уксусную кислоту (100 мл) вновь загружали в круглодонную колбу с тремя шейками объемом 12 л. Раствор нагревали до 41 С (объем 5100 мл). Оставшуюся половину реакционной смеси с соединением 4 (3 л) добавляли к новому теплому раствору уксусной кислоты для преципитации мелких частиц твердого вещества. Затем рН доводили до 7-7,5 уксусной кислотой (15 мл). Температура была 44 С(объем 8115 мл). Твердые вещества отфильтровывали при 53 С с использованием изолированного вакуума. Фильтрация была быстрой и легкой. Реактор и отфильтрованный осадок промывали теплой (35 С) водой (2,5 л), и фильтраты объединяли. Из влажного отфильтрованного осадка вытягивали воду в течение 15-20 мин. Два влажных отфильтрованных осадка(3587 г) высушивали под вакуумом при 60 С в течение 90 часов с получением неочищенного Соединения 4 с сухим весом 1075,38 г. Теоретический выход 977 г. Стадия Г. Очистка соединения 4 Химические соединения Источник Анализ Кг Л Сырое соединение 4 895-131 91,82% 290 г Ацетон Фишер 4038 г 5105 Вода Дист. 1070 г 1070 Целит Олдрич 29 г Активированный уголь Darco Фишер 44 гG-60 Круглодонную колбу с 3-мя шейками на 12 л, снабженную холодильником, температурным датчиком и механической мешалкой, загружали неочищенным соединением 4 (290 г, 92%, 469 ммоль), активированным углем (Darco G-60, 44 г), ацетоном (4305 мл) и водой (870 мл, диcт.). Смесь нагревали с обратным холодильником(объем = 5509 мл). Горячую пасту фильтровали через целит (29 г) с использованием изолированного вакуума. Реактор и отфильтрованный осадок промывали ацетоном (200 мл), и прозрачные светло-желтые фильтраты объединяли. Смеси давали медленно остыть до 25 С в течение 2.5 ч при перемешивании для преципитации мелких частиц белого твердого вещества (объем= 5665 мл). Белую пасту охлаждали до 0-10 С и выдерживали в течение 1 часа. Твердые вещества отфильтровывали с использованием изолированного вакуума, а уровень жидкости отсасывали через поверхность влажного отфильтрованного осадка. Реактор и влажный осадок промывали холодной (0-10 С) смесью ацетона/воды(2:1, 300 мл). Жидкость отсасывали через поверхность влажного отфильтрованного осадка, и реактор и отфильтрованный осадок вновь промывали холодной (0-10 С) смесью ацетона/воды(2:1, 300 мл). Из влажного осадка отсасывали жидкость, насколько это было возможно, с использованием изолированного вакуума и рези нового каптажа с получением сухого веса 581 г. Продукт высушивали под вакуумом при 65 С в течение 16 ч с получением соединения 4 с сухим весом 221.61 г. Теоретический выход был 266.28 г. ВЭЖХ и ROI анализы показали 99% и 0,14%, соответственно. Установленный выход был 82%. Настоящее изобретение также направлено на новые способы конвертирования свободного основания нелфинавира, соединения 4, в нелфинавира метилсульфонат, соединение 7. Эти способы более детально описаны ниже, включая способ получения соединения 4 из соединения 5 и способ получения соединения 5. Процедура получения соединения 5 Один эквивалент 2S,3R-N-Сbz-3-амино-1 хлорфенил-сульфанилбутан-2-ола (который может быть приобретен в Корпорации Канека или получен, как описано в патенте США 5,484,926) перемешивают в достаточном объеме метанола, этанола, изопропанола, или спиртовых растворителях с низкой температурой ки 33 пения при 20-45 С. Предпочтительным растворителем является изопропанол. Небольшой недостаток щелочного основания, такого как гидроокись натрия или гидроокись калия, как в виде водного раствора, так и в виде твердого вещества, добавляли к этой смеси при перемешивании. Предпочтительным основанием является 10N гидроокись натрия. Смесь перемешивали от 30 мин до 24 ч до завершения образования эпоксида. Когда период перемешивания заканчивался, рН доводили до 6-7 кислотой, являющейся донором протонов, такой, как HCl, либо чистой, либо растворенной в реакционном растворителе. Небольшой избыток 3S,4 аR,8 аR-3-N-третбутилкарбоксамидодекагидроизохинолина (который может быть получен так, как описано в патенте США 5,256,783, который включен сюда полностью в качестве ссылки) добавляли либо в виде твердого вещества, либо пасты к реакционной смеси, и смесь нагревали до 40 С с обратным холодильником в течение 12-24 ч или до тех пор, пока не принималось решение, что реакция завершена. Альтернативно, 3S,4 аR,8 аR3-N-трет-бутилкарбоксамидодекагидроизохинолин мог быть введен в реакцию в то же самое время, когда в реактор загружали 2S,3R-N-Cbz3-aмино-1-хлорфенилсульфанилбутан-2-ол. Образованию эпоксида давали произойти, как описано. В этом случае, реакционную смесь не нейтрализовали до рН 6-7, но добавляли фиксированное количество дающей протоны кислоты для нейтрализации оставшегося избытка основания. В любом случае реакционную смесь частично концентрировали в вакууме. Смесь разводили эквивалентным объемом воды и нагревали с обратным холодильником. Альтернативно,реакционную смесь полностью концентрировали, и добавляли ацетон или другой кетонный растворитель. Смесь в этот момент можно было отфильтровать, затем добавляли эквивалентное количество воды, и смесь нагревали. Образующуюся смесь охлаждали при перемешивании. Образовавшуюся пасту фильтровали, промывали водным растворителем и высушивали с выходом соединения 5. Процедура получения свободного основания нелфинавира (соединение 4) Кроме процедуры, описанной выше, следующая процедура может быть использована для конверсии соединения 5 в свободное основание нелфинавира (соединение 4). Один эквивалент соединения 5, избыток щелочного основания (такого, как гидроокись натрия или гидроокись калия) и спиртовой рас 002051 34 творитель (такой, как метанол, этанол или изопропанол) объединяют, и смесь нагревают с обратным холодильником при перемешивании. Предпочтительным основанием является 50%ная каустическая сода, а изопропанол является предпочтительным растворителем. Для повышения растворимости основания может быть добавлена вода. Если реакцию признают завершенной, смесь охлаждают с 30 до 35 С, а нижний водный слой, если он есть, может быть удален. Смесь охлаждают до температуры ниже 25 С, и добавляют избыточное количество органического основания (такого, как диизопропилэтиламин или триэтиламин). Триэтиламин является основанием выбора. Раствор избытка 3-ацетокси-2-метилбензоилхлорида в метаноле, этаноле, изопропаноле,ТГФ или других спиртовых растворителях медленно добавляют к холодной смеси при перемешивании. ТГФ является предпочтительным растворителем. Добавляют избыток щелочного основания,такого, как гидроокись натрия или гидроокись калия, и смесь нагревают до 40 С с обратным холодильником при перемешивании. Предпочтительным основанием является 50%-ная каустическая сода. Когда реакцию признают закончившейся, смесь охлаждают, и нижний водный слой удаляют. Реакционную смесь частично концентрируют в вакууме. Если признано необходимым,смесь можно развести спиртовым растворителем для облегчения перемешивания. Метанол является предпочтительным растворителем. Смесь добавляют к водному раствору кислоты для образования пасты. НСl является предпочтительной кислотой. рН доводят до 7-8 водным раствором кислоты. Пасту фильтруют и промывают водой. Влажный отфильтрованный осадок можно повторно развести водой до пастообразного состояния. Неочищенный продукт высушивают (частично или полностью) или его можно взять в следующую стадию влажным. Как сухой, так и влажный неочищенный продукт растворяют в водном растворе ацетона с обратным холодильником в присутствии активированного угля. Горячую смесь фильтруют,добавляют воду, и всю смесь охлаждают при перемешивании с образованием пасты. Пасту фильтруют, промывают водным раствором ацетона и высушивают с получением свободного основания нелфинавира. Другие способы получения свободного основания нелфинавира раскрыты в патенте США 5,484,926 и находящейся в процессе одновременного рассмотрения патентной заявке США авторов изобретения S.Babu, B.Borer,T.Remarchuk, R.Szendroi, K.Whitten, J.Busse иK.Albizati, озаглавленной "Методы получения ингибиторов ВИЧ-протеазы и промежуточных соединений для получения ингибиторов ВИЧпротеазы",патентная заявка США 35 08/708,607, зарегистрированная 5 сентября 1996,которая включена сюда полностью в качестве ссылки. Процедура сушки распылением свободного основания нелфинавира с получением нелфинавира метилсульфоната Обычно свободное основание нелфинавир может быть конвертировано в нелфинавира метилсульфонат с использованием нижеследующей новой процедуры сушки распылением. Свободное основание нелфинавир и органический растворитель (такой как метанол, этанол, изопропанол, ТГФ, ацетон или МIВК) смешивают в подходящем сосуде и добавляют эквивалентное количество метилсульфокислоты. Предпочтительным растворителем является этанол. Смесь перемешивают до тех пор, пока не образуется нелфинавира метилсульфонат. Образующуюся пасту или раствор перекачивают в распылительную сушилку, причем устанавливаются следующие параметры: Температура на входе: 100-190 С. Температура на выходе: 60-120 С. Тип распылителя: крыльчатый, совместный поток или противоток Скорость высыхания газа: зависит от масштаба оборудования Температуры на входе и выходе, скорость подачи и тип распылителя могут быть подобраны для оптимизации выхода и распределения частиц по размерам. Высушенный распылением нелфинавира метилсульфонат собирают на выходе распылительной сушилки. Специфически эту конверсию производили как описано ниже. 19,4 кг 5% спирта (USP,190 крепость) и 6,00 кг 1% свободного основания нелфинавира помещали в чистый, сухой контейнер из нержавеющей стали на 20-40 л. Смесь перемешивали до гомогенности, затем добавляли 1,04 кг 1% метилсульфокислоты,99%. Смесь перемешивали до растворения всех твердых веществ. Фильтровальный картридж на 0,2 мкм присоединяли к входу насоса, и спиртовой раствор прокачивали через фильтр в распылительную сушилку, на которой были установлены следующие начальные параметры: Температура на входе: 160 С. Температура на выходе: 90 С. Тип маховика: 50 мм крыльчатое колесо. Скорость маховика: 27000 об/мин. Скорость высушивания газа: 75 кг/ч. Температуры на входе и выходе, скорость подачи и тип распылителя могут быть подобраны для оптимизации выхода и распределения частиц по размерам. Использовавшейся специфической распылительной сушилкой была портативная распылительная сушилка Niro Atom 002051izer, тип НТ (оборудованная для инертного газа), соединенная с фильтром из активного угля для удаления остатков органического растворителя. После того как объем раствора высушивали распылением, бак для смешивания промывали в распылительную сушилку 1,0 кг 5% спирта, USP, крепость 190. Высушенный при распылении нелфинавира метилсульфонат собирали с 80-100% от теоретического выхода. Процедура преципитации свободного основания нелфинавира для получения нелфинавира метилсульфоната Альтернативно, свободное основание нелфинавира может быть конвертировано в нелфинавира метилсульфонат с использованием нижеследующей новой процедуры преципитации. Свободное основание нелфинавира переводили в пастообразное состояние или растворяли в подходящем растворителе (таком как ТГФ, метанол или этанол). Предпочтительным растворителем является ТГФ. Добавляли эквивалентное молярное количество метилсульфокислоты, и смесь перемешивали до тех пор, пока все твердые вещества не растворялись. Раствор добавляли к нескольким объемам антирастворителя (такого как метил-трет-бутиловый эфир, диэтиловый эфир, гексан или гептан), который быстро перемешивали. Диэтиловый эфир является предпочтительным растворителем. После перемешивания смесь фильтровали и промывали антирастворителем. Твердое вещество высушивали в вакуумном термостате с выходом нелфинавира метилсульфоната. Специфически, эту конверсию выполняли как описано ниже. Свободное основание нелфинавира (10,2 кг, 18,0 моль) и 24 л тетрагидрофурана добавляли в реактор на 100 л. Метилсульфокислоту (1,8 кг, 18,48 моль) также добавляли в реактор. Реактор перемешивали до тех пор, пока все твердые вещества не растворялись, а затем раствор фильтровали в полипропиленовую цистерну на 100 галлонов, содержащую 306 л метил-третбутилового эфира или диэтилового эфира, который быстро перемешивали. После перемешивания в течение 2 ч содержимое цистерны на 100 галлонов фильтровали, промывали 17 л метилтрет-бутилового эфира или диэтилового эфира,и вытягивали жидкость настолько, насколько это было возможно. Твердое вещество переносили во вращающуюся коническую сушилку и высушивали в вакуумном термостате при 6065 С (уровень вакуума минимум 660 мм рт.ст. или более высокий) в течение 12-72 ч или до тех пор, пока содержание метил-трет-бутилового эфира или диэтилового эфира в высушенном твердом веществе не становилось ниже 1%.Eсли было необходимо, содержимое сушилки можно было размолоть на мельнице Fitzmill для ускорения высыхания. Типичные выходы не 37 лфинавира метилсульфоната варьировали от 9 до 11 кг (76%-92% теоретического выхода). В этой заявке заявители описали некоторые теории и механизмы реакций, пытаясь объяснить, как и почему это изобретение работает так, как оно работает. Эти теории и механизмы представлены только с целью информации. Заявители не связаны какой-либо определенной химической, физической или механической теорией действия. Хотя изобретение было описано в отношении различных предпочтительных способов осуществления изобретения с использованием специфических примеров, специалисты в данной области техники поймут, что могут быть произведены различные изменения и модификации без отклонения от смысла и объема изобретения, которые определены в прилагаемой формуле изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения с формулой (7) включающий превращение соединения с формулой (4)(б) приведения соединения с формулой (4) в контакт с метилсульфокислотой для образования соединения с формулой (7) и(в) высушивания распылением соединения с формулой (7). 2. Способ по п.1, отличающийся тем, что органическим растворителем является этанол. 3. Способ по п.1, дополнительно включающий превращение соединения с формулой где R1 является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой или гетероарильной группой; или группой с формулой 38 где R2 является алкильной группой, циклоалкильной группой, гетероциклоалкильной группой или О-R6,где R6 является алкильной группой, аралкильной группой или арильной группой; или, кроме того, где R1 является группой с формулой где каждый R3 независимо является алкильной группой, циклоалкильной группой,гетероциклоалкильной группой, арильной группой, или гетероарильной группой; или, кроме того, где R1 является группой с формулой где каждый R4 и каждый R5 независимо являются алкильной группой, циклоалкильной группой,гетероциклоалкильной группой,арильной группой или гетероарильной группой; и Х является ОН;OR7, где R7 является алкильной или арильной группой; галогеном; азидом, цианидом, изоцианатом или изотиоцианатной группой;OSO2R8, где R8 является алкильной или арильной группой; гетероарильной группой, присоединенной через гетероатом; или Т-гидроксигетероциклическим радикалом,присоединенным через атом кислорода; и где алкильная группа содержит предпочтительно от одного до восьми, более предпочтительно - от одного до шести, и наиболее предпочтительно - от одного до четырех атомов углерода; циклоалкильная группа представляет собой насыщенное или частично насыщенное,моно- или поликарбоциклическое кольцо и предпочтительно содержит 5-14 атомов углерода в кольце; гетероциклоалкильная группа представляет собой неароматический одновалентный моноциклический, бициклический или трициклический радикал, который является насыщенным или ненасыщенным, содержит от 3 до 18 атомов в кольце и включает от 1 до 5 гетероатомов,выбранных из азота, кислорода и серы; арильная группа представляет собой ароматический, одновалентный моноциклический,бициклический или трициклический радикал и содержит 6, 10, 14 или 18 атомов углерода в кольце; гетероарильная группа представляет собой ароматический одновалентный, моноциклический, бициклический или трициклический радикал, содержащий от 5 до 18 атомов в кольце, 39R1 является -С(О)СН 3. 7. Способ по п.3, отличающийся тем, что указанное превращение соединения формулы(3) в соединение формулы (4) включает снятие защиты с соединения с формулой (5) и присоединение к лишенному защиты соединению с формулой (5) соединения с формулой (3). 40 8. Способ по п.7, отличающийся тем, что в формуле (3) R1 является -С(O)СН 3. 9. Способ по п.7, отличающийся тем, что в формуле (3) Х является Cl. 10. Способ по п.9, отличающийся тем, что в формуле (3) R1 является -С(O)СН 3. 11. Способ по п.3, отличающийся тем, что указанное превращение соединения формулы(3) в соединение формулы (4) включает объединение соединения с формулой (3) с соединением формулы (6)
МПК / Метки
МПК: C07D 217/26, C07C 69/86
Метки: ингибиторов, вич, получения, способ, протеазы
Код ссылки
<a href="https://eas.patents.su/21-2051-sposob-polucheniya-ingibitorov-vich-proteazy.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения ингибиторов вич – протеазы</a>
Предыдущий патент: Электронный многотарифный счетчик электрической энергии
Следующий патент: Способ получения катализатора циглера-натта для полимеризации альфа-олефинов в растворе
Случайный патент: Производные 1-[алкил]-, 1-[(гетероарил)алкил]- и 1-[(арил)алкил]-7-(пиримидин-4-ил)имидазо[1, 2-a]пиримидин-5(1н)-она












